Напівтверда композиція похідного азетидину і полімерного вітаміну е (tpgs), спосіб її приготування і набір
Номер патенту: 80633
Опубліковано: 10.10.2007
Автори: Пераккія Марія-Тереза, Коте Софі, Бобіно Валері
Формула / Реферат
1. Стабільна фармацевтична композиція, яка містить щонайменше одне похідне азетидину загальної формули:
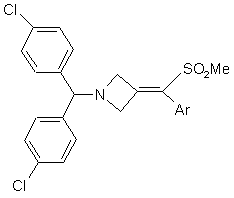 (Ia) або
(Ia) або 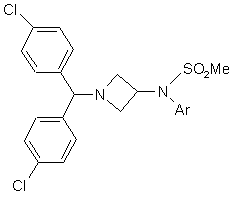 , (Ib)
, (Ib)
в якому Аr - це ароматична або гетероароматична група, необов'язково заміщена одним або більше (С1-С4)алкілом, галогеном, NO2, CN, (С1-С4)алкокси або ОН групами, необов'язково в комбінації з іншим активним інгредієнтом, здатним посилювати дію похідного азетидину загальної формули (Іа) або (Іb), в системі, яка містить полімерний напівтвердий матеріал, яким є Вітамін Е TPGS®.
2. Фармацевтична композиція за п. 1, в якій щонайменше одним похідним азетидину є сполука
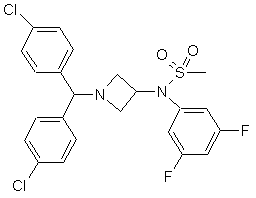 . (Ic)
. (Ic)
3. Фармацевтична композиція за п. 1, в якій препаративна форма містить до 200 мг похідного азетидину на грам.
4. Композиція за будь-яким з пп. 1-3, яка крім того містить додаткову домішку, вибрану зі стабілізаторів, консервантів, засобів, які регулюють в'язкість, або засобів, які можуть, наприклад, модифікувати органолептичні властивості.
5. Фармацевтична композиція за п. 1, в якій активний інгредієнт, отриманий з азетидину, присутній в кількості від 0,01 до 70 % від загальної ваги композиції.
6. Спосіб отримання композицій за будь-яким з пп. 1-5, згідно з яким Вітамін Е TPGS®, коли це прийнятно, змішують з іншими наповнювачами, якщо необхідно, після нагрівання у разі твердих або напівтвердих наповнювачів, і потім, якщо необхідно, змішують з додатковими домішками, і потім додають похідні азетидину за п. 1, і, коли це прийнятно, додають активний інгредієнт, здатний посилювати дію похідного азетидину загальної формули (Іа) або (Іb), і здійснюють перемішування для отримання гомогенної суміші.
7. Набір, який містить композицію за п. 1 або 2 і композицію, яка містить активний інгредієнт, здатний посилювати дію похідного азетидину, визначеного в п. 1.
8. Набір за п. 7, в якому активним інгредієнтом, здатним посилювати дію похідного азетидину, є сибутрамін.
9. Набір, який містить композицію за п. 1 або 2 і композицію, що містить засіб, який активує дофамінергічну нейропередачу в мозку.
Текст
1. Стабільна фармацевтична композиція, яка містить щонайменше одне похідне азетидину загальної формули: Cl 3 80633 4 необхідно, змішують з додатковими домішками, і 8. Набір за п. 7, в якому активним інгредієнтом, потім додають похідні азетидину за п. 1, і, коли це здатним посилювати дію похідного азетидину, є прийнятно, додають активний інгредієнт, здатний сибутрамін. посилювати дію похідного азетидину загальної 9. Набір, який містить композицію за п. 1 або 2 і формули (Іа) або (Іb), і здійснюють перемішування композицію, що містить засіб, який активує для отримання гомогенної суміші. дофамінергічну нейропередачу в мозку. 7. Набір, який містить композицію за п. 1 або 2 і композицію, яка містить активний інгредієнт, здатний посилювати дію похідного азетидину, визначеного в п. 1. Даний винахід стосується стабільних препаративних форм, які містять похідні азетидину. Похідні азетидину, які використовуються в лікарських препаратах згідно з даним винаходом, можуть бути описані нижченаведеною загальною формулою (Іа) або (Іb): , де Аr - це ароматична або гетероароматична група, заміщена за вибором одним або більше (С1С4)алкілом, галогеном, NO2, CN, (С1-С4)алкокси або ОН групами. У приведеному вище визначенні похідних азетидину під ароматичною групою мають на увазі, зокрема, фенільну або нафтильну груп у, під гетероароматичною групою піридильну, фурильну, тієнільну, тіазолільну, імідазолільну або оксазолільну груп у, і під галогеном - фтор, хлор, бром і йод. Приведена нижче сполука (Іс) є конкретним прикладом азетидину загальної формули (Іа): У [Міжнародних патентних публікаціях WO 00/15609, WO 01/64633, WO 0064634 і WO 99/01451] вже описані похідні азетидину загальної формули (Іа) або (Ib) і їх застосування. Зокрема, ці похідні азетидину представляють особливий інтерес через їх високу спорідненість до канабіноїдих рецепторів і, зокрема до СВ1рецепторів. На жаль, похідні азетидину стосуються продуктів, які дуже погано розчинні у воді. До даного моменту відоме застосування похідних азетидину загальної формули (Іа) або (Іb), зокрема, перорально в формі таблеток в препаративних формах, які містять, крім того, целюлозу, лактозу і інші наповнювачі. Однак такі склади не завжди досить добре підходять до погано розчинних у воді продуктів через надзвичайно низьку біологічну засвоюваність. У багатьох публікаціях описані системи, які сприяють солюбілізації і/або посиленню біодоступності гідрофобних активних інгредієнтів. Однак до цього часу ці вивчені системи довели свою неефективність для отримання фармацевтичних композицій, які містять описані вище похідні азетидину, які були б стабільні і біодоступні, і в яких при розчиненні похідної азетидину могла б досягатися його ефективна концентрація. Зокрема, в [J. Pharm Sciences, 89(8), 967 (2000) і Pharmaceutical Technology Europe, p.20, September 2000] описується препаративна форма погано розчинних у воді активних інгредієнтів в тригліцеридах із середньою довжиною ланцюга. Однак ці дослідження, які проводяться з препаративними формами на основі Мігліолу (MiglyolÒ), дали незадовільні результати з точки зору їх біодоступності. Крім того, в [міжнародній патентній публікації WO 95/24893] описані композиції, які містять засвоюване масло, ліпофільну поверхневоактивну речовину і гідрофільну поверхневоактивну речовину, які призначаються для препаративних форм гідрофобних активних інгредієнтів і для поліпшення їх біодоступності. Але в [міжнародній патентній заявці PCT/FR02/04514] зазначається, що в складі такого типу ви щенаведені похідні азетидину мають низьку біодоступність. Зокрема, лікарська форма похідних азетидину в системі Мігліол/Капріол/Кремофор (MiglyolÒ/CapryolÒ/CremophorÒ) показує in vivo незадовільні результати з точки зору фармакокінетики. Було виявлено, і це складає предмет даного винаходу, що можна стримати хімічно і фізично стабільні лікарські препарати, які містять похідне загальної формули (Іа) або (Іb), необов'язково в сполученні з іншим активним інгредієнтом, здатним до потенціювання дій похідного азетидину загальної формули (Іа) або (Іb), в системі, яка містить полімерний напівтвердий матеріал, яким є Еітамін Ε (Vitamin E TPGSÒ). 5 80633 6 І дійсно було виявлено, що препаративні містить азетидин згідно з першим аспектом винаходу, в якому готують, коли це прийнятно, форми сполук (Іа) або (Іb) з Вітаміном Ε (TPGSÒ) дозволяють отримувати in vivo несподівано дуже суміш основних наповнювачів, якщо необхідно після нагрівання у разі твердих або напівтвердих хороший фармакокінетичний профіль, а саме наповнювачів, і потім додають, якщо необхідно, значення параметрів AUC, Сmах і варіабельності суміш і інших добавок, і потім похідного азетидину Сmах. Вітамін Ε (TPGSÒ) є також найзручнішим (Іа) або (Іb), і, коли це прийнятно, активний наповнювачем для вивільнення лікарського засобу інгредієнт, здатний посилювати дії похідного в змодельованому кишковому середовищі до їди азетидину загальної формули (Іа) або (Іb) (дивись прикладені Фігури). відповідно до пункту 1 формули винаходу, і Переважна препаративна форма містить здійснюють перемішування для отримання сполуку (Іс). гомогенної суміші. Фармацевтична препаративна форма Згідно з ще одним аспектом, цей винахід переважно містить до 200мг похідного азетидину стосується набору, який містить композицію на грам. визначену ви ще, і композицію, яка містить Фармацевтична композиція може, крім того, активний інгредієнт, здатний посилювати дії містити добавку, вибрану з стабілізаторів, похідної азетидину (Іа) або (Іb). консервантів, речовин, які дозволяють регулювати Як активний інгредієнт набору, здатного в'язкість, або речовин, які можуть змінювати, посилювати дії похідної азотидину, переважно наприклад, органолептичні властивості. використовува ти сибутрамін. Для певних видів терапії, наприклад, лікування Згідно з останнім аспектом, цей винахід ожиріння, може бути корисним прийом похідних стосується набору, що містить композицію, згідно з азетидину загальної формули (Іа) або (Іb) першим аспектом, і композицію, яка містить одночасно з сибутраміном, що викликає речовину, що активує дофамінергічну синергетичний ефект при зменшенні споживання нейропередачу в мозку. їжі. У перших предклінічних дослідженнях, Сибутрамін і його дія описані в приведених проведених на щура х, пероральне введення нижче посиланнях: [WO 90/061110; D. Н. RYAN et водної суспензії лікарської субстанції формули (І) в al., Obesity Research, 3 (4), 553 (1995); Η. С. 0,5% метилцелюлози/0,2% твін 80 (в дозі 10мг/кг) JACKSON et al., British Journal of Pharmacology, приводило до дуже низької біодоступності (3%). 121, 1758 (1997); G. FANGH ANEL et al., Inter. J. Перший підхід до приготування лікарської форми Obes., 24 (2), 144 (2000); G. A. BR AY et al., полягав в використанні розчину 25мг/мл (Іс) в Obes.Res., 7(2), 189 (1999)]. Мігліолі 812N (Migliol 812N), вибраним через більш Крім того, при лікуванні інших захворювань, високу розчинність лікарської субстанції в таких як шизофренія, або неврологічних розладів, маслянистих компонентах (35,9мг/мл в Мігліолі такі як хвороба Паркінсона, може бути корисним 812). Крім того, цей наповнювач (тригліцерид зі прийом похідних азетидину загальної формули (Іа) середньою довжиною ланцюга) відомий через його або (Іb) одночасно з однією або більшою кількістю засвоюваність і прийнятність регуляторних речовини, що активують дофамінергічну властивостей. Ця препаративна форма була нейропередачу в мозку. використана для подальших передклінічних Такі комбінації дають можливість посилювати досліджень, які показали підвищену біодоступність дії дофамінергічної монотерапії (леводону, лікарської субстанції формули (Іс) у щурів (13 і дофамінергічні агоністи і інгібітори ензимів), і 37% при дозах 1мг/кг і 10мг/кг відповідно). Однак в знижувати побічні дії, зокрема дискінезію. першому дослідженні на людині спостерігався З дофамінергічних агоністів можуть бути важливий вплив їжі і міжособистісні відмінності: згадані, зокрема, наступні продукти: бромокриптин максимально допустима доза до їди складала (Novartis), каберголін (Pharmacia Corp.) адроголід близько 100мг з міжособистісними відмінностями (Abbott Laboratories), ВАМ-1110 (Maruko Seiyaku 50%, в той час як після їди максимально Co Ltd), Дуодопа (DuodopaÒ, Neopharma), L-допа, переносна доза була в 10 раз менше при допадоза (Neopharma), CHF1512 (Chiesi), зменшенні міжособистісних відмінностей до 30%. NeurоCell-PD (Diacrin Inc), PNU-95666 (Pharmacia Основуючись на всіх цих результатах, були & Upjohn), ропінірол (GlaxoSrithKline Beecham), поставлені наступні задачі для розробки нової праміпексол (Boehringer Ingelheim), ротиготин лікарської форми: (Discovery Theiapeutics, Lohmann Therapie System), 1. розробити препаративну форму з більш сферамін (Titan Pharmaceuticals), TV 1203 (Teva низькою концентрацією лікарського засобу (10мг/г pharmaceutical), уридин (Polifarma). замість 25мг/г) Мається на увазі, що композиції, які містять 2. збільшити біодоступність додатково активний інгредієнт, відмінний від 3. зменшити міжособистісні відмінності похідної азетидину загальної формули (Іа) або (Іb) 4. зменшити вплив їжі (після їди/до їди) і здатний посилювати її дії, можуть містити Розробка нестандартних препаративних форм визначений вище продукт, і ці згадані вище була наслідком використання наповнювачів, композиції входять в об'єм даного винаходу. здатних збільшити солюбілізацію діючої речовини. Активний інгредієнт, отриманий з азетидину, Тому з метою посилення стадій присутній в кількості, переважно, від 0,01 до 70% солюбілізації/абсорбції ліків надалі були від загальної ваги складу. досліджені інші ліпідні наповнювачі для лікарських Згідно з іншим аспектом, цей винахід форм. Зусилля були сфокусовані на стосується способу отримання композиції, що 7 80633 8 "Препаративних формах на основі ліпідів", здатних Фігура 4: - Фармакокінетичний профіль (РК) утворювати завдяки поверхнево-активним сполуки (Іс) лікарської форми з Вітаміном Ε TPGS властивостям цих наповнювачів in situ гомогенну і у 3 різних собак породи Бігль. тонку емульсію або мікроемульсію або міцелярний Фігура 5: - Фармакокінетичний профіль (РК) розчин. І насправді Мігліол (Miglyol) володіє сполуки (Іс) лікарської форми з Мігліолом 812Ν емульгуючими властивостями, але він утворює (Miglyol 812N) у 3 різних собак породи Бігль. при контакті з водним середовищем гетерогенну і Приклади препаративної форми грубу емульсію (макроскопічно видимі великі Преамбула: Опис наповнювачів маслянисті краплі), що пояснює результати, (і) Вітамін Ε TPGS (Vitamin E TPGS, Eastman отримані in vivo. "Препаративні форми на основі Chemicals): ліпідів" являють собою велику різноманітність від Вітамін Ε TPGS (d-a-токоферил чистих масел до сумішей, що містять значні поліетиленгліколь 1000 сукцннат) є кількості поверхнево-активних речовин і водорозчинним похідним вітаміну Е, отриманим з співрозчинників (більш високої полярності). На природної сировини нетваринного походження. початку дослідження була визначена розчинність (іі) Фозал 50ПГ (Phosal 50PG, Aventis сполуки (Іс) у вичерпних рядах ліпідів і інших Nattermann) фармацевтичних співрочинників. Фозал 50ПГ є концентратом Для лікарської форми сполуки (Іс) були фосфа тидилхоліну, що містить, принаймні, 50% ідентифіковані і вибрані три категорії ФХ і пропіленгліколю. наповнювачів: Склад: - амфіфільні наповнювачі для застосування у Фосфатіділхолін: відпов. 56,8% вигляді розчинів (Phosal 50PG, Labrasol), здатні до Пропіленгліколь: відпов. 38% самоемульгування при контакті з фізіологічним Моно/дигліцериди соняшника: відпов. 3% середовищем (розмір краплі 1-10мкм); Жирні кислоти сої: відпов. 2% - амфіфільні наповнювачі для застосування у Аськорбіл пальмітат: відпов. 0,2%; вигляді напівтвердих матриць (Gelucire 44/14, Етанол: до 100% Vitamin E TPGS) для солюбілізації ліків за рахунок Його синтезують з лецитину сої, очищають в утворення міцел (розмір краплі 50%Лабрафіл Μ 1944 CS, ліпофільний компонент (HLB властивості Статус: 11,7 пропіленгліколі Natterman) 4), при концентрації 40% (ваг.). визнана нешкідливою Система, здатна тверда мимовільно утворювати Соскоподібна мікроемульсію: суміш масло/поверхнево-активний речовина/Температура речовина/додаткова поверхнево-активна речовина Макрогол-32 гліцериди плавлення 44°C/HLB 14 90,1 GelucireÒ 44/14 (Gattefosse) лаурилової кислоти (псевдо потрійна суміш). Статус: визнана Будь-яка лікарська форма, яка містить пару: нешкідливою/Європейська поверхнево-активна речовина/додаткова монографія поверхнево-активна речовина, приходить до Соскоподібна тверда декількох міцелярних станів. Нами була речовина/Температура Вітамін Е d-a-токоферил плавлення 38°C/HLB препаративну форму, поставлена мета розробити 13 Вітамін Е TPGS (Vitamin Ε 100 поліетиленгліколь 1000 Статус: здатну мимовільно утворювати мікроемульсію з TPGS, Eastman) визнана сукцинат фізіологічними рідинами. Мікроемульсії можуть нешкідливою/USP бутимонографія охарактеризовані як прозорі, ізотропні, термодинамічні стійкі рідини. І рідинами Суміш наповнювачів, здатна сама утворювати мікро емульсію при контакті з фізіологічнимияк наслідок, мікроемульсії бути необмежено Масляниста можуть фаза/Жирні розбавлені. СПрозорість є наслідком їх Тригліцерид кислоти: 8 і С10 Статус: Мігліол 812(Miglyol 37,4 каприлової/капринової мікроструктури, яка складається з мікрокрапель з визнана 812,Condea) розміром 2мкм, також як і кристали ліків >2мкм), потім визначали дозу ліків методом рідинної хроматографії високого розрізнення. Розмір пор фільтра (2мкм) був вибраний після дослідження фільтрів з різними розмірами пор (0,45, 2 і 5мкм) на водних розчинах ліків. У результаті, як показано на Фігурі 1, для будьякого розміру фільтра (0,45, 2 і 5мкм) 15 80633 16 спостерігалася високий ступінь втримання ліків на Очевидно, що при виборі оптимальної денної фільтрі, що давало можливість передбачити про дози для застосуванню ліків на людях, потрібно присутність кристалів розміром >5мкм. Ε еличина брати до уваги вагу пацієнта, його загальний стан розміру пор фільтра (в дослідженій області) не здоров'я, його вік і всі чинники, які можуть впливає на кількість витриманої фракції, в той час впливати на ефективність терапії. Переважно так як склад середовища впливає дуже сильно. У готувати склади, щоб разова доза містила від 0,1 результаті, відфільтрована фракція становила до 50мг активного продукту. приблизно 1% в шлунковому середовии і, 2% - в Серед похідних азетидину загальної формули кишковому середовищі до їди, 4,5-5,5% - в (Іа) або (Іb), кишковому середовищі після їди. 1-[біс(4-хлорфеніл)метил]-3-[(3,5-дифторЦі дані, далі приведені в таблиці і феніл)(метилсульфоніл)метилен]азетидин); проілюстровані на фігурі, показують, що будь-яка N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-Nпротестована лікарська форма продемонструвала пірид-3-илметилсульфонамід; поліпшену поведінку в порівнянні з контрольними Ν-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N(Мігліол 812Ν і ПЕГ400), підтверджуючи тик самим (3,5-дифторфеніл)метилсульфонамід. здатність вибраних наповнювачів до Природно, що склади згідно з даним самоемульгування в присутності рідин шлункововинаходом, які містять ці продукти, є особливо кишкового тракту. Мікроемульсії (3:1 і 4:1), переважними. міцелярний розчин, отриманий з Вітаміном Ε У альтернативному варіанті, коли вводиться TPGS, і емульсія, отримана з Фозал 50PG, були другий активний інгредієнт, склади можуть містити найгомогеннішим і стабільними системами в будьвід 0,2 до 50мг у випадку, коли супутнім продуктом якому серодовищі. Нанокристали були стабільні в є сибутрамін. Однак може вибиратися і менша кишкових середовищах, в той час як в шлунковому кількість в інтервалі від 0,2 до 10мг. середовищі спостерігалася "флокуляція", що У випадку, коли супутнім продуктом є L-допа, приводить до повного затримання ліків на фільтрі. склади можуть містили від 100 до 300мг цього У емульсіях, отриманих з Лабрафіл/Лабразол і другого активного інгредієнта, переважно 250мг. Geluciie 44/14, концентрація ліків після фільтрації Як стабілізатори можуть бути використані, була в діапазоні 20-60% (Лабрафіл/Лабразол) і 40наприклад, антиоксиданти, зокрема токоферол, 90% (Gelucire 44/14). На всі ці нові лікарські аскорбіл пальмінат, БГТ (бутилгідрокситолуол), форми, за винятком системи Labrafil/Labrasol, БГА (бутилгідроксіанізол), пропіл галат або прийняття їжі не впливало ніякого чином (рН, наприклад яблучна кислота. концентрація лецитину і жовчних солей). Як консерванти можна вибрати метабисульфит натрію, пропіленгліколь, етанол або гліцерин. Таблиця 3 З речовин, здатних регулювати в'язкість, Сполука (Іс) (мкг/мл), витягнута в результаті фільтраціїможуть після попередньоїне приклад, лецитини, (2мкм) бути названі, інкубації з шлунково-кишковими середовищами (дивись також Фігуру 2) фосфоліпіди, пропіленгліколь альгінат, альгінат натрію або гліцерин. До речовин, здатних модифікувати Мікроемульсія Gelucire Фозал Мікроемульсія Наповнювачі/Середовище ЛікиПЕГ400 Лабрафіл/ЛабразолМігліол властивості складу, відносяться, органолептичні Кремофор/КапріолКремофор/Капріол 44/14 50PG наприклад, яблучна кислота, 3/1 фумарова кислота, 4/1 гліцерин, ванілін або ментол. Теоретична концентрація 200мкг/мл Шлункове 1/9 58,3 182,2 84,1 При використанні таких добавок, останні 0 188,0 188,3 189,3 можуть складати177,00,001% 187,1 за вагою від від до 5% Кишкове після їди рН 5 8,8 20,5 90 123,6 2,3 194,2 сумарного складу лікарської форми. Кишкове до їди рН 6,8 4,2 14,5 118,4 39,1 0,6 175,7 198,8 195,6 Згідно з даним винаходом лікарський препарат може бути отриманий, коли це прийнятно, Висновки по поведінці in vitro змішуванням основних наповнювачів (якщо Як загальний висновок, що стосується необхідне, після нагрівання у разі твердих або здатності до самоемульгування і колоїдної напівтвердих наповнювачів), і потій, якщо стабільності лікарської форми, всі протестовані необхідно, змішуванням з додатковими лікарські форми продемонстрували поліпшену добавками, з подальшим введенням похідного поведінку в порівнянні з контрольними (Мігліол азетидину загальної формули (Іа) або (Іb) і, коли 812N і ПЕГ 400), підтверджуючи здатність це прийнятно, активного інгредієнта, здатного вибраних наповнювачів до самоемульгування в посилювати дії похідного азетидину загальної присутності шлунково-кишкових рідин. Мікроемулі формули (Іа) або (Іb), і здійсненням сії (3:1 і 4:1), емульсія, отримана з Фозал 50PG, і перемішування для отримання гомогенної суміші. міцелярний розчин, отриманий з Вітаміном Ε Використання цього способу описане більш TPGS, були найгомогенішими і стабільними детально в прикладах. системами в будь-якому середовищі. Для всіх Склади згідно з даним винаходом можуть нових лікарських форм не спостерігалося ніякого знаходитися в рідкому, твердому або впливу умов до або після прийняття їжі на напівпастоподібному стані. колоїдну стабільність, за винятком для системи Їх особливо зручно застосовувати у вигляді Лабрафіл/Лабразол, коли у випадку кишкового твердих желатинових капсул або м'яких середовища до їди фракція відфільтрованих ліків желатинових капсул, або у вигляді перорального зменшувалася від 60 до 20%. розчину. 17 80633 Ці композиції згідно з даним винаходом володіють особливо цінними властивостями внаслідок їх хорошої стабільності як фізичної, так і хімічної, і підвищення біодоступності, яку вони забезпечують при пероральному застосуванні похідних азетидину загальної формули (Іа) або (Іb). Згідно з одним з варіантів даного винаходу, переважно, щоб визнаіені вище композиції, які містять, принаймні, один активний інгредієнт загальної формули (Іа) або (Іb), приймалися одночасно з прийомом або після прийому активного інгредієнта, здатного посилювати дії похідної азетидину загальної формули (Іа) або (Іb). Очевидно, що також підпадають під дію даного винаходу набори, як містять, з одного боку, переважний склад згідно з даним винаходом як визначено вище, і, з іншого боку, композицію, яка містить активний інгредієнт, здатний посилювати дії похідного азетидину загальної формули (Іа) або (Іb). Також очевидно, що презентаційні комплекти можуть містити як композицію, здатну посиль звати дії похідного азетидину загальної формули (Іа) або (Іb), композиції, які містять сибутрамін, або речовину, яка активує дофамінергічну нейропередачу в мозку. 18
ДивитисяДодаткова інформація
Назва патенту англійськоюSemi-solid compound containing azetidine derivative and polimer e-vitamine (tpgs), method of its preparation and make-up
Автори англійськоюPeracchia Maria-Teresa, Cote Sophie, Bobineau Valerie
Назва патенту російськоюПолутвердая композиция производного азетидина и полимерного витамина е (tpgs), способ ее приготовления и набор
Автори російськоюПераккия Мария-Тереза, Коте Софи, Бобино Валери
МПК / Мітки
МПК: A61K 31/397, A61P 25/18, A61P 3/04, A61K 47/34, A61K 9/48, A61K 9/10
Мітки: набір, tpgs, напівтверда, спосіб, полімерного, азетидину, вітаміну, композиція, приготування, похідного
Код посилання
<a href="https://ua.patents.su/9-80633-napivtverda-kompoziciya-pokhidnogo-azetidinu-i-polimernogo-vitaminu-e-tpgs-sposib-prigotuvannya-i-nabir.html" target="_blank" rel="follow" title="База патентів України">Напівтверда композиція похідного азетидину і полімерного вітаміну е (tpgs), спосіб її приготування і набір</a>
Попередній патент: Підбирач коренеплодів буряків
Наступний патент: Приймально-роздавальний патрубок резервуара для рідини
Випадковий патент: Модифікований полімером фактор viii для лікування гемофілії, спосіб його одержання












