Циклічні інгібітори протеїнтирозинкіназ
Номер патенту: 87456
Опубліковано: 27.07.2009
Автори: Вітьяк Джон, Довейко Артур М.П., Чен Пінг, Падманабха Рамеш, Норріс Дерек Дж., Барріш Джоел, Лі Франціс Уай Ф., Ломбардо Луіс Дж., Дас Джагабандху
Формула / Реферат
1. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі:
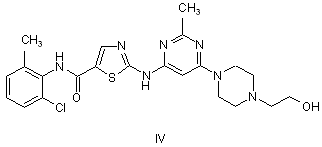 ,
,
де ракове захворювання являє собою хронічну мієлогенну лейкемію (CML).
2. Процес за п. 1, який відрізняється тим, що хронічна мієлогенна лейкемія (CML) є резистентною до STI-571.
3. Процес за п. 1, який відрізняється тим, що сполуку за формулою IV вводять один раз на день протягом 5 днів поспіль, після чого роблять перерву протягом 2 днів.
4. Процес за п. 1, який відрізняється тим, що сполуку за формулою IV вводять від 1 до 4 разів на день.
5. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі:
 ,
,
де ракове захворювання являє собою стромальну пухлину шлунково-кишкового тракту (GIST).
6. Процес за п. 5, який відрізняється тим, що стромальна пухлина шлунково-кишкового тракту (GIST) є резистентною до STI-571.
7. Процес за п. 6, який відрізняється тим, що сполуку за формулою IV вводять один раз на день протягом 5 днів поспіль, після чого роблять перерву протягом 2 днів.
8. Процес за п. 7, який відрізняється тим, що сполуку за формулою IV вводять від 1 до 4 разів на день.
9. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі:
 ,
,
де ракове захворювання являє собою гостру мієлогенну лейкемію (AML).
10. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі:
 ,
,
де ракове захворювання являє собою мастоцитоз.
11. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі:
 ,
,
де ракове захворювання являє собою герміному.
12. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі:
 ,
,
де ракове захворювання являє собою дрібноклітинний рак легень (SCLC).
13. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі:
 ,
,
де ракове захворювання являє собою меланому.
14. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі:
 ,
,
де ракове захворювання являє собою рак підшлункової залози.
15. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі:
 ,
,
де ракове захворювання являє собою рак простати.
16. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі:
 ,
,
де ракове захворювання являє собою дитячу саркому.
17. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі:
 ,
,
де ракове захворювання є резистентним до STI-571.
Текст
1. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі: 3 87456 11. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі: CH3 CH3 Cl N N H N N N H S O 4 де ракове захворювання являє собою рак підшлункової залози. 15. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі: CH3 N CH3 N , де ракове захворювання являє собою герміному. 12. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі: IV CH3 CH3 Cl N N H N N N H S O Cl N Cl N CH3 OH N N H S O N Cl S O Cl N N H N N N H N N H S O N N OH IV , де ракове захворювання являє собою дитячу саркому. 17. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі: CH3 OH CH3 N OH CH3 , де ракове захворювання являє собою меланому. 14. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі: H N N N IV CH3 N CH3 CH3 N N H S O N , де ракове захворювання являє собою дрібноклітинний рак легень (SCLC). 13. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі: H N N IV , де ракове захворювання являє собою рак простати. 16. Процес перорального лікування ракового захворювання, який включає введення пацієнту, що потребує такого лікування, ефективної кількості сполуки за формулою IV або її солі: IV CH3 N N H N OH Cl N N H N S O N H N N N OH , де ракове захворювання є резистентним до STI571. IV N N N IV OH , Даний винахід стосується циклічних сполук, їх солей, і фармацевтичних композицій, що містять ці сполуки, а також процесів їх застосування для лікування таких пов'язаних з протеїнтирозинкіназами медичних станів, як імунологічні та онкологічні захворювання. Протеїнтирозинкінази (РТК: protein tyrosine kinases) є ферментами, котрі у взаємодії з аденозинтрифосфатом (АТР) як субстратом фосфорилюють тирозинові залишки в пептидах і білках. Ці ферменти є ключовими елементами в регуляції передачі сигналів клітин, включаючи проліферацію і диференціацію клітин До РТК належать, поряд з іншими, рецепторні тирозинкінази (RPTK), включаючи членів сімейства кіназ епідермального фактора росту (наприклад, HER1 і HER2), тромбоцитарний фактор росту (PDGF) і кінази, що беруть участь в ангіогенезі (Тіе-2 і KDR); і, крім того, нерецепторні тирозинкінази, включаючи членів сімейств Syk, JAK і Src (наприклад, Src, Fyn, Lyn, Lck і Blk), див. [Bolen J.B. Kowley R.B., Spana С and Tsygankov A.Y., "The src family of tyrosine protein 5 87456 kinases in hemopoetic signal transduction", FASEB J., 6, 3403-3409 (1992); Ullrich, A. and Schlessinger, J, "Signal transduction by receptors with tyrosine kinase activity", Cell, 61, 203-212 (1990); і Ihle, J.N., "The Janus protein tyrosine kinases in hematopoetic cytokine signaling", Sem. Immunol., 7, 247-254 (1995)]. З підвищеною активністю РТК стали асоціюватися різноманітні злоякісні і незлоякісні проліферативні захворювання. Крім того, РТК відіграють центральну роль в регуляції клітин імунної системи. Отже, інгібітори РТК можуть впливати на найрізноманітніші онкологічні та імунологічні розлади. Такі розлади можна лікувати шляхом селективного інгібування певної рецепторної або нерецепторної РТК, наприклад, Lck, або завдяки гомологічності членів класів РТК шляхом інгібування більш ніж однієї РТК одним інгібітором. Особливо цікавою РТК при цьому є Lck, яка була виявлена в Т-клітинах, де вона залучена до процесу фосфорилювання ключових білкових субстратів. Вона потребується для продуктивної регуляції антиген-рецепторної передачі сигналів і для активації клітин. За відсутності Lck-активності зета-ланцюг Т-кпітинного рецептора (TCR) не фосфорилюється, кіназа ZAP-70 не активується, і суттєва для активації Т-клітин мобілізація Са2+ не відбувається, див. [Weiss, A. and Littman, D. R., "Signal transduction by lymphocyte antigen receptors", Cell, 76, 263-274 (1994); Iwashima, M., Irving, Β. Α., van Oers, N.S.C., Chan, А. С., and Weiss, A , "Sequential interactions of the TRC with two distinct cytoplasmic tyrosine kinases", Science, 263, 1136-1139 (1994); Chan, A. C., Dalton, M., Johnson, R., Kong, G., Wang, Τ., Thoma R., і Kurosaki, Т., "Activation of ZAR-70 kinase activity phosphoryiation of tyrosine 493 is required for lymphocyte antigen receptor function", EMBO J., 14, 2499-2508 (1995)] Таким чином, інгібітори Lck можуть використовуватися в лікуванні розладів, опосередкованих Т-клітинами, якими є хронічні захворювання з важливим Т-клітинним компонентом, наприклад, ревматоїдний артрит, розсіяний склероз і вовчак, а також гострі захворювання, де, як відомо, Т-клітини відіграють значну роль, наприклад, реакції гострого відторгнення трансплантата і гіперчутливості сповільненого типу (DTH: delayedtype hypersensititvity). Даним винаходом пропонуються циклічні сполуки за формулою І та їх солі, придатні до застосування як інгібітори протеїнтирозинкіназ: I де Q означає: (1) 5-членне гетероарильне кільце; (2) 6-членне гетероарильне кільце; (3) арильне кільце; у разі потреби заміщене однією або кількома групами R1; 6 Ζ означає: (1) простий зв'язок; (2) -R15C=CH-; або (3) -(СН2)m- де m є число від 1 до 2; Х1 і Х2 кожний є водень або разом утворюють =O або =S; R1 означає (1) водень або R6; де R6 означає алкіл, алкеніл, алкініл, циклоалкіл, циклоалкілалкіл, циклоалкеніл, циклоалкенілалкіл, арил, аралкіл, гетероцикл або гетероциклоалкіл, кожний з яких є незаміщеним або заміщеним Z1, Z2 i однією або кількома (переважно однією або двома) групами Ζ3, (2) -ОН або OR6, (3) -SH або -SR6, (4) -C(O)2H-C(O)qR6 або -OC(O)qR6, де q є 1 або 2, (5) -SO3H або -S(O)qR6; (6) галоїд, (7) ціан; (8) нітро; (9) -Z4-NR7R8; (10) -Z4-N(R9)-Z5-NR10R11; (11) -Z4-N(R12)-Z5-R6; (12) -P(O)(OR6)2; R2 і R3 кожний незалежно є: (1) водень або R6, (2) -Z4-R6 або (3) -Z13-NR7R8; R4 і R5: (1) кожний незалежно є водень або R6; (2) -Z4-N(R9)-Z5-NR10R11; (3) -NR9-Z4R6; або (4) разом з атомом азоту, до якого вони приєднані, утворюють 3-8-членний насичений або ненасичений гетероцикл, котрий є незаміщеним або заміщеним Ζ1, Ζ2 і Z3, причому гетероцикл може бути сконденсований з бензольним кільцем, яке само по собі може бути незаміщеним або заміщеним Z1, Ζ2 i Ζ3, R7, R8, R9, R10, R11, R12: (1) кожний незалежно є водень або R6; (2) R7 і R8 можуть разом бути алкіленом, алкеніленом або гетероалкілом, що входить до складу 3-8-членного, насиченого або ненасиченого, кільця разом з атомом азоту, до якого вони приєднані, причому зазначене кільце є незаміщеним або заміщеним Z1, Z2 або Z3; або (3) будь-які два із R9, R10, R11 можуть разом бути алкіленом або алкеніленом, що входить до складу 3-8-членного, насиченого або ненасиченого, кільця разом з атомом азоту, до якого вони приєднані, причому зазначене кільце є незаміщеним або заміщеним Z1, Z2 або Z3; R13 означає: (1) ціан; (2) нітро; (3) -NH2, (4) -NНОалкіл, (5) -ОН; (6) -NНОарил; (7) -NНСООалкіл, (8) -NНСООарил; (9) -NHSO2алкіл, 7 (10) -NHSO2apил; (11) арил, (12) гетеро арил (13) -Оалкіл або (14) -Оарил; R14 означає: (1) -NO2, (2) -СООалкіл або (3) -СООарил; R15 означає: (1) водень; (2) алкіл; (3) арил; (4) арилалкіл або (5) циклоалкіл; Z1, Z2 і Z3 кожний незалежно означає: (1) водень або Z6, де Z6 означає: (і) алкіл, алкеніл, алкініл, циклоалкіл, циклоалкілалкіл, циклоалкеніл, циклоалкенілалкіл, арил, аралкіл, алкіларил, циклоалкіларил, гетероцикл або гетероциклоалкіл; (іі) групу (і), яка сама по собі є заміщеною однією або кількома однаковими чи різними групами (і); або (ііі) групу (і) або (іі), що є заміщеними однією або кількома групами, вибраними серед груп (2) (16) для Z1, Z2 і Z3, (2) -OH або -OZ6; (3) -SH або -SZ6; (4) -C(O)qH, -C(O)qZ6 або -O-C(O)qZ6; (5) -SO3H, -S(O)qZ6 або -S(O)qN(Z9)Z6; (6) галоїд; (7) ціан; (8) нітро; (9) -Z4-NZ7-Z8; (10) -Z4-N(Z9)-Z5-NZ7Z8; (11) -Z4-N(Z10)Z5-Z6; (12) -Z4-N(Z10)-Z5-H, (13) оксо; (14) -OC(O)-Z6; (15) будь-які дві групи серед Z1, Z2 і Z3 можуть разом бути алкіленом або алкеніленом, що входить до складу 3-8-членного, насиченого або ненасиченого, кільця разом з атомами, до яких вони приєднані, або (16) будь-які дві групи серед Z1, Z2 і Z3 можуть разом бути -О-(СН2)r-О-, де r є число від 1 до 5, входячи до складу 4-8-членного, насиченого або ненасиченого, кільця разом з атомами, до яких вони приєднані, Z4 і Z5 кожний незалежно означає: (1) простий зв'язок; (2) -Z11-S(O)q-Z12-; (3) -Z11-C(O)-Z12-, (4) -Z11-C(S)-Z12-; (5) -Z11-O-Z12-; (6) -Z11-S-Z12; (7) -Z11-O-C(O)-Z12- або (8) -Z11-C(O)-OZ12-; Z7, Z8, Z9 i Z10 (1) кожний незалежно означає водень або Z6; (2) Z7 і Z8 або Z6 і Z10 можуть разом бути алкіленом або алкеніленом, що входить до складу 3-8членного, насиченого або ненасиченого, кільця разом з атомами, до яких вони приєднані, причому 87456 8 зазначене кільце є незаміщеним або заміщеним Z1, Z2 або Z3, або (3) Z7 або Z8 разом із Z9 можуть бути алкіленом або алкеніленом, що входять до складу 3-8членного, насиченого або ненасиченого, кільця разом з атомами азоту, до яких вони приєднані, причому зазначене кільце є незаміщеним або заміщеним Z1, Z2 або Z3; Z11 і Z12 кожний незалежно означає: (1) простий зв'язок; (2) алкілен; (3) алкенілен або (4) алкінілен; і Z13 означає: (1) простий зв'язок; (2) -Z11-S(O)q-Z12-; (3) -Z11-C(O)-Z12-; (4) -Z11-C(S)-Z12-; (5) -Ζ11-Ο-Ζ12-; (6) -Z11-S-Z12-; (7) -Z11-O-C(O)-Z12-; (8) -Z11-C(O)-O-Z12-; (9) -C(NR13)-; (10) -C(CHR14)- або (11) -C(C(R14)2)-. До числа сполук за формулою І входять також сполуки за формулою (II) та їх солі: II де n є 1 або 2; А вибраний серед вуглецю й азоту; В вибраний серед азоту, кисню і сірки; Х3 є кисень або сірка, а R1, R2, R3, R4 і R5 є такими, як зазначено вище. Нижче дані визначення термінів, використовуваних у даному описі. Якщо не вказано іншого, то подані тут визначення для групи або терміну залишаються правомірними для цієї групи або терміну на протязі всього опису як у відокремленому застосуванні так і стосовно частини іншої групи. Терміни «алк» і «алкіл» стосуються прямолінійних і розгалужених вуглеводневих груп, що містять 1-12 і переважно 1-8 атомів вуглецю. Термін «нижчий алкіл» стосується алкільних груп, що містять 1-4 атоми вуглецю. Термін «алкеніл» стосується прямолінійних і розгалужених вуглеводневих груп, що містять 2-10 і переважно 2-4 атоми вуглецю, які мають принаймні один подвійний зв'язок. Якщо алкенільна група зв'язана з атомом азоту, то така група в кращому варіанті не є зв'язаною безпосередньо через атом вуглецю, що несе подвійний зв'язок. Термін «алкініл» стосується прямолінійних і розгалужених вуглеводневих груп, що містять 2-10 і переважно 2-4 атоми вуглецю, які мають принаймні один потрійний зв'язок. Якщо алкінільна група зв'язана з атомом азоту, то така група в кращому варіанті не є зв'язаною безпосередньо через атом вуглецю, що несе потрійний зв'язок. Термін «алкілен» означає прямолінійний місток із 1-5 атомів вуглецю, з'єднаних простими зв'я 9 зками (наприклад, -(СН2)x-, де x=1-5), який може бути заміщений 1-3 нижчими алкільними групами. Термін «алкенілен» означає прямолінійний місток із 2-5 атомів вуглецю, що мають один або два подвійні зв'язки, який з'єднаний простими зв'язками і може бути заміщений 1-3 нижчими алкільними групами. Прикладами алкеніленових груп можуть бути -СН Н-СН Н С = С = -, -СН2-СН=CН-, -СН2СН СН-СН2- -С(СН3)2=СН- і -СН(С2Н5)-СН=СН-. = Термін «алкінілен» означає прямолінійний місток із 2-5 атомів вуглецю, що має потрійний зв'язок, з'єднаний простими зв'язками і може бути заміщений 1-3 нижчими алкільними групами Прикладами алкініленових груп можуть служити СºС-, -СН2-СºС-, -СН(СН3)-СºСі -CºCCH(C2H5)CH2-. Терміни «ар» і «арил» означають ароматичні циклічні групи (наприклад, 6-членне моноциклічне, 10-членне біциклічне або 14-членне трициклічне кільце), котрі містять 6-14 атомів вуглецю. Прикладами арильних груп можуть бути феніл, нафтил, біфеніл і антрацен. Терміни «циклоалкіл» і «циклоалкеніл» означають циклічні вуглеводневі групи із 3-12 атомів вуглецю. Терміни «галоген» і «галоїд» означають фтор, хлор, бром і йод. Термін «ненасичене кільце» охоплює своїм визначенням частково ненасичені й ароматичні кільця. Терміни «гетероцикл», «гетероциклічний» і «гетероцикло» означають повністю насичені або ненасичені, включаючи неароматичні (тобто «гетероциклоалкільні») й ароматичні (тобто «гетероарильні») циклічні групи, наприклад, 4-7-членні моноциклічні, 7-11-членні біциклічні або 10-15членні трициклічні кільцеві системи, що містять, принаймні, один гетероатом, принаймні, в одному кільці, що складається із атомів вуглецю. Кожне кільце гетероциклічної групи, що містить гетероатом, може містити 1, 2, 3 або 4 гетероатоми, вибрані серед атомів азоту, кисню і/або сірки, причому гетероатоми азоту і сірки в разі потреби можуть бути окисленими, а гетероатоми азоту - кватернізованими. Гетероциклічна група може приєднуватися будь-яким гетероатомом або атомом вуглецю кільця чи кільцевої системи. Як приклади моноциклічних гетероциклічних груп можна назвати піролідиніл, піроліл, піразоліл, оксетаніл, піразолініл, імідазоліл, імідазолініл, імідазолідиніл, оксазоліл, оксазолідиніл, ізоксазолініл, ізоксазоліл, тіазоліл, тіадіазоліл, тіазолідиніл, ізотіазоліл, ізотіазолідиніл, фурил, тетрагідрофурил, тієніл, оксадіазоліл, пірединіл, піперазиніл, 2оксопіперазиніл, 2-оксопіперидиніл, 2оксопіролодиніл, 2-оксоазепініл, азепініл, 4піперидоніл, піридиніл, піразиніл, піримідиніл, піридазиніл, тетрагідропіраніл, морфолініл, тіаморфолініл, тіаморфолінілсульфоксид, тіаморфолінілсульфон, 1,3-діоксолан і тетрагідро-1,1діоксотієніл, триазоліл, триазолініл і т.п. Типовими біциклічними гетероциклічними групами є, наприклад, індоліл, бензотіазоліл, бензооксазоліл, бензодіоксоліл, бензотієніл, хінуклідиніл, хінолініл, терагідроізохінолініл, ізохінолініл, 87456 10 бензимідазоліл, бензопіраніл, індолізиніл, бензофурил, хромоніл, кумариніл, бензопіраніл, цинолініл, хіноксалініл, індазоліл, піролопіридил, фуропіридиніл (наприклад, фуро[2,3-с]піридиніл, фуро[3,2-b]піридиніл і фуро[2,3-b]піридиніл), дигідроізоіндоліл, дигідрохіназолініл (наприклад, 3,4дигідро-4-оксо-хіназолініл), тетрагідрохінолініл і т.п. Серед типових трициклічних гетероциклічних груп можна назвати карбазоліл, бензидоліл, фенантролініл, акридиніл, фенантридиніл, ксантеніл, тощо. Термін «гетероарил» стосується ароматичних гетероциклічних груп. До числа типових гетероарильних груп належать піроліл, піразоліл, імідазоліл, оксазоліл, ізоксазоліл, тіазоліл, тіадіазоліл, ізотіазоліл, фурил, тієніл, оксадіазоліл, піридиніл, піразиніл, піримідиніл, піридазиніл, триазоліл, триазиніл і т.п. Коли q є 1 або 2, вираз «-C(O)qH» означає С(О)-Н або -С(О)-ОН; вирази «-C(O)qR6» і «C(O)qZ6» означають, відповідно, -C(O)-R6 і -C(O)OR6 або -C(O)-Z6 і -С(О)-OZ6; вирази «-O-C(O)qR6» і «-O-C(O)qZ6» означають, відповідно, -O-C(O)-R6 і О-С(О)-OR6 або -O-C(O)-Z6 і -O-C(O)-OZ6; а вирази «-S(O)qR6» і «-S(O)qZ6» означають, відповідно, S(O)-RS і -SO2-R6 або -S(O)-Z6 і -SO2-Z6. Сполуки за формулою І в деяких випадках можуть утворювати солі, які також охоплюються даним винаходом Отже, якщо не зазначено іншого, то згадування в даному описі сполук за формулою І слід сприймати як такі, що включають у себе також їх солі. Використовуваний тут термін «сіль» («солі») означає кислі і/або лужні солі, утворені з неорганічними і/або органічними кислотами й основами. Полем цього терміну охоплюються також цвітеріони (внутрішні солі) (які можуть утворюватися, наприклад, коли замісники R містять кислотну частину, наприклад, карбоксильну групу). До кола цих сполук належать також четвертинні солі амонію, такі як алкіламонійні солі. Кращими серед них є фармацевтично прийнятні (тобто нетоксичні, фізіологічно прийнятні) солі, хоча використовуватися можуть також інші солі, наприклад, на стадіях відокремлення або очистки, котрі можуть застосовуватися в процесі одержання сполук. Солі сполук за формулою І можуть утворюватися, наприклад, шляхом реакції сполуки за формулою І з певною, наприклад, еквівалентною кількістю кислоти або основи в середовищі, в якому сіль, наприклад, випадає в осад, або ж у водному середовищі з наступною ліофілізацією. Типовими кислими адитивними солями є ацетати (утворені, наприклад, з оцтовою або тригалоїдоцтовою і, зокрема, з трифтороцтовою кислотою), адипати, альгінати, аскорбати, аспартати, бензоати, бензосульфонати, бісульфати, борати, бутирати, цитрати, камфорати, камфосульфонати, циклопентанпропіонати, диглюконати, додецилсульфати, етансульфонати, фумарати, глюкогептаноати, глицерофосфати, напівсульфати, гептаноати, гексаноати, гідрохлориди, гідроброміди, гідройодиди, 2-гідроксіетансульфонати, лактати, малеати, метансульфонати, 2нафталінсульфонати, нікотинати, нітрати, оксала 11 ти, пектинати, персульфати, 3-фенілпропіонати, фосфати, пікрати, півалати, пропіонати, саліцилати, сукцинати, сульфати (утворені, наприклад, із сірчаною кислотою), сульфонати (наприклад, згадані вище), тартрати, тіоціанати, толуолсульфонати, ундеканоати і т.п. Серед типових основних солей (наприклад, утворених із замісниками R, що містять кислотну, зокрема, карбоксильну групу) можна назвати амонійні солі, солі лужних металів, такі як солі натрію, літію і калію, солі лужноземельних металів, такі як солі кальцію і магнію, солі з органічними основами (наприклад, з органічними амінами), наприклад, бензатини, дициклогексиламіни, гідрабаміни, Nметил-D-глюкаміди, N-метил-D-глюкаміди, третбутиламіни, і солі з амінокислотами, наприклад, аргініном, лізином і т.п. Основні азотовмісні групи можуть бути кватернізовані такими агентами, як нижчі галоїдалкіли (наприклад, метил-, етил-, пропіл- і бутил-хлоридами, бромідами і йодидами), діалкілсульфати (наприклад, диметил-, діетил-, дибутил- i діаміл-сульфатами), довголанцюгові галоїдні сполуки (наприклад, децил-, лаурил-, міристил- і стеарил-хлоридами, бромідами і йодидами), аралкілгалоїди (наприклад, бензил- і фенілбромідами), тощо. Винаходом передбачені також проліки і сольвати запропонованих сполук. Під «проліками» тут мається на увазі сполука, яка після введення її пацієнту зазнає хімічного перетворення метаболічним або хімічним шляхом, внаслідок чого утворюється сполука за формулою І або її сіль і/або сольват. Кращими сполуками за формулою І є гідрати. Об'ємом винаходу охоплюються всі стереоізомери запропонованих сполук, які можуть існувати завдяки асиметричним атомам вуглецю в замісниках R сполуки за формулою І, включаючи енантіомерні і діастереомерні форми. Відокремлені стереоізомери сполук за даним винаходом можуть, наприклад, практично не містити інших ізомерів або ж можуть бути змішаними, наприклад, у формі рацематів або з будь-якими іншими або з вибраними тим чи іншим способом стереоізомерами. Хіральні центри згідно з даним винаходом можуть мати S- або R-конфігурацію, як визначено в IUPAC 1974 Recommendations. Добір груп та їх замісників, що розглядаються в даному описі, робиться врозрахунку на одержання стабільних сполук та їх частин. Кращі сполуки Кращими сполуками згідно з даним винаходом є сполуки, що описуються формулою І, та їх солі, де Q означає тіазол i де один або декілька, а краще всі із сукупності Ζ, X1, Х2, R1, R2, R3, R4 і R5 мають такі визначення Ζ означає простий зв'язок; R1 вибраний серед водню, галоїду, алкілу, арилу, алкокси, алкосикарбонілу або арилоксикарбонілу, і переважно є воднем; Х1 і Х2 разом утворюють =O або =S, а краще утворюють =O; R2 означає водень; R3 вибраний серед -Z4-R6 або -Z13-NR7R8 і в кращому випадку означає -Z4-R6, де Z4 є простим 87456 12 зв'язком, a R6 означає арил або гетероарил, котрий є незаміщеним або заміщеним Ζ1, Ζ2 і однією або кількома (переважно однією або двома) групами Z3; R4 означає водень; R5 вибраний серед арильних або гетероарильних груп, заміщених Z1, Z2 і однією або кількома (наприклад, однією або двома) групами Z3. Процеси одержання Сполуки за формулою І можуть бути одержані за допомогою процесів згідно зі Схемами А-Ε і І-XI. Розчинники, температури, величини тиску та інші умови реакцій можуть легко визначатися фахівцем у даній галузі. Усі цитовані документи включені тут в усій їхній повноті шляхом посилання. Зазначені вихідні матеріали є у продажу або можуть легко отримуватися фахівцем у даній галузі. Компоненти сполук указані в описі і на схемах. Процеси згідно з даним винаходом можна здійснювати, використовуючи вихідні матеріали і/або реагенти у стані розчину або ж, де це потребується, у зв'язаному стані на твердій основі, див. [(1) Thompson, L. Α., Ellman J. Α., Chemical Reviews, 96, 555-600 (1996); (2) Terrett, N. K., Gardner, M., Gordon, D. W., Kobylecki, R. J., Steele, J., Tetrahedron, 51, 8135-8173 (1995); (3) Gallop, Μ. Α., Barrett, R. W., Dower, W. J., Fodor S. P. Α., Gordon, E. M., Journal of Medicinal Chemistry, 37, 1233-1251 (1994); (4) Gordon, E. M., Barrett, R. W., Dower, W. J., Fodor S. Ρ Α., Gallop, Μ. Α., Journal of Medicinal Chemistry, 37, 1385-1401 (1994); (5) Balkenhohl, F., von dem Bussche-Hunnefeld, Lansky, Α., Zechel, C, Angewandte Chemie International Edition in English, 35, 2288-2337 (1996); (6) Balkenhohl, F., von dem Bussche-Hunnefeld, Lansky, Α., Zechel, C, Angewandte Chemie, 108, 2436-2487 (1996); і (7) Sofia, M. J., Drugs Discovery Today, 1, 27-34 (1996)]. 13 87456 14 Base - основа L - група, що відщеплюється Saponification - омилення На Схемі А ілюстрований загальний процес одержання сполуки Іа, яка визначається формулою І, де X1 і Х2 разом утворюють =О. У відповідності з цією схемою сполуку Іа, де R2 і R3 обидва є водень, можна отримувати шляхом омилення вихідного матеріалу і (де R* є карбоксильною захисною групою, наприклад, алкілом або арилалкілом) з наступною реакцією з аміном iiі у відповідності з відомими процесами. Інакше вихідний матеріал i може реагувати з R2L, де L є група, що відщеплю ється, наприклад, галоїд (наприклад, в еквімолярній кількості), після чого можна проводити реакцію з R3L (наприклад, в еквімолярній кількості) з утворенням іі. Інакше вихідний матеріал і може бути підданий відновному амінуванню, використовуючи підходящий альдегід або кетон i отримуючи сполуку ii. Далі сполука ii може бути піддана омиленню i реакції з аміном iii в умовах, добре відомих фахівцеві в даній галузі, з одержанням сполуки Іа, де R2 і/або R3 не є воднем. Процеси одержання кращих заміщених сполук І ілюстровані на поданих нижче Схемах І-XI. Reduction - відновлення Oxidation - окислення Saponification - омилення На Схемі В ілюстрований загальний процес одержання сполуки Іb, що визначається формулою І, де Ζ є -СН =СН, а Х1 і Х2 разом утворюють =О. У відповідності з цією схемою 2галоїдзаміщену сполуку vі виготовляють шляхом реакції відповідним чином заміщеної 2аміносполуки іа з галогенідом міді (ii) й алкілнітритом, наприклад трет-бутилнітритом, в апротонному розчиннику, наприклад ацетонітрилі, у результаті чого одержують 2-галоїдвмісну сполуку іv [J. Het. Chem. 22, 1621 (1985)]. Далі сполуку іv відновлюють, наприклад, боргідридом натрію в етанолі або водному розчині тетрагідрофурану з одержанням спирту, котрий може бути окислений таким окисником, як хлорхромат піридинію або біхромат піридинію, з одержанням альдегіду v. Сполуку v приводять у взаємодію з алкіл(трифенілфосфориліден)ацетатом з одержанням карбоксилату vі. Сполуку vі омилюють i піддають реакції з аміном iii відомим шляхом з одержанням сполуки vіі. Сполуку vіі приводять у взаємодію з аміном R2R3NH з утворенням Іb, де Ζ=-СН=СН - і Х1 і Х2 разом утворюють =O. Інакше сполуки за формулою Іb, де R2 i R3 є водень, можуть бути приготовані шляхом взаємодії vii з відповідним чином заміщеним бензиламіном, наприклад, 4-метоксибензиламіном, внаслідок чого утворюється сполука iх, яку піддають гідрогенолізу або обробці кислотою, наприклад, трифторметансульфокислотою і трифтороцтовою кислотою при наявності анізолу, одержуючи сполуку Іb, де R2 і R3 є воднем. Процеси одержання кращих заміщених сполук І ілюстровані на поданих нижче Схемах І-XI. 15 Saponification - омилення Deprotection - зняття захисту Base - основа Leaving groop - група, що відщеплюється На Схемі С ілюстрований загальний процес одержання сполуки Іс, яка визначається формулою І, де Ζ = -R15-C=CH-, а Χ1 i Χ2 разом утворюють =O. У відповідності зі Схемою С 2амінозаміщену сполуку іа приводять у взаємодію з хлорформіатом або дикарбонатом з утворенням сполуки х, яку піддають омиленню й обробці літійорганічним реагентом з утворенням сполуки хі. Сполуку хі приводять у взаємодію с алкіл(трифенілфосфориліден)ацетатом з наступним видаленням захисної карбаматної групи з утво 87456 16 ренням сполуки хii. Інакше сполуку Іс, де R2 і R3 обидва є водні, можна одержати шляхом омилення сполуки хii з наступною її реакцією з аміном R4R5NH у відповідності з відомими процесами. Іншим чином, сполуку хii можна привести у взаємодію з R2L, де L - група, наприклад, галоїдна (наприклад, в еквімолярній кількості), що відходить, після чого можна провести реакцію з R3L (наприклад, в еквімолярній кількості) з утворенням сполуки хii, яку піддають омиленню і реакції з аміном R4R5NH у відповідності з добре відомими процесами, одержуючи сполуку Іс, де R2 і/або R3 не є воднями. Процеси одержання кращих заміщених сполук за формулою І ілюстровані нижче, на Схемах І-XI. На Схемі D ілюстрований загальний процес одержання сполуки Id, визначеної формулою І, де Χ1 і Х2 разом утворюють =S. Сполуки за формулою Іа, отримані за Схемою А, можуть піддаватися перетворенню на відповідні тіоаміди Id за допомогою реагенту Лавесона, (2,4-біс(4-метоксифеніл)-1,3-дитіа-2,4дифосфетан-2,4-дисульфід) [Bull. Soc. Chim. Belg., 87, 223 (1978)]. Процеси одержання кращих заміщених сполук за формулою І ілюстровані на Схемах І-XI, поданих нижче. 17 На Схемі Ε ілюстрований загальний процес одержання сполуки Іе, визначеної формулою І, де обидва Х1 і Х2 є воднем. Як показано на Схемі Е, сполуку за формулою Id, отриману згідно зі Схемою D, шляхом відновлення, наприклад, реакцією 87456 18 з нікелем Ренея, перетворюють на відповідний амін Іе. Процеси одержання кращих заміщених сполук за формулою І ілюстровані нижче, на Схемах І-XI. 19 87456 20 Написи на Схемі І: (1) ocнова/R2X X= галоїд для R2= алкіл, арилалкіл або циклоалкілалкіл (A) синтез пептидного зв'язку, тобто приведення в контакт з iii або (B) синтез через хлорангідрид кислоти, тобто (1) тіонілхлорид або оксалілхлорид (If) виходячи із 2: R2= алкіл, арилалкіл або циклоалкілалкіл виходячи із 3: R2=Η У відповідності зі Схемою І карбоксилат і приводять у взаємодію з хлорформіатом або дикарбонатом з утворенням сполуки 1. Сполуку 1 піддають обробці основою, наприклад гідридом натрію, гексаметилдисілазидом натрію або калію, або діізопропіламідом літію (LDA), й алкілувальним агентом R2X, де X є галоїд, a R2 є алкіл, арилалкіл або циклоалкіл-алкіл, і проводять омилення водним розчином основи, наприклад гідроксиду калію, одержуючи сполуку 2. В іншому варіанті сполуку 1 піддають відновному амінуванню, використовуючи відповідний альдегід або кетон, і омилюють водним розчином основи, наприклад гідроксиду калію, одержуючи сполуку 2. Інакше сполуку 1 можна просто омилити водним розчином основи, наприклад гідроксиду калію і в результаті одержати сполуку 3, де R2 є водень. Кислоту 2 приводять у взаємодію з аміном іii в добре відомих умовах пептидного синтезу [Bodanszky and Bodanszky, The Practice of Peptide Chemistry, Springer-Verlag, 1984; Bodanszky, Principles of Peptide Synthesis, Springer-Verlag, 1984] з утворенням сполуки Id, визначеної форму лою І, де Х1 і Х2 разом утворюють =O, R3 є COOR6, a, R2 є алкілом, арилалкілом або циклоалкілалкілом, оскільки вихідним матеріалом є сполука 2. Реагентами активації карбоксильної групи сполуки 2 для реакції з аміном іv можуть бути, наприклад, біс-(2-оксо-3-оксазолідиніл)фосфінхлорид (хлорид ВОР), бензотриазол-1-ілокситрис(диметиламіно)фосфонійгексафторфосфат (реагент ВОР), [О-(7-азабензо-триазол-1-іл)1,1,3,3-тетраметилуроний]гексафторфосфат (HATU) і карбодіімиди, як-от дициклогексилкарбодіімід (DCC) і 3-етил-3'(диметиламіно)пропілкарбодіімід (EDCI) відокремлено або у сполученні з гідроксибензотриазолом. В альтернативному варіанті відокремлюють активований проміжний естер, який піддають обробці відповідним аміном іv в апротонному розчиннику, наприклад, тетрагідрофурані (THF) або диметилформаміді (DMF) при наявності, наприклад, органічної основи, такої як гексаметилдисілазид натрію або калію, триетиламін, діізопропілетиламін або 1,8-діазабіцикло[5.4.0]ундец-7-ен (DBU), або неорганічної основи, такої як карбонат натрію, калію або цезію, або гідрид натрію чи калію. Іншим чином галоідангідрид 2 може бути отриманий, наприклад, за допомогою реакції з тюнілхлоридом або оксалілхлоридом i наступної за цим реакції з аміном iii, у результаті чого утворюється сполука If, визначена формулою І, де R3 є COOR6, Χ1 i Χ2 разом утворюють =O, a R2 є алкілом, арилалкілом або циклоалкілалкілом. Реакції, подібні використовуваним для перетворення сполуки 2 на продукт If, можна проводити для перетворення сполуки 3 на продукт If, де R3 є COOR6, Χ1 i Χ2 разом утворюють =O, a R2 є воднем. Написи на Схемі II: Reduction - відновлення Reductive amination - відновне амінування У відповідністю зі Схемою II кислоту 4, де R2 і R3 не є воднем і вибрані так, що азот, до якого вони приєднані, не був основним, відновлюють до альдегіду 5 за допомогою добре відомих процесів 21 87456 22 [March, Advanced Organic Chemistry, Wiley, 1985] Для цього кислоту 4 можна, наприклад, перетворити на відповідний естер з наступним відновленням останнього гідридом діізобутилалюмінію. Або ж кислоту 4 можна відновити до відповідного первинного спирту, наприклад, шляхом обробки сумішшю боран/THF, LіАІН4, або шляхом відновлення змішаним ангідридом з наступним окисленням до альдегіду 5 за допомогою Cr(VI) (наприклад, хлорхромату піридинію, «РСС») або в умовах Сверна (Swem) чи Мофата (Moffatt) (наприклад, (СО СІ)2/диметилсульфоксид). Вихідна кислота 4 при цьому може бути отримана, наприклад, омиленням сполуки ii. Відновне амінування [Hudlicky, Reduction in Organic Chemistry, Wiley, 1984] альдегіду 5 аміном iiі при наявності відновника, наприклад NaBH3CN, NaBH(OAc)3 (Ac= ацетил) або водню, і паладієвого каталізатора дозволяє отримувати амін Іg, визначений формулою І, де Х1 і Х2 обидва є воднями, a R2 і R3 обидва не є воднями. У відповідністю зі Схемою III кислоту 4 відновлюють до первинного спирту (наприклад, шляхом обробки сумішшю боран/тетрагідрофуран, LіАІН4 або шляхом відновлення змішаного ангідриду) і після перетворення за допомогою відомих процесів [March, Advanced Organic Chemistry, Wiley, 1985] одержують сполуку 6, яка містить частину, як-от галоїд, тозилат (OTs), мезилат (OMs), триф лат (OTf) і т.п., що відходить. Групи R2 і R3 добирають таким чином, щоб отриманий в результаті атом азоту, до якого вони приєднуються, не був основним. Після цього сполуку 6 перетворюють на сполуку In, яка визначається формулою І, де Хі і Х2, обидва є воднями, a R2 і R3 обидва не є воднями, шляхом реакції заміщення аміном iii у кращому варіанті в умовах надлишку останнього. 23 87456 24 Написи на Схемі IV: R2= будь-яка визначена для нього група R3= ацил або тіоацил Амід/тіоамід X= галоген Карбамат Сечовина/тіосечовина На Схемі IV ілюстровані процеси, котрі можна застосовувати для одержання сполук Ij, Ik, II, Im і In. Сполуки Ij, Ik, II, Im і In визначаються формулою І, де R2 може бути будь-якою групою згідно з визначеним для нього вище, R3 є ацил або тіоацил, X1 і Х2 не є воднями, a R1 не є первинним або вторинним аміном. Сполуки Ij, Ik, II, Im і In містять інші специфічні замісники, зазначені на цій схемі і нижче. Вихідна сполука Іі може бути приготована у відповідності з процесами за Схемами А і D. Амід Ij одержують шляхом обробки аміну Іі карбоновою кислотою 7 при наявності реагентів, що активують карбоксильну групу для реакції згідно з описаним вище; такими реагентами можуть бути, наприклад, BOP, HATU і карбодііміди DCC або EDCI, взяті відокремлено або у сполученні з гідроксибензотриазолом. В іншому варіанті галоїдангідрид 8 приводять у взаємодію з аміном її при на явності поглинача кислоти, наприклад діізопропілетиламіну. Відповідний тіоамід Ik можна одержати, піддаючи амід Іі (де X, і Х2¹Ο) обробці реагентом Лавесона, як описано вище. Карбамат II одержують обробкою амінної сполуки Іі хлорформіатом 9 або дикарбонатом 10 при наявності поглинача кислоти, наприклад, діізопропілетиламіну. Сечовину Іm одержують шляхом обробки аміну Іі: 1) хлорформіатом 9, наприклад фенілхлорформіатом, з наступною реакцією з аміном 11; або 2) карбамоїлхлоридом 12 при наявності поглинача кислоти, наприклад, діізопропілетиламіну; або 3) ізоціанатом 13а (де Rc в Іm означає Н). Відповідна тіосечовина In може бути отримана за допомогою реакції аміну І і з тіоізоціанатом 13b. Ra добирають серед груп, що входять у перелік значень R6, таким чином, що група -C(=A)-Ra є ацильною або тіоацильною групою в межах визначення R3. Rb і Rc добирають серед груп, що входять у перелік значень R7 і R8, таким чином, що група -C(=A)-N(Rb)(Rc) є ацильною або тіоацильною групою в межах визначення R3. Написи на Схемі V: R2 - будь-яка із зазначених для нього груп, окрім ацилу R3 - алкіл, циклоалкіл, циклоалкілалкіл, циклоалкенілалкіл, аралкіл або насичений гетероцикл Reduction animation - відновне амінування X - галоген Base - основа На Схемі V ілюстрований процес, який може використовуватися для одержання сполуки Ір, визначеної формулою І, де: R2 є будь-якою зазначеною для нього групою, окрім ацилу, котру добирають таким чином, що азот, до якого вона приєднана, є основним; R3 є алкіл, циклоалкіл, циклоалкілалкіл, циклоалкенілалкіл, аралкіл або насичений гетероцикл, а Х1 і Х2 обидва не є воднями. Вихідні матеріали Іо і Iq можуть бути приготовані за допомогою процесів, відображених на Схемах А і D. Як показано на Схемі V, амінна сполука Іо реагує з альдегідом або кетоном 14 в описаних вище умовах відновного амінування, з утворенням аміну Ір. Сполука Ір може бути отримана також шляхом приведення аміну Iq, де R2 і R3 є водень, у взаємодію з трет-бутилнітритом або нітритом натрію при наявності галоїдної сполуки міді(ІІ) з утворен 25 87456 26 ням галоїдзаміщеної сполуки 15 i наступним заміщенням аміном 16 при наявності основи, якою може бути, наприклад, гідрид натрію, калію і т.п. [Lee et al., J. Heterocyclic Chemistry, 22, 1621 (1985)]. Rd і Re незалежно добирають серед алкілу, арилу, циклоалкілу або циклоалкенілу, або разом вони є алкіленом або алкеніленом, що доповню ють 3-8-членне, насичене або ненасичене, кільце таким чином, що група -CH(RdRe) лежить у межах визначення для R3. Схема VI R2 - будь-яка із визначених для нього груп, окрім ацилу R3 - арил, гетеро арил Як показано на Схемі VI, де компонент R2 приймає будь-яке із наведених для нього значень, окрім ацилу, і добраний таким чином, що атом азоту, до якого він приєднаний, не є основним; R3 є арилом або гетероарилом, а X1 і Х2 не є атомами водню, амін Іr приводять у взаємодію з галоїдфенілом або галоїдзаміщеною гетероароматичною групою 17 при наявності паладієвого (0) каталіза тора [J. Am. Chem. Soc, 118, 7215 (1996)] з утворенням аміну Is, що відповідає формулі І із замісниками, зазначеними на цій схемі Вихідну сполуку Іr можна одержати за допомогою процесів, розглянутих на Схемах А і D. Схема VII R2 - будь-яка із визначених для нього груп R3 – гетеро арил Як показано на Схемі VII, де R2 є будь-якою визначеною для нього групою, a R3 є гетероароматичною групою, амін It, якщо потрібно, то при наявності основи, приводять у взаємодію з 2галоїдзаміщеною гетероароматичною сполукою 17, де Q разом з атомами, з якими він з'єднаний, утворює 5- або 6-членне моноциклічне або 10-12 членне біциклічне гетероароматичне кільце (наприклад, утворюючи 2-хлорпіридин або 2хлорпіримидин) з утворенням аміну їй, визначеного формулою І із замісниками, зазначеними на схемі. Вихідну сполуку It можна одержати за допомогою процесів, розглянутих на Схемах А і D. Як показано на схемі VIII, тіосечовину In (де ні Х1 ні Х2 не є воднем) приводять у взаємодію з відповідним аміном при наявності біс(2-оксо-3оксазолідиніл)фосфінхлориду (хлориду ВОР), гексафторфосфату бензотриазол-1-ілокситрис(диметиламіно)фосфонію (реагенту ВОР), [О(7-аза-бензотриазол-1-іл)-1,1,3,3тетраметилуроній]гексафторфосфату (HATU) і карбодііміду, наприклад, дициклогексилкарбодііміду (DCC) або 3-етил-3'(диметиламіно)пропілкарбодііміду (EDCI), або діізопропілкарбодііміду (DIC), при наявності органіч ної основи, наприклад, триетиламіну, діізопропіламіну або диметиламінопіридину, в розчиннику, наприклад, диметилформаміді, дихлорметані або тетрагідрофурані з утворенням сполуки Iv, визначеної формулою І із замісниками, зазначеними на схемі. Альтернативним чином сполуку In приводять у взаємодію з відповідним аміном при наявності солі ртуті(ІІ), наприклад хлориду ртуті, або у відповідності з іншими відомими процесами з утворенням сполуки Iv. 27 87456 28 Як показано на схемі IX, амін Іr (де ні X1 ні Х2 не є атомами водню) приводять у взаємодію з дифенілціанкарбоімідатом відокремлено або при наявності основи, наприклад, гідриду натрію, гексаметилдисілазиду натрію або диметиламінопіридину у середовищі ацетонітрилу, тетрагідрофура ну або диметилформаміду при кімнатній або при підвищеній температурі з утворенням проміжної сполуки Iw. Далі сполука Iw вступає у взаємодію з аміном R7R8NH з утворенням сполуки Iv, визначеної формулою І із замісниками, зазначеними на схемі. Як показано на схемі X, сполуку Іr (де ні X1 ні Х2 не є атомами водню) приводять у взаємодію зі сполуками 18 i 19 у разі потреби при наявності основи, такої як гідрид натрію, гексаметилдисілазид натрію, диметиламінопіридин, у диметилформаміді або тетрагідрофурані при кімнатній або при підвищеній температурі з утворенням сполук lх і Іv, відповідно, котрі можна приводити в реакцію з аміном R7R8NH при кімнатній або при підвищеній температурі з утворенням сполук Iz або Iz*, відповідно. Сполука Iz описується формулою І із замісниками, зазначеними на цій схемі. Сполука Iz* також описується формулою І із замісниками, зазначеними на цій схемі. 29 87456 Схема XI R2= арил, гетероарил, біцикличний гетероарил R3= Η, алкіл, арил, гетероарил, біцикличний гетероарил Як показано на схемі XI, сполуку за формулою І можна одержати із сполуки 15 шляхом реакції з певним аміном при наявності кислого каталізатора, див. наприклад [Gunzenhauser et al., Helv. Chem Acta, 71, 33 (1988)]. Винаходом пропонуються також сполуки, що описуються формулою III III де кожний із R1, R3 і R4 незалежно один від одного є гетероциклічною або арильною групою, в разі потреби заміщеною одним або кількома замісниками, a R2 є водень або алкіл. Кращим сполуками згідно з даним винаходом є такі, що відповідають формулі IV: IV Корисність Сполуки за даним винаходом інгібують протеїнтирозинкінази і зокрема ті, що належать до сімейства Src-кіназ, тобто Lck, Fyn, Src, Yes, Hck, Fgr і Вік, і тому є корисними при лікуванні, включаючи профілактику і терапію, розладів, що асоціюються з протеїнтирозинкіназами, наприклад, імунологічних і онкологічних захворювань. Ці сполуки інгібують також рецепторні тирозинкінази, включаючи HER1 і HER2, і отже можуть використовуватися в лікуванні проліферативних розладів - псоріазу і раку. Здатність цих сполук інгібувати HER1 та інші рецепторні кінази дозволяє застосовувати їх у ролі антиангіогенних агентів для лікування таких захворювань, як рак і діабетична ретинопатія. «Розладами, що асоціюються з протеїнтирозинкіназами» називають такі порушення, які виникають у результаті аберантної активності тирозинкінази і/або які полегшуються шляхом інгібування одного або декількох із цих ферментів. Наприклад, при лікуванні цілого ряду таких розладів (наприклад, при лікуванні автоімунних хвороб) дуже корисними є інгібітори Lck, оскільки інгібування Lck блокує активність Т-клітин. Особливо підходящою цариною застосування даного винаходу є лікування хвороб, опосередкованих Т-клітинами, де може застосовуватися інгібування активації Т-клітин та їх проліферації. Кращими для цього є сполуки, що селективно блокують активацію Т-клітин. Сполуки за даним винаходом, які блокують активацію РТК 30 клітин ендотелію окиснювальним стресом, обмежуючи поверхневу експресію адгезивних молекул, що викликають зв'язування нейтрофілів та інгібують РТК, необхідну для активації нейтрофілів, є придатними, наприклад, для лікування ішемії і реперфузійного ушкодження. Отже, даним винаходом пропонуються процеси лікування розладів, що асоціюються з протеїнтирозинкіназами. Дані процеси включають у себе стадію введення пацієнту, що потребує такого лікування, ефективної кількості принаймні однієї сполуки за формулою І. Разом зі сполуками за даним винаходом у цих процесах можна застосовувати також інші терапевтичні агенти згідно з описаним нижче. При здійсненні процесів за даним винаходом інші терапевтичні агенти можуть вводиться до введення, після введення або водночас з уведенням сполуки (або сполук) за даним винаходом. У сферу застосування сполук згідно з даним винаходом входить лікування таких видів розладів, що асоціюються з протеїнтирозинкіназами: відторгнення трансплантата (наприклад, трансплантата органа, гострого трансплантата або гетеротрансплантата чи гомотрансплантата, наприклад, використовуваного при лікуванні опіків); захист від ішемічного або реперфузійного ушкодження, наприклад, ішемічного або реперфузійного ушкодження під час трансплантації органів, інфаркту міокарда, серцевого нападу, тощо; індукція толерантності до трансплантації; артрит (наприклад, ревматоїдний артрит, псоріатичний артрит або остеоартрит); розсіяний склероз; хронічне обструктивне захворювання легень (COPD), наприклад емфізема; запалення кишкового тракту, включаючи виразковий коліт і хворобу Крона; люпус (системний червоний вовчак); синдром «трансплантату проти хазяїна»; опосередкована Т-клітинами гиперчутливість, включаючи гиперчутливість при контакті, гиперчутливість сповільненого типу, глютеночутлива ентеропатія (глютенова хвороба); псоріаз; контактний дерматит (включаючи опік отруйним плющем); тиреоїдит Хашимото; синдром Сьогрена; автоімунний гіпертиреоїдит, наприклад, хвороба Грейвса; хвороба Адісона (автоімунне захворювання надниркових залоз), автоімунне полігландулярне захворювання (відоме як автоімунний полігландулярний синдром); автоімунна алопеція; перніціозна анемія; вітиліго; автоімунний гіперпітуатаризм; синдром Гійена-Баре; інші автоімунні хвороби; ракові захворювання, включаючи різновиди раку, при яких відбувається активація або надекспресія Lck та інших, таких як Src, кіназ сімейства Src, наприклад, карцинома товстої кишки і тимома, і ракові захворювання, при котрих активність кінази сімейства Src сприяє росту та виживанню пухлин; гломерулонефрит; сироваткова хвороба; uticaria; алергічні захворювання, такі як респіраторні алергії (астма, поліноз, алергічний риніт) і шкірна алергія; scleracierma; грибоподібний мікоз; гострі запальні реакції (наприклад, гострий респіраторний дистрес-синдром і ішемічне/реперфузійне ушкодження); дерматоміозит; вогнищева алопеція; хронічний актинічний дерматит; екзема; хвороба Бехчета; Pustulosis 31 palmoplanteris; гангренозна піодермія; синдром Сезари; атопічний дерматит; системний склероз; кільцеподібна склеродермія. Даним винаходом пропонується також процес лікування таких серед вищезазначених розладів, як атопічний дерматит, шляхом введення будь-якої сполуки, здатної інгібувати протеїнтирозинкінази. Відмінні від Lck кінази сімейства Src, як-от Нск і Fgr, відіграють важливу роль у Fc-гаммарецепторних відповідях моноцитів і макрофагів. Сполуки за даним винаходом інгібують Fc-гаммазалежне продукування альфа-TNF у моноцитній клітинній лінії ТНР-1, котра не експресує Lck. Здатність інгібувати Fc-гамма-рецептор-залежні відповіді моноцитів і макрофагів надає сполукам за даним винаходом додаткової протизапальної активності, окрім їхньої дії на Т-клітини. Ця активність є особливо важливою, наприклад, при лікуванні таких запальних хвороб, як артрит і запалення кишкового тракту. Зокрема, сполуки за даним винаходом можуть використовуватися для лікування автоімунного гломерулонефриту та інших видів гломерулонефриту, що викликаються відкладанням імунних комплексів у нирці, яке запускає Fc-гамма-рецепторні відповіді, що призводять до ушкодження нирки. Крім того, відмінні від Lck кінази сімейства Src, як-от Lyn і Src, займають важливе місце в індукованій Fc-епсилон-рецепторами дегрануляції мастоцитів і базофілів, котрі відіграють важливу роль при астмі, алергічному риніті та інших алергічних розладах. Fc-епсилон-рецептори стимулюються lgE-антигенними комплексами. Сполуки за даним винаходом інгібують Fc-епсилон-індуковані дегрануляційні відповіді, включаючи відповіді в клітинній лінії базофілів RBL, котра не експресує Lck. Здатність інгібувати Fc-епсилон-рецептор-залежні відповіді мастоцитів і базофилів надає сполукам за даним винаходом додаткової протизапальної активності, окрім їхньої дії на Т-клітини. Запропоновані сполуки є корисними, зокрема, при лікуванні астми, алергічного риніту й інших алергічних станів. Комплексна активність сполук за даним винаходом щодо моноцитів, макрофагів, Т-клітин і т.д. може використовуватися при лікуванні будь-якого з вищеперелічених розладів. В одному з конкретних варіантів здійснення даного винаходу запропоновані сполуки можуть використовуватися для лікування вищезазначених типових розладів незалежно від їхньої етіології, і зокрема, наприклад, для лікування відторгнення трансплантатів, ревматоїдного артриту, розсіяного склерозу, хронічних обструктивних легеневих захворювань, запалень кишкового тракту, лупуса, синдрому типу «трансплантат проти хазяїна», опосередкованої Т-клітинами гіперчутливості, псоріазу, тиреоїдиту Хашимото, синдрому Гійена-Баре, раку, контактного дерматиту, алергічних захворювань, таких як алергічного риніту, астми, ішемічного і реперфузійного ушкодження або атопічного дерматиту, як зв'язаних, так і не зв'язаних з РТК. Завдяки здатності інгібувати HER1- і HER2кінази, сполуки за даним винаходом можуть також застосовуватися для лікування проліферативних 87456 32 хвороб, включаючи псоріаз і рак. HER1 рецепторна кіназа експресується й активується в багатьох твердих пухлинах, включаючи недрібноклітинний рак легенів, колоректальний рак і рак грудей. Подібним чином, HER2 рецепторна кіназа надекспресується в ракових пухлинах грудей, яєчника, легенів і шлунку. Моноклональні антитіла, що зменшують чисельність НЕР2-рецептора або інгібують передачу сигналів HER1-рецептором, володіють протипухлинним ефектом, що було продемонстровано в ході доклінічних і клінічних досліджень. У зв'язку з цим, очікується, що інгібітори HER1- і HER2-кіназ будуть ефективними при лікуванні пухлин, які залежать від сигналів одного або обох рецепторів. Очікується, що ці сполуки будуть ефективними як у відокремленому застосуванні, так і в утриманні з іншими хіміотерапевтичними засобами, наприклад, з паклитакселом (ТахоІ), доксорубіцингідрохлоридом (адріаміцином) і цисплатином (Platinol) [Cobleigh, Μ. Α., Vogel, С. L, Tripathy, D., Robert, N. J., Scholl, S., Fehrenbacher, L, Wolter, J. M., Paton, V., Shak, S., Lieberman, G., and Slamon, D. J., "Multinational study of the efficacy and safety of humanized anti-HER2 monoclonal antibody in women who have HER2-overexpressing metastatic breast cancer that has progressed after chemotherapy for metastatic disease", J. of Clin. Oncol. 17(9), p.26392648 (1999); Baselga, J., Pfister, D., Cooper, M. R., Cohen, R., Burtness, В., Bos, M., D'Andrea, G., Seidman Α., Norton, L, Gunnett, K., Falcey, J., Anderson, V., Waksal, H., and Mendelsohn, J., "Phase I studies of anti-epidermal growth factor receptor chimeric antibody C225 alone and in combination with cisplatin', J. Clin. Oncol. 18(4), p.904-914 (2000)]. Сполуки за даним винаходом є придатними для лікування таких ракових захворювань, як хронічна мієлогенна лейкемія (CML), стромальна пухлина шлунково-кишкового тракту (GIST), дрібноклітинний рак легень (SCLC), недрібноклітинний рак легень (NSCLC), рак яєчника, меланома, мастоцитоз, герміноми, гостра мієлогенна лейкемія (AML), дитячі саркоми, рак грудей, колоректальний рак, рак простати та інші види, що асоціюються з протеїнтирозинкіназами, такими наприклад, як SRC, BCR-ABL і с-КІТ. Сполуки за даним винаходом можуть застосовуватися також для лікування тих видів раку, які є чутливими і резистентними до хіміотерапевтичних засобів, скерованих на BCRABL і с-КІТ, яким є, наприклад, Gleevec® (STI-571). Даним винаходом передбачені також фармацевтичні композиції', що містять в ефективній кількості, принаймні, одну зі сполук за формулою І, придатну до лікування пов'язаних з протеїнтирозинкіназами розладів, і фармацевтично прийнятний носій або розчинник. Композиції за даним винаходом можуть містити інші терапевтичні засоби, що розглянуто нижче, і можуть бути приготовані, наприклад, при використанні звичайних твердих або рідких носіїв чи розчинників, а також фармацевтичних добавок (наприклад, ексципієнтів, сполучних, консервантів, стабілізаторів, ароматизаторів, тощо), тип яких відповідає методу введення, за допомогою процесів, добре відомих фахівцям у галузі фармацевтики. 33 Сполуки за формулою І можна вводити будьяким підходящим шляхом, наприклад, перорально у формі таблеток, капсул, гранул, порошків і т.п., під язик, трансбукально, парентерально, наприклад, підшкірно, внутрішньовенно, внутрішньом'язово або шляхом внутрішньогрудинної ін'єкції чи інфузії (наприклад, у формі стерильних водних або неводних розчинів для ін'єкцій, або суспензій), назально, наприклад, шляхом інгаляції, місцевого введення, наприклад, у формі крему або мазі, або ректально, наприклад, у формі супозиторіїв, у формі однодозових препаратів, що містять нетоксичні, фармацевтично прийнятні носії чи розчинники. Сполуки за даним винаходом можуть уводитися, наприклад, у лікарській формі, розрахованій на швидке або на пролонговане вивільнення. Способи швидкого і пролонгованого вивільнення можуть здійснюватися за допомогою відповідних фармацевтичних композицій, що містять сполуки за даним винаходом, а для пролонгованого вивільнення - ще й такі пристрої, як підшкірні імплантати або осмотичні насоси. Запропоновані сполуки можуть уводитися також ліпосомальним шляхом. Типові композиції для перорального введення можуть мати форму суспензій, які можуть містити, наприклад, мікрокристалічну целюлозу для надання об'єму, альгінову кислоту або альгінат натрію як суспендувальний агент, метилцелюлозу як засіб збільшення в'язкості, а також звичайні підсолоджувачі й ароматизатори; таблетки швидкого вивільнення, котрі можуть містити, наприклад, мікрокристалічну целюлозу, дикальцийфосфат, крохмаль, стеарат магнію, лактозу та інші ексципієнти, сполучні, наповнювачі, дезінтегратори, розчинники і мастила, добре відомі в даній галузі. Через порожнину рота сполуки за даним винаходом можуть вводиться способами під язик і трансбуккально. Типові композиції при цьому мають форму литих таблеток, пресованих таблеток або таблеток, виготовлених методом сушки заморожуванням. До складу їх входять швидкорозчинні розріджувачі - маніт, лактоза, сахароза і/або циклодекстрини. Такі склади можуть містити високомолекулярні ексципієнти, наприклад, целюлози (Avicel) або поліетиленгліколі (PEG). В них може використовуватися також ексципієнт, що сприяє адгезії на слизуватій оболонці, наприклад, гідроксипропілцелюлоза (НРС), гідроксипропілметилцелюлоза (НРМС), натрієва сіль карбоксиметилцелюлози (SCMC), співполімер малеїнового ангідриду (наприклад, Gantrez) і регулятори вивільнення, наприклад, поліакриловий співполімер (Carbopol 934). Для полегшення виготовлення і вживання можуть додаватися мастила, гліданти, барвники і стабілізатори. Типові композиції для назальних аерозолів або для інгаляції готують у фізіологічному розчині і можуть містити, наприклад, бензиловий спирт або інші підходящі консерванти, активатори абсорбції для підвищення біодоступності і/або інші добре відомі солюбілізатори і диспергатори. Для парентерального введення композиції звичайно мають форму розчинів або суспензій для ін'єкцій, котрі можуть містити, наприклад, підходящі для парентерального вживання нетоксичні роз 87456 34 ріджувачі або розчинники, наприклад, маніт, 1,3бутандіол, воду, розчин Рінгера, ізотонічний розчин хлориду натрію або інші підходящі диспергувальні або змочувальні і суспендувальні агенти, включаючи синтетичні моно- або дигліцериди та жирні кислоти, включаючи олеїнову кислоту. Типові композиції для ректального введення мають форму супозиторіїв, до складу яких можуть входити, наприклад, підходящий неподразливий ексципієнт, як-от какаова олія, синтетичні гліцериди або поліетиленгліколі, які при звичайній температурі є твердими, але в ректальній порожнині стають рідкими і/або розчиняються, звільняючи лікарський засіб. У типових композиціях для місцевого введення носієм служить такий матеріал, як Plastibase (мінеральне масло, желатиноване поліетиленом). Ефективна кількість сполуки за даним винаходом може бути легко визначена фахівцем у даній галузі і для дорослого звичайно лежить у межах доз приблизно від 0,1 до 100мг активної сполуки на кілограм маси тіла (мг/кг) на день і може вводитися однократною дозою або поділеними дозами, наприклад, 1-4 рази на день. Цілком зрозуміло, що величина дози і частота її введення у кожного пацієнта можуть бути різними і залежать від таких чинників, як активність конкретної використовуваної сполуки, її метаболічна стабільність і тривалість дії, стать, вік, маса тіла, загальний стан здоров'я і режим харчування пацієнта, спосіб і час введення, швидкість екскреції, вживана комбінація лікарських засобів і ступінь тяжкості конкретного стану. Кращими об'єктами для лікування є тварини, а найкращими - ссавці, включаючи людей і свійських тварин, наприклад собак, кішок і т.п., що страждають на розлади, пов'язані з протеїнтирозинкіназами. При внутрішньовенному введенні сполуки за даним винаходом, включаючи сполуки за формулами III і IV, вводять переважно у формі описаних тут фармацевтичних препаратів. У загальному випадку сполуки за даним винаходом, включаючи сполуки за формулами III і IV, вводять шляхом внутрішньовенного вливання протягом часу, приблизно, від 10хв. до 3год., переважно від 30хв. до 2год., краще від 45хв. до 90хв. і найкраще протягом приблизно 1год. Сполуки вводять звичайно внутрішньовенним шляхом з дозою, приблизно, від 0,5мг/м2 до 65мг/м2, краще від 1мг/м2 до 50мг/м2, ще краще від 2,5мг/м2 до 30мг/м21 найкраще приблизно 25мг/м2. Методика перерахування дози, вираженої в мг/кг, у дозу, виражену в мг/м2, за відомих даних щодо росту і/або маси тіла пацієнта повинна бути добре відомою фахівцеві в даній галузі, див , наприклад, [http7/www.fda.gov/cder/cancer/animalfram htm]. Як зазначалося вище, сполуки за даним винаходом, включаючи сполуки за формулами III і IV, можна вводити перорально, внутрішньовенно або обома цими шляхами. Зокрема, процеси згідно з даним винаходом можуть здійснюватися, наприклад, за такими графіками дозування: один раз на день протягом 2-10 днів, краще - кожні 3-9 днів, ще краще - кожні 4-8 днів і найкраще - кожні 5 днів. У відповідності з одним із варіантів між циклами ви 35 тримують проміжок без лікування від 3 днів до 5 тижнів, краще - від 4 днів до 4 тижнів, ще краще від 5 днів до 3 тижнів і найкраще - від 1 тижня до 2 тижнів. Згідно з іншим варіантом здійснення винаходу запропоновані сполуки, включаючи ті, що описуються формулами III і IV, можуть уводитися перорально, внутрішньовенно або обома цими шляхами 1 раз на день протягом 3 днів з перервою 1-3 тижні без лікування між циклами. Згідно з ще одним варіантом сполуки за даним винаходом, включаючи сполуки, що описуються формулами III і IV, можуть уводиться перорально, внутрішньовенно або обома цими шляхами 1 раз на день протягом 5 днів з перервою 1-3 тижні без лікування між циклами. В одному з кращих варіантів цикл введення сполук за даним винаходом, включаючи сполуки, що описуються формулами III і IV, складається із щоденного введення ліків один раз на день протягом 5 днів поспіль, а проміжок між циклами складає 2-10 днів, а ще краще - 1 тиждень. В іншому подібному варіанті сполуки за даним винаходом, включаючи сполуки за формулами III і IV, можуть уводитися один раз на день протягом 5 днів поспіль, після чого роблять перерву протягом 2 днів. Сполуки за даним винаходом, включаючи сполуки, що описуються формулами III і IV, можуть уводитися перорально, внутрішньовенно або обома цими шляхами 1 раз кожні 1-10 тижнів, краще кожні 2-8 тижнів, ще краще - кожні 3-6 тижнів і найкраще - кожні 3 тижні. В одному з варіантів процесу за даним винаходом запропоновані сполуки, включаючи ті, що описуються формулам III і IV, вводять протягом 28-денного циклу в 1-й, 7-й і 14-й дні внутрішньовенно і в 21-й день перорально. За іншим графіком сполуки згідно з даним винаходом, включаючи описувані формулами III і IV, вводять протягом 28денного циклу, під час якого сполуки за формулами І і II вводять перорально в 1-й день і внутрішньовенно - в 7-й, 14-й і 28-й дні. У відповідності з процесами за даним винаходом сполуки, включаючи описувані формулами III і IV, вводять доти, аж поки у пацієнта не виникне реакція у відповідь, як-от зменшення розмірів пухлини, або поки не буде досягнута токсична межа введеної дози. Сполуки за даним винаходом вживаються як відокремлено, так і в сполученнях між собою та підходящими іншими терапевтичними засобами, придатними для лікування розладів, що асоціюються з (білок-тирозин)-кіназами. Такими іншими терапевтичними засобами можуть бути інгібітори РТК, відмінні від запропонованих даним винаходом, протизапальні засоби, антипроліферативні засоби, хіміотерапевтичні засоби, імуносупресанти, протиракові і цитотоксичні засоби. Як приклади інших терапевтичних засобів можна назвати циклоспорини (наприклад, циклоспорин A), CTLA4-lg, антитіла (наприклад анти-ІСАМ3), рецептор анти-IL-2 (Anti-Tac), aнти-CD45RB, анти-СО2, анти-СО3 (ОКТ-3), анти-СО-4, антиСD80, анти-CD86, моноклональне антитіло ОКТ3, засоби блокування взаємодії між CD40 і др39, якот антитіла, специфічні до CD40 і/або gр39 (тобто 87456 36 CD154), злиті білки, сконструйовані із CD40 і gр39 (CD401g і CD8gp39), інгібітори NF-капа-В-функції, наприклад інгібітори ядерної транслокації, такі як деоксиспергуалін (DSG), нестероїдні протизапальні засоби (NSAIDs), наприклад ібупрофен, стероїди, наприклад преднізон або дексаметазон, сполуки золота, антипроліферативні агенти, наприклад метотрексат, FK506 (такролімус, Prograf), мофетилмікофенолят, цитотоксичні засоби, наприклад азатиприн і циклофосфамід, інгібітори TNF-α, наприклад тенідап, антитіла проти TNF або розчинний рецептор TNF, такий як етанерцепт (Enbrel), рапаміцин (сиролімус або Rapamune), лефлунімід (Arava) та інгібітори циклооксигенази-2 (СОХ-2), такі як целекоксиб (Celebrex) і рофекоксиб (Vioxx) або їх похідні, та інгібітори РТК, описані в таких заявках США: №60/056 770, подана 8/25/97 (Attorney Docket No QA202*), №60/069 159, подана 12/9/97 (Attorney Docket No QA202a*), №09/097 338, подана 6/15/98 (Attorney Docket No QA202b), №60/056 797, подана 8/25/97 (Attorney Docket No QA205*), №09/094 797, подана 6/15/98 (Attorney Docket No QA205a), №60/065 042, подана 11/10/97 (Attorney Docket No QA207*), №09/173 413, подана 10/15/98 (Attorney Docket No QA207a), №60 076 789, подана 3/4/98 (Attorney Docket No QA208*), №09 262 525, подана 3/4/99 (Attorney Docket No QA208a), а також в таких публікаціях і зроблених в них посиланнях: Hollenbaugh, D., Douthwright, J., McDonald, V., and Aruffo, Α., "Cleavable CD40lg fusion proteins and the binding to sgp39", J. Immunol. Methods (Netherlands), 188(1), p.1-7 (Dec. 15 1995); Hollenbaugh, D., Grosmaire, L. S., Kullas, C. D., Chalupny, N. J., Braesch-Andersen, S., Noelle, R. J., Stamenkovie, I., Ledbetter, J. Α., and Aruffo, Α., "The human Τ cell antigen gp39, a member of TNF gene family, is a ligand for the CD40 receptor: expression of a soluble form of gp39 with В cell costimulatory activity", EMBO J (England), 11(12), p.4313-4321 (Dec. 1992); and Moreland, L. W. et al., "Treatment of rheumatoid arthritis with a recombinant human tumor necrosis factor receptor (p75)-Fc fusion protein", New England J. of Medicine, 337(3), p.141-147 (1997). Серед типових протиракових і цитотоксичних засобів можна назвати, наприклад, алкілувальні агенти, такі як мустин, алкілсульфонати, нітрозосечовини, етиленіміни і триазени; антиметаболіти, такі як фолатні антагоністи, аналоги пурину й аналоги піримідину; антибіотики, такі як антрацикліни, блеоміцини, митоміцин, дактиноміцин і плікаміцин; ферменти, такі як L-аспарагіназа, інгібітори фарнезил-білок-трансферази; гормональні засоби, наприклад глюкокортикоїди, естрогени і антиестрогени, андрогени й антиандрогени, прогестини й антагоністи гормону, що звільнює лютеїнізуючий гормон, октреотидацетат; засоби руйнування мікротрубочок, такі як ектеїнасцидини або їх аналоги і 37 похідні; засоби стабілізації микротрубочок, такі як паклітаксел (ТахоІ®), доцетаксел (Taxotere®) і епотилони A-F або їх аналоги і похідні; продукти рослинного походження, такі як Vinса-алкалоїди, епіподофілотоксини, таксани; інгібітори топоізомерази; інгібітори пренілпротеїнтрансферази; та інші різноманітні засоби, такі як оксисечовина, прокарбазин, мітотан, гексаметилмеламін, координаційні комплекси платини, наприклад цисплатин і карбоплатин; інші засоби, використовувані як протиракові і цитотоксичні ліки, наприклад модифікатори біологічних реакцій, фактори росту; імуномодулятори і моноклональні антитіла. Сполуки за даним винаходом можна застосовувати у комбінації з радіаційною терапією. Типовими представниками цих класів протиракових і цитотоксичних засобів є гідрохлорид мехлоретаміну, циклофосфамід, хлорамбуцил, мелфалан, іфосфамід, бісульфан, кармустин, ломустин, семустин, стрептозоцин, тіотепа, дакарбазин, метотрексат, тіогуанін, меркаптопурин, флударабін, пентастатин, кладрибін, цитарабін, флуорурацил, доксорубіцингідрохлорид, даунорубіцин, ідарубіцин, сульфат блеоміцину, мітоміцин С, актиноміцин D, сафрацини, сафраміцини, хінокарцини, дискодермоліди, вінкристин, вінбластин, тартрат вінорельбіну, етопозид, теніпозид, паклітаксел, тамоксифен, естрамустин, естрамустинфосфат натрію, флутамід, бузерелін, лейпролід, птеридини, діінези, левамізол, афлакон, інтерферон, інтерлейкіни, альдеслейкін, філграстим, сарграмостим, ритуксимаб, BCG, третіноїн, іринотекану гідрохлорид, бетаметозон, гемцитабіну гідрохлорид, альтретамін і топотека, а також будьякі їх аналоги та похідні. Серед кращих для застосування згідно з винаходом представників цих класів можна назвати, наприклад, паклітаксел, цисплатин, карбоплатин, доксорубіцин, карміноміцин, даунорубіцин, аміноптерин, метотрексат, метоптерин, мітоміцин С, ектеїнасцидин 743, порфіроміцин, 5-флуорурацил, 6-меркаптопурин, гемицитабін, цитозинарабінозид, подофілотоксин і похідні подофілотоксину, такі як етопозидфосфат або тенопозид, мелфалан, вінбластин, вінкристин, лейрозидин, віндесин і лейрозин. Підходящими протираковими та іншими цитотоксичними засобами є також похідні епотилону, описані в заявці США №09/506 481, від 17 лютого 2000p. (Attorney Docket No LD186); патенті DE №4138042.8; заявках WO 97/19086, WO 98/22461, WO 98/25929, WO 98/38192, WO 99/01124, WO 99/02224, WO 99/02514, WO 99/03848, WO 99/07692, WO 99/27890, WO 99/28324, WO 99/43653, WO 99/54330, WO 99/54318, WO 99/54319, WO 99/65913, WO 99/67252, WO 99/67253 і WO 00/00485; інгібітори циклінзалежних кіназ, описаних у WO 99/24416, та інгібітори пренілпротеїнтрансферази, описані в WO 97/30992 і WO 98/54966. Вищезазначені «інші терапевтичні засоби» при застосуванні їх у комбінаціях зі сполуками за даним винаходом можуть уводитися в кількостях, наприклад, рекомендованих у довіднику лікаря 87456 38 [Physician's Desk Reference (PDR)] або ж добраних фахівцем. Для оцінки активності сполуки («випробуваної сполуки») як інгібітору РТК можна застосовувати описані нижче аналітичні методики. Сполуки, описані в нижченаведених прикладах, були піддані аналізу за однією або декількома методиками і продемонстрували подані тут рівні активності. Ферментний аналіз із застосуванням Lck, Fyn, Hck, Fgr, Src, Blk і Yes Випробування із застосуванням (білоктирозин)-кіназ Lck, Fyn, Hck, Fgr, Src, Blk або Yes проводили за такою методикою. Потрібну протеїнтирозинкіназу інкубували в кіназному буферному розчині (20ммоль MOPS, pH7, 10ммоль МgСІ2) при наявності випробуваної сполуки. Реакцію ініціювали шляхом добавлення субстратів до кінцевої концентрації 1мкмоль АТР, 3,3мкКюрі/мл [33Р] гамма-АТР і 0,1мг/мл денатурованої кислотою енолази (приготованої так, як описано в [Cooper J. Α., Esch, F. S., Taylor, S. S., and Hunter Т., "Phosphorylation sites in enolase and lactate dehydrogenase utilized by tyrosine protein kinases in vivo and in vitro", J. Biol. Chem., 259, 7835-7841 (1984)]. Реакцію зупиняли через 10хв. добавленням 10% трихлороцтової кислоти, 100ммоль пірофосфату натрію з наступним введенням 2мг/мл альбуміну бичачої сироватки. Мічений протеїненолазний субстрат осаджували при 4°С, збирали на планшети Packard Unifilter і підраховували за допомогою сцинтиляційного лічильника Topcount, визначаючи таким чином активність інгібування випробуваної сполуки щодо даної (білок-тирозин)-кінази (активність інгібування є зворотно-пропорційною кількості міченої протеїненолази). Точну концентрацію реагентів і кількість мітки можна змінювати за потребою. Ця методика випробувань має ту перевагу, що в ній використовується екзогенний субстрат (енолаза), який підвищує точність ферментної кінетики, і може здійснюватися на 96-лунковому планшеті, який легко автоматизувати. Крім того, His-мічені протеїнтирозинкіназами (описані нижче) можна готувати з великими виходами і з високим ступенем чистоти порівняно з GST- протеїнтирозинкіназним злитим білком. Протеїнтирозинкінази можуть бути придбані із комерційних джерел або одержані за допомогою описаного тут рекомбінантного методу. Для одержання рекомбінантної Lck готували Lck людини у формі His-міченого злитого білка при використанні продажного (Life Technologies, Gibco) вектора pFastBac Hta бакуловірусу в клітинах комах. У цей вектор вставляли PCR (полімеразно-ланцюгова реакція) виділену кДНК, що кодує Lck людини, і експресували білок за методикою виробника. Lck очищали методом афінної хроматографії. Виробляти Lck в клітинах комах із застосуванням бакуловірусу можна за методикою, описаною в [Spana, С, O'Rourke, Ε. С, Bolen, J. В and Fargnoli, G., "Analysis of the tyrosine kinase p56lck expressed as a glutathione S-transferase protein in Spodoptera frugiperda cells", "Protein expression and purification", Vol.4, p.390-397 (1993)]. Аналогічні 39 методи можна застосовувати для рекомбінантного одержання інших кіназ сімейства Src. Ферментний аналіз із застосуванням HER1 або HER2 Вибрані сполуки піддавали випробуванням у кіназному буфері, ще містив 20ммоль Tris.HCI, pH7,5, 10ммоль МnСІ2, 0,5ммоль дитіотреітолу, альбумін бичачої сироватки 0,1мг/мл, полі(gІu/tyr, 4:1) у концентрації 0,1мг/мл, 1мкмоль АТР і 4мкКюрі/мл [гамма 33Р]АТР. Полі(gІu/tyr, 4:1) є синтетичним полімером, котрий служить акцептором фосфорильних груп і може бути придбаний у Sigma Chemicals. Кіназну реакцію ініціювали добавленням ферменту, і реакційні суміші інкубували при 26°С протягом 1год. Реакцію зупиняли добавленням ЕДТК, 50ммоль/л, і білки осаджували добавленням трихлороцтової кислоти до 5%. Осаджені білки виділяли шляхом фільтрування на Packard Unifilter, і виміряли радіоактивність за допомогою лічильника Topcount. Для приготування рекомбінантного HER1 експресували цитоплазматичну послідовність рецептора в клітинах комах у формі GST злитого білка, котрий очищали методом афінної хроматографії аналогічно описаному вище для Lck. Цитоплазматичну послідовність HER2 субклонували у бакуловірусному векторі експресії рВІuеВас4 (Invitrogen) і експресували у формі неміченого білка в клітинах комах. Рекомбінантний білок частково очищали методом іонної хроматографії. Клітинні випробування Фосфорилювання клітинного тирозину Т-клітини Jurkat інкубують разом з випробуваними сполуками, а потім стимулюють шляхом добавлення антитіла проти CD3 (моноклональне антитіло G19-4). За 4хв. або в інший підходящий час клітини піддають лізису шляхом добавлення лізисного буфера, що містить детергент NP-40. Фосфорилювання білків виявляють методом антифосфотирозинового імуноблотінгу. Виявлення фосфорилювання потрібних білків, наприклад ZAP-70, здійснювали методом імуноосадження за допомогою антитіла проти ZAP-70 з наступним антифосфотирозиновим імуноблотінгом. Докладно такі методики описані в [Schieven, G. L., Mittler, R. S., Nadler, S. G., Kirihara, J. M., Bolen J. В., Kanner, S. В., and Ledbetter, J. Α., "ZAP-70 tyrosine kinase, CD45 and Τ cell receptor involvement in UV and H2O2 induced Τ cell signal transduction", J. Biol. Chem., 269, 20718-20726 (1994)] і в посиланнях цієї публікації. Інгібітори Lck пригнічують фосфорилювання тирозину клітинних білків, викликане антитілами проти CD3. Моноклональне антитіло G19-4 готують так, як описано в [Hansen, J. Α., Martin, P. J., Beatty, P. G., Clark, Ε. Α., and Ledbetter, J. Α., "Human Τ lymphocyte cell surface molecules defined by the workshop monoclonal antibodies", in Leukocyte Typing I, A. Bernard, J. Boumsell, J. Dausett, C. Milstein, and S. Schlossman, eds. (New York: Springer Verlag), p.195-212 (1984); and Ledbetter, J. Α., June, С Η., Rabinovitch, P. S., Grossman, Α., Tsu, Т. Т., and Imboden J. В., "Signal transduction through CD4 receptors: stimulatory vs. inhibitory activity is 87456 40 regulated by CD4 proximity to the CD3/T cell receptor, Eur. J. Immunol., 18, 525 (1988)]. Випробування на кальцій Інгібітори Lck блокують мобілізацію кальцію в Т-клітинах, стимульованих антитілами проти CD3. Клітини завантажують індикатором кальцію - барвником індо-1, обробляють антитілом проти CD3, наприклад моноклональним антитілом G19-4, і визначають мобілізацію кальцію методом проточної цитометрії, реєструючи зміни колірного відношення синій/фіолетовий барвника індо-1 так, як описано в [Schieven, G. L., Mittler, R. S., Nadler, S. G., Kirihara, J. M., Bolen, J. В., Kanner, S. В., and Ledbetter, J. Α., "ZAP-70 tyrosine kinase, CD45 and Τ cell receptor involvement in UV and H2O2 induced Τ cell signal transduction", J. Biol. Chem., 269, 2071820726 (1994)] і в посиланнях, поданих у цій публікації. Випробування на проліферацію Інгібітори Lck інгібують проліферацію нормальних Т-клітин периферійної крові людини, ріст яких стимульований антитілами проти CD3 плюс проти CD28. 96-лунковий планшет обробляють моноклональним антитілом до CD3 (як-от G19-4), дають антитілу можливість зв'язатися з планшетом і планшет промивають. Зв'язане з планшетом антитіло використовують для стимуляції клітин. До лунок для спільної стимуляції додають нормальні Т-клітини периферійної крові людини разом з випробуваною сполукою плюс антитіло проти CD28. Через певний час (наприклад, 3 дні) до клітин додають [3Н]-тимідин, і після подальшого інкубування для входження мітки в заново синтезовану ДНК клітини збирають і за допомогою сцинтиляційного лічильника виміряють їх проліферацію. Нижче наведені скорочення, застосовані в тексті даного опису, і приклади, що ілюструють різноманітні варіанти здійснення даного винаходу без обмеження його об'єму. Сполуки у прикладах позначені номером відповідного прикладу і номером стадії, на котрій вони одержані (так, позначення «1А» надане сполуці, отриманій на стадії А Прикладу 1), або ж тільки номером прикладу, якщо сполука була отримана в одну стадію (так, позначення «2» надане сполуці, отриманій у Прикладі 2) Скорочення aq. - водний соnc. - концентрований DMSO - диметилсульфоксид ЕtOАс - етилацетат Et2O - діетиловий етер H - година НАNU - N-[диметиламіно-1Н-1,2,3-триазол[4,5-b]піридин-1-ілметилен]-NметилметанамінийгексафторфосфатуN-оксид МеОН - метанол MOPS - 4-морфолінпропансульфокислота MS - мас-спектрометрія Ret time - час утримання (хроматограф.) RT - кімнатна температура Satd. - насичений TFA - трифтороцтова кислота THF - тетрагідрофуран DMF- Ν,Ν-диметилформамід Приклад 1 41 Одержання 1,1-диметилетилового естеру [5[[(2,4,6-триметилфеніл)аміно]карбоніл]-4-метил-2тіазоліл]карбамінової кислоти А. Етил-2-трет-бутоксикарбонілоксіаміно-4метилтіазол-5-карбоксилат Суспензію етил-2-аміно-4-метилтіазол-5карбоксилату (18,6г, 100ммоль), ди-третбутилдикарбонату (26,2г, 120ммоль) і 4диметиламінопіридину (800мг, 6,55ммоль) в сухому тетрагідрофурані (300мл) перемішали в атмосфері азоту протягом 16год. Розчинник випарили у вакуумі. Залишок суспендували в дихлорметані (1л) і профільтрували через целітовий фільтр. Фільтрат промили 1н. водним розчином НСІ (300мл, двічі), водою і соляним розчином, просушили (MgSO4) і концентрували у вакуумі. Залишок розтерли з гексаном. Твердий залишок профільтрували і просушили у вакуумі одержавши зазначену в заголовку сполуку (20г, 72%) у вигляді твердої речовини золотистого кольору. B. 2-трет-бутоксикарбонілоксіаміно-4метилтіазол-5-карбонова кислота Розчин етил-2-трет-бутоксикарбонілоксіаміно4-метилтіазол-5-карбоксилату (10г, 34,95ммоль) у суміші тетрагідрофурану з етанолом (250мл, 2:3) при перемішуванні обробили 6н. розчином КОН (250мл). Суміш нагріли до 55°С і витримали при цій температурі протягом ночі. Розчин охолодили до 0°С і підкислили концентрованою НСl до рН1. Розчинник випарили у вакуумі. Залишок промили водою, діетиловим етером і просушили у вакуумі над безводним двоп'ятиокисом фосфору, одержавши цільову кислоту (6г, 89%) у вигляді твердої речовини білого кольору. C. Хлорангідрид 2-третбутоксикарбонілоксіаміно-4-метилтіазол-5карбонової кислоти Розчин 2моль/л оксалілхлориду в дихлорметані (22,5мл, 45ммоль) по краплях добавили до перемішуваної суспензії 2-третбутоксикарбонілоксіаміно-4-метилтіазол-5карбонової кислоти (10г, 38,72ммоль) у дихлорметані (150мл) і Ν,Ν-диметилформаміді (150мкл) при 0°С. Суспензія після завершення добавлення поступово гомогенізувалася. Розчину дали відігрітися до кімнатної температури і перемішали при кімнатній температурі протягом 1,5год. Розчинник випарили у вакуумі, а залишок випарили разом з толуолом (300мл, двічі) і просушили у вакуумі, одержавши зазначений у заголовку хлорангідрид кислоти (10,7г, 99%) у вигляді твердої речовини золотистого кольору. D. 1,1-Диметилетиловий естер [5-[[(2,4.6триметилфеніл)аміно]карбоніл]-4-метил-2тіазолілікарбамінової кислоти 2,4,6-триметиланілін (6,3мл, 38,66ммоль) по краплях добавили до перемішуваного розчину хлорангідриду 2-трет-бутоксикарбонілоксіаміно-4метилтіазол-5-карбонової кислоти (10,7г, 38,66ммоль) в дихлорметані (150мл) при 0°С. Че 87456 42 рез 20хв. по краплях добавили діізопропілетиламін (8,8мл, 44,88ммоль). Розчину дали відігрітися до кімнатної температури і перемішали протягом ще 2год. Розчинник випарили у вакуумі. Залишок суспендували в ЕtOАс (700мл), промили 1 н. водним розчином НСІ (300мл, двічі), водою і соляним розчином, просушили (MgSO4), профільтрували і концентрували. Залишок розтерли з етером, отримавши зазначену в заголовку сполуку (12,5г, 86%) у вигляді твердої речовини золотистого кольору. Приклад 2 Одержання 2-аміно-N-(2,4,6триметилфеніл)-4-метил-5-тіазолкарбоксаміду Розчин 1,1-диметилетилового естеру [5[[(2,4,6-триметилфеніл)аміно]карбоніл]-4-метил-2тіазоліл]карбамінової кислоти (10г, 26,63ммоль) в трифтороцтовій кислоті (100мл) перемішали протягом 3год. при кімнатній температурі. Після цього розчин концентрували під зниженим тиском, і залишок розбавили ЕtOАс (700мл), промили 5% водним розчином KНСО3 (400мл, двічі), водою і соляним розчином, просушили (MgSO4), профільтрували і концентрували. Залишок промили етером (200мл) і ацетонітрилом (100мл), одержавши зазначену в заголовку сполуку (6,7г, 91%) у вигляді твердої речовини білого кольору. Приклад 3 Одержання 1,1-диметилетилового естеру [5[[(2,4,6-триметилфеніл)аміно]карбоніл]-4трифторметил-2-тіазоліл]карбамінової кислоти A. Етил-2-трет-бутоксикарбонілоксіаміно-4трифторметил-тіазол-5-карбоксилат Суспензію етил-2-аміно-4трифторметилтіазол-5-карбоксилату (5,05г, 21,02ммоль), ди-трет-бутилдикарбонату (4,82г, 22,07ммоль) і 4-диметиламінопіридину (260мг, 2,1ммоль) в дихлорметані (209мл) перемішали в атмосфері азоту протягом 1,5год. Розчинник випарили у вакуумі. Залишок піддали хроматографії на колонці з силікагелем. Після елюювання 5% ЕtOАс в гексані з наступним елююванням 15% ЕtOАс в гексані одержали зазначену в заголовку сполуку (6,57г, 92%) у вигляді твердої речовини білого кольору. B. 2-трет-бутоксикарбонілоксіаміно-4трифторметилтіазол-5-карбонова кислота Перемішуваний розчин етил-2-третбутоксикарбонілоксіаміно-4-трифтор-метилтіазол5-карбоксилату (6,5г, 19,1ммоль) в метанолі (100мл) обробили 1н. водним розчином NaOH (573мл). Суміш перемішали при кімнатній температурі протягом ночі. Розчин охолодили до 0°С, підкислили 6моль/л водним розчином НСІ до рН1 і екстрагували хлороформом (150мл, 6х). Екстракти в хлороформі об'єднали, просушили (Na2SO4), 43 87456 44 профільтрували і концентрували під зниженим тиском і у вакуумі, одержавши зазначену в заголовку кислоту (5,75г, 96%) у вигляді твердої речовини білого кольору. С. 1,1-Диметилетиловий естер [5-[[(2,4,6триметилфеніл)аміно]карбоніл]-4-трифторметил-2тіазолілікарбамінової кислоти До суміші 2-трет-бутокси-карбонілоксіаміно-4трифторметилтіазол-5-карбонової кислоти (100мг, 0,32ммоль), 2,4,6-триметиламіну (45мкл, 0,32ммоль) і гексафторфосфату бензотриазол-1ілокситрис-(диметиламіно)фосфонію (реагент ВОР, 380мг, 0,4ммоль) в DMF (2мл) добавили 4метилморфін (40мкл, 0,39ммоль). Розчин перемішали при кімнатній температурі протягом 72год., розбавили дихлорметаном і промили 0,25моль/л водним розчином KHSO4, а потім насиченим водним розчином KНСО3. Екстракт у дихлорметані відокремили, просушили (Na2SO4), профільтрували і концентрували. Залишок піддали хроматографії на колонці з силікагелем і елюювали 5% ЕtOАс в гексані, а потім 10% ЕtOАс в гексані, одержавши в результаті зазначену в заголовку сполуку (90г, 65%) у вигляді твердої речовини білого кольору. Приклад 4 Одержання 2-аміно-N-(2,4,6-триметилфеніл)4-трифторметил-5-тіазолкарбоксаміду, трифторацетату (1:1) B. 2-трет-бутоксикарбонілоксіаміно-4фенілтіазол-5-карбонова кислота Сполуку 5В одержували аналогічно процесу виготовлення сполуки 3В, за винятком того, що в результаті застосування 5А одержували сполуку 5В у вигляді твердої речовини білого кольору (99%). C. Хлорангідрид 2-третбутоксикарбонілоксіаміно-4-фенілтіазол-5карбонової кислоти Сполуку 5С одержували аналогічно процесу виготовлення сполуки 1С, за винятком того, що в результаті застосування 5В одержували сполуку 5С у вигляді твердої речовини білого кольору (90%). D. 1,1-Диметилетиловий естер [5-[[(2,4,6триметилфеніл)аміно]карбоніл]-4-феніл-2тіазолілікарбамінової кислоти Сполуку 5D одержували аналогічно процесу виготовлення сполуки 1D, за винятком того, що в результаті застосування сполуки 5С одержували сполуку 5D у вигляді твердої речовини світложовтого кольору (93%). Приклад 6 Одержання 2-аміно-N-(2,4,6-триметилфеніл)4-феніл-5-тіазолкарбоксаміду, трифторацетату (1:1) Розчин 1,1-диметилетилового естеру [5[[(2,4,6-триметилфеніл)аміно]карбоніл]-4трифторметил-2-тіазоліл]карбонової кислоти (120мг, 0,28ммоль) у трифтороцтовій кислоті (5мл) перемішали при 0°С протягом 1год. Далі розчин концентрували під зниженим тиском, а залишок випарили разом з етером, одержавши тверду речовину жовтого кольору, котру розтерли з гексаном, і в результаті отримали зазначену в заголовку сполуку (96мг, 76%) у вигляді твердої речовини світло-жовтого кольору. Приклад 5 Одержання 1,1-диметилетилового естеру [5[[(2,4,6-триметилфеніл)аміно]карбоніл]-4-феніл-2тіазоліл]карбамінової кислоти Сполуку 6 одержували аналогічно процесу виготовлення сполуки 4, за винятком того, що в результаті застосування 5D, одержували сполуку 6 у вигляді твердої речовини білого кольору (68%). Приклад 7 Одержання 1,1-диметилетилового естеру [5[[феніламіно]карбоніл]-4-метил-2тіазоліл]карбамінової кислоти A. Етил-2-трет-бутоксикарбонілоксіаміно-4фенілтіазол-5-карбоксилат Сполуку 5А одержували аналогічно процесу виготовлення сполуки 3А, за винятком того, що в результаті застосування етил-2-аміно-4фенілтіазол-5-карбоксилату одержали зазначену в заголовку сполуку 5А у вигляді твердої речовини білого кольору (90,5%). Зазначену в заголовку сполуку одержували аналогічно процесу виготовлення сполуки 1D, але використовуючи анілін замість 2,4,6триметиланіліну і триетиламін замість діізопропілетиламіну; в результаті одержували сполуку 7 у вигляді твердої речовини не зовсім білого кольору (76%). Приклад 8 Одержання 2-аміно-N-(феніл)-4метил-5-тіазолкарбоксаміду, трифторацетату (1:1) Сполуку 8 одержували аналогічно процесу виготовлення сполуки 4, за винятком того, що використовували сполуку 7, а утворювана в результаті 45 сполука 8 мала вигляд твердого порошку білого кольору (68%). Приклад 9 Одержання 1,1-диметилетилового естеру [5[[(2,4-дихлорфеніл)аміно]карбоніл]-4-метил-2тіазоліл]карбамінової кислоти Сполуку 9 одержували аналогічно процесу виготовлення сполуки 1D, але при використанні 2,4дихлораніліну, а утворювана сполука 9 мала вигляд твердої речовини білого кольору (28%) Приклад 10 Одержання 2-аміно-N-(2,4-дихлорфеніл)-4метил-5-тіазолкарбоксаміду, трифторацетату (1:1) Сполуку 10 одержували аналогічно процесу виготовлення сполуки 4, за винятком того, що використовували сполуку 9, а утворювана сполука 10 мала вигляд твердої речовини білого кольору (100%). Приклад 11 Одержання 1,1-диметилетилового естеру [5[[(2,4,6-триметилфеніл)аміно]карбоніл]-2тіазоліл]карбамінової кислоти A. Етил-2-третбутоксикарбонілоксіамінотіазол-5-карбоксилат. Сполуку 11А одержували аналогічно процесу виготовлення сполуки 3А, за винятком того, що використовували етил-2-амінотіазол-5карбоксилат, а утворювана сполука 11А мала вигляд твердої речовини білого кольору (79,5%). B. 2-трет-бутоксикарбонілоксіамінотіазол-5карбонова кислота Сполуку 11В одержували аналогічно процесу виготовлення сполуки 3В, за винятком того, що використовували сполуку 11А, а утворювана сполука 11В мала вигляд твердої речовини білого кольору (95,5%). С. Хлорангідрид 2-третбутоксикарбонілоксіамінотіазол-5-карбонової кис 87456 46 лоти Сполуку 11С одержували аналогічно процесу виготовлення сполуки 1С, використовуючи 11В. D. [5-[[(2,4,6-триметилфеніл)аміно]карбоніл]-2тіазоліл]карбамінової кислоти 1,1диметилетиловий естер Сполуку 11D одержували аналогічно процесу виготовлення сполуки 1D, за винятком того, що використовували 11С, а утворювана сполука 11D мала вигляд твердої речовини не зовсім білого кольору (70%). Приклад 12 Одержання 2-аміно-N-(2,4,6-триметилфеніл)4-феніл-5-тіазолкарбоксаміду, трифторацетату (1:1) Сполуку 12 одержували аналогічно процесу виготовлення сполуки 4, за винятком того, що використовували сполуку 11D, а утворювана сполука 12 мала вигляд твердої речовини світло-жовтого кольору (88%). Приклади 13-53 Загальний процес Сполуки 13-53 одержували, використовуючи такий процес. До суспензії сполуки 1С (100мг, 0,36ммоль) в дихлорметані (3мл) добавляли відповідні аміни (0,40ммоль) і діізопропілетиламін (70мкл, 040ммоль). Розчин перемішували механічним способом у герметично закритій пробірці при кімнатній температурі протягом 16год. Реакційну суміш розбавляли метанолом (200мкл) і поміщали в іонообмінні колонки (2г/6см3) Varian SCX, попередньо оброблені сумішшю метанол/дихлорметан (8мл, 1:1), а потім дихлорметаном (8мл). Фільтрацію в колонках SCX здійснювали за допомогою робота Gilson. Колонку промивали послідовно дихлорметаном (9мл), сумішшю дихлорметан/метанол (9мл, 4:1), сумішшю дихлорметан/метанол (9мл, 1:1), метанолом (9мл), 0,01моль/л розчином гідроксиду амонію в метанолі (9мл) і 0,05моль/л розчином гідроксиду амонію в метанолі (9мл). Елюати збирали відокремлено роботом і концентрували у вакуумі. Фракції, що містили цільові продукти, об'єднували. Зазначений у таблиці нижче параметр «HPLC Ret Time» являє собою час утримання при HPLC (рідинній хроматографії високого розрізнення), визначений в таких умовах: баластна колонка YMC S5 ODS 4,6´50мм, 4хв. градієнт, починаючи від 100% розчинника А (10% МеОН, 90% Н2О, 0,2% Н3РО4) і закінчуючи 100% розчинника В (90% МеОН, 10% Н2О, 0,2% Н3РО4), витрата елюенту 4мл/хв., довжина хвилі =220нм. 47 87456 48 49 87456 50 51 87456 52 53 87456 54 55 87456 56 57 Приклади 54-129 Загальний процес Сполуки 54-129 одержували у відповідності з таким процесом. Діізопропілетиламін (60мкл, 0,34ммоль добавляли до суміші аміну 2 (30мг, 0,11ммоль), відповідної карбонової кислоти (0,13ммоль), 1-гідрокси-7-азабензотриазолу (19,5мг, 0,14ммоль) і етил-3-(3диметиламіно)пропілкарбодіімідгідрохлориду (26,8мг, 0,14ммоль) в THF (0,4мл). Суміш нагрівали в герметично закритій пробірці в атмосфері аргону при 45°С протягом 24год. Реакційну суміш розбавляли дихлорметаном (4мл) і промивали 2н. водним розчином НСІ (2мл, тричі). Розчин дихлорметану перепускали через катіонообмінну колонку Varian SCX (2г, 6см3), використовуючи робот Gilson. Елюювання здійснювали послідовно сумішшю ацетонітрил/метанол (10мл, 4:1), сумішшю метанолу з 2моль/л розчином аміаку в метанолі (3мл, 4:1) і 2моль/л розчином аміаку в метанолі 87456 58 (3мл, 4х). Фракції збирали відокремлено за допомогою робота Gilson. Фракцію, що містила цільовий продукт, концентрували і просушували у вакуумі. Зазначений у таблиці нижче параметр «HPLC Ret Time» являє собою час утримання при HPLC (рідинній хроматографії високого розрізнення), визначений для сполук 54-127 в таких умовах: баластна колонка YMC S5 ODS 4,6´50мм, 4хв. градієнт, починаючи від 100% розчинника А (10% МеОН, 90% Н2О, 0,2% Н3РО4) і закінчуючи 100% розчинника В (90% МеОН, 10% Н2О, 0,2% Н3РО4), витрата елюенту 4мл/хв., довжина хвилі =220нм. Для сполук 128-129 використовувалися такі умови HPLC-хроматографії: коротка колонка Zorbax S8C18 4,5мм´7,5см, 8хв. градієнт, починаючи від 100% розчинника А (10% МеОН, 90% Н2О, 0,2% Н3РО4) і закінчуючи 100% розчинника В (90% МеОН, 10% Н2О, 0,2% Н3РО4), витрата елюенту 2,5мл/хв., довжина хвилі =217нм. 59 87456 60
ДивитисяДодаткова інформація
Назва патенту англійськоюCyclic protein tyrosine kinase inhibitors
Автори англійськоюDJAGABANDHU DAS, PING CHEN, Chen Ping, Norris Derek J., LEE FRANCIS Y F, RAMESH PADMANABHA, NORRIS DEREK J, JOEL BARRISH, LOMBARDO LOUIS J
Назва патенту російськоюЦиклические ингибиторы протеинтирозинкиназы
Автори російськоюДас Джагабандху, Падманабха Рамеш, Чен Пинг, Норрис Дерек Дж., Довейко Артур М.П., Барриш Джоел, Витьяк Джон, Ломбардо Луис Дж., Ли Францис Уай Ф.
МПК / Мітки
МПК: A61K 31/506, A61K 31/427
Мітки: інгібітори, циклічні, протеїнтирозинкіназ
Код посилання
<a href="https://ua.patents.su/94-87456-ciklichni-ingibitori-protentirozinkinaz.html" target="_blank" rel="follow" title="База патентів України">Циклічні інгібітори протеїнтирозинкіназ</a>
Попередній патент: Спосіб та пристрій для автентифікації документів та товарів
Наступний патент: Спосіб оправлення каменя у металевій деталі та інструмент для оправлення каменя
Випадковий патент: Спосіб холедохопластики з зовнішнім дренуванням та пристрій для його здійснення












