Похідні 1,2,4-триазоло[1,5с]піримідин-2-сульфонаміду і спосіб придушення небажаної рослинності
Номер патенту: 25905
Опубліковано: 26.02.1999
Автори: Уільям А. Клешик, Джон С. Ван Хеєртум, Бен Кліффорд Гервік
Формула / Реферат
1. Производные 1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамида общей формулы
где X - OCH3 или OC2H5;
Y и Z каждый независимо OCH3, OC2H5, H, CH3, Cl, Br или F;
A - F, Cl, Br, CO2R, CF3 или NO2;
B - H, F, Cl, Br, CH3, SCH3 или OCH3;
D - H или CH3;
R - C1-C3 - ал кил, обладающие гербицидной активностью.
2. Производное по п.1, представляющее собой N-(2,6-дихлор-3-метилфенил)-5,7-диметокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид.
3. Производное по п.1, представляющее собой N-(2-фтор-6-карбометилоксифенил)-7-хлор-5-метокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид.
4. Производное по п.1, представляющее собой N-(2,6-дихлорфенил)-7-фтор-5-этокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид.
5. Производное по п.1, представляющее собой N-(2-хлор-6-карбометилоксифенил)-7-фтрр-5-этокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид.
6. Производное по п.1, представляющее собой N-(2,6-дифторфенил)-8-хлоро-5-метокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид.
7. Производное по п.1, представляющее собой N-(2-фтор-6-карбометилоксифенил)-8-фтор-5-метокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид.
8. Производное по п.1, представляющее собой N-(2,6-дифторфенил)-8-фтор-5-метокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид.
9. Производное по п.1, представляющее собой N-(2-хлор-6-фторфенил)-7-фтор-5-этокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид.
10. Способ подавления нежелательной растительности, отличающийся тем, что указанную растительность или очаги ее распространения обрабатывают соединениями общей формулы
где X - OCH3 или OC2H5;
Y и Z каждый независимо OCH3, OC2H5, H, CH3, Cl, Br или F;
A- F, Cl, Br, CO2R, CF3 или NO2;
B - H, F, Cl, Br, CH3, SCH3 или OCH3;
D - H или CH3;
R - C1-C3 - алкил,
в количестве - 5 - 313г/га.
11. Способ по п.10, отличающийся тем, что используемое соединение является N-(2,6-дихлор-3-метилфенил)-5,7-диметокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамидом.
12. Способ по п.10, отличающийся тем, что используемое соединение является N-(2-фтор-6-карбометилоксифенил)-7-хлор-5-метокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамидом.
13. Способ по п.10, отличающийся тем, что используемое соединение является N-(2,6-дихлорфенил)-7-фтор-5-этокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамидом.
14. Способ по п.10, отличающийся тем, что используемое соединение является N-(2-хлор-6-карбометилоксифенил)-7-фтор-5-этокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамидом.
15. Способ по п.10, отличающийся тем, что используемое соединение является N-(2,6-дифторфенил)-8-хлоро-5-метокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамидом.
16. Способ по п.10, отличающийся тем, что используемое соединение является N-(2-фтор-6-карбометилоксифенил)-8-фтор-5-метокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамидом.
17. Способ по п.10, отличающийся тем, что используемое соединение является N-(2,6-дифторфенил)-8-фтор-5-метокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамидом.
18. Способ по п.10, отличающийся тем, что используемое соединение является N-(2-хлор-6-фторфенил)-7-фтор-5-этокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамидом.
Текст
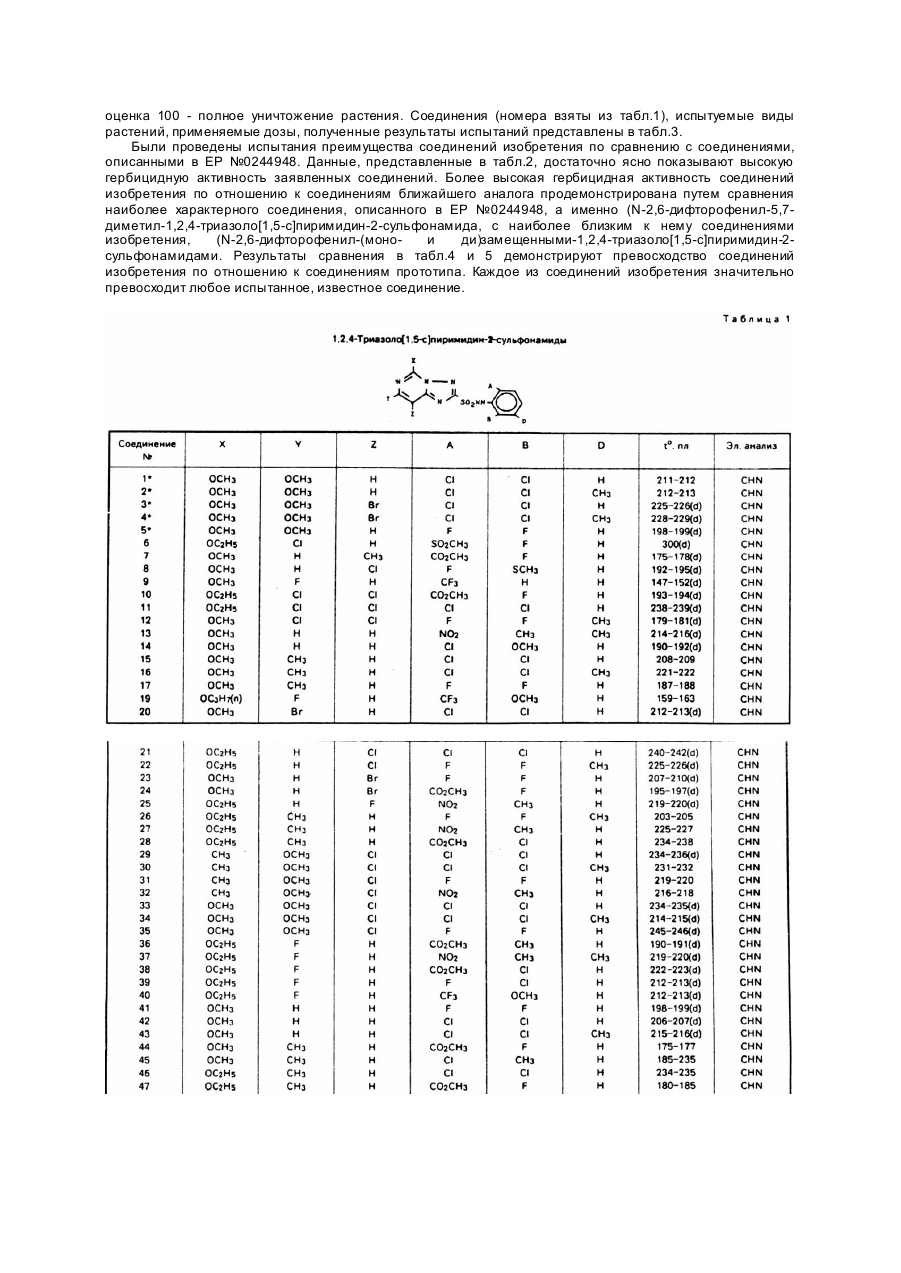
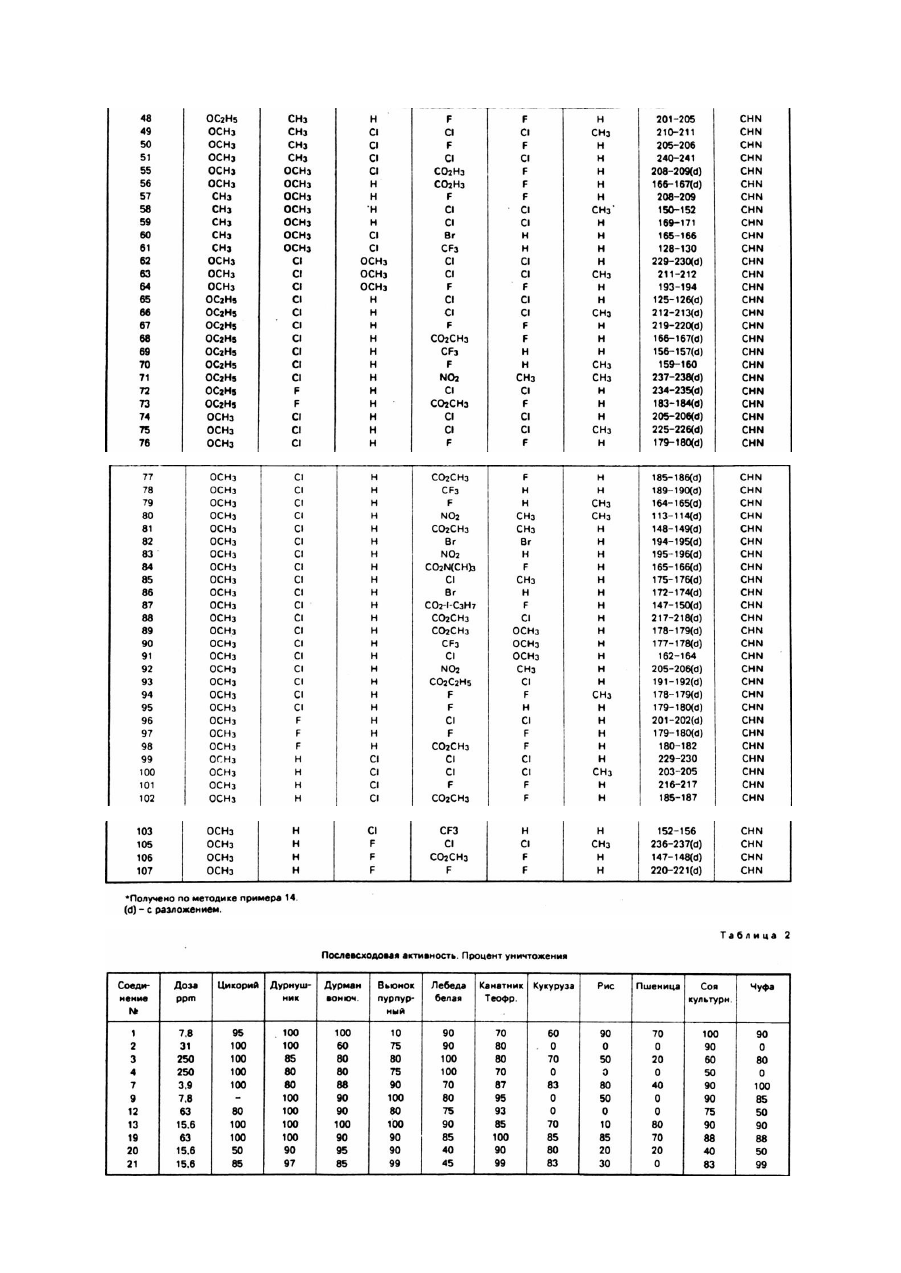
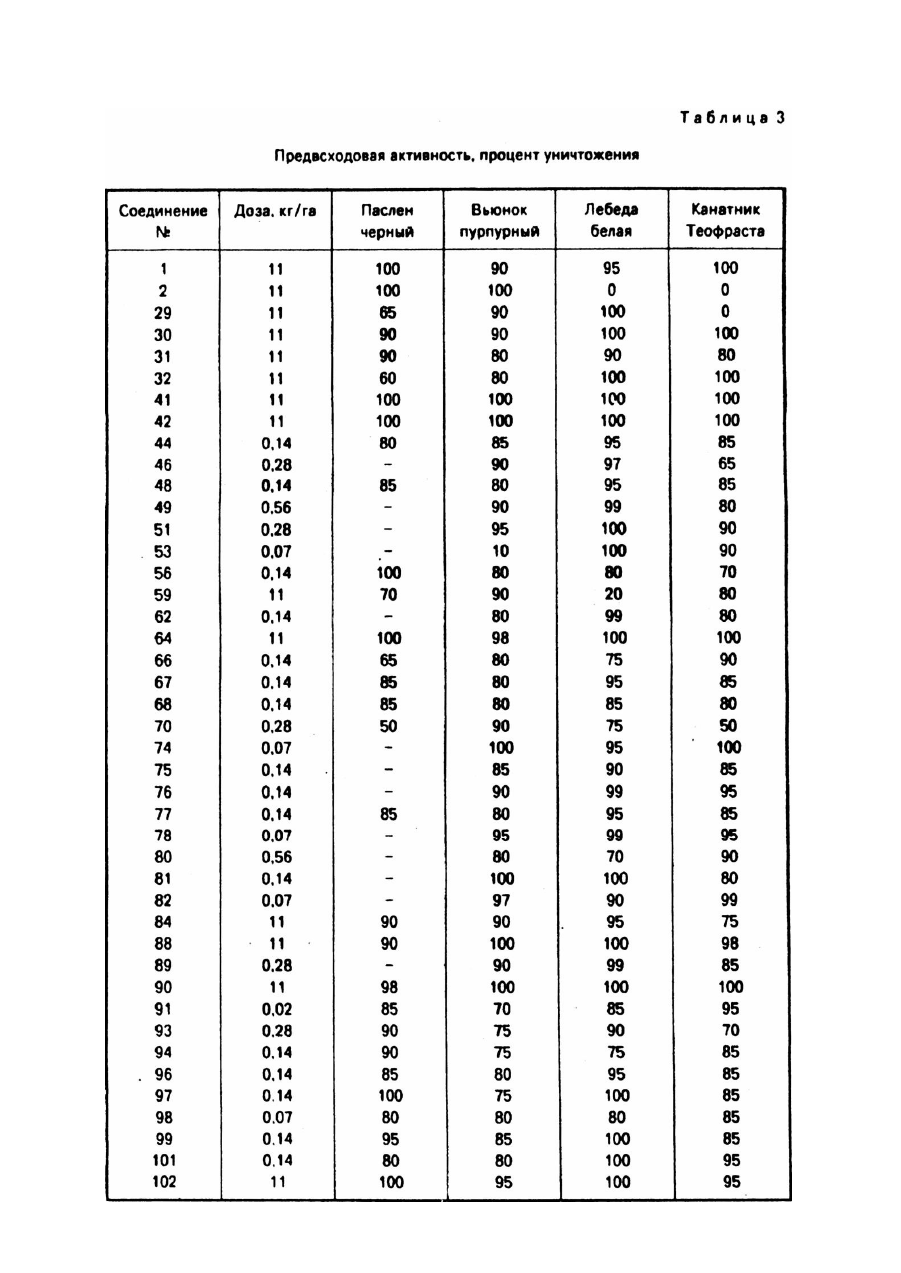
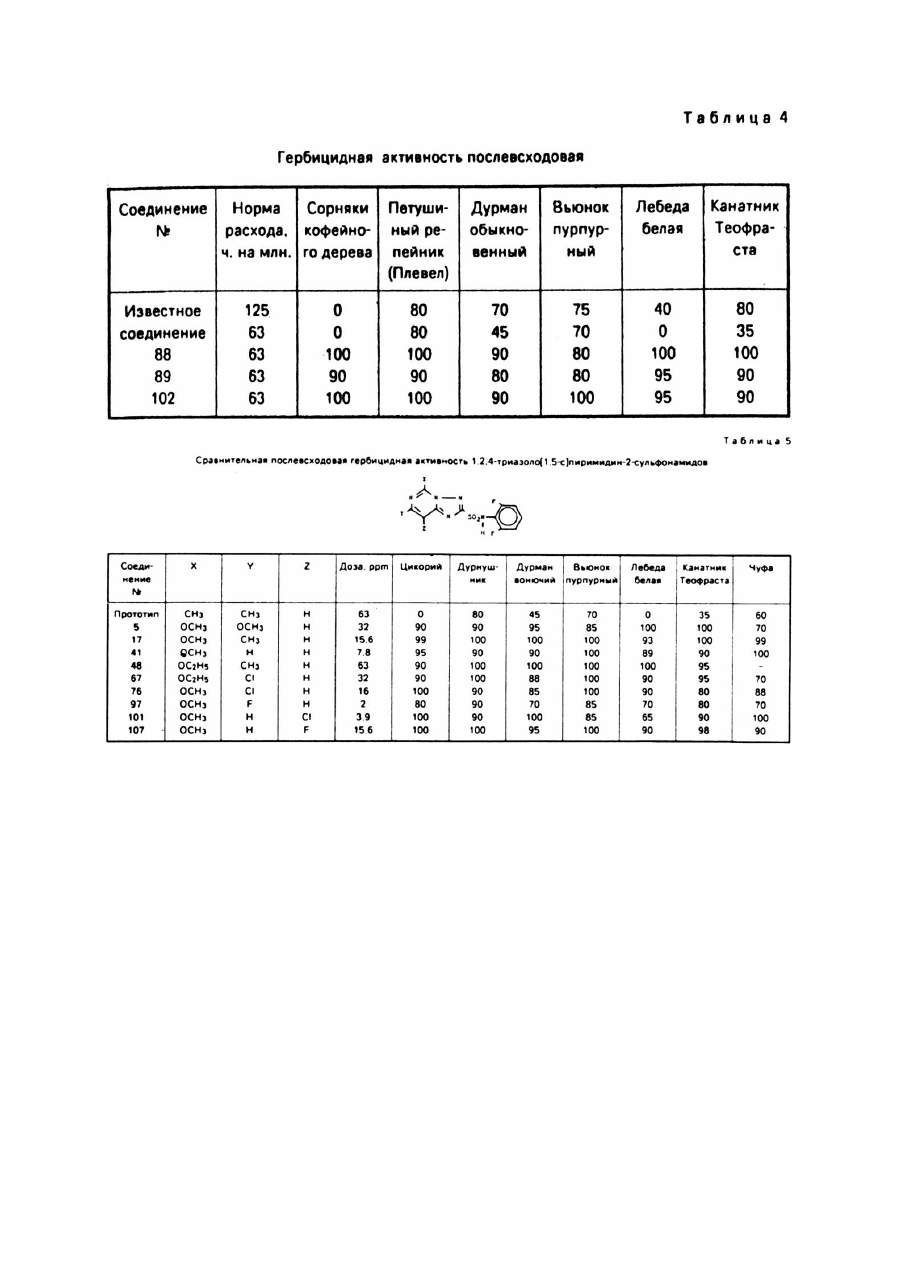
Изобретение относится к новым алкоксизамещенным 1,2,4-триазоло[1,5-с]пиримидин-2сульфонамидным соединениям и использованию указанных соединений с целью борьбы с нежелательной растительностью. Борьба с нежелательной растительностью при помощи химических средств, т.е. гербицидов, является важным аспектом современного сельского хозяйства и агротехники. И хотя в настоящее время имеется много различных химических средств, применяемых в целях борьбы с сорняками, новые соединения изобретения, обладающие более высокой общей или специфической к определенным видам растений активностью, являются при этом менее токсичными к возделываемым культурам, безопасными для человека и окружающей среды, менее дорогостоящими для использования или обладают другими ценными преимуществами. Известно, что некоторые 1,2,4-триазоло[1,5-а]пиримидин-2-сульфонамиды обладают гербицидной активностью (Европейская заявка №0142152, опубл. 22 мая 1985г.). Указанные соединения являются эффективными при использовании их против сорняков в очагах и х распространения путем довсходовой или послевсходовой обработки. Описаны также различные способы получения указанных гербицидов и необходимых промежуточных продуктов, 1,2,4-триазоло[1,5-а]-1,3,5-триазин-2-сульфонамиды, обладающие гербицидными свойствами, также являются известными такие, например, (патент США №4605433), как имидазоло[1,2-а]пиримидин-2-сульфонамиды (патент США №4731446) и пиразоло[1,5а]пиримидин-2-сульфонамиды. Было обнаружено, что алкокси/замещенные-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамиды формулы I где X представляет OCH3 или OC2H5; Y и Z каждый независимо представляет OCH3, OC2H5, H, CH 3, Cl, Br или F; A представляет F, Cl, Br, CO 2R, CF 3 или NO2 ; B представляет H, F, Cl, Br, CH 3, SCH3 или OCH3; D представляет H или CH3; R представляет C1-C3 - алкил, обладают активностью против нежелательной растительности и могут быть использованы в борьбе против нежелательной растительности в присутствии кормовых культур и соевых культур. Соединения формулы I, используемые обычно в виде гербицидных композиций, содержащих указанные соединения в сочетании с агрономически приемлемыми адъювантом или носителем, проявляют гербицидные свойства при применении их непосредственно к очагам распространения нежелательной растительности или путем довеходовой или послевсходовой обработки. Типичные соединения изобретения представлены в табл.1. 1,2,4-Триазоло[1,5-с]пиримидин-2-сульфонамиды формулы I могут быть использованы непосредственно в качестве гербицидов, однако предпочтительно использовать их в смесях, содержащих гербицидно эффективное количество указанного соединения в сочетании по крайней мере с одним агрономически приемлемым адъювантом или носителем. Соответствующими адъювантами или носителями должны быть нетоксичные к возделываемым культурам вещества, особенно в концентрациях, используемых при составлении композиций, предназначенных для применения в целях избирательного воздействия на сорняки в присутствии возделываемых культур; указанные адъюванты или носители также не должны вступать в химические реакции с соединениями формулы I или др угими ингредиентами композиции. Эти смеси могут быть предназначены для применения непосредственно к сорнякам или к очагам их распространения, или же могут быть концентратами, или препаратами, которые перед употреблением обычно разбавляют с добавочными носителями или адъювантами. Они могут быть твердыми веществами, такими как порошки, гранулы, диспергируемые в воде гранулы или смачиваемые порошки; либо жидкими веществами, такими как эмульсионные концентраты, растворы, эмульсии или суспензии. Соответствующие агрономически приемлемые адъюванты и носители, которые обычно применяются при изготовлении гербицидных смесей, хорошо известны специалистам. Соединения формулы I являются ценными предвсходовыми и послевсходовыми гербицидами. Некоторые из соединений формулы I обладают ценными свойствами в качестве избирательных гербицидов против широколистых сорняков и против осокообразных сорняков в злаках, таких как кукуруза, пшеница, ячмень и рис, и особенно в качестве избирательных гербицидов против широколистых сорняков, произрастающих в пшенице и кукурузе. Другие соединения могут быть использованы в борьбе против широколистных сорняков, произрастающих в сое культурной. Примерами таких широколистных сорняков могут служить различные виды грудинки колючей, вьюнок пурпурный, дурнушник, дурман обыкновенный, канатник Теофраста, лебеда белая и паслен черный. Указанные соединения можно также использовать против таких травянистых сорняков, как росичка и лисохвост. Однако, как известно любому специалисту, не все соединения можно применять против всех указанных сорняков и не все они являются избирательными для всех указанных возделываемых культур. Гербицидно эффективными или подавляющими растительность количеством является количество активного ингредиента, вызывающее неблагоприятное воздействие на естественный рост растения, включая его уничтожение, обезвоживание, замедление его роста и т.п. Термины "растения" и "растительность" означает проросшие семена, всходы и укоренившееся растение. Соединения изобретения проявляют гербицидную активность при применении их непосредственно к растению или к очагу его распространения в стадии его роста или прорастания. Наблюдаемый эффект зависит от вида сорняков, стадии их роста, параметров разведения и размеров распыляемых капель, размеров частиц твердых компонентов, условий окружающей среды во время применения соединений, конкретно используемых соединений вида используемых адъювантов и носителей, типа почвы и т.п., а также количества применяемых химических веществ. Перечисленные выше и другие факторы могут быть подобраны специалистами для стимулирования избирательного гербицидного действия. Для получения максимального эффекта при применении к широколистным сорнякам, в основном предпочтительно использовать соединения изобретения в послевсходовый период к относительно незрелым растениям. Предпочтительно также использовать указанные соединения в условиях, при которых широколистные сорняки уничтожаются в присутствии пшеничной культуры. Применяемые дозы при послевсходовой обработке в основном составляют 0,001 - 10кг/га, а при предвсходовой обработке эти дозы в основном составляют 0,01 - 10кг/га, предпочтительно от 5 до 313г/га. Пример 1. Получение 4,5-дихлоро-6-метокси-2-метилпиримидина. Раствор, содержащий 38г (0,17М) 2-метил-4,5,6-трихлоропиримидина в 200мл метанола охлаждают в ледяной бане до 10 - 15°C и медленно добавляют метоксид натрия в виде 25% - ного раствора в метаноле, при этом перемешивая до тех пор, пока исходный пиримидин не будет обнаруживаться посредством ГХ. Затем добавляют воду и полученную смесь экстрагируют метиленхлоридом. После удаления из экстракта растворителя и других ле тучи х ве ществ п утем выпаривания при пониженном давлении получают целевое соединение в виде белого порошка с точкой плавления 77 - 78°C. Пример 2. Получение 4,6-дихлоро-2-метилтиопиримидина. Суспензию, содержащую 21,9г (0,377М) фторида калия в 200мл N-метилпирролидона, получают в реакционной колбе, которую затем нагревают с целью удаления влаги. Когда температура достигает 200°C, смесь охлаждают приблизительно до 85°C и добавляют 24,5г (0,126М) 4,6-дихлоро-2метилтиопиримидина, при этом перемешивая. Затем смесь нагревают, перемешивая при этом при температуре приблизительно 144°C и пониженном давлении около 150мм рт.ст., медленно удаляя растворитель и целевое соединение путем перегонки. Эту процедуру продолжают до тех пор, пока в колбе не остается очень небольшое количество жидкости. Дистиллят и остаток объединяют и разбавляют эфиром и полученную смесь экстрагируют водой несколько раз. Оставшийся эфирный раствор сушат сульфатом магния и концентрируют при пониженном давлении для получения остатка. После перегонки кипящую фракцию приблизительно при 127°C и при давлении 150мм рт.ст. собирают и получают целевое соединение (16,1г) в виде кристаллов белого цвета с точкой плавления 31 - 32°C. Пример 3. Получение 4,6-дибромо-2-метилтиопиримидина. Смесь, состоящую из 20,0г (0,126М) 4,6-дигидрокси-2-метилтиопиримидина, 150г (0,523М) оксибромида фосфора и 600г эцетонитрила, нагревают в колбе с обратным холодильником в течение 3ч. Твердые вещества, которые сначала проявляют тенденцию к растворению, затем начинают формироваться в твердые частицы. Летучие ве щества удаляют путем выпаривания при пониженном давлении, а остаток разбавляли метиленхлоридом, а затем осторожно водой. Водный слой удаляют, а органический слой несколько раз экстрагируют водой, суша т сульфатом магния и концентрируют при пониженном давлении. Остаток растворяют в гексане, а полученный раствор сушат сульфатом магния и концентрируют при пониженном давлении, в результате чего получают 26,8г целевого соединения в виде белого порошка с температурой плавления 82 - 84°C. Пример 4. Получение 5-хлоро-4-метокси-2-метил-6-гидразинопиримидина. Получают смесь, содержащую 21г 4,5-дихлоро-6-метокси-2-метиленпиримидина (0,11М), 25мл гидразингидрата и 25мл воды, и нагревают ее в колбе с обратным холодильником в течение 25мин. Затем смесь охлаждают и экстрагируют метиленхлоридом. Экстракт промывают водой, сушат сульфатом магния и концентрируют при пониженном давлении. Твердый остаток экстрагируют гексаном и сушат, в результате чего получают 12,8г (теоретически 62%) целевого соединения в виде пемзообразного твердого вещества белого цвета с точкой плавления 158 - 159°C. Приведенные ниже соединения получают аналогичным способом с использованием описанной выше методики и при соответствующем корректировании реакционной температуры: 4-бромо-2-метилтио-6-гидразинопиримидин в виде порошка не совсем белого цвета с точкой плавления 153 - 154°C; 4-метил-2-метилтио-6-гидразинопиримидин в виде белого порошка с точкой плавления 136 - 137°C; 5-хлоро-2-метилтио-4-гидразинопиримидин в виде белого порошка с температурой плавления 154 155°C; 2-метилтио-4-гидразинопиримидин в виде порошка желтовато-коричневого цвета с температурой плавления 138 - 139°C. Пример 5. Получение 4-фторо-2-метилтио-6-гидразинопиримидина. Раствор 15,8г (0,097М) 4,6-дифторо-2-метилтиопиримидина в 50мл этанола медленно добавляют, перемешивая, к раствору 11,6мл (12,0г 0,214М) гидразинмоногидрата в 100мл этанола, поддерживая температуру ниже 0°C путем внешнего охлаждения. Реакционную смесь подвергают взаимодействию еще 30мин, а затем летучие вещества удаляют путем выпаривания при пониженном давлении. Остаток разбавляют этилацетатом, а полученный раствор экстрагируют водой, сушат сульфатом магния и концентрируют при пониженном давлении, в результате чего получают 16,0г целевого соединения в виде белого порошка с температурой плавления 153 - 154°C. Элементный анализ для C5H7FN4S Вычислено, %: C 34,5, H 4,05, N 32,2 Найдено, %: C 34,5, H 3,94, N 32,2 Пример 6. Получение 4-хлоро-2-метилтио-5-метокси-6-гидразинопиримидина. Смесь, состоящую из 48,1г (0,21М) 4,6-дихлоро-2-метилтио-5-метоксипиримидина. 29,5г (0,21М) карбоната калия, 80мл гидразиномоногидрата и 80мл воды, нагревают в колбе с обратным холодильником, перемешивая в течение 30мин, так как за это время, как показывал анализ посредством ВЭЖХ, реакция завершается. Затем смесь охлаждают и экстрагируют метиленхлоридом. Экстракт сушат сульфатом магния и концентрируют при пониженном давлении. Затем остаток смешивают с гексаном, а твердые вещества удаляют фильтрацией и сушат, в результате чего получают 34,7г целевого соединения в виде твердого вещества желто-коричневого цвета с температурой плавления 118 119°C. Пример 7. Получение 2-бензилтио-8-хлоро-7-метокси-5-метил-1,2,4-триазоло[1,5-с]пиримидина. 5-Хлоро-4-метокси-2-метил-6-гидразинопиримидин (11,3г 0,060М), 13,7г (0,18М) сероуглерода, 15,6г (0,072М) метоксида натрия в виде 25% - ного раствора в метаноле и 250мл этанола объединяют, перемешивают в течение 1ч при комнатной температуре, а затем нагревают в колбе с обратным холодильником в течение 2ч, так как за это время, как показывал анализ ВЭЖХ, реакция завершается. Затем добавляют бензилхлорид (9,1г, 0,072М), продолжая при этом нагревать с обратным холодильником и перемешивать. Твердые вещества тотчас же отделяют. За тем добавляют добавочные небольшие количества метоксида натрия и бензилхлорида до тех пор, пока ВЭЖХ-анализ не покажет, что реакция бензилирования завершилась. После чего смесь охлаждают и добавляют 10мл уксусной кислоты. Полученную смесь разбавляют водой до приблизительно 1л и экстрагируют метиленхлоридом. Экстракт промывают водой, сушат сульфатом магния и концентрируют при пониженном давлении. Остаток от выпаривания растирают с гексаном, фильтруют и сушат. Затем его перекристаллизовывают из метанола и получают 16,3г (85% теоретически) целевого соединения в виде не совсем белого цвета порошка с температурой плавления 115 - 116°C. Элементарный анализ для C14H13CIN4OS Вычислено, %: C 52,4, H 4,08, N 17,47 Найдено, %: C 52,3; H 4,04, N 17,14 Пример 8. Получение З-бензилтио-7-фторо-5-метилтио-1,2,4-триазоло[4,3-с]пиримидина. 4-Фторо-2-метилтио-6-гидразинопиримидин (15,0г, 0,086М), 15,5мл (19,7г, 0,258М), сероуглерода, 48мл (34,8г, 0,344М) триэтиламина и 400мл этанола объединяют, перемешивают и через 15мин нагревают в колбе с обратным холодильником, перемешивая при этом в течение 2,5ч. Полученную смесь охлаждают до комнатной температуры и, перемешивая, добавляют 16,4г (0,129М) бензилхлорида, после чего подвергают реакции в течение 3 часов. Летучие вещества удаляют выпариванием при пониженном давлении, а остаток растворяют в метиленхлориде. Полученный раствор экстрагируют водой, сушат сульфатом магния и концентрируют при пониженном давлении. Остаток растирают с гексаном и фильтруют, в результате чего получают 20,9г целевого соединения в виде порошка желто-оранжевого цвета с температурой плавления 74 - 77°C. Присутствует также небольшое количество 2-бензилтио-7фторо-5-метилтио-1,2,4-триазоло[1,5-с]пиримидина. ЯМР- и УФ-спектры показывают соответственно с предлагаемой структурой и наличие примеси. Приведенные ниже соединения получают аналогичным способом, и полученные продукты имеют ЯМРи УФ-спектры, соответствующие спектрам предлагаемых структур: 3-бензилтио-7-хлоро-5-метилтио-1,2,4-триазоло[4,3-с]пиримидин, в виде порошка светло-желтого цвета с точкой плавления 131 - 132°C; 3-бензилтио-7-метил-5-метилтио-1,2,4-триазоло[4,3-с]пиримидин, в виде светло-желтого порошка с точкой плавления 138 - 139°C; 3-бензилтио-7-бромо-5-метилтио-1,2,4-триазоло[4,3-с]пиримидин, в виде желтовато-коричневого порошка с температурой плавления 125 - 127°C; 3-бензилтио-7-бромо-5-метилтио-1,2,4-триазоло[4,3-с]пиримидин, в виде порошка не совсем белого цвета с температурой плавления 108 - 109°C; и 3-бензилтио-8-хлор-5-метилтио-1,2,4-триазоло[4,3-с]пиримидин в виде вязкого масла красного цвета, содержащего значительное количество 1,5-с изомера, т.пл. 103 - 106°C, выделенный независимо. Пример 9. Получение 2-бензилтио-7-фторо-5-метокси-1,2,4-триазоло[1,5-с]пиримидина. 25% - ный раствор метоксида натрия в метаноле (1,9мл, 0,085М) добавляют в раствор 19,9г (0,065М) 3-бензилтио-7-фторо-5-метилтио-1,2,4-триазоло[4,3-с]пиримидина, содержащего небольшое количество 2бензилтио-7-фторо-5-метилтио-1,2,4-триазоло[1,5-с]пиримидина и 11,2г (0,065М) диэтилмалеата в 250мл этанола, размешивая при комнатной температуре, а затем реакционную смесь оставляют для реакции приблизительно на 1ч. Затем добавляют уксусн ую кислоту (4мл), а летучие ве щества удаляют п утем выпаривания при пониженном давлении. Остаток растворяют в метиленхлориде, а полученный раствор экстрагируют водой, суша т сульфатом магния и концентрируют путем выпаривания при пониженном давлении. Остаток растирают с гексаном, фильтруют и сушат, в результате чего получают 10,7г целевого соединения в виде белого порошка с точкой плавления 121 - 122°C. ЯМР- и УФ-спектры полученного соединения показали соответствие с предлагаемой структурой. Приведенные ниже соединения были получены аналогичным способом и имели их ЯМР- и УФспектры, соответствующие спектрам предлагаемых структур: 2-бензилтио-7-хлоро-5-метокси-1,2,4-триазоло[1,5-с]пиримидин, порошок не совсем белого цвета с температурой плавления 121 - 122°C, имеющий соответствующий CHN-анализ; 2-бензилтио-7-хлоро-5-этокси-1,2,4-триазоло[1,5-с]пиримидин, белый порошок с точкой плавления 85 86°C; 2-бензилтио-7-метил-5-метокси-1,2,4-триазоло[1,5-с]пиримидин, белый порошок с точкой плавления 93 - 94°C; 2-бензилтио-7-метил-5-этокси-1,2,4-триазоло[1,5-с]пиримидин, белый порошок с точкой плавления 77 78°C; 2-бензилтио-5-метокси-1,2,4-триазоло[1,5-с]пиримидин, порошок светло-желто-коричневого цвета с точкой плавления 96 - 97°C; 2-бензилтио-8-хлоро-5-метокси-1,2,4-триазоло[1,5-с]пиримидин, порошок бледно-желтого цвета с точкой плавления 109 - 110°C; 2-бензилтио-7-хлоро-5,8-диметокси-1,2,4-триазоло(1,5-с]пиримидин, порошок светло-желтокоричневого цвета с точкой плавления 94 - 95°C. Пример 10. Получение 5-хлоро-7-метокси-2-бензилтио-1,2,4-триазоло[1,5-с]пиримидина. 2,4-Диметокси-6-гидразинопиримидин 48,4г (0,28М), 121,6г (1,6М) сероуглерода, 145,2г (1,44М) триэтиламина и 2л этанола объединяют, перемешивая, и через 30мин нагревают в колбе с обратным холодильником в течение 2ч. Затем добавляют бензилхлорид 40,4г (0,32М) и продолжают нагревание с обратным холодильником еще 1ч. Затем смесь концентрируют при пониженном давлении, а остаток объединяют с 800мл ацетонитрила и 250мл оксихлорида фосфора. Смесь нагревают с обратным холодильником, перемешивая, в течение 3ч. Затем ее концентрируют при пониженном давлении и остаток выливают в смесь льда и метиленхлорида. Органическую фазу отделяют, фильтруют через силикагель и концентрируют при пониженном давлении. Остаток экстрагируют горячим гексаном, а затем гексан удаляют выпариванием. Указанную фракцию очищают при помощи препаративной ВЭЖХ и получают около 5г целевого соединения. Вещества, не растворившиеся в гексане, растворяют в нагретом четыреххлористом углероде. В результате фильтрации и выпаривания четыреххлористого углерода получают маслянистое вещество, которое затвердевает, если в него добавить небольшое количество ацетона. Его объединяют с заранее выделенным продуктом и экстрагируют нагретым гексаном. Остаток сушат и получают 31,2г (теоретически 36%) целевого соединения в виде порошка бледно-желтого цвета 95% чистоты. Образец, который затем очищают при помощи ВЭЖХ, плавится при 140 - 141°C. Элементный анализ для C134H11CIN4OS Вычислено, %: C 50,89, H 3,61, N 18,26 Найдено, %: C 50,00, H 3,62, N 18,44 Соединение 8-бромо-5-хлоро-7-метокси-2-бензилтио-1,2,4-триазоло[1,5-с]пиримидин получают аналогичным способом; проведенный элементный анализ показал удовлетворительные результаты, его точка плавления составляет 124 - 125°C. Пример 11. Получение 8-хлоро-2-хлоросульфонил-7-метокси-5-метил-1,2,4-триазоло[1,5с]пиримидина. 2-Бензилтио-8-хлоро-7-метокси-5-метил-1,2,4-триазоло[1,5-с]пиримидин (2,0г; 0,0060М), 50мл хлороформа и 50мл воды объединяют и смесь охлаждают в ледяной ванне. Затем медленно добавляют газообразный хлор (4,4г, 0,060М), перемешивая и поддерживая температуру ниже 10°C. Затем смесь перемешивают еще 30мин, после чего водный слой удаляют, а органический слой сушат сульфатом натрия и концентрируют при пониженном давлении. Остаток растирают с гексаном и получали твердый продукт, который выделяют фильтрацией и сушат, в результате чего получают 1,6г (теоретически 90%) целевого соединения в виде белого порошка с точкой плавления 100 - 101°C. Приведенные ниже соединения получают аналогичным способом, они имеют ЯМР- и УФ-спектры, соответствующие н ужным структурам: 8-хлоро-2-хлоросульфонил-5-метокси-1,2,4-триазоло[1,5-с]пиримидин, порошок белого цвета с точкой плавления 122 - 124°C; 2-хлоросульфонил-7-фторо-5-метокси-1,2,4-триазоло[1,5-с]пиримидин, порошок белого цвета сточкой плавления 106 - 107°C; 7-хлоро-2-хлоросульфонил-5,8-диметокси-1,2,4-триазоло[1,5-с]пиримидин, порошок бледно-желтого цвета с точкой плавления 132 - 133°C; 2-хлоросульфонил-5-метокси-1,2,4-триазоло[1,5-с]пиримидин, порошок белого цвета с точкой плавления 128 - 129°C; 7-хлоро-2-хлоросульфонил-5-метокси-1,2,4-триазоло[1,5-с]пиримидин, бледно-желтый порошок с точкой плавления 136 - 137°C; 7-хлоро-2-хлоросульфонил-5-этокси-1,2,4-триазоло[1,5-с]пиримидин, порошок белого цвета с точкой плавления 99 - 101°C; 2-хлоросульфонил-5-метокси-7-метил-1,2,4-триазоло[1,5-с]пиримидин, белый порошок с точкой плавления 104 - 106°C. Пример 12. Получение 5-хлоро-7-метокси-2-хлоросульфонил-1,2,4-триазоло[1,5-с]пиримидина. 5-Хлоро-7-метокси-2-бензилтио-1,2,4-триазоло[1,5-с]пиримидин (10,0г, 0,033М), 200мл хлороформа и 200мл воды объединяют и охлаждают в ледяной бане. Затем, перемешивая, медленно добавляют газообразный хлор (10,2г, 0,143М), поддерживая при этом температуру приблизительно ниже 3°C, и продолжают перевешивать еще 30мин. Затем органическую фазу отделяют, сушат сульфатом магния и концентрируют при пониженном давлении, в результате чего получают 9,1г (теоретически 97%) целевого соединения в виде полутвердого вещества желтого цвета. Небольшую часть очи щают, растирая с эфиром, и получают белый порошок с точкой плавления 79 - 80°C. Приведенное ниже соединение было получено аналогичным способом: 8-бромо-5-хлоро-7-метокси-2-хлоросульфонил-1,2,4-триазоло[1,5-с]пиримидин: т.пл. 164 - 166°C. Пример 13. Получение 2,6-дихлорофенил-8-хлоро-7-метокси-5-метил-1,2,4-триазоло[1,5-с]пиримидин2-сульфонамида. Безводный йодит натрия (11,7г, 0,078М) помещают в 50мл сухого ацетонитрила и, перемешивая, добавляют 8,5г (0,078М) триметилсилилхлорида. Затем к смеси добавляют 6,3г (0,039М) 2,6дихлоранилина и 7,9г (0,078М) триэтиламина. Смесь перемешивают при комнатной температуре в течение 30мин, затем летучие ве щества осторожно удаляют путем выпаривания при пониженном давлении, а остаток разбавляют эфиром и фильтруют. Анализ путем газовой хроматографии показал, что раствор содержит N-триметилсилил-2,6-дихлороанилин около 97% чистоты. Затем повторяют процедуру осаждения не растворенных веществ эфиром, после чего эфир удаляют путем выпаривания при пониженном давлении. Остаток смешивают с 50мл сухого ацетонитрила, 3,9г (0,013М) 8-хлоро-2хлоросульфонил-7-метокси-5-метил-1,2,4-триазоло[1,5-с]пиримидина, и 0,2мл (0,008М) диметилсульфоксида и полученную смесь перемешивают в течение ночи. Затем смесь концентрируют при пониженном давлении, а твердый остаток смешивают с гексаном и водой и фильтруют. Затем остаток растворяют в 400мл метиленхлориде и полученный раствор дважды экстрагируют водой, высушивают сульфатом натрия и фильтруют, после чего концентрируют при пониженном давлении, а остаток смешивают с гексаном, собирают фильтрацией и сушат, в результате чего получают 3,3г (70% теоретически) целевого соединения в виде порошка бледно-желтого цвета с точкой плавления 255 - 256°C с разложением. Элементный анализ для C17H10Cl3N5O3S Вычислено, %: C 36,94, H 2,38, N 16,57 Найдено, %: C 26,98, H 2,41, N 16,30 Приведенные ниже соединения и другие соединения, свойства которых даны в табл.1, являются промежуточным для получения соединений, получены аналогичным способом и имеют удовлетворительные элементы (CHN) анализы и ЯМР-спектры, соответствующие желаемым структурам: N-(2,6-дихлорофенил)-5-хлоро-7-метокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид: порошок не совсем белого цвета; N-(2,6-дихлоро-3-метилфенил)-5-хлоро-7-метокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид: т.пл. 204 - 205°C; N-(2,6-дихлорофенил)-8-бромо-5-хлоро-7-метокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид: порошок, N-(2,6-дихлоро-3-метилфенил)-8-бромо-5-хлоро-7-метокси-1,2,4-триазоло[1,5-с]пиримиднн2сульфонамид: порошок желто-коричневого цвета; N-(2,6-дихлоро-3-метилфенил)-8-хлоро-7-метокси-5-метил-1,2,4-триазоло[1,5-с]пиримидин-2сульфонамид: т.пл. 234 - 236°C. Пример 14. Получение N-(2,6-дихлорофенил)-5,7-диметокси-1,2,4-триазоло[1,5с]пиримидин-2сульфонамида. N-(2,6-дихлорофенил-5-хлоро-7-метокси-1,2,4-триазоло(1,5-с]пиримидин-2-сульфонамид (0,8г, 0,002мл) смешивают с 25мл метанола и, перемешивая, добавляют 1,34мл 25% - ного метоксида натрия в метаноле (0,006М). Через 10мин добавляют 2мл уксусной кислоты и полученную смесь концентрируют при пониженном давлении. Остаток растворяют в метиленхлориде и раствор экстрагируют водой, сушат сульфатом натрия и концентрируют при пониженном давлении. Остаток смешивают с четыреххлористым углеродом, собирают фильтрацией и сушат, в результате чего получают 0,5г целевого соединения в виде порошка не совсем белого цвета с точкой плавления 211 - 212°C. Элементный анализ для C13H11Cl2N5O4S Вычислено, %: C 38,62, H 2,74, N 17,33 Найдено, %: C 38,09, H 2,82, N 17,18 Приведенные ниже соединения получают аналогичным способом, они показали удовлетворительные результаты при элементном анализе и ЯМР-анализе: N-(2,6-дихлоро-3-метилфенил)-5,7-диметокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид: т.пл. 212 - 213°C; N-(2,6-дихлорофенил)-8-бромо-5,7-диметокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид: т.пл. 228 - 229°C (разл.); и N-(2,6-дихлоро-3-метилфенил)-8-бромо-5,7-диметокси-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамид: т.пл. 228 - 229°C (разл.). Пример 15. Оценка послевсходовой гербицидной активности. Наиболее типичные соединения формулы I оценивают на послевсходовую гербицидную активность против различных видов растений. Для этого испытуемые растения выращивают до высоты около 4 дюймов (10см), а затем при помощи стандартной аппаратуры их опрыскивают водным составом, содержащим определенные концентрации соединений изобретения. Составы для разбрызгивания изготавливают путем смешивания требуемого количества активного ингредиента и эмульгатора или диспергатора в водном ацетоновом носителе для образования эмульсии или дисперсии. Контрольные растения опрыскивают тем же способом и аналогичными составами, в которых отсутствует активный ингредиент. После чего растения содержат в оранжерее в условиях, способствующи х росту растений. Через две недели после обработки рост растений оценивают по шкале от 0 до 100, где оценка 0 означает отсутствие эффекта, а оценка 100 - полное уничтожение растения. В указанном испытании 100ppm представляет 0,25кг/га. Номера соединений (из табл.1) и испытуемые виды растений, применяемые дозы и полученные результаты испытаний представлены в табл.2. Пример 16. Оценка предвсходовой гербицидной активности. Наиболее типичные соединения формулы I оценивают на предвсходовую гербицидную активность против различных видов растений. С этой целью семена растений высаживают в горшки в пахотн ую почву, после чего почву с семенами сразу поливают определенными количествами испытуемых соединений в виде водной эмульсии или суспензии, позволяя им хорошо пропитать почву. Водные эмульсии или суспензии изготавливают путем смешивания требуемого количества активного ингредиента в водном ацетоном носителе, содержащем 0,1мас.% поверхностно-активного вещества. Контрольные горшки поливают аналогичной смесью, в которой отсутствует активный ингредиент. Затем горшки помещают в оранжерею при условиях, способствующих прорастанию и росту растения. Через 2 недели после обработки рост растений оценивают по шкале от 0 до 100, где оценка 0 означала отсутствие эффекта, а оценка 100 - полное уничтожение растения. Соединения (номера взяты из табл.1), испытуемые виды растений, применяемые дозы, полученные результаты испытаний представлены в табл.3. Были проведены испытания преимущества соединений изобретения по сравнению с соединениями, описанными в EP №0244948. Данные, представленные в табл.2, достаточно ясно показывают высокую гербицидную активность заявленных соединений. Более высокая гербицидная активность соединений изобретения по отношению к соединениям ближайшего аналога продемонстрирована путем сравнения наиболее характерного соединения, описанного в EP №0244948, а именно (N-2,6-дифторофенил-5,7диметил-1,2,4-триазоло[1,5-с]пиримидин-2-сульфонамида, с наиболее близким к нему соединениями изобретения, (N-2,6-дифторофенил-(монои ди)замещенными-1,2,4-триазоло[1,5-с]пиримидин-2сульфонамидами. Результаты сравнения в табл.4 и 5 демонстрируют превосходство соединений изобретения по отношению к соединениям прототипа. Каждое из соединений изобретения значительно превосходит любое испытанное, известное соединение.
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A01N 43/90, C07D 487/04
Мітки: 1,2,4-триазоло[1,5с]піримідин-2-сульфонаміду, небажаної, придушення, спосіб, рослинності, похідні
Код посилання
<a href="https://ua.patents.su/10-25905-pokhidni-124-triazolo15spirimidin-2-sulfonamidu-i-sposib-pridushennya-nebazhano-roslinnosti.html" target="_blank" rel="follow" title="База патентів України">Похідні 1,2,4-триазоло[1,5с]піримідин-2-сульфонаміду і спосіб придушення небажаної рослинності</a>
Попередній патент: Спосіб одержання гексагідрату тринатрійфосфоноформіату
Наступний патент: Спосіб адсорбції радіоактивних речовин і іонів заліза з водних розчинів
Випадковий патент: Дисковий двигун постійного струму