Оксимпохідні піперазину з антагоністичною активністю до рецептора nk-1, їх застосування, фармацевтична композиція на їх основі, спосіб її одержання та спосіб одержання проміжних сполук
Номер патенту: 75425
Опубліковано: 17.04.2006
Автори: Коолен Гейн К.А.К., Тульп Мартінус Т.М., ван Маарсевейн Ян Г., МакКрірі Ендрю К., Івема Баккер Воутер І., Герреманс Арнольдус Г.Й., ван ден Гоогенбанд Адріанус, ван Шарренбург Густаф Й.М.
Формула / Реферат
1. Сполуки загальної формули (1)
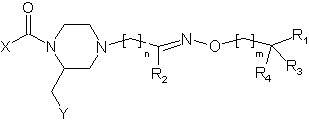 , (1)
, (1)
де:
Х означає феніл чи піридил, заміщений 1 або 2 замісниками з групи СН3, СF3, ОСН3, галоген, ціано та 5-СF3-тетразол-1-іл;
Y означає 2- або 3-індоліл, феніл, 7-азоіндол-3-іл або 3-індазоліл, 2-нафтіл, 3-бензо[b]тіофеніл або 2-бензофураніл, причому ці групи можуть бути заміщеними одним або більше галогеном або групами алкіл (1-3С);
n має значення 0-3;
m має значення 0-2;
R1 означає NH2, NH-алкіл (1-3С), діалкіл (1-3C)N, морфолін або морфолін, заміщений однією чи двома метильними та/або метоксиметильними групами, тіоморфолін, 1,1-діоксотіоморфолін, 2-, 3- або 4-піридил або 4-СН3-піперазиніл;
R2 означає водень, алкіл (1-4С) або феніл, або R2 разом з (СH2)m, де m - 1, а проміжні атоми вуглецю, азоту та кисню утворюють ізоксазолільну або 4,5-дігідроізоксазолільну групу;
R3 та R4 незалежно один від одного являють собою водень або метил, або разом являють собою кисень;
та їх фізіологічно прийнятні солі.
2. Сполуки за п. 1 формули (1), де Y означає 2- або 3-індоліл, феніл, 7-азоіндол-3-іл або 3-індазоліл, де групи можуть бути заміщені одним або більше галогеном або алкілом (1-3С); R1 означає NH2, NH-алкіл (1-3С), діалкіл(1-3С)N, морфолін або морфолін, заміщений однією чи двома метильними та/або метоксиметильними групами, тіоморфолін, 2-, 3- або 4-піридил або 4-СН3-піперазиніл; R3 та R4 є водень, а X, n, m та R2 мають значення, наведені у п. 1.
3. Сполуки формули (1), де Х означає феніл, заміщений двома замісниками з групи CF3 та галоген, Y означає 3-індоліл, m є 1 або 2, n є 1 або 2, a R1, R2, R3 та R4 мають значення, наведені у п. 1, та
їх фізіологічно прийнятні солі.
4. Сполуки за п. 3, де Х означає феніл, заміщений у позиціях 3 та 5 CF3 або галогеном.
5. Спосіб одержання проміжних сполук загальної формули
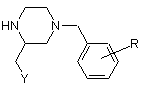 ,
,
де R означає водень, алкіл (1-4С) або O-алкіл (1-4С), а Y має значення, наведені у п. 1, який відрізняється тим, що розчин сполуки загальної формули
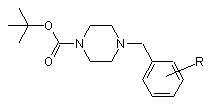
у присутності координуючого ді- або триаміну, переважно тетраметилетилендіаміну, обробляють розчином алкіллітієвої основи, переважно втор-бутиллітію, після чого додають сполуку загальної формули
Y-CH2Br,
й одержують сполуку загальної формули
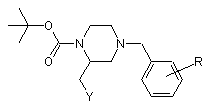 ,
,
видаляючи при цьому трет-бутилкарбонільну групу.
6. Спосіб за п. 5 для застосування при синтезі сполук за пп. 1-4.
7. Фармацевтична композиція, що містить фармацевтично активну кількість принаймні однієї сполуки за пп. 1-4 як діючої речовини.
8. Спосіб одержання композиції за п. 7, який відрізняється тим, що сполуку за пп. 1-4 приводять у форму, придатну для прийому.
9. Застосування сполуки за пп. 1-4 для приготування фармацевтичної композиції для лікування розладів, пов'язаних з нейрокінінами, що взаємодіють з рецепторами NK-1, або розладів, які можуть лікуватись шляхом маніпулювання з рецепторами NK-1.
10. Застосування за п. 9, яке відрізняється тим, що зазначеними розладами є гострий та хронічний біль, блювання, запалювальні захворювання такі як менінгіт, артрит, астма, псоріаз та сонячні опіки; шлунково-кишкові захворювання, зокрема подразнювальний синдром кишечнику, запалення кишечнику, або хвороба Крона, виразковий коліт; гіперрухомість сечового міхура або шлунково-кишкового тракту, запалення сечових шляхів; алергійні реакції, наприклад екзема та риніт; серцево-судинні розлади, такі як гіпертонія, атеросклероз, набряки, стенокардія, наскрізний головний біль та мігрень; хвороби шкіри, такі як кропивниця, короста, сверблячка; респіраторні захворювання, включаючи хронічні обструктивні захворювання легенів, бронхоспазми, бронхопневмонію, бронхіт, синдром розладу дихання та цистофіброз; різноманітні новоутворення; психічні та/або неврологічні розлади, в тому числі шизофренія та інші психози; розлади настрою, такі як двополярні депресії І та II, однополярні депресії, в тому числі легка депресія, сезонні афективні розлади, післяпологова дистимія та важка депресія; бентежні стани, включаючи панічний синдром (з агорафобією чи без), соціальну фобію, нав'язливі стани (з супутнім хронічним тиком або шизоподібним розладом чи без), посттравматичні розлади та генералізовані страхи; розлади, пов'язані з речовинами, включаючи вживання речовин (алкогольно-наркотична залежність та зловживання) або спричинені різними речовинами (наприклад, утримання від тієї чи іншої речовини); розповсюджені розлади розвитку, такі як аутизм та хвороба Ретта; дефіцит уваги та руйнівні розлади поведінки, наприклад, гіперактивність на тлі дефіциту уваги; розлади неотримання імпульсів, таких як агресивна поведінка, патологічний потяг до азартних ігор; розлади харчування, наприклад, нервова анорексія та нервова булімія, опасистість; розлади сну, безсоння; тики типу хвороби Туретта; синдром неспокійних ніг; розлади, що характеризуються дефіцитом розуму та пам'яті, наприклад, хвороба Альцгеймера, хвороба Крейцфельда-Жакоба, хвороба Гантінгтона, хвороба Паркінсона та нейрореабілітація (посттравматичні ураження мозку).
Текст
1. Сполуки загальної формули (1) C2 2 (19) 1 3 75425 4 біль, блювання, запалювальні захворювання такі HN N як менінгіт, артрит, астма, псоріаз та сонячні опіки; R шлунково-кишкові захворювання, зокрема подразнювальний синдром кишечнику, запалення кишечY , нику, або хвороба Крона, виразковий коліт; гіперде R означає водень, алкіл (1-4С) або O-алкіл (1рухомість сечового міхура або шлунково4С), а Y має значення, наведені у п. 1, який відрізкишкового тракту, запалення сечових шляхів; аленяється тим, що розчин сполуки загальної формургійні реакції, наприклад екзема та риніт; серцеволи судинні розлади, такі як гіпертонія, атеросклероз, набряки, стенокардія, наскрізний головний біль та O мігрень; хвороби шкіри, такі як кропивниця, коросN N та, сверблячка; респіраторні захворювання, вклюO R чаючи хронічні обструктивні захворювання легенів, бронхоспазми, бронхопневмонію, бронхіт, синдром у присутності координуючого ді- або триаміну, перозладу дихання та цистофіброз; різноманітні нореважно тетраметилетилендіаміну, обробляють воутворення; психічні та/або неврологічні розлади, розчином алкіллітієвої основи, переважно вторв тому числі шизофренія та інші психози; розлади бутиллітію, після чого додають сполуку загальної настрою, такі як двополярні депресії І та II, одноформули полярні депресії, в тому числі легка депресія, сеY-CH2Br, зонні афективні розлади, післяпологова дистимія й одержують сполуку загальної формули та важка депресія; бентежні стани, включаючи панічний синдром (з агорафобією чи без), соціальO ну фобію, нав'язливі стани (з супутнім хронічним N N тиком або шизоподібним розладом чи без), посттO R равматичні розлади та генералізовані страхи; розY , лади, пов'язані з речовинами, включаючи вживанвидаляючи при цьому трет-бутилкарбонільну груня речовин (алкогольно-наркотична залежність та пу. зловживання) або спричинені різними речовинами 6. Спосіб за п. 5 для застосування при синтезі (наприклад, утримання від тієї чи іншої речовини); сполук за пп. 1-4. розповсюджені розлади розвитку, такі як аутизм та 7. Фармацевтична композиція, що містить фармахвороба Ретта; дефіцит уваги та руйнівні розлади цевтично активну кількість принаймні однієї сполуповедінки, наприклад, гіперактивність на тлі дефіки за пп. 1-4 як діючої речовини. циту уваги; розлади неотримання імпульсів, таких 8. Спосіб одержання композиції за п. 7, який відріяк агресивна поведінка, патологічний потяг до зняється тим, що сполуку за пп. 1-4 приводять у азартних ігор; розлади харчування, наприклад, форму, придатну для прийому. нервова анорексія та нервова булімія, опасистість; 9. Застосування сполуки за пп. 1-4 для приготурозлади сну, безсоння; тики типу хвороби Туретта; вання фармацевтичної композиції для лікування синдром неспокійних ніг; розлади, що характерирозладів, пов'язаних з нейрокінінами, що взаємозуються дефіцитом розуму та пам'яті, наприклад, діють з рецепторами NK-1, або розладів, які мохвороба Альцгеймера, хвороба Крейцфельдажуть лікуватись шляхом маніпулювання з рецепЖакоба, хвороба Гантінгтона, хвороба Паркінсона торами NK-1. та нейрореабілітація (посттравматичні ураження 10. Застосування за п. 9, яке відрізняється тим, що мозку). зазначеними розладами є гострий та хронічний Винахід стосується групи нових оксім-похідних піперазину, що мають цікаві антагоністичні властивості щодо NK-1. Винахід також стосується способу одержання нових сполук та фармаційних композицій, що містять принаймні одну з нових сполук у якості діючої речовини, а також застосування зазначених сполук для лікування розладів, у яких відіграють роль рецептори нейрокініну-1. [У ЕР 0899270] описані 2-(3-індолілметил)-1бензоїл-4-[(2-бензиламін)етил)амінокарбоніл)] похідні піперазину, що посідають антагоністичну активність щодо NK-1. Зараз встановлено, що сполуки, в яких групу [(бензиламін)етил)амінокарбоніл] у позиції N-4 заміщено оксімною групою, також посідають дуже цікаві антагоністичні властивості щодо NK1. Винахід мули (1) стосується сполук загальної фор (1) де: X - феніл чи піриділ, заміщений 1 або 2 замісниками з групи СН3, CF3, ОСН3, галоген, ціан та 5СF3-тетразол-1-іл Υ - 2- або 3-індоліл, феніл, 7-азо-індол-3-іл або 3-індазоліл, 2-нафтіл, 3-бензо[b]тіофеніл або 2-бензофураніл, причому ці групи можуть заміщуватися одним або кількома атомами галогену або групами алкіл(1-3С) n - має значення 0-3 5 75425 6 m - має значення 0-2 R1 - NH2, NН-алкіл(1-3С), діалкіл(1-3С)N, морфолін або морфолін, заміщений однією чи двома (4) метильними та/або метоксіметильними групами, тіоморфолін, 1,1-діоксотіо-морфолін, 2-, 3- або 4піриділ або 4-СН3-піперазиніл з Ν,Ν-діметилформамід-діметилацетатом, пеR2 - водень, алкіл (1-4С) або феніл, або R2 рареважно в ацетонітрилі за температури флегми, зом з (СН2)m, де m - 1, а проміжні атоми вуглецю, після чого провадять реакцію зі сполукою формули азоту та кисню утворюють ізоксазолільну або 4,5(3), наприклад, тетрагідрофураном, за температудігідроізоксазолільну групу ри флегми. R3 та R4 незалежно один від одного представСполуки формули (1), де n=1, R2 - водень, a R1 ляють водень або метил, або разом являють ки- морфолін, можна одержати реакцією сполуки сень, формули (2) зі сполукою формули (7) та їхні фізіологічно прийнятні солі. В описі замінників скорочення "алкіл(1-3С)" (7) означає "метил, етил, n-пропил або ізопропил", а Цю реакцію провадять у розчиннику, наприскорочення "алкіл(1-4С)" означає "метил, етил, nклад, ацетонітрилі, у присутності основи, наприпропил, ізопропил, 1-бутил, 2-бутил, 1-(2-метил)клад, триетиламіну, та KІ при температурах від пропил та 2-(2-метил)пропил". кімнатної до 80°С. Винахід, зокрема, стосується сполук формули Сполуки формули (1), де R2 разом з (СН2)m та (1), де Υ - 2-або 3-індоліл, феніл, 7-азо-індол-3-іл проміжними атомами утворює ізоксазолільну або або 3-індазоліл, де групи можуть бути заміщені 4,5-дігідроізоксазолільну групу, можна одержати галогеном або алкілом(1-3С); R1 - це ΝΗ2, NНреакцією сполуки формули (4) зі сполукою формуалкіл(1-3С), діалкіл(1-3С)N, морфолін або морфоли (9), лін, заміщений однією чи двома метильними та/або метоксіметильними групами, тіоморфолін, 2-, 3- або 4-піриділ або 4-СН3-піперазиніл; R3 та R4 (9) - водень, а X, n, m та R2 мають значення, наведені вище. де L - так звана відщеплювана група, наприЗокрема, винахід стосується сполук формули клад, хлор чи бром, а пунктиром позначено зв'язок (1), де X - феніл, заміщений двома замісниками з або його відсутність. групи CF3 та галоген, Υ - 3-індоліл, m - 1 або 2, n Вихідні матеріали формули (2) можна одер1 або 2, a R1, R2, R3 та R4 мають значення, навежати: дені вище. а) реакцією сполуки формули (4) зі сполукою У більш вузькому сенсі винахід стосується таформули (5) ких сполук формули (1), де X - феніл, заміщений у позиціях 3 та 5 CF3 або галогеном. У цій переважній групі сполук m та n мають значення 1 або 2, R1 - амін, діметиламін або морфолін, R2 - водень, метил або феніл, або ж R2 разом з (СН2)m, де m=1, та проміжними атомами вуглецю, азоту та кисню утворює ізоксазолільну або дігидроізоксазолільну групу. Обидві сполуки формули (1), де група -CH2-Y має R-конфігурацію або S-конфігурацію, та Е- й Zенантіомери оксіметеру охоплюються винаходом. Сполуки формули (1) та їхні солі можна одержувати принаймні одним з нижченаведених способів, відомих для сполук цього типу. Сполуку формули (1), де n має значення 1-3, можна одержати реакцією сполуки формули (2) (2) зі сполукою формули (3) (3) де X, Y, m, R1 та R2 мають вищенаведені значення. Цю реакцію переважно провадять у розчиннику, наприклад, метанолі чи етанолі, у присутності ацетату натрію. Сполуку формули (1), де n=0, можна одержати реакцією сполуки формули (4) (5) де L - так звана відщеплювана група, наприклад, хлор чи бром. Цю реакцію провадять у розчиннику, наприклад, ацетонітрилі, у присутності основи, наприклад, триетиламіну, та КІ при температурах від кімнатної до 80°С. б) кислотним гідролізом сполуки, одержаної реакцією між сполукою формули (4) та сполукою формули (6) (6) де символи мають вищенаведені значення. Реакцію алкілювання можна провадити у розчиннику, наприклад, ацетонітрилі чи діметилформаміді, у присутності основи, наприклад, триетиламіну, та KІ при температурах від кімнатної до 80°С. Реакцію гідролізу одержаного продукту можна вести у розчиннику, наприклад, 1,4-діоксані з 6М НСl (водний розчин), або с) реакцією сполуки формули (4) з метилвінилкетоном. Цю реакцію переважно провадять у такому розчиннику, як толуол, при кімнатній температурі. Вихідні компоненти формули (3) можна приготувати а) реакцією сполуки формули (8) 7 75425 8 гіперрухомість сечового міхура або шлунково(8) кишкового тракту, запалення сечових шляхів; алергійні реакції, наприклад, екзема та риніт; серцевоз 1-фенілетанон-оксімом з наступним кислотсудинні розлади (гіпертонія, атеросклероз, набряним гідролізом, де L - так звана відщеплювана ки, стенокардія, наскрізний головний біль та міггрупа, наприклад, хлор чи бром. рень); хвороби шкіри (кропивниця, короста, свербРеакцію алкілювання можна провадити у дволячка); респіраторні захворювання, включаючи фазній системі, що складається з розчиннику, нахронічні обструктивні захворювання легенів, бронприклад, толуолу, та водного розчину NaOH і тетхоспазми, бронхопневмонію, бронхіт, синдром рабутиламонійбромиду при температурі близько розладу дихання та цистофіброз; розмаїті ново90°С. Гідроліз можна вести у 6М НС1 (водний розутворення; психічні та/або неврологічні розлади, в чин); або ж тому числі шизофренія та інші психози; розлади б) за способом, наведеним [у статті Henmi et настрою, як от двополярні депресії І та II, однопоal., Org.Prep.Proceed.Int. 1994,26, 111]. лярні депресії, в тому числі легка депресія, сезонні Вихідні компоненти формули (4) можна одерафективні розлади, післяпологова дистимія та жувати зі сполук формули (10) за важка депресія; бентежні стани, включаючи панічспособом, описаним [у ЕР 0655442] ний синдром (з агорафобією чи без), соціальну фобію, нав'язливі стани (з супутнім хронічним тіком або шизоподібним розладом чи без), посттра(10) вматичні розлади та загальну збентеженість; розлади, пов'язані зі вживанням різних речовин Вихідні компоненти формули (7) можна одер(алкогольно-наркотична залежність та зловживанжувати аналогічно синтезові 1 -хлор-2ня) або спричинені різними речовинами (наприметоксімінетану, як описано [у J.Chem.Soc.Perkin клад, утримання від тієї чи іншої речовини); розпоTrans.1, 1991, 1721]. всюджені розлади розвитку, як аутизм та хвороба Вихідні компоненти формули (9) можна одерРетта; дефіцит уваги та руйнівні розлади поведінжувати з 2-нітроетил-2-тетрагідропіранил-етеру та ки, наприклад, гіперактивність на тлі дефіциту увавідповідного аліл- або пропаргіламіну подібно до ги; розлади нестримання імпульсів (агресивна поспособу, описаного [у J.Med.Chem.1995, 38, 4198]. ведінка, патологічне картярство); розлади Вихідні компоненти формули (10) можна одехарчування, наприклад, нервова анорексія та нерржати способом, що описаний [у ЕР 0655442], або вова булімія, опасистість; розлади сну (нічниці); з трет-бутилефіру 4-бензил-піперазин-1тіки типу хвороби Туретта; синдром бентежливих карбонової кислоти алкілюванням з наступною ніг; розлади, що характеризуються дефіцитом рокислотною обробкою. зуму та пам'яті, наприклад, хвороба Альцгеймера, Алкілювання трет-бутилефіру 4-бензилхвороба Крейцфельда-Жакоба, хвороба Гантінгпіперазин-1-карбонової кислоти (T.R.Herrin, тона, хвороба Паркінсона та нейрореабілітація J.M.Pauvlik, E.V.Schuber, A.O.Geiszler, (посттравматичні ураження мозку). J.Med.Chem.1975, 18, 1216) можна вести у діетиАнтагоністичні властивості сполук за винахолетері шляхом утворення аніонів за допомогою дом щодо NK-1 випробувалися наступними метоміцного лугу, наприклад, друг-бутил-літію, у присудами. тності тетраметилетилендіаміну при низькій темФармакологічні методи пературі, після чого додавати належний алкілююЗв'язування людського рецептора NK-1 чий агент формули (11) Спорідненість сполук до людських рецепторів YCH2Br (11) NK-1 визначали аналізом зв'язування радіорецепВидалення трет-бутилоксікарбонільної групи торів. Готували мембранні препарати з клітин фібможна здійснювати відомим чином [T.W.Greene, робластів яєчників китайського хом'яка (ЯКХ), у P.G-M-Wuts, Protective Groups in Organic Synthesis, яких людський рецептор NK-1 має постійну екс3rd Ed., John Wiley and Sons, 1999]. пресію. Мембрани інкубували з [3Н]Р у присутності Придатні кислі адуктні солі можна одержувати завданих концентрацій дослідних сполук або без за допомогою неорганічних кислот (соляної, сірчаних, розбавляли у належному буфері у присутності ної, фосфорної та азотної), або органічних кислот інгібітору пептидази протягом 10 хв. при 25°С. (лимонної, фумарової, малеїнової, винної, оцтової, Зв'язану радіоактивність відокремлювали від вільтрифтороцтової, бензойної, р-толуолсульфонової, ної фільтрацією на скловолокнистих фільтрах метансульфонової та нафталінсульфонової). Whatman GF/B з двома промивками по 5 с кожна. Сполуки за винаходом загальної формули (1), Зв'язану радіоактивність рахували рідиннояк і їхні солі, посідають антагоністичну активність сцинтиляційним лічильником Betaplate. Одержані щодо NK-1 і добру біозасвоюваність. Вони придатзначення радіоактивності накладали на графік ні для лікування розладів, при яких нейрокініни концентрації витискної дослідної сполуки, а криві взаємодіють з рецепторами, наприклад, нейроківитиснення розраховували логістичною регресією нін-1 (=речовина Р), або які можна лікувати маніза чотирма параметрами, одержуючи величини пулюванням з цими рецепторами. Це, наприклад, ІС50, тобто концентрацій витискної сполуки, за яких гострий та хронічний біль, блювання, запалювальвитискується 50% радіоліганду. Значення рK1 споні захворювання (менінгіт, артрит, астма, псоріаз рідненості вираховували коригуванням величин та сонячні опіки); шлунково-кишкові захворювання ІС50 на концентрацію радіоліганду, а значення (подразнювальний синдром кишковика, запалення спорідненості до людського рецептора NK-1 - за кишковика, або хвороба Крона, виразковий коліт); рівнянням Ченга-Прусоффа: 9 75425 10 PK1=-log(IC50/(l+S/Kd)) дослідом середовище замінювали вільним від сиде IC50 - дивись вище, S - концентрація [3Н]Р, роватки α-модифікованим за Дульбекко культурщо використовувалась у тесті, у ммолях/л, a Kd ним середовищем Ігла, яке містило [3Н]-аденін, 3 постійна дисоціації рівноваги [ Н]Р з людськими котрий засвоювався клітинами й поступово перетрецепторами NK-1 у молях/л. ворювався на радіомічений аденозин, АМФ, АДФ і, Функціональні методи для рецепторів NK-1 in нарешті, радіомічений АТФ. За 2 години клітини vitro двічі промивали фосфатно-буферним фізрозчиМетаболізм ПІ ном (рН7,4) у присутності 1мМ ізобутилметилксанВипробували вплив дослідних сполук на метатину (ІБМК; інгібітор фостфодіестераз, який гідроболізм фосфатиділінозитолу (ФІ) у клітинах ЯКХ, лізує цАМФ до АМФ). Після того клітини де стійко виражені клоновані людські рецептори стимулювали 10нМ речовини Ρ у присутності або нейрокініну NK-1. У цих клітинах рецептори NK-1 відсутності дослідних сполук у фосфатнопозитивно прив'язані до фосфоліпази С, вивільбуферному розчині/ІБМК протягом 20хв. Після няючи інозитолфосфати з мембранних фосфоліпістимулювання середовище продмухували й екстдів. Інозитолфосфати можуть накопичуватися у рагували клітини 5% трихлороцтовою кислотою. клітинах, коли інозитол-1-фосфатаза інгібується Радіомічені АТФ та цАМФ видобували з екстракту шляхом преінкубації клітин літієм. Для дослідів послідовною колонковою хроматографією. Екстраклітини вирощували на 24-лункових пластинках та кти розділяли іонообмінною хроматографією на інкубували на ніч [3Н]-міоінозитолом, який метабоколонках DOWEX 50WX4 аж до поновлення АТФ. лічно включався до мембранних фосфоліпідів. Після того колонки ставили зверху на колонки з Після мічення клітини двічі промивали фосфатнооксидом алюмінію та елюювали водою. Відновбуферним фізрозчином (рН7,4) та інкубували 1 лення цАМФ здійснювали елююванням колонок з годину в α-модифікованому за Дульбекко середооксидом алюмінію 100мМ імідазолом (рН7,4). Равищі Ігла. Після того додавали LiCl, а за 20хв. по діоактивність обох фракцій АТФ та цАМФ рахуватому до інкубаційного середовища вводили досліли рідинно-сцінтиляційним лічильником та вираходні сполуки й інкубували 1 годину. Як LiCl, так і вували коефіцієнти конверсії: речовину Ρ у присутності або відсутності дослід=[цАМФ]*100%/([АТФ]+[цАМФ]) них сполук (у завданих концентраціях) розбавляли Співвідношення "концентрація-відгук" будувадо відповідних концентрацій у вільному від сироли, накладаючи значення конверсії цАМФ на граватки α-модифікованому за Дульбекко середовищі фік концентрацій сполук, й вираховували концентІгла таким чином, що кінцева концентрація LiCl рації IC50 за допомогою логістичної регресії за становила 5ммолів. чотирма параметрами. Значення антагоністичної Після інкубування середовище продмухували потужності (рА2) визначали за формулою: й екстрагували клітини 5% трихлороцтовою кислоpA2=IC50/(1+[SP]/EC50) тою. Інозитолфосфати виділяли з екстракту посліде значення ІС50 дослідної сполуки одержано довною органічною екстракцією діхлорметаном та зі співвідношень концентрація-ефект, [SP] - концеводою, а потім іонообмінною хроматографією на нтрація речовини Ρ у молях/л (звичайно 10нМ), а колонках AG-1X2 DOWEX, які елюювали 1М форЕС50 - потужність речовини Ρ щодо клонованих міатом амонію (рН7). Радіоактивність в елюйовалюдських рецепторів ΝΚ-1. них фракціях рахували рідкісно-сцінтиляційним Спричинене агоністом ΝΚ-1 тупання ногою у лічильником і наносили одержані величини на піщанок графік відносно концентрацій сполук, одержуючи Відома здатність антагоністів ΝΚ-1 антагонізуспіввідношення "концентрація-ефект". Логістична вати тупання ногою, спричинене введеними до регресія за чотирма параметрами дозволила зроцентральної нервової системи агоністами NK-1 бити оцінку потенційної та наявної активності спо[Rupniak and Williams, 1994 (Eur.J. Pharmacol. 265: лук. 179; Bristow and Young, 1994 Eur.J.Pharmacol. Одержано величини ІС50, тобто концентрації 254:245]. Через те ми використали цю модель для сполук, які антагонізують 50% спричиненого Роцінки активності in vivo сполук за винаходом. речовиною накопичення інозитолфосфатів, і вираЗа 60хв. до анестезування N2O (0,8л/хв.), 3% хувано значення антагоністичної потужності (рА2) галотаном та О2 (0,8л/хв.) самці піщанки з Чарлзза формулою: Рівер (40-60г) одержували ін'єкцію носія чи дослідpA2=IC50/(1+[SP]/EC50) ної сполуки (pars orale). Після успішного наркозуде значення ІС50 дослідної сполуки одержано вання анестезію змінили наN2O (0,6л/хв), 1,5% зі співвідношень концентрація-ефект, [SP] - концегалотан та О2 (0,6л/хв) та зробили надрізи уздовж нтрація речовини Ρ у молях/л (звичайно 10нМ), а середньої лінії голови. До мізково-шлуночкової ЕС50 - потужність речовини Ρ щодо клонованих порожнини інфузували GR 73632 (АР-0,5мм, Lлюдських рецепторів ΝΚ-1. 1,2мм та вертикаль - 4,5мм від брегми). Після виВимірювання цАМФ ходу з анестезії (за 3-4хв.) реакція тупання ногою Вплив дослідних речовин на утворення цикліфіксувалася 5 хвилин. Завданим критерієм антачного АМФ (цАМФ) оцінювали на клітинах фібробгонізму до цієї реакції було припинення тупання ласту ЯКХ, де стійко виражені клоновані людські за 5хв. рецептори нейрокініну NK-1.Ha додаток до прив'яСполуки за винаходом мають високу спорідзування до фосфоліпази С людські рецептори NKненість до рецепторів NK-1 у вищеописаних ви1 здатні також стимулювати аденілатциклазу, яка пробуваннях на зв'язування. Сполуки за винахоперетворює АТФ на цАМФ. Для дослідів клітини дом також виявляються активними у пробі на вирощували на 24-лункових пластинках. Перед цАМФ, причому величини рА2 та рK1 у них на од 11 75425 12 ному рівні. Деякі сполуки за винаходом долають (СН2Сl2/MeOH/NH4OH 92/7,5/0,5). кров'яний бар'єр до мозку, як видно з їх активності 8) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2щодо спричиненого агоністом нейрокініну тупання (1Н-індол-3-їлметил)піперазин-4-їл}-2-пропанон-Оногою у піщанок. Це дає змогу застосовувати їх [2-(4-метил-1-піперазиніл)етил]оксім. МН+ 653; Rf для лікування розладів ЦНС. 0,30 (СН2СІ2/MeOH/NH4OH 92/7,5/0,5). Далі винахід ілюструється наступними прикла9) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2дами, які призначені лише для того, щоб повніше (1Н-індол-3-їлметил)піперазин-4-їл}-2-пропанон-Оілюструвати винахід, і ніяким чином не обмежують [2-амінетил]оксім. МН+ 570. обсяг винаходу. 10) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2Приклад 1 (1Н-індол-3-їлметил)піперазин-4-їл}-2-пропанон-О[2-(метиламін)етил]оксім. МН+ 584; Rt 0,43 (СН2Сl2/MeOH/NH4OH 85/15/1). 11) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2(1H-iндoл-3-їлметил)піперазин-4-їл}-2-пропанон-О[3-(морфолін-4-їл)пропил]оксім. Rf 0,30 (СН2Сl2/МеОН 95/5). 12) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2(1Н-індол-3-їлметил)піперазин-4-їл}-2-пропанон-ОСуміш 255мг (2R)-1-[3,5[3-(діметиламін)пропил]оксім. МН+ 611; Rf 0,35 біс(трифторметил)бензоїл]-2-(1Н-індол-3-їлметил)(СН2Сl2/МеОН/ NH4OH 92/7,5/0,5). 4-(2-пропанон-1-їл)піперазину, 89мг О-[213) 1-{(2R)-1-[3,5-бic(тpифтopмeтил)бeнзoїл]-2(діметиламін)етил]гідроксиламіндігідрохлориду, (1H-iндoл-3-їлметил)піперазин-4-їл}-3-бутанон-Окаталітичної кількості ацетату натрію та 10мл ме[2-(діметиламін)етил]оксім. МН+ 612; Rf 0,10 танолу нагрівають зі зворотнім холодильником 2 (СН2СІ2/MeOH/NH4OH 93/7/0,5). години. Розчинник відганяють у вакуумі, залишок 14) 1-{(2R)-1-[3,5-бic(тpифтopмeтил)бeнзoїл]-2обробляють діхлорметаном та 2N водного розчину (1H-iндoл-3-їлметил)піперазин-4-їл}-3-бутанон-ОNaOH. Фази розділяють, органічну фазу сушать та [2-(морфолін-4-їл)етил]оксім. МН+ 654; Rf 0,37 концентрують у вакуумі. Осад очищують випарю(СН2СІ2/МеОН/NH4OH 93/7/0,5). вальною хроматографією (SiO2, 15) 1-{(2R)-1-[3,5-бic(тpифтopмeтил)бeнзoїл]-2CH2CI2/MeOH/NH4OH 92/7,5/0,5) і одержують 0,31г (1Н-індол-3-їлметил)піперазин-4-їл}-3-бутанон-О1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2-(1Н[2-амінетил]оксім. МН+ 584; Rf 0,16 індол-3-їлметил)піперазин-4-їл}-2-пропанон-О-[2(СН2СІ2/MeOH/NH4OH 93/7/0,5). (діметиламін)-етил]оксіму (вихід 95%) у вигляді 16) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2суміші E/Z енантіомерів. Rf 0,26 (1Н-індол-3-їлметил)піперазин-4-їл}-3-бутанон-О(СН2СІ2/MeOH/NH4OH 92/7,5/0,5). [2-(діметиламін)пропил]оксім. МН+ 626; Rf 0,20 Подібним чином одержують наступні сполуки: (СН2Сl2/МеОН/NH4OH 93/7/0,5). 1) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-217) 1-{(2R)-1-[3,5-бic(тpифтopмeтил)бeнзoїл]-2(1Н-індол-3-їлметил)піперазин-4-їл}-2-феніл-2(1H-iндoл-3-їлметил)піперазин-4-їл}-3-бутанон-О+ етанон-О-[2-(морфолін-4-їл)-етил]оксім. МН 702; [3-(морфолін-4-їл)пропил]оксім. МН+ 668; Rf 0,50 Rf 0,27+0,34 (Ε+Ζ ізомери) (СН2Сl2/МеОН 95/5). (СН2СІ2/MeOH/NH4OH 93/7/0,5). 2) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-218) 1-{(2R)-1-[3,5-бic(тpифтopмeтил)бeнзoїл]-2(1Н-індол-3-їлметил)піперазин-4-їл}-2-феніл-2(1H-індол-3-їлметил)піперазин-4-їл}-4-пентанон-О+ етанон-О-[2-(діметиламін)-етил]оксім. МН 702; Rf [3-(морфолін-4-їл)етил]оксім. МН+ 668; Rf 0,33 0,50 (СН2СІ2/MeOH/NH4OH 92/7,5/0,5). (СН2Сl2/МеОН 80/20). 3) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-219) 1-{(2R)-1-[3,5-бic(тpифтopмeтил)бeнзoїл]-2(1Н-індол-3-їлметил)пшеразин-4-їл}-2-феніл-2(1H-індол-3-їлметил)піперазин-4-їл}-пропаналь-Оетанон-О-[2-амінетил]оксім. Rf 0,30 [2-(діетиламін)етил]оксім. МН+ 598; Rf 0,29 (СН2СІ2/MeOH/NH4OH 92/7,5/0,5). (СН2Сl2/MeOH/NH4OH 93/7/0,5). 4) 1-{(2R)-1-[3,5-бic(тpифтopмeтил)бeнзoїл]-220) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2(1H-iндoл-3-їлметил)піперазин-4-їл}-2-феніл-2(1Н-індол-3-їлметил)піперазин-4-їл}-пропаналь-О+ етанон-O-[3-(морфолін-4-їл)пропил]оксім. МН 716; [2-(морфолін-4-їл)етил]оксім. МН+ 640; Rf 0,33 Rf 0,30 (СН2СІ2/МеОН 95/5). (СН2СІ2/МеОН 90/10). 4а) 1-{(2R)-1-[3,5-бic(тpифтopмeтил)бeнзoїл]-221) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2(1H-iндoл-3-їлмeтил)пiпepaзин-4-їл}-2-феніл-2(1Н-індол-3-їлметил)піперазин-4-їл}-3-пропанон-O+ етанон-О-[3-(діметиламін)пропил]оксім. МН 674; [2-(морфолін-4-їл)етил]оксім. МН+ 716; Rf 0,26 Rf 0,40 (СН2Сl2/MeOH/NH4OH 92/7,5/0,5). (СН2Сl2/МеОН/NH4OH 93/7/0,5). 5) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-222) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2(1H-індол-3-їлметил)піперазин-4-їл}-2-пропанон-O(1Н-індол-3-їлметил)піперазин-4-їл}-2-пропанон-O+ метилоксім. МН 541; Rf 0,55 (EtOAc). [3-(морфолін-4-їл)пропил]оксім. МН+ 730; Rf 0,23 6) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2(СН2Сl2/МеОН 95/5). (1Η-ін дол-3-їлметил)піперазин-4-їл}-2-пропанон23) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2+ О-[2-(морфолін-4-їл)етил]оксім. МН 640; Rf 0,30 (1Н-індол-3-їлметил)піперазин-4-їл}-пропанон-O(СН2Сl2/МеОН 95/5). [2-(2-піриділ)етил]оксім. МН+ 632; Rf 0,12 7) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2(СН2СІ2/МеОН 98/2). (1Н-індол-3-їлметил)піперазин-4-їл}-2-пропанон-O24) 1-{(2R)4-[3,5-бic(тpифтopмeтил)бeнзoїл]-2[2-(1-тіоморфолін-4-їл)етил]оксім. МН+ 656; Rf 0,70 (1H-індол-3-їлметил)піперазин-4-їл}-2-пропанон-О 13 75425 14 [2-піриділметил]оксім. МН+ 618; Rf 0,24 метил-1H-індол-3-їлметил)піперазин-4-їл}-2(СН2Сl2/МеОН 97/3). пропанон-О-[2-(морфолін-4-їл)етил]оксім. МН+ 654; 25) 1-{(2R)4-[3,5-бic(тpифтopмeтил)бeнзoїл]-2Rf 0,22 (СН2Сl2/MeOH/NH4OH 92/7,5/0,5). (1H-індол-3-їлметил)піперазин-4-їл}-2-пропанон-О42) 1-{1-[3,5-біс(трифторметил)бензоїл]-2-(5[3-піриділметил]оксім. МН+ 618; Rf 0,27 метил-1H-індол-3-їлметил)піперазин-4-їл}-2+ (СН2СІ2/МеОН 97/3). пропанон-О-[2-(діметиламін)етил]оксім. МН 612; 26) 1-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2Rf 0,09 (СН2Сl2/ MeOH/NH4OH 92/7,5/0,5). (1Н-індол-3-їлметил)піперазин-4-їл}-пропанон-О43) 1-{1-[3,5-біс(трифторметил)бензоїл]-2-(7[4-піриділметил]оксім. МН+ 618; Rf 0,19 азо-1H-індол-3-їлметил)піперазин-4-їл}-2(СН2СІ2/МеОН 97/3). пропанон-O-[2-(морфолін-4-їл)етил]оксім. МН+ 641; 27) 1-{(2R)-1-[3,5-дiфтopбeнзoїл]-2-(1lH-iндoлRf 0,34 (СН2СІ2/МеОН 90/10). 3-їлмeтил)пiпepaзин-4-їл}-2-пропанон-O-[244) 1-{1-[3,5-біс(трифторметил)бензоїл]-2(морфолін-4-їл)етил]оксім. МН+ 540; Rf 0,61 бензилпіперазин-4-їл}-2-пропанон-О-[2-(морфолін(СН2Сl2/МеОН/ NH4OH 93/7/0,5). 4-їл)етил]оксім. МН+601; Rf 0,45 (СН2СІ2/МеОН 28) 1-{(2R)-1-[3,5-дixлopбeнзoїл]-2-(1H-iндoл-397/3). їлмeтил)пiпepaзин-4-їл}-2-пропанон-О-[245) 1-{1-[3,5-біс(трифторметил)бензоїл]-2-(1Н(морфолін-4-їл)етил]оксім. МН+ 572; Rf 0,20 індол-2-їлметил)піперазин-4-їл}-2-пропанон-О-[2(СН2СІ2/МеОН 95/5). (морфолін-4-їл)етил]оксім. МН+ 640; Rf 0,46 29) 1-{(2R)-1-[3,5-дiбpoмбeнзoїл]-2-(1H-iндoл-3(СН2СІ2/МеОН/NH4OH 93/7/0,5). їлмeтил)пiпepaзин-4-їл}-2-пропанон-О-[246) 1-{(2R)-1-[3,5-бic-(тpифтopмeтил)бeнзoїл](морфолін-4-їл)етил]оксім. МН+ 662; Rf 0,44 2-(1H-iндoл-3-їлметил)піперазин-4-їл} -2-пропанон(СН2Сl2/МеОН/NH4OH 93/7/0,5). O-[2-(морфолін-4-їл)2-оксо-етил]оксім. Rt 0,25 30) 1-{(2R)-1-[3,5-діціанбeнзoїл]-2-(1H-iндoл-3(СН2Сl2/МеОН 97/3). їлмeтил)пiпepaзин-4-їл}-2-пропанон-O-[247) 1-{(2R)4-[3,5-біс-(трифторметил)бензоїл]-2(морфолін-4-їл)етил]оксім. МН+ 554. (1H-індол-3-їлметил)піперазин-4-їл} -2-пропанон31) 1-{(2R)-1-[2-мeтoкci-5-(5О-[2-(морфолін-4-їл)пропил]оксім. МН+ 654; Rf 0,19 тpифтopмeтилтeтpaзoл-1-їл)бeнзoїл]-2-(1H-індол(СН2СІ2/МеОН 97/3). 3-їлметил)піперазин-4-їл}-2-пропанон-О-[248) 1-{(2R)-1-[3,5-бic-(тpифтopмeтил)бeнзoїл](морфолін-4-їл)етил]оксім. 2-(1Н-iндoл-3-їлметил)піперазин-4-їл}-2-пропанон32) 1-{(2R)-1-[2-мeтoкci-5-(5О-[2-метил-2-(морфолін-4-їл)пропил]оксім. МН+ тpифтopмeтилтeтpaзoл-1-їл)бeнзoїл]-2-(1H-індол668; Rf 0,45 (СН2СІ2/МеОН 97/3). 3-їлметил)піперазин-4-їл}-2-пропанон-O-[249) 1-{(2R)-1-[3,5-бic-(тpифтopмeтил)бeнзoїл](морфолін-4-їл)етил]оксім. 2-(1H-iндoл-3-їлметил)піперазин-4-їл}-2-пропанон33) 1-{(2R)-1-[(2,6-дixлopпіpидiн-4-їл)O-[2-(2,6-діметилморфолін-4-їл)етил]оксім. МН+ кapбoнiл]-2-(1Н-iндoл-3-їлметил)піперазин-4-їл}-2668; Rf 0,34 (СН2СІ2/МеОН/ NH4OH 96/3,75/0,25). пропанон-О-[2-(морфолін-4-їл)етил]оксім. 50) 1-{(2R)-1-[3,5-бic-(тpифтopмeтил)бeнзoїл]34) 1-{(2R)4-[2,4-бic(тpифтopмeтил)бeнзoїл]-22-(1Н-індол-3-їлметил)піперазин-4-їл}-2-пропанон(1H-індол-3-їлметил)піперазин-4-їл}-2-пропанон-ОО-[2-(1,1-діоксо-1-тіоморфолін-4-їл)етил]оксім. [2-(морфолін-4-їл)етил]оксім. МН+ 640; Rf 0,74 МН+ 688; Rf 0,34 (СН2СІ2/МеОН/ NH4OH (СН2СІ2/МеОН 97/3). 96/3,75/0,25). 35) 1-{(2R)4-[2,5-бic(тpифтopмeтил)бeнзoїл]-251) 1-{(2R)-1-[3,5-бic-(тpифтopмeтал)бeнзoїл](1H-індол-3-їлметил)піперазин-4-їл}-2-пропанон-О2-(1H-індoл-3-їлметил)піперазин-4-їл}-2-пропанон[2-(морфолін-4-їл)етил]оксім. МН+ 640; Rf 0,64 О-[2-(3,5-діметилморфолін-4-їл)етил]оксім (ізомер (СН2СІ2/МеОН 97/3) 1). МН+ 668; Rf 0,20+0,28 (Ε+Ζ ізомери) 36) 1-{(2R)-1-[3,5-дiмeтилбeнзoїл]-2-(1H-iндoл(СН2СІ2/МеОН/ΝΗ4ΟΗ 96/3,75/0,25). 3-їлмeтил)пiпepaзин-4-їл}-2-пропанон-О-[252) 1-{(2R)-1-[3,5-біс-(тpифтopмeтал)бeнзoїл](морфолін-4-їл)етил]оксім. МН+ 532; Rf 0,57 2-(1H-індoл-3-їлметил)піперазин-4-їл}-2-пропанон(СН2Сl2/МеОН 97/3) О-[2-(3,5-діметилморфолін-4-їл)етил]оксім (ізомер 37) 1-{(2R)-1-[2-хлор-52). МН+ 668; Rf 0,21+0,31 (Ε+Ζ ізомери) (трифторметил)бензоїл]-2-(1Н-індол-3(СН2СІ2/МеОН/ΝΗ4ΟΗ 96/3,75/0,25). їлметил)піперазин-4-їл}-2-пропанон-О-[253) 1-{(2R)-1-[3,5-бic-(тpифтopмeтил)бeнзoїл](морфолін-4-їл)етил]оксім. МН+ 606; Rf 0,75 2-(1H-iндoл-3-їлметил)піперазин-4-їл}-2-пропанон(СН2Сl2/МеОН 97/3) О-[2-(3-метоксіметилморфолін-4-їл)етил]оксім. 38) 1-{(2R)-1-[2,5-мeтoкciбeнзoїл]-2-(1H-iндoлМН+ 684; Rf 0,46+0,54 (Ε+Ζ ізомер) 3-їлмeтил)пiпepaзин-4-їл}-2-пропанон-О-[2(СН2СІ2/MeOH/NH4OH 92/7,5/0,5). (морфолін-4-їл)етил]оксім. МН+ 534; Rf 0,63 54) 1-{(2R)-1-[3,5-бic-(тpифтopмeтил)бeнзoїл](СН2Сl2/МеОН 97/3) 2-(1H-iндoл-3-їлметил)піперазин-4-їл}-2-пропанон39) 1-{(2R)4-[2,5-бic(тpифтopмeтил)бeнзoїл]-2О-[2-(ціс-3,5-біс-метоксіметилморфолін-4(1H-індол-3-їлметил)піперазин-4-їл}-2-пропанон-Оїл)етил]оксім. Rf 0,17+0,23 (Ε+Ζ ізомер) + [2-(морфолін-4-їл)етил]оксім. МН 658; Rf 0,33 (СН2СІ2/MeOH/NH4OH 96/3,75/0,25). (СН2Сl2/МеОН 90/10) 55) 1-{(2R)-1-[3,5-бic-(тpифтopмeтил)бeнзoїл]40) 1-{1-[3,5-біс(трифторметил)бензоїл]-2-(52-(1H-індoл-3-їлметил)піперазин-4-їл}-2-пропанонфтор-1Н-індол-3-їлметил)піперазин-4-їл}-2О-[2-(транс-3,5-біс-метоксіметилморфолін-4пропанон-О-[2-(діметиламін)етил]оксім. МН+ 616; їл)етил]оксім). МН+ 728. Rf 0,15 (СН2СІ2/МеОН 90/10) 56) 1-{1-[3,5-біс-(трифторметил)бензоїл]-2-(1Н41) 1-{1-[3,5-біс(трифторметил)бензоїл]-2-(5індол-3 15 75425 16 їлметил)піперазин-4-їл}-2-пропанон-О-[2водним розчином K2СО3. Фази розділяють, органі(морфолін-4-їл)етил]оксім. МН+ 635; Rf 0,46 чну фазу сушать над Na2SO4 та концентрують у (СН2СІ2/МеОН 95/5). вакуумі. Осад очищують випарювальною хромато57) 1-{1-[3,5-біс-(трифторметил)бензоїл]-2графією (SiO2, CH2CI2/MeOH/NH4OH 92/7,5/0,5) і (3,4-діхлорбензил)піперазин-4-їл}-2-пропанон-О-[2одержують 0,38г (вихід 95%) 2-{(2R)-1-[3,5+ (морфолін-4-їл)етил]оксім. МН 669; Rf 0,63 біс(трифторметил)бензоїл]-2-(1H-індол-3(СН2СІ2/МеОН 95/5). їлметил)піперазин-4-їл}-етаналь-О-[2-(морфолін-458) 1-{1-[3,5-біс-(трифторметил)бензоїл]-2їл)етил]оксіму у вигляді суміші E/Z енантіомерів. (нафталін-2-ілметил)піперазин-4-їл}-2-пропанон-ОМН+ 626; Rf 0,53+0,66 (Ε+Ζ ізомери) + [2-(морфолін-4-їл)етил]оксім. МН 651; Rt 0,65 (CH2Cl2/МеОН/ΝΗ4ΟΗ 92/7,5/0,5). Подібним чином (СН2СІ2/МеОН/NH4OH 93/7/0,5). одержують наступні сполуки: 59) 1-{2-(бензо [b]тіофен-3-ілметил-1-[3,5біс1) 2-{(2R)-1-[3,5-біс(трифторметил)бензоїл]-2(трифторметил)бензоїл]-2-(нафталін-2(1Н-індол-3-їлметил)4-5-морфолін-етаналь-О-[3ілметил)піперазин-4-їл}-2-пропанон-O-[2(морфолін-4-їл)пропил]оксім. Rf 0,63+0,72 (Ε+Ζ (морфолін-4-їл)етил]оксім. МН+ 657; Rf 0,30 ізомери) (СН2Сl2/МеОН/ΝΗ4ΟΗ 92/7,5/0,5). (СН2Сl2/МеОН 95/5). 2) (2R)-1-[3,5-біс(трифторметил)бензоїл]-260) 1-{1-[3,5-біс-(трифторметил)бензоїл]-2-(1Н(1Н-індол-3-їлметил)-4-{[5-((морфолін-4-іл)метил)індазол-3-ілметил)піперазин-4-їл}-2-пропанон-О-[24,5-дігідроізоксазол-3-їл]метил}піперазин. МН+ + (морфолін-4-їл)етил]оксім. МН 641; Rf 0,40 638; виділено два ізомери, Rf 0,51 (ізомер 1), Rf (СН2Сl2/МеОН/NH4OH 93/7/0,5). 0,61 (ізомер 2) (СН2Сl2/МеОН/ΝΗ4ΟΗ 96/3,75/0,25). 61) 1-{2-(бензофуран-2-ілметил-1-[3,5-біс3) (2R)-1-[3,5-бic(тpифтopмeтил)бeнзoїл]-2(трифторметил)бензоїл]-піперазин-4-їл}-2(1H-iндoл-3-їлмeтил)-4-{[5-((морфолін-4-іл)метил)пропанон-О-[2-(морфолін-4-їл)етил]оксім. МН+ 641; 4,5-дігідроізоксазол-3-їл]метилпіперазин. Виділена Rf 0,30 (СН2Сl2/МеОН 95/5). як сіль НСl: точка топлення 182-184°С, МН+ 636; Rf Приклад 2 0,28 (СН2Сl2/МеОН/NH4OH 96/3,75/0,25). Приклад 4 Приготування проміжних сполук формули (2) Суміш 0,47г (2R)-1-[3,5бic(тpифтopмeтал)бeнзoїл]-2-(1H-індoл-3їлметил)піперазину, 0,12г Ν,Νдіметилформаміддіметилацеталю та 15мл ацетонітрилу нагрівають зі зворотнім холодильником 24 години. Після охолодження до кімнатної температури летучі компоненти відганяють у вакуумі, залишок розчиняють у сухому тетрагідрофурані, додають 547мг О-[2(діметиламін)етил]гідроксиламіндігідрохлориду та 1,1мл діізопропилетиламіну й суміш нагрівають зі зворотнім холодильником 2 години.. Розчинник видаляють у вакуумі. Осад очищують випарювальною хроматографією (SiO2, СН2СІ2/MeOH/NH4OH 85/15/1) і одержують 0,79г 1{(2R)-1-[3,5-біс(трифторметил) бензоїл]-2-(1Ніндол-3-їлметил)піперазин-4-їл}-метанон-О-[2(діметиламін)етил]оксіму у вигляді суміші E/Z енантіомерів. МН+ 570; Rf 0,32+0,49 (Ε+Ζ ізомери) (СН2Сl2/МеОН/ΝΗ4ΟΗ 85/15/1). Приклад 3 Суміш 0,29г (2R)-1-[3,5бic(тpифтopмeтил)бeнзoїл]-2-(1H-iндoл-3їлметил)піперазину, 0,13г 2-хлоретаналь-О[2(морфолін-4-іл)етил]оксіму, 0,11мл діізопропилетиламіну та 10мл ацетонітрилу нагрівають зі зворотнім холодильником усю ніч. Після охолодження до кімнатної температури розчинник відганяють у вакуумі, залишок обробляють діхлорметаном та Суміш 0,88г фенацілбромиду, 2г (2R)-1-[3,5бic(тpифтopмeтил)бeнзoїл]-2-(1H-індол-3їлметил)піперазину, каталітичної кількості йодиду калію, 0,77мл діізопропилетиламіну та 20мл ацетонітрилу перемішують при кімнатній температурі усю ніч. Після охолодження до кімнатної температури розчинник відганяють у вакуумі, залишок обробляють діхлорметаном та 2N NaOH. Фази розділяють, органічну фазу сушать над Na2SO4 та концентрують у вакуумі. Осад очищують випарювальною хроматографією (SiO2, СН2Сl2/МеОН 97/3) і одержують 2,16г (вихід 85%) (2R)-1-[3,5біс(трифторметил)бензоїл]-2-(1Н-індол-3-їлметил)4-(2-феніл-2-етанон-1-іл)піперазину. МН+ 574; Rf 0,44 (СН2СІ2/МеОН 97/3). Подібним чином одержують наступні сполуки: (2R)-1-[3,5-бic(тpифтopмeтил)бeнзoїл]-2-(1Hiндoл-3-їлмeтил)-4-(2-пpoпaнoн-1-iл)піперазин. МН+512; Rf 0,38 (СН2Сl2/МеОН 97/3). (2R)-1-[3,5-дiфтopбeнзoїл]-2-(1H-iндoл-3їлмeтил)-4-(2-пpoпaнoн-1-iл)пiпepaзин. Rf 0,72 (СН2Сl2/МеОН/NH4OH 93/7/0,5). (2R)-1-[3,5-дixлopбeнзoїл]-2-(1H-iндoл-3їлмeтил)-4-(2-пpoпaнoн-1-iл)пiпepaзин. Rf 0,50 (СН2СІ2/МеОН/NH4OH 93/7/0,5). (2R)-1-[3,5-дiбpoмбeнзoїл]-2-(1H-iндoл-3їлмeтил)-4-(2-пpoпaнoн-1-iл)пiпepaзин. (2R)-1-[2-мeтoкci-5-(5-тpифтopмeтилтeтpaзoл1-iл)бeнзoїл]-2-(1H-iндoл-3-їлмeтил)-4-(2пропанон-1-іл)піперазин. (2R)-1-[3-фтop-(5-тpифтopмeтил)бeнзoїл]-2(1H-iндoл-3-їлмeтил)-4-(2-пpoпaнoн-1-іл)піперазин. 17 75425 18 (2R)-1-[(2,6-дixлopпipидiн-4-iл)кapбoнiл]-2-(1Hта концентрують у вакуумі. Осад очищують випаiндoл-3-їлмeтил)-4-(2-пpoпaнoн-1-іл) піперазин. рювальною хроматографією (SiO2, СН2Сl2/МеОН (2R)-1-[3,5-діціанобензоїл]-2-(1Н-індол-395/5) і одержують 0,7г (вихід 40%) (2R)-1-[3,5їлметил)-4-(2-пропанон-1-іл)піперазин. біс(трифторметил)бензоїл]-2-(1Н-індол-3-їлметил)(2R)-1-[2,4-біс(трифторметил)бензоїл]-2-(1H4-[3-(2-метил-1,3-діоксолан-2-іл)]піперазину. + індол-3-їлметил)-4-(2-пропанон-1-іл)піперазин. МН 584. (2R)-1-[3,5-діметилбензоїл]-2-(1Н-індол-3Подібним чином одержують (2R)-1-[3,5їлметил)-4-(2-пропанон-1-іл)піперазин. біс(трифторметил) бензоїл]-2-(1Н-індол-3(2R)-1-[2-хлор-5-(трифторметил)бензоїл]-2їлметил)-4-[2-(1,3-діоксолан-2-іл)]піперазин. Rf 0,30 (1Н-індол-3-їлметил)-4-(2-пропанон-1-іл) піпера(СН2Сl2/МеOН/NH4OH 93/7/0,5). зин. Приклад 6 (2R)-1-[2,5-біс(трифторметил)бензоїл]-2-(1Ніндол-3-їлметил)-4-(2-пропанон-1-іл)піперазин. (2R)-1-[2-метоксібензоїл]-2-(1Н-індол-3їлметил)-4-(2-пропанон-1-іл)піперазин. 1-[3,5-біс(трифторметил)бензоїл]-2-бензил-4(2-пропанон-1-іл)піперазин. МН+ 473; Rf 0,65 (СН2Сl2/МеОН 97/3). Суміш 0,7г (2R)-1-[3,5-біс(трифторметил) бен1-[3,5-біс(трифторметил)бензоїл]-2-(4зоїл]-2-(1Н-індол-3-їлметил)-4-[3-(2-метил-1,3+ хлорбензил)-4-(2-пропанон-1-іл)піперазин. МН діоксолан-2-іл)піперазину, 6мл 1,4-діоксану та 5мл 507; Rf 0,89 (СН2Сl2/МеОН 95/5). 6N соляної кислоти нагрівають 2 години при 50°С. 1-[3,5-біс(трифторметил)бензоїл]-2-(3,4Після охолодження до кімнатної температури судіхлорбензил)-4-(2-пропанон-1-іл)піперазин. Rf міш виливають у гідроксид амонію і екстрагують 0,63 (СН2Сl2/МеОН 95/5). етилацетатом. Органічну фазу сушать та концент1-[3,5-біс(трифторметил)бензоїл]-2-(нафталінрують у вакуумі, одержуючи сирий (2R)-1-[3,52-ілметил)-4-(2-пропанон-1-іл)піперазин. Rf 0,77 біс(трифторметил)бензоїл]-2-(1Н-індол-3-їлметил)(СН2Сl2/МеОН 95/5). 4-[(4-пентанон-1-іл)]піперазин, що його використо1-[3,5-біс(трифторметил)беюоїл]-2-(1H-індолвують як такий. МН+ 540, Rf 0,51 2-їлметил)-4-(2-пропанон-1-іл)піперазин. (СН2Сl2/МеOН/NH4OH 93/7/0,5). 1-[3,5-біс(трифторметил)бензоїл]-2-(5-фторПодібним чином одержують (2R)-1-[3,51Н-індол-3-їлметил)-4-(2-пропанон-1-іл)піперазин. біс(трифторметил)бензоїл]-2-(1Н-індол-3-їлметил)1-[3,5-біс(трифторметил)бензоїл]-2-(5-метил4-[(3-пропанал-1-іл)]піперазин. Rf 0,33 1Н-індол-3-їлметил)-4-(2-пропанон-1-іл) піперазин. (СН2Сl2/МеOН 95/5). МН+526; Rf 0,52 (СН2СІ2/МеОН/NH4OH 92/7,5/0,5). Приклад 7 1-[3,5-біс(трифторметил)бензоїл]-2-(7-азо-1Ніндол-3-їлметил)-4-(2-пропанон-1-іл)піперазин. МН+513; Rf 0,38 (СН2Сl2/МеОН/NH4OH 93/7/0,5). 1-[3,5-біс(трифторметил)бензоїл]-2-(1Ніндазол-3-їлметил)-4-(2-пропанон-1-іл)піперазин. МН+513; Rf 0,32 (СН2СІ2/МеОН/NH4OH 93/7/0,5). 2-(бензо[b]тіофен-3-ілметил)-1-[3,5біс(трифторметил)бензоїл]-4-(2-пропанон-1-іл)До розчину 1,37г (2R)-1-[3,5піперазин. Rf 0,73 (СН2Сl2/МеОН 95/5). бic(тpифтopмeтил)бeнзoїл]-2-(1H-iндoл-3-їлмeтил)(2-бензофуран-2-ілметил)1-[3,54-[(4-пентанон-1-іл)]піперазину в 15мл толуолу біс(трифторметил)бензоїл]їлметил)-4-(2-пропанондодають по краплинах 0,3г метилвінилкетону. 1-іл)піперазин. Після 2,5 годин при кімнатній температурі роз(2R)-1-[3,5-бic(тpифтopмeтил)бeнзoїл]-2-(1Hчин концентрують, одержуючи сирий (2R)-1-[3,5iндoл-3-їлмeтил)-4-(3-фeнiл-3--пропанон-1бic(тpифтopмeтил)бeнзoїл]-2-(1H-iндoл-3-їлмeтил)іл)піперазин. МН+588; Rf 0,50 (СН2Сl2/МеОН 95/5). 4-[(3-бyтaнoн-1-іл)]піперазин, що його використо(2R)-1-[3,5-бic(тpифтopмeтил)бeнзoїл]-2-(1Hвують як такий. Rf 0,55 (СН2СІ2/МеOН 95/5). iндoл-3-їлмeтил)-4-(3-бyтaнoн-1-iл)піперазин. Приклад 8 Приклад 5 Приготування проміжних сполук формули (7) Суміш 0,54г 5-хлор-2-пентанонетиленкеталю, 1,37г (2R)-1-[3,5-бic(тpифтopмeтил) бензоїл]-2-(1Ніндол-3-їлметил)піперазину, 0,6мл діізопропилетиламіну та 25мл діметилформаміду нагрівають усю ніч при 90°С. Після охолодження до кімнатної температури суміш виливають у воду і екстрагують етилацетатом. Органічну фазу сушать над Na2SO4 Суміш 0,1мл 50% водного розчину ацетальдегіду, 0,14г О-[2-(морфолін-4-іл)етил] гідроксиламіндігідрохлориду, 0,64мл 2N NaOH та 5мл води перемішують усю ніч при кімнатній температурі. Розчин підлужують 1N NaOH та екстрагують діхлорметаном. Органічну фазу сушать над Na2SO4 та концентрують у вакуумі, одержуючи 0,13г 2хлоретаналь-O-[2-(морфолін-4-іл)етил]оксіму (~100%), що його використовують як такий. Подібним чином одержують 2-хлоретаналь-O[3-(морфолін-4-іл)пропил]оксім. 19 Приклад 9 Приготування проміжних сполук формули (9) 75425 20 у вакуумі, одержуючи 0,52г (вихід 100%) [5((морфолін-4-іл)метил)-4,5-дігідроізоксазол-3іл]метанолметансульфонату. Rf 0,63 (СН2Сl2/МеОН/NH4OH 92/7,5/0,5). Подібним чином одержують [5-((морфолін-4іл)метил)ізоксазол-3-іл] метанолметан-сульфонат. До розчину 0,76г (5,0ммолів) N-алілморфоліну Rf 0,62 (СН2Сl2/МеOН/NH4OH 92/7,5/0,5). в 10мл толуолу додають 1,34г (7,7 ммолів) 2-(2Приклад 13 нітроетоксі)тетрагідрофурану, 2,43г (20,1ммолів) Приготування проміжних сполук формули (3) фенілізоціанату та 52мг (0,5ммолів) триетиламіну. Одержану суміш нагрівають усю ніч при 55°С. Після охолодження до кімнатної температури одерДо розчину 20г ацетофеноноксіму в 700мл тожаний осад відфільтровують, а маточний розчин луолу послідовно додають 4,77г тетрабутиламоконцентрують у вакуумі. Осад очищують випарюнійбромиду, 8мл води, 30,31г 4-(2вальною хроматографією (SiO2, хлоретил)морфолінгідрохлориду і, нарешті, 52мл СН2Сl2/MeOH/NH4OH 96/3,75/0,25) і одержують 50% водного розчину гідроксиду натрію. Одержану 0,63г (вихід 44%) [5-((морфолін-4-іл) метил)-4,5суміш нагрівають усю ніч при 75°С. Після охолодігідроізоксазол-3-іл]метил-2+ дження до кімнатної температури додають воду тетрагідропіранилетеру. МН 285, Rf 0,34 для розчинення усіх солей, розділяють фази те (СН2Сl2/МеOН/NH4OH 96/3,75/0,25). екстрагують водну фазу ацетоном. Органічну фазу Подібним чином одержують [5-((морфолін-4сушать над MgSO4 та концентрують у вакуумі. іл)метил)ізоксазол-3-іл]метил-2Осад очищують випарювальною хроматографією тетрагідропіранилетер. Rf 0,18 (EtO/MeOH 99/1). (SiO2, СН2Сl2/МеОН 95/5) і одержують О-[2Приклад 10 (морфолін-4-іл)етил]оксім у вигляді олії. Одержану олію розчинюють у 500мл 6М водного розчину НСl та нагрівають 5 годин зі зворотнім холодильником, після чого перемішують усю ніч при кімнатній темСуміш 0,63г [5-((морфолін-4-іл)метил)-4,5пературі. Суміш екстрагують етером та концентдігідроізоксазол-3-іл]метил-2рують у вакуумі. Осад кристалізують з етанолу й тетрагідропіранилетеру з 10мол.% розчином піриодержують 24,8г О-[2-(морфолін-4діній-р-толуолсульфонату в толуолі нагрівають зі іл)етил]гідроксиламіндігідрохлориду (вихід 77%). зворотнім холодильником 24 години. Після охолоПодібним чином одержують наступні сполуки: дження до кімнатної температури розчинник відгаО-[2няють у вакуумі. Осад очищують випарювальною (діметиламін)етил]гідроксиламіндігідрохлорид хроматографією (SiO2, СН2СІ2/MeOH/NH4OH О-[292/7,5/0,5) і одержують з виходом 95% [5(метиламін)етил]гідроксиламіндігідрохлорид ((морфолін-4-іл) метил)-4,5-дігідроізоксазол-3О-[2іл]метанол. Rf 0,17 (СН2СІ2/МеOН/NH4OH (діметиламін)пропил]гідроксиламіндігідрохлорид 92/7,5/0,5). О-[2-(морфолін-4Приклад 11 іл)пропил]гідроксиламіндігідрохлорид 0-[2-піриділметил]гідроксиламіндігідрохлорид О-[3-піриділметил]гідроксиламіндігідрохлорид О-[4-піриділметил]гідроксиламіндігідрохлорид. 1,0г [5-((морфолін-4-іл)метил)-ізоксазол-3Приклад 14 іл]метил-2-тетрагідропіранилетеру розчиняють у 2мл метанолу та обробляють 10мл водного розчину 1М. Суміш перемішують 1 годину при кімнатній температурі, потім підлужують K2СО3 та екстрагують діхлорметаном. Органічну фазу сушать над Na2SO4 та концентрують у вакуумі. Осад очищують випарювальною хроматографією (SiO2, CH2Cl2/MeOH/NH4OH 92/7,5/0,5) і одержують з виДо розчину 2г трет-бутилефіру 4ходом 53% [5-((морфолін-4-іл)метил)-ізоксазол-3бензилпіперазин-1-карбонової кислоти у 35мл діе+ іл]метанол. МН 199, Rf 0,24 (СН2Сl2/МеOН/NH4OH тилетеру додають 1,4мл тетраметилетилендіамі92/7,5/0,5). ну. Одержану суміш охолоджують до -70°С та доПриклад 12 дають по краплинах 7мл розчину 1,3М третбутиллітію; після завершення розчин повільно підігрівають до -10°С и при цій температурі перемішують 1 годину. Далі суміш знов охолоджують до До розчину 0,38г [5-((морфолін-4-іл)метил)-4,570°С, додають по краплинах розчин 2г 2дігідроізоксазол-3-іл]метанолу в діхлорметані до(бромметил) нафталіну в діетилетері та продовдають по краплинах 0,33мл діізопропилетиламіну жують перемішування при 70°С ще 1 годину. Одета 0,15мл метансульфонхлориду. Одержаний розржану суміш перемішують і дають за ніч нагрітися чин перемішують при кімнатній температурі 3 годо кімнатної температури, після чого розділяють дини та обробляють водою. Фази розділяють, орміж насиченим водним розчином хлориду амонію ганічну фазу сушать над Na2SO4 та концентрують та етилацетатом. Органічну фазу сушать над су 21 75425 22 льфатом магнію, фільтрують та концентрують у фатом магнію, фільтрують та концентрують у вавакуумі. Осад очищують випарювальною хроматокуумі, одержуючи 0,53г 1-бензил-3-(нафталін-2графією (SiO2, CH2CI2/МеОН 99/1) і одержують 0,8г ілметил)піперазину у вигляді олії (вихід 93%), що трет-бутилефіру 4-бензил-2-(нафталін-2його використовують як такий. МН+ 317, Rf 0,61 ілметил)піперазин-1-карбонової кислоти у вигляді (CH2Cl2/MeOH/NH4OH 93/7/0,5). + олії (вихід 27%), Rf 0,47 (СН2Сl2/МеОН 99/1), МН Подібним чином одержують наступні сполуки: 417. 3-(7-азо-1-(толуол-4-сульфоніл)-1Н-індол-3Подібним чином одержують наступні сполуки: ілметил)-1-бензилпіперазин; Rf 0,13 (СН2Сl2/МеOН Трет-бутилефір 2-(7-азо-1-(толуол-495/5). сульфоніл)-1H-індол-3-ілметил)-41,3-дібензилпіперазин-піперазин; МН+267, Rf бензилпіперазин-1-карбонової кислоти; Rf 0,28 0,19 (CH2Cl2/MeOH/NH4OH 93/7/0,5). (СН2Сl2/МеОН 99/1). 1-бензил-3-(1-(толуол-4-сульфоніл)1Н-індол-2Трет-бутилефір 2,4-дібензилпіперазин-1ілметил)піперазин; МН+ 460, Rf 0,56 + карбонової кислоти; МН 367, Rf 0,84 (CH2Cl2/MeOH/NH4OH 93/7/0,5). (CH2Cl2/MeOH/NH4OH 93/7/0,5). 1-бензил-3-(4-хлорбензил)піперазин; МН+ 301, Трет-бутилефір 4-бензил-2-(1-(толуол-4Rf 0,26 (CH2Cl2/MeOH/NH4OH 95/4,5/0,5). сульфоніл)-1H-індол-2-ілметил)піперазин-11-бензил-3-(3,4-діхлорбензил)піперазин; МН+ карбонової кислоти; МН+560, Rf 0,70 (СН2Сl2/МеOН 335, Rf 0,35 (СН2Сl2/МеОН/МН4ОН 93/7/0,5). 95/5). 3-(бензо[b]тіофен-3-ілметил)-1Трет-бутилефір 4-бензил-2-(4бензилпіперазин; МН+ 323, Rf 0,35 + хлорбензил)піперазин-1-карбонової кислоти; МН (CH2Cl2/MeOH/NH4OH 95/4,5/0,5). 401, Rf 0,26 (СН2Сl2/МеOН 99/1). 1-бензил-3-(1Н-індазол-3-ілметил)піперазин; Трет-бутилефір 4-бензил-2-(3,4МН+ 307, Rf 0,10 (СН2Сl2/МеOН 90/10). діхлорбензил)піперазин-1-карбонової кислоти; Rf 3-(бензофуран-2-ілметил)-1-бензилпіперазин; 0,77 (CH2Cl2/MeOH/NH4OH 93/7/0,5). МН+ 307, Rf 0,26 (CH2Cl2/MeOH/NH4OH 93/7/0,5). Трет-бутилефір 2-(бензо[b]тіофен-3-ілметил)4Приклад 16 бензилпіперазин-1-карбонової кислоти; МН+423, Rf 0,30 (СН2Сl2/МеOН 99/1). Трет-бутилефір 3-(4-бензил-1-третбутоксікарбонілпіперазин-2-ілметил)-1-карбонової кислоти; МН+507. Трет-бутилефір 2-(бензофуран-2-ілметил)-4+ бензилпіперазин-1-карбонової кислоти; МН 407, Rf До розчину 0,65г 3-(7-азо-1-(толуол-40,33 (СН2Сl2/МеOН 99/1). сульфоніл)-1Н-індол-3-ілметил)-1Приклад 15 бензилпіперазину в 28мл метанолу додають 5,6мл Приготування проміжних сполук формули (10) водного розчину 3Μ гідроксиду натрію й нагрівають суміш при 60°С 90хв. Після охолодження до кімнатної температури більшу частину метанолу відганяють у вакуумі, а осад екстрагують діхлорметаном. Органічну фазу сушать над сульфатом магнію, фільтрують та концентрують у вакуумі. Осад очищують випарювальною хроматографією До розчину 0,75г трет-бутилефіру 4-бензил-2(SiO2, СН2Сl2/МеОН/NН4ОН 85/15/1) і одержують (нафталін-2-ілметил)піперазин-1-карбонової кис0,3г 3-(7-азо-1Н-індол-3-ілметил)-1лоти у 3мл діхлорметану додають по краплинах бензилпіперазину; МН+ 307, Rf 0,51 3мл трифтороцтової кислоти. Після 75хв. при кім(CH2Cl2/MeOH/NH4OH 85/15/1). натній температурі суміш виливають на кригу та Подібним чином одержують 1-бензил-3-(1Hпідлужують 25% розчином гідроксиду амонію. Фаіндол-2-ілметил)піперазин; МН+ 306, Rf 0,32 зи розділяють, водну фазу екстрагують діхлорме(CH2Cl2/MeOH/NH4OH 93/7/0,5). таном. Об'єднані органічні фази сушать над суль Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPiperazine oxime derivatives with antagonistic activity to nk-1 receptor, use thereof, a pharmaceutical composition based thereon, a method for producing and a method for producing intermediary compounds
Автори англійськоюvan Scharrenburg Gustaaf J.M., Tulp Martinus T. M., Mccreary Andrew C., Iwema Bakker, Wouter I., Iwema Bakker Wouter I.
Назва патенту російськоюОксимпроизводные пиперазина с антагонистической активностью к рецептору nk-1, их применение, фармацевтическая композиция на их основании, способ ее получения и способ получения промежуточных соединений
Автори російськоюван Шарренбург Густаф Й.М., Тульп Мартинус Т.М., Маккрири Эндрю К., Ивема Баккер Воутер И.
МПК / Мітки
МПК: C07D 209/00, C07D 265/00, C07D 241/00, A61K 31/495, A61P 1/00, C07D 413/14, C07D 403/14, C07D 403/06
Мітки: антагоністичною, рецептора, одержання, проміжних, застосування, сполук, композиція, активністю, оксимпохідні, спосіб, нк-1, фармацевтична, основі, піперазину
Код посилання
<a href="https://ua.patents.su/11-75425-oksimpokhidni-piperazinu-z-antagonistichnoyu-aktivnistyu-do-receptora-nk-1-kh-zastosuvannya-farmacevtichna-kompoziciya-na-kh-osnovi-sposib-oderzhannya-ta-sposib-oderzhannya-promizh.html" target="_blank" rel="follow" title="База патентів України">Оксимпохідні піперазину з антагоністичною активністю до рецептора nk-1, їх застосування, фармацевтична композиція на їх основі, спосіб її одержання та спосіб одержання проміжних сполук</a>
Попередній патент: Чіп-картка
Наступний патент: Спосіб пригнічення бур’янів
Випадковий патент: Пристрій для герметизації внутрішнього простору при підйомі колони насосно-компресорних труб під тиском












