Похідні триазолу, спосіб їх одержання, фармацевтичний препарат, спосіб лікування або профілактики грибкових інфекцій та проміжна сполука
Номер патенту: 46828
Опубліковано: 17.06.2002
Автори: Стефенсон Пітер Т., Грін Стюарт, Мертіашоу Чарльз В.
Формула / Реферат
1. Производные триазола формулы I:
R1-ОР(О)(ОН)2 , I
где R1 представляет собой группу формулы Iа
где
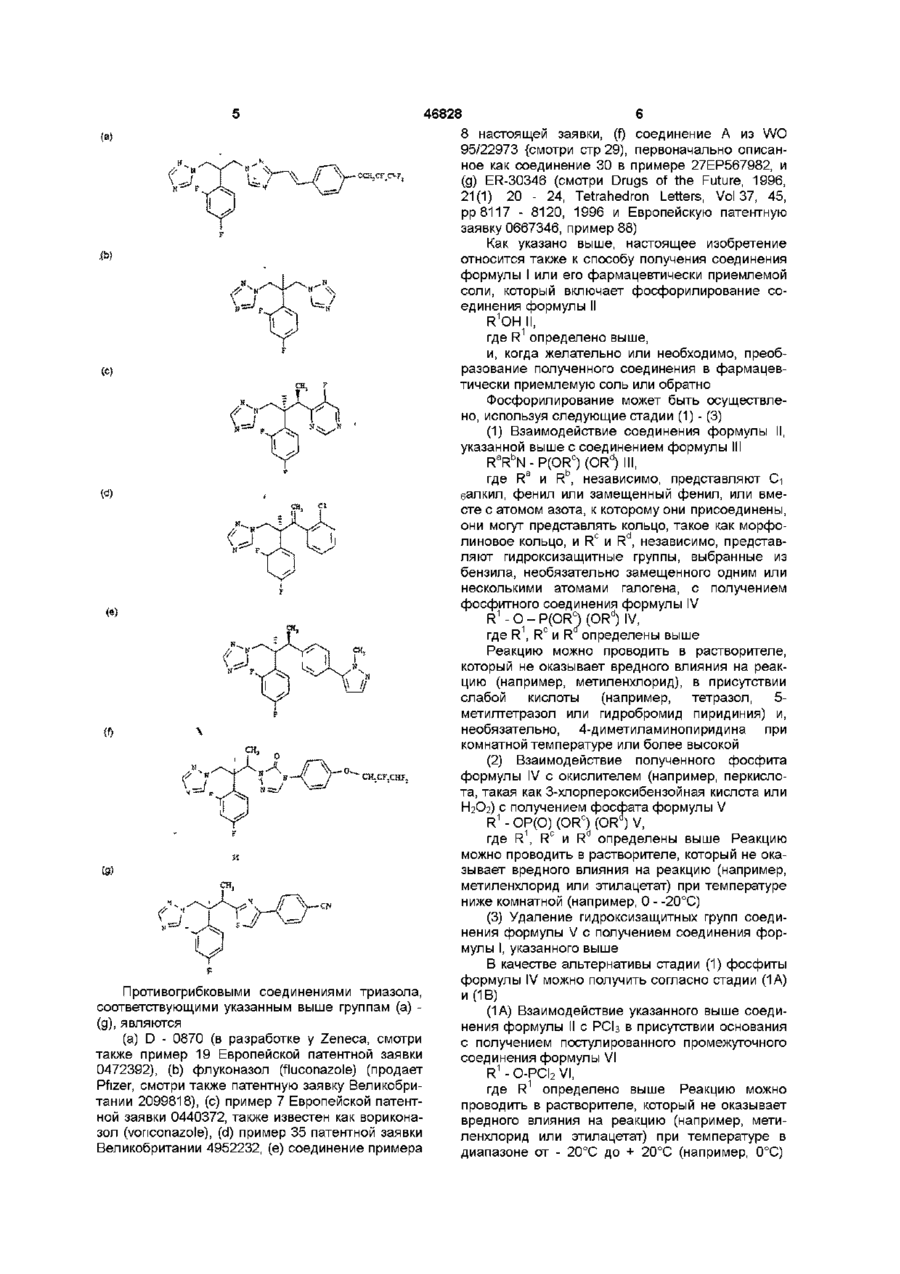
R2 представляет фенил, замещенный одним или несколькими атомами галогена;
R3 представляет Η или СН3;
R3a представляет Η или вместе с R3 может представлять =СН2; и R4 представляет 5- или 6-членное азотсодержащее гетероциклическое кольцо, которое произвольно замещено одной группой или более, выбранное из галогена, =О, фенила [замещенного группой, выбранной из CN и (C6H4)-OCH2CF2CHF2] или СН=СН(C6H4)ОСН2СF2СНF2; или фенила, замещенного одной или несколькими группами, выбранными из галогена и метилпиразолила,
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, где R2 является 2,4-дифторфенилом.
3. Соединение по пп. 1 или 2, где R3 является Η или метилом.
4. Соединение по любому из пп. 1-3, где R4 представляет собой или содержит триазолильную, пиримидинильную или тиазолильную группу.
5. Соединение по любому из предшествующих пунктов, которое представляет собой: 2-(2,4-дифторфенил)-1,3-бис-(1,2,4-триазол-1-ил)-2-пропилдигидрофосфат или (2R,3S)-2-(2,4-дифторфенил)-3-(5-фтор-4-пиримидинил)-1-(1Н-1,2,4-триазол-1-ил)-2-бутандигидрофосфат или их фармацевтически приемлемые соли.
6. Фармацевтический препарат, содержащий эффективное количество соединения формулы I по п. 1 или его фармацевтически приемлемой соли в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем.
7. Соединение формулы I по п.1 или его фармацевтически приемлемая соль для применения в качестве лекарственного препарата для лечения или профилактики грибковых инфекций.
8. Способ лечения или профилактики грибковых инфекций, заключающийся во введении соединения формулы I по п. 1 или его фармацевтически приемлемой соли нуждающемуся в таком лечении пациенту.
9. Способ получения соединения формулы I по п. 1 или его фармацевтически приемлемой соли, заключающийся в фосфорилировании соединения формулы II
R1ОН , II
где R1 определено в п. 1;
когда, желательно или необходимо, преобразование полученного соединения в фармацевтически приемлемую соль или обратно.
10. Способ по п. 9, отличающийся тем, что включает cтадию удаления гидроксизащитных групп соединения формулы V
R1-OP(O)(ORc)(ORd), V
где R1 определено в п. 1 и Rc и Rd независимо представляют гидроксизащитные группы, выбранные из бензила, необязательно замещенного одним или несколькими атомами галогена.
11. Соединение формулы V
R1-OP(O)(ORc)(ORd), V
где R1 определено в п. 1 и Rc и Rd независимо представляют гидроксизащитные группы, выбранные из бензила, необязательно замещенного одним или несколькими атомами галогена.
Текст
1 Производные триазола формулы І R1-OP(O)(OH)2, I где R1 представляет собой группу формулы la R представляет фенил, замещенный одним или несколькими атомами галогена, R3 представляет Н или СНз, R3a представляет Н или вместе с R3 может пред4 ставлять =СЬІ2, и R представляет 5- или 6членное азотсодержащее гетероциклическое кольцо, которое произвольно замещено одной группой или более, выбранное из галогена, =0, фенила [замещенного группой, выбранной из CN и (C6H4)-OCH2CF2CHF2] или CH=CH(C6H4)OCH2CF2CHF2, или фенила, замещенного одной или несколькими группами, выбранными из галогена и метилпиразолила, или его фармацевтически приемлемая соль 2 2 Соединение по п 1, где R является 2,4дифторфенилом 3 3 Соединение по пп 1 или 2, где R является Н или метилом СПОСІБ 4 Соединение по любому из пп 1-3, где R представляет собой или содержит триазолильную, пиримидинильную или тиазолильную группу 5 Соединение по любому из предшествующих пунктов, которое представляет собой 2-(2,4дифторфенил)-1,3-бис-(1,2,4-триазол-1-ил)-2пропилдигидрофосфат или (2R,3S)-2-(2,4дифторфенил)-3-(5-фтор-4-пиримидинил)-1-(1Н1,2,4-триазол-1-ил)-2-бутандигидрофосфат или их фармацевтически приемлемые соли 6 Фармацевтический препарат, содержащий эффективное количество соединения формулы I по п 1 или его фармацевтически приемлемой соли в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем 7 Соединение формулы І по п 1 или его фармацевтически приемлемая соль для применения в качестве лекарственного препарата для лечения или профилактики грибковых инфекций 8 Способ лечения или профилактики грибковых инфекций, заключающийся во введении соединения формулы І по п 1 или его фармацевтически приемлемой соли нуждающемуся в таком лечении пациенту 9 Способ получения соединения формулы I по п 1 или его фармацевтически приемлемой соли, заключающийся в фосфорилировании соединения формулы II R1OH, II 1 где R определено в п 1, когда, желательно или необходимо, преобразование полученного соединения в фармацевтически приемлемую соль или обратно 10 Способ по п 9, отличающийся тем, что включает стадию удаления гидроксизащитных групп соединения формулы V 1 c d R -OP(O)(OR )(OR ), V 1 где R определено в п 1 и Rc и Rd независимо представляют гидроксизащитные группы, выбранные из бензила, необязательно замещенного одним или несколькими атомами галогена 11 Соединение формулы V 1 c d R -OP(O)(OR )(OR ), V 1 где R определено в п 1 и Rc и Rd независимо представляют гидроксизащитные группы, выбранные из бензила, необязательно замещенного одним или несколькими атомами галогена О 00 00 (О 46828 Данное изобретение относится к производным триазола, которые могут использоваться в терапии (в частности, для лечения грибковых инфекций людей и других млекопитающих), способу их применения, содержащим их препаратам и способам их получения Известно большое количество противогрибковых соединений триазола Например, в Европейской патентной заявке 0440372, пример 7, описан (2Р,33)-2-(2,4-дифторфенил)-3-(5-фтор-4пиримидинил)-1 -(1Н-1,2,4-триазол-1 -ил)бутан-2-ол (так же известный, как вориконазол), который обладает особо хорошей активностью против клинически важных грибков Aspergillus spp Однако это соединение имеет низкую растворимость в водной среде, что делает необходимым применение комплексообразующих агентов для получения удовлетворительных водных препаратов, таких как препараты для внутривенного введения В Европейской патентной заявке 0440372 предлагаются совместные препараты с "производными циклодекстрина для повышения растворимости, однако всегда желательно свести число компонентов в препарате до минимума для минимизации возможных вредных реакций у пациентов В патентной заявке Великобритании 2128193 описаны эфиры фосфорной кислоты для применения в качестве фунгицидов и инсектицидов растений Maunne и др [Int J Pharm, 1993, 94 (1 -3), 11 14] описывают бисмезилат а-(2,4-дифторфенил)а-[(1 -(2-(3-пиридил)фенилэтенил)]-1 Н-1,2,4триазол-1 -этанола, который, как установлено, является противогрибковым агентом с высокой растворимостью Другие триазольные противогрибковые средства известны из Европейской патентной заявки 0576201 и Международной патентной заявки WO 97/01552 В Европейской патентной заявке 0413674 описано получение пролекарств терапевтических ингибиторов гликозидазы путем фосфорилирования свободной гидроксильной группы этой молекулы Однако фосфорилирование третичных гидроксильных групп не описано В настоящее время обнаружено, что противогрибковые соединения триазола типа соединений, содержащих третичную гидроксильную группу, включая (2Р,33)-2-(2,4-дифторфенил)-3-(5-фтор-4пиримидинил)-1 -(1 Н-1,2,4-триазол-1 -ил)-бутан-2ол, могут быть преобразованы в пролекарства со значительно большей растворимостью, которые легко преобразуются in vivo, давая желаемый активный радикал Согласно данному изобретению предложено соединение формулы 1 R1 - ОР(О) (ОН)2, I где R1 представляет негидроксильную часть противогрибкового соединения триазола типа соединения, содержащего третичную гидроксильную группу, или его фарамацевтически приемлемая соль (здесь обозначены как "соединения по изобретению") Соединения по изобретению отличаются от известных соединений, так как третичная гидроксильная группа в противогрибковых соединениях триазола данного типа раньше не подвергалась функционализации Фармацевтически пригодные соли, которые можно указать, включают соли щелочных металлов фосфатной группы, например, динатриевые или дикалиевые соли, и соли с противоионом амина, например, соли этилендиамина, глицина или холина R1, предпочтительно, представляет группу формулы la гд где R представляет фенил, замещенный одним или несколькими атомами галогена, R3 представляет Н или СНз R3a представляет Н или вместе с R3 может представлять = СНг, и R4 представляет 5- или 6-членное азотсодержащее гетероциклическое кольцо, которое необязательно замещено одной или несколькими группами, выбранными из галогена, = О, фенила [замещенного группой, выбранной из CN и (СбН4)OCH2CF2CHF2] или СН = СН - (С6Н4) OCH2CF2CHF2, или фенил, замещенный одной или несколькими группами, выбранными из галогена и метилпиразолила Когда R1 представляет группу формулы la, как определено выше, R2, предпочтительно, является 2,4-дифторфенилом и R3, предпочтительно, является Н или метилом Азотсодержащие гетероциклические кольца, которые может представлять или содержать R4, включаюттриазолил, пиримидинил итиазолил Предпочтительные конкретные группы, которые может представлять R1, включают, 46828 8 настоящей заявки, (f) соединение А из WO (a) 95/22973 {смотри стр 29), первоначально описанное как соединение 30 в примере 27ЕР567982, и (g) ER-30346 (смотри Drugs of the Future, 1996, 21(1) 20 - 24, Tetrahedron Letters, Vol 37, 45, pp8117 - 8120, 1996 и Европейскую патентную заявку 0667346, пример 88) Как указано выше, настоящее изобретение (Ь) относится также к способу получения соединения формулы I или его фармацевтически приемлемой соли, который включает фосфорилирование соединения формулы II 1 R OH II, 1 где R определено выше, и, когда желательно или необходимо, преобразование полученного соединения в фармацев(C) тически приемлемую соль или обратно Фосфорилирование может быть осуществлено, используя следующие стадии (1) - (3) (1) Взаимодействие соединения формулы II, указанной выше с соединением формулы III R a R b N-P(OR c ) (ORd) III, где Ra и Rb, независимо, представляют Сі (d) єалкил, фенил или замещенный фенил, или вместе с атомом азота, к которому они присоединены, они могут представлять кольцо, такое как морфолиновое кольцо, и Rc и Rd, независимо, представляют гидроксизащитные группы, выбранные из бензила, необязательно замещенного одним или несколькими атомами галогена, с получением фосфитного соединения формулы IV R1 - О - P(ORC) (ORd) IV, где R1, Rc и R определены выше Реакцию можно проводить в растворителе, который не оказывает вредного влияния на реакцию (например, метиленхлорид), в присутствии слабой кислоты (например, тетразол, 5метилтетразол или гидробромид пиридиния) и, необязательно, 4-диметиламинопиридина при (0 комнатной температуре или более высокой (2) Взаимодействие полученного фосфита формулы IV с окислителем (например, перкислоCH.CF.CHF. та, такая как 3-хлорпероксибензойная кислота или Н2О2) с получением фосфата формулы V R1 - ОР(О) (ORC) (ORd) V, где R1, Rc и Rd определены выше Реакцию можно проводить в растворителе, который не оказывает вредного влияния на реакцию (например, метиленхлорид или этилацетат) при температуре ниже комнатной (например, 0 - -20°С) (3) Удаление гидроксизащитных групп соединения формулы V с получением соединения формулы I, указанного выше В качестве альтернативы стадии (1) фосфиты формулы IV можно получить согласно стадии (1А) Противогрибковыми соединениями триазола, и (1В) соответствующими указанным выше группам (а) (1А) Взаимодействие указанного выше соеди(д), являются нения формулы II с РСІз в присутствии основания (a) D - 0870 (в разработке у Zeneca, смотри с получением постулированного промежуточного также пример 19 Европейской патентной заявки соединения формулы VI 0472392), (Ь) флуконазол (fluconazole) (продает R1 - О-РСЬ VI, Pfizer, смотри также патентную заявку Великобригде R1 определено выше Реакцию можно тании 2099818), (с) пример 7 Европейской патентпроводить в растворителе, который не оказывает ной заявки 0440372, также известен как вориконавредного влияния на реакцию (например, метизол (vonconazole), (d) пример 35 патентной заявки ленхлорид или этилацетат) при температуре в Великобритании 4952232, (е) соединение примера диапазоне от - 20°С до + 20°С (например, 0°С) 46828 8 Подходящие основания включают пиридин и Nметилимидазол (1В) Взаимодействие соединения формулы VI с соединением формулы RCOH и/или RdOH (где Rc d и R определены выше), с получением указанного выше соединения формулы IV Эту реакцию проводят без выделения соединения формулы VI при температуре около комнатной Гидроксизащитные группы, которые могут представлять Rc и Rd, включают 2,6-дихлорбензил и 2-хлор-6-фторбензил Бензильные группы можно удалить путем каталитического гидрирования (например, над катализатором Перлмана "Pearlman's catalyst" или палладием-на-угле) или с помощью бромтриметилсилана Если стадию (3) проводят в присутствии ацетата натрия или гидроксида натрия, можно сразу получить динатриевую соль Указанная выше стадия (3) способа и промежуточные соединения формулы V являются дополнительными аспектами данного изобретения Соединения формулы II и III либо являются известными, либо их можно получить, применяя известные методы Специалистам понятно, что в процессе синтеза соединения данного изобретения может потребоваться защита чувствительных функциональных групп и удаление защиты Этого можно достичь общеизвестными способами, например, как описаної W Green и Р G M Wuts "Protective Groups in Organic Synthesis", John Wiley and Sons Inc, 1991 Соединения по изобретению могут использоваться для животных, включая человека, вследствие своей фармакологической активности В частности, соединения могут использоваться при лечении или профилактике локальных грибковых инфекций у людей, вызванных, среди прочих организмов, штаммами Candida, Tnchophyton, Microsporum или Epidermophyton или инфекцией слизистой оболочки, вызванных Candida albicans (например, кандидозного стоматита и вагинального кандидоза) Их также можно применять при лечении грибковых инфекций организма, вызванных, например, штаммами Candida (например, Candida albicans), Cryptococcus neoformans, Aspergillus flavus, Aspergil-lus fumigatus, Coccidioides, Paracoccidiodes, Histoplasma или Blastomyces агаровой средой, каждая из которых включает конкретную концентрацию исследуемого соединения, засевают стандартной культурой, например, Candida albicans, и затем каждую чашку инкубируют в течение 48 часов при 37°С Затем чашки исследуют на присутствие или отсутствие роста грибков и отмечают соответствующее значение минимальной ингибирующей концентрации, м и к Другие используемые в этом тесте микроорганизмы могут включать Aspergillus fumigatus, Tnchophyton spp, Microsporum spp, Epidermophyton floccosum, Coccidioides immitis и Torulopsis glabrata Некоторые соединения по изобретению, хотя и являются активными in vivo, могут не проявлять активность в этих тестах in vitro Оценить соединения данного изобретения m vivo можно по сериям доз при внутрибрюшинной или внутривенной инъекции или при оральном введении мышам, зараженным, например, штаммом Candida albicans или fumigatus Активность основана на продолжительности жизни обработанной группы мышей после смерти мышей из необработанной группы Отмечают величину дозы, при которой данное соединение обеспечивает 50% защиту против летального действия инфекции (PD50) Для моделей инфекции Aspergillus spp количество мышей, прошедших курс лечения после установленной дозы, позволяет дополнительно оценить активность Таким образом, согласно другому аспекту данного изобретения предложен способ лечения или профилактики грибковой инфекции, который включает введение пациенту терапевтически эффективного количества соединения по изобретению Предложено также применение соединений по изобретению в качестве фармацевтических препаратов и применение соединений по изобретению при получении лекарственных препаратов для лечения или профилактики грибковых инфекций Оценку противогрибковой активности соединений данного изобретения in vitro проводили путем определения минимальной ингибирующей концентрации (м и к), которая является концентрацией исследуемого соединения в подходящей среде, при которой не происходит роста конкретного микроорганизма На практике серии чашек с Ежедневная доза соединений данного изобретения для орального и парентерального введения людям составляет от 0,01 до 20мг/кг (в виде разовой дозы или разделенной на несколько раз), когда введение производят орально или парентерально Следовательно, таблетки или капсулы этих соединений содержат от 5мг до 0,5г активного соединения для введения одного соединения или двух или более одновременно, как предусмотрено В любом случае врач определяет фактическую дозировку, которая наиболее подходит конкретному пациенту, и она меняется в зависимости от 'Возраста, веса и реакции конкретного пациента Указанная выше дозировка является примером среднего случая, конечно, могут быть отдельные случаи, когда предпочтительны диапазоны больших или меньших доз, и такие случаи входят в объем данного изобретения Людям можно вводить соединения по изобретению сами по себе, но обычно в смеси с фармацевтически пригодным носителем, выбранным в соответствии с предполагаемым способом введения и обычной фармацевтической практикой Например, их можно принимать орально в виде таблеток, содержащих такой наполнитель, как крахмал или лактоза, или в виде капсул или драже, самих по себе или в смеси с наполнителем, или в виде эликсиров, растворов или суспензий, содержащих вкусовые или подкрашивающие агенты Их можно вводить парентерально, например, внутривенно, внутримышечно или подкожно Для парентерального введения лучше всего применять их в виде стерильных водных растворов, которые могут содержать другие вещества, например, соли или глюкозу в количестве, достаточном для достижения изотоничности раствора с кровью 46828 10 Альтернативно, соединения по изобретению можно вводить в виде суппозитория или пессария, 1 PClj, ЩфИДИН или их можно наносить наружно в виде лосьона, 2. BnOH ___.— раствора, крема (например, включающего водную з НА эмульсию полиэтиленгликолей или вазелинового масла), или их можно ввести в состав при концентрации от 1 до 10% мазей, содержащих основу из К перемешиваемому этилацетату (1530мл) белого воска или бесцветного мягкого парафина добавляют 2-(2,4-дифторфенил)-1,3-бис(1 Н-1,2,4вместе со стабилизаторами и консервантами, котриазол-1-ил)-2-ол (известный так же как флукоторые могут потребоваться назол, 306,0г, 1,00ммоль) и пиридин (237,Зг, З.ООмоль) перед охлаждением до 0°С К реакциТаким образом, согласно еще одному аспекту, онной смеси добавляют по каплям треххлористыи данное изобретение относится к фармацевтичефосфор (137,4г, 1,00моль), поддерживая темпераской композиции, содержащей, предпочтительно, туру между 0 и 5°С, затем дают реакционной смеменее 50мас % соединения по изобретению в си нагреться до 15°С за 30 минут Затем добавсмеси с фармацевтически пригодным адъюванляют бензиловый спирт (216г, 2,00моль) за 30 том, разбавителем или носителем Особый интеминут при 15 - 20°С Еще через 30 минут добаврес представляют водные препараты для внутриляют перекись водорода (27,5%мас/мас в воде, венного введения 373г), поддерживая температуру при 15 - 20°С Приведенные далее Примеры иллюстрируют Через 30 минут отделяют водную фазу, и органиданное изобретение ческую фазу промывают водным метабисульфиПример 1 2-(2,4-Дифторфенил)-1,3-бис(1 Нтом натрия, разбавленной соляной кислотой и 1,2,4-триазол-1-ил)-2-пропилдигидрофосфат водой Растворитель удаляют при пониженном (а) Дибензил 2-(2,4-дифторфенил)-1,3-бис(1Ндавлении и заменяют метил изобутил кетоном 1,2,4-триаэол-1-ил)-2-пропилфосфат (850мл) и трет-бутилметиловым эфиром (1132мл) Способ А После гранулирования при 20°С в течение 1 часа и при 0°С в течение 1 часа продукт фильтруют и промывают охлажденными на льду трет1 (ВпО^РН'Рг бутилметиловым эфиром (2 х 220мл) и сушат при 50°С в вакууме в течение 18 часов, получая ука2 тСРВА занное в подзаголовке соединение (358г, 63%) Точка плавления и спектроскопические данные Раствор 2-(2,4-дифторфенил)-1,3-бис(1 Нидентичны данным, установленным в способе А 1,2,4-триазол-1-ил)-2-ола (известного так же, как флуконазол, 10,Ог, 32,6ммоль), 1Н-тетразола (б) 2-(2,4-Дифторфенил)-1,3-бис(1 Н-1,2,4(6,85г, 97,8ммоль), дибензилдиизопропилфосфотриазол-1-ил)-2-про-пилдигидрофосфат рамидита) (phosphoramidite) (22,55г, 65,2ммоль) в P0JL метиленхлориде (100мл) перемешивают при комнатной температуре в атмосфере азота в течение N *> Pd/C 2 часов Затем смесь охлаждают до 0°С и добавляют раствор 3-хлорпероксибензойной кислоты (13,5г, 50 - 55% мас/мас, 39,1ммоль) в метиленхлориде (50мл), поддерживая температуру при 0°С Полученной смеси дают нагреться до комПасту соединения стадии (а) (9,80г, натной температуры в течение 1 часа, затем про17,3ммоль), катализатора 5% палладия-на-угле мывают водным метабисульфитом натрия и би(50% влажность, 1,0г) и гидроксида натрия (1,38г, карбонатом натрия После сушки (MgSC^) 34,6ммоль) в воде (26мл) гидрируют при комнатрастворитель удаляют и заменяют метилизобуной температуре и давлении 414 килопаскалей тилкетоном (37мл) и трет-бутилметиловым эфи(60psi = 4,219кг/см2) в течение 20 часов Раствор ром (74мл) После гранулирования при - 10°С в фильтруют через набивку из целлита (торговая течение 1 часа продукт фильтруют, промывают марка) и промывают водой (5мл) Отделяют толуохлажденными на льду метилизобутидкетоном и ол и охлаждают водную фазу до 0°С, после чего трет-бутилметиловым эфиром (1 3, 15мл) и судобавляют серную кислоту (1,70г, 17,3ммоль) шат при 50°С в вакууме в течение 18 часов, полуПолученную ласту гранулируют при 0°С в течение чая указанное в подзаголовке соединение (16,05г, 1 часа и затем отфильтровывают, промывают во87%), т пл 93°С дой (2 х 5мл) и сушат в вакууме при 50°С, получая указанное в заголовке соединение (5,80г, 87%), т Найдено С 57,12, Н 4,46, N 14,85 пл 223-224°С Рассчитано для C27H25F2N6O4P С 57,24, Н Найдено С 40,28, Н 3,39, N 21,63 4,46, N 14,84% Рассчитано для C13H13F2N6O4P С 40,43, Н m/z 567 (МН+) 1 3,39, N21,76% Н ЯМР (300МГц, CDCI3) 5 = 4,90 (д, 2Н), 4,95 1 Н ЯМР (300МГц, ДМСО) 5 = 5,07 (д, 2Н), 6,77 (д, 2Н), 5,05 (д, 2Н), 5,19 (д, 2Н), 6,58 - 6,73 (м, 2Н), - 6,83 (м, 1Н), 7,00 - 7,18 (м, 2Н), 7,75 (с, 2Н), 8,53 6,88 - 6,95 (м, 1Н), 7,20 - 7,30 (м, 4Н), 7,32 - 7,38 (с, 2Н) (м, 6Н), 7,80 (с, 2Н), 8,36 (с, 2Н) Пример 2 2-(2,4-Дифторфенил) -1, 3-бис(1НСпособ В 1,2,4-триазол-1-ил)-2-пропилдинатрийфосфат 11 46828 12 57%мас/мас, 48,9ммоль) в метиленхлориде PO-Na, РОЛп, (100мл), поддерживая температуру ниже 0°С Полученной смеси дают нагреться до комнатной температуры в течение 10 минут и затем промывают водным метабисульфитом натрия и бикарбонатом натрия После сушки (MgSC^) и конценF F трирования сырой продукт очищают методом Раствор соединения Примера 1(а) (10,0г, колоночной хроматографии (силикагель - ЗООг, 17,7ммоль) и (ацетата натрия (2,90г, 35,3ммоль) в элюирование этилацетатом) получая указанное в этаноле (160мл) и воде (20мл) гидрируют на катаподзаголовке соединение в виде вязкого сиропа лизаторе Перлмана (1,00г) при комнатной темпе(17,86г. 60%) ратуре и давлении 345 килопаскалей (50psi = + 2 m/z610(MH ) 3,515кг/см ) в течение 16 часов Раствор фильт1 Н ЯМР (300МГц, CDCI3) 5 = 1,39 (д, ЗН), 4,41 руют через набивку из целлита (торговая марка), и (квартет, 1Н), 4,79 (д, 2Н), 4,96 (д, 2Н), 5,34 (д, 1Н), растворители удаляют при пониженном давлении, 5,40 (д, 1Н), 6,59 - 6,66 (м, 1Н), 6,72 - 6,82 (м, 1Н), оставляя густой сироп Его растворяют в этаноле 7,02 - 7,18 (м, ЗН), 7,23 - 7,37 (м, 8Н), 7,79 (с, 1Н), (100мл) при помощи ультразвука и нагревают до 8,46 (д, 1Н), 8,52 (с, 1Н), 8,90 (д, 1Н) кипения с обратным холодильником Полученному (б) (2R.3S) 2-(2,4-дифторфенил)-3-(5-фтор-4раствору дают медленно остыть и гранулируют в пиримидинил-1-(1Н-1,2,4-триазол-1-ил)-2течение 1 часа при комнатной температуре Пробутилдигидрофосфат дукт отфильтровывают, промывают этанолом (10мл) и сушат в вакууме при 50°С, получая указанное в заголовке соединение (4,48г, 59%), т пл 160-162°С 1 Н ЯМР (300МГц, D2O) 5 = 5,01 (д, 2Н), 5,40 (д, 2Н), 6,60 (м, 1Н), 6,79 (м, 1Н), 7,11 (м, 1Н), 7,63 (с, 2Н), 8,68 (с, 2Н) Пример 3 (2R.3S) 2-(2,4-дифторфенил)-3-(5фтор-4-пиримиди-нил-1 -(1Н-1,2,4-триазол-1 -ил)-2бутилдигидрофосфат (а) Дибензил (2R.3S) 2-(2,4дифторфенил)-3-(5-фтор-4-пирими-динил)-1-(1Н1,2,4-триазол-1 -ил)-2-бутилфосфат ЗаО)Р№Рг: гоя, N = = ; / F DMA? mCPBA Раствор {2R.3S) 2-(2,4-дифторфенил)-3-(5фтор-4-пирими-динил)-1-(1Н-1,2,4-триазол-1-ил)2-ола (соединение Примера 7, ЕР 0440372, известное так же, как вориконазол, 17,0г, 48,7ммоль), 4-диметиламинопиридина (10,2г, 83,5ммоль), 1Н тет-разола (10,2г, 146ммоль) и дибензилдиизопропилфосфорамидита) (33,6г, 97,4ммоль) в метиленхлориде (100мл) перемешивают при кипячении с обратным холодильником в течение 2 часов и еще 16 часов при комнатной температуре в атмосфере азота После этого реакционную смесь промывают соляной кислотой и затем бикарбонатом натрия, сушат (MgSO4) и концентрируют Сырой продукт (фосфит) очищают методом колоночной хроматографии (силикагель ЗООг, элюирование гексаном этилацетатом от 3 1 до 1 1), получая светло-желтое масло Его растворяют в метиленхлориде (100мл) и охлаждают до - 10°С, после чего добавляют раствор 3хлорпероксибензойной кислоты (14,8г, Раствор соединения со стадии (а) (5,0г, 8,83ммоль) в метаноле (100мл) гидрируют на катализаторе Перлмана (Pearlman's catalyst) (1,0г) при комнатной температуре и давлении 414 килопаскалей (60psi = 4,219кг/см2) в течение 16 часов Раствор фильтруют через набивку из целлита (торговая марка) и концентрируют Сырой продукт снова растворяют в горячем метаноле (20мл) и гранулируют при 0°С в течение 1 часа После фильтрования и промывания метанолом (5мл) продукт сушат в вакууме при 50°С, получая указанное в заголовке соединение (1,72г, 49%), т пл 145-146°С 1 Н ЯМР (300МГц, ДМСО) 5 = 1,31 (д, ЗН), 4,01 (квартет, 1Н), 5,31 (д, 1Н), 5,42 (д, 1Н), 6,90 - 6,97 (м, 1Н), 7,04 - 7,14 (м, 1Н), 7,20 - 7,30 (м, 1Н), 7,95 (с, 1Н), 8,70 (д, 1Н), 8,73 (с, 1Н), 8,89 (д, 1Н) Пример 4 (2R.3S) 2-(2,4-дифторфенил)-3-(5фтор-4-пиримиди-нил-1 -(1 Н-1,2,4-триазол-1 -ил)-2бутилдигидрофосфат (Альтернативный способ получения) (а) Бис(2-хлор-6-фторбензил) (2R.3S) 2-(2,4дифторфенил)-3-(5-фтор-4-пиримидинил)-1-(1Н1,2,4-триазол-1 -ил) -2-бутилфосфат Раствор (2R.3S) 2-(2,4-дифторфенил)-3-(5фтор-4-пирими-динил)-1-(1Н-1,2,4-триазол-1-ил)2-ола (соединение Примера 7, ЕР 0440372, известное так же, как вориконазол, 10,Ог, 28,6ммоль) и 1-метилимидазола (9,40г, 114ммоль) в метиленхлориде (30мл) охлаждают до 0°С, после чего добавляют раствор треххлористого фосфора (4,73г, 34,4ммоль) в метиленхлориде (20мл), поддержи 13 14 46828 вая температуру ниже 10°С Через 15 минут добавляют раствор 2-хлор-6-фторбензилового спирта (12,0г, 74,4ммоль) в метиленхлориде (40мл) при температуре между 0 и 10°С Через 30 минут добавляют по каплям перекись водорода (25мл, 30% раствор в воде), поддерживая температуру ниже 20°С при охлаждении Еще через 1 час реакционную смесь разделяют 7 и органическую фазу промывают водой (20 х 100мл), сушат (MgSO4) и концентрируют Полученное вязкое масло гранулируют с трет-бутилметиловым эфиром (60мл) в течение 2 часов при 0°С Продукт отфильтровывают, промывают трет-бутилметиловым эфиром (20мл) и сушат при 50°С в течение 18 часов, получая указанное в заголовке соединение в виде белого твердого кристаллического вещества (18,1г, выход 88%), т пл 140 -141 °С 1 Н ЯМР (300МГц, CDCI3) 5 = 1,39 (д, ЗН), 4,33 (квартет, 1Н), 5,08 (д, 1Н), 5,13 (д, 1Н), 5,27 (д, 1Н), 5,31 (д, 1Н), 5,32 (д, 1Н), 5,42 (д, 1Н), 6,60 - 6,75 (м, 2Н), 6,92 - 7,07 (м, 2Н), 7,11 - 7,37 (м, 5Н), 7,81 (с, 1Н), 8,44 (д, 1Н), 8,61 (с, 1Н), 8,91 (с, 1Н) (б) (2R.3S) 2-(2,4-дифторфенил)-3-(5-фтор-4пиримидинил-1-(1Н-1,2,4-триазол-1-ил)-2бутилдигидрофосфат (2070мл) добавляют в течение 10 минут раствор холинбикарбоната (75%мас/мас в воде, 110г, 500ммоль), фильтруют через набивку из целлита (торговая марка) для удаления нерастворимых продуктов, затем охлаждают до 20°С и гранулируют в течение 1 часа Полученный продукт собирают фильтрацией, промывают ацетоном (2 х 250мл) и сушат при 20°С в вакууме в течение 18 часов, получая указанное в заголовке соединение (233,3г, 74%), т пл114-115°С 1 Н ЯМР (300МГц, ДМСО) 5 = 1,23 (д, ЗН), 3,07 (с, 9Н), 3,38 (т, 2Н), 3,60 (квартет, 1Н), 3,78 (квартет, 2Н), 5,50 (с, 2Н), 6,72 - 6,80 (м, 1Н), 6,94 - 7,02 (м, 1Н), 7,36 - 7,42 (м, 1Н), 7,82 (с, 1Н), 8,59 (д, 1Н), 8,78 (д, 1Н), 9,35 (с, 1Н) Пример 6 2-(2,4-Дифторфенил)-1-{3-[(Е)-4(2,2,3,3-тетрафтор-пропокси)стирил]-1 Н-1,2,4триазол-1 -ил)-3-(1 Н-1,2,4-триазол-1 -ил)-2пропилдигидрофосфат (а) (Дибензил) 2-(2,4-дифторфенил)-1-{3-[(Е)4-(2,2,3,3-тетрафторпропокси)стирил]-1 Н-1,2,4триазол-1 -ил}-3-(1 Н-1,2,4-триазол-1 -ил)-2пропилфосфат ])(ВпО),РНРг, 1}И, Смесь соединения со стадии (а) (50г, 70ммоль), гидроксида натрия (8,40г, 210ммоль) и катализатора 5% палладия-на-угле (Юг) в толуоле (450мл) и воде (150мл) гидрируют при комнатной температуре и давлении 414 килопаскалей (60psi = 4,219кг/см2) в течение 24 часов Реакционную смесь фильтруют через целит (торговая марка), и толуольный слой отделяют и выбрасывают Водный слой промывают метиленхлоридом (2 х 75мл) и толуолом (2 х 75мл) и затем охлаждают до 0°С, после чего добавляют серную кислоту (10,Зг, 105ммоль) После гранулирования при 0°С в течение 1 часа продукт отфильтровывают, промывают водой (60мл) и сушат в вакууме при 50°С в течение 16 часов, получая указанное в заголовке соединение (20,5г, 68%) Данные протонного ЯМР идентичны данным, полученным в Примере 3 (б) Найдено С 44,48, Н 3,45, N 16,19 Рассчитано для C16H15F3N5O4P С 44,77, Н 3,52, N 16,31% Пример 5 Дигидрат (2R.3S) 2-(2,4дифторфенил)-3-(5-фтор-4-пиримидинил-1-(1Н1,2,4-триазол-1 -ил)-2-бутил(2-гидроксиэтил) триметиламмонийгидрофосфата РОДд РО 3 Н(М=>СН.СН-ОН) К перемешиваемой пасте из соединения Примера 3 (б) (214,7г, 500ммоль) в ацетоне CHF, 2-(2,4-Дифторфенил)-1-{3-[(Е)-4-(2,2,3,3тетрафторпроп-окси)стирил]-1Н-1,2,4-триазол-1ил}-3-(1 Н-1,2,4-триазол-1 -ил)пропан-2-ол (рацемат по примеру 19, ЕР 0472392, 475мг, 0,88ммоль), 1Н-тетразол (185мг, 2,64ммоль) и дибензилдиизопропилфосфорамидит (607мг, 1,76ммоль) в метиленхлориде (5мл) перемешивают при комнатной температуре в атмосфере азота в течение 20 часов Затем смесь охлаждают до 0°С и добавляют по каплям перекись водорода (1,0мл, 30% раствор в воде), поддерживая температуру ниже 20°С Полученную смесь перемешивают при 20°С в течение 30 минутки затем отделяют органический слой, который промывают водой, сушат (MgSC^), и выпаривают растворитель Полученное светложелтое масло очищают методом колоночной хроматографии (силикагель, элюирование этилацетатом / гексаном), получая указанное в подзаголовке соединение в виде вязкого сиропа (595мг, 84%) 1 Н ЯМР (300МГц, CDCI3) 5 = 4,37 (т, 2Н), 4,91 (д, 2Н), 4,97 (д, 2Н), 5,02 (д, 1Н), 5,07 (д, 1Н), 5,16 (д, 1Н), 5,18 (д, 1Н), 6,05 (тт, 1Н), 6,59 - 6,78 (м, 2Н), 6,82 (д, 1Н), 6,90 (д, 2Н), 6,91 - 7,00 (м, 1Н), 7,21 - 7,38 (м, ЮН), 7,42 (д, 2Н), 7,42 (д, 1Н), 7,79 (с, 1Н), 8,28 (с, 1Н), 8,39 (с, 1Н) (б) 2-(2,4-Дифторфенил)-1-{3-[(Е)-4-(2,2,3,3тетрафтор-проп-окси)стирил]-1Н-1,2,4-триазол-1ил}-3-(1 Н-1,2,4-триазол-1 -ил)-2пропилдигидрофосфат 15 46828 CHF. Раствор соединения стадии (а) (298мг, 0,37ммоль) в метиленхлориде (5мл) охлаждают до 0°С и затем обрабатывают бромтриметилсиланом (254мг, 1,66ммоль) и пиридином (180мг, З.Юммоль) Полученную смесь перемешивают при 0°С в течение 3 часов и затем резко охлаждают водой (1мл), содержащей гидроксид натрия (96мг, 2,41ммоль) Затем смесь подкисляют разбавленной серной кислотой, и продукт экстрагируют в этилацетат После промывания солевым раствором фазу этилацетата сушат (MgSO4) и выпаривают растворитель, получая указанное в заголовке соединение в виде светло-желтой пены (202мг, 88%) Пример 7 (2RS,3RS)-3-(4-[4цианфенил]тиазол-2-ил)-2-(2,4-дифторфенил)-1(1Н-1,2,4-триазол-1 -ил)-2-бутилдигидрофосфат (а) Дибензил (2RS,3RS)-3-(4-[4цианфенил]тиазол-2-ил)-2-(2,4-дифторфенил)-1(1 Н-1,2,4-триазол-1 -ил)-2-бутилфосфат 3-[4-(4-Цианфенил)тиазол-2-ил]-2-(2,4дифторфенил)-1 -(1 Н-1,2,4-триазол-1 -ил)бутан-2ол (пример 88, ЕР 0667346, 900мг, 2,06ммоль), 1Н-тетразол (432мг, 6,18ммоль), 4диметиламинопиридин (100мг, 0,82ммоль) и дибензилдиизопропилфосфорамидит (1,42г, 4,12ммоль) в метиленхлориде (10мл) кипятят с обратным холодильником в атмосфере азота в течение 20 часов Затем смесь охлаждают до 0°С и добавляют по каплям перекись водорода (2,5мл, 30% раствор в воде), поддерживая температуру ниже 20°С Полученную смесь перемешивают при 20°С в течение 30 минут и затем отделяют органический слой, который промывают водой, сушат (MgSO4) и выпаривают растворитель Полученное светло-желтое масло очищают методом колоночной хроматографии (силикагель, элюирование етилацетатом / гексаном), получая указанное в подзаголовке соединение в виде вязкого сиропа (732мг, 51%) 1 Н ЯМР (300МГц, CDCI3) 5 = 1,40 (д, ЗН), 4,38 (квартет, 1Н), 4,81 - 4,96 (м, 4Н), 5,40 (д, 1Н), 5,43 (д, 1Н), 6,62-6,71 (м, 1Н), 6,74-6,82 (м, 1Н), 7,157,37 (м, ЮН), 7,58 (с, 1Н), 7,62 (д, 2Н), 7,73 (с, 1Н), 7,97 (д, 2Н), 8,48 (с, 1Н) (б) ^3^3)-3-(4-[4-цианфенил]тиазол-2-ил)2-(2,4-дифтор-фенил)-1 -(1 Н-1,2,4-триазол-1 -ил)-2бутилдигидрофосфат 16 Раствор соединения стадии (а) (310мг, 0,44ммоль) в метиленхлориде (5мл) охлаждают до 0°С и затем обрабатывают бромтриметилсиланом (303мг, 1,98ммоль) и пиридином (215мг, 3,7ммоль) Полученную смесь перемешивают при 0°С в течение 3 часов и потом резко охлаждают водой (1мл), содержащей гидроксид натрия (115мг, 2,87ммоль) Получают желтый осадок, который выделяют путем фильтрации и затем делят между разбавленной серной кислотой и метиленхлоридом Органическую фазу промывают солевым раствором, сушат (MgSO4), и выпаривают растворитель, получая указанное в заголовке соединение в виде светло-желтого твердого вещества (80мг, 35%) 1 Н ЯМР (300МГц, ДМСО) 5 = 1,38 (д, ЗН), 4,22 (квартет, 1Н), 5,37 (д, 1Н), 5,41 (д, 1Н), 6,88 - 6,97 (м, 1Н), 7,09 - 7,19 (м, 1Н), 7,31 - 7,40 (м, 1Н), 7,80 (с, 1Н), 7,87 (д, 2Н), 8,05 (д, 2Н), 8, 32 (с, 1Н), 8, 65 (с, 1Н) Пример 8 ^,33)-2-(2,4-дифторфенил)-3-[4(1-диметилпиразол-5-ил)фенил]-1-(1,2,4-триазол1-ил)-2-бутилдинатрийфосфат (а) О,І\І-диметил-4-йодбензолгидроксамовая кислота Раствор пиридина (104г, 1,32моль) в дихлорметане (150мл) добавляют по каплям к суспензии 4-йодбензоилхлорида (251 г, 0,94моль) и N,0диметилгидроксиамингидрохлорида (97г, 0,94моль) в дихлорметане (850мл) при 0°С Смеси дают нагреться до комнатной температуры и перемешивают в течение 18 часов Раствор выпаривают при пониженном давлении, остаток растворяют в этилацетате (1л) и затем промывают разбавленной соляной кислотой (2Н, 3 х 400мл) и насыщенным раствором бикарбоната натрия (300мл) и сушат (МагЄСч) Органический экстракт выпаривают при пониженном давлении Остаток чистят путем перегонки, получая указанное в подзаголовке соединение (241 г, 93%) в виде желтого масла, т кип 130°С (0,1мм рт ст), которое харак1 теризуют методом Н ЯМР (б) 2-(2,4-Дифторфенил)-1-(4иодфенил)этанон 2,4-Дифторбензилбромид (23,7мл, 0,114моль) добавляют по каплям к перемешиваемой смеси магниевых стружек (8,1 г, 0,183моль) в сухом эфире (300мл) под азотом Сначала смесь нагревают до тех пор, пока не начнется реакция, и после этого добавляют бромид с такой скоростью, чтобы поддерживать спокойное кипение с обратным холодильником Через 1 час полученный раствор реактива Гриньяра добавляют по каплям при 78°С к раствору О,І\І-диметил-4иодбензолгидроксамовой кислоты [см Стадию (а)] (45,7г, 0,157моль) в сухом эфире (300мл), и смеси дают медленно нагреться до комнатной температуры в течение ночи Смесь делят между насыщенным водным хлоридом аммония и этилацетатом, органический раствор отделяют, сушат 17 46828 18 (MgS04) и концентрируют при пониженном давле(1Н-1,2,4-триаэол-1 -ил)-3-бутен-2-ол нии, получая указанное в заголовке соединение в Натрий (1,2,4-триазол) (12,15г, ІЗЗммоль) довиде белого твердого вещества (38,71 г, 69%), кобавляют к раствору (2,4-дифторфенил)-2-[1-(4торое характеризуют методом 1Н ЯМР спектроиодфенил)этенил]оксирана [34,Зг, 89ммоль из скопии стадии (д)] в сухом ДМФ (350мл) в атмосфере с азотом при 70°С Смесь перемешивают в течение (в) 2-(2,4-Дифторфенил)-1-(4-иодфенил)проп5 часов, охлаждают и удаляют растворитель при 2-енон пониженном давлении Остаток делят между эфиБис(диметиламино)метан (8,78мл, 0,075моль) ром (800мл) и водой (2 х 500мл) Органический добавляют по каплям к перемешиваемой суспенраствор сушат (MgSO4), фильтруют и добавляют зии 2-(2,4-дифторфе-нил)этанона [17,73г, силикагель (60 - 200т, 75г) Эфир удаляют при 0,04595моль из стадии (б)] в уксусном ангидриде пониженном давлении, и оставшееся твердое ве(23,1мл, 0,248моль) при комнатной температуре щество наносят на верхний коней колонки с силиЭта реакция является экзотермической, и темпекагелем (40 - 60т, 75г) и элюируют продукт, исратура смеси возрастает до 60°С По окончании пользуя гексан и возрастающее количество добавления смесь перемешивают при комнатной этилацетата (0 - 75%) Получают продукт в виде температуре в течение 35 минут и затем добавбелой пены (23,8г, 61%), который характеризуют ляют ледяную воду для гидролиза избытка уксусметодом 1Н ЯМР-спектроскопии ного ангидрида Еще через 30 минут продукт экстрагируют в этилацетат, и экстракты промывают (ж) [(Р)-2-(2,4-Дифторфенил)-3-(4-йодфенил)разбавленной соляной кислотой, насыщенным 1 -(1 Н-1,2,4-триазол-1 -ил)-3-бутен-2-ол](+)-3водным бикарбонатом натрия, сушат (MgSO4) и бромкамфор-10-сульфонат концентрируют при пониженном давлении, полуРаствор (+)-3-бромкамфор-10-сульфоновой чая указанное в заголовке соединение в виде бекислоты (36,Зг, 0,110моль) в IMS (40мл) добавлялого твердого вещества(17,03г, 93%), которое хают к раствору продукта стадии (е) (50г, 0,110моль) рактеризуют методом 1Н ЯМР-спектроскопии в IMS (300мл) После внесения затравки полученную пасту гранулируют в течение 20 часов при (г) 2-(2,4-Дифторфенил)-2-(4комнатной температуре Белое твердое вещество иодбензоил)оксиран (22г, О.ОЗмоль) собирают посредством фильтраГидроксид бензилтриметиламмония (3,44мл, ции после дополнительного гранулирования в 40% водный раствор, 8,2ммоль) добавляют одной течение 1 часа при низкой температуре Хиральпорцией к раствору 2-(2,4-дифторфенил)-1-(4ная чистота, оцененная способом хиральной выйодфенил)проп-2-енона [37,Зг, 100,8ммоль из стасокоэффективной жидкостной хроматографии с дии (в)] и трет-бутилгидропероксида (36,6мл, ЗМ в применением колонки Chiralcel OD и элюирования триметилпентане, ЮЭммоль) в толуоле (500мл) этанолом / гексаном [40 60], составляет 95% при комнатной температуре Через два часа смесь (95% ее) промывают водой (2 х 500мл), сушат (MgSO4) и концентрируют при пониженном давлении, полу(з) (Р)-2-(2,4-Дифторфенил)-3-(4-йодфенил)-1 чая указанное в заголовке соединение в виде бе(1 Н-1,2,4-триазол-1 -ил)-3-бутен-2-ол лого твердого вещества (37,46г, 96%), которое Продукт стадии (ж) (206,5г, 0,27моль) добавхарактеризуют методом 1Н ЯМР-спектроскопии ляют к метиленхлориду (620мл) и подщелачивают 40% NaOH Смесь перемешивают в течение 15 (д) (2,4-Дифторфенил)-2-[1 -(4минут при комнатной температуре и делят Водиодфенил)этенил]оксиран ную фазу повторно экстрагируют метиленхлорин-Бутиллитий (50мл, 2,5М в гексане, дом (310мл) Органический раствор продукта про125ммоль) добавляют по каплям за 10 минут к мывают водой (620мл) и концентрируют до перемешиваемой суспензии метилтрифенилфособъема 245мл К перемешиваемому концентрату с фонийбромида (45,Ог, 126ммоль) в сухом ТГФ затравкой добавляют при комнатной температуре (600мл) под азотом при - 70°С Смеси дают нагексан (2450мл) с постоянной скоростью Полугреться до - 20°С за 20 минут, затем добавляют за ченную пасту гранулируют при 5°С в течение 1 5 минут раствор 2-(2,4-дифтофенил)-2-(4часа Фильтрация дает белое твердое вещество иодбензоил)оксирана [37,46г, 97ммоль из стадии (117,4г, 0,26моль), которое характеризуют мето(г)] в сухом ТГФ (200мл) Смеси дают нагреться до дом 1Н ЯМР-спектроскопии комнатной температуры и перемешивают в течение 84 часов Добавляют 10% водный хлорид ам(и) (2Р)-2-(2,4-Дифторфенил)-3-[4-(1 мония (500мл) и смесь концентрируют при пониметилпиразол-5-ил)фенил]-1 -(1,2,4-триазол-1 -ил)женном давлении Продукт экстрагируют в З-бутен-2-ол этилацетат и объединенный экстракты сушат н-BuLi (1,6Н, 24,1мл, 0,04моль) добавляют к (MgSO4)n концентрируют при пониженном давлераствору 1-метилпиразола (3,28г, 0,04моль) в ТГФ нии (370мл) при - 70°С, сохраняя температуру ниже 60°С, и перемешивают в течение 30 минут ПодТвердый остаток обрабатывают кипящим гекдерживая температуру ниже - 40°С, добавляют саном (3 х 500мл), и выбрасывают оставшееся раствор хлорида цинка (0,5Н, 77,1мл, 0,04моль), а твердое вещество Гексановые растворы объедизатем палладий-тетракис (трифенилфосфин) няют, фильтруют через небольшую набивку из (15%мас/мас, 0,9г) Поддерживая температуру силикагеля и концентрируют при пониженном ниже - 40°С, добавляют с постоянной скоростью давлении, получая указанное в заголовке соедираствор стадии (з) (6г, 0,013моль) в ТГФ (36мл) нение в виде желтого масла (34,Зг, 92%), которое Реакционной смеси дают нагреться до комнатной характеризуют методом 1Н ЯМР-спектроскопии температуры и затем кипятят с обратным холо(е) 2-(2,4-Дифторфенил)-3-(4-йодфенил)-1 19 46828 20 дильником в течение 2 часов После охлаждения 67 в совместно поданной международной патентдо комнатной температуры реакцию резко охлажной заявке РСТ / ЕР96 / 02470] дают уксусной кислотой (12мл) и водой (120мл), (л) (Дибензил) (2Р,33)-2-(2,4-дифторфенил)-3поддерживая температуру ниже 25°С Реакцион[4-(1 -метилпира-зол-5-ил)фенил]-1 -(1,2,4-триазолную смесь выпаривают при пониженном давлении 1 -ил)-2-бутилфосфат для удаления ТГФ Продукт экстрагируют метиленхлоридом (120мл), и затем водную фазу экстрагируют метиленхлоридом (50мл) Объединенные органические экстракты промывают водой (2 х l)(-Pr) NPf0Bn) 120мл) и концентрируют, получая масло К перемешиваемому раствору масла в этилацетате м 2) mcpba (100мл) добавляют 5-сульфосалициловую кислоту Раствор продукта со стадии (к) (2,0г, (3,3г, 0,13моль) в ІРА (10мл) Полученную смесь 4,4ммоль), дибензилдиизопропилфосфорамидита перемешивают в течение 1/2 часа при комнатной (2,28г, б.бммоль), тетразола (0,92г, 13,2ммоль) и температуре Полученное отфильтрованное твер4-диметиламинопиридина (50мг) в дихлорметане дое соединение повторно суспендируют в этил(30мл) нагревают при кипячении с обратным хоацетате (50мл) и перекристаллизовывают из ІРА лодильником в течение 13 часов Реакционную (60мл), получая белое твердое вещество (7,2г, смесь охлаждают (0°С) и добавляют мета0,01 моль) Это твердое вещество добавляют к хлорпербензойную кислоту (1,52г, 8,8ммоль) Расметиленхлориду (35мл) и воде (50мл) и подщелатвор перемешивают при 0°С в течение часа, затем чивают 40% NaOH Смесь перемешивают при дают нагреться до комнатной температуры Реаккомнатной температуре в течение 15 минут и деционную смесь промывают водным раствором лят Водную фазу повторно экстрагируют метисульфита натрия (10%, 30мл), насыщенным растленхлоридом (25мл), и объединенные органичевором бикарбоната натрия (30мл) и солевым расские экстракты промывают водой (35мл) твором (10%, 30мл) Органический слой сушат Органический раствор продукта концентрируют до (Na2SO4), и выпаривают растворитель в вакууме, пены и характеризуют получая масло Очистка методом колоночной хроматографии (силикагель - 45г, градиентное [a] D = - 25,6° элюирование от толуола до 3,5% диэтиламина в Рассчитано для C27H25F2N6O4P С 63,45, Н толуоле) дает требуемый продукт в виде бесцвет4,84, N 16,82% ного масла (0,8г, 27%), m/z 671 (М++1) Найдено С 63,92, Н 4,86, N 16,64 1 (к) (2Р,33)-2-(2,4-Дифторфенил)-3-[4-(1Н ЯМР (CDCI3) 5= 1,3 (д, ЗН), 3,8 (с, ЗН), 3,85 метилпиразол-5-ил)фенил]-1 -(1,2,4-триазол-1 -ил)(квартет, 1Н), 4,8 (м, 2Н), 4,9 (м, 2Н), 5,2 (с, 2Н), З-бутан-2-ол 6,25 (с, 1Н), 6,6 (м, 1Н), 6,8 (м, 1Н), 7,05 (м, 1Н), 2 2 7,15 (м, 2Н), 7,2 - 7,35 (м, 12Н), 7,5 (с, 1Н), 7,8 (с, 1Н), 8,23 (с, 1Н) (м) (2Р,33)-2-(2,4-Дифторфенил)-3-[4-(1 метилпиразол-5-ил)фенил]-1 -(1,2,4-триазол-1 -ил)2-бутилдинатрийфосфат Раствор продукта стадии (и) (2,0г, 5ммоль) в этаноле (50мл) гидрируют при 50°С и давлении 50psi (333 килопаскаля = 3,515кг/см2) над 5% палладием-на-угле (0,2г) в течение 18 часов Добавляют еще порцию катализатора (0,2г) и продолжают гидрирование еще в течение 18 часов Смесь фильтруют через Arbocel™ и выпаривают фильтрат при пониженном давлении Остаток хроматорафируют на диоксиде кремния при градиентном элюировании этилацетатом / гексаном / диэтиламином (0 95 5 65 33 2) Фракции, содержащие требуемый продукт, объединяют и выпаривают при пониженном давлении Остаток растворяют в диэтилацетате и повторно выпаривают его (хЗ), затем растворяют в эфире и выпаривают (хЗ), получая бесцветное твердое вещество Это твердое вещество перекристаллизовывают из водного этанола, получая указанное в подзаголовке соединение (1,25г, 62%) в виде бесцветного твердого вещества, т пл 144-145°С, [
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07F 9/6558, C07F 9/6518, A61K 31/00, A61P 31/10, A61K 31/675, A61P 31/00
Мітки: сполука, фармацевтичний, спосіб, грибкових, лікування, одержання, похідні, проміжна, препарат, триазолу, інфекцій, профілактики
Код посилання
<a href="https://ua.patents.su/11-46828-pokhidni-triazolu-sposib-kh-oderzhannya-farmacevtichnijj-preparat-sposib-likuvannya-abo-profilaktiki-gribkovikh-infekcijj-ta-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Похідні триазолу, спосіб їх одержання, фармацевтичний препарат, спосіб лікування або профілактики грибкових інфекцій та проміжна сполука</a>
Попередній патент: Спосіб синтезу кристалічних матеріалів, переважно оксидних
Наступний патент: Установка і спосіб отримання чавуну і/або губчастого заліза
Випадковий патент: Спосіб моделювання інформаційного взаємовпливу біосистем