Похідні піперазину як антагоністи 5-нт1а рецепторів, спосіб їх одержання та проміжна сполука
Формула / Реферат
1. Производные пиперазина общей формулы (I):
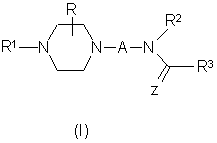
или его фармацевтически приемлемая соль, где
А представляет собой необязательно замещенную одной или более низшей алкильной группой алкиленовую цепь, содержащую от 2 до 4 атомов углерода,
Ζ является атомом кислорода или серы,
R представляет водород или низший алкил,
R1 представляет собой арил, тетрагидронафтил, гетероарил, где арил является фенилом или нафтилом, каждый из которых может быть необязательно замещен одним или более заместителями, независимо выбранными из низшего алкила, низшего алкокси, галогена, гало(низшего)алкила, нитро, нитрила, аминокарбонила, низшего алкоксикарбонила, амино, низшего алкиламино, или ди(низшего)алкиламино, и гетероарил является моноциклическим ароматическим 5-членным гетероциклическим кольцом, имеющим в качестве гетероатомов один или два атома Ν, или один атом N и один атом О или S, или моноциклическим ароматическим 6-членным гетероциклическим кольцом, имеющим в качестве гетероатомов один или два атома Ν, или бициклической ароматической гетероциклической кольцевой системой, имеющей одно такое моноциклическое ароматическое гетероциклическое кольцо, конденсированное с бензольным кольцом, причем каждое кольцо может быть необязательно замещено также, как арил, и тетрагидронафтил может быть необязательно замещен также, как арил, или
R1 представляет бициклический кислородсодержащий арильный радикал формулы:
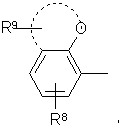
где гетероциклическое кислородсодержащее кольцо содержит от 5 до 7 атомов в кольце, причем указанное гетероциклическое кольцо является неароматическим и необязательно имеет еще один гетероатом в кольце, выбранный из -О-, -S-, -SO2 или NR7, где R7 является водородом или низшим алкилом, и где R8 и R9 представляют водород или один или более заместителей независимо выбранных из низшего алкила, галогена, гидрокси, низшего алкокси, гидрокси(низшего)алкила, низшего алкилокси(низшего)алкила, низшего алканоилокси(низшего)алкила, низшего алкилкарбонила, низшего алкилкарбонил(низшего)алкила, амино, низшего алкиламино или ди(низшего)алкиламино,
или R1 представляет бициклический кислородсодержащий арильный радикал формулы:
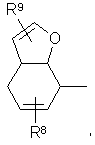
где R8 и R9 имеют вышеуказанные значения,
R2 представляет гетероарил, такой, как определено для R1, или представляет бициклическую ароматическую гетероциклическую систему с двумя конденсированными 6-членными кольцами, каждое из которых имеет немостиковый атом N и которое может быть необязательно замещено так, как определено для арила, при условии, что когда R2 является бициклическим гетероарильным радикалом только с одним гетероциклическим кольцом, указанный бициклический гетероциклический радикал соединен с азотом амина формулы (I) через такое гетероциклическое кольцо, и
R3 представляет водород, низший алкил, циклоалкил, циклоалкенил, циклоалкил(низший)алкил, арил, арил(низший)алкил, группу формулы –NR4R5 или группу формулы OR6, где R4 представляет водород, низший алкил, арил или арил(низший)алкил, и R5 представляет водород, низший алкил, -СO(низший)алкил, арил, -СО(арил), арил(низший)алкил, циклоалкил или циклоалкил(низший)алкил, или R4 и R5 вместе с атомом азота, к которому они оба присоединены, представляют азетидино, пирролидино, пиперидино, гексагидроазепино, морфолино или пиперазино, который может быть необязательно замещен низшим алкилом, арилом или арил(низшим)алкилом, и
R6 представляет низший алкил, циклоалкил, циклоалкил(низший)алкил, арил или арил(низший)алкил, где арил является таким, как определено для R1, и циклоалкил или циклоалкенил является моно-, би-, три- или тетрациклической углеводородной группой с 3-12 атомами углерода, в качестве антагонистов 5-НТ1a рецепторов.
2. Соединение по п.1, где А представляет собой -(СН2)2-, -(СН2)3-,-(СН2)4-, или -СН(СН3)СН2-.
3. Соединение по п. 1 или 2 , где R представляет водород.
4. Соединение по любому из пп. 1-3, где R1 представляет орто-метоксифенил, орто-изопропилфенил, 4-фтор-2-метоксифенил, 2,3-дигидро[1,4]бензодиоксан-5-ил, пиримид-2-ил, 1-нафтил, 3-(1,2-бензоизотиазолил), 1-(7-метоксинафтил) или 1-(5,6,7,8-тетрагидро)нафтил.
5. Соединение по любому из пп. 1-4, где R2 представляет пиридил-2-ил, хинолин-2-ил или тиазол-2-ил.
6. Соединение по любому из пп. 1-5, где R3 представляет низший алкил, циклоалкил, циклоалкенил, фенил, пиперидино или -NH-циклоалкил.
7. Соединение по п. 1, выбранное из группы:
N-(2-(1-(4-(2-метоксифенил)пиперазинил))этил)-N-(2-пиридинил)циклогексанкарбоксамид,
N-циклогексил-N-(2-(1-(4-(2-метоксифенил)пиперазинил))этил)-N-(2-пиридинил)циклогексанмочевину,
N-(2-(1-(4-(2-метоксифенил)пиперазинил))этил)-N-(2-пиридинил)бензамид,
N-(2-(1-(4-(2-метоксифенил)пиперазинил))этил)-N-(2-пиридинил)триметилацетамид,
N-(2-(1-(4-(2-метоксифенил)пиперазинил))этил)-N-(2-тиазолил)циклогексанкарбоксамид,
N-(2-(1-(4-(4-фтор-2-метоксифенил)пиперазинил))этил)-N-(2-пиридинил)циклогексанкарбоксамид,
N-(2-(1-(4-(2,3-дигидро-1,4-бензодиоксин-5-ил))пиперазинил))этил-N-(2-пиридинил)циклогексанкарбоксамид,
Ν-[2-[1-[4-[3-(1,2-бензизотиазолил)]]пиперазинил]этил]-N-(2-пиридил)циклогексанкарбоксамид,
Ν-(2-(1-(4-(2-метоксифенил)пиперазинил))этил)-N-(1-пиперидинилкарбонил)-2-аминопиридин,
N-(2-(4-(2-метоксифенил)пиперазин-1-ил)этил)-N-(пиридин-2-ил)-N'-циклогексантиомочевина,
N-(2-(4-(2-гидpoкcифeнил)пипepaзинил)этил)-N-(2-пиридинил)циклогексанкарбоксамид,
Ν-(2-(1-(4-(1-нафтил))пиперазинил)этил)-N-(2-пиридил)циклогексанкарбоксамид,
Ν-(2-(1-(4-(2-метилфенил))пиперазинил)этил)-N-(2-пиридинил)циклогексанкарбоксамид,
Ν-(2-(1-(4-(2-фторфенил))пиперазинил)этил)-N-(2-пиридинил)циклогексанкарбоксамид,
N-[2-[1-[4-(1-изохинолинил)]пиперазинил]этил]-N-(2-пиридинил)циклогексанкарбоксомид,
Ν-[2-[1-[4-[1-(7-метокси)нафтил]]пиперазинил]этил]-N-(2-пиридил)циклогексанкарбоксамид,
Ν-(2-(1-(4-(2-метоксифенил)пиперазинил))этил)-N-(2-пиридил)адамантан-1-карбоксамид,
N-[2-[1-[4-[1-(2-метокси)нафтил]]пиперазинил]этил]-1-(2-пиридил)циклогексанкарбоксамид,
N-[2-[1-[4-[1-(5,6,7,8-тетрагидро)нафтил]]пиперазинил]этил]-N-(2-пиридил)циклогексанкарбоксамид,
(S)-N-(1-метил-2-(4-(2-метоксифенил)-1-пиперазинил)этил)-N-(2-пиридинил)циклогексанкарбоксамид,
(R)-N-(1-метил-2-(4-(2-метоксифенил)-1-пиперазинил)этил)-N-(2-пиридинил)циклогексанкарбоксамид,
N-[3-[4-(2-метоксифенил)-1-пиперазинил]пропил]-N-(2-пиридинил)циклогексанкарбоксамид,
N-(2-(4-(2-метоксифенил)-1-пиперазинил)этил)-N-(2-хинолинил)циклогексанкарбоксамид,
(рацемат)-N-(2-(4-(2-метоксифенил)-1-пиперазинил)пропил)-N-(2-пиридил)циклогексанкарбоксамид,
(S)-N-(2-(4-(2-метоксифенил)-1-пиперазинил)пропил)-N-(2-пиридил)циклогексанкарбоксамид,
(R)-N-(2-(4-(2-метоксифенил)-1-пиперазинил)пропил)-N-(2-пиридил)циклогексанкарбоксамид,
N-(2-(4-фенил-1 -пиперазинил)этил)-N-(2-пиридинил)циклогексанкарбоксамид,
N-(2-(4-(2-изопропилфенил)-1-пиперазинил)этил)-N-(2-пиридил)циклогексанкарбоксамид,
N-(2-(4-(2-метоксифенил)-1-пиперазинил)этил)-N-(4-пиридинил)циклогексанкарбоксамид,
Ν-(2-(4-(2-метоксифенил)-1-пиперазинил)этил)-N-(3-пиридил)циклогексанкарбоксамид,
Ν-(2-(4-(2-метоксифенил)-1-пиперазинил)этил)-N-(2-пиридинил)циклогекс-1-енкарбоксамид,
N-(2-(4-(2-метоксифенил)-1-пиперазинил)этил)-N-(2-пиридинил)циклогексантиокарбоксамид,
или его фармацевтически приемлемая соль присоединения кислоты.
8. Соединение по любому из пп. 1-7, пригодное в качестве фармацевтического препарата.
9. Соединение по любому из пп. 1-7, пригодное в качестве анксиолитика, антидепрессанта, гипотензивного средства или в качестве средства, регулирующего цикл сна и бодрствования и/или сексуальную деятельность.
10. Способ получения производных пиперидина общей формулы (I), отличающийся тем, что проводят одну из следующих реакций:
а) ацилирование амина формулы (II):
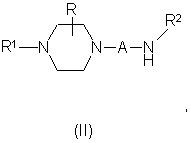
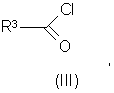
где A, R, R1, R2 имеют значения, указанные выше, хлорангидридом кислоты формулы (III):
б) взаимодействие амина формулы (II) с изоцианатом или изотиоцианатом формулы R4R5NCZ, где R4, R5 и Ζ имеют значения, указанные выше,
в) алкилирование амида или тиоамида формулы (IV):
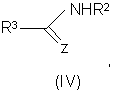
где R2, R3 и Ζ имеют значения, указанные выше, алкилирующим агентом формулы (V):
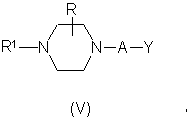
где R, R1, А имеют значения, указанные выше, a Y является уходящей группой;
г) взаимодействие соединения формулы (I), где Ζ = О, с P2S5, с получением соединения формулы (I), где Z=S.
11. 1-(2-Метоксифенил)-4-[2-(2-пиридиниламино)этил]пиперазин в качестве промежуточного соединения.
Текст
1. Производные пиперазина общей формулы (I) 39917 которое может быть необязательно замещено так, как определено для арила, при условии, что когда R2 является бициклическим гетероарильным радикалом только с одним гетероциклическим кольцом, указанный бициклический гетероциклический радикал соединен с азотом амина формулы (I) через такое гетероциклическое кольцо, и R3 представляет водород, низший алкил, циклоалкил, циклоалкенил, циклоалкил(низший)алкил, арил, арил(низший)алкил, группу формулы -NR4R5 или группу формулы OR6, где R4 представляет водород, низший алкил, арил или арил(низший)алкил, и R5 представляет водород, низший алкил, -СO(низший)алкил, арил, -СО(арил), арил(низший)алкил, циклоалкил или циклоалкил(низший)алкил, или R4 и R5 вместе с атомом азота, к которому они оба присоединены, представляют азетидино, пирролидино, пиперидино, гексагидроазепино, морфолино или пиперазино, который может быть необязательно замещен низшим алкилом, арилом или арил(низшим)алкилом, и R6 представляет низший алкил, циклоалкил, циклоалкил(низший)алкил, арил или арил(низший)алкил, где арил является таким, как определено для R1, и циклоалкил или циклоалкенил является моно-, би-, три- или тетрациклической углеводородной группой с 3-12 атомами углерода, в качестве антагонистов 5-НТ1a рецепторов. 2. Соединение по п. 1, где А представляет собой -(СН2)2-, -(СН2)3-, -(СН2)4- или -СН(СН3)СН2-. 3. Соединение по п. 1 или 2, где R представляет водород. 4. Соединение по любому из пп. 1-3, где R1 представляет орто-метоксифенил, орто-изопропилфенил, 4-фтор-2-метоксифенил, 2,3-дигидро[1,4]бензодиоксан-5-ил, пиримид-2-ил, 1-нафтил, 3-(1,2бензоизотиазолил), 1-(7-метоксинафтил) или 1-(5, 6,7,8-тетрагидро)нафтил. 5. Соединение по любому из пп. 1-4, где R2 представляет пиридил-2-ил, хинолин-2-ил или тиазол2-ил. 6. Соединение по любому из пп. 1-5, где R3 представляет низший алкил, циклоалкил, циклоалкенил, фенил, пиперидино или -NH-циклоалкил. 7. Соединение по п. 1, выбранное из группы: N-(2-(1-(4-(2-метоксифенил)пиперазинил))этил)-N-(2-пиридинил)циклогексанкарбоксамид, N-циклогексил-N-(2-(1-(4-(2 - метоксифенил)пиперазинил))этил)- N -(2-пиридинил)циклогексанмочевину, N-(2-(1-(4-(2-метоксифенил)пиперазинил))этил)-N-(2-пиридинил)бензамид, N-(2-(1-(4-(2-метоксифенил)пиперазинил))этил)-N-(2-пиридинил)триметилацетамид, N-(2-(1-(4-(2-метоксифенил)пиперазинил))этил)-N-(2-тиазолил)циклогексанкарбоксамид, N-(2-(1-(4-(4-фтор-2-метоксифенил)пиперазинил))-этил)-N-(2-пиридинил)циклогексанкарбоксамид, N-(2-(1-(4-(2,3-дигидро-1,4-бензодиоксин-5ил))пиперазинил))этил-N-(2-пиридинил)циклогексанкарбоксамид, N-[2-[1-[4-[3-(1,2-бензизотиазолил)]]пиперазинил]этил]-N-(2-пиридил)циклогексанкарбоксамид, N-(2-(1-(4-(2-метоксифенил)пиперазинил))этил)-N-(1-пиперидинилкарбонил)-2-аминопиридин, N-(2-(4-(2-метоксифенил)пиперазин-1-ил)этил)N-(пиридин-2-ил)-N'-циклогексантиомочевина, N-(2-(4-(2-гидpoкcифeнил)пипepaзинил)этил)N-(2-пиридинил)циклогексанкарбоксамид, N-(2-(1-(4-(1-нафтил))пиперазинил)этил)-N-(2пиридил)циклогексанкарбоксамид, N-(2-(1-(4-(2-метилфенил))пиперазинил)этил)N-(2-пиридинил)циклогексанкарбоксамид, N-(2-(1-(4-(2-фторфенил))пиперазинил)этил)-N(2-пиридинил)циклогексанкарбоксамид, N-[2-[1-[4-(1-изохинолинил)]пиперазинил]этил]N-(2-пиридинил)циклогексанкарбоксамид, N-[2-[1-[4-[1-(7-метокси)нафтил]]пиперазинил]этил]-N-(2-пиридил)циклогексанкарбоксамид, N-(2-(1-(4-(2-метоксифенил)пиперазинил))этил)-N-(2-пиридил)адамантан-1-карбоксамид, N-[2-[1-[4-[1-(2-метокси)нафтил]]пиперазинил]этил]-N-(2-пиридил)циклогексанкарбоксамид, N-[2-[1-[4-[1-(5,6,7,8-тетрагидро)нафтил]]пиперазинил]этил]-N-(2-пиридил)циклогексанкарбоксамид, (S)-N-(1-метил-2-(4-(2-метоксифенил)-1-пиперазинил)этил)-N-(2-пиридинил)циклогексанкарбоксамид, (R)-N-(1-метил-2-(4-(2-метоксифенил)-1-пиперазинил)этил)-N-(2-пиридинил)циклогексанкарбоксамид, N-[3-[4-(2-метоксифенил)-1-пиперазинил]пропил]-N-(2-пиридинил)циклогексанкарбоксамид, N-(2-(4-(2-метоксифенил)-1-пиперазинил)этил)N-(2-хинолинил)циклогексанкарбоксамид, (рацемат)-N-(2-(4-(2-метоксифенил)-1-пиперазинил)пропил)-N-(2-пиридил)циклогексанкарбоксамид, (S)-N-(2-(4-(2-метоксифенил)-1-пиперазинил)пропил)-N-(2-пиридил)циклогексанкарбоксамид, (R)-N-(2-(4-(2-метоксифенил)-1-пиперазинил)пропил)-N-(2-пиридил)циклогексанкарбоксамид, N-(2-(4-фенил-1-пиперазинил)этил)-N-(2-пиридинил)циклогексанкарбоксамид, N-(2-(4-(2-изопропилфенил)-1-пиперазинил)этил)-N-(2-пиридил)циклогексанкарбоксамид, N-(2-(4-(2-метоксифенил)-1-пиперазинил)этил)N-(4-пиридинил)циклогексанкарбоксамид, N-(2-(4-(2-метоксифенил)-1-пиперазинил)этил)N-(3-пиридил)циклогексанкарбоксамид, N-(2-(4-(2-метоксифенил)-1-пиперазинил)этил)N-(2-пиридинил)циклогекс-1-енкарбоксамид, N-(2-(4-(2-метоксифенил)-1-пиперазинил)этил)N-(2-пиридинил)циклогексантиокарбоксамид или его фармацевтически приемлемая соль присоединения кислоты. 8. Соединение по любому из пп. 1-7, пригодное в качестве фармацевтического препарата. 9. Соединение по любому из пп. 1-7, пригодное в качестве анксиолитика, антидепрессанта, гипотензивного средства или в качестве средства, регулирующего цикл сна и бодрствования и/или сексуальную деятельность. 2 39917 10. Способ получения производных пиперидина общей формулы (I), отличающийся тем, что проводят одну из следующих реакций: а) ацилирование амина формулы (II): (IV) где: R2, R3 и Z имеют значения, указанные выше, алкилирующим агентом формулы (V): (II) где: A, R, R1, R2 имеют значения, указанные выше, хлорангидридом кислоты формулы (III): (V) где: R, R1, А имеют значения, указанные выше, a Y является уходящей группой; г) взаимодействие соединения формулы (I), где Z=О, с P2S5, с получением соединения формулы (I), где Z=S. 11. 1-(2-Метоксифенил)-4-[2-(2-пиридиниламино)этил]пиперазин в качестве промежуточного соединения. (III) б) взаимодействие амина формулы (II) с изоцианатом или изотиоцианатом формулы R4R5NCZ, где R4, R5 и Z имеют значения, указанные выше, в) алкилирование амида или тиоамида формулы (IV): Это изобретение относится к производным пиперазина, способам их получения, промежуточному соединению для их получения. Эти новые соединения оказывают действие на центральную нервную систему путем присоединения к 5-НТ рецепторам (что более подробно объяснено ниже) и поэтому могут быть использованы в качестве лекарственных препаратов для лечения людей и других млекопитающих. Патент US 5169845 раскрывает соединения общей формулы: Опубликованная заявка РСТ WO 9311122 раскрывает соединения общей формулы: и их фармацевтически приемлемые кислотно-аддитивные соли, где: А представляет алкиленовую цепь из 1-2 атомов углерода, необязательно замещенную одним или несколькими низшими алкилами, Z представляет бициклическую кислородсодержащую группу формулы: и их фармацевтически приемлемые кислотно-аддитивные соли, где: n=0, 1 или 2, А представляет алкиленовую цепь из 1-2 атомов углерода, необязательно замещенную одним или несколькими низшими алкилами, R представляет водород или низший алкил, R1 представляет арил или моно- или бициклический гетероарильный радикал, R2 представляет водород или низший алкил, R3 представляет гетероарильный радикал, R4 представляет водород, низший алкил или арил, и R5 представляет водород, низший алкил, циклоалкил, циклоалкил(низший)алкил, арил или арил(низший)алкил, или R4 и R5 вместе с атомом азота, к которому они оба присоединены, представляют насыщенное гетероциклическое кольцо, которое может содержать дополнительный гетероатом. Указано, что эти соединения полезны как анксиолитики. , где: гетероциклическое кольцо, содержащее атом кислорода, содержит в целом 5-7 кольцевых членов, причем указанное кольцо является насыщенным или ненасыщенным, необязательно замещено и необязательно содержит один или несколько гетероатомов в качестве кольцевых членов дополнительно к указанному атому кислорода, R представляет водород или один или два одинаковых или различных низших алкила, R1 представляет арил или арил(низший)алкил, R2 представляет водород или низший алкил, R3 представляет водород, алкил с 1-10 атомами углерода, циклоалкил с 3-12 атомами углерода, циклоалкил(низший)алкил, арил или арил(низший)алкил, или R2 и R3, вместе с атомом азота, к которому они оба присоединены, представляют насыщен 3 39917 гетероарил(низший)алкил, группу формулы -NR4R5 (где R4 является водородом, низшим алкилом, арилом или арил(низший)алкилом; а R5 представляет собой водород, низший алкил, -СО(низший)алкил, арил, СОарил, арил(низший)алкил, циклоалкил или циклоалкил(низший) алкил или R4 и R5, вместе с атомом азота, к которому они оба прикреплены, представляют собой насыщенный гетероцикл; который может содержать дополнительный гетероатом или группу формулы ОR6 (где R6 представляет собой низший алкил, циклоалкил, циклоалкил(низший)алкил, арил, арил(низший)алкил, гетероарил или гетероарил(низший)алкил). Используемый здесь термин "низший" означает, что названный радикал содержит 1-6 атомов углерода. Предпочтительно, такие радикалы содержат 1-4 атома углерода. Примерами "низших алкилов" являются метил, этил, пропил, изопропил, бутил, трет-бутил, пентил и изопентил. Примерами циклоалкильных групп являются циклопентил, циклогексил, циклогептил. Предпочтительным примером является циклогексил. Циклоалкильные группы включают в себя бициклические, трициклические и тетрациклические группы, например, адамантил. Предпочтительно; циклоалкильная группа содержит от 3 до 12 атомов углерода. Используемый здесь термин "арил" означает ароматический радикал, содержащий 6-12 атомов углерода (например, фенил или нафтил), который, возможно, может быть заменен одним или более заместителем. Предпочтительными заместителями являются низший алкил, низший алкоксил (например, метоксил, этоксил пропоксил, бутоксил), галоген, галогенсодержащий низший алкил; (например, трифторметил), нитрильная; (низший)алкоксикарбонильная, нитро-, амидо-, амино-, (низший)алкиламино- или ди(низший)алкиламино-группа. Два заместителя в ароматическом кольце могут быть соединены друг с другом с образованием другого кольца. Напpимep, R1 может быть возможно замещенным тетрагидронафтильным радикалом или бициклическим кислород-содержащим радикалом формулы ное гетероциклическое кольцо, которое может содержать дополнительный гетероатом, R4 представляет водород или один или несколько одинаковых или различных заместителей, выбранных из низшего алкила, галогена, галоген(низшего)алкила (например, трифторметила), нитро, нитрила, оксо, гидрокси, (низшего)алкокси, гидрокси(низшего)алкокси, (низшего)алкокси(низшего)алкила, низшегоалканоилокси(низшего алкила), (низшего)алкилкарбонила, (низшего)алкилкарбокнил(низшего)алкила, карбоксамидо, амино, ациламино (например, низшегоалканоиламино), (низшего)алкиламино или ди(низшего)алкиламино. Сообщается, что указанные соединения полезны для лечения тревожных состояний. Патент US 5177078 описывает соединения формулы: где: А представляет алкиленовую цепь с 1-2 атомами углерода, необязательно замещенную одним или несколькими низшими алкильными группами, R представляет водород или низший алкил, R1 представляет арил или гетероциклический радикал, R2 представляет моно- или бициклический гетероциклический радикал, R3 представляет водород, низший алкил или гидрокси, и R4 представляет арил или гетероарильный радикал. Указанные соединения пригодны для лечения заболеваний ЦНС, таких как тревожные состояния. Новыми соединениями этого изобретения являются соединения общей формулы и их фармацевтически приемлемые соли, присоединения кислоты. В формуле (I): А представляет собой алкиленовую цепь, содержащую 2-4 атома углерода и, возможно; замещенную одним или более низшим алкилом, Z представляет собой кислород или серу, R является водородом или низшим алкилом, R1 является моно- или бициклическим арилом или гетероарилом, R2 представляет собой моно- или бициклический гетероарил, а R3 представляет собой водород, низший алкил, циклоалкил, циклоалкенил, циклоалкил(низший)алкил, арил, арил(низший)алкил; гетероарил, , (А) где: гетероциклическое кольцо, содержащее атом кислорода насчитывает 5-7 звеньев, причем указанное гетероциклическое кольцо является насыщенным или ненасыщенным, возможно замещенным и возможно содержащим одно или более гетерозвено (например, -О-, -NR7-, где R7 - водород или низший алкил, -S- или -SО2-), помимо приведенного атома кислорода, и где R8 представляет собой заместитель или несколько одинаковых или различных заместителей, выбранных из низшего алкила, галогена, оксо-группы, гидроксила, (низ 4 39917 ший)алкоксила, окси(низший)алкила, (низший)алкокси(низшего)алкила, (низший)алканоилокси(низшего(алкила), (низший)алкилкарбонила, (низший)алкилкарбонил(низшего)алкила, амино-, (низ ший)алкиламино- или ди(низший)алкиламиногруппы. Предпочтительными примерами бициклических кислород-содержащих радикалов являются бициклические радикалы формул: где: R8 определен выше, R9 принимает значения R8, определенные выше, а X представляет собой -СО-, -S- или –NR7, где 7 R является водородом или низшим алкилом. В тех случаях когда R1 представляет собой арил, то, предпочтительно, он является фенилом, содержащим заместитель в орто-положении. Предпочтительным примером R1 является орто(низший)алкоксифенил, например, орто-метоксифенил. R1 может быть также, например, І-нафтилом, возможно, замещенным в положениях 2 или 7, например, (низшим)-алкоксилом. Предпочтительными примерами арил(низший)алкилом являются бензил и этоксифенил, в которых фенильные кольца могут быть замещены заместителями, приведенными выше. Термин "гетероарил" относится к ароматическому радикалу, содержащему один или более гетероатомов (например, кислород, азот, сера), и который, возможно, может быть замещен одним или более заместителями. Примеры подходящих заместителей приведены выше в связи с "ари 5 39917 лами". Арильный радикал может содержать, например, до 10 атомов в кольце. Предпочтительным гетероарильным радикалом является моноциклический радикал, содержащий в кольце 5-7 атомов. Предпочтительно, гетероциклсодержит в качестве гетероатома азот вместе с (или без) одним или более дополнительным гетероатомом. Когда R1 представляет собой гетероарильный радикал, то он, предпочтительно, является, возможно, замещенным пиримидилом (в частности, 2-пиримидилом), изохинолинильным радикалом (в частности, 1-изохинолинилом) или 1,2-бензизотиазолильным радикалом. Когда R2 представляет собой бициклический гетероарильный радикал, то оба кольца этого радикала могут содержать гетероатомы или только одно кольцо может содержать гетероатом или гетероатомы. В последнем случае радикал R2 связан с остатком молекулы формулы (I) через кольцо, содержащее гетероатом или гетероатомы. Примеры гетероарильного радикала включают в себя моноциклические радикалы, содержащие один гетероатом, например, возможно, замещенный пиридил (в частности, 2-пиридил-), моноциклические радикалы, содержащие два гетероатома, например, тиазолил (в частности, 2-тиазолил) и бициклические радикалы, содержащие один или два гетероатома, например, хинолинил или изохинолинил (в частности, 2-хинолинил). Когда R4 и R5 вместе с атомом азота, к которому они оба прикреплены, представляют насыщенное гетероциклическое кольцо, то оно может быть, например, азетидиновым, пирролидиновым, пиперидиновым, гексагидроазепиновым, морфолиновым или пиперазиновым кольцом; которое, возможно, может быть замещено, например, низшим алкилом, арилом или арил(низшим)алкилом. Предпочтительные соединения имеют или независимо, или в сочетании следующие заместители: (а) А представляет собой -(СН2)2-, -(СН2)3-, -(СН2)4 или СН(СН3)-СН2-; (в) R является водородом; (с) R1 представляет собой орто-метоксифенил, орто-изопропил-фенил, 4-фтор-2-метоксифенил, 2,3-дигидро/1,4/бензидиоксан-5-ил, пиримид2-ил, 1-нафтил, 3-/1,2-бензизотиазолил/, 1-/7-метокси-нафтил/ или 1-/5,6,7,8-/тетрагидронафтил; (d) R2 является пирид-2-илом, хинолин-2 илом или тиазол-2-илом; (e) R3 представляет собой низший алкил (например, метил или трет-бутил), циклоалкил (например, циклогексил), циклоалкенил (например, циклогексенил), фенил, пиперидиновый, цикл адамантил или -NНциклоалкил (например, -NНциклогексил); (f) Z является кислородом. Соединения этого изобретения могут быть получены способами, известными в данной области, из известных исходных веществ или из исходных веществ, которые могут быть получены общепринятыми способами. Один из способов получения соединений этого изобретения включает в себя ацелирование амина формулы , (ІІ) (где А, R, R1 и R2 имеют значения, определенные выше) кислотой формулы R3CZOH (ІІІ) (где Z и R3 определены выше) или ее ацилированным производным Z, предпочтительно, является кислородом. Примеры ацилированных производных включают в себя галоидангидриды (например; хлорангидриды); азиды, ангидриды, имидазолиды (например, полученные из карбонилдиимидазола), активированные сложные эфиры или 0-ацил-мочевины, полученные из карбодиимида, такого как диалкилкарбодиимида, в частности, циклогексилкарбодиимида. Соединения, в которых R3 представляет собой –NR4R5 являются производными мочевины или тиомочевины и могут быть получены взаимодействием амина формулы (ІІ) с подходящим изоцианатом или изотиоцианатом (включая подходящий ацилизоцианат или ацилизотиоцианат). Мочевины, в которых R5 представляет собой -СО(низший)алкил или -СОарил, также могут быть получены ацилированием соответствующей мочевины или тиомочевины, в которой R5 является водородом. Исходный амин формулы (ІІ) может быть получен способом типа того, что приведен ниже: (В) (где R, R1, R2 и А определены выше. Hal представляет собой галоген, особенно хлор или вром, а А' является алкиленом С1-С3, возможно замещенным одним или более низшим алкилом). Восстановление может быть проведено бор-содержащим восстанавливающим агентом (например, боран-диметилсульфидом) или смешанным гидридом металла, например, гидридом литий-алюминия. Некоторые из аминов формулы (ІІ) являются новыми соединениями. В частности, предпочтительным новым амином, который предлагается этим изобретением, является 1-/2-метоксифенил/4-[2-/2-пиридинил-амино/этил]-пиперазин. Следующий способ получения соединений данного изобретения включает в себя алкилирование амида иди тиоамида формулы (IV) 6 39917 R2 / HN:CZR3 алкилирующим агентом; предоставляющим группу леофильному замещению, то соединения этого изобретения могут быть получены еще одним способом, включающим в себя взаимодействие подходящего фторсодержащего соединения формулы R1F с соединением пиперазина формулы (C) (F) агентом может , (Д) Соединения этого изобретения, в которых является серой, могут быть получены введением атома серы в молекулы соединений данного изобретения, в которых Z представляет собой кислород. Например, может быть проведена реакция соединений; в которых Z является кислородом, с сульфирующим агентом, таким как смесь пятисернистого фосфора и сульфида калия. Описанные выше способы могут быть проведены с получением соединения этого изобретения в виде свободного основания или в виде соли присоединения кислоты. Если соединение данного изобретения получают в виде соли присоединения кислоты, то свободное основание может быть получено добавлением к раствору соли присоединения кислоты основания. И наоборот; если продуктом, полученным в результате проведения способа данного изобретения, является свободное основание, то соль присоединения кислоты, в частности, фармацевтически приемлемая соль присоединения кислоты, может быть получена растворением свободного основания в подходящем растворителе и обработкой этого раствора кислотой, используя обычные методики получения солей присоединения кислоты из основных соединений. Примерами солей присоединения кислоты являются соли, образованные из неорганических и органических кислот, таких как серная, соляная, бромистоводородная, фосфорная, винная, фумаровая, малеиновая, лимонная, уксусная, муравьиная, щавелевая, янтарная кислоты, метансульфокислота и пара-толуолсульфокислота. Соединения этого изобретения могут содержать один или несколько асимметричных атомов углерода, таким образом некоторое соединения могут находиться в различных стереоизомерных формах. Эти соединения могут быть рацематами или оптически активными формами. Оптически активные формы могут быть получены или разделением рацематов, или асимметрическим синтезом. Соединения данного изобретения обладают фармакологической активностью. В частности, они оказывают действие на центральную нервную систему путем присоединения к 5-НТ рецепторам. При фармакологическом испытании было найдено, что эти соединения присоединяются особенно к рецепторам 5-НТ1А типа. В общем, эти соединения присоединяются селективно к рецепторам 5-НТ1А типа в значительно большей степени, чем они присоединяются к другим рецепторам, таким как a1 и D2 рецепторам. При фармакологическом испытании многие из этих соединений проявляют Например, алкилирующим быть соединение формулы (IV) где А, R и R1 определены выше, а Х является уходящей группой, такой как галоген алкил- или арил-сульфонилоксигруппой, Z, предпочтительно, является кислородом. Следующей способ получения соединений данного изобретения включает в себя алкилирование соединения формулы (Е) соединением формулы X-A NR2. CZ.P3 , (V) где А, R, R1, R2, R3, Z и Х определены выше, Z, предпочтительно, является кислородом. Исходное соединение формулы (V) может быть получено, например, по схеме, приведенной ниже X-A-Bг+NHR2CZR3 (V) Еще один способ получения соединений этого изобретения включает в себя гетероарилирование соединения формулы (VI) соединением, предоставляющем гетероарильную группу R2. Например, может быть проведена реакция соединения формулы (VI) с фторсодержащим соединением формулы R2F, например, в присутствии сильного ненуклеофильного основания (например, диизопропиламида лития). В тех случаях, когда R1 представляет собой группу, которая активирована по отношению к нук 7 39917 активность в качестве 5-НТ1А антагонистов. Соединения этого изобретения могут быть использованы для лечения расстройств центральной нервной системы, таких как страх у млекопитающих, особенно, у людей. Они также могут быть использованы в качестве антидепрессантов, гипотензивных средств и в качестве средств, регулирующих цикл сна и бодрствования, режим питания и/или сексуальную деятельность. Соединения этого изобретения были испытаны на активность присоединения к 5-НТ1А рецепторам на гомогенате гипокампальной мембраны крысы по методике, описанной В.S. Alexander и М.D. Wood, J. Pharm. Pharmacol, 1988, 40, 888-891. Соединения примеров 3, 4 и 17. которые являются представительными соединениями этого изобретения, имели значения IC50 по этой методике испытаний 2,2, 5,8 и 3 нм. Соединения испытывали на активность антагонизма к 5-НТ1А рецептору в опыте, включая антагонизм 5-карбоксамидотриптамина, на подвздошной кишке морской свинки in vitro (испытание основано на методике, предложенной Foxard и др., Br. J. Pharmac, 1985, 86, стр. 601). Результаты для представительных соединений этого изобретения приведены ниже. Соединение примера 3 имело рА2, равное 8,7, примера 4 - 7,8, а соединение примера 17 имело рА2, равное 9,8. Это изобретение также предлагает фармацевтическую композицию, содержащую соединение или его фармацевтически приемлемую соль присоединения кислоты; в сочетании с фармацевтически приемлемым носителем. Для получения этой фармацевтической композиции можно использовать любой подходящий носитель, известный в этой области применения. В такой композиции носитель обычно является твердым или жидким веществом, или смесью твердых или жидких веществ. Композиции в твердом виде включают в себя порошки гранулы, таблетки. капсулы (например, твердые и мягкие желатиновые капсулы); суппозитории и вагинальные суппозитории. Например, твердым носителем может быть одно или несколько веществ, которые могут вести себя как ароматизирующие вещества, смазывающие вещества вещества, увеличивающие растворимость, суспендирующие средства, наполнители, вещества, улучшающие скольжение вещества, способствующие прессованию, связующее вещества или как вещества, расщепляющие таблетки; носителем может быть также инкапсулированное вещество. В порошках носитель представляет собой тонко раздробленное твердое вещество, которое находится в смеси с тонко раздробленным активным ингредиентом. В таблетках активный ингредиент смешан в соответствующих пропорциях с носителем, обладающим свойствами, необходимыми для прессования, и уплотнен в подходящую форму и до подходящего размера. Порошки и таблетки, предпочтительно, содержат до 99% активного ингредиента, например, от 0,03 до 99%, предпочтительно, до 1-80% активного ингредиента. Подходящие твердые носители включают в себя, например, фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, жела тин, целлюлозу, метил-целлюлозу, натрий карбоксиметил-целлюлозу, поливинилпирролидин, парафины с низкой температурой плавления и ионообменные смолы. Термин "композиция" подразумевает содержание рецептуры активного ингредиента с инкапсулирующим веществом, используемым в качестве носителя, для получения капсулы, в которой активный ингредиент (с или без других носителей) окружен носителем и, таким образом, с ним ассоциирован. Подобным же образом включена и крахмальная облатка. Композиции в жидком виде включают в себя, например, растворы, суспензии; эмульсии, сиропы, элексиры и композиции, находящиеся под давлением. Например, активный ингредиент может быть растворен или суспендирован в фармацевтически приемлемом жидком носителе; таком как вода, органический растворитель, смесь их обоих или фармацевтически приемлемые масла или жиры. Этот жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как вещества, увеличивающие растворимость, эмульгаторы, буферы, консервирующие средства, подсластители, ароматизирующие вещества, суспендирующие средства, загустители, пигменты, вещества, регулирующие вязкость, стабилизаторы или вещества, регулирующие осмос. Подходящие примеры жидких носителей для перорального и парентерального введения включают в себя воду (особенно, содержащую добавки, указанные выше, например, производные целлюлозы, предпочтительно, раствор натрий карбоксиметил целлюлозы), спирты (например, глицерин и гликоли) и их производные, масла (фракционированное кокосовое масло и арахисовое масло). При парентеральном введении носителем также может быть маслянистый эфир, такой как этилолеат и изопропиловый эфир миристиновой кислоты. При парентеральном введении используют стерильные жидкие носители в виде стерильных жидких композиций. Жидкие фармацевтические композиции; которые представляют собой стерильные растворы или суспензии, могут быть использованы, например, посредством внутримышечной, внутрибрюшинной или подкожной инъекции. Стерильные растворы также могут быть введены внутривенно. Если соединение перорального действия, то оно может быть введено перорально или в виде жидкой, или твердой композиции. Фармацевтическая композиция, предпочтительно, находится в виде единичной дозы, например, в виде таблеток или капсул. В таком виде композиция подразделена на единичные дозы, содержащие подходящие количества активного ингредиента: этими единичными дозами может быть расфасованная композиция, например, упакованные порошки, пузырьки, ампулы, предварительно заполненные шприцы или крахмальные капсулы, содержащие жидкость. Единичная доза может быть в виде капсулы или таблетки или может быть упакована в виде подходящего количества любых таких композиций. Количество активного ингредиента в единичной дозе композиции можно варьировать или устанавливать от 0,5 мг, или менее, до 8 39917 750 мг или более, что зависит от конкретной потребности и активности активного ингредиента. Нижеприведенные примеры иллюстрируют это изобретение. В примерах 1, 2, 7, 9, 10, 12-16, 18, 19, 21-29, 32 и 34-45 описано получение промежуточных соединений. Пример 1. 2- /1- /4- /2-метоксифенил/пиперазинил//-N-/2пиридинил/ацетамид. К перемешиваемому раствору 9,9 г (58 ммолей) 2-хлор-N-/2-пиридинил/-ацетамида в 40 мл безводного диметилформамида добавляли при О°С раствор 11,1 г /58 ммолей/ 1-/2-метоксифенил/пиперазина в 40 мл безводного диметилформамида, затем обрабатывали 9,2 г (67 ммолями) карбоната калия, спустя 30 минут смесь нагревали до комнатной температуры, выдерживали при этой температуре в течение 18 часов, после чего смесь обрабатывали 400 мл воды. Эмульсию экстрагировали диэтиловым эфиром (3х200 мл), а экстракты промывали водой (500 мл), сушили над Na2SO4, испаряли в вакууме и получали масло желтого цвета. После очистки хроматографией (двуокись кремния, этилацетат) получали 17,3 г продукта в виде масла, которое кристаллизовалось при стоянии, температура плавления 86-89°С. Пример 2. 1- /2 - метоксифенил/ - 4 - /2-/2-пиридиниламино/этил/пиперазин. Раствор 13,87 г (42,5 ммолей) продукта, полученного в примере 1; в 150 мл ТГФ нагревали до кипения в атмосфере аргона добавляли к нему по каплям 8 мл (84,3 ммоля) боран-диметилсульфида, спустя 2;5 часа добавляли к нему по каплям 50 мл метанола и обрабатывали 200 мл 0,25 N НСІ. Спустя 1 час реакционную смесь охлаждали до комнатной температуры, промывали этилацетатом (2х200 мл) добавляли к ней основание - 2N NaOН и экстрагировала этилацетатом (2х200 мл). Экстракты сушили над Na2SO4, испаряли в вакууме и получали 11,8 г продукта в виде масла. Этот продукт очищали хроматографией (двуокись кремния, этилацетат – этанол, 20:1) и переводили в солевую форму эфирным хлористым водородом. После кристаллизации из ацетонитрила получали треххлористоводородную соль продукта в виде белых кристаллов, температура плавления 212-214°С. (Найдено: С, 50,8; Н, 6,7; N, 13,2%. Вычислено: для С18Н24N40.3HCI.I/4H2O: C, 50,7; H, 6,5; N, 13,1%). Пример 3. N-/2-/1-/4-/2-метоксифенил/пиперазинил/этил/N-/2-пиридинил/-циклогексанкарбоксамид. К 35%-ной суспензии гидрида калия в минеральном масле (2,99 г, около 26,1 ммоля) в 25 мл диметилформамида добавляли по каплям при перемешивании в атмосфере аргона 2,14 г (6,9 ммоля) свободного основания указанного в примере 2, в 16 мл диметил-формамида. Через 20 минут к реакционной смеси добавляли 1,4 мл (10,5 ммоля) хлорангидрида циклогексанкарбоновой кислоты, спустя 1 час осторожно обрабатывали 200 мл воды, подкисляли приблизительно 70 мл 2N-HCl, промывали гексаном (2х200 мл), добавляли к ней 2N-NaOH и экстрагировали этилацетатом (2х200 мл). Экстракты промывали рассолом (100 мл), сушили над Na2SO4, испаряли в вакууме и получали масло красного цвета; которое очищали хроматографией (двуокись кремния; этилацетат). Раствор этого масла в 40 мл метанола подкисляли эфирным хлористым водородом, испаряли в вакууме и получали 1,04 г треххлористоводородной соли продукта, температура плавления 165-172°С (разл.). (Найдено: С, 54,2; Н, 7,3; N, 10,0%. Вычислено: для C25Н34N4О2.3НСІ.Н2О: С, 54,6; Н, 7,15; N, 10,2%). Пример 4. N-циклогексил-N'-/2 -/1-/4-/2-метоксифенил/пиперазинил//этил/-N-/2-пиридинил/мочевина. К 35%-ной суспензии гидрида калия в минеральном масле (2,91 г, около 21,8 ммоля) в 20 мл безводного диметилфомамида добавляли по каплям при перемешивании в атмосфере Аг 2,92 г (9,4 ммоля) свободного основания, указанного в примере 2, в 15 мл безводного диметилфомамида. Через 1 час к реакционной смеси добавляли 1,3 мл (10,2 ммоля) циклогексилизоцианата, а спустя еще 18 часов смесь обрабатывали 200 мл воды, подкисляли 2NНСI (приблизительно 50 мл), промывала гексаном (2х200 мл), добавляли к ней 2N NaOH и экстрагировали этилацетатом (2´ ´200 мл). Экстракты промывали рассолом (200 мл), сушили над Na2SO4, испаряли в вакууме и получали масло коричневого цвета, которое очищали хроматографией (двуокись кремния; этилацетат, затем окись алюминия; диэтиловый эфир). Бесцветное масло растворяли в 10 мл этанола, этот раствор подкисляли эфирным хлористым водородом, испаряли в вакууме и получали треххлористоводородную соль продукта в виде гидратированного стеклообразного вещества, содержащего четверть моля этилацетата (0,456 г). (Найдено: С, 53,2; Н, 7,5; N, 11,8%. Для С25Н35N5O2.3HCI.H2O.1/4С4H8O2 вычислено: С, 53,2; Н, 7,2; N, 11,9%). Пример 5. N-/2-/1-/4-/2-метоксифенил/пиперазинил//этил/-N-/2-пиридинил/-бензамид. 1,69 г хлористого бензоила (12 ммолей) осторожно добавляли к перемешиваемому раствору 1,94 г (6 ммолей) свободного основания, приведенного в примере 2, и 2,2 мл (14 ммолей) диизопропил-этиламина в 20 мл дихлорметана. Смесь перемешивали в атмосфере аргона в течение 24 часов, испаряли в вакууме, а масло коричневого цвета растворяли в 50 мл воды. Раствор подкисляли 2NНСІ, промывали дихлорметаном (3х х50 мл), добавляли к нему 2N NаОН и экстрагировали дихлорметаном (3х75 мл). Экстракты сушили над MgSO4, испаряли в вакууме, а остаток очищали хроматографией (окись алюминия; толуол - этилацетат, 7:3). Полученное масло растворяли в 10 мл этилацетата и осаждали из этого раствора добавлением эфирного хлористого водорода двуххлористоводородную соль продукта в виде бесцветных кристаллов (1,3 г), температура плавления 105-112°С. (Найдено: С, 61,6; Н, 6,1; N, 11,3%. 9 39917 шили над MgSO4, испаряли в вакууме и получали масло желтого цвета. После очистки хроматографией (двуокись кремния; диэтиловый эфир) получали 1,61 г продукта в виде бесцветных кристаллов, температура плавления 110-120°С (образец размягчается при 32°C). Пример 10. 1-/4-фтор-2-метоксифенил/- 4-/2-/2-пиридиниламино/этил/ пиперазин. Раствор, содержащий 1,51 г (4,4 ммоля) продукта примера 9 в 20 мл тетрагидрофурана, нагревали в атмосфере аргона до кипения и добавляли к нему по каплям боран-метилсульфидный комплекс, 2М раствор в тетрагидрофуране (4,4 мл, 8,8 ммоля). Через 4 часа к реакционной смеси добавляли по каплям 10 мл метанола, а затем 10 мл 2NHCІ. Спустя 1 час реакционную смесь охлаждали до комнатной температуры, обрабатывали 100 мл воды, добавляли к ней 2N NaOH и экстрагировали этилацетатом (2х100 мл). Экстракты промывали 50 мл рассола, сушили над MgSO4, испаряли в вакууме и получали 1,29 г продукта в виде масла желтого цвета, который использовали в следующем опыте без дополнительной очистки. Пример 11. N-/2-/1-/-/4-фтор - 2 - метоксифенил/пиперазинил//этил-N-/2-пиридинил/циклогексанкарбоксамид К перемешиваемому раствору продукта примера 10 (1,26, г 3,8 ммоля) в 20 мл дихлорметана добавляли в атмосфере аргона 1,4 мл (8,4 ммоля) диизопропилэтиламина и 1 мл (7,5 ммоля) хлорангидрида циклогексанкарбоновой кислоты, через 24 часа смесь промывали 20 мл воды, 20 мл насыщенного водного раствора NaHCO3 и 20 мл воды, сушили над МgSO4, испаряли в вакууме и получали масло желтого цвета, которое очищали хроматографией (двуокись кремния; этилацетат). Раствор этого масла в 5 мл метанола подкисляли эфирным хлористым водородом, испаряли в вакууме и получали треххлористоводородную соль продукта (10,5 г, 30%), температура плавления 160-172°С. (Найдено: С, 54,7; Н, 6,4; N, 10,1 %. Вычислено: для C25H33FN4О2.3НСІ: С, 54,6; H, 6,6; N, 10,2%). Пример 12. 5-нитро-2,3-дигидро-1,4-бензодиоксин. 12,0 г (0,064 ммоля) 1,2дибромэтана, 17,6 г (0,127 моля) карбоната калия и 1,37 г (0,0043 моля) бромистого тетра-н-бутиламмония добавляли к перемешиваемому раствору 6,59 г (0,043 моля) 3-нитрокатехина в 210 мл толуола. Этот раствор нагревали с обратным холодильником в течение 23 часов, отгоняя с азеотропом воду, затем охлаждали до комнатной температуры, промывали 150 мл 2N-раствора NаОН, сушили над Na2SO4, испаряли в вакууме и получали масло оранжевого цвета. После очистки хроматографией на колонке (двуокись кремния; диэтиловый эфир) получали 2,55 г продукта, температура плавления 55-59°С. Пример 13. 2,3-дигидро-1,4-бензодиоксин-5-амин. 3,40 г (0,054 моля)муравьинокислого аммония и 10%-ный палладий на древесном угле (1,44 г) добавляли к перемешиваемому раствору продукта примера 12 (2,45 г, 0,0135 моля) в 15 мл метанола. После того, как бурное выделение газа прекра Вычислено для С25Н28N4О2.2НСI: C, 61,4; H, 6,2; N, 11,5%). Пример 6. N-/2-/1-/4-/2 -метоксифенил/пиперазинил/этилN-/2-пиридинил/-триметилацетамид. Это соединение синтезировали по методике, аналогичной той, что описана в примере 5, заменяя хлористый бензоил на триметилацетилхлорид (1,57 г, 13 ммолей), и получали 1,2 г треххлористоводородной соли продукта в виде белого твердого вещества, температура плавления 138140°C. (Найдено: С, 53,5; Н, 7,3; N, 10,8 %. Вычислено: для C23H32N4О2.3НСІ.1/2Н2О: С, 53,7; H, 7,1; N, 10,9%). Пример 7. N-/2-тиазолил/циклогексанкарбоксамид. К раствору 2аминотиазола (3,00 г, 30 ммолей) и диизопропил-этиламина (3,87 г, 30 ммолей) в 50 мл дихлорметана добавляли по каплям при 0°С 4,38 г (30 ммолей) хлорангидрида циклогексанкарбоновой кислоты. Смесь нагревали до комнатной температуры, перемешивали в течение 18 часов, промывали 1NHCI (2х50 мл) и 1N NaOH (2х50 мл), сушили над МgSО4, испаряли в вакууме и получали продукт (4,59 г) в виде кристаллов белого цвета. Пример 8. N-/2-/1-/4-/2-мeтoкcифeнил/пипepaзинил//этилN-/2-тиaзoлил-/-циклогексанкарбоксамид. Раствор продукта примера 7 (2,10 г, 10 ммолей) в диметилформамиде добавляли по каплям в атмосфере аргона к перемешиваемой суспензии гидрида калия (35%-ная суспензия в минеральном масле 1,6 г, приблизительно 14 ммолей) в 20 мл диметилформамида. Спустя один час к смеси добавляли по частям 2,53 г (10 ммолей) 1-/2-хлорэтил/-4-/2-метоксифенил/пиперазин, после чего смесь перемешивали при 80°С в течение 5 часов. К смеси осторожно добавляли 20 мл Nа2СО3 и концентрировали ее в вакууме. Остаток переносили в 100 мл диэтилового зфира и экстрагировали 1NНСI (3х50 мл). К водной фазе добавляли 1N NaOH и экстрагировали диэтиловым эфиром (3х50 мл). Эфирные экстракты сушили над MgSO4, испаряли в вакууме, а остаток очищали хроматографией (двуоокись кремния; этилацетат). Масло растворяли в 10 мл этилацетата и осаждали из раствора эфирным хлористым водородом двуххлористоводородную соль продукта в виде твердого вещества белого цвета (1,1 г), температура плавления 205°C (фазовый переход наблюдали при 80°С, а при 205°С образец разлагался). (Найдено: С, 53,4; Н, 6,8; N, 10,7 %. Для C23H32N4О2S.2НСІ.3/4Н2О вычислено: С, 53,6; H, 7,0; N, 10,9%). Пример 9. 2//1-/4-/4 - фтор - 2 - метоксифенил/пиперазинил//N-/2-пиридинил/ацетамид. К перемешиваемому раствору 0,94 г (5,5 ммолей) 2-хлор-N-/2-пиридинил/ацетамида в 10 мл безводного диметилформамида добавляли 1,16 г (5,5 ммоля) 1-/4-фтор-2метоксифенил/пиперазина и 1,1 мл (6,3 ммоля) диизопропилэтиламина, а спустя 19 часов обрабатывали 50 мл воды. Эмульсию экстрагировали диэтиловым эфиром (2х х50 мл), а экстракты промывали 100 мл воды, су 10 39917 тилось, смесь отфильтровывали, испаряли в вакууме и истирали в порошок с цетонитрилом. Остаток очищали хроматографией (двуокись кремния; диэтиловый эфир) и получали 1,51 г продукта. Пример 14. 1-/2,3-дигидро -1,4- бензодиоксин-5-ил/пиперазин. Раствор продукта примера 13 (1,50 г, 0,010 моля) и хлористоводородной соли бис/2хлорэтил/амина (1,77 г, 0,01 моля) в 20 мл хлорбензола кипятили с обратным холодильником в течение 24 часов, охлаждали до комнатной температуры и испаряли в вакууме. Твердое вещество белого цвета растворяли в 100 мл водного раствора гидроокиси натрия и экстрагировали этилацетатом (3х50 мл). Экстракты сушили над MgSO4, испаряли в вакууме и получали 2,00 г продукта. Пример 15. 2-/1-/4-/2,3-дигидро- 1,4-бензодиоксин-5-ил/пиперазинил/-N-/пиридин-2-ил/ацетамид. К перемешиваемому раствору 9,9 г (58 ммолей) 2-хлор-N-/2-пиридинил/ацетамида в 40 мл безводного диметилформамида добавляли при 0°С раствор продукта примера 14 (58 ммолей) в 40 мл безводного диметилформамида, затем обрабатывали 9,2 г (67 ммолями) карбоната калия, спустя 30 минут нагревали до комнатной температуры, а через 18 часов обрабатывали 400 мл воды. Эмульсию экстрагировали диэтиловым эфиром (3х200 мл), а экстракты промывали 500 мл воды, сушили над Na2SO4, испаряли в вакууме и получали масло желтого цвета. После очистки хроматографией (двуокись кремния; этилацетат) получали продукт в виде масла. Пример 16. 1-/2,З- дигидро -1,4-бензодиоксин-5-ил/-4-/2-/2пиридинил-амино/-этил/пиперазин. Раствор продукта примера 15 (42,5 ммоля) в 150 мл тетрагидрофурана нагревали до кипения в атмосфере аргона, добавляли к нему по каплям 8 мл (84,3 ммоля) боран-диметилсульфида, а спустя 2,5 часа добавляли к нему по каплям 50 мл метанола и обрабатывали 200 мл 1/4 N HCL Через 1 час реакционную смесь охлаждали до комнатной температуры, промывали этилацетатом (2х х100 мл), добавляли к ней 2N NаОН и экстрагировали этилацетатом (2х200 мл). Экстракты сушили над Na2SO4 и испаряли в вакууме. После очистки хроматографией (двуокись кремния; этилацетат – этанол, 20:1) получали продукт в виде масла. Пример 17. N-/2-/1-/4-/2,3-дигидро-1,4-бензодиоксин-5-ил/пиперазинил//этил/-N-/2-пиридинил/циклогексанкарбоксамид. К 35%-ной суспензии гидрида калия в минеральном масле (2,99 г, приблизительно 26,1 ммоля) в 25 мл диметилформамида добавляли по каплям при перемешивании в атмосфере аргона 6,9 ммоля продукта примера 16 в 15 мл диметилформамида. Через 20 минут к реакционной смеси добавляли по каплям 1,4 мл (10,5 ммоля) хлорангидрида циклогексанкарбоновой кислоты, а спустя 1 час осторожно обрабатывали 200 мл воды, подкисляли 2N НСІ (приблизительно 70 мл), промывали гексаном (2х200 мл), добавляли к ней 2N NaOH и экстрагировали етилацетатом (2х200 мл). Экстракты промывали 100 мл рассола, сушили над Nа2SO4, испаряли в вакууме и получали масло красного цвета, которое очищали хроматографией (двуокись кремния; этилацетат). Раствор этого масла в 40 мл метанола подкисляла эфирным хлористым водородом, испаряли в вакууме и получали хлористоводородную соль продукта (1,04 г), температура плавления 125-131°С. (Найдено: С, 62,6; Н, 7,3; N, 11,0%. Для C26H34N4O2.HCI.3/4H2O вычислено: С, 62,4; Н, 7,З5; N, 11,2%). Пример 18. 2/1-/4-/3- /1,2-бензизотиазолил//пиперазинил//N-/2-пириридинил/-ацетамид. Раствор 2,06 г (6,4 ммолей) 3-пиреразино-1,2бензизотиазола в 10 мл диметилформамида обрабатывали 2 мл (12,3 ммолями) N,N-диизопропилэтиламина, добавляли к нему 1,84 г (9,6 ммолей) N-/2-пиридинил/хлорацетамида в 10 мл диметилформамида, перемешивали в течение 63 часов, обрабатывали 150 мл воды и экстрагировали этилацетатом (3х50 мл). Экстракты испаряли в вакууме, а остаток очищали хроматографией (двуокись кремния; этилацетат) и получали 2,63 г продукта в виде пены. Пример 19. 2[1-[4-[3- 1,2 -бензизотиазолил/]]пиперазинил]N-/2-пипиридил/-этиламин. К перемешиваемому раствору продукта примера 18 (2,63 г, 7,44 ммоля) в 27 мл тетрагидрофурага добавляли по каплям в атмосфере аргона боран-метилсульфидный комплекс (10М; 4,0 мл, 40 ммолей). Через 18 часов раствор охлаждали до 0°С, обрабатывали 10 мл метанола, 10 мл воды и 10 мл концентрированной водной НСІ, нагревали до кипения, охлаждали до комнатной температуры и испаряли в вакууме. Твердый остаток желтого цвета обрабатывали 50 мл воды и 16 мл 12,5N NaOH. Смесь экстрагировали CH2CI2 (2х50 мл), а экстракты сушили над Na2SO4, испаряли в вакууме, смолу очищали хроматографией (AI2O3; этилацетат) и получали 0,986 г продукта в виде светло-розового масла. Пример 20. N-[2-[1-[4-[3-/1,2 - бензиэотиазолил/]]пиперазинил]-этил]-N-/2-пиридил/циклогексанкарбоксиамид Раствор 0,40 мл (3,0 ммолей) хлорангидрида циклогексанкарбоновой кислоты в 25 мл CH2CI2 добавляли по каплям при 0°С в атмосфере аргона к перемешиваемому раствору продукта примера 19 (0,99 г, 2,90 ммоля) и С5Н5 (0,32 мл, 4,0 ммоля) в 10 мл CH2CI2. Раствор оранжевого цвета перемешивали при комнатной температуре в течение 18 часов, промывали 25 мл воды и 10 мл насыщенного водного раствора NаНСО3, сушили над Na2SO4, испаряли в вакууме и получали масло оранжевого цвета, которое хроматографировали (двуокись кремния; этилацетат) и получали 0,84 г продукта. Хлористоводородную соль получали обычным способом и кристаллизовали путем растирания в порошок с ацетонитрилом; было получено 0,84 г бесцветных кристаллов, температура плавления 174-176°C. (Найдено: С, 56,92; H, 6,64; N, 13,24%. Для C25H31N5OS.2HCI.0,25H2O вычислено: С, 56,97; Н, 6,41; N, 13,29%). 11 39917 Пример 21. 1-[4-бензил-/1-пиперазинил/]изохинолин. Раствор 1,64 г (10 ммолей) 1-хлоризохинолина в 5 мл безводного диметилформамида добавляли при комнатной температуре в атмосфере аргона к перемешиваемому раствору 1,85 г (10,5 ммолей) 1-бензилпиперазина и 2 мл (1,5 г 11,5 ммолей) N,N-диизопропилэтил-амина в 5 мл безводного диметилформамида. Этот раствор перемешивали при комнатной температуре в течение 17 часов. Этот раствор затем желтого цвета нагревали при 110°С в течение 7 часов, обрабатывали 100 мл воды и экстрагировали диэтиловым эфиром (2х x50 мл). Экстракты сушили над Nа2SO4 и концентрировали в вакууме. Остаток очищали хроматографией (двуокись кремния; этилацетат) и получали 1,233 г продукта. Пример 22. 1-[1-пиперазинил]изохинолин. К перемешиваемому раствору продукта примера 21 (1,23 г, 4,06 ммоля) в 4 мл метанола последовательно добавляла 1,01 г (16,0 ммолей) муравьинокислого аммония и 10%-ный Pd/C (42,5 мг, 0,4 ммоля) 10 мол.%. Эту смесь перемешивали при комнатной температуре в течение 6 часов и нагревали при температуре 75°С в течение 16 часов. Затем к смеси добавляла 40 мл метанола, фильтровали ее через кизельгур, концентрировали в вакууме и получали продукт в виде масла бледно-желтого цвета. Пример 23. 1-[1-/5,6,7,8-тетрагидро/нафтил]пиперазинил. К перемешиваемому раствору 4,78 г (3,5 ммолей) 5,6,7,8-тетрагидро-1-нафтиламина в 90 мл хлорбензола добавляли 8,70 г (48,7 ммоля) хлористоводородной соли бис/2-хлор/этиламина. Смесь нагревали при 140°С в течение 38 часов, а затем охлаждали до комнатной температуры. Осадок собирали и промывали минимальным количеством хлорбензола. После рекристаллизации из этанола получали 2,4 г хлористоводородной соли продукта в виде кристаллов белого цвета, температура плавления 324°С (разл.). (Найдено: С, 66,8; Н, 8,5; N, 11,1%. Для С14Н2ON2.HCI вычислено: С, 66,5; Н, 8,4; N, 11,1%). Пример 24. /S/-/1-/2-/2-пиридиламино/пропил// - 4 -/2-метоксифенил/пиперазин 25 г (100 ммолей) /S/-1-/2-аминопропил/--/4-/2метоксифенил/-пиперазина перемешивали в бомбе при 130°С в течение 10 дней с 2,6 мл (30 ммолями) 2 фторпиридина. Получающийся темный остаток растворяли в 150 мл воды и добавляли к нему раствор гидроокиси натрия. Эту смесь встряхивали с тремя порциями хлороформа, хлороформный раствор промывали водой и сушили над сульфатом магния. Оставшееся темное масло (20 г) очищали хроматографией (двуокись кремния), элюируя этилацетатом, и получали 1,84 г продукта в виде масла. Пример 25. /R/-/1-/2-/2-пиридиламино/пропил//- 4 - /2-метоксифенил/пиперазин. /R/-/ 1-/ 2-/ 2-пиридиламино/пропил//-4-/2-метоксифенил/пиперазин получали из /R/-1-/2-аминопропил//-4-/2-метоксифенил/пиперазина (30,8 г, 123 ммоля) и 2-фторпиридина (3,0 мл, 27,4 ммоля) по методике, описанной в примере 24; было получено 5 г продукта в виде масла. Пример 26. 3-[4-/2-метоксифенил/пиперазин- 1 -ил]пропионитрил. К перемешиваемому раствору 3,84 г (20 ммолей) 2-метоксифенил-пиперазина в 100 мл этанола добавляли раствор 1,06 г (20 ммолей) акрилонитрила в 50 мл этанола. Через 18 часов растворитель испаряли в вакууме и получали 4,5 г продукта в виде твердого вещества белого цвета. Пример 27. 4-/2-метоксифенил/-1- /3-аминопропил/пиперазин. Раствор продукта примера 26 (4,4 г, 18 ммолей) в 150 мл концентрированного этанольного раствора аммиака гидрировали при давлении 3,4 ат в течение 50 часов в присутствии катализатора (0,6 г), содержащего 5% родия, нанесенного на порошок окиси алюминия, и получали 3,9 г продукта в виде масла коричневого цвета. Пример 28. 4-/2-метоксифенил/- 1 -/З-пиридин-2-ил/аминопропил/пиперазин. Продукт примера 27 (3,9 г, 16 ммолей) и 1,82 г (16 ммолей) 2-хлорпиридина нагревали при 160°С в течение 6 часов в герметически закрытом сосуде. После охлаждения остаток переносили в 50 мл CH2СІ2, промывали водным раствором NaOH (3х50 мл), сушили над МgSО4 и испаряли в вакууме. Остаток очищали хроматографией (окись алюминия; этилацетат – толуол, 1:4) и получали 0,7 г продукта в виде масла коричневого цвета. Пример 29. 1-/2-/2-хинолиниламино/этил/- 4-/2-метоксифенил/пиперазин. 9,4 г (40 ммолей) 1-/2-аминоэтил/-4-/2-метоксифенил/пиперазина и 6,5 г (40 ммолей) 2-хлорхинолина нагревали в герметически закрытом сосуде при 160°С в течение 3 часов, а затем при 120°С в течение 18 часов. Полученную смолу коричневого цвета переносили в 300 мл разбавленной соляной кислоты, промывали дихлорметаном (3х100 мл), добавляли к раствору гидроокись натрия, экстрагировали дихлорметаном (3х100 мл), сушили над МgSO4, а затем испаряли в вакууме и получали масло коричневого цвета. Это масло очищали хроматографией (окись алюминия; этилацетат - толуол, 1:4) и получали 1,8 г продукта в виде светлого масла. Пример 30. N - / 2 - / 1 - / 4 - / 2 – метоксифенил/ пиперазинил//этил/-N-/1-пиперидинил-карбонил/-2-аминопиридин. К перемешиваемому раствору продукта примера 2 (1 г, 3,2 ммоля) в 50 мл толуола добавляли в атмосфере аргона и при охлаждении на водяной бане 0,84 мл (4,8 ммоля) диизопропилэтиламина, а затем 12,5%-ный (вес./вес.) раствор фосгена в толуоле (7,5 мл, около 8,6 ммолей), спустя 1 час к смеси добавляли 1,5 мл (15 ммолей) пиперидина, а через 18 часов ее обрабатывали 100 мл воды и экстрагировали этилацетатом -(2х100 мл). Экстракты промывали 100 мл воды, сушили над МgSO4 и испаряли в вакууме. Масло очищали хроматографией (двуокись кремния; этилацетат – этанол, 12 39917 20:1), растворяли в 10 мл этанола и подкисляли эфирным хлористым водородом. После испарения в вакууме получали продукт в виде стеклообразного вещества розового цвета (0,43 г), которое размягчается при температуре выше 70°С. (Найдено: С, 50,2; Н, 7,4; N, 10,7%. Для С24Н33N5О2.3HCI.2,5Н2О 1,5ЕtОН вычислено:С, 50,1; Н, 7,8; N, 10,8%). Пример 31. N - / 2 - / - 4 - / 2-метоксифенил / пиперазин - 1ил/этил/-N-/пиридин-2-ил/ -N'-циклогексилтиомочевина/. Суспензию продукта примера 2 (3,12 г, 10 ммолей) в 50 мл диметилсульфоксида добавляли в атмосфере аргона к КН, 35%-ной дисперсии в минеральном масле (1 г, 8,7 ммоля). Через 1 час к смеси добавляли 1,41 г (10 ммолей) циклогексилизотиоцианата и перемешивали ее при 80°С в течение 16 часов, затем охлаждали до комнатной температуры и выливали в 500 мл 2N НСІ. Эту смесь промывали этилацетатом (3х х200 мл), добавляли к ней NаОН и экстрагировали этилацетатом (3х100 мл). Экстракты сушили над MgSO4, испаряли в вакууме и получали масло, которое очищали хроматографией (окись алюминия; этилацетат – гексан, 1:4) и радиальной хроматографией (двуокись кремния; хлороформ - этанол, 100:1); было получено 0,1 г продукта в виде масла. (Найдено: С, 66,3; Н, 7,8; N, 15,4%. Для С25Н35N5О вычислено: С, 66,2; Н, 7,8; N, 15,4%). Пример 32. 2/1-/4-/2-оксифенил/пиперазинил/-N-/2-пиридинил/этиламин. К раствору продукта примера 2 (5,25 г, 16,8 ммоля) в 40 мл диметилформамида добавляли в атмосфере аргона 4,53 г (40 ммолей) третбутилата калия, затем добавляли 3,14 г (41,3 ммоля) пропилмеркаптана, смесь перемешивали при 100°С в течение 18 часов, охлаждали до комнатной температуры и выливали в 200 мл воды. Смесь экстрагировали этилацетатом (3х80 мл), органические фазы объединяли, промывали 40 мл воды, сушили над MgSO4 и испаряли в вакууме. После очистки хроматографией (окись алюминия; гексан – этилацетат, 1:1) получали продукт в виде масла -(2,79 г). Треххлористоводородная соль представляла собой бесцветное твердое вещество, температура плавления 260-265°С. Пример 33. N-/2-/4-/2-оксифенил/- 1 -пиперазинил/этил/-N/2-пиридинил/-циклогексанкарбоксамид. К раствору продукта примера 32 (0,87 г, 2,9 ммоля) в 10 мл дихлорметана добавляли 0,46 г (5,8 ммоля) пиридина и 0,85 г (5,8 ммоля) хлорангидрида циклогексанкарбоновой кислоты. Смесь перемешивали в течение 18 часов, испаряли в вакууме, обрабатывали 10 мл 10%-ного раствора NaOH и 10 мл этанола, перемешивали в течение 2 часов, подкисляли разбавленной НСІ (и это приводило к расщеплению сложного эфира фенола); добавляли к смеси насыщенной водный раствор NаНСО3 и экстрагировали дихлорметаном (3х30 мл). Экстракты промывали 30 мл воды, сушили над МgSO4 и испаряли в вакууме. Масло очищали хроматографией (двуокись кремния; этилацетат) и получали 1,09 г продукта в виде масла. Хлористоводородную соль получали обычным способом, она представляла собой бесцветный порошок с температурой плавления 220223°С. (Найдено: С, 61 5; Н, 7,6; N, 11,4%. Для C24Н32N4O2.1,5HCI.0,25Н2О вычислено: С, 61,6; Н, 7,3; N, 12,0%). Примеры 34-39. Следующие соединения получены по методике, аналогичной той, что описана в примере 18. Пример 34 (а) N-/2-пиридинил/ - 2 - /1-/4-/1-нафтил/пиперазинил/-//ацетамид был получен из 1-/1-нафтил/пиперазинхлоргидрата (2,49 г, 10 ммолей) и N-/2пиридинил/хлорацетамида (1,69 г, 9,9 ммоля) в виде бесцветных кристаллов (3,01 г), температура плавления 171-173°С. (Найдено: С, 72,5; Н, 6,35; N, 16,1%. Для C21Н22N4O вычислено: С, 72,8; Н, 6,4; N, 16,2%). (в) Пример 35. 2/1-/4-/2-метилфенил/пиперазинил//-N-/2-пиридинил/ацетамид был получен из орто-толилпиперазинхлоргидрата (3,19 г, 15 ммолей) и N-/2-пиридинил/-2-хлорацетамида (2,56 г, 15,0 ммолей) в виде смолы желтого цвета (4,63 г). (с) Пример 36. 2-/1-/4-/1-изохинолинил/пиперазинил//-N-/2-пиридил/ацетамид был получен из продукта примера 22 (707 мг, 3,3 ммоля) и N-/2-пиридил/хлорацетамида (568 мг 3,33 ммоля) в виде масла желтого цвета (1,16 г). (d) Пример 37. 2-/1-/4-/1- /7-метокси/-нафтил/пиперазинил//-N/2-пиридил/ацетамид был получен из 1-/1-/7-метокси//нафтилпиперазина (3,33 г, 13,8 ммоля) и N-/2пиридил/хлорацетамида (1,88 г, 11,0 ммолей) в виде твердого вещества (3,125 г) с температурой плавления 142-144°С. (Найдено: С, 68,6; Н, 6,6: N, 14,3%. Для C22Н24N4O2.0,5Н2О вычислено: С, 68,55; Н, 6,5; N, 14,5%). (е) Пример 38. 2/1- /4- /1- /2-метокси/нафтил/пиперазинил//-N/2-пиридил/-ацетамид был получен из 1-[1-/2-метокси/нафтил]пиперазин-хлоргидрата'3/4 Н2О (1,75 г, 5,99 ммоля) и N-/2-пиридил/хлорацетамида (1,08 г, 6,33 ммоля) в виде твердого вещества (1,71 г) с температурой плавления 184-185°С (из диэтилового эфира). (Найдено: С, 69,9; Н, 6,5; N, 14,8%. Для C22Н24N4O2 вычислено: С, 70,2; Н, 6,4; N, 14,9%). (f) Пример 39. 2-/1-/4-/1-/5,6,7,8-тетрагидро/нафтил/пиперазинил//-N-2-/пиридил/ацетамид был получен из продукта примера 23 (2,88 г, 9,96 ммоля) и N-/2-пиридил/хлорацетамида в виде бесцветной смолы (2,50 г). 13 39917 Примеры 40-45. Следующие соединения были получены по методике, аналогичной той, что описана в примере 19. (а) Пример 40. 2- 1/- 4 - /1-нафтил//пиперазинил/-N-/2-пиридинил/этиламин был получен из продукта примера 34 (2,965 г, 8,6 ммоля) и боран-метилсульфидного комплекса (10 М; 4,0 мл, 40 ммолей) в виде масла (2,33 г). (в) Пример 41. 2- /1- /4- /2-метилфенил//пиперазинил/-N-/2-пиридинил/этиламин был получен из продукта примера 35 (4,63 и 14,9 ммоля) в виде бесцветного масла (3,235 г). (с) Пример 42. 2[1- [4- /1-изохинолинил/пиперазинил]]-N-/2-пиридил//этиламин был получен из продукта примера 36 (976 мг, 2,8 ммоля) и боран-метилсульфидного комплекса (10 М; 1,4 мл, 14 ммолей) в виде масла (0,695 г). Пример 43. (d) 2-[1- [4- [1- 7/метокси/нафтил]]пиперазинил]-N/2-пиридил/-этиламин получали из продукта примера 37 (3,0 г, 8,0 ммолей) и боран-метилсульфидного комплекса (10 М; 4,0 мл, 40 ммолей), в виде масла (2,57 г). (е) Пример 44. 2- [1- [4-[1-/2-метокси/нафтил]]пиперазинил]-N/2-пиридил/-этиламин получали из продукта примера 38 (1,665 г, 4,4 ммоля) и боран-метилсульфидного комплекса (2,4 мл, 24 ммоля) в виде масла желтого цвета (1,229 г). (f) Пример 45. 2/1-/4-/1-/5,6,7,8-тетрагидро/нафтил//пиперазинил/-N-/2-пиридил/этиламин получали из продукта примера 39 (2,50 г, 7,1 ммоля) и боран-метилсульфидного комплекса (10 М; 3,8 мл, 38 ммолей) в виде бесцветной смолы (1,96 г). Примеры 46-65. Следующие соединения были получены по методике, аналогичной той, что описана в примере 20. (а) Пример 46 N-/2- /1- /4- /1-нафтил//пиперазинил/этил/-N-/2пиридил/-цикло/гексанкарбоксамид был получен из продукта примера 40 (2,33 г, 7,0 ммолей) и хлорангидрида циклогексанкарбоновой кислоты (0,94 мл, 7,0 ммолей). Двуххлористоводородную соль получали в виде бесцветного твердого вещества (2,56 г) с температурой плавления 180190°С. (Найдено: С, 65,3; Н, 7,1; N, 10,8%. Для C28Н34N4O.2НСІ вычислено: С, 65,2; Н, 7,0; N, 10,9%). (в) Пример 47. N-/2-/1- /4- /2 -метилфенил//пипзразинил/этил/N-/2-пиридинил/циклогексанкарбоксамид был получен из продукта примера 41 (3,235 г, 10,9 ммо ля) в виде двуххлористоводородной соли (3,66 г) с температурой плавления 191-199°С. (Найдено: С, 60,3; Н, 7,65; N, 11,3%. Для C25Н34N4O.2НСІ.Н2О вычислено: С, 60,4; Н, 7,7; N 11,3%). (с) Пример 48 N-/2-/1-/4-/2-фторфенил//пиперазинил/этил/-N/2-пиридинил/циклогексанкарбоксамид малеат гидрат был получен в виде белого твердого вещества с температурой плавления 121-127°С. (Найдено: С, 61,75; Н, 6,7; N, 10,2%. Для C24Н31FN4O вычислено: С, 61,75; Н, 6,85; N, 10,3%). (d) Пример 49. N-[2- [1-[4-/1-изохинолинил]]пиперазинил]этилN-/2-пиридинил/циклогексанкарбоксамид был получен из продукта примера 42 (695 мг, 2,1 ммоля) и хлорангидрида циклогексанкарбоновой кислоты (0,3 мл, 2,2 ммоля). Треххлористоводородная соль представляла собой бесцветное твердое вещество (0,392 г) с температурой плавления 145°С. (е) Пример 50 N-[2- [1- [4- [1-/7 - метокси/нафтил]]пиперазинил]этил]-N-/2 - пиридил/циклогексанкарбоксамид был получен из продукта примера 43 (2,57 г, 7,1 ммоля) и хлорангидрида циклогексанкарбоновой кислоты (1,75 г, 12 ммолей). Хлористоводородная соль (2,36 г) представляла собой низкоплавкое твердое вещество, температура плавления 90°С (выше этой температуры постепенно разлагается). (Найдено: С, 66,17; Н, 7,35; N , 10 38%. Для C29Н36N4O2.HCI.Н2О вычислено: С, 66,08; Н, 7,46; N, 10,63%). (f) Пример 51. N - / 2 - / 1 - / 4 - / 2 - метоксифенил/пиперазинил//этил/-N-/2/пиридил/адамантан-1 -карбоксамид был получен из продукта примера 2 и адамантан1-карбонилхлорида. Двуххлористоводородная соль представляла собой белое твердое вещество с температурой плавления 132-136°С. (Найдено: С, 58,6; Н, 7,5; N, 9,2%. Для C29Н38N4O2.2НСІ.2,5Н2О вычислено: С, 58,8; Н, 7,65; N, 9,45%). (g) Пример 52. N-[2 - [1 - [4 - [1 - /2-мeтoкcи/нaфтил]]пипepaзинил]этил] -N- [2 - пиридил]циклогексанкарбоксамид был получен из продукта примера 44 (1,23 г, 3,4 ммоля) и хлорангидрида циклогексанкарбоновой кислоты (0,7 мл, 0,8 г, 5,2 ммоля). Было получено 0,83 г двуххлористоводородной соли в виде бесцветных кристаллов, температура плавления 151-156°С. (Найдено: С, 63,6; Н, 7,1; N, 10,6%. Для C29Н36N4O2.2НСІ вычислено: С, 63,85; Н, 7,0; N, 10,3%). (h) Пример 53. N-[2-[1-[4- [1-/5,6,7,8-тетрагидронафтил]]-пиперазинил]-этил]-N-/2-пиридил/циклогексанкарбоксамид был получен из продукта примера 45 (1,96 г, 14 39917 5,8 ммоля) и хлорангидрида циклогексанкарбоновой кислоты (1 мл, 1,1 г, 75 ммоля). Было получено 2,21 г двуххлористоводородной соли с температурой плавления 178-180°С. (Найдено: С , 64,6; Н, 7,8; N, 10,9%. Для C28Н38N4O.2НСІ вычислено: С, 64,7; Н, 7,8; N, 10,8%). (i) Пример 54. /S/-N-/1-метил- 2 -/4-/2-метоксифенил/-1-пиперазинил/- этил -N-/2-пиридинил/циклогексанкарбоксамид был получен из продукта примера 24 (1,84 г, 5,6 ммоля) и хлорангидрида циклогексанкарбоновой кислоты (0,8 мл, 5,6 ммоля). Было получено 1,29 г, треххлористоводородной соли в виде кристаллов с температурой плавления 178180°С [a]26 Д=+61° (метанол). (Найдено: С, 57,7; H, 7,5; N, 10,32%. Для C26Н36N4O2.3НСІ вычислено: С, 57,2; Н, 7,2; N, 10,26%). (j) Пример 55. /R/-N-/1-метил-2- /4- /2 -метоксифенил/-1-пиперазинил/этил/ - N- /2-пиридинил/циклогексанкарбоксамид был получен из продукта примера 25 (1,87 г, 5,7 ммоля) и хлорангидрида циклогексанкарбоновой кислоты (0,8 мл, 5,6 ммоля). Было получено 2,1 г двуххлористоводородной соли в виде кристаллов с температурой плавления 175180°С [a]26 Д=-60° (метанол). (Найдено: С, 59,8; Н, 7,8; N, 10,45%. Для C26Н36N4O2.2НСІ.3/4Н2О вычислено: С, 59,7; Н, 7,6; N, 10,7%). (k) Пример 56. /N-[3- [4- /2-метоксифенил/-1-пиперазинил]пропил]-N-/2-пиридинил/циклогексанкарбоксамид был получен из продукта примера 28 (0,7 г, 2,1 ммоля) и хлорангидрида циклогексанкарбоновой кислоты (0,63 г, 4,3 ммоля). Треххлористоводородная соль (0,9 г) представляла собой твердое белое вещество с температурой плавления 137-141°С. (Найдено: С ,55,6; Н, 7,3; N, 9,8%. Для C26Н36N4O2.3НСІ Н2О найдено: С, 55,4; Н, 7,3; N, 9,9%). (l) Пример 57. N-/2-/4-/2-метоксифенил/-1-пиперазинил/этил/N-/2-хинолинил/циклогексанкарбоксамид был получен из продукта примера 29 (1,8 г, 5 ммолей) и хлорангидрида циклогексанкарбоновой кислоты (1,42 мл, 10 ммолей). Монохлористоводородная соль (2,31 г) представляла собой белое твердое вещество с температурой плавления 189-192°С. (Найдено: С, 66,7; Н, 7,3; N, 10,5%. Для C29Н36N4O2.НСІ.3/4Н2О вычислено: С, 66,6; Н, 7,4; N, 10,74%). (m) Пример 58. /Рацемич./-N-/2-/4-/2-метоксифенил/-1-пиперазинил/пропил/-N-/2-пиридил/циклогексанкарбоксамид был получен из /рацемич./-4-/2-метоксифенил/-1- /2- /1-/2-пиридиламино/пропил//пиперазина (2,28 г, 7 ммолей) и хлорангидрида циклогексанкарбоновой кислоты (1,03 мл, 7,7 ммоля). Было получено 0,68 г двуххлористоводородной соли, температура плавления 195-196°С (из этанола диэтилового эфира). (Найдено: С, 60,7; Н, 7,2; N, 10,9%. Для C26Н36N4O2.2НСІ.1/4Н2О вычислено: С, 60,75; Н, 7,55; N, 10,9%). (n) Пример 59. /S/ -N- /2- /4- /2-метоксифенил/ - 1 - пиперазинил/пропил/-N- /2-пиридил/-циклогексанкарбоксамид был получен из /S/-4-/2-метоксифенил/-1-/2-/1/2-пиридиламино/пропил//пиперазина (синтезированного из хлорангидрида /R/-2-хлорпропионовой кислоты) по методике, используемой в примере 58. Треххлористоводородная соль представляла собой белое твердое вещество с температурой плавления 129-130°С, [a]25 Д=-25°(с=1, метанол). (Найдено: С, 54,7; H, 7,2; N, 9,5%. Для C26Н36N4O2.3НСІ.1,5Н2О вычислено: С, 54,5; Н, 7,5; N, 9,8%). (о) Пример 60. /R/ - N - /2- /4- /2-метоксифенил/ - 1 -пиперазинил/пропил-N-/ - 2 - пиридил/циклогексанкарбоксамид был получен способом, аналогичным тому, что использовали в примере 59. (р) Пример 61. N-/2-/4-фенил- 1 -пиперазинил/этил/-N-/2-пиридинил циклогексан-карбоксамид получали из 2/4фенил-1-пиперазинил/-N-/2-пиридил-/этиламина и хлорангидрида циклогексанкарбоновойкислоты. Треххлористоводородная соль представляла собой белое твердое вещество с температурой плавления 198-200°С. (Найдено: С, 57,2; Н, 7,1; N, 11,1%. Для C24Н32N4O.3НСІ вычислено: С, 57,4; Н, 7,0; N, 11,2%). (g) Пример 62. N - /2 - /4 - /2 - изопропилфенил/ - 1 - пиперазинил/этил/ - N -/2-пиридил-циклогексанкарбоксамид был получен из 2/4-/2-изопропил-фенил/-1-пиперазинил/-N-/2-пиридил/этиламина и хлорангидрида циклогексанкарбоновой кислоты. Хлористоводородная соль представляла собой бесцветный порошок с температурой плавления 168-170°С. (Найдено: С, 67,15; Н, 8.2; N, 11.5%. Для C27Н38N4O.НСІ.3/4Н2О вычислено: С, 66,9; Н, 8,4; N, 11,6%). (r) Пример 63. N-/2-/4-/2-метoкcифeнил/-1-пипepaзинил/этил/N-/4-пиридинил/-циклогексанкарбоксамид получали из 2-/4-/2--метоксифенил-1-пиперазинил//-N-/4пиридил/-этиламина (0,39 г, 1,2 ммоля) и хлорангидрида циклогексанкарбоновой кислоты (0,37 мл, 2,5 ммоля). Треххлористоводородная соль (0,15 г) представляла собой бесцветное твердое вещество с температурой плавления 151-153°C. (Найдено: С, 55,7; Н, 7,3; N, 10,2%). Для C25Н34N4O2.3НСІ.0,5Н2О вычислено: С, 55,5; Н, 7,1; N, 10,4%). (s) Пример 64. N-/2-/4-/2-метоксифенил/-1-пиперазинил/этил/N-/3-пиридил/ циклогексанкарбоксамид получали из 2/4-/2-метоксифенил-1-пиперазинил/-N-/3-пири 15 39917 дил/этиламина и хлорангидрида циклогексанкарбоновой кислоты. Двуххлористоводородная соль представляла собой гигроскопическое твердое вещество белого цвета, температура плавления 138-140°С. (Найдено: С, 56,8; Н, 7,8; N, 10,5%. Для C25Н34N4O2.2НСІ.2Н2О вычислено: С, 56,7; Н, 7,2; N, 10,6%). (t) Пример 65. N-/2-/4-/2-метоксифенил/пиперазин-1-ил/этил/N-/2-пиридинил/циклогекс-1-енкарбоксамид был получен из продукта примера 2 (1,49 г, 5 ммолей) и хлорангидрида циклогекс-1-енкарбоновой кислоты (1,08 г, 7,5 ммолей) в виде светлого масла. (Найдено: С, 71,3; Н, 7,9; N, 13,0%. Для C25Н32N4O2 вычислено: С, 71,4; Н, 7,7; N, 13,3%). Пример 66. N-/2-/4-/2-метоксифенил/-1-пиперазинил/этил/N-/2-пиридинил/-цинлогексантиокарбоксамид. 2,0 г (4,5 ммоля) пятисернистого фосфора и 0,47 г (4,5 ммоля) карбоната натрия добавляли к 30 мл тетрагидрофурана, а полученную смесь интенсивно перемешивали при слабом нагревании до полного растворения (30 минут). К раствору добавляли 1,5 г (3,55 ммоля) продукта примера 3 в 10 мл тетрагидрофурана, полученную смесь перемешивали при комнатной температуре в течение 16 часов, кипятили с обратным холодильником в течение 3 часов и охлаждали до комнатной температуры. Затем к смеси добавляли реактив (awessоn) (1,5 г, 3,71 ммоля) и диоксан (30 мл) и кипятили ее с обратным холодильником в течение 4 часов. Охлажденную реакционную смесь промывали 100 мл 10%-ного раствора гидроокиси натрия и 200 мл дихлорметана. Органический слой отделяли, а водный слой экстрагировала дихлорметаном (3х100 мл). Объединенные экстракты промывали 200 мл рассола, сушили над МgSO4, фильтровали и концентрировали в вакууме. Полученное масло (1.0 г) хроматографировали на силикагеле, используя в качестве элюентов дихлорметан, а затем 2% метанола в дихлорметане, и получали 280 мг масла. Это масло повторно очищали хроматографией на окиси алюминия дважды, используя в качестве элюента дихлорметан и получали 50 г масла. Его растворяли в этаноле и при добавлении эфирного НСІ кристаллизовалась двуххлористоводородная соль продукта (50 мг) температура плавления 108-110°С. (Найдено: С, 58,5; Н, 7,4; N, 10,85%). Для C25Н34N4OS.2НСІ вычислено: С, 58,7; Н, 7,1; N, 10,95%). __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 16
ДивитисяДодаткова інформація
Автори англійськоюIan Anthony Cliffe
Автори російськоюЯн Ентони Клифф
МПК / Мітки
МПК: A61K 31/495, C07D 217/22, A61P 43/00, C07D 215/38, A61P 25/00, C07D 277/46, A61P 9/12, C07D 319/00, C07D 401/12, C07D 213/74, C07D 277/20, C07D 417/12, A61P 25/20, A61P 25/24, C07D 411/00, A61P 25/26, C07D 405/12, C07D 213/75, C07D 277/38, C07D 277/44
Мітки: 5-нт1а, спосіб, одержання, похідні, рецепторів, сполука, антагоністи, піперазину, проміжна
Код посилання
<a href="https://ua.patents.su/16-39917-pokhidni-piperazinu-yak-antagonisti-5-nt1a-receptoriv-sposib-kh-oderzhannya-ta-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Похідні піперазину як антагоністи 5-нт1а рецепторів, спосіб їх одержання та проміжна сполука</a>
Попередній патент: Спосіб регенерації відпрацьованої сірчаної кислоти хімічних процесів /варіанти/
Наступний патент: Похідні циклопентан- або циклопентен-b-амінокислот та їх солі, композиція, активна щодо штамів s. aureus, candida i trichophyton
Випадковий патент: Спосіб генерування псевдовипадкових чисел та пристрій для його здійснення












