Застосування похідної піразоліну для одержання лікарського засобу для запобігання або лікування проліферативних клітинних захворювань
Номер патенту: 75402
Опубліковано: 17.04.2006
Автори: Контіхоч-Йобет Марія Монтсеррат, Беррокал-Ромеро Хуана Марія, Куберес-Альтісент Марія Роза
Формула / Реферат
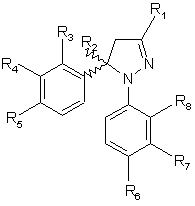
1. Застосування похідної піразоліну загальної формули (І)
 (I),
(I),
де
R1 - атом водню, метил, фторметил, дифторметил, трифторметил, карбонова кислота, нижчий алкілкарбоксилат з 1-4 атомами вуглецю, карбоксамід або ціаногрупа,
R2 - атом водню або метил,
R3, R4, R7 та R8, однакові або різні, - атом водню, хлору, фтору, метил, трифторметил або метоксигрупа,
R5 - атом водню, хлору, фтору, метил, трифторметил, метокси-, трифторметоксигрупа, метилсульфоніл, аміносульфоніл або ацетиламіносульфоніл,
R6 - атом водню, хлору, фтору, метил, трифторметил, метокси-, трифторметоксигрупа або метилсульфоніл,
за умови, що має місце одне з нижченаведеного – або замісником R5 є метилсульфоніл, аміносульфоніл або ацетиламіносульфоніл, або замісником R6 є метилсульфоніл, та
за умови, що у разі, коли R1 - метил,
R2 - атом водню або метил,
R3 та R8, однакові або різні, - атом водню, хлору, фтору, метил або трифторметил,
R4 - атом водню, фтору, метил, трифторметил або метоксигрупа,
R5 - атом фтору, трифторметил, трифторметоксигрупа, метилсульфоніл, аміносульфоніл або ацетиламіносульфоніл,
R6 - атом водню, хлору, фтору, метил, трифторметил, метокси-, трифторметоксигрупа або метилсульфоніл,
за умови, що має місце одне з нижченаведеного – або замісником R5 є метилсульфоніл, аміносульфоніл або ацетиламіносульфоніл, або замісником R6 є метилсульфоніл, та
R7 - атом водню, хлору, фтору, метил, трифторметил або метоксигрупа;
або однієї з її фізіологічнo прийнятних солей для одержання лікарського засобу для запобігання або лікування клітинних проліферативних захворювань, зокрема для запобігання або лікування передракових або неопластичних процесів, пухлинного ангіогенезу, кахексії та процесів, пов'язаних із некротичним пухлинним фактором (TNF) і, у цілому, процесів, корисним для яких може бути пригнічення експресії гена, що відповідає за синтез циклооксигенази-2 (СОХ-2) у ссавців, у тому числі у людини.
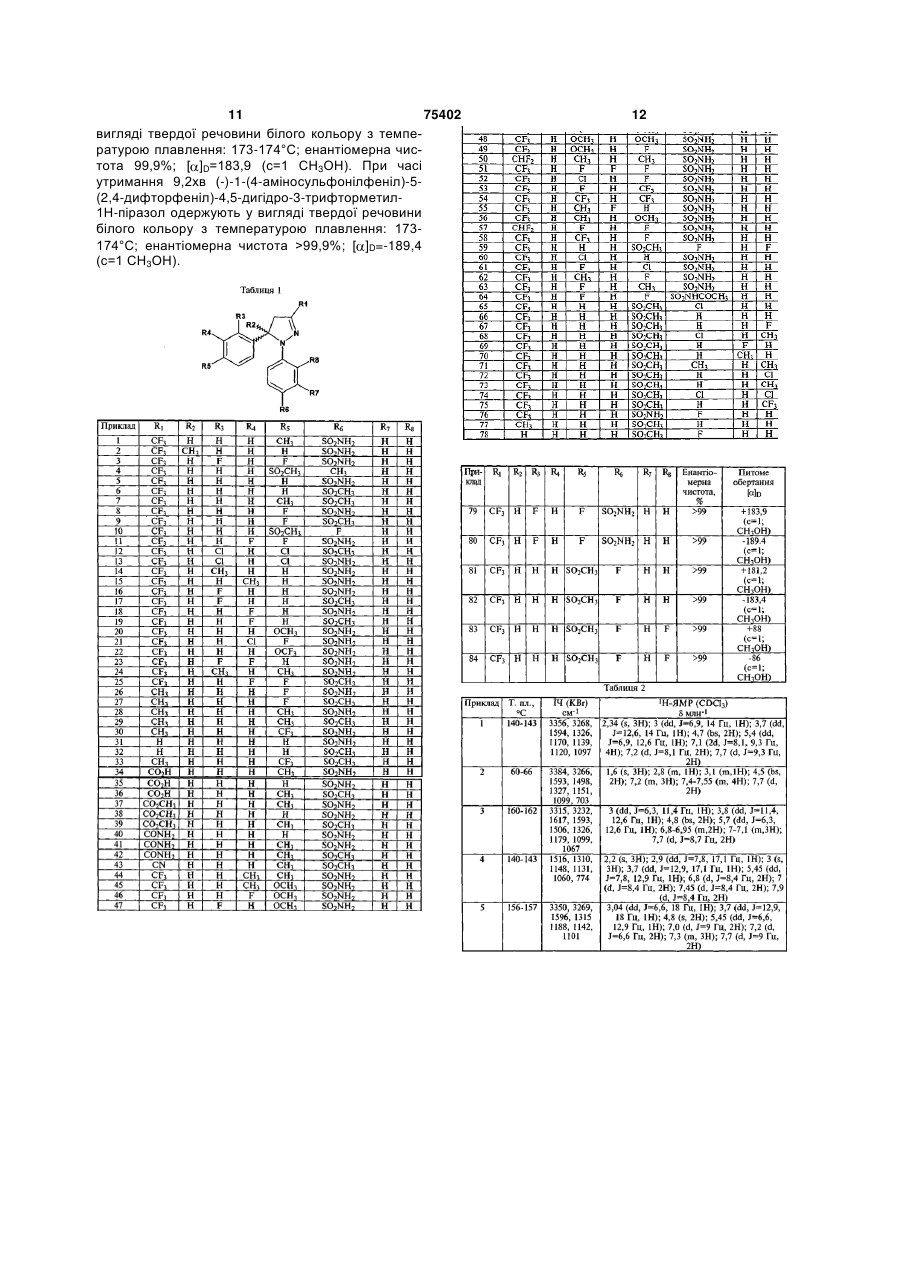
2. Застосування за п. 1 сполуки загальної формули (І), яку вибирають із групи, що включає:
4,5-дигідро-1-(4-метилфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-5-феніл-1-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-5-(4-фторфеніл)-1-(4-метилсульфонілфеніл)-3-трифторметил-lH-піразол,
4,5-дигідро-1-(4-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
5-(2,4-дихлорфеніл)-4,5-дигідро-1-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-5-(2-фторфеніл)-1-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-5-(3-фторфеніл)-1-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
5-(3,4-дифторфеніл)-4,5-дигідро-1-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-5-(4-фторфеніл)-3-метил-1-(4-метилсульфонілфеніл)-1H-піразол,
4,5-дигідро-3-метил-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1H-піразол,
4,5-дигідро-5-феніл-1-(4-метилсульфонілфеніл)-1H-піразол,
4,5-дигідро-3-метил-1-(4-метилсульфонілфеніл)-5-(4-трифторметилфеніл)-1H-піразол,
4,5-дигідро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1H-піразол-3-карбонову кислоту,
4,5-дигідро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1Н-піразол-3-метилкарбоксилат,
4,5-дигідро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1H-піразол-3-карбоксамід,
3-ціан-4,5-дигідро-5-(4-метилфеніл)-1-(4-метилсульфонілфеніл)-1H-піразол,
1-(2,4-дифторфеніл)-4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
1-(4-хлорфеніл)-4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-1-феніл-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-1-(2-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
1-(4-хлор-2-метилфеніл)-4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-1-(3-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-1-(3-метилфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-1-(2,4-диметилфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
1-(2-хлорфеніл)-4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-1-(2-метилфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
1-(2,4-дихлорфеніл)-4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1-(2-трифторметилфеніл)-1H-піразол,
5-(4-аміносульфонілфеніл)-4,5-дигідро-1-(4-фторфеніл)-3-трифторметил-1H-піразол,
4,5-дигідро-1-феніл-3-метил-5-(4-метилсульфонілфеніл)-1H-піразол,
4,5-дигідро-1-(4-фторфеніл)-5-(4-метилсульфонілфеніл)-1H-піразол,
(+)-4,5-дигідро-1-(4-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
(-)-4,5-дигідро-1-(4-фторфеніл)-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
(+)-1-(2,4-дифторфеніл)-4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
(-)-1-(2,4-дифторфеніл)-4,5-дигідро-5-(4-метилсульфонілфеніл)-3-трифторметил-1H-піразол,
або однієї з її фізіологічно прийнятних солей для одержання лікарського засобу для запобігання або лікування клітинних проліферативних захворювань, зокрема для запобігання або лікування передракових або неопластичних процесів, пухлинного ангіогенезу, кахексії та процесів, пов'язаних із некротичним пухлинним фактором (TNF) і, у цілому, процесів, корисним для яких може бути пригнічення експресії гена, що відповідає за синтез циклооксигенази-2 (СОХ-2) у ссавців, у тому числі у людини.
3. Застосування за п. 1 сполуки загальної формули (І) або однієї з її фізіологічно прийнятних солей, разом з іншим продуктом, що звичайно застосовується для лікування неоплазій, з одержанням у цьому разі синергії, для одержання лікарського засобу для запобігання або лікування клітинних проліферативних захворювань, зокрема для запобігання або лікування передракових або неопластичних процесів, пухлинного ангіогенезу, кахексії та процесів, пов'язаних із некротичним пухлинним фактором (TNF) і, у цілому, процесів, корисним для яких може бути пригнічення експресії гена, що відповідає за синтез циклооксигенази-2 (СОХ-2) у ссавців, у тому числі у людини.
Текст
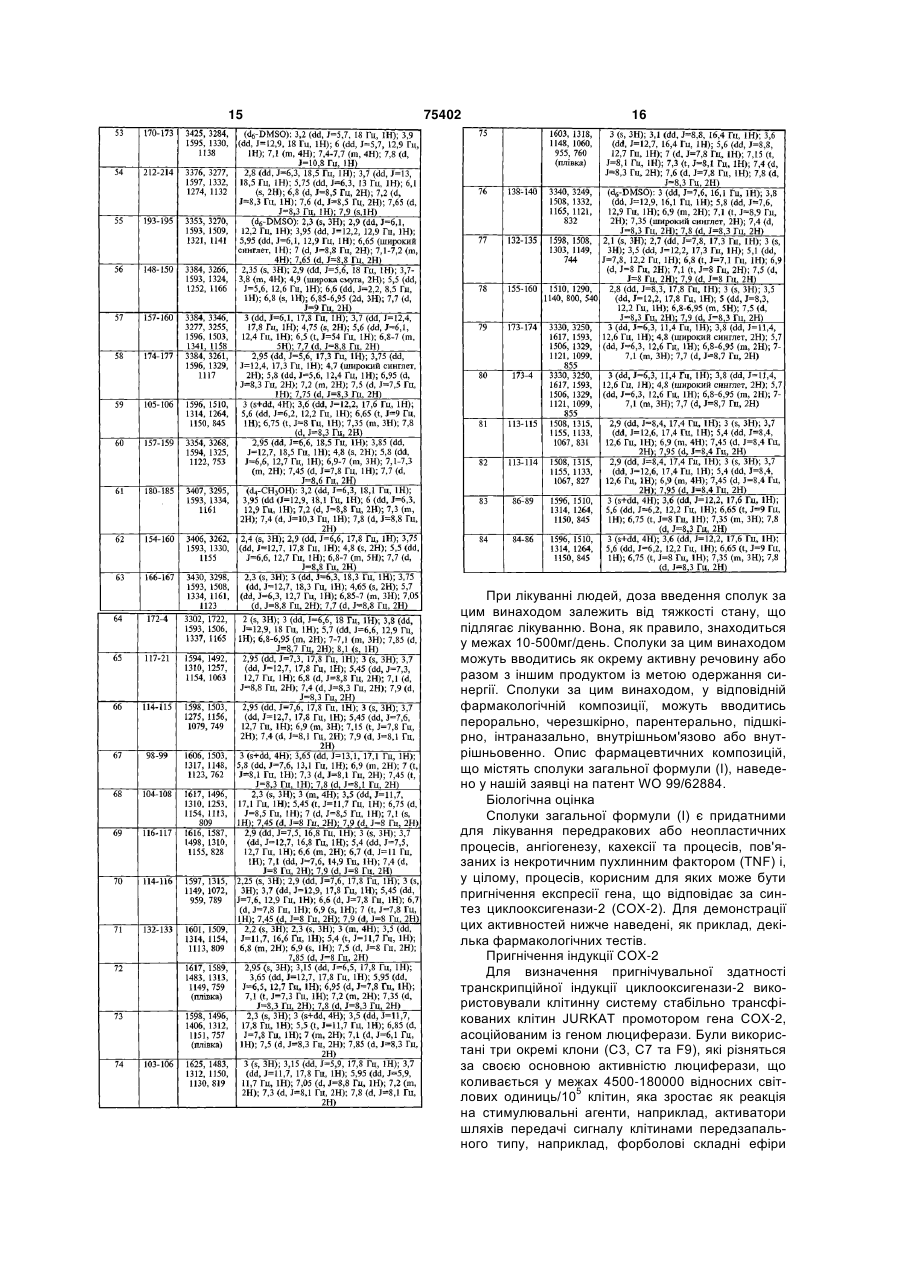
1. Застосування похідної піразоліну загальної формули (І) R1 C2 2 (19) 1 3 75402 4 4,5-дигідро-5-(4-фторфеніл)-1-(44,5-дигідро-1-(2,4-диметилфеніл)-5-(4метилсульфонілфеніл)-3-трифторметил-lHметилсульфонілфеніл)-3-трифторметил-1Hпіразол, піразол, 4,5-дигідро-1-(4-фторфеніл)-5-(41-(2-хлорфеніл)-4,5-дигідро-5-(4метилсульфонілфеніл)-3-трифторметил-1Hметилсульфонілфеніл)-3-трифторметил-1Hпіразол, піразол, 5-(2,4-дихлорфеніл)-4,5-дигідро-1-(44,5-дигідро-1-(2-метилфеніл)-5-(4метилсульфонілфеніл)-3-трифторметил-1Hметилсульфонілфеніл)-3-трифторметил-1Hпіразол, піразол, 4,5-дигідро-5-(2-фторфеніл)-1-(41-(2,4-дихлорфеніл)-4,5-дигідро-5-(4метилсульфонілфеніл)-3-трифторметил-1Hметилсульфонілфеніл)-3-трифторметил-1Hпіразол, піразол, 4,5-дигідро-5-(3-фторфеніл)-1-(44,5-дигідро-5-(4-метилсульфонілфеніл)-3метилсульфонілфеніл)-3-трифторметил-1Hтрифторметил-1-(2-трифторметилфеніл)-1Hпіразол, піразол, 5-(3,4-дифторфеніл)-4,5-дигідро-1-(45-(4-аміносульфонілфеніл)-4,5-дигідро-1-(4метилсульфонілфеніл)-3-трифторметил-1Hфторфеніл)-3-трифторметил-1H-піразол, піразол, 4,5-дигідро-1-феніл-3-метил-5-(44,5-дигідро-5-(4-фторфеніл)-3-метил-1-(4метилсульфонілфеніл)-1H-піразол, метилсульфонілфеніл)-1H-піразол, 4,5-дигідро-1-(4-фторфеніл)-5-(44,5-дигідро-3-метил-5-(4-метилфеніл)-1-(4метилсульфонілфеніл)-1H-піразол, метилсульфонілфеніл)-1H-піразол, (+)-4,5-дигідро-1-(4-фторфеніл)-5-(44,5-дигідро-5-феніл-1-(4-метилсульфонілфеніл)метилсульфонілфеніл)-3-трифторметил-1H1H-піразол, піразол, 4,5-дигідро-3-метил-1-(4-метилсульфонілфеніл)-5(-)-4,5-дигідро-1-(4-фторфеніл)-5-(4(4-трифторметилфеніл)-1H-піразол, метилсульфонілфеніл)-3-трифторметил-1H4,5-дигідро-5-(4-метилфеніл)-1-(4піразол, метилсульфонілфеніл)-1H-піразол-3-карбонову (+)-1-(2,4-дифторфеніл)-4,5-дигідро-5-(4кислоту, метилсульфонілфеніл)-3-трифторметил-1H4,5-дигідро-5-(4-метилфеніл)-1-(4піразол, метилсульфонілфеніл)-1Н-піразол-3(-)-1-(2,4-дифторфеніл)-4,5-дигідро-5-(4метилкарбоксилат, метилсульфонілфеніл)-3-трифторметил-1H4,5-дигідро-5-(4-метилфеніл)-1-(4піразол, метилсульфонілфеніл)-1H-піразол-3-карбоксамід, або однієї з її фізіологічно прийнятних солей для 3-ціан-4,5-дигідро-5-(4-метилфеніл)-1-(4одержання лікарського засобу для запобігання або метилсульфонілфеніл)-1H-піразол, лікування клітинних проліферативних захворю1-(2,4-дифторфеніл)-4,5-дигідро-5-(4вань, зокрема для запобігання або лікування пеметилсульфонілфеніл)-3-трифторметил-1Hредракових або неопластичних процесів, пухлинпіразол, ного ангіогенезу, кахексії та процесів, пов'язаних із 1-(4-хлорфеніл)-4,5-дигідро-5-(4некротичним пухлинним фактором (TNF) і, у цілометилсульфонілфеніл)-3-трифторметил-1Hму, процесів, корисним для яких може бути пригніпіразол, чення експресії гена, що відповідає за синтез цик4,5-дигідро-1-феніл-5-(4-метилсульфонілфеніл)-3лооксигенази-2 (СОХ-2) у ссавців, у тому числі у трифторметил-1H-піразол, людини. 4,5-дигідро-1-(2-фторфеніл)-5-(43. Застосування за п. 1 сполуки загальної формуметилсульфонілфеніл)-3-трифторметил-1Hли (І) або однієї з її фізіологічно прийнятних солей, піразол, разом з іншим продуктом, що звичайно застосову1-(4-хлор-2-метилфеніл)-4,5-дигідро-5-(4ється для лікування неоплазій, з одержанням у метилсульфонілфеніл)-3-трифторметил-1Hцьому разі синергії, для одержання лікарського піразол, засобу для запобігання або лікування клітинних 4,5-дигідро-1-(3-фторфеніл)-5-(4проліферативних захворювань, зокрема для запометилсульфонілфеніл)-3-трифторметил-1Hбігання або лікування передракових або неопласпіразол, тичних процесів, пухлинного ангіогенезу, кахексії 4,5-дигідро-1-(3-метилфеніл)-5-(4та процесів, пов'язаних із некротичним пухлинним метилсульфонілфеніл)-3-трифторметил-1Hфактором (TNF) і, у цілому, процесів, корисним піразол, для яких може бути пригнічення експресії гена, що відповідає за синтез циклооксигенази-2 (СОХ-2) у ссавців, у тому числі у людини. Цей винахід має відношення до застосування похідних піразоліну загальної формули (І), а також їхніх фізіологічно прийнятних солей для одержан ня лікарського засобу, що може застосовуватись у медицині та/або ветеринарії для запобігання або лікування клітинних проліферативних захворю 5 75402 6 вань, зокрема, для лікування передракових або зв'язані таким чином, що згадана промоторна поснеопластичних процесів, пухлинного ангіогенезу, лідовність гена СОХ-2 спрямовує експресію згадакахексії та процесів, пов'язаних із некротичним ного гена-мішені у відповідь на відповідний стипухлинним фактором (TNF) і, у цілому, будь-яких мул. Експериментальний спосіб перевірки включає процесів, корисним для яких може бути пригніченконтактування згаданої клітинної лінії зі сполукою, ня експресії гена, що відповідає за синтез циклоощо підлягає перевірці, з визначенняміснування ксигенази-2 (СОХ-2), окремо або у поєднанні з сигналу, що вказує на експресію активності, обуіншими продуктами, з одержанням синергії у мовленої геном-мішенню. Цей спосіб заявляється останньому згаданому випадку. як придатний для пошуку селективних інгібіторів У нашій заявці на патент WO 99/62884 навеіндукції на транскрипційному рівні СОХ-2 відповіддено опис сполук загальної формули (І) та їхніх ними стимулами. фізіологічно прийнятних солей, Ми встановили, що сполуки загальної формули (І), а також їхні фізіологічно прийнятні солі, є особливо придатними для одержання лікарського засобу, що може застосовуватись у медицині та/або ветеринарії для запобігання або лікування клітинних проліферативних захворювань, зокрема, для лікування передракових або неопластичних процесів, ангіогенезу, кахексії та процесів, пов'язаних із некротичним пухлинним фактором (TNF) і, у цілому, процесів, корисним для яких може бути пригнічення експресії гена, що відповідає за синтез циклооксигенази-2 (СОХ-2), окремо або у поєднанні з іншими продуктами, з одержанням синергії у останньому згаданому випадку. Цей винахід має відношення до застосування піразолінів, що є похідними 2-піразоліну, відомими також як 4,5-дігидро-1Н-піразоли, загальної як інгібіторів циклооксигенази-2 (СОХ-2) із заформули (І) стосуванням у медицині як протизапальних лікарських засобів. Посилення інтересу до регуляції гена, що відповідає за синтез СОХ-2, пояснюється залученням циклооксигенази не тільки до протизапальної відповіді, але також і до важливих патологічних процесів, наприклад, проліферації клітин та раку, регуляції імунної відповіді, дегенеративних захворювань головного мозку тощо, що проявляється у збільшенні обсягу відповідної літератури. Результатом цілого ряду спостережень є розглядання інгібіторів СОХ-2 як потенційних хіміопрофілактичних засобів у разі раку ободової та прямої кишок (CRC). Вибір СОХ-2 на роль мішені пояснюється частотою її надекспресії: до 90% карцином та 40% аденом товстої кишки демонструють високі рівні мРНК та білка СОХ-2 [Еберхарт (Eberhard) та інші: (Gastroenterology 1994 107: 1183-1188; Дюбуя для одержання лікарського засобу, що може (Do Bios) та інші: Gastroenterology 1993 110: 1259застосовуватись у медицині та/або ветеринарії 1262; Прескотт (Рraycott) та інші: Сеll 1996 87: 783для запобігання або лікування клітинних проліфе786]. Окрім того, видається зрозумілим, що ця наративних захворювань, зокрема, для лікування декспресія додає свій внесок до пухлинного фенопередракових або неопластичних процесів, ангіотипу у разі CRC: а) надекспресія СОХ-2 пов'язугенезу, кахексії та процесів, пов'язаних із некротиється з пригніченням апоптозу [Цуджі (Tsujii) та чним пухлинним фактором (TNF) і, у цілому, проінші: Сеll 1995 83: 493-501]; b) інактивація СОХ-2 у цесів, корисним для яких може бути пригнічення мишей Арc (-) асоціюється із пригніченням пухлинекспресії гена, що відповідає за синтез циклооксиного росту; с) дві з найпоширеніших генетичних генази-2 (СОХ-2), окремо або у поєднанні з іншими змін у разі раку ободової та прямої кишок, мутації продуктами, з одержанням синергії у останньому генів супресії пухлин Арc та мутації онкогенів ras, згаданому разі. пов'язуються з надекспресією СОХ-2 [Булбол У формулі (І) (Bооlbоl) та інші: Сanceг Rеs. 1996 56: 2556-2560; R1 - атом водню, метил, фторметил, дифторШенг Г. (Seng H.) та інші: J. Biol. Chem. 1998 273 метил, трифторметил, карбонова кислота, алкіл(34): 2720-2727]. карбоксилат з менше ніж 1-4 атомами вуглецю, У нашій заявці на патент PCT/ES00/00245 накарбоксамід або ціаногрупа, ведено опис лінії клітин, що включає генноR2 - атом водню або метил, інженерну конструкцію, до складу якої, у цілому R3, R4, R7 та R8, однакові або різні, - атом водабо частково, входить промоторна послідовність ню, хлору, фтору, метил, трифторметил або метогена СОХ-2 та ген-мішень, функціонально взаємоксигрупа, 7 75402 8 R5 - атом водню, хлору, фтору, метил, трики, раку сечового міхура, раку підшлункової залофторметил, метокси-, трифторметоксигрупа, мези, раку легень, раку передміхурової залози, раку тилсульфоніл, аміносульфоніл або ацетиламінояєчника, раку шийки матки та раку молочної залосульфоніл, зи, або для запобігання чи лікування аденоматозR6 - атом водню, хлору, фтору, метил, триних поліпів, у тому числі вродженого родинного фторметил, метокси-, трифторметоксигрупа, меполіпозу. тилсульфоніл, аміносульфоніл або ацетиламіноСполуки загальної формули (І) можуть застосульфоніл, совуватись, із введенням терапевтично ефективза умови, що одним із замісників R5 або R6 є ної дози, на ссавцях, у тому числі людині, як засометилсульфоніл, аміносульфоніл або ацетиламіби для запобігання або лікування захворювань, носульфоніл, та пов'язаних з ангіогенезом, наприклад, росту та за умови, що у разі коли R1 є метилом, метастазування пухлин, які залежать від процесу R2 - атом водню або метил, ангіогенезу, та інших розладів, наприклад, ретиноR3 та R8, однакові або різні, - атом водню, хлопатій та ендометріозу. ру, фтору, метил або трифторметил, Сполуки загальної формули (І) можуть застоR4 - атом водню, фтору, метил, трифторметил совуватись, з введенням терапевтично ефективної або метоксигрупа, дози, на ссавцях, у тому числі людині, як засоби R5 - атом фтору, трифторметил, трифторметодля запобігання або лікування кахексії або інших ксигрупа, метилсульфоніл, аміносульфоніл або розладів, до яких є залученим некротичний пухацетиламіносульфоніл, линний фактор (TNF- ). R6 - атом водню, хлору, фтору, метил, триПохідні загальної формули (І) можуть одержуфторметил, метокси-, трифторметоксигрупа, меватись за способами, опис яких наведено у нашій тилсульфоніл, аміносульфоніл або ацетиламінозаявці на патент WO 99/62884. Нижче, як приклад, сульфоніл, наведено опис одержання 1-(4за умови, що одним із замісників R5 або R6 є аміносульфонілфеніл)-5-(2,4-дифторфеніл)-4,5метилсульфоніл, аміносульфоніл або ацетиламідигідро-3-трифторметил-1Н-піразолу (Приклад 3) носульфоніл, та та його енантіомерів (Приклади 79 та 80). У ТабR7 - атом водню, хлору, фтору, метил, трилицях 1 та 2 наведено сімейство сполук загальної фторметил або метоксигрупа. формули (І), які становлять особливий інтерес, а Сполуки загальної формули (І) мають стереотакож їхні характерні фізико-хімічні властивості. генний центр і, завдяки цьому, їх можна одержуваПриклад 3. Одержання 1-(4-аміносульфоніл ти у енантіомерно чистому вигляді або у формі феніл)-5-(2,4-дифторфеніл)-4,5-дигідро-3рацематів. Рацемати сполук (І) можуть розділятрифторметил-1Н-піразолу тись на їхні оптичні ізомери традиційними способами, наприклад, засобами хіральної роздільної хроматографії або шляхом фракціонованої кристалізації їхніх діастереоізомерних солей, які можуть одержуватись шляхом реагування сполук (І) з енантіомерно чистими кислотами або основами. Подібним чином, їх можна також одержати шляхом енантіоселективного синтезу з використанням енантіомерно чистих хіральних попередників. Цей винахід має також відношення до фізіологічно прийнятних солей сполук загальної формули (І), до солей, які одержують доданням мінеральних та органічних кислот, та до солей, які одержують із лужними металами. Сполуки загальної формули (І), а також їхні фізіологічно прийнятні солі, пригнічують експресію гена, що відповідає за синтез циклооксигенази-2 (СОХ-2), що може бути показано на клітинній системі стабільно трансфікованих клітин JURKAT промотором гена СОХ-2, асоційованим із геном люциферази, за способом, опис якого наведено у нашій заявці на патент PCT/ES00/00245. Сполуки загальної формули (І) можуть застосовуватись, із введенням терапевтично ефективОдержання, через ацетимідоїл. (E)-1,1,1ної дози, на ссавцях, у тому числі людині, як засотрифтор-4-(2,4-дифторфеніл)-3-бутен-2-ону би для запобігання або лікування передракових До колби із сухою інертною атмосферою вноабо неопластичних процесів, із частковим або посять 260мл безводного тетрагідрофурану, охоловним пригніченням росту, розповсюдження або джують до температури -78°С і додають 225мл 2Μ метастазування новоутворень, а також із часткорозчину LDA (лаурилдіетаноламіду) у суміші тетвим або повним руйнуванням неопластичних клірагідрофурану/п-гептану зі швидкістю, яка дозвотин. Наприклад, сполуки загальної формули (І) ляє підтримувати температуру нижче -65°С. Після можуть застосовуватись у разі неоплазій, наприцього крапля за краплею швидко додають розчин клад, раку шлунково-кишкового тракту, раку печін 9 75402 10 діетилметилфосфонату (34,25г, 0,225моль) у 30мл піразолу тетрагідрофурану і збовтують впродовж 30хв при Розчин 4-(аміносульфоніл)фенілгідразину температурі -78°С. Потім крапля за краплею дохлоргідрату (234,8г, 1,09моль) та (Е)-1,1,1дають розчин N-фенілтрифторацетимідоїлхлориду трифтор-4-(2,4-дифторфеніл)-3-бутен-2-ону (46,7г, 0,225моль) у 40мл тетрагідрофурану і ви(281,4г) у 1600мл оцтової кислоти нагрівають зі тримують зі збовтуванням за тих саме умов прозворотним холодильником впродовж 24год у атдовж 1год. Додають розчин 2,4мосфері азоту. Розчин охолоджують, повільно дифторбензальдегіду (33,6г, 0,236моль) у 40мл виливають на суміш води та льоду (10-12л) з енертетрагідрофурану, охолоджувальну ванну видагійним збовтуванням і фільтрують. Суміш промиляють і витримують із підвищенням температури вають толуолом (500мл) і сушать. Шляхом кристадо температури навколишнього середовища. Сулізації з діоксану одержують 328г неочищеного міш збовтують впродовж ночі за тих саме умов. продукту (чистота 95,6%). Одержують 216,7г 1-(4Наступного ранку додають 450мл 2N розчину НСІ і аміносульфонілфеніл)-5-(2,4-дифторфеніл)-4,5збовтування здійснюють впродовж 24год. Тетрагідигідро-3-трифторметил-1Н-піразолу з чистотою дрофуран видаляють на роторному випарнику, 98,1%. З кристалізаційного розчину, після конценодержаний водний розчин екстрагують AcOEt трування, додатково одержують 69,3г із чистотою 97,5%. Дві згадані фракції об'єднують і перекрис(2 200мл), промивають 5% розчином NaHCO3, талізовують з ізопропанолу з одержанням 267,8г насиченим розчином NaCl, сушать сульфатом на(61%) цільового продукту з розміром частинок трію, фільтрують і розчинник випарюють на ротор99,9%; [ ]D=-189,4 (с=1 СН3ОН). 12 13 75402 14 15 75402 16 При лікуванні людей, доза введення сполук за цим винаходом залежить від тяжкості стану, що підлягає лікуванню. Вона, як правило, знаходиться у межах 10-500мг/день. Сполуки за цим винаходом можуть вводитись як окрему активну речовину або разом з іншим продуктом із метою одержання синергії. Сполуки за цим винаходом, у відповідній фармакологічній композиції, можуть вводитись перорально, черезшкірно, парентерально, підшкірно, інтраназально, внутрішньом'язово або внутрішньовенно. Опис фармацевтичних композицій, що містять сполуки загальної формули (І), наведено у нашій заявці на патент WO 99/62884. Біологічна оцінка Сполуки загальної формули (І) є придатними для лікування передракових або неопластичних процесів, ангіогенезу, кахексії та процесів, пов'язаних із некротичним пухлинним фактором (TNF) і, у цілому, процесів, корисним для яких може бути пригнічення експресії гена, що відповідає за синтез циклооксигенази-2 (СОХ-2). Для демонстрації цих активностей нижче наведені, як приклад, декілька фармакологічних тестів. Пригнічення індукції СОХ-2 Для визначення пригнічувальної здатності транскрипційної індукції циклооксигенази-2 використовували клітинну систему стабільно трансфікованих клітин JURKAT промотором гена СОХ-2, асоційованим із геном люциферази. Були використані три окремі клони (С3, С7 та F9), які різняться за своєю основною активністю люциферази, що коливається у межах 4500-180000 відносних світлових одиниць/105 клітин, яка зростає як реакція на стимулювальні агенти, наприклад, активатори шляхів передачі сигналу клітинами передзапального типу, наприклад, форболові складні ефіри 17 75402 18 (терефталева кислота) та іонофори (іономіцин). IC50 (мкг/мл) 5,8 0,9 1,8 Для проведення випробування клітини впродовж 1год піддавали попередній обробці експериПротипухлинна активність у разі раку товстої ментальними сполуками, після чого стимулювали кишки людини терефталевою кислотою+іономіцин впродовж Протипухлинну активність сполук загальної 6год. Після цього одержували клітинні екстракти, у формули (І) вивчали шляхом визначенняїхньоі дії яких перевіряли активність люциферази та визнана лінії клітин раку товстої кишки людини (TD20 та чали концентрацію білка. Пригнічення активності NC59). Дві згадані клітинні лінії мають білок K-Ras люциферази вказує на пригнічення індукції СОХ-2. дикого типу. TD 20 включає мутацію генаЯк приклад активності сполук загальної форсупресора р53, у той час як NC 59 має білок р53 мули (І), нижче ми наводимо результати, одержані дикого типу. зі сполукою Прикладу 10, які показують чітке пригОбидві лінії клітин культивували на модифіконічення індукції СОХ-2. ваному за способом Дульбекко живильному середовищі Ігла (Life Technologies), доповненому 10% Пригнічення активності сироватки зародка великої рогатої худоби (Life Приклад 10 люциферази (%) Technologies), при температурі 37°С та 5% СО2. (Концентрація мкг/мл) Клон С7 Клон С9 Клон F9 Тести на цитотоксичність здійснювали із застосуванням набору ХТТ (Boehringer-Manheim), за 0,5 20% 40% 32% допомогою якого визначають здатність клітин ме5 55% 75% 65% таболізувати сіль тетразолію на формазан. 50 85% 85% 95% Концентрація (мкМ) Приклад 3 1 20 30 40 60 100 Приклад 10 1 20 40 60 80 Процент життєздатності клітин ракової пухлини ободової та прямої кишок+середнє квадратичне відхилення NC59 TD20 99,64±0,51 98,58±2,83 76,52±8,70 84,46±3,05 56,50±0,25 66,34±5,84 16,74±10,53 27,38±4,12 1,16±0,83 1,79±2,09 0±0 0,69±0,01 ІС-50=29,87 ІС-50=33,87 92,09±9,35 95,03±8,87 76,14±7,17 90,24±5,97 15,77±9,37 43,13±13,77 2,59±1,54 5,42±4,11 1,66±1,57 3,22±3,46 IС-50=27,18мкМ IС-50=37,92мкМ Як приклад активності сполук загальної формули (І), сполуки прикладів 3 та 10 продемонстрували цитотоксичну активність відносно обох ліній клітин ракової пухлини ободової та прямої кишок людини. ІС50 згаданих сполук відносно лінії клітин NC59 становила30мкМ та 27мкМ; відносно лінії клітин TD20 вона становила 34мкМ та 38мкМ, відповідно. Для кращого розуміння механізму дії цих сполук, вивчали здатність сполуки прикладу 3 до індукування апоптозу лінії пухлинних клітин TD20 (доза 100мкМ). За цих умов через 24год було виявлено 20% апоптозних клітин і 80% через 48год, у той час як у лінії клітин, яка піддавалась обробці носієм, вміст апоптозних клітин не перевищував 1%. Рівні цитотоксичності, що визначались за допомогою ХТТ, були подібними рівням апоптозу, що дозволяє зробити припущення про те, що цитотоксична активність прикладу З обумовлена їхньою здатністю до індукування апоптозу. Після цього вивчали шляхи трансдукції сигналу, що асоціювались з апоптозним процесом. Після піддання клітин лінії NC59 дії сполуки прикладу 3 у концентрації 100мкМ, вивчали рівні експресії р53, FAK та -актину і рівень активації МАР-кіназ (Ж4Р - білок, асоційований з мікротрубочкамм), JNK та PKB/Akt (протеїнкіназа В/аспартаткіназа) після 5 та 20год експозиції. Результати показали активацію інших шляхів трансдукції сигналу, аніж р53, JNK або р38, які є шляхами, що активуються традиційними генотоксичними лікарськими засобами (наприклад, 5-фторурацилом). Підсумково можна сказати, що сполуки прикладів 3 та 10 є ефективними протипухлинними засобами для раку прямої кишки людини, що дозволяє припустити можливість застосування сполук загальної формули (І) не лише для профілактики, але і для лікування уже існуючого раку прямої кишки. Крім того, їхній протипухлинний ефект опосередковується апоптозом і активація шляхів трансдукції здійснюється іншими сигналами, окрім р53, JNK або р38, що дозволяє припустити можливість того, що ці сполуки можуть застосовуватись як допоміжні засоби до сучасних хіміотерапевтичних протоколів, оскільки вони мають інший механізм цитотоксичної дії. Протипухлинна активність у разі раку молочної залози Протипухлинну активність сполук загальної формули (І) вивчали шляхом визначення їхнього ефекту на лінію клітин раку молочної залози (MDAMB 453). Згадану лінію клітин культивували на модифікованому за способом Дульбекко живильному середовищі Ігла (Life Technologies), доповненому 10% сироватки зародка великої рогатої худоби (Life 19 75402 20 Technologies), при температурі 37°С та 5% СО2. ракової пухлини прямої кишки людини, тимчасово Тести на цитотоксичність здійснювали із затрансфікованих вектором, що включає промотор стосуванням набору ХТТ (Boehringer-Manheim), за людського гена VEGF. Після встановлення експедопомогою якого визначають здатність клітин мериментальних умов, здатність експериментальнотаболізувати сіль тетразолію на формазан. го продукту до пригнічення експресії генів VEGF та TF вивчали шляхом визначення люциферазної активності їхніх промоторів. Процент життєздатності клітин Під час експерименту було використано ракової пухлини молочної залоКонцентрація 1,25 105 клітин лінії Сасо-2, тимчасово трансфікози±середнє квадратичне відхи(мкМ) ваних відповідною ДНК у 500мкл модифікованого лення за способом Дульбекко живильного середовища MDAMB 453 Ігла, доповненого 10% сироватки зародка великої Приклад 3 1 94,76+8,71 рогатої худоби на 24-лункових планшетах. Клітини 20 31,52±9,12 впродовж 1год піддавали попередній обробці екс40 12,77±4,80 периментальними сполуками, після чого стимулю60 5,97±5,06 вали терефталевою кислотою впродовж 16год. У 80 2,84±1,71 подальшому одержували клітинні екстракти і досІС-50=12,87мкМ ліджували їхню люциферазну активність шляхом Приклад 10 1 97,53±3,25 визначення концентрації білка. 20 42,75±9,31 Як приклад активності сполук загальної фор40 33,30±7,34 мули (І), нижче наведені результати, одержані для 60 8,25±6,82 сполук прикладів 3 та 10, які демонструють чіткий 80 5,8±4,76 антиангіогенний ефект, оскільки пригнічується як ІС-50=17,88мкМ VEGF, так і TF. Як приклад активності сполук загальної форПригнічення індукції мули (І), сполуки прикладів 3 та 10 продемонструсудинновали цитотоксичну активність відносно лінії клітин тканинної тромСполука ендотеліального ракової пухлини молочної залози з ІС50, що станобокінази фактора росту вила 3мкМ (Приклад 3) та 18мкМ (Приклад 10). ІС50 (мкг/мл) ІС50 (мкг/мл) Підсумково можна сказати, що сполуки прикПриклад 3 20 25 ладів 3 та 10 є ефективними протипухлинними засобами для раку молочної залози, що дозволяє Приклад 10 25 22 припустити можливість застосування сполук загальної формули (І) не лише для профілактики, але і Пригнічення некротичного пухлинного фактодля лікування уже існуючого раку молочної залози. ра- (TNF- ) Антиангіогенна активність Некротичний пухлинний фактор- (TNF- ) явЦю активність вивчали шляхом визначення ляє собою цитокін, сильнодіючий передзапальний пригнічення індукції експресії VEGF (судиннота імунний модулятор, що залучається до різних ендотеліальний фактор росту). Підвищена експрезапальних станів, наприклад, ревматоїдного артсія судинно-ендотеліального фактора росту риту, гранулематозної хвороби, розсіяного склеро(VEGF) пов'язувалась із розвитком пухлини та анзу та кахексії, пов'язаної з раком, а також до імугіогенезом. VEGF являє собою проангіогенний нодефіциту людини, що пов'язується з вірусними фактор, що посилює мітогенез, міграцію та підвиінфекціями. Початковий опис TNF- було здійснещену судинну проникність ендотеліальних клітин но завдяки його здатності до індукування геморагіin vitro. Нещодавно було показано, що СОХ-2 мочного некрозу певних пухлин у тварин, які піддаже регулювати процес ангіогенезу, індукований вались обробці ліпополісахаридом (LPS). Він клітинами ракової пухлини товстої кишки, з підвитакож одержав назву кахектину, оскільки предстащенням експресії проангіогенних факторів згадавляє собою циркулюючий медіатор синдрому хроними клітинами. Пригнічення СОХ-2 може блокунічної втомленості, що пов'язується з певними вати цей процес із пригніченням експресії деяких із паразитарними захворюваннями. Кахексія або цих факторів, наприклад, VEGF. втомленість, що є наслідком TNF, пов'язується з У свою чергу, VEGF також індукує експресію його властивістю до підвищення рівня ліпази ліпотканинної тромбокінази (TF) у мембранах моноципротеїну і вичерпання, з цього приводу, ліпоцитів. тів, епітеліальних клітинах та ендотелії. Хоча гоTNF- продукується головним чином макрофагаловна функція TF полягає у ініціюванні системи ми, коли вони активуються найрізноманітнішими згортання крові, вона може трансдукувати внутрістимулами, наприклад, присутністю бактеріальних шньоклітинні сигнали, приймаючи участь у метасабо мікобактеріальних білків, грибкових антигенів, тазуванні та ангіогенезі, що пов'язуються з пухливірусу, комплементу С5а або гамма-інтерферону. нами. TF полегшує ріст пухлин in vivo, сприяючи TNF- є одним із медіаторів ендотоксинового ангіогенезу. Було показано, що пухлинні клітини, бактеріально-токсичного шоку і, як видається, несе трансфіковані TF, забезпечують більшу васкулявідповідність за гарячку, метаболічний ацидоз, ризацію. діарею, гіпертензію, генералізований тромбогемоЗ метою вивчення антиангіогенної активності рагічний синдром і, у певних випадках, навіть продуктів загальної формули (І), експресію VEGF смерть. Крім того, TNF- може призвести до актипромотора вивчали за умов основної та стимульовації нейтрофілів шляхом індукування експресії ваної ситуації з використанням лінії клітин Сасо-2 21 75402 22 генів IL-1 (інтерлейкіну-1), підвищення експресії Клемен (Р. Kiemen) та іншими (Eurор. J. антигенів головного комплексу гістосумісності (з Pharmacol. 1995 281: 69-74)], сутність якого поляголовним комплексом гістосумісності класу І) у гає у визначенні продукування TNF- на локалізоендотеліальних клітинах і є залученим до реабсованій ділянці з гострим запальним процесом, конкрбування кісткового мозку та до продукування ретно, з використанням моделі повітряних мішків простагландину (PGE2) та колагенази синовіальмишей, наповнених зимозаном. Визначали кільними клітинами та людськими фібробластами. кість TNF- у запальних ексудатах, продукованих у Таким чином, продукти, здатні до антагонізування згаданих мішках, як результат стимулювання зиактивності цього медіатора, можуть мати клінічну мозаном. Аналітичне визначення TNF- здійснюцінність для боротьби з летальними ефектами вали за допомогою імуноферментного твердофаз[К.А. Макінтайр (С.А. Mc Intyre) та інші: Drugs News ного аналізу (ELISA). and Реrspectives 1992 5 (4): 207-213; АЮДж.Г. ГіЯк приклад активності сполук загальної форрінг (A.J.H. Gearing) та інші: Nature 1994 370: 555мули (І), нижче наведені результати, одержані зі 557; М.А. Палавані (M.A. Pahlavani): Drugs of Tuday сполукою Прикладу 10, які показують значну приг1993 29 (8): 525-533]. нічувальну активність TNF- , що дуже добре кореВивчення пригнічувальної активності TNFлює з дозою. здійснювали за методом, опис якого наведено [П. Приклад 10 Модель повітряних мішків мишей Процент пригнічення TNF- у запальному ексудаті, що стимулюДози (мг/кг, внутрішньоочеревинно) ється зимозаном 0,039 12,6±2,6 0,156 15,7±4,9 0,625 46,8±12,5 2,5 58,8±13,6 DE (декстрозний еквівалент) 50=1,20мг/кг, внутрішньоочеревинно (r=0,957) Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of pyrazoline derivative for the preparation of medicament for prevention or treatment of proliferative cellular diseases
Назва патенту російськоюПрименение производной пиразолина для получения лекарственного средства для предотвращения или лечения пролиферативных клеточных заболеваний
МПК / Мітки
МПК: A61P 35/00, A61P 15/00, A61P 27/02, A61P 35/04, A61P 43/00, A61K 31/415, A61P 29/00, C07D 231/06
Мітки: піразоліну, похідної, лікування, одержання, проліферативних, запобігання, захворювань, клітинних, лікарського, застосування, засобу
Код посилання
<a href="https://ua.patents.su/11-75402-zastosuvannya-pokhidno-pirazolinu-dlya-oderzhannya-likarskogo-zasobu-dlya-zapobigannya-abo-likuvannya-proliferativnikh-klitinnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Застосування похідної піразоліну для одержання лікарського засобу для запобігання або лікування проліферативних клітинних захворювань</a>
Попередній патент: Пристрій для оптичного контролю масок флексоформ
Наступний патент: Пристрій для розподілу сипких матеріалів (варіанти)
Випадковий патент: Порошковий вогнегасник