Похідні 8-азабіцикло[3.2.1]октан-3-метанаміну, фармацевтична композиція та лікарський засіб
Номер патенту: 58476
Опубліковано: 15.08.2003
Автори: Де Перетті Даніель, Мерлі Жан-П'єр, Машнік Дєвід, Жорж Паскаль, Руа Жоселін, Севрен Мірей, МАРАБУ Бенуа
Формула / Реферат
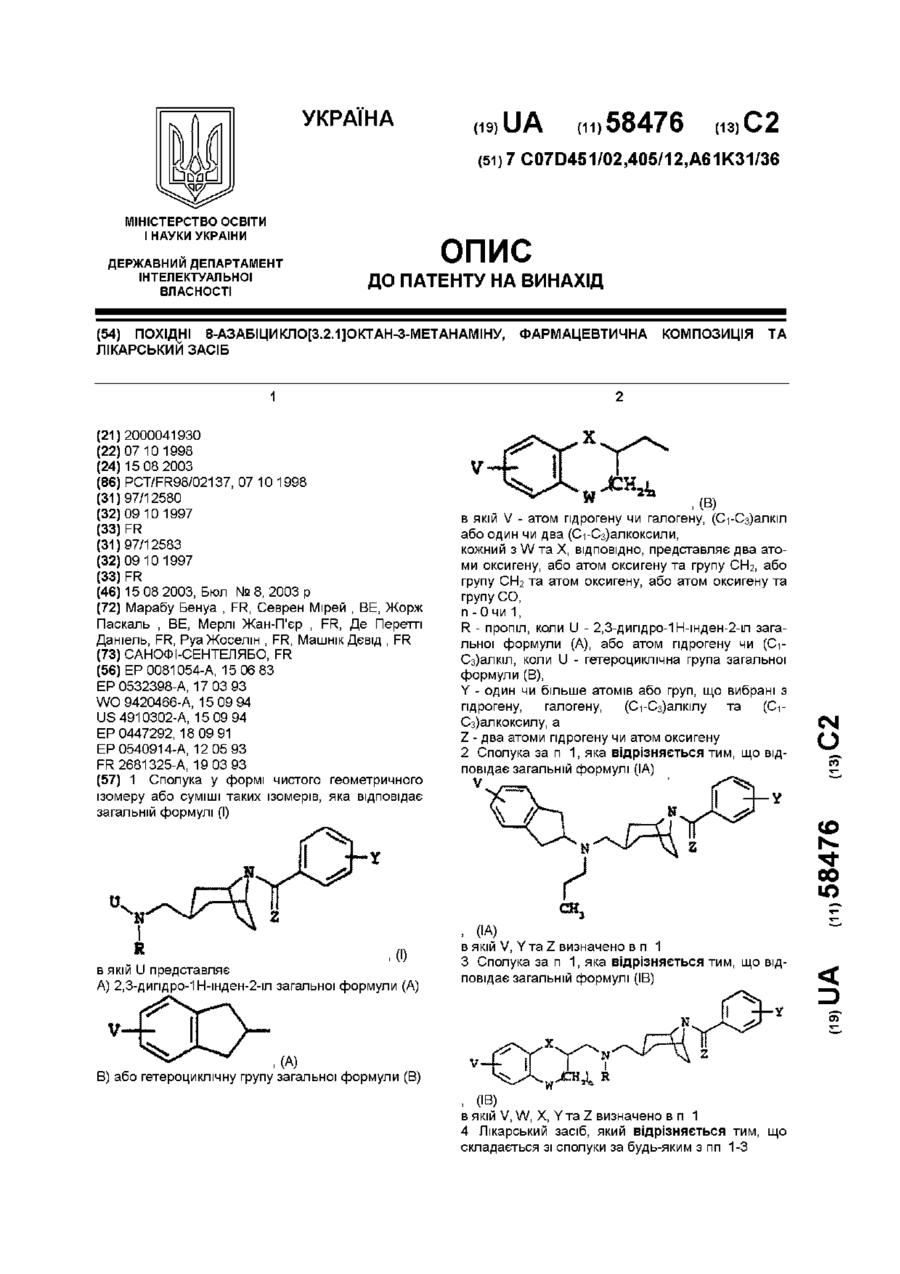
1. Сполука у формі чистого геометричного ізомеру або суміші таких ізомерів, яка відповідає загальній формулі (І)
, (I)
в якій U представляє
А) 2,3-дигідро-1Н-інден-2-іл загальної формули (А)
, (А)
В) або гетероциклічну групу загальної формули (В)
, (В)
в якій V - атом гідрогену чи галогену, (С1-С3)алкіл або один чи два (С1-С3)алкоксили,
кожний з W та X, відповідно, представляє два атоми оксигену, або атом оксигену та групу СH2, або групу СН2 та атом оксигену, або атом оксигену та групу СО,
n - 0 чи 1,
R - пропіл, коли U - 2,3-дигідро-1H-інден-2-іл загальної формули (А), або атом гідрогену чи (С1-С3)алкіл, коли U - гетероциклічна група загальної формули (В),
Y - один чи більше атомів або груп, що вибрані з гідрогену, галогену, (С1-С3)алкілу та (С1-С3)алкоксилу, а
Z - два атоми гідрогену чи атом оксигену.
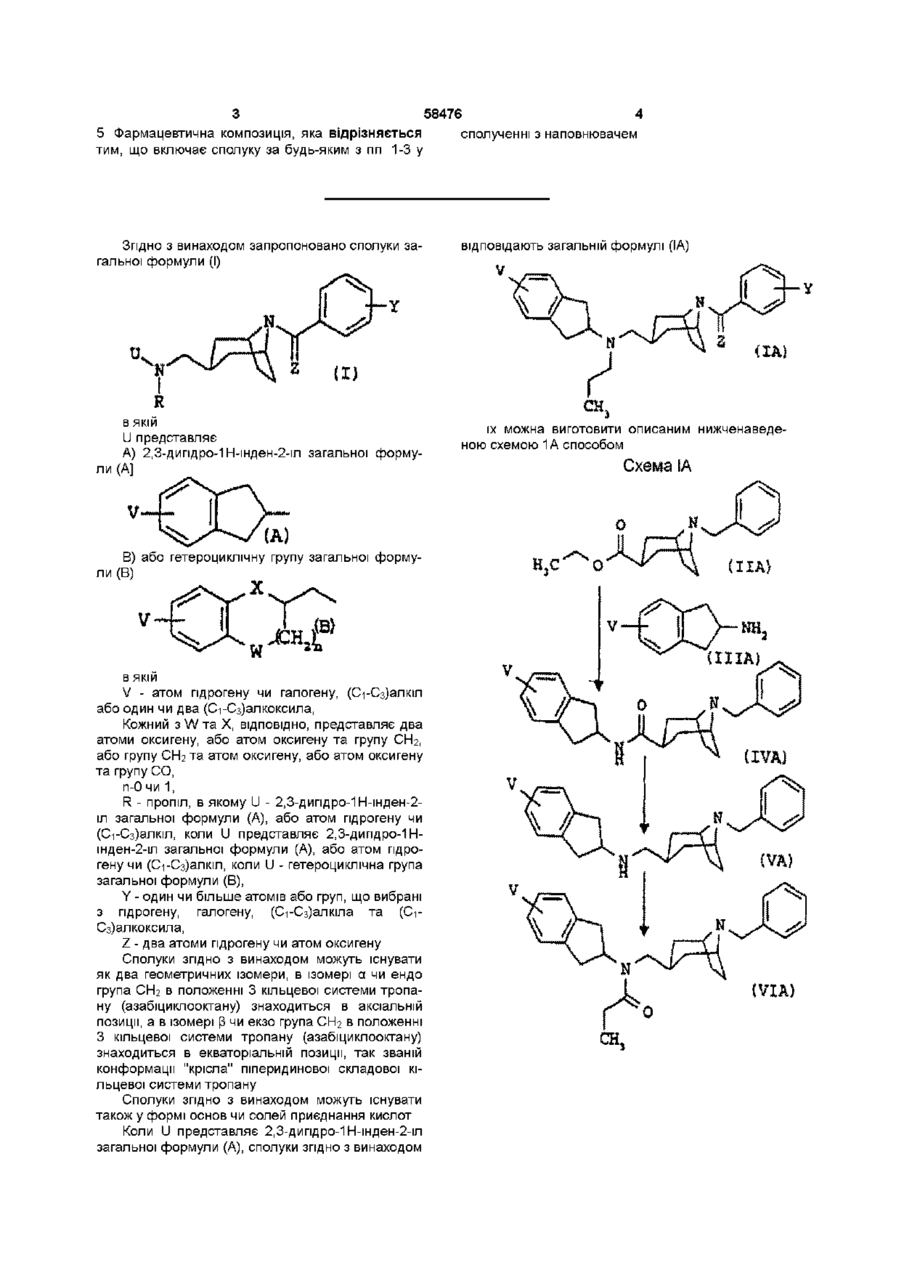
2. Сполука за п. 1, яка відрізняється тим, що відповідає загальній формулі (ІА)
, (IA)
в якій V, Y та Z визначено в п. 1.
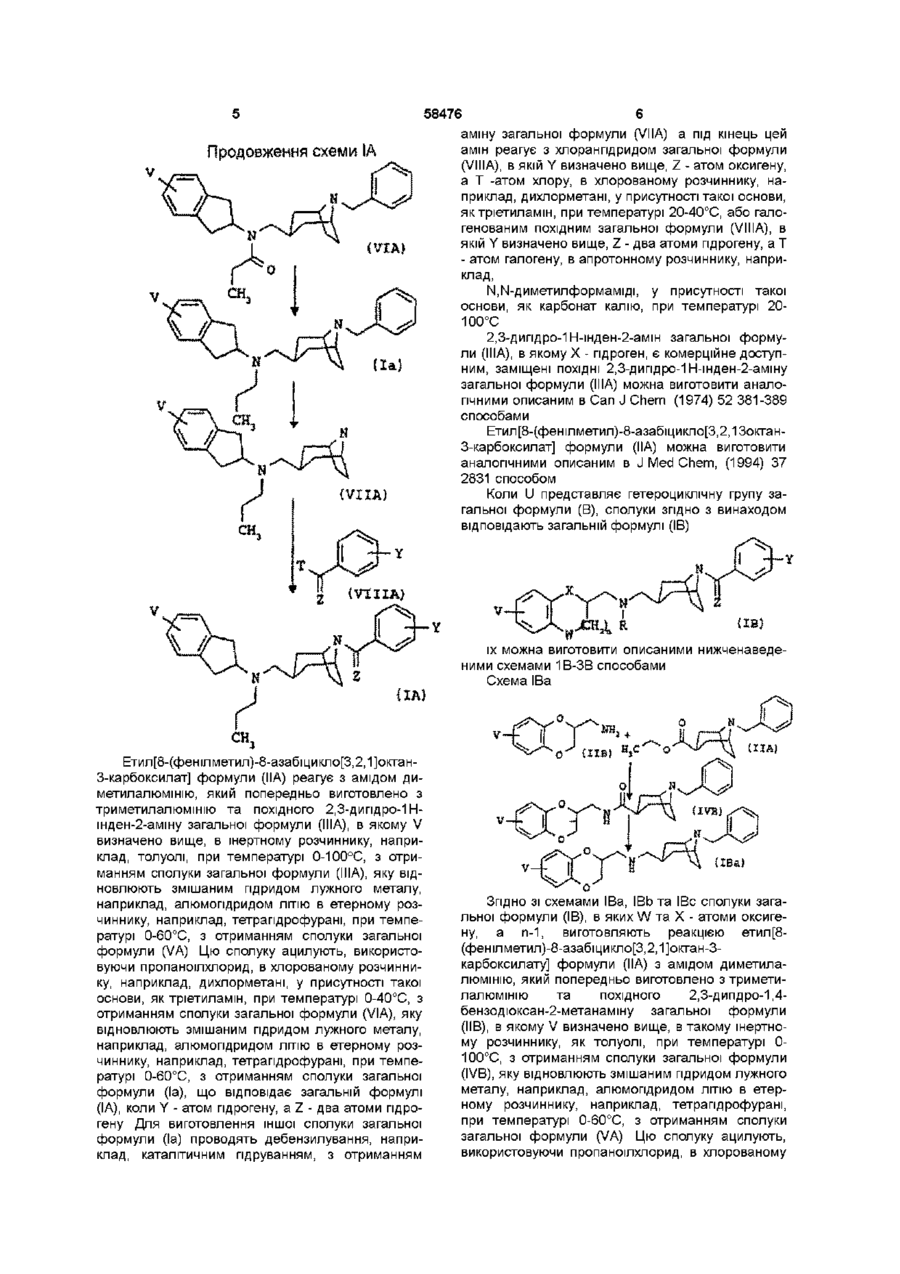
3. Сполука за п. 1, яка відрізняється тим, що відповідає загальній формулі (IВ)
, (IB)
в якій V, W, X, Y та Z визначено в п. 1.
4. Лікарський засіб, який відрізняється тим, що складається зі сполуки за будь-яким з пп. 1-3.
5. Фармацевтична композиція, яка відрізняється тим, що включає сполуку за будь-яким з пп. 1-3 у сполученні з наповнювачем.
Текст
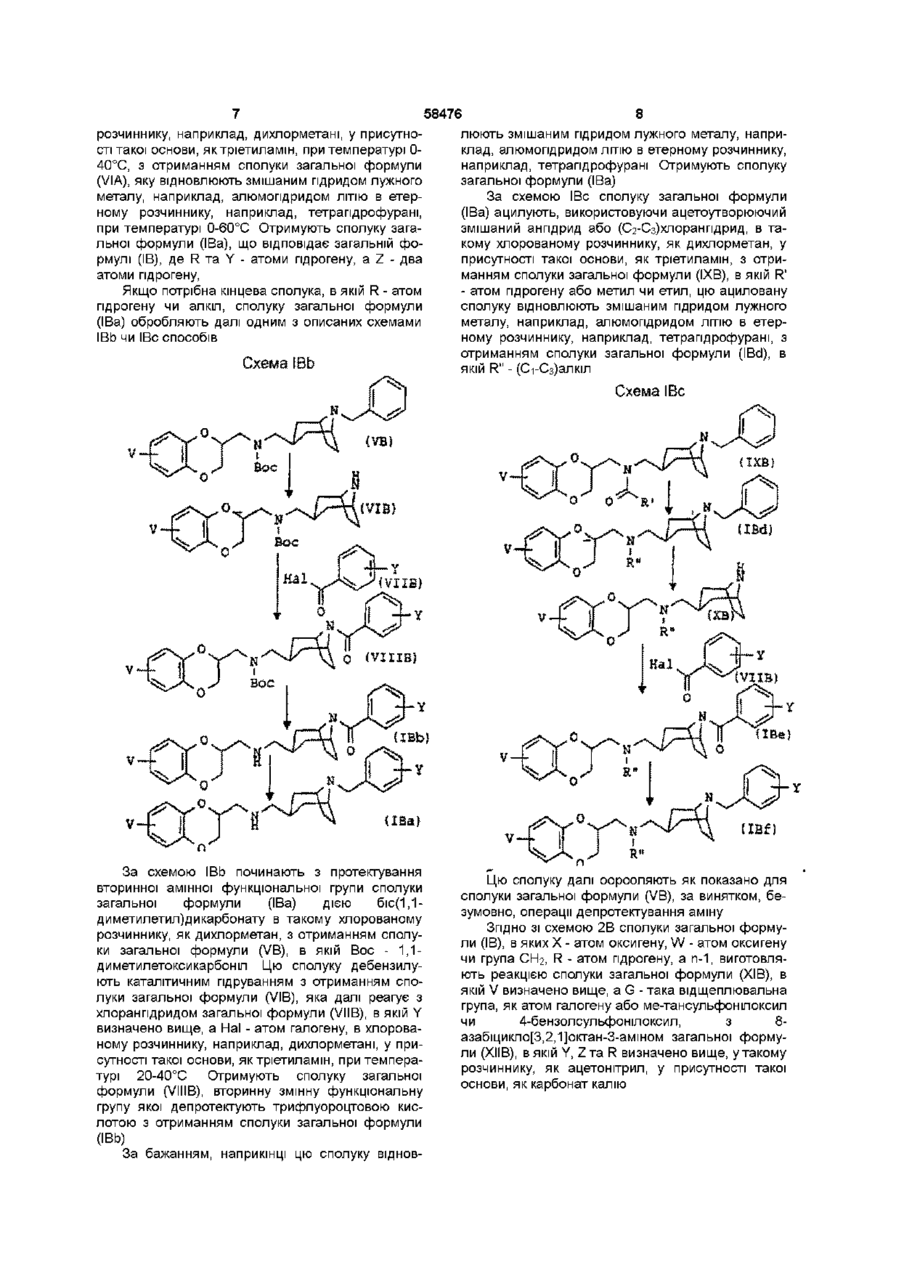
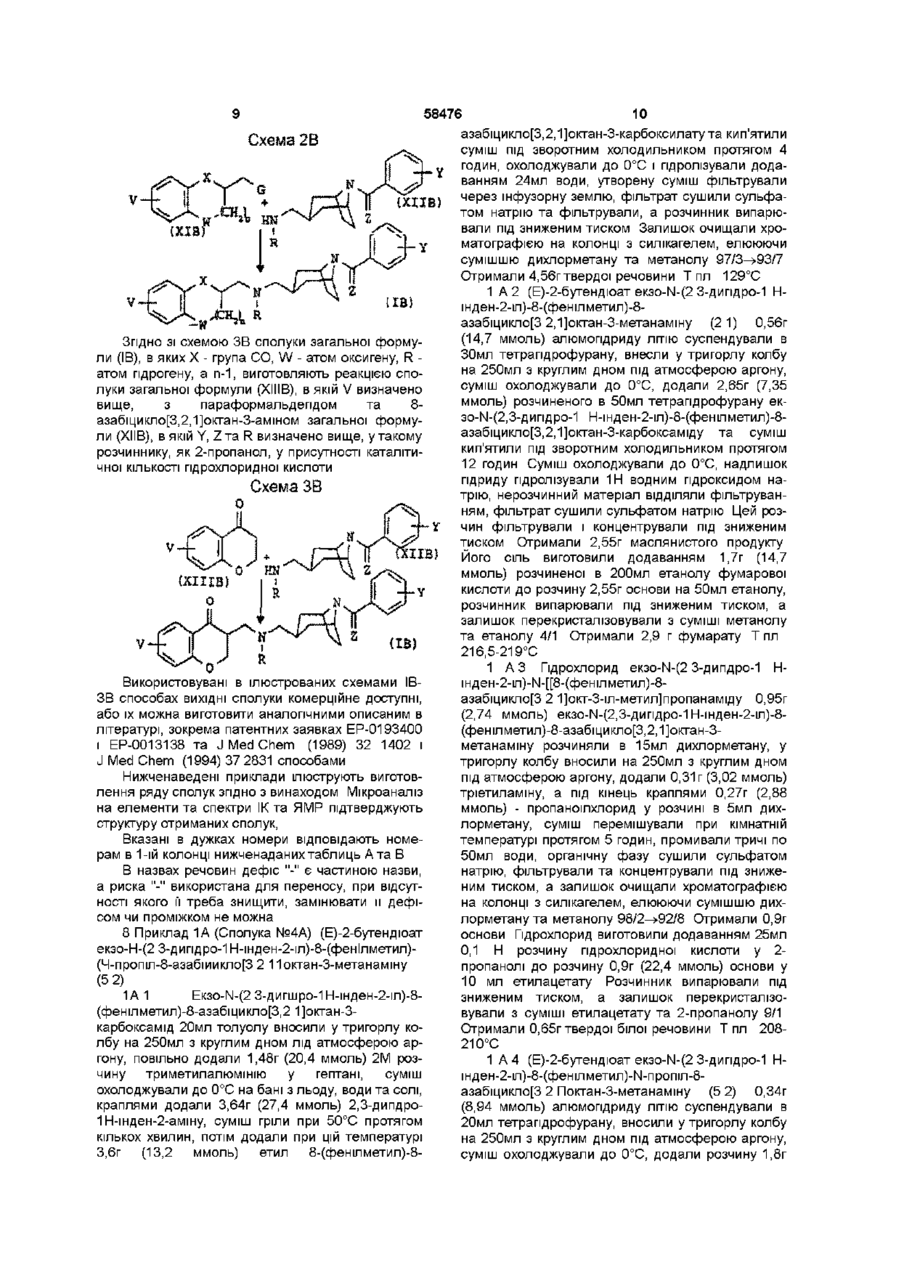
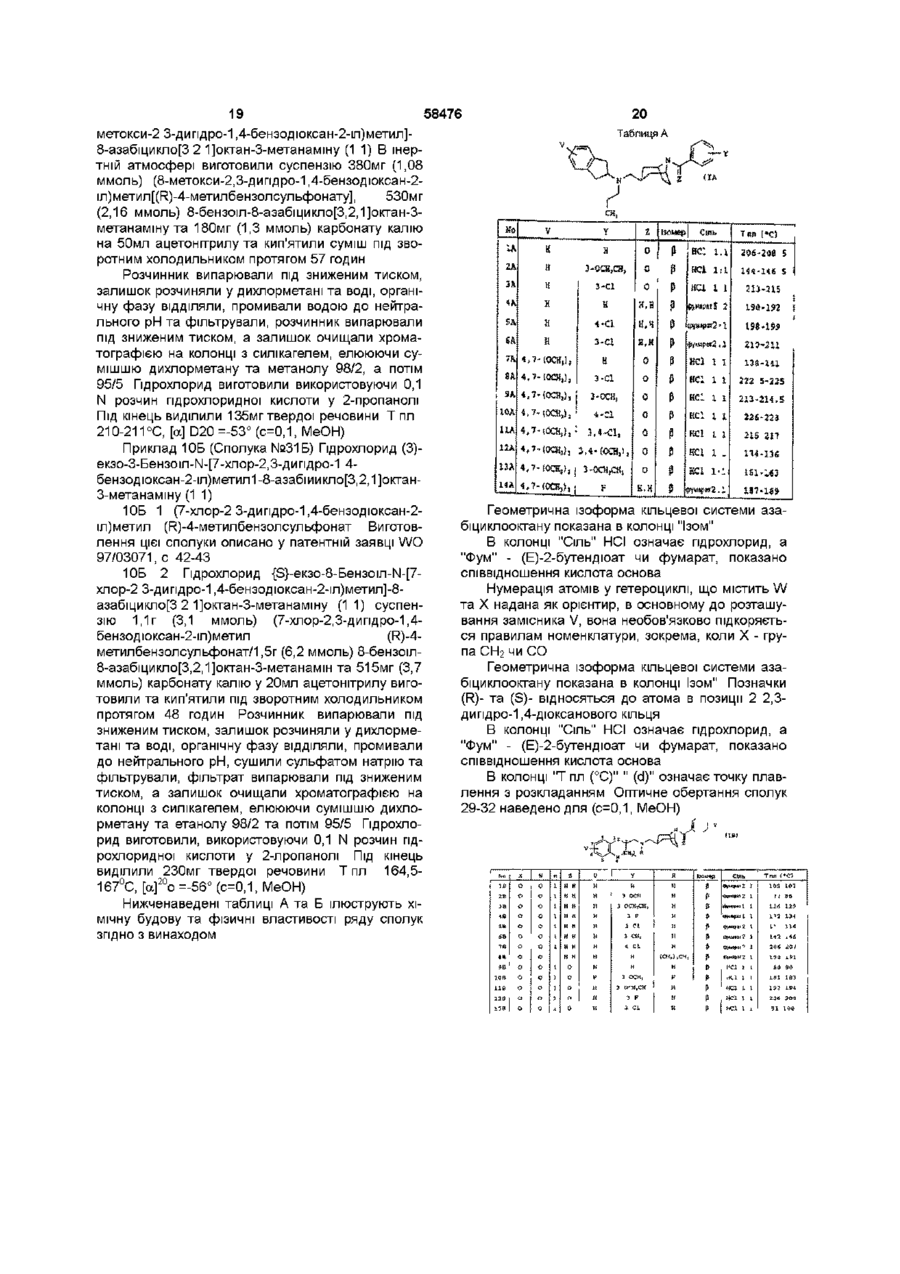
1 Сполука у формі чистого геометричного ізомеру або суміші таких ізомерів, яка відповідає загальній формулі (І) ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ ТА .(В) в якій V - атом гідрогену чи галогену, (Сі-Сз)алкіл або один чи два (Сі-Сз)алкоксили, кожний з W та X, ВІДПОВІДНО, представляє два ато ми оксигену, або атом оксигену та групу СЬЬ, або групу СЬІ2 та атом оксигену, або атом оксигену та групу СО, п - 0 чи 1, R - пропіл, коли U - 2,3-дипдро-1Н-шден-2-іл загальної формули (А), або атом гідрогену чи ( d Сз)алкіл, коли U - гетероциклічна група загальної формули (В), Y - один чи більше атомів або груп, що вибрані з гідрогену, галогену, (Сі-Сз)алкілу та ( d Сз)алкоксилу, а Z - два атоми гідрогену чи атом оксигену 2 Сполука за п 1, яка відрізняється тим, що відповідає загальній формулі (ІА) V (О л b 00 ю N в якій U представляє А) 2,3-дипдро-1Н-шден-2-іл загальної формули (А) О в якій V, Ута Z визначено в п 1 З Сполука за п 1, яка відрізняється тим, що відповідає загальній формулі (IB) В) або гетероциклічну групу загальної формули (В) в якій V, W, X, Y та Z визначено в п 1 4 Лікарський засіб, який відрізняється тим, що складається зі сполуки за будь-яким з пп 1-3 З 58476 4 5 Фармацевтична композиція, яка відрізняється сполученні з наповнювачем тим, що включає сполуку за будь-яким з пп 1-3 у Згідно З винаходом запропоновано сполуки загальної формули (І) відповідають загальній формулі (ІА) V (ІА) (І) в якій U представляє А) 2,3-дипдро-1Н-шден-2-іл загальної формули (А] їх можна виготовити описаним нижченаведеною схемою 1А способом Схема іА VВ) або гетероциклічну групу загальної формули (В) ПА) s. v—ь в якій V - атом гідрогену чи галогену, (Сі-Сз)алкіл або один чи два (Сі-Сз)алкоксила, Кожний з W та X, ВІДПОВІДНО, представляє два атоми оксигену, або атом оксигену та групу СЬЬ, або групу СЬІ2 та атом оксигену, або атом оксигену та групу СО, п-0 чи 1, R - пропіл, в якому U - 2,3-дипдро-1Н-шден-2іл загальної формули (А), або атом гідрогену чи (С-і-Сз)алкіл, коли U представляє 2,3-дипдро-1Ншден-2-іл загальної формули (А), або атом гідрогену чи (С-і-Сз)алкіл, коли U - гетероциклічна група загальної формули (В), Y - один чи більше атомів або груп, що вибрані з гідрогену, галогену, (Сі-Сз)алкіла та ( d Сз)алкоксила, Z - два атоми гідрогену чи атом оксигену Сполуки згідно з винаходом можуть існувати як два геометричних ізомери, в ізомері а чи ендо група СЬІ2 в положенні 3 кільцевої системи тропану (азабіциклооктану) знаходиться в аксіальній позиції, а в ізомері р чи екзо група СЬЬ в положенні З кільцевої системи тропану (азабіциклооктану) знаходиться в екваторіальній позиції, так званій конформації "крісла" піперидинової складової кільцевої системи тропану Сполуки згідно з винаходом можуть існувати також у формі основ чи солей приєднання кислот Коли U представляє 2,3-дипдро-1Н-шден-2-іл загальної формули (А), сполуки згідно з винаходом У-нн, (VIA) 58476 аміну загальної формули (VIIA) а під кінець цей амін реагує з хлорангідридом загальної формули (VINA), в якій Y визначено вище, Z - атом оксигену, а Т -атом хлору, в хлорованому розчиннику, наприклад, дихлорметані, у присутності такої основи, як тріетиламін, при температурі 20-40°С, або галогенованим похідним загальної формули (VINA), в якій Y визначено вище, Z - два атоми гідрогену, а Т - атом галогену, в апротонному розчиннику, наприклад, N.N-диметилформаміді, у присутності такої основи, як карбонат калію, при температурі 20100°С 2,3-дипдро-1Н-інден-2-амш загальної формули (ІІІА), в якому X - гідроген, є комерційне доступним, заміщені ПОХІДНІ 2,3-дипдро-1Н-інден-2-амшу загальної формули (ІІІА) можна виготовити аналогічними описаним в Can J Chem (1974) 52 381-389 способами Етил[8-(фенілметил)-8-азабіцикло[3,2,13октан3-карбоксилат] формули (ПА) можна виготовити аналогічними описаним в J Med Chem, (1994) 37 2831 способом Коли U представляє гетероциклічну групу загальної формули (В), сполуки згідно з винаходом відповідають загальній формулі (IB) Продовження схеми ІА {IB) (ЇМ Етил[8-(фенілметил)-8-азабіцикло[3,2,1]октан3-карбоксилат] формули (НА) реагує з амідом диметилалюмінію, який попередньо виготовлено з триметилалюмінію та похідного 2,3-дипдро-1Нінден-2-амшу загальної формули (ІІІА), в якому V визначено вище, в інертному розчиннику, наприклад, толуолі, при температурі 0-100°С, з отриманням сполуки загальної формули (ІІІА), яку відновлюють змішаним гідридом лужного металу, наприклад, алюмопдридом ЛІТІЮ В етерному розчиннику, наприклад, тетрапдрофурані, при температурі 0-60°С, з отриманням сполуки загальної формули (VA) Цю сполуку ацилують, використовуючи пропаноілхлорид, в хлорованому розчиннику, наприклад, дихлорметані, у присутності такої основи, як тріетиламін, при температурі 0-40°С, з отриманням сполуки загальної формули (VIA), яку відновлюють змішаним гідридом лужного металу, наприклад, алюмопдридом ЛІТІЮ В етерному розчиннику, наприклад, тетрапдрофурані, при температурі 0-60°С, з отриманням сполуки загальної формули (Іа), що відповідає загальній формулі (ІА), коли Y - атом гідрогену, a Z - два атоми гідрогену Для виготовлення іншої сполуки загальної формули (Іа) проводять дебензилування, наприклад, каталітичним гідруванням, з отриманням їх можна виготовити описаними нижченаведеними схемами 1В-ЗВ способами Схема ІВа Згідно ЗІ схемами ІВа, ІВЬ та ІВс сполуки загальної формули (IB), в яких W та X - атоми оксигену, а п-1, виготовляють реакцією етил[8(фенілметил)-8-азабіцикло[3,2,1]октан-3карбоксилату] формули (НА) з амідом диметилаЛЮМІНІЮ, який попередньо виготовлено з триметилалюмінію та похідного 2,3-дипдро-1,4бензодюксан-2-метанаміну загальної формули (ИВ), в якому V визначено вище, в такому інертному розчиннику, як толуолі, при температурі 0100°С, з отриманням сполуки загальної формули (IVB), яку відновлюють змішаним гідридом лужного металу, наприклад, алюмопдридом ЛІТІЮ В етерному розчиннику, наприклад, тетрапдрофурані, при температурі 0-60°С, з отриманням сполуки загальної формули (VA) Цю сполуку ацилують, використовуючи пропаноілхлорид, в хлорованому 58476 8 розчиннику, наприклад, дихлорметані, у присутнолюють змішаним гідридом лужного металу, напристі такої основи, яктріетиламш, при температурі 0клад, алюмопдридом ЛІТІЮ В етерному розчиннику, 40°С, з отриманням сполуки загальної формули наприклад, тетрапдрофурані Отримують сполуку (VIA), яку відновлюють змішаним гідридом лужного загальної формули (ІВа) металу, наприклад, алюмопдридом ЛІТІЮ В етерЗа схемою ІВс сполуку загальної формули ному розчиннику, наприклад, тетрапдрофурані, (ІВа) ацилують, використовуючи ацетоутворюючий при температурі 0-60°С Отримують сполуку загазмішаний ангідрид або (С2-Сз)хлоранпдрид, в тальної формули (ІВа), що відповідає загальній фокому хлорованому розчиннику, як дихлорметан, у рмулі (IB), де R та Y - атоми гідрогену, a Z - два присутності такої основи, як тріетиламш, з отриатоми гідрогену, манням сполуки загальної формули (ІХВ), в якій R' - атом гідрогену або метил чи етил, цю ациловану Якщо потрібна кінцева сполука, в якій R - атом сполуку відновлюють змішаним гідридом лужного гідрогену чи алкіл, сполуку загальної формули металу, наприклад, алюмопдридом ЛІТІЮ В етер(ІВа) обробляють далі одним з описаних схемами ному розчиннику, наприклад, тетрапдрофурані, з ІВЬ чи ІВс способів отриманням сполуки загальної формули (IBd), в Схема ІВЬ якій R" - (Сі-Сз)алкіл Схема ІВс 4s^-V Xі Вое VIIB) і If (ХВа) За схемою ІВЬ починають з протектування вторинної змінної функціональної групи сполуки загальної формули (ІВа) дією біс(1,1диметилетил)дикарбонату в такому хлорованому розчиннику, як дихлорметан, з отриманням сполуки загальної формули (VB), в якій Вос - 1,1диметилетоксикарбоніл Цю сполуку дебензилують каталітичним гідруванням з отриманням сполуки загальної формули (VIB), яка далі реагує з хлорангідридом загальної формули (VIIB), в якій Y визначено вище, a Hal - атом галогену, в хлорованому розчиннику, наприклад, дихлорметані, у присутності такої основи, як тріетиламш, при температурі 20-40°С Отримують сполуку загальної формули (VIIIB), вторинну змінну функціональну групу якої депротектують трифлуороцтовою кислотою з отриманням сполуки загальної формули (ІВЬ) За бажанням, наприкінці цю сполуку віднов авеї UBf) < X Цю сполуку далі оорооляють як показано для сполуки загальної формули (VB), за винятком, безумовно, операції депротектування аміну Згідно ЗІ схемою 2В сполуки загальної формули (IB), в яких X - атом оксигену, W - атом оксигену чи група СЬІ2, R - атом гідрогену, а п-1, виготовляють реакцією сполуки загальної формули (ХІВ), в якій V визначено вище, a G - така відщеплювальна група, як атом галогену або ме-тансульфонілоксил чи 4-бензолсульфонілоксил, з 8азабіцикло[3,2,1]октан-3-амшом загальної формули (ХІІВ), в якій Y, ZTa R визначено вище, у такому розчиннику, як ацетонітрил, у присутності такої основи, як карбонат калію 58476 10 азабіцикло[3,2,1]октан-3-карбоксилатута кип'ятили Схема 2В суміш під зворотним холодильником протягом 4 годин, охолоджували до 0°С і пдролізували додаванням 24мл води, утворену суміш фільтрували через інфузорну землю, фільтрат сушили сульфатом натрію та фільтрували, а розчинник випарювали під зниженим тиском Залишок очищали хроматографією на колонці з силікагелем, елююючи сумішшю дихлорметану та метанолу 97/3^93/7 Отримали 4,56г твердої речовини Т пл 129°С 1 А 2 (Е)-2-бутендюат екзо-ІЧ-(2 З-дипдро-1 Ншден-2-іл)-8-(фенілметил)-8азабіцикло[3 2,1]октан-3-метанамшу (21) 0,56г (14,7 ммоль) алюмопдриду ЛІТІЮ суспендували в Згідно ЗІ схемою ЗВ сполуки загальної формуЗОмл тетрапдрофурану, внесли у тригорлу колбу ли (IB), в яких X - група CO, W - атом оксигену, R на 250мл з круглим дном під атмосферою аргону, атом гідрогену, а п-1, виготовляють реакцією спосуміш охолоджували до 0°С, додали 2,65г (7,35 луки загальної формули (ХІІІВ), в якій V визначено ммоль) розчиненого в 50мл тетрапдрофурану еквище, з параформальдегідом та 830-N-(2,З-дипдро-1 Н-шден-2-іл)-8-(фенілметил)-8азабіцикло[3,2,1]октан-3-амшом загальної формуазабіцикло[3,2,1]октан-3-карбоксаміду та суміш ли (ХІІВ), в якій Y, ZTa R визначено вище, у такому кип'ятили під зворотним холодильником протягом розчиннику, як 2-пропанол, у присутності каталіти12 годин Суміш охолоджували до 0°С, надлишок чної КІЛЬКОСТІ пдрохлоридної кислоти гідриду пдролізували 1Н водним гідроксидом наСхема ЗВ трію, нерозчинний матеріал ВІДДІЛЯЛИ фільтруван0 ням, фільтрат сушили сульфатом натрію Цей розчин фільтрували і концентрували під зниженим тиском Отримали 2,55г маслянистого продукту Його сіль виготовили додаванням 1,7г (14,7 ммоль) розчиненої в 200мл етанолу фумарової кислоти до розчину 2,55г основи на 50мл етанолу, розчинник випарювали під зниженим тиском, а залишок перекристалізовували з суміші метанолу та етанолу 4/1 Отримали 2,9 г фумарату Т пл 216,5-219°С (IB) Використовувані в ілюстрованих схемами ІВЗВ способах ВИХІДНІ сполуки комерційне доступні, або їх можна виготовити аналогічними описаним в літературі, зокрема патентних заявках ЕР-0193400 і ЕР-0013138 та J Med Chem (1989) 32 1402 і J Med Chem (1994) 37 2831 способами Нижченаведені приклади ілюструють виготовлення ряду сполук згідно з винаходом Мікроаналіз на елементи та спектри ІК та ЯМР підтверджують структуру отриманих сполук, Вказані в дужках номери відповідають номерам в 1-ій колонці нижченаданих таблиць А та В В назвах речовин дефіс "-" є частиною назви, а риска "-" використана для переносу, при відсутності якого її треба знищити, замінювати и дефісом чи проміжком не можна 8 Приклад 1А (Сполука №4А) (Е)-2-бутендюат екзо-Н-(2 З-дипдро-1 Н-шден-2-іл)-8-(фенІлметил)(Ч-пропіл-8-азабшикло[3 2 11октан-3-метанамшу (5 2) 1А 1 EK30-N-(2 З-дигшро-1 Н-шден-2-іл)-8(фенілметил)-8-азабіцикло[3,2 1]октан-3карбоксамід 20мл толуолу вносили у тригорлу колбу на 250мл з круглим дном лід атмосферою аргону, повільно додали 1,48г (20,4 ммоль) 2М розчину триметилалюмінію у гептані, суміш охолоджували до 0°С на бані з льоду, води та солі, краплями додали 3,64г (27,4 ммоль) 2,3-дипдро1Н-шден-2-амшу, суміш гріли при 50°С протягом кількох хвилин, потім додали при цій температурі 3,6г (13,2 ммоль) етил 8-(фенілметил)-8 1 A 3 Гідрохлорид екзо-ІЧ-(2 З-дипдро-1 Нінден-2-іл)-І\І-[[8-(фенілметил)-8азабіцикло[3 2 1]окт-3-іл-метил]пропанаміду 0,95г (2,74 ммоль) екзо-г\І-(2,3-дипдро-1Н-шден-2-іл)-8(фенілметил)-8-азабіцикло[3,2,1]октан-3метанамшу розчиняли в 15мл дихлорметану, у тригорлу колбу вносили на 250мл з круглим дном під атмосферою аргону, додали 0,31г (3,02 ммоль) тріетиламшу, а під кінець краплями 0,27г (2,88 ммоль) - пропаноілхлорид у розчині в 5мл дихлорметану, суміш перемішували при кімнатній температурі протягом 5 годин, промивали тричі по 50мл води, органічну фазу сушили сульфатом натрію, фільтрували та концентрували під зниженим тиском, а залишок очищали хроматографією на колонці з силікагелем, елююючи сумішшю дихлорметану та метанолу 98/2^92/8 Отримали 0,9г основи Гідрохлорид виготовили додаванням 25мл 0,1 Н розчину пдрохлоридної кислоти у 2пропанолі до розчину 0,9г (22,4 ммоль) основи у 10 мл етилацетату Розчинник випарювали під зниженим тиском, а залишок перекристалізовували з суміші етилацетату та 2-пропанолу 9/1 Отримали 0,65г твердої білої речовини Т пл 208210°С 1 А 4 (Е)-2-бутендюат екзо-ІЧ-(2 З-дипдро-1 Нінден-2-іл)-8-(фенілметил)-І\І-пропіл-8азабіцикло[3 2 Поктан-3-метанаміну (5 2) 0,34г (8,94 ммоль) алюмопдриду ЛІТІЮ суспендували в 20мл тетрапдрофурану, вносили у тригорлу колбу на 250мл з круглим дном під атмосферою аргону, суміш охолоджували до 0°С, додали розчину 1,8г 12 11 58476 (4,47 ммоль) екзо-І\І-(2,З-дипдро-1 Н-інден-2-іл)-І\Іпропіл-8-азабіцикло[3,2,1]октан-3-метанамшу роз[[8-(фенілметил)-8-азабіцикло[3,2,1]окт-3чиняли в 18мл дихлорметану, вносили під атмосіл)метил]пропанаміду в 40мл тетрагідрофурану та ферою аргону утригорлу колбу на 50мл з круглим суміш гріли під зворотним холодильником протядном, додали 0,51г (5,03 ммоль) тріетиламшу, погом 6 годин Суміш охолоджували до 0°С, надлитім повільно додавали 0,88г (5,02 ммоль) 3шок гідриду пдролізували 1 Н водним гідроксидом хлорбензоілхлориду, та суміш перемішували при натрію, нерозчинний матеріал ВІДДІЛЯЛИ фільтрукімнатній температурі протягом 24 годин Суміш ванням, фільтрат сушили сульфатом натрію і розвиливали у ЮОмл води та екстрагували етилацечин фільтрували та концентрували під зниженим татом, органічну фазу ВІДДІЛЯЛИ, промивали вотиском, отримавши 1,6г маслянистого продукту дою, сушили сульфатом натрію та фільтрували, фільтрат концентрували під зниженим тиском, а Дифумарат виготовили додаванням розчину залишок очищали хроматографією на колонці з 0,96г (8,24 ммоль) фумарової кислоти в 250мл силікагелем, елююючи 99/1^98/2 сумішшю дихетанолу до розчину 1,6г (4,12 ммоль) основи у лорметану та метанолу ЮОмл етанолу Розчинник випарювали під зниженим тиском, а твердий залишок перекристалізову0,2г основи отримали, пдрохлорид, який виговали з 95/5 суміші етанолу та метанолу товили додаванням 5мл 0,1 N розчину пдроПісля фільтрування та сушки отримали 1,3г хлоридної кислоти у 2-пропанол до розчину 0,2г фумарату (5 2) Т пл 190-192°С (0,42 ммоль) основи у Юмл етилацетату, розчинник випарювали під зниженим тиском, а залишок Приклад 2А (Сполука №5А) (Е)-2-бутендюат перекристалізовували з суміші етилацетату та 2екзо-8-[(4-хлорфеніл)метил]-І\І-(2 З-дипдро-1 Нпропанолу 95/5 Отримали 0,1 г твердої білої речоінден-2-іл)-г\І-пропіл-8-азабіцикло[3 2 1]октан-3вини, Тпл 213-215°С метанамшу (2 1) 2А 1 Екзо-І\І-{2,3-дипдро-1 Н-інден-2-іл)-І\ІПриклад 4А (Сполука № 14А) екзо-ІЧ-(4 7пропіл-8-азабіцикло[3 2 Поктан-3-метанамін ВигоДиметокси-2 З-дипдро-1 Н-Інден-2-іл)-8товили суспензію 1,75г (4,5 ммоль) екзо-І\І-(2,3(фенілметил)-І\І-пропіл-8-азабіцикло[3,2 11 октан-3дипдро-1Н-інден-2-іл)-8-(фенілметил)-г\І-пропіл-8метанамш (Е)-2-бутендюат(2 1), азабіцикло[3,2,1]октан-3-метанамшу у 40мл ета4А 1 екзо-ІЧ-(4 7-диметокси-2 З-дипдро-1 Ннолу, додали 0,5г 10% паладію на вугіллі та прошден-2-іл)-8-(фенілметил)-8водили гідрування в апараті Парра, при тиску приазабіцикло[3,2 Поктан-3-карбоксамід Описаним в близно 0,32МПа і 45°С Після охолодження до прикладі 1А 1 способом, починаючи з 4 64г (24 кімнатної температури, каталізатор ВІДДІЛЯЛИ фіммоль) 4,7-диметокси-2,З-дипдро-1 Н-інден-2-амшу льтруванням, фільтрат концентрували під знижета 3,8г (13,9 ммоль) етил[8-(фенілметил)-8ним тиском, а маслянистий залишок переносили у азабіцикло[3,2,1]октан-3-карбоксилату], отримали водний розчин аміаку та екстрагували діетиловим 4,1г твердої речовини, яку використовували без етером Органічну фазу промивали водою, сушили подальшої очистки на наступному етапі сульфатом натрію, фільтрували та концентрували 4А 2 екзо-ІЧ-(4 7-Диметокси-2 З-дипдро-1 Нпід зниженим тиском Отримали 1,1г маслянистого шден-2-іл)-8-(фенілметил)-8жовтого залишку, який використовували без подаазабіцикло[3 2 11октан-3-метанамш Використовульшої очистки на наступному етапі 2А 2 Е)ючи описаний в прикладі 1А 2 спосіб, починаючи з азабіцикло[3,2,1]октан-3-метанамшу (2 1) 2 94г (9,8 4,85г (11,5 ммоль) екзо-І\І-(4,7-диметокси-2,3ммоль) екзо-г\І-(2,3-дипдро-1Н-шден-2-іл)-Ндипдро-1Н-шден-2-іл)-8-(фенілметил)-8пропіл-8-азабіцикло[3,2,1]октан-3-метанамшу розазабіцикло[3,2,1]октан-3-карбоксаміду та 0,88г (23 чиняли в 45мл N.N-диметилформаміду, утригорлу ммоль) алюмопдриду ЛІТІЮ, отримали 4,6г масляколбу на ЮОмл з круглим дном під атмосферою нистого продукт, який використовували без подааргону вносили 2,2г (10,7 ммоль) 1-бромметил-4льшої очистки на наступному етапі хлорбензолу, 2,7г (19,6 ммоль) гідрокарбонату 4А 3 екзо-ІЧ-(4 7-Диметокси-2 3-дипдрокалію та 0,1г йодиду натрію, а потім суміш гріли 1Н-інден-2-іл)-І\І-[[8-(Фенілметил)-8при 60°С протягом 3 годин Суміші давали охолоазабіцикло[3 2 1]окт-3-іл]метил]пропанамід Виконути та виливали у 150мл льодяної води і екстраристовуючи описаний в прикладі 1АЗ спосіб, погували етилацетатом Органічну фазу промивали чинаючи з 4,6г (11,3 ммоль) екзо-І\І-(4,7водою, сушили сульфатом натрію та фільтрували, диметокси-2,3-дипдро-1Н-шден-2-іл)-8фільтрат концентрували під зниженим тиском, а (фенілметил)-8-азабіцикло[3,2,1]октан-3залишок очищали хроматографією на колонці з метанамшу, 1,3г (12,8 ммоль) тріетиламшу та 1,13 силікагелем, елююючи 100/0^90/10 сумішшю ди(12,2 ммоль) пропаноілхлорид, та після очистки хлорметану та метанолу Отримали 4,0г основи, хроматографією на колонці з силікагелем, елюююфумаратякої виготовили додаванням розчину 2,1г чи сумішшю дихлорметану та метанолу98/2^92/8, (18,8 ммоль) фумарової кислоти в 50мл етанолу отримали 4,7г маслянистого продукту, який викодо розчину 4,0г (9,4 ммоль) основи у 100 мл етаристовували без подальшої очистки на наступнонолу, розчинник випарювали під зниженим тиском, му етапі а залишок перекристалізовували з етанолу Отримали 2,62г твердої білої речовини Т пл 1984А 4 (Е)-2-бутендюат екзо-ІЧ-(4/7-диметокси-2 199°С З-дипдро-1 Н-шден-2-іл)-8-(фенілметил)-Н-пропіл8-азабіцикло[3 2 1]октан-3-метанамшу(2 1) Використовуючи описаний в прикладі 1А4 спосіб, поПриклад ЗА (Сполука № ЗА) Пдрохлорид екзочинаючи з 4,7г (10,1 ммоль) екзо-І\І-(4,78-(3-хлорбензоіл)-І\І-(2 З-дипдро-1 Н-інден-2-іл)-І\Ідиметокси-2,3-дипдро-1Н-шден-2-іл)-г\І-[[8пропіл-8-азабіцикло[3 2,1]октан-3-метанамшу 0 75г (фенілметил)-8-азабіцикло[3,2,1]окт-3(2,51 ммоль) екзо-І\І-(2,З-дипдро-1 Н-інден-2-іл)-І\І 14 13 58476 іл]метил]пропанаміду і 0,78г (20,6 ммоль) алюмогііл)метил1-8-(Фенілметил)-8-азабіцикло[3 2 1]октандриду ЛІТІЮ, та після очистки хроматографією на 3-метанамшу(2 1) колонці з силікагелем, елююючи сумішшю дихло1В 1 екзо-ІЧ-[(2 З-дипдро-1,4-бензодюксан-2рметану та метанолу 96/4^88/12, отримали 4,5г іл)метил1-8-(Фенілметил)-8~ сполуки у формі жовтого масла 1,0г (2,23 ммоль) азабіцикло[3 21Іоктан-3-карбоксамід 20 мл 2М цього продукту розчиняли в ЮОмл етанолу, додарозчину триметилалюмінію у толуолі вносили у ли розчин 0,52г (4,46 ммоль) фумарової кислоти В тригорлу колбу на 500мл з круглим дном під атмоЮОмл етанолу, розчинник випарювали під знижесферою азоту, суміш охолоджували до 0°С, доданим тиском, а твердий залишок перекристалізовули краплями розчин 7,75г (39,7 ммоль) 2,3-дипдровали з етанолу Отримали 0,68г фумарату (2 1) 1,4-дюксан-2-метанамш в 150мл толуолу, суміш Тпл 187-189°С, нагрівали до 50°С, потім додали при цій температурі розчин 6,9г (25,1 ммоль) етил 8-(фенілметил)Приклад 5А (Сполука №13А) Гідрохлорид ек8-азабіцикло[3,2,1]октан-3-карбоксилату в 35мл 30-N-(4 7-диметокси-2 З-дипдро-1 Н-шден-2-іл)-8толуолу та кип'ятили суміш під зворотним холоди(3-етоксибензоіл)-І\І-пропіл-8льником протягом 8 годин, охолоджували до 0°С азабіцикло[3 2 11октан-3-метанамшу та пдролізували додаванням 50мл води, фільтру5А 1 екзо-І\І-("4 7-Диметокси-2 3-дипдровали через інфузорну землю, фільтрат сушили 1 Нчнден-2чл)-г\І-пропт-8-азаб|цикло[3 2,1]октан-3сульфатом натрію, розчин фільтрували, а розчинметанамш Використовуючи описаний в прикладі ник випарювали під зниженим тиском Залишок 2А 1 спосіб, починаючи з 4,95г (11 ммоль) екзо-Nочищали хроматографією на колонці з силікаге(4,7-диметокси-2,З-дипдро-1 Н-шден-2-іл)-8лем, елююючи сумішшю дихлорметану та метано(фенілметил)-г\І-пропіл-8-азабіцикло[3,2,1]октан-3лу 95/5 Отримали 8,4г сполуки у формі масла метанамшу та 1,2г 10% паладію на вугіллі, отри мали 3,4г маслянистої сполуки, яку без подальшої очистки використовували на наступному етапі 5А 2 Гідрохлорид екзо-ІЧ-(4 7-Диметокси-2 3дипдро-1 Н-інден-2-іл)-8-(3-етоксибензоіл)-І\Іпропіл-8-азабіцикло[3 2 ]октан-3-метанамшу Використовуючи описаний в прикладі ЗА спосіб, починаючи з 1,1г (3,07 ммоль) екзо-І\І-(4,7-диметокси2,3-дипдро-1Н-шден-2-іл)-г\І-пропіл-8азабіцикло[3,2,1]октан-3-метанамш, 0,62г (6,14 ммоль) тріетиламін та 1,13г (6,12 ммоль) 3етоксибензоїл хлорид, та після очистки хроматографією на колонці з силікагелем, елююючи 99/1^96/4 сумішшю дихлорметану та метанолу Отримали 1,43г сполуки як масло Гідрохлорид виготовили додаванням 30мл О У розчину пдрохлоридної кислоти у 2-пропанолі до розчину 1,43г (2,82 ммоль) основи у ЗОмл етанолу, розчинник випарювали під зниженим тиском, а твердий залишок перекристалізовували з суміші етилацетату та етанолу9/1 Отримали 0,56г твердої білої речовини Тпл 161-168°С Приклад 6А (Сполука №12А) Гідрохлорид екзо-8-(3,4-диметоксибензоіл)-І\І-(4 7-диметокси-2 3дипдро-1 Н-шден-2-іл)-Н-пропіл-8азабіцикло[3 2 1]октан-3-метанамшу Використовуючи описаний в прикладі ЗА спосіб, починаючи з 1,25г (3,49 ммоль) екзо-І\І-(4,7-диметокси-2,3дипдро-1 Н-1 -іден-2-іл)-І\І-пропт-8азаб|цикло[3,2,1]октан-3-метанам1ну, 0,71г (6,98 ммоль) тріетиламшу та 1,4г (6,96 ммоль) 3,4диметоксибензоілхлориду, та після очистки хроматографією на колонці з силікагелем, елююючи сумішшю дихлорметану та метанолу 99/1^96,5/3,5, отримали 1,5г сполуки у формі жовте масла Гідрохлорид виготовили додаванням ЗОмл 0 1 Н розчину пдрохлоридної кислоти у 2пропанолі до розчину 1,5г (2,87 ммоль) основи у ЗОмл етанолу, розчинник випарювали під зниженим тиском, а твердий залишок перекристалізовували з суміші етилацетату та етанолу 9/1 Отримали 1,12г твердої білої речовини Тпл 134136°С 13 Приклад 1Б (Сполука №1Б) (Е)-2бутендюат екзо-ІЧ-[(2 З-дипдро-1 4-бензодюксан-2 1Б 2 (Е)-2-бутендюат екзо-ІЧ-[(2 З-дипдро-1,4бензодюксан-2-іл)метил]-8-(фенілметил)-8азабіцикло[3 2 1]октан-3-метанамшу ((2 1) 5г (131 ммоль) суспензії алюмогідриду ЛІТІЮ В 50МЛ тетрапдрофурану вносили у тригорлу колбу на 1л з круглим дном під атмосферою азоту, суміш охолоджували до 0°С, додали розчин 8,4г (21,4 ммоль) екзо-І\І-[(2, З-дипдро-1,4-бензод10ксан-2-т)метил]8-(фенілметил)-8-азабіцикло[3,2,1]октан-3карбоксаміду в 420мл тетрапдрофурану та кип'ятили суміш під зворотним холодильником протягом 15 годин, охолоджували до 0°С, надлишок гідриду пдролізували 1Н воднимгідроксидом натрію, нерозчинний матеріал ВІДДІЛЯЛИ фільтруванням, а фільтрат сушили сульфатом натрію та концентрували під зниженим тиском Отримали 7,3 г основи у масла формі До 2,9г (7,66 ммоль) цього продукту додали розчин 1,8г (15,5 ммоль) фумарової кислоти в етанолі, розчинник випарювали, а залишок перекристалізовували з 2-пропанолу та потім з етанолу Отримали 1,3г твердої білої речовини, Тпл 105-107°С Приклад 2Б (Сполука № 15Б) Гідрохлорид ек30-N-[(2 З-дипдро-1 4-бензодюксан-2-іл)метил]-8(4-метоксибензоІл)-8-азабіцикпо[3 2,1]октан-3метанамшу(1 1) 2Б 1 1 1-Диметилетил[екзо-[(2 З-дипдро-1,4бензодюксан-2-іл)метил1[[8-(фенілметил)-8азабіцикло[3 2 1]окт-3-іл1метил]карбам ат] Розчин 7,3г (193 ммоль) екзо-ІЧ-[(2, З-дипдро-1,4сег 'zoflioKcaH-2-іл) метил]-8-(фенілметил)-8азабіцикло[3,2,1]октан-3-метанамш в 18мл дихлорметану вносили у тригорлу колбу з круглим дном під атмосферою азоту, додали краплями розчин 4,6г (21 ммоль) біс(1,1диметилетил)пдрокарбонату в 18мл дихлорметану і перемішували суміш при кімнатній температурі протягом 24 годин Розчинник випарювали під зниженим тиском, залишок розчиняли в ЮОмл діетилового етеру, розчин промивали водою, сушили сульфатом натрію та фільтрували, а фільтрат концентрували під зниженим тиском Отримали 8,8г сирого продукту, який очищали хроматографією на колонці з силікагелем, елююю 16 15 58476 чи сумішшю дихлорметану та метанолу 92,5/7,5 наючи з 3,5г (9 ммоль) 1,1-диметилетил[екзо-[(2,3Отримали 7,7г сполуки у формі масла дипдро-1,4-бензод юксан-2-іл)метил](8азабіцикло[3,2,1]окт-3-ілметил)карбамату] та 1,57г 2Б 2 1 1-Диметилетил[екзо-[(2 З-дипдро-1 4(99 ммоль) 3-флуорбензоілхлориду, у присутності бензодюксан-2-іл)метил](8-азабіцикло-[3 2 1]окт-3каталітичної КІЛЬКОСТІ йодиду калію отримали 2,7г ілметил)карбамат] Виготовили розчин 7,4г (15,45 маслянистого продукту, який використовували без ммоль) 1,1-диметилетил [екзо-((2,З-дипдро-1,4подальшої очистки на наступному етапі бензодюксан-2-іл)метил][[-(фенілметил)-8азабіцикло[3,2,1]окт-3-іл]метил]карбамату] у 240мл ЗБ 2 Пдрохлорид екзо-ІЧ-[(2 З-дипдро-1,4етанолу, додали 3,5г 10% паладію на вугіллі та бензодюксан-2-іл)метил]-8-О-флуорбензоіл)проводили в апараті Парра гідрування при 35°С і азабіцикло[3 2 1]октан-3-метанамшу (1 1) тиску О.ЗОМПа Після охолодження до кімнатної Використовуючи описаний в прикладі 2Б 4 температури, каталізатор ВІДДІЛЯЛИ фільтруванспосіб, починаючи з 2,7г (5,28 ммоль) 1,1ням, а фільтрат концентрували під зниженим тисдиметилетил[екзо-[(2, З-дипдро-1,4-бензод юксан-2ком Отримали 5,23г маслянистого залишку, який іл)метил][[8-(3-флуорбензоіл)-8використовували без подальшої очистки на настуазабіцикло[3,2,1]окт-3-іл]метил]карбамату], та піспному етапі ля очистки хроматографією на колонці з силікагелем, елююючи сумішшю дихлорметану та метано2Б 3 1 1-Диметилетил[екзо-[(2 З-дипдро-1 4лу 36,5/3,5, отримали 1,6г сполуки у формі основи бензодюксан-2-іл)метил][[8-(4-метоксибензоіл)-8Пдрохлорид виготовили обробкою 0,5г основи 0,1 азабіцикло[3 2,1]окт-3-іл]метил]карбамат] 2г (5, 15 N розчином пдрохлоридної кислоти у 2-пропанолі, ммоль) 1,1-диметил [етил [екзо-[(2,З-дипдро-1,4розчинник випарювали, а залишок перекристалібензойюЗсап-2-іл)метил](8-азабіцикло[3,2,1]окт-3зовували з етилацетату Під кінець виділили 0,4г ілметил)карбамату], 52мл N.N-диметилформаміду твердої білої речовини Т пл 206-209°С та 0,71г (5, ммоль) карбонату калію вносили під атмосферою азоту у тригорлу колбу на 250мл з Приклад 4Б (Сполука №4Б) (Е)-2-бутендюат круглим дном, суміш нагрівали до 50°С, додали 1г екзо-ІЧ-[(2 З-дипдро-1 4-бензодюксан-2-іл)метил](5,66 ммоль) 4-метоксибензоіл хлорид та перемі8-(3-флуорфеніл)-8-азабіцикло[3,2 1]октан-3шували суміш при 50°С протягом 10 годин Розметанамшу (1 1) Розчин 0,25г (6,6 ммоль) алюмочинник випарювали під зниженим тиском, до запдриду ЛІТІЮ, Юмл тетрапдрофурану та 1г (2,4 лишку додали 50мл води та ЗООмл етилацетату, ммоль) екзо-І\І-[(2, З-дипдро-1,4-бензод юксан-2-іл) органічну фазу ВІДДІЛЯЛИ, промивали водою, суметил]-8-(3-флуорбензоіл)-9шили сульфатом натрію та фільтрували, фільтрат азабіцикло[3,2,1]октан-3-метанамшу в 60мл тетраконцентрували під зниженим тиском, а залишок пдрофурану вносили під азотом у тригорлу колбу очищали хроматографією на колонці з силікагена 250мл з круглим дном та перемішували суміш лем, елююючи сумішшю дихлорметану та метанопри температурі кипіння протягом 2 годин, а потім лу 92/8 Отримали 2,5г сполуки, яку використовупри кімнатній температурі протягом 24 годин Сували без подальшої очистки на наступному етапі міш охолоджували до 0°С, надлишок гідриду пдролізували 1 Н водним гідроксидом натрію, нероз2Б 4 Пдрохлорид екзо-І\І-[(2, З-дипдро-1,4чинний матеріал ВІДДІЛЯЛИ фільтруванням, бензодюксан-2-іл)метил]-8-(4-метиксобензоіл)-8фільтрат сушили сульфатом натрію, розчин фільазабіцикло[3 2 1]октан-3-метанамшу (1 1) 2 5г (48 трували, фільтрат концентрували під зниженим ммоль) 1 1-диметилетилІекзо-[(2,З-дипдро-1,4тиском, а залишок очищали хроматографією на бензодюксан-2-іл)метил][[8-(4-метоксибензоіл)-8колонці з силікагелем, елююючи сумішшю дихлоазабіцикло[3,2,1]окт-3-іл]метил]карбамату], 25мл рметану та метанолу 93/7, Отримали 0,6г основи дихлорметану та 25мл трифлуороцтової кислоти у, який розчиняли в 5мл етанолу, 0,35г (3 ммоль) вносили у колбу на ЮОмл з круглим дном та кип'яфумарової кислоти додали та продукт залишали тили суміш під зворотним холодильником протякристалізуватися при охолодженні Отримали 0,2г гом 8 годин фумарату Т пл 132-134°С Суміш охолоджували, додали краплями ЗОмл 10 Н водного розчину гідроксиду натрію, водну Приклад 5Б (Сполука № 8Б) (Е)-2фазу ВІДДІЛЯЛИ та екстрагували дихлорметаном, бутендюатекзо-N-C (2 З-дипдро-1 4-бензодюксанорганічну фазу промивали водою, сушили суль2-іл)метил]-8-(фенілметил)-І\І-пропіл-8фатом натрію та фільтрували, фільтрат концентазабіцикло[3 2 1]октан-3-метанамшу (2 1) рували під зниженим тиском, а залишок очищали 5Б 1 екзо-ІЧ-[(2 З-дипдро-1,4-бензодюксан-2хроматографією на колонці з силікагелем, елюююіл)метил]-І\І-[[8-(фенілметил)-8чи сумішшю дихлорметану та метанолу 96/4 азабіцикло[3 2 1]окт-3-іл]метил]пропанамід Розчин Отримали 0,85г основи, яку перетворили у пдроЗг (7,9 ммоль) екзо-І\І-[(2, З-дипдро-1,4хлорид додаванням насиченого газуватим пдробензодюксан-2-іл)метил]-8-(фенілметил)-8хлоридом діетилового етеру Отримали 0,45г твеазабіцикло[3 2 1]октан-3-метанамшу, ЮОмл дихрдої білої речовини Т пл 93-110°С лорметану та 0,75г (8,7 ммоль) пропаноілхлориду в Юмл дихлорметану вносили утригорлу колбу на Приклад ЗБ (Сполука №12Б) Пдрохлорид ек250мл з круглим дном та перемішували суміш при 30-N-[(2, З-дипдро-1,4-бензод юксан-2-іл)метил]-9кімнатній температурі протягом 20 годин Суміш (3-флуорбензоіл)-8-азабіцикло[3 2 1]октан-3промивали тричі по 50мл води, органічну фазу метанамшу (1 1) сушили сульфатом та фільтрували, фільтрат конЗБ 1 1 1-Диметилетил[екзо-[(2, З-дипдро-1 4центрували під зниженим тиском, а залишок очибензодюксан-2-іл)метил][[8-(3-флуорбензоіл)-8щали хроматографією на силікагелі, елююючи азабіцикло[3 2,1]окт-3-іл]метил]карбамат] Викорисумішшю дихлорметану та метанолу 94/6 Отристовуючи описаний в прикладі 2Б 3 спосіб, почи 18 17 58476 мали 1,6г сполуки, яку використовували без подаПісля перекристалізації, Отримали 0,65г твердої льшої очистки на наступному етапі білої речовини Тпл 95-112°С 5Б 2 (Е)-2-бутендюат екзо-ІЧ-[(2 З-дипдро-1 4Приклад 7Б (Сполука №22Б) Гідрохлорид 8бензодіоксан-2-іл)метил1-8-(фенілметил)-І\ІБензоіл-І\І-[(3 4-дипдро-2Н-1-бензопіран-2-іл) мепропіл-8-азабіцикло[3 2,1]октан-3-метанамшу (2 1) тил]-8-азабіцикло[3 2 1]октан-3-метанамш Вигото0,3г (7,4 ммоль) алюмогідриду ЛІТІЮ та 15мл тетравили суспензію 0,6г (1,9 ммоль) (3,4-дипдро-2Н-1гідрофурану вносили під атмосферою азоту у трибензопіран-2-іл)метил4-метилбензолсульфонату, горлу колбу на ЮОмл з круглим дном, суміш охо1г (4,1 ммоль) 8-бензоіл-8-азабіцикло[3,2,1]октанлоджували до 0°С, додали розчин 1,6г (3,7 ммоль) 3-метанамш та 0,26г (1,9 ммоль) карбонату калію у екзо-І\І-[(2, З-дипдро-1,4-бензод юксан-2-іл)метил]11мл ацетонітрилу та кип'ятили її під зворотним г\І-[[8-(фенілметил)-8-азабіцикло[3,2,1]окт-3холодильником протягом 18 годин Додали невеіл]метил]пропанаміду в 32мл тетрагідрофурану та лику КІЛЬКІСТЬ йодиду калію та ще 0,15г карбонату кип'ятили суміш під зворотним холодильником калію та кип'ятили суміш під зворотним холодильпротягом 7 годин Суміш охолоджували до 0°С, ником протягом ще 8 годин Нерозчинний матеріал надлишок гідриду пдролізували 1 Н водним гідроВІДДІЛЯЛИ фільтруванням, фільтрат концентрували ксидом натрію, нерозчинний матеріал ВІДДІЛЯЛИ під зниженим тиском, залишок розчиняли у дихлофільтруванням, фільтрат сушили сульфатом нарметані, промивали водою, сушили сульфатом трію, розчин фільтрували та концентрували фільтнатрію та фільтрували, фільтрат концентрували рат під зниженим тиском Фумарат виготовили з під зниженим тиском, а залишок очищали хрома1,45г (3,44 ммоль) основи, яку розчиняли в 5мл тографією на колонці з силікагелем, елююючи суетанолу та додавали розчин 0,8г (6,9 ммоль) фумішшю етилацетату та метанолу 80/20 та потім марової кислоти в Юмл етанолу Осад збирали 70/30 Гідро-хлорид виготовили використовуючи фільтруванням та перекристалізовували з етано0,1 N розчин пдрохлоридної кислоти у 2лу Отримали 1,1гтвердоі білої речовини пропанолі Отримали 0,4г твердої речовини Тпл 148,5-151,5°С Тпл 190-191 °С Приклад 8Б (Сполука №24Б) Гідрохлорид 8Приклад 6Б (Сполука №21 Б) Гідрохлорид екБензоіл-г\І-[(4-охо-2,3-дипдро-4Н-1-бензопіран-330-N-[(2 З-дипдро-1 4-бензодюксан-2-іл)метил]-8іл)метил]-8-азабіцикло[3 2 1]октан-3-метанамшу (4-метилбензоіл)-І\І-пропіл-81 71г (6,1 ммоль) 8-бензоіл-8азабшикло[3,2 1]октан-3-метанамшу (1 1) азабіцикло[3,2,1]октан-3-метанамш гідрохлорид, 6Б 1 екзо-ІЧ-[(2 З-дипдро-1 4-бензодюксан-20,2г (6,3 ммоль) параформальдегіду та кілька краіл)метил]-г\І-пропіл-8-азабіцикло[3,2,1]октан-3пель концентрованої пдрохлоридної кислоти у 10 метанамш 3,45г (8,2 ммоль) екзо-І\І-[(2,3-дипдромл 2-пропанолі вносили у тригорлу колбу з круг1,4-бензод юксан-2-іл)метил]-8-(феніл метил)-І\Ілим дном, суміш кип'ятили під зворотним холодипропіл-8-азабіцикло[3,2,1]октан-3-метанаміН) 70мл льником протягом 5 хвилин, 0,78г (5,3 ммоль), дометанолу, 3,4г 10% паладію на вугіллі та 3,4г фодали розчин 2,3-дипдро-4Н-1 -бензопіран-4-ону у рміату амонію під атмосферою азоту вносили у Юмл 2-пропанолу та гріли під зворотним холодиколбу на 250мл з круглим дном та кип'ятили суміш льником протягом 18 годин Суміш охолоджували, під зворотним холодильником протягом 2 годин а гідрохлорид збирали фільтруванням Отримали Суміші дали охолонути, каталізатор ВІДДІЛЯЛИ фі126гтвердої речовини Тпл 187-189°С льтруванням, розчинник випарювали під зниженим тиском, а залишок розчинили у дихлорметані, розПриклад 9Б (Сполука № 29Б) Гідрохлочин промивали водою, сушили сульфатом натрію рид (8)-екзо-8-бензіл-І\І-[8-метокси-2, 3-д и пдрота фільтрували, а фільтрат концентрували під 1,4-бензодюксан-2-іл)метил1 -8зниженим тиском Отримали 1,8г сполуки, яку виазабіцикло[3,2,1]октан-3-метанамшу (1 1) користовували без подальшої очистки на наступ9Б 1 (8)-8-метокси-1,4-бензод юксан-2ному етапі метанол Виготовлення цієї сполуки описано у Тес Letters (1992) 33 6283-6286 6Б 2 Гідрохлорид екзо-ІЧ-[(2 З-дипдро-1 49Б 2 (8-метокси-2 З-дипдро-1,4-бензодюксанбензодіоксан-2-іл)метил]-8-(4-метилбензоіл)-І\І2-іл)метил[(Р)-4-метилбензолсульфонат] До розпропіл-8-азабіцикло[3,2 1]октан-3-метанамшу (1 1) чину 410мг (2,1 ммоль) (5)-8-метокси-1,41г (3 ммоль) екзо-І\І-[2,З-дипдро-1,4-бензодюксанбензодюксан-2-метанолу в 5мл піридину, додали 2-іл)метил]-г\І-пропіл-8-азабіцикло[3,2,1]октан-3398мг (2,1 ммоль) 4метанамш, Юмл тетрагідрофурану, Юмл етилацетату та 0,31г (3 ммоль) тріетиламшу під атмосфеметилбензолсульфонілхлориду та перемішували рою азоту вносили у тригорлу колбу на 100 мл з суміш при кімнатній температурі протягом 20 гокруглим дном Суміш охолоджували до 0°С, додадин Суміш виливали у ЗОмл льодяної води та ексли краплями розчин 0,51 г (3,3 ммоль) 4трагували ДВІЧІ по 15мл етилацетату, органічну метилбензоілхлориду в 1мл етилацетату та перефазу промивали водним 1 N розчином пдрохломішували суміш при кімнатній температурі протяридної кислоти, потім водним розчином гідрокаргом 5 годин Гідрохлорид тріетиламшу ВІДДІЛЯЛИ бонату натрію, а потім водою та сушили сульфафільтруванням, фільтрат концентрували під знитом натрію Цей розчин фільтрували, розчинник женим тиском, залишок розчинили у дихлорметані, випарювали під зниженим тиском, залишок перерозчин промивали водою, сушили сульфатом наносили у пентан та збирали гумоподібну тверду трію та фільтрували, а фільтрат концентрували під речовину, промивали и пентаном та сушили Видізниженим тиском Отримали 1,4г основи, Гідролили 405мг сполуки, яку використовували без похлорид якої виготовили додаванням ЗОмл насичедальшої очистки на наступному етапі ного газуватим пдрохлоридом діетилового етеру 9Б 3 Гідрохлорид (3)-екзо-8-Бензоіл-І\І-[8 20 19 58476 Таблиця А метокси-2 З-дипдро-1,4-бензодюксан-2-іл)метил]8-азабіцикло[3 2 1]октан-3-метанамшу (1 1) В інертній атмосфері виготовили суспензію 380мг (1,08 ммоль) (8-метокси-2,З-дипдро-1,4-бензод юксан-2іл)метил[(Р)-4-метилбензолсульфонату], 530мг (2,16 ммоль) 8-бензоіл-8-азабіцикло[3,2,1]октан-3СН г*—— метанамшу та 180мг (1,3 ммоль) карбонату калію ї г ІІПМЩЇ 1 С ль Тип ["С! Іл? V на 50мл ацетонітрилу та кип'ятили суміш під звоУі К О s Р |нс: .1 296-208 S ротним холодильником протягом 57 годин 2А н 3-ОСЯ,СН, о р неї 1 !І И Ч - И 6 5 Розчинник випарювали під зниженим тиском, ЗА к з-а о Р неї 1 1 2ІЗ-П5 залишок розчиняли у дихлорметані та воді, органі** к к 8, a Р ф;маратї 2 190-192 чну фазу ВІДДІЛЯЛИ, промивали водою до нейтрального рН та фільтрували, розчинник випарювали SA 4-а н агЗ •1 н.ч Р 198-1SS під зниженим тиском, а залишок очищали хрома6А 3-Cl а,к Р E l «2 ,1 213-3U , тографією на колонці з силікагелем, елююючи су7Л 4 . 7-ІОСН,), н о Р неї 1 1 133-111 мішшю дихлорметану та метанолу 98/2, а потім 8А 4, Э-С1 0 Р не: 1 1 222 5-225 95/5 Пдрохлорид виготовили використовуючи 0,1 ЗА 4, 3-ОСЙ, N розчин пдрохлоридної кислоти у 2-пропанолі о & кс: І 1 213-214.S ' ІОА і . Під кінець ВИДІЛИЛИ 135мгтвердоі речовини Т пл 4-Сі о & кс: 1 1 226-223 210-211 °С, [a] D20 =-53° (с=0,1, МеОН) НА 7-їООУ, ЗД-С1, О Р неї 1 1 215 ЗП 12А Приклад 10Б (Сполука №31 Б) Пдрохлорид (3)'-iocs,), 3,4-(oca,), 0 0 КС1 1 _ П4-13Й екзо-3-Бензоіл-І\І-[7-хлор-2,З-дипдро-1 4ПА 4, 7-ІОС^), 0 1 неї 1 1 1S1-163 3 бензодюксан-2-іл)метил1-8-азабіиикло[3,2,1]октан14А к к,н 1 1Э7-16Э 3-метанамшу (1 1) Геометрична ізоформа кільцевої системи аза10Б 1 (7-хлор-2 З-дипдро-1,4-бензодюксан-2біциклооктану показана в колонці "Ізом" іл)метил (Р)-4-метилбензолсульфонат Виготовлення цієї сполуки описано у патентній заявці WO В колонці "Сіль" НСІ означає пдрохлорид, а 97/03071, с 42-43 "Фум" - (Е)-2-бутендюат чи фумарат, показано співвідношення кислота основа 10Б 2 Пдрохлорид {S}-eK30-8-EeH30in-N-[7хлор-2 З-дипдро-1,4-бензодюксан-2-іл)метил]-8Нумерація атомів у гетероциклі, що містить W азабіцикло[3 2 1]октан-3-метанамшу (1 1) суспента X надана як орієнтир, в основному до розташузію 1,1г (3,1 ммоль) (7-хлор-2,З-дипдро-1,4вання замісника V, вона необов'язково підкоряєтьбензодюксан-2-іл)метил (R)-4ся правилам номенклатури, зокрема, коли X - група СН 2 чи CO метилбензолсульфонат/1,5г (6,2 ммоль) 8-бензоіл8-азабіцикло[3,2,1]октан-3-метанамш та 515мг (3,7 Геометрична ізоформа кільцевої системи азаммоль) карбонату калію у 20мл ацетонітрилу вигобіциклооктану показана в колонці Ізом" Позначки товили та кип'ятили під зворотним холодильником (R)- та (S)- відносяться до атома в позиції 2 2,3протягом 48 годин Розчинник випарювали під дипдро-1,4-дюксанового кільця зниженим тиском, залишок розчиняли у дихлормеВ колонці "Сіль" НСІ означає пдрохлорид, а тані та воді, органічну фазу ВІДДІЛЯЛИ, промивали "Фум" - (Е)-2-бутендюат чи фумарат, показано до нейтрального рН, сушили сульфатом натрію та співвідношення кислота основа фільтрували, фільтрат випарювали під зниженим В колонці "Т пл (°С)" " (d)" означає точку плавтиском, а залишок очищали хроматографією на лення з розкладанням Оптичне обертання сполук колонці з силікагелем, елююючи сумішшю дихло29-32 наведено для (с=0,1, МеОН) рметану та етанолу 98/2 та потім 95/5 Пдрохлорид виготовили, використовуючи 0,1 N розчин пдрохлоридної кислоти у 2-лропанолі Під кінець виділили 230мг твердої речовини Т пл 164,520 167°С, [а] о =-56° (с=0,1, МеОН) 3 1 п2 Нижченаведені таблиці А та Б ілюструють хімічну будову та фізичні властивості ряду сполук згідно з винаходом 58476 21 15В О О здв < • 0 зве !SB о а о о 1 м 36Н ° о а а к V ! о н ! ° і о а осн. і о и о 9 ООІ, і " 7 С! Ч-СІ J ! «В, ОеВ,СИ, 1st р н ш-р к и N N р 9 НС1 ] НС1 1 1 1 НС1 1 1 ИМ р 161 5 167 [apj°. 56' •61 43 [•к-- - я 175 176 ад ш 1 1 исі і г «е « I S Сполуки згідно з винаходом фармакологічно тестували, що продемонструвало їх ЦІННІСТЬ ЯК речовин з терапевтичною активністю Дослідження спорідненості до допамінергічних рецепторів типу Dg v смугастому ТІЛІ щурів Сполуки перешкоджають зв'язуванню специфічного міченого ліганду, спіперону, (далі позначеного як [3Н]спіперон і описаного Впіеу і Langer, Eur J PharmacoL, (1978) 50 283) з О2-рецепторами, наявними в смугастому ТІЛІ щурів Використовували самців щурів Sprague-Dawley масою 150-250г Після обезголовлення мозок видаляли і вирізали смугасте тіло Тканину розмелювали на млині Pohtron™ у 50 об'ємах буферу Трис-НСІ з вмістом 120мм хлориду натрію, 5мм хлориду калію та доведеному до 7,4 рН (тобто ЮОмг свіжої тканини на 5мл) Гомогенізовану тканину ДВІЧІ промивали при 4°С, центрифугуючи кожного разу при 40000хд протягом 10 хвилин і ресуспендуючи пелету у охолодженому свіжому буфері Кінцеву пелету ресуспендували в тому ж об'ємі буферу і додавали аскорбінову кислоту (до кінцевої концентрації 0,1%) та парплін (до кінцевої концентрації ЮмкМ) Суміш при 37°С шкубували протягом 10 хвилин Зв'язування [3Н]спіперону (New England Nuclear, специфічна активність 20-40мКі/ммоль) визначали інкубуванням при 37°С протягом 20 хвилин ЮОмкл мембранної суспензії з 0,25нМ радюліганду в кінцевому об'ємі 1мл у присутності чи відсутності досліджуваної сполуки Неспецифічне зв'язування визначали у присутності галоперидолу в концентрації ЮмкМ Після інкубування мембрани ВІДДІЛЯЛИ фільтруванням на фільтрах Whatman GF/B™, які промивали ДВІЧІ по 5 мл охолодженого льодом буферу Фільтри екстрагували в СЦИНТИЛЯЦІЙНІЙ рідині і вимірювали радіоактивність рідинною сцинтиграфією з ефективністю 50-60% Для кожної досліджуваної сполуки результати виражали як ІК50 - розраховану графічним чи математичним способом концентрацію, при якій інгібування зв'язування [3Н]спіперону складає 50% Для сполук згідно з винаходом величина ІК50 знаходиться в межах 0,05-2мкМ 22 Дослідження спорідненості до допамінергічних рецепторів типу Рз у бичачому серцевинному хвості (noyau caude] In vitro визначали спорідненість сполук до отриманих з препаратів мембран бичачого серцевинного хвоста рецепторів типу D3, як в основному описано Н Shoemaker в Eur J PharmacoL, (1993) 242R1-R2В день експерименту бичачі серцевинні хвости (Collect Organe, Pans, France), що зберігалися при -80°С, розморожували та гомогенізували при 4°С в 10 об'ємах буферу (10мм Трис, 1мм ЕДТА, рН 7,5 при 25°С), використовуючи Pohtron™ (позиція 5, 30с) Гомогенат центрифугували при 2500хд протягом 1 хвилини (центрифуга Pohtron™, опоряджена ротором SS34) Верхній шар збирали та центрифугували при ЗбОООхд протягом 15 хвилин, пелету промивали ресуспензуван-ням в 10 об'ємах буферу, гомогенізацією та центрифугуванням, а кінцеву пелету суспендували в 10 об'ємах буферу та попередньо шкубували при 37°С протягом 10 хвилин Гомогенат центрифугували при 35000хд протягом 15 хвилин, пелету ресуспендували в інкубаційному буфері (50мм ГЕПЕС, 1мм ЕДТА, 50мкМ 8-пдроксихіноліну, 0,005% аскорбінової кислоти, рН 7,5 при 25°С) в пропорції ЮОмг вихідної тканини на мл 150мкл суспензії мембран шкубували при 23°С протягом 60 хвилин в пробірках у присутності 0,8нМ [3H]7-OH-DPAT (специфічна активність 120ЮОмКі/ммоль, Amersham™) у кінцевому об'ємі 1мл інкубаційного буферу з вмістом 0,2мкМ пдрохлориду золпідему та 1 мг альбуміну бичачої сироватки у присутності чи відсутності досліджуваної сполуки Інкубування зупиняли фільтруванням на Brander Harvester M-48™, використовуючи фільтри Whatman GF/B™, попередньо оброблені 0,1% альбуміном бичачої сироватки протягом ЗО хвилин Після розбавлення 4мл буферу (50мм Трис, 120мм хлориду натрію, 5мМ, рН 7,4 при 25°С) кожного реакційного середовища пробірки промивали ДВІЧІ 4 мл цього буферу Фільтри розрізали та сушили в шафі при 120°С протягом 10 хвилин, радіоактивність вимірювали рідинною спектрометрією Неспецифічне зв'язування визначали у присутності допамшу в концентрації 1мкМ Для кожної концентрації досліджуваної сполуки розраховували процент інгібування специфічного зв'язування [3H]7-OH-DPAT, після чого визначали ІК50 - концентрацію, при якій інгібування зв'язування складає 50% Для сполук згідно з винаходом величина IKso знаходиться в межах 0,01 -2мкМ Дослідження спорідненості до серотоншерпчних рецепторів типу 5-НТід Сполуки перешкоджають зв'язуванню специфічного міченого ліганду [3Н]-8-пдрокси-2-ди-япропіламінотетралш ([3H]-8-OH-DPAT, описано Gozlan et al , Nature, (1983) 305 140) з 5-HTiAрецепторами, наявними в ппокампусі щурів Використовували самців щурів Sprague-Dawley масою 160-200г Після обезголовлення мозок видаляли і вирізали ппокампус Тканину розмелювали на млині Ultra-TurraxPohtron протягом 30с при половинній швидкості у 10 об'ємах буферу Трис 24 23 58476 НСІ з доведеним пдрохлоридною кислотою до 7,4 гуванням, а кінцеву пелету Кінцеву пелету розбарН (тобто ЮОмг свіжої тканини на мл) Гомогенізовляли в тій же буферній суміші в пропорції ЮОмг вану тканину ДВІЧІ промивали при 4°С, центрифувологої тканини на 1 мл буферу гуючи кожного разу при 48000хд протягом 10 хвиТканину далі попередньо шкубували при 37°С лин і ресуспендуючи пелету у охолодженому протягом 10 хвилин у присутності Юмкмоль/л парсвіжому буфері Кінцеву пелету ресуспендували в пліну, а потім при 37°С протягом 20 хвилин у при3 буфері до кінцевої концентрації вихідної тканини сутності 0,3нмоль/л [ Н]спіперону (специфічна ак50мг на мл буферу при 50мМ Суміш при 37°С тивність 15-30мКі/ммоль) та досліджуваної шкубували протягом 10 хвилин сполуки 3 Зв'язування з 1нМ [ H)-8-OH-DPAT визначали Мембрани ВІДДІЛЯЛИ фільтруванням, викорисінкубуванням при 37°С протягом 20 хвилин 50мкл товуючи фільтри Whatman GF/B™ і промивали мембранної суспензії з 0,25нМ радюліганду в кінДВІЧІ 5мл холодного буферу цевому об'ємі 250мкл буферу з вмістом ЮмкМ Для оцінки активності сполук будували криву парпліну та ЗмкМ пароксетину Після інкубування залежності проценту інгібування зв'язування 3 при 37°С протягом 20 хвилин мембрани ВІДДІЛЯЛИ [ Н]спіперону від концентрації заміщувального фільтруванням на фільтрах Whatman GF/B™, які лікарняного засобу, після чого графічно визначали промивали тричі по 5мл охолодженого льодом ІК50 - концентрацію, при якій інгібування зв'язуванбуферу Фільтри екстрагували в СЦИНТИЛЯЦІЙНІЙ ня складає 50% рідині і вимірювали радіоактивність рідинною сциСпецифічне зв'язування визначали як зв'язунтиграфією Специфічне зв'язування [3Н]-8-ОНвання при заміщенні ЮОмкмоль/л 5-НТ DPAT визначали як величину залишкової радіоакДля сполук згідно з винаходом величина IKso тивності на фільтрі і яка може бути інгібована спізнаходиться в межах 0,02-5мкМ вшкубуванням з ЮмкМ пдроксит-риптамшу При Результати дослідження свідчать, що сполуки концентрації 1нМ [3H]-8-OH-DPAT специфічне зв'язгідно з винаходом мають сильну спорідненість до зування складало 90% загальної радіоактивності допамінерпчних рецепторів типу D2 та D3 та серона фільтрі тоншерпчних рецепторів типу 5-НТід та 5-НЇ2А Ці результати підтверджують, що сполуки можна виДля кожної концентрації досліджуваної сполукористовувати для лікування хвороб та патолопй, ки розраховували процент інгібування специфічноасоційованих з дисфункцією допамінерпчного та го зв'язування [3H]8-OH-DPAT, після чого визначасеротоншерпчного переносу, зокрема, допамінерли ІК50 - концентрацію, при якій інгібування пчних рецепторів типу D2Ta D3 та серотонінерпчзв'язування складає 50% них рецепторів типу 5-НТІА та 5-НЇ2А Для сполук згідно з винаходом величина IKso знаходиться в межах 0,1-500нМ Тому їх можна використовувати для лікування психозів, зокрема, шизофренії (дефіцитної чи проДослідження спорідненості до серотоншерпчдуктивної форми), викликаних нейролептиками НИХ рецеПТОріВ ТИПУ 5-НЇ2А гострих чи хронічних екстрапірамідальних симптоДля сполук згідно з винаходом також визначамів, для лікування різних форм тривожності напали in vitro здатність перешкоджати зв'язуванню дів паніки, фобій, примусово-нав'язливих розладів, спіперону на серотоншерпчних рецептора типу 5різних форм депресії, обумовлених залежністю від НЇ2А кори головного мозку щурів алкоголю чи відвиканням від нього розладів, розДля цього досліду видаляли мозок щурів і виладів сексуальної поведінки, харчових розладів та різали з нього кору та гомогенізували при 0°С в 10 мігрені об'ємах суміші з вмістом на літр 50 ммоль буферу Трис/НСІ, рН 7,4, 120 ммоль хлориду натрію та 5 Наприкінці, їх можна застосовувати у будь-якій ммоль хлориду калію Гомогенну суміш центрифуприйнятній для перорального та парентерального гували при 40000хд протягом 10 хвилин, пелету застосування формі у сполученні з будь-якими ВІДДІЛЯЛИ та ДВІЧІ промивали суспендуванням в тій придатними наповнювачами та у дозах, що забезже буферній суміші, гомогенізацією та центрифупечують добову дозу від 1 до 1000мг Комп'ютерна верстка О В Кураєв Підписано до друку 05 09 2003 Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійською8-azabicyclo[3.2.1]octane-3-methanamine derivatives, its preparation and application in therapeutics
Автори англійськоюMarabout Benoit
Назва патенту російськоюПроизводные 8-азабицикло[3.2.1]октане-3-метанамина, их изготовление и применение в терапии
Автори російськоюМАРАБУ Бенуа
МПК / Мітки
МПК: A61P 1/14, A61P 15/00, A61K 31/46, A61K 31/439, A61P 25/18, A61P 43/00, A61P 25/32, A61P 25/22, C07D 451/02, A61P 3/04, A61K 31/36, A61P 25/06, A61P 25/24
Мітки: засіб, похідні, фармацевтична, композиція, 8-азабіцикло[3.2.1]октан-3-метанаміну, лікарський
Код посилання
<a href="https://ua.patents.su/12-58476-pokhidni-8-azabiciklo321oktan-3-metanaminu-farmacevtichna-kompoziciya-ta-likarskijj-zasib.html" target="_blank" rel="follow" title="База патентів України">Похідні 8-азабіцикло[3.2.1]октан-3-метанаміну, фармацевтична композиція та лікарський засіб</a>
Попередній патент: Рентгенопоглинаючий матеріал (варіанти)
Наступний патент: 1 – феніл – 5 – (п-метоксифеніл) – 3 – [1,8 – нафтоїлен – 1′,2′ – бензімідазоліл – 4 ] -2 – піразол як органічний люмінофор зеленого світіння
Випадковий патент: Спосіб гарячої прокатки тонкої штаби і стан для його здійснення