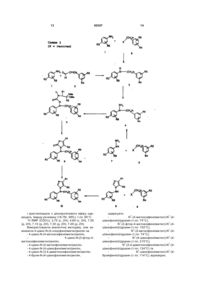
Похідні 1-n-феніламіно-1н-імідазолу та фармацевтична композиція (варіанти), що їх містить
Номер патенту: 80307
Опубліковано: 10.09.2007
Автори: Карньято Дені, Бонне Поль, Ляфей Жан, Адже Наталі, Паскаль Жан-Клод, Делансорне Ремі
Формула / Реферат
1. Похідне імідазолу формули (І):
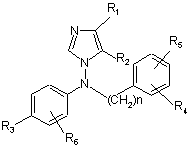 (I)
(I)
та його кислотно-адитивні солі, сольвати та стереоізомерні форми, де:
- кожний з R1 і R2 незалежно означає водень, (С1-С6)алкіл або (С3-С8)циклоалкіл;
- n=0, 1 або 2;
- кожний з R3, R4, R5 і R6 незалежно означає водень або (С1-С6)алкіл, галоген, ціано, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл, сульфонамідо, ацил, (С1-С6)алкоксикарбоніл або карбоксамідогрупу;
- R3 і R6 разом з фенільним циклом, що їх несе, можуть також утворювати бензофуран або N-метилбензотриазол.
2. Похідне за п. 1, де:
- n дорівнює 0 або 1;
- кожний з R1 і R2 незалежно означає водень або (С1-С6)алкіл;
- R3 означає ціано або трифторметил;
- R4 означає водень, (С1-С6)алкіл, галоген, ціано, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл або (С1-С6)алкоксикарбоніл;
- R5 означає водень, галоген, (С1-С6)алкокси або трифторметил;
- R6 означає водень;
- або R3 і R6 разом з фенільним циклом, що їх несе, утворюють N-метилбензотриазол;
та його кислотно-адитивні солі, сольвати та стереоізомірні форми.
3. Похідне за п. 1 або 2, де:
- n дорівнює 0 або 1;
- кожний з R1, R2 і R6 означає водень;
- R4 означає галоген, ціано або трифторметил;
та його кислотно-адитивні солі, сольвати та стереоізомірні форми.
4. Похідне за одним з пп. 1-3, де R3 означає ціано, та його кислотно-адитивні солі, сольвати та стереоізомірні форми.
5. Похідне за одним з пп. 1-4, де R5 означає водень або трифторметил, та його кислотно-адитивні солі, сольвати та стереоізомірні форми.
6. Похідне за одним з пп. 1-5, де n дорівнює 1, та його кислотно-адитивні солі, сольвати та стереоізомірні форми.
7. Фармацевтична композиція, яка містить похідне за одним з пп. 1-6 або його фармацевтично прийнятну кислотно-адитивну сіль і фармацевтично прийнятний носій.
8. Фармацевтична композиція за п. 7, яка є композицією для інгібування ароматази.
9. Фармацевтична композиція за п. 7 або 8, яка містить від 0,1 до 400 мг вказаного похідного.
10. Застосування похідного за одним з пп. 1-6 або його фармацевтично прийнятної кислотно-адитивної солі для одержання лікарського засобу для лікування або попередження естрогензалежних порушень, де вказане похідне, необов'язково, знаходиться у комбінації з терапевтичним ендокринним гормональним препаратом, який належить до статевої функції.
11. Застосування похідного за одним з пп. 1-6 або його фармацевтично прийнятної кислотно-адитивної солі для одержання лікарського засобу для регулювання або керування репродуктивними функціями, такими як чоловіча або жіноча плідність, вагітність, аборт або пологи, де вказане похідне, необов'язково, знаходиться у комбінації з агоністом або антагоністом LH-RH, естропрогестативним контрацептивом, прогестином, антипрогестином або простагландином.
12. Застосування похідного за одним з пп. 1-6 або його фармацевтично прийнятної кислотно-адитивної солі для одержання лікарського засобу для лікування або попередження доброякісних або злоякісних хвороб молочної залози, матки або яєчника, де вказане похідне, необов'язково, знаходиться у комбінації з антиестрогеном, прогестином або агоністом або антагоністом LH-RH.
13. Застосування похідного за одним з пп. 1-6 або його фармацевтично прийнятної кислотно-адитивної солі для одержання лікарського засобу для лікування або попередження доброякісних або злоякісних хвороб передміхурової залози або яєчок, де вказане похідне, необов'язково, знаходиться у комбінації з антиандрогеном, прогестином, інгібітором ліази або агоністом або антагоністом LH-RH.
Текст
1. Похідне імідазолу формули (І): 2 (19) 1 3 80307 4 адитивної солі для одержання лікарського засобу для регулювання або керування репродуктивними функціями, такими як чоловіча або жіноча плідність, вагітність, аборт або пологи, де вказане похідне, необов'язково, знаходиться у комбінації з агоністом або антагоністом LH-RH, естропрогестативним контрацептивом, прогестином, антипрогестином або простагландином. 12. Застосування похідного за одним з пп.1-6 або його фармацевтично прийнятної кислотноадитивної солі для одержання лікарського засобу для лікування або попередження доброякісних або злоякісних хвороб молочної залози, матки або яєчника, де вказане похідне, необов'язково, знаходиться у комбінації з антиестрогеном, прогестином або агоністом або антагоністом LH-RH. 13. Застосування похідного за одним з пп.1-6 або його фармацевтично прийнятної кислотноадитивної солі для одержання лікарського засобу для лікування або попередження доброякісних або злоякісних хвороб передміхурової залози або яєчок, де вказане похідне, необов'язково, знаходиться у комбінації з антиандрогеном, прогестином, інгібітором ліази або агоністом або антагоністом LH-RH. Цей винахід відноситься до похідних 1-Νфеніламіно-1Н-імідазолу як інгібітору ароматази та фармацевтичних композицій, які містять вказані похідні. Ароматаза є фізіологічним ферментом, що відповідає за специфічну конверсію андрогенів, таких як андростендіон або тестостерон, в естрогени, такі як естрон та естрадіол, відповідно [Simpson ER et al., Endocrine Reviews, 1994, 15: 342355]. Тому принцип підходу полягає в інгібуванні ароматази, що дозволяє перешкоджати нормальним або патологічним естроген-індукованим або естроген-залежним біологічним процесам, таким як жіноча статева диференціація, овуляція, імплантація, вагітність, проліферація клітинмолочної залози та ендометріальна клітинна проліферація, а також забезпечувати регуляцію сперматогенезу або проліферації клітин передміхурової залози у чоловіків, або нерепродуктивних функцій, таких як остеогенез або імунний баланс Т-клітин і цитокінів [Simpson ER et al., Recent Progress in Hormone Research, 1997, 52:185-213 and the whole issues of Endocrine Related Cancer (1999, volume 6, n°2) and Breast Cancer Research Treatment (1998, volume 49, supplement n°1)]. Відома велика кількість похідних азолу, які використовують як протигрибкові засоби. Деякі похідні імідазолу або тріазолу вже описані як інгібітори ферменту ароматази. Як правило, імідазолільна або тріазолільна група пов'язана з ароматичними циклами, як виявлено для летрозолу [ЕР-А236940; Lamb HM and Adkins JC, Drugs, 1998, 56:1125-1140]: Імідазоли або тріазоли, пов'язані через метиленову групу з бензотріазолом, [описані в ЕР-А293 978]: або анастрозолу [ЕР-А-296749; Wiseman LR and Adkins JC, Drugs Aging, 1998,13:321-332]: Ди-трет-бутилфеноли, що містять Nаміноімідазольну групу в пара-положенні, [описані у патенті США 4908363] і подані як такі, що мають властивості, які інгібують запалення й едему: Пізніше [М. OKADA та ін [Chem. Pharm. Bull., 44 (10), 1996, 1871-1879] описали ряд [4(бромфенілметил)-4-(ціанофеніл)аміно]азолів та їх азинових аналогів: Встановлено, що похідні імідазолу, які незмінно містять 1-[N-феніламіно]-групу, виявляють несподівано високу ефективність в інгібуванні ароматази. Відповідно, одна із задач цього винаходу полягає в одержанні похідних 1-[Nфеніламіно]імідазолу, які є ефективними інгібіторами ароматази. Інша задача цього винаходу полягає в розробці фармацевтичної композиції, яка містить як активний інгредієнт похідне 1-[N-феніламіно]імідазолу, подане нижче, або фармацевтично прийнятну кислотно-адитивну сіль вказаної сполуки. Ще одна задача цього винаходу полягає у застосуванні похідного 1-[N-феніламіно]імідазолу для одержання лікарського засобу, призначеного для лікування або профілактики різних захворювань та для керування репродуктивними функція 5 80307 ми у жінок, у чоловіків, а також у жіночих та чоловічих особнів диких і хатніх тварин. Похідні 1-[N-феніламіно]імідазолу за цим винаходом представлені такою загальною формулою (І): (I) та кислотно-адитивними солями, сольватами та стереоізомірними формами вказаних сполук, де: - кожний з R1 і R2 незалежно означає водень, (С1-С6)алкіл або (С3-С8)циклоалкіл; - n=0,1,2; - кожний з R3, R4, R5, і R6 незалежно означає водень або (С1-С6)алкіл, гёлоген, ціано, (С1С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1С6)алкілсульфоніл, сульфонамідо, ацил, (С1С6)алкоксикарбоніл або карбоксамідогрупу; - R3 і R6 разом з фенільним кільцем, що їх несе, можуть також утворювати бензофуран або Nметилбензотріазол. Мається на увазі, що в описі і формулі винаходу термін "(С1-С6)алкіл" означає лінійний або розгалужений вуглеводневий ланцюгз 1-6 атомами вуглецю. Радикал (С1-С6)алкіл означає, наприклад, радикал: метил, етил, пропіл, ізопропіл, бутил, ізобутил, трет-бутил, пентил, ізопентил або гексил. Мається на увазі, що термін "галоген" означає атом хлору, брому, йоду або фтору. Мається на увазі, що термін "(С3С8)циклоалкіл" означає насичений моноциклічний вуглеводень з 3-8 атомами вуглецю. Радикал (С3С8)циклоалкіл означає, наприклад, радикал: циклопропіл, циклобутил, циклопентил, циклогекбил, циклогептил або циклооктил. Мається на увазі, що термін "(С1-С6)алкокси" означає групу OR, в якій R означає вищевказаний (С1-С6)алкіл. Радикал (С1-С6)алкокси означає, наприклад, радикал: метокси, етокси, пропокси, ізопропокси, бутокси, ізобутокси, трет-бутокси, нпентилокси або ізопентилокси. Мається на увазі, що термін "ацил" означає групу , де R' означає водень або вищевка заний (С1-С6)алкіл. Сполуки формули (І) утворюють кислотноадитивні солі, наприклад, з неорганічними кислотами, такими як хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота і тому подібне, або з органічними карбоновими кислотами, такими як оцтова кислота, пропіонова кислота, гліколева кислота, піровиноградна кислота, щавлева кислота, яблучна кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, корична кислота, мигдальна кислота, метансульфонова кислота і тому подібне. 6 Кращими сполуками формули (І) є сполуки, в яких: - n дорівнює 0 або 1; - кожний з R1 і R2 незалежно означає водень або (С1-С6)алкіл; - R3 означає ціано або трифторметил; - R4 означає водень, (С1-С6)алкіл, галоген, ціано, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл або (С1-С6)алкоксикарбоніл; - R5 означає водень, галоген, (С1-С6)алкокси або трифторметил; - R6 означає водень; - або R3 і R6 разом з фенільньїм циклом утворюють N-метилбензотріазол. Також кращими є сполуки формули (І), де: - n дорівнює 0 або 1; - кожний з R1, R2 і R6 означає водень; - R4 означає галоген, ціано або трифторметил. Особливо кращими сполуками формули (І) є сполуки, в яких R3 означає ціано; в яких R5 означає водень або трифторметил; і в яких n дорівнює 1. Особливо корисні сполуки вибирають з групи, яка містить: 4-[N-(1Н-імідазол-1-іл)-N-(4трифторметилфенілметил)аміно]бензонітрил, 4-[Ν-(1Н-імідазол-1-іл)-N-(4хлорфенілметил)аміно]бензонітрил, 4-[N-(1H-iмiдaзoл-1-iл)-N-(4цiaнoфeнiлмeтил)aмiнo]бeнзoнiтpил, 4,4'-[Ν-(1Н-імідазол-1-іл)аміно]біс-бензонітрил, 4-[Ν-(1Н-імідазол-1-іл)-N-(4фторфенілметил)аміно]бензонітрил, 4-[Ν-(1Н-імідазол-1-іл)-N-(3,4дифторфенілметил)аміно]бензонітрил та кислотно-адитивні солі, сольвати або стереоізомірні форми вказаних сполук. Завдяки особливості сполук, що розглядаються, інгібувати ароматазу та, відповідно, добувати всі джерела ендогенних естрогенів, сполуки за цим винаходом можуть бути використані окремо або в комбінації з іншими активними інгредієнтами для лікування або профілактики будь-якого естроген-залежного порушення або для керування естроген-регульованими репродуктивними функціями у людей, а також у диких або хатніх тварин. Оскількимолочні залози є найбільш сприйнятливими об'єктами естроген-стимульованої проліферації та/або диференціації, інгібітори ароматази є особливо корисними у терапії або профілактиці доброякісних хворобмолочної залози у жінок, гінекомастії у чоловіків та доброякісних або злоякісних пухлинмолочної залози з наявністю або відсутністю метастазів як у чоловіків, так і у жінок [Brodie AM and Njar VC, Steroids, 2000, 65:171-179; Pritchard Kl, Cancer, 2000, 85, suppl 12: 3065-3072], або у чоловічих та жіночих особнів хатніх тварин. Завдяки залученню естрогенів у механізми овуляції, імплантації та вагітності, інгібітори ароматази за цим винаходом можуть бути використані, відповідно, з контрацептивною, контрагестивною або абортивною метою у жінок [Njar VC and Brodie AM, Drugs, 1999, 58: 233-255], а також у самок диких або хатніх тварин. 7 Матка є іншим репродуктивним органом, що реагує на естрогенну стимуляцію, і через те інгібування ароматази є корисним для лікування або попередження ендометріозу, доброякісних хвороб матки або доброякісних або злоякісних пухлин матки з наявністю або відсутністю метастазів у жінок [Njar VC and Brodie AM, Drugs, 1999, 58: 233255] або у самок хатніх тварин. Оскільки яєчник є фізіологічним джерелом естрогену, інгібітори ароматази можуть бути використані для лікування аномального або несвоєчасного оваріального продукування естрогену, такого як синдром полікистозних яєчників або передчасна статева зрілість, відповідно [Bulun et al., J Steroid Biochem Моl Biol, 1997, 61: 133-139]. Оваріальні, а також неоваріальні, але естроген-продуковані доброякісні або злоякісні пухлини з наявністю або відсутністю метастазів (Sasano Η and Harada N, Endocrine Reviews, 1998, 19: 593-607] також можна ефективно виліковувати інгібіторами ароматази за цим винаходом. У чоловіків передміхурова залоза та тестикулярні тканини також реагують на естрогенну стимуляцію [Abney TO, Steroids, 1999, 64: 610-617; Carreau S et al., Int J Androl, 1999, 22: 133-138]. Тому інгібітори ароматази можуть бути використані для лікування або попередження доброякісних [Sciarra F and Toscano V, Archiv Androl, 2000, 44: 213-220] або злоякісних пухлин передміхурової залози з наявністю або відсутністю метастазів [Auclerc G et al., Oncologist, 2000, 5: 36-44] або для лікування, попередження порушення або регуляції сперматогенезних функцій або дисфункцій у чоловіків, а також самців диких або хатніх тварин. Відомо також, що естрогени залучені у регуляцію оновлення кісток, тому інгібітори ароматази можуть бути корисними, окремо або у комбінації з іншими антирезорбтивними або проостеогенними засобами, у лікуванні або профілактиці кісткових порушень згідно з відповідними терапевтичними схемами або режимами. Крім того, естрогени залучені у регуляцію балансу між предомінантними імунними функціями Th1 і Th2 і тому можуть бути корисними у лікуванні або попередженні гендернозалежних аутоімунних захворювань, таких як вовчак, розсіяний склероз, ревматоїдний артрит і тому подібне. Коли сполуки формули (І) вводять для лікування або попередження естроген-залежних порушень, вказані сполуки можна комбінувати з одним або декількома іншими терапевтичними ендокринними гормональними препаратами, що стосуються статевої функції. У разі регуляції або керування репродуктивними функціями, такими як чоловіча або жіноча плодовитість, вагітність, аборт або пологи, сполуки формули (І) можуть бути комбіновані, наприклад, з агоністом або антагоністом LH-RH, естропрогестативним контрацептивом, прогестином, антипрогестином або простагландином. Коли сполуки формули (І) призначені для лікування або попередження доброякісних або злоякісних захворюваньмолочної залози, матки або яєчника, вказані сполуки можуть бути комбіновані, наприклад, з антипрогестином, прогестином або агоністом або антагоністом LH-RH. У разі ліку 80307 8 вання або попередження доброякісних або злоякісних захворювань передміхурової залози або яєчка, сполуки формули (І) можуть бути комбіновані, наприклад, з антиандрогеном, прогестином, інгібітором ліази або агоністом або антагоністом LHRH. Термін "комбінований" означає будь-який протокол для спільного введення сполуки формули (І) та однієї або більше інших фармацевтичних речовин, незалежно від природи, часу введення та зміни дози з часом для будь-якої з речовин. Спільне введення може бути, наприклад, паралельним або послідовним. Таким чином, винахід відноситься також до способу лікування або попередження вищевказаних захворювань, що містить введення пацієнту, який цього потребує, терапевтично ефективної кількості сполуки формули (І) або фармацевтично прийнятної кислотно-адитивної солі вказаної сполуки, необов'язково, у комбінації з іншим активним інгредієнтом. Для лікування або попередження будь-якого з цих захворювань сполуки формули (І) можуть бути введені, наприклад, перорально, місцево, парентерально, у стандартних лікарських сумішах, що містять загальноприйняті нетоксичні фармацевтично прийнятні носії, допоміжні речовини і розріджувачі. Ці дозовані форми наведені як приклади, але спеціалістами в галузі фармації можуть бути розроблені інші лікарські форми для введення сполук формули (І). Термін парентеральний, як він використаний в описі, вміщує підшкірні ін'єкції, внутрішньовенні, внутрішньом'язові, інтрастенальні способи ін'єкції або інфузії. Окрім застосування для лікування людей сполуки за винаходом є ефективними для лікування теплокровних, таких як миші, пацюки, коні, велика рогата худоба, вівці, собаки, кішки та інші. Фармацевтичні композиції, що містять активний інгредієнт, можуть бути у придатній для перорального вживання формі, наприклад, такій як таблетки, пастилки, коржі, водні або олійні суспензії, порошки або гранули, що диспергуються, емульсії, тверді або м'які капсули, або сиропи чи еліксири. Композиції, призначені для перорального вживання, можуть бути одержані будь-яким способом, відомим з рівня техніки для одержання фармацевтичних сумішей, і такі композиції можуть містить один або більше засобів, що вибирають з групи, яка містить підсолоджувані, коригенти, барвники та консерванти, які забезпечують фармацевтично вишукані та приємні на смак препарати. Таблетки містять активний інгредієнт у суміші з нетоксичними фармацевтично прийнятними наповнювачами, які є зручними для одержання таблеток. Цими наповнювачами можуть бути, наприклад, інертні розріджувачі, такі як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; гранулювальні та дезінтегрувальні засоби, наприклад, кукурудзяний крохмаль або альгінова кислота; зв'язувальні засоби, наприклад, крохмаль, желатин або камедь акації, та мастильні засоби, наприклад, стеарат магнію, стеаринова кислота або тальк. Таблетки можуть бути без оболонки або на таблетки може бути на 9 несена відомими способами оболонка, що перешкоджає розпаду та поглинанню у шлунковокишковому тракті, тим самим забезпечується уповільнена дія впродовж тривалого періоду. Наприклад, може бути використаний такий матеріал для затримки часу, як гліцерил моностеарат або гліцерил дистеарат. Оболонка також може бути нанесена способом, [описаним у патентах США 4256108, 4166452 та 4265874], з метою одержання осмотичних терапевтичних таблеток для регульованого вивільнення. Сполуки для перорального вживання можуть також бути представлені у вигляді твердих желатинових капсул, де активний інгредієнт змішаний з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або у вигляді м'яких желатинових капсул, де активний інгредієнт змішаний з водним або масляним середовищем, наприклад, арахісовим маслом, рідким парафіном або оливковою олією. Водні суспензії містять активний інгредієнт у суміші з наповнювачами, які підходять для одержання водних суспензій. Такими наповнювачами є суспендувальні засоби, наприклад, натрійкарбоксиметилцелюлоза, метилцелюлоза, гідроксипропілметилцелюлоза, альгінат натрію, полівінілпіролідон, трагакантова камедь і камедь акації; диспергувальними або змочувальними засобами, наприклад, природними фосфатидами, такими як лецитин, або продуктами конденсації алкіленоксиду з жирними кислотами, наприклад, поліоксіетиленстеаратом, або продуктами конденсації етиленоксиду з довголанцюговими аліфатичними спиртами, наприклад, гептадекаетиленоксицетанолом, або продуктами конденсації етиленоксиду з неповними ефірами, утвореними жирними кислотами та гекситом, такими як поліоксіетиленсорбітмоноолеат, або продуктами конденсації етиленоксиду з неповними ефірами, утвореними жирними кислотами та ангідридами гекситів, наприклад, з поліетиленсорбітанмоноолеат. Водні суспензії можуть також містити один або більше консервантів, наприклад, етилабо н-пропілпгідроксибензоат, один або більше барвників, один або більше коригентів та один або більше підсолоджувачів, таких як сахароза, сахарин або аспартам. Масляні суспензії можуть бути приготовані шляхом суспендування активного інгредієнта у рослинній олії, наприклад, арахісовій олії, оливковій олії, кунжутній олії або кокосовій олії або мінеральній олії, такій як рідкий парафін. Масляні суспензії можуть містити згущувачі, наприклад, бджолиний віск, твердий парафін або цетиловий спирт. Для одержання приємного на смак перорального препарату можуть бути додані вищевказані підсолоджувані та коригенти. Для схоронності таких композицій може бути доданий антиоксидант, такий як аскорбінова кислота. Порошки і гранули, що диспергуються, придатні для одержання водної суспензії шляхом додавання води, містять активний інгредієнт у суміші з диспергувальним або змочувальним засобом, суспендувальним засобом та одним або більше консервантами. Прикладами придатних диспергува 80307 10 льних або змочувальних засобів і суспендувальних засобів є вищезгадані засоби. Можуть також бути присутніми додаткові наповнювачі, наприклад, підсолоджувачі, коригенти та барвники. Фармацевтичні композиції за цим винаходом можуть також бути у формі емульсії масло-уводі. Масляною фазою може слугувати рослинна олія, наприклад, арахісова олія, оливкова олія, або мінеральна олія, наприклад, рідкий парафін, або їх суміші. Придатними емульгувальними засобами можуть слугувати природні фосфатиди, наприклад, соєвий лецитин, та ефіри або неповні ефіри, утворені жирними кислотами та ангідридами гекситів, наприклад, сорбітанмоноолеат, та продукти конденсації вказаних неповних ефірів з етиленоксидом, наприклад, поліоксіетиленсорбітанмоноолеат. Емульсії можуть також містити підсолоджувачі та коригенти. Фармацевтичні композиції можуть бути у формі стерильної водної або масляної суспензії для ін'єкції. Така суспензія може бути приготована згідно з відомим рівнем техніки із застосуванням вищевказаних придатних диспергувальних або змочувальних засобів та суспендувальних засобів. Стерильний препарат для ін'єкції може також бути у вигляді стерильного розчину або стерильної суспензії для ін'єкції у нетоксичному парентеральноприйнятному розріджувачі або розчиннику, наприклад, у вигляді розчину у 1,3-бутандіолі. Як прийнятні розріджувачі та розчинники можуть також бути використані вода, розчин Рінгера та ізотонічний розчин хлориду натрію. Крім того, як середовище, що розчиняє або суспендує, звичайно використовують стерильні нелетучі масла. З цією метою може бути використане будь-яке пом'якшуюче нелетуче масло, включаючи моно- або дигліцериди. Крім того, жирні кислоти, такі як олеїнова кислота, знаходять застосування у препаратах для ін'єкції. Для лікування вищевказаних станів використовують дозування в інтервалі від близько 0,0001мг до близько 20мг/кг маси тіла на день, або альтернативно, в інтервалі від близько 0,1мг до близько 2000мг на пацієнта на день. Кількість активного інгредієнта, яка може бути об'єднана з носіями для одержання разової лікарської форми, змінюється залежно від пацієнта, який піддається лікуванню, та конкретного способу введення. Стандартні лікарські форми звичайно містять приблизно від 0,1мг до 400мг, краще, від 1мг до 100мг, активного інгредієнта, в основному 0,1мг, 1мг, 2мг, 5мг, 10мг, 20мг, 40мг, 50мг, 60мг, 80мг, 100мг або 400мг. Зрозуміло, проте, що конкретний рівень дози для кожного окремого пацієнта варіюється залежно від факторів, до складу яких входить вік, маса тіла, загальний стан здоров'я, стать, дієта, час введення, спосіб введення, швидкість виведення, комбінації лікарських засобів і складність конкретного захворювання, яке виліковують. Похідні 1-Ν-феніламіно-1Н-імідазолу формули (І) за винаходом та кислотно-адитивні солі, що їм відповідають, можуть бути одержані за такою загальною схемою 1. Згідно зі схемою 1 похідне аниліну (1) конденсують з альдегідом формули (2) та проміжний імін 11 відновлюють натрійборгідридом або гідрогенизують, використовуючи оксид паладію або платини як каталізатор, що дає Ν,Ν-дизаміщений анілін (3). Вказаний анілін (3) може також бути одержаний шляхом взаємодії галогенової похідної (8) з аніліном формули (1). Ν,Ν-дизаміщений анілін (3) перетворюють на відповідну нітрозо-похідну, використовуючи стандартні умови, потім відновлюють, одержуючи 1,1дизаміщений гідразин формули (4). Альтернативно, 1,1-дизаміщений гідразин (4) може бути одержаний шляхом селективного N-алкілування сполуки формули (7) сполукою формули (8) із використанням умов, [описаних U. LERCH та J. KÖNIG (Synthesis, 1983, 2,157-8]. Після чого конденсація (4) з діалкілоксіалкілізотіоціанатною або етилендіоксіалкілізоціанатною похідною дає тіосемікарбазид (5), який перетворюють на 1-аміноімідазол-2-тіон (6) шляхом обробки кислотою, такою як оцтова кислота або сірчана кислота. Десульфуризація (6) в оцтовій кислоті в умовах, [описаних S.GRIVAS та E.RONNE у Acta Chemica Scandinavia, 1995, 49, 225-229], дає кінцеву похідну 1-N-феніламіно-1Н-імідазолу (І), яку, необов'язково, перетворюють на одну з фармацевтично прийнятних кислотно-адитивних солей. Альтернативно, сполука (І), де R3 або R6 означає електроноакцепторну групу, може бути одержана конденсацією N-імідазолоаніліну (9) з галогеновою похідною (8). Наступні приклади та випробування наведені з метою ілюстрування винаходу і не можуть розглядатись як такі, що обмежують. Одержання N-алкіланілинів (3) Приклад 1 N-(4-хлорФенілметил)-4-ціаноанілін До розчину 4-хлорбензальдегіду (35,69г, 0,253моль) в абсолютному етанолі (250мл) додають порціями 4-амінобензонітрил (30г, 0,253моль). Реакційну суміш перемішують при кімнатній температурі впродовж 3год., осад фільтрують, промивають діетиловим ефіром і виливають у 1/1 суміш ТГФ/етанол (250мл). Утворену суспензію охолоджують льодом, додають порціями NaBH4 (4,8г, 0,127моль) і реакційну суміш перемішують при кімнатній температурі 0,75год. Після додання оцтової кислоти (3мл) і води (500мл) осад фільтрують, промивають водою і сушать, одержуючи білу тверду речовину (51,27г, 84%), т.пл. 130°С. 1 Н ЯМР (CDCI 3): 4,35 (д, 2Н), 4,75 (с, 1Н), 6,55 (д, 2Н), 7,20-7,50 (м, 6Н). Використовуючи аналогічну методику, але замінюючи 4-хлорбензальдегід на - 4-метоксибензальдегід, - 3-фтор-4-метоксибензальдегід, одержують - 4-ціано-N-(4-метоксифенілметил)анілін (т.пл. 109°С) та 80307 12 4-ціано-N-(3-фтор-4метоксифенілметил)анілін (т.пл. 108°С), відповідно. Приклад 2 4-ціано-N-(4-метилфенілметил)анілін Суміш п-толуальдегіду (40,68г, 0,338моль), 4амінобензонітрилу (40г, 0,338моль) та 5% Pd/C (4г) в абсолютному етанолі (300мл) гідрують при кімнатній температурі впродовж ночі. Реакційну суміш розріджують метиленхлоридом, фільтрують на целіті та концентрують досуха. Кристалізація з етанолу дає білу тверду речовину (74,9г, 99%), т.пл. 100°С. 1 Н ЯМР (CDCI 3): 2,35 (с, 3Н), 4,3 (д, 2Н), 4,7 (с, 1Н), 6,55 (д, 2Н), 7,10-7,30 (м, 4Н), 7,35 (д, 2Н). Використовуючи аналогічну методику, але замінюючи п-толуальдегід на - 4-ціанобензальдегід, - 3,4-диметоксибензальдегід, одержують - 4-ціано-N-(4-ціанофенілметил)анілін (т.пл. 156°С) та - 4-цiaнo-N-(3,4-димeтoкcифeнiлмeтил)aнiлiн (т.пл. 150°С), відповідно. Одержання Ν,Ν-дизаміщених гідразинів (4) Вказані сполуки звичайно одержують за методикою, [описаною у Tetrahedron 1982, 38(3): 419423 та Organic Fonctional Group Preparations 1968,1: 374-376]. Приклад 3 N1-(4-хлорфенілметил)-N1-(4ціанофеніл)гідразин До охолоджуваної льодом суспензії 4-ціано-N(4-хлорфенілметил)аніліну (30г, 0,125моль) у 2н. H2SO4 (150мл) додають розчин нітриту натрію (9,48г, 0,137моль) у воді (30мл). Реакційну суміш перемішують при кімнатній температурі впродовж 2год. Додають розчин нітриту натрію (9,48г, 0,137моль) у воді (30мл) і реакційну суміш перемішують впродовж ночі. Додають розчин нітриту натрію (6,6г, 0,095моль) у воді (20мл) і реакційну суміш перемішують впродовж 1год. Після екстракції етилацетатом органічний шар промивають послідовно насиченим розчином гідрокарбонату натрію, водою, насиченим розчином солі, сушать над сульфатом натрію та випарюють у вакуумі, одержуючи білу тверду речовину (30,5г). До суспензії одержаної твердої речовини у суміші з діетилового ефіру (60мл), АсОН (60мл) і води (60мл) додають цинковий порошок (24,5г, 0,375моль) з такою швидкістю, щоб підтримувати температуру нижче 35°С. Суміш перемішують впродовж 2год., додають АсОН (60мл), воду (60мл) та цинк (6г) і перемішування продовжують ще впродовж 0,5год. Після додавання ефіру (200мл) реакційну суміш фільтрують, неорганічну речовину промивають етилацетатом, продукт екстрагують етилацетатом і органічний шар промивають водою, насиченим розчином солі і сушать над сульфатом натрію. Розчинники концентрують у вакуумі 13 і кристалізацією з діізопропілового ефіру одержують тверду речовину (18,78г, 58%), т.пл. 90°С. 1 Н ЯМР (CDCl3): 3,75 (с, 2Н), 4,69 (с, 2Н), 7,05 (д, 2Н), 7,15 (д, 2Н), 7,35 (д, 2Н), 7,49 (д, 2Н). Використовуючи аналогічну методику, але замінюючи 4-ціано-N-(4-хлорфенілметил)анілін на - 4-ціано-N-(4-метоксифенілметил)анілін, 4-ціано-N-(3-фтор-4метоксифенілметил)анілін, - 4-ціано-N-(4-метилфенілметил)анілін, - 4-ціано-N-(4-ціанофенілметил)анілін, - 4-ціано-N-(3,4-диметоксифенілметил)анілін, - 4-бром-N-(4-ціанофенілметил)анілін, 80307 14 одержують N1-(4-метоксифенілметил)-N1 -(4ціанофеніл)гідразин (т.пл. 74°С), N1-(3-фтор-4-метоксифенілметил)-N1 -(4ціанофеніл)гідразин (т.пл. 102°С), N1-(4-метилфенілметил)-N1 -(4ціІанофеніл)гідразин (т.пл. 74°С), N1-(4-цiaнoфeнiлмeтил)-N1 -(4цiaнoфeнiл)гiдpaзин (т.пл. 215°С), N1-(3,4-диметоксифенілметил)-N1 -(4ціанофеніл)гідразин (т.пл. 134°С) та N1-ціанофенілметил)-N1 -(4бромфеніл)гідразин (т.пл. 114°С), відповідно. 15 Приклад 4 N1-(4-трифторметилфенілметил)-N1-(4ціанофеніл)гідразин В атмосфері азоту порошкоподібний амід натрію (95%, 4,8г, 0,117моль) вносять при перемішуванні у колбу, яка містить ТГФ (100мл). Розчин охолоджують льодом і додають порціями 4ціанофенілгідразингідрохлорид [одержаний за Jose L.Castro et al. J. Med. Chem. 1994, 37, 30233032] (10г, 0,058моль). Крижану баню забирають і крізь оранжеву суспензію пропускають потік азоту впродовж 1год. для видалення більшої частини розчиненого аміаку. При охолодженні льодом додають 4-трифторметилбензилхлорид (12г, 0,062моль), потім реакційну суміш перемішують при кімнатній температурі впродовж 1,5год. і виливають у воду (100мл). Після екстракції етилацетатом органічний шар промивають водою, сушать над сульфатом натрію і випарюють у вакуумі. Тритурування з діізопропілового ефіру дає жовту тверду речовину (7,5г, 43%), т.пл. 98°С. 1 Н ЯМР (CDCl3): 3,8 (с, 2Н), 4,8 (с, 2Н), 7,05 (д, 2Н), 7,33 (д, 2Н), 7,5 (д, 2Н), 7,6 (д, 2Н). Використовуючи аналогічну методику, але замінюючи 4-трифторметилбензилхлорид на - 4-фторбензонітрил, - 4-фторбензилбромід, - 4-метилтіобензилхлорид, - 3,4-дифторбензилхлорид, - 2,4-дифторбензилхлорид, - 3,5-дифторбензилхлорид, - 4-бромбензилбромід, одержують - N1-біс-(4-ціанофеніл)гідразин (т.пл. 222°С), N1-(4-фторфенілметил)-N1 -(4ціанофеніл)гідразин (т.пл. 114-115°С), N1-(4-метилтіофенілметил)-N1 -(4ціанофеніл)гідразин (т.пл. 72°С), N1-(3,4-дифторфенілметил)-N1 -(4ціанофеніл)гідразин (т.пл. 72°С), N1-(2,4-дифторфенілметил)-N1 -(4ціанофеніл)гідразин (т.пл. 70°С), N1-(3,5-дифторфенілметил)-N1 -(4ціанофеніл)гідразин (т.пл. 124°С) та N1-бромфенілметил)-N1 -(4ціанофеніл)гідразин (т.пл. 90°С), відповідно. Приклад 4А N1-(4-ціаноазенілметил)-N1-(4метоксифеніл)гідразин Хлорметилбензонітрил (25г, 164,90ммоль) вносять при перемішуванні у колбу, яка містить толуол (200мл) і тріетиламін (46,40мл, 329,80ммоль). Додають порціями 4ціанофенілгідразингідрохлорид [одержаний за Jose L.Castro et al., J. Med. Chem. 1994, 37, 30233032] (28,80г, 164,90ммоль) і реакційну суміш перемішують 3год. при нагріванні до кипіння зі зворотним холодильником. Після охолодження суміш фільтрують, промивають толуолом (50мл) і водою (200мл) та одержують білу тверду речовину (27,20г, 65%), т.пл. 115°С. 1 Н ЯМР (ДМСО d6): 3,65 (с, 3Н), 4,30 (с, 2Н), 4,57 (с, 2Н), 6,77 (д, 2Н), 6,94 (д, 2Н), 7,48 (д, 2Н), 7,76 (д, 2Н). Одержання імідазолів формули (І) 80307 16 Приклад 5 4-[N-(1Н-імідазол-1-іл)-N-(4трифторметилфеніл)аміно]бензонітрил До охолодженого розчину (10-15°С) третВuОK (1,06г, 0,00895моль) у ДМСО (18мл) додають порціями N-(1Н-імідазол-1-іл)-4-трифторметиланілін (1,85г, 0,00814моль) (одержаний десульфуризацією з відповідного 2,3-дигідро-1Н-імідазол-2-тіону, [J.G.Schantl, Heterocycles, 37(3), 1873, 1994]). Реакційну суміш перемішують при кімнатній температурі впродовж 1год., потім додають 4-фторбензонітрил (0,936г, 0,00773моль) до ДМСО (18мл), реакційну суміш перемішують впродовж 2 год. і виливають у воду концентрований розчин гідроксиду натрію. Осад збирають і сушать у вакуумі. Флеш-хроматографія на силікагелі (суміш толуол/діоксан: 7/3) і кристалізація з діізопропілового ефіру дають тверду речовину (1,6г, 60%), т.пл. 104°С. Аналіз Розраховано: С: 62,2; Н: 3,38; F: 17,36; N: 17,07. Знайдено: С: 62,22; Н: 3,40; F: 17,3; N: 17,1. 1 Н ЯМР (ДМСО d6): 6,96 (д, 2Н), 7,15 (с, 1Н), 7,31 (д, 2Н), 7,68 (с, 1Н), 7,6-7,85(м,4Н),7,87(с,1Н). Приклад 6 4-[N-(1Н-імідазол-1-іл)-N-(4трифторметилфенілметил)аміно]бензонітрил а) 4-[N-(2,3-дигідро-1Н-імідазол-1-іл-2-тіон)-N(4-трифторметилфенілметил)аміно] бензонітрил До суспензії N1-(4-трифторметилфенілметил)N1-(4-ціанофеніл)гідразину (7,5г, 0,025моль) в етанолі (100мл) додають краплями 2,2диметоксіетилізотіоціанат (4г, 0,027моль) і реакційну суміш нагрівають до температури кипіння зі зворотнім холодильником впродовж 2год. Після охолодження розчинник випаровують у вакуумі, одержаний осад виливають у 2н H2SO4 (20мл) і суспензію нагрівають до температури кипіння зі зворотнім холодильником впродовж 0,3год. Після екстракції етилацетатом органічний шар промивають водою, сушать над сульфатом натрію і концентрують у вакуумі. Флеш-хроматографія на силікагелі (толуол/діоксан: 8/2) та тритурування із суміші діізопропіловий ефір/етанол дають жовту тверду речовину (2,7г, 28%), т.пл. 200°С. 1 Н ЯМР (ДМСО d6): 5-5,4 (м, 2Н), 6,65 (д, 2Н), 6,95 (д, 1Н), 7,15 (д, 1Н), 7,7 (м, 6Н). b) 4-[Ν-(1Н-імідазол-1-іл)-N-(4трифторметилфенілметил)аміно]бензонітрил 35% пероксид водню (1,1мл, 0,035моль) додають краплями до охолоджуваної льодом суспензії 4-[N-(2,3-дигідро-1Н-імідазол-1-іл-2-тіон)-N(4-трифторметилфенілметил)аміно]бензонітрилу (2,7г, 0,0072моль) в оцтовій кислоті (20мл). Після того, як ТСХ підтвердить завершення взаємодії, реакційну суміш розріджують водою, доводять до рН11 за допомогою гідроксиду натрію, обробляють гідросульфітом натрію та екстрагують етилацетатом. Органічний шар сушать над сульфатом натрію і концентрують у вакуумі. Флешхроматографія на силікагелі (суміш толуол/етилацетат: 7/3, потім 6/4) і кристалізація з діізопропілового ефіру дають тверду речовину (1г, 41%), т.пл. 134°С. Аналіз Розраховано: С: 63,1; Н: 3,8; N: 16,3. 17 Знайдено: С: 63,4; Н: 3,58; N: 16,3. Н ЯМР (ДМСО d6): 5,15 (с, 2Н), 6,65 (д, 2Н), 7 (с, 1Н), 7,4 (с, 1Н), 7,5-7,9 (м, 7Н). М+=342. Використовуючи аналогічну методику, але замінюючи N1-(4-трифторметилфеніл-метил)-N1-(4ціанофеніл)гідразин на N1-(4-хлорфенілметил)-N1 -(4ціанофеніл)гідразин, N1-(4-метоксифенілметил)-N1 -(4ціанофеніл)гідразин, N1-(3-фтор-4-метоксифенілметил)-N1 -(4ціанофеніл)гідразин, N1-(4-метилфенілметил)-N1 -(4ціанофеніл)гідразин, N1-(4-ціанофенілметил)-N1 -(4ціанофеніл)гідразин, N1-(3,4-диметоксифенілметил)-N1 -(4ціанофеніл)гідразин, - N1-бис-(4-ціанофеніл)гідразин, N1-(4-фторфенілметил)-N1 -(4ціанофеніл)гідразин, N1-(4-метилтіофенілметил)-N1 -(4ціанофеніл)гідразин, N1-(3,4-дифторфенілметил)-N1 -(4ціанофеніл)гідразин, N1-(2,4-дифторсренілметил)-N1 -(4ціанофеніл)гідразин, N1-(3,5-дифторфенілметил)-N1 -(4ціанофеніл)гідразин, N1-(4-бромфенілметил)-Ν1 -(4ціанофеніл)гідразин, N1-(4-ціанофенілметил)-N1 -(4бромфеніл)гідразин, N1-(4-цiaнoфeнiлмeтил)-N1 -(1мeтилбeнзoтpiaзoл-6-iл)гiдpaзин, - N1-(4-цiaнoфeнiлмeтил)-N1 -(3-тpифтopмeтил4-цiaнoфeнiл)гiдpaзин, - N1-(фeнiлмeтил)-N1-(4-цiaнoфeнiл)гiдpaзин, N1-(4-ціанофеніл)-Ν1-(3-тpифтopмeтил-4цiaнoфeнiл)гiдpaзин, N1-(3-фторфенілметил)-Ν1 -(4ціанофеніл)гідразин, N1-(4-метоксикарбонілфенілметил)-Ν1 -(4ціанофеніл)гідразин, - N1-(4-ціанофеніл)-Ν1-(4-фторфеніл)гідразин, N1-(3-тpифтopмeтилфeнiлмeтил)-N1 -(4цiaнoфeнiл)гiдpaзин, одержують, відповідно, такі сполуки: Приклад 7 4-[N-(1Н-імідазол-1-іл)-N-(4хлорфенілметил)аміно]бензонітрилгідрохлорид Т.пл. 190°С. Аналіз Розраховано: С: 59,15; Н: 4,09; СІ: 20,54; N: 16,23. Знайдено: С: 59,04; Н: 3,99; СІ: 20,5; N: 16,2. 1 Н ЯМР (ДМСО d6): 5,15 (с, 2Н), 6,95 (д, 2Н), 7,4 (с, 4Н), 7,75 (м, 3Н), 8,10 (с, 1Н), 9,6(с,1Н). Приклад 8 4-[N-(1Н-імідазол-1-іл)-N-(4метоксифенілметил)аміно]бензонітрил гідро хлорид Т.пл. 178°С. Аналіз Розраховано: С: 63,44; Н: 5,03; СІ: 10,40; N: 16,44. Знайдено: С: 63,4; Н: 5,01; СІ: 10,4; N: 16,6. 1 80307 18 1 Н ЯМР (ДМСО d6): 3,70 (с, 3Н), 5,05 (с, 2Н), 6,85 (д, 2Н), 7 (д, 2Н), 7,25 (д, 2Н), 7,79 (с, 1Н), 7,80 (д, 2Н), 8,1 (с, 1Н), 9,50 (с, 1Н). Приклад 9 4-[N-(1Н-імідазол-1-іл)-N-(3-фтор-4метоксифенілметил)аміно]бензонітрилгідрохлорид Т.пл. 190°С. 1 Н ЯМР (ДМСО d6): 3,80 (с, 3Н), 5,05 (с, 2Н), 7 (д, 2Н), 7,05-7,15 (м, 2Н), 7,30 (д, 1Н), 7,8 (д, 2Н), 7,75 (с, 1Н), 8,1 (с, 1Н), 9,50 (с, 1Н). Приклад 10 4-[N-(1Н-імідазол-1-іл)-N-(4метилфенілметил)аміно]бензонітрил Т.пл. 156°С. Аналіз Розраховано: С: 74,98; Η: 5,59; Ν: 19,43. Знайдено: С: 74,55; Η: 5,56; Ν: 19,3. 1 Η ЯМР (ДМСО d6): 2,25 (с, 3Н), 4,95 (с, 2Н), 6,65 (д, 2Н), 6,98 (с, 1Н), 7,10 (д, 2Н), 7,2(д,2Н),7,35(с,1Н),7,70(м,3Н). Приклад 11 4-[N-(1Н-імідазол-1-іл)-N-(4ціанофенілметил)аміно]бензонітрилгідрохлорид Т.пл. 195°С. Аналіз Розраховано: С: 64,38; Η: 4,2; СІ: 10,56; Ν: 20,86. Знайдено: С: 64,31; Η: 4,29; СІ: 10,6; Ν: 20,9. 1 Н ЯМР (ДМСО d6): 5,30 (с, 2Н), 7,10 (д, 2Н), 7,62 (д, 2Н), 7,70-8 (м, 5Н), 8,17 (с, 1Н),9,7(с, 1Н) Приклад 12 4-[N-(1Н-імідазол-1-іл)-N-(3,4диметоксифенілметил)аміно]бензонітрилгідрохлорид Т.пл. 167°С. Аналіз Розраховано: С: 61,54; Н: 5,16; СІ: 9,56; N: 15,11. Знайдено: С: 61,39; Н: 5,13; СІ: 9,57; N: 15,1. 1 Н ЯМР (ДМСО d6): 3,70 (с, 3Н), 3,73 (с, 3Н), 5 (с, 2Н), 6,65-7,15 (м, 5Н), 7,75 (с, 1Н), 7,80 (с, 2Н), 8,10 (с, 1Н), 9,5 (с, 1Н). Приклад 13 4,4-[N-(1Н-імідазол-1-іл)аміно]бісбензонітрилгідрохлорид Т.пл. 199°С. Аналіз Розраховано: С: 63,46; Н: 3,76; СІ: 11,02; N: 21,76. Знайдено: С: 63,2; Н: 3,81; СІ: 11,0; N: 21,9. 1 Н ЯМР (ДМСО d6): 7,26 (д, 4Н), 7,9 (с, 1Н), 7,92 (д, 4Н), 8,30 (с, 1Н), 9,80 (с, 1Н). Приклад 14 4-[N-(1Н-імідазол-1-іл)-N-(4фторфенілметил)аміно]бензонітрилпдрохлоридгемігідрат Т.пл. 176-178°С. Аналіз Розраховано: С: 60,45; Н: 4,48; F: 5,62; СІ: 10,05; N: 16,59. Знайдено: С: 60,71; Н: 4,64; F: 5,54; СІ: 10,6; N: 17,0. 1 Н ЯМР (ДМСО d6): 5,15 (с, 2Н), 7,2 (τ, 2Н), 7,4 (кв, 2Н), 7,8 (с, 1Н), 7,0-7,8 (АВ, 4Н),9,6(с, 1Н). Приклад 15 4-[N-(1Н-імідазол-1-іл)-N-(4метилтіофенілметил)аміно]бензонітрил Т.пл. 128°С. 19 Аналіз Розраховано: С: 67,56; Н: 5,03; Ν: 17,5; S: 10,02. Знайдено: С: 67,12; Н: 4,90; Ν: 17,2; S: 9,51. 1 Н ЯМР (ДМСО d6): 2,4 (с, 3Н), 5,05 (с, 2Н), 6,65 (д, 2Н), 7 (с, 1Н), 7,15-7,3 (м, 4Н), 7,35 (с, 1Н),7,7(м,3Н). Приклад 16 4-[N-(1Н-імідазол-1-іл)-N-(4метилсульфонілфенілметил)аміно]бензонітрил Т.пл. 190°С. 1 Н ЯМР (ДМСО d6): 3,2 (с, 3Н), 5,2 (с, 2Н), 6,6 (д, 2Н), 7 (с, 1Н), 7,45 (с, 1Н), 7,6-7,9 (м, 7Н). Приклад 17 4-[N-(1Н-імідазол-1-іл)-N-(3,4дифторфенілметил)аміно]бензонітрил Т.пл. 132°С. Аналіз Розраховано: С: 65,86; Н: 3,9; N: 18,07. Знайдено: С: 65,47; Н: 3,78; N: 18,1. 1 Н ЯМР (ДМСО d6): 5,0 (с, 2Н), 6,7 (д, 2Н), 6,97,8 (м, 8Н). Приклад 18 4-[N-(1Н-імідазол-1-іл)-N-(2,4дифторфенілметил)аміно]бензонітрил Т.пл. 149°С. Аналіз Розраховано: С: 65,86; Н: 3,9; N: 18,07. Знайдено: С: 66,0; Н: 3,84; N: 18,2. 1 Н ЯМР (ДМСО d6): 5,1 (с, 2Н), 6,7 (д, 2Н), 6,97,8 (м, 8Н). Приклад 19 4-[N-(1Н-імідазол-1-іл)-N-(3,5дифторфенілметил)аміно]бензонітрил Т.пл. 170°С. Аналіз Розраховано: С: 65,86; Н: 3,9; N: 18,07. Знайдено: С: 65,73; Н: 3,8; N: 18,02. 1 Н ЯМР (ДМСО d6): 5,1 (с, 2Н), 6,6 (д, 2Н), 77,2 (м, 4Н), 7,5 (с, 1Н), 7,75 (д, 2Н), 7,9(с,1Н). Приклад 20 4-[N-(1Н-імідазол-1-іл)-N-(4бромфенілметил)аміно]бензонітрилгідрохлорид Т.пл. 125°С. 1 Н ЯМР (CDCI 3): 5 (с, 2Н), 6,8 (д, 2Н), 7 (с, 1Н), 7,25 (м, 3Н), 7,35 (с, 1Н), 7,4 (д, 2Н), 7,65 (д,2Н), 9,85 (с,1Н). Приклад 21 4-[N-(1Н-імідазол-1-іл)-N-(4бромфеніл)амінометил]бензонітрил Т.пл. 138°С. Аналіз Розраховано: С: 57,81; Н: 3,71; N: 15,86; Вг: 22,62. Знайдено: С: 57,85; Н: 3,7; N: 15,9; Вr: 23,2. 1 Н ЯМР (ДМСО d6): 4,85 (с, 2Н), 6,5 (д, 2Н), 7 (с, 1Н), 7,1 (с, 1Н), 7,25-7,55 (м, 5Н), 7,6 (д, 2Н) Приклад 22 4-[N-(1-метилбензотріазол-6-іл)-N-(1Німідазол-1-іл)амінометил]бензонітрил Т.пл. 184°С. 1 Н ЯМР (ДМСО d6): 4,20 (с, 3Н), 5,1 (с, 2Н), 6,5 (дд, 1Н), 6,95 (с, 1Н), 7,2 (с, 1Н), 7,4 (с, 1Н), 7,57 (д, 2Н), 7,7-7,85 (м, 3Н), 7,9 (д, 1Н) Приклад 23 4-[N-(1Н-імідазол-1-іл)-N-(4ціанофенілметил)аміно]-3-трифторметилбензонітрил Т.пл. 226°С. 80307 20 Аналіз Розраховано: С: 62,18; Н: 3,29; N: 19,08. Знайдено: С: 61,89; Н: 3,35; N: 18,9. 1 Н ЯМР (ДМСО d6): 5,25 (с, 2Н), 6,8-7,05 (м, 3Н), 7,45 (с, 1Н), 7,55 (д, 2Н), 7,8 (д, 3Н),8,05 (д, 1Н) Приклад 24 4-[N-(1Н-імідазол-1-іл)-N(фенілметил)аміно]бензонітрил Т.пл. 107°С. 1 Н ЯМР (ДМСО d6): 5,05 (с, 2Н), 6,65 (д, 2Н), 7 (с, 1Н), 7,25-7,4 (м, 6Н), 7,65-7,75 (м, 3Н) Приклад 25 4-[N-(1Н-імідазол-1-іл)-N-(4-ціанофеніл)аміно]3-трифторметилбензонітрил Т.пл. 166°С. 1 Н ЯМР (ДМСО d6): 7,2 (м, 3Н), 7,3 (д, 2Н), 7,75 (с, 1Н), 7,95 (д, 2Н), 8,15 (д, 1Н), 8,25 (с,1Н) Приклад 26 4-[N-(1Н-імідазол-1-іл)-N-(3фторфенілметил)аміно]бензонітрил Т.пл. 112°С. Аналіз Розраховано: С: 69,9; Н: 4,48; N: 19,18. Знайдено: С: 69,38; Н: 4,35; N: 19,3. 1 Н ЯМР (ДМСО d6): 5,05 (с, 2Н), 6,65 (д, 2Н), 7 (с, 1Н), 7,05-7,25 (м, 3Н), 7,3-7,45 (м, 2Н), 7,7-7,85 (м, 3Н) Приклад 27 Метил 4-[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)амінометил]бензоат Т.пл. 178°С. 1 Н ЯМР (ДМСО d6): 3,85 (с, 3Н), 5,15 (с, 2Н), 6,65 (д, 2Н), 7 (с, 1Н), 7,4 (с, 1Н), 7,5 (д, 2Н), 7,657,8 (м, 3Н), 7,9 (д, 2Н). Приклад 28 4-[N-(1Н-імідазол-1-іл)-N-(4фторфеніл)аміно]бензонітрил Т.пл. 113°С. 1 Н ЯМР (ДМСО d6): 6,45 (д, 2Н), 7,1 (с, 1Н), 7,25-7,45 (м, 2Н), 7,5-7,7 (м, 5Н), 8,2 (с,1Н) Приклад 29 4-[N-(1Н-імідазол-1-іл)-N-(3трифторметилфеніпметип)аміно]бензонітрил Т.пл. 122°С. 1 Н ЯМР (ДМСО de): 5,15 (с, 2Н), 6,7 (д, 2Н), 7 (с, 1Н), 7,4 (с, 1Н), 7,5-7,8 (м, 7Н). Використовуючи методику, аналогічну тій, що наведена у прикладі 6, але замінюючи 2ізоціанатоацетальдегіддиметилацеталь на 2ізотіоціанатопропіональдегіддиетилацеталь, - 1-ізотіоціанатопропан-2-ондіетилацеталь, - 2-ізотіоціанатобутан-3-ондіетилацеталь, одержують такі сполуки: Приклад 30 4-[N-(4-метил-1Н-імідазол-1-іл)-N-(4бромфенілметил)аміно]бензонітрил Т.пл. 152°С. Аналіз Розраховано: С: 58,9; Н: 4,11; N: 15,26. Знайдено: С: 58,67; Н: 4,16; N: 15,3. 1 Н ЯМР (ДМСО d6): 2,1 (с, 3Н), 5 (с, 2Н), 6,65 (д, 2Н), 7,05 (с, 1Н), 7,3 (д, 2Н), 7,5 (д, 2Н), 7,6 (с, 1Н),7,7 (д, 2Н). М+=366. Приклад 31 21 4-[N-(5-метил-1Н-імідазол-1-іл)-N-(4бромфенілметил)аміно]бензонітрил Т.пл. 152°С. 1 Н ЯМР (CDCI 3): 2 (с, 3Н), 4,9-5,2 (м, 2Н), 6,65 (д, 2Н), 7 (с, 1Н), 7,25 (д, 2Н), 7,5 (д, 2Н), 7,6 (д, 2Н), 9,25 (с, 1Н) М+=366. Приклад 32 4-[N-(4,5-диметил-1Н-імідазол-1-іл)-N-(4бромфенілметил)аміно]бензонітрил Т.пл. 150°С. Аналіз Розраховано: С: 59,8; Н: 4,49; N: 14,7. Знайдено: С: 58,7; Η: 4,41; Ν: 14,6. 1 Η ЯМР (ДМСО d6): 1,9 (с, 3Н), 2,1 (с, 3Н), 4,955,25 (м, 2Н), 6,6 (д, 2Н), 7,3-7,8 (м, 7Н) М+=380. Приклад 33 4-[N-(1Н-імідазол-1-іл)-N-(4метоксифеніл)аміно]метилбензонітрил a) 4-[N-(2,3-дигідро-1Н-імідазол-1-іл-2-тіон)-N(4-метоксиaеніл)аміно]метилбензонітоил До суспензії N1-(4-ціанофенілметил)-N1 -(4метоксифеніл)гідразину (27,10г, 106,98ммоль) в етанолі (250мл) додають краплями 2,2диметоксіетилізотіоціанат (17,30г, 117,67ммоль) і реакційну суміш нагрівають до температури кипіння зі зворотнім холодильником впродовж 2год. Після охолодження розчинник випаровують у вакуумі, одержане масло розріджують сумішшю оцтова кислота/вода (9/1, 250мл) і суспензію нагрівають до температури кипіння зі зворотнім холодильником впродовж 1,5год. і при кімнатній температурі впродовж ночі. Одержаний залишок виливають у воду (1400мл) і збирають коричневий осад. Після тритурування з етанолом коричнева тверда речовина дає білий твердий продукт (9,60г, 27%), т.пл.: 150°С. 1 Н ЯМР (ДМСО de): 3,70 (с, 3Н), 5,08 (с, 2Н), 6,60 (д, 2Н), 6,75-7,00 (м, 3Н), 7,20 (с, 1Н), 7,80 (с, 4Н). b) 4-[N-(1Н-імідазол-1-іл)-N-(4метоксифеніл)аміно]метилбензонітрил 35% пероксид водню (1,1мл, 0,035моль) додають краплями до охолоджуваної льодом суспензії 4-[N-(2,3-дигідро-1Н-імідазол-1-іл-2-тіон)-N(4-метоксифеніл) аміно]метилбензонітрилу (9,50г, 28,24ммоль) в оцтовій кислоті (50мл). Після того, як ТСХ підтвердить завершення взаємодії, реакційну суміш розріджують водою, доводять до рН11 за допомогою гідроксиду натрію, обробляють гідросульфітом натрію та екстрагують етилацетатом. Органічний шар сушать над сульфатом натрію і концентрують у вакуумі. Флеш-хроматографія на силікагелі (суміш толуол/діоксан: 6/4) дає чисте оранжеве масло (5,80г, 67%). 1 Н ЯМР (ДМСО d6): 3,70 (с, 3Н), 4,90 (с, 2Н), 6,60-7,00 (м, 5Н), 7,40 (с, 1Н), 7,55 (д, 2Н), 7,70 (с, 1Н), 7,78 (д, 2Н). Кристалізація з хлористоводневого етанолу дає білі кристали (5,70г, 66%). Т.пл. 207°С. 1 Н ЯМР (ДМСО d6): 3,70 (с, 3Н), 4,97 (с, 2Н), 6,93 (д, 2Н), 7,13 (д, 2Н), 7,45 (д, 2Н), 7,70 (с, 1Н), 7,84 (д, 2Н), 8,04 (с, 1Н), 8,18 (с, 1Н), 9,55 (с, 1Н). 80307 22 Результати біологічних випробувань Випробування in vitro Клітинна лінія JEG-3, одержана з плацентарної хореокарциноми людини, є, за своєю природою, дуже багатою ароматазою людини [Bahn RS et al., J Clin Endocrinol Metab, 1981, 52: 447-450] і, відповідно, корисною практичною біологічною системою для скринінгу й оцінки передбачуваних інгібіторів ароматази in vitro [Yue W and Brodie AM, J Steroid Biochem Моl Biol, 1997, 63: 317-328]. Вихідну лінію клітин JEG-3 вирощують до 80% злиття у моношарах, використовуючи пластикові колби, у мінімальному середовищі Голка з 1г/л глюкози і без 10% сироватки плоду теля, при рН7,4 і 37°С, в атмосфері 5% СО2. Потім, за 24 години до визначення активності ароматази, клітини JEG-3 розподіляють для культивування по 96-лункових мікропланшетах (60000-100000 життєздатних клітин у 100мкл культурального середовища на комірку); після 24 годин мікропланшети промивають і додають свіже середовище, яке містить радіоактивний субстрат ароматаз (1β-3H-андростендіон, 10нМ) разом зі сполукою, яку випробовують, розчиненою 1% диметилсульфоксидом, при інтервалі концентрацій, що випробовують, від 10-12 до 10-4Μ у загальному об'ємі 150мкл. Через дві години після початку інкубації 100мкл супернатантів переносять на нові гомологічні 96-лункові мікропланшети. Розчин, який містить навантажений декстраном вугільний пил (1%), додають у кожну комірку (100мкл/комірка); після витримування впродовж 10 хвилин на льоду мікропланшети центрифугують (1500г) понад 10 хвилин при 4°С. Усі стероїди, включаючи радіоактивний субстрат і заново біосинтезовані естрогени, захоплюються за рахунок комплексного зв'язування з вугіллям; тільки 3Нвода, яка специфічно утворюється при ароматизації 1β-3Н-андростендіону, що містить специфічний окислювальний ступінь відщіплення 1β-3Η, залишається на цій стадії у супернатанті. Перенесені на інший гомологічний 96-лунковий мікропланшет супернатанти у кількості 100мкл здобувають деяку рідину (200мкл/комірка), придатну для сцинтиляційного вимірювання β-радіоактивності за допомогою лічильника для мікропланшетів Microbeta Plus 1450 (Wallac, EG & G). Паралельно, реакцію ароматази у мікропланшетах, що містять клітини, зупиняють шляхом деструкції і розчинення клітин JEG-3 у 10мМ розчині етилендіамінтетраацетату при рН12,3. Потім ДНК визначають стандартним люмінісцентним методом, використовуючи флюорохром Hoechst 33258 і Victor2 (Wallac, EG & G) флуориметр для мікропланшетів. Нарешті, активність ароматази виражають у ммолях/мкг ДНК за 2 години та інгібування ароматази у процентах від контрольної інкубації без інгібіторів. Нелінійний аналіз ступеню узгодженості підібраної кривої з емпіричними даними, графіку залежності % інгібування від концентрації, дозволяє визначити концентрацію 50% інгібування (ІС50): найменша ІС50 відповідає найбільш ефективним інгібіторам (таблиця А). 23 80307 Таблиця А Інгібування ароматази людини in vitro Сполука Анастрозол Приклад 28 Приклад 30 Приклад 21 Приклад 25 Приклад 31 Летрозол Приклад 5 Приклад 23 Приклад 13 Приклад 19 Приклад 16 Приклад 6 YM511 Приклад 17 Приклад 20 Приклад 15 Приклад 22 Приклад 29 Приклад 11 Приклад 24 Приклад 9 Приклад 14 Приклад 7 Приклад 8 Приклад 10 Приклад 18 Приклад 26 ІС50±спс (нМ) 8,21±1,27 1,57±0,74 1,16±0,55 1,12±0,55 0,66±0,14 0,58±0,18 0,56±0,10 0,54±0,26 0,48±0,13 0,44±0,04 0,40±0,06 0,35±0,07 0,31±0,01 0,30±0,04 0,24±0,02 0,22±0,05 0,21±0,05 0,20±0,05 0,19±0,05 0,18±0,02 0,18±0,09 0,16±0,06 0,16±0,02 0,14±0,05 0,14±0,05 0,14±0,03 0,14±0,01 0,13±0,05 N 3 3 3 3 3 3 12 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 Інгібування ароматази in vivo Ароматаза є стероїдогенним ферментом, що відповідає за біосинтез естрадіолу, основного жіночого статевого гормону з числа естрогенів. У пацюків естрадіол фізіологічно синтезується на високих циркуляційних рівнях у певний період впродовж 4-денного естрального циклу: це так званий передовуляторний сплеск, що має місце у день, який передує тічці, безпосередньо перед овуляцією, яка відбувається за ніч між проеструсною та естральною фазами. Чуттєва фізіологічна модель для оцінки in vivo інгібування ароматази розроблена на основі інгібування цього передовуляторного сплеску рівнів естрадіолу. Проводять моніторинг дорослих самок пацюків Wistar на регулярну 4-денну естральну циклічність за допомогою щоденного вагінального мазка; після 2 або 3 регулярних циклів тваринам однократно перорально вводять дуже низьку диференціювальну дозу у 10мікрограмів/кг в об'ємі 4мл/кг близько 04:00 після півдня на діеструс, тобто на день, що передує проеструсу. Комп’ютерна верстка Т. Чепелева 24 Після рівно 24 годин беруть проби крові з аорти при анестезії газом. Рівні естрадіолу у плазмі вимірюють радіоімунологічним аналізом за допомогою наборів, які промислово випускаються (Diagnostic Systems Laboratories, Webster, Texas, U.S.A.). Контрольні та випробувані групи звичайно складаються з 7-10 пацюків, залежно від числа пацюків з регулярним циклом, які розподіляють на випробувані групи. Результати наведені у пг/мл і потім у % інгібування, де рівні естрадіолу контрольних тварин, які одержують перорально лише розчинник, прийняті за 100%, що дозволяє провести порівняння між різними незалежними дослідженнями, оскільки рівень передовуляторного сплеску може змінюватись у кожній контрольній групі при переході від одного дослідження до іншого приблизно в межах від 25 до 40пг/мл. Таблиця В Інгібування ароматази in vivo Сполука Анастрозол YM511 Приклад 7 Приклад 14 Приклад 6 Приклад 11 Приклад 17 Інгібуванняу % при 10 мкг/кг 18-33% 35% 47% 49-57% 57% 57-59% 60% n 2 1 1 2 1 2 1 Є очевидним, що сполуки, описані загальною формулою (І) за цим винаходом, викликають незначно більше або помітно більше інгібування біосинтезу естрадіолу завдяки інгібуванню ароматази in vivo, ніж YM 511, взятий як структурний еталон N-тріазолу [Okada et al., Chem Pharm Bull, 1996, 44: 1871-1879], або анастрозол, стандартна антиароматаза, яка вже використовується терапевтично. Таким чином, сполуки, описані загальною формулою (І), є суттєвим удосконаленням порівняно з останніми речовинами. Дані in vivo (таблиця В) не мають абсолютної кореляції з даними in vitro (таблиця А), але, у цілому, обидва наведених біологічних результати свідчать про те, що ряд похідних 1-Ν-феніламіно1Н-імідазола за цим винаходом дає численні наномолярні та субнаномолярні інгібітори ароматази, деякі з яких викликають ефективне інгібування in vivo біосинтезу естрогену. Відповідно, ці сполуки є корисними у протидії або керуванні патологічними або фізіологічними естроген-залежними механізмами, переважно у жіночих особнів (жінок і самок тварин), але також і у чоловічих (чоловіків або самців тварин). Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською1-n-phenylamino-1h-imidazole derivatives and pharmaceutical composition (variants)
Автори англійськоюAdje Nathalie, Bonnet Paule, Carniato Denis, Lafay Jean, Delansorne Remi, Pascal Jean-Claude
Назва патенту російськоюПроизводные 1-n-фениламино-1н-имидазола и фармацевтическая композиция (варианты), которая их содержит
Автори російськоюАдже Натали, Бонне Поль, Карньято Дени, Ляфей Жан, Делансорне Рэме, Паскаль Жан-Клод
МПК / Мітки
МПК: C07D 521/00, C07D 233/54, A61P 43/00, C07D 233/88
Мітки: 1-n-феніламіно-1н-імідазолу, фармацевтична, похідні, містить, варіанти, композиція
Код посилання
<a href="https://ua.patents.su/12-80307-pokhidni-1-n-fenilamino-1n-imidazolu-ta-farmacevtichna-kompoziciya-varianti-shho-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Похідні 1-n-феніламіно-1н-імідазолу та фармацевтична композиція (варіанти), що їх містить</a>
Попередній патент: Теплообмінний апарат
Наступний патент: Спосіб виготовлення листової сталі, що має абразивну стійкість, і одержаний цим способом лист
Випадковий патент: Робоче обладнання екскаватора