N-заміщені піразоліламідилбензімідазоліли як c-kit інгібітори
Номер патенту: 84712
Опубліковано: 25.11.2008
Автори: Кастелано Арліндо Л., Крю Ендрю Філіп, Лі Ань-Ху, Болджер Джошуа, Сунь Інчуань, Сембрук Сміт Колін Пітер, Лауфер Радослав
Формула / Реферат
1. Сполука, представлена формулою (І):
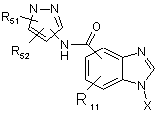 , (I)
, (I)
або її фармацевтично прийнятна сіль або N-оксид,
де R11 являє собою F, Сl, С0-8алкіл, С0-8алкокси або -N(С0-8алкіл)(С0-8алкіл);
R51 являє собою феніл, необов’язково заміщений 1-5 замісниками, незалежно вибраними з галогену, -NR34R35, -NR34COR35, -NR34C(O)OR35, -NR34SO2R35, -OR34, -SR34, -SO2R34, -SO2NR34R35, -C(O)OR34, -CO2H, -CONR34R35, С0-8алкілу, С2-8алкенілу, С2-8алкінілу, CN, CF3, NO2, оксо, циклілу або гетероциклілу;
R52 являє собою галоген, CF3, -CN, С0-8алкіл, С0-8алкокси, -СООН або -N(C0-8алкіл)(С0-8алкіл);
X являє собою циклільну або гетероциклільну групу, необов’язково заміщену 1-4 замісниками, незалежно вибраними з F, Сl, CF3, -CN, С0-8алкілу, С0-8алкокси, -СООН або -N(C0-8aлкiл)(C0-8aлкiл);
R34 і R35 незалежно являють собою С0-8алкіл, необов’язково заміщений гетероциклільним або ОН замісником; -С0-8алкіл-С3-8циклоалкіл, CF3, -С0-8алкіл-О-С0-8алкіл, -С0-8алкіл-N(С0-8алкіл)(С0-8алкіл), -С0-8алкіл-S(О)0-2-С0-8алкіл; або гетероцикліл, необов’язково заміщений С0-8алкільним, циклільним або заміщеним циклільним замісником.
2. Сполука за п. 1 або її фармацевтично прийнятна сіль або N-оксид, де X являє собою необов’язково заміщений цикліл.
3. Сполука за п. 2 або її фармацевтично прийнятна сіль або N-оксид, де X являє собою необов’язково заміщений феніл.
4. Композиція, що містить сполуку за п. 1 або її фармацевтично прийнятну сіль або N-оксид і фармацевтично прийнятний носій.
5. Композиція, що містить сполуку за п. 1 або її фармацевтично прийнятну сіль або N-оксид, і
протинеопластичний засіб, протипухлинний засіб, засіб, що перешкоджає розвитку кровоносних судин, або хіміотерапевтичний засіб.
6. Композиція, що містить сполуку за п. 1 або її фармацевтично прийнятну сіль або N-оксид і цитотоксичний протираковий терапевтичний засіб.
7. Композиція, що містить сполуку за п. 1 або її фармацевтично прийнятну сіль або N-оксид і протираковий терапевтичний засіб, що інгібує розвиток кровоносних судин.
8. Сполука, яка являє собою:
1-(3-фторфеніл)-N-[3-(5)-фенілпіразол-5(3)-іл]-1H-бензімідазол-5-карбоксамід;
1-(3-фторфеніл)-N-[3-(5)-(4-хлорфеніл)піразол-5-(3)-іл]-1H-бензімідазол-5-карбоксамід;
1-(3-фторфеніл)-N-[3-(5)-п-толілпіразол-5(3)-іл]-1Н-бензімідазол-5-карбоксамід;
1-(3-фторфеніл)-N-(1-метил-3-фенілпіразол-5-іл)-1Н-бензімідазол-5-карбоксамід;
1-(4-метоксифеніл)-N-(3-(5)-фенілпіразол-5(3)-іл)-1Н-бензімідазол-5-карбоксамід;
1-[3-метокси-5-(трифторметил)феніл]-N-(3(5)-фенілпіразол-5(3)-іл)-1Н-бензімідазол-5-карбоксамід;
1-(3,5-диметоксифеніл)-N-(3(5)-фенілпіразол-5-(3)-іл)-1Н-бензімідазол-5-карбоксамід;
1-(3-ізопропоксифеніл)-N-(3(5)-фенілпіразол-5(3)-іл)-1Н-бензімідазол-5-карбоксамід;
1-(4-бромфеніл)-N-(3(5)-фенілпіразол-5(3)-іл)-1Н-бензімідазол-5-карбоксамід;
або її фармацевтично прийнятна сіль або N-оксид.
9. Спосіб лікування гіперпроліферативного розладу, в якому здійснюють введення ефективної кількості сполуки за п. 1.
10. Спосіб за п. 9, що додатково включає стадію введення протинеопластичного засобу, протипухлинного засобу, засобу, що перешкоджає розвитку кровоносних судин, або хіміотерапевтичного засобу.
11. Спосіб за п. 9, де гіперпроліферативний розлад являє собою рак молочної залози, рак голови або рак шиї.
12. Спосіб за п. 9, де гіперпроліферативний розлад являє собою шлунково-кишковий рак.
13. Спосіб за п. 9, де гіперпроліферативний розлад являє собою лейкоз.
14. Спосіб за п. 9, де гіперпроліферативний розлад являє собою рак яєчника, бронхіальний рак, рак легені або рак підшлункової залози.
15. Спосіб за п. 9, де гіперпроліферативний розлад являє собою дрібноклітинний рак легені або рак прямої кишки.
16. Спосіб за п. 9, де гіперпроліферативний розлад являє собою синоназальну лімфому, асоційовану з природними кілерами/Т-клітинами, семіному яєчника, карциному щитовидної залози, злоякісну мелано(бласто)му, аденокістозну карциному, ангіосаркому, анапластичну великоклітинну лімфому, ендометріальну карциному або карциному передміхурової залози.
Текст
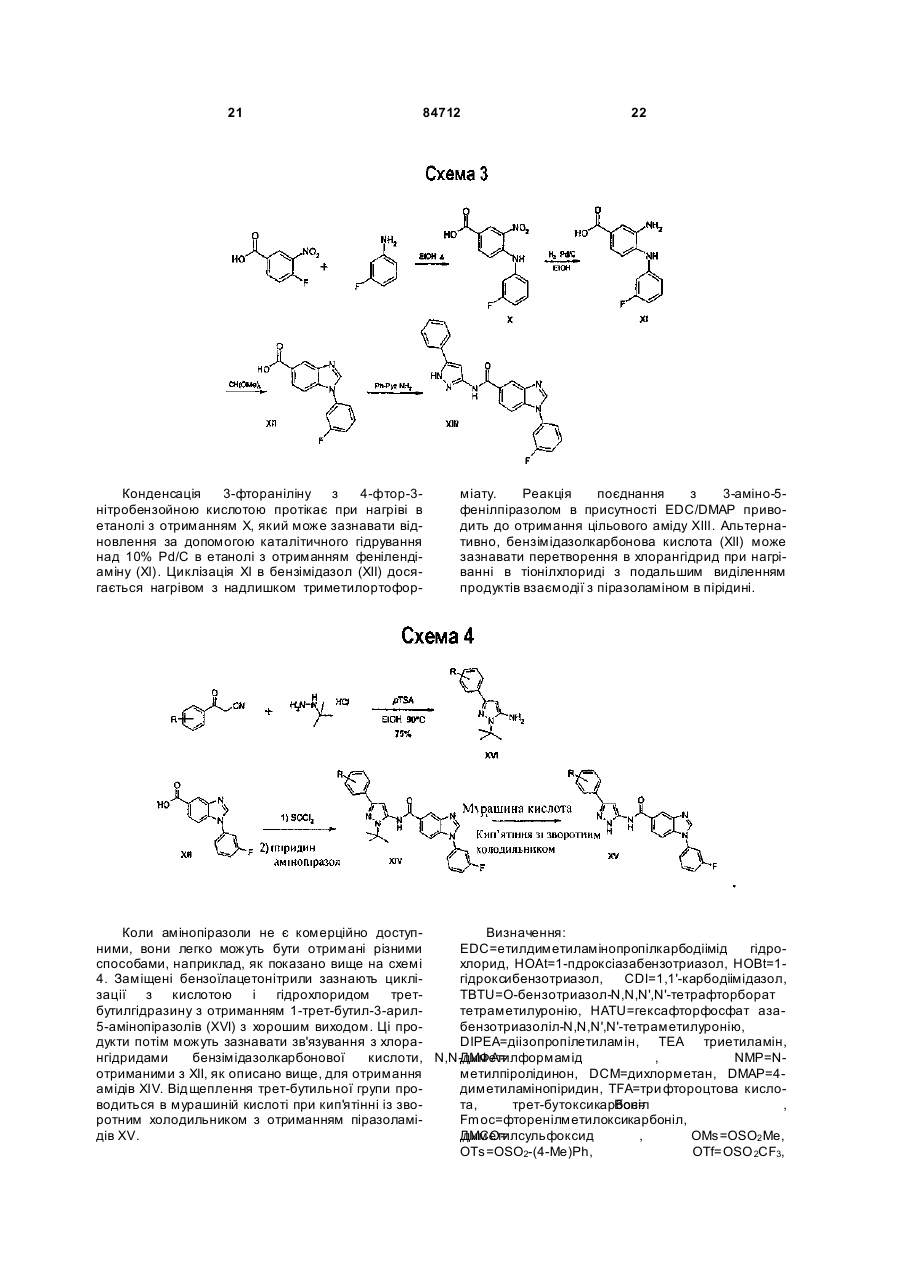
1. Сполука, представлена формулою (І): N N R51 O N R52 N H 2 (19) 1 3 84712 4 1-(4-бромфеніл)-N-(3(5)-фенілпіразол-5(3)-іл)-1Нбензімідазол-5-карбоксамід; або її фармацевтично прийнятна сіль або N-оксид. 9. Спосіб лікування гіперпроліферативного розладу, в якому здійснюють введення ефективної кількості сполуки за п. 1. 10. Спосіб за п. 9, що додатково включає стадію введення протинеопластичного засобу, протипухлинного засобу, засобу, що перешкоджає розвитку кровоносних судин, або хіміотерапевтичного засобу. 11. Спосіб за п. 9, де гіперпроліферативний розлад являє собою рак молочної залози, рак голови або рак шиї. 12. Спосіб за п. 9, де гіперпроліферативний розлад являє собою шлунково-кишковий рак. 13. Спосіб за п. 9, де гіперпроліферативний розлад являє собою лейкоз. 14. Спосіб за п. 9, де гіперпроліферативний розлад являє собою рак яєчника, бронхіальний рак, рак легені або рак підшлункової залози. 15. Спосіб за п. 9, де гіперпроліферативний розлад являє собою дрібноклітинний рак легені або рак прямої кишки. 16. Спосіб за п. 9, де гіперпроліферативний розлад являє собою синоназальну лімфому, асоційовану з природними кілерами/Т-клітинами, семіному яєчника, карциному щитовидної залози, злоякісну мелано(бласто)му, аденокістозну карциному, ангіосаркому, анапластичну великоклітинну лімфому, ендометріальну карциному або карциному передміхурової залози. Даний винахід стосується N-заміщених піразоліламідилбензімідазоліл-похідних. Зокрема, даний винахід стосується N-заміщених піразоліламідилбензімідазоліл-похідних, які є інгібіторами c-Kit протоонкогену (відомого також як KIT, CD-117, рецептор фактора стовбурових клітин, рецептор фактора росту мастоциту). Вважається, що c-Kit протоонкоген відіграє важливу роль в ембріогенезі, меланогенезі, гемопоезі і патогенезі мастоцитів, шлунково-кишкових пухлин і інших твердих пухлин, а також в деяких лейкозах, включаючи гострий мієлолейкоз (AML). Відповідно, було б бажано розробити нові сполуки, які були б інгібіторами c-Kit рецептора. У цей час в багатьох програмах лікування гіперпроліферативних розладів (рак) використовуються сполуки, які інгібують синтез ДНК. Ме ханізм дії таких сполук оснований на тому, що вони повинні бути токсичними для клітин, зокрема, для клітин пухлин, що швидко діляться. Тому широкий спектр токсичності цих сполук може представляти проблему для пацієнта, що підлягає лікуванню. Однак для підвищення селективності протиракової дії і, отже, для можливого зниження шкідливої дії побічних ефектів досліджувалися й інші підходи до розробки протиракових засобів, які діють інакше, ніж інгібування синтезу ДНК. Відомо, що клітина може стати злоякісною внаслідок перетворення частини її ДНК в онкоген (тобто ген, який при активації приводить до утворення клітин злоякісних пухлин). Велику кількість онкогенів кодують білки, які являють собою аберантні білок-тирозинкінази, здатні викликати трансформацію клітини. Надекспресія нормальної прото-онкогенної тирозинкінази різним чином також може приводити до проліферативних розладів, що іноді приводять до малігнантного фенотипу. Крім того, спільна експресія рецепторної тирозинкінази і її спорідненого по жіночій лінії ліганду в клітині такого ж типу може також приводити до малігнантної трансформації. Рецепторні тирозинкінази являють собою великі ферменти, які з'єднують клітинні мембрани і мають і) екстрацелюлярний зв'язувальний домен для ростових факторів, таких як КІТ ліганд (відомий також як фактор стовбурових клітин (stem cell factor SCF), стальний фактор (Steel factor SLF) або фактор росту мастоїдитів (mast cell growth factor MGF)), ii) транс-мембранний домен і ііі) внутрішньоклітинну частину, яка діє як кіназа на фосфорилатні специфічні тирозинові залишки в білках. Зв'язування КІТ ліганду з КІТ тирозинкіназою приводить до гомодимеризації рецептора, активації активності КІТ тирозинкінази і послідовного фосфорилювання різних білкових субстратів, багато з яких є ефекторами внутрішньоклітинної сигнальної трансдукції. Ці події можуть приводити до підвищеної клітинної проліферації або сприяти підвищеному виживанню клітин. Деякі рецепторні кінази можуть також брати участь в процесах рецепторної гетеродимеризації. Відомо, що такі кінази часто аберантно експресовані в звичайних злоякісних пухлинах людини, таких як рак молочної залози, злоякісні пухлини голови і шиї, шлунково-кишковий рак, такий як рак ободової кишки, рак прямої кишки або рак шлунка, лейкоз і рак яєчника, бронхіальний рак, рак легені або рак підшлункової залози. Експресія КІТ кінази була описана у великій кількості різних злоякісних пухлин, таких як мастоцитоз/базофільний лейкоз, шлунково-кишкові стромальні пухлини (GIST), дрібноклітинний рак легені SCLC), синоназальна лімфома, асоційована з природними кілерами/Т-клітинами, семінома яєчника, карцинома щитовидної залози, злоякісна мелано(бласто)ма, карцинома яєчника, аденокіс 5 84712 тозна карцинома, гострий мієлолейкоз (AML), рак молочної залози, педіатричний гострий лімфобластний лейкоз, асоційований з Т-клітинами, ангіосаркома, анапластична крупноклітинна лімфома, ендометріальна карцинома і карцинома передміхурової залози. Кіназна активність КІТ була залучена в патофізіологію деяких з цих і інших п ухлин, включаючи рак молочної залози, SCLC, GIST, гоноцитому, базофільний лейкоз, нейробластому, AML, меланому і карциному яєчника. У літературі були описані деякі механізми активації пухлинних клітин, включаючи активуючі мутації, а утокринну і паракринну активацію рецепторної кінази її лігандом, втрату білоктирозинфосфатазної активності і перехресну активацію іншими кіназами. Вважається, що механізми трансформації, що ініціюються активуючими мутаціями, включають утворення димера і підвищену внутрішню активність кіназного домену, і обидва ці шляхи приводять до конститутивної лігандзалежної активації кінази і, можливо, зміненої субстратної специфічності. Більше тридцяти активуючих м утацій Kit білка були пов'язані з вельми небезпечними злоякісними пухлинами у людей. Відповідно, було показано, що інгібітори рецепторних тирозинкіназ застосовні як селективні інгібітори росту ракових клітин ссавців. Наприклад, Gleevec™ (відомий також під назвою мезилат іматинібу або STI571), 2-фенілпіримідиновий інгібітор тирозинкінази, який інгібує кіназну активність, був дозволений до застосування для лікування CML Управлінням по контролю якості харчових продуктів і лікарських засобів США. Gleevec™ в доповнення до інгібування BCR-ABL кінази інгібує також КІТ кіназу і PDGF рецепторну кіназу, хоч він не ефективний у відношенні всіх мутантни х ізоформ КІТ кінази. Kit ліганд-стимульований ріст М07е клітин лейкемії людини інгібується з допомогою Gleevec™, який в цих умовах стимулює також апоптоз. І навпаки, Gleevec™ не впливає на GM-CSF стимульований ріст МО7е клітин лейкемії людини. Далі, в проведених останнім часом клінічних дослідженнях з використанням Gleevec™ для лікування пацієнтів, що страждають на GISTзахворюванням, при якому КІТ кіназа залучена в трансформацію клітин, багато хто з пацієнтів показав помітне поліпшення стану. Ці дослідження показують, як інгібітори КІТ кінази можуть лікувати пухлини, ріст яких залежить від активності КІТ кінази. Інші інгібітори кінази показують навіть ще більшу кіназну селективність. Наприклад, 4-анілінохіназолін-похідне Tarceva™ з високою ефективністю інгібує тільки EGF рецепторну кіназу, хоч воно може інгібувати сигнальну трансдукцію інших рецепторних кіназ, ймовірно, внаслідок того, що ці рецептори гетеродимеризують з EGF рецептором. Хоч протиракові сполуки, такі як сполуки, описані вище, роблять значний внесок в розвиток даної галузі техніки, все ще існує потреба в більш ефективних протиракових фармацевтичних препаратах, і було б бажано розробити нові сполуки з кращою селективністю або ефективністю або із зниженою токсичністю або зниженими побічними ефектами. 6 У патентах США №5990146 і 6218388 описуються бензімідазоли для інгібування клітинної проліферації, опосередкованої білоктирозинкіназою. У патенті США №6348032 описується спосіб інгібування неопластичних клітин за допомогою похідних бензімідазолу. У міжнародній патентній публікації №WO01/21634 описуються похідні бензімідазолу і їх суміші. У міжнародній патентній публікації №WO01/57020 описуються індольні і бензімідазольні інгібітори фактора Xa. У міжнародній патентній публікації №WO00/15222 описуються похідні конденсованого піридину, які є інгібіторами cGMP фосфодіестерази. У міжнародній патентній публікації №WO01/12600 описуються інгібітори фактора Xa. У міжнародній патентній публікації №WO97/12613 описується спосіб лікування і профілактики запалення і атеросклерозу. У патенті США №6316474 описуються 2бензил- і 2-гетероарилбензімідазольні антагоністи NMDA/NR2b. У патенті США №6479508 описуються інгібітори вірусної полімерази. У патенті США №6444617 описуються гербіцидні діамід-похідні дикарбонових кислот конденсованих гетероциклів або їх солі, а також застосування вказаних сполук. У патентах США №6087380, 6414008 і 6469039 описуються дизаміщені біциклічні гетероцикли. У патенті США №5118688 описуються тетрагідропіридонхінолон-похідні. У патенті США №4975435 описуються деякі 1Н-піроло[3,4-b]хінолін-1-он-9аміно-2,3-дигідро-похідні, застосовні для лікування стану неспокою. У патенті США №6548524 описуються ортосульфонамідобіциклічні гетероарилгідроксамові кислоти. У патенті США №6348474 описуються сульфонамідні сполуки. У патентах США №5972980 і 6001866 описується спосіб лікування і профілактики запалення і атеросклерозу. У патенті США №5814651 описуються прості катехолдіефіри як селективні PDEIV інгібітори. У патенті США №6329383 описуються похідні 2-аміно-5-піримідиноцтової кислоти. У патенті США №5688809 описуються 5гетероариліндольні похідні. У європейській заявці на патент №EP0846689 описуються похідні бензімідазолу. У міжнародній патентній публікації №WO00/59888 описуються Nбензімідазолілметил- і N-індолілметилбензаміди і їх застосування як CRF модуляторів. У міжнародній патентній публікації №WO02/069965 описуються похідні бензімідазолу як терапевтичні лікарські засоби. У міжнародній патентній публікації №WO02/30886 описуються гетероциклічні інгібітори розвитку кровоносних судин. У патенті США №6162804 описуються інгібітори тирозинкінази. У патенті США №6465484 описуються інгібітори розвитку кровоносних судин. У міжнародній патентній публікації №WO00/12089 описуються нові інгібітори розвитку кровоносних судин. У патентній публікації Німеччини №2244908 описуються полімерні мембрани з селективною проникністю. У європейській заявці на патент №EP0706795 описуються прості катехолдіефіри як інгібітори вивільнення TNF. У міжнародній патентній публікації №WO02/076960 описується спосіб, що проводиться за допомогою перехідного металу. У міжнародній патентній публікації 7 84712 №WO02/059118 описується спосіб Nоксіалкілювання карбоксамідів. У міжнародній патентній публікації №WO02/04425 описуються інгібітори вірусної полімерази. У міжнародній патентній публікації №WO02/083143 описуються антагоністи CXCR3. В міжнародній патентній публікації №WO01/57019 описуються індолонові і бензімідазолонові інгібітори фактора Xa. У європейській заявці на патент №EP1085372 описується фотоматеріал, що має поліпшені кольовідтворення. У міжнародній патентній публікації №WO01/14342 описуються амінокарбонілзаміщені похідні бензімідазолу. У міжнародній патентній публікації №WO00/76501 описуються антагоністи IL-8 рецептора. Таким чином, бажано розробити сполуки, які проявляють Kit інгібування для лікування онкологічних захворювань. Крім того, такі сполуки можуть бути активними у відношенні інших кіназ, таких як, наприклад, GIST, FLT3, гематопоетиновий R-PTKs, PDGFR-бета або KDR в доповнення до ефективності відносно базофільного лейкозу, дрібноклітинного раку легені (SCLC), мастоцитозу, лейкозу, мієлодисплазичних розладів або захворювань, пов'язаних з розвитком кровоносних судин. Сполуки, представлені формулою (І): або їх фармацевтично прийнятна сіль або Nоксид, застосовні для лікування пухлин. Даний винахід відноситься до сполуки, представленої формулою (І): або її фармацевтично прийнятної солі або Nоксиду, де R11 являє собою F, Cl, С0- 8алкіл, С0-8алкокси або -N(С0-8алкіл)(С0-8алкіл); R51 являє собою феніл, необов'язково заміщений 1-5 замісниками, незалежно вибраними з галогену, -NR 34R35 , -NR 34COR35, -NR 34C(O)OR 35 , -NR34SO2R35, -OR34 , -SR34 , -SO 2R34 , -SO 2NR34R35, 8 -C(O)OR34, -CO2H, -CONR34R35 , С0-8алкілу, C28алкенілу, С 2-8алкінілу, CN, CF3, NO2 , оксо, циклілу або гетероциклілу; R52 являє собою галоген, CF3 , -CN, С 0-8алкіл, С0-8алкокси, -COOH або -N(С0-8алкіл)(С0-8алкіл); X являє собою циклільну або гетероциклільну груп у, необов'язково заміщену 1-4 замісниками, незалежно вибраними з F, Cl, CF3, -CN, С0-8алкілу, С0-8алкокси, -COOH або -N(С0-8алкіл)(С0-8алкіл); R34 і R35 незалежно являють собою С 0-8алкіл необов'язково заміщений гетероциклільним або OH замісником; -С0-8алкіл-С 3-8циклоалкіл, CF3, -С0-8алкіл-О-С 0-8алкіл; -С0-8алкіл-N(С0-8алкіл)(С08алкіл)-С 0-8алкіл-S(O)0-2-С 0-8алкіл; або гетероцикліл, необов'язково заміщений С 0-8алкільним, циклільним або заміщеним циклільним замісником. Відповідно до одного аспекту, даний винахід відноситься до сполуки, представленої формулою (І) або її фармацевтично прийнятної солі або Nоксиду, де X являє собою необов'язково заміщений цикліл, а інші змінні набувають значень, описаних вище для формули (І). В одному варіанті здійснення даного аспекту даний винахід відноситься до сполуки, представленої формулою (І) або її фармацевтично прийнятної солі або N-оксиду, де X являє собою необов'язково заміщений феніл, а інші змінні набувають значень, описаних ви ще для формули (І). У відповідності з другим аспектом, даний винахід відноситься до сполуки, представленої формулою (І) або її фармацевтично прийнятної солі або N-оксиду, де X являє собою необов'язково заміщений гетероцикліл, а інші змінні набувають значень, описаних ви ще для формули (І). Крім випадків, обумовлених особливо, в даному описі «алкіл», а також інші групи, що містять частку «алк», такі як, наприклад, алкокси, алканіл, алкеніл, алкініл і т.п., являють собою вуглецеві ланцюги, які можуть бути лінійними або розгалуженими або їх поєднаннями. Приклади алкільних груп включають метил, етил, пропіл, ізопропіл, бутил, втор- і трет-бутил, пентил, гексил, гептил і т.п. Терміни «алкеніл», «алкініл», а також інші подібні терміни включають вуглецеві ланцюги, що містять, щонайменше, один ненасичений вуглецьвуглецевий зв'язок. Термін «С0-4алкіл» в даному описі використовується для позначення алкілу, що містить 0-4 атоми вуглецю, тобто 0, 1, 2, 3 або 4 атоми вуглецю в ланцюгу прямої або розгалуженої конфігурації. Алкіл, що не містить атомів вуглецю, являє собою водень, коли алкіл є кінцевою групою. Алкіл, що не містить атомів вуглецю, являє собою прямий зв'язок, коли алкіл є місточковою (з'єднувальною) групою. Терміни «циклоалкіл», «карбоциклічне кільце», «циклічний» або «циклільний» означають 3-10членні моно- або поліциклічні ароматичні, частково ароматичні або неароматичні кільцеві карбоцикли, що не містять гетероатомів, і включають моно-, бі- і трициклічні насичені карбоцикли, а також конденсовані і місточкові системи. Такі конденсовані кільцеві системи можуть включати одне кільце, яке є частково або повністю ненасиченим, таке як бензольне кільце, з утворенням конденсованих 9 84712 кільцевих систем, таких як карбоцикли конденсованих бензольних кілець. Циклоалкіл включає такі кільцеві системи, як спіроконденсовані кільцеві системи. Приклади циклоалкільних і карбоциклічних кілець включають С3-8циклоалкіл, такий як циклопропіл, циклобутил, циклопентил, циклогексил і декагідронафталін, адамантан, інданіл, 1,2,3,4тетрагідронафталін і т.п. Термін «галоген» включає атоми фтору, хлору, брому і йоду. Термін «карбамоїл», за винятком особливо обумовлених випадків, означає C(O)-NH- або NHC(O)-. Термін «арил» добре відомий хімікам. Переважними арильними групами є феніл і нафтил. Термін «гетероарил» добре відомий хімікам. Даний термін включає 5- або 6-членні гетероарильні кільця, що містять 1-4 гетероатоми, вибрані з кисню, сірки і азоту, в яких кисень і сірка не слідують один за одним. Прикладами таких гетероарильних кілець є фурил, тієніл, піроліл, піразоліл, імідазоліл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, триазоліл, оксадіазоліл, тіадіазоліл, тетразоліл, піридил, піридазиніл, піримідиніл, піразиніл і триазиніл. Термін «гетероарил» включає гетероарильні кільця з конденсованими карбоциклічними кільцевими системами, які є частково або повністю ненасиченими, такими як бензольне кільце, з утворенням гетероарилу, конденсованого з бензольним кільцем, наприклад, бензімідазол, бензоксазол, бензотіазол, бензофуран, хінолін, ізохінолін, хіноксалін і т. п. За винятком особливо обумовлених випадків, терміни «гетероциклічне кільце», «гетероцикл», «гетероциклічний» і «гетероцикліл» є еквівалентами і набувають значень, визначених для циклічних груп, але включають також один або декілька атомів, незалежно вибраних з атомів N, O і S, і їх оксиди, при умові, що такі похідні проявляють відповідні і стабільні валентності, за винятком фрагментів, що містять 0-0, S(O)n-S(O)n , S(O)n-O зв'язки, де n=0-2. Дані терміни включають 4-8членні насичені цикли, що містять один або два гетероатоми, вибрані з атомів кисню, сірки і азоту. Приклади гетероциклічних кілець включають азетидин, оксетан, тетрагідрофуран, тетрагідропіран, оксепан, оксокан, тіетан, тіазолідин, оксазолідин, оксазетидин, піразолідин, ізоксазолідин, ізотіазолідин, тетрагідротіофен, тетрагідротіопіран, тієпан, тіокан, азетидин, піролідин, піперидин, азепан, азокан, [1,3]діоксан, оксазолідин, піперазин, гомопіперазин, морфолін, тіоморфолін і т.п. Інші приклади гетероциклічних кілець включають оксидовану форму сірковмісних кілець. Таким чином, тетрагідротіофен-1-оксид, тетрагідротіофен-1,1діоксид, тіоморфолін-1-оксид, тіоморфолін-1,1діоксид, тетрагідротіопіран-1-оксид, тетрагідротіопіран-1,1-діоксид, тіазолідин-1-оксид і тіазолідин1,1-діоксид також розглядаються як гетероциклічні кільця. Термін «гетероциклічний» також включає конденсовані циклічні системи і може включати карбоциклічне кільце, яке є частково або повністю ненасиченим, таке як бензольне кільце, з утворенням гетероциклів, конденсованих з бензольним 10 кільцем, наприклад, 3,4-дигідро-1,4-бензодіоксин, тетрагідрохінолін, тетрагідроізохінолін і т.п. Сполуки, описані в даному винаході, можуть містити один або декілька асиметричних центрів і, таким чином, можуть приводити до утворення діастереомерів і оптичних ізомерів. Даний винахід включає всі такі можливі діастереомери, а також їх рацемічні суміші, їх по суті чисті розділені енантіомери, всі можливі геометричні ізомери і їх фармацевтично прийнятні солі. Наведена вище формула І представлена без визначення стереохімії деяких положень. Даний винахід включає всі стереоізомери формули І і їх фармацевтично прийнятні солі. Крім того, суміші стереоізомерів, а також ізольовані специфічні стереоізомери також включені в галузь даного винаходу. У процесі здійснення методик синтезу, що використовуються для отримання таких сполук, або при використанням методик рацемізації або епімеризації, відомих кваліфікованим в даній галузі фахівцям, продукти таких методик можуть являти собою суміші стереоізомерів. Винахід також відноситься до фармацевтичної композиції, яка включає сполуки формули І в поєднанні з фармацевтично прийнятним носієм. Переважно композиція включає фармацевтично прийнятний носій і нетоксичну терапевтично ефективну кількість сполуки формули І, яка описана вище (або її фармацевтично прийнятної солі або N-оксиду). Крім того, в рамках даного переважного варіанту винахід включає фармацевтичну композицію для лікування захворювання інгібуванням c-Kit кінази, яка може являти собою білок дикого типу або білок мутантної форми, композиція містить фармацевтично прийнятний носій і нетоксичну терапевтично ефективну кількість сполуки формули І, описаної вище (або її фармацевтично прийнятної солі або N-оксиду). Сполуки і композиції даного винаходу є ефективними для лікування ссавців, таких як, наприклад, люди. Термін «фармацевтично прийнятні солі» відноситься до солей, отриманих з фармацевтично прийнятних нетоксичних основ або кислот. Коли сполука даного винаходу є кислотною, її відповідна сіль може бути зручно отримана з фармацевтично прийнятних нетоксичних основ, включаючи неорганічні основи і органічні основи. Солі, отримані з таких неорганічних основ, включають алюмінієві, амонієві, кальцієві, солі міді (одновалентної і двовалентної міді), солі заліза (тривалентного і двовалентного), солі літію, магнію і марганцю (одно- і двовалентного), калієві, натрієві солі, солі цинку і т.п. солі. Особливо переважними є амонієві, кальцієві, магнієві, калієві і натрієві солі. Солі, отримані з фармацевтично прийнятних органічних нетоксичних основ, включають солі первинних, вторинних і третинних амінів, а також циклічних амінів і заміщених амінів, таких як природні і синтетичні заміщені аміни. Інші фармацевтично прийнятні органічні нетоксичні основи, з яких можуть бути отримані солі, включають іонообмінні смоли, такі як, наприклад, аргінін, бетаїн, кофеїн, холін, Ν',Ν'-дибензилетилендіамін, діетиламін, 2 11 84712 діетиламіноетанол, 2-диметиламіноетанол, етаноламін, етилендіамін, N-етилморфолін, Nетилпіперидин, глюкамін, глюкозамін, гістидин, гідрабамін, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, поліамінові смоли, прокаїн, пурини, теобромін, гриетиламін, триметиламін, трипропіламін, трометамін і т.п. Коли сполука даного винаходу є основною, її відповідна сіль може бути зручно отримана з фармацевтично прийнятних нетоксичних кислот, включаючи неорганічні і органічні кислоти. Такі кислоти включають, наприклад, оцтову, бензолсульфонову, бензойну, камфорсульфонову, лимонну, е тансульфонову, фумарову, глюконову, глютамінову, бромистоводневу, соляну, ізетіонову, молочну, малеїнову, яблучн у, мигдалеву, метансульфонову, слизеву, азотну, памоїнову, пантотенову, фосфорну, янтарну, сірчану, винну, птолуолсульфонову кислоту і т.п. кислоти. Особливо переважними є лимонна, соляна, малеїнова, фосфорна, сірчана, метансульфонова і винна кислоти. Фармацевтичні композиції даного винаходу включають сполуку, представлену формулою І (або її фармацевтично прийнятну сіль або Nоксид) як активний інгредієнт, фармацевтично прийнятний носій і, необов'язково, інші терапевтичні інгредієнти або ад'юванти. Вказані композиції включають композиції, прийнятні для перорального, ректального, місцевого і парентерального (включаючи підшкірне, внутрішньом'язове і внутрішньовенне) введення, хоч найбільш прийнятний спосіб введення в будь-якому випадку буде залежати від конкретного організму, природи і тяжкості станів, що підлягають лікуванню введенням даного активного інгредієнта. Фармацевтичні композиції можуть бути зручно представлені в лікарській формі стандартної дози і можуть бути отримані будь-яким з способів, добре відомих в галузі фармацевтики. На практиці сполуки даного винаходу, представлені формулою І, або їх фармацевтично прийнятні солі або N-оксиди можуть об'єднуватися як активний інгредієнт в тонко подрібнені суміші з фармацевтичним носієм, згідно з стандартними методами отримання фармацевтичних препаратів. Носій може набувати найрізноманітніших форм в залежності від бажаного способу введення препарату, наприклад перорального або парентерального (включаючи внутрішньовенний). Таким чином, фармацевтичні композиції даного винаходу можуть бути представлені у вигляді дискретних одиниць, прийнятних для перорального введення, таких як капсули, саше або таблетки, кожна з яких містить заздалегідь визначену кількість активного інгредієнта. Далі, композиції можуть бути представлені у вигляді порошку, у вигляді гранул, у вигляді розчину, у вигляді суспензії у водній рідині, у вигляді неводної рідини, у вигляді емульсії типу «масло у воді» або типу «вода в маслі». Крім звичайних лікарських форм, описаних вище, сполука, представлена формулою І, або її фармацевтично прийнятна сіль або N-оксид також може вводитися способами контрольованого вивільнення діючої речовини і/або за допомогою пристроїв доставки. 12 Композиції можуть бути отримані будь-яким з фармацевтичних способів. Звичайно такі способи включають стадію приведення в зіткнення активного інгредієнта з носієм, який складають один або декілька обов'язкових інгредієнтів. Звичайно композиції отримують ретельним змішуванням активного інгредієнта з рідкими носіями або тонко подрібненими твердими носіями або носіями обох типів. Отриманий продукт після цього може бути зручно представлений в бажаній формі. Таким чином, фармацевтичні композиції даного винаходу можуть включати фармацевтично прийнятний носій і сполуку формули І або її фармацевтично прийнятну сіль або N-оксид. Сполуки формули І або їх фармацевтично прийнятні солі і N-оксиди можуть також вводитися в фармацевтичні композиції в поєднанні з однією або декількома іншими терапевтично активними сполуками. Фармацевтичні композиції даного винаходу включають фармацевтично прийнятний ліпосомний препарат, що містить сполуку формули І або її фармацевтично прийнятну сіль або її N-оксид. Застосовуваний фармацевтичний носій може бути, наприклад, твердим, рідким або газоподібним. Приклади твердих носіїв включають лактозу, каолін, сахарозу, тальк, желатин, агар, пектин, акацію, стеарат магнію і стеаринову кислоту. Прикладами рідких носіїв є цукровий сироп, арахісова олія, оливкова олія і вода. Приклади газоподібних носіїв включають діоксид вуглецю і азот. При отриманні композицій лікарських форм для перорального введення може застосовуватися будь-яке фармацевтичне середовище. Наприклад, вода, гліколі, масла, спирти, смакові агенти, консерванти, барвники і т.п. можуть застосовуватися для отримання рідких препаратів для перорального введення, таких як суспензії, еліксири і розчини, в той час як такі носії, як крохмаль, цукор, мікрокристалічна целюлоза, розріджувачі, гранулюючі агенти, добавки, що сприяють ковзанню, зв'язувальні речовини, дезінтегруючі агенти і т.п., можуть застосовуватися для отримання твердих препаратів для перорального введення, таких як порошки, капсули і таблетки. Завдяки легкості введення таблетки і капсули є переважними лікарськими формами стандартної дози для перорального введення, в яких використовуються тверді фармацевтичні носії. На таблетки за допомогою стандартних водних або неводних способів можуть необов'язково наноситися покриття. Таблетка, що містить композицію даного винаходу, може бути отримана пресуванням або формуванням, необов'язково з одним або декількома додатковими інгредієнтами або ад'ювантами. Пресовані таблетки можуть бути отримані у відповідному обладнанні пресуванням активного інгредієнта в сипучій формі, такій як порошок або гранули, необов'язково змішаній зі зв'язувальною речовиною, добавкою для сприяння ковзанню, інертним розріджувачем, поверхнево-активною речовиною або диспергуючим агентом або іншими такими наповнювачами. Такими наповнювачами можуть бути, наприклад, інертні розріджувачі, такі як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; гранулюючі і дезінте 13 84712 груючі агенти, наприклад, кукурудзяний крохмаль або альгінова кислота; зв'язувальні речовини, наприклад, крохмаль, желатин або акація; і речовини, що сприяють ковзанню, наприклад, стеарат магнію, стеаринова кислота або тальк. Таблетки можуть не мати покриття або вони можуть покриватися відомими способами для уповільненої дезінтеграції і абсорбції в шлунково-кишковому тракті і, таким чином, забезпечення дії, що підтримується протягом більш тривалого періоду часу. Наприклад, може використовуватися матеріал, що забезпечує уповільнену дію, такий як гліцерилмоностеарат або гліцерилдистеарат. У твердих желатинових капсулах активний інгредієнт змішується з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном. У м'яких желатинових капсула х активний інгредієнт змішується з водою або масляним середовищем, наприклад, арахісовою олією, рідким парафіном або оливковою олією. Формовані таблетки можуть бути отримані формуванням у відповідному апараті суміші порошкоподібної сполуки, зволоженої інертним рідким розріджувачем. Кожна таблетка переважно містить від приблизно 0,05мг до приблизно 5г активного інгредієнта, і кожне саше або кожна капсула переважно містить від приблизно 0,05мг до приблизно 5г активного інгредієнта. Наприклад, препарат, призначений для перорального введення людям, може містити від приблизно 0,5мг до приблизно 5г активного інгредієнта разом з відповідною прийнятною кількістю речовини носія, яка може складати від приблизно 5 до приблизно 95 відсотків всієї композиції. Лікарські форми стандартної дози будуть звичайно містити від приблизно 1мг до приблизно 2г активного інгредієнта, звичайно 25мг, 50мг, 100мг, 200мг, 300мг, 400мг, 500мг, 600мг, 800мг або 1000мг. Фармацевтичні композиції даного винаходу, прийнятні для парентерального ведення, можуть бути отримані у вигляді розчинів або суспензій активних інгредієнтів у воді. Може додаватися відповідна поверхнево-активна речовина, така як, наприклад, гідроксипропілцелюлоза. Можуть також готуватися дисперсії в гліцерині, рідких поліетиленгліколях і їх суміша х в маслах. Крім того, для запобігання несприятливому росту мікроорганізмів можуть додаватися консерванти. Фармацевтичні композиції даного винаходу, прийнятні для застосування у вигляді ін'єкцій, включають стерильні водні розчини або дисперсії. Крім того, композиції можуть бути представлені в формі стерильних порошків для швидкого приготування таких стерильних розчинів або дисперсій для ін'єкцій. У будь-якому випадку, кінцева форма для ін'єкцій повинна бути стерильною і повинна бути е фективно рідкою для легкого введення за допомогою шприца. Фармацевтичні композиції повинні бути стабільними в умовах виробництва і зберігання; таким чином, композиції переважно мають бути збережені від забруднювальної дії мікроорганізмів, таких як бактерії і гриби. Носієм може бути, наприклад, розчинник або дисперсійне середовище, що містить, наприклад, воду, етанол, багатоатомний спирт (наприклад, гліцерин, пропі 14 ленгліколь і рідкий поліетиленгліколь), рослинні олії і їх відповідні суміші. Фармацевтичні композиції даного винаходу можуть бути представлені у формі, прийнятній для місцевого застосування, такій як, наприклад, аерозоль, крем, мазь, лосьйон, сипучий порошок і т.п. Далі, композиції можуть бути представлені в формі, прийнятній для застосування в черезшкірних виробах. Такі препарати можуть бути приготовані з використанням сполуки даного винаходу, представленої формулою І, або її фармацевтично прийнятної солі або N-оксиду за допомогою стандартних технологічних способів. Наприклад, крем або мазь готують змішуванням гідрофільної речовини і води з приблизно від 5% мас. до приблизно 10% мас. сполуки для отримання крему або мазі потрібної консистенції. Фармацевтичні композиції даного винаходу можуть бути представлені у формі, прийнятній для ректального введення, де носій являє собою тверду речовину. Переважно, суміш утворюють свічки стандартної дози Відповідні носії включають масло какао і інші матеріали, що звичайно використовуються в даній галузі. Свічки можуть бути зручно отримані спочатку змішуванням композиції з розм'якшеним(и) або розплавленим(и) носієм(ями) з подальшим охолоджуванням і формуванням їх в формах. Крім вказаних вище інгредієнтів, носії фармацевтичних препаратів, описані вище, можуть включати, коли це підходить, один або декілька додаткових інгредієнтів носіїв, таких як розріджувачі, буфери, смакові агенти, зв'язувальні речовини, поверхнево-активні речовини, загусники, речовини, що поліпшують ковзання, консерванти (включаючи антиоксиданти) і т.п. Крім того, для надання препаратам ізотонічності з кров'ю передбачуваного реципієнта в них можуть включатися інші ад'юванти. Композиції, що містять сполуки описаної вище формули І або її фармацевтично прийнятні солі або N-оксиди, можуть також готуватися в формі порошкоподібного або рідкого концентрату. Звичайно для лікування вказаних вище станів застосовуються рівні доз порядку від приблизно 0,01мг/кг до приблизно 150мг/кг маси тіла на добу або, альтернативно, від приблизно 0,5мг до приблизно 10г на добу одному пацієнту Наприклад, рак молочної залози, ракові пухлини голови і шиї і шлунково-кишковий рак, такий як рак ободової кишки, рак прямої кишки або рак шлунка, може ефективно лікуватися введенням від приблизно 0,01 до приблизно 100мг сполуки на кілограм маси тіла на добу або, альтернативно, від приблизно 0,5мг до приблизно 7г на пацієнта на добу. Аналогічно, лейкоз, рак яєчника, бронхіальний рак, рак легені і рак підшлункової залози може ефективно лікуватися введенням від приблизно 0,01 до 100мг сполуки на кілограм маси тіла на добу або, альтернативно, від приблизно 0,5мг до 7г на пацієнта на добу. Мастоцитоз/базофільний лейкоз, шлунковокишкові стромальні пухлини (GIST), дрібноклітинний рак легені (SCLC), синоназальна лімфома, асоційована з природними кілерами/Т-клітинами, 15 84712 семінома яєчника, карцинома щитовидної залози, злоякісна меланома, карцинома яєчника, аденокістозна карцинома, гострий мієлолейкоз (AML), рак молочної залози, педіатричний гострий лімфобластний лейкоз, асоційований з Т-клітинами, ангіосаркома, анапластична крупноклітинна лімфома, ендометріальна карцинома і карцинома передміхурової залози можуть ефективно лікуватися введенням від приблизно 0,01 до 100мг сполуки на кілограм маси тіла на добу або, альтернативно, від приблизно 0,5мг до приблизно 7г на пацієнта на добу. Однак потрібно уявляти, що конкретний рівень дозування для будь-якого конкретного пацієнта буде залежати від різних чинників, включаючи вік, масу тіла, загальний стан здоров'я, стать, харчування, час введення, спосіб введення, швидкість виведення, поєднання з іншими лікарськими засобами і тяжкість конкретного захворювання, що підлягає терапевтичному лікуванню. Сполуки даного винаходу або їх фармацевтично прийнятні солі або N-оксиди також можуть ефективно вводитися в поєднанні з іншими протираковими терапевтичними засобами. Наприклад, цитотоксичні засоби і інгібітори розвитку кровоносних судин можуть бути корисними лікарськими засобами для спільного введення із сполуками даного винаходу. Відповідно, даний винахід включає композиції, що містять сполуки, представлені формулою І, або їх фармацевтично прийнятну сіль або N-оксид і цитотоксичний лікарський засіб або лікарський засіб, що інгібує розвиток кровоносних судин. Кількість кожного з них може бути окремо терапевтично ефективною - в кожному випадку додаткові ефекти можуть перекривати стійкість ракових захворювань до лікування за допомогою одного терапевтичного засобу. Кількість будьякого з них також може бути субтерапевтичною для зниження до мінімуму побічних ефектів, особливо у чутливи х пацієнтів. Потрібно уявляти, що лікування раку залежить від типу раку. Наприклад, терапевтичні засоби першого рівня для лікування раку легень відрізняються від терапевтичних засобів першого рівня для лікування ракy товстої кишки або молочної залози. Навіть при раку легень, наприклад, терапевтичні засоби першого рівня відрізняються від терапевтичних засобів другого рівня, які, в свою чергу, відрізняються від терапевтичних засобів третього рівня. Вперше діагностовані пацієнти могли б лікуватися з використанням в програмі лікування цисплатинуму. При невдалому лікуванні в рамках цієї програми лікування вони переходять на лікування терапевтичними засобами другого рівня, такими як таксан. Нарешті, якщо і це не допомагає, вони могли б отримувати EGFR інгібітор тирозинкінази як лікарський засіб третього рівня. Далі, процеси дозволу застосування лікарського засобу в різних країнах відрізняються один від одного. Відповідно, прийняті програми лікування в різних країнах можуть відрізнятися. Проте, сполуки даного винаходу або їх фармацевтично прийнятні солі або N-оксиди можуть успішно вводитися в поєднанні або в комбінації з іншими сполуками, що мають протиракову терапевтичну дію. Такі інші 16 сполуки включають, наприклад, ряд цитотоксичних засобів (алкілатори, інгібітори ДНК топоізомерази, антиметаболіти, тубулін-зв'язувальні сполуки); інгібітори розвитку кровоносних судин і інші різні види терапевтичних засобів, включаючи інгібітори кінази, такі як Tarceva, моноклональні антитіла і вакцини проти раку. Інші такі сполуки, які можуть переважно вводитися із сполуками даного винаходу, включають доксорубіцин, вінкристин, цисплатин, карбоплатин, гемцитабін і таксани. Таким чином, композиції даного винаходу включають сполуку формули І або її фармацевтично прийнятну сіль або N-оксид і протинеопластичний засіб, протипухлинний засіб, засіб, який перешкоджає розвитку кровоносних судин, або хіміотерапевтичний засіб. Сполука даного винаходу або її фармацевтично прийнятна сіль або N-оксид можуть також ефективно вводитися разом, крім терапевтичних протиракових засобів, з іншими терапевтичними засобами. Наприклад, терапевтичні засоби, ефективні для зниження шкідливих побічних ефектів, можуть бути корисними лікарськими засобами для спільного введення із сполуками даного винаходу. І. Кількісне визначення інгібування c-Kit в інтактних клітинах Здатність сполук інгібувати активність тирозинкінази c-Kit визначають в досліді на клітинному рівні ELISA, використовуючи Н526 клітинну лінію (ATCC # CRL-5811), яка була спочатку отримана з клітин дрібноклітинного раку легені людини. Внаслідок даного досліду визначають здатність сполук блокувати ліганд-стимульоване тирозинфосфорилювання білка c-Kit рецептора дикого типу, який ендогенно експресований в Н526 клітинах. Перед додаванням фактора стовбурових клітин (SCF), ліганду для c-Kit рецепторної тирозинкінази, клітини інкубують із сполуками в різних концентраціях. Після цього готують клітинні лізати, і c-Kit білок вміщують на 96-ямковий мікропланшет ELISA, покритий c-Kit антитілом. Потім вміст фосфотирозину рецепторного білка відстежують кількісним визначенням ступеня зв'язування антитіла, яке розпізнає тільки фосфорильовані тирозинові залишки в межах захопленого білка. Антитіло, що використовується як повідомляючий фермент (наприклад, пероксидаза хрону звичайного, HRP), ковалентно приєднується таким чином, що зв'язування антитіла з фосфорильованим c-Kit може кількісно визначатися інкубуванням з відповідним HRP субстратом. Вихідними реагентами є наступні: 50мМ Tris-HCl, pH 7,4 150мM NaCl 10% Гліцерин 1% Triton X-100 0,5мМ EDTA 1мкг/мл леупептин 1мкг/мл апротинін 1мМ ортованадату натрію Анти c-Kit антитіло: 0,5мкг/мл анти c-Kit Ab-3 (каталог Lab Vision, #MS289P1) в 50мМ бікарбонату натрію, рН 9. Дослідні мікропланшети ELISA: 17 84712 Дослідні мікропланшети ELISA готують додаванням 100мкл анти-c-Kit антитіла в кожну ямку 96-ямкового мікропланшета Microlite-2 (каталог Dynex, # 7417) з подальшим інкубуванням при 37°С протягом 2 годин. Потім ямки двічі промивають 300мкл промивного буфера. Буфер для промивання мікропланшета: PBS, що містить 0,5% Tween-20 (PBST) Дослідне клітинне середовище: RPMI з 0,1% BSA pY20-HRP: 25нг/мл pY20-HRP (каталог Calbiochem, # 525320) в PBS, що містить 0,5% Tween-20, 5% BSA, 1мМ ортованадату натрію. HRP субстрат Реагент хемолюмінесцентного виявлення (каталог Pierce, #37075). Протокол експерименту Культури Н526 клітин, вирощені в RPMI з 10% фетальної телячої сироватки збирають центрифугуванням, двічі промивають PBS і суспендують в дослідному середовищі клітин. Клітини потім розподіляють в 96-ямковий мікропланшет з Vподібним дном з концентрацією 7,5×104 клітин на ямку в 100мкл дослідного клітинного середовища. Розведення сполук отримують 10мМ ДМСО розведенням в дослідному середовищі клітин, причому кінцева концентрація ДМСО в досліді дорівнює 0,1%. В інкубаційні ямки сполук додають 50мкл дослідної сполуки (сполуки випробовують в концентраціях від 0,1нМ до 100мкМ); в позитивну і негативну контрольну ямку додають 50мкл дослідного клітинного середовища, що містить 0,1% ДМСО. Після цього клітини інкубують із сполукою при 37°C протягом 3 годин. Потім для стимулювання Kit рецептора і індукування його тирозинфосфорилювання додають SCF (каталог R&D Systems, #255-SC-010). Далі у всі ямки окремо від негативної контрольної ямки додають 10мкл 1,6мкг/мл розчину SCF в дослідному середовищі клітин і клітини інкубують протягом додаткових 15 хвилин при 37°С. Після додавання охолодженого на льодяній бані PBS планшет центрифугують з швидкістю 1000об./хв.. протягом 5 хвилин, середовище видаляють аспірацією і клітинний пелет 18 лізують додаванням в кожну ямку 120мкл охолодженого на льодяній бані буфера лізування. Планшет залишають на льодяній бані протягом 20 хвилин, 100мкл клітинних лізатів з кожної ямки переносять в ямку на дослідний мікропланшет ELISA і інкубують при 4°С протягом 16 годин. Після інкубування клітинних лізатів на мікропланшеті ELISA ямки промивають 4 рази 300мкл промивного буфера, потім в кожну ямку додають антитіло фосфотирозин виявлення pY20-HRP, і мікропланшет інкубують при кімнатній температурі протягом 2 годин. Після цього ямки промивають 4 рази 300мкл промивного буфера Потім в кожну ямку додають 50мкл хемолюмінесцентного HPR субстрату для люмінометричного підрахунку кількості зв'язування «антифосфотирозин-HPR кон'югат». Порівняння дослідних сигналів, отриманих в присутності сполуки, з сигналами позитивного і негативного контролю (клітини, інкубовані в присутності або у відсутність SCF, без додавання сполуки) дозволяє визначити ступінь інгібування c-Kit рецепторного фосфорилювання тирозину в певному інтервалі концентрацій сполук. Отримані значення інгібування використовують для побудови сигмоїдальної кривої «доза-ефект інгібування» для визначення значень IC50 (тобто концентрації сполуки, при якій воно інгібує SCF-індуковане фосфорилювання тирозину c-Kit білка на 50%). Сполуки прикладів даного винаходу знижують рівень SCF-індукованого тирозином Kit в інтактних клітинах H 526, як визначено вище в аналізі для значень IC50 менше за 15мкМ. Переважно, щоб значення IC50 було меншим, ніж 1мкМ, більш переважно, щоб значення IC50 було меншим, ніж 100нМ, ще більш переважно, щоб значення IC50 було меншим за 30нМ. Сполуки прикладів даного винаходу отримують відповідно до методик способів, представлених на наведених далі схемах. Відповідні розчинники, температури, тиск і інші умови реакцій можуть легко підбиратися фахівцями в даній галузі техніки. Аналогічно, відповідні початкові речовини можуть бути комерційно доступними або можуть бути легко отримані фахівцем даної галузі техніки. 19 84712 20 Відповідно до схеми 1, діариламіни (III) можуть бути отримані конденсацією нітробензолів (І, X=F, OMS, OTs) із заміщеними анілінами (II). Реакція поєднання анілінів (II) може також здійснюватися, коли X-I, Br, Cl, OTf, в умовах реакції BuchwaldHartwig з використанням Pd(0) або Cu(I) каталізаторів і основи (наприклад, K2CO3). Відновлення III для отримання фенілендіамінів (IV) може досягатися при використанні, наприклад, водню в присутності відповідного каталізатора перехідного металу (паладій, платина, рутеній, нікель), заліза, цинку і олова в кислотних умовах з гідросульфітом натрію або з дигідратом хлориду олова (II). Циклізація IV в бензімідазоли (V) може досягатися взаємодією з відповідною карбоновою кислотою, галогенангідридом кислоти, ангідридом кислоти або ортоформіатом (наприклад, (MeO)3CH) і кислотою, такою як мурашина або п-толуолсульфонова кислота. У деяких умовах, що використовуються для відновлення III (наприклад, залізний порошок в мурашиній кислоті), перетворення в бензімідазоли V може досягатися в одній ємності. Крім того, введення триметилортоформіату в гідр уючу суміш з III дозволяє здійснювати пряме перетворення в V. На схемі 2 нижче показано, що отримання Nарилбензімідазолів (V) може також здійснюватися за допомогою представленого способу, де N1H бензімідазоли (VIII) можуть зазнавати арилювання в присутності Pd(0), як описано в публікації J. Am. Chem. Soc, (2000), 122, 7600. Бензімідазоли (VIII) можуть бути отримані циклізацією анілідів (VII) з кислотами, такими, як, але без обмеження тільки ними, оцтова, п-толуолсульфонова, соляна, сірчана або фосфорна кислота. У свою чергу, аніліди (VII) можуть бути отримані взаємодією профенілендіамінів з галогенангідридами кислот або ангідридами або з карбоновими кислотами в присутності відповідних зв'язувальних реагентів, відомих кваліфікованим фахівцям в даній галузі техніки, таких як, але без обмеження тільки ними, EDC, DCC, HOAt, HOBt, HATU, TBTU або CDI, в тому числі нанесені на тверді носії або реагенти в розчині. У тому випадку, коли R3=H, сполуки, такі як VII, можуть бути отримані формілюванням VI алкілформіатами (наприклад, метилформіатом). В описаних способах перетворення VI в VII можуть також приводити до часткового або повного перетворення в VIII. Функціональності R1 і R2 можуть вводитися в цільові молекули за допомогою відповідного підбору ви хідних речовин, наприклад, типу І, II, VI і IX. Коли кінцева функціональність є недоступною безпосередньо даним способом або коли така функціональність може зазнавати несприятливого впливу при подальших хімічних перетвореннях для отримання кінцевої молекули, можуть використовуватися альтернативні функціональності з подальшим перетворенням їх в кінцеву бажану функціональність способами в точках і послідовностях, що легко визначаються кваліфікованим фа хівцем в даній галузі техніки. Наприклад, неповний перелік таких перетворень включає наступні: Оmе→OH (BBr3), NH2→Cl (NaNO2, CuCl), Br→CN (Pd2(dba)3, Zn(CN)2, DPPF), Me→CO2H (KMnO4), CO2H→CO2 Me (MeOH, H2SO4), OH→OAIk (алкілгалогенід, основа), CO2H→CONR'R" (EDC, HOAt, DIPEA, HNRR'R"), Br→CO2 Me (Pd2(dba)3, DPPF, СО(газ.), MeOH), Br→CO2H (tBuLi, CO2), Ar-H→ArBr (NBS), CN→CO2H (конц. H2SO4), Br→NR'R" (Pd2(dba)3, DPPF, HNR'R"). Типові приклади введення такої функціональності в цільові молекули наведені нижче на схемах 3 і 4. 21 84712 Конденсація 3-фтораніліну з 4-фтор-3нітробензойною кислотою протікає при нагріві в етанолі з отриманням X, який може зазнавати відновлення за допомогою каталітичного гідрування над 10% Pd/C в етанолі з отриманням фенілендіаміну (XI). Циклізація XI в бензімідазол (XII) досягається нагрівом з надлишком триметилортофор 22 міату. Реакція поєднання з 3-аміно-5фенілпіразолом в присутності EDC/DMAP приводить до отримання цільового аміду XIII. Альтернативно, бензімідазолкарбонова кислота (XII) може зазнавати перетворення в хлорангідрид при нагріванні в тіонілхлориді з подальшим виділенням продуктів взаємодії з піразоламіном в пірідині. Коли амінопіразоли не є комерційно доступВизначення: ними, вони легко можуть бути отримані різними EDC=етилдиметиламінопропілкарбодіімід гідроспособами, наприклад, як показано вище на схемі хлорид, HOAt=1-пдроксіазабензотриазол, HOBt=14. Заміщені бензоїлацетонітрили зазнають циклігідроксибензотриазол, CDI=1,1'-карбодіімідазол, зації з кислотою і гідрохлоридом третTBTU=О-бензотриазол-N,N,N',N'-тетрафторборат бутилгідразину з отриманням 1-трет-бутил-3-арилтетраметилуронію, HATU=гексафторфосфат аза5-амінопіразолів (XVI) з хорошим виходом. Ці пробензотриазоліл-Ν,Ν,Ν',Ν'-тетраметилуронію, дукти потім можуть зазнавати зв'язування з хлораDIPEA=діізопропілетиламін, TEA триетиламін, нгідридами бензімідазолкарбонової кислоти, Ν,Ν-диметилформамід = ДМФА , NMP=Nотриманими з XII, як описано вище, для отримання метилпіролідинон, DCM=дихлорметан, DMAP=4амідів XIV. Відщеплення трет-бутильної групи продиметиламінопіридин, TFA=три фтороцтова кисловодиться в мурашиній кислоті при кип'я тінні із звота, трет-бутоксикарбоніл = Вос , ротним холодильником з отриманням піразоламіFmoc=фторенілметилоксикарбоніл, дів XV. ДМСО диметилсульфоксид = , OMs=OSO2 Me, OTs=OSO2-(4-Me)Ph, OTf=OSO 2CF3, 23 84712 ВЗЗА=Pd2(dba)3, NBS=N-бромсукцинімід, HCl(водн.)=водна соляна кислота, DMA=Ν,Νдиметилацетамід, MeOH=метанол, EtOH=етанол, EtOAc=етилацетат, DCM=ди хлорметан, ТГФетрагідрофуран , HOAc=оцтова кислота, т = ДМФА Ν,Ν-диметилформамід, = ВЕРХ=високоефективна рідинна хроматографія. Приклад B1 1-(3-Фторфеніл)-N-[3(5)-фенілпіразол-5(3)-іл]1Н-бензімідазол-5-карбоксамід a) 3-Фтор-2-нітробензойну кислоту (4,0г, 21,6ммоль) і 3-фторанілін (4,8г, 43,2ммоль) в 15мл етанолу перемішують при кип'ятінні із зворотним холодильником в атмосфері аргону протягом 5 годин, що приводить до утворення осаду оранжевого кольору. Через 12 годин гетерогенну реакційну суміш виливають в 50мл IN HCl (водн.) і розбавляють 100мл води. Розчин перемішують протягом 20 хвилин, після чого осад відфільтровують, отримуючи 4-(3-фторфеніламіно)-3нітробензойну кислоту: 1 H ЯМР (400МГц, DMSO-d6) δ 10,14 (с, 1H), 8,68 (с, 1H), 7,90 (д, J=1,8Гц, 1H), 7,26 (д, J=8,8Гц, 2H), 7,04 (д, J=8,8Гц, 2H), 6,97 (д, J=6,0Гц, 1H), 6,76 (с, 2H); MC (ES+): m/z 289 [MH +]. b) B розчин 4-(3-фторфеніламіно)-3нітробензойної кислоти (5,57г, 20,1ммоль) в ТГФ (100мл) завантажують 10% Pd/C (500мг), з реакційної колби відкачують повітря і потім заповнюють її H2 (газоподібним) три рази. Суміш енергійно перемішують протягом 12 годин, після чого фільтрують через діатомову землю і фільтрат концентрують у вакуумі, отримуючи 3-аміно-4-(3фтор феніламіно)бензойну кислоту у вигляді твердої не зовсім білої речовини: 1 H ЯМР (400МГц, DMSO-d6) δ 7,63 (с, 1H), 7,34 (д, J=2,0Гц, 1H), 7,19-7,13 (м, 2H), 7,08 (д, J=8,4Гц, 1H), 6,70 (д, J=8,0Гц, 1H), 6,60 (д, J=11,6Гц, 1H), 6,54 (т, J=8,4Гц, 1H), 5,02 (b, 1H); MC (ES+): m/z 247 [MH4]. c) В розчин 3-аміно-4-(3фтор феніламіно)бензойної кислоти (4,96г, 20,1ммоль) в мурашиній кислоті (40мл) завантажують триметилортоформіат (2,4мл, 22,0ммоль), отриману суміш кип'ятять із зворотним холодильником протягом 3 годин, після чого суміші дають охолонути до кімнатної температури і перемішують її при кімнатній температурі протягом 12 годин. Потім реакційну суміш виливають в 150мл H2O і перемішують протягом 20 хвилин, отримуючи осад, який збирають фільтруванням, отримуючи 1-(фторфеніл)-1Н-бензімідазол-5-карбонову кислоту у вигляді твердої не зовсім білої речовини, 1 H ЯМР (400МГц, DMSO-d6) δ 12,88 (с, 1H), 8,73 (с, 1H), 8,32 (с, 1H), 7,95 (д, J=8,5Гц, 1H), 7,757,66 (м, 3H), 7,59 (д, J=8,0Гц, 2H), 7,38 (т, J=8,8Гц, 1H); MC (ES+): m/z 257 [MH +]. d) Розчин 1-(фторфеніл)-1Н-бензімідазол-5карбонової кислоти (200мг, 0,78ммоль) в ДМФА (4мл) обробляють EDC (227мг, 1,18ммоль) і DMAP (9мг, 0,07ммоль), суміш перемішують протягом 10 хвилин і додають 3-(5)-аміно-5(3)-фенілапіразол (267мг, 1,68ммоль). Суміш перемішують протягом ночі, після чого продукт збирають фільтруванням і 24 осад на фільтрі промивають метанолом (3×5мл), отримуючи вказану в заголовку сполук у: 1 H ЯМР (400МГц, DMSO-d6): δ=7,08 (с, 1H), 7,48-7,35 (м, 4Н), 7,61 (д, J=8,0Гц, 1H), 7,78-7,69 (м, 5Н), 8,06 (д, J=8,4Гц, 1H), 8,53 (с, 1H), 8,73 (с, 1H), 10,93 (с, 1H), 13,21 (с, 1H), MC (ES+): m/z 398 (100) [MH+]. Сполуки, перераховані нижче, отримують відповідно до методик, що використовуються в прикладі B1, із застосуванням відповідним чином заміщеного аніліну замість 3-фтораніліну з частини (а) і відповідного заміщеного аміну замість 3(5)аміно-5(3)фенілпіразолу, який використовувався в частині (d). Приклад В2 1-(3-Фторфеніл)-N-[3-(5)-(4-хлорфеніл)піразол5-(3)-іл]-1Н-бензімідазол-5-карбоксамід. MS (ES+): m/z 432 [MH +]. Приклад В3 1-(3-Фторфеніл)-N-[3-(5)-п-толілпіразол-5(3)іл]-1Н-бензімідазол-5-карбоксамід. MS (ES+): m/z 412 [MH+]. Приклад В4 1-(3-Фторфеніл)-N-(1-метил-3-фенілпіразол-5іл)-1Н-бензімідазол-5-карбоксамід. MS (ES+): m/z 412 [MH+]. Приклад В5 1-(4-Метоксифеніл-N-(3-(5)-фенілпіразол-5(3)іл)-1Н-бензімідазол-5-карбоксамід. MS (ES+): m/z 409,0 [MH+]. Приклад В6 1-[3-Метокси-5-(трифторметил)феніл]-N-(3(5)фенілпіразол-5(3)-іл)-1Н-бензімідазол-5карбоксамід. MS (ES+): m/z 478,0 [MH +]. Приклад В7 1-(3,5-Диметоксифеніл)-N-(3(5)-фенілпіразол5-(3)-іл)-1Н-бензімідазол-5-карбоксамід. MS (ES+): m/z 440,1 [MH +]. Приклад В8 1-(3-Ізопропоксифеніл)-N-(3(5)-фенілпіразол5(3)-іл)-1Н-бензімідазол-5-карбоксамід. MS (ES+): m/z 437,9 [MH +]. Приклад В9 1-(4-Бромфеніл)-N-(3(5)-фенілпіразол-5(3)-іл)1Н-бензімідазол-5-карбоксамід. MS (ES+): m/z 459,9 [MH+]. Загальна методика отримання піразолу: розчин 4-метоксибензоїлацетонітрилу (500мг, 2,85ммоль), трет-бутилгідразину гідрохлориду (391мг, 3,14ммоль) і каталітичної кількості птолуолсульфонової кислоти в етанолі (3мл) перемішують в атмосфері аргону при 90°C протягом 4 годин в герметично закритій пробірці. Реакційну суміш концентрують і залишок розподіляють між EtOAc і насиченим розчином NaHCO3. Органічний шар промивають насиченим розчином солі, сушать над Na2SO4, фільтрують і упарюють у вакуумі. Залишок хроматографують на силікагелі (елюювання з градієнтом: 10-30% EtOAc в гексанах), отримуючи 2-трет-бутил-5-(4-метоксифеніл)-2Нпіразол-3-іламін: 1 Н-ЯМР (400МГц, CDCl3) δ 1,70 (с, 9Н), 3,58 (шир. с, 2Н), 3,84 (с, 3Н), 5,85 (с, 1H), 6,91 (д, J=8,8Гц, 2H), 7,69 (д, J=8,8Гц, 2H); MC (ES+): m/z 246 [MH+], m/z 190 [М-tбутил]. 25 84712 Відповідно до методики, описаної вище, синтезують наступні похідні піразолу. 2-трет-бутил-5-(4-трифторметилфеніл)-2Нпіразол-3-іламін: тверда біла речовина; MS (ES+): m/z 228 [М- t бутил]; 2-трет-бутил-5-м-толіл-2Н-піразол-3-іламін: тверда біла речовина; MS (ES+): m/z 174 [Мt бутил]; 2-трет-бутил-5-(3-фторфеніл)2Н-піразол-3іламін; речовина коричневого кольору; MS (ES+): m/z 177 [М- tбутил]; 2-трет-бутил-5-(4-ізопропоксифеніл)-2-Нпіразол-3-іламін; прозорі пластівці; MS(ES+): m/z 218 [М-tбутил]; 2-трет-бутил-5-(3-хлор феніл)-2Н-піразол-3іламін; склоподібна тверда речовина коричневого кольору; MS (ES+): m/z 194 [М-tбутил]. Методика зв'язування амінопіразолів (описаних вище) з бензімідазольним ядром з використанням тіонілхлориду: 1-(3-фторфеніл)-1Нбензімідазол-5-карбонову кислоту (100мг, 0,39ммоль) розчиняють в тіонілхлориді (1,5мл) і перемішують при 50°C протягом 1 години. Тіоніхлорид видаляють за допомогою роторного випарника і залишок розчиняють в пірідині (2мл). До отриманого розчину додають 3-аміно-2-третбутил-5-(3-фторфеніл)піразол в пірідині і реакційну суміш перемішують протягом ночі. Реакційну суміш концентрують і залишок розподіляють між EtOAc і водою. Органічний шар промивають водою, насиченим розчином NaHCO3, насиченим розчином солі, сушать над Na2SO4 фільтрують і концентрують у вакуумі до масла коричневого кольору. Залишок хроматографують на силікагелі (елюювання: 1% MeOH в CHCl3). Фракції об'єднують, концентрують і залишок кристалізують з суміші ЕЮН/гексани, отримуючи N-[2-трет-бутил-5(3-фторфеніл)-2Н-піразол-3-іл]-1-(3-фторфеніл)1Н-бензімідазол-5-карбоксамід: 1 H ЯМР (400МГц, CDCl3) δ 1,79 (с, 9Н), 6,84 (с, 1H), 6,97-7,01 (м, 1H), 7,25-7,39 (м, 4H), 7,57-7,65 (м, 3H), 7,72 (д, J=8,4Гц, 1H), 8,08 (дд, J=8,8Гц, J=1,6Гц, 1H), 8,16 (с, 1H), 8,20 (с, 1H), 8,46 (с, 1H); MC (ES+): m/z 472 [MH +], m/z 416 [M-tбутил]. Відповідно до методики, описаної вище, синтезують наступні сполуки: Комп’ютерна в ерстка А. Рябко 26 N-[2-трет-бутил-5-(4-метоксифеніл)-2Нпіразол-3-іл]-1-(3-фторфеніл)-1H-бензімідазол-5карбоксамід: тверда біла речовина; MS (ES+): m/z 484 [MH+], m/z 428 [М- tбутил]; N-[2-трет-бутил-5-(4-трифторметилфеніл)-2Нпіразол-3-іл]-1-(3-фторфеніл)-1Н-бензімідазол-5карбоксамід: тверда біла речовина; MS(ES+): m/z 522 [MH+], m/z 566 [М-(бутил]; N-(2-трет-бутил-5-м-толіл-2Н-піразол-3-іл)-1(3-фторфеніл)-1Н-бензімідазол-5-карбоксамід: тверда біла речовина; MS (ES+): m/z 468 [MH+], m/z 412 [М- tбутил]; N-[2-трет-бутил-5-(4-ізопропоксифеніл)-2Нпіразол-3-іл]-1-(3-фторфеніл)-1Н-бензімідазол-5карбоксамід: тверда біла речовина; MS(ES+): m/z 512 [MH+], m/z 456 [М- tбутил]. Загальна методика видалення третбутильного фрагмента: Ν-(2-трет-бутил-5-м-тол іл2Н-піразол-3-іл)-1-(3-фторфеніл)-1Н-бензімідазол5-карбоксамід (110мг, 0,235ммоль) розчиняють в мурашиній кислоті (3мл) і суміш кип'ятять із зворотним холодильником при перемішуванні протягом 30 хвилин. Потім розчинник випарюють і відганяють з CHCl3 і Et2O і залишок розтирають з MeOH. Осад, що утворюється, відфільтровують і промивають MeOH і CHCl3, отримуючи N-(5-м-толіл-2Нпіразол-3-іл)-1-(3-фторфеніл)-1Н-бензімідазол-5карбоксамід: 1 H ЯМР (400МГц, CDCl3) δ 2,55 (с, 3Н), 7,05 (шир. с, 1H), 7,18 (шир. д, J=8,4Гц, 1H), 7,33-7,43 (м, 2H), 7,57 (шир. д, J=7,6Гц, 1H), 7,62 (шир. д, J=8,0Гц, 2Н), 7,70-7,74 (м, 2H), 7,78 (д, J=8,4Гц, 1H), 8,07 (дд, J=8,0Гц, J=2,0Гц, 1H), 8,54 (с, 1H), 8,75 (с, 1H); MC (ES+): m/z 412 [MH 4]. N-[5-(4-метоксифеніл)-2Н-піразол-3-іл]-1-(3фтор феніл)-1Н-бензімідазол-5-карбоксамід: тверда біла речовина; MS (ES+): m/z 428 [MH +]; N-[5-(4-трифторметилфеніл)-2Н-піразол-3-іл]1-(3-фторфеніл)-1Н-бензімідазол-5-карбоксамід: тверда біла речовина; MS (ES+): m/z 466 [MH +]; N-[5-(3-фторфеніл)-2Н-піразол-3-іл]-1-(3фтор фенш)-1Н-бензімідазол-5-карбоксамід: тверда біла речовина; MS (ES+): m/z 416 [MH +]; N-[5-(4-ізопропоксифеніл)2Н-піразол-3-іл]-1-(3фтор феніл)-1Н-бензімідазол-5-карбоксамід: тверда біла речовина; MS (ES+): m/z 456 [MH +]. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюN-substituted pyrazolyl-amidyl-benzimidazolyl c-kit inhibitors
Автори англійськоюBolger Joshua, Castelhano Arlindo L., Crew Andrew Philip, Laufer Radoslaw, Li An-Hu, Sambrook Smith Colin Peter, Sun Yingchuan
Назва патенту російськоюN-замещенные пиразолиламидилбензимидазолилы как c-kit ингибиторы
Автори російськоюБолджер Джошуа, Кастелано Арлиндо Л., Крю Эндрю Филип, Лауфер Радослав, Ли Ань-Ху, Сембрук Смит Колин Питер, Суй Инчуань
МПК / Мітки
МПК: A61K 31/4184, A61K 31/4155, C07D 403/12, A61P 35/00
Мітки: n-заміщені, піразоліламідилбензімідазоліли, інгібітори, c-kit
Код посилання
<a href="https://ua.patents.su/13-84712-n-zamishheni-pirazolilamidilbenzimidazolili-yak-c-kit-ingibitori.html" target="_blank" rel="follow" title="База патентів України">N-заміщені піразоліламідилбензімідазоліли як c-kit інгібітори</a>
Попередній патент: Теплообмінна труба
Наступний патент: Пристрій для підйому глибинної морської води на поверхню
Випадковий патент: Серовинна суміш для виготовлення силікатних виробів