Похідні індолу з ефектом, що індукує апоптоз
Номер патенту: 86021
Опубліковано: 25.03.2009
Автори: Герлах Маттіас, Шмідт Петер, Еміг Петер, Шустер Тілманн, Гюнтер Екхард, Басснер Сільке
Формула / Реферат
1. Похідна індолу загальної формули І:
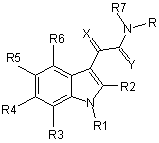 формула І,
формула І,
у якій
R являє собою незаміщений або заміщений хіноліл, піридопіразиніл, індазоліл або піридил і безпосередньо зв'язаний з амідною групою,
R1 являє собою незаміщений або заміщений алкіларил,
R2 являє собою водень,
R3-R6 являють собою водень,
R7 являє собою (С1-С6)-алкілкарбоніл або (С1-С6)-алкоксикарбоніл,
та
X, Y являють собою кисень або сірку,
за умови, що, коли R являє собою незаміщену або заміщену 2-, 3-, 4-, 5- і 6-піридильну групу, a R1-R6 приймають зазначені вище значення, R7 не являє собою ацетильний радикал або трет-бутилоксикарбонільну групу;
та її фізіологічно толерантні солі.
2. Похідна індолу за п. 1, у якій R являє собою: незаміщений або заміщений 5-, 6-, 7-хіноліл, незаміщений або заміщений 2-, 3-, 6-, 7- і 8-піридопіразиніл, незаміщений або заміщений 3-, 4-, 5-, 6- і 7-індазоліл, незаміщений або заміщений 2-, 3-, 4-, 5- і 6-піридил.
3. Похідна індолу за п. 1 або п. 2, у якій R7 являє собою метоксикарбоніл, етоксикарбоніл, пропоксикарбоніл, ацетил або пропіоніл.
4. Похідна індолу за п. 1, яку вибирають з групи, що включає:
N-{2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксоацетил}-N-хінолін-6-ілацетамід (2),
метил {2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксоацетил}хінолін-6-ілкарбамат (3),
етил {2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксоацетил}хінолін-6-ілкарбамат (5),
пропіл {2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксоацетил}хінолін-6-ілкарбамат (6),
N-{2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксоацетил}-N-хінолін-6-ілпропіонамід (7),
етил {2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксоацетил}піридин-4-ілкарбамат (8).
5. Похідна індолу за п. 1, у якій R1 являє собою 4-хлорбензил; R2-R6 являють собою водень; X, Y являють собою кисень або сірку.
6. Похідна індолу загальної формули І, у якій
R являє собою безпосередньо зв'язаний з азотом аміду заміщений 6-хіноліл, заміщений або незаміщений 7-хіноліл, де 2-метил-6-хіноліл виключається і де, коли X являє собою атом сірки, R може також бути незаміщеним 6-хінолілом; незаміщений або заміщений 2-, 3-, 6-, 7- і 8-піридопіразиніл; незаміщений або заміщений 3-, 4-, 5-, 6- і 7-індазоліл,
R1 являє собою незаміщений або заміщений алкіларил,
R2 являє собою водень,
R3-R6 являють собою водень, та
R7 являє собою водень,
X, Y являють собою кисень або сірку,
та її фізіологічно толерантні солі.
7. Похідна індолу за п. 6, яку вибирають з групи, що включає:
2-[1-(4-хлорбензил)-1Н-індол-3-іл]-N-хінолін-6-іл-2-тіоксоацетамід (11),
2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксо-N-піридо[2,3-b]піразин-7-ілацетамід (1),
2-[1-(4-хлорбензил)-1Н-індол-3-іл]-N-(1Н-індазол-5-іл)-2-оксоацетамід (4).
8. Похідна індолу за п. 6, у якій R1 являє собою 4-хлорбензил, R2-R6 являють собою водень, а X і Y являють собою кисень або сірку.
9. Фармацевтична композиція, яка відрізняється тим, що містить принаймні одну похідну індолу, визначену у будь-якому з пп. 1-8.
10. Композиція за п. 9, у якій похідна індолу знаходиться в складі мікрочастинок або наночастинок.
11. Композиція за п. 9 або п. 10, яка додатково містить фармацевтично придатний носій та/або допоміжну речовину, і знаходиться у формі таблеток, таблеток із цукровим покриттям, капсул, розчинів для інфузії або ампул, супозиторіїв, пластирів, препаратів у вигляді порошків, які можуть застосовуватися для інгаляції, суспензій, кремів і мазей.
12. Застосування похідних індолу за будь-яким з пп. 1-8 для одержання фармацевтичної композиції для лікування пухлинних захворювань.
13. Застосування за п. 12 для лікування пухлинних захворювань у випадку лікарської резистентності відносно інших активних сполук.
14. Застосування за п. 12 для лікування пухлинних захворювань у випадку карцином, що метастазують.
Текст
1. Похідна індолу загальної формули І: 2 (19) 1 3 86021 4 7. Похідна індолу за п. 6, яку вибирають з групи, що включає: 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-N-хінолін-6-іл-2тіоксоацетамід (11), 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксо-Nпіридо[2,3-b]піразин-7-ілацетамід (1), 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-N-(1Н-індазол-5іл)-2-оксоацетамід (4). 8. Похідна індолу за п. 6, у якій R1 являє собою 4хлорбензил, R2-R6 являють собою водень, а X і Y являють собою кисень або сірку. 9. Фармацевтична композиція, яка відрізняється тим, що містить принаймні одну похідну індолу, визначену у будь-якому з пп. 1-8. 10. Композиція за п. 9, у якій похідна індолу знаходиться в складі мікрочастинок або наночастинок. 11. Композиція за п. 9 або п. 10, яка додатково містить фармацевтично придатний носій та/або допоміжну речовину, і знаходиться у формі таблеток, таблеток із цукровим покриттям, капсул, розчинів для інфузії або ампул, супозиторіїв, пластирів, препаратів у вигляді порошків, які можуть застосовуватися для інгаляції, суспензій, кремів і мазей. 12. Застосування похідних індолу за будь-яким з пп. 1-8 для одержання фармацевтичної композиції для лікування пухлинних захворювань. 13. Застосування за п. 12 для лікування пухлинних захворювань у випадку лікарської резистентності відносно інших активних сполук. 14. Застосування за п. 12 для лікування пухлинних захворювань у випадку карцином, що метастазують. Даний винахід відноситься до нових похідних індолу, які мають більш виражений біологічний ефект, краще переносяться, демонструють більш високу пероральну біодоступність і використовуються як ліки для лікування ракових захворювань, особливо коли має місце резистентність до інших активних сполук і коли карцинома метастазує. Лікування ракових захворювань має величезну важливість у медицині. В усьому світі існує потреба в ефективних методах ракової терапії для того, щоб добитися лікування, яке підходить для пацієнта й із прицільно спрямованим впливом. Це можна бачити у великій кількості робіт, які з'явилися останнім часом в області прикладної онкології, і у фундаментальних дослідженнях, що мають відношення до терапії ракових захворювань. Ефекти інгібіторів раку мають місце завдяки широкому різноманіттю механізмів, причому відомі тільки деякі з них. І нерідко виявляють, що відомі протиракові препарати мають нові механізми дії. Цього також очікують відносно сполук даного винаходу. Багато протиракових засобів діють шляхом таких механізмів, як блокування механізму клітинного поділу в клітинах, перешкоджання постачання пухлини живильними речовинами і киснем (антиангіогенез), попередження метастаз, запобігання прийому й передачі раковій клітині сигналів росту або шляхом введення ракової клітини в програму смерті клітини (апоптоз). Придатні для клінічного використання агенти часто вводять у комбінації для досягнення синергічного терапевтичного ефекту з тієї причини, що вони мають різні механізми дії, включаючи взаємодію з різними внутрішньоклітинними мішенями. Похідні індолу використовуються багатьма різними способами як фармакологічно активні сполуки та як будівельні блоки для синтезу у фармакологічній хімії. [Документи WO 99/51224 A1 та WO 01/22954 A1] описують похідні індол-3-ілу, які мають антинеопластичний ефект та які можуть бути заміщені великою кількістю груп, включаючи 2-, 3-, 4- і 8хінолінові радикали або 2-, 3-, 4-, 5- і 6-піридинові радикали. 2-метил-8-хінолінова група згадується в Прикладі 60, як замісник при амідній групі. Однак, немає згадування про біологічні властивості цих сполук. [WO 99/55696 A1] описує заміщені оксііндоли як інгібітори фосфодіестерази 4. Однак, немає повідомлень про те, що сполуки даного винаходу мають антинеопластичну активність, а також немає припущень про те, що вони можуть мати таку активність. [WO 02/08225 A1] описує похідні 2-(1Н-індол-3іл)-2-оксоацетаміду, які проявляють антинеопластичний ефект відносно твердих пухлин. Однак, немає згадувань про приклади спеціального здійснення, що включають радикали хіноліну, піридопіразину або індазолілу. В [WO 00/67802] описується індол-3гліоксиламиди, які заміщаються жирними кислотами з порівняно довгими ланцюжками, як потенційні антинеопластичні засоби. Однак, немає згадування про приклади спеціального здійснення, що включають радикали хіноліну, піридопіразину та індазолілу. Не наводять також ніяких біологічних даних щодо прикладів такого здійснення. [Публікація W.-T.Li та інші (J. Med. Chem. 2003, 46, 1706 та наступні)] описує N-гетероциклічні індолілгліоксиламіди як орально активні сполуки, що мають антинеопластичну активність. Однак, не надають ніякої інформації відносно механізму їх дії. [WO 03/022280 А2] описує 3гліоксиламідиндоли та їх застосування як ліків для лікування неопластичних захворювань. Їх загальна формула також включає похідні 6-хінолінів. Крім того, згадуються два приклади, що містять радикал 6-хіноліну як приклади здійснення та підкріплені біологічними результатами. Однак, немає згадування про приклади спеціального здійснення, що включають радикали піридопіразину та індазолілу. [US 03/0181482 A1] описує нові індолілгліоксиламіди. У цьому випадку сполуки за даним винаходом характеризують як антинеопластичні засо 5 би, що мають цититоксичну активність і є інгібіторами ангіогенезу. До того ж показано, що похідна 6-хіноліну може бути прикладом здійснення (сполука 3; с.10), а також підтверджені факти наявності антипроліферативної активності (див. с.19; Таблиці 1a та 1b) і антиангіогенних властивостей (див. с.20). Однак, немає згадування про приклади спеціального здійснення, що включають радикали піридопіразину та індазолілу. [WO 02/10152 А2] вже описує другий клас похідних індолу для лікування пухлинних захворювань. У цьому документі активна сполука N-(2метил-6-хіноліл)-[1-(4-хлорбензил)індол-3іл]гліоксиламід, між іншим, була протестовала у відношенні антипроліферативного впливу на цілий ряд ліній ракових клітин. Клінічно протестовані сполуки, які або зв'язуються з мікротрубочками (паклітаксел і вінкристин), або інгібують топоізомеразу II (доксорубіцин, етопозид і мітоксантрон) у цей час широко використовуються в терапії раку при, у тому числі, раку молочної залози, раку яєчників, раку шлунку та раку легень, а також у випадку саркоми Капоши та при лейкеміях. Однак, їх використання обмежено появою лікарської резистентності, а також серйозними неврологічними, шлунково-кишковими, серцево-судинними та печінковими побічними ефектами. Ціллю даного винаходу є створення доступних цитотоксичних речовин, які мають комбіновані механізми дії і які придатні для лікування великої кількості пухлинних захворювань, особливо коли має місце лікарська резистентність відносно інших препаратів і коли карциноми метастазують. Зазначеної цілі досягають за допомогою похідних індолу загальної формули І, у якій R: являє собою насичений, ненасичений або ароматичний, заміщений або незаміщений (С2С14)-гетероцикл, що містить один або більше гетероатомів, вибраних із групи N, O і S, і який безпосередньо зв'язаний з азотом аміду, причому гетероцикл переважно є (і) незаміщеним або заміщеним 5-, 6-, 7хінолілом, (іі) незаміщеним або заміщеним 2-, 3-, 6-, 7- і 8-піридопіразинілом, (ііі) незаміщеним або заміщеним 3-, 4-, 5-, 6- і 7-індазолілом, (iv) незаміщеним або заміщеним 2-, 3-, 4-, 5- і 6-піридилом, (v) незаміщеним або заміщеним 3-, 4- і 5ізоксазолілом, (vi) незаміщеним або заміщеним 3-, 4- і 5ізотіазолілом, R1: являє собою незаміщений або заміщений алкіл-арил, 86021 6 R2: (і) водень, (іі) незаміщений або заміщений (С1-С6)-алкіл, R3-R6: (і) водень, (іі) незаміщений або заміщений (С1-С6)-алкіл, (ііі) незаміщений або заміщений (С3-С7)циклоалкіл, (iv) аміно, моно-( С1-С4)-алкіламіно, ді-(С1-С4)алкіламіно, (v) галоген, (vi) (С1-С4)-алкіл, що заміщується одним або більше атомів фтору, переважно трифторметильною групою, (vii) ціано, ціано-(С1-С6)-алкіл з прямим або розгалуженим ланцюгом, (viii) (С1-С6)-алкілкарбоніл, (іх) карбоксил, (С1-С4)-алкоксикарбоніл, карбокси-(С1-С6)-алкіл або (С1-С6)-алкоксикарбоніл-(С1С6)-алкіл, (х) гідроксил, (хі) -( С1-С6)алкокси, (хіі) арил-(С1-С6)-алкокси, переважно бензилокси, (хііі) (С1-С6)-алкоксикарбоніламіно, (С1-С6)алкоксикарбоніламіно-( С1-С6)-алкіл, R7: (С1-С6)-алкілкарбоніл, переважно ацетил або пропіоніл, (С1-С6)-алкоксикарбоніл, переважно метоксикарбоніл, етоксикарбоніл або пропоксикарбоніл, та X, Y: кисень або сірка, їх таутомери і стереоізомери, включаючи діастереомери та енантіомери, а також їх фізіологічно толерантні солі. Коли R - являє собою незаміщену або заміщену 2-, 3-, 4-, 5- і 6-піридильну групу, а R1-R6 мають згадані вище значення, R7 не повинен у цьому випадку бути ацетильним радикалом або третбутилоксикарбонільною групою. Даний винахід далі відноситься до похідних індолу загальної формули І: у якій R: являє собою безпосередньо зв'язаний з азотом аміду (і) заміщений 6-хіноліл, заміщений або незаміщений 7-хіноліл, де 2-метил-6-хіноліл виключений і де, коли X - являє собою атом сірки, R може також бути незаміщеним 6-хінолілом, (іі) незаміщений або заміщений 2-, 3-, 6-, 7- і 8піридопіразиніл, (ііі) незаміщений або заміщений 3-, 4-, 5-, 6- і 7-індазоліл, R1: незаміщений або заміщений алкіл-арил, R2: водень, R3-R6: (xiv) водень, 7 (xv) незаміщений або заміщений (С1-С6)-алкіл, (xvi) незаміщений або заміщений (С3-С7)циклоалкіл, (xvii) аміно, моно-(С1-С4)-алкіламіно, ді-(С1-С4)алкіламіно, (xviii) галоген, (хіх) (С1-С4)-алкіл, що заміщується одним або більше атомів фтору, переважно трифторметильною групою, (хх) ціано, ціано-(С1-С6)-алкіл із прямим або розгалуженим ланцюгом, (ххі) (С1-С6)-алкілкарбоніл, (ххіі) карбоксил, (С1-С4)-алкоксикарбоніл, карбокси-(С1-С6)-алкіл або (C1-C6)-алкоксикарбоніл(С1-С6)-алкіл, (ххііі) -(С1-С6)-алкокси, (xxiv) арил-(С1-С6)-алкокси, переважно бензилокси, (xxv) (С1-С6)-алкоксикарбоніламіно, (С1-С6)алкоксикарбоніламіно-(С1-С6)-алкіл, та R7: водень, X, Y: кисень або сірка, їх таутомери і стереоізомери, включаючи діастереомери та енантіомери, а також їх фізіологічно толерантні солі. Даний винахід є подальшим розвитком винаходу, що описаний у [WO 02/10152]. Було помічено, що похідні індолу, які були одержані шляхом заміни 2-метил-6-хінолільної групи незаміщеним або заміщеним 2-, 3-, 6-, 7- і 8-піридопіразинілом або незаміщеним або заміщеним 3-, 4-, 5-, 6- і 7індазолілом, демонструють високий антипроліферативний вплив на ряд ліній пухлинних клітин. Далі було відзначено, що сполуки даного винаходу виявляють потужний цитотоксичний ефект, що може бути результатом дії широкого спектру різних механізмів. Один механізм дії сполук за даним винаходом, що був продемонстрований у даному винаході, базується на інгібуванні полімеризації тубуліну та на інгібуванні топоізомерази II. Це приводить до пригнічення онкогенних клітин у фазі G2M. Додатково до цього, сполуки даного винаходу індукують апоптоз. Далі було помічено, що сполуки даного винаходу мають дуже високу розчинність у воді, і, отже, також високу біологічну доступність. Крім того, було показано, що введення ацетильного радикалу як R7-paдикaлy приводить до одержання сполук за винаходом, що мають надзвичайно високу активність in vivo, що є в той же час більш толерантними. Клас речовин, описаний у даному винаході, повинен відкрити можливість одержання антинеопластичного лікарського засобу, який при більш низьких дозах має більш тривалу дію та є краще переносним, ніж це може бути досягнуто при використанні загальноприйнятих цитотоксичних засобів. Зокрема, повинна з'явитися можливість обійти несприятливе розвинення резистентності, що, як відомо, має місце у випадку застосування багатьох антинеопластичних засобів. Ефект посилення, що досягається при використанні похідних індолу даного винаходу, повинен зробити вживання лікарських засобів більш ефективним. Крім того, буде 86021 8 можливо поширити лікування на випадки, які характеризуються резистентністю до терапії. У кращому варіанті R1 являє собою 4хлорбензил, R2-R6 - водень, R -гетероцикл та R7 алкілкарбоніл або алкоксикарбоніл у похідній індолу формули І. В іншому кращому варіанті R являє собою незаміщений 5-хіноліл, незаміщений 6-хіноліл або незаміщений 7-хіноліл, a R7 являє собою ацетил або пропіоніл у похідній індолу формули І. В іншому кращому варіанті R являє собою незаміщений 5-хіноліл, незаміщений 6-хіноліл або незаміщений 7-хіноліл, a R7 являє собою метоксикарбоніл, етоксикарбоніл або пропіоноксикарбоніл у похідній індолу формули І. Деяким термінам, які використовуються в описі та у формулі винаходу, нижче дані визначення. Що стосується терміну "гетероцикл", його розуміють як термін, що означає, як дотепер докладно не згадували, пірол, фуран, тіофен, піразол, тіазол, індол, оксазол, імідазол, ізотіазол, ізоксазол, 1,2,3-триазол, 1,2,4-триазол, 1,2,4-оксадіазол, 1,3,4-оксадіазол, 1,2,5-тіадіазол, 1,3,4-тіадіазол, тетразол, піридин, піримідин, піридазин, піразин, бензофуран, індазол, карбазол, бензоксазол, бензімідазол, бензотіазол, хінолін, цинолін, хіноксалін, хіназолін, фталазин, піридопіразин, 1,2,3-триазин, 1,2,4-триазин, 1,3,5-триазин, пурин, птеридин, акридин і фенатридин. У рамках даного винаходу вираз "алкіл" охоплює ациклічні насичені або ненасичені вуглеводні, які можуть мати прямий або розгалужений ланцюг. Стосовно терміну "алкіл" термін "заміщений" розуміють, у рамках змісту даного винаходу, але ще не дали докладне визначення, як заміну водневого радикалу на F, Cl, Br, I, CN, NH2, NH-алкіл, NHциклоалкіл, OH або О-алкіл, де полізаміщені радикали слід розуміти як такі, що означають заміщені більше, ніж один раз, наприклад, два або три рази, або при різних атомах або при однакових атомах, наприклад, три рази при тому самому атомі С, як у випадку -CF3 та -CH2CF3, або при різних сайтах, як у випадку -СН(ОН)-СН2-СН2-СНСІ2. Полізаміщення можна проводити, використовуючи ті самі або різні замісники. Вираз "алкіл-арил" означає (С1-С6)-алкіл-(С6С14)-арил і переважно (С1-С6)-алкіл-С6-арил. У відношенні термінів "алкіл-арил" та "циклоалкіл", "однозаміщений або заміщений більше, ніж один раз" у рамках даного винаходу розуміють, але ще не уточнили вище, у значенні однієї або багаторазової, наприклад, дворазової, триразової або чотириразової, заміни одного або більше атомів водню в кільцевій системі на F, Cl, Br, І, CN, NH2, NH-алкіл, NH-циклоалкіл, OH або О-алкіл, CF3, алкіл, (C6-C10)-арил, (C6-C10)-арил-(С1-С6)алкіл та/або гетероцикліл при одному або, де необхідно, при різних атомах (тим, що може бути замісником, його частиною, що заміщають, де слід). У зв'язку із цим багаторазове заміщення проводять, використовуючи ті самі або різні замісники. У відношенні термінів "гетероцикл", "однозаміщений або заміщений більше, ніж один раз" у рамках даного винаходу розуміють, але ще не 9 уточнили вище, у значенні однієї або багаторазової, наприклад, дворазової, триразової або чотириразової, заміни одного або більше атомів водню в кільцевій системі на F, Cl, Br, І, нітро, аміно, (C1C6)-алкіл, переважно метил, моно-(С1-С6)алкіламіно, ді-(С1-С6)-алкіламіно, гідроксил, (C1С6)-алкокси, бензилокси, карбоксил, (С1-С6)алкоксикарбоніл, (C1-C6)-алкоксикарбоніламіно або (С1-С6)-алкіл, що заміщений один або більше разів фтором, переважно трифторметилом, (C6C10)-арилом, та/або (С6-С10)-арил-(С1-С6)-алкілом при одному або, де необхідно, при різних атомах (тим, що може бути замісником, його частиною, що заміщають, де слід). У зв'язку із цим багаторазове заміщення проводять, використовуючи однакові або різні замісники. За умови, що сполуки винаходу формули І мають, принаймні, один центр асиметрії, вони можуть бути представлені у формі їх рацематів, у вигляді чистих енантіомерів та/або діастереомерів або у вигляді суміші цих енантіомерів та/або діастереомерів. Стереоізомери можуть бути присутніми у суміші в будь-яких довільних пропорціях. У тому випадку, якщо це можливо, сполуки за даним винаходом можуть бути присутніми у формі таутомерів. Таким чином, методи, які відомі дотепер, можуть бути використані, наприклад, щоб розділяти сполуки даного винаходу загальної формули І, які мають один або більше хіральних центрів та існують як рацемати, на їх оптичні ізомери, тобто, енантіомери або діастереомери. Розділення можна проводити шляхом розподілу на колонці на хіральних фазах або шляхом перекристалізації з оптично активного розчиннику або шляхом використання оптично активної кислоти або основи або шляхом утворення похідного з оптично активним реагентом, таким як оптично активний спирт, з наступним відщепленням залишку. Якщо сполуки за даним винаходом загальної формули І містять досить кислу групу, таку як карбоксильна, вони можуть бути перетворені у свої фізіологічно толерантні солі, за допомогою неорганічних та/або органічних основ. Прикладами прийнятних неорганічних основ є гідроксид натрію, гідроксид калію та гідроксид кальцію, у той час як прикладами прийнятних органічних основ є етаноламін, діетаноламін, триетаноламін, циклогексиламін, дибензилетилендіамін і лізин. У цьому контексті, стехіометрія одержаних солей сполук за винаходом може бути або цілим, або нецілим числом, кратним одному. Якщо вони мають досить основну групу, таку як вторинний або третинний амін, сполуки за даним винаходом загальної формули І можуть бути перетворені в солі з застосуванням неорганічних та органічних кислот. Фармацевтично переносні солі сполук даного винаходу загальної структури І переважно утворюються при дії хлороводневої кислоти, бромоводневої кислоти, сірчаної кислоти, фосфорної кислоти, метансульфонової кислоти, пара-толуолсульфонової кислоти, вугільної кислоти, мурашиної кислоти, оцтової кислоти, трифтороцтової кислоти, щавлевої кислоти, малонової кислоти, малеїнової кислоти, бурштинової кисло 86021 10 ти, винної кислоти, піровиноградної кислоти, яблучної кислоти, ембонової кислоти, мигдальної кислоти, фумарової кислоти, молочної кислоти, лимонної кислоти, глутамінової кислоти або аспарагінової кислоти. Солі, які утворяться, зокрема, це гідрохлориди, гідроброміди, сульфати, фосфати, метансульфонати, сіль сульфооцтової кислоти, тозилати, карбонати, гідрокарбонати, формати, ацетати, трифлати, оксалати, малонати, малеати, сукцинати, тартрати, малати, ембонати, манделати, фумарати, лактати, цитрати та глутамінати. У цьому контексті, стехіометрія одержаних солей сполук за винаходом може бути або цілим, або нецілим числом, кратним одному. Перевагу також надають сольватам, особливо гідратам, сполук формули І за винаходом, які можуть бути одержані, наприклад, шляхом кристалізації з розчинника або з водного розчину. У цьому контексті одна, дві, три або будь-яке довільне число молекул розчинника або води може бути зв'язано зі сполуками за даним винаходом з утворенням сольватів або гідратів. Відомо, що хімічні речовини утворюють тверді частки, які існують у стані різного ступеню впорядкованості та називаються поліморфними формами або модифікаціями. Різні модифікації поліморфної речовини можуть сильно відрізнятися своїми фізичними властивостями. Сполуки даного винаходу загальної формули І можуть бути присутніми у різних поліморфних формах, з можливістю для спеціальних модифікацій, будучи метастабільними. Сполуки формули І, а також їх солі біологічно активні. Сполуки формули І можуть застосовуватися у вільній формі та у вигляді солей фізіологічно толерантних кислот або основ. Сполуки загальної формули І можна застосовувати перорально, ректально, трансбукально (наприклад, під'язично), парентерально (наприклад, підшкірно, внутрім'язово, внутрішкірно або внутрівенно), місцево або черезшкірно. Даний винахід далі має відношення до лікарських препаратів, що мають у складі, принаймні, одну із сполук формули І або їх солі фізіологічно толерантних неорганічних або органічних кислот та, де прийнятно, фармацевтично застосовні носії та/або розріджувачі або добавки. Ці лікарські препарати використовуються для лікування пухлинних захворювань, особливо для лікування таких пухлинних захворювань, які ускладнені лікарською резистентністю у відношенні інших активних сполук та/або пухлинних захворювань, включаючи карциному, що метастазує. Прикладами зручних для застосування форм є таблетки, таблетки із цукровим покриттям, капсули, розчини для інфузії або ампули, супозиторії, пластирі, препарати у вигляді порошків, які можуть застосовуватися для інгаляції, суспензії, креми та мазі. Сполуки за винаходом можуть бути також дисперговані в композиції, що містить мікрочастинки, наприклад, наночастинки. Докладно, терапевтично корисні властивості, які були встановлені, пов'язані з наступними перевагами: 11 - сполуки згідно винаходу характеризуються сильними антипроліферативними властивостями; - сполуки згідно винаходу інгібують полімеризацію тубуліну; - сполуки згідно винаходу інгібують топоізомеразу II; - сполуки згідно винаходу пригнічують клітини, що діляться, у фазі G2M; - сполуки згідно винаходу індукують апоптоз; - сполуки згідно винаходу характеризуються надзвичайно високою антинеопластичною активністю in vivo, в той же час вони є більш толерантними; - сполуки згідно винаходу формули І активні in vitro на mdr-резистентних клітинних лініях, на відміну від паклітакселу, вінкристину, доксорубіцину або етопозиду. Найбільша перевага надається сполукам згідно даного винаходу загальної формули І, які включені в наступний набір: 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксо-Nпіридо[2,3-b]піразин-7-ілацетамід (1) 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-N-(1Ніндазол-5-іл)-2-оксоацетамід (4) N-{2-[1-(4-хлорбензил)-1 Н-індол-3-іл]-2оксоацетил}-N-хінолін-6-ілацетамід (2) метил {2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2оксоацетил}хінолін-6-ілкарбамат (3) етил {2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2оксоацетил}хінолін-6-ілкарбамат(5) пропіл {2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2оксоацетил}хінолін-6-ілкарбамат (6) N-{2-[1-(4-xлopбeнзил)-lH-iндoл-3-iл]-2oкcoaцeтил}-N-xiнoлiн-6-iлпpoпioнaмiд (7) етил {2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2оксоацетил}піридин-4-ілкарбамат (8) 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-N-хінолін-6іл-2-тіоксоацетамід (11) Сполуки (1), (4) і (11) являють собою сполуки, у яких радикал R7 є воднем. Сполуки (2), (3), (5) і (6) - (8) містять алкілкарбонільну групу або алкоксикарбонільну групу як групу R7. Наступні сполуки (9), (10), (12), (13), (14) і (15) являють собою сполуки, які були вивчені з метою порівняння. Сполуки (9), (10), (14) і (15) відомі з попередніх досягнень. Сполука (9) описана в [WO 02/10152] Заявника, сполука (10) описана в [WO 03/022280], сполука (13) вичерпно висвітлюється у формулі винаходу в [WO 02/08225 A1], а сполуки (12), (14) і (15) представлено у формулі винаходу в [WO 99/51224 A1 та WO 01/22954]. 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-N-(2метилхінолін-6-іл)-2-оксоацетамід (9) 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксо-Nхінолін-6-ілацетамід (10) 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксо-Nхінолін-8-ілацетамід (12) 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-N-ізохінолін5-іл-2-оксоацетамід (13) 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксо-Nпіридин-4-ілацетамід (14) 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-N-(2метилхінолін-8-іл)-2-оксоацетамід (15) 86021 12 Сполуки із загальними формулами 1a та 1b на схемі можуть бути одержані у відповідності з наступною схемою: Сполуки загальної формули 1c, у яких X=S, можуть бути одержані відповідно до Схеми 2: Сполуки загальної формули 1c, у яких Y=S, можуть бути одержані шляхом використання методів, відомих з літератури [W.-D. Malberg та інші. Liebigs Ann. Chem. 10, 1983; 1649-1711]. Вихідні сполуки II, III та IV можуть бути придбані комерційно або одержані з використанням вже відомих методів. Вихідні сполуки II, III та IV є цінними інтермедіатами для одержання похідних індолу за даним винаходом формули І. Для одержання вихідних сполук і кінцевих сполук можна рекомендувати, наприклад, наступні зразкові роботи з органічного синтезу, зміст яких, таким чином, мають намір включити в опис даної заявки: - Houben-Weyl, том E 7а (Частина 1) стор. 290492, стор. 571-740 - Houben-Weyl, том E 7а (Частина 2) стор. 119156, стор. 205-686, стор. 157-204 Монографія "Heterocyclic Compounds" (Elderfield), Том 1, стор. 119-207, стор. 397-616 Том 3, стор. 1-274 Том 6, стор. 101-135, стор. 234-323 Монографія "Comprehensive Organic Chemistry" (S.D. Barton, W.D. Ollis) Tом 4, стор. 155-204, стор. 205-232, стор. 493564 Кваліфікований спеціаліст знайомий, завдяки своїм професійним знанням, з розчинниками та допоміжними засобами, з параметрами реакції, 13 такими як температура реакції та тривалість реакції, які використовують, де необхідно. Наступні сполуки, включення яких у наступний розгляд зрозуміло, виходячи з характерної для них хімічної структури, були синтезовані відповідно до цих загальних напрямків для стадій 1, 2 та 3, як представлено на Схемах синтезу 1 та 2. Сполуки даного винаходу були охарактеризовані аналітично шляхом визначенням їх точок плавлення та/або за допомогою 1H ЯМР-спектроскопії та/або масспектроскопії. Використовувані хімічні препарати та розчинники або придбали комерційним шляхом від звичайних постачальників (Acros, Avocado, Aldrich, Fluka, Lancaster, Maybridge, Merck, Sigma, TCI і т.д.), або синтезували. Винахід буде пояснено більш детально за допомогою наступних прикладів, не обмежуючись ними. Приклади Приклад 1 (Реакція за Схемою 1, 1 стадія): Одержання 1-(4-хлорбензил)індолу Розчин 5,86г (0,05 моль) індолу в 25мл диметилсульфоксиду (DMSO) додають до суміші 1,32г гідриду натрію (0,055 моль, суспензія в мінеральному маслі) в 50мл диметилсульфоксиду. Одержану суміш нагрівають при 60°C впродовж 1,3 годин; після цього дають охолонути та по краплині додають 17,7г (0,11 моль) 4-хлорбензил хлориду. Розчин нагрівають до 60°C і залишають на ніч; потім його виливають в 200мл води при перемішуванні. Цю суміш екстрагують загальним об'ємом 75мл СН2Сl2, після чого органічну фазу видаляють шляхом висушування за допомогою збезводненого сульфату натрію та фільтрують, а фільтрат випарюють у вакуумі. Вихід: 11,5г (95% від теоретичного). Приклад 2 (Реакція за Схемою 1, 2-а стадія): 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксо-Nпіридо[2,3-b]піразин-7-ілацетамід (1) Розчин 10,2г (10,7 ммоль) 1-(4хлорбензил)індолу в 200мл ефіру при 0°C і в атмосфері азоту по краплині додають до розчину 1,12мл оксаліл хлориду в 50мл ефіру. Суміш нагрівають зі зворотним холодильником протягом 2 годин і розчинник потім випарюють. 30мл DMF потім додають до осаду, після цього додають 1,93г (13,9 ммоль) карбонату калію та суспензію охолоджують до 0°C; далі по краплині додають розчин 1,57г (10,7 ммоль) аміно-компонента в 10мл DMF. Реакційну суміш залишають при перемішуванні на всю ніч при кімнатній температурі. Наприкінці її перемішують у крижаній воді та отриманий осад фільтрують через скляний фільтр. Отриманий неочищений продукт хроматографують на 100г силікагелю, використовуючи систему нгептан/етилацетат = 4:1. Вихід: 3,23г (68,0%) Точка плавлення: 250°C 1 Н-ЯМР (DMSO-D6) d = 11,56 (s, 1H), 9,53 (d, 1H), 9,12 (s, 1H), 9,09 (d, 1H), 9,04 (s, 1H), 8,32 (d, 1H), 7,6 (d, 1H), 7,40 (d, 2H), 7,35 (m, 3H), 7,32 (т, 2Н), 5,64 (s, 2H) ррm Приклад 3 (Реакція за Схемою 1, 3-я стадія): 86021 14 N-{2-[1-(4-хлорбензил)-1 Н-індол-3-іл]-2оксоацетил}-N-хінолін-6-ілацетамід (2) 0,833г (6,82 ммоль) DMAP, 1,38г (13,6 ммоль) триетиламіну та 13,9г (136 ммоль) оцтового ангідриду додають в атмосфері азоту до розчину, що перемішують, 6,0г (13,6 ммоль) 2-[1-(4хлорбензил)-1Н-індол-3-іл]-2-оксо-N-хінолін-6ілацетаміду у 60мл DMF. Реакційну суміш перемішують при кімнатній температурі протягом 10 хвилин і після цього виливають в 200мл етилацетату. Потім додають 300мл води, суміш струшують у ділильній лійці, після чого дві фази розділяють. Преципітація починається через 20 хвилин. Блідожовті кристали відфільтровують і висушують у вакуумі при 60°C. Вихід: 4,04г (61,5%) Точка плавлення: 122,9°C 1 Н-ЯМР (600МГц, DMSO-d6) d = 9,02 (d, 1H), 8,54 (s, 1H), 8,44 (d, 1H), 8,21 (d, 1H), 8,17 (d, 1H), 8,10 (m, 1H), 7,88 (m, 1H), 7,65 (m, 1H), 7,58 (m, 1H), 7,44 (d, 2H), 7,33 (d, 2H), 7,28 (m, 2H), 5,60 (s, 2H), 2,15 (s, 3H). MS(ESI) m/z 482,1 (MH+), (теор. 481, 94) Приклад 4 (Реакція за Схемою 1. 3-я стадія(а)): Метил {2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2оксоацетил} хінолін-6-ілкарбамат (3) 930,2мг (27,3 ммоль) NaH (у вигляді 60% дисперсії в мінеральному маслі) додають в атмосфері азоту до охолодженого розчину, що перемішують, 10,0г (22,7 ммоль) 2-[1-(4-хлорбензил)-1Н-індол-3іл]-2-оксо-N-хінолін-6-ілацетаміду в 500мл сухогоTHF. Розчин перемішують при 0°C поки не виділиться жовтий осад і після цього перемішують ще 15 хвилин. Потім по краплині додають 2,58г (27,3 ммоль) метилхлорформіату при температурі нижче +5°C. Реакцію контролюють за допомогою тонкошарової хроматографії (елюент: нгептан/етилацетат 1/1 RF=0,11). Реакційну суміш виливають у воду та отриману суміш екстрагують етилацетатом; органічну фазу вимивають насиченим розчином хлориду натрію та висушують над збезводненим MgSO4. Випарювання розчинника дає неочищений продукт, що очищають з допомогою колоночної хроматографії (н-гептан/ацетон 2/1) для того, щоб одержати 3. Тонкошарова хроматографія показує, що 3 усе ще містить незначні домішки, які можна видалити перемішуванням неочищеного 3 с ацетоном протягом 1 години. Фільтрація дозволяє одержати 3 у вигляді блідожовтих кристалів. Вихід: 3,0г (26,5%) Точка плавлення: 178,5°С 1 Н-ЯМР (600МГц, DMSOd6) d = 9,02 (d, 1H), 8,58 (s, 1H), 8,47 (d, 1H), 8,17 (m, 3H), 7,84 (m, 1H), 7,63 (m, 2H), 7,44 (d, 2H), 7,34 (m, 4H), 5,60 (s, 2H), 3,65 (s, 3H). MS(ESI) m/z 498,2 (MH+), (теор. 497,94) Приклад 5 (Реакція за Схемою 2, 3-я стадія (b)): Одержання 2-[1-(4-хлорбензил)-1Н-індол-3-іл]N-хінолін-6-іл-2-тіоксоацетаміду (11) 3,68г (9,1 ммоль) 2,4-біс(4-метоксифеніл)-1,3дитіа-2,4-дифосфетан-2,4-дисульфіду додають в атмосфері азоту до суспензії 4,00г (9,1 ммоль) 2 15 [1-(4-хлорбензил)-1H-індол-3-іл]-2-оксо-N-хінолін6-ілацетаміду в 200мл толуолу, після чого суміш нагрівають при 75°C впродовж 3 годин. Осад, що утворився, відфільтровують гарячим з реакційного розчину та потім промивають 100мл метиленхлориду. Фільтрат концентрують у вакуумі та осад хроматографують на флеш силікагелі (елюент: метилен хлорид/метанол 99:1). Фракції продукту були відфільтровані на флеш силікагелі (елюент: н-гептан/етилацетат 1/1) після того, як розчинник був видалений знову. Вихід: 0,46г (11% від теоретичного) ESI-MS: m/е = 456,1 (MH+), (теор. 455,97) 1 H-ЯMP(DMSO-D6) d = 10,89 (s, 1H), 8,8 (s, 1H), 8,75 (s, 1H), 8,55 (s, 1H), 8,12 (d, 1H), 8,35 (d, 1H), 8,0 (d, 1H), 7,93 (d, 1H), 7,63 (d, 1H), 7,50 (m, 1H), 7,4 (m, 3H), 7,3 (m, 3H), 5,6 (s, 2H) ppm. Наступні сполуки з формулою І були спрощені за аналогією зі шляхом синтезу на Схемі 1 і відповідно до Прикладів 2 та 3. Приклад 6: 2-[1-(4-хлорбензил)-1H-індол-3-іл]-N-(1Ніндазол-5-іл)-2-оксоацетамід (4) Точка плавлення: 203°C 1 Н-ЯМР (DMSO-D6) d = 13,02 (s, 1H), 10,7 (s, 1H), 9,04 (s, 1H), 8,48 (s, 1H), 8,42 (d, 1H), 8,06 (s, 1H), 7,73 (d, 1H), 7,6 (d, 1H), 7,55 (d, 1H), 7,40 (d, 2H), 7,28-7,35 (m, 4H), 5,63 (s, 2H) ррm. Приклад 7: Етил {2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2оксоацетил}хінолін-6-ілкарбамат(5) Точка плавлення: 199°С 1 Н-ЯМР (600МГц, DMSO-d6) d = 9,02 (m, 1H), 8,60 (s, 1H), 8,48 (d, 1H), 8,15 (m, 3H), 7,83 (m, 1H), 7,63 (m, 2H), 7,43 (d, 2H), 7,32 (m, 4H), 5,60 (s, 2H), 4,15 (q, 2H), 0,95 (t, 3H). MS(ESI) m/z 514,2, 512,1 (MH+), (теор. 511,97). Приклад 8: Пропіл {2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2оксоацетил}хінолін-6-ілкарбамат(6) Точка плавлення: 164°С 1 Н-ЯМР (600МГц, DMSO-d6) d = 9,02 (m, 1H), 8,60 (s, 1H), 8,48 (d, 1H), 8,17 (m, 3H), 7,84 (m, 1H), 7,63 (m, 2H), 7,43 (d, 2H), 7,33 (m, 4H), 5,61 (s, 2H), 4,03 (t, 2H), 1,32 (m, 2Н), 0,56 (t, 3H). Приклад 9: N-{2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2оксоацетил}-N-хінолін-6-ілпропіонамід (7) 1 Н-ЯМР (600МГц, DMSO-d6) d = 9,03 (m, 1H), 8,52 (s, 1H), 8,45 (d, 1H), 8,23 (d, 2H), 8,18 (d, 1H), 8,13 (m, 1H), 7,88 (m, 1H), 7,65 (m, 1H), 7,58 (m, 1H), 7,45 (d, 2H), 7,30 (m, 4H), 5,59 (s, 2H), 2,61 (q, 3H), 0,88 (t, 3H). Приклад 10: Етил {2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2оксоацетил}піридин-4-ілкарбамат (8) Точка плавлення: 62°С 86021 16 1 Н-ЯМР (600МГц, DMSO-d6) d =8,74 (m, 2H), 8,52 (s, 1H), 8,12 (m, 1H), 7,60 (m, 1H), 7,55 (m, 2H), 7,40 (m, 2H), 7,30 (m, 4H), 5,57 (s, 2H), 4,10 (q, 2H), 0,95 (t, 3H). Приклад 11 (Речовина порівняння): Одержання 2-[1-(4-хлорбензил)-1Н-індол-3-іл]N-(2-метилхінолін-6-іл)-2-оксоацетаміду (9) Вихід: 14,8г (77,3% від теоретичного) Точка плавлення: 182-185°C 1 H-ЯMP(CDCl3) d = 9,58 (s, 1H), 9,12 (s, 1H), 8,5 (s, 1H), 8,41 (s, 1H), 8,05 (t, 2H), 7,78 (d, 1H), 7,4 (dd, 1H), 7,32 (m, 4H), 7,26 (s, 1H), 7,15 (d, 1H), 5,38 (s, 2H), 2,73 (s, 3H) ррm. Приклад 12 (Речовина порівняння): 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксо-Nхінолін-6-ілацетамід (10) Точка плавлення: 200°C 1 Н-ЯМР (DMSO-D6) d = 11,5 (s, 1H), 9,05 (s, 1H), 8,85 (s, 1H), 8,66 (s, 1H), 8,32 (d, 2Н), 8,12 (d, 1H), 8,03 (d, 1H), 7,63 (d, 1H), 7,53 (dd, 1H), 7,42 (d, 2H), 7,3-7,38 (m, 4H), 5,63 (s, 2Н) ррm. Приклад 13 (Речовина порівняння): 2-[1-(4-хлорбензил)-1H-індол-3-іл]-2-оксо-Nхінолін-8-ілацетамід (12) Точка плавлення: 178°С Приклад 14 (Речовина порівняння): 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-N-ізохінолін5-іл-2-оксоацетамід (13) Точка плавлення: 239-241°C Приклад 15 (Речовина порівняння): 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-2-оксо-Nпіридин-4-ілацетамід (14) Точка плавлення: 264°С Приклад 16 (Речовина порівняння): 2-[1-(4-хлорбензил)-1Н-індол-3-іл]-N-(2метилхінолін-8-іл)-2-оксоацетамід (15) Точка плавлення: 200-202°C Біологічні ефекти сполук згідно даного винаходу Проведення in vitro та in vivo тестів на відібраних пухлинних моделях показало наявність наступних фармакологічних активностей. Приклад 17: Антипроліферативний ефект на різних лініях ракових клітин Досліджували антипроліферативну активність речовин 1, 2, 4, 9, 11, 12, 13 та 15 у тесті на проліферацію на лініях стійких ракових клітин [D.A.Scuderio та інші. Cancer Res. 1988, 48, 48274833]. Використовуваний тест характеризує активність клітинної дегідрогенази та дозволяє визначити життєздатність клітин, а також побічно визначити число клітин. Використовувалися наступні клітинні лінії: лінія клітин цервікальної карциноми KB/HeLa (ATCC CCL17), клітинна лінія аденокарциноми яєчників SKOV-3 (ATCC HTB77), клітинна лінія гліобластоми людини SF-268 (NCI 503138) і клітинна лінія карциноми легенів NCI-H460 (NCI 503473). 17 86021 18 Таблиця 1 Здатність сполук винаходу інгібувати проліферацію в XTT цитотоксичному тесті, проведеному на клітинних лініях раку людини Приклад 1 2 4 11 9(C) 12(C) 13(C) 15(C) KB/HeLa 0,045 0,202 0,335 0,036 0,183 >3,16 >3,16 >3,16 Аналіз ХТТ-проліферації, EC 50 в мкг/мл SKOV-3 SF-268 0,029 0,042 0,123 0,166 0,144 >3,16 0,029 0,036 0,174 0,261 >3,16 >3,16 >3,16 >3,16 н. в. >3,16 NCI-H460 >3.16 >3.16 н. в. C = Речовина порівняння; н.в.: не визначено Результати показують, що приклади здійснення 1, 2, 4 та 11 є дуже сильними інгібіторами проліферації вибраних ліній пухлинних клітин. Приклад 18: Антипроліферативний ефект на лініях ракових клітин MDR З метою подальшої характеристики речовини 1, 2, 4 та 11 вивчали відносно їх впливу на множинну лікарську резистентність клітинних ліній у порівнянні з нерезистентними лініями клітин дикого типу. Були вивчені наступні клітинні лінії: мишачі клітини лінії L1210, лінія клітин гострого мієлоїдного лейкозу LT12 та резистентні лінії L1210/mdr та LT12/mdr. Мишачі клітини лінії Р388 (метилхолантрен-індукована лімфоїдна неоплазма) та доксорубіцин-резистентна лінія Р388 також були включені як тест-системи. Результати зведені в Таблиці 2 нижче. Таблиця 2 Інгібіторний ефект речовин лінії клітин раку людини в тесті на XTT-проліферацію. Аналіз ХТТ-проліферації, EC 50 у мкг/мл Приклад 1 2 4 11 Паклітаксел (С) Вінкристин (С) Доксорубіцин (С) Мітоксантрон (С) Етопозид (С) LT12 0,015 0,225 0,084 0,023 0,005 0,002 0,029 0,006 0,094 LT12/mdr 0,017 0,272 0,093 0,054 0,34 0,134 >3,6 3,1 >3,6 L1210 0,018 0,206 0,246 0,052 0,048 0,015 0,269 0,09 0,269 L1210VCR 0,021 0,558 0,241 0,067 >3,16 >3,16 >3,16 2,1 >3,16 Р388 0,012 0,224 0,175 0,018 0,035 0,004 0,204 0,053 0,202 P388ADR 0,019 0,215 0,231 0,051 >3,16 0,93 >3,16 0,608 >3,16 С = Приклад для порівняння Речовини 1, 2, 4 та 11 демонструють дуже високий інгібіторний ефект на всі протестовані лінії клітин, у той час як класичні речовини такі, які роблять тубулін-інгібуючу дію, наприклад, паклітаксел або вінкристин, і інгібітори топоізомерази II (доксорубіцин, мітоксантрон та етопозид), як можна помітити, роблять на MDR1-резистентні клітинні лінії ефект, що принаймні значно менше. Приклад 19: Інгібування полімеризації тубуліну Речовини 1, 4, 9, 11, 12, 13 та 15 були вивчені відносно їх здатності інгібувати полімеризацію би чачого тубуліну в тесті in vitro [D.M.Bollag та інші. Cancer Res. 1955, 55, 2325-2333]. Цей тест проводять із використанням тубуліну, що був очищений у процесі полімеризації - деполімеризації, і який полімеризується при додаванні ГТФ і нагріванні. Таблиця 3 дає значення ЕС50, при яких відбувається інгібування полімеризації тубуліну, що містить 30% зв'язаних білків (максимально допустима кількість). 19 86021 20 Таблиця 3 Інгібування полімеризації тубуліну. Середні значення двох незалежних експериментів Приклад 1 4 11 9 (C) 12 (C) 13 (C) 15 (C) Вінкристин Інгібування полімеризації тубуліну, ЕС50 у мкг/мл 0,71 1,26 0,97 1,16 >10мкМ >10мкМ >10мкМ 0,35 C - приклад для порівняння Результати показують, що речовини 1, 4, 9 та 11 роблять дуже сильний інгібіторний ефект на полімеризацію тубуліну в той час, як сполуки 12, 13 та 15 не дають ніякого ефекту. Приклад 20: Інгібування топоізомерази II Здатність речовини інгібувати топоізомеразу II вивчали у двох тестах in vitro. - Аналіз кДНК для визначення активності топоізомерази II У цьому кількісному аналізі, що був описаний P.Arimondo [Anti-Cancer Drag Design 2000, 15(6), 413-421], кДНК обробляють ДНК-топоізомеразой II людини за відсутності та у присутності складених компонентів аналізу. У даній системі сполуку 1 даного винаходу було піддано тестуванню при трьох різних концентраціях (100, 31,6 та 10мкм). Для порівняння використали позитивний контроль і стандартні сполуки м-амсакрин (m-amsa), паклітаксел (Тахоl) та вінкристин, у кожному випадку концентрація була 100мкм. Проведення аналізу: 2мкл 10x стандартного буфера для аналізу, 1мкл кДНК (200нг), 0,5мкл топоізомерази II людини (1 одиниця) та 15,5мкл Н2О додають піпеткою до 1мкл попередньо введеної речовини, що аналізують, (сконцентрованої в 20 разів в 100% DMSO) і змішують реагенти. Проби з реакційною сумішшю поміщають у термостат, що попередньо нагрівають до 37°С і інкубують при 37°С впродовж 10 хвилин. Інкубацію зупиняють після додавання 4мкл 5х стоп-буферу та речовину далі екстрагують CIA. Після цього 20мкл супернатанта наносять на 1% агарозний гель, що містить 0,25мкг етидіумброміду в 1мл, і піддають розділенню при 100V протягом 1 години. Наприкінці гель фотографують в УФ-світлі (див. Фіг.1). Інгібування декатенації (розплітання) кДНК оцінюють кількісно, використовуючи Програмне Забезпечення Аналізатора GelPRO® (див. Фіг.2). - Аналіз вивільнення pRYG для визначення активності топоізомерази II Ця аналітична система використовувалася для подальшого виявлення інгібітор них властивостей сполук даного винаходу у відношенні топоізомерази II. У даній системі сполуку 1 даного винаходу було піддано тестуванню при трьох різних концентраціях (100, 31,6 та 10мкм). Для порівнян ня використовували стандартні сполуки мамсакрин (m-amsa), паклітаксел (Тахоl) і вінкристин у концентраціях 316 та 100мкм. Аналіз проводили в такий спосіб: 2мкл 10x стандартного буферу для аналізу, 0,5мкл pRYG кДНК (125нг), 0,5мкл топоізомерази II людини (1 одиниця) та 16мкл Н2О додають піпеткою до 1мкл попередньо введеної речовини, що аналізують, (сконцентрованої в 20 разів в 100% DMSO) і змішують реагенти. Проби з реакційною сумішшю поміщають у термостат, що попередньо нагрівають до 37°С і інкубують при 37°C впродовж 30 хвилин. Інкубацію зупиняють після додавання 4мкл 5х стоп-буферу. Після цього 10мкл зразка наносять на 1,2% агарозний гель, що містить 0,25мкг етидіум-броміду в 1мл, і піддають розділенню при 100V протягом 2,5 годин. Наприкінці гель фотографують в УФ-світлі (див. Фіг.3). Інгібування вивільнення pRYG оцінюють кількісно, використовуючи Програмне Забезпечення Аналізатора GelPRO® (див. Фіг.2). Приймаючи до уваги всі факти, можна зробити висновок, що було показано, що сполука 1 даного винаходу в значній мірі інгібує топоізомеразу II в обох аналітичних системах. Результати, одержані із сполукою 1 порівнянні зі значеннями інгібування, отриманими з інгібітором топоізомерази II мамсакрином. Як очікували, ні паклітаксел, ні вінкристин не продемонстрували інгібіторного ефекту у двох проведених визначеннях. Приклад 21: Аналіз клітинного циклу Клітинний цикл включає в себе розвиток клітини від однієї клітинної генерації до іншої. Під час фази спокою (G0) і фази предсинтезу (G1) клітина має диплоїдний набір хромосом (2с). У фазі синтезу (S) кількість ДНК збільшується шляхом реплікації. Фаза закінчується, коли наступає премітотична фаза (G2M), у якій клітина має подвоєний набір хромосом (4с) і подвоєний вміст ДНК. У наступній фазі мітозу (M), що є короткою по тривалості, редупліковані хромосоми однаковим чином розподіляються між двома дочірніми клітинами, кожна з яких знову має диплоїдний вміст ДНК і перебуває у фазі G01, що означає, що клітинний цикл може початися знову. Для аналізу клітинного циклу клітини KB/HeLa обробляли досліджуваними речовинами в різних 21 86021 концентраціях (0,1-1000нМ) при 37°C впродовж 24 годин. Процентний вміст клітин, зупинених у фазі G2/M клітинного циклу, після того, як вони були оброблені стандартними речовинами або обраними речовинами, що тестують, показано в наведеній нижче Таблиці 4. Результати аналізували, використовуючи спеціальне програмне забезпечення (ModFit™). Таблиця 4 Концентрація, необхідна для інгібування 50% клітин у фазі G2/M Приклад 1 2 4 11 14(C) Паклітаксел Мітоксантрон ЕС50 у нМ (50% клітин в G2/M) 25,2 125,3 252 41,8 >1000 26,9 25,3 Речовини 1, 2, 4 та 11 даного винаходу демонструють активності, які порівнянні з активностями стандартних сполук паклітаксела та мітоксантрона. Приклад 22: Демонстрація апоптозу CDDplus-нуклеосомний тест ELISA Дроблення ядер є пізнім наслідком процесів апоптозу. Зміни, які можна спостерігати в цьому зв'язку можуть бути характерною ознакою того, що тяжи ДНК розщеплюються ендонуклеазами та у результаті відбувається дроблення на нуклеосомні частинки. CDDplus-нуклеосомний тест ELISA, описаний Roche Molecular Biochemicals, був використаний для демонстрації нуклеосомних часток. 22 Для цього були вивчені ефекти сполук 1 та 2 на клітинну лінію U-937 при різних концентраціях (1нм-10мкм; 24 години обробки). (Див. Фіг.5 та 6). У цьому тесті було можливо спостерігати залежне від концентрації збільшення вмісту нуклеосом у клітинних лізатах для сполук 1 та 2. Було неможливо продемонструвати скільки-небудь значне збільшення в супернатанті клітинної культури, що є фактом на користь загибелі апоптозних клітин, що відбувалася після впливу сполук 1 та 2. Приклад 23: Демонстрація розчинності у воді сполук винаходу в умовах насичення Визначали розчинність речовин 1, 2, 10 та 14 у воді в умовах насичення, як описано нижче. Додавали максимум 1% DMSO з метою розчинення речовин, а також для того, щоб домогтися змочування зразків. Використали метод HPLC-UV для перевірки вмісту. Результати зведені в Таблицю 5, представлену нижче. Таблиця 5 Значення розчинності при насиченні речовин 1, 2, 10 та 14 Назва сполуки 1 2 10 (C) 14 (C) Розчинність у воді при насиченні [мкг/мл] 25,0 28,5 0,038 0,35 1) Число мертвих тварин у порівнянні із загальним числом Приклад 24: Активність in vivo У моделі ксенотрансплантанту людини (меланома, MEXF-462) вивчали активність і переносимість in vivo сполуки 2 винаходу в порівнянні з тими ж показниками в речовин 10 та 14. Результати зібрані в Таблиці 6, представленій нижче: Активність сполук 2,10 та 14 in vivo (меланома, MEXF-462). Таблиця 6 Активність сполук 2, 10 та 14 in vivo (меланома, MEXF-462) Речовина Доза, мкг/кг Застосування Загибель, n1 2 80 усередину 0/6 мишей 10 (C) 10 (C) 14(C) 14(C) 70 55 32 16 усередину усередину усередину усередину 5/6 мишей мертві 2/6 мишей мертві 3/5 мишей мертві 3/5 мишей мертві Оптимум Т/С% (день) 0,0% (18), повна ремісія у всіх 6 тварин 2,3% (7) 0,8% (14) 14,6% (7) 0,7% (18) 1) Число мертвих тварин у порівнянні із загальним числом У цій моделі ксенотрансплантанту спостерігали, що сполуки 2 викликає повну ремісію пухлинних захворювань у тварин, підданих лікуванню, у той же час воно добре переноситься. Порівнянний антинеопластичний ефект спостерігали також у випадку сполук 10 та 14, але ці речовини гірше переносилися. Приклад 25: Активність in vivo В іншій моделі ксенотрансплантанту людини (молочна залоза, MAXF857) вивчали активність і переносимість in vivo сполуки 2 винаходу в порів 23 86021 нянні з тими ж показниками для речовини 10. Результати показані в таблиці, наведеній нижче: 24 Ефект сполук 2 та 10 на рак молочної залози MAXF857. Таблиця 7 Активність in vivo сполук 2 та 10 (молочна залоза, MAXF857) Речовина 2 10 (C) Доза, [мкг/кг] 80 40 Застосування усередину усередину Загибель, n1 0/6 мишей 2/6 мишей мертві Оптимум Т/С% (день) 9,6 % (10) 6,5 % (10) 1) Число мертвих тварин у порівнянні із загальним числом У той час, як було виявлено, що сполуки 2 та 10 мають порівнянний антинеопластичний ефект, речовина 10 значно гірше переносилася (2,6 мишей мертві), ніж речовина 2. 25 Комп’ютерна верстка М. Ломалова 86021 Підписне 26 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюIndole derivatives with apoptosis-inducing effect
Автори англійськоюGerlach Matthias, Schuster Tilmann, Emig Peter, Schmidt Peter, Bassner Silke, Guenther Eckhard
Назва патенту російськоюПроизводные индола с эффектом, который индуцирует апоптоз
Автори російськоюГерлах Маттиас, Шустер Тильманн, Эмиг Петер, Шмидт Петер, Басснер Сильке, Гюнтер Экхард
МПК / Мітки
МПК: C07D 401/12, A61P 35/00, C07D 471/04, C07D 403/12
Мітки: індукує, ефектом, апоптоз, індолу, похідні
Код посилання
<a href="https://ua.patents.su/13-86021-pokhidni-indolu-z-efektom-shho-indukueh-apoptoz.html" target="_blank" rel="follow" title="База патентів України">Похідні індолу з ефектом, що індукує апоптоз</a>
Попередній патент: Спосіб графітації електродних заготовок
Наступний патент: Спосіб виготовлення багатошарової плити з перегородками
Випадковий патент: Спосіб лікування наркоманій












