Фармацевтичні сполуки
Номер патенту: 95799
Опубліковано: 12.09.2011
Автори: Шуттлеуорт Стівен, Ханкокс Тім, Чуковрі Ірина, Фолкс Адріан
Формула / Реферат
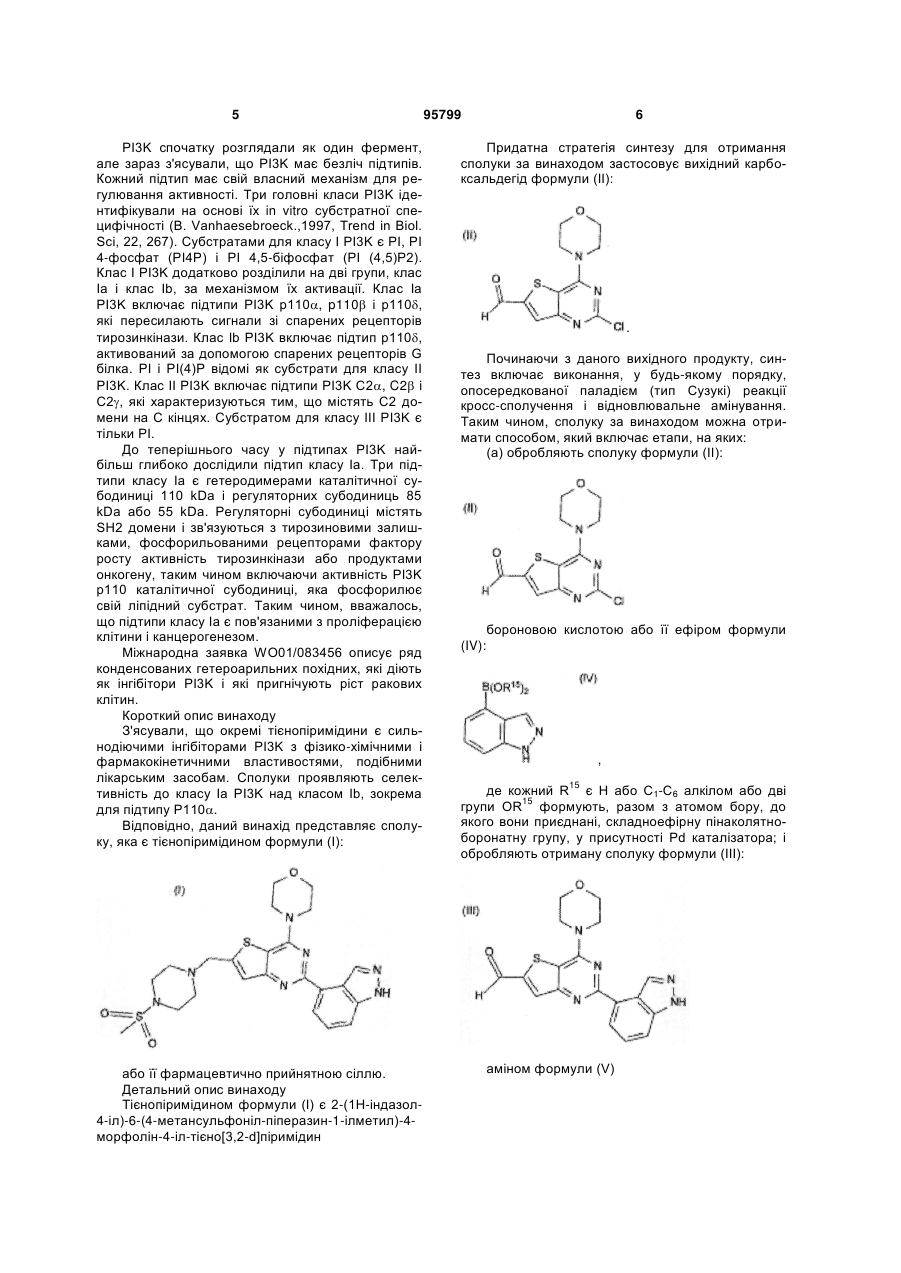
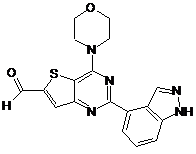
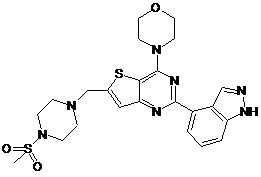
1. Сполука, яка являє собою тієнопіримідин формули (І):
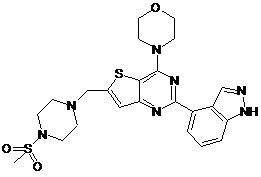 , (I)
, (I)
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, де фармацевтично прийнятна сіль вибрана з солей з соляною кислотою, бромистоводневою кислотою, йодистоводневою кислотою, сірчаною кислотою, азотною кислотою, фосфорною кислотою, метансульфоновою кислотою, бензолсульфоновою кислотою, мурашиною кислотою, оцтовою кислотою, трифтороцтовою кислотою, пропіоновою кислотою, щавлевою кислотою, малоновою кислотою, сукциновою кислотою, фумаровою кислотою, малеїновою кислотою, молочною кислотою, яблучною кислотою, винною кислотою, лимонною кислотою, етансульфоновою кислотою, аспарагіновою кислотою і глутаміновою кислотою.
3. Сполука за п. 1 або 2, де фармацевтично прийнятна сіль являє собою моносіль або біссіль.
4. Сполука за будь-яким з пп. 1-3, яка є моносіллю або біссіллю з метансульфоновою кислотою, бензолсульфоновою кислотою, соляною кислотою, фосфорною кислотою або сірчаною кислотою.
5. Сполука за п. 1, яка являє собою 2-(1Н-індазол-4-іл)-6-(4-метансульфонілпіперазин-1-ілметил)-4-морфолін-4-ілтієно[3,2-d]піримідинбісмезилат.
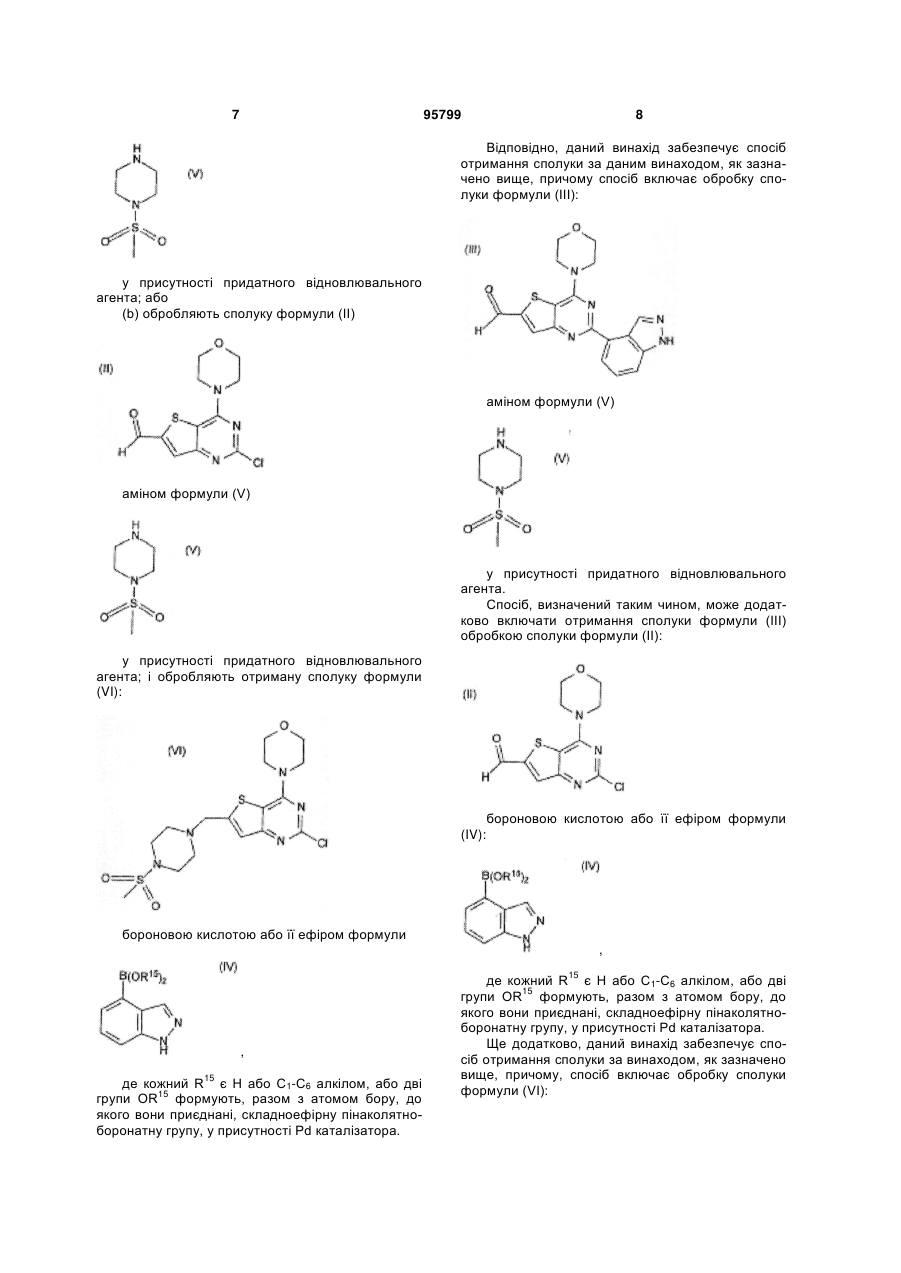
6. Спосіб отримання сполуки за п. 1, в якому обробляють сполуку формули (III):
 (III)
(III)
аміном формули (V)
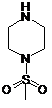 (V)
(V)
у присутності придатного відновлювального агента.
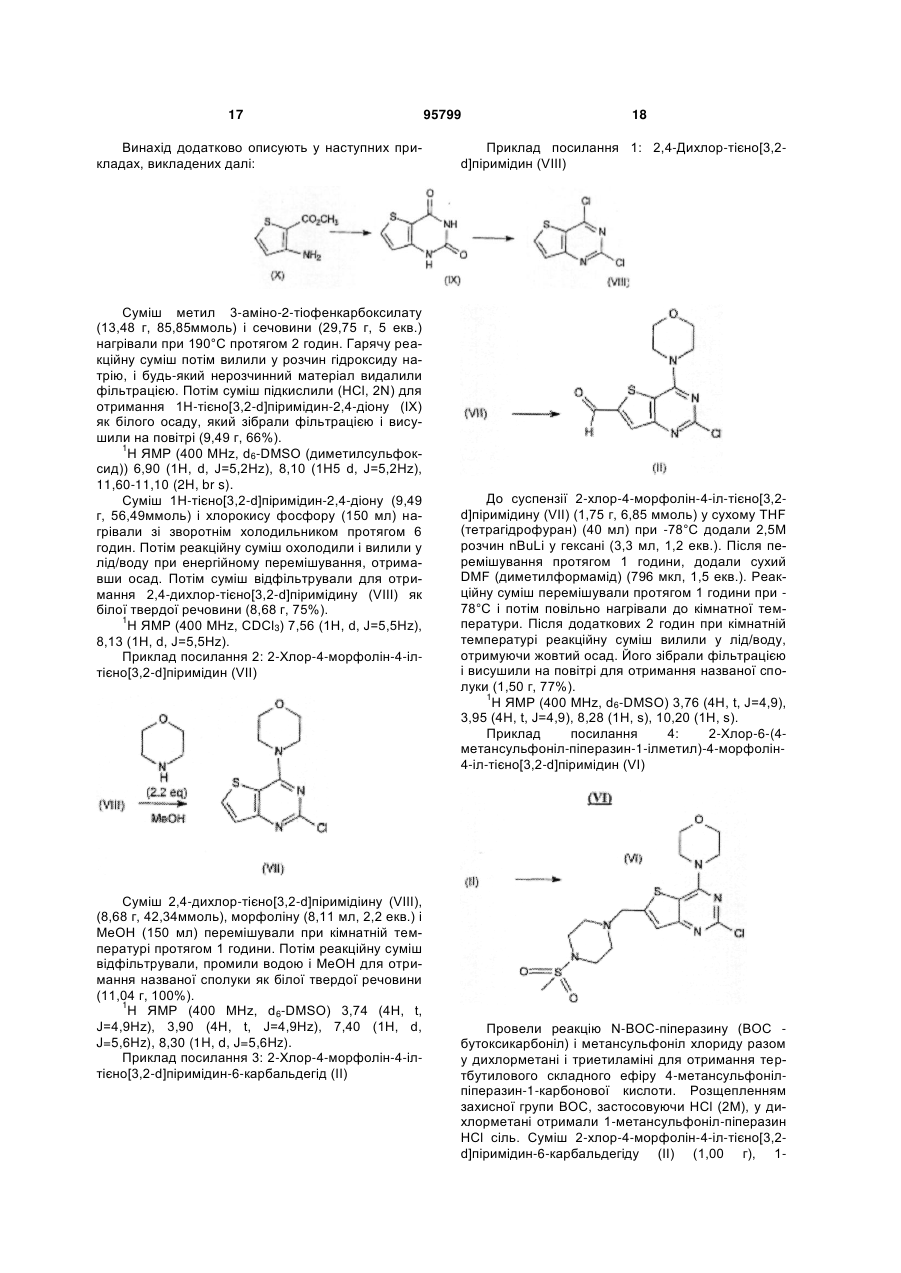
7. Спосіб отримання сполуки за п. 1, в якому обробляють сполуку формули (VI)
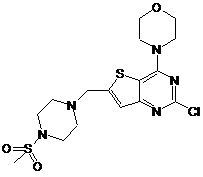 (VI)
(VI)
бороновою кислотою або її естером формули (IV):
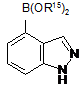 , (IV)
, (IV)
де кожний R15 є Н або С1-С6алкілом, або дві групи OR15 формують, разом з атомом бору, до якого вони приєднані, складноефірну пінаколятборонатну групу, у присутності Pd-каталізатора.
8. Спосіб отримання фармацевтично прийнятної солі за п. 1, в якому обробляють тієнопіримідин формули (І):
 (I)
(I)
придатною кислотою у придатному розчиннику.
9. Фармацевтична композиція, яка містить фармацевтично прийнятний носій або розріджувач і, як активний інгредієнт, сполуку за будь-яким з пп. 1-5.
10. Композиція за п. 9, яка сформована для перорального введення.
11. Сполука за п. 1 для застосування у терапевтичному лікуванні організму тварини або людини.
12. Сполука за п. 1 для застосування для лікування захворювання або порушення, що виникає з анормального росту клітин, функції або поведінки, пов'язаних з РІ3-кіназою.
13. Сполука за п. 12, де захворювання або порушення вибрано з раку, імунних порушень, серцево-судинного захворювання, вірусної інфекції, запалення, метаболічних/ендокринних порушень і неврологічних порушень.
14. Сполука за п. 13, де рак вибрано з солідних пухлин товстої кишки, молочної залози, мозку, печінки, яєчників, легенів, голови і шиї; шлункових пухлин; гліобластоми; меланоми; нейробластоми; простати, ендометріального, гепатоцелюлярного раку і раку щитовидної залози, і раку матки, простати, сім'яника, сечостатевого тракту, стравоходу, гортані, гліобластоми, нейробластоми, раку шлунка або шкіри, кератоакантоми, легенів, епідермоїдної карциноми, великоклітинної карциноми, недрібноклітинної карциноми легенів (NSCLC), дрібноклітинної карциноми, аденокарциноми легенів, кістки, товстої кишки, аденоми, підшлункової залози, аденокарциноми, раку щитовидної залози, фолікулярної карциноми, недиференційованої карциноми, папілярної карциноми, семіноми, меланоми, саркоми, карциноми сечового міхура, карциноми печінки і жовчних проток, карциноми нирок, мієлоїдних порушень, лімфоїдних порушень, ворсинчастих клітин, раку ротової порожнини і глотки (оральний), губи, язика, рота, глотки, тонкого кишечнику, ободової і прямої кишки, товстої кишки, прямої кишки, мозку і центральної нервової системи, раку Ходжкіна і лейкемії.
15. Набір для лікування РІ3К-опосередкованого стану, що включає:
(a) першу фармацевтичну композицію, яка містить сполуку за п. 1;
(b) інструкції застосування; і
(c) другу фармацевтичну композицію, де друга фармацевтична композиція містить другу сполуку, що має антигіперпроліферативну активність, і інструкції, представлені для сумісного, послідовного або окремого введення зазначеної першої і другої фармацевтичних композицій пацієнту у разі потреби.
16. Продукт, що містить
(a) сполуку за п. 1; і
(b) сполуку, що має антигіперпроліферативну активність;
для окремого, сумісного або послідовного введення для профілактики або терапевтичного лікування раку.
Текст
1. Сполука, яка являє собою тієнопіримідин формули (І): O 3 95799 O N S N N N Cl N O S O (VI) бороновою кислотою або її естером формули (IV): B(OR15)2 N N H , (IV) 15 де кожний R є Н або С1-С6алкілом, або дві групи 15 OR формують, разом з атомом бору, до якого вони приєднані, складноефірну пінаколятборонатну групу, у присутності Pd-каталізатора. 8. Спосіб отримання фармацевтично прийнятної солі за п. 1, в якому обробляють тієнопіримідин формули (І): O N S N N N N NH N O S O (I) придатною кислотою у придатному розчиннику. 9. Фармацевтична композиція, яка містить фармацевтично прийнятний носій або розріджувач і, як активний інгредієнт, сполуку за будь-яким з пп. 1-5. 10. Композиція за п. 9, яка сформована для перорального введення. 11. Сполука за п. 1 для застосування у терапевтичному лікуванні організму тварини або людини. 12. Сполука за п. 1 для застосування для лікування захворювання або порушення, що виникає з Пріоритет винаходу Дана заявка заявляє пріоритет за попередньою заявкою на патент США № 60/794,966, що була подана 26 квітня 2006. Повний зміст даної попередньої заявки включений у даному описі посиланням. Область винаходу Даний винахід відноситься до похідних піримідину і їх застосування як інгібіторів фосфатидилінозитол 3-кінази (PI3K). 4 анормального росту клітин, функції або поведінки, пов'язаних з РІ3-кіназою. 13. Сполука за п. 12, де захворювання або порушення вибрано з раку, імунних порушень, серцево-судинного захворювання, вірусної інфекції, запалення, метаболічних/ендокринних порушень і неврологічних порушень. 14. Сполука за п. 13, де рак вибрано з солідних пухлин товстої кишки, молочної залози, мозку, печінки, яєчників, легенів, голови і шиї; шлункових пухлин; гліобластоми; меланоми; нейробластоми; простати, ендометріального, гепатоцелюлярного раку і раку щитовидної залози, і раку матки, простати, сім'яника, сечостатевого тракту, стравоходу, гортані, гліобластоми, нейробластоми, раку шлунка або шкіри, кератоакантоми, легенів, епідермоїдної карциноми, великоклітинної карциноми, недрібноклітинної карциноми легенів (NSCLC), дрібноклітинної карциноми, аденокарциноми легенів, кістки, товстої кишки, аденоми, підшлункової залози, аденокарциноми, раку щитовидної залози, фолікулярної карциноми, недиференційованої карциноми, папілярної карциноми, семіноми, меланоми, саркоми, карциноми сечового міхура, карциноми печінки і жовчних проток, карциноми нирок, мієлоїдних порушень, лімфоїдних порушень, ворсинчастих клітин, раку ротової порожнини і глотки (оральний), губи, язика, рота, глотки, тонкого кишечнику, ободової і прямої кишки, товстої кишки, прямої кишки, мозку і центральної нервової системи, раку Ходжкіна і лейкемії. 15. Набір для лікування РІ3К-опосередкованого стану, що включає: (a) першу фармацевтичну композицію, яка містить сполуку за п. 1; (b) інструкції застосування; і (c) другу фармацевтичну композицію, де друга фармацевтична композиція містить другу сполуку, що має антигіперпроліферативну активність, і інструкції, представлені для сумісного, послідовного або окремого введення зазначеної першої і другої фармацевтичних композицій пацієнту у разі потреби. 16. Продукт, що містить (a) сполуку за п. 1; і (b) сполуку, що має антигіперпроліферативну активність; для окремого, сумісного або послідовного введення для профілактики або терапевтичного лікування раку. Передумови винаходу Фосфатидилінозит (далі абревіатура "РІ") є одним з чисельних фосфоліпідів, що виявлені у клітинних мембранах. Останні роки стає зрозумілим, що РІ грає важливу роль у внутрішньоклітинному перетворенні сигналів. Наприкінці 1980-тих з'ясували, що РІ3 кіназа (PI3K) є ферментом, який фосфорилює 3-положення кільця інозитолу фосфатидилінозиту (D. Whitman et al, 1988, Nature, 332, 664). 5 PI3K спочатку розглядали як один фермент, але зараз з'ясували, що PI3K має безліч підтипів. Кожний підтип має свій власний механізм для регулювання активності. Три головні класи PI3K ідентифікували на основі їх in vitro субстратної специфічності (В. Vanhaesebroeck.,1997, Trend in Biol. Sci, 22, 267). Субстратами для класу І PI3K є РІ, РІ 4-фосфат (РІ4Р) і РІ 4,5-біфосфат (РІ (4,5)Р2). Клас І PI3K додатково розділили на дві групи, клас Іа і клас Іb, за механізмом їх активації. Клас Іа PI3K включає підтипи PI3K p110, p110 і p110, які пересилають сигнали зі спарених рецепторів тирозинкінази. Клас Іb PI3K включає підтип p110, активований за допомогою спарених рецепторів G білка. РІ і РІ(4)Р відомі як субстрати для класу II PI3K. Клас II PI3K включає підтипи PI3K С2, C2 і С2, які характеризуються тим, що містять С2 домени на С кінцях. Субстратом для класу III PI3K є тільки РІ. До теперішнього часу у підтипах PI3K найбільш глибоко дослідили підтип класу Іа. Три підтипи класу Іа є гетеродимерами каталітичної субодиниці 110 kDa і регуляторних субодиниць 85 kDa або 55 kDa. Регуляторні субодиниці містять SH2 домени і зв'язуються з тирозиновими залишками, фосфорильованими рецепторами фактору росту активність тирозинкінази або продуктами онкогену, таким чином включаючи активність PI3K р110 каталітичної субодиниці, яка фосфорилює свій ліпідний субстрат. Таким чином, вважалось, що підтипи класу Іа є пов'язаними з проліферацією клітини і канцерогенезом. Міжнародна заявка WO01/083456 описує ряд конденсованих гетероарильних похідних, які діють як інгібітори PI3K і які пригнічують ріст ракових клітин. Короткий опис винаходу З'ясували, що окремі тієнопіримідини є сильнодіючими інгібіторами PI3K з фізико-хімічними і фармакокінетичними властивостями, подібними лікарським засобам. Сполуки проявляють селективність до класу Іа PI3K над класом Іb, зокрема для підтипу Р110. Відповідно, даний винахід представляє сполуку, яка є тієнопіримідином формули (І): або її фармацевтично прийнятною сіллю. Детальний опис винаходу Тієнопіримідином формули (І) є 2-(1Н-індазол4-іл)-6-(4-метансульфоніл-піперазин-1-ілметил)-4морфолін-4-іл-тієно[3,2-d]піримідин 95799 6 Придатна стратегія синтезу для отримання сполуки за винаходом застосовує вихідний карбоксальдегід формули (II): . Починаючи з даного вихідного продукту, синтез включає виконання, у будь-якому порядку, опосередкованої паладієм (тип Сузукі) реакції кросс-сполучення і відновлювальне амінування. Таким чином, сполуку за винаходом можна отримати способом, який включає етапи, на яких: (а) обробляють сполуку формули (II): бороновою кислотою або її ефіром формули (IV): , 15 де кожний R є Η або С1-С6 алкілом або дві 15 групи OR формують, разом з атомом бору, до якого вони приєднані, складноефірну пінаколятноборонатну групу, у присутності Pd каталізатора; і обробляють отриману сполуку формули (III): аміном формули (V) 7 95799 8 Відповідно, даний винахід забезпечує спосіб отримання сполуки за даним винаходом, як зазначено вище, причому спосіб включає обробку сполуки формули (III): у присутності придатного відновлювального агента; або (b) обробляють сполуку формули (II) аміном формули (V) аміном формули (V) у присутності придатного відновлювального агента. Спосіб, визначений таким чином, може додатково включати отримання сполуки формули (III) обробкою сполуки формули (II): у присутності придатного відновлювального агента; і обробляють отриману сполуку формули (VI): бороновою кислотою або її ефіром формули (IV): бороновою кислотою або її ефіром формули , 15 , 15 де кожний R є Η або С1-С6 алкілом, або дві 15 групи OR формують, разом з атомом бору, до якого вони приєднані, складноефірну пінаколятноборонатну групу, у присутності Pd каталізатора. де кожний R є Η або С1-С6 алкілом, або дві 15 групи OR формують, разом з атомом бору, до якого вони приєднані, складноефірну пінаколятноборонатну групу, у присутності Pd каталізатора. Ще додатково, даний винахід забезпечує спосіб отримання сполуки за винаходом, як зазначено вище, причому, спосіб включає обробку сполуки формули (VI): 9 95799 10 кросс-сполучень типу Сузукі, таким як PdCl2(PPh3)2. Відновлювальним агентом типово є боргідрид, наприклад NaBH(OAc)3, NaBH4 або NaCNBH4, зокрема, NaBH(OAc)3. Складноефірний пінаколятноборонат може бути, наприклад, отриманий способом, що описаний в одному з прикладів посилання 5 і 6, викладених далі. Сполуку формули (II), як визначено вище, можна отримати способом, який включає обробку сполуки формули (VII): бороновою кислотою або її ефіром формули (IV): , 15 де кожний R є Η або С1-С6 алкілом, або дві 15 групи OR формують, разом з атомом бору, до якого вони приєднані, складноефірну пінаколятноборонатну групу, у присутності Pd каталізатора. Спосіб, визначений таким чином, може додатково включати отримання сполуки формули (VI) обробкою сполуки формули (II): агентом літіювання, а потім Ν,Ν'диметилформамідом (DMF). Реакцію, типово, проводять додаванням розчину агенту літіювання у неполярному органічному розчиннику, наприклад, вуглеводневому розчиннику, такому як гексан, до суспензії сполуки формули (IX) у органічному розчиннику, такому як тетрагідрофуран (THF). Якщо застосовують THF, додавання відбувається при низькій температурі, приблизно -78°С. Агентом літіювання типово є алкіллітій, наприклад, nбутиллітій. Сполуку формули (VII), як визначено вище, можна отримати способом, який включає обробку сполуки формули (VIII): аміном формули (V): у присутності придатного відновлювального агента. Фармацевтично прийнятна сіль тієнопіримідину формули (І) може бути отримана при застосуванні звичайних методик. Типово, спосіб включає обробку тієнопіримідину формули (І), як зазначено вище, придатною кислотою у придатному розчиннику. У способі за даним винаходом, як зазначено вище, і етап амінування, і етап Pdопосередкованого кросс-сполучення проходять при звичайних умовах. Паладієвий каталізатор може бути будь-яким, що типово застосовують для морфоліном у органічному розчиннику. Розчинником типово є спирт, такий як метанол. Реакцію в основному проводять при кімнатній температурі. Сполуку формули (VIII) можна отримати способом, описаним у прикладі посилання 1, або аналогічним з такою методикою. Тієнопіримідин формули (І) можна перетворити на фармацевтично прийнятну сіль, і сіль можна перетворити на вільну сполуку звичайними способами. Приклади фармацевтично прийнятних солей включають солі з неорганічними кислотами, такими як соляна кислота, бромістоводнева кислота, йодистноводнева кислота, сірчана кислота, азотна кислота і фосфорна кислота; і органічними кислотами, такими як метансульфонова кислота, бензолсульфонова кислота, мурашина кислота, оцтова кислота, трифтороцтова кислота, пропіонова кислота, щавлева кислота, малонова кислота, сукцинова кислота, фумарова кислота, малеїнова кислота, молочна кислота, яблучна кислота, винна кислота, лимонна кислота, 11 етансульфонова кислота, аспарагінова кислота і глутамінова кислота. Типово, сіллю є мезилат, гідрохлорид, фосфат, бензолсульфонат або сульфат. Найбільш типово сіллю є мезилат або гідрохлорид. Солі, наприклад, солі з будь-якими неорганічними або органічними кислотами, що згадані вище, можуть бути моносолями або бісолями. Таким чином, наприклад, сіль мезилату може бути мономезилатом або бімезилатом. Сполуки формули (І) та їх солі можуть існувати як гідрати або сольвати. Було з'ясовано у біологічних дослідженнях, що сполука за даним винаходом була інгібітором PI3 кінази. Сполука є селективною для класу Іа PI3 кінази над класом Іb і типово проявляє, щонайменше, 20-кратну селективність для класу Іа над класом Іb PI3 кіназ. Зокрема, сполука є селективною для ізоформи р110. Сполука за даним винаходом може, таким чином, застосовуватись як інгібітор PI3 кінази, зокрема класу Іа PI3 кінази. Відповідно, сполука за даним винаходом може застосовуватись для лікування захворювання або порушення, що виникають з анормального росту клітин, функції або поведінки. Такий анормальний ріст клітин, функції або поведінки типово пов'язаний з PI3 кіназою. Приклади таких захворювань і порушень обговорювали Drees et al in Expert Opin. Ther. Patents (2004) 14(5):703-732. Вони включають рак, імунні порушення, серцево-судинні порушення, вірусні інфекції, запалення, метаболічні/ендокринні порушення і неврологічні порушення. Приклади метаболічних/ендокринних порушень включають діабет і ожиріння. Прикладами раку, який можна лікувати, застосовуючи дані сполуки, включають лейкемію, пухлини мозку, рак нирок, рак шлунку і рак шкіри, сечового міхура, молочної залози, матки, легенів, кишечнику, простати, яєчника та підшлункової залози. Пацієнтів людей або тварин, що страждають на імунне порушення, рак, серцево-судинне захворювання, вірусну інфекцію, запалення, порушення метаболізму/ендокринне або неврологічні порушення, таким чином, можна лікувати способом, що включає введення їм сполуки за даним винаходом, як зазначено вище. Стан пацієнта, таким чином, можна покращити або підвищити. Захворювання та стани, що лікують за способами даного винаходу, включають, але не обмежуються, напад, діабет, гепатомегалію, серцевосудинне захворювання, хворобу Альцгеймера, кістозний фіброз, вірусне захворювання, аутоімунне захворювання, атеросклероз, рестеноз, псоріаз, алергічні захворювання, запалення, неврологічні порушення, хворобу, пов'язану з гормонами, стани, пов'язані з трансплантацією органу, порушення імунодефіциту, деструктивні порушення кості, проліферативні порушення, інфекційні захворювання, стани, пов'язані з некрозом клітин, індуковану тромбіном агрегацію тромбоцитів, хронічний мієлолейкоз (ХМЛ), захворювання печінки, патологічні імунні умови, що включають активацію Тклітин і порушення ЦНС у пацієнта. У одному варіанті здійснення пацієнта лікують сполукою форму 95799 12 ли І і фармацевтично прийнятним носієм, ад'ювантом або наповнювачем, де кількість зазначеної сполуки формули І достатня для явного інгібування активності PI3 кінази. Рак, який лікують згідно способам за даним винаходом включає, але не обмежується, рак молочної залози, яєчника, шийки матки, простати, сім'яника, сечостатевого тракту, стравоходу, гортані, гліобластому, нейробластому, рак шлунку, шкіри, кератоакантому, рак легенів, епідермоїдну карциному, великоклітинну карциному, недрібноклітинну карциному легенів (NSCLC), дрібноклітинну карциному, аденокарциному легенів, кістки, товстої кишки, аденоми, підшлункової залози, аденокарциному, рак щитовидної залози, фолікулярну карциному, недиференційовану карциному, папілярну карциному, семіному, меланому, саркому, карциному сечового міхура, карциному печінки і жовчних протоків, карциному нирок, мієлоїдні порушення, лімфоїдні порушення, ворсинчасті клітини, рак ротової порожнини і глотки (оральний), губи, язика, роту, глотки, тонкого кишечнику, ободової і прямої кишки, товстої кишки, прямої кишки, мозку і центральної нервової системи, рак Ходжкіна і лейкемію. Серцево-судинні порушення, які можна лікувати способами за даним винаходом включають, але не обмежуються, рестеноз, кардіомегалію, атеросклероз, інфаркт міокарда та ішемічну хворобу серця. Нейродегенеративне захворювання, яке можна лікувати способами за даним винаходом, включає, але не обмежується, хворобу Альцгеймера, хворобу Паркінсона, боковий аміотрофічний склероз, хворобу Хантінгтона, ішемію головного мозку і нейродегенеративне захворювання, спричинене травматичним ураженням, нейротоксичністю глутамата і гіпоксією. Запальні захворювання, які можна лікувати способами за даним винаходом включають, але не обмежуються, ревматоїдний артрит, псоріаз, контактний дерматит і реакції підвищеної чутливості. Крім біохімічної активності сполука за даним винаходом проявляє фізико-хімічні і фармакокінетичні властивості, які роблять її частково адаптованою для застосування у лікарських засобах. Це показано, наприклад, у результатах біологічних досліджень, описаних у прикладі 3, що представлений далі. Зокрема, сполука має високу водну розчинність при фізіологічному рН; розчинність більше, ніж 100 мкМ. Висока розчинність при фізіологічному рН є бажаною, так як вона підтримує біологічну доступність. Сполука також володіє високою метаболічною стійкістю, як показано, зокрема, дослідженням кліренса гепатоцитів, який описано у прикладі 3, у якому показали, що сполука має низький кліренс гепатоцитів. Низький кліренс гепатоцитів корелює з низькою швидкістю метаболізму печінки. Таки чином, може бути видно, що сполука за даним винаходом володіє покращеними фізико-хімічними і фармакокінетичними властивостями, в той час як зберігає біохімічну активність як інгібітор PI3 кінази. 13 Сполука за даним винаходом може бути введена у різних формах дозування, наприклад, перорально, наприклад, у формі таблеток, капсул, таблеток, покритих цукром або плівкою, рідких розчинів або суспензій, або парентерально, наприклад, внутрішньом'язово, внутрішньовенно або підшкірно. Таким чином, сполуку можна ввести ін'єкцією або вливанням. Дозування залежить від різних факторів, включаючи вік, вагу і стан пацієнта, та шлях введення. Щоденне дозування може варіювати у широких межах і буде відрегульовано до індивідуальних вимог у кожному окремому випадку. Типово, тим не менш, дозування, адаптоване для кожного шляху введення, при введенні тільки однієї сполуки дорослим людям складає від 0,0001 до 50 мг/кг, більш звичайно від 0,001 до 10 мг/кг ваги тіла, наприклад, від 0,01 до 1 мг/кг. Так, дозування може складати, наприклад, від 1 до 5 разів на день. Для внутрішньовенної ін'єкції придатна форма дозування складає від 0,0001 до 1 мг/кг ваги тіла, переважно від 0,0001 до 0,1 мг/кг ваги тіла. Щоденна доза може бути введена як одна доза або згідно з графіком розділеної дози. Типово, доза для лікування людей може знаходитись в діапазоні від приблизно 10 мг до приблизно 1000 мг сполуки за винаходом. Типова доза може складати від приблизно 100 мг до приблизно 300 мг сполуки. Доза може бути введена один раз на день (QID), двічі на день (BID) або частіше, в залежності від фармакокінетичних і фармакодинамічних властивостей, включаючи абсорбцію, розподіл, метаболізм і виділення окремої сполуки. До того ж, фактори токсичності можуть впливати на дозування і режими введення. При пероральному введенні пігулку, капсулу або таблетку можна приймати щоденно або менш частіше протягом певного періоду часу. Режим можна повторити протягом кількох циклів терапії. Сполука сформульована для застосування як фармацевтична або ветеринарна композиція, яка також включає фармацевтично або ветеринарно прийнятний носій або розріджувач. Композиції типово отримують наступними звичайними способами і вводять у фармацевтично або ветеринарно прийнятній формі. Сполуку можна ввести у будьякій звичайній формі, наприклад, як описано далі. А) Перорально, наприклад, як таблетки, покриті таблетки, драже, пастилки, льодяники, водні або масляні суспензії, рідкі розчини, дисперсні порошки або гранули, емульсії, тверді або м'які капсули, або сиропи, або еліксири. Композиції, що призначені для перорального застосування, можуть бути отримані будь-яким способом, відомим у техніці, для виготовлення фармацевтичних композицій, і такі композиції можуть містити один або більше агентів, вибраних з групи, що складається з підсолоджувачів, ароматизаторів, барвників та консервантів для забезпечення фармацевтично прийнятних на вигляд і на смак препаратів. Таблетки містять активний інгредієнт у суміші з нетоксичними фармацевтично прийнятними наповнювачами, які придатні для виготовлення таблеток. Цими наповнювачами можуть бути, наприклад, інертні розріджувачі, такі як карбонат 95799 14 кальцію, карбонат натрію, лактоза, декстроза, сахароза, целюлоза, кукурудзяний крохмаль, картопляний крохмаль, фосфат кальцію або фосфат натрію; агенти грануляції і дезінтеграції, наприклад, маїсовий крохмаль, альгінова кислота, альгінати або натрію крохмаль гліколят; агенти, що зв'язують, наприклад, крохмаль, желатин або акація; агенти, що змащують, наприклад, кремнезем, стеарат магнію або кальцію, стеаринова кислота або тальк; шипучі суміші; барвники, підсолоджувачі, зволожуючі агенти, такі як лецитин, полісорбати або лаурилсульфат. Таблетки можуть бути непокриті або вони можуть бути покриті за відомими технологіями для затримки розпаду і адсорбції у шлунково-кишковому тракті і, таким чином, забезпечують тривалу дію протягом продовженого періоду. Наприклад, можна застосовувати матеріал з затримкою часу, такий як гліцерил моностеарат або гліцерил дістеарат. Такі препарати можуть бути виготовлені відомим способом, наприклад, змішуванням, грануляцією, таблетуванням, способом покриття цукром або плівкою. Склади для перорального застосування можна також здійснити як тверді желатинові капсули, де активний інгредієнт змішали з інертним твердим розріджувачем, наприклад, карбонат кальцію, фосфат кальцію або каолін, або як м'які желатинові капсули, де активний інгредієнт присутній сам по собі, або змішаний з водою або масляним середовищем, наприклад, горіхове масло, рідкий парафін або оливкове масло. Водні суспензії містять активні матеріали у суміші з наповнювачами, що придатні для виготовлення водних суспензій. Такими наповнювачами є суспендуючі агенти, наприклад, карбоксиметилцелюлоза натрію, метилцелюлоза, гідроксипропілметилцелюлоза, альгінат натрію, трагакантова камедь полівінілпіролідону і аравійська камедь; агенти, що диспергують або зволожують, можуть бути фосфатидами, що зустрічаються у природі, наприклад, лецитин або продукти конденсації алкіленоксиду з жирними кислотами, наприклад, поліоксиетилен стеарат, або продукти конденсації етиленоксиду з аліфатичними спиртами з довгим ланцюгом, наприклад, гептадекаетиленоксицетанол, або продукти конденсації етиленоксиду з неповними ефірами, що отримані з жирних кислот, і гекситолу, такого як поліоксиетилен сорбітол моноолеат або продукти конденсації етиленоксиду з неповними ефірами, що отримані з жирних кислот, і ангідридів гекситолу, наприклад, поліоксиетилен сорбітан моноолеат. Зазначені водні суспензії можуть також містити один або більше консервантів, наприклад, етил або n-пропіл р-гідроксибензоату, один або більше барвників, такі як цукроза або сахарин. Масляна суспензія може бути сформульована суспендуванням активного інгредієнта у рослинному маслі, наприклад, арахісове масло, оливкове масло, сезамове масло або кокосове масло, або у мінеральному маслі, такому як рідкий парафін. Масляні суспензії можуть містити агент, що згущує, наприклад, бджолиний віск, твердий парафін або цетиловий спирт. 15 Підсолоджувані, такі, які зазначені вище, і ароматизатори можна додати для забезпечення приємного смаку препарату для перорального прийому. Дані композиції можуть бути захищені додаванням антиоксиданту, такого як аскорбінова кислота. Дисперсні порошки і гранули, що придатні для отримання водної суспензії додаванням води, забезпечують активний інгредієнт у суміші з агентами, що диспергують або зволожують, агентом, що суспендує, та одним або більше консервантом. Придатні агенти, що диспергують або зволожують та агенти, що суспендують, описані вище. Додаткові наповнювачі, наприклад, підсолоджувані, ароматизатори та барвники, також можуть бути присутніми. Фармацевтичні композиції за винаходом також можуть бути у формі емульсій масло-у-воді. Масляною фазою може бути рослинне масло, наприклад, оливкове масло, або арахісове масло, або мінеральне масло, наприклад, рідкий парафін або його суміші. Придатні агенти, що емульгують, можуть бути природними камедями, наприклад аравійська камедь або трагакантова камедь, природними фосфатидами, наприклад, соєвий лецитин, та ефірами або неповними ефірами, що отримані з жирних кислот ангідридів гекситу, наприклад, моноолеат сорбіту, і продуктами конденсації зазначених неповних ефірів з етиленоксидом, наприклад, моноолеат сорбіту поліоксиетилену. Емульсія також може містити підсолоджувачі та ароматизатори. Сиропи і еліксири можуть бути сформульовані з підсолоджувачами, наприклад, гліцерин, сорбітол або цукроза. Зокрема, сироп для діабетиків може містити як наповнювачі тільки продукти, наприклад, сорбітол, які не метаболізуються до глюкози або метаболізуються тільки в дуже невеликій кількості до глюкози. Такі склади можуть також містити пом'якшувач, консервант, ароматизатори та фарбники. В) Парентерально, або підшкірно, або внутрішньовенно, або внутрішньом'язово, або інтрастернально, або методиками вливання, у формі стерильних ін'єкційних водних або масляних суспензій. Дана суспензія може бути сформульована відомими способами, із застосуванням придатного диспергування агентів, що зволожують, та агентів, що суспендують, згаданих вище. Стерильній ін'єкційний препарат може також бути стерильним ін'єкційним розчином або суспензією у нетоксичному парентерально прийнятному розріджувачі або розчиннику, наприклад, як розчин у 1,3бутандіолі. Серед прийнятних наповнювачів і розчинників, що можна застосовувати, є вода, розчин Рінгера та ізотонічний розчин хлориду натрію. До того ж, стерильні, жирні масла звичайно застосовують як середовище розчинення або суспендування. Для цього може застосовуватись будь-яке легке масло, включаючи синтетичні моно або дигліцериди. До того ж, жирні кислоті, такі як олеїнова кислота, знаходять застосування у ін'єкційних препаратах. C) Інгаляцією, у формі аерозолів або розчинів для розпилювачів. D) Ректально, у формі супозиторіїв, отриманих змішуванням лікарського засобу з придатним не 95799 16 подразнюючим наповнювачем, який є твердим при звичайній температурі, але рідким при ректальній температурі, і, таким чином, плавиться у прямій кишці для вивільнення лікарського засобу. Такими матеріалами є масло какао і поліетиленгліколі. E) Місцево, у формі кремів, мазей, желе, примочок, розчинів або суспензій. F) Вагінально, у формі песаріїв, тампонів, кремів, гелів, паст, пін або складів, що розпорошується, які містять на додаток до активного інгредієнта такі носії, що відомі у техніці і є придатними. Можна отримати препарати уповільненого вивільнення сполуки за даним винаходом. Придатні приклади препаратів уповільненого вивільнення включають напівпроникні матриці твердих гідрофобних полімерів, що містять сполуку формули І, причому матриці знаходяться у формі профільованих виробів, наприклад, плівки або мікрокапсули. Приклади матриць уповільненого вивільнення включають поліефіри, гідрогелі (наприклад, полі(2гідроксиетилметакрилат), або полівініловий спирт), полілактиди (патент США № 3773919), сополімери L-глутамінової кислоти і гама-етил-L-глутамат, етилен вініл ацетат, що не розкладається, сополімери молочної кислоти-гліколевої кислоти, що розкладаються, такі як LUPRON DEPOT (ін'єкційні мікросфери, що складаються з сополімеру молочної кислоти-гліколевої кислоти і лейпроліду ацетату) і полі-D-(-)-3-гідроксимасляна кислота. Сполуку за даним винаходом можна застосовувати окремо або у комбінації з другим терапевтичним агентом для лікування захворювання або порушення, описаного тут, такого як гіперпроліферативне порушення (наприклад, рак). В окремих варіантах здійснення сполуку за винаходом комбінують у фармацевтичні комбінаційні склади, або режим дозування, як комбінаційна терапія, з другою сполукою, що має анти-гіперпроліферативні властивості, або яку використовують для лікування гіперпроліферативного порушення наприклад, раку). Друга сполука фармацевтичного комбінаційного складу або режим дозування переважно має додаткові активності до сполуки за даним винаходом, так що вони не впливають негативно одна на одну. Такі сполуки відповідно знаходяться у комбінації у кількостях, ефективних для призначення. У одному варіанті здійснення композиція за даним винаходом включає сполуку за винаходом у комбінації з хіміотерапевтичним агентом, як описано тут. Комбінаційну терапію можна вводити як одночасний або послідовний режим. Коли введення послідовне, комбінацію можна вводити двома або більше введеннями. Комбіноване введення включає сумісне введення із застосуванням окремих складів або одного фармацевтичного складу, а наступне введення у будь-якому порядку, де переважно є період часу, коли обидва (або всі) активні агенти одночасно проявляють свої біологічні активності. Придатні дозування для будь-яких вищезгаданих сумісно введених агентів, що зараз застосовують, можна знизити завдяки комбінованій дії (синергізму) заново ідентифікованого агента і інших хіміотерапевтичних агентів або лікувань. 17 Винахід додатково описують у наступних прикладах, викладених далі: Суміш метил 3-аміно-2-тіофенкарбоксилату (13,48 г, 85,85ммоль) і сечовини (29,75 г, 5 екв.) нагрівали при 190°С протягом 2 годин. Гарячу реакційну суміш потім вилили у розчин гідроксиду натрію, і будь-який нерозчинний матеріал видалили фільтрацією. Потім суміш підкислили (НCl, 2N) для отримання 1Н-тієно[3,2-d]піримідин-2,4-діону (IX) як білого осаду, який зібрали фільтрацією і висушили на повітрі (9,49 г, 66%). 1 Н ЯМР (400 MHz, d6-DMSO (диметилсульфоксид)) 6,90 (1Н, d, J=5,2Hz), 8,10 (1Н5 d, J=5,2Hz), 11,60-11,10 (2H, br s). Суміш 1Н-тієно[3,2-d]піримідин-2,4-діону (9,49 г, 56,49ммоль) і хлорокису фосфору (150 мл) нагрівали зі зворотнім холодильником протягом 6 годин. Потім реакційну суміш охолодили і вилили у лід/воду при енергійному перемішування, отримавши осад. Потім суміш відфільтрували для отримання 2,4-дихлор-тієно[3,2-d]піримідину (VIII) як білої твердої речовини (8,68 г, 75%). 1 Н ЯМР (400 MHz, CDCl3) 7,56 (1Н, d, J=5,5Hz), 8,13 (1Н, d, J=5,5Hz). Приклад посилання 2: 2-Хлор-4-морфолін-4-ілтієно[3,2-d]піримідин (VII) Суміш 2,4-дихлор-тієно[3,2-d]піримідіину (VIII), (8,68 г, 42,34ммоль), морфоліну (8,11 мл, 2,2 екв.) і МеОН (150 мл) перемішували при кімнатній температурі протягом 1 години. Потім реакційну суміш відфільтрували, промили водою і МеОН для отримання названої сполуки як білої твердої речовини (11,04 г, 100%). 1 Н ЯМР (400 MHz, d6-DMSO) 3,74 (4Н, t, J=4,9Hz), 3,90 (4Н, t, J=4,9Hz), 7,40 (1H, d, J=5,6Hz), 8,30 (1H, d, J=5,6Hz). Приклад посилання 3: 2-Хлор-4-морфолін-4-ілтієно[3,2-d]піримідин-6-карбальдегід (II) 95799 18 Приклад посилання 1: 2,4-Дихлор-тієно[3,2d]піримідин (VIII) До суспензії 2-хлор-4-морфолін-4-іл-тієно[3,2d]піримідину (VII) (1,75 г, 6,85 ммоль) у сухому THF (тетрагідрофуран) (40 мл) при -78°С додали 2,5М розчин nBuLi у гексані (3,3 мл, 1,2 екв.). Після перемішування протягом 1 години, додали сухий DMF (диметилформамід) (796 мкл, 1,5 екв.). Реакційну суміш перемішували протягом 1 години при 78°С і потім повільно нагрівали до кімнатної температури. Після додаткових 2 годин при кімнатній температурі реакційну суміш вилили у лід/воду, отримуючи жовтий осад. Його зібрали фільтрацією і висушили на повітрі для отримання названої сполуки (1,50 г, 77%). 1 Н ЯМР (400 MHz, d6-DMSO) 3,76 (4Н, t, J=4,9), 3,95 (4Н, t, J=4,9), 8,28 (1Н, s), 10,20 (1Н, s). Приклад посилання 4: 2-Хлор-6-(4метансульфоніл-піперазин-1-ілметил)-4-морфолін4-іл-тієно[3,2-d]піримідин (VI) Провели реакцію N-ВОС-піперазину (ВОС бутоксикарбоніл) і метансульфоніл хлориду разом у дихлорметані і триетиламіні для отримання тертбутилового складного ефіру 4-метансульфонілпіперазин-1-карбонової кислоти. Розщепленням захисної групи ВОС, застосовуючи НCl (2М), у дихлорметані отримали 1-метансульфоніл-піперазин НCl сіль. Суміш 2-хлор-4-морфолін-4-іл-тієно[3,2d]піримідин-6-карбальдегіду (II) (1,00 г), 1 19 95799 20 метансульфоніл-піперазину (750 мг) і триметилортоформіату (3,80 мл) перемішували у 1,2дихлоретані (30 мл) протягом 6 годин при кімнатній температурі. До неї додали триацетоксиборгідрид натрію (900 мг), і реакційну суміш перемішували протягом 24 годин при кімнатній температурі. Суміш потім погасили розсолом, екстрагували ди хлорметаном, висушили (MgSO4), і розчинник видалили in vacuo. Залишок перетерли на порошок з гарячим етилацетатом для отримання названої сполуки (VI) як білої твердої речовини (1,01 г). Приклад посилання 5: 4-(4,4,5,5тетраметил[1,3,2]діоксаборолан-2-іл)-1Н-індазол (IVa) - метод 1 До розчину 3-бром-2-метил аніліну (5,0 г, 26,9ммоль) у хлороформі (50 мл) додали ацетат калію (1,05 екв., 28,2ммоль, 2,77 г). Оцтовий ангідрид (2,0 екв., 53,7ммоль, 5,07 мл) додали з супутнім охолодженням у льодяній воді. Потім суміш перемішували при кімнатній температурі протягом 10 хвилин, після чого сформувалась біла желатинова тверда речовина. Потім додали 18-краун-6 (0,2 екв., 5,37ммоль, 1,42 г), а потім ізоамілнітрит (2,2 екв., 59,1 ммоль, 7,94 мл), і суміш нагрівали зі зворотнім холодильником протягом 18 годин. Реакційну суміш охолодили і розділили між хлороформом(3x100 мл) і насиченим водним гідрокарбонатом натрію (100 мл). Комбіновані органічні екстракти промили розсолом (100 мл), розділили і висушили (MgSO4). Неочищений продукт випарили над кремнеземом і очистили хроматографією, елююванням з 20%40% EtOAc-бензином отримали 1-(4-броміндазол-1-іл)-етанон (А) (3,14 г, 49%), як оранжеву тверду речовину, і 4-бром-1Н-індазол (В) (2,13 г, 40%), як блідо-оранжеву тверду речовину. 1 Α: Н ЯМР (400 MHz, CDCl3) 2,80 (3Н, s), 7,41 (1Н, t, J=7,8Hz), 7,50 (1H, d, J=7,8Hz), 8,15 (1H, s), 8,40 (1H, d, J=7,8Hz). 1 Β: Н ЯМР (400 MHz, CDCl3) 7,25 (1H, t, J=7,3Hz) 7,33 (1H d J=7,3Hz), 7,46 (1H, d, J=7,3Hz) 8,11 (1H, s), 10,20 (1H, br s). До розчину 1-(4-бром-індазол-1-іл)-етанону (3,09 г, 12,9ммоль) у МеОН (50 мл) додали 6N водний НCl (30 мл), і суміш перемішували при кімнатній температурі протягом 7 годин. МеОН випарили і суміш розділили між EtOAc (2x50 мл) і водою (50 мл). Комбіновані органічні шари промили розсолом (50 мл), розділили і висушили (MgSO4). Розчинник видалили випарюванням під зниженим тиском для отримання 4-бром-1Н-індазолу (2,36 г, 93%). До розчину 4-бром-1Н-індазолу (500 мг, 2,54ммоль) і bis(пінаколато)дибору (1,5 екв., 3,81 ммоль) у DMSO (20 мл) додали ацетат калію (3,0 екв., 7,61 ммоль, 747 мг; висушений у пістолеті для сушки) і PdCl2(dppf)2 (3 мол.%, 0,076ммоль, 62 мг). Суміш дегазували аргоном і нагрівали при 80°С протягом 40 годин. Реакційну суміш охолодили і розділили між водою (50 мл) і ефіром (3x50 мл). Комбіновані органічні шари промили розсо лом (50 мл), розділили і висушили (MgSO4). Неочищений матеріал очистили хроматографією, елююючи 30%40% EtOAc-бензином для отримання нероздільної 3:1 суміші 4-(4,4,5,5тетраметил-[1,3,2]діоксаборолан-2-іл)-1Н-індазолу (369 мг, 60%) і індазолу (60 мг, 20%); названу сполуку (IVa) виділили як жовту камедь, який затверднув при стоянні до утворення білуватої твердої речовини. 1 Н ЯМР (400 MHz, d6-DMSO) 1,41 (12Н, s), 7,40 (1Н, dd, J=8,4Hz, 6,9Hz), 7,59 (1Н, d, J=8,4Hz), 7,67 (1H, d, J=6,9Hz), 10,00 (1H, br s), 8,45 (1H, s), і індазол: 7,40 (1Н, t), 7,18 (1H t, J=7,9Hz), 7,50 (1H, d, J=9,1Hz), 7,77 (1H d, J=7,9Hz), 8,09 (1Н, s). Домішок приблизно 1,25. Приклад посилання 6: 4-(4,4,5,5-тетраметил [3,2,1]діоксаборолан-2-іл)-1Н-індазол (IVa) - метод 2 До розчину 2-метил-3-нітроаніліну (2,27 г, 14,91ммоль) у оцтовій кислоті (60 мл) додали розчин нітриту натрію (1,13 г, 1,1 екв.) у воді (5 мл). Через 2 години темно-червоний розчин вилили у лід/воду і отриманий осад зібрали фільтрацією для отримання 4-нітро-1Н-індазолу (67) (1,98 г, 81%). Суміш 4-нітро-1Н-індазолу (760 мг, 4,68ммоль), паладію на вугіллі (10%, кат.) і етанолу (30 мл) перемішували під балоном азоту протягом 4 годин. Реакційну суміш потім відфільтрували через целіт, і розчинник видалили in vacuo для 21 отримання 1Н-індазол-4-іламіну (68) (631 мг, 100%). Водний розчин нітриту натрію (337 мг, 4,89 ммоль) у воді (2 мл) по краплям додали до суспензії 1Н-індазол-4-іламіну (631 мг, 4,74 ммоль) у 6М соляній кислоті (7,2 мл) при температурі нижче 0°С. Після перемішування протягом 30 хвилин, до реакційної суміші додали тетрафторборат натрію (724 мг). Отримали в'язкий розчин, який відфільтрували і швидко промили водою для отримання 1Н-індазол-4-діазоній тетрафторборатної солі (69) (218 мг, 20%) як темно-червоної твердої речовини. Сухий МеОН (4 мл) прочищали аргоном протягом 5 хвилин. До нього додали 1Н-індазол-4діазоній тетрафторборатну сіль (218 мг, 0,94 ммоль), bis(пінаколато)дибор (239 мг, 1,0 екв.) і [1,1-bis(дифенілфосфіно)фероцен]паладію (II) хлорид (20 мг). Реакційну суміш перемішували протягом 5 годин і потім відфільтрували через целіт. Залишок очистили, застосовуючи флешхроматографію, для отримання необхідної названої сполуки (IVa), (117 мг). Приклад посилання 7: 2-(1Н-індазол-4-іл)-4морфолін-4-іл-тієно[3,2-d]піримідин-6-карбальдегід (III) Суміш 2-хлор-4-морфолін-4-іл-тієно[3,2d]піримідин-6-карбальдегіду (II) (100 мг, 0,35ммоль), 4-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1Н-індазолу (70) (95 мг, 0,39ммоль) і карбонату натрію (112 мг) суспендували у толуолі (2,5 мл), етанолі (1,5 мл) і воді (0,7 мл). До неї додали bis(трифенілфосфін)паладій(II) хлорид (13,5 мг) і реакційну посудину промили аргоном. Реакційну суміш піддавали мікрохвилям при 120°С протягом 1 години і потім розділили між DCM (дихлорметан) і водою, органічний шар промили розсолом, висушили над сульфатом магнію, відфільтрували і випарили in vacuo. Отриманий залишок очистили, застосовуючи флешхроматографію, для отримання названої сполуки (III) (97 мг). Приклад 1: 2-(1Н-індазол-4-іл)-6-(4метансульфоніл-піперазин-1-ілметил)-4-морфолін4-іл-тієно[3,2-d]піримідин (І) Суміш 2-хлор-6-(4-метансульфоніл-піперазин1-ілметил)-4-морфолін-4-іл-тієно[3,2-d]піримідину (2,00 г), 4-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1Н-індазолу (2,26 г), толуолу (24 мл), етанолу (12 мл), води (6 мл), карбонату натрію (1,72 г) і PdCl2(PPh3)2 (325 мг) нагрівали до 130°С у мікрохвилях протягом 90 хвилин. Реакційну суміш охолодили, розбавили хлороформом, промили розсолом, висушили (MgSO4) 95799 22 і розчинник видалили in vacuo. Залишок очистили, застосовуючи флеш-хроматографію (етилацетат, потім 5% етилацетат/метанол) і потім перетерли у порошок з ефіром, отримуючи необхідну названу сполуку (1,4 г). Дані масс-спектрометрії: (ESI+): МН+ 514 Дані ЯМР: (CDCl3): 2,67-2,71 (4Н, m), 2,81 (3Н, s), 3,29-3,33 (4Н, m), 3,89 (2Н, s), 3,89-3,93 (4Н, m), 4,08-4,12 (4Н, m),7,41 (1Н, s), 7,51 (1Н, t, J=7,2), 7,60 (1Н, d, J=8,3), 8,28 (1Н, d, J=7,5), 9,02 (1Н, s), 10,10 (1H, br). Приклад 2: 2-(1Н-індазол-4-іл)-6-(4метансульфоніл-піперазин-1-ілметил)-4-морфолін4-іл-тієно[3,2-d]піримідин бісмезилат До 2-(1Н-індазол-4-іл)-6-(4-метансульфонілпіперазин-1-ілметил)-4-морфолін-4-іл-тієно[3,2d]піримідину (2,00 г, 3,89ммоль) у дихлорметані (50 мл) і метанолі (20 мл) додали метансульфонову кислоту (2 еквів., 505 мкл). Реакційну суміш перемішували протягом 3 годин при кімнатній температурі, протягом цього часу поступово осідає білий осад. Леткі речовини видалили in vacuo, залишок перетерли у порошок з діетиловим ефіром, розчинник декантували і тверду речовину висушили під вакуумом для отримання названої сполуки (2,70 г). ЯМР (400MHz, DMSO). Включає наступні сигнали: 2,32 (s, 6H), 3,00 (s, 3H), 3,84-3,86 (4H, m). 4,09-4,11 (4H, m), 8,8 (1Н, s). Приклад 3. Біологічне дослідження Сполуку за винаходом, отриману як описано у попередніх прикладах, піддали наступним серіям біологічних аналізів: (і) Біохімічний скринінг PI3K Інгібування сполуки PI3K досліджували радіометричним аналізом, застосовуючи очищений, рекомбінантний фермент і АТР при концентрації 1uM. Сполуку серійно розбавили у 100% DMSO. Реакцію кінази інкубували протягом 1 години при кімнатній температурі, і реакцію закінчили додаванням PBS (сополімер стірола с бутадієном). Значення ІС50 послідовно досліджували, застосовуючи відповідну сингомоїдальну криву залежності від дози (перемінна крутизна). Сполука мала ІС50 проти PI3K менше ніж 0,1 мкМ. (іі) Інгібування клітинної проліферації Клітини висіяли при оптимальній густині у 96 лунковій пластині і інкубували протягом 4 днів у присутності досліджуваної сполуки. Послідовно додали Alamar Blue до середовища для кількісного визначення, і клітини інкубували протягом 6 годин перед зчитуванням при збуджуванні 544 нм, емісії 590 нм. Значення ЕС50 розрахували, застосовуючи відповідну сингомоїдальну криву залежності від дози. Сполука мала ЕС50 50uM або менше у діапазоні застосованих ліній клітини. (ііі) Проникність сасо-2 Клітини сасо-2 висіяли на багатоситових 5 планшетах з ультратонким фільтром при 1x10 2 клітина/см , і культивували протягом 20 днів. Потім провели оцінювання проникності сполуки. Сполуки наносили на апікальну поверхню (А) клітинних моношарів і виміряли проникність сполуки у базолатеральний (В) відсік. Це виконали у зворотному напрямку (В-А) для дослідження активного пере 23 носу. Розрахували значення коефіцієнта проникності, Рарр, для кожної сполуки, ступінь швидкості проникнення сполуки через мембрану. Сполуки 6 згрупували у групи з низьким (Рарр/=1,0x10 см/с) абсорбційним потенціалом, на основі порівняння з контрольними сполуками з встановленою абсорбцією людини. Для оцінювання здатності сполуки піддаватись активному виходу досліджували співвідношення базолатерального (В) переносу до апікального (А) у порівнянні з А до В. Значення В-А/А-В >/= 1,0 означає виникнення активного клітинного виходу. 6 Рарр>/=1,0x10 см/с. (іv) Кліренс гепатоцитів Застосовували суспензії заморожених гепатоцитів людини. Інкубації виконали при концентрації сполуки 1мМ або 3мкМ при щільності клітин 6 0,5x10 життєздатних клітин/мл. Заключна концентрація DMSO у інкубації дорівнює 0,25%. Контрольні інкубації також виконали при відсутності клітин, щоб показати будь-яке не ферментативне розщеплення. Повторну вибірку (50 мкл) видалили з інкубаційної суміші через 0, 5, 10, 20, 40 і 60 хвилин (контрольний зразок тільки через 60 хвилин) і додали до внутрішнього стандарту, що містить МеОН (100 мкл), для закінчення реакції. Толбутамід, 7-гідроксикумарин і тестостерон застосовували як контрольні сполуки. Зразки центрифугували і супернатанти у кожний момент часу об'єднали для аналізу за допомогою LC-MSMS. З графіку співвідношення логарифму площі піку (площа піку первісної сполуки/площа піку внутрішнього стандарту) проти часу, властивий кліренс (CLint) розраховували наступним чином: CLint (мкл/хв./мільйон клітин)=Vxk, де k являє собою константу швидкості елімінації, отриману з градієнту логарифму концентрації в залежності від часу; V представлений у об'ємних показниках, що отримані з об'єму інкуба6 -1 ційногооб'єму, і виражений як uL 10 клітин . 6 На основі низького (CL/=4,6; /=25,2 мкл/хв./10 клітин) кліренса, досліджувана сполука за даним винаходом, має низький кліренс гепатоцитів. (v) Інгібування цитохрому Р450 Сполуку за винаходом досліджували зап'ятьома цільовими CYP450 (1А2, 2С9, 2С19, 2D6, 3А4) при 10 концентраціях у повторі, з застосованою максимальною концентрацією 100uМ. Стандартні інгібітори (фурафулін (furafylline), сульфафеназол, транілципромін, хінідін, кетоконазол) застосовували як контролі. Планшети зчитували, застосовуючи пристрій BMG LabTechnologies PolarStar у способі флуоресценції. Сполука проявляла слабку активність (ІС50>/=5uМ) проти всіх ізоформ CYP450. (vi) Індукція цитохрому Р450 Тільки виділені гепатоцити людини з одного донора культивували протягом 48 годин перед додаванням досліджуваної сполуки при трьох концентраціях і інкубували протягом 72 годин. Субстрати проби для CYP3A4 і CYP1A2 додавали протягом 30 хвилин і за 1 годину перед закінченням інкубації. За 72 години клітини і середовище видалили, і ступінь метаболізму кожного субстрату 95799 24 проби визначили кількісно за допомогою LCMS/MS. Експеримент контролювали, застосовуючи індуктори окремих Р450, інкубованих при одній концентрації у трьох повторах. Сполука за винаходом проявляла незначний ефект на індукцію ферментів цитохрому Р450. (vii) Зв'язування білка плазми Розчини досліджуваної сполуки (5 um, 0,5% заключної концентрації DMSO) приготували у буфері і 10% плазмі (об'єм/об'єм у буфері). 96 лунковий НТ діалізний планшет склали так, що кожна лунка була розділена на дві напівпроникною целюлозною мембраною. Розчин буферу додали на одну сторону мембрани, а розчин плазми на іншу сторону; потім інкубації проводили при 37°С протягом 2 годин у трьох повторах. Клітини поступово звільнили, і розчини для кожної партії сполук скомбінували у дві групи (без плазми і ті, що містять плазму), потім аналізували за допомогою LCMSMS, застосовуючи два набори стандартів калібрування для розчинів без плазми (6 точок) і що містять плазму (7 точок). Для сполуки розрахували значення вільної фракції: сполуки з високим зв'язуванням білка (>/=90% зв'язування) мали Fu/= 0,1. (viii) Блокування каналів hERG (ген специфічних калієвих каналів серця) Сполуку за винаходом оцінювали за її здатністю модулювати вихід рубідію з клітин НЕK-294 стабільно виражених калієвих каналів hERG, застосовуючи встановлену методику потоку. Клітини приготували у середовищі, що містить RbCl, висіяли на 96-лункових планшетах, і вони росли протягом ночі для формування моношарів. Експеримент виходу ініціювали, всмоктуючи середовище, і промили кожну лунку 3x100 мкл попередньо інкубованим буфером (що містить низьку кількість [K+]) при кімнатній температурі. Після заключного всмоктування 50 мкл робочого запасу (2х) сполуки додали до кожної лунки і інкубували при кімнатній температурі протягом 10 хвилин. Потім додали 50 мкл стимулюючого буферу (що містить високу кількість [K+]) до кожної лунки, надаючи заключні концентрації досліджуваної сполуки. Клітинні планшети інкубували при кімнатній температурі додатково 10 хвилин. 80 мкл супернатанту з кожної лунки потім перенесли у еквівалентні лунки 96-лункового планшету і аналізували за допомогою атомно-емісійної спектроскопії. Сполуку досліджували як 10pt подвійного ІС50 криві, n=2, з максимальної концентрацією 100 мкМ. Приклад 4 Композиція таблетки Таблетки, кожна вагою 0,15 г і що містять 25 мг сполуки за винаходом, виготовлені наступним чином: Композиція для 10000 таблеток Активна сполука 250 г Лактоза 800 г Кукурудзяний крохмаль 415 г Талькова пудра 30 г Стеарат магнію 5г Змішали активну сполуку, лактозу і половину кукурудзяного крохмалю. Потім суміш продавили через сито з розміром 0,5 мм меш. Кукурудзяний 25 крохмаль (10 г) суспендували у теплій воді (90 мл). Отриману пасту застосовували для гранулювання порошку. Гранулят висушили і розбили на невеликі фрагменти на ситі розміром 1,4 мм меш. Додали кількість, що залишилась, крохмалю, тальку і магнію, обережно змішали і переробили у таблетки. Приклад 5: Ін'єкційний склад Склад А Активна сполука 200 мг Розчин соляної кислоти 0,1М або Розчин гідроксиду натрію 0,1М достатня кількість до рН 4,0-7,0 Стерильна вода достатня кількість до 10 мл Сполуку за винаходом розчинили у більшості у воді (35° 40°С) і рН відрегулювали від 4,0 до 7,0 соляною кислотою або гідроксидом натрію при необхідності. Пробу потім довели до об'єму водою і відфільтрували через стерильний мікропористий фільтр у стерильну 10 мл скляну пробірку з жовтого скла (тип 1) і запаяли стерильними пробками і закупорками. Склад В Активна сполука 125 мг Стерильний, вільний від пірогену, рН 25 мл Комп’ютерна верстка О. Гапоненко 95799 26 7 фосфатний буфер, достатня кількість до Активна сполука 200 мг Бензиловий спирт 0,10 г Глікофурол 75 1,45 г Вода для ін'єкції, достатня кількість до 3,00 мл Активну сполуку розчинили у глікофуролі. Потім додали бензиловий спирт і розчинили, і додали воду до 3 мл. Потім суміш відфільтрували через стерильний мікропористий фільтр і запаяли у стерильні 3 мл скляні пробірки (тип 1). Приклад 6: Склад сиропу Активна сполука 250 мг Розчин сорбітолу 1,50 г Гліцерол 2,00 г Бензоат натрію 0,005 г Ароматизатор 0,0125 мл Очищена вода достатня кількість до 5,00 мл Сполуку за винаходом розчинили у суміші гліцерину і більшій частині очищеної води. Потім додали водний розчин бензоату натрію до розчину, а потім додали розчин сорбітолу і наприкінці ароматизатор. Об'єм довели очищеною водою і добре змішали. Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical compounds
Автори англійськоюChuckowree Irina, Folkes Adrian, Hancox Tim, Shuttleworth Stephen
Назва патенту російськоюФармацевтические соединения
Автори російськоюЧуковри Ирина, Фолкс Адриан, Ханкокс Тим, Шуттлеуорт Стивен
МПК / Мітки
МПК: C07D 495/04, A61P 35/00, A61K 31/519
Мітки: сполуки, фармацевтичні
Код посилання
<a href="https://ua.patents.su/13-95799-farmacevtichni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Фармацевтичні сполуки</a>
Попередній патент: Похідні циклогексилпіразоллактаму як інгібітори 11-бета-гідроксистероїддегідрогенази 1
Наступний патент: Сідло велосипеда
Випадковий патент: Спосіб боротьби з небажаною рослинністю