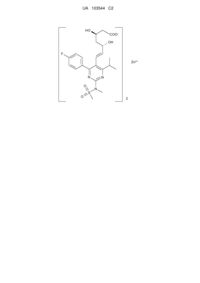
Кристалічна форма і цинкової солі розувастатину
Номер патенту: 103544
Опубліковано: 25.10.2013
Автори: Капуі Імре, БАРКОЦІ Йожеф, Імре Янош, Кованьїне Лакс Дьйорді, Сент-Кіраллі Жужанна, Моров'ян Дьордь, Цлементіш Дьйордь, Шлегель Петер, Надь Кальман, Барта Ференц, Краснаі Дьйордь, Сіміг Дюла, Ружич Дьйордь, Хофманне Фекете Валерія, Кестелі Адріен, Волк Балаж
Формула / Реферат
1. Кристалічна форма І солі розувастатину цинку (2:1) формули І
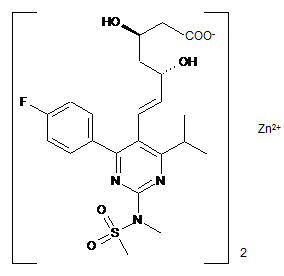 , (I)
, (I)
що має порошкову рентгенівську дифрактограму, яка містить специфічні кути дифракції 6,621; 19,089 і 22,466 градусів 2θ, виміряні з застосуванням СuKa-випромінювання.
2. Кристалічна форма І солі розувастатину цинку (2:1), що має порошкову рентгенівську дифрактограму, яка містить специфічні кути дифракції 6,621; 18,756; 19,089; 19,505; 22,466 градусів 2θ, виміряні з застосуванням СuKа-випромінювання.
3. Кристалічна форма І солі розувастатину цинку (2:1), що має порошкову рентгенівську дифрактограму, яка містить специфічні кути дифракції 6,621; 9,920; 11,213; 13,248; 16,127; 16,471; 17,230; 18,756; 19,089; 19,505; 22,101; 22,466 градусів 2θ, виміряні з застосуванням СuKа-випромінювання.
4. Кристалічна форма І солі розувастатину цинку (2:1) формули (І), що має рентгенівську дифрактограму, що показана на Фіг. 1, та такі специфічні дані дифракції:
Пік №
2θ
d(Å)
Відносна вологість (%)
Пік №
2θ
d(Å)
Відносна вологість (%)
1
5,584
15,81321
22,2
21
20,738
4,27984
25,9
2
5,889
14,99555
12,1
22
21,217
4,18430
11
3
6,621
13,33946
69,1
23
21,620
4,10713
11,3
4
7,038
12,55036
5,1
24
22,101
4,01878
31,4
5
9,920
8,90897
29,4
25
22,466
3,95434
76,3
6
11,072
7,98468
24,4
26
22,968
3,86898
18,2
7
11,213
7,88447
29,5
27
23,499
3,78272
27,4
8
11,679
7,57108
23,6
28
24,372
3,64924
14
9
12,391
7,13765
10,4
29
25,001
3,55888
18
10
13,248
6,67775
29,2
30
25,751
3,45684
6,7
11
14,266
6,20332
18,7
31
26,806
3,32318
19,7
12
15,311
5,78220
19,4
32
27,243
3,27079
7,2
13
16,127
5,49159
31,1
33
27,828
3,20337
7,8
14
16,471
5,37744
36,6
34
28,171
3,16516
7,2
15
17,230
5,14225
32,2
35
29,239
3,05194
8,5
16
17,936
4,94151
17,9
36
29,885
2,98740
4,9
17
18,756
4,72726
59,1
37
30,971
2,88504
6,5
18
19 089
4,64561
100
38
31,655
2,82424
15,7
19
19,505
4,54752
50,5
39
32,635
2,74171
13,1
20
20,074
4,41990
58,8
5. Суміш аморфної і кристалічної форми І солі розувастатину цинку (2:1) формули (І).
6. Кристалічна форма І солі розувастатину цинку (2:1), відповідна формулі (І) за будь-яким з пп. 1-5, що містить від 1 до 10 моль, переважно від 1 до 6 моль, води.
7. Спосіб одержання кристалічної форми І солі розувастатину цинку (2:1) формули (І), при якому здійснюють перемішування аморфної солі розувастатину цинку (2:1) в 5-100-кратній, переважно 20-кратній, масі води, при температурі від 0 до 25 °C, переважно від 0 до 5 °C, протягом від 4 до 168 годин, переважно від 4 до 8 годин, виділення твердих речовин і, необов’язково, промивання і сушіння кристалічного продукту.
8. Спосіб одержання кристалічної форми І солі розувастатину цинку (2:1) формули (І), при якому здійснюють перемішування аморфної солі розувастатину цинку (2:1) в 5-100-кратній, переважно 20-кратній, масі води, при температурі від 0 до 25 °C, переважно від 0 до 5 °C, протягом від 2 до 168 годин, переважно протягом від 4 до 8 годин, виділення твердих речовин шляхом фільтрування, промивання твердих речовин водою щонайменше одноразово, перемішування одержаної таким чином твердої маси в 5-100-кратній, переважно 20-кратній, масі води, при температурі від 0 до 25 °C, переважно від 0 до 5 °C, протягом від 1 до 168 годин, переважно протягом від 2 до 4 годин, виділення кристалічного продукту шляхом фільтрування і, необов’язково, промивання і сушіння одержаної в результаті кристалічної форми І солі розувастатину цинку (2:1).
9. Спосіб одержання кристалічної форми І солі розувастатину цинку (2:1) формули (І), при якому здійснюють перемішування аморфної солі розувастатину цинку (2:1) в 5-100-кратній, переважно 20-кратній, масі водного розчину 0,0005-0,01 молярного еквівалента, переважно 0,005 молярного еквівалента, гідроксиду лужного металу, переважно гідроксиду натрію, у розрахунку на молярну кількість солі розувастатину цинку формули (І) протягом від 4 до 168 годин, переважно від 4 до 8 годин, при температурі від 0 до 25 °C, переважно при 20 °C, виділення твердого продукту шляхом фільтрування і, необов’язково, промивання і сушіння продукту.
10. Спосіб одержання кристалічної форми І солі розувастатину цинку (2:1) формули (І), при якому здійснюють перемішування аморфної солі розувастатину цинку (2:1) в 5-100-кратній, переважно 20-кратній, масі водного розчину 0,0005-0,01 молярного еквівалента, переважно 0,005 молярного еквівалента, гідроксиду лужного металу, переважно гідроксиду натрію, у розрахунку на молярну кількість солі розувастатину цинку формули (І), протягом від 4 до 168 годин, переважно від 4 до 8 годин, при температурі від 0 до 25 °C, переважно при 20 °C, виділення твердого продукту шляхом фільтрування, щонайменше одноразове промивання виділеної твердої речовини розчином 0,0005-0,01 молярного еквівалента гідроксиду лужного металу, переважно гідроксиду натрію, в 5-100-кратній масі води, у розрахунку на кількість солі розувастатину цинку (2:1), і перемішування одержаної таким чином твердої речовини в 5-100-кратній, переважно 20-кратній, масі водного розчину 0,0005-0,01 молярного еквівалента, переважно 0,005 молярного еквівалента, гідроксиду лужного металу, переважно гідроксиду натрію, у розрахунку на молярну кількість солі розувастатину цинку формули (І), протягом від 1 до 168 годин, переважно від 2 до 4 годин, при температурі від 0 до 25 °C, переважно при 20 °C, виділення твердого продукту шляхом фільтрування і, необов’язково, промивання і сушіння кристалічної форми І солі розувастатину цинку (2:1).
11. Лікарський засіб, що містить терапевтично ефективну кількість кристалічної форми І солі розувастатину цинку (2:1) за будь-яким з пп. 1-6, необов’язково змішану з фармацевтично прийнятним носієм або допоміжним агентом.
12. Спосіб одержання лікарського засобу за п. 13, при якому перетворюють кристалічну форму І солі розувастатину цинку (2:1) за будь-яким з пп. 1-6 або її суміш, одержану з фармацевтично прийнятним носієм або допоміжним агентом, у фармацевтичну лікарську форму.
13. Застосування кристалічної форми І солі розувастатину цинку (2:1) за будь-яким з пп. 1-6 для лікування захворювань або розладів, що асоціюються з метаболізмом ліпідів, що включають гіперхолестеринемію, гіперліпопротеїнемію, дисліпідемію і атеросклероз.
14. Застосування кристалічної форми І солі розувастатину цинку (2:1) за будь яким з пп. 1-6 для приготування лікарських засобів, придатних для лікування розладів або захворювань, що асоціюються з метаболізмом ліпідів, що включають гіперхолестеринемію, гіперліпопротеїнемію, дисліпідемію і атеросклероз.
15. Спосіб лікування захворювань або розладів, що асоціюються з метаболізмом ліпідів, що включають гіперхолестеринемію, гіперліпопротеїнемію, дисліпідемію або атеросклероз, при якому пацієнтові, що потребує такого лікування, вводять лікарський засіб, що містить терапевтично ефективну кількість кристалічної форми солі розувастатину цинку (2:1) за будь-яким з пп. 1-6.
Текст
Реферат: Даний винахід стосується кристалічної форми І солі розувастатину цинку (2:1), способу її одержання та її застосування як фармацевтично активного інгредієнта для лікування захворювань, пов'язаних з метаболізмом ліпідів, що включають гіперліпопротеїнемію, гіперхолестеринемію, дисліпідемію і атеросклероз. UA 103544 C2 (12) UA 103544 C2 HO COOOH F Zn2+ N O O S N N 2 UA 103544 C2 Область винаходу Даний винахід відноситься до кристалічної солі (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2(метансульфоніл-метил-аміно)-піримідин-5-іл]-(3R,5S)-дигідрокси-гепт-6-енової кислоти та цинку формули (I). HO COOOH F Zn2+ N O O 5 S N N 2 , (I) Сполука (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфоніл-метил-аміно)-піримідин-5-іл](3R,5S)-дигідрокси-гепт-6-енова кислота формули (II) 10 15 20 відома під міжнародною незапатентованою назвою розувастатин і застосовується в медицині в якості фармацевтично активного інгредієнта для лікування розладів метаболізму ліпідів. Розувастатин проявляє свою активність шляхом інгібування 2-метил-глутарил-коензим A редуктази, що присутня в печінці, таким чином зменшуючи швидкість біосинтезу холестерину в печінці та концентрацію холестерину в крові. Розувастатин в основному у формі його солей застосовується для лікування гіперхолестеринемії, гіперліпопротеїнемії і атеросклерозу. Об'єктом даного винаходу є кристалічна форма I солі (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2(метансульфоніл-метил-аміно)-піримідин-5-іл]-(3R,5S)-дигідрокси-гепт-6-енової кислоти та цинку (2:1), спосіб її одержання та її застосування при одержанні лікарських засобів. Попередній рівень техніки (+)-7-[4-(4-Фторфеніл)-6-ізопропіл-2-(метансульфоніл-метил-аміно)-піримідин-5-іл]-(3R,5S)дигідрокси-гепт-6-енова кислота формули (II) (розувастатин) відома в області техніки. Розувастатин вперше розкрито в Європейському патенті № 521471 у вигляді вільної кислоти і деяких його фармацевтично прийнятних солей, таких як сіль кальцію формули (III) 1 UA 103544 C2 5 10 15 20 25 30 35 40 45 і амонієва сіль. В опублікованій міжнародній заявці на патент WO 01/060804 розкриті кристалічні літієві, магнієві солі розувастатину та кристалічні солі сполук з деякими амінами. В опублікованих міжнародних заявках на патенти WO 2005023779, WO 2006079611 та WO 2008036286 розкрито кілька різних кристалічних гідратних форм розувастатину кальцію формули (III). Міжнародні заявки на патенти WO 2005051921 і WO 2008038132 відносяться до інших солей розувастатину з амінами або диамінами. У міжнародній заявці на патент W O 2005077917 розкрита аморфна сіль розувастатину магнію. В опублікованій міжнародній заявці на патент WO 2007086082 розкрита аморфна та кристалічна сіль калію та спосіб її одержання. Сіль розувастатину цинку (2:1) формули (I) розкрита вперше в заявці на патент Угорщини P0600293 і у відповідній міжнародній заявці на патент WO 2007119085. Заявка на патент Угорщини P070667 і відповідна опублікована міжнародна заявка на патент WO 2009047577 відноситься до додаткових способів одержання солі розувастатину цинку формули (I), де розувастатин формули (II), його натрієва сіль, його алкілових ефір, розувастатину лактон або розувастатину кеталевий ефір застосовуються як вихідні речовини. У міжнародній заявці на патент WO 2008015563 розкритий спосіб одержання солі розувастатину цинку формули (I), при якому сіль розувастатину трет-бутиламін перетворюють на сіль розувастатину натрію і одержують сіль цинку шляхом взаємодії зазначеної солі розувастатину натрію з іонами цинку та фільтрування продукту з водного розчинника. Заявка на патент Угорщини P0900019 відноситься до ще одного способу одержання солі розувастатину цинку формули (I), де сіль розувастатину цинку формули (I) одержують безпосередньо починаючи з солі розувастатину трет-бутиламіна та виділення зазначеного продукту з органічного розчинника. Сіль розувастатину цинку формули (I), одержана за допомогою способів із заявок на патенти Угорщини P0600293, P070667 і P0900019 або за допомогою способу, розкритого в міжнародній заявці на патент WO 2008015563, має аморфну морфологію. Жодна кристалічна форма солі розувастатину цинку формули (I) не відома з рівня техніки. Якість фармацевтично активного інгредієнта, що застосовується в медичному продукті, визначають за допомогою точних критеріїв, встановлених органами охорони здоров'я. Деякі з цих критеріїв пов'язані з хімічною чистотою і стабільністю активного інгредієнта. Додаткові критерії застосовуються до якості та стабільності медичного продукту. Ці критерії викладені й опубліковані в фармакопеях. Головна умова для одержання дозволу на реалізацію полягає в відповідності вимогам якості, що стосуються фармацевтично активних інгредієнтів, а також медичних продуктів. Під час застосування розувастатину для приготування лікарських засобів виникає необхідність в одержанні фармацевтично активного інгредієнта високої чистоти, хімічно стабільного і знаходиться у формі, якою можна легко маніпулювати під час виготовлення медичного продукту. Останнім часом певна потреба виникла у фармацевтичній промисловості в відтворюваних способах приготування фармацевтично активного інгредієнта в хімічно та морфологічно чистій формі. Одержання фармацевтично активного інгредієнта в гомогенному твердому стані є передумовою для відповідності вимогам промислового одержання кінцевих лікарських форм. Добре відомий факт, що тверді форми того ж самого активного інгредієнта, що володіє відмінною морфологією, можуть демонструвати значні відмінності в швидкості розчинення, біологічної доступності та хімічної стабільності. З точки зору промислової хімічної та фармацевтичної технології важливо, що різні тверді форми активного інгредієнта можуть мати істотно різні властивості щодо технологічних операцій, наприклад швидкості фільтрування або 2 UA 103544 C2 5 10 15 20 25 30 35 40 45 50 55 60 сушки, розчинності, поведінки при таблетуванні. Згадані вище безпосередньо впливають на ефективність, економічність, відтворюваність і складність способу промислового виготовлення і в той же самий час призводить в результаті до морфологічно гомогенного продукту. Загалом, вважають, що кристалічні форми фармацевтично активних інгредієнтів мають покращену хімічну стабільністю в порівнянні з аморфною формою. Внаслідок різних процесів руйнування під час виготовлення та терміну придатності кінцевої лікарської форми дане припущення має загальну важливість. Таким чином, виробники медичних продуктів воліють застосовувати кристалічні форми активних інгредієнтів під час фармацевтичної розробки. Активні інгредієнти, що відносяться до групи статинів, явно схильні до руйнування (Ravi P. Shah, Vijay Kumar and Saranjit Singh, LC-MS/MS Studies on Identification and Characterization of th Hydrolytic Products of Atorvastatin, Proceedings of 12 ISMAS Symposium cum Workshop on Mass Spectrometry, March 25-30, 2007, Cidade de Goa, Dona Paula, Goa), таким чином, існує потреба в одержанні форм активних інгредієнтів, що відносяться до цієї групи, які демонструють поліпшену хімічну стабільність. Наприклад, відомо, що аморфна форма аторвастатину, що має структуру, схожу на розувастатин (тобто обидві сполуки мають угруповання 3,5 дигідроксиалканової кислоти), або навіть морфологічно негомогенна суміш аморфної і кристалічної форм, розкритих в Європейському патенті 409281, менш стабільні в порівнянні з його кристалічними формами. Таким чином, розробка кристалічних форм I, II і IV, що демонструють поліпшені властивості під час хімічних або фармацевтичних маніпуляцій (наприклад, легкість фільтрування) і підвищену стабільність, як це описано в опублікованій міжнародній заявці на патент WO 97/03959, ініційована від імені декількох компаній, що призвело в результаті до розробки більш ніж сорока кристалічних форм аторвастатину. Розувастатин особливо схильний до руйнування в результаті дії світла, кисню та нагрівання. Наприклад, при впливі світла продукти руйнування, що описані Astrarita і співавторами, утворюються навіть у твердому стані (J. Photochem. Photobiol. A. Chem. 2007, 187, 263-268). Короткий зміст суті винаходу Відповідно до вищезгаданих фактів існує велика потреба в одержанні кристалічних солей розувастатину формули (II). Завдання розробки авторів цього винаходу полягала в тому, щоб запропонувати сіль розувастатину цинку (2:1) у кристалічній формі, яка придатна для виготовлення лікарських засобів і може бути одержана стабільно з високою якістю в промислових умовах. Вищенаведене завдання вирішується в даному винаході. Автори винаходу несподівано виявили, що сіль розувастатину цинку (2:1) може бути синтезована в морфологічно гомогенній кристалічній формі, що має відповідну стабільність та фізико-хімічні властивості, і яка може бути відтворено одержана в промисловому масштабі з використанням простого способу. Це спостереження є несподіваним, оскільки всі відомі способи виготовлення солі розувастатину цинку (2:1) завжди призводять до аморфного продукту і оскільки більш ранні спроби кристалізувати сіль розувастатину цинку (2:1) були неуспішними. Крім того, відомо, що кристалічні форми розувастатину кальцію, вперше розкриті в 1991 році, доступні протягом більш ніж 10 років після відкриття аморфної форми. Незважаючи на те, що були одержані кристалічні форми розувастатину кальцію, зазначені кристалічні форми все ж не застосовуються для приготування лікарських засобів. Це явище відображається у тому, що ® навіть вихідний продукт CRESTOR містить розувастатин кальцію в аморфній формі. Несподівано виявлено, що сіль розувастатину цинку (2:1) може бути одержана в кристалічній формі, оскільки утворення комплексів перехідного металу цинку з органічними лігандами, а також водою добре відомо. Крім того, в області техніки відсутній спосіб, який міг би застосовуватися для передбачення шансів утворення кристалічної форми хімічної сполуки або солі, що відома тільки в аморфній формі. Відповідно до першого аспекту даного винаходу запропонована кристалічна форма I солі (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфоніл-метил-аміно)-піримідин-5-іл]-(3R,5S)дигідрокси-гепт-6-енової кислоти та цинку (2:1) формули (I). Відповідно до другого аспекту даного винаходу запропоновані способи виготовлення кристалічної форми I солі розувастатину цинку (2:1). Відповідно до третього аспекту винаходу запропоновані способи застосування кристалічної форми I солі розувастатину цинку (2:1) формули (I) в виготовленні лікарських засобів. Ще одним аспектом даного винаходу є застосування кристалічної форми I солі розувастатину цинку (2:1) для лікування розладів, що асоціюються з порушенням метаболізму холестерину і ліпідів. Детальний опис винаходу 3 UA 103544 C2 5 10 15 В попередньому рівні техніки відсутня інформація про кристалічні форми солі розувастатину цинку (2:1). Всі відомості в попередньому рівні техніки пов'язані з аморфної сіллю розувастатину цинку (2:1). Сіль розувастатину цинку (2:1) формули (I), одержана у відповідності зі способом, розкритим в заявках на патенти Угорщини P0600293, P070667 і P0900019, не мала чітко визначену температуру плавлення. Плавлення починається при 137 °C і відбувається в широкому діапазоні температур. Сіль розувастатину цинку (2:1), одержана за допомогою способу відповідно до міжнародної заявки на патент WO 2008015563, характеризується порошковою рентгенівською дифрактограмою. Аналітичні результати, розкриті у зазначеній заявці на патент, ясно вказують на те, що одержаний продукт має аморфну морфологію. Температура плавлення не розкрита. Відповідно до першого аспекту даного винаходу запропонована кристалічна форма I солі (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфоніл-метил-аміно)-піримідин-5-іл]-(3R,5S)дигідрокси-гепт-6-енової кислоти та цинку (2:1) формули (I). Кристалічна форма I солі розувастатина цинку (2:1) є новою. Картина порошкової рентгенівської дифрактограми, характерна для кристалічної форми I солі розувастатину цинку (2:1), виміряної з застосуванням Cu Kα випромінювання, представлена на Фіг. 1. Характеристичні кути дифракції рентгенівських променів і відповідні відносні інтенсивності, що переважають 5 %, наведені в Таблиці 1 нижче. Таблиця 1 Дані дифракції кристалічної форми I солі розувастатину цинку (2:1) Пік № 2θ d( Å) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 5,584 5,889 6,621 7,038 9,920 11,072 11,213 11,679 12,391 13,248 14,266 15,311 16,127 16,471 17,230 17,936 18,756 19,089 19,505 20,074 15,81321 14,99555 13,33946 12,55036 8,90897 7,98468 7,88447 7,57108 7,13765 6,67775 6,20332 5,78220 5,49159 5,37744 5,14225 4,94151 4,72726 4,64561 4,54752 4,41990 Відносна інтенсивність (%) 22,2 12,1 69,1 5,1 29,4 24,4 29,5 23,6 10,4 29,2 18,7 19,4 31,1 36,6 32,2 17,9 59,1 100 50,5 58,8 Пік № 2θ d( Å) 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 20,738 21,217 21,620 22,101 22,466 22,968 23,499 24,372 25,001 25,751 26,806 27,243 27,828 28,171 29,239 29,885 30,971 31,655 32,635 4,27984 4,18430 4,10713 4,01878 3,95434 3,86898 3,78272 3,64924 3,55888 3,45684 3,32318 3,27079 3,20337 3,16516 3,05194 2,98740 2,88504 2,82424 2,74171 Відносна інтенсивність (%) 25,9 11 11,3 31,4 76,3 18,2 27,4 14 18 6,7 19,7 7,2 7,8 7,2 8,5 4,9 6,5 15,7 13,1 20 25 30 Умови вимірювання для аналізу порошкової рентгенівської дифрактограми були наступними: Прилад: порошковий дифрактометр BRUKER D8 ADVANCE Випромінювання: CuKα1 (λ=1,54060 Å), CuK α2 (λ=1,54439 Å) Напруга: 40 кВ Анодний струм: 30 мА Допоміжні приналежності: дзеркало Гебеля, щілина Соллера, пробовідбірник, позиція пропускання Детектор: LynxEye Вимірювання: безперервне сканування θ/θ: 4°-35° 2θ Крок: 0,02° Зразок: без попередньої обробки, кімнатна температура Відтворюваність: ±0,2° 2θ 4 UA 103544 C2 5 10 15 20 25 30 35 40 45 50 55 В області техніки відомо, що попередня обробка зразка (наприклад, пульверизація) може мати значний вплив на відносні інтенсивності порошкової рентгенівської дифрактограми. Таким чином, ніяка попередня обробка зразка не застосовується. Спеціаліст в даній галузі техніки може ідентифікувати морфологію відомої речовини в твердому стані за допомогою порошкових рентгенівських дифрактограм. Це може бути здійснено просто шляхом визначення позиції (кут дифракції) сигналів дифракції рентгенівських променів невеликої інтенсивності. Така ідентифікація дуже важлива для тестування морфології активного інгредієнта в твердих лікарських формах, оскільки під час виготовлення твердої кінцевої лікарської форми зміни морфології можуть відбуватися шляхом перетворення кристалічного активного інгредієнта в кристалічну форму, що відрізняється або в аморфну форму. Кути дифракції, що відносяться до найбільш інтенсивних сигналів дифракції кристалічної форми I солі розувастатину цинку (2:1), складають 6,621, 19,089 і 22,466 градусів 2θ. Ці сигнали дифракції рентгенівських променів можуть бути найбільш зручним чином застосовані для ідентифікації кристалічної форми I солі розувастатину цинку (2:1). Кути дифракції дифракційних ліній, для яких відносна інтенсивність перевершує 50 % на дифрактограмі кристалічної форми I солі розувастатину цинку (2:1), складають 6,621; 18,756; 19,089; 19,505; 22,466 градусів 2θ. Кути дифракції, що відносяться до сигналів дифракції кристалічної форми I солі розувастатину цинку (2:1), що володіють щонайменше 20 % відносною інтенсивністю, є наступними: 6,621; 9,920; 11,213; 13,248; 16,127; 16,471; 17,230; 18,756; 19,089; 19,505; 22,101; 22,466 градусів 2θ. Кристалічна морфологія форми I солі розувастатину цинку (2:1), підтверджена порошковою рентгенівською дифрактограмою, що описана вище, додатково підтверджується тим, що вказана кристалічна форма I солі розувастатину цинку (2:1) має чітку температуру плавлення 119-121° C. Кристалічна форма I солі розувастатину цинку (2:1) за даним винаходом може містити від 1 до 10 мольних еквівалентів води у формі гідратної води або у вигляді фізично абсорбованої води. Хоча результати фізико-хімічного тесту свідчать про те, що кристалічна форма I солі розувастатину цинку (2:1) переважно містить від 1 до 6 мольних еквівалентів води, виявлено, що вказана речовина, що містить більш високу кількість води, також прийнятна для виготовлення кінцевих лікарських форм. Згідно з другим аспектом даного винаходу запропоновані способи одержання кристалічної форми I сіль розувастатину цинку (2:1) формули (I). Переважно всі маніпуляції здійснюють в атмосфері інертного газу. Кристалічну форму I солі розувастатину цинку (2:1) за даним винаходом одержують шляхом суспендування аморфної солі розувастатину цинку (2:1) в 5-100-кратній масі води при температурі від 0 до 25 °C, перемішування суспензії протягом 4-168 годин, і виділення продукту. Відповідно до переважного втілення способу кристалічну форму I солі розувастатину цинку (2:1) одержують шляхом суспендування аморфної солі розувастатину цинку (2:1) у 20-кратній масі води при температурі від 0 до 5 °C, перемішування суспензії протягом від 4 до 8 годин, збору твердих речовин шляхом фільтрування або центрифугування, промивання твердих речовин водою і сушки продукту. Згідно з другим способом одержання кристалічної форми I солі розувастатину цинку (2:1) суспензію аморфної солі розувастатину цинку (2:1) в 5-100-кратній, переважно 20-кратній масі води, готують при температурі від 0 до 25 °C, переважно при 0-5 °C, зазначену суспензію перемішують при тій же самій температурі протягом від 2 до 168 годин, переважно протягом від 4 до 8 годин, тверді речовини виділяють і промивають один або кілька разів водою, і потім одержані таким чином тверді речовини суспендують в 5-100-кратній, переважно в 20-кратній масі води, при 0-25 °C, переважно при 0-5 °C, суспензію перемішують протягом від 1 до 168 годин, переважно протягом від 2 до 4 годин, при тій же самій температурі, і тверду речовину виділяють, промивають і сушать. В третьому способі одержання кристалічної форми I солі розувастатину цинку (2:1) за даним винаходом здійснюють суспендування аморфної солі розувастатину цинку (2:1) в 5-100-кратній, переважно 20-кратній масі води, що містить від 0,0005 до 0,01 молярних еквівалентів, переважно 0,005 молярного еквівалента гідроксиду лужного металу, переважно гідроксиду натрію, у розрахунку на молярну кількість солі розувастатину цинку формули (I), при температурі від 0 до 25 °C, переважно при 20 °C, перемішування суспензії, що одержується таким чином протягом 4-168 годин, переважно від 4 до 8 годин, при тій же самій температурі, 5 UA 103544 C2 5 10 15 20 25 30 виділення і можливо промивання і сушіння твердої кристалічної форми I солі розувастатину цинку (2:1). В ще одному способі одержання солі розувастатину цинку (2:1) у кристалічній формі I здійснюють суспендування аморфної солі розувастатину цинку (2:1) в 5-100-кратній, переважно 20-кратній масі води, що містить від 0,0005 до 0,01 молярних еквівалентів, переважно 0,005 молярного еквівалента, гідроксиду лужного металу, переважно гідроксиду натрію, у розрахунку на молярну кількість солі розувастатину цинку формули (I), при температурі від 0 до 25 °C, переважно при 20 °C, перемішування суспензії, що одержується таким чином протягом 4-168 годин, переважно від 4 до 8 годин при тій же самій температурі, виділення і можливо промивання твердого речовини водою або 0,0005-0,01 молярним розчином гідроксиду лужного металу, переважно гідроксиду натрію, і повторне суспендування твердих речовин в тих же самих умовах протягом від 1 до 168 годин, переважно протягом від 2 до 4 годин, виділення і можливо промивання і сушіння кристалічної форми I солі розувастатину цинку (2:1). Відповідно до ще одного способу кристалічна форма I солі розувастатину цинку (2:1) може бути одержана шляхом суспендування аморфної солі розувастатину цинку (2:1) в суміші води і ізопропілацетата при температурі від 0 до 30 °C, переважно при кімнатній температурі, перемішування суспензії протягом 4-168 годин і виділення продукту шляхом фільтрування і можливо промивання та сушіння кристалічної форми I солі цинку (2:1). Автори винаходу виявили, що кристалічна форма I солі розувастатину цинку (2:1) більш вигідна щодо хімічної стабільності в порівнянні з аморфною формою, що відома в області техніки. Хімічна стабільність фармацевтично активного інгредієнта є важливою властивістю, оскільки очікують, що концентрація домішок в кінцевій лікарській формі не повинна значно збільшуватися під час терміну придатності (1-2 роки). Крім того, існують офіційні вимоги, які змушують виробника здійснювати окреме токсикологічне дослідження щодо домішок з відомою структурою, якщо концентрація такої домішки перебільшує граничну концентрацію 0,15 %. Хімічну стабільність аморфної та кристалічної форм I солі розувастатину цинку (2:1) визначали шляхом зберігання зазначених речовин в умовах 25 °C, 60 % відносної вологості. Результати тесту представлені в Таблиці 2. Концентрація двох найбільш значних домішок 7-[4(4-фторфеніл)-6-(1-метилетил)-2-[метил-метилсульфоніл-аміно]-5-піримидінил]-3-гідрокси-5оксо-(3R,5R,6E)-6-гептенової кислоти (5-оксопохідна, що є домішкою M-2) формули (IV) та N-(4-(4-фторфеніл)-5-{(E)-2-[{2S,4R)-4-гідрокси-2-оксо-тетрагідро-2H-піран-2-іл]етеніл}-6ізопропіл-піримідин-2-іл)-N-метилметансульфонамід (розувастатина лактон) формули (V) 35 6 UA 103544 C2 5 10 15 20 збільшуються в набагато більшому ступені в продукті аморфної морфології в порівнянні з кристалічною формою I солі цинку за даним винаходом. Виявлено, що концентрація домішки M-2 збільшується вже протягом одного місяця в умовах тестування стабільності протягом тривалого періоду (25 °C, 60 % відносна вологість) до трьох крат відносно вихідної концентрації в аморфній формі солі розувастатину цинку. При порівнянні, концентрація тієї ж самої домішки в кристалічній формі I речовини, яка зберігається в тих же самих умовах, практично не змінюється, тобто знаходиться в межах відтворюваності способу аналізу. Аналогічним чином, виявлено, що кристалічна форма I солі розувастатину цинку (2:1) менш схильна до утворення лактону розувастатину порівняно з аморфною сіллю цинку. Навіть хоча лактони статинів розглядаються як нетоксичні домішки статинів, п'ятикратне збільшення концентрації розувастатину лактону, виявлене в разі аморфної солі розувастатину цинку (2:1) після одного місяця зберігання, є підставою для міркувань, пов'язаних з якістю, внаслідок зменшення кількості активного інгредієнта. Крім того, автори винаходу виявили, при зберіганні кристалічної форми I солі розувастатину цинку, що загальна кількість домішок, а також безліч індивідуальних домішок (у вигляді хімічних сполук) значно менше, ніж при зберіганні аморфної форми. Важлива перевага кристалічної форми I солі розувастатину цинку (2:1) полягає в тому, що зазначена форма набагато менш гігроскопічна в порівнянні з аморфною формою, що є сприятливим через стабільність та з метою простоти фармацевтичного виготовлення. Виявлено, що аморфна сіль розувастатину цинку (2:1) абсорбує 1,88 мас. % води, тоді як для кристалічної форми I солі розувастатину цинку (2:1) згідно з цим винаходом кількість абсорбованої води становить лише 0,24 мас. %. Таблиця 2 Порівняння даних по стабільності для кристалічної форми I і аморфної солі розувастатину цинку (2:1) 25C, 60 % RH (відносної вологи) Домішка M-2 Домішка лактону Загальні домішки Аморфна Початково 1 місяць 0,03 % 0,10 % 0,10 % 0,51 % 0,38 % (7 піків) 0,77 % (6 піків) Форма I Початково 1 місяць 0,07 % 0,08 % 0,13 % 0,32 % 0,28 % (3 піку) 0,49 % (3 піку) 25 30 35 40 45 50 Відповідно до ще одного аспекту даного винаходу запропоновані лікарські засоби, що містять кристалічну форму I солі розувастатину цинку (2:1) формули (I). Такі лікарські засоби також можуть містити один або більше ніж один відомий наповнювач або допоміжний агент. Лікарський засіб згідно з аспектом даного винаходу в більшості випадків містить від 0,1 до 95 мас. % фармацевтично активного інгредієнта формули (I). Частка активного інгредієнта переважно складає від 5 до 75 мас. %. Лікарські засоби за даним винаходом вводять перорально (наприклад, порошки, таблетки, вкриті або що мають плівкову оболонку таблетки, капсули, мікрокапсули, гранули, пігулки, драже, розчини, суспензії або емульсії), парентерально (в формі, наприклад, внутрішньовенних, внутрішньом'язових, підшкірних або інтраперитонеальних ін'єкцій або у вигляді інфузії), ректально (наприклад, у формі супозиторіїв) або локально (наприклад, у вигляді кремів, мазей або пластирів). Тверді, напівтверді або рідкі лікарські засоби згідно з даним винаходом одержують у відповідності зі способами, відомими з попереднього рівня техніки. Лікарські засоби, які підходять для перорального введення, що містять кристалічну форму I солі розувастатину цинку (2:1) формули (I), можуть бути у твердій формі, яка може містити крім активного інгредієнта один або більше ніж один носій або наповнювач (наприклад, лактозу, глюкозу, крохмаль, фосфат кальцію, мікрокристалічну целюлозу), що зв'язує речовину (наприклад, желатин, сорбіт, полівінілпіролідон), розпушувач (наприклад, кроскармелозу, натрієву карбоксиметилцелюлозу, кросповідон), допоміжні агенти, що таблетують (наприклад, стеарат магнію, тальк, поліетиленгліколь, кремнезем або діоксид кремнію) або поверхневоактивні речовини (наприклад, лаурилсульфат натрію). Рідкі лікарські засоби, призначені для перорального застосування, що містять кристалічну форму (I) солі розувастатину цинку (2:1) згідно з даним винаходом, можуть бути у вигляді розчинів, суспензій або емульсій, і можуть містити агенти, що суспендують (наприклад, желатин, карбоксиметилцелюлозу), емульгатори (наприклад, сорбітанмоноолеат), розчинники 7 UA 103544 C2 5 10 15 20 25 30 35 40 45 50 55 60 або рідкі носії (наприклад, воду, масла, гліцерин, пропіленгліколь, етанол), агенти, що регулюють pH (наприклад, ацетатні, фосфатні, цитратні буфери), або стабілізуючі агенти (наприклад, метил 4-гідроксибензоат), змішані з активним інгредієнтом. Лікарські засоби, що містять кристалічну форму I сполуки формули (I), призначені для парентерального застосування, зазвичай є стерильними ізотонічними водними розчинами або суспензією, що можуть містити агент, який регулює pH, і консерванти як допоміжні агенти. Лікарські засоби, у вигляді напівтвердих композицій, що містять кристалічну форму I сполуки формули (I), такі як супозиторії, що містять активний інгредієнт, гомогенно диспергований в напівтвердій основі (наприклад, поліетиленгліколі, маслі какао). Лікарські засоби, що містять кристалічну форму I солі розувастатину цинку (2:1) згідно з даним винаходом, можуть бути приготовлені у вигляді композицій з модифікованим вивільненням, контрольованим вивільненням або тривалим вивільненням. Таким чином, досягається тривала дія або можуть бути збільшені інтервали між введенням лікарського засобу. Лікарські засоби з модифікованим вивільненням, контрольованим вивільненням або тривалим вивільненням одержують у відповідності зі способами, відомими в попередньому рівні техніки. Відповідно до ще одного аспекту даного винаходу запропоновано спосіб одержання лікарських засобів, що містять кристалічну форму I солі розувастатину цинку (2:1) формули (I), при якому зазначену кристалічну форму I солі розувастатину цинку (2:1) змішують з фармацевтично прийнятним носієм і допоміжним агентом і перетворюють одержану таким чином суміш у фармацевтичну лікарську форму з застосуванням способів, відомих в області техніки. Відповідні фармацевтичні прийнятні носії та допоміжні агенти, а також способи приготування розкриті у попередньому рівні техніки (Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co., Easton, USA, 1990). Лікарські засоби, що містять кристалічну форму I сполуки формули (I), що містить активний інгредієнт в дозованих лікарських формах. Відповідно до ще одного аспекту даного винаходу запропоновано спосіб застосування кристалічної форми I солі розувастатину цинку (2:1) формули (I) для лікування захворювань або розладів, що асоціюються з метаболізмом ліпідів, що включають гіперхолестеринемію, гіперліпопротеїнемію, дисліпідемію і атеросклероз. Згідно до ще одного аспекту даного винаходу запропоновано спосіб лікування захворювань або розладів, що асоціюються з метаболізмом ліпідів, що включають гіперхолестеринемію, гіперліпопротеїнемію, дисліпідемію і атеросклероз, при якому пацієнтові, що потребує такого лікування, вводять ефективну кількість кристалічної форми I солі розувастатину цинку (2:1) формули (I). Інші аспекти даного винаходу продемонстровані в наступних прикладах, що жодним чином не обмежують обсяг винаходу. Приклад 1 Аморфна форма солі 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфоніл-метил-аміно)піримідин-5-іл]-(3R,5S)-дигідрокси-гепт-6-енової кислоти і цинку (2:1) 50,0 г (0,09 моль) солі 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфоніл-метил-аміно)піримідин-5-іл]-(3R,5S)-дигідрокси-гепт-6-енової кислоти і трет-бутиламіну розчиняють в суміші 3 3 500 см етилацетату і 153 см дистильованої води шляхом перемішування при температурі 3 25 °C. Після цього в одержану таким чином суміш, яка містить два шари, додають 55 см 2,23 M розчину сульфату цинку (відповідного 0,122 молям ZnSO 4 моногідрату) протягом 15 хвилин при температурі 25 °C. Суміш перемішують протягом години, шари поділяють і органічний шар двічі 3 3 промивають кожен раз 100 см 2,23 M розчину сульфату цинку і, нарешті, 100 см води (під час 3 останнього промивання водою, 12 см етанолу додають до суміші із забезпеченням більш легкого поділу шарів). Органічний шар сушать шляхом азеотропної перегонки у вакуумі при температурі 50 °C і при тиску від 50 до 70 мбар (прибл. 5-7 кПа) в кілька стадій у відповідності з наступною процедурою. 3 На першій стадії розчинник майже повністю відганяють. Залишок розчиняють в 500 см етилацетату при температурі приблизно 30 °C і розчинник вдруге відганяють з одержанням густої, частково отверділої суспензії масою 154 г. Одержаний таким чином продукт 3 гомогенізують з 300 см етилацетату і розчинник знову випарюють до утворення густої суспензії. 3 Таким чином одержують 182,0 г гомогенного продукту у формі суспензії. Її змішують з 200 см етилацетату, і суспензію фільтрують шляхом аспірації. Продукт тричі суспендується на фільтрі, 3 кожен раз в 90 см етилацетату. Отримувані таким чином тверді речовини сушать у вакуумній сушці до тонкого добре розподіленого шару протягом 24 годин при температурі 25 °C і при тиску 8 UA 103544 C2 5 10 15 20 25 30 35 40 45 50 55 60 5 мбар (прибл. 5 кПа), захищаючи від світла. Потім продукт подрібнюють і знову сушать протягом 6 годин при 50 °C при тиску 5 мбар. Таким чином одержують 41,74 г (90 %) продукту. IR (KBr): 3425 (шир.), 2969, 1605, 1547, 1510, 1381, 1230, 1197, 1156, 965, 901, 844, 811,776, -1 576, 567, 520 см . Температура плавлення: плавлення починається при 137 °C. Вміст води: 0,85 %. Приклад 2 Кристалічна форма I солі 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфоніл-метил-аміно)піримідин-5-іл]-(3R,5S)-дигідрокси-гепт-6-енової кислоти і цинку (2:1) 37,0 г (36,0 ммоль) аморфної солі розувастатину цинку (2:1), одержаної відповідно до 3 способу Приклада 1, ретельно подрібнюють в ступці і поступово змішують з 740 см суміші ліддистильована вода в апараті в атмосфері аргону. Суспензію перемішують при температурі 0 °C протягом чотирьох годин. Після цього суспензію фільтрують, тверді речовини п'ять разів 3 промивають на фільтрі кожного разу з суспендуванням в 90 см води при температурі 20-22 °C, і воду ретельно видаляють шляхом аспірації. Одержаний таким чином вологий продукт 3 переносять в апарат, обладнаний змішувачем, поступово додають 740 см охолодженої на льоду дистильованої води, і суспензію перемішують при температурі 0 °C протягом двох годин в 3 атмосфері аргону. Кремоподібну суспензію фільтрували, колбу промивали 100 см дистильованої води, і рідина потім застосовується для промивання відфільтрованої твердої речовини. Одержану таким чином тверду речовину сушать у вакуумній сушці до тонкого добре розподіленого шару протягом 24 годин при температурі 25 °C і при тиску 5 мбар (прибл. 0,5 кПа), захищаючи від світла. Потім продукт подрібнюють і знову сушать протягом 5 годин при 50 °C при тиску 5 мбар. Таким чином, одержують 31,6 г (85 %) продукту. Порошкова дифрактограма продукту представлена на Фіг. 1. Температура плавлення: 119-121 °C. Чистота (відповідно до ВЕРХ): 99,78 %. Вміст води: 5,7 % Приклад 3 Кристалічна форма I солі 7-[4-(4-фторфеніл)-6-ізопропіл-2- (метансульфоніл-метил-аміно)піримідин-5-іл]-(3R,5S)-дигідрокси-гепт-6-енової кислоти і цинку (2:1) 69,0 г (67,2 ммоль) аморфної солі розувастатину цинку (2:1), одержаної відповідно до 3 Прикладу 1, ретельно подрібнюють в ступці і переносять в колбу. 1380 см водного розчину, що містить 0,014 г (0,35 ммоль) гідроксиду натрію поступово додають при температурі 20 °C в атмосфері аргону. Суспензію перемішують при тій же самій температурі протягом 4 годин, 3 фільтрують, двічі промивають на фільтрі кожного разу з 150 см розчину гідроксиду натрію (0,35 3 ммоль/1380 см ) і велику частину води видаляють шляхом аспірації. Одержаний таким чином 3 вологий продукт переносять в апарат, перемішують з 1380 см водного розчину, що містить 0,014 г (0,35 ммоль) гідроксиду натрію, при 20 °C протягом 2 годин. Густу суспензію фільтрують, 3 колбу промивають розчином гідроксиду натрію (0,35 ммоль/1380 см ), який потім застосовують для промивання відфільтрованих твердих речовин. Одержаний таким чином продукт обережно розподіляють в тонкому шарі, сушать у вакуумній сушці протягом 40 годин при 25-27 °C і при тиску 5 мбар, захищаючи від світла. Таким чином, одержують 60,03 г (87 %) продукту, який має рентгенівську дифрактограму, що схожа на дифрактограму продукту, отриманого в Прикладі 2. Температура плавлення: 119-121° C. Чистота (відповідно до ВЕРХ): 99,71 %. Вміст води: 5,4 %. Приклад 4 Кристалічна форма I солі 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфоніл-метил-аміно)піримідин-5-іл]-(3R,5S)-дигідрокси-гепт-6-енової кислоти і цинку (2:1) 0,30 г (29 ммоль) аморфної солі розувастатину цинку (2:1), одержаної відповідно до способу 3 3 Приклада 1, додають до 3 см ізопропілацетату і 3 см води при перемішуванні. Реакційну суміш, яка містить два шари, перемішують протягом 1 тижня при температурі 25 °C, фільтрують і сушать у вакуумній сушці при 25-27 °C і тиску 5 мбар протягом 24 годин, захищаючи від світла. Таким чином, одержують 0,26 г (87 %) продукту, який має рентгенівську дифрактограму, що схожа на дифрактограму продукту, отриманого в Прикладі 2. Температура плавлення: 119-121 °C. 9 UA 103544 C2 ФОРМУЛА ВИНАХОДУ 1. Кристалічна форма І солі розувастатину цинку (2:1) формули І HO COOOH F Zn2+ N O O 5 10 15 S N N 2 , (I) що має порошкову рентгенівську дифрактограму, яка містить специфічні кути дифракції 6,621; 19,089 і 22,466 градусів 2θ, виміряні з застосуванням СuKa-випромінювання. 2. Кристалічна форма І солі розувастатину цинку (2:1), що має порошкову рентгенівську дифрактограму, яка містить специфічні кути дифракції 6,621; 18,756; 19,089; 19,505; 22,466 градусів 2θ, виміряні з застосуванням СuKа-випромінювання. 3. Кристалічна форма І солі розувастатину цинку (2:1), що має порошкову рентгенівську дифрактограму, яка містить специфічні кути дифракції 6,621; 9,920; 11,213; 13,248; 16,127; 16,471; 17,230; 18,756; 19,089; 19,505; 22,101; 22,466 градусів 2θ, виміряні з застосуванням СuKа-випромінювання. 4. Кристалічна форма І солі розувастатину цинку (2:1) формули (І), що має рентгенівську дифрактограму, що показана на Фіг. 1, та такі специфічні дані дифракції: Пік № 2θ d(Å) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 5,584 5,889 6,621 7,038 9,920 11,072 11,213 11,679 12,391 13,248 14,266 15,311 16,127 16,471 17,230 17,936 18,756 19 089 19,505 20,074 15,81321 14,99555 13,33946 12,55036 8,90897 7,98468 7,88447 7,57108 7,13765 6,67775 6,20332 5,78220 5,49159 5,37744 5,14225 4,94151 4,72726 4,64561 4,54752 4,41990 Відносна вологість (%) 22,2 12,1 69,1 5,1 29,4 24,4 29,5 23,6 10,4 29,2 18,7 19,4 31,1 36,6 32,2 17,9 59,1 100 50,5 58,8 Пік № 2θ d(Å) 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 20,738 21,217 21,620 22,101 22,466 22,968 23,499 24,372 25,001 25,751 26,806 27,243 27,828 28,171 29,239 29,885 30,971 31,655 32,635 4,27984 4,18430 4,10713 4,01878 3,95434 3,86898 3,78272 3,64924 3,55888 3,45684 3,32318 3,27079 3,20337 3,16516 3,05194 2,98740 2,88504 2,82424 2,74171 Відносна вологість (%) 25,9 11 11,3 31,4 76,3 18,2 27,4 14 18 6,7 19,7 7,2 7,8 7,2 8,5 4,9 6,5 15,7 13,1 5. Суміш аморфної і кристалічної форми І солі розувастатину цинку (2:1) формули (І). 10 UA 103544 C2 5 10 15 20 25 30 35 40 45 50 55 6. Кристалічна форма І солі розувастатину цинку (2:1), відповідна формулі (І) за будь-яким з пп. 1-5, що містить від 1 до 10 моль, переважно від 1 до 6 моль, води. 7. Спосіб одержання кристалічної форми І солі розувастатину цинку (2:1) формули (І), при якому здійснюють перемішування аморфної солі розувастатину цинку (2:1) в 5-100-кратній, переважно 20-кратній, масі води, при температурі від 0 до 25 °C, переважно від 0 до 5 °C, протягом від 4 до 168 годин, переважно від 4 до 8 годин, виділення твердих речовин і, необов’язково, промивання і сушіння кристалічного продукту. 8. Спосіб одержання кристалічної форми І солі розувастатину цинку (2:1) формули (І), при якому здійснюють перемішування аморфної солі розувастатину цинку (2:1) в 5-100-кратній, переважно 20-кратній, масі води, при температурі від 0 до 25 °C, переважно від 0 до 5 °C, протягом від 2 до 168 годин, переважно протягом від 4 до 8 годин, виділення твердих речовин шляхом фільтрування, промивання твердих речовин водою щонайменше одноразово, перемішування одержаної таким чином твердої маси в 5-100-кратній, переважно 20-кратній, масі води, при температурі від 0 до 25 °C, переважно від 0 до 5 °C, протягом від 1 до 168 годин, переважно протягом від 2 до 4 годин, виділення кристалічного продукту шляхом фільтрування і, необов’язково, промивання і сушіння одержаної в результаті кристалічної форми І солі розувастатину цинку (2:1). 9. Спосіб одержання кристалічної форми І солі розувастатину цинку (2:1) формули (І), при якому здійснюють перемішування аморфної солі розувастатину цинку (2:1) в 5-100-кратній, переважно 20-кратній, масі водного розчину 0,0005-0,01 молярного еквівалента, переважно 0,005 молярного еквівалента, гідроксиду лужного металу, переважно гідроксиду натрію, у розрахунку на молярну кількість солі розувастатину цинку формули (І) протягом від 4 до 168 годин, переважно від 4 до 8 годин, при температурі від 0 до 25 °C, переважно при 20 °C, виділення твердого продукту шляхом фільтрування і, необов’язково, промивання і сушіння продукту. 10. Спосіб одержання кристалічної форми І солі розувастатину цинку (2:1) формули (І), при якому здійснюють перемішування аморфної солі розувастатину цинку (2:1) в 5-100-кратній, переважно 20-кратній, масі водного розчину 0,0005-0,01 молярного еквівалента, переважно 0,005 молярного еквівалента, гідроксиду лужного металу, переважно гідроксиду натрію, у розрахунку на молярну кількість солі розувастатину цинку формули (І), протягом від 4 до 168 годин, переважно від 4 до 8 годин, при температурі від 0 до 25 °C, переважно при 20 °C, виділення твердого продукту шляхом фільтрування, щонайменше одноразове промивання виділеної твердої речовини розчином 0,0005-0,01 молярного еквівалента гідроксиду лужного металу, переважно гідроксиду натрію, в 5-100-кратній масі води, у розрахунку на кількість солі розувастатину цинку (2:1), і перемішування одержаної таким чином твердої речовини в 5-100кратній, переважно 20-кратній, масі водного розчину 0,0005-0,01 молярного еквівалента, переважно 0,005 молярного еквівалента, гідроксиду лужного металу, переважно гідроксиду натрію, у розрахунку на молярну кількість солі розувастатину цинку формули (І), протягом від 1 до 168 годин, переважно від 2 до 4 годин, при температурі від 0 до 25 °C, переважно при 20 °C, виділення твердого продукту шляхом фільтрування і, необов’язково, промивання і сушіння кристалічної форми І солі розувастатину цинку (2:1). 11. Лікарський засіб, що містить терапевтично ефективну кількість кристалічної форми І солі розувастатину цинку (2:1) за будь-яким з пп. 1-6, необов’язково змішану з фармацевтично прийнятним носієм або допоміжним агентом. 12. Спосіб одержання лікарського засобу за п. 13, при якому перетворюють кристалічну форму І солі розувастатину цинку (2:1) за будь-яким з пп. 1-6 або її суміш, одержану з фармацевтично прийнятним носієм або допоміжним агентом, у фармацевтичну лікарську форму. 13. Застосування кристалічної форми І солі розувастатину цинку (2:1) за будь-яким з пп. 1-6 для лікування захворювань або розладів, що асоціюються з метаболізмом ліпідів, що включають гіперхолестеринемію, гіперліпопротеїнемію, дисліпідемію і атеросклероз. 14. Застосування кристалічної форми І солі розувастатину цинку (2:1) за будь яким з пп. 1-6 для приготування лікарських засобів, придатних для лікування розладів або захворювань, що асоціюються з метаболізмом ліпідів, що включають гіперхолестеринемію, гіперліпопротеїнемію, дисліпідемію і атеросклероз. 15. Спосіб лікування захворювань або розладів, що асоціюються з метаболізмом ліпідів, що включають гіперхолестеринемію, гіперліпопротеїнемію, дисліпідемію або атеросклероз, при якому пацієнтові, що потребує такого лікування, вводять лікарський засіб, що містить терапевтично ефективну кількість кристалічної форми солі розувастатину цинку (2:1) за будьяким з пп. 1-6. 11 UA 103544 C2 Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline form s rosuvastatin zinc salt
Автори англійськоюBartha, Ferenc, Kovanyine Lax, Gyorgyi, Volk, Balazs, Barkoczy, Jozsef, Nagy, Kalman, Simig, Gyula, Ruzsics, Gyorgy, Clementis, Gyorgy, Kapui, Imre, Slegel, Peter, Keszthelyi, Adrienn, Szent-Kirallye, Zsuzsanna, Hoffmanne Fekete, Valeria, Imre, Janos
Автори російськоюБарта Ференц, Кованьйине Лакс Дьйорди, Волк Балаж, Баркоци Йожеф, Моровьян Дьордь, Краснаи Дьйордь, Надь Калман, Симиг Дьюла, Ружич Дьйордь, Цлементиш Дьйордь, Капуи Имре, Шлегель Петер, Кестели Адриен, Сент-Киралли Жужанна, Хофманне Фекете Валерия, Имре Янош
МПК / Мітки
МПК: A61P 3/06, A61K 31/505, C07D 239/42
Мітки: форма, кристалічна, солі, розувастатину, цинкової
Код посилання
<a href="https://ua.patents.su/14-103544-kristalichna-forma-i-cinkovo-soli-rozuvastatinu.html" target="_blank" rel="follow" title="База патентів України">Кристалічна форма і цинкової солі розувастатину</a>
Попередній патент: Поглинаючий апарат автозчепу залізничного транспортного засобу
Наступний патент: Спосіб діагностики стану рослини
Випадковий патент: Спосіб ультразвукового телегістологічного дослідження стінки черевної аорти