Похідне 2-ціаноіміноімідазолу, фармацевтична композиція та спосіб одержання сполуки
Номер патенту: 62939
Опубліковано: 15.01.2004
Автори: Фрейне Едді Жан Едгар, Андрес-Гіл Хосе Ігнасіо, Фернандес-Гадеа Франциск Хав'єр
Формула / Реферат
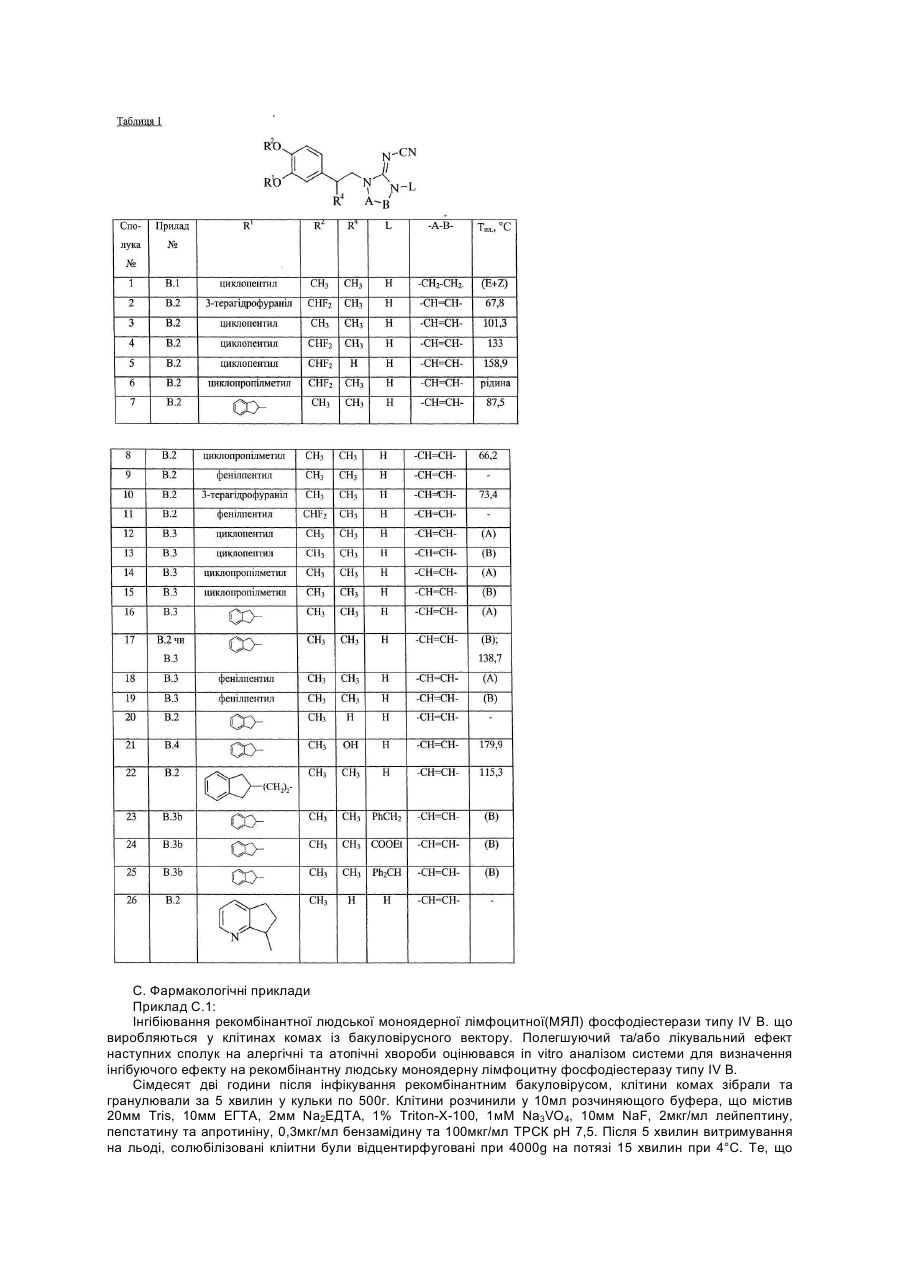
1. Похідне 2-ціаноіміноімідазолу формули (І)
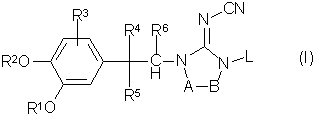
його N-оксид, фармацевтично прийнятна кислотна або основна адитивна сіль, стереоізомерна форма, де:
R1 та R2 кожний незалежно являє собою атом водню, С1-С6алкіл, дифторметил, трифторметил, С3-С6циклоалкіл, насичений п‘яти-, шести- або семичленний гетероцикл, що містить один або два гетероатоми, вибрані із кисню, сірки або азоту, інданіл, 6,7-дигідро-5Н-циклопентапіридиніл, біцикло[2.2.1]-2-гептеніл, біцикло[2.2.1]гептаніл, С1-С6-алкілсульфоніл, арилсульфоніл, або С1-С10-алкіл, заміщений одним або двома замісниками кожний незалежно вибраний із арилу, піридину, тієнілу, фуранілу, інданілу, 6,7-дигідро-5Н-циклопентапіридинілу, С3-С7-циклоалкілу, насиченого п‘яти-, шести- або семичленного гетероциклу, що містить один або два гетероатоми вибрані із кисню, сірки або азоту,
R3 являє собою атом водню, атом галогену, або С1-С6-алкоксигрупу,
R4 являє собою атом водню, атом галогену, або С1-С6-алкіл, трифторметил, С3-С6-циклоалкіл, карбоксильну групу, С1-С4-алкілоксикарбоніл, С3-С6циклоалкіламінокарбоніл, арил або Het1, або
R4 радикал формули:
-O-R7 (a-1), або
-NH-R8 (a-2),
де R7 являє собою атом водню, С1-С6-алкіл, С1-С6-алкіл, заміщений гідроксигрупою, карбоксильну групу, С1-С4-алкілоксикарбонільну групу, аміногрупу, моно- або ди-(С1-С4-алкіл)аміногрупу, арил або Het1,
R8 являє собою атом водню, С1-С6-алкіл, С1-С6-алкіл, заміщений гідроксигрупою, карбоксильну групу, С1-С4-алкілоксикарбонільну групу, аміногрупу, моно- або ди-(С1-С4-алкіл)аміногрупу, арил або Het1,
R5 являє собою атом водню, атом галогену, гідроксигрупу, С1-С6-алкіл, С1-С6-алкоксигрупу, або
R4 та R5 взяті разом можуть утворювати бівалентний радикал формули:
-(СН2)n- (b-1),
-CH2-CH2-O-CH2-CH2- (b-2),
-CH2-CH2-N(R9)-CH2-CH2- (b-3), або
-CH2-CH=CH-CH2- (b-4),
де n = 2, 3, 4 або 5,
R9 являє собою атом водню, С1-С6-алкіл, С1-С6-алкілсульфоніл або р-толуолсульфоніл,
R6 являє собою атом водню, С1-С4-алкіл, або
R4 та R6 взяті разом можуть утворювати бівалентний радикал формули -(СН2)m-, де m = 1, 2, 3 або 4,
-А-В- представляють собою бівалентний радикал формули:
-СR10=CR11- (c-1), або
-СHR10-CHR11- (c-2),
де кожен R10 та R11, незалежно, представляють собою атом водню або С1-С4-алкіл, та
L являє собою атом водню, С1-С6-алкіл, С1-С6-алкілкарбоніл, С1-С6-алкоксикарбоніл, С1-С6-алкіл, заміщений одним або двома замісниками, вибраними із групи, що містить гідроксигрупу, С1-С4-алкоксигрупу, С1-С4-алкоксикарбоніл, моно- або ди-(С1-С4-алкіл)аміногрупу, арил та Het2,
С1-С3-алкеніл, С1-С3-алкеніл, заміщений арилом, піперидиніл, незаміщений або заміщений С1-С4-алкілом або арилС1-С4-алкілом, С1-С6-алкілсульфоніл або арилсульфоніл,
арил являє собою феніл, незаміщений або заміщений одним, двома або трьома замісниками, вибраними із атома галогену, гідроксигрупи, С1-С4-алкілу, С1-С4-алкоксигрупи, С3-С4-циклоалкілу, трифторметилу, аміногрупи, нітрогрупи, карбоксильної групи, С1-С4-алкоксикарбонільної групи та С1-С4-алкілкарбоніламіногрупи,
Het1 являє собою піридиніл, незаміщений або заміщений С1-С4-алкілом, фураніл, незаміщений або заміщений С1-С4-алкілом, тієніл, незаміщений або заміщений С1-С4-алкілкарбоніламіногрупою, гідроксипіридиніл, гідроксипіридиніл, заміщений С1-С4-алкілом або С1-С4-алкокси-С1-С4-алкілом, імідазоліл, незаміщений або заміщений С1-С4-алкілом, тіазоліл, незаміщений або заміщений С1-С4-алкілом, оксазоліл, незаміщений або заміщений С1-С4-алкілом, ізохінолініл, ізохінолініл, заміщений С1-С4-алкілом, хінолініл, незаміщений або заміщений С1-С4-алкілом, морфолініл, піперидиніл, незаміщений або заміщений С1-С4-алкілом, С1-С4-алкілкоксикарбонілом або арилС1-С4-алкілом, піперазиніл, незаміщений або заміщений С1-С4-алкілом, С1-С4-алкілкоксикарбонілом або арилС1-С4-алкілом, та
Het2 являє собою морфолініл, піперидиніл, піперидиніл, заміщений С1-С4-алкілом або арилС1-С4-алкілом, піперазиніл, піперазиніл, заміщений С1-С4-алкілом або арилС1-С4-алкілом, піридиніл, піридиніл, заміщений С1-С4-алкілом, фураніл, фураніл, заміщений С1-С4-алкілом, тієніл або тієніл, заміщений С1-С4-алкілом, С1-С4-алкілкарбоніламіногрупою.
2. Сполука за п. 1, яка відрізняється тим, що R1 та R2 кожен незалежно означає атом водню С1-С6-алкіл, дифторметил, трифторметил, С3-С6-циклоалкіл, насичений п¢яти-, шести- та семичленний гетероцикл, що містить один або два гетероатоми, вибрані із кисню, сірки або азоту, інданіл, біцикло[2.2.1]-2-гептил, біцикло[2.2.1]гептаніл, С1-С6-алкілсульфоніл, арилсульфоніл, або С1-С10-алкіл, заміщений одним або двома замісниками, кожний незалежно вибраний із арилу, піридинілу, тієнілу, фуранілу, С3-С7-циклоалкілу, та насичений п¢яти-, шести- та семичленний гетероцикл, що містить один або два гетероатоми, вибрані із кисню, сірки або азоту.
3. Сполука за будь-яким з пп. 1 або 2, яка відрізняється тим, що R1 та R2 кожен незалежно означає С1-С6-алкіл, С3-С6-циклоалкіл, дифторметил, насичений п¢яти-, шести- та семичленний гетероцикл, що містить один або два гетероатоми, вибрані із кисню, сірки або азоту, переважно тетрагідрофураніл, інданіл або С1-С10-алкіл, заміщений арилом, інданілом, 6,7-дигідро-5Н-циклопентапіридинілом або С3-С6-циклоалкілом.
4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що R4 являє собою С1-С6-алкіл.
5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що R1 являє собою, циклопентил, тетрагідрофураніл, циклопропілметил, 5-фенілпентил, 2-інданілетил, 6,7-дигідро-5Н-циклопета[b]піридиніл або інданіл, та R2 являє собою метил або дифторметил, та R3, R5, R6, R10, R11 та L представляють собою атом водню.
6. Сполука за п. 1, яка відрізняється тим, що сполукою є [1-[2-[4-(дифторметокси)-3-[(тетрагідро-3-фураніл)окси]феніл]пропіл]-1,3-дигідро-2Н-імідазоліл-2-іліден]ціанаміду та [1-[2-[4-(метокси)-3-[(1,3-дигідро-2Н-інден-2-іл)окси]феніл]пропіл]-1,3-дигідро-2Н-імідазоліл-2-іліден]ціанамід, або його N-оксид, стереохімічно ізомерна форма чи фармацевтично прийнятна адитивна сіль.
7. Сполука за будь-яким з пп. 1-6 для використання як лікарського засобу.
8. Сполука за будь-яким з пп. 1-6 для виготовлення медикаментів, корисних для лікування атопічних або астматичних хвороб.
9. Фармацевтична композиція, що містить активний інгредієнт та фармацевтично прийнятний носій, яка відрізняється тим, що як активний інгредієнт містить терапевтично ефективну кількість сполуки, за будь-яким з пп. 1-6.
10. Спосіб одержання сполук за п.1, який відрізняється тим, що проводять циклізацію проміжних сполук формули (ІІ) або їх функціональних похідних, де R1, R2, R3, R4, R5, R6, R10 та R11 визначені у п.1,
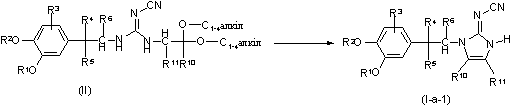
у реакційно інертному розчиннику, в присутності придатної кислоти, із утворенням сполук формули (І-а-1); та, якщо потрібно, проводять перетворення сполук формули (І) одна в одну за допомогою різних загальновідомих методів, та у подальшому, якщо це потрібно, перетворюють їх у терапевтично активні нетоксичні кислотні адитивні солі обробкою кислотою, або у терапевтично активні нетоксичні основні адитивні солі обробкою основою, чи навпаки, проводять перетворення кислотних адитивних солей у вільні основи обробкою лугом, або проводять перетворення основних адитивних солей у вільні кислоти обробкою кислотою, та якщо потрібно, одержують стереохімічно ізомерні форми чи їх N-оксиди.
Текст
Даний винахід відноситься до похідних 2-ціаніміноімідазолу, що мають здатність інгібувати фосфодіестеразу IV(PDE IV) та цитокін, та їх способу отримання, далі даний винахід відноситься до композицій, що включають вказані сполуки, та їх використання в якості медичних препаратів. В заявці Сміткляйн Бічам Корпорейшн WO 95/05386, опублікованій 23 лютого 1995 року, розкрито фенетиламінові похідні, такі як N-[2-(3-циклопентилокси-3-метоксифеніл)етил]імідодикарбамід та N'-ціано1-[2-(3-циклопентилокси-4-метоксифеніл)етил]карбоксімідамід, придатних для лікування хворобливих станів викликаних фосфодіестеразою IV. Тут також в загальному розкрито похідні фенетиламіну, що містять ціаногуанідинову частину. Сполуки даного винаходу відрізняються по структурі від відомих інгібіторів фосфодіестерази IV(PDE IV) тим фактом, що вони незмінно містять 2-ціаноімідоімідазольну частину. Вони мають терапевтичну корисність при лікуванні хворобливих станів, викликаних ненормальною ферментативною або каталітичною активністю фосфодіестерази IV(PDE IV), та/або хворобливих станів, викликаних фізіологічно шкідливим надлишком цитокінів, зокрема алергій, атопічних та запалювальних хвороб. Представлені сполуки також мають незначний гастрокишковий побічний ефект, що завжди присутній у інгібіторів фосфодіестерази IV(PDEIV). Представлений винахід відноситься до похідних 2-ціаноіміноімідазолу загальної формули: їх N-оксидів, адитивних солей фармацевтично прийнятних кислот або основ, стереоізомерних форм, де: R1 та R2 кожний незалежно представляє атом водню, С1-С6алкіл, дифторметил, трифторметил, С3-С6циклоалкіл, насичений п'яти-, шести- або семичленний гетероцикл, що містить один або два гетероатоми, вибрані із кисню, сірки або азоту, інданіл, 6,7-дигідро-5Н-циклопентапіридиніл, біцикло[2.2.1]-2-гептеніл, біцикло[2.2.1]гептаніл, С1-С6-алкілсульфоніл, арилсульфоніл, або С1-С10-алкіл, заміщений одним або двома замісниками кожний незалежно вибраний із арилу, піридину, тієнілу, фуранілу, інданілу, 6,7-дигідро5Н-циклопентапіридинілу, С3-С7-циклоалкілу, насиченого п'яти-, шести- або семичленного гетероциклу, що містить один або два гетеро атоми, вибрані із кисню, сірки або азоту; R3 представляє собою атом водню, атом галогену, або С1-С6-алкоксигрупу; R4 представляє собою атом водню, атом галогену, або С1-С6-алкіл, трифторметил, С3-С6-циклоалкіл, карбоксильну групу, С1-С4-алкілоксикарбоніл, С3-С6циклоалкіламінокарбоніл, арил або Het1, або R4 радикал формули: -O-R7(а-1), або -NH-R8(а-2), де R7 представляє собою атом водню, С1-С6-алкіл, С1-С6-алкіл заміщений гідроксигрупою, карбоксильну групу, С1-С4-алкілоксикарбонільну групу, аміногрупу, моно- або ди-(С1-С4-алкіл)аміногрупу, арил або Het1; R8 представляє собою атом водню, С1-С6-алкіл, С1-С6-алкіл, заміщений гідроксигрупою, карбоксильну групу, С1-С6-алкілоксикарбонільну групу, аміногрупу, моно- або ди-(С1-С4-алкіл)аміногрупу, арил або Het1; R5 представляє собою атом водню, атом галогену, гідроксигрупу, С1-С6-алкіл, С1-С6-алкоксигрупу, або R4 та R5 взяті разом можуть утворювати бівалентний радикал формули: -(СН2)n-(b-1), -СН2-СН2-О-СН2-СН2-(b-2), -CH2-CH2-N(R9)-CH2-CH2-(b-3), або -СН2-СН=СН-СН2-(b-4), де n = 2, 3, 4 або 5; R9 представляє собою атом водню, C1-С6-алкіл, С1-С6-алкілсульфоніл або р-толуолсульфоніл; R6 представляє собою атом водню, С1-С4-алкіл, або R4 та R6 взяті разом можуть утворювати бівалентний радикал формули -(СН2)m -, де m = 1, 2, 3 або 4; -А-В- представляють собою бірадикал формули: -CR10=CR11-(с-1),або -CHR10-CHR11-(с-2), де кожен R10 та R11, незалежно, представляють собою атом водню або С1-С4-алкіл, та L представляє собою атом водню, С1-С6-алкіл, С1-С6-алкілкарбоніл, С1-С6-алкоксикарбоніл, С1-С6-алкіл, заміщений одним або двома замісниками, вибраними із групи, що містить гідроксигрупу, С1-С4алкоксигрупу, С1-С4-алкоксикарбоніл, моно- або ди-(С1-С4-алкіл)аміногрупу, арил та Het2, С1-С3-алкеніл, С1С3-алкеніл, заміщений арилом, піперидиніл, піперидиніл, заміщений С1-С4-алкілом або арил С1-С4-алкілом, С1-С6-алкілсульфоніл або арилсульфоніл; арил представляє собою феніл, або феніл, заміщений одним, двома або трьома замісниками, вибраними із атому галогену, гідроксигрупи, С1-С4-алкілу, С1-С4-алкоксигрупи, С3-С4-циклоалкілу, трифторметилу, аміногрупи, нітрогрупи, карбоксильної групи, С1-С4-алкоксикарбонільної групи та С1-С4алкілкарбоніламіногрупи; Het1 представляє собою піридиніл, незаміщений або заміщений С1-С4-алкілом, фураніл, незаміщений або заміщений С1-С4-алкілом, тієніл, незаміщений або заміщений С1-С4-алкілкарбоніламіногрупою, гідроксипіридиніл, гідроксипіридиніл, заміщений С1-С4-алкілом або С1-С4-алкокси- С1-С4-алкілом, імідазоліл, незаміщений або заміщений С1-С4-алкілом, тіазоліл, незаміщений або заміщений С1-С4алкілом,оксазоліл, незаміщений або заміщений С1-С4-алкілом, ізохінолініл, ізохінолініл, заміщений С1-С4алкілом, хінолініл, незаміщений або заміщений С1-С4-алкілом, морфолініл, піперидиніл, незаміщений або заміщений С1-С4-алкілом, С1-С4-алкілкоксикарбонілом або арилС1-С4-алкілом, піперазиніл, незаміщений або заміщений С1-С4-алкілом, С1-С4-алкілкоксикарбонілом або арилС1-С4-алкілом, та Het2 представляє собою морфолініл, піперидиніл, незаміщений або заміщений С1-С4-алкілом або арилС1-С4-алкілом, піперазиніл, незаміщений або заміщений С1-С4-алкілом або арилС1-С4-алкілом, піридиніл, незаміщений або заміщений С1-С4-алкілом, фураніл, незаміщений або заміщений С1-С4-алкілом, тієніл, незаміщений або заміщений С1-С4-алкілом, С1-С4-алкілкарбоніламіногрупою. Деякі сполуки формули (І) можуть також існувати в декількох таутомерних формах. Такі форми, не дивлячись на те, що явно не розкриті в вищевказаній формулі, мається на увазі, що вони включені в даний винахід. Зокрема, сполуки формули (І), де L атом водню, можуть існувати у їх відповідних таутомерних формах. В R1 та R2 являють собою насичений п'яти-, шести- або семичленний гетероцикл, що містить один або два гетероатоми, вибрані із кисню, сірки або азоту, дані гетероцикли можуть бути вибрані з групи гетероциклів, таких як, наприклад, тетрагідрофураніл, діоксоланіл, пірролідиніл, морфолініл, піперидиніл, піперазиніл та тетрогідропіраніл. Вказані гетероциклічні радикали приєднані до атому кисню або С1-С10алкільного радикалу будь-яким атомом вуглецю або, якщо вказано, атомом азоту. Також для R1 та R2, термін 6,7-дигідро-5Н-циклопентапіридиніл, може вживатися як 6,7-дигідро-5Нпіридиніл, це вказує на присутність 6,7-дигідро-5Н-циклопента[b]піридину або 6,7-дигідро-5Нциклопента[с]піридину та може бути приєднаний до залишку молекули будь-яким аліфатичним або ароматичним атомом вуглецю. При використанні в даній заявці, термін "галоген" в загальному означає фтор, хлор, бром та йод, термін "С1-С4-алкіл" вказує на наявність розгалужених та нерозгалужених насичених вуглеводневих ланцюгів, що містять від 1 до 4 атомів вуглецю, таких як, наприклад, метил, етил, 1-метилетил, 1,1диметилетил, пропіл, 2-метилпропіл та бутил, термін "С1-С6-алкіл" вказує на наявність С1-С4-алкільних радикалів або їх вищих гомологів, що мають п'ять або шість атомів вуглецю, такі як, наприклад, 2метилбутил, пентил, гексил та подібні, термін "С1-С6-алкіл" вказує на наявність С2-С6-алкільних радикалів або їх нижчого гомолога, що має один атом вуглецю, такий як, наприклад, метил, термін "С1-С10-алкіл" вказує на наявність С1-С6-алкільних радикалів або їх вищих гомологів, що мають від семи до десяти атомів вуглецю, такі як, наприклад, гептил, октил, децил, 1-метилгексил, 2-метилгептил та тому подібні, термін "С3-С6-алкеніл" вказує на наявність вуглеводневих радикалів з розгалуженими та нерозгалуженими ланцюгами, що містять один подвійний зв'язок та мають від трьох до шести атомів вуглецю, такі як, наприклад, 2-пропеніл, 3-бутеніл, 2-бутеніл, 2-пентеніл, 3-пентеніл, З-метил-2-бутеніл та пому подібні, атоми вуглецю у вказаних С3-С6-алкенілах, якими вони приєднані до атому азоту, звичайно насичені, термін "С3-С6-циклоалкіл" звичайно означає циклопропіл, циклобутил, циклопентил та циклогексил, термін "С1-С4-алкандиїл" вказує на наявність насиченого бівалентного вуглеводневого радикалу з розгалуженим та нерозгалуженим ланцюгом, що містить від одного до чотирьох атомів вуглецю, таких як, наприклад, метилен, 1,2-етандиїл, 1,1-етандиїл, 1,3-пропандиїл, 1,2-пропандиїл, 1,4-бутандиїл, 2-метил-1,3пропандиїл та тому подібних. При використанні вищевказаних визначень та далі описі, галоС1-С4-алкандиїл означає моно-або полігалогензаміщенийС1-С4-алкандиїл, зокрема, С1-С4-алкандиїл заміщений одним або більше атомами фтору. Адитивні солі фармацевтично прийнятних кислот, як визначено вище, вказує на те, що сполука у формі солі з кислотою, яка може бути звичайно отримана взаємодією основної форми сполуки формули (І) з придатними кислотами, такими як неорганічні кислоти, наприклад, галогенводневі кислоти, а саме хлороводнева або бромоводнева, сірчана кислота, азотна кислота, фосфорна кислота та подібні кислоти, або органічні кислоти, такі як, наприклад, оцтова кислота, гідрокиоцтовакислота, пропіонова кислота, молочна кислота, піровиноградна кислота, щавелева кислота, малонова кислота, янтарна кислота, малеїнова кислота, фумарова кислота, яблочна кислота, винна кислота, лимонна кислота, метансульфонова кислота, етансульфонова кислота, бензолсульфонова кислота, п-толуолсульфонова кислота, цикламінова кислота, саліцилова кислота, п-аміносаліцилова, памоїнова кислота та подібні кислоти. Навпаки, вказані сполуки із форми адитивної солі з кислотою може бути переведено в форму вільної основи взаємодією з придатною основою. Сполуки формули (І), що містять кислий протон, можуть також бути перетворені в їх солі з нетоксичними металами або амінами, взаємодією з придатними органічними або неорганічними основами. Придатні адитивні солі з основами включають, наприклад, амонієві солі, солі лужних та лужноземельних металів, таких як літій, натрій, калій, магній, кальцій та тому подібні, адитивні солі з органічними основами, такими як бензатін, N-метил-D-глікамін, гідрабамін, та адитивні солі з амінокислотами, такими як, наприклад, агрінін, лізин та тому подібні. Термін "адитивні солі" включає також гідрати та адитивні сольватні форми які можуть утворювати сполуки формули (І). Приклади таких форм включають гідрати, алкоголяти та тому подібні. Під N-оксидними формами сполук формули (І) розуміють ті сполуки формули (І) у яких один або декілька атомів азоту окислено до так званого N-оксиду. Термін "стереохімічно ізомерні форми", як тут він використовується, визначає всі можливі ізомерні форми, які сполуки формули (І) можуть утворювати. Якщо інше не вказано або не визначено, то хімічні формули сполук вказують на суміш всіх можливих стереохімічно ізомерних форм, вказані суміші містять всі діастереомери та енантіомери основної молекулярної структури. Зокрема, хіральні центри мають R- або Sконфігурацію, a = N-CN та заміщені С3-С6-алкенільні залишки можуть мати Z- Е-конфігурацію. Кожен раз при використанні нижче, термін "сполуки формули (І)" включає також N-оксидні форми, фармацевтично прийнятні адитивні солі з кислотами або фармацевтично прийнятні адитивні солі з основами та всі стереоізомерні форми. Деякі сполуки формули (І) та деякі проміжні сполуки даного винаходу можуть містити асиметричний атом вуглецю. Стереохімічно чисті ізомерні форми вказаних сполук та вказаних проміжних сполук можуть бути отримані загальновідомими методами. Наприклад, діастереомери можуть бути розділені фізичними методами, такими як селективна кристалізація або хроматографія, наприклад, протиточне розділення, рідинна хроматографія та тому подібні методи. Енантіомери можуть бути отримані з рацемічної суміші при попередньому перетворенні вказаної рацемічної суміші придатним розділяючим агентом, таким як, наприклад, хіральні кислоти, в суміш діастереомерних солей або сполук, далі фізично розділяють вказані суміші діастереомерних солей або сполук, наприклад селективною кристалізацією або хроматографією, наприклад, рідинною хроматографією та тому подібними методами, в кінці перетворюють вказані розділені діастереомерні солі або сполуки у відповідні енантіомери. Стереохімічно чисті ізомерні форми можуть також бути отримані при утворенні з стереохімічно чистих ізомерних форм придатних проміжних сполук та вихідних матеріалів, що зумовлюють стереоспецифічне протікання реакції. Чисті та змішані стереохімічно ізомерні форми сполуки формули (І) також включені в даний винахід. Альтернативний спосіб розділення енантіомерних форм сполук формули (І) та інтермедіатів включає рідинну хроматографію, зокрема рідинну хроматографію з використанням хіральної стаціонарної фази. Особлива група сполук включає такі сполуки формули (І), де R1 та R2 кожен незалежно означає атом водню С1-С6-алкіл, дифторметил, трифторметил, С3-С6-циклоалкіл, насичений п'яти-, шести- та семичленний гетероцикл, що містить один або два гетероатоми вибрані із кисню, сірки або азоту, інданіл, біцикло[2.2.1]-2-гептил, біцикло[2.2.1]гептаніл, С1-С6-алкулсульфоніл, арилсульфоніл, або С1-С10-алкіл, заміщений одним або двома замісниками, кожний незалежно вибраний із арилу, піридинілу, тієнілу, фуранілу, С3-С7-циклоалкілу та насичених п'яти-, шести- та семичленний гетероцикл, що містить один або два гетероатоми вибрані із кисню, сірки або азоту. Найбільш цікаві ті сполуки формули (І), де R1 та R2 кожен незалежно означаєС1-С6-алкіл, С3-С6циклоалкіл, дифторметил, насичений п'яти-, шести- та семичленний гетероцикл, що містить один або два гетероатоми вибрані із кисню, сірки або азоту, переважно тетрагідрофураніл, інданіл або C1-C10-алкіл, заміщений арилом, інданілом, 6,7-дигідро-5Н-циклопентапіридинілом або С3-С6-циклоалкілом. Також цікаві ті сполуки формули (І), де R5 представляє собою атом водню та R4 представляє собою атом водню, гідроксигрупу або С1-С6-алкіл, зокрема R4 представляє собою метильну групу. Інша цікава група включає ті сполуки формули (І), де L представляє собою атом водню, C1-С6алкоксикарбоніл, С1-С6-алкіл заміщений одним або двома фенільними кільцями. Особливі сполуки це ті сполуки формули (І), де R1 представляє собою, циклопентил, тетрагідрофураніл, циклопропілметил, 5-фенілпентил, 2-інданілетил, 6,7-дигідро-5Н-циклопета[b]піридиніл або інданіл, та R2 представляє собою метил або дифторметил. Переважні сполуки це ті особливі сполуки, де R3, R5, R6, R10, R11 та L представляють собою атом водню. Найбільш переважні наступні сполуки: [1-[2-[4-(дифторметокси)-3-[(тетрагідро-3-фураніл)окси]феніл]пропіл]-1,3-дигідро-2Н-імідазоліл-2іліден]ціанамід та [1-[2-[4-(метокси)-3-[(1,3-дигідро-2Н-інден-2-іл)окси]феніл]пропіл]-1,3-дигідро-2Німідазоліл-2-іліден]ціанамід, їх N-оксиди, їх стереохімічно ізомерні форми та їх фармацевтично прийнятні адитивні солі. Кожен раз при використанні нижче, радикали від R1 до R11, Y, -А-В- та L мають значення, як визначено для сполук формули (І), якщо не вказано інше. Сполуки формули (І), де -А-В- радикал формули (с-1) та L атом водню, вказані сполуки представлені формулою (І-а-1), можуть бути зручно отримані циклізацією проміжних сполук формули (II) або їх функціональних похідних в присутності придатних кислот, таких як, наприклад, хлороводнева кислота. Вказана циклізація, може проводитися в реакційно інертному розчиннику, такому як, наприклад, тетрагідрофуран(ТГФ) або 1,4-діоксан, або їх суміші. Перемішування та нагрівання підвищують швидкість реакції. В даному та наступних прикладах отримання, продукт реакції може бути виділений з реакційного середовища, при необхідності, з подальшою очисткою загальновідомими методами, такими як, наприклад, екстракція, кристалізація, розтиранням та хроматографією. Зокрема, сполуки формули (І-а-1), де R5-гідроксигрупа, вказані сполуки представлені формулою (І-а-11), можуть бути отримані циклізацією проміжних сполук формули (II-1), де Р атом водню або, переважно, триметилсілільна захисна група, або їх функціональна похідна, способом аналогічним до описаного способу отримання сполук формули (І-а-1) з проміжних сполук формули (II). Сполуки формули (І), де -А-В- радикал формули (с-2) та L представляє собою атом водню, вказані сполуки представлені формулою (І-а-2), можуть бути отримані циклізацією проміжних сполук формули (III) або їх функціональних похідних в присутності придатних реагентів, таких як, наприклад, диметилціанокарбонімідодитіоат або дифеніл-N-ціанокарбонімідат. Альтернативно, сполуки формули (І) можуть бути отримані реакцією металоорганічних проміжних сполук формули (IV), де М відповідний метал або металокомплексний йон, такий як, наприклад, Li+, (MgBr)+, В(ОН)2+ або Sn(СНз)з+ в реакційно-інертному розчиннику з придатним похідним 2ціаноіміноімідазолу формули (V), W 1 може також бути ціанідним радикалом, маючи на увазі, що проміжна сполука формули (IV) являється реактивом Гріньяра. Вказана реакція може проходити в реакційно-інертному розчиннику, такому як, наприклад, диметоксиетан, тетрагідрофуран або діетиловий ефір. Перемішування та нагрівання підвищують швидкість реакції. У випадку проміжної сполуки формули (V), де L заміщено придатною захисною групою, використовують вказану реакцію, сполук формули (І), де L атом водню, вказані сполуки представлені сполуками формули (I-а), можуть бути отримані використовуючи відомі реакції зняття захисних груп. Сполуки формули (І) можуть також бути перетворені в їх похідні відомими методами трансформування функціональних груп. Наприклад, сполуки формули (І), де L інший ніж атом водню, вказані сполуки представлені формулою (І-b), можуть бути отримані взаємодією сполук формули (l-а) з L'-W2 (VI), де V такий як визначено L для сполук формули (І) окрім атому галогену та W2 реакційно відхідна група така як, наприклад, атом галогену. Також можуть використовуватись відомі реакції перетворення сполук формули (l-а) в сполуки формули (І-b). Сполуки формули (І) також можуть бути перетворені у відповідні N-оксидні форми, наступними відомими методами для перетворення тривалентного атому азоту в його N-оксидну форму. Вказані реакції N-оксидування можуть в загальному відбуватися при взаємодії вихідних сполук формули (І) з 3-феніл-2(фенілсульфоніл)оксазірідіном або з придатним органічним або неорганічним пероксидом. Придатні неорганічні пероксиди включають, наприклад, пероксид водню, пероксиди лужних металів або лужноземельних металів, а саме пероксид натрію, пероксид калію, придатний органічний пероксид може включати пероксикислоти, такі як, наприклад, бензолкарбоперокси кислота або галоген заміщена бензолкарбоперокси кислота, наприклад, 3-хлорбензолкарбоперокси кислота, пероксиалканові кислоти, наприклад, пероксиоцтова кислота, алкілгідропероксиди, наприклад, трет-бутилгудропероксид. Придатними розчинниками є, наприклад, вода, нижчі спирти, наприклад, етанол та тому подібні, вуглеводні, наприклад, толуол, котони, наприклад, 2-бутанон, галогеновані вуглеводні, неприклад, дихлорметан, та суміш таких розчинників. Проміжні сполуки, згадані вище, можуть бути отримані відомими середньому спеціалісту методами. Зокрема, проміжні сполуки формули (II) можуть бути отримані спочатку взаємодією аміну формули (VII) з диметилціанокарбонілімідодитіонатом або дифенілціанокарбонілімідатом або його функціональним похідним. Вказану реакцію зручно проводити в реакційно інертному розчиннику, такому як, наприклад, дихлорметан, бензол або толуол, при необхідності охолоджуючи на льодяній бані, в присутності основи, такої як, наприклад, N,N-диетилетанамін або натрію бікарбонат. Так отримані проміжні сполуки можуть далі взаємодіяти з проміжною сполукою формули (VIII) або її функціональним похідним, з утворенням проміжної сполуки формули (II). Вказану реакцію зручно проводити в реакційно-інертному розчиннику, такому як, наприклад, N,N-диетилетанамін, та, необов'язково, в присутності каталізатора такого як, наприклад, N,N-диметилпіридинамін. Перемішування та підвищення температури може підняти швидкість реакції. Альтернативно, вказана вище реакція може бути проведена в зворотному порядку, а саме, спочатку реагує проміжна сполука формули (VIII) з диметлціанокарбонілімідодитіонатом або дифенілціанокарбонілімідатом або його функціональним похідним, та далі взаємодія так отриманої проміжної сполуки з аміном формули (VII). Проміжні сполуки формули (III), де R11 представляє собою атом водню, вказані проміжні сполуки представлені формулою (III-1), можуть бути отримані спочатку взаємодією аміну формули (VII) з ціановим похідним формули (IX), де W3 придатна група, що відходить, така як, наприклад, галоген, в присутності основи, такої як, наприклад, карбонат натрію, в реакційно-інертному розчиннику, такому як, наприклад, N,N-диметилформамід. Далі ціанідна частини таким чином отриманої проміжної сполуки, може бути відновлена використовуючи придатний відновлюючий агент, такий як, наприклад, нікель Ренея, з отриманням таким чином, проміжної сполуки формули (III-1). Деякі проміжні сполуки формули (VII) були описані в WO 92/00968, WO 93/15044 та WO 93/15045. Зокрема проміжні сполуки формули (VII) можуть бути отримані взаємодією проміжної сполуки формули (X), де W4 придатна група, що відходить, така як, наприклад, галоген, з проміжною сполукою формули (XI), де М відповідний йон металу або металокомплексний йон, такий як, наприклад, Li+, (MgBr)+, та Р придатна захисна група, така як, наприклад, (1,1-диметилетил)оксикарбоніл. Таким чином, з отриманої захищеної проміжної сполуки формули (VII) далі може бути знято захисні групи відомими середньому спеціалісту методами, такими як, наприклад, кислотний гідроліз. Проміжна сполука формули (VII), де R6 представляє собою атом водню, вказані проміжні сполуки представлені формулою (VII-1), можуть бути отримані відновленням ненасичених зв'язків вуглець - азот в проміжних сполуках формули (XII) придатним відновлюючим агентом, таким як, наприклад, борантетрагідрофурановий комплекс, літійалюміній гідрид, або водень в присутності каталізатора, такого як, наприклад, нікель Ренея. Ціанідний залишок в проміжних сполуках формули (XII) може бути також заміщений його функціональними похідними, такими як, наприклад, оксимний залишок. Деякі проміжні сполуки формули (XII) описані в WO 92/00968, WO 93/15044, WO 93/15045. Зокрема, проміжні сполуки формули (XII), де R5 захищена гідроксигрупа та R4 атом водню, вказані проміжні сполуки представлені формулою (XII-1), можуть бути зручно отримані взаємодією альдегіду формули (XIII) з реагентом формули (XIV) або його функціональним похідним, де Р захисна група, така як, наприклад, триметилсілільна та тому подібні, в реакційно-інертному розчиннику, такому як, наприклад, дихлорметан, та в присутності каталітичної кількості йодиду цинку (Znl2) або його функціонального похідного. Вказані проміжні сполуки формули (XII-1) можуть далі взаємодіяти, як описано вище, з утворенням в кінці сполуки формули (І), де R5 представляє собою гідроксигрупу. Альдегіди формули можуть бути приготовані аналогічно до процедури, описаній Міцумото Ойо(Mitsumoto Оуо) в Synthethis, 1 - 28, 1981. Деякі сполуки формули (1) та деякі проміжні сполуки відповідно даному винаходу можуть містити, як мінімум, один асиметричнй вуглецевий атом. Чисті стереоізомери вищевказаних сполук та вищевказаних проміжних сполук можуть бути отримані шляхом процедур, що відомі з рівня техніки. Наприклад, діастереомери можна розділити фізичними методами, такими як селективна кристалізація або хроматографічними методами, наприклад підрахованого розподілення потоків, рідкофазна хроматографія та подібні методи. Вільні енантіомери отримують з рацемічних суміш шляхом переведення вихідної рацемічної суміші в суміш діастереомерів відповідним агентом, наприклад, хіральною кислотою, з послідуючим розділенням суміші діастереомерів фізичними методами, такими як селективна кристалізація або хроматографічними методами, наприклад підрахованого розподілення потоків, рідкофазна хроматографія та подібними методами, і, нарешті, переведенням діастереомерних солей в відповідні енантіомери. Чисті стереоізомери відповідних сполук формули (1) можуть бути отримані, виходячи з чистих стереоізомерів початкових сполук та проміжних сполук, дотримуючись стереоспецифічності реакцій, що проводяться. Чисті стереоізомери сполук формули (1) та їх суміші включаються у обсяг даного винаходу. Сполуки формули (1), їх N-оксиди, їх фармацевтично прийнятні адитивні солі з кислотами та основами, стереоізомери сполук формули (1) є потенційними інгібіторами ізоферментів фосфодіестерази(ФДЕ, або PDE) сімейства IV (цАМФ-специфічне сімейства). цАМФ(циклічний 3',5'-аденозинмонофосфат) являє собою ключовий вторинний месенджер, концентрація якого впливає на діяльність деяких клітин шляхом активування ферментів кіназ. Фосфодіестераза IV(PDE IV) гідролізує цАМФ до його неактивного метаболіту - 5'-монофосфату. Таким чином, інгібування фосфодіестерази IV(PDE IV) веде до підвищення рівня цАМФ в деяких клітинах, таких як гладкі клітини дихальної мускулатури та численні запальні клітини, тобто деякі лімфоцити, наприклад базофіли, нейтрофіли та еозінофіли, моноцити та клітини молочної залози. Деякі алергічні, атопічні на запальні хвороби, як передбачають, є наслідком більшої, ніж нормальної концентрації фосфодіестерази IV(PDE IV), наслідком якої є низька концентрація цАМФ, і таким чином, до гіперчутливості вражених клітин до зовнішніх збуджувачів(як приклад такої гіперчутливості можна навести надлишкове вивільнення гістаміну базофілами та клітинами молочної залози і надмірне утворення супероксидного аніон-радікалу еозінофілами). Таким чином, сполуки даного винаходу мають властивості потенційних інгібіторів фосфодіестерази IV(PDE IV) та можуть бути використані для попередження та/або лікування алергічних, атопічних та запальних хвороб. Функціональними ефектами інгібіторів фосфодіестерази IV(PDE IV) є, наприклад, релаксація гладких клітин дихальної мускулатури, бронходиляція, інгібування агрегації тромбоцитів та інгібування вивільнення медіатору білих кров'яних тілець. Прикладами алергічних захворювань є бронхіальна астма, шеіліт, кон'юктивіт, контактний дерматит та екзема, подразнююча хвороба кишок, дегідроформна екзема, уртікарія, васкуліт, вульвіт; прикладами атопічних захворювань є дерматит і екзема, астма, алергічний риніт; та пов'язані захворювання, наприклад, псоріаз та інші проліферативні захворювання. Даний винахід також стосується сполук формули (1), що визначені вище, для використання у медицині, зокрема для використання в медицині для лікування атопічних хвороб та як антиастматичні засоби. Таким чином, сполук формули даного винаходу можуть бути використані для виготовлення медпрепаратів для лікування атопічних та астматичних хвороб, зокрема атопічного дерматиту. Інгібуюча активність фосфодіестерази IV(PDE IV) сполук формули (1) може бути продемонстрована результатами тесту "Інгібування фосфодіестерази IV(PDE IV) рекомбінантних моноядерних лімфоцитів людини(МЛЛ), продукованої в клітинах комахи з вектором бакуловірусу." Деякі тести in vivo та in vitro можуть бути використані для демонстрації корисності сполук формули (1) для лікування вищезгаданих алергічних, атопічних та запальних хвороб. Такими тестами є "Бронхоконстрикція трахеї морської свинки in vitro", „Бронхоконстрикція трахеї морської свинки in vivo” та тести in vivo. "Піннальне запалення у миші, індуковане арахідонової кислотою", "Запалення вуха у миші, індуковане ТРА", Гіперчутливість сповільненого типу у миші". Далі, сполуки даного винаходу мають дуже низький рівень активності по відношенню до інгібування ізоферментів фосфодіестераз сімейства III(цГМФ-інгібуюче сімейство). Так, інгібування фосфодіестерази III(PDE III) веде до підвищення рівню цАМФ в кардіальному м'язі, таким чином, викликаючи ефект скорочующої сили серця, так само, як і релаксацію серця. В лікування вищеописаних аергічних, атопічних та запальних хвороб, карбіоваскулярні ефекти, ясна річ, є небажаними. Оскільки сполуки даного винаходу інгібують фосфодіестеразу IV(PDE IV) при значно нижчий концентрації, ніж фосфодіестеразу III(PDE III), їх використання в терапії піддається коригуванню для виключення кардіоваскулярних ефектів. Інгібітори фосфодіестерази IV(PDE IV), що відомі з рівня техніки, часто викликають небажані ефекти на шлунково-кишечний тракт. Більшість сполук даного винаходу, напроти, мають слабку дію на шлунковокишечний тракт, що може бути показано в тесті "Шлункове спорожнення калорійної їжі в щурів". Назви фосфодіестераза IV(PDE IV) та фосфодіестераза III(PDE III), використані тут, відносяться до класифікації Біво (J. F. Beavo) та Рейфснайдера (D. Y. Reifsnyder), TIPS Review, квітень 1990, с. 150 - 155. Сполуки даного винаходу мають також активність по відношенню до інгібуванню цитокініну. Цитокіном є будь-який поліпептид, що секретується клітиною та впливає на функції інших клітин шляхом міжклітинної взаємодії при імунному або запальному відклику. Прикладами цитокінів є монокіни і лімфокіни, вони можуть продукуватися широким колом клітин. Звичайно вказується, що монокін продукується і секретується моноядерними клітинами, такими як монофаги та моноцити, але може продукуватися і іншими клітинами, наприклад, клітини-кілери, фібробласти, базофіли, нейтрофіли, ендотеліальні тільця, астроцити мозку, клітини кісткового мозку, епідермальні кератиноцити, та β-лімфоцити. Звичайно також вказується, що лімфокіни продукуються і секретуються лімфоцитами. Прикладами цитокінів є інтерлейкін1(IL-1), інтерлейкін-2(IL-2), інтерлейкін-6(IL-6), інтерлейкін-8(IL-8), альфа-фактор некрозу пухлин(αTNF) та бета-фактор некрозу пухлин (βTNF). Бажаною є селективне інгібування цитокіну альфа-фактору некрозу пухлин(αTNF). Надмірне або нерегульоване вивільнення TNF впливає на розвиток багатьох хвороб, включаючи ревматоїдний артрит, ревматоїдний спондиліт, остеоартрит, артрит гуті, інші артричні стани; сепсис, септичний шок, ендотоксичний шок, грам-негативний сепсис, синдром токсичного шоку, синдром дихального розладу дорослих, церебральна малярія, хронічна запальна хвороба легенів, силікоз, легеневий саркоідоз, хвороба розм'якшенння кісток, захворювання, при яких підвищується проникність тканин для крові, реакція відторгнення пересаджених тканин, лихоманка та інфекторні міалгії, такі як інфлуенца, вторинна кахексія до інфекції або злоякісності, вторинна кахексія до синдрому набутого імунодефіциту(СНІД), синдром набутого імунодефіциту(СНІД), комплекс хвороб, пов'язаних зі СНІДом(синдромом набутого імунодефіциту), утверення келоїдів, хвороба Крона, ульцеративні коліти або пірезис. Активніть сполук даного винаходу по відношенню до інгібування цитокінів, наприклад інгібування продукціі альфа-фактору некрозу пухлин(α-TNF), може бути показано в тесті in vitro "Продукування цитокінів в цільній культурі крові людини". До того, сполуки даного винаходу, очікувалося, повинні мати малі або зовсім не мати ендокринологічних сайд-ефектів. Це можна довести тестами "Тестостерон in vivo", "Інгібування активності ароматази in vitro", "Інгібування активності ароматази in vivo". Зважаючи на корисні властивості інгібування фосфодіестераз IV(PDE IV) та цитокінів, сполуки даного винаходу можуть бути використані для приготування різних фармацевтичних композицій, що містять фармацевтично прийнятний носій, та терапевтично ефективну кількість сполуки формули (1), для призначення пацієнтам. Для приготування фармацевтичної композиції по цьому винаході, змішують до тісного контакту терапевтично активну кількість сполуки формули (1) в якості активного інгридієнту, у формі адитивної солі з кислотою чи основою, з фармацевтично прийнятним носієм, що може бути варіюватися у широких межах в залежності від бажаної форми призначення. Бажано, щоби ці фармацевтичні композиції були у формі одиничного дозування, переважно, для орального, ректального, топікального, перкутанеального призначення, інгаляцій або парентеральних ін'єкцій. Для прикладу, приготування композицій в формі орального дозування, може бути використане будь-яке з звичайних середовищ, таких, як, наприклад, вода, гліколі, олія, спирти та подібні у випадку рідкої форми, таких як суспензії, сиропи, еліксири, розчини; або тверді носії, такі як крохмаль, цукор, каолін, покривачі, зв'язувачі, роздрібнюючі агенти та подібне в випадку порошків, таблеток, капсул та пілюль. Через легке вживання, форма таблеток та капсул має найбільше переваг серед оральних форм одиничного дозування, в яких використовується твердий носій. Для парентеральних композицій, носій звичайно містить стерильну воду, як мінімум у великому процентному співвідношенні, до якій можуть бути додані, наприклад, агенти, що підвищують розчинність. Розчини для ін'єкцій також можуть бути приготовані на основі розчину солі, розчину глюкози, або суміші розчину солі і розчину глюкози. Суспензії для ін'єкцій можуть бути приготовані на основі придатного рідкого носія, суспензуючого агента, та іншого подібного. В композиціях для перкутанеального призначення, носій може необов'язково містити проникаючий агент та/або зволожуючий агент, що необов'язково містить добавки будь-якої природи, в меньших кількості, які не спричинюють серйозного подразнення шкіри. Такі добавки можуть полегшувати призначення на шкіру та/або є допоміжними для приготування бажаної композиції. Такі композиції можуть бути призначені різними шляхами, наприклад, трансдермальним, локального нанесення на шкіру, та намазуванням. Як відповідні композиції для топічного вживання можуть бути вказані всі композиції, що звичайно вживаються для топічного призначення, наприклад креми, гелі, одяг, шампуні, тінктури, пасти, мазі, бальзами, порошки, та подібні. Також методом вживання таких композицій є аерозолі, наприклад, з такими пропелентами як азот, діоксид вуглецю, фреон, аьо без пропелентів, наприклад, спрей, краплі, лосьони, або напівтверді композиції, такі як тонкі композиції, що використовуються для намазування. Зокрема, напівтвердими композиціями є бальзами, креми, гелі, мазі, та подібного використання. З метою підвищення розчинності та/або стабільності сполук формули (1) в фармацевтичних композиціях, може дати деякі переваги використання α-, β-, або γ-циклодекстринів, або їх похідних, зокрема гідроксиалкілзаміщених циклодекстринів, наприклад, 2-гідроксипропіл-β-циклодекстрину. Також розчиненості та/або стабілізації в фармацевтичних композиціях можуть сприяти со-розчинники, такі, наприклад, як спирти. При приготуванні водних розчинів, додавання адитивних солей сполук формули (1) є найбільш переважним, завдяки їх підвищеній розчинності у воді. Особливо переважно використовувати вищезгадані фармацевтичні композиції у формах одиничного дозування для більш легкого призначення та універсальності дозування. Під формою одиничного дозування маються на увазі фізично діскретні одиниці, що придатні до підходять для відокремленого використання, кожна з яких містить передвизначену кількість активного компоненту для створення бажаного терапевтичного ефекту та необхідну кількість фармацевтично прийнятного носію. Прикладами таких дозованих одиниць є таблетки(включаючи лічені та покриті таблетки), капсули, пілюлі, порошкові пакети, вафлі, розчини для ін'єкцій та подібні. Даний винахід також відноситься до методу лікування хворобливих станів в теплокровних тварин, що пов'язані з ненормальною ферментативною та каталітичною активністю фосфодіестерази IV(PDE IV) та/або хворобливих станів в теплокровних тварин, що пов'язані з фізіологічним надлишком цитокінів, зокрема, алергічних, атопічних та запальних захворювань, більш конкретно астматичних та атопічних захворювань, найбільш конкретно атопічних дерматитів. Вказаний метод включає призначення терапевтично ефективної кількості сполуки формули (1) або її N-оксидної форми, або їх фармацевтично прийнятних адитивних солей з кислотами або з основами, або їх стереоізомерних форм в суміші з фармацевтичним носієм. В загальному визначена денна кількість може бути від 0.01мг/кг до 10мг/кт маси тіла. Очевидно, що вказана ефективна кількість може біти зменшена або збільшена в залежності від реакції пацієнта, що лікується та/або в залежності від значення фізичного призначення сполук даного винаходу. Ефективний денний інтервал дозування вказаний вище, є тільки вказівкою і ні в якій мірі не звужує винахід або використання цих сполук. Послідуючі приклади ілюструють, але не обмежують об'єм даного винаходу. Експериментальна частина Для деяких сполук формули (1) абсолютна стереохімічна конфігурація не була експериментально визначена. В таких випадках перша виділенню стереоізомерна форма позначається "А", а інша, відповідно "В", без подальшого вказування справжньої стереохімічної конфігурації. Тут та далі, "ТГФ" означає тетрагідрофуран, "КТ" означає кімнатна температура, "ДМФА" означає N,Nдиметилформамід, "ДІПЕ" означає діізопропіловий етер. А. Приготування проміжних сполук Приклад А. 1 а). Карбонат калію(0.0569моль) по краплям додавали до суміші 4-дифторметокси-3гідроксибензальдегіду(0.053моль) та (тетрагідро-3-фуранол)-4-метилбензенсульфонату(15.35г.) в N,Nдиметилформаміді(100мл) під током азоту. Реакційну суміш перемішували на протязі 4-х годин при 100°С. Після цього суміш охолодили та додали по краплям розчин (тетрагідро-3-фуранол)-4метилбензенсульфонату(3.98г.) в N,N-диметилформаміді(40мл) та реакційну суміш знов перемішували на протязі 3-х годин при 100°С, потім залишили на ніч при кімнатній температурі. Розчинник випарували, залишок промили насиченим водним розчином карбонату натрію, потім екстрагували діізопропіловому етері. Відділений органічний шар висушили, відфільтрували, розчинник випарували, що дало 17.77г. (±)-4(дифторметокси)-3-[(тетрагідро-3-фураніл)окси]бензальдегіду (проміжна сполука 1). б). Розчин боргідриду натрію(0.0177моль ) додали порціями до розчину проміжної сполуки 1(0.0532моль) в метанолі(100мл), реакційну суміш перемішували на протязі 1-єї години при кіматній температурі. Розчинник випарували, залишок промили водою, потім екстрагували дихлорметаном. Відділений органічний шар висушили, відфільтрували, розчинник випарували. Залишок очистили хроматографією на силикагелі з відкритою колонкою(елюент: дихлорметан/2-пропанол = 96/4 та 90/10; дихлорметан/метанол = 96/4). Зібрали чисті фракції, розчинник випарували, що дало 11.3г.(81%) (±)-4(дифторметокси)-3-[(тетрагідро-3-фураніл)окси]фенілметанолу (проміжна сполука 2). в). Розчин проміжної сполуки 2(0.039моль) в толуені(45мл) додали по краплям до суміші SOCІ2(0.059моль) та N,N-диметилформаміді(0.0019моль) в толуені(75мл), при перемішуванні при 40°С. Отриману реакційну суміш перемішували при 40°С доти, поки не припинилося виділення газоподібного хлороводню. Розчинник випарували, залишок промили насиченим водним розчином гідрокарбонату натрію, потім екстрагували дихлорметаном. Відділений органічний шар висушили, відфільтрували, розчинник випарували, що дало 10.59г.(96%) (±)-4-(дифторметокси)-3-[(тетрагідро-3фураніл)окси]фенілметилхлориду (проміжна сполука 3). г.). Розчин ціаніду калію(0.076моль) в воді(4мл), нагрітий до 80°С, по краплям додали до розчину проміжної сполуки 3(0.038моль) в N,N-диметилформаміді(82.4мл), при перемішуванні при 60°С. Отриману реакційну суміш перемішували на протязі 30-ти хвилин при 60°С. Реакційну суміш охолодили, промили водою, потім екстрагували діізопропіловому етері. Відділений органічний шар висушили, відфільтрували, розчинник випарували, що дало 8.23г.(±)-4-(дифторметокси)-3-[(тетрагідро-3-фураніл)окси]фенілацетонітрилу (проміжна сполука 4). Аналогічним шляхом було приготовано: 3-(циклопропілметокси)-4-метоксифенілацетонітрил (проміжна сполука 5); 3-[(1,3-дигідро-2Н-інден-2-іл)окси]-4-метоксифенілацетонітрил (проміжна сполука 6); (±)-4-метокси-3-[(тетрагідро-3-фураніл)окси]фенілацетонітрилу (проміжна сполука 7); 4-метокси-3-[(5-фенілпентил)окси]фенілацетонітрилу (проміжна сполука 8); (4-дифторметокси)-3-[(5-фенілпентил)окси]фенілацетонітрилу (проміжна сполука 23). Приклад А.2 а). Літієву сіль N-(1-метилетил)-2-пропанаміну(0.0325моль; 1М розчин у тетрагідрофурані) по краплям додали до розчину проміжної сполуки 4 в тетрагідрофурані(70мл), охолодженного до -78°С в тоці азоту. Отриману реакційну суміш перемішували на протязі 30-ти хвилин при -78°С. Потім по краплям додали йодметана йодид(0.034моль), та реакційну суміш перемішували на протязі 2-х годин при кіматній температурі. Після цього суміш погасили насиченим водним розчином хлориду амонію, та екстрагували етилацетатом. Відділений органічний шар висушили, відфільтрували, розчинник випарували. Залишок очистили хроматографією на силикагелі з відкритою короткою колонкою(елюент: дихлорметан). Зібрали чисті фракції, розчинник випарували, що дало 4.64г.(53%) (±)-4-(дифторметокси)-альфа-метил-3[(тетрагідро-3-фураніл)окси]фенілацетонітрилу (проміжна сполука 9). б). Розчин проміжної сполуки 9(0.0129моль) в метанолі/аміаку(100мл) гідрогенізували при кіматній температурі над нікелем Ренея(3г.) як каталізатором. Після поглинення водню, каталізатор відфільтрували, розчинник випарували, що дало 3.66г.(98%) (±)-4-(дифторметокси)-р-метил-3-[(тетрагідро3-фураніл)окси]-фенілетиламіну (проміжна сполука 10). в). Суміш проміжної сполуки 10(0.0158моль) та N-ціанокарбонімідату(0.0158моль) в етанолі(60мл) перемішували ніч при кімнатній температурі. Розчинник випарували, залишок очистили хроматографією на силикагелі з відкритою колонкою(елюент: гексан/етилацетат = 3/2; дихлорметан/метанол = 96/4, 90/10 та 85/5). Зібрали чисті фракції, розчинник випарували, що дало 5.11г. (74%) (±)-феніл-N-ціано-N-[2-[4(дифторметокси)-3-[(тетрагідро-3-фураніл)окси]феніл]-пропіл]карбімідату (проміжна сполука 11). г.). Суміш 2,2-диметоксиетиламіну(0.0129моль), N,N-диетиламіну(0.023моль) та N,N-диметил-4амінопіридину(0.0059моль) в 1,4-діоксані(30мл) додали до розчину проміжної сполуки 11(0.0117моль) в 1,4-діоксані(10мл), при перемішуванні при кімнатній температурі. Реакційну суміш кип'ятили з зворотнім холодильником при перемішуванні ніч. Розчинник випарували, залишок промили водою та 1М водним розчином гідроксиду натрію, потім екстрагували дихлорметаном. залишок очистили хроматографією на силикагелі з відкритою колонкою(елюент: дихлорметан/метанол = 96/4). Зібрали чисті фракції, розчинник випарували, що дало 4.97г.(95%) (±)-N''-ціано-N-[2-[4-(дифторметокси)-3-[(тетрагідро-3фураніл)окси]феніл]пропіл]-N'-(2,2-диметоксиетил)гуанідину (проміжна сполука 12). Аналогічним шляхом було приготовано: (±)-N"-ціано-N-[2-[3-(циклопентилокси)-4-метоксифенiл]пропіл]-N'-(2,2-диметоксиетил)гуанідин (проміжна сполука 13); (±)-N''-ціано-N-[2-[3-(циклопентилокси)-4-(дифторметокси)феніл]пропіл]-N'-(2,2-диметоксиетил)гуанідин (проміжна сполука 14); N"-цiaнo-N-[2-[3-(циклoпeнтилoкcи)-4-(дифтopмeтoкcи)фeнiл]eтил]-N'-(2,2-диметоксиетил)гуанідин (проміжна сполука 15); (±)-N"-ціано-N-[2-[3-(циклопропілметокси)-4-(дифторметокси)феніл]пропіл]-N'-(2,2диметоксиетил)гуанідин (проміжна сполука 16); (±)-N''-ціано-N-[2-[3-[(1,3-дигідро-2Н-інден-2-іл)окси)]-4-метоксифеніл]-пропіл]-N'-(2,2диметоксиетил)гуанідин (проміжна сполука 17); (±)-N''-ціано-N-[2-[3-(циклопропілметокси)-4-метоксифеніл]пропіл]-N'-(2,2-диметоксиетил)гуанідин (проміжна сполука 18); (±)-N"-ціано-N-(2,2-диметоксиетил)-N'-[2-[4-метокси-3-[(5-фенілпентил)окси]феніл]пропіл]гуанідин (проміжна сполука 19); (±)-N''-ціано-N-(2,2-диметоксиетил)-N'-[2-[4-метокси-3-[(тетрагідро-3-фураніл)окси]феніл]пропіл]гуанідин (проміжна сполука 20); (±)N''-ціано-N-(2,2-диметоксиетил)-N'-[2-[4-(дифторметокси)-3-[(5фенілпентил)окси]феніл]пропіл]гуанідин (проміжна сполука 24); N'' ціано-N-[2-[3-[(2,3-дигідро-1Н-інден-2-іл)окси)]-4-метоксифеніл]-етил]-N'-(2,2-диметоксиетил)гуанідин (проміжна сполука 25); (±)-N''-ціано-N-[2-[3-[(2,3-дигідро-1Н-інден-2-іл)етокси)]-4-метоксифеніл]-пропіл]-N'-(2,2диметоксиетил)гуанідин (проміжна сполука 27); (±)-N"-ціано-N-[2-[3-[(2,3-дигідро-1Н-інден-2-іл)окси)]-4-метоксифеніл]-2-[(тетрагідро-2Н-піран-2іл)окси]етил]-N'-(2,2-диметоксиетил)гуанідин (проміжна сполука 28); Приклад А.3 а). Суміш (±)-3-(циклопентилокси)-4-метокси-β-метилфенілетиламіну(0.029моль), хлорацетонітрилу(0.0146моль) та карбонату натрію(0.0219моль) в N,N-диметилформаміді(200мл) перемішували на протязі 5-ти годин при 60°С. Реакційну суміш відфільтрували, розчинник випарували, залишок промили водою, потім екстрагували 2-метокси-2-метилпропаном. Відділений органічний шар висушили, відфільтрували, розчинник випарували. Залишок очистили хроматографією на силикагелі з відкритою колонкою(елюент: дихлорметан/2-пропанол = 96/4 та 90/10; дихлорметан/метанол = 80/20). Зібрали чисті фракції, розчинник випарували, що дало 3.24г.(77%) (±)-[[2-[3-(циклопентилокси)-4метоксифеніл]пропіл]аміно]ацетонітрилу (проміжна сполука 21). б). Розчин проміжної сполуки 21(0.0117моль) в метанолі/аміаку(100мл) гідрогенізували при кіматній температурі над нікелем Ренея(2г.) як каталізатором. Після поглинення водню, каталізатор відфільтрували, розчинник випарували. Залишок обробили 10% водним розчином соляної кислоти, потім екстрагували етилацетатом. Відділений органічний шар висушили, відфільтрували, розчинник випарували, що дало 2.71г.(75%) (±)-N-[2-[3-(циклопентилокси)-4-метоксифеніл]пропіл]-1,2-атилендіаміну (проміжна сполука 22). Приклад А.4 а). Суміш 6,7-дигідро-5Н-циклопента[b]піридин-7-олу(0.03544моль), 3-гідрокси-4метоксибензальдегіду(0.0322моль) та трифенілфосфіну(0.0322моль) в тетрагідрофурані(100мл) перемішували при 5°С. Далі по каплям додали біс(1-метилетил)діазендикарбоксилату(0,0322моль), отриману реакційну суміш перемішували на протязі 12-ти годин при кіматній температурі. Розчинник випарували, до залишку додали дихлорметан. Суміш промили водою, висушили, відфільтрували, розчинник випарували. Залишок очистили хроматографією на силикагелі на скляному фільтрі(елюент: дихлорметан/метанол = від 100/0 до 98.5/1.5). Зібрали потрібні чисті фракції, розчинник випарували. Залишок розчинили в 2-пропанолі та перетворили в гідрохлорид(1 : 1) з розчином HCl/2пропанол. Розчинник випарували. Залишок перемішали в діізопропіловому етері, відфільтрували та висушили, що дало 8.2г.(83%) 3-[(5,6-дигідро-7Н-піридин-7-іл)окси]-4-метоксибензальдегіду (проміжна сполука 34). б). Розчин триметилсиланкарбонітрилу(0.1472моль) в дихлорметані(60мл) по краплям додали до суміші 3-[(2,3-дигідро-1Н-інден-2-іл)окси)]-4-метоксибензальдегіду та йодиду цинку(0.0061моль) в дихлорметані(240мл). Отриману реакційну суміш перемішували на протязі однієї години при кімнатній температурі. Неочищену реакційну суміш промили водою та насиченим водним розчином хлориду натрію, потім екстрагували дихлорметаном. Відділений органічний шар висушили, відфільтрували, розчинник випарували. Залишок перекристалізували з діізопропіловому етері. Осад відфільтрували та висушили, що дало 37.39г.(83%) (±)-3-[(2,3-дигідро-1Н-інден-2-іл)окси)]-4-метокси-α-[(трисилілметил)окси]фенілацетонітрилу (проміжна сполука 29). в). Проміжну сполуку 29(0.1116моль) розчинили в метанолі та додали соляну кислоту(3N, 25мл). Суміш перемішували 5 хвилин. Більшу частину розчинника випарували, до залишку додали дихлорметану. Відділений органічний шар промили насиченим водним розчином гідрокарбонату натрію, висушили, відфільтрували, розчинник випарували. Залишок розчинили в дихлорметані. До розчину додали 3,4дигідро-2Н-пірану(0.2231моль) та 4-метилбензенсульфокислоту(каталітична кількість). Отриману реакційну суміш перемішували на протязі ночі при кімнатній температурі. Суміш промили насиченим водним розчином гідрокарбонату натрію, висушили, відфільтрували, розчинник випарували. Залишок очистили хроматографією на силикагелі з відкритою короткою колонкою(елюент: гексан/етилацетат = 9/1, потім 8/2). Зібрали потрібні чисті фракції, розчинник випарували, що дало 28.01г.(66%) (±)-3-[(2,3-дигідро-1Н-інден-2іл)окси)]-4-метокси-α-[(тетрагідро-2Н-піран-2-іл)окси]-фенілацетонітрилу (проміжна сполука 30). Приклад А. 5 а). Розчин біс(1,1-диметилетил)дикарбонату(1.268моль) в дихлорметані(1800мл) по краплям додали до розчину (±)-3-[(2,3-дигідро-1Н-інден-2-іл)окси)]-4-метокси-β-метилфенілетиламіну(1.208моль) в дихлорметані(1800мл). Отриману реакційну суміш перемішували на протязі 2-х годин при кімнатній температурі. Розчинник випарювали.Залишок перемішали в гексані, відфільтрували та висушили, що дало 420г. (±)-1,1-диметилетил-[2-[3-[(2,3-дигідро-1Н-інден-2-іл)окси)]-4-метоксифеніл]пропіл]карбамату (проміжна сполука 31). б). Проміжну сполуку 31(1.056моль) очистили та розділили на стереоізомери за допомогою хіральної колоночної хроматографії на Chiralpack AD(елюент: гексан/етанол/метанол = 90/10/10). Зібрали потрібні чисті фракції, розчинник випарували, що дало 268г. В-(±)-1,1-диметилетил-[2-[3-[(2,3-дигідро-1Н-інден-2іл)окси)]-4-метоксифеніл]пропіл]карбамату (проміжна сполука 32). в). Суміш проміжної сполуки 32(0.67моль) в соляній кислоті(670мл; 6N) та метанолі(2700мл) кип'ятили з зворотнім холодильником при перемішуванні на протязі 90 хвилин. Розчинник випарували. Залишок обробили дихлорметаном(СН2СІ2). Органічний розчин промили водою(1000мл) та насиченим водним розчином гідрокарбонату натрію. Органічну фазу відділили, висушили, відфільтрували та розчинник випарували, що дало 158г.(99 %) (В)-3[(2,3-дигідро-1Н-інден-2-іл)окси]-4-метокси-β-метилбензенетанамін (проміжна сполука 33). Проміжну сполуку 33 використали у подальших перетвореннях у відповідності із методикою, що описана у прикладах А.2.b - A.2.d, для одержання (B)-N"-цiaно-N-[2-[3-[(2,3-дигідро-1Н-інден-2-іл)окси]-4метоксифеніл]пропіл]-N'-(2,2-диметоксиетил)гуанідин (проміжна сполука 26). В. Синтез сполук формули (І) Приклад В. 1 Суміш проміжної сполуки 22(0,0068моль) та диметил ціанокарбонімідодитіоат(0,0068моль) у етанолі(20мл) перемішували та гріли із оберненим холодильником на протязі двох діб. Розчинник випарували та залишок спершу очистили хроматографією на відкритій, короткій колонці, використовуючи у якості носія силікагель(елюент: дихлорметан, дихлорметан/метиловий спирт = 96/4 та 90/10), а потім двічі очищали за допомогою ВЕРХ(високоефективна рідинна хроматографія) (1-ий елюент: дихлорметан/метиловий спирт = 90/10 та 2-ий елюент: дихлорметан/метиловий спирт = 96/4). Очищену фракцію зібрали та розчинник випарували, що дало 0,3г.(13%) (±)-[1-[2-[3-(циклопентилокси)-4метоксифеніл]пропіл]-2-імідазолідиніліден]ціанамід (сполука 1). Приклад В.2 Водний розчин 0,5 N соляної кислоти(0,0162моль) додали по краплинам до розчину проміжної сполуки 12(0,0108моль) у 1,4-діоксані(20мл), при перемішуванні та охолодженні на льодяній бані. Реакційну суміш перемішували на протязі 2 діб при кімнатній темпратурі(у якості альтернативи, 1,4-діоксан може бути замінено на тетрагідрофуран та реакційну суміш можна буде нагрівати із оберненим холодильником на протязі 1 години замість 2 діб при кімнатній температурі). Реакційну суміш обробили водою, додали розведений водний розчин гідроксиду натрію, а потім екстрагували етилацетатом. Органічний шар, що відділили, висушили, відфільтрували та розчинник випарували. Залишок очистили хроматографією на відкритій колонці, використовуючи у якості носія силікагель(елюент: дихлорметан/2-пропанон = 96/4; дихлорметан/метиловий спирт = 96/4), а потім двічі очищали за допомогою ВЕРХ(високоефективна рідинна хроматографія) (1-ий елюент: дихлорметан/метиловий спирт = 96/4 та 2-ий елюент: дихлорметан/метиловий спирт = 97/3). Очищену фракцію зібрали та розчинник випарували, що дало 0,64г.(15%) (±)-[1-[2-[4-(дифторметокси)-3-[(тетрагідро-3-фураніл)окси]феніл]пропіл]-1,3-дигідро-2Німідазол-2-іліден]ціанамід (сполука 2; Тпл.= 67,8°С). Приклад В.3 а). Сполуку 7(0,00644моль) розділили на енантіомери за допомогою хіральної колонкової хроматографії над носієм Chiralpak AD(20мкм, 250г., 5см, швидкість потоку: 60мл/хв; елюент: гексан/етанол/метанол = 80/15/5). Дві потрібні фракції, що містили відповідні енантіомери, зібрали. Розчинник із першої (А)-фракції випарували. Залишок перемішували із DIPE, потім відфільтрували, промили DIPE та висушили. Подальша очистка залишку проводилася за допомогою колонкової хроматографії над силікагелем Kromasil(200г, 5мкм, елюент: дихлорметан/метиловий сприт = 100/0, а потім після 30 хвилин, 90/10). Очищену фракцію зібрали та розчинник випарували, що дало 0,39г.(50%) (+)(А)-[1-[2-[3-[(2,3-дигідро-1Н-інден-2-іл)окси]-4-метоксифеніл]пропіл]-1Н-імідазол-2-іл]ціанамід; [α]20D = +95,46°(c = 0,1% у метанолі) (сполука 16). Розчинник із другої (В)-фракції випарували. Залишок перемішували із DIPE, потім відфільтрували, промили DIPE та висушили. Подальша очистка залишку проводилася за допомогою колонкової хроматографії над силікагелем Kromasil(200г, 5мкм, елюент: дихлорметан/метиловий сприт = 100/0, а потім після 30 хвилин, 90/10). Очищену фракцію зібрали та розчинник випарували, що дало 0,5г.(90 %) (-)(В)-[1-[2-[3-[(2,3-дигідро-1Н-інден-2-іл)окси]-4-метоксифеніл]пропіл]-1Н-імідазол-2-іл]ціанамід; [a]20D = 109,04°(c = 0,1% у метанолі) (сполука 17). б). Суміш сполуки 17 у диметилформаміді(40мл) перемішували при 0°С. Потім додали гідрид натрію(0,0028моль; 60%) та суміш перемішували на протязі 30 хвилин при 0°С та 30 хвилин при кімнатній температурі. Розчин брометилбензену(0,0028моль) у диметилформаміді(10мл) додали по краплинам та реакційну суміш перемішували на протязі 3 годин при кімнатній температурі. Розчинник випарували та додали толуен, а потім зробили азеотропну перегонку на роторному випаровувачі. Залишок обробили дихлорметаном. Додали воду, органічний шар відділили, висушили, відфільтрували та розчинник випарували. Залишок очистили хроматографією на короткій колонці, використовуючи у якості носія силікагель(елюент: дихлорметан/метиловий спирт = 98/2). Потрібні фракції зібрали та розчинник випарували, що дало 0,7г.(63%) (В)-[1-[2-[3-[(2,3-дигідро-1Н-інден-2-іл)окси]-4-метоксифеніл]пропіл]-3фенілметил-1Н-імідазол-2-іл]ціанамід (сполука 23). Приклад В.4 Водний розчин 0,5 N соляної кислоти(0,0268моль) додали до розчину проміжної сполуки 28(0,0179моль) у тетрагідрофурані(250мл), при перемішуванні та охолодженні на льодяній бані. Реакційну суміш перемішували та нагрівали із оберненим холодильником на протязі 1,5 годин, потім охолодили на льодяній бані. Суміш додали до етилацетату та води, потім додали твердий карбонат натрію для створення лужного середовища. Органічний шар відділили, висушили, відфільтрували та розчинник випарували. Залишок очистили хроматографією на відкритій, короткій колонці, використовуючи у якості носія силікагель(елюент: дихлорметан/метиловий спирт = 97/3, потім 95/5). Потрібну очищену фракцію зібрали. Розчинник випарували та залишок перекристалізували із ацетонітрилу, відфільтрували осад, що випав, та висушили, що дало(35%) (±)-[1-[2-[3-[(2,3-дигідро-1Н-інден-2-іл)окси]-4-метоксифеніл]2гідроксиетил]-1,3-дигідро-2Н-імідазол-2-іліден]ціанамід (сполука 21). Таблиця 1, що показує сполуки формули (І), одержані за методикою одного із вищенаведених прикладів. С. Фармакологічні приклади Приклад С.1: Інгібіювання рекомбінантної людської моноядерної лімфоцитної(МЯЛ) фосфодіестерази типу IV В. що виробляються у клітинах комах із бакуловірусного вектору. Полегшуючий та/або лікувальний ефект наступних сполук на алергічні та атопічні хвороби оцінювався in vitro аналізом системи для визначення інгібуючого ефекту на рекомбінантну людську моноядерну лімфоцитну фосфодіестеразу типу IV В. Сімдесят дві години після інфікування рекомбінантним бакуловірусом, клітини комах зібрали та гранулювали за 5 хвилин у кульки по 500г. Клітини розчинили у 10мл розчиняющого буфера, що містив 20мм Tris, 10мм ЕГТА, 2мм Nа2ЕДТА, 1% Triton-X-100, 1мМ Na3VO4, 10мм NaF, 2мкг/мл лейпептину, пепстатину та апротиніну, 0,3мкг/мл бензамідину та 100мкг/мл ТРСК pH 7,5. Після 5 хвилин витримування на льоді, солюбілізовані кліитни були відцентирфуговані при 4000g на потязі 15 хвилин при 4°С. Те, що плавало на поверхні після центрифугування профільтрували крізь фільтр із діаметром пор 0,45мкм(Mііlipore) та перенесли до TBS буферу(50мм Tris, 150мм NaCl, pH 7,4). Масу, що плавала на поверхні і яка містила фосфодіестеразу(ФДЕ) типу IV В згодом перенесли на aнти-FLAG-M2 споріднену гель-колонку на 5мл, яка перед цим була активована 5мл розчину 100мм гліцину pH 3,5 та врівноважена буфером, PDE IV елюювали у фракцію об'ємом 1,5мл, що містила 37,5мкл 1M Tris pH 8. Для фракцій провели діаліз, що тривав цілу ніч із розчином 20мм Tris, 2мм Na2ЕДТА, 400мм NaCl, pH 7,5 та протестували на PDE IV активність. Ідентифікація була зроблена на SDS PAGE та Western Blot(aнтиFLAG-M2). Активні фракції зібрали, додали до 10% гліцерину та зберігали при -70 °С. Інкубаційну суміш(pH 8) (200мкл), що місить 20мм Tris, 10мМ сульфату магнію, 0,8мкМ 3НцАМФ(310мКюрі/ммоль) та фосфодіестеразу типу IV В, кількість якої залежить від ензиматичної активності. Концентрація протеїну була вибрана такою, щоб спостерігати лінійне збільшення фосфодіестеразної активності на протязі інкубаційного періоду максимум 10 хвилин при 37°С та принаймні 10% початкового субстрату гідролізувало. Коли ефект різних сполук на фосфодіестеразну активність було протестовано то середовище, яке не містило цАМФ піддали інкубації із сполукою(ами) чи її носієм(ДМСО - 1% кінцева концентрація) на протязі 5 хвилин. Ензиматична реакція розпочалася при додаванні 3Н-цАМФ та зупинена через 10 хвилин після переносу мікротитрувального скельця у водяну баню при 100°С на протязі 5 хвилин. Після охолодження до кімнатної температури додали лужну фосфотазу(0,25мкг/мл) та суміш піддали інкубації при 37°С на протязі 20 хвилин. 100мкл суміші зодом перенесли на GF-B фільтрувальне мікротитрувальне скельце(Miilipore), що було заповнене суспензією 300мкл DEAE-Sephadex-A25. Скельце промили три рази 75мкл 20мм Tris pH 7,5 та фільтрат зібрали для вимірювання радіоактивності на сцинтиляційному лічильнику Packard Top Count. Інгібуючий ефект наступних сполук на рекомбінантну людську моноядерну лімфоцитну фосфодіестеразу типу IV В був виміряний при різних концентраціях цих сполук. Значення ІС50(подані у молярній концентрації) були розраховані графічно за цими одержаними значеннями інгібіювання та подані у Таблиці 2. Таблиця 2 Сполука № 1 2 3 4 5 6 7 8 9 10 IC50(y 10-8 M) 33,0 10,0 3,00 1,53 2,66 2,24 1,90 5,65 3,61 19,6 Сполука № 11 12 13 14 15 16 17 18 19 20 IC50(y 10-8 M) 3,27 2,19 2,22 2,72 3,35 1,80 3,00 4,09 3,75 7,65 D. Приклади фармацевтичної композиції Наступні рецептури є прикладами типових фармацевтичних композицій, прийнятних для систематичного чи місцевого вживання тваринами чи людинами у відповідності до наступного винаходу. «Активний інгредієнт» (А. І.) використовується у цих прикладах разом із сполуками формули (І) чи їх фармацевтично прийнятних адитивних солей. Приклад D.1: таблетки, що покриті оболонкою Одержання серцевини таблетки Суміш 100г. А. І., 570г. лактози та 200г. крохмалю добре змішали та потім зволожували розчином, що містив 5г. додецисулфату та 10г. полівінілпіролідону у приблизно 200мл води. Вологу суміш просіяли, висушили та просіяли знову. Потім додали до неї 100г. мікрокристалічної целюлози та 15г. гідрогенезованої рослинної олії. Усю масу добре перемішали та спресували у таблетки, що дало 10000 таблеток, кожна з якої містила 10мг активного інгредієнту. Одержання покриття До розчину 10г. метилцелюлози у 75мл денатурованого етилового спирту додали розчин, що містив 5г. етилцелюлози у 150мл дихлорметану. Потім додали 75мл дихлорметану та 2,5мл 1,2,3-пропантриолу. 10г. поліетиленгліколю розплавили та розчинили у 75мл дихлорметану. Цей розчин додали до вищезгаданого розчину та потім додали 2,5г. магнію октадеканоату, 5г. полівінілпіролідону та 30мл концентрованої забарвленої суспензії та суміш гомогенізували. Серцевина таблеток була покрита цією одержаною сумішшю у спеціальному апараті. Приклад D.2: 2% крем для місцевого використання До розчину 200мг гідроксипропіл β-циклодекстрину у очищеній воді додали 20мг А. І. при перемішуванні. До суміші добавляли водний розчин соляної кислоти до повного розчинення та потім додали гідроксид натрію до pH 6,0. Туди ж додали 50мг гліцерину та 35мг полісорбату 60 при перемішуванні та суміш нагрівали до 70°С. Цю суміш додали при повільному перемішуванні до суміші 100мг мінеральної олії, 20мг стеарилового спирту, 20мг цетилового спирту, 20мг моностеарату гліцерину та 15мг сорбату 60, що мала температуру 70°С на протязі перемішування. Після охолодження приблизно до 25°С додали 1г. очищеної води та суміш гомогенізували пермішуванням.
ДивитисяДодаткова інформація
Назва патенту англійською2-cyanoiminoimidazole derivatives for inhibition of pde iv
Автори англійськоюFreyne Eddy Jean Edgard
Назва патенту російськоюПроизводные 2-цианоиминоимидазола для угнетения pde iv
Автори російськоюФрейне Эдди Жан Эдгар
МПК / Мітки
МПК: A61P 37/08, C07D 233/88, C07D 233/44, A61K 31/00, C07D 405/12, A61P 11/00, A61K 31/4168, A61P 37/00, C07D 233/48, A61K 31/415, A61K 31/4164, A61P 11/06
Мітки: спосіб, 2-ціаноіміноімідазолу, одержання, фармацевтична, композиція, сполуки, похідне
Код посилання
<a href="https://ua.patents.su/14-62939-pokhidne-2-cianoiminoimidazolu-farmacevtichna-kompoziciya-ta-sposib-oderzhannya-spoluki.html" target="_blank" rel="follow" title="База патентів України">Похідне 2-ціаноіміноімідазолу, фармацевтична композиція та спосіб одержання сполуки</a>
Попередній патент: Спосіб одержання бензотіофенів
Наступний патент: Установка для виробництва поглинальної маси для очищення газів від сірчаних сполук
Випадковий патент: Замок для ременя безпеки транспортного засобу