Сполуки піролідиніл- і піролінілетиламіну як агоністи капа-рецептора, спосіб їх одержання, фармацевтична композиція, спосіб лікування та проміжні сполуки
Формула / Реферат
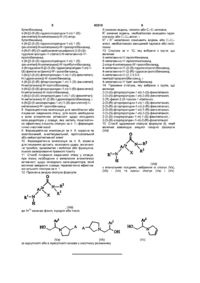
1. Сполуки піролідиніл- і піролінілетиламіну формули
(І)
та їх солі,
де А означає водень, галоген, гідрокси, С1-С6алкіл, галоген-С1-С6алкіл, С1-С6-алкокси, галоген-С1-С6алкокси, оксо, OY, де Y означає гідроксизахисну групу або відсутній;
пунктирна лінія означає необов'язковий подвійний зв'язок за умови, що, якщо пунктирна лінія є подвійним зв'язком, А відсутній;
Аr1 означає феніл, необов'язково заміщений одним чи кількома замісниками, вибраними з галогену, гідрокси, С1-С4-алкілу, С1-С4-алкокси, С1-С4-алкокси-С1-С4-алкокси, СF3, карбокси-С1-С4-алкокси і С1-С4-алкоксикарбоніл- С1-С4-алкокси;
Аr2 означає арил або гетероарил, вибраний з фенілу, нафтилу, піридилу, тієнілу, фурилу, піролілу та піримідилу, причому арил або гетероарил необов'язково заміщені одним чи кількома замісниками, вибраними з галогену, гідрокси, аміно, нітро, карбокси, С1-С4-алкілу, С1-С4-алкокси, С1-С4-алкіламіно, ді-С1-С4-алкіламіно, галоген-С1-С4-алкілу, С1-С4-алкілтіо та сульфонілметилу;
R1 означає водень, гідрокси, С1-С4-алкіл, С1-С4-алкокси або OY, де Y означає гідроксизахисну групу; та
R2 і R3 незалежно вибрані з водню, гідрокси, С1-С7-алкілу, необов'язково заміщеного одним чи кількома гідрокси або галогеном, С3-С6-циклоалкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С7-алкокси, фенілу, необов'язково заміщеного галогеном, фенілу-С1-С7-алкілу, галогензаміщеного феніл-С1-С7-алкілу і (CH2)nX-R4, де n дорівнює 1 або 2, Х означає О, NH або S і R4 означає С1-С3-алкіл або, коли Аr2 являє собою феніл, то -Ar2-C(=O)-N(R2) - являє собою фталімідну групу і R3 являє собою С1-С7-алкіл, або
R2 і R3 разом з атомом азоту, до якого вони приєднані, утворюють піролідинове, піперидинове або морфолінове кільце, необов'язково заміщене С1-С3-алкілом чи галогеном.
2. Сполука за п. 1, де:
А означає водень, галоген, гідрокси, оксо або OY; або, якщо пунктирна лінія означає подвійний зв'язок, А відсутній;
Аr1 означає феніл, необов'язково заміщений одним-трьома замісниками, вибраними з галогену, гідрокси, С1-С4-алкокси, карбокси-С1-С4-алкокси і С1-С4-алкоксикарбоніл-С1-С4-алкокси;
Аr2 означає феніл, піридил або тієніл, необов'язково заміщений одним-двома галогенами або С1-С4-алкокси;
R1 означає водень, гідрокси або С1-С4-алкіл; і
R2 і R3 незалежно вибрані з водню, С1-С7-алкілу, необов'язково заміщеного одним чи кількома гідрокси або галогенами, С3-С6-циклоалкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С4-алкокси, фенілу та галогензаміщеного феніл-С1-С7-алкілу або, коли Аr2 означає феніл, -Аr2-C(=O)-N(R2)- означає фталімідну групу і R3 означає С1-С7-алкіл,або
R2 і R3 разом з атомом азоту, до якого вони приєднані, утворюють піролідинове або морфолінове кільце.
3. Сполука за п. 2, де
А означає водень, фтор, хлор, гідрокси або OY, де Y означає метоксиметил або тетрагідропіраніл; або, якщо пунктирна лінія є подвійним зв'язком, А відсутній;
Аr1 означає феніл, необов'язково заміщений хлором, гідрокси, метокси або карбоксиметокси;
Аr2 означає феніл, піридил або тієніл, необов'язково заміщений хлором, фтором або метокси;
R1 означає С1-С4-алкіл;
R2 означає С1-С7-алкіл, необов'язково заміщений гідрокси або фтором, С2-С6-алкеніл, галогензаміщений фенілметил або феніл; і
R3 означає водень чи метил; або
R2 і R3 разом з атомом азоту, до якого вони приєднані, утворюють піролідинове або морфолінове кільце.
4. Сполука за п. 3, де
А означає гідрокси, фтор чи хлор; або, якщо пунктирна лінія являє собою подвійний зв'язок, А відсутній; Аr1 означає феніл, необов'язково заміщений карбоксиметокси; Аr2 означає феніл, необов'язково заміщений метокси або піридил; R1 означає С1-С4-алкіл; R2 означає С1-С7-алкіл, необов'язково заміщений гідрокси; і R3 означає водень.
5. Сполука за п. 4, яку вибрано з групи, що включає
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-пропілбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-2-метокси-N'-пропілбензамід;
6-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-пропілнікотинамід;
4-{N-[1-(S)-(3-кapбoксимeтoксифeніл)-2-(3-(S)-гiдроксипіролідин-1-іл)етил]-N-метиламіно}-N'-пропілбензамід;
4-{N-[2-(3-(S)-фтоpпipoлідин-1-iл)-1-(S)-фінiлeтил]-N-мeтилaміно}-N'-пропілбензамід;
4-{N-[2-(3-(S)-гiдроксипіролідин-1-iл)-1-(S)-фінілетил]-N-метиламіно)-N'-(2-(S)-гідроксипропіл)бензамід;
5-{N-[2-(3-(S)-фтopпipoлiдин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-пропілпіколінамід;
4-{N-метиламіно-N-[2-(3-піролін-1-іл)-1-(S)-фенілетил]}-N'-пропілбензамід; і
4-{N-[2-(3-(S)-xлорпіролідин-1-iл)-1-(S)-фінiлeтил]-N-мeтиламіно}-N'-(2-(S)-гідроксипропіл)бензамід.
6. Сполука за п. 3, яку вибрано з групи, що включає
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-ізопропілбензамід;
3-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}N'-пропілбензамід;
2-хлор-4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-пропілбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-3-метокси-N'- -пропілбензамід;
3-хлор-4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-пропілбензамід;
4-{N-[1-(S)-(3-гідроксифеніл)-2-(3-(S)-гідроксипіролідин-1-іл)етил]-N-метиламіно}-N-пропілбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-(3-метоксифеніл)етил]-N-метиламіно}-N'-пропілбензамід;
4-{N-[1-(S)-феніл-2-(піролідин-1-іл)етил]-N-метиламіно}-N'-пропілбензамід;
4-{N-[1-(S)-(3-хлорфеніл)-2-(3-(S)-гідроксипіролідин-1-іл)eтил]-N-метиламіно}-N'-пропілбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(R)-фенілетил]-N-метиламіно}-N'-пропілбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-iл)-1-(S)-фенілетил]-N-метиламіно}піролідинбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}морфолінбензамід;
4-{N-[2-(3-(S)-гiдроксипіролідин-1-iл)-1-(S)-фeнілeтил]-N-мeтилaміно}-N'-(2-(R)-гідроксипропіл)бензамід;
4-{N-[2-(3-(S)-гiдроксипіролідин-1-іл)-1-(S)-фeнілeтил]-N-мeтилaміно}-N'-ізобутилбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно)-N'-алілбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-(3,3,3-трифторпропіл)бензамід;
3-фтор-4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фeнілeтил]-N-метиламіно)-N'-пропілбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-(2,2,3,3,3-пентафторпропіл)бензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно)-N'-третамілбензамід;
5-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-пропілпіколінамід;
4-{N-[2-(3-(S)-фтopпipoлідин-1-iл)-1-(S)-фeнілeтил]-N-мeтилaміно}-N'-(2-(S)-гідроксипропіл)бензамід;
2-хлор-4-{N-[2-(3-(S)-фторпіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-пропілбензамід; і
4-{N-[2-(3-(S)-хлорпіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-пропілбензамід.
7. Сполука за п. 2, яку вибрано з групи, що включає
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-метилбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-етилбензамід;
4-{N-[2-(3-(S)-гiдроксипіролідин-1-iл)-1-(S)-фeнілeтил]-N-мeтилaміно)-N'-бутилбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-пентилбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-фенілбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-(2-хлорбензил)бензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно)-N',N'-диметилбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-метил-N'-пропілбензамід;
5-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно)-N'-пропіл-2-тіофенкарбоксамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]аміно}-N'-пропілбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-пропілфталімід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-етоксибензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-(3-гідроксипропіл)бензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}N'-циклопропілбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-(S)-втор-бутилбензамід;
4-{N-[2-(3-(S)-гiдроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно)-N'-(R)-втор-бутилбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно)-N'-пропаргілбензамід;
4-{N-[1-(R)-(3-карбоксиметоксифеніл)-2-(3-(S)-гідроксипіролідин-1-іл)етил]-N-метиламіно}-N'-пропілбензамід;
4-{N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-третбутилбензамід;
4-{N-гiдрокси-N-[2-(3-(S)-гідроксипіролідин-1-іл)-1-(S)-фенілетил]аміно)-N'-пропілбензамід;
4-{N-[2-(3-(S)-фторпіролідин-1-іл)-1-(S)-фенілетил]-N-гідроксіаміно}-N'-пропілбензамід;
4-{N-[2-(3-(R)-фторпіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно}-N'-пропілбензамід;
4-{N-[2-(3-(S)-фторпіролідин-1-іл)-1-(R)-фенілетил]-N-метиламіно}-N'-пропілбензамід;
4-{N-[2-(3-(S)-хлорпіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно)-N'-(2-{R)-гідроксипропіл)бензамід; і
4-{N-[2-(3-оксопіролідин-1-іл)-1-(S)-фенілетил]-N-метиламіно)-N'-пропілбензамід.
8. Фармацевтична композиція для запобігання або лікування медичного стану, для якого необхідним є вияв агоністичної активності щодо опіоїдного капа-рецептора у ссавця, яка містить терапевтично ефективну кількість сполуки за п. 1 і фармацевтично інертний носій.
9. Фармацевтична композиція за п. 8, корисна як аналгезивний, анестезувальний, протизапальний або нейропротективний агент.
10. Фармацевтична композиція за п. 8, корисна для лікування артриту, мозкового удару, включаючи тромбоз, крововилив і емболію або функціонального захворювання травного тракту.
11. Спосіб лікування медичного стану у ссавця, при якому необхідним є виявлення агоністичної активності щодо опіоїдного кала-рецептора, який включає введення ссавцю терапевтично ефективної кількості сполуки за п. 1.
12. Проміжна амідна сполука формули:
, (VId)
де Аг2a означає феніл, піридил або тієніл;
Х означає водень, галоген або С1-С7-алкокси;
R1 означає водень, необов'язково захищену гідроксигрупу або С1-С4-алкіл; і
R2 і R3 незалежно означають водень або С1-С7-алкіл, необов'язково заміщений гідрокси або галогеном.
13. Сполука за п. 12, яку вибрано з групи, що включає
4-метиламіно-N'-пропілбензамід;
5-метиламіно-N'-пропілпіколінамід;
2-хлор-4-метиламіно-N'-пропілбензамід;
4-мeтилaміно-N'-(2-(S)-гiдроксипропіл)бензамід;
4-метиламіно-N'-(2-(R)-гiдроксипропіл)бензамід;
4-метиламіно-N'-(2,2,3,3,3-пентафторпропіл)бензамід; і
4-метиламіно-N'-трет-амілбензамід.
14. Проміжна сполука, яку вибрано з групи, що включає
2-(3-(S)-фторпіролідин-1-іл)-1-(S)-фенілетанол;
2-(3-(S)-фторпіролідин-1-іл)-2-(R)-фенілетанол;
2-(R)-феніл-2-(3-піролін-1-іл)етанол;
2-(3-(R)-фторпіролідин-1-iл)-1-(S)-фенілетанол;
2-(3-(R)-фторпіролідин-1-іл)-2-(R)-фенілетанол;
2-(3-(S)-фторпіролідин-1-іл)-1-(R)-фенілетанол;
2-(3-(S)-фторпіролідин-1-іл)-2-(S)-фенілетанол;
2-(3-(S)-хлорпіролідин-1-іл)-1-(S)-фенілетанол; і
2-(3-(S)-хлорпіролідин-1-іл)-2-(R)-фенілетанол.
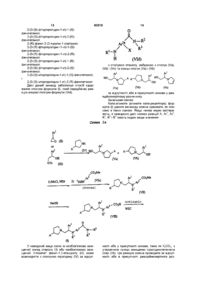
15. Спосіб одержання сполуки формули (І), який включає взаємодію амідної похідної формули (VId):
(VId)
з етанольним похідним, вибраним зі сполук (Va), (Vb) і (Vc) та суміші сполук (Va) і (Vb):
, (Va)
, (Vb)
, (Vc)
за відсутності або в присутності основи у інертному розчиннику.
Текст
1 Сполуки піролідиніл- і піролінілетиламшу формули та їх солі, де А означає водень, галоген, гідрокси, Сі-Сєалкіл, галоген-Сі-Сєалкіл, Сі-Сє-алкокси, галоген-Сг Сєалкокси, оксо, OY, де Y означає пдроксизахисну групу або відсутній, пунктирна ЛІНІЯ означає необов'язковий подвійний зв'язок за умови, що, якщо пунктирна ЛІНІЯ Є ПОДВІЙНИМ зв'язком, А відсутній, Аг1 означає феніл, необов'язково заміщений одним чи кількома замісниками, вибраними з галогену, гідрокси, Сі-С4-алкілу, Сі-С4-алкокси, С1-С4алкокси-Сі-С4-алкокси, CF3, карбокси-Сі-С4алкокси і Сі-С4-алкоксикарбоніл- Сі-С4-алкокси, Аг2 означає арил або гетероарил, вибраний з фенілу, нафтилу, піридилу, тієнілу, фурилу, піролілу та піримідилу, причому арил або гетероарил необов'язково заміщені одним чи кількома замісниками, вибраними з галогену, гідрокси, аміно, нітро, карбокси, Сі-С4-алкілу, Сі-С4-алкокси, С1-С4алкіламшо, ді-Сі-С4-алкіламшо, галоген-Сі-С4алкілу, Сі-С4-алкілтю та сульфонілметилу, R1 означає водень, гідрокси, Сі-С4-алкіл, С1-С4 алкокси або OY, де Y означає пдроксизахисну групу, та R21 R3 незалежно вибрані з водню, гідрокси, С1-С7алкілу, необов'язково заміщеного одним чи кількома гідрокси або галогеном, Сз-Сє-циклоалкілу, Сг-Сє-алкенілу, Сг-Сб-алкінілу, Сі-Суалкокси, фенілу, необов'язково заміщеного галогеном, фенілуСі-С7-алкілу, галогензаміщеного феніл-Сі-С7алкілу і (CH2)nX-R4, де п дорівнює 1 або 2, X означає О, NH або S і R4 означає Сі-Сз-алкіл або, коли Аг2 являє собою феніл, то -Ar2-C(=O)-N(R2) - являє собою фталімідну групу і R3 являє собою С1-С7алкіл, або R2 і R3 разом з атомом азоту, до якого вони приєднані, утворюють піролідинове, піперидинове або морфолінове кільце, необов'язково заміщене d Сз-алкілом чи галогеном 2 Сполука за п 1, де А означає водень, галоген, гідрокси, оксо або OY, або, якщо пунктирна ЛІНІЯ означає подвійний зв'язок, А відсутній, Аг1 означає феніл, необов'язково заміщений одним-трьома замісниками, вибраними з галогену, гідрокси, Сі-С4-алкокси, карбокси-Сі-С4-алкокси і Сі-С4-алкокси карбон іл-Сі-С4-алкокси, Аг2 означає феніл, піридил аботієніл, необов'язково заміщений одним-двома галогенами або С1-С4алкокси, R1 означає водень, гідрокси або Сі-С4-алкіл, і R2 і R3 незалежно вибрані з водню, Сі-С7-алкілу, необов'язково заміщеного одним чи кількома гідрокси або галогенами, Сз-Сє-циклоалкілу, Сг-Сєалкенілу, Сг-Сб-алкінілу, Сі-С4-алкокси, фенілу та галогензаміщеного феніл-Сі-С7-алкілу або, коли Аг2 означає феніл, -Ar2-C(=O)-N(R2)- означає фталімідну групу і R3 означає Сі-С7-алкіл,або R2 і R разом з атомом азоту, до якого вони приєднані, утворюють піролідинове або морфолінове кільце 3 Сполука за п 2, де А означає водень, фтор, хлор, гідрокси або OY, де Y означає метоксиметил або тетрапдропіраніл, або, якщо пунктирна ЛІНІЯ Є ПОДВІЙНИМ ЗВ'ЯЗКОМ, А відсутній, Аг означає феніл, необов'язково заміщений хлором, гідрокси, метокси або карбоксиметокси, Аг2 означає феніл, піридил аботієніл, необов'язко О C O О (О во заміщений хлором, фтором або метокси, 1 R означає Сі-С4-алкіл, 2 R означає Сі-Суалкіл, необов'язково заміщений гідрокси або фтором, Сг-Сє-алкеніл, галогензаміщений фенілметил або феніл, і R означає водень чи метил, або 2 3 R і R разом з атомом азоту, до якого вони приєднані, утворюють піролідинове або морфолінове кільце 4 Сполука за п 3, де А означає гідрокси, фтор чи хлор, або, якщо пунктирна ЛІНІЯ являє собою подвійний зв'язок, А від1 сутній, Аг означає феніл, необов'язково заміще2 ний карбоксиметокси, Аг означає феніл необов'язково заміщений метокси або піридил, R 2 означає Сі-С4-алкіл, R означає Сі-Суалкіл, не3 обов'язково заміщений гідрокси, і R означає водень 5 Сполука за п 4, яку вибрано з групи, що включає 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-г\Г-пропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-2-метокси-г\Гпропілбензамід, 6-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-г\Г-пропілнікотинамід, 4-{М-[1-(3)-(3-карбоксиметоксисреніл)-2-(3-(3)пдроксипіролідин-1-іл)етил]-г\І-метиламіно}-г\Гпропілбензамід, 4-{М-[2-(3-(3)-фторпіролідин-1-іл)-1-(3)-фшілетил]г\І-метиламіно}-г\Г-пропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фінілетил]-г\І-метиламіно)-г\Г-(2-(3)пдроксипропіл)бензамід, 5-{М-[2-(3-(3)-фторпіролідин-1-іл)-1-(3)-фенілетил]г\І-метиламіно}-г\Г-пропілпіколінамід, 4-{г\І-метиламіно-г\І-[2-(3-піролін-1-іл)-1-(3)фенілетил]}-І\Г-пропілбензамід, і 4-{М-[2-(3-(3)-хлорпіролідин-1-іл)-1-(3)-фшілетил]М-метиламіно}-г\Г-(2-(3)-пдроксипропіл)бензамід 6 Сполука за п 3, яку вибрано з групи, що включає 4-{М-[2-(3-(3)-гідроксипіролідин-1-іл)-1-(3)фенілетил]-г\І-метиламіно}-г\Г-ізопропілбензамід, 3-{N-[2-(3-(S)-riflpoKCHniponiflHH-1-UT)-1-(S)фенілетил]-г\І-метиламіно}г\Г-пропілбензамід, 2-хлор-4-{І\І-[2-(3-(3)-пдроксипіролідин-1 -іл)-1 -(S)фенілетил]-г\І-метиламіно}-г\Г-пропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-3-метокси-М'пропілбензамід, 3-хлор-4-{М-[2-(3-(3)-гідроксипіролідин-1 -іл)-1 -(S)фенілетил]-М-метиламшо}-М'-пропілбензамід, 4-{М-[1-(3)-(3-пдроксифеніл)-2-(3-(3)пдроксипіролідин-1-іл)етил]-М-метиламшо}-Мпропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)-(3метоксифеніл)етил]-М-метиламшо}-М'пропілбензамід, 4-{N-[1 -(3)-феніл-2-(піролідин-1 -1л)етил]-Ыметиламшо}-М'-пропілбензамід, 4-{М-[1-(3)-(3-хлорфеніл)-2-(3-(3)пдроксипіролідин-1-іл)етил]-М-метиламшо}-М'пропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(R) 60310 фенілетил]-М-метиламшо}-М'-пропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}піролідинбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламіно}морфолшбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фeнlлeтил]-N-мeтилaмlнo}-N'-(2-(R)пдроксипропіл)бензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-ізобутилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо)-М'-алілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-г\Г-(3,3,3трифторпропіл)бензамід, 3-фтор-4-{М-[2-(3-(3)-гідроксипіролідин-1-іл)-1-(3)фенілетил]-М-метиламшо)-М'-пропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-г\Г-(2,2,3,3,3пентафторпропіл)бензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо)-М'-третамілбензамід, 5-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-г\Г-пропілпіколінамід, 4-{М-[2-(3-(3)-фторпіролідин-1-іл)-1-(3)-фенілетил]М-метиламіно}-М'-(2-(3)-гідроксипропіл)бензамід, 2-хлор-4-{М-[2-(3-(3)-фторпіролідин-1-іл)-1-(3)фенілетил]-М-метиламшо}-М'-пропілбензамід, і 4-{М-[2-(3-(3)-хлорпіролідин-1-іл)-1-(3)-фенілетил]М-метиламшо}-М'-пропілбензамід 7 Сполука за п 2, яку вибрано з групи, що включає 4-{М-[2-(3-(3)-гідроксипіролідин-1-іл)-1-(3)фенілетил]-г\І-метиламіно}-г\Г-метилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-етилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно)-г\Г-бутилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-пентилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-фенілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-(2хлорбензил)бензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо)-М',М'-диметилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-метил-М'пропілбензамід, 5-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо)-М'-пропіл-2тюфенкарбоксамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]амшо}-М'-пропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-пропіл фталімід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-етоксибензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-(3пдроксипропіл)бензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}М'-циклопропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-(3)-втор бутилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно)-г\Г-^)-вторбутилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламіно)-г\Г-пропарплбензамід, 4-{М-[1-(Р)-(3-карбоксиметоксифеніл)-2-(3-(3)пдроксипіролідин-1-іл)етил]-г\І-метиламіно}-М'пропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-г\Г-третбутилбензамід, 4-{N-riflpoKCH-N-[2-(3-(S)-riflpoKCHniponiflHH-1-in)-1(3)-фенілетил]аміно)-г\Г-пропілбензамід, 4-{М-[2-(3-(3)-фторпіролідин-1-іл)-1-(3)-фенілетил]І\І-пдроксіаміно}-М'-пропілбензамід, 4-{І\І-[2-(3-^)-фторпіролідин-1-іл)-1-(3)-фенілетил]г\І-метиламіно}-г\Г-пропілбензамід, 4-{М-[2-(3-(3)-фторпіролідин-1-іл)-1-(Р)-фенілетил]г\І-метиламіно}-г\Г-пропілбензамід, 4-{І\І-[2-(3-(3)-хлорпіролідин-1-іл)-1-(3)-фенілетил]М-метиламіно)-г\Г-(2-^)-пдроксипропіл)бензамід, і 4-{М-[2-(3-оксопіролідин-1-іл)-1-(3)-фенілетил]-І\Іметиламшо)-г\Г-пропілбензамід 8 Фармацевтична композиція для запобігання або лікування медичного стану, для якого необхідним є вияв агоністичної активності щодо опюїдного капа-рецептора у ссавця, яка містить терапевтично ефективну КІЛЬКІСТЬ сполуки за п 1 і фармацевтично інертний носій 9 Фармацевтична композиція за п 8, корисна як аналгезивний, анестезувальний, протизапальний або нейропротективний агент 10 Фармацевтична композиція за п 8, корисна для лікування артриту, мозкового удару, включаючи тромбоз, крововилив і емболію або функціонального захворювання травного тракту 11 Спосіб лікування медичного стану у ссавця, при якому необхідним є виявлення агоністичної активності щодо опюмдного кал а-рецептора, який включає введення ссавцю терапевтично ефективної КІЛЬКОСТІ сполуки за п 1 12 Проміжна амідна сполука формули 60310 X означає водень, галоген або Сі-Суалкокси, 1 R означає водень, необов'язково захищену пдроксигрупу або Сі-С4-алкіл, і 2 3 R і R незалежно означають водень або С1-С7алкіл, необов'язково заміщений гідрокси або галогеном 13 Сполука за п 12, яку вибрано з групи, що включає 4-метиламшо-г\Г-пропілбензамід, 5-метиламіно-г\Г-пропілпіколінамід, 2-хлор-4-метиламшо-г\Г-пропілбензамід, 4-метиламіно-г\Г-(2-(3)-пдроксипропіл)бензамід, 4-метиламіно-г\Г-(2-^)-пдроксипропіл)бензамід, 4-метиламіно-І\Г-(2,2,3,3,3пентафторпропіл)бензамід, і 4-метиламшо-г\Г-трет-амілбензамід 14 Проміжна сполука, яку вибрано з групи, що включає 2-(3-(3)-фторпіролідин-1-іл)-1-(3)-фенілетанол, 2-(3-(3)-фторпіролідин-1-іл)-2-^)-фенілетанол, 2-^)-феніл-2-(3-піролш-1-іл)етанол, 2-(3-(R)-фтopпlpoлlдин-1-lл)-1-(S)-фeнlлeтaнoл, 2-(3-(R)-фтopпlpoлlдин-1-lл)-2-(R)-фeнlлeтaнoл, 2-(3-(S)-cpTopmponiflHH-1-in)-1-(R)-cpeHineTaHon, 2-(3-(3)-фторпіролідин-1-іл)-2-(3)-фенілетанол, 2-(3-(3)-хлорпіролідин-1-іл)-1-(3)-фенілетанол, і 2-(3-(S)-xлopпlpoлlдин-1-lл)-2-(R)-фeнlлeтaнoл 15 Спосіб одержання сполуки формули (І), який включає взаємодію амідної похідної формули (Vld) О N А к \ (d V) l к з етанольним похідним, вибраним зі сполук (Va), (Vb) 1 (Vc) та суміші сполук (Va) 1 (Vb) О N н де Аг , (vid) означає феніл, піридил або ТІЄНІЛ, Аг1 (Va) (Vb) за відсутності або в присутності основи у інертному розчиннику (Vc) 60310 Даний винахід стосується нових сполук піролідиніл- і піролінілетиламшу та їх фармацевтично прийнятних солей і фармацевтичних композицій, що містять їх Фармацевтично активні сполуки даного винаходу можуть використовуватись як вибірні агоністи капа-рецептора ОПІОІДНІ аналгезивні речовини, такі як морфін, застосовні в терапії, але їх придатність суворо обмежена внаслідок їх побічних ефектів, таких як лікарська залежність та зловживання ліками Таким чином, бажаними є аналгезивні речовини з високою корисністю і із зниженою тенденцією індукування лікарської залежності Значні фармакологічні та біохімічні дослідження проводились для виявленням опюїдних пептидів та опюїдних рецепторів, і відкриття підтипу опюїдного рецептора, такого як мю (ц), дельта (5), капа (к), в різних видах, у тому числі в людині, поклало початок створенню нових аналгезивних засобів Оскільки вважається, що ОПІОІДНІ аналгезивні засоби, такі як морфін, діють як агоністи JJ,-рецептора, досліджували відділення дії на основі агоніста к-рецептора, від дії на основі агоніста ц-рецептора Недавно про капа-вибірні агоністи (капа-агоністи) повідомлялося з зазначеної вище точки зору, наприклад, EMD-61753 A Barber et al , Вг J Pharmacol, Vol 113, рр 1317-1327, 1994 Деякі з них зараз вже випробувані в КЛІНІЧНИХ випробуваннях (Med Res Rev, Vol 12, p 525, 1992) Європейський Патент №ЕР 0254545 B1 описує численні сполуки етилендіаміну Європейський Патент №ЕР 0483580 А2 описує численні сполуки піролідину як аналгетики Міжнародна Публікація WO 96/30339 описує велике різноманіття сполук піролідинілпдроксамової кислоти як вибірні агоністи капа-рецептора Даний винахід забезпечує сполуку такої формули О Аг N -т>3 та и солі, де А означає водень, галоген, гідрокси, С-і-Сє (більш прийнятно С1-С4) алкіл, галоген -С-і-Сє (більш прийнятно С1-С4) алкіл, С-і-Сє (більш прийнятно С1-С4) алкокси, галоген -С-і-Сє (більш прийнятно Сі-С4)алкокси, оксо, OY, де Y означає пдроксизахисну групу або відсутній, пунктирна ЛІНІЯ означає необов'язковий подвійний зв'язок за умови, що, якщо пунктирна ЛІНІЯ є подвійним зв'язком, А відсутній, Аг1 означає феніл, необов'язково заміщений одним чи кількома (більш прийнятно одним-двома) замісниками, вибраними з галогену, гідрокси, d С4-алкілу, Сі-С4-алкокси, Сі-С4-алкокси-Сі-С4алкокси, CF3, карбокси-Сі-С4-алкокси і С1-С4алкокси карбон і л-Сі-С4-алкокси, Аг2 означає арил або гетероарил, вибраний з 8 фенілу, нафтилу, піридилу, тієнілу, фурилу, піролілу та піримідилу, причому арил або гетероарил необов'язково заміщені одним чи кількома (більш прийнятними одним-двома) замісниками, вибраними з галогену, гідрокси, аміно, нітро, карбокси, Сі-С4-алкілу, Сі-С4-алкокси, Сі-С4-алкіламшо, діСі-С4-алкіламшо, галоген-Сі-С4-алкілу, С1-С4алкілтюта сульфонілметилу, 1 R означає водень, гідрокси, Сі-С4-алкіл, d С4-алкокси або OY, де Y означає пдроксизахисну групу, та 2 3 R і R незалежно вибрані з водню, гідрокси, Сі-Суалкілу, необов'язково заміщеного одним чи кількома (більш прийнятно одним-п'ятьма) гідрокси або галогеном, Сз-Сє-циклоалкілу, Сг-Сє-алкенілу, Сг-Сб-алкінілу, С1-С7 (більш прийнятно dСб)алкокси, фенілу, необов'язково заміщеного галогеном (більш прийнятно заміщеного одним чи двома атомами галогену), фенілу-Сі-С? (більш прийнятно С1-С5) алкілу, галоген-заміщеного феніл-Сі-С7-алкілу і (CH2)nX-R4, де п дорівнює 1 або 2, X означає О, NH або S і R4 означає Сі-Сз-алкіл, або, коли Аг2 являє собою феніл, -Аг2-С (=О)N(R2)- являє собою фталімідну групу і R3 являє собою Сі-С7-алкіл, або R2 і R3 разом з атомом азоту, до якого вони приєднані, утворюють піролідинове, піперидинове або морфоліновекільце, необов'язково заміщене Сі-Сз-алкілом чи галогеном Коли Аг2 являє собою феніл, R2R3N-C(=O)знаходиться більш прийнятно в мета- або параположенні на фенільному КІЛЬЦІ ВІДНОСНО 2-(А піролідиніл)-1-Аг1-етил-г\І^1)- Коли оксо вибрано як "А"-групу, очевидно, що атом кисню повинен бути приєднаний до піролідинільної групи через подвійний зв'язок Сполуки пірол ід иніл- та пірол ідинетиламшу даного винаходу формули (І) виявляють гарну активність агоніста капа-рецептора і, отже, можуть застосовуватись як аналгезивні, анестезувальні, протизапальні або нейропротективні агенти і також застосовні у лікуванні артриту, раптового мозкового нападу (крововиливу, тромбозу, емболії) або функціонального захворювання травного тракту, такого як біль в животі, для лікування суб'єктуссавця, зокрема, суб'єкту-людини Конкретно, ці сполуки є застосовними як аналгезивні засоби для гострого і хронічного болю Зокрема, ці сполуки застосовні як аналгезивні засоби у центральній нервовій системі у ссавці Також ці сполуки можуть застосовуватись як аналгезивні засоби для периферійно медійованого запального болю, зумовленого, наприклад, опіками (індукованими контактом з нагріванням, кислотою або іншими агентами), опіками (індукованими контактом з гарячою рідиною чи парою), ревматизмом тощо, в означеному суб'єкті Таким чином, даний винахід забезпечує фармацевтичну композицію, що є застосовною як аналгезивний, анестезувальний, протизапальний або нейропротективний агент і також є застосовною у лікуванні названих вище захворювань, яка містить терапевтично ефективну КІЛЬКІСТЬ сполуки формули (І) і фармацевтично прийнятний носій Даний винахід забезпечує також спосіб ліку 60310 вання медичного стану, для якого необхідна агоністична активність щодо опюїдного капарецептора, в суб'єкті-ссавці, який передбачає введення цьому суб'єкту терапевтично ефективної КІЛЬКОСТІ сполуки формули (І) У цьому описі термін "пдроксизахисна група" означає функціональну групу для захисту пдроксигрупи проти небажаних реакцій під час синтетичних процедур, у тому числі, але не тільки, бензил, бензоїл, метоксиметил, тетрапдропіраніл і триалКІЛСИЛІЛ Термін "Сі-Сб-алкіл" означає тут прямий або розгалужений алкіл, у тому числі, але не тільки, метил, етил, н-пропіл, ізопропіл, н-бутил, вторбутил, трет-бутил тощо Термін "Сі-Сб-алкокси" означає тут прямий або розгалужений -OR- (R означає С-і-Сє-алкіл), утому числі, але не тільки, метокси, етокси, пропокси, ізопропокси, н-бутокси, ізобутокси, трет-бутокси тощо Термін "галоген" означає F, СІ, Вг або І, більш прийнятно F або СІ Термін "галоген-Сі-Сє-алкіл" означає прямий або розгалужений, галогензаміщений алкіл з 1-6 атомів вуглецю, у тому числі, але не тільки, метил, етил, н-пропіл, ізопропіл, н-бутил, втор-бутил і трет-бутил, заміщений 1-13 (більш прийнятно 1-5) атомами галогену Термін "галоген-Сі-Сє-алкокси" означає С-і-Сєалкокси, заміщений 1-13 (більш прийнятно 1-3) атомами галогену Термін "галогензаміщений феніл-Сі-Суалкіл" означає Сі-Суалкіл, який має фенільну групу, приєднану до його кінцевого атому вуглецю, причому ця фенільна група заміщена одним-п'ятьма (більш прийнятно одним-двома) атомами галогену Більш прийнятна група сполук даного винаходу включає сполуки формули (І), де А означає водень, галоген, гідрокси, оксо або OY, або, якщо пунктирна ЛІНІЯ означає подвійний зв'язок, А відсутній, Аг1 означає феніл, необов'язково заміщений одним-трьома замісниками, вибраними з галогену, гідрокси, Сі-Скалко кс и, карбокси-Сі-С4-алкокси і Сі-С4-алкокси карбон іл-Сі-С4-алкокси, Аг2 означає феніл, піридил або ТІЄНІЛ, необов'язково заміщений одним-двома галогенами або Сі-С4-алкокси, R1 означає водень, гідрокси або Сі-С4-алкіл, і R2 і R3 незалежно вибрані з водню, С1-С7алкілу, необов'язково заміщеного одним чи кількома гідрокси або галогенами, Сз-Сє (більш прийнятно С3-С4) циклоалкілу, Сг-Сє-алкенілу, Сг-Сє (більш прийнятно С2-Сз)алкшілу, С1-С4алкоксифенілу та галогензаміщеного Сі-Суалкілу, коли Аг2 означає феніл, -Ar2-C(=O)-N(R )- означає фталімідну групу і R3 означає Сі-Суалкіл, або R2 і R3 разом з атомом азоту, до якого вони приєднані, утворюють піридинове або морфолінове кільце Ще більш прийнятна група даного винаходу включає сполуки формули (І), де А означає водень, фтор, хлор, гідрокси або OY, де Y означає метоксиметил або тетрапдропіраніл, або, якщо пунктирна ЛІНІЯ Є ПОДВІЙНИМ ЗВ'ЯЗ КОМ, А відсутній, або 10 Аг1 означає феніл, необов'язково заміщений хлором, гідрокси, метокси або карбоксиметокси, Аг2 означає феніл, піридил або ТІЄНІЛ, необов'язково заміщений хлором, фтором або метокси, R1 означає Сі-С4-алкіл, R2 означає С1-С7 (більш прийнятно С1-С5) алкіл, необов'язково заміщений гідрокси або фтором, Сг-Сб (більш прийнятно С2-Сз)алкеніл, галогензаміщений фенілметил або феніл, і R3 означає водень чи метил, або R2 і R3 разом з атомом азоту, до якого вони приєднані, утворюють піролідинове або морфолінове кільце Ще більш прийнятною групою даного винаходу є сполуки формули (І), де А означає гідрокси, фтор чи хлор, або, якщо пунктирна ЛІНІЯ являє собою подвійний зв'язок, А відсутній, Аг1 означає феніл, необов'язково заміщений карбоксиметокси, Аг2 означає феніл, необов'язково заміщений метокси або піридилом, R1 означає Сі-С4-алкіл, R2 означає Сі-С7-алкіл, необов'язково заміщений гідрокси, і R3 означає водень Більш прийнятними індивідуальними сполуками є 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламіно}-г\Г-пропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-2-метокси-г\Гпропілбензамід, 6-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-М'-пропілнікотинамід, 4-(І\І-[1-(3}-(3-карбоксиметоксифеніл)-2-(3-(3)пдрокси-піролідин-1-іл)етил]-М-метиламіно}-г\Гпропілбензамід, 4-{N-[2-(3-(S)-4mjpmponiflHH-1-in)-1-(S)фенілетил]-М-метиламіно}-г\Г-пропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-г\Г-(2-(3)пдроксипропіл)бензамід, 5-{N-[2-(3-(S)-4mjpmponiflHH-1-in)-1-(S)фенілетил]-М-метиламіно}-г\Г-пропілпіколінамід, 4-{N-Me™-iaMiHO-N-[2-(3-mponiH-1-in)-1-(S)фенілетил]}-г\Г-пропілбензамід, і 4-(N-[2-(3-(S)-xnopmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-г\Г-(2-(3)пдроксипропіл)бензамід Іншими більш прийнятними індивідуальними сполуками є 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламіно}-г\Г-ізопропілбензамід, 3-(N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламіно}-г\Г-пропілбензамід, 2-хлор-4-{г\І-[2-(3-(3)-пдроксипіролідин-1 -іл)-1 (3)-фенілетил]-г\І-метиламіно}-г\Г-пропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-3-метокси-г\Гпропілбензамід, 3-хлор-4-{М-[2-(3-(3)-гідроксипіролідин-1 -іл)-1 (3)-фенілетил]-М-метиламіно}-г\Г-пропілбензамід, 4-{N-[1-(S)-(3-riflpoKCH(peHin)-2-(3-(S)пдроксипіролідин-1-іл)етил]-М-метиламіно}-г\Гпропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)-(3метокси-феніл)етил]-г\І-метиламіно}-г\Гпропілбензамід, 60310 12 11 4-{N-[1 -(3)-феніл-2-(піролідин-1 -іл)етил]-І\Іфеніл етил]-М-метиламшо}-М'-(3метиламіно}-г\Г-пропілбензамід, пдроксипропіл)бензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)4-{N-[1-(S)-(3-xnopcpeHin)-2-(3-(S)фенілетил]-М-метиламшо}-М'гідроксипіролідин-1-іл)етил]-г\І-метиламіно)-г\Гциклопропілбензамід, пропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(R)4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламіно}-г\Г-пропілбензамід, фенілетил]-М-метиламшо}-М'-(3)-вторбутилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламшо}піролідинбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-(Р)-втор4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)бутилбензамід, фенілетил]-г\І-метиламіно}морфолшбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)4-(N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-г\Г-(2-^)фенілетил]-М-метиламіно}-І\Г-пропарплбензамід, пдроксипропіл)бензамід, 4-{М-[1-(Р)-(3-карбоксиметоксифеніл)-2-(3-(3)пдрокси-піролідин-1-іл)етил]-М-метиламшо}-М'4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)пропілбензамід, фенілетил]-г\І-метиламіно}-М'-ізобутилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-г\І-метиламіно}-г\Г-алілбензамід, фенілетил]-І\І-метиламіно}-І\Г-трет-бутилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)4-{N-riflpoKCH-N-[2-(3-(S)-riflpoKCHniponiflHH-1фенілетил]-І\І-метиламіно}-М'-(3,3,3іл)-1-(3)-фенілетил]аміно}-М'-пропілбензамід, трифторпропіл)бензамід, 4-{N-[2-(3-(S)-(p7opmponiflHH-1-in)-1-(S)3-фтор-4-(г\І-[2-(3-(3)-пдроксипіролідин-1-іл)-1фенілетил]-М-пдроксіаміно}-М'-пропілбензамід, (3)-фенілетил]-г\І-метиламіно)-г\Г-пропілбензамід, 4-{N-[2-(3-(R)-(p7opmponiflHH-1-in)-1-(S)4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-пропілбензамід, фенілетил]-М-метиламшо}-М'-(2,2,3,3,34-{N-[2-(3-(S)-(p7opmponiflHH-1-in)-1-(R)пентафторпропіл)бензамід, фенілетил]-М-метиламшо}-М'-пропілбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)4-{N-[2-(3-(S)-xnopmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-трет-амілбензамід, фенілетил]-М-метиламшо}-М'-(2-(Р)5-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)пдроксипропіл)бензамід, і фенілетил]-М-метиламіно}-М'-пропілпіколшамід, 4-{М-[2-(3-оксопіролідин-1-іл)-1-(3)-фенілетил]М-метиламшо}-М'-пропілбензамід 4-{N-[2-(3-(S)-4mjpmponiflHH-1-in)-1-(S)Далі, даний винахід забезпечує сполуку такої фенілетил]-М-метиламшо}-М'-(2-(3)формули пдроксипропіл)бензамід, 2-xnop-4-{N-[2-(3-(S)-4mjpmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-пропілбензамід, і 4-{N-[2-(3-(S)-xnopmponiflHH-1-in)-1-(S)фенілетил]-М-метиламіно)-І\Г-пропілбензамід R» Іншими більш прийнятними сполуками є 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-метилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо)-М'-етилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-бутилбензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)фенілетил]-М-метиламшо}-М'-пентилбензамід, А г а означає феніл, піридил або ТІЄНІЛ, 4-(N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)X означає водень, галоген або Сі-Суалкокси, фенілетил]-І\І-метиламіно}-М'-фенілбензамід, R1 означає водень, необов'язково захищену п4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)дроксигрупу або Сі-С4-алкіл, і фенілетил]-М-метиламшо}-М'-(2R2 і R3 незалежно означає водень або С1-С7хлорбензил)бензамід, алкіл, необов'язково заміщений гідрокси або гало4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)геном фенілетил]-І\І-метиламіно}-І\Г, N'-диметилбензамід, Більш прийнятними сполуками формули (VId) 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)є фенілетил]-М-метиламшо}-М'-метил-М'4-метиламіно-г\Г-пропілбензамід, пропілбензамід, 5-М-метиламіно-г\Г-пропілпіколінамід, 2-хлор-4-метиламіно-г\Г-пропілбензамід, 5-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)4-метиламіно-М'-(2-(3)фенілетил]-М-метиламшо}-М'-пропіл-2тюфенкарбоксамід, пдроксипропіл)бензамід, 4-{N-[2-(3-(S)-riflpoKCHniponiflHH-1-in)-1-(S)4-MeTnnaMiHO-N'-(2-(R)фенілетил] аміно}-І\Г-пропілбензамід, пдроксипропіл)бензамід, 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)4-метиламшо-М'-(2,2,3,3,3фенілетил]-М-метиламшо}-М'-пропіл фталімід, пентафторпропіл)бензамід, і 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)4-метиламшо-М'-трет-амілбензамід фенілетил]-М-метиламшо}-М'-етоксибензамід, Далі, цей винахід забезпечує сполуки, вибрані 4-{N-[2-(3-(S)-riflpoKCHmponiflHH-1-in)-1-(S)з таких сполук о Rl-N H (VId) 14 13 60310 2-(3-(S)-qbTopniponiflHH-1-in)-1-(S)О феніл етанол, 2-(3-(S)-(pTopniponiflHH-1-in)-2-(R)феніл етанол, 2-(Р)-феніл-2-(3-піролш-1-іл)етанол, 2-(3-(R)-4mjpmponiflHH-1-in)-1-(S)феніл етанол, 2-(3-(R)-(p7opmponiflHH-1-in)-2-(R)феніл етанол, Н (VId) 2-(3-(S)-(pTopniponiflHH-1-in)-1-(R)феніл етанол, з сполукою етанолу, вибраною з сполук (Va), 2-(3-(S)-(p7opmponiflHH-1-in)-2-(S)(Vb) і (Vc) та суміші сполук (Va) і (Vb) феніл етанол, Аг* ^ ^ Аг' 2-(3-(3)-хлорпіролідин-1-іл)-1-(3)-фенілетанол, НО, і 2-(3-(3)-хлорпіролідин-1-іл)-2-^)-фенілетанол Далі даний винахід забезпечує спосіб одержання сполуки формули (І), який передбачає реа(b V} {c V) (a V) кцію амідної сполуки формули (VId), за відсутності або в присутності основи у реакційношертному розчиннику Загальний синтез Капа-агоністи (агоністи кап а-рецептора) формули (І) даного винаходу можна одержати, як описано в таких схемах Якщо немає інших застережень, в наведених далі схемах реакцій А, Аг1, Аг2, R1, R21 R3 мають подані вище значення А NR — Схема 1а Аг1 (П) Аг1 or Аг U 7 он ОН . (Va) (Vb) (Ш) CO2Me l te 2 Ai DMsClHEO 2} IRHN' (VIa) К (Основа) N' A (VH) алкіламін 1 At NaOH .АГ A WSC (УШ) A" У наведеній вище схемі Іа необов'язково заміщений оксид стиролу (II) або необов'язково заміщений 2-тозилат феніл-1,2-етандюлу (III) може взаємодіяти з сполукою піролідину (IV) за відсут ності або у присутності основи, такої як К2СО3, з утворенням суміші заміщених піролідинілетанолів (Va)i (Vb) Цю реакцію можна проводити за відсутності або в присутності реакційнешертного роз 60310 16 15 чинника (наприклад, метанолу (МеОН), етанолу Аг1 є необов'язково заміщеним фенілом, можна (ЕЮН), ізопропілового спирту, тетрапдрофурану одержати згідно з процедурами, описаними, на(ТГФ), диоксану, N.N-диметилформаміду (ДМФ), приклад, в Tetrahedron, Vol 47, рр 9861-9866, диметилсульфоксиду (ДМСО), метиленхлориду Chem Rev, Vol 80, рр 187-213, 1980 або J Org (СН2СІ2), води, бензолу, толуолу, н-гексану або Chem , Vol 47, рр 1229-1232, 1982, з подальшим циклогексану) Цю реакцію можна проводити при тозилуванням, таким як реакція з птемпературі від -78°С до температури дефлегмації толуолсульфонілхлоридом у піридині при 0°С розчинника, більш прийнятно від кімнатної темпеОптично неактивний (Vb) можна одержати згідно з ратури до температури дефлегмації розчинника, процедурами, описаними, наприклад, в Tetraheпротягом 5 хвилин - 48 годин, більш прийнятно від dron Lett, Vol 35, рр 1511-1514, 1994, з подаль0,5 до 12 годин Сполуку (Va) або суміш сполук шим узвичаєним відновленням (Va) і (Vb) можна обробити метансульфонілхлориСполуку формули (І), де А являє собою гідродом у присутності основи, такої як триетиламш, у кси, R2 являє собою алкокси і R3 являє собою вопідхожому розчиннику, такому як дихлоретан, з день, можна одержати з метилбензоату формули подальшим зв'язуванням з метиловим ефіром (VII), де А є гідрокси Спочатку пдроксигрупу месполуки формули (Via) з отриманням проміжної тилбензоатної сполуки можна захистити підхожою сполуки (VII) Цю реакцію сполучання можна прозахисною групою, такою як третводити за відсутності або в присутності основи, бутилдиметилсилільна група Потім пдроксизахитакої як гідрид натрію (NaH), в підхожому полярщену сполуку метилового ефіру можна піддати ному розчиннику, такому як вода, ЕЮН або ДМФ, гідролізу з одержанням відповідної карбонової при температурі від кімнатної температури до текислоти Потім карбонову кислоту можна піддати мператури дефлегмації розчинника, протягом 15 амідуванню з одержанням сполуки (І) Захист гідхвилин - 6 годин рокси можна здійснити реакцією сполуки формули (VII) в ДМФ з трет-бутилдиметилсилілхлоридом і Потім, проміжну сполуку (VII) можна обробити розчином імідазолу при ~0°С протягом 1-6 годин основою, такою як NaOH, в реакційношертному Гідроліз може проводитись в присутності основи, розчиннику, такому як метанол, при температурі такої як гідроксид натрію, у полярному розчиннику, від 0 до 100°С протягом 5 хвилин - 12 годин з одетакому як метанол при температурі дефлегмації ржанням сполуки карбонової кислоти (VIII) розчинника протягом від 1 до 10 годин АмідуванКарбонова кислота (VIII) може взаємодіяти з ня можна проводити з бажаним Оалкіламіном в присутності карбодммідної сполуки з алкілпдроксиламшом у присутності карбодиміду, утворенням сполуки піролідинілетиламшу (І) Зрутакого як WSC, при кімнатній температурі протячною карбодммідною сполукою є 1-етил-3-(3гом від 1 до 24 годин Якщо вимагається вилучендиметиламшопропіл)карбодммід (WSC) Цю реакня захисної групи, можна застосувати узвичаєні цію можна проводити контактуванням по суті еквіпроцедури Наприклад, коли пдроксигрупа захивалентних кількостей карбонової кислоти і алкілащена трет-бутилдиметилсилільною групою, амідну міну з невеликим надлишком КІЛЬКОСТІ карбодиміду сполуку можна обробити тетрабутиламонійфторив підхожому розчиннику Підхожими розчинниками дом в підхожому розчиннику, такому як ТГФ, при є інертні ароматичні вуглеводні, прості ефіри, гакімнатній температурі логеновані вуглеводні, особливо дихлорметан Реакція може мати місце при температурі в діапаСполуку формули (І), де А відсутній і пунктирзоні від -ЗО до 100°С, як правило від 0 до 30°С на ЛІНІЯ є подвійним зв'язком, можна також отрипротягом ЗО хвилин - 24 годин, як правило 12-16 мати реакціями сполучення 2-феніл-2-(3-піролш-1годин при кімнатній температурі Одержаний проіл)етанольноі сполуки (Vc) і бензамідної сполуки, дукт можна виділити і очистити у стандартні спощо їх проілюстровано в схемі 1 а соби Якщо потрібно, пдроксизахисну групу в А одержаної сполуки (І) (тобто Y-OY) можна вилучити у підхожий спосіб для конкретної вибраної захисної групи Наприклад, типову захисну групу метоксиметил можна вилучити каталізованим кислотою гідролізом у присутності кислотного каталізатора, такого як НСІ Іншою зручною захисною групою в А є тетрапдропіранільна група (ТНР) І також може бути усунено каталізованим кислотою гідролізом Підхожими КИСЛОТНИМИ каталізаторами є органічні кислоти, неорганичні кислоти або кислоти Льюіса, такі як оцтова кислота (АсОН), птолуолсульфокислота (p-TsOH), соляна кислота (НСІ) і диметилалюмінійхлорид (МегАІСІ) Більш прийнятним кислотним каталізатором є НСІ Оптично неактивну сполуку (І), де Аг1 є необов'язково заміщеним фенілом, можна одержати, піддавши ВІДПОВІДНИЙ оптично неактивний 2тозилат 1-феніл-1,2-етандюл формули (III) або 1феніл-2-піролідинілетанол (Vb) реакціям, описаним в схемі 1а Оптично неактивні сполуки (III), де (Vc) Похідну етанолу (Vc) можна одержати реакцією ВІДПОВІДНОГО фенілгліцинолу та 1,4 дихлорбутену в присутності основи, такої як Et3N, У реакційношертному розчиннику, такому як етанол, при температурі дефлегмації розчинника протягом 1-24 годин Сполуку формули (І), де А є оксо (=0), можна одержати окисленням відповідної похідної піродинолу Підхожим окисленням є окислення Сверна Далі, сполуки формули (І), де -Ar2-C(=O)-N(R2)є фталімідною групою, можна одержати з використанням сполуки формули (Vlb) 60310 N-R" MeHN (Vlb) замість сполуки (Via) у зазначеній вище схемі 1а Сполуки формули (І), де Аг являє собою ТІЄНІЛ, можна одержати з використанням метиламшотюфенкарбоксаміду формули (Vic) NR2R3 замість сполуки (Via) у зазначеній вище схемі 1а Сполуки (Vic) можна одержати, спочатку реакцією нітротюфенкарбоксальдепду з реагентом Jones з утворенням нітротюфенкарбонової кислоти Потім отриману карбонову кислоту піддають конденсації з сполукою формули NHR R3 і потім відновленню нітрогрупи порошком заліза та хлоридом алюмінію з подальшим метилуванням аміногрупи Сполуки формул (II), (III) і (IV) є або відомими сполуками, що їх можна одержати у ВІДОМІ способи, або вони є аналогами відомих сполук, що їх можна одержати у способи, аналогічні до відомих способів Згідно З добре відомими процедурами або наведеними далі процедурами, можна селективно визначити R, S-конфігурацію сполук (Va) і (Vb) шляхом взаємодії з 3-піролідинолом з ВІДПОВІДНОЮ R, S-конфігурацією Сполуки формули (Va) і (Vb), де А являє собою фтор і Аг являє собою феніл, можна одержати з комерційно доступного 1 -бензил-3піролідинолу Спочатку, пдроксигрупу піролідинолу можна перетворити на підхожу групу, що відходить, таку як п-толуолсульфонат Це перетворення можна досягти реакцією піролідинолу з птолуолсульфонілхлоридом у піридині Потім, групу, що уходить, можна витіснити фтором реакцією з підхожим фторувальним агентом, таким як тетрабутиламонійфторид, у реакційношертному розчиннику, такому як ТГФ Потім, 3-фторпіролідин можна піддати гідруванню з подальшим сполученням з стиролоксидом формули (II) Гідрування можна проводити у присутності підхожого каталізатора, такого як гідроксид паладію на вугіллі в атмосфері водню у реакційношертних розчинниках, таких як ЕЮН, при температурі від 0°С до кімнатної температури протягом 5 хвилин - 48 годин, більш прийнятно 12-36 годин Реакція поєднання може проходити за відсутності або в присутності реакційношертного розчинника, такого як EtOH Сполуки формули (Va) і (Vb), де А є хлором і 18 1 Аг є фенілом, можна також одержати з 1-бензил3-піролідинолу Наприклад, 1-бензил-Зпіролідинол можна піддати хлоруванню з одержанням 1-бензил-З-хлорпіролідину Бензильну групу 1-бензил-З-хлорпіролідину можна вилучити обробкою 1 -бензил-3хлорпіролідину 1хлоретилхлорформіатом з подальшим сполученням з стиролоксидом формули (II) Хлорування 1бензил-3-піролідинолу можна проводити за звичайних умов, наприклад, у присутності підхожого реагенту, такого як трифенілфосфш, в підхожому розчиннику, такому як ССЦ, при кімнатній температурі Дебензилювання, як правило, проводять у реакційношертному розчиннику, такому як дихлоретан, при температурі дефлегмації розчинника протягом 5 хвилин - 3 годин Потім розчинник можна випарити, та залишок піддати реакції сполучення з стиролоксидом у підхожому розчиннику, такому як ЕЮН, при температурі дефлегмації розчинника протягом 5 хвилин - 4 годин Сполуки формули (Va) і (Vb), де А є галогеном і Аг1 є необов'язково заміщеним фенілом, можна одержати з бажаної N-захищеноі сполуки 3піролідинолу через ВІДПОВІДНИЙ N-захищений Згалогенпіролідин По-перше, 1-бензил-Зпіролідинол можна обробити підхожим галогенувальним реагентом в реакційношертному розчиннику, наприклад, трифенілфосфшом в ССЦ, при температурі дефлегмації розчинника протягом від З до 36 годин По-друге, 1-бензил-З-хлорпіролідин можна очистити, і депротектування провести за умов, відомих фахівцю у цій галузі (наприклад, з 1хлоретилхлорформіатом в дихлоретані при 0°С протягом ЗО хвилин - 6 годин) По-третє, 3хлорпіролідин можна обробити сполукою стиролоксиду з одержанням етанолів (Va) і (Vb) згідно з процедурами, що їх проілюстровано в схемі 1а ПОХІДНІ метилового ефіру формули (Via), де Аг2 являє собою необов'язково заміщений феніл, є відомими сполуками або їх можна одержати обробкою заміщеної сполуки 4-амшобензойноі кислоти алкілгалогенідом у присутності основи, такої як NaH або ІЧагСОз, у реакційноінертном розчиннику, такому як ДМФ Більш конкретно, сполуки формули (Via) можна одержати такими способами А Метил-3-метиламшобензоат формули (Via) можна одержати спочатку метилуванням 3ацетамідбензойної кислоти в присутності основи, такої як NaH, у реакційношертному розчиннику, такому як ДМФ, з подальшим деацетилуванням у присутності кислотного каталізатора, такого як концентрована сірчана кислота (H2SO4) В Сполуку формули (Via), де Аг заміщений фтором і R1 являє собою водень, можна одержати з нітробензойної кислоти етерифікацією нітробензойної кислоти з подальшим відновленням Етерифікацію можна здійснювати в присутності кислотного каталізатора, такого як сірчана кислота, в МеОН при температурі дефлегмації розчинника протягом 1 - 12 годин Відновлення можна проводити в присутності відновлювального агента, такого як порошок заліза, у підхожому розчиннику, такому як оцтова кислота, при температурі від кімнатної температури до 60°С протягом 0,5-6 годин Якщо бажано, аміногрупу можна алкілувати у 20 19 60310 добре відомий спосіб Наприклад, спочатку метиллоту можна піддати амідуванню за умов, подібних овий ефір можна обробити трифтороцтовим ангіддо умов, що їх проілюстровано в схемі 1а Якщо ридом у присутності основи, такої як ЫагСОз, у бажано, аміногрупу бензамідної сполуки може бупідхожому розчиннику, такому як СН2СІ2, потім ти алкільовано Наприклад, більш прийнятним можна алкілювати підхожим алкілувальним агеналкілувальним агентом є алкілгалогенід, і це алкітом, таким як йодметан Сполуку формули (Via), лювання може проводитися в присутності основи, 2 1 де Аг заміщений хлором і R є алкілом, можна такої як карбонат калію, при приблизно кімнатній одержати з хлорбензойної кислоти алкілуванням температурі протягом 12-24 годин 2а Алкілування може мати місце вприсутності осноС Амідну сполуку (Vld), де Аг є піридилом і 1 ви, такої як NaH, з підхожим алкілгалогенідом у група -NHR знаходиться в положенні 5 та амідна реакційношертному розчиннику, такому як ДМФ, група знаходиться в положенні 2 кільця піридину, при температурі приблизно 0°С протягом 1-24 гоВІДПОВІДНО, можна одержати обробкою амінозахидин щеної ПІКОЛІНОВОІ кислоти оксалілхлоридом з подальшим амідуванням бажаним алкіламіном ОбС Сполуку формули (Via), де Аг є піридилом, робку 5-захищеноі амінопіколінової кислоти група метилового ефіру знаходиться в положенні З 1 оксалілхлоридом можна здійснювати в реакційноіі R HN- знаходиться в положенні 6 кільця піридину, нертному розчиннику, такому як СН2СІ2 або суміш ВІДПОВІДНО, можна одержати етерифікацією 6ДМФ/СН2СІ2, в присутності основи, такої як триамінонікотинової кислоти Неочищений залишок етиламш, при кімнатній температурі Амідування метилового ефіру, отриманий таким чином, можна може проводитись в присутності основи у реакційпіддати метилюванню аміногрупи Підхожим етеношертному розчиннику Основа більш прийнятно рифікувальним агентом є, наприклад, триметилявляє собою триетиламш і реакцію можна провосилілдіазометан Метилювання аміногрупи може дити у підхожому розчиннику, наприклад, дихлопроводитися згідно з тими самими процедурами, ретані, при ~15°С Якщо потрібно, амшозахисну що їх наведено вище для одержання сполук (Via) групу можна вилучити процедурами, відомими Альтернативно, амідну сполуку загальної фофахівцям у цій галузі рмули (Vld) лN о Альтернативний спосіб одержання сполук формули (І) проілюстровано на наведеній нижче схемі ІЬ Схема ІЬ \ /CN 2 R' Н (Vld) де Аг2а, X, R1, R2 і R3 мають наведені вище значення, можна піддати реакції сполучення з сполуками (Va) і (Vb) з прямим одержанням сполуки (І) Цю реакцію сполучення можна проводити за відсутності або в присутності основи, такої як NaH, у реакційношертному розчиннику Більш прийнятні розчинники включають ЕЮН і ДМФ Реакція може проводитися при температурі в діапазоні від -78°С до температури дефлегмації розчинника, більш прийнятно від кімнатної температури до температури дефлегмації, протягом 5 хвилин - 48 годин, більш прийнятно 0,5-24 годин АМІДНІ сполуки формули (Vld) можна одержати згідно з процедурами, описаними нижче А Сполуку формули (Vld), де Аг2а є фенілом, R1 є гідрокси і X є воднем, можна отримати відновленням відомої HiTpo-N-алкілбензамідноі сполуки ПІДХОЖІ відновлювальні агенти включають, наприклад, порошок цинку Це відновлення може проводитися доданням відновлювального агента до суміші HiTpo-N-алкілбензамідноі сполуки і хлориду амонію при кімнатній температурі (наприклад, 2025°С) протягом 1-3 годин В Сполуку формули (Vld), де Аг2а є фенілом, R1 воднем або Сі-С4-алкілом, R2 є Сі-Суалкілом, необов'язково заміщеним гідрокси, R3 є воднем і X є воднем або галогеном, можна одержати з відомої амінобензойної сполуки, де фенільне кільце необов'язково заміщене галогеном Бензойну кис (Va) + (Vb) Ar I /isCl, NEtj M CN А e N H ' ' £V1e) > Ч » - І - І І — — — —>•» 3 ) 4 } Ц ^ , Основа апкоксид алкілгалorєнід N' І R l (Vllb) Суміш сполук (Va) 1 (Vb) можна обробити метансульфонілхлоридом так само, як показано у схемі 1а, з подальшим сполученням з ціаносполукою (Vic) з одержанням сполуки формули (Vllb) Ця реакція сполучення може проводитися у реакційношертному розчиннику, такому як ДМФ або етанол, в присутності або за відсутності основи, такої як NaH, NaNH2 або 2,6-лутидин Ця реакція може мати місце при температурі від кімнатної до температури дефлегмації розчинника протягом ЗО хвилин -12 годин Потім, сполуку (Vllb) можна піддати реакції з підхожим алкоксидом, таким як t-BuOK, у присутності води, в полярному розчиннику, такому як tBuOH Ця реакція може мати місце при температурі дефлегмації розчинника протягом 5 хвилин - 6 годин Потім, ДО отриманої реакційної суміші можна додати підхожий алкілгалогенід Отриману таким чином суміш нагрівають із зворотним холодильником протягом 5 хвилин - 5 годин Цільову сполуку (І) можна виділити та очистити з одержаної реакційній суміші у стандартні способи Ціаносполуки формули (Vic), де Аг2а є заміще 22 21 60310 ним фенілом, можна одержати обробкою відомих відношенні до опюїдного капа-рецептора і, отже, є заміщених 4-амшобензонітрильних сполук NaH застосовними як аналгезивні, анестизувальні, проабо К2СО3 з подальшим алкілуванням алкілгалотизапальні агенти або нейропротективні агенти і генідом у реакційношертному розчиннику, такому також застосовні в лікуванні артриту, мозкового якДМФ нападу або функціонального захворювання травного тракту, такого як біль у животі, для лікування Сполуки формули (І) цього винаходу є основсуб'єкту-ссавця, зокрема, суб'єкту-людини ними і, отже, вони можуть утворювати кислотноадитивні солі Всі такі солі входять до обсягу даноАктивність сполук капа-агоністів формули (І) го винаходу Однак, треба використовувати кислоданого винаходу демонструється зв'язувальною тно-адитивні солі, які є фармацевтично прийнятактивністю щодо опюїдного рецептора Таку актиними для введення ссавцю Кислотно-адитивні вність можна визначити у гомогенаті з суцільного солі можна одержати у стандартні способи, напримозку морської свинки, як описано Regma, A et al , клад, контактуванням основних і кислотних сполук in J Receptor Res, Vol 12, pp 171-180, 1992 Копо суті в еквівалентних співвідношеннях у воді або ротко, гомогенат тканини шкубують при 25°С проорганічному розчиннику, такому як метанол чи тягом ЗО хвилин в присутності міченого ліганда і етанол або їх суміші Ці солі можна виділити випатест-сполук Мю-сайти мітять 1нМ (3H)-[D-Ala2, рюванням розчинника Типові СОЛІ, ЯКІ можуть бути MePhe4, СІу-о15]енкефалшом (DAMGO), дельтаутворені, являють собою солі пдрохлорид, нітрат, сайти 1нМ (3H)-[D-Pen2, 5]енкефалшом (DPDPE) і сульфат, бісульфат, фосфат, ацетат, лактат, циткапа-сайти 0,5нМ (ЗН)-СІ-977 Неспецифічне зв'ярат, тартрат, сукцинат, малат, фумарат, глюконат, зування вимірюють з використанням 1мкМ СІ-977 сахарат, бензоат, метансульфонат, п(капа), 1мкМ (DAMGO) (мю), 1мкМ (DPDPE) (дельтолуолсульфонат, оксалат і памоат (1,1'-метилента) Дані виражають у вигляді величин ICso, отрибіс-(2-пдрокси-3-нафтоат)) маних програмою нелінійної побудови з викорис1 танням рівняння Cheng і Prusoff Деякі сполуки, Сполуки формули (І) даного винаходу, де Аг є приготовані в прикладах, демонстрували переконфенілом, заміщеним карбокси -Сі-С4-алкокси, є ливу величину ІС50 проти капа-рецептора в діапакислими, і вони можуть утворювати основнозоні 0,01 - ЮОнМ адитивні солі Всі ЦІ СОЛІ ВХОДЯТЬ ДО обсягу даного винаходу Однак, треба використовувати сіль основи, що є фармацевтично прийнятною для введення ссавцю Основні СОЛІ можна одержати у стандартні способи, наприклад, контактуванням кислотних або основних сполук по суті в еквівалентних співвідношеннях у воді або органічному розчиннику, такому як метанол чи етанол або їх суміші Солями, що можуть утворюватись, є солі натрію, калію, кальцію та магнію, а також солі з аміаком і амінами, такі як солі етиламшу, діетиламіну, циклогексиламшу, піперидину або морфоліну До обсягу цього винаходу включені також бюпопередники (так звані проліки) сполук капаагоністів формули (І) Бюпопередник капа-агоніста формули (І) є його ХІМІЧНОЮ похідною, що легко перетворюється назад на вихідну сполуку формули (І) в біологічних системах Зокрема, бюпопередник капа-агоніста формули (І) перетворюється назад на вихідну сполуку формули (І) після того, як цей бюпопередник був введений суб'єкту-ссавцю і абсорбувався суб'єктом-ссавцем, наприклад, суб'єктом-людиною Наприклад, можна приготувати бюпопередник капа-агоніста даного винаходу формули (І), в якому один чи обидва А і R1 є пдроксигрупами, одержуючи складний ефір цих пдроксигруп Коли лише один з А і R1 є пдроксигрупою, можливі лише моноефіри Коли обидва А і R1 є пдроксигрупами, можна одержати моно- і діефіри (які можуть бути однаковими чи різними) Типовими ефірами є прості алканоатні ефіри, такі як ацетат, пропюнат, бутират тощо Крім того, коли А або R1 є пдроксигрупою, бюпопередники можна приготувати перетворенням цієї пдроксигрупи на ацилоксиметил похід ну (наприклад, півалоілоксиметилпохідну) реакцією з ацилоксиметилгалогенідом (наприклад, півалоілоксиметилхлоридом) Сполуки капа-агоністи даного винаходу формули (І) виявляють значну агоністичну активність у Аналгезивну активність сполук капа-агоністів в центральній нервовій системі можна також продемонструвати за допомогою Формалінового Теста, описаного Wheeler-Aceto, Н et al , m Psychopharmacology, Vol 104 pp 35-44, 1991 В цьому тестуванні самців щурів SD (80-100г) ін'єкували підшкірне тест-с пол укою, розчиненою в 0,1% метилцелюлозі, сольовому розчині або носи Після ЗО хвилин 50мкл 2% формаліну ін'єкували в задню лапку КІЛЬКІСТЬ облизувань ін'єкованої лапки за період спостереження вимірюють через 15-30 хвилин після ін'єкції формаліну і виражають у вигляді % інгібування порівняно з ВІДПОВІДНОЮ групою носія Деякі сполуки, отримані в прикладах, виявили переконливу величину ED50 в діапазоні менше 25мг/кг р о Активність капа-агоністів проти периферійного гострого болю можна продемонструвати тестом Randall-Sehtto (ME Planas, Pain, Vol 60, pp 6771, 1995) У цьому тестуванні використовували самців щурів SD (100-120г) і поріг сприйняття болю у правій лапці вимірювали у спосіб Randall-Sehtto (Ugo Basile) Після трьох днів акліматизації до умов теста проводили експерименти Гіпералгезію індукували штраплантарною (внутрішньопідошвовою) ІН'ЄКЦІЄЮ 0,1 мл/праву лапку 1% розчину карагеніну Болісне натискування здійснювали на праву підошву за допомогою кліноподібного пістону і рівень ВІДПОВІДІ вимірювали при 3, 5 і 4, 5 годинах після ін'єкції карагеншу Деякі сполуки, отримані в робочих прикладах, описаних нижче, тестували згідно з описаними вище процедурами і вони показали гарну активність проти гострого болю (тобто величину ED50 менше 10мг/кг р о ) Активність капа-агоністів проти хронічного болю в периферії можна продемонструвати за допомогою індукованої ад'ювантом ппералгезм, згідно з процедурою, описаною Judith S Waker et al , як повідомлялося в Life Sciences, Vol 57, pp 371-378, 24 23 60310 1995 У цьому тестуванні використовували самців ють тверді розріджувачі або наповнювачі, щурів SD вагою 180-230г при часі інокуляції Для стерильні водні середовища та різні нетоксичні одержання ад'ювантного артриту крис анестезуорганічні розчинники тощо Крім того, пероральні вали ефіром та інокулювали штрадермально в фармацевтичні композиції можна підхожим чином ступню правої задньої лапки 0,05мл Mycobactenum підсолодити і/або ароматизувати Взагалі, терапеbutyncum, суспендованою в парафіновому маслі втично ефективні сполуки даного винаходу прису(2мг/мл) Поріг сприйняття болю оцінювали тестом тні в таких дозованих формах при рівні концентранатискання на лапку, за допомогою тих самих процій в діапазоні 5%-70% за вагою, більш прийнятно цедур, що описані вище для теста Randal -Sehtto, і 10%-50% за вагою набряк вимірювали як ширину ступні Тести проДля перорального введення, таблетки, що місводили протягом всього періоду тять різні наповнювачі, такі як мікрокристалічна целюлоза, цитрат натрію, карбонат кальцію, дикаСедативну функцію капа-агоністів можна вилій-фосфат і гліцин, можуть застосовуватись разначити Rotarod-тестом, описаним Hayes, A G et зом з різними дезинтеграторами, такими як крохal , in Br J Pharmacol , Vol 79, рр 731-736, 1983 У маль, і більш прийнятно кукурудзяний, цьому випробуванні групу з 6-10 самців щурів SD картопляний крохмаль або крохмаль тапюки, аль(100-120г) відбирають за їх спроможністю баланпнова кислота і деякі комплексовані силікати, расувати на стержні, що обертається (діаметр 9см, зом із зв'язувальними речовинами, що гранулюшвидкість обертання 5об/хвил) Потім відібраних ють, такими як полівшілпіролідон, сахароза, щурів ін'єкують s с тест-с пол укою, розчиненою в желатин та аравійська камедь Додатково, з метою 0,1% сольовому розчині, що містить метилцелютаблетування часто дуже застосовні змащувальні лозу Тварин тестують знову через ЗО хвилин після агенти, такі як стеарат магнію, лаурилсульфат обробки, щура, який впав з стержню більше двох натрію і тальк Тверді композиції подібного типу разів в межах 150 секунд, розглядають як такого, можуть також використовуватись як наповнювачі що виявляє рухову недостатність, і рухову активдля желатинових капсул, більш прийнятні матеріність тварини (тобто час на обертовому стержні) али у цьому зв'язку також включають лактозу або реєструють Величину ED50, що визначається як молочний цукор, а також високомолекулярні полідоза лікарського засобу, що має час рухової актиетиленгліколі Коли водні суспензії і/або еліксири вності, спостерігають у контрольній групі Кілька бажані для перорального введення, активний інгсполук, отриманих в робочих прикладах, описаних редієнт може комбінуватися з різними підсолоджунижче, тестували згідно з описаними вище процевальними агентами або агентами, які покращують дурами смак і запах, барвниками, і, якщо бажано, емульгаФункцію діурезу капа-агоністів можна визначиторами та суспендувальними агентами, а також ти згідно з процедурою, описаною A Barber et al , разом з такими розріджувачами, як вода, етанол, (Br J Pharmacol, Vol III, pp 843-851, 1994) Деякі пропіленгліколь, гліцерин та різні їх комбінації сполуки, отримані в робочих прикладах, описаних нижче, тестували згідно з описаними вище процеДля парентерального введення можуть викодурами ристовуватися розчини даного винаходу або в кунжутному, або в арахісовому маслі чи у водному Сполуки капа-агоністи формули (І) даного випропіленгліколі Водні розчини повинні бути підхонаходу можуть вводитись перорально, парентеражим чином забуферені (більш прийнятно до рН>8), льно або топічно ссавцям Більш прийнятний ріякщо необхідно, і рідкий розріджувач спочатку ровень доз може бути в діапазоні від 0,01 мг до Юмг блять ІЗОТОНІЧНИМ Ці ВОДНІ розчини придатні для на кг ваги тілу на день, хоча будуть обов'язково внутрішньовенних ІН'ЄКЦІЙ Приготування всіх цих мати місце варіації залежно від ваги і стану суб'єкрозчинів в стерильних умовах легко здійснюється ту, якого піддають обробці, причому лікуванню за допомогою стандартних фармацевтичних спопіддають певний патологічний стан і вибирають собів, добре відомих фахівців у цій галузі Крім конкретний спосіб введення Однак рівень дози, того, можна вводити сполуки даного винаходу тощо знаходиться в діапазоні від 0,01 мг до 1 мг на кг пічно (місцево), при обробці запальних станів шківаги тілу на день, у вигляді однієї дози або у вири, і це віддай більш прийнятно робити із застосугляді поділених доз є найбільш застосовним для ванням мазей тощо, згідно застосуванням кремів, людини у випадку лікування болю у постопераційжеле, гелів, паст, мазей тощо із стандартною фаного пацієнта і болю, подібного до ппералгезм, що рмацевтичною практикою викликається хронічними захворюваннями Сполуки даного винаходу можуть вводитися окремо або в комбінації з фармацевтично прийнятними носіями чи розріджувачами будь-яким з зазначених вище шляхів введення, і таке введення може проводитися єдиною дозою або у вигляді численних доз Більш конкретно, нові терапевтичні агенти цього винаходу можуть вводитись у великій різноманітності різних дозованих форм, тобто вони можуть комбінуватися з різними фармацевтичними прийнятними носіями у формі таблеток, капсул, лепішок, пастилок, карамелі, порошків, спреїв, кремів, мазей, супозиторієв, желе, гелів, паст, лосьйонів, мазей, водних суспензій, ІН'ЄКЦІЙНИХ розчинів, еліксирів, сиропів тощо Такі носи включа Приклади і препаративні приклади Даний винахід ілюструється наведеними далі прикладами і одержаннями Однак, повинно бути зрозуміло, що винахід не обмежується до конкретних деталей цими прикладами і одержаннями Точки плавлення визначали у мікроприборі для визначення точки плавлення Buchi і вони є некорегованими Спектр інфрачервоного поглинання (ІЧ) вимірювали в інфрачервоному спектрофотометрі Shimadzu (IR-470) 1Н і 13С-ЯМР вимірювали в CDCI3 за допомогою ЯМР-спектрофотометру JEOL (JNM-GX270, 270МГц), якщо немає інших застережень, і положення ПІКІВ виражають в мільйонних частках (м ч) в бік слабкого поля від тетраметил 26 25 60310 силану Форми ПІКІВ позначають так с, синглет, д, м), 2,20-2,00 (1Н, м), 1,95-1,75 (2Н, м) дублет, т, триплет, м, мультиплет, шир , широкий Препаративний приклад З Препаративний приклад 1 2-(3-(3)-Метоксиметоксипіролідин-1-іл)-1-(3)2-(3-(3)-Метоксиметоксипіролідин-1-іл)-2-(Р)фенілетанол і 2-(3-(3)-Метоксиметоксипіролідин-1феніл етанол іл)-2-(Р)-фенілетанол До перемішуваного розчину (S)-(-)-1,2,4Суміш 3-(3)-метоксиметоксипіролідину (6,10г, бутантрюлу (10,61г, 0,1 моль) у піридині (50мл) 46,5 ммоль) і (3)-(+)-1-феніл-1,2-етандюл-2додавали п-толуолсульфонілхлорид (38,13г, 0,2 тозилату (13,6г, 46,5 ммоль) та К2СО3 (7,06г, 51,1 моль) порціями при 0°С Після 14 годин перемішуммоль) в ЕЮН (80мл) нагрівали із зворотним ховання реакційну суміш виливали у водний розчин лодильником при перемішуванні протягом 4,5 гоконцентрованої НСІ з льодом і підкислювали до рН дин Після випарювання розчинника додавали до 2 Суміш екстрагували ефіром (100мл х 3) Об'єдзалишку СН2СІ2 і промивали насиченим водним наний екстракт промивали насиченим сольовим розчином бікарбонату натрію, насиченим сольорозчином, сушили (Na2SO4) і концентрували з одевим розчином, сушили (Na2SO4) і концентрували з ржанням 18,58г безбарвного масла До перемішуодержанням 14,94г неочищених продуктів, які ваного розчину цього неочищеного дитозилату очищали колонковою хроматографією (силікагель (18,58г, 45,7 ммоль) і диметоксиметану (50мл) в 150г, СН2СІ2/МеОН=50 1-20 1) з одержанням 7,75г СН2СІ2 (50мл) додавали порціями Р2О5 при кімнат(66,4%) коричневого масла у вигляді суміші ній температурі і перемішували протягом 26 годин 0,65 0,35 зазначених у заголовку сполук 1 Шар СН2СІ2 ВІДДІЛЯЛИ і тверду речовину Р2О5 (50г) Н-ЯМР (270МГц, CDCI3) 5 7,40-7,27 (5Н, м), промивали СН2СІ2 (50мл х 4) Об'єднаний шар 4,68-4,63 (2,65Н, м), 4,35-4,15 (1Н, м), 3,90-3,75 СН2СІ2 промивали насиченим водним розчином (0,7Н, м), 3,49 (0,35Н, т, и=5,9Гц), 3,38 (1,95Н, с), бікарбонату натрію і насиченим сольовим розчи3,32 (1,05Н, с), 3,10-2,90 (1,3Н, м), 2,80-2,40 (4Н, ном Після висушування (Na2SO4) розчинник випам), 2,20-2,00 (1Н, м), 1,95-1,75 (2Н, м) рювали з одержанням 18,01г коричневого в'язкого Препаративний приклад 4 масла Суміш цього масла (18,00г, 40 ммоль), R-(2-(R)-eHin-2-(3-(S)-TeTpariflpompaH-2)-2-фенілгліцинолу (4,80г, 35 ммоль) і EtsN ілоксипіролідин-1-іл)етанол і 1-(S)-eHin-2-(3-(S)(11,3мл, 80 ммоль) в етанолі (20мл) нагрівали із тетрапдротран-2-ілоксипіролідин-1-іл) етанол зворотним холодильником з перемішуванням проСуміш одержували з 3-(S)тягом 8 годин Розчинник випарювали і залишок тетрапдропіранілоксипіролідину (3,00г, 17,5 розчиняли в СН2СІ2 (200мл) Цей розчин промиваммоль) і (3)-(-)-стиролоксиду (2,10г, 17,5 ммоль) з ли насиченим водним розчином бікарбонату навиходом 50% у вигляді суміші 0,35 0,65 зазначених трію і насиченим сольовим розчином, сушили у заголовку сполук згідно з процедурою, подібною (Na2SO4) і концентрували з одержанням 16,69г до процедури, описаної в препаративному прикоричневого в'язкого масла, яке очищали колонкокладі 2 вою хроматографією (силікагель 200г, 1 Н-ЯМР (270МГц, CDCI3) 67,50-7,20 (5Н, м), СН2СІ2/Ме0Н 20/1) з одержанням 5,13г (20,4%, 4,71 (0,65Н, дд, J=3,3, 10,6Гц), 4,65-4,50 (1Н, м), загальний вихід) прозорого коричневого в'язкого 4,45-4,25 (1Н, м), 3,95-3,75 (1,7Н, м), 3,60-3,42 масла (1,35Н, м), 3,20-2,40 (5,3Н, м), 2,25-1,45 (9Н, м) 1 Н-ЯМР (270МГц, CDCI3) 6 7,40-7,25 (5Н, м), Препаративний приклад 5 4,62 (1Н, д, J=7,0l~4), 4,58 (1Н, д, и=7,0Гц), 4,254,15 (1Н, м), 3,88 (1Н, дд, J=5,9, 10,6Гц), 3,80 (1Н, дд, J=5,9, 10,6Гц), 3,50 (1Н, т, и=5,9Гц), 3,33 (ЗН, с), 2,76 (1Н, дт, J=6,2, 8,4Гц), 2,71 (1Н, дд, J=5,9, 10,3Гц), 2,63 (1Н, дд, J=3,3, 10,3Гц), 2,45 (1Н, дт, J=6,2, 8,1Гц), 2,18 (1Н, шире), 2,16-2,02 (1Н, м), 1,87-1,75 (1Н, м) ІЧ (чистий) 3450см 1 Препаративний приклад 2 2-(3-(3)-Метоксиметоксипіролідин-1-іл)-1-(3)фенілетанол і 2-(3-(3)-Метоксиметоксипіролідин-1-іл)-2-(Р)феніл етанол Суміш 3-(3)-метоксиметоксипіролідину (4,37г, 33,3 ммоль) і (3)-(-)-стиролоксиду (4,00г, 33,3 ммоль) в ЕЮН (40мл) нагрівали із зворотним холодильніком при перемішуванні протягом 2 годин Після випарювання розчинника залишок очищали колонковою хроматографією (силікагель 120г, СН2СІ2 МеОН=401-201) з одержанням 4,91г (58,7%) блідо-жовтого масла у вигляді суміші 0,65 0,35 зазначених у заголовку сполук 1 Н-ЯМР (270МГц, CDCI3) 5 7,40-7,27 (5Н, м), 4,68-4,63 (2,65Н, м), 4,35-4,15 (1Н, м), 3,90-3,75 (0,7Н, м), 3,49 (0,35Н, т, и=5,9Гц), 3,38 (1,95Н, с), 3,32 (1,05Н, с), 3,10-2,90 (1,3Н, м), 2,80-2,40 (4Н, 27 60310 28 вали з одержанням коричневого масла, яке очиі екстрагували сумішшю AcOEt толуол=2 1 (200мл щали колонковою хроматографією (силікагель х 3) Екстракт промивали водою, насиченим со190г, H-reK/AcOEt=10/1 і силікагель 35г, СН2СІ2 льовим розчином, сушили (Na2SO4) і концентруватільки) З одержанням 481 мг (13%) зазначеної у ли з одержанням 3,08г коричневого масла Суміш заголовку сполуки цього коричневого масла і концентрованої H2SO4 1 (5мл) в МеОН (ЗОмл) нагрівали із зворотним холоН-ЯМР (270МГц, CDCI3)5 7,66 (1Н, дд, J=1,8, дильником при перемішуванні протягом 7 годин 8,4Гц), 7,40 (1Н, д, J=1,8riO, 6,52 (1Н, д, и=8,4Гц), Після охолоджування до кімнатної температури 4,72 (1Н, шир с), 3,89 (ЗН, с), 3,86 (ЗН, с), 2,91 (ЗН, розчинник випарювали Залишок підлуговували Д,и=5,1Гц) насиченим водним розчином ЫаНСОз і екстрагуПрепаративний приклад 7 вали СН2СІ2 Екстракт промивали водою, насичеМетил-2-метокси-4-метиламшобензоат ним сольовим розчином, сушили (Na2SO4) і концеЦю сполуку одержували з 4-амшо-2нтрували з одержанням 2,31г (84%) коричневого пдроксибензойної кислоти (3,00г, 19,6 ммоль) з масла виходом 22% згідно з процедурою, подібною до процедури, описаної в препаративному прикладі 6 ^Н-НМР (270МГц, CDCI3) 5 7,77 (1Н, д, и=8,8Гц), 6,16 (1Н, дд, J=2,2, 8,8Гц), 6,08 (1Н, д, J=1,8riO, 4,19 (1Н, шире), 3,88 (ЗН, с), 3,82 (ЗН, с), 2,89 (ЗН, д, J=5,1I~LO Препаративний приклад 8 Метил-2-хлор-4-метиламшобензоат Сполуку одержували з 4-амшо-2хлорбензойної кислоти (2,00г, 11,7 ммоль) з виходом 13% згідно з процедурою, подібною до процедури, описаної у препаративному прикладі 6 1 Н-ЯМР (270МГц, CDCI3)5 7,80 (1Н, д, и=8,8Гц), 6,59 (1Н, д, и=2,6Гц), 6,44 (1Н, дд, J=2,6, 8,8Гц), 4,21 (1Н, шире), 3,86 (ЗН, с), 2,87 (ЗН, д, J=5,1I~LO Препаративний приклад 9 З-Хлор-4-метиламшобензонітрил Цю сполуку одержували з 4-амшо-Зхлорбензонітрилу (2,00г, 13,1 ммоль) з виходом 42% згідно з процедурою, подібною до процедури, описаної в препаративному прикладі 6 1 Н-ЯМР (270МГц, CDCI3) 5 7,50 (1Н, д, J=1,8riO, 7,43 (1Н, дд, J=1,8, 8,4Гц), 6,61 (1Н, д, и=8,4Гц), 4,92 (1Н, шире), 2,96 (ЗН, д, J=5,1 Гц) Препаративний приклад 10 Метил-6-метиламшонікотинат До суспензії 6-амшонікотиновоі кислоти (1,00г, 7,24 ммоль) у МеОН (20мл) і MeCN (Юмл) додавали 10% розчин три-метилсилілдіазометану в СН2СІ2 (25мл) при кімнатній температурі Після перемішування при кімнатній температурі протягом 0,5 години, розчинник випарювали з одержанням неочищеного метил-6-амшонікотинату у вигляді жовтої твердої речовини Назувану у заголовку сполуку одержували з неочищеного метил-6-амшонікотинату з виходом 17% згідно з процедурою, подібною до процедури, описаної в препаративному прикладі 6 1 Н-ЯМР (270МГц, CDCI3) 5 8,75 (1Н, д, и=2,2Гц), 8,01 (1Н, дд, J=2,2, 8,8Гц), 6,36 (1Н, д, и=9,2Гц), 5,11 (1Н, шире), 3,87 (ЗН, с), 2,99 (ЗН, д, Препаративний приклад 11 Метил-3-метиламінобензоат До суспензії NaH (1,54г, 38,5 ммоль) у ДМФ (20мл) додавали розчин 3-ацетамідбензойноі кислоти (3,00г, 16,7 ммоль) у ДМФ (20мл) при 0°С Після перемішування при кімнатній температурі протягом 0,5 год, до цієї суміші додавали йодметан (2,40мл, 38,5 ммоль) при 0°С і перемішували при кімнатній температурі протягом 1,5 години Суміш виливали у крижаний водний розчин 6н НСІ 1 Н-ЯМР (270МГц, CDCI3) 5 7,37 (1Н, дт, J=1,4, 7,5Гц), 7,28-7,20 (2Н, м), 6,78 (1Н, ддд, J=0,73, 2,6, 8,1 Гц), 3,89 (ЗН, с), 2,87 (ЗН, с) Препаративний приклад 12 4-Амшо-г\Г-пропілфталімід До суспензії NaH (493г, 12,3 ммоль) у ДМФ (Юмл) додавали розчин 4-амшофталіміду (2,00, 12,3 ммоль) у ДМФ (Юмл) при 0°С Після перемішування при кімнатній температурі протягом 1 год, до цієї суміші додавали йодпропан (1,20мл, 12,3 ммоль) при 0°С і перемішували при кімнатній температурі протягом 28 годин Суміш виливали у воду та екстрагували сумішшю AcOEt толуол=2 1 (150мл х 3) Екстракт промивали водою, насиченим сольовим розчином, сушили (Na2SO4) і концентрували з одержанням жовтого масла, яке очищали колонковою хроматографією (силікагель 130г, СН2СІ2 тільки СН2СІ2/Ме0Н=75/1) з одержанням 1,14г (45%) жовтої твердої речовини 1 Н-ЯМР (270МГц, CDCI3)5 7,59 (1Н, д, J=8,iriO, 7,03 (1Н, д, и=2,2Гц), 6,81 (1Н, дд, J=2,2, 8,1 Гц), 4,32 (2Н, шире), 3,65-3,55 (2Н, м), 1,80-1,60 (2Н, м), 0,93 (ЗН,т, и=7,ЗГц) Препаративний приклад 13 4-Метил-амшо-г\Г-пропіл фталімід Цю сполуку одержували з 4-аміно-ІЧ'пропілфталіміду з виходом 11% згідно з процедурою, подібною до процедури, описаної у препаративному прикладі 12 'Н-ЯМР (270МГц, CDCI3)5 7,59 (1Н, д, и=8,4Гц), 6,96 (1Н, д, и=2,2Гц), 6,71 (1Н, дд, J=2,2, 8,4Гц), 4,50 (1Н, шире), 3,65-3,55 (2Н, м), 2,95 (ЗН, д, J=5,iriO, 1,80-1,60 (2Н, м), 0,93 (ЗН, т, и=7,ЗГц) Препаративний приклад 14 5-Нітро-2-тюфенкарбонова кислота До розчину 5-нітро-2-тюфенкарбоксальдепду (1,00г, 6,24 ммоль) в ацетоні (50мл) додавали реагент Jones (8н в ацетоні, 8,12мл, 65 ммоль) при 20°С Після перемішування протягом 1 години до суміші додавали ЗОмл ізопропанолу До суміші додавали НгО і екстрагували СН2СІ2 Екстракт промивали водою, насиченим сольовим розчином, сушили (Na2SO4) і концентрували з одержанням 967мг (90%) жовтої аморфної твердої речовини 1 Н-ЯМР (270МГц, CDCI3) 5 7,88 (1Н, д, и=4,4Гц), 7,66 (1Н, д, и=4,0Гц), 5,14 (1Н, шире) Препаративний приклад 15 5-Нітро-г\І-пропіл-2-тіофенкарбоксамід До розчину 5-нітро-2-тюфенкарбоновоі кислоти (967мг, 5,59 ммоль) у ДМФ (0,745мл) і СН2СІ2 (4мл) додавали оксалілхлорид при 0°С Після перемішування протягом 0,5 год при кімнатній тем 29 60310 ЗО пературі розчинник випарювали при температурі СН2СІ2/МеОН=60/1-40/1) з одержанням 122,5мг нижче 30°С з одержанням жовтого масла і твердої (44%) зазначеної у заголовку сполуки 1 речовини До розчину н-пропіламшу (0,551 мл, 6,71 Н-ЯМР (270МГц, CDCI3) 5 7,16 (1Н, д, ммоль) в Et3N (1,87мл, 13,4 ммоль) і СН2СІ2 (25мл) и=4,0Гц), 5,89 (1Н, д, и=4,4Гц), 5,68 (1Н, шире), додавали розчин неочищеного хлорангідриду в 4,32 (1Н, шире), 3,40-3,30 (2Н, м), 2,91 (ЗН, д, СН2СІ2 (Юмл) нижче 20°С Після перемішування и=5,1Гц), 1,70-1,50 (2Н, м), 0,96 (ЗН, т, и=7,ЗГц) протягом 4 годин при кімнатній температурі суміш Препаративний приклад 18 промивали водою, насиченим водним розчином (3)-1-(3-Метоксиметоксифеніл)-1,2-етандюл ІЧаНСОз, водою, насиченим сольовим розчином, Суміш 3-метоксиметоксистиролу (отриманого сушили (Na2SO4) і концентрували з одержанням метоксиметилуванням 3-пдроксистиролу у станкоричневої твердої речовини, яку очищали колондартний спосіб) (1,54г, 9,39 ммоль) і AD-мікса-а ковою хроматографією (силікагель 50г, (13,18г, 9,41 ммоль) у воді (48мл) і t-BuOH (48мл) СН2СІ2/МеОН=100/1-30/1) в одержанням 815мг перемішували при 0°С протягом 6,5 годин До цієї (68%) білої твердої речовини реакційної суміші додавали ІЧагЄОз (14,13г) і суміш 1 перемішували при кімнатній температурі протягом Н-ЯМР (270МГц, CDCI3) 5 7,85 (1Н, д, 1 години Реакційну суміш екстрагували етилацеJ=4,0l~4), 7,35 (1Н, д, и=4,4Гц), 6,12 (1Н, шире), татом Екстракт промивали насиченим сольовим 3,50-3,35 (2Н, м), 1,75-1,55 (2Н, м), 0,99 (ЗН, т, розчином, сушили (Na2SO4) і концентрували з одержанням світло-коричневого масла, яке очищали Препаративний приклад 16 колонковою хроматографією (силікагель 90г, ети5-Аміно-г\Г-пропіл-2-тюфенкарбоксамід лацетат/гексан 1/2-3/1 з одержанням 1,69г (91%) Суміш 5-нітро-г\І-пропіл-2-тіофенкарбоксаміду цільового продукту у вигляді безбарвного масла (815мг, 3,81 ммоль), порошку заліза (1,06г, 19,0 ммоль) і NH4CI (102мг, 1,90 ммоль) в ЕЮН (12мл) і НгО (бмл) нагрівали із зворотним холодильником при перемішуванні протягом 2 годин Реакційну суміш фільтрували і промивали ЕЮН Об'єднаний фільтрат випарювали Залишок розчиняли в AcOEt і промивали водою, насиченим сольовим розчином, сушили над безводним сульфатом натрію (Na2SO4) і концентрували з одержанням коричневої аморфної речовини, яку очищали колонковою хроматографією (силікагель, 40г, СН2СІ2/МеОН=40/1) з одержанням 411мг (59%) коричневої аморфної речовини 1 Н-ЯМР (270МГц, CDCI3)5 7,09 (1Н, д, и=3,7Гц), 6,07 (1Н, д, и=4,0Гц), 5,80-5,60 (1Н, м), 4,14 (2Н, шире), 3,40-3,25 (2Н, м), 1,70-1,50 (2Н, м), 0,96 (ЗН,т, и=7,ЗГц) Препаративний приклад 17 5-Метиламіно-г\Г-пропіл-2-тюфенкарбоксамід До розчину 5-амшо-г\Г-пропіл-2тюфенкарбоксаміду (411мг, 2,23 ммоль) в СН2СІ2 (12мл) додавали ІЧагСОз (71 Омг, 6,70 ммоль) і трифтороцтовий ангідрид (0,631 мл, 4,47 ммоль) при кімнатній температурі Після перемішування протягом 5 годин тверду речовину відфільтровували Фільтрат промивали водою і насиченим сольовим розчином, сушили (Na2SO4) і концентрували з одержанням 396мг жовтого масла До розчину цього масла у ДМФ (6,5мл) додавали ІЧагСОз (2,35г, 22,2 ммоль) та йодметан (2,90мл, 46,6 ммоль) при кімнатній температурі Після перемішування протягом 22 годин суміш виливали у крижану 1н НСІ і екстрагували сумішшю AcOEt толуол=2 1 Екстракт промивали водою, насиченим сольовим розчином, сушили (Na2SO4) і концентрували з одержанням 298мг оранжевої твердої речовини До розчину цієї твердої речовини в МеОН (3,5мл) додавали 7% водний розчин К2СО3 (1,8мл) при кімнатній температурі Після перемішування протягом 18 годин розчинник випарювали Залишок розчиняли в AcOEt і воді Органічний шар промивали водою, насиченим сольовим розчином, сушили (Na2SO4) і концентрували з одержанням коричневого масла, яке очищали колонковою хроматографією (силікагель, 15г, 1 Н-ЯМР (270МГц, CDCI3) 5 7,25 (1Н, дд, J=7,7, 8,1Гц), 7,03 (1Н, д, и=1,8Гц), 6,98-6,92 (2Н, м), 5,15 (2Н, с), 4,74 (1Н, дд, J=3,3, 8,1 Гц), 3,71 (1Н, шир д , и=9,9Гц), 3,65-3,55 (2Н, м, у тому числі 1Н, дд, J=8,1, 11,0Гц при 3,61 м ч , СНСН2ОН), 3,44 (ЗН, с), 3,14 (1Н, шире, ОН) Препаративний приклад 19 (3)-1-(3-Метоксиметоксифеніл)-1,2-етандюл-2тозилат До перемішуваного розчину (S)-1-(3метоксиметоксифеніл)-1,2-етандюлу (1,69г, 8,54 ммоль) у піридині (20мл) додавали птолуолсульфонілхлорид (1,63г, 8,54 ммоль) і 4диметиламшопіридин (1,04г, 8,54 ммоль) при 0°С і реакційну суміш перемішували при температурі від 0°С до кімнатної температури протягом 16 годин і при 60°С протягом 1 години Реакційну суміш подкислювали 2н водним розчином НСІ і екстрагували етилацетатом Екстракт промивали водою і насиченим сольовим розчином, сушили (Na2SO4) та концентрували з одержанням коричневого масла, яке очищали колонковою хроматографією (силікагель 150г, етил ацетат/гексан 1/2-2/1) з одержанням 2,01г (67%) цільового продукту у вигляді безбарвного масла Його оптична чистота була 98% єн надл згідно з ВРХ 1 Н-ЯМР (270МГц, CDCI3)5 7,77 (2Н, д, и=8,4Гц), 7,34 (2Н, д, J=8,H~LO, 7,25 (1Н, дд, J=7,7, 8,4Гц), 7,00-6,92 (ЗН, м), 5,15 (2Н, с), 4,95 (1Н, ддд, J=3,3, 3,3, 8,4Гц), 4,15 (1Н, дд, J=3,3, 10,3Гц), 4,03 (1Н, дд, J=8,4, 10,3Гц), 3,46 (ЗН, с), 2,65 (1Н, д, и=3,ЗГц), 2,45 (ЗН, с) Препаративний приклад 20 2-(Р)-(3-Метоксиметоксифеніл)-2-(3-(3)метоксиметоксипіролідин-1-іл)етанол і 1-(S)-(3Метоксиметоксифеніл)-2-(3-(3)метоксиметоксипіролідин-1-іл) етанол Ці сполуки одержували з (S)-1-(3метоксиметилоксифеніл)-1,2-етандюл-2-тозилату з виходом 79% у вигляді суміші 0,25 0,75 зазначених у заголовку сполук згідно з процедурою, подібною до процедури, описаної у препаративному прикладіЗ 1 Н-ЯМР (270МГц, CDCI3) 5 7,29-7,21 (1Н, м), 32 31 60310 7,09-6,91 (ЗН, м), 5,22-5,13 (2Н, м), 4,80-4,55 температурі Після 1,5 годин перемішування при нагріванні із зворотним холодильником до реак(2,75Н, м), 4,33-4,15 (1Н, м), 3,90-3,72 (0,5Н, м), ційної суміші додавали воду (150мл) і суміш екст3,51-3,45 (0,25Н, м), 3,48 (ЗН, с), 3,38 (2,25Н, с), рагували етилацетатом (100мл х 2) Об'єднаний 3,33 (0,75Н, с), 3,05-2,90 (1,5Н, м), 2,80-2,43 (4Н, екстракт промивали водою, насиченим сольовим м), 2,23-2,02 (1Н, м), 1,95-1,70 (2Н, м) розчином, сушили (Na2SO4) і концентрували з одеПрепаративний приклад 21 ржанням коричневого масла, яке очищали колон(3)-1-(3-Хлорфеніл)-1,2-етандюл ковою хроматографією (силікагель 80г, Цю сполуку одержували з 3-хлорстиролу з виСН2СІ2/Ме0Н 50/1) з одержанням 1,18 (71%) коходом 100% згідно з процедурою, подібною до ричневого масла процедури, описаної в препаративному прикладі 1 Н-ЯМР (270МГц, CDCI3) 5 7,45-7,20 (5Н, м), 18 1 5,29-5,00 (1Н, м), 3,68 (1Н, д, и=13,2Гц), 3,63 (1Н, Н-ЯМР (270МГц, CDCI3) 5 7,40-7,20 (4Н, м), д, J=12,8riO, 2,95-2,60 (ЗН, м), 2,55-2,38 (1Н, м), 4,90-4,75 (1Н, м), 3,85-3,75 (1Н, м), 3,75-3,60 (1Н, 2,30-1,90 (2Н, м) м), 2,66 (1Н, д, и=2,9Гц), 2,20-2,05 (1Н, м) Препаративний приклад 26 Препаративний приклад 22 2-(3-(3)-Фторпіролідин-1-іл)-1-(3)-фенілетанол (3)-1-(3-Хлорфеніл)-1,2-етандюл-2-тозилат і 2-(3-(3)-Фторпіролідин-1-іл)-2-(Р)-фенілетанол Цю сполуку одержували з (З)-і-(З-хлорфеніл}Суспензію суміші (S)-1 -бензил-31,2-етандюлу з виходом 74% згідно з процедурою, фторпіролідину (1,18г, 6,58 ммоль) і 20% гідроксиподібною до процедури, описаної у препаративноду паладію на вугіллі (354мг) в ЕЮН (20мл) перему прикладі 19 Його оптична чистота була 98% мішували в атмосфері водню при кімнатній темпеєн надл згідно з ВРХ 1 ратурі протягом 21,5 годин Після вилучення Н-ЯМР (270МГц, CDCI3)5 7,76 (2Н, д, каталізатора фільтруванням крізь целіт до цього J=8,H~LO, 7,32 (2Н, д, и=8,4Гц), 7,31-7,17 (4Н, м), розчину додавали розчин (3)-(-)-стиролоксиду 5,00-4,92 (1Н, м), 4,14 (1Н, дд, J=3,3, 10,6Гц), 4,02 (791 мг, 6,58 ммоль) в ЕЮН (5мл) Суміш нагрівали (1Н, дд, J=8,4, 10,6Гц), 2,63 (1Н, д, 3,7Гц), 2,46 (ЗН, із зворотним холодильником протягом 3,5 годин с) Після випарювання розчинника залишок очищали Препаративний приклад 23 колонковою хроматографією (силікагель 80г, 2-(R)-(3-Xnop4,eHin)-2-(3-(S)СН2СІ2 МеОН=401-301) з одержанням 713мг метоксиметоксипіролідин-1-іл)етанол і 1-(S)-(3(51,8%) жовтого масла у вигляді суміші 0,7 0,3 заХлорфеніл)-2-(3-(3)-метоксиметоксипіролідин-1-іл) значених у заголовку сполук етанол 1 Н-ЯМР (270МГц, CDCI3) 5 7,45-7,20 (5Н, м), Ці сполуки одержували з (З)-і-(З-хлорфеніл)5,35-5,05 (0,7Н, м), 5,25-4,95 (0,3Н, м), 4,71 (0,7Н, 1,2-етандюл-2-тозилату з виходом 62% у вигляді дд, J=3,3, 10,6Гц), 3,95-3,75 (0,6Н, м), 3,52 (0,3, т, суміші 0,15 0,85 зазначених у заголовку сполук и=5,9Гц), 3,15-2,40 (5,4Н, м), 2,30-1,80 (ЗН, м) згідно з процедурою, подібною до процедури, описаної у препаративному прикладі З Препаративний приклад 27 1 2-(3-(3)-Метоксиметоксипіролідин-1-іл)-1-(Р)Н-ЯМР (270МГц, CDCI3) 5 7,40-7,20 (4Н, м), фенілетанол і 2-(3-(3)-Метоксиметоксипіролідин-14,80-4,57 (2,85Н, м), 4,32-4,15 (1Н, м), 3,85-3,80 іл)-2-(3)-фенілетанол (0,3Н, м), 3,48-3,40 (0,15Н, м), 3,38 (2,55Н, с), 3,34 (0,45Н, с), 3,05-2,92 (1,7Н, м), 2,80-2,62 (2Н, м), Ці сполуки одержували з 3-(S)2,58-2,40 (2Н, м), 2,23-2,05 (1Н, м), 1,95-1,80 (1Н, метоксиметоксипіролідину і (Р)-(-)-стиролоксиду з м) виходом 53% у вигляді суміші 0,7 0,3 зазначених у заголовку сполук згідно з процедурою, подібною Препаративний приклад 24 до процедури, описаної у препаративному прикла(Р)-і-Бензил-З-піролідинолтозилат ді 2 До перемішуваного розчину (Р)-і-бензил-З1 піролідинолу (1,77г, 10 ммоль) у піридині (ЗОмл) Н-ЯМР (270МГц, CDCI3) 5 7,40-7,20 (5Н, м), додавали п-толуолсульфонілхлорид (9,53г, 50 4,72 (0,7Н, дд, J=3,3, 10,6Гц), 4,66 (0,7Н, д, ммоль) порціями при 0°С Після 90 годин переміи=7,0Гц), 4,63 (0,7Н, д, и=7,0Гц), 4,63-4,56 (0,6Н, м) шування при кімнатній температурі до реакційної 4,35-4,17 (1Н, м), 3,92-3,77 (0,6Н, м), 3,50 (0,3Н, т, суміші додавали воду і суміш екстрагували ефіром и=5,5Гц), 3,37 (2,1Н, с), 3,33 (0,9Н, с), 3,10-2,50 (150мл) Екстракт промивали водою, насиченим (5,4Н, м), 2,25-2,00 (1Н, м), 1,95-1,70 (2Н, м) сольовим розчином, сушили (Na2SO4) і концентруПрепаративний приклад 28 вали з одержанням 3,06г (92%) у вигляді коричне(Р)-1-(3-Метоксиметоксифеніл)-1,2-етандюл вого масла Цю сполуку одержували з 31 метоксиметоксистиролу і AD-MiKca-p з виходом Н-НМР (270МГц, CDCI3) 5 7,76 (2Н, д, 100% згідно з процедурами, подібними до процеи=8,4Гц), 7,31 (2Н, д и=8,4Гц), 7,35-7,20 (5Н, м), дур, описаних у препаративному прикладі 18 5,05-4,90 (1Н, м), 3,61 (1Н, д, и=12,8Гц), 3,54 (1Н, 1 д, J=12,8riO, 2,76 (1Н, дд, J=6,0, 11,2Гц), 2,75-2,60 Н-ЯМР (270МГц, CDCI3) 5 7,31-7,25 (1Н, м), (1Н, м), 2,55-2,35 (2Н, м), 2,44 (ЗН, с), 2,12-2,05 7,06-6,96 (ЗН, м), 5,18 (2Н, с), 4,80 (1Н, дд, J=3,7, (1Н, м), 2,03-1,90 (1Н, м) 8,1 Гц), 3,78 (1Н, дд, J=3,7, 11,4Гц), 3,66 (1Н, дд, J=8,1, 11,4Гц), 3,48 (ЗН, с) Препаративний приклад 25 (З)-і-Бензил-З-фторпіролідин Препаративний приклад 29 До розчину (R)-1 -бензил-3(Р)-1-(3-Метоксиметоксифеніл)-1,2-етандюл-2піролідинолтозилату (3,06г, 9,24 ммоль) у ТГФ тозилат (ЗОмл) додавали 1,0М розчин тетрабутиламонійфЦю сполуку одержували з (R)-1-(3ториду в ТГФ (37,0мл, 37,0 ммоль) при кімнатній Метоксиметоксифеніл)-1,2-етандюлу з виходом 34 33 60310 77% згідно з процедурами, подібними до процеДо перемішуваного розчину (Р)-і-бензил-Здур, описаних у препаративному прикладі 19 піролідинолу (886мг, 5,0 ммоль) в ССЦ (20мл) до1 давали трифенілфосфш (1,574г, 6,0 ммоль) при Н-ЯМР (270МГц, CDCI3)5 7,77 (2Н, д, кімнатній температурі Після перемішування проJ=8,4I~4), 7,33 (2Н, д, J=7,7I~4), 7,28-7,18 (1Н, м), тягом 20 годин при температурі дефлегмації роз7,00-6,92 (ЗН, м), 5,15 (2Н, с), 5,00-4,90 (1Н, м), чинник випарювали Насичений водний розчин 4,20-4,00 (2Н, м), 3,46 (ЗН, с), 2,80-2,60 (1Н, м), ЫаНСОз і воду додавали до залишку, і суміш екст2,45 (ЗН, с) рагували AcOEt Екстракт промивали насиченим 97% енантюмерний надлишок (згідно з ВРХ) сольовим розчином, сушили (Na2SO4) і концентруПрепаративний приклад ЗО вали з одержанням коричневого масла, яке очи2-(Р)-Феніл-2-(3-піролш-1-іл )етанол щали колонковою хроматографією (силікагель Цю сполуку одержували з R-(-)-2100г, СН2СІ2/Ме0Н 50/1-45/1) з одержанням 706мг фенілгліцинолу і цис-1,4-дихлор-2-бутену з вихо(72%) блідо-жовтого масла дом 58% згідно з процедурами, подібними до про1 цедур, описаних у препаративному прикладі 1 Н-ЯМР (270МГц, CDCI3) 5 7,33-7,23 (5Н, м), 1 4,42-4,33 (1Н, м), 3,73-3,61 (2Н, м), 3,09 (1Н, дд, Н-ЯМР (270МГц, CDCI3) 5 7,36-7,29 (5Н, м), и=6,6Гц), 2,81-2,61 (ЗН, м), 2,48-2,35 (1Н, м), 2,135,77 (2Н, с), 3,83 (2Н, д, и=5,9Гц), 3,66 (1Н, м), 3,50 2,03 (1Н, м) (4Н, с) Препаративний приклад 36 Препаративний приклад 31 2-(3-(3)-Хлорпіролідин-1-іл)-1-(3)-феніл етанол (З)-і-Бензил-З-піролідинолтозилат і 2-(3-(3)-Хлорпіролідин-1-іл)-2-(Р)-фенілетанол Цю сполуку одержували з (S)-1 -бензил-3До перемішуваного розчину (З)-і-бензил-Зпіролідинолу і п-толуолсульфонілхлориду з вихохлорпіролідину (695мг, 3,55 ммоль) у дихлоретані дом 98% згідно з процедурами, подібними до про(Юмл) додавали 1-хлоретил-хлорформіат (0,38мл, цедур, описаних в препаративному прикладі 24 1 3,55 ммоль) при 0°С Суміш перемішували при 0°С Н-ЯМР (270МГц, CDCI3)5 7,76 (2Н, д, протягом 10 хвилин і нагрівали із зворотним холои=8,4Гц), 7,33-7,26 (7Н, м), 4,97 (1Н, т, и=2,9Гц), дильником протягом 1,5 годин Після охолоджу3,69-3,58 (2Н, м), 2,89-2,83 (1Н, м), 2,73-2,68 (2Н, вання до кімнатної температури розчинник випам), 2,58-2,55 (1Н, м), 2,44 (ЗН, с), 2,20-2,12 (1Н, м), рювали Залишок розчиняли в МеОН (5мл) і 1,99-1,93 (1Н, м) нагрівали із зворотним холодильником протягом 1 Препаративний приклад 32 години Після охолоджування до кімнатної темпе(Р)-і-Бензил-З-фторпіролідин ратури розчинник випарювали з одержанням Цю сполуку одержували з (S)-1 -бензил-3787мг коричневої твердої речовини піролідинолтозилату з виходом 6 1 % згідно з проНазвані у заголовку сполуки одержували з вицедурами, подібними до процедур, описаних в щезазначеної твердої речовини і (S)-(-)препаративному прикладі 25 1 стиролоксиду із загальним виходом 39% у вигляді Н-ЯМР (270МГц, CDCI3) 5 7,33-7,23 (5Н, м), суміші 0,67 0,33 зазначених у заголовку сполук 5,28-5,04 (1Н, м), 3,71-3,61 (2Н, м), 2,91-2,67 (ЗН, згідно з процедурами, подібними до процедур, м), 2,50-2,42 (1Н, м), 2,24-2,00 (2Н, м) описаних у препаративному прикладі 2 Препаративний приклад 33 1 Н-ЯМР (270МГц, CDCI3) 57,39-7,27 (5Н, м), 2-(3-(Р)-Фторпіролідин-1-іл)-1-(3)-фенілетанол 4,70 (0,67Н, дд, J=3,3, 10,3Гц), 4,45-4,40 (0,67Н, м), і 2-(3-(Р)-Фторпіролідин-1-іл)-2-(Р)-фенілетанол 4,38-4,32 (0,33Н, м), 3,91-3,02 (2,33Н, м), 2,88-2,56 Ці сполуки одержували з (R)-1 -бензил-3(4Н, м), 2,50-2,31 (1Н, м), 2,17-2,03 (1Н, м) фторпіролідину з загальним виходом 76% у вигляПрепаративний приклад 37 ді суміші 0,6 0,4 зазначених у заголовку сполук Метил-З-фтор-4-нітробензоат згідно з процедурами, подібними до процедур, Суміш З-фтор-4-нітробензойноі кислоти (2,07г, описаних у препаративному прикладі 26 1 11,2 ммоль) і концентрованої H2SC4 (0,5мл) в МеН-ЯМР (270МГц, CDCI3) 5 7,40-7,24 (5Н, м), ОН (Юмл) нагрівали із зворотним холодильником 5,32-5,27 (0,3Н, м), 5,25-5,21 (0,2Н, м), 5,11-5,07 протягом 8 годин Розчинник випарювали Зали(0,3Н, м), 5,07-5,01 (0,2Н, м), 4,71 (0,6Н, дд, J=3,3, шок розчиняли в AcOEt і промивали насиченим 10,3Гц), 3,90-3,78 (0,6Н, м), 3,55-3,51 (0,4Н, м), водним розчином ЫаНСОз, водою, насиченим со3,13-2,44 (5,4Н, м), 2,23-1,94 (2Н, м) льовим розчином, сушили (Na2SO4) і концентруваПрепаративний приклад 34 ли з одержанням 2,14г (96%) твердої речовини 2-(3-(3)-Фторпіролідин-1-іл)-1-(Р)-фенілетанол кольору слонової кістки і 1 Н-ЯМР (270МГц, CDCI3) 5 8,15-8,07 (1Н, м), 2-(3-(3)-Фторпіролідин-1-іл)-2-(3)-фенілетанол 7,99-7,96 (1Н, м), 7,95-7,92 (1Н, м), 3,99 (ЗН, с) Ці сполуки одержували з 3(3)-фторпіролідину і Препаративний приклад 38 (Р)-(+)-стиролоксиду з виходом 72% у вигляді суМетил-4-амшо-З-фторбензоат міші 0,7 0,3 названих у заголовку сполук згідно з Суміш метил-3-фтор-нітробензоату (2,14г, 10,8 процедурами, подібними до процедур, описаних у ммоль) і порошку заліза (2,63г) в оцтовій кислоті препаративному прикладі 26 1 (22мл) перемішували при 50°С протягом 2,5 годин Н-ЯМР (270МГц, CDCI3) 5 7,39-7,24 (5Н, м), Після охолоджування до кімнатної температури до 5,31-5,28 (0,35Н, м), 5,28-5,22 (0,15Н, м), 5,12-5,07 суміші додавали СН2СІ2 (ЮОмл) і воду (ЗООмл) та (0,35Н, м), 5,06-5,01 (0,15Н, м), 4,73-4,68 (0,7Н, м), фільтрували для вилучення порошку заліза Орга3,88-3,79 (0,7Н, м), 3,54-3,50 (0,3Н, м), 3,13-2,44 нічний шар ВІДДІЛЯЛИ і водний шар екстрагували (5,3Н, м), 2,20-1,93 (2Н, м) СН2СІ2 (70мл х 2) Розчин СН2СІ2 об'єднували, Препаративний приклад 35 промивали водою, насиченим сольовим розчином, (S)-1 -Бензил-3-хлорпіролідин 36 35 60310 сушили (Na2SO4) і концентрували з одержанням 5-г\І-Метиламіно-г\Г-пропілпіколінамід 1,77г (97%) блідо-коричневої твердої речовини Розчин 5-[г\І-(трет-бутоксикарбоніл)-г\І1 метиламіно]-г\Г-пропілпіколінаміду (1,82г, 6,21 Н-ЯМР (270МГц, CDCI3) 5 7,70-7,62 (2Н, м), ммоль) у трифтороцтовій кислоті (ЗОмл) перемі6,79-6,70 (1Н, м), 4,13 (2Н, шире), 3,86 (ЗН, с) шували при 0°С протягом 2 годин Після вилученПрепаративний приклад 39 ня розчинника залишок розчиняли в СН2СІ2 і 25% Метил-З-фтор-4-метиламшобензоат розчині аміаку Органічний шар ВІДДІЛЯЛИ І промиДо розчину метил-4-амшо-З-фторбензоату вали насиченим сольовим розчином, сушили (1,77г, 10,5 ммоль) в СН2СІ2 (50мл) додавали (Na2SO4) і концентрували з одержанням 1,20г ЫагСОз (3,33г, 31,4 ммоль) і трифтороцтовий ангі(100%) коричневої твердої речовини дрид (2,96мл, 20,9 ммоль) при кімнатній темпера1 турі Після перемішування протягом 2,5 годин твеН-ЯМР (270МГц, CDCI3) 5 8,01 (1Н, д, рду речовину відфільтровували Фільтрат и=8,4Гц), 7,88 (1Н, д, и=2,9Гц), 7,78 (1Н, шире), промивали водою, насиченим сольовим розчином, 6,90 (1Н, дд, J=2,9, 8,4Гц), 4,17 (1Н, шире), 3,45сушили (Na2SO4) і концентрували з одержанням 3,35 (2Н, м), 2,91 (ЗН, д, и=5,1Гц), 1,75-1,55 (2Н, 2,70г (97%) білої твердої речовини До розчину цієї м), 0,98 (ЗН,т, и=7,ЗГц) твердої речовини (2,70г, 10,2 ммоль) уДМФ (48мл) Препаративний приклад 42 додавали ЫагСОз (16,9г, 160 ммоль) і йодметан 4-г\І-гідроксіаміно-г\Г-пропілбензамід (20,8мл, 334 ммоль) при 0°С Після перемішування До розчину 4-нггро-г\І-пропілбензаміду (2,75г, протягом 2 годин при 0°С протягом 1 години при 13,2 ммоль) і хлориду амонію (812мг, 15,2 ммоль) кімнатній температурі суміш виливали в 2н НСІ з в ЕЮН (20мл) і воді (Юмл) додавали порошок цильодом і екстрагували сумішшю AcOEt толуол=2 1 нку (1,70г, 26,0 ммоль) порціями з охолоджуван(200мл х 2) Екстракт промивали водою, насиченям водою Після перемішування протягом ЗО ним сольовим розчином, сушили (Na2SO4) і концехвилин при кімнатній температурі порошок цинка нтрували з одержанням 3,06г (КІЛЬКІСН вихід) ко(0,50г, 7,65 ммоль) додавали до суміші і переміричневого масла Це масло розчиняли в МеОН шували протягом ЗО хвилин Тверду речовину ви(25мл) і додавали 7% розчин К2СО3 (12,5мл) при лучали фільтруванням крізь целіт і промивали 0°С Після перемішування протягом 2 годин при МеОН Фільтрат і промивання об'єднували і кон0°С впродовж 4 годин при кімнатній температурі центрували з одержанням жовтої твердої речовидодавали 7% розчин К2СО3 (12,5мл) Після перени, яку очищали колонковою хроматографією (симішування впродовж 1,5 годин при кімнатній темлікагель, 130г, СН2СІ2/Ме0Н 25/1-10/1) з пературі суміш підкислювали 5н НСІ і МеОН випаодержанням 2,06г (80%) твердої речовини кольору рювали Залишок екстрагували AcOEt Екстракт слонової кістки промивали водою, насиченим сольовим розчином, 1 Н-ЯМР (270МГц, CDCI3-flMSO-d6) 5 8,32 (1Н, сушили (Na2SO4) і концентрували з одержанням д, и=2,2Гц), 7,72 (2Н, д, и=8,4Гц), 7,25-7,10 (1Н, м), 1,83г (98%) блідо-коричневої твердої речовини 6,95 (2Н, д, и=8,8Гц), 3,45-3,30 (2Н, м), 2,91 (1Н, с), 1 1,70-1,55 (2Н, м), 0,96 (ЗН, т, и=7,ЗГц) Н-ЯМР (270МГц, CDCI3) 5 7,80-7,72 (1Н, м), Препаративний приклад 43 7,62 (1Н, дд, J=1,8, 12,5Гц), 6,63 (1Н, т, и=8,6Гц), 4-Амшо-2-хлор-г\Г-пропілбензамід 4,40 (1Н, шире), 3,86 (ЗН, с), 2,94 (ЗН, д, J=5,1I~LO Суміш 4-амшо-2-хлорбензойноі кислоти (3,00г, Препаративний приклад 40 17,5 ммоль), н-пропіламіну (2,88мл, 35,0 ммоль) і 5-[М-(трет-Бутоксикарбоніл)-г\І-метиламіно]-г\ГWSC (6,71г, 35,0 ммоль) в СН2СІ2 (35мл) переміпропілпіколінамід шували при кімнатній температурі протягом 16 До розчину 5-[г\І-(трет-бутоксикарбоніл)-г\Ігодин Суміш промивали водою, насиченим сольометиламшо] ПІКОЛІНОВОІ кислоти (1,93г, 7,66 вим розчином, сушили (Na2SO4) і концентрували з ммоль) і триетиламшу (1,60мл, 11,5 ммоль) у ДМФ одержанням коричневого масла, яке очищали ко(0,678мл) та СН2СІ2 (14мл) додавали оксалілхлолонковою хроматографією (силікагель, 180г, рид (0,989мл, 11,3 ммоль) краплями при кімнатній СН2СІ2/Ме0Н 30/1-10/1) з одержанням 2,32г (62%) температурі Після перемішування протягом ЗО блідої твердої речовини кольору слонової кістки хвилин при кімнатній температурі розчинник випа1 рювали Залишок розчиняли в СН2СІ2 (14мл) Цей Н-ЯМР (270МГц, CDCI3)5 7,64 (1Н, д, розчин додавали краплями до перемішуваного, и=8,4Гц), 6,64 (1Н, д, и=2,6Гц), 6,57 (1Н, дд, J=2,6, охолодженого розчину н-пропіламіну (0,756мл, 8,4Гц), 6,44 (1Н, шире), 3,97 (2Н, шире), 3,50-3,30 9,19 ммоль) і триетиламшу (3,20мл, 23,0 ммоль) в (2Н, м), 1,75-1,55 (2Н, м), 0,99 (ЗН, т, и=7,ЗГц) СН2СІ2 (28мл) при підтриманні температури нижПрепаративний приклад 44 чою від 15°С Після перемішування протягом 15 2-Хлор-4-метиламшо-г\Г-пропілбензамід годин при кімнатній температурі суміш промивали Суміш 4-амшо-2-хлор-г\Г-пропілбензаміду водою, насиченим сольовим розчином, сушили (2,32г, 10,9 ммоль), йодметану (0,68мл, 10,9 (Na2SO4) і концентрували з одержанням коричнеммоль) і К2СО3 (1,51г, 10,9 ммоль) у ДМФ (50мл) вого масла, яке очищали колонковою хроматогперемішували при кімнатній температурі протягом рафією (силікагель 100г, СН2СІ2/Ме0Н 60/1) з 20 годин До цієї суміші додавали воду і екстрагуодержанням 1,82г (81%) блідо-коричневого масла вали сумішшю AcOEt толуол=1 1 Екстракт проми1 вали водою, насиченим сольовим розчином, суН-ЯМР (270МГц, CDCI 3 )5 8,49 (1Н, д, шили (Na2SO4) і концентрували з одержанням и=2,6Гц), 8,16 (1Н, д, и=8,4Гц), 7,95 (1Н, шире), блідо-коричневої твердої речовини, яку очищали 7,71 (1Н, дд, J=2,6, 8,4Гц), 3,50-3,40 (2Н, м), 3,32 колонковою хроматографією (силікагель, 120г, (ЗН, с), 1,75-1,55 (2Н, м), 1,48 (9Н, с), 1,00 (ЗН, т, СН2СІ2/Ме0Н 40/1) з одержанням 887мг (36%) блідо-коричневої твердої речовини Препаративний приклад 41 37 60310 38 (2Н, с), 4,17 (2Н, ддд, J=6,2, 14,7, 14,7Гц), 3,36 (ЗН, Н-ЯМР (270МГц, CDCI3) 5 7,57 (1Н, д, и=8,4Гц), 6,80 (1Н, шире), 6,53 (1Н, д, J=2,2I~4), с) 6,50 (1Н, дд, J=2,2, 8,4Гц), 5,00-4,80 (1Н, м), 3,45Препаративний приклад 49 3,30 (2Н, м), 2,82 (ЗН, д, J=5,1I~4), 1,75-1,55 (2Н, 4-[г\І-(Бензилоксикарбоніл)-г\І-метиламшо] N'м), 0,99 (ЗН,т, J=7,3I~4) трет-амілбензамід Цю сполуку одержували з 4-[NПрепаративний приклад 45 (бензилоксикарбоніл)-І\І-метиламіно]бензойноі 4-Метиламіно-І\Г-(2-(3)-пдроксипропіл) бензакислоти і трет-аміламшу з виходом 22% згідно з мід процедурами, подібними до процедур, описаних у Сполуку одержували з 4препаративному прикладі 48 (метиламшо)бензойноі кислоти і (S)-(+)-1-aMiHO-21 пропанолу з виходом 22% згідно з процедурами, Н-ЯМР (270МГц, CDCI3)5 7,69 (2Н, д, подібними до процедур, описаних у препаративи=8,4Гц), 7,32-7,29 (7Н, м), 5,86-5,75 (1Н, м), 5,17 ному прикладі 43 (2Н, с), 3,33 (ЗН, с), 1,88-1,80 (2Н, м), 1,40 (6Н, с), 1 0,89 (ЗН, т, и=7,ЗГц) Н-ЯМР (270МГц, CDCI3-flMSO-d6) 5 7,69 (2Н, д, и=8,4Гц), 7,14 (1Н, шире), 6,56 (2Н, д, и=8,8Гц), Препаративний приклад 50 4,60-4,30 (2Н, м), 3,98-3,94 (1Н, м), 3,64-3,55 (1Н, 4-[М-(Бензилоксикарбоніл)-г\І-метиламіно]-г\Гм), 3,28-3,18 (1Н, м), 2,85 (ЗН, с), 1,20 (ЗН, д, трет-бутилбензамід Цю сполуку одержували з 4-[N(бензилоксикарбоніл)-І\І-метиламіно]бензойноі Препаративний приклад 46 кислоти і трет-бутиламшу з виходом 93% згідно з 4-Метиламшо-І\Г-(2-(Р)-лдроксипропіл) бензапроцедурами, подібними до процедур, описаних у мід препаративному прикладі 48 Сполуку одержували з 41 (метиламшо)бензойноі кислоти і (R)-(-)-1-3MIHO-2Н-ЯМР (270МГц, CDCI3)5 7,69 (2Н, д, пропанолу з виходом 4 1 % згідно з процедурами, и=8,8Гц), 7,32-7,29 (7Н, м), 5,89 (1Н, шире), 5,17 подібними до процедур, описаних у препаратив(2Н, с), 3,33 (ЗН, с), 1,46 (9Н, с) ному прикладі 43 Препаративний приклад 51 1 4-Метиламіно-І\Г-(2,2,3,3,3Н-ЯМР (270МГц, CDCI3-flMSO-d6) 5 7,68 (2Н, пентафторпропіл)бензамід дд, J=1,8, 7,0Гц), 7,12 (1Н, шире), 6,55 (2Н, дд, J=1,8, 7,0Гц), 4,50 (1Н, шире), 4,37 (1Н, шире), Суміш суспензії 4-[г\І-(бензилоксикарбоніл)-г\І3,98-3,93 (1Н, м), 3,64-3,55 (1Н, м), 3,28-3,18 (1Н, метиламіно-]-І\Г-(2,2,3,3,3м), 2,85 (ЗН, д, и=4,8Гц), 1,20 (ЗН, д, и=6,2Гц) пентафторпропіл)бензаміду (532мг, 1,28 ммоль) і 10% паладію на вугіллі (41 мг) в МеОН (5мл) переПрепаративний приклад 47 мішували в атмосфері водню при кімнатній темпе4-Метиламшо-г\Г-пропілбензамід ратурі протягом 6 годин Каталізатор вилучали Сполуку одержували з 4фільтруванням крізь целіт і промивали МеОН Фі(метиламшо)бензойноі кислоти і н-пропіламшу з льтрат і промивання об'єднували та концентрувавиходом 82% згідно з процедурами, подібними до ли з одержанням 345мг (96%) названої у заголовку процедур, описаних в препаративному прикладі сполуки 43 1 1 Н-ЯМР (270МГц, CDCI3) 5 7,66 (2Н, д, Н-ЯМР (270МГц, CDCI3)5 7,63 (2Н, д, и=8,4Гц), 6,58 (2Н, д, и=8,4Гц), 6,15-6,12 (1Н, м), и=8,8Гц), 6,56 (2Н, д, и=8,8Гц), 6,05 (1Н, шире), 4,23-4,09 (ЗН, м), 2,89 (ЗН, д, и=4,4Гц) 4,11 (1Н, шире), 3,45-3,30 (2Н, м), 2,86 (ЗН, с), 1,70-1,50 (2Н, м), 0,97 (ЗН, т, и=7,ЗГц) Препаративний приклад 52 4-Метиламшо-г\Г-трет-амілбензамід Препаративний приклад 48 Цю сполуку одержували з 4-[N4-[М-(Бензилоксикарбоніл)-г\І-метиламіно]-г\Г(бензилоксикарбоніл)-г\І-метиламіно]-г\Г-трет(2,2,3,3,3-пентафторпропіл) бензамід амілбензаміду з виходом 88% згідно з процедураДо розчину 4-[г\І-(бензилоксикарбоніл)-г\Іми, подібними до процедур, описаних у препараметиламшо]бензойноі кислоти (ЮОмг, 0,351 тивному прикладі 51 ммоль) в СН2СІ2 (1мл) додавали оксалілхлорид 1 (0,122мл, 1,40 ммоль) і ДМФ (0,026мл) при кімнатН-ЯМР (270МГц, CDCI3)5 7,58 (2Н, д, ній температурі Після перемішування протягом 4 и=8,4Гц), 6,56 (2Н, д, и=8,8Гц), 5,70 (1Н, шире), годин при кімнатній температурі розчинник випа4,00 (1Н, шире), 2,87 (ЗН, с), 1,83 (2Н, к, и=7,7Гц), рювали Залишок розчиняли в СН2СІ2 (Юмл) До 1,39 (6Н, с), 0,89 (ЗН, т, и=7,7Гц) цього розчину додавали 2,2,3,3,3Препаративний приклад 53 пентафторпропіламш (523мг, 3,51 ммоль) і три4-Метиламіно-г\Г-трет-бутилбензамід етиламш (0,372мл, 2,67 ммоль) при кімнатній темЦю сполуку одержували з 4-[Nпературі Після перемішування протягом 18 годин (бензилоксикарбоніл)-г\І-метиламіно]-г\Г-третпри кімнатній температурі до суміші додавали набутилбензаміду з виходом 100% згідно з процедусичений водний розчин NaHCO3 і екстрагували рами, подібними до процедур, описаних у препаСН2СІ2 Екстракт промивали насиченим сольовим ративному прикладі 51 1 розчином, сушили (Na2SO4) і концентрували з одеН-ЯМР (270МГц, CDCI3)5 7,58 (2Н, д, ржанням коричневого масла, яке очищали колони=8,4Гц), 6,56 (2Н, д, и=8,8Гц), 5,78 (1Н, шире), ковою хроматографією (силікагель, 30г, СН2СІ2 2,86 (ЗН, с), 1,45 (9Н, с) тільки - СНгСЬ/МеОН 50/1) з одержанням 532мг Приклад 1 (72%) зазначеної в заголовку сполуки Одержання 4-{N-[2-(3-(S)1 Н-ЯМР (270МГц, CDCI3)5 7,75 (2Н, д, Метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Ми=8,8Гц), 7,39-7,31 (7Н, м), 6,42-6,31 (1Н, м), 5,19 метиламшо}-г\Г-пропілбензаміду 1 39 60310 40 (I) Метил-4-{Н-[2-(3-(Э)ном, сушили (ІЧагЗСч) і концентрували з одержанМетоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мням коричневого масла, яке очищали колонковою метиламшо}бензоат хроматографією (силікагель 100г, СНгСЬ/МеОН До перемішуваного розчину суміші 2-(3-(S)25/1) з одержанням 1,52г (72%) блідо-коричневої Метоксиметоксипіролідин-1-іл)-1-(3)-фенілетанолу аморфної речовини 1 і 2-(3-(3)-Метоксиметоксипіролідин-1-іл)-1-(Р)Н-ЯМР (270МГц, CDCI3)5 7,65 (2Н, д, фенілетанолу (2,01г, 8,00 ммоль) і триетиламшу и=8,8Гц), 7,35-7,20 (5Н, м), 6,79 (2Н, д, и=9,2Гц), (1,34мл, 9,60 ммоль) в СН2СІ2 (35мл) додавали 6,05-5,90 (1Н, м), 5,14 (1Н, дд, J=6,6, 8,1Гц), 4,59 метансульфонілхлорид (0,744мл, 9,60 ммоль) кра(1Н, д, и=7,0Гц), 4,55 (1Н, д, и=7,0Гц), 4,24-4,10 плями при 0°С (на бані з льодом) Після перемішу(1Н, м), 3,39 (2Н, дд, J=6,6, 13,9Гц), 3,30 (ЗН, с), вання протягом 5,5 годин при кімнатній темпера3,14-2,96 (2Н, м), 2,90-2,80 (1Н, м), 2,85 (ЗН, с), турі реакційну суміш промивали насиченим 2,78-2,52 (ЗН, м), 2,14-1,96 (1Н, м), 1,84-1,70 (1Н, водним розчином ІЧаНСОз, насиченим сольовим м), 1,68-1,56 (2Н, м), 0,97 (ЗН, т, и=7,ЗГц) розчином, сушили (Na2SO4) і концентрували з одеПриклад 2 ржанням 2,16г коричневого в'язкого масла До цьоОдержання 4-{г\І-[2-(3-(3)-пдроксипіролідин-1го масла додавали метил-4-метиламшобензоат іл)-1-(3)-фенілетил]-г\І-метиламіно}-г\Г(1,45г, 8,80 ммоль) і етанол (16мл), та суміш перепропілбензаміду мішували при нагріванні із зворотним холодильниСуміш 4-{І\І-[2-(3-(3)-метоксиметоксипіролідинком протягом 1,5 годин Розчинник випарювали 1-іл)-1-(3)-фенілетил]-г\І-метиламіно}-г\ГЗалишок розчиняли в СН2СІ2 і промивали насичепропілбензаміду (1,52г, 3,58 ммоль) і 10% НСІ в ним водним розчином ІЧаНСОз і насиченим сольоМеОН (25мл) перемішували при кімнатній темпевим розчином, сушили (Na2SO4) і концентрували з ратурі протягом 6 годин Розчинник випарювали одержанням коричневого масла, яке очищали коЗалишок підлуговували 25% гідроксидом амонію, лонковою хроматографією (силікагель 150г, екстрагували СН2СІ2 Екстракт промивали насичеСН2СІ2/Ме0Н 100/1-35/1) з одержанням 1,99г ним сольовим розчином, сушили (Na2SO4) і конце(62,5%) коричневого масла нтрували з одержанням блідо-коричневої аморф1 ної речовини, яку очищали колонковою Н-ЯМР (270МГц, CDCI3)5 7,89 (2Н, д, J=9, хроматографією (силікагель 65г, СНгСЬ/МеОН 2Гц), 7,35-7,20 (5Н, м), 6,78 (2Н, д, и=9,2Гц), 5,17 25/1-15/1) з одержанням 1,21г (89%) блідо(1Н, дд, J=6,6, 8,1 Гц), 4,59 (1Н, д, и=7,0Гц), 4,55 коричневої аморфної речовини (1Н, д, и=7,0Гц), 4,22-4,12 (1Н, м), 3,85 (ЗН, с), 3,30 1 (ЗН, с), 3,10 (1Н, дд, J=6,2, 12,8Гц), 3,03 (1Н, дд, Н-ЯМР (270МГц, вільний амін, CDCI3) 5 7,66 J=8,4, 12,8Гц), 2,86 (ЗН, с), 2,85-2,80 (1Н, м), 2,77(2Н, д, и=9,2Гц), 7,40-7,20 (5Н, м), 6,81 (2Н, д, 2,67 (1Н, м), 2,65-2,53 (2Н, м), 2,05 (1Н, ддд, J=7,5, и=9,2Гц), 6,05-5,90 (1Н, м), 5,15 (1Н, дд, J=5,9, 13,9, 13,9Гц), 1,83-1,70 (1Н, м) 9,2Гц), 4,28-4,16 (1Н, м), 3,46-3,32 (2Н, м), 3,13 (1Н, дд, J=9,2, 12,8Гц), 3,03 (1Н, дд, J=5,9, 12,8Гц), (II) 4-(І\І-[2-(3-(3)-Метоксиметоксипіролідин-12,90 (1Н, ддд, J=5,0, 8,5, 8,5Гц), 2,84 (ЗН, с), 2,73 іл)-1-(3)-фенілетил]-І\І-метиламіно}бензойна кис(1Н, д, и=9,9Гц), 2,56 (1Н, дд, J=4,6, 9,7Гц), 2,32 лота (1Н, ддд, J=6,1, 9,0, 9,0Гц), 2,18-2,00 (1Н, м), 1,90Суміш MeTHn-4-(N-[2-(3-(S)1,50 (4Н, м), 0,98 (ЗН, т, и=7,ЗГц) метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мметиламшо}бензоату (1,99г, 5,00 ммоль) і 4н 600мг цієї аморфної речовини розчиняли в NaOH (12,5мл, 50,0 ммоль) в МеОН (35мл) пере10% НСІ в МеОН (Юмл) Розчинник концентрували мішували при 75°С протягом 3 годин Суміш нейтз одержанням 625мг солі НСІ у вигляді блідоралізували 5н НСІ при 0°С Розчинник вилучали у коричневої аморфної речовини вакуумі До залишку додавали СН2СІ21 нерозчинну ІЧ (КВг) 3300, 1610см 1 + тверду речовину вилучали фільтруванням ФільтМС m/z 382 (М+Н) рат концентрували з одержанням 2,04г (КІЛЬКІСН ) Анал розраховано для СгзНгіМзОг-НСИ ,5Н2О блідо-коричневої аморфної речовини С, 62,08, Н, 7,93, N, 9,44 1 Н-ЯМР (270МГц, CDCI3) 5 7,93 (2Н, д, Знайдено С, 62,29, Н, 8,01, N, 9,42 и=8,8Гц), 7,40-7,10 (5Н, м), 6,81 (2Н, д, и=9,2Гц), Приклад З 5,85 (1Н, шире), 5,26 (1Н, дд, J=6,2, 8,1 Гц), 4,60 Одержання 4-{N-[2-(3-(S)(1Н, д, и=7,0Гц), 4,56 (1Н, д, и=7,0Гц), 4,25-4,15 метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М(1Н, м), 3,30 (ЗН, с), 3,20-3,05 (2Н, м), 2,97 (1Н, дд, метиламшо}-г\Г-метилбензаміду J=6,2, 9,9Гц), 2,87 (ЗН, с), 2,80-2,65 (ЗН, м), 2,15Цю сполуку одержували з 4-{N-[2-(3-(S)2,00 (1Н, м), 1,90-1,75 (1Н, м) метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М(III) 4-{І\І-[2-(3-(3)-Метоксиметоксипіролідин-1метиламшо}бензойноі кислоти та пдрохлориду іл)-1-(3)-фенілетил]-г\І-метиламіно}-г\Гметиламіну з виходом 26% згідно з процедурою, пропілбензамід подібною до процедури, описаної в прикладі 1 (III) До перемішуваного розчину 4-{N-[2-(3-(S)1Н-ЯМР (270МГц, CDCI3) 5 7,64 (2Н, д, метоксиметокси-піролідин-1-іл)-1-(3)-фенілетил]и=8,8Гц), 7,40-7,20 (5Н, м), 6,79 (2Н, д, и=8,8Гц), |\|-метиламіно}бензойноі кислоти (2,04г, 5,00 6,02 (1Н, шире), 5,13 (1Н, дд, J=6,6, 8,1Гц), 4,59 ммоль) і н-пропіламшу (0,822мл, 10,0 ммоль) в (1Н, д, и=7,0Гц), 4,55 (1Н, д, и=6,6Гц), 4,20-4,13 СН2СІ2 (35мл) додавали пдрохлорид 1-етил-3-(3(1Н, м), 3,30 (ЗН, с), 3,15-3,00 (2Н, м), 2,97 (ЗН, д, диметиламшопропіл) карбодмміду (1,92г, 10 J=5,iriO, 2,90-2,80 (1Н, м), 2,83 (ЗН, с), 2,75-2,55 ммоль) при кімнатній температурі Після перемі(ЗН, м), 2,05 (1Н, ддц, J=7,7, 14,3, 13,9Гц), 1,90шування протягом 15,5 годин реакційну суміш 1,70 (1Н, м) промивали водою і насиченим сольовим розчиПриклад 4 42 41 60310 Одержання 4-{N-[2-(3-(S)-riflpoKCHniponiflHH-1метиламшо}бензойноі кислоти та н-бутиламшу з іл)-1-(3)-фенілетил]-І\І-метиламшо}-І\Гвиходом 40% згідно з процедурою, подібною до метилбензаміду процедури, описаної в прикладі 1 (III) Цю сполуку одержували з 4-{N-[2-(3-(S)^Н-ЯМР (270МГц, CDCI 3 )5 7,63 (2Н, д, метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Ми=9,2Гц), 7,34-7,24 (5Н, м), 6,79 (2Н, д, и=9,2Гц), метиламшо}-г\Г-метилбензаміду з виходом 82% 6,00-5,85 (1Н, м), 5,12 (1Н, дд, J=6,6, 7,1Гц), 4,59 згідно з процедурою, подібною до процедури, опи(1Н, д, и=6,6Гц), 4,55 (1Н, д, и=6,6Гц), 4,19-4,15 саної в прикладі 2 (1Н, м), 3,50-3,40 (2Н, м), 3,29 (ЗН, с), 3,07-3,02 1 (2Н, м), 2,90-2,80 (1Н, м), 2,84 (ЗН, с), 2,72-2,57 Н-ЯМР (270МГц, вільний амін, CDCI3)5 7,66 (ЗН, м), 2,08-2,01 (1Н, м), 1,78-1,60 (1Н, м), 1,58(2Н, д, J=9,2I~4), 7,40-7,20 (5Н, м), 6,81 (2Н, д, 1,36 (4Н, м), 0,94 (ЗН, т, и=7,ЗГц) J=8,8I~4), 6,00-5,95 (1Н, м), 5,15 (1Н, дд, J=6,0, 9,0Гц), 4,25-4,20 (1Н, м), 3,13 (1Н, дд, J=9,2, Приклад 8 12,8Гц), 3,03 (1Н, дд, J=5,9, 12,8Гц), 2,98 (ЗН, д, Одержання 4-{М-[2-(3-(3)-гідроксипіролідин-1J=5,1I~4), 2,95-2,80 (1Н, м), 2,83 (ЗН, с), 2,74 (1Н, д, іл)-1-(3)-фенілетил]-г\І-метиламіно}-г\ГJ=9,9I~4), 2,55 (1Н, дд, J=4,6, 9,7Гц), 2,35-2,25 (1Н, бутилбензаміду м), 2,17-2,05 (1Н, м), 1,80-1,60 (2Н, м) Цю сполуку одержували з 4-{N-[2-(3-(S)метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-МСіль НСІ аморфна тверда речовина метиламіно}-г\Г-бутилбензаміду з виходом 59% ІЧ (КВг) 3300, 1610см 1 згідно з процедурою, подібною до процедури, опиАнал розраховано для C2iH27N3O2-HCM ,2Н2О саної в прикладі 2 С, 61,29, Н, 7,45, N, 10,21 1 Н-ЯМР (270МГц, вільний амін, CDCI3) 5 7,65 Знайдено С, 61,68, Н, 7,84, N, 10,20 (2Н, д, и=8,8Гц), 7,35-7,24 (5Н, м), 6,80 (2Н, д, Приклад 5 и=8,8Гц), 5,82-5,78 (1Н, м), 5,15 (1Н, дд, J=5,9, Одержання 4-{N-[2-(3-(S)8,8Гц), 4,26-4,24 (1Н, м), 3,43 (2Н, дд, J=7,0, метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М12,8Гц), 3,13 (1Н, дд, J=8,8, 12,8Гц), 3,03 (1Н, дд, метиламшо}-І\Г-етилбензаміду J=6,2, 12,8Гц), 2,93-2,85 (1Н, м), 2,84 (ЗН, с), 2,73 Сполуку одержували з 4-(N-[2-(3-(S)(1Н, д, и=9,5Гц), 2,56 (1Н, дд, J=4,8, 9,5Гц), 2,37метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М2,28 (1Н, м), 2,10-2,06 (1Н, м), 1,72-1,52 (4Н, м), метиламшо}бензойноі кислоти і пдрохлориду ети1,47-1,25 (2Н, м), 0,95 (ЗН, т, и=7,ЗГц) ламіну з виходом 33% згідно з процедурою, подібною до процедури, описаної в прикладі 1 (III) Сіль НСІ аморфна тверда речовина 1 ІЧ (КВг) 3350, 1610см 1 Н-ЯМР (270МГц, CDCI3)5 7,64 (2Н, д, и=8,8Гц), 7,34-7,24 (5Н, м), 6,79 (2Н, д, и=8,8Гц), МС m/z 396 (М+Н)+ 5,95-5,83 (1Н, м), 5,13 (1Н, дд, J=7,0, 7,5Гц), 4,59 Анал розраховано для C24H33N3O2-HCI-1,4H2O (1Н, д, и=7,0Гц), 4,55 (1Н, д, и=6,6Гц), 4,25-4,14 С, 63,05, Н, 8,11, N, 9,19 (1Н, м), 3,52-3,42 (2Н, м), 3,30 (ЗН, с), 3,10-3,01 Знайдено С, 63,06, Н, 8,04, N, 8,98 (2Н, м), 2,89-2,80 (1Н, м), 2,83 (ЗН, с), 2,75-2,53 Приклад 9 (ЗН, м), 2,11-2,01 (1Н, м), 1,80-1,74 (1Н, м), 1,23 Одержання 4-{N-[1-(S)^eHin-2-(3-(S}(ЗН,т, и=7,1Гц) тетрапдропіран-2-ілоксипіролідин-1-іл)етил]-г\ІПриклад 6 метиламшо}-г\Г-пенталбензаміду Одержання 4-{г\І-[2-(3-(3)-Пдроксипіролідин-1Цю сполуку одержували з 2-(Р)-феніл-2-(3-(3)іл)-1-(3)-фенілетил]-г\І-метиламіно}-г\Гтетрапдро-піран-2-ілоксипіролідин-1-іл)етанолу і 1етилбензаміду (3)-феніл-2-(3-(3)-тетрапдропіран-2ілоксипіролідин-1-іл)етанолу з загальним виходом Цю сполуку одержували з 4-(N-[2-(3-(S)33% згідно з процедурою, подібною до процедури, метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мописаної в прикладі 1 (І)-(ІІІ) метиламшо}-г\Г-етилбензаміду з виходом 43% згід1 но з процедурою, подібною до процедури, описаН-ЯМР (270МГц, CDCI3) 5 7,70-7,60 (2Н, м), ної в прикладі 2 7,40-7,20 (5Н, м), 6,79 (2Н, д, и=8,8Гц), 6,00-5,90 1 (1Н, м), 5,20-5,10 (1Н, м), 4,60-4,55 (0,6Н, м), 4,50Н-ЯМР (270МГц, вільний амін, CDCI3) 5 7,65 4,40 (0,4Н, м), 4,35-4,20 (1Н, м), 3,90-3,72 (1Н, м), (2Н, д, и=8,8Гц), 7,34-7,23 (5Н, м), 6,80 (2Н, д, 3,50-3,35 (ЗН, м), 3,15-2,90 (ЗН, м), 2,84 (1,8Н, с), и=8,8Гц), 6,01 (1Н, шире), 5,14 (1Н, дд, J=6,2, 2,83 (1,2Н, с), 2,80-2,50 (ЗН, м), 2,20-1,95 (1Н, м), 8,8Гц), 4,22-4,18 (1Н, м), 3,50-3,40 (2Н, м), 3,11 1,90-1,25 (13Н, м), 0,91 (ЗН,т, и=7,0Гц) (1Н, дд, J=8,8, 12,8Гц), 3,02 (1Н, дд, J=5,9, 12,8Гц), 2,92-2,85 (1Н, м), 2,82 (ЗН, с), 2,70 (1Н, д, и=9,5Гц), Приклад 10 2,57 (1Н, дд, J=4,8, 9,9Гц), 2,37-2,29 (1Н, м), 2,12Одержання 4-{М-[2-(3-(3)-гідроксипіролідин-12,01 (2Н, м), 1,68-1,60 (1Н, м), 1,21 (ЗН, т, и=7,ЗГц) іл)-1-(3)-фенілетил]-г\І-метиламіно}-г\Гпентилбензаміду Сіль НСІ аморфна тверда речовина ІЧ (КВг) 3350, 1610см 1 Сполуку одержували з 4-{І\І-[1-(3)-феніл-2-(3(3)-тетрапдропіран-2-ілоксипіролідин-1-іл)етил]-МАнал розраховано для C22H29N3O2-HCI-4H2O метиламшо}-М'-пентилбензаміду з виходом 98% С, 55,72, Н, 7,70, N, 8,97 згідно з процедурою, подібною до процедури, опиЗнайдено С, 55,51, Н, 8,05, N, 8,83 саної в прикладі 2 Приклад 7 1 Н-ЯМР (270МГц, вільний амін, CDCI3)5 7,65 Одержання 4-{N-[2-(3-(S)(2Н, д, и=9,2Гц), 7,40-7,20 (5Н, м), 6,81 (2Н, д, метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Ми=8,8Гц), 6,00-5,90 (1Н, м), 5,16 (1Н, дд, J=6,0, металаміно}-г\Г-бутилбензаміду 9,0Гц), 4,26-4,18 (1Н, м), 3,50-3,37 (2Н, м), 3,13 Цю сполуку одержували з 4-{N-[2-(3-(S)(1Н, дд, J=9,2, 12,8Гц), 3,03 (1Н, дд, 6,3, 12,8Гц), метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М 44 43 60310 2,93-2,80 (1Н, м), 2,84 (ЗН, с), 2,73 (1Н, д, J=9,2I~4), Приклад 14 2,56 (1Н, дд, J=4,8, 9,5Гц), 2,37-2,28 (1Н, м), 2,17Одержання 4-{М-[2-(3-(3)-гідроксипіролідин-12,00 (1Н, м), 1,90-1,55 (4Н, м), 1,50-1,30 (4Н, м), іл)-1-(3)-фенілетил]-г\І-метиламіно}-г\Г0,93 (ЗН, т, и=7,ЗГц) фенілбензаміду Сіль НСІ аморфна тверда речовина Цю сполуку одержували з 4-{N-[2-(3-(S)1 метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-МІЧ (КВг) 3350, 1610см метиламшо}-г\Г-фенілбензаміду з виходом 16% Анал розраховано для згідно з процедурою, подібною до процедури, опиС25Нз5МзО2-НСІ-0,25Н2О С, 66,65, Н, 8,17, N, 9,33 саної в прикладі 2 Знайдено С, 66,57, Н, 8,47, N, 9,31 1 Н-ЯМР (270МГц, вільний амін, CDCI3)5 7,84 Приклад 11 (1Н, шир с), 7,76 (2Н, д, и=8,8Гц), 7,66-7,60 (2Н, м), Одержання 4-{N-[2-(3-(S)7,40-7,24 (7Н, м), 7,10 (1Н, т, и=7,ЗГц), 6,84 (2Н, д, метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Ми=9,2Гц), 5,18 (1Н, дд, J=6,2, 8,8Гц), 4,30-4,17 (1Н, метиламіно-І\Г-ізопропілбензаміду м), 3,15 (1Н, дд, J=9,2, 12,8Гц), 3,05 (1Н, дд, J=5,9, Цю сполуку одержували з 4-(N-[2-(3-(S)12,8Гц), 3,00-2,85 (1Н, м), 2,85 (ЗН, с), 2,74 (1Н, д, метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Ми=9,5Гц), 2,59 (1Н, дд, J=4,8, 9,5Гц), 2,45-2,30 (1Н, метиламшо]бензойноі кислоти та ізопропіламшу з м), 2,25 (1Н, шире), 2,15-2,00 (1Н, м), 1,80-1,60 виходом 15% згідно з процедурою, подібною до (1Н, м) процедури, описаної в прикладі 1 (III) Сіль НСІ аморфна тверда речовина ^Н-ЯМР (270МГц, CDCI3) 5 7,63 (2Н, д, J=9, ІЧ (КВг) 3400, 1600см 1 2Гц), 7,34-7,21 (5Н, м), 6,78 (2Н, д, и=9,6Гц), 5,755,72 (1Н, м), 5,12 (1Н, дд, J=6,2, 8,8Гц), 4,59 (1Н, д, Анал розраховано для СгбНгэМзОг-НСЖгО С, и=6,6Гц), 4,55 (1Н, д, и=6,6Гц), 4,30-4,23 (1Н, м), 66,44, Н, 6,86, N, 8,94 4,18-4,14 (1Н, м), 3,30 (ЗН, с), 3,06-3,03 (2Н, м), Знайдено С, 66,33, Н, 7,16, N, 8,86 2,90-2,80 (1Н, м), 2,85 (ЗН, с), 2,81-2,72 (1Н, м), Приклад 15 2,66-2,57 (2Н, м), 2,08-2,01 (1Н, м), 1,79-1,76 (1Н, Одержання 4-{N-[2-(3-(S)м), 1,23 (6Н, д, и=6,6Гц) метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-МПриклад 12 метиламіно}-І\Г-(2-хлорбензил)бензаміду Одержання 4-{М-[2-(3-(3)-гідроксипіролідин-1Цю сполуку одержували з 4-{N-[2-(3-(S)іл)-1-(3)-фенілетил]-г\І-метиламіно}-г\Гметоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мізопропілбензаміду метиламшо}бензойноі кислоти і 2хлорбензиламшу з виходом 88% згідно з процедуЦю сполуку одержували з 4-{N-[2-(3-(S)рою, подібною до процедури, описаної в прикладі метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М1 (III) метиламіно}-І\Г-ізопропілбензаміду з виходом 80% 1 згідно з процедурою, подібною до процедури, опиН-ЯМР (270МГц, CDCI3) 5 7,68 (2Н, д, J=9, саної в прикладі 2 2Гц), 7,50-7,20 (9Н, м), 6,80 (2Н, д, и=9,2Гц), 6,501 6,40 (1Н, м), 5,13 (1Н, дд, J=6,6, 8,1Гц), 4,71 (2Н, д, Н-ЯМР (270МГц, вільний амін, CDCI3) 5 7,64 и=5,9Гц), 4,59 (1Н, д, и=7,0Гц), 4,54 (1Н, д, (2Н, д, и=8,8Гц), 7,34-7,22 (5Н, м), 6,80 (2Н, д, и=7,0Гц), 4,22-4,10 (1Н, м), 3,29 (ЗН, с), 3,15-2,97 и=8,8Гц), 5,79-5,77 (1Н, м), 5,15 (1Н, дд, J=6,2, (2Н, м), 2,87-2,80 (1Н, м), 2,85 (ЗН, с), 2,75-2,52 8,8Гц), 4,30-4,19 (2Н, м), 3,13 (1Н, дд, J=9,2, (ЗН, м), 2,13-1,98 (1Н, м), 1,85-1,70 (1Н, м) 12,8Гц), 3,03 (1Н, дд, J=6,2, 12,8Гц), 2,93-2,84 (1Н, м), 2,82 (ЗН, с), 2,72 (1Н, д, и=9,5Гц), 2,57 (1Н, дд, Приклад 16 J=4,8, 9,9Гц), 2,38-2,29 (1Н, м), 2,14-2,02 (2Н, м), Одержання 4-{М-[2-(3-(3)-гідроксипіролідин-11,68-1,58 (1Н, м), 1,23 (6Н, д, и=6,6Гц) іл)-1-(3)-фенілетил]-г\І-метиламіно}-г\Г-(2хлорбензил)бензаміду Сіль НСІ аморфна тверда речовина 1 ІЧ (КВг) 3350, 1610см Цю сполуку одержували з 4-{N-[2-(3-(S)метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-ММС m/z 382 (М+Н)+ метиламшо}-г\Г-(2-хлорбензил) бензаміду з вихоАнал розраховано для СгзНзіМзОз-НСИ .ЭНгО дом 98% згідно з процедурою, подібною до процеС, 61,09, Н, 7,98, N, 9,29 дури, описаної в прикладі 2 Знайдено С, 61,16, Н, 7,61, N, 9,12 1 Приклад 13 Н-ЯМР (270МГц, вільний амін, CDCI3) 5 7,68 Одержання 4-{N-[2-(3-(S)(2Н, д, и=8,8Гц), 7,50-7,20 (9Н, м), 6,79 (2Н, д, и=8,8Гц), 6,50-6,40 (1Н, м), 5,14 (1Н, дд, J=6,0, метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М9,0Гц), 4,71 (2Н, д, и=5,9Гц), 4,25-4,20 (1Н, м), 3,12 метиламшо}-г\Г-фенілбензаміду (1Н, дд, J=8,8, 12,8Гц), 3,03 (1Н, дд, J=6,2, 12,8Гц), Цю сполуку одержували з 4-{N-[2-(3-(S)2,95-2,80 (1Н, м), 2,84 (ЗН, с), 2,72 (1Н, д, и=9,9Гц), метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М2,56 (1Н, дд, J=4,4, 9,9Гц), 2,40-2,32 (1Н, м), 2,16метиламшо}бензойноі кислоти та аніліну з вихо2,00 (1Н, м), 1,80-1,55 (2Н, м) дом 48% згідно з процедурою, подібною до процедури, описаної в прикладі 1 (III) Сіль НСІ аморфна тверда речовина 1 Н-ЯМР (270МГц, CDCI3) 5 7,63 (2Н, д, ІЧ (КВг) 3300, 1630, 1605см 1 и=8,8Гц), 7,69 (1Н, шире), 7,62 (2Н, д, и=7,7Гц), Анал розраховано для СгтНзоМзОгСІ-НСІ-НгО 7,40-7,24 (7Н, м), 7,11 (1Н, т, и=7,ЗГц), 6,88-6,80 0,ЗС3Н8О С, 62,46, Н, 6,65, N, 7,83 (2Н, м), 5,18 (1Н, дд, J=7,7, 15,0Гц), 4,60 (1Н, д, Знайдено С, 62,51, Н, 7,02, N, 7,94 и=7,0Гц), 5,56 (1Н, д, и=7,0Гц), 4,25-4,10 (1Н, м), Приклад 17 3,31 (ЗН, с), 3,15-3,05 (2Н, м), 2,89 (ЗН, с), 2,95Одержання 4-{N-[2-(3-(S)2,80 (1Н, м), 2,80-2,55 (ЗН, м), 2,15-2,00 (1Н, м), метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М1,90-1,70 (1Н, м) метиламшо}-г\Г,г\Г-диметилбензаміду 46 45 60310 Цю сполуку одержували з 4-(N-[2-(3-(S)Сіль НСІ аморфна тверда речовина 1 метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-МІЧ (КВг) 3350, 1610см метиламшо}бензойноі кислоти і пдрохлориду диАнал розраховано для метиламіну з виходом 7 1 % згідно з процедурою, С24НззМзО2-НСІ-0,75Н2О С, 64,70, Н, 8,03, N, 9,43 подібною до процедури, описаної в прикладі 1 (III) Знайдено С, 64,68, Н, 8,39, N, 9,49 1 Н-ЯМР (270МГц, CDCI3) 5 7,50-7,20 (7Н, м), Приклад 21 7,00-6,75 (2Н, м), 5,35-5,25 (1Н, м), 4,62 (1Н, д, Одержання 3-{N-[2-(3-(S)J=1,0l~4), 4,58 (1Н, д, J=6,6I~4), 4,35-4,20 (1Н, м), метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М3,40-3,20 (2Н, м), 3,32 (ЗН, с), 3,15-3,30 (1Н, м), метиламіно}-І\Г-пропілбензаміду 3,07 (6Н, с), 2,95-2,70 (2Н, м), 2,81 (ЗН, с), 2,25(I) MeTnn-3-{N-[2-(3-(S)2,05 (1Н, м), 2,00-1,80 (1Н, м), 1,80-1,55 (1Н, м) метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мметиламшо}бензоат Приклад 18 Одержання 4-{М-[2-(3-(3)-гідроксипіролідин-1Цю сполуку одержували з 2-(3-(S)іл)-1-(3)-фенілетил]-М-метиламіно}-М',г\Гметоксиметоксипіролідин-1-іл)-2-(Р)-фенілетанолу диметилбензаміду та метил-3-метиламінобензоату з виходом 78% згідно з процедурою, подібною до процедури, опиЦю сполуку одержували з 4-{N-[2-(3-(S)саної в прикладі 1 (І) метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М1 метиламіно}-М',І\Г-диметилбензаміду з виходом Н-ЯМР (270МГц, CDCI3) 5 7,51-7,48 (1Н, м), 88% згідно з процедурою, подібною до процедури, 7,39-7,34 (1Н, м), 7,33-7,20 (6Н, м), 7,04-6,98 (1Н, описаної в прикладі 2 м), 5,15-5,05 (1Н, м), 4,59 (1Н, д, и=7,0Гц), 4,55 1 (1Н, д, и=7,0Гц), 4,20-4,10 (1Н, м), 3,89 (ЗН, с), 3,30 Н-ЯМР (270МГц, вільний амін, CDCI3) 5 7,37 (ЗН, с), 3,15-2,97 (2Н, м), 2,90-2,80 (1Н, м), 2,82 (2Н, д, и=8,8Гц), 7,35-7,20 (5Н, м), 6,79 (2Н, д, (ЗН, с), 2,77-2,55 (ЗН, м), 2,12-1,98 (1Н, м), 1,83и=9,2Гц), 5,13 (1Н, дд, J=6,0, 9,0Гц), 4,25-4,17 (1Н, 1,60 (1Н, м) м), 3,18-2,98 (2Н, м), 3,07 (6Н, с), 2,91 (1Н, ддд, 5,1, 8,4, 8,4Гц), 2,81 (ЗН, с), 2,74 (1Н, д, и=9,2Гц), (II) 3-{І\І-[2-(3-(3)-метоксиметоксипіролідин-12,55 (1Н, дд, J=4,8, 9,5Гц), 2,37-2,25 (1Н, м), 2,20іл)-1-(3)-фенілетил]-г\І-метиламшо}бензойна кис2,00 (1Н, м), 1,80-1,55 (2Н, м) лота Сіль НСІ аморфна тверда речовина Цю сполуку одержували з метил-3-{І\І-[2-(3-(3)метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-МІЧ (КВг) 3400, 1610см 1 метиламшо}бензоату з виходом 100% згідно з Анал розраховано для СггНгэМзОг-НСЖгО С, процедурою, подібною до процедури, описаної в 62,62, Н, 7,64, N, 9,96 прикладі 1 (II) Знайдено С, 62,52, Н, 7,86, N, 9,98 1 Н-ЯМР (270МГц, CDCI3) 5 7,98 (1Н, шире), Приклад 19 7,47 (1Н, д, и=7,7Гц), 7,30-7,10 (6Н, м), 6,82 (1Н, д, Одержання 4-{N-[1 -(3)-феніл-2-(3-(3)J=2,2, 8,4Гц), 5,70-5,60 (1Н, м), 4,63 (1Н, д, тетрапдропіран-2-ілоксипіролідин-1-іл) етил]-Ыи=6,6Гц), 4,59 (1Н, д, и=6,6Гц), 4,40-4,30 (1Н, м), метиламіно}-г\Г-метил-г\Г-пропілбензаміду 4,04 (1Н, шире), 3,77 (1Н, дд, J=5,9, 11,7Гц), 3,68Цю сполуку одержували з 2-(Р)-феніл-2-(3-(3)3,58 (1Н, м), 3,48-3,28 (2Н, м), 3,32 (ЗН, с), 3,12тетрапдропіран-2-ілоксипіролідин-1-іл)етанолу і 13,00 (1Н, м), 2,96-2,84 (1Н, м), 2,71 (ЗН, с), 2,26(3)-феніл-2-(3-(3)-тетрапдропіран-22,12 (1Н, м), 2,06-1,92 (1Н, м) ілоксипіролідин-1-іл)етанолу з загальним виходом 32% згідно з процедурою, подібною до процедури, (III) 3-{І\І-[2-(3-(3)-метоксиметоксипіролідин-1описаної у прикладі 1 (І)-(ІІІ) іл)-1-(3)-фенілетил]-г\І-метиламіно}-г\Г1 пропілбензамід Н-ЯМР (270МГц, CDCI3) 5 7,40-7,20 (7Н, м), 6,77 (2Н, д, и=8,8Гц), 5,11 (1Н, дд, J=7,0, 7,7Гц), Цю сполуку одержували з 3-{N-[2-(3-(S)4,60-4,55 (0,6Н, м), 4,53-4,47 (0,4Н, м), 4,38-4,25 метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М(1Н, м), 3,90-3,75 (1Н, м), 3,55-3,30 (ЗН, м), 3,15метиламшо}бензойноі кислоти і н-пропіламшу з 2,92 (2Н, м), 3,03 (ЗН, с), 2,81 (1,8Н, с), 2,80 (1,2Н, виходом 78% згідно з процедурою, подібною до с), 2,80-2,70 (1Н, м), 2,68-2,50 (ЗН, м), 2,15-1,95 процедури, описаної в прикладі 1 (III) (1Н, м), 1,90-1,45 (9Н, м), 1,00-0,80 (ЗН, м) ^Н-ЯМР (270МГц, CDCI3) 5 7,34-7,19 (7Н, м), 6,98 (1Н, д, и=7,ЗГц), 6,91 (1Н, дд, J=2,2, 8,1 Гц), Приклад 20 6,22 (1Н, шире), 5,16-5,06 (1Н, м), 4,57 (1Н, д, Одержання 4-{І\І-[2-(3-(3)-пдроксипіролідин-1и=6,6Гц), 4,53 (1Н, д, и=6,6Гц), 4,22-4,12 (1Н, м), іл)-1-(3)-фенілетил]-М-метиламіно}-г\Г-метил-г\Г3,46-3,32 (2Н, м), 3,28 (ЗН, с), 3,16-2,96 (1Н, м), пропілбензаміду 2,81 (ЗН, с), 2,86-2,52 (4Н, м), 2,14-1,98 (1Н, м), Цю сполуку одержували з 4-{І\І-[1-(3)-феніл-21,82-1,56 (4Н, м), 0,98 (ЗН, т, и=7,ЗГц) (3-(3)-тетрапдропіран-2-ілоксипіролідин-1-іл)етил]М-метиламіно}-М'-метил-г\Г-пропілбензаміду з виПриклад 22 ходом 83% згідно з процедурою, подібною до проОдержання 3-{г\І-[2-(3-(3)-пдроксипіролідин-1цедури, описаної в прикладі 2 іл)-1-(3)-фенілетил]-М-метиламшо}-М'1 пропілбензаміду Н-ЯМР (270МГц, вільний амін, CDCI3) 5 7,407,20 (7Н, м), 6,79 (2Н, д, и=8,8Гц), 5,11 (1Н, дд, Цю сполуку одержували з 3-{N-[2-(3-(S)J=6,2, 8,8Гц), 4,28-4,16 (1Н, м), 3,46-3,32 (2Н, м), метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М3,18-2,98 (1Н, м), 3,03 (ЗН, с), 2,90 (1Н, ддд, J=5,1, метиламшо}-М'-пропілбензаміду з виходом 90% 8,4, 8,5Гц), 2,81 (ЗН, с), 2,78-2,70 (1Н, м), 2,56 (1Н, згідно з процедурою, подібною до процедури, опидд, J=4,6, 6,9Гц), 2,32 (1Н, ддд, J=6,2, 9,2, 9,2Гц), саної в прикладі 2 1 2,18-2,00 (1Н, м), 1,90-1,50 (4Н, м), 1,00-0,80 (ЗН, Н-ЯМР (270МГц, CDCI3) 5 7,42-7,37 (1Н, м), м) 7,36-7,19 (6Н, м), 6,97 (1Н, д, и=7,7Гц), 6,92 (1Н, 60310 48 47 пдроксипіролідин-1-іл)-1-(3)-фенілетил]-г\Ідд, J=2,6, 8,1Гц), 6,21 (1Н, шире), 5,13 (1Н, дд, метиламіно}-г\Г-пропілбензаміду J=5,9, 8,8Гц), 4,26-4,14 (1Н, м), 3,48-3,32 (2Н, м), 3,18-3,00 (2Н, м), 2,92 (1Н, ддд, J=4,8, 8,4, 8,4Гц), Цю сполуку одержували з 2-xnop-4-{N-[1-(S)2,86-2,72 (1Н, м), 2,78 (ЗН, с), 2,50 (1Н, дд, J=4,8, феніл-2-(3-(3)-тетрапдропіран-2-ілоксипіролідин-19,9Гц), 2,36-2,22 (1Н, м), 2,20-2,02 (1Н, м), 2,00іл)етил]-М-метиламіно}-г\Г-пропілбензаміду з вихо1,70 (2Н, м), 1,63 (2Н, ддд, J=7,3, 14,7, 14,7Гц), дом 89% згідно з процедурою, подібною до проце0,98 (ЗН, т, и=7,ЗГц) дури, описаної в прикладі 2 1 Сіль НСІ коричневий порошок Н-ЯМР (270МГц, вільний амін, CDCI3)5 7,76 Т пл 105-114°С (1Н, д, и=8,8Гц), 7,40-7,20 (5Н, м), 6,75 (1Н, дд, 1 J=2,6, 8,8Гц), 6,72 (1Н, д, и=2,6Гц), 6,54 (1Н, ІЧ (КВг) 3350, 1635см + шире), 5,07 (1Н, дд, J=5,9, 9,2Гц), 4,30-4,20 (1Н, МС m/z 381 (М+Н) м), 3,46-3,35 (2Н, м), 3,12 (1Н, дд, J=9,2, 12,8Гц), Анал розраховано для С2зНзіМзО2-НСІ-0,7Н2О 3,01 (1Н, дд, J=6,0, J=13,0ri0, 2,95-2,78 (1Н, м), С, 64,58, Н, 8,22, N, 9,11 2,83 (ЗН, с), 2,72 (1Н, д, и=9,9Гц), 2,58 (1Н, дд, Знайдено С, 64,42, Н, 8,54, N, 9,34 J=4,8, 9,5Гц), 2,35 (1Н, ддд, J=6,0, 8,9, 9,0Гц), 2,18Приклад 23 2,00 (1Н, м), 1,90-1,50 (4Н, м), 0,99 (ЗН, т, и=7,7Гц) Одержання 2-xnop-4-{N-[1 -(S)-4>eHin-2-(3-(S)тетрапдропіран-2-ілоксипіролідин-1-іл) етил]-ІЧСіль НСІ аморфна тверда речовина метиламіно}-г\Г-пропілбензаміду ІЧ (КВг) 3350, 1600см 1 (I) Метил-2-хлор-4-{Ы-[1 -(3)-феніл-2-(3-(3)Анал розраховано для тетрапдропіран-2-ілоксипіролідин-1-іл)етил]-г\ІС2зНзоНз02СІ-НСІ-0,2Н20 С, 60,58, Н, 6,94, N, 9,21 метиламшо}бензоат Знайдено С, 60,29, Н, 7,13, N, 9,13 Цю сполуку одержували з 2-(R)-qbeHin-2-(3-(S)Приклад 25 тетрапдро-піран-2-ілоксипіролідин-1-іл)етанолу і 1Одержання 2-MeTOKCH-4-{N-[2-(3-(S)(3)-феніл-2-(3-(3)-тетрапдропіран-2метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мілоксипіролідин-1-іл)етанолу та метил-2-хлор-4метиламіно}-І\Г-пропілбензаміду метиламінобензоату з виходом 40% згідно з про(I) Метил-2-метокси-4-{І\І-[2-(3-(3)цедурою, подібною до процедури, описаної в приметоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мкладі 1 (І) метиламшо}бензоат 1 Н-ЯМР (270МГц, CDCI3) 5 7,86-7,80 (1Н, м), Цю сполуку одержували з 2-(3-(S)7,38-7,22 (5Н, м), 6,83-6,78 (1Н, м), 6,72-6,65 (1Н, метоксиметоксипіролідин-1-іл)-1-(3)-фенілетанолу м), 5,10 (1Н, дд, J=6,6, 7,7Гц), 4,60-4,55 (0,6Н, м), і 2-(3-(3)-метоксиметоксипіролідин-1-іл)-2-(Р)4,50-4,45 (0,4Н, м), 4,38-4,22 (1Н, м), 3,86 (ЗН, с), фенілетанолу та м етил-2-мето кс и-43,85-3,75 (1Н, м), 3,50-3,37 (1Н, м), 3,13-2,90 (ЗН, метиламінобензоату з виходом 4 1 % згідно з пром), 2,85 (1,8Н, с), 2,84 (1,2Н, с), 2,80-2,50 (ЗН, м), цедурою, подібною до процедури, описаної в при2,20-1,95 (1Н, м), 1,95-1,40 (7Н, м) кладі 1 (І) 1 (II) 2-xnop-4-{N-[1-(S)-qbeHin-2-(3-(S)Н-ЯМР (270МГц, CDCI3)5 7,79 (1Н, д, J=9, тетрапдропіран-2-іл-оксипіролідин-1-іл)етил]-І\І2Гц), 7,36-7,20 (5Н, м), 6,40 (1Н, дд, J=2,4, 8,9Гц), метиламшо)бензойна кислота 6,27 (1Н, д, и=2,6Гц), 5,13 (1Н, дд, J=7,0, 8,1 Гц), 4,60 (1Н, д, и=7,0Гц), 4,56 (1Н, д, ^6,6Гц), 4,25Цю сполуку одержували з метил-2-хлор-4-{ІЧ4,15 (1Н, м), 3,86 (ЗН, с), 3,82 (ЗН, с), 3,30 (ЗН, с), [1-(S)-qbeHin-2-(3-(S)-TeTpariflpompaH-23,14-2,96 (2Н, м), 2,87 (ЗН, с), 2,90-2,80 (1Н, м), ілоксипіролідин-1-іл)етил]-г\І-метиламшо}бензоату 2,78-2,52 (ЗН, м), 2,14-1,96 (1Н, м), 1,84-1,70 (1Н, з виходом 100% згідно з процедурою, подібною до м) процедури, описаної в прикладі 1 (II) ^Н-ЯМР (270МГц, CDCI3) 5 7,86-7,75 (1Н, м), (II) 2-MeTOKCH-4-{N-[2-(3-(S)7,38-7,22 (5Н, м), 6,80-6,60 (2Н, м), 5,20-5,10 (1Н, метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мм), 4,60-4,55 (0,6Н, м), 4,50-4,45 (0,4Н, м), 4,38метиламшо}бензойна кислота 4,22 (1Н, м), 3,85-3,37 (ЗН, м), 3,20-3,00 (2Н, м), Цю сполуку одержували з м етил-2-мето кс и-42,80-2,50 (4Н, м), 2,69 (ЗН, с), 2,20-1,35 (1Н, м), {г\І-[2-(3-(3)-метоксиметоксипіролідин-1-іл)-1-(3)1,95-1,40 (7Н, м) фенілетил]-І\І-метиламіно} бензоату з виходом (III) 2-Xnop-4-{N-[1-(S)-4>eHin-2-(3-(S)100% згідно з процедурою, подібною до процедутетрапдропіран-2-ілоксипіролідин-1-іл)етил]-г\Іри, описаної в прикладі 1 (II) 1 метиламіно}-г\Г-пропілбензамід Н-ЯМР (270МГц, CDCI3)5 7,98 (1Н, д, Цю сполуку одержували з 2-xnop-4-{N-[1-(S)и=8,8Гц), 7,38-7,16 (5Н, м), 6,54 (1Н, дд, J=2,4, феніл-2-(3-(3)-тетрапдропіран-2-ілоксипіролідин-19,0Гц), 6,35-6,25 (1Н, м), 5,20-5,05 (1Н, м), 4,60 іл)етил]-М-метиламшо} бензойної кислоти і н(1Н, д, и=7,0Гц), 4,56 (1Н, д, и=7,0Гц), 4,25-4,15 пропіламіну з виходом 68% згідно з процедурою, (1Н, м), 3,99 (ЗН, с), 3,30 (ЗН, с), 3,14-3,05 (2Н, м), подібною до процедури, описаної в прикладі 1 (III) 2,91 (ЗН, с), 2,90-2,52 (4Н, м), 2,14-2,00 (1Н, м), 1 1,90-1,70 (1Н, м) Н-ЯМР (270МГц, CDCI3) 5 7,78-7,72 (1Н, м), 7,38-7,22 (5Н, м), 6,79-6,70 (2Н, м), 6,60-6,48 (1Н, (III) 2-MeTOKCH-4-{N-[2-(3-(S)м), 5,07 (1Н, дд, J=6,6, 7,3Гц), 4,60-4,55 (0,6Н, м), метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М4,50-4,45 (0,4Н, м), 4,38-4,22 (1Н, м), 3,90-3,75 (1Н, метиламіно}-г\Г-пропілбензамід м), 3,50-3,37 (ЗН, м), 3,13-2,90 (2Н, м), 2,82 (ЗН, с), Цю сполуку одержували з 2-метокси-4-{І\І-[2-(32,80-2,50 (4Н, м), 2,20-1,95 (1Н, м), 1,95-1,40 (9Н, (3)-метоксиметоксипіролідин-1-іл)-1-(3)м), 0,99 (ЗН,т, и=7,ЗГц) фенілетил]-І\І-метиламіно}бензойноі кислоти і нпропіламіну з виходом 84% згідно з процедурою, Приклад 24 подібною до процедури, описаної в прикладі 1 (III) Одержання 2-xnop-4-{N-[2-(3-(S) 50 49 60310 (2Н, м), 2,64 (ЗН, с), 2,40-2,23 (1Н, м), 2,15-2,00 Н-ЯМР (270МГц, CDCI3)5 8,07 (1H, д, (1Н, м) и=8,8Гц), 7,78-7,68 (1Н, м), 7,36-7,20 (5Н, м), 6,51 (1Н, дд, J=2,4, 9,0Гц), 6,27 (1Н, д, и=2,2Гц), 5,11 (III) 3-MeTOKCH-4-{N-[2-(3-(S)(1Н, дд, J=6,6, 8,1 Гц), 4,60 (1Н, д, и=7,0Гц), 4,56 метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М(1Н, д, и=6,6Гц), 4,25-4,15 (1Н, м), 3,89 (ЗН, с), метиламіно}-г\Г-пропілбензамід 3,45-3,35 (2Н, м), 3,30 (ЗН, с), 3,14-2,96 (2Н, м), Цю сполуку одержували з 3-метокси-4-{І\І-[2-(32,86 (ЗН, с), 2,90-2,80 (1Н, м), 2,78-2,52 (ЗН, м), (3)-метоксиметоксипіролідин-1-іл)-1-(3)2,14-1,96 (1Н, м), 1,84-1,70 (1Н, м), 1,68-1,50 (2Н, фенілетил]-г\І-метиламшо}бензойноі кислоти і нм), 0,97 (ЗН,т, 7,3Гц) пропіламіну з виходом 64% згідно з процедурою, подібною до процедури, описаної в прикладі 1 (III) Приклад 26 1 Н-ЯМР (270МГц, CDCI3) 5 7,45 (1Н, д, Одержання 4-{N-[2-(3-(S)-riflpoKCHniponiflHH-1и=1,8Гц), 7,32-7,18 (5Н, м), 7,11 (1Н, дд, J=1,8, іл)-1-(3)-фенілетил]-г\І-метиламіно}-2-метокси-г\Г8,4Гц), 6,66 (1Н, д, J=8,iriO, 6,15-6,05 (1Н, м), 5,03 пропілбензаміду (1Н, т, J=1,1 Гц), 4,59 (1Н, д, и=7,0Гц), 4,54 (1Н, д, Цю сполуку одержували з 2-метокси-4-(ІЧ-[2-(3и=7,0Гц), 4,15-4,05 (1Н, м), 3,96 (ЗН, с), 3,45-3,35 (3)-метоксиметоксипіролідин-1-іл)-1-(3)(2Н, м), 3,30 (ЗН, с), 3,08 (2Н, д, и=7,7Гц), 2,95-2,85 фенілетил]-М-метиламіно}-г\Г-пропілбензаміду з (1Н, м), 2,65-2,50 (2Н, м), 2,57 (ЗН, с), 2,46 (1Н, дд, виходом 85% згідно з процедурою, подібною до J=4,4, 9,9Гц), 2,10-1,90 (1Н, м), 1,75-1,55 (ЗН, м), процедури, описаної в прикладі 2 0,99 (ЗН, т, и=7,ЗГц) Н-ЯМР (270МГц, вільний амін, CDCI3)5 8,07 Приклад 28 (1Н, д, и=8,8Гц), 7,78-7,68 (1Н, м), 7,38-7,22 (5Н, м), 6,53 (1Н, дд, 2,2, 8,8Гц), 6,27 (1Н, д, и=2,2Гц), Одержання 4-{г\І-[2-(3-(3)-пдроксипіролідин-15,13 (1Н, дд, J=6,2, 8,4Гц), 4,30-4,20 (1Н, м), 3,89 іл)-1-(3)-фенілетил]-г\І-метиламіноі-3-метокси-г\Г(ЗН, с), 3,45-3,35 (2Н, м), 3,20-3,00 (2Н, м), 2,95пропілбензаміду 2,80 (1Н, м), 2,85 (ЗН, с), 2,74 (1Н, д, и=9,5Гц), 2,58 Цю сполуку одержували з 3-метокси-4-{І\І-[2-(3(1Н, дд, J=4,8, 9,5Гц), 2,40-2,27 (1Н, м), 2,18-2,02 (3)-метоксиметоксипіролідин-1-іл)-1-(3)(1Н, м), 1,95-1,55 (4Н, м), 0,97 (ЗН, т, и=7,ЗГц) фенілетил]-М-метиламіно}-г\Г-пропілбензаміду з виходом 77% згідно з процедурою, подібною до Сіль НСІ аморфна тверда речовина процедури, описаної в прикладі 2 ІЧ (КВг) 3400, 1600см 1 Н-ЯМР (270МГц, вільний амін, CDCI3)5 7,48 Анал розраховано для (1Н, д, и=2,2Гц), 7,37-7,22 (5Н, м), 7,12 (1Н, дд, С24НззМзОз-НСІ-0,8СН4О С, 62,89, Н, 7,92, N, 8,87 J=2,2, 8,4Гц), 6,72 (1Н, д, и=8,4Гц), 6,15-6,05 (1Н, Знайдено С, 63,16, Н, 8,32, N, 9,20 м), 5,16 (1Н, дд, J=6,6, 8,8Гц), 4,15-4,05 (1Н, м), Приклад 27 3,97 (ЗН, с), 3,45-3,35 (2Н, м), 3,23 (2Н, дд, J=8,8, Одержання 3-MeTOKCH-4-{N-[2-(3-(S)12,5Гц), 2,99 (1Н, дд, J=6,4, 12,3Гц), 2,80-2,70 (1Н, метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мм), 2,59 (ЗН, с), 2,45 (1Н, дд, J=4,4, 9,9Гц), 2,20метиламіно}-І\Г-пропілбензаміду 1,90 (2Н, м), 1,75-1,40 (4Н, м), 0,99 (ЗН, т, и=7,ЗГц) (I) Метил-3-метокси-4-{ІЧ-[2-(3-(3)Сіль НСІ аморфна тверда речовина метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мметиламшо}бензоат ІЧ (КВг) 3350, 1630см 1 Приклад 29 Цю сполуку одержували з 2-(3-(S)Одержання 3-xnop-4-{N-[2-(3-(S)метоксиметоксипіролідин-1-іл)-1-(3)-фенілетанолу і 2-(3-(3)-метоксиметоксипіролідин-1-іл)-2-(Р)метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мфенілетанолу та м етил-3-мето кс и-4метиламіно}-г\Г-пропілбензаміду (І) 3-Xnop-4-{N-[2-(3-(S)метиламінобензоату з виходом 60% згідно з прометоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мцедурою, подібною до процедури, описаної в приметиламшо}бензонітрил кладі 1 (І) 1 До перемішуваного розчину суміші 2-(3-(S)Н-ЯМР (270МГц, CDCI3) 5 7,58-7,53 (2Н, м), метоксиметоксипіролідин-1-іл)-1-(3)-фенілетанолу 7,31-7,20 (5Н, м), 6,71 (1Н, д, и=8,4Гц), 5,13 (1Н, т, і 2-(3-(3)-метоксиметоксипіролідин-1-іл)-2-(Р)и=1,ЗГц), 4,59 (1Н, д, и=7,0Гц), 4,55 (1Н, д, фенілетанолу (251 мг, 1,00 ммоль) та триетиламшу и=7,0Гц), 4,15-4,05 (1Н, м), 3,95 (ЗН, с), 3,89 (ЗН, (0,167мл, 1,20 ммоль) в СН2СІ2 (4мл) додавали с), 3,30 (ЗН, с), 3,09 (2Н, д, и=7,ЗГц), 2,87 (1Н, дд, метансульфонілхлорид (0,093мл, 1,20 ммоль) краJ=6,2, 9,9Гц), 2,60 (ЗН, с), 2,60-2,52 (2Н, м), 2,47 плями при 0°С (баня з льодом) Після перемішу(1Н, дд, J=4,0, 9,9Гц), 2,08-1,92 (1Н, м), 1,73-1,60 вання протягом 15,5 годин при кімнатній темпера(1Н, м) турі реакційну суміш промивали насиченим (II) 3-MeTOKCH-4-{N-[2-(3-(S)водним розчином ІЧаНСОз, насиченим сольовим метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мрозчином, сушили (Na2SO4) і концентрували з одеметиламшо}бензойна кислота ржанням 238мг коричневого в'язкого масла - (І) До Цю сполуку одержували з м етил-3-мето кс и-4суспензії NaH (48мг, 1,20 ммоль) в N,N{г\І-[2-(3-(3)-метоксиметоксипіролідин-1-іл)-1-(3)диметилформаміді (2мл) додавали розчин 3-хлорфенілетил]-І\І-метиламіно}бензоату з виходом 4-метиламшобензонітрилу (200мг, 1,20 ммоль) при 100% згідно з процедурою, подібною до процедукімнатній температурі Після перемішування прори, описаної в прикладі 1 (II) тягом 45 хвилин, до цієї суміші додавали розчин 1 Н-ЯМР (270МГц, CDCI3) 5 7,52-7,45 (2Н, м), зазначеного вище коричневого в'язкого масла - (І) 7,32-7,12 (5Н, м), 6,65 (1Н, д, и=8,4Гц), 5,47 (1Н, в N.N-диметилформаміді (2мл) при кімнатній темдд, J=6,6, 7,0Гц), 4,64 (1Н, д, и=7,0Гц), 4,60 (1Н, д, пературі, і суміш перемішували при кімнатній теми=6,6Гц), 4,45-4,35 (1Н, м), 4,02 (ЗН, с), 3,85-3,70 пературі протягом 4,5 годин До цієї суміші дода(ЗН, м), 3,68-3,57 (1Н, м), 3,32 (ЗН, с), 3,30-3,05 1 51 60310 52 + вали НгО, підлуговували 25% ІЧЬЦОН і екстрагуваMCm/z 416, 418(М+Н) ли СН2СІ2 Екстракт промивали водою, насиченим Анал розраховано для сольовим розчином, сушили (Na2SO4) і концентруС2зНзоМз02СІ-С4Н404-Н20 С, 58,96, Н, 6,60, N, вали з одержанням коричневого масла, яке очи7,64 щали колонковою хроматографією (силікагель Знайдено С, 59,35, Н, 6,64, N, 7,55 20г, СН2СІ2/Ме0Н 100/1-50/1) з одержанням 244мг Приклад 31 (61%) коричневого масла Одержання 6-{N-[2-(3-(S)1 Н-ЯМР (270МГц, CDCI3) 5 7,61 (1Н, д, метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-МJ=2,2I~4), 7,43-7,25 (6Н, м), 6,98 (1Н, д, и=8,4Гц), метиламіно}-г\Г-пропілнікотинаміду 5,03 (1Н, дд, J=7,3, 7,7Гц), 4,58 (1Н, д, и=6,6Гц), (I) Метил 6-{N-[2-(3-(S)4,54 (1Н, д, и=6,6Гц), 4,10-3,97 (1Н, м), 3,31 (ЗН, с), метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М3,10 (2Н, дд, J=1,5, 7,7Гц), 2,75-2,65 (1Н, м), 2,69 метиламшо)нікотинат (ЗН, с), 2,55-2,43 (ЗН, м), 2,03-1,85 (1Н, м), 1,70Цю сполуку одержували з 2-(3-(S)1,60 (1Н, м) метоксиметоксипіролідин-1-іл)-1-(3)-фенілетанолу (II) 3-Xnop-4-{N-[2-(3-(S)і 2-(3-(3)-метоксиметоксипіролідин-1-іл)-2-(Р)фенілетанолу метил-6-метиламшонікотинату з метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мвиходом 60% згідно з процедурою, подібною до метиламіно)-г\Г-пропілбензамід процедури, описаної в прикладі 29 (І) До суспензії t-BuOH (381 мг, 3,05 ммоль)і НгО (0,055мл, 3,05 ммоль) в t-BuOH (1,0мл) додавали ^Н-ЯМР (270МГц, CDCI3) 5 8,83 (1Н, д, розчин 3-xnop-4-{N-[2-(3-(S)и=2,2Гц), 8,01 (1Н, дд, J=2,2, 9,2Гц), 7,35-7,20 (5Н, метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мм), 6,48 (1Н, д, и=9,2Гц), 6,44-6,32 (1Н, м), 4,59 метиламшо}бензонітрилу (244мг, 0,611 ммоль) в t(1Н, д, и=7,0Гц), 4,56 (1Н, д, и=6,6Гц), 4,22-4,12 BuOH (1,0мл) при кімнатній температурі Після (1Н, м), 3,86 (ЗН, с), 3,30 (ЗН, с), 3,17-2,92 (ЗН, м), нагрівання із зворотним холодильником протягом 2,83 (ЗН, с), 2,80-2,70 (1Н, м), 2,65-2,50 (2Н, м), 0,5 годин суміші давали охолонути до кімнатної 2,12-1,95 (1Н, м), 1,80-1,65 (1Н, м) температури До суміші додавали н-пропілйодид (II) 6-{І\І-[2-(3-(3)-метоксиметоксипіролідин-1(0,298мл, 3,05 ммоль), і суміш нагрівали із зворотіл)-1-(3)-фенілетил]-г\І-метиламшо]нікотинова кисним холодильником протягом 3 годин Після охолота лоджування до кімнатної температури розчинник Цю сполуку одержували з метил-6-(І\І-[2-(3-(3)випарювали Залишок розчиняли в СН2СІ21 промиметоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мвали водою, насиченим сольовим розчином, суметиламшо}нікотинату з виходом 100% згідно з шили (Na2SO4) і концентрували з одержанням бліпроцедурою, подібною до процедури, описаної в до-коричневого масла, яке очищали колонковою прикладі 1 (II) хроматографією (силікагель 15г, СНгСЬ/МеОН 1 Н-ЯМР (270МГц, CDCI3) 5 8,80-8,75 (1Н, м), 80/1-50/1) з одержанням 206мг (73%) аморфної 7,95-7,87 (1Н, м), 7,35-7,15 (5Н, м), 6,57 (1Н, речовини кольору слонової кістки шире), 6,42 (1Н, д, и=9,2Гц), 4,62 (1Н, д, ^6,6Гц), 1 Н-ЯМР (270МГц, CDCI3)5 7,77 (1Н, д, 4,59 (1Н, д, и=7,0Гц), 4,35-4,00 (2Н, м), 3,50-3,25 и=2,2Гц), 7,52 (1Н, дд, J=2,2, 8,4Гц), 7,36-7,20 (5Н, (2Н, м), 3,32 (ЗН, с), 3,18-3,08 (1Н, м), 3,02-2,70 м), 6,92 (1Н, д, и=8,4Гц), 6,15-6,00 (1Н, м), 4,91 (ЗН, м), 2,79 (ЗН, с), 2,20-2,05 (1Н, м), 1,90-1,80 (1Н, дд, J=7,3, 7,7Гц), 4,57 (1Н, д, и=7,0Гц), 4,53 (1Н, м) (1Н, д, и=7,0Гц), 4,10-3,98 (1Н, м), 3,45-3,35 (2Н, (III) 6-(І\І-[2-(3-(3)-метоксиметоксипіролідин-1м), 3,29 (ЗН, с), 3,14 (1Н, дд, J=7,7, 12,5Гц), 3,05 іл)-1-(3)-фенілетил]-г\І-метиламіно}-г\Г(1Н, дд, J=7,3, 12,5Гц), 2,73 (1Н, дд, J=6,2, 9,9Гц), пропілнікотинамід 2,64 (ЗН, с), 2,55-2,43 (ЗН, м), 2,05-1,88 (1Н, м), Цю сполуку одержували з 6-{N-[2-(3-(S)1,75-1,55 (ЗН, м), 0,96 (ЗН, т, и=7,ЗГц) метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-МПриклад ЗО метиламшо}нікотиновоі кислоти і н-пропіламшу з виходом 65% згідно з процедурою, подібною до Одержання 3-xnop-4-{N-[2-(3-(S)процедури, описаної в прикладі 1 (III) пдроксипіролідин-1-іл)-1-(3)-фенілетил]-г\Іметиламіно}-І\Г-пропілбензаміду ^Н-ЯМР (270МГц, CDCI3) 5 8,57 (1Н, д, Цю сполуку одержували з 3-xnop-4-{N-[2-(3и=2,6Гц), 7,89 (1Н, дд, J=2,6, 9,2Гц), 7,35-7,20 (5Н, (3)-метоксиметоксипіролідин-1-іл)-1-(3)м), 6,50 (1Н, д, и=9,2Гц), 6,40-6,35 (1Н, м), 6,00фенілетил]-М-метиламіно}-г\Г-пропілбензаміду з 5,90 (1Н, м), 4,59 (1Н, д, и=7,0Гц), 4,56 (1Н, д, виходом 96% згідно з процедурою, подібною до и=7,0Гц), 4,20-4,10 (1Н, м), 3,45-3,35 (2Н, м), 3,30 процедури, описаної в прикладі 2 (ЗН, с), 3,17-2,92 (ЗН, м), 2,82 (ЗН, с), 2,80-2,70 (1Н, м), 2,65-2,50 (2Н, м), 2,12-1,95 (1Н, м), 1,80Н-ЯМР (270МГц, вільний амін, CDCI3) 5 7,81 1,55 (ЗН, м), 0,99 (ЗН, т, и=7,ЗГц) (1Н, д, и=2,2Гц), 7,51 (1Н, дд, J=2,2, 8,4Гц), 7,427,22 (5Н, м), 6,93 (1Н, д, Л=8АГц), 6,15-6,00 (1Н, Приклад 32 м), 4,99 (1Н, дд, J=7,3, 7,9Гц), 4,20-4,05 (1Н, м), Одержання 6-{г\І-[2-(3-(3)-пдроксипіролідин-13,45-3,35 (2Н, м), 3,16 (1Н, дд, J=7,7, 12,5Гц), 3,08 іл)-1-(3)-фенілетил]-г\І-метиламіно}-г\Г(1Н, дд, J=7,3, 12,5Гц), 2,75-2,60 (2Н, м), 2,65 (ЗН, пропілнікотинаміду с), 2,41 (1Н, дд, J=4,4, 9,5Гц), 2,25-2,15 (1Н, м), Цю сполуку одержували з 6-{N-[2-(3-(S)2,08-1,93 (1Н, м), 1,90-1,40 (4Н, м), 0,99 (ЗН, т, метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мметиламшо}-М'-пропілнікотинаміду з виходом 73% згідно з процедурою, подібною до процедури, опиСіль фумарової кислоти аморфна тверда ресаної в прикладі 2 човина 1 ІЧ (КВг) 3350, 1630см 1 Н-ЯМР (270МГц, вільний амін, CDCI3) 5 8,58 54 53 60310 (2Н, д, и=8,8Гц), 6,05-5,90 (1Н, м), 5,14 (2Н, с), (1Н, д, J=2,6I~4), 7,89 (1Н, дд, J=2,6, 8,8Гц), 7,355,08 (1Н, дд, J=7,0, 7,7Гц), 4,59 (1Н, д, 6,6Гц), 4,55 7,20 (5Н, м), 6,50 (1Н, д, и=9,5Гц), 6,36 (1Н, дд, (1Н, д, и=7,0Гц), 4,22-4,12 (1Н, м), 3,46 (ЗН, с), J=5,9, 9,9Гц), 6,00-5,92 (1Н, м), 4,25-4,15 (1Н, м), 3,45-3, 35 (2Н, м), 3,30 (ЗН, с), 3,03 (2Н, д, 3,45-3,35 (2Н, м), 3,17 (1Н, дд, J=9,9, 12,5Гц), 3,05и=7,7Гц), 2,86 (ЗН, с), 2,85-2,80 (1Н, м), 2,75-2,50 2,95 (2Н, м), 2,81 (ЗН, с), 2,72 (1Н, д, ^9,5Гц), 2,62 (ЗН, м), 2,12-1,95 (1Н, м), 1,85-1,52 (ЗН, м), 0,97 (1Н, дд, J=4,8, 9,9Гц), 2,40-2,25 (1Н, м), 2,17-2,02 (ЗН, т, и=7,ЗГц) (1Н, м), 1,95-1,75 (2Н, м), 1,70-1,55 (2Н, м), 0,98 (ЗН, т, и=7,ЗГц) Приклад 34 Сіль фумарової кислоти аморфна тверда реОдержання 4-{Н-[1-(3)-(3-пдроксифеніл)-2-(3човина (З)-пдроксипіролідин-і-іл) етил]-г\І-метиламіно}-г\Г1 пропілбензаміду ІЧ (КВг) 3350, 1630см + МС m/z 383 (М+Н) Цю сполуку одержували з 4-{N-[1-(S)-(3метоксиметоксифеніл)-2-(3-(3)Анал розраховано для метоксиметоксипіролідин-1-іл)етил]-г\ІC22H3oN402-C4H404-1,5H20 С, 59,42, Н, 7,10, N, метиламшо}-г\І-пропілбензаміду з виходом 97% 10,66 згідно з процедурою, подібною до процедури, опиЗнайдено С, 59,50, Н, 7,43, N, 10,73 саної в прикладі 2 Приклад 33 1 Н-ЯМР (270МГц, вільний амін, CDCI3-flMCOОдержання 4-{N-[1-(S)-(3de) 5 8,85 (1Н, шире), 7,69 (2Н, д, и=9,2Гц), 7,11 метоксиметоксифеніл)-2-(3-(3)(1Н, т, и=7,7Гц), 6,98-6,90 (1Н, м), 6,82-6,68 (5Н, м), метоксиметоксипіролідин-1-іл) етил]-ІЧ5,06 (1Н, дд, J=6,2, 8,4Гц), 4,30-4,18 (1Н, м), 3,67 метиламіно}-г\Г-пропілбензаміду (1Н, шире), 3,40-3,30 (2Н, м), 3,15-2,95 (2Н, м), (I) Метил-4-{І\І-[1-(3)-(3-метоксиметоксифеніл)2,86 (ЗН, с), 2,85-2,67 (2Н, м), 2,63-2,56 (1Н, м), 2-(3-(3)метоксиметоксипіролідин-1-іл)етил]-г\І2,55-2,43 (1Н, м), 2,15-1,98 (1Н, м), 1,70-1,52 (ЗН, метиламшо}бензоат м), 0,96 (ЗН,т, и=7,ЗГц) Цю сполуку одержували з суміші 2-(R)-(3метоксиметоксифеніл)-2-(3-(3)Сіль НСІ аморфна тверда речовина метоксиметоксипіролідин-1-іл) етанолу і 1-(S)-(3ІЧ (КВг) 3350, 1610см 1 метоксиметоксифеніл)-2-(3МС m/z 397 (М+н)+ (3)метоксиметоксипіролідин-1-іл)етанолу і метилАнал розраховано для С2зНзіМзОз-НСІ-2,ЗН2О 4-метиламшобензоату з виходом 60% згідно з С, 58,11, Н, 7,76, N, 8,84 процедурою, подібною до процедури, описаної в Знайдено С, 57,82, Н, 8,06, N, 9,24 прикладі 1 (І) Приклад 35 1 Н-ЯМР (270МГц, CDCI3)5 7,89 (2Н, д, Одержання 4-{г\І-[2-(3-(3)-пдроксипіролідин-1и=9,2Гц), 7,27-7,19 (1Н, м), 6,98-6,88 (ЗН, м), 6,77 іл)-1-(3)-(3-метоксифеніл)етил]-г\І-метиламіно}-г\Г(2Н, д, и=9,2Гц), 5,14 (2Н, с), 5,14-5,08 (1Н, м), 4,59 пропілбензаміду (1Н, д, и=6,6Гц), 4,55 (1Н, д, и=7,0Гц), 4,22-4,12 До розчину 4-{г\І-[1-(3)-(3-пдроксифеніл)-2-(3(1Н, м), 3,85 (ЗН, с), 3,46 (ЗН, с), 3,30 (ЗН, с), 3,04 (3)-пдроксипіролідин-1-іл)етил]-М-метиламіно}-г\Г(2Н, д, J=8,iriO, 2,88 (ЗН,с), 2,85-2,53 (4Н, м), пропілбензаміду (ЮОмг, 0,252 ммоль) в суміші 2,10-1,98 (1Н, м), 1,83-1,70 (1Н, м) МеОН (0,1 мл) - CH3CN (0,9мл) додавали N,Nдмзопропілетиламін (0,0641 мл, 0,353 ммоль) і 10% (II) 4-{І\І-[1-(3)-(3-метоксиметоксифеніл)-2-(3триметилсилілдіазометан в СН2СІ2 (0,6мл) при (3)-метоксиметоксипіролідин-1-іл)етил]-г\Ікімнатній температурі Після перемішування прометиламшо}бензойна кислота тягом 22 годин при кімнатній температурі до цієї Цю сполуку одержували з метил-4-{Н-[1-(3)суміші додавали 25% NH4OH і екстрагували (3)-метоксиметоксифеніл)-2-(3-(3)СН2СІ2 Екстракт промивали насиченим сольовим метоксиметоксипіролідин-1-іл)етил]-г\Ірозчином, сушили (Na2SO4) і концентрували з одеметиламшо}бензоату з виходом 100% згідно з ржанням коричневого масла, яке очищали колонпроцедурою, подібною до процедури, описаної в ковою хроматографією (силікагель 5г, прикладі 1 (II) 1 СН2СІ2/Ме0Н 30/1-10/1) з одержанням 55,2мг Н-ЯМР (270МГц, CDCI3)5 7,88 (2Н, д, (53%) білої аморфної речовини и=8,8Гц), 7,30-7,12 (1Н, м), 6,98-6,84 (ЗН, м), 6,68 1 (2Н, д, и=8,8Гц), 5,15-5,05 (1Н, м), 5,10 (2Н, с), 4,55 Н-ЯМР (270МГц, вільний амін, CDCI3) 5 7,65 (1Н, д, и=6,6Гц), 4,51 (1Н, д, и=7,0Гц), 4,18-4,08 (2Н, д, и=8,8Гц), 7,24 (1Н, т, и=7,7Гц), 6,90-6,77 (1Н, м), 3,42 (ЗН, с), 3,25 (ЗН, с), 3,10-2,92 (2Н, м), (5Н, м), 6,05-5,90 (1Н, м), 5,10 (1Н, дд, J=5,9, 2,85 (1Н, дд, J=6,4, 9,9Гц), 2,74 (ЗН, с), 2,70-2,53 8,8Гц), 4,25-4,18 (1Н, м), 3,77 (ЗН, с), 3,45-3,35 (2Н, (ЗН, м), 2,10-1,93 (1Н, м), 1,80-1,65 (1Н, м) м), 3,11 (1Н, дд, J=9,2, 12,8Гц), 3,01 (1Н, дд, J=5,9, 12,8Гц), 2,95-2,80 (1Н, м), 2,84 (ЗН, с), 2,72 (1Н, д, (III) 4-{г\І-[1-(3)-(3-метоксиметоксифеніл)-2-(3и=9,5Гц), 2,56 (1Н, д, J=4,8, 9,5Гц), 2,38-2,25 (1Н, (3)-метоксиметоксипіролідин-1-іл}етил]-г\Ім), 2,16-2,00 (1Н, м), 1,85-1,55 (4Н, м), 0,97 (ЗН, т, метиламіно}-г\Г-пропілбензамід Цю сполуку одержували з 4-(N-[1-(S)-(3метоксиметоксифеніл)-2-(3-(3)Сіль НСІ аморфна тверда речовина метоксиметоксипіролідин-1-іл)етил]-г\ІІЧ (чистий, вільний амін) 3350, 1610см 1 метиламшо}бензойноі кислоти і н-пропіламшу з MCm/z 412(M+H) + виходом 80% згідно з процедурою, подібною до Анал розраховано для С24НззМзОз-НСІ-0, процедури, описаної в прикладі 1 (III) С, 63,08, Н, 7,72, N, 9,19 ^Н-ЯМР (270МГц, CDCI3) 5 7,65 (2Н, д, Знайдено С, 62,89, Н, 7,77, N, 9,25 и=9,2Гц), 7,28-7,18 (1Н, м), 6,98-6,88 (ЗН, м), 6,76 Приклад 36 55 60310 56 Одержання 4-{N-[1-(S)-(3-TpeTцедурою, подібною до процедури, описаної в прикладі 1 (І) бутоксикарбонілметоксифеніл)-2-(3-(3)1 пдроксипіролідин-1-іл) етил]-г\І-метиламіно}-г\ГН-ЯМР (270МГц, CDCI3)5 7,88 (2Н, д, пропілбензаміду и=9,2Гц), 7,38-7,20 (5Н, м), 6,78 (2Н, д, и=9,2Гц), 5,17 (1Н, т, и=7,ЗГц), 3,84 (ЗН, с), 3,04 (2Н, д, Суміш 4-{N-[1 -(3)-(3-гідроксифеніл)-2-(3-(3)и=7,ЗГц), 2,86 (ЗН, с), 2,65-2,45 (4Н, м), 1,80-1,65 пдроксипіролідин-1-іл)етил]-М-метиламіно}-г\Г(4Н, м) пропілбензаміду (ЮОмг, 0,252 ммоль), третбутил о ром ацетату (0,0409мл, 0,277 ммоль) і К2СО3 (II) 4-{М-[1-(3)-феніл-2-(піролідин-1-іл)етил]-І\І(38,3мг, 0,277 ммоль) уДМФ (1,5мл) перемішували метиламшо}бензойна кислота при кімнатній температурі протягом 2 годин До Цю сполуку одержували з метил-4-{І\І-[1-(3)суміші додавали ЬЬО і екстрагували сумішшю феніл-2-(піролідин-1-іл)етил]-г\ІАсОЕ1/голуол=2/1 Екстракт промивали водою, метиламшо}бензоату з виходом 100% згідно з НаСИЧеНИМ СОЛЬОВИМ РОЗЧИНОМ, СуШИЛИ (N32SO4) І процедурою, подібною до процедури, описаної в прикладі 1 (II) концентрували з одержанням блідо-коричневої 1 аморфної речовини, яку очищали колонковою Н-ЯМР (270МГц, CDCI3-flMCO-d6) 5 7,92 (2Н, хроматографією (силікагель 8г, СЬЬСЬ/МеОН д, и=8,8Гц), 7,38-7,20 (5Н, м), 7,02 (2Н, д, и=8,8Гц), 30/1-10/1) з одержанням 80,1мг (62%) білої амор5,80 (1Н, шире), 4,00-3,00 (7Н, м), 2,85 (ЗН, с), фної речовини 2,20-1,90 (4Н, м) 1 Н-ЯМР (270МГц, CDCI3) 5 7,65 (2Н, д, (III) 4-{М-[1-(3)-феніл-2-(піролідин-1-іл)етил]-І\ІJ=9,2I~4), 7,23 (1Н, т, J=7,7I~4), 6,94-6,86 (2Н, м), метиламіно}-г\Г-пропілбензамід 6,82-6,72 (ЗН, м), 6,05-5,90 (1Н, м), 5,09 (1Н, дд, Цю сполуку одержували з 4-{І\І-[1-(3)-феніл-2J=6,2, 8,8Гц), 4,48 (2Н, с), 4,25-4,18 (1Н, м), 3,45(піролідин-1-іл)етил]-г\І-метиламшо}бензойноі кис3,35 (2Н, м), 3,09 (1Н, дд, J=9,2, 12,8Гц), 3,00 (1Н, лоти і н-пропіламшу з виходом 56% згідно з продд, J=5,9, 12,8Гц), 2,95-2,80 (1Н, м), 2,83 (ЗН, с), цедурою, подібною до процедури, описаної в при2,71 (1Н, д, и=9,5Гц), 2,54 (1Н, дд, 4,8, 9,5Гц), 2,38кладі 1 (III) 1 2,25 (1Н, м), 2,16-2,00 (1Н, м), 1,85-1,50 (4Н, м), Н-ЯМР (270МГц, вільний амін, CDCI3) 5 7,65 1,46 (9Н, с), 0,98 (ЗН, т, и=7,ЗГц) (2Н, д, и=8,8Гц), 7,36-7,20 (5Н, м), 6,79 (2Н, д, Приклад 37 и=8,8Гц), 6,05-5,90 (1Н, м), 5,14 (1Н, т, и=7,0Гц), Одержання 4-{N-[1-(S)-(33,45-3,35 (2Н, м), 3,04 (2Н, д, и=7,0Гц), 2,84 (ЗН, с), карбоксиметоксифеніл)-2-(3-(3)-пдроксипіролідин2,65-2,45 (4Н, м), 1,75-1,50 (6Н, м), 0,97 (ЗН, т, 1-іл) етил]-М-метиламіно}-г\Г-пропілбензаміду Розчин 4-{N-[1-(S)-(3-TpeTСіль НСІ аморфна тверда речовина бутоксикарбонілметоксифеніл)-2-(3-(3)ІЧ (КВг) 1610см 1 пдроксипіролідин-1-іл)етил]-М-метиламіно}-г\ГМС m/z 366 (М+Н)+ пропілбензаміду (80,1мг, 0,157 ммоль) у трифтоАнал розраховано для СгзНзіМзО-НСІ-О.бНгО роцтовій кислоті (1мл) і СН2СІ2 (0,5мл) перемішуС, 67,22, Н, 8,09, N, 10,22 вали при кімнатній температурі протягом 1,5 гоЗнайдено С, 67,48, Н, 8,37, N, 10,32 дин Розчинник випарювали Залишок розчиняли в Приклад 39 СН2СІ2 і додавали 1,0М розчин хлориду водню в Одержання 4-{г\І-[2-(3-(3)-пдроксипіролідин-1діетиловому ефірі (1мл) Білий порошок збирали і іл)-1-(3)-фенілетил]-г\І-метиламіно}-г\Гпромивали Et20 та сушили за пониженого тиску пропілфталіміду протягом 6,5 годин при 45°С з одержанням 86,2мг Цю сполуку одержували з 2-(Р)-феніл-2-(3-(3)(КІЛЬКІСН ) білого порошку тетрапдропіран-2-ілоксипіролідин-1-іл)етанолу і 1Сіль НСІ білий порошок (3)-феніл-2-(3-(3)-тетрапдропіран-21 Н-ЯМР (270МГц, CDCI3-flMCO-d6) 5 12,49 (1Н, ілоксипіролідин-1-іл)етанолу і 4-метиламшо-М'шир с), 7,79 (2Н, д, и=8,4Гц), 7,42 (1Н, шир с), 7,23 пропілфталіміду із загальним виходом 16% згідно (1Н, т, и=7,7Гц), 7,07 (2Н, д, и=8,4Гц), 6,85-6,76 з процедурою, подібною до процедури, описаної в (ЗН, м), 5,95-5,80 (1Н, м), 4,53 (2Н, с), 4,50-4,40 прикладі 1 (І) і 2 1 (1Н, м), 4,00-3,70 (4Н, м), 3,50-2,50 (ЗН, м), 2,80 Н-ЯМР (270МГц, вільний амін, CDCI3)5 7,63 (ЗН, с), 2,50-2,00 (2Н, м), 1,75-1,55 (4Н, м), 0,96 (1Н, д, и=8,4Гц), 7,38-7,22 (6Н, м), 6,94 (1Н, дд, (ЗН, т, и=7,ЗГц) J=2,6, 8,4Гц), 5,19 (1Н, дд, J=5,9, 9,5Гц), 4,30-4,20 ІЧ (КВг) 3400, 1730, 1610см 1 (1Н, м), 3,59 (2Н, т, и=7,ЗГц), 3,18 (1Н, дд, J=9,5, МС m/z 456 (М+Н)+ 13,2Гц), 3,03 (1Н, дд, J=5,5, 12,8Гц), 2,95 (ЗН, с), Т пл 108-110°С 2,95-2,85 (1Н, м), 2,71 (1Н, д, и=9,2Гц), 2,61 (1Н, Анал розраховано для СгбНззМзОб-НСІ-З.бНгО дд, J=4,8, 9,5Гц), 2,37 (1Н, ддд, J=5,9, 8,8, 8,8Гц), С, 54,10, Н, 7,45, N, 7,57 2,20-2,05 (1Н, м), 1,75-1,60 (4Н, м), 0,93 (ЗН, т, Знайдено С, 54,07, Н, 7,49, N, 7,39 Приклад 38 Сіль НСІ аморфна тверда речовина Одержання 4-{І\І-[1-(3)-феніл-2-(піролідин-1-іл ІЧ (КВг) 3400, 1760, 1700, 1620см 1 )етил]-г\І-метиламіно-г\Г-пропілбензаміду Анал розраховано для С24Н2эМзОз-НС1-0,5Н2О (І) Метил-4-{І\І-[1 -(3)-феніл-2-(піролідин-1 С, 63,64, Н, 6,90, N, 9,28 іл)етил]-І\І-метиламіно}бензоат Знайдено С, 63,99, Н, 7,18, N, 9,00 Цю сполуку одержували з суміші 2-(Р)-фенілПриклад 40 2-(піролідин-1-іл)етанолу і 1-(3)-феніл-2Одержання 5-{N-[2-(3-(S)(піролідин-і-іл)етанолу та метил-4метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-Мметиламінобензоату з виходом 52% згідно з прометиламіно}-г\Г-пропіл-2-тюфенкарбоксаміду 60310 58 57 Цю сполуку одержували з 2-(3-(S)прикладі 1 (II) 1 метоксиметоксипіролідин-1-іл)-1-(3)-фенілетанолу Н-ЯМР (270МГц, CDCI3)5 7,72 (2Н, д, і 2-(3-(3)-метоксиметоксипіролідин-1-іл)-2-(Р)и=8,4Гц), 7,36-7,23 (5Н, м), 6,42 (2Н, д, и=8,4Гц), фенілетанолу та 5-метиламіно-І\Г-пропіл-25,80 (1Н, шире), 4,69-4,65 (1Н, м), 4,63 (1Н, д, тюфенкарбоксаміду з виходом 49% згідно з прои=7,0Гц), 4,60 (1Н, д, и=7,0Гц), 4,39-4,37 (1Н, м), цедурою, подібною до процедури, описаної в при4,32-4,22 (1Н, м), 3,34 (ЗН, с), 3,00-2,82 (ЗН, м), кладі 1 (І) 2,66-2,48 (ЗН, м), 2,17-2,10 (1Н, м), 1,95-1,78 (1Н, 1 м) Н-ЯМР (270МГц, CDCI3) 5 7,35-7,25 (5Н, м), 7,18 (1Н, д, J=4,4I~4), 5,83 (1Н, д, и=4,0Гц), 5,68(III) 4-{І\І-[2-(3-(3)-метоксиметоксипіролідин-15,60 (1Н, м), 4,86 (1Н, дд, J=7,0, 7,7Гц), 4,62 (1Н, д, іл)-1 -(З)-фенілетил] амшо}-г\Г-пропілбензамід J=7,0l~4), 4,58 (1Н, д, и=7,0Гц), 4,25-4,15 (1Н, м), Цю сполуку одержували з 4-{N-[2-(3-(S)3,40-3,30 (2Н, м), 3,32 (ЗН, С), 3,13-3,00 (2Н, м), метоксиметоксипіролідин-1-іл)-1-(3)2,94 (1Н, дд, J=6,2, 9,9Гц), 2,83 (ЗН, с), 2,80-2,70 фенілетил]амшо}бензойноі кислоти і н-пропіламшу (1Н, м), 2,67-2,55 (2Н, м), 2,15-2,00 (1Н, м), 1,87з виходом 62% згідно з процедурою, подібною до 1,73 (1Н, м), 1,70-1,50 (2Н, м), 0,95 (ЗН, т, J=7,7I~4) процедури, описаної в прикладі 1 (III) Приклад 41 ^Н-ЯМР (270МГц, CDCI3)5 7,49 (2Н, д, Одержання 5-{І\І-[2-(3-(3)-пдроксипіролідин-1и=8,5Гц), 7,38-7,24 (5Н, м), 6,48 (2Н, д, и=8,8Гц), іл)-1-(3)-фенілетил]-І\І-метиламіно}-І\Г-пропіл-25,95-5,80 (1Н, м), 5,46 (1Н, шире), 4,65 (1Н, д, тюфенкарбоксаміду и=7,0Гц), 4,61 (1Н, д, и=7,0Гц), 4,32-4,23 (2Н, м), 3,36 (ЗН, с), 3,38-3,31 (2Н, м), 2,90-2,76 (ЗН, м), Цю сполуку одержували з 5-{N-[2-(3-(S)2,59 (1Н, дд, J=3,9, 10,8Гц), 2,53-2,42 (2Н, м), 2,18метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил]-М2,11 (1Н, м), 1,83-1,82 (1Н, м), 1,60-1,50 (2Н, м), метиламіно}-г\Г-пропіл-2-тюфенкарбоксаміду з ви0,93 (ЗН, т, и=7,ЗГц) ходом 78% згідно з процедурою, подібною до процедури, описаної в прикладі 2 Приклад 43 1 Н-ЯМР (270МГц, вільний амін, CDCI3) 5 7,38Одержання 4-{г\І-[2-(3-(3)-пдроксипіролідин-17,24 (5Н, м), 7,18 (1Н, д, и=4,0Гц), 5,84 (1Н, д, іл)-1 -(З)-фенілетил] амшо}-г\Г-пропілбензаміду и=4,4Гц), 5,70-5,60 (1Н, м), 4,88 (1Н, дд, J=6,0, Цю сполуку одержували з 4-(N-[2-(3-(S)9,0Гц), 4,30-4,22 (1Н, м), 3,40-3,30 (2Н, м), 3,15 метоксиметоксипіролідин-1-іл)-1-(3)(1Н, дд, J=9,2, 12,8Гц), 3,07-2,95 (2Н, м), 2,81 (ЗН, фенілетил]аміно}-г\Г-пропілбензаміду з виходом с), 2,75 (1Н, д, и=9,5Гц), 2,63 (1Н, дд, J=4,8, 9,5Гц), 67% згідно з процедурою, подібною до процедури, 2,42-2,30 (1Н, м), 2,22-2,05 (1Н, м), 1,80-1,50 (4Н, описаної в прикладі 2 1 м), 0,96 (ЗН,т, и=7,7Гц) ІЧ-ЯМР (270МГц, вільний амін, CDCI3) 5 7,50 Сіль фумарової кислоти аморфна тверда ре(2Н, д, и=8,8Гц), 7,38-7,22 (5Н, м), 6,48 (2Н, д, човина и=8,8Гц), 5,95-5,80 (1Н, м), 5,39 (1Н, шире), 4,394,29 (2Н, м), 3,40-3,28 (2Н, м), 2,99-2,84 (2Н, м), ІЧ (КВг) 3300, 1610см 1 2,73-2,53 (ЗН, м), 2,40-2,31 (1Н, м), 2,26-2,13 (1Н, МС m/z 388 (М+Н)+ м), 1,90-1,67 (2Н, м), 1,65-1,50 (2Н, м), 0,94 (ЗН, т, Анал розраховано для C2iH29N3O2S-C4H4O4-0,5H2O-CH4O С, 57,34, Н, 7,03, N, 7,71 Сіль НСІ аморфна тверда речовина Знайдено С, 57,37, Н, 7,31, N, 7,79 ІЧ (КВг) 3350, 1610см 1 Приклад 42 Анал розраховано для СггНгэМэОг-Н ,1 Нг Одержання 4-{N-[2-(3-(S)С, 62,44, Н, 8,05, N, 9,72 метоксиметоксипіролідин-1-іл)-1-(3)-фенілетил ] Знайдено С, 62,36, Н, 7,66, N, 9,92 амшо}-г\Г-пропілбензаміду Приклад 44 (I) MeTnn-4-{N-[2-(3-(S)Одержання 4-{N-[1 -(3)-(3-хлорфеніл)-2-(3-(3)метоксиметоксипіролідин-1-іл)-1-(3)метоксиметоксипіролідин-1-іл) етил]-Ыфенілетил]амшо}бензоат метиламшо}-М'-пропілбензаміду Цю сполуку одержували з 2-(3-(S)(I) Метил-4-{Ы-[1 -(3)-(3-хлорфеніл)-2-(3-(3)метоксиметоксипіролідин-1-іл)-1-(3)-фенілетанолу метоксиметоксипіролідин-1-іл)етил]-г\Іі 2-(3-(3)-метоксиметоксипіролідин-1-іл)-2-(Р)метиламшо}бензоат фенілетанолута метил-4-амшобензоату з виходом Цю сполуку одержували з суміші 2-(R)-(369% згідно з процедурою, подібною до процедури, хлорфеніл)-2-(3-(3)-метоксиметоксипіролідин-1описаної в прикладі 1 (І) іл)етанолу і 1 -(3)-(3-хлорфеніл)-2-(3-(3)1 метоксиметоксипіролідин-1-іл) етанолу та метил-4Н-ЯМР (270МГц, CDCI3)5 7,75 (2Н, д, метиламінобензоату з виходом 66% згідно з прои=8,8Гц), 7,37-7,27 (5Н, м), 6,47 (2Н, д, и=8,8Гц), цедурою, подібною до процедури, описаної в при5,56 (1Н, шире), 4,65 (1Н, д, и=6,6Гц), 4,61 (1Н, д, кладі 1 (І) и=7,0Гц), 4,35-4,28 (1Н, м), 4,26-4,23 (1Н, м), 3,80 1 (ЗН, с), 3,36 (ЗН, с), 2,90-2,76 (ЗН, м), 2,62-2,51 Н-ЯМР (270МГц, CDCI3)5 7,90 (2Н, д, (2Н, м), 2,48-2,42 (1Н, м), 2,18-2,10 (1Н, м), 1,84и=8,8Гц), 7,30-7,14 (4Н, м), 6,77 (2Н, д, и=9,2Гц), 1,82 (1Н, м) 5,11 (1Н, дд, J=7,0, 7,7Гц), 4,60 (1Н, д, и=7,0Гц), 4,55 (1Н, д, и=7,0Гц), 4,22-4,13 (1Н, м), 3,86 (ЗН, с), (II) 4-{І\І-[2-(3-(3)-метоксиметоксипіролідин-13,30 (ЗН, с), 3,12-2,94 (2Н, м), 2,90-2,78 (1Н, м), іл)-1-(3)-фенілетил]аміно}бензойна кислота 2,87 (ЗН, с), 2,76-2,52 (ЗН, м), 2,15-1,98 (1Н, м), Цю сполуку одержували з метил-4-{І\І-[2-(3-(3)1,85-1,70 (1Н, м) метоксиметоксипіролідин-1-іл)-1-(3)фенілетил]амшо}бензоату з виходом 100% згідно з (II) 4-{Ы-[1-(3)-(3-хлорфен1л)-2-(3-(3)процедурою, подібною до процедури, описаної в метоксиметоксипіролідин-1-іл) етил]-ІЧ 60 59 60310 метиламшо} бензойна кислота (II) 4-{М-[2-(3-(3)-фторпіролідин-1-іл)-1-(3)фенілетил]-І\І-метиламіно}бензойна кислота Цю сполуку одержували з метил-4-{І\І-[1-(3)-(3хлорфеніл)-2-(3-(3)-метоксиметоксипіролідин-1Цю сполуку одержували з метил-4-{І\І-[2-(3-(3)іл)етил]-І\І-метиламшо}бензоату з виходом 96% фторпіролідин-1-іл)-1-(3)-фенілетил]-г\Ізгідно з процедурою, подібною до процедури, опиметиламшо)бензоату з виходом 100% згідно з саної в прикладі 1 (II) процедурою, подібною до процедури, описаної у 1 прикладі 1 (II) Н-ЯМР (270МГц, CDCI3) 5 7,93 (2Н, д, 1 J=9,2I~4), 7,32-7,10 (4Н, м), 6,82 (2Н, д, и=9,2Гц), Н-ЯМР (270МГц, CDCI3)5 7,92 (2Н, д, 5,40-5,25 (1Н, м), 4,62 (1Н, д, и=7,0Гц), 4,58 (1Н, д, и=8,8Гц), 7,40-7,10 (5Н, м), 6,83 (2Н, д, и=8,8Гц), и=7,0Гц), 4,30-4,18 (1Н, м), 3,40-3,00 (ЗН, м), 3,31 5,40-5,00 (2Н, м), 3,40-3, 15 (2Н, м), 3,10-2,70 (4Н, (ЗН, с), 2,95-2,65 (ЗН, м), 2,88 (ЗН, с), 2,20-2,00 м), 2,90 (ЗН, с), 2,30-1,90 (2Н, м) (1Н, м), 1,95-1,80 (1Н, м) (III) 4-{М-[2-(3-(3)-фторпіролідин-1-іл)-1-(3)фенілетил]-М-метиламіно}-г\Г-пропілбензамід (III) 4-{N-[1-(S)-(3-xnop4)eHin)-2-(3-(S)метоксиметоксипіролідин-1-іл)етил]-МЦю сполуку одержували з 4-{N-[2-(3-(S)метиламіно)-І\Г-пропілбензамід фторпіролідин-1-іл)-1-(3)-фенілетил]-г\Іметиламшо}бензойноі кислоти і н-пропіламшу з Цю сполуку одержували з 4-{N-[1-(S)-(3виходом 73% згідно з процедурою, подібною до хлорфеніл)-2-(3-(3)-метоксиметоксипіролідин-1процедури, описаної в прикладі 1 (III) іл)етил]-І\І-метиламіно}бензойноі кислоти і нпропіламіну з виходом 77% згідно з процедурою, Н-ЯМР (270МГц, вільний амін, CDCI3)5 7,65 подібною до процедури, описаної в прикладі 1 (III) (2Н, д, и=8,8Гц), 7,37-7,22 (5Н, м), 6,79 (2Н, д, 1 и=8,8Гц), 6,03-5,92 (1Н, м), 5,25-4,95 (1Н, м), 5,11 Н-ЯМР (270МГц, CDCI3)5 7,66 (2Н, д, (1Н, дд, J=6,2, 8,4Гц), 3,45-3,35 (2Н, м), 3,18-3,02 и=9,2Гц), 7,30-7,13 (4Н, м), 6,78 (2Н, д, и=9,2Гц), (2Н, м), 2,95-2,72 (ЗН, м), 2,87 (ЗН, с), 2,63-2,50 6,02-5,92 (1Н, м), 5,07 (1Н, дд, J=6,6, 7,7Гц), 4,60 (1Н, м), 2,18-1,85 (2Н, м), 1,72-1,54 (2Н, м), 0,97 (1Н, д, и=7,0Гц), 4,55 (1Н, д, и=7,0Гц), 4,25-4,12 (ЗН, т, и=7,ЗГц) (1Н, м), 3,45-3,35 (2Н, м), 3,30 (ЗН, с), 3,12-2,93 (2Н, м), 2,90-2,78 (1Н, м), 2,85 (ЗН, с), 2,75-2,52 Сіль НСІ аморфна тверда речовина (ЗН, м), 2,13-1,97 (1Н, м), 1,85-1,70 (1Н, м), 1,69ІЧ (КВг) 1605см 1 1,54 (2Н, м), 0,98 (ЗН, т, и=7,ЗГц) МС m/z 384 (М+Н)+ Приклад 45 Анал розраховано для Одержання 4-{N-[1 -(3)-(3-хлорфеніл)-2-(3-(3)C23H30N3OF-HCI-0,3H2O СН4О С, 63,02, Н, 7,84, N, пдроксипіролідин-1-іл) етил]-г\І-метиламіноІ-г\Г9,19 пропілбензаміду Знайдено С, 62,69, Н, 8,17, N, 9,57 Цю сполуку одержували з 4-{N-[1-(S)-(3Приклад 47 хлорфеніл)-2-(3-(3)-метоксиметоксипіролідин-1Одержання 4-{N-[2-(3-(S)іл)етил]-М-метиламіно}-г\Г-пропілбензаміду з вихометоксиметоксипіролідин-1-іл)-1-(Р)-фенілетил]-Мдом 83% згідно з процедурою, подібною до процеметиламіно}-г\Г-пропілбензаміду дури, описаної в прикладі 2 (I) MeTnn-4-{N-[2-(3-(S)1 Н-ЯМР (270МГц, вільний амін, CDCI3)5 7,67 метоксиметоксипіролідин-1-іл)-1-(Р)-фенілетил]-М(2Н, д, и=9,2Гц), 7,30-7,14 (4Н, м), 6,79 (2Н, д, метиламшо}бензоат и=8,8Гц), 6,03-5,94 (1Н, м), 5,09 (1Н, дд, J=6,2, Цю сполуку одержували з 2-(3-(S)8,8Гц), 4,27-4,18 (1Н, м), 3,45-3,35 (2Н, м), 3,09 метоксиметоксипіролідин-1-іл)-1-(Р)-фенілетанолу (1Н, дд, J=8,8, 12,8Гц), 3,01 (1Н, дд, J=6,2, 12,8Гц), і 2-(3-(3)-метоксиметоксипіролідин-1-іл)-2-(3)2,93-2,80 (1Н, м), 2,84 (ЗН, с), 2,72 (1Н, д, и=9,9Гц), фенілетанолу та метил-4-метиламшобензоату з 2,57 (1Н, дд, J=5,0, 9,7Гц), 2,38-2,27 (1Н, м), 2,17виходом 49% згідно з процедурою, подібною до 2,02 (1Н, м), 1,80-1,55 (4Н, м), 0,98 (ЗН, т, и=7,ЗГц), процедури, описаної в прикладі 1 (І) Сіль фумарової кислоти аморфна тверда ре^Н-ЯМР (270МГц, CDCI3)5 7,88 (2Н, д, човина и=8,8Гц), 7,34-7,23 (5Н, м), 6,78 (2Н, д, и=9,2Гц), 1 ІЧ (КВг) 3350, 1610см 5,17 (1Н, дд, J=7,0, 7,7Гц), 4,58 (1Н, д, и=7,0Гц), + 4,53 (1Н, д, и=6,6Гц), 4,22-4,15 (1Н, м), 3,85 (ЗН, с), MCm/z 416(M+H) 3,68-3,52 (1Н, м), 3,28 (ЗН, С), 3,08-3,04 (2Н, м), Приклад 46 2,86 (ЗН, с), 2,76-2,67 (1Н, м), 2,62-2,51 (2Н, м), Одержання 4-{г\І-[2-(3-(3)-фторпіролідин-1-іл)2,08-1,97 (1Н, м), 1,83-1,72 (1Н, м) 1-(3)-фенілетил]-г\І-метиламіно}-г\Гпропілбензаміду (II) 4-{М-[2-(3-(3)-метоксиметоксипіролідин-1(І) Метил 4-{І\І-[2-(3-(3)-фторпіролідин-1-іл)-1іл)-1-(Р)-фенілетил]-М-метиламшо}бензойна кис(3)-фенілетил]-І\І-метиламіно)бензоат лота Цю сполуку одержували з 2-(3-(S)Цю сполуку одержували з метил 4-{N-[2-(3-(S)фторпіролідин-1-іл)-1-(3)-фенілетанолу і 2-(3-(S)метоксиметоксипіролідин-1-іл)-1-(Р)-фенілетил]-Мфторпіролідин-1-іл)-2-(Р)-фенілетанолу та метилметиламшо}бензоату з виходом 100% згідно з 4-метиламшобензоату з виходом 54% згідно з процедурою, подібною до процедури, описаної в процедурою, подібною до процедури, описаної в прикладі 1 (II) 1 прикладі 1 (І) Н-ЯМР (270МГц, CDCI3) 5 7,89 (2Н, д, 1 Н-ЯМР (270МГц, CDCI3)5 7,89 (2Н, д, и=9,2Гц), 7,33-7,18 (5Н, м), 6,75 (2Н, д, и=9,2Гц), и=9,2Гц), 7,38-7,22 (5Н, м), 6,78 (2Н, д, и=9,2Гц), 5,15 (1Н, дд, J=7,0, 7,3Гц), 4,57 (1Н, д, и=7,0Гц), 5,25-4,95 (1Н, м), 5,14 (1Н, дд, J=6,6, 8,8Гц), 3,84 4,52 (1Н, д, и=7,0Гц), 4,25-4,15 (1Н, м), 3,33 (ЗН, с), (ЗН, с), 3,18-3,00 (2Н, м), 2,95-2,75 (ЗН, м), 2,89 3,05 (1Н, д, и=6,6Гц), 2,88-2,84 (1Н, м), 2,85 (ЗН, с), (ЗН, с), 2,60-2,50 (1Н, м), 2,15-1,85 (2Н, м) 2,76-2,62 (1Н, м), 2,50-2,61 (ЗН, м), 2,07-2,02 (1Н,
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrolidinyl and pyrolinylethylene compounds as kappa-receptors agonists, a process for preparation thereof, pharmaceutical composition, a method for treatment and intermediate compounds
Автори англійськоюIto Fumitaka, Kondo Hiroshi
Назва патенту російськоюСоединения пиролидинил- и пиролинилэтиламина как агонисты каппа-рецептора, способ их получения, фармацевтическая композиция, способ лечения и промежуточные соединения
Автори російськоюИто Фумитака, Кондо Хироси
МПК / Мітки
МПК: C07D 401/12, C07D 213/81, A61K 31/40, A61P 29/00, A61K 31/4427, A61P 1/06, C07F 7/18, C07D 213/82, C07D 333/40, A61P 25/28, C07D 405/12, C07D 207/12, C07D 409/12, A61K 31/4035, C07C 239/00, A61P 43/00, C07D 207/10, A61P 23/00, A61K 31/443, A61P 25/04, C07C 237/30, A61K 31/4439, A61K 31/4025, C07D 403/12, C07D 207/20, A61K 31/5377, A61P 19/02, A61K 31/4433, C07D 207/24, A61P 25/00, A61K 31/4015
Мітки: одержання, сполуки, спосіб, проміжні, лікування, композиція, піролідиніл, піролінілетиламіну, фармацевтична, агоністи, капа-рецептора
Код посилання
<a href="https://ua.patents.su/46-60310-spoluki-pirolidinil-i-piroliniletilaminu-yak-agonisti-kapa-receptora-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-sposib-likuvannya-ta-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Сполуки піролідиніл- і піролінілетиламіну як агоністи капа-рецептора, спосіб їх одержання, фармацевтична композиція, спосіб лікування та проміжні сполуки</a>
Попередній патент: Газорозрядний субміліметровий лазер з зовнішніми електродами
Наступний патент: Антагоністи рецептора вітронектину, спосіб одержання цих сполук та фармацевтична композиція
Випадковий патент: Система віброзбудження вібраційного верстата