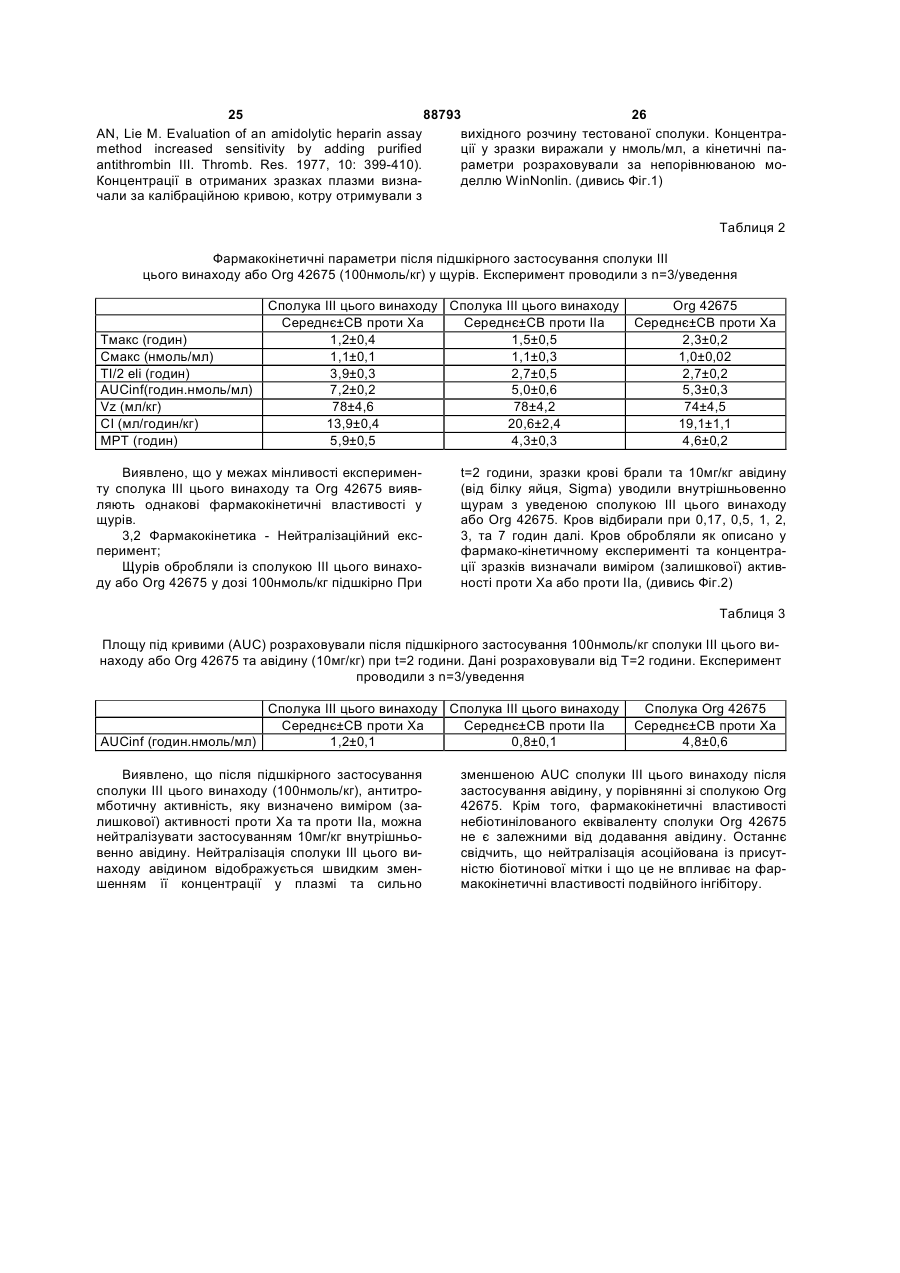
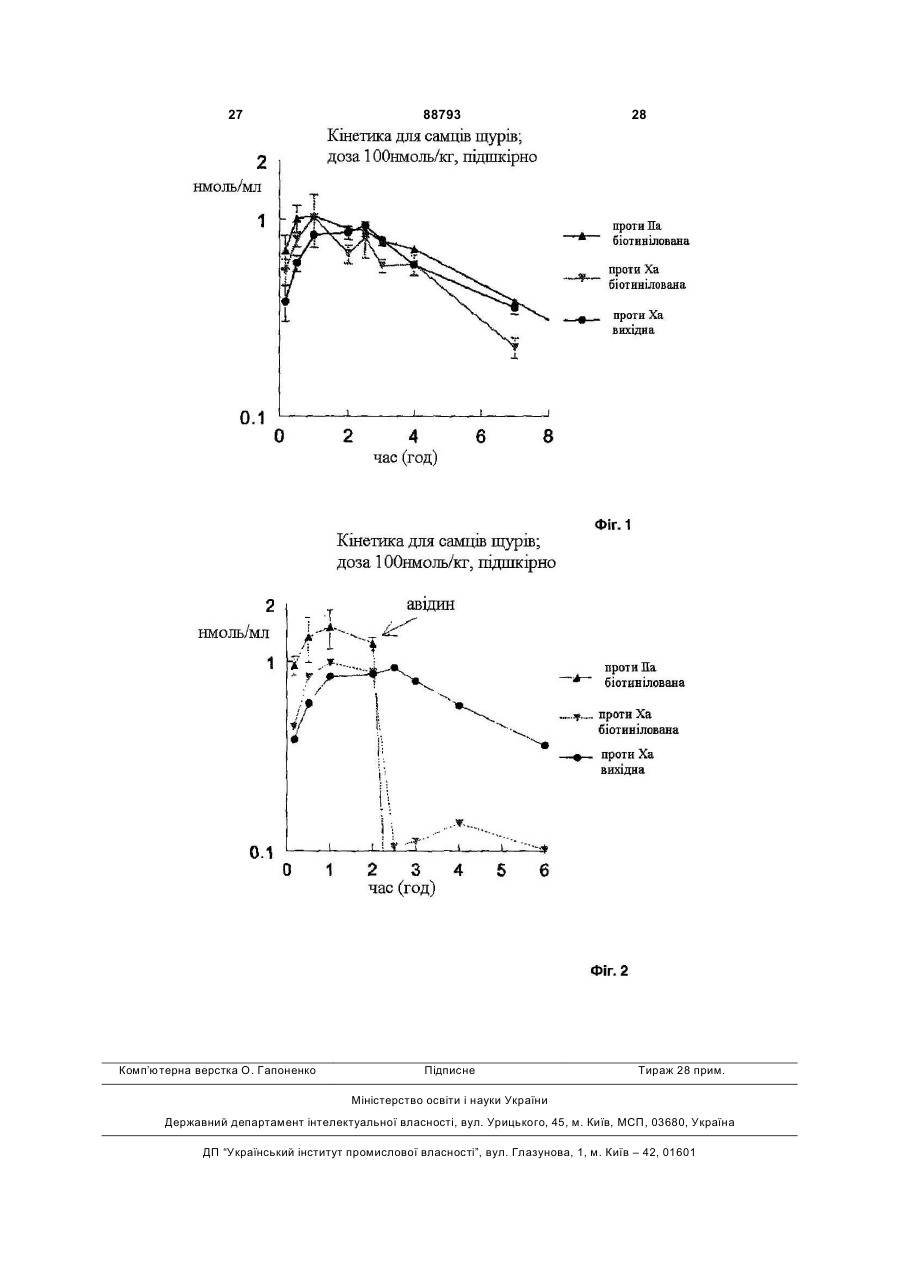
Антитромботичні подвійні інгібітори, що містять залишок біотину
Номер патенту: 88793
Опубліковано: 25.11.2009
Формула / Реферат
1. Антитромботична сполука формули (І)
олігосахарид-спейсер-А, (І)
де олігосахарид є негативно зарядженим олігосахаридним залишком, що має 2-25 моносахаридних ланок, заряд компенсовано позитивно зарядженими протиіонами, а олігосахаридний залишок є похідним від олігосахариду, котрий має (опосередковану АТ-ІІІ) активність сам по собі;
спейсер є по суті фармакологічно неактивним гнучким з'єднувальним залишком, що має довжину ланцюга 10-70 атомів;
А є залишком -CH[NH-SO2-R1][CO-NR2-CH(4-бeнзaмiдин)-CO-NR3R4], де R1 - феніл, нафтил, 1,2,3,4-тетрагідронафтил, (ізо)хінолініл, тетрагідро(ізо)хінолініл, 3,4-дигідро-1Н-ізохінолініл, хроманіл або камфорна група, ці групи можуть, як варіант, бути заміщеними одним або більше замісниками, вибраними з (1-8С)алкілу або (1-8С)алкоксилу; a R2 та R3, незалежно, - Н або (1-8С)алкіл; R4 - (1-8С)алкіл або (3-8С)циклоалкіл; або R3 та R4 разом з атомом нітрогену, до котрого вони приєднані, є неароматичним (4-8)членним кільцем, що містить, як варіант, ще один гетероатом, кільце заміщене, як варіант, (1-8С)алкілом або SО2-(1-8С)алкілом;
або її фармацевтично прийнятна сіль, проліки або сольват;
де сполука формули І крім того містить принаймні один ковалентний зв'язок із залишком біотину або його аналога.
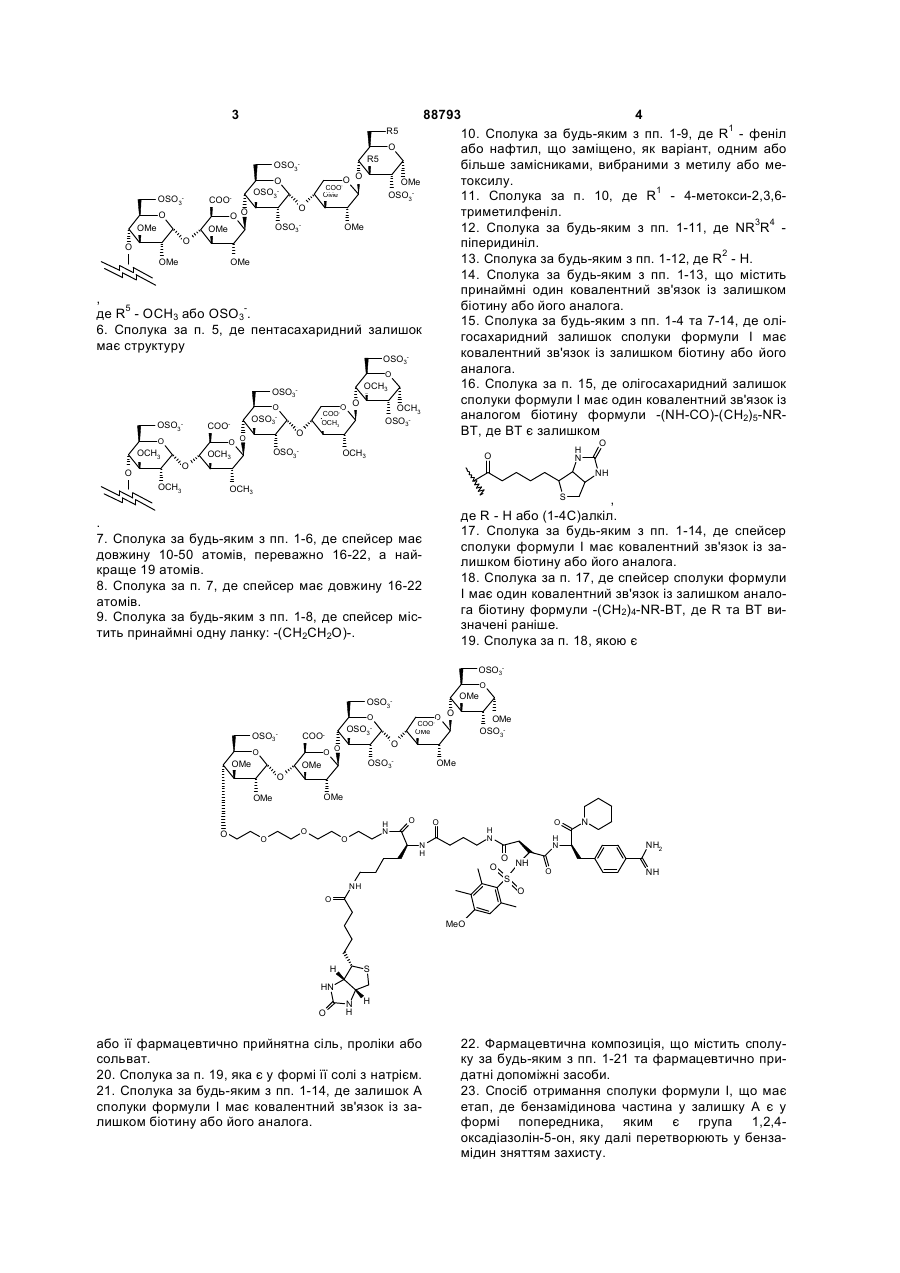
2. Сполука за п. 1, де олігосахаридний залишок має 2-16 моносахаридних ланок.
3. Сполука за п. 2, де олігосахарид є сульфатованим пентасахаридним залишком.
4. Сполука за п. 3, де олігосахарид є пентасахаридним залишком формули (II), де R5, незалежно, - залишок біотину або його аналога, OSO3- або (1-8С)алкоксил.
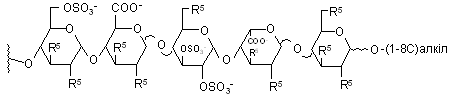 (II),
(II),
5. Сполука за п. 4, де пентасахаридний залишок має структуру
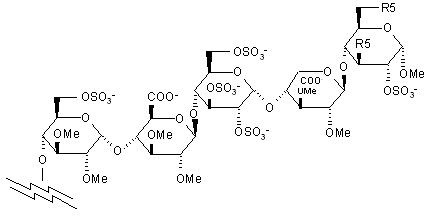 ,
,
де R5 - OCH3 або OSO3-.
6. Сполука за п. 5, де пентасахаридний залишок має структуру
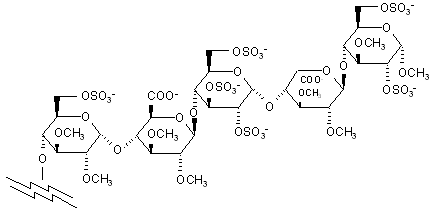 .
.
7. Сполука за будь-яким з пп. 1-6, де спейсер має довжину 10-50 атомів, переважно 16-22, а найкраще 19 атомів.
8. Сполука за п. 7, де спейсер має довжину 16-22 атомів.
9. Сполука за будь-яким з пп. 1-8, де спейсер містить принаймні одну ланку: -(СН2СН2О)-.
10. Сполука за будь-яким з пп. 1-9, де R1 - феніл або нафтил, що заміщено, як варіант, одним або більше замісниками, вибраними з метилу або метоксилу.
11. Сполука за п. 10, де R1 - 4-метокси-2,3,6-триметилфеніл.
12. Сполука за будь-яким з пп. 1-11, де NR3R4 - піперидиніл.
13. Сполука за будь-яким з пп. 1-12, де R2 - Н.
14. Сполука за будь-яким з пп. 1-13, що містить принаймні один ковалентний зв'язок із залишком біотину або його аналога.
15. Сполука за будь-яким з пп. 1-4 та 7-14, де олігосахаридний залишок сполуки формули І має ковалентний зв'язок із залишком біотину або його аналога.
16. Сполука за п. 15, де олігосахаридний залишок сполуки формули І має один ковалентний зв'язок із аналогом біотину формули -(NH-CO)-(CH2)5-NR-BT, де ВТ є залишком
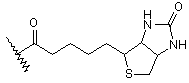 ,
,
де R - Н або (1-4С)алкіл.
17. Сполука за будь-яким з пп. 1-14, де спейсер сполуки формули І має ковалентний зв'язок із залишком біотину або його аналога.
18. Сполука за п. 17, де спейсер сполуки формули І має один ковалентний зв'язок із залишком аналога біотину формули -(CH2)4-NR-BT, де R та ВТ визначені раніше.
19. Сполука за п. 18, якою є

або її фармацевтично прийнятна сіль, проліки або сольват.
20. Сполука за п. 19, яка є у формі її солі з натрієм.
21. Сполука за будь-яким з пп. 1-14, де залишок А сполуки формули І має ковалентний зв'язок із залишком біотину або його аналога.
22. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-21 та фармацевтично придатні допоміжні засоби.
23. Спосіб отримання сполуки формули І, що має етап, де бензамідинова частина у залишку А є у формі попередника, яким є група 1,2,4-оксадіазолін-5-он, яку далі перетворюють у бензамідин зняттям захисту.
24. Сполука за будь-яким з пп. 1-21 для застосування у терапії.
25. Застосування сполуки за будь-яким з пп. 1-21 у виробництві медикаменту для лікування або попередження тромбозу або інших пов'язаних з тромбіном хвороб.
Текст
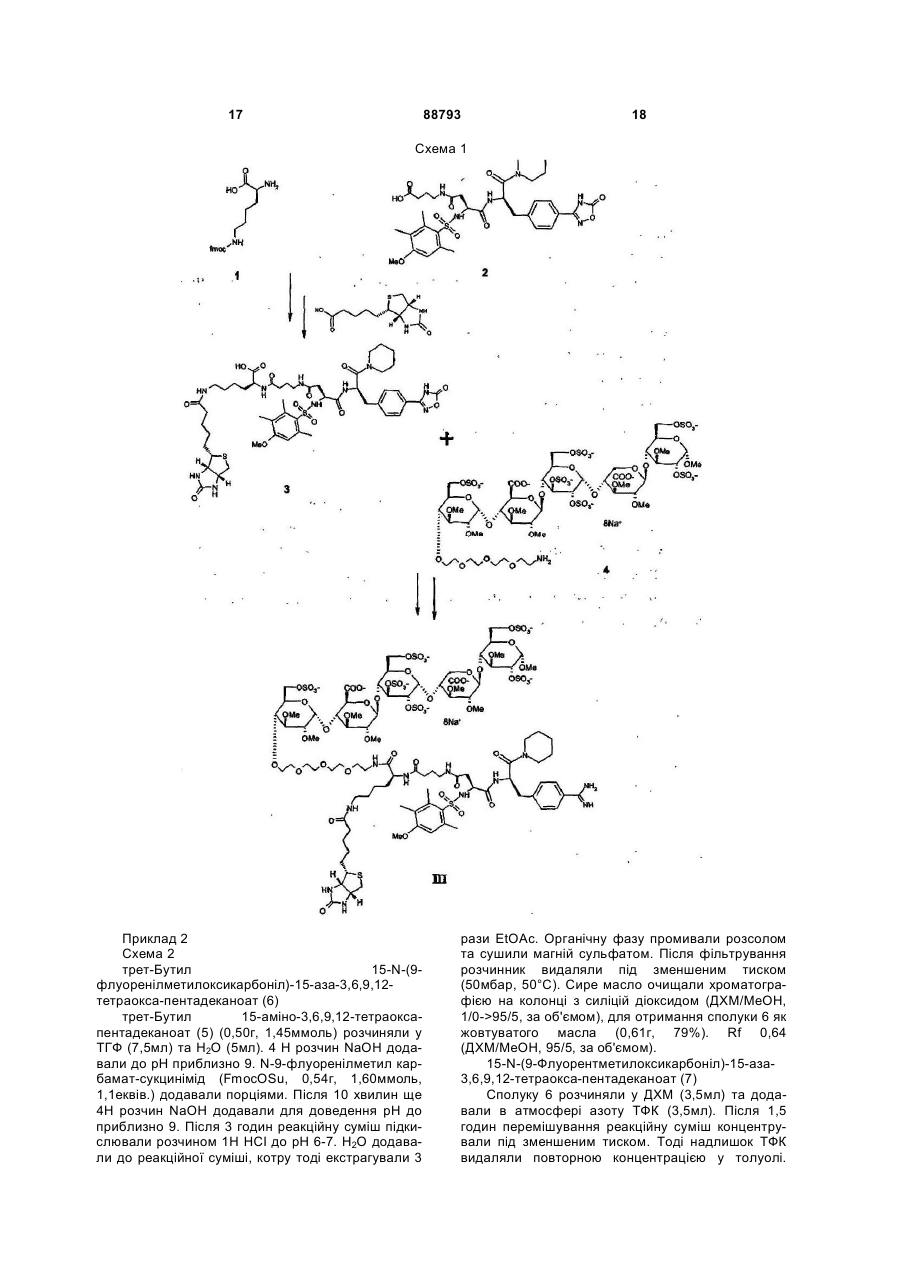
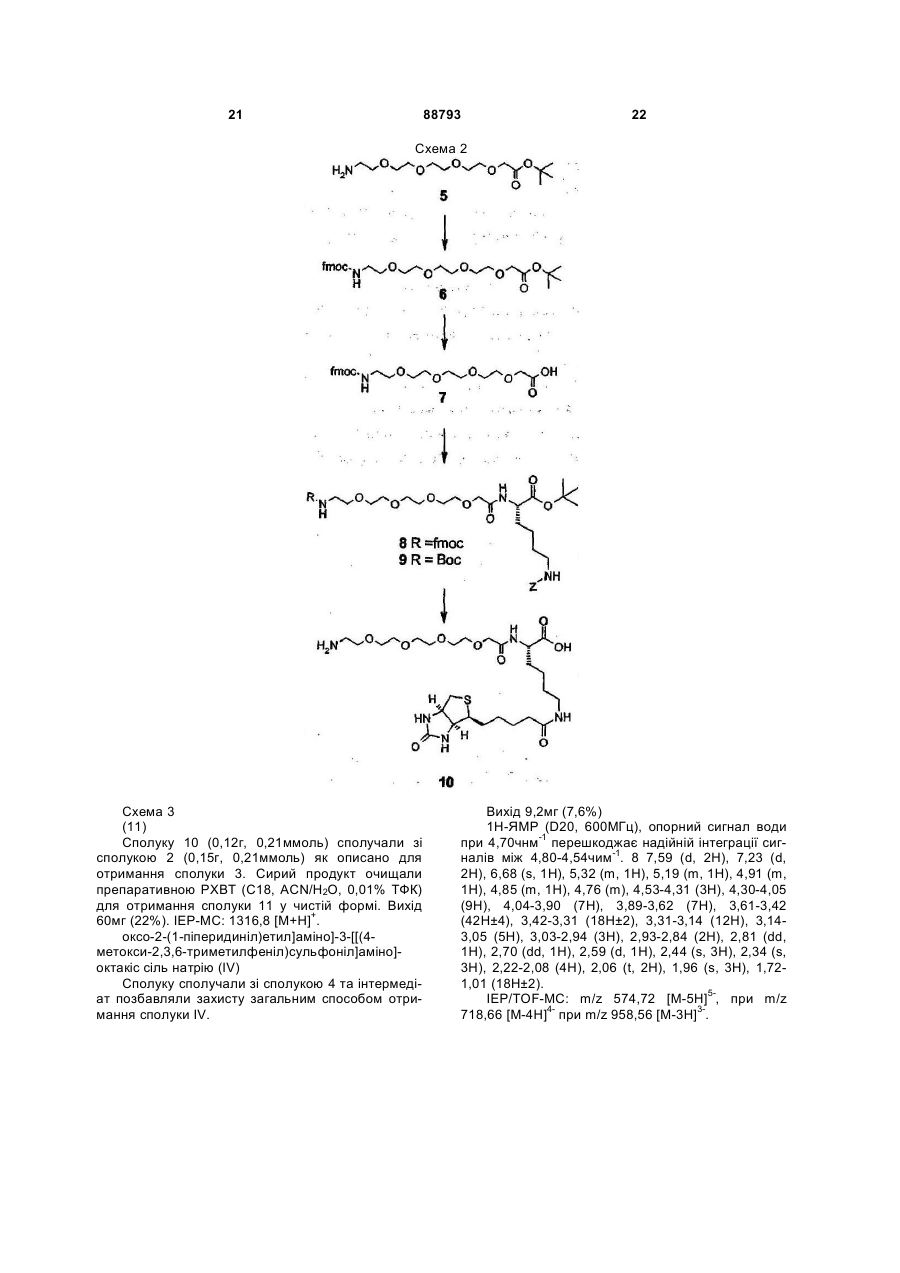
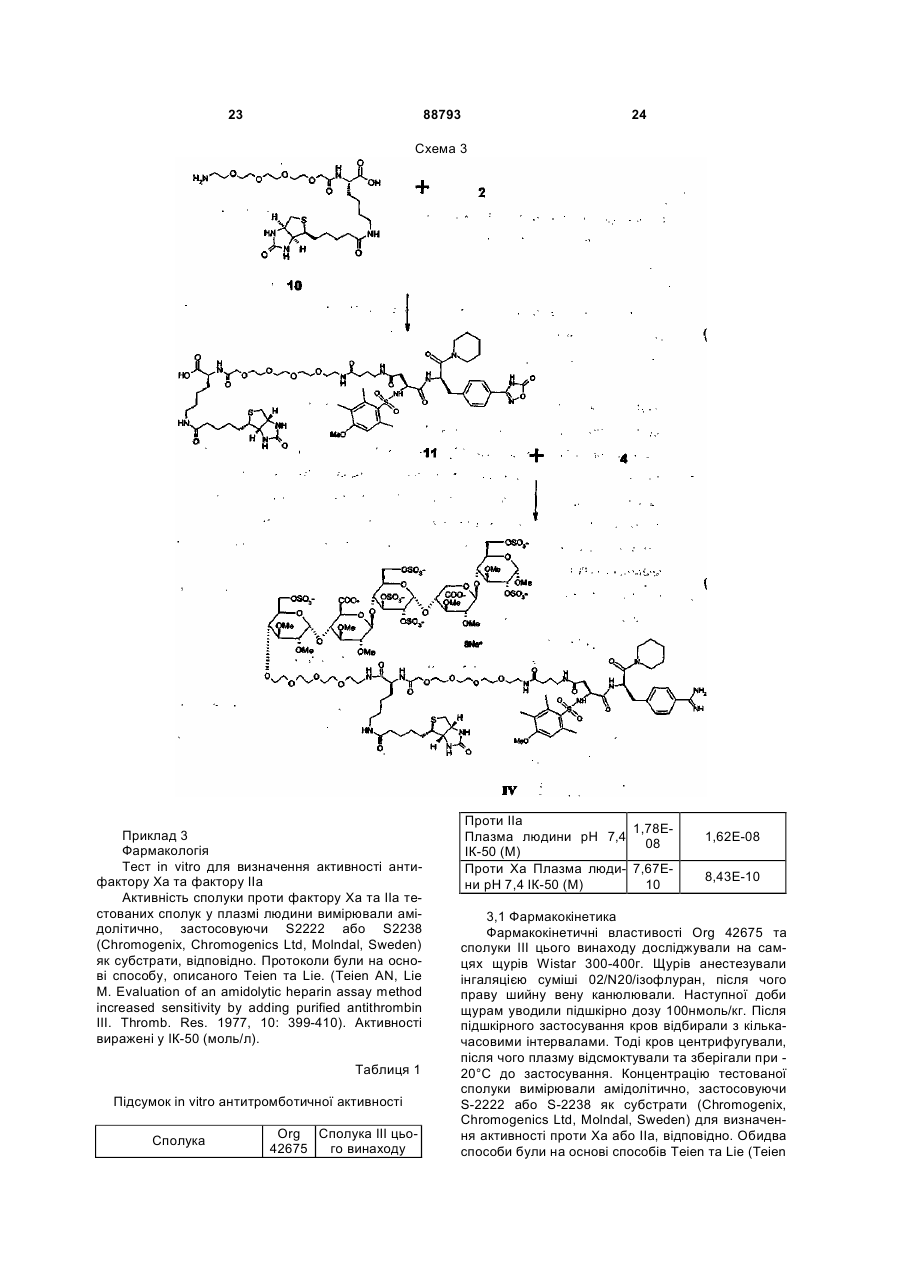
1. Антитромботична сполука формули (І) 2 (19) 1 3 88793 4 10. Сполука за будь-яким з пп. 1-9, де R1 - феніл O або нафтил, що заміщено, як варіант, одним або R5 OSO3більше замісниками, вибраними з метилу або меO O O токсилу. OMe COO OSO3OMe OSO311. Сполука за п. 10, де R1 - 4-метокси-2,3,6OSO3COOO O триметилфеніл. O O OSO3OMe OMe 12. Сполука за будь-яким з пп. 1-11, де NR3R4 OMe O піперидиніл. O 13. Сполука за будь-яким з пп. 1-12, де R2 - Н. OMe OMe 14. Сполука за будь-яким з пп. 1-13, що містить принаймні один ковалентний зв'язок із залишком , біотину або його аналога. де R5 - OCH3 або OSO3-. 15. Сполука за будь-яким з пп. 1-4 та 7-14, де олі6. Сполука за п. 5, де пентасахаридний залишок госахаридний залишок сполуки формули І має має структуру ковалентний зв'язок із залишком біотину або його OSO3аналога. O 16. Сполука за п. 15, де олігосахаридний залишок OCH3 OSO3 сполуки формули І має один ковалентний зв'язок із O O O OCH3 COO аналогом біотину формули -(NH-CO)-(CH2)5-NROSO3OSO3 OCH OSO3COOBT, де ВТ є залишком O O R5 3 O OCH3 O OCH3 OSO3 OCH3 O O H N O O NH OCH3 OCH3 S , де R - Н або (1-4С)алкіл. 17. Сполука за будь-яким з пп. 1-14, де спейсер сполуки формули І має ковалентний зв'язок із залишком біотину або його аналога. 18. Сполука за п. 17, де спейсер сполуки формули І має один ковалентний зв'язок із залишком аналога біотину формули -(CH2)4-NR-BT, де R та ВТ визначені раніше. 19. Сполука за п. 18, якою є . 7. Сполука за будь-яким з пп. 1-6, де спейсер має довжину 10-50 атомів, переважно 16-22, а найкраще 19 атомів. 8. Сполука за п. 7, де спейсер має довжину 16-22 атомів. 9. Сполука за будь-яким з пп. 1-8, де спейсер містить принаймні одну ланку: -(СН2СН2О)-. OSO3O OMe OSO3 OSO3 O OSO3 COO OMe OSO3 O O O O OMe O O COOOMe OSO3 OMe OMe O OMe OMe O O O H N O O O O H N N H O H N O NH S NH O N NH2 NH O O MeO H S HN O N H H або її фармацевтично прийнятна сіль, проліки або сольват. 20. Сполука за п. 19, яка є у формі її солі з натрієм. 21. Сполука за будь-яким з пп. 1-14, де залишок А сполуки формули І має ковалентний зв'язок із залишком біотину або його аналога. 22. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-21 та фармацевтично придатні допоміжні засоби. 23. Спосіб отримання сполуки формули І, що має етап, де бензамідинова частина у залишку А є у формі попередника, яким є група 1,2,4оксадіазолін-5-он, яку далі перетворюють у бензамідин зняттям захисту. 5 88793 6 24. Сполука за будь-яким з пп. 1-21 для застосуредження тромбозу або інших пов'язаних з тромвання у терапії. біном хвороб. 25. Застосування сполуки за будь-яким з пп. 1-21 у виробництві медикаменту для лікування або попе Заявлений винахід стосується нових антитромботичних подвійних інгібіторів, що містять залишок біотину або похідне біотину, способу їх отримання, фармацевтичних композицій, що містять сполуки як активні інгредієнти, а також застосування вказаних сполук у виробництві медикаментів. Нещодавній прогрес у дослідженнях синтетичних активних фармацевтичних речовин, що мають подібні або кращі антитромботичні властивості при порівнянні з гепарином, має результатом створення нових подвійних інгібіторів, наприклад, як описано у WO 99/65934 та WO 01/42262. Ці сполуки є звичайно кон'югатами залишку олігосахаридів, приєднаного до безпосереднього інгібітору тромбіну по суті фармакологічно неактивним спейсером. Олігосахаридний залишок у молекулі виявляє опосередковану анти-тромбіном III (АТ-ІІІ) активність проти Ха. Таким чином, нові кон'югати мають подвійну, антитромботичну та антикоагуляційну, активність. Чудовим прикладом нового класу подвійних інгібіторів є сполука, показана під кодовою назвою Org 42675, у котрій пентасахариди приєднано до безпосереднього інгібітору тромбіну, що має наступну структуру. Дослідження експериментального тромбозу продемонстрували, що ця сполука на додаток до потужних антикоагуляційних та антитромботичних властивостей також інгібує активність зв'язаного тромбом тромбіну. Крім того, Org 42675 виявлено як високо ефективну у попередженні тромботичної реоклюзії після тромболізу оклюзійних артеріальних тромбів. Сполука виявляє 10-кратно подовжений період перетворення у порівнянні з відповідним некон'югованим безпосереднім інгібітором тромбіну, похідним від NAPAP. У порівнянні із аргартробаном, гепарином та фондапаринуксом, Org 42675 показувала поліпшену ефективність. [Journal of Thrombosis та Haemostasis, Vol. 1, Issue 9, Page 1945, 2003]. Клінічний потенціал нових подвійних інгібіторів, як вважають, буде значним, а тому вже ініційоване клінічне тестування. Як попередній вимір, у межах антикоагуляційної та антитромботичної терапії є потреба в антидоті для здатності ефективно нейтралізувати або мінімізувати активність застосовуваних антикоагуляційних або антитромботичних ліків. Це є тому, що добре вщомо, що крововилив може бути ініційованим у пацієнта протягом лікування будь-якою випадковою причиною. Крім того, може бути необхідним хірургічне втручання у пацієнта при антитромботичному або антикоагуляційному лікуванні. На додаток, при деяких хірургічних процедурах антикоагулянти можна застосовувати при високій дозі для попередження коагуляції крові та у кінці операції необхідно їх нейтралізувати. Тому корисно мати придатні антитромботичні/антикоагуляційні засоби, котрі можна нейтралізувати для припинення антитромботичної/антикоагуляційної активності у будь-який час. У US 2004/0024197 розкрито, що у випадку критичної ситуації антитромботичну активність деяких полісахаридів можна зменшувати, застосовуючи авідин, якщо ці полісахариди містять принаймні ковалентний зв'язок з біотином або похідним біотину. Заявлений винахід стосується нових здатних до нейтралізації подвійних інгібіторів, похідних від подвійних інгібіторів, описаних у WO 99/65934 та WO 01/42262. Виявлено, що певна біотинова "мітка", що є групою, також розглянута у цьому документі як "ВТ" (похідне від гексагідро-2-оксо-1Нтієно[3,4-d]імідазол-4-пентанової кислоти, переважно D(+)-ізомер) або її аналог, може бути приєднаною або уведеною у структуру сполуки, описаної у WO 99/65934 та WO 01/42262, призводячи до здатності нейтралізації подвійних інгібіторів. Таким чином, заявлений винахід стосується сполуки формули (І) олігосахарид-спейсер-А (І) де олігосахарид є негативно зарядженим олігосахаридним залишком, що має 2-25 моносахаридних ланок, заряд компенсовано позитивно зарядженими протиіонами, а олігосахаридний залишок є похідним від олігосахариду, котрий має (опосередковану АТ-ІІІ) активність проти Ха сам по собі; спейсер є по суті фармакологічно неактивним гнучким з'єднувальним залишком, що має довжину ланцюга 10-70 атомів; А є залишком -CH[NH-SO2-R1][CO-NR2-CH(4бензамідин)-CO-NR3R4], де R1 - феніл, нафтил, 1,2,3,4-тетрагідронафтил, (ізо)хінолініл, тетрагідро(ізо)хінолініл, 3,4-дигідро-1Н-ізохінолініл, хроманіл або камфорна група, ці групи можуть, як варіант, бути заміщеними одним або більше замісниками, вибраними з (1-8С)алкілу або (1 7 88793 8 8С)алкоксилу; a R2 та R3, незалежно, - Η або (1ній ситуації, дію подвійного інгібітору можна швид8С)алкіл; R4 - (1-8С)алкіл або (3-8С)циклоалкіл; ко нейтралізувати застосуванням авідину або або R3 та R4 разом з атомом нітрогену, до котрого стрептавідину, наприклад ін'єкцією фармацевтичвони приєднані, є неароматичним (4-8)членним ного розчину, що їх містить. Аналоги авідину та кільцем, як варіант, що містить ще один гетерострептавідину, що мають високий афінітет до біоатом, кільце, як варіант, заміщене (1-8С)алкілом тину можна застосовувати так само. Утворений або SО2-(1-8С)алкілом; неактивний комплекс антидот-інгібітор виводиться або її фармацевтично прийнятної солі, проліз кровообігу. ків або сольвату; Аналоги біотину, котрі можна застосовувати як де сполука формули І крім того містить примітку згідно з цим винаходом, можна вибрати, але наймні один ковалентний зв'язок із залишком біобез обмеження, з аналогів біотину з каталогу тину або його аналог; Pierce, 1999-2000, pages 62 до 81, як-то 6Сполуки винаходу є подвійними інгібіторами, біотинамідогексаноат, 6-(6що мають переладнуваний змішаний профіль біотинамідогексанамідо)гексаноат, та 2обох, неопосередкованих, безпосередньої активбіотинамідоетантіол, тощо. У таких аналогах заності проти тромбіну у (фактору IIа) та опосередлишок біотину ВТ, який визначено раніше, є хараккованої активності проти тромбіну у III (АТ-ІІІ) протерною частиною молекули. Іншими аналогами є ти Ха. Змішаний профіль сполук винаходу можна наприклад аналоги біотину, що алкіловані на біопереладнувати варіюванням природи олігосахатинамідному зв'язку (де алкілом є (1-4С)алкіл, перидного залишку та ефективність безпосереднього реважно метил), та котрі є стабільними до розщеінгібітору тромбіну (аналоги NAPAP). Межа профіплення біотинідазою [Bioconjugate Chem., Vol. 11, лів є таким чином придатними. Сполуки винаходу 2000, 569-583; Bio-conjugate Сhеm., Vol. 11, 2000, мають довгий період перетворення у плазмі та, як 584-598] або інші аналоги біотину, що містять нарезультат, вони виявляють подовжену активність приклад гідроксиметилен, карбоксилат, або ацетат проти тромбіну порівняно з NAPAP або його похідальфа, стосовно біотинамідного зв'язку, як описаними, про що повідомлено у літературі раніше. На но у Bioconjugate Chem., Vol. 12, №4, 2001, 616додаток, сполуки винаходу можуть бути позбавле623. ними нейтралізувальної дії тромбоцитного фактоКращі залишки аналогів біотину мають форру 4 (PF4). Низька токсичність є також корисним мулу -(NH-CO)n-(CH2)p-NR-BT, де n=0 або 1 (зокаспектом сполук цього винаходу. рема n=0), p=4 або 5 (зокрема p=4), R - Η або (1Сполуки заявленого винаходу корисні для лі4С)алкіл та ВТ визначено раніше. У кращих втікування та попередження опосередкованих тромленнях R - Н. біном та пов'язаних з тромбіном хвороб. Це охопВиявлено у порівняльних дослідженнях із їх лює ряд тромботичн та протромботичних станів, у відповідними небіотинілованими сполуками, що котрих є активованим коагуляційний каскад, котрі уведення біотинової мітки у подвійні інгібітори цьоохоплюють, але без обмеження, глибокий тромбоз го винаходу по суті не інтерферує ані з їх безпосевен, емболію легень, тромбофлебіт, артеріальну редньою інгібіторною ефективністю проти тромбіоклюзію від тромбозу або емболії, артеріальну ну, ані з їх опосередкованою тромбіном III (АТ-ІІІ) реоклюзію протягом або після ангіопластики або активністю проти Ха. На додаток, антитромботичтромболізу, рестеноз після артеріального порана активність сполук формули І є (по суті) повністю нення або інвазивних кардіологічних процедур, нейтралізованою при застосуванні авідину або після операції венозного тромбозу або емболії, стрептавідину. гострий або хронічний атеросклероз, інсульт, інБудь-який негативно заряджений олігосахарифаркт міокарда, рак та метастаз, та нейродегенедний залишок з 2-25 моносахаридних ланок є приративні хвороби. Сполуки винаходу можна також датним для застосування у сполуках заявленого застосовувати як антикоагулянти у штучному кровинаходу. Придатні сполуки винаходу є сполукавообігу, коли необхідно, у діалізі та хірургії. Сполуми, де олігосахаридом є сульфатований олігосаки винаходу можна також застосовувати як антихаридний залишок. Переважно, олігосахаридний коагулянти in vitro. залишок є похідним від олігосахариду, котрий має Біотинова мітка (або її аналог) у сполуці заявактивність (опосередковану АТ-ІІІ) проти Ха сам по леного винаходу є швидко визначуваною певним собі, як-то олігосахарид розкритий у ЕР 0,454,220, антидотом, яким є звідин [The Merck Index, Twelfth ЕР 0,529,715, WO 97/47659, WO 98/03554, WO edition, 1996, M.N. 920, pages 151-152] або стреп99/36443 та WO 99/36428. Ще кращими є олігосатавідин, та приєднується до нього, двома тетрахаридні залишки, що мають 2-17, зокрема 2-6, момерними білками із відповідними масами приблизносахаридних ланок. Найкращим олігосахаридом є но 66000 та 60000Да, котрі мають дуже високий сульфатований пентасахаридний залишок. Кращі афінітет стосовно біотину. Таким чином, у критичпентасаха-ридні залишки мають формулу (II) 9 де R5, незалежно, - залишок біотину або його аналогу, OSO3" або (1-8С)алкоксил. У кращих пентасахаридних залишках загальне число сульфатних груп є 4, 5, 6 або 7. Кращими сполуками згідно з винаходом є сполуки, де пентасахаридний залишок має структуру: де R5 - OCH3 або OSO3". Особливо кращим пентасахаридним залишком є Ще кращі сполуки винаходу є сполуками формули І, де R1 - феніл або нафтил, що, як варіант, заміщено одним або більше замісниками, вибраними з метилу або метоксилу. Ще краще, коли R1 88793 10 4-метокси-2,3,6-триметилфеніл. У кращих сполуках NR3R4 - піперидиніл. Переважно, R2 - Н. Спейсером є по суті фармакологічно неактивний гнучкий з'єднувальний залишок, що переважно має 10-50 атомів вздовж "стрижня" спейсера, оксиген олігосахаридного залишку не враховано. Ще кращою є довжина 13-25 атомів, переважно 16-22, а найкраще 19 атомів. Хімічна природа спейсера має другорядне значення для анти-тромботичної активності сполук винаходу. Спейсер може містити (деякою мірою) жорсткі ланки, як-то кільцеві структури та ненасичені зв'язки. Високо гнучкі спейсери є більше придатними, ніж інші. Придатні спейсери можуть бути легко визначені спеціалістом. Для синтезу довші спейсери розглядають як менш придатні, однак, довші спейсери можуть бути успішно застосовуваними у сполуках заявленого винаходу. Кращі спейсери містять принаймні одну ланку (СН2СН2О)-. Кращі сполуки згідно з винаходом містять один ковалентний зв'язок із залишком біотину або його аналогу. Біотинова (або його аналогу) мітка може бути присутня в усіх частинах сполуки формули І. Тому, втілення цього винаходу є сполуками, де (а) олігосахаридний залишок сполуки формули І містить ковалентний зв'язок із залишком біотину або його аналогу, (b) спейсер сполуки формули І містить ковалентний зв'язок із залишком біотину або його аналогу та (с) залишок А сполуки формули І містить ковалентний зв'язок із залишком біотину або його аналогу (що означає, що атом гідрогену або замісник визначенні А заміщено залишком біотину). Репрезентативними прикладами біотинілованих подвійних інгібіторів заявленого винаходу є 11 та їх солі, але також сполуки формули І, де спейсер приєднано до олігосахариду у ще одній позиції, та/або сполуки, де залишок біотину (аналогу) є в інших позиціях молекули. Кращою є сіль натрію. Сполука формули III є кращим прикладом цього винаходу. В описі сполук формули (І) застосовують наступні визначення. Терміни (1-4С)алкіл та (18С)алкіл означають розгалужений або нерозгалужений алкіл, що має 1-4 та 1-8 атомів карбону, відповідно, наприклад метил, етил, пропіл, ізопропіл, бутил, втор-бутил, трет-бутил, гексил та октил. Метил та етил є кращими алкілами. Термін (18С)алкоксил означає алкоксигрупу, що має 1-8 атомів карбону, алкільну частину визначено раніше. Метоксил є кращою алкоксигрупою. Термін (3-8С)циклоалкіл означає циклоалкіл, що має 3-8 атомів карбону, а саме циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил або циклооктил. Циклопентил та циклогексил є кращими циклоапкілами. Довжина спейсера є числом атомів спейсера, підрахованим вздовж найкоротшого ланцюга між олігосахаридним залишком та пептидною частиною молекули, не враховуючи атом оксигену олігосахаридного залишку, котрий приєднано до спейсера. Термін "проліки" означає сполуку винаходу, у котрій наприклад, аміногрупа амідиночастини є захищеною, наприклад, гідроксилом або (1-6С)алкоксикарбонілом. Сольвати згідно з винаходом охоплюють гідрати. Стосовно синтетичного шляху, котрим залишок біотину приєднано до сполуки формули І, хімічна література пропонує кілька можливостей, котрі можна застосовувати, та котрими можна застосовувати відмінні серії захисних груп, добре відомих спеціалісту. Залишок біотину, що містить реакційну групу, наприклад, типу активованого естеру, малеїнімід, йодацетилу або первинного аміну, переважно реагуватиме із функціональною групою аміну, функціональною групою тіолу, функціональною групою карбонової кислоти, або альдегідною функціональною групою, реакція перебігатиме згідно з умовами, описаними у літературі [Savage et al., Avidin-Biotin Chemistry: A Handbook; Pierce Chemical Company, 1992]. Залишок біотину може наприклад, бути зв'язаним з олігосахаридним залишком (негативно зарядженим) безпосередньо або через N-(1 88793 12 4С)алкіловану, як варіант, аміно-функціональну групу залишку олігосахарид-спейсер, чи через N(1-4С)алкілований, як варіант, амінокислотниий залишок з N-(1-4С)алкілованою, як варіант, амінофункціональною групою олігосахаридного залишку сполуки формули І. Згідно з ще одним аспектом цього винаходу залишок біотину може, наприклад, бути зв'язаним із залишком А безпосередньо або через N-(14С)алкіловану, як варіант, аміно-функціональну групу з'єднувального залишку, чи через N-(14С)алкілований, як варіант, амінокислотниий залишок з N-(1-4С)алкілованою, як варіант, амінофункціональною групою залишку А сполуки формули І. Згідно з ще одним аспектом цього винаходу залишок біотину може, наприклад, бути уведеним поетапно спершу зв'язуванням із залишком А безпосередньо або через N-(1-4С)алкіловану, як варіант, аміно-функціональну групу частини спейсера формули І, чи через N-(1-4С)алкілований, як варіант, амінокислотниий залишок з N-(14С)алкілованою, як варіант, амінофункціональною групою залишку А сполуки формули І, а по-друге зв'язуванням безпосередньо з олігосахаридом або через N-(1-4С)алкіловану, як варіант, аміно-функціональну групу частини спейсера формули І, чи через N-(1-4С)алкілований, як варіант, амінокислотний залишок з N-(14С)алкілованою, як варіант, амінофункціональною групою (негативно зарядженого) олігосахариду сполуки формули І, або навпаки. Згідно з ще одним аспектом винаходу Nалкіловані, як варіант, амінокислотні залишки або a-Ν-заміщені (бета-)амінокислотні аналоги, як-то описані у [Bioconjugate Chem., Vol. 12, №4, 2001, 616-623] можна уводити способами пептидного сполучення, відомими у рівні техніки. Азидогрупа є придатною латентною аміно-функціональною групою, котру можна застосовувати у попередниках сполуки формули І для наступного уведення залишку біотину. Кращий спосіб отримання сполуки формули І має етап, де бензамідинова частина у залишку А є у формі попереднику, переважно групи 1,2,4- оксадіазолін-5-он, що далі перетворюють у бензамідин зняттям захисту, зокрема гідрогенуванням [Bolton, R.E. et al, Tetrahedron Letters, Vol 36, No 25, 1995, pp. 4471-4474]. Сполуки заявленого винаходу крім того отримують дериватизацією NAPAP (або NAPAP 13 88793 14 аналогу) у позиції гліціну цистеїном, лізином чи Сполуки винаходу можна застосовувати ентеаспартатом способами, загалом відомими у рівні рально або парентерально. Точна доза та режим техніки, ці сполук далі (а) сполучають із залишком цих сполук та їх композицій неодмінно залежатиме олігосахарид-спейсер або (b) сполучають з спейвід потреби індивідуала до якого застосовано месером, котрий тоді дериватизують тіоловою функдикамент, ступеню хвороби або потреби, та ріціональною групою або карбоксильною функціошення лікаря. Загалом, парентеральне застосунальною групою, а далі сполучають з вання потребує нижчого дозування, ніж інші олігосахаридним залишком. Будь-який придатний способи застосування, котрі є більше залежними олігосахарид можна застосовувати для цього, навід абсорбції. Однак, добове дозування для людей приклад олігосахарид, відомий у літературі (нає переважно 0,001-100мг/кг маси тіла, більш переприклад, з ЕР 0,454,220 та ЕР 0,529,715, але без важно 0,01-10мг/кг маси тіла. Медикамент, виробобмеження цими джерелами), або комерційно долений із сполуки цього винаходу, можна також ступний олігосахарид. Сполучення спейсера з олізастосовувати як ад'ювант у гострій антикоагулягосахаридом можна наприклад, проводити спосоційній терапії. У такому випадку медикамент забами, описаними у ЕР 0,649,854. стосовують з іншими сполуками, корисними у лікуПептидне сполучення, етап у вищенаведеному ванні таких станів хвороб. способі отримання сполуки винаходу, можна проЗмішані із фармацевтично придатними доповодити способами, загалом відомими у рівні техніміжними засобами, наприклад, як описано у станки для сполучення або конденсації пептидних дартному довіднику, Gennaro et al., Remington's фрагментів, як-то азидним способом, змішаноPharmaceutical Sciences, (18th ed., Mack Publishing ангідридним способом, активовано-естерним споCompany, 1990, дивись зокрема Part 8: собом, карбодіімідним способом, або, переважно, Pharmaceutical Preparations and Their Manufacture) під дією солі амонію/уронію типу TBTU, особливо сполуки можна пресувати у тверді одиниці дозуіз додаванням каталітичних та пригнічуючих рацевання, як-то пілюлі, таблетки, або уводити у капмізацію сполук типу N-гідроксисукциніміду, Nсули або супозиторії. Як фармацевтично придатні гідроксибензотриазолу та 7-аза-Nрідини сполуки можна також застосовувати у форгідроксибензотриазолу. [The Peptides. Analysis, мі розчину, суспензії, емульсії, як препарату для Synthesis. Biology, Vol 3, E. Gross and J. ін'єкцій, або як аерозолю, наприклад, як назальноMeienhofer, eds. (Academic Press, New York, 1981) го аерозолю. and Peptides: Chemistry and Biology. N. Sewald and Для вироблення одиниць дозування, наприH.-D. Jakubke (Wiley-VCH, Weinheim, 2002)]. клад, таблеток, є доречним застосування звичайАміно-функціональні групи у сполуках можна них добавок, як-то наповнювачі, барвники, полімезахищати у процесі синтезу N-захисною групою, рні зв'язуючі тощо. Загалом можна застосовувати котра означає групу, звичайно застосовувану у будь-які фармацевтично прийнятні добавки, котрі не впливають на функцію активних сполук. Придапептидній хімії для захисту a-аміногрупи типу треттні носії, з котрими можна застосовувати композибутилоксикарбонілу (Вос), бензилоксикарбонілу ції, охоплюють лактозу, крохмаль, похідні целюло(Z), 9-флуореніліпетилоксикарбонілу (Fmoc) або зи тощо, або їх суміші, застосовувані у придатній фталоїлу (Phth), або можна уводити демаскуванкількості. ням азидної частини. [The Peptides, Аналіз, Система визначень на фігурах Synthesis, Biology, Vol 3 та Peptides: Chemistry та Фіг.1 Середні рівні у плазмі визначено виміром Biology]. активності стосовно Ха або IIa після підшкірного Сполуки винаходу, котрі можуть існувати у застосування 100нмоль/кг біотинілованої сполуки формі незв'язаної основи, можна виділяти з реакIII цього винаходу ("біотин"). Більш того, рівні у ційної суміші у формі фармацевтично прийнятної плазмі надані для Org 42675 ("вихідна") після висолі. Фармацевтично прийнятні солі можна також значення активності стосовно Ха. отримувати обробкою незв'язаної основи формули Фіг.2 Показує середні рівні у плазмі±СВ після (І) органічною або неорганічною кислотою, як-то підшкірного застосування 100нмоль/кг сполук. При хлоридна кислота, бромідна кислота, йодидна киt=2 години авідин (10мг/кг) було застосовано внутслота, сульфатна кислота, фосфатна кислота, рішньовенно до цих щурів, підданих дії сполуки III оцтова кислота, пропіонова кислота, гліколева цього винаходу ("біотин") або Org 42675 ("вихідкислота, малеїнова кислота, малонова кислота, на"). Фармакокінетичні властивості сполуки III цьометансульфонова кислота, фумарова кислота, го винаходу є ефективними при застосуванні авібурштинова кислота, винна кислота, лимонна кисдину на відміну від властивостей вихідної сполуки. лота, бензойна кислота, аскорбінова кислота тоВинахід далі ілюстровано наступними приклащо. дами. Сполуки цього винаходу або їх інтермедіати Приклади мають хіральні атоми карбону, та їх можна тому Скорочення отримувати як чистий енантіомер, або як суміш АТІІІ = антитромбін енантіомерів, або як суміш, що містить діастереоВос = трет-бутилоксикарбоніл мери. Способи отримання чистих енантіомерів ДХМ = дихлорметан добре відомі у рівні техніки, наприклад, кристаліDіРЕА = N,N-діізопропілетиламін зацією солей, котрі отримані з оптично активних ДМФ = Ν,Ν-диметилформамід кислот та рацемічної суміші, або хроматографією, Et = етил застосовуючи хіральні колонки. Для діастереомеfmoc = 9-флуоренілметоксикарбоніл рів можна застосовувати лінійно-фазові або звоNMM = N-метилмофолін ротно-фазові колонки. 15 88793 16 рацією у сухому ДМФ (2x2мл), розчиняли у ДМФ Me = метил (1мл) та перемішували у присутності TBTU (11мг, PRP = збагачена тромбоцитами плазма 33мкмоль) та DiPEA (5,7мкл, 33мкмоль), в атмосРРР = бідна тромбоцитами плазма фері азоту. Через 1 годину додавали пентасахаTBTU = 2-(1Н-бензотриазол-1-іл)-1,1,3,3рид 4 (31мкмоль). Реакційну суміш перемішували тетраметилуроній тетрафлуорборат протягом 16 годин при кімнатній температурі та ΤΦΚ = трифлуороцтова кислота аналізували іонообмінною (Моно-Q) хроматограТГФ = тетрагідрофуран фією. Реакційну суміш концентрували (4)-3-O-метил-2,6-діMC:m/z1089[M+H]+. O-сульфо-альфа-D-глюкопіранозид октакіс, сіль Захищений fmoc інтермедіат (0,15г, натрію (III) 0,14ммоль) розчиняли у ТГФ (5мл) та додавали Сполуку III отримували та очищали кон'югаціEt2NH (2мл). Суміш перемішували протягом 45 єю сполуки 3 (86мг, 81мкмоль) із сполукою 4 хвилин при 45°С. Розчин концентрували під змен(0,14г, 80мкмоль), котру отримували як описано у шеним тиском та концентрували у толуолі. ІЕРWO 01/42262, загальним способом. Вихід 0,14г МС: m/z 857 [М+Н]І+. Nе-позбавлене захисту похід(60%). IEP/TOF-MC: 880,91 [М-3H]3-, 888,57 [Мне лізину (0,14ммоль) розчиняли у ДМФ (3мл) та 3H+Na]3-, 660,43 [М-4Н]4-. додавали до розчину D-(+)-біотину (34мг, 1еквів.), 1Н-ЯМР (D2O, 600МГц); опорний сигнал води TBTU (45мг, 1еквів.) та DiPEA (61мкл, 2,5еквів.) у при 4,71чнм-1 перешкоджає надійній інтеграції сигДМФ (4мл), що перемішували в атмосфері азоту налів між 4,80-4,50чнм-1. 8 7,66 (m, 2Н), 7,30 (m, протягом 1 години. Утворену суміш перемішували 2Н), 6,74 (m, 1Н), 5,36 (m, ІК), 5,25 (m, 1Н), 5,05 (m, протягом 16 годин. Розчинник видаляли під змен1Н), 4,98 (m, 1Н), 4,84 (m, 1Н), 4,46 (m, 2Н), 4,31 шеним тиском. EtOAc (30мл) додавали та перемі(m, 1Н), 4,27-4,13 (5Н), 4,13-3,99 (5Н), 3,92 (m, 1Н), шували. Твердий продукт 3 збирали фільтруван3,88-3,70 (8Н), 3,70-3,07 (49Н1±5), 3,07-2,92 (4Н), ням та промивали МеОН та EtOAc і сушили у 2,85 (m, 1Н), 2,76 (m, 1Н), 2,65 (m, 1Н), 2,51 (s, 3H), вакуумі. Вихід 86мг (57%). Rf 0,15 (ДХМ/МеОН, 9/1, 2,40 (s, 3H), 2,36-2,22 (m, 2Н), 2,21-2,11 (m, за об'ємом). ІЕР-МС: 1083,6 [М+Н]+. 2Н),2,08 (m, 1Н), 2,06-1,91 (4Н), 1,83-1,03 (20Н±2). Загальний спосіб отримання сполук EDE та IV: Карбоново-кислотне похідне (33мкмоль) (тобто сполуку 3 або 11) сушили повторною концент 17 88793 18 Схема 1 Приклад 2 Схема 2 трет-Бутил 15-N-(9флуоренілметилоксикарбоніл)-15-аза-3,6,9,12тетраокса-пентадеканоат (6) трет-Бутил 15-аміно-3,6,9,12-тетраоксапентадеканоат (5) (0,50г, 1,45ммоль) розчиняли у ТГФ (7,5мл) та Н2О (5мл). 4 Η розчин NaOH додавали до рН приблизно 9. N-9-флуоренілметил карбамат-сукцинімід (FmocOSu, 0,54г, 1,60ммоль, 1,1еквів.) додавали порціями. Після 10 хвилин ще 4Η розчин NaOH додавали для доведення рН до приблизно 9. Після 3 годин реакційну суміш підкислювали розчином 1Η НСІ до рН 6-7. Н2О додавали до реакційної суміші, котру тоді екстрагували 3 рази EtOAc. Органічну фазу промивали розсолом та сушили магній сульфатом. Після фільтрування розчинник видаляли під зменшеним тиском (50мбар, 50°С). Сире масло очищали хроматографією на колонці з силіцій діоксидом (ДХМ/МеОН, 1/0->95/5, за об'ємом), для отримання сполуки 6 як жовтуватого масла (0,61г, 79%). Rf 0,64 (ДХМ/МеОН, 95/5, за об'ємом). 15-N-(9-Флуорентметилоксикарбоніл)-15-аза3,6,9,12-тетраокса-пентадеканоат (7) Сполуку 6 розчиняли у ДХМ (3,5мл) та додавали в атмосфері азоту ТФК (3,5мл). Після 1,5 годин перемішування реакційну суміш концентрували під зменшеним тиском. Тоді надлишок ТФК видаляли повторною концентрацією у толуолі. 19 88793 20 ДХМ/Et2O (100мл, 1/2, за об'ємом) додавали та атмосфері азоту. Після перемішування протягом 5 промивали 1Η НСІ. Водний шар екстрагували годин суміш додавали до холодного (5°С) 0,1Η ДХМ/Еt2О (100мл, 1/2, за об'ємом). Комбіновані розчину НСІ та екстрагували EtOAc. Органічний органічні шари промивали розсолом та сушили шар промивали розсолом та сушили безводним магній сульфатом Після фільтрування розчинник магній сульфатом. Після фільтрування розчинники видаляли при атмосферному тиску (50°С). Сире видаляли під зменшеним тиском (180мбар, 50°С). масло очищали хроматографією на колонці з силіОчистка хроматографією на колонці з силікагелем (ДХМ/МеОН, 1/0->95/5, за об'ємом), для отриманцій діоксидом (ДХМ/МеОН/АсОН, 99/0/1®89/10/1, ня 9 як безбарвного масла (0,17г, 82%). Rf 0,5 за об'ємом), для отримання сполуки 7. Залишкову (ДХМ/МеОН, 9/1, за об'ємом). ІЕР-МС: АсОН видаляли розчиненням сирого масляного 670,6[М+Н]+, 692,4[M+Na]+, 570,4 [М-Вос+Н]+, 514,1 продукту у ДХМ/Et2O (1/2, за об'ємом) та промив[M-Boc-tBu+H]+. кою із Н2О (3 рази) та розсолом, а потім сушкою 15-аза-3,6,9,12-тетраокса-пентадеканоїл-e-[DMgSO4. Після фільтрування розчинник видаляли при атмосферному тиску (50°С) для отримання (+)-біотиніл]-Х-лізин (10) сполуки 7 як жовтуватого масла (0,37г, 67%). Rf Сполуку 9 (0,23г, 0,34ммоль) розчиняли у 0,32 (ДХМ/МеОН, 89/10/1, за об'ємом). EtOH (8мл) та Н2О (1,2мл). Після продування розтрет-Бутил 15-N-(9чину азотом протягом 5 хвилин, додавали Pd/C Флуоренілметилоксикарбоніл)-15-аза-3,6,9,1210% (0,11г). Водень пропускали через розчин протетраокса-пентадеканоїл-8-N-(Z)-L.-лізин (8) тягом 4 годин. Азот продували через розчин проСполуку 7 (0,37мг, 0,77ммоль) розчиняли у тягом 10 хвилин для видалення усього водню. СуДХМ (18мл). DIPEA (0,40мкл, 2,31ммоль, 3еквів.) міш фільтрували через декаліт та концентрували та TBTU (0,25г, 0,77ммоль) були далі додані в атпід зменшеним тиском (170мбар, 50°С) для отримосфері азоту та розчин перемішували протягом мання N-L-лізин-позбавленого захисту інтермедіату як безбарвного масла (0,15г, 81%). Rf 0,02 10 хвилин. Тоді e-(Z)-L-Lys-OtBu·HCI (0,29г, (ДХМ/EtOAc, 9/1, за об'ємом). 0,77ммоль) додавали та суміш перемішували ще D-(+)-Біотин (75мг, 0,31ммоль) суспендували у 1,5 годин. Реакційну суміш розбавляли ДХМ та ДХМ (7мл). DIPEA (0,11мл, 0,62ммоль, 2еквів.) та промивали Н2О, 0,1Η НСІ, насич. NaНСО3 та розTBTU (0,10г, 0,31ммоль) були далі додані в атмосолом. Органічну фазу сушили безводним магній сфері азоту та розчин перемішували протягом 1 сульфатом та концентрували при атмосферному години. Розчин вищеописаного -L-лізинтиску. Очистка хроматографією на колонці з силіпозбавленого захисту інтермедіату у ДХМ (3мл) кагелем (ДХМ/МеОН, 1/0®9/1, за об'ємом), для додавали до реакційної суміші. Суміш перемішуотримання сполуки 8 як жовтуватого масла (0,51г, вали протягом 16 годин. Н2О додавали та екстра83%). Rf 0,85 (ДХМ/МеОН, 9/1, за об'ємом). ІЕРгували ДХМ (3х). Органічний шар сушили безводМС: 792,6[М+Н]+, 814,6[М+Na]+, 736,4 [M-tBu+H]+. ним магній сульфатом, фільтрували та трет-Бутил 15-N-трет-бутилоксикарбоніл-15концентрували під зменшеним тиском (850мбар, аза-3,6,9,12-тетраокса-пентадеканоїл-e-N-(Z)-L50°С). Очистка хроматографією на колонці з силілізин (9) кагелем (елюенти: ДХМ/МеОН, 1/0->9/1 за об'Сполуку 8 (0,26г, 0,32ммоль) розчиняли у ТГФ ємом), для отримання масла (0,13г, 60%). Rf 0,48 (5мл). Et2N (1мл) додавали та розчин перемішува(ДХМ/МеОН, 9/1, за об'ємом). ІЕР-МС: 762,6[М+Н], ли протягом 24 годин. Надлишок Et2N та розчин784,6[M+Na], 662,4 [М-Вос+Н], 606,4 [M-Bocник видаляли під зменшеним тиском (50°С). ТолуtBu+H]. ол додавали та видаляли під зменшеним тиском Масло розчиняли у сухому 4Η розчині НСІ у (50°С, 65мбар) для отримання N-позбавленого діоксані (4мл) та перемішували. Через 1 годину захисту інтермедіату (0,21г, 0,32ммоль), Rf 0,23 виявили нерозчинене масло, після чого розчинник (ДХМ/МеОН, 9/1, за об'ємом) ІЕР-МС: 570,4 видаляли під зменшеним тиском (100мбар, 50°С) [М+Н]+, 514,4 [M-tBu+H]+. для отримання сполуки 10 з кількісним виходом. Сирий продукт розчиняли у ДХМ (3мл). Et3N ІЕР-МС: 606,4 [M+H]+, 628,4 [M+Na]+. (0,11мл) додавали, а потім ді-третбутилдикарбонат (73мг, 0,34ммоль, 1,1еквів.) в 21 88793 22 Схема 2 Схема 3 (11) Сполуку 10 (0,12г, 0,21ммоль) сполучали зі сполукою 2 (0,15г, 0,21ммоль) як описано для отримання сполуки 3. Сирий продукт очищали препаративною РХВТ (С18, ACN/H2O, 0,01% ТФК) для отримання сполуки 11 у чистій формі. Вихід 60мг (22%). ІЕР-МС: 1316,8 [M+H]+. оксо-2-(1-піперидиніл)етил]аміно]-3-[[(4метокси-2,3,6-триметилфеніл)сульфоніл]аміно]октакіс сіль натрію (IV) Сполуку сполучали зі сполукою 4 та інтермедіат позбавляли захисту загальним способом отримання сполуки IV. Вихід 9,2мг (7,6%) 1Н-ЯМР (D20, 600МГц), опорний сигнал води при 4,70чнм-1 перешкоджає надійній інтеграції сигналів між 4,80-4,54чим-1. 8 7,59 (d, 2H), 7,23 (d, 2H), 6,68 (s, 1H), 5,32 (m, 1H), 5,19 (m, 1Н), 4,91 (m, 1Н), 4,85 (m, 1Н), 4,76 (m), 4,53-4,31 (3H), 4,30-4,05 (9Н), 4,04-3,90 (7Н), 3,89-3,62 (7Н), 3,61-3,42 (42Н±4), 3,42-3,31 (18Н±2), 3,31-3,14 (12Н), 3,143,05 (5Н), 3,03-2,94 (3H), 2,93-2,84 (2Н), 2,81 (dd, 1H), 2,70 (dd, 1H), 2,59 (d, 1H), 2,44 (s, 3H), 2,34 (s, 3H), 2,22-2,08 (4Н), 2,06 (t, 2Η), 1,96 (s, 3H), 1,721,01 (18Н±2). IEP/TOF-MC: m/z 574,72 [М-5Н]5-, при m/z 718,66 [М-4Н]4- при m/z 958,56 [М-3H]3-. 23 88793 24 Схема 3 Приклад 3 Фармакологія Тест in vitro для визначення активності антифактору Ха та фактору IIa Активність сполуки проти фактору Ха та IIa тестованих сполук у плазмі людини вимірювали амідолітично, застосовуючи S2222 або S2238 (Chromogenix, Chromogenics Ltd, Molndal, Sweden) як субстрати, відповідно. Протоколи були на основі способу, описаного Теіеn та Lie. (Teien AN, Lie M. Evaluation of an amidolytic heparin assay method increased sensitivity by adding purified antithrombin III. Thromb. Res. 1977, 10: 399-410). Активності виражені у ІК-50 (моль/л). Таблиця 1 Підсумок in vitro антитромботичної активності Сполука Org Сполука III цьо42675 го винаходу Проти IIa 1,78ЕПлазма людини рН 7,4 08 ІК-50 (М) Проти Ха Плазма люди- 7,67Ени рН 7,4 ІК-50 (М) 10 1,62Е-08 8,43Е-10 3,1 Фармакокінетика Фармакокінетичні властивості Org 42675 та сполуки III цього винаходу досліджували на самцях щурів Wistar 300-400г. Щурів анестезували інгаляцією суміші 02/N20/ізофлуран, після чого праву шийну вену канюлювали. Наступної доби щурам уводили підшкірно дозу 100нмоль/кг. Після підшкірного застосування кров відбирали з кількачасовими інтервалами. Тоді кров центрифугували, після чого плазму відсмоктували та зберігали при 20°С до застосування. Концентрацію тестованої сполуки вимірювали амідолітично, застосовуючи S-2222 або S-2238 як субстрати (Chromogenix, Chromogenics Ltd, Molndal, Sweden) для визначення активності проти Ха або IIа, відповідно. Обидва способи були на основі способів Teien та Lie (Teien 25 88793 26 AN, Lie M. Evaluation of an amidolytic heparin assay вихідного розчину тестованої сполуки. Концентраmethod increased sensitivity by adding purified ції у зразки виражали у нмоль/мл, а кінетичні паantithrombin III. Thromb. Res. 1977, 10: 399-410). раметри розраховували за непорівнюваною моКонцентрації в отриманих зразках плазми визнаделлю WinNonlin. (дивись Фіг.1) чали за калібраційною кривою, котру отримували з Таблиця 2 Фармакокінетичні параметри після підшкірного застосування сполуки III цього винаходу або Org 42675 (100нмоль/кг) у щурів. Експеримент проводили з n=3/уведення Тмакс (годин) Смакс (нмоль/мл) ТІ/2 еlі (годин) АUСіnf(годин.нмоль/мл) Vz (мл/кг) СІ (мл/годин/кг) МРТ (годин) Сполука III цього винаходу Сполука III цього винаходу Середнє±СВ проти Ха Середнє±СВ проти IIа 1,2±0,4 1,5±0,5 1,1±0,1 1,1±0,3 3,9±0,3 2,7±0,5 7,2±0,2 5,0±0,6 78±4,6 78±4,2 13,9±0,4 20,6±2,4 5,9±0,5 4,3±0,3 Виявлено, що у межах мінливості експерименту сполука III цього винаходу та Org 42675 виявляють однакові фармакокінетичні властивості у щурів. 3,2 Фармакокінетика - Нейтралізаційний експеримент; Щурів обробляли із сполукою III цього винаходу або Org 42675 у дозі 100нмоль/кг підшкірно При Org 42675 Середнє±СВ проти Xа 2,3±0,2 1,0±0,02 2,7±0,2 5,3±0,3 74±4,5 19,1±1,1 4,6±0,2 t=2 години, зразки крові брали та 10мг/кг авідину (від білку яйця, Sigma) уводили внутрішньовенно щурам з уведеною сполукою III цього винаходу або Org 42675. Кров відбирали при 0,17, 0,5, 1, 2, 3, та 7 годин далі. Кров обробляли як описано у фармако-кінетичному експерименті та концентрації зразків визначали виміром (залишкової) активності проти Ха або проти IIa, (дивись Фіг.2) Таблиця 3 Площу під кривими (AUC) розраховували після підшкірного застосування 100нмоль/кг сполуки III цього винаходу або Org 42675 та авідину (10мг/кг) при t=2 години. Дані розраховували від Т=2 години. Експеримент проводили з n=3/уведення Сполука III цього винаходу Сполука III цього винаходу Середнє±СВ проти Ха Середнє±СВ проти IIа AUCinf (годин.нмоль/мл) 1,2±0,1 0,8±0,1 Виявлено, що після підшкірного застосування сполуки III цього винаходу (100нмоль/кг), антитромботичну активність, яку визначено виміром (залишкової) активності проти Ха та проти IIa, можна нейтралізувати застосуванням 10мг/кг внутрішньовенно авідину. Нейтралізація сполуки III цього винаходу авідином відображується швидким зменшенням її концентрації у плазмі та сильно Сполука Org 42675 Середнє±СВ проти Ха 4,8±0,6 зменшеною AUC сполуки III цього винаходу після застосування авідину, у порівнянні зі сполукою Org 42675. Крім того, фармакокінетичні властивості небіотинілованого еквіваленту сполуки Org 42675 не є залежними від додавання авідину. Останнє свідчить, що нейтралізація асоційована із присутністю біотинової мітки і що це не впливає на фармакокінетичні властивості подвійного інгібітору. 27 Комп’ютерна верстка О. Гапоненко 88793 Підписне 28 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAntithrombotic dual inhibitors comprising a biotin residue
Автори англійськоюDe Kort Martin, Van Boeckel Constant Adriaan Anton
Назва патенту російськоюАнтитромботические двойные ингибиторы, которые содержат остаток биотина
Автори російськоюДе Корт Мартин, ван Бекель Констант Адриаан Антон
МПК / Мітки
МПК: A61P 9/00, A61K 47/48, C07H 15/26
Мітки: залишок, подвійні, біотину, містять, інгібітори, антитромботичні
Код посилання
<a href="https://ua.patents.su/14-88793-antitrombotichni-podvijjni-ingibitori-shho-mistyat-zalishok-biotinu.html" target="_blank" rel="follow" title="База патентів України">Антитромботичні подвійні інгібітори, що містять залишок біотину</a>
Попередній патент: Гідроксибензоатні солі метанікотинових сполук
Наступний патент: Піролопіразоли як сильнодіючі інгібітори кінази
Випадковий патент: Нейрон