Інгібітори каспази, що містять ізоксазолінове кільце
Номер патенту: 83240
Опубліковано: 25.06.2008
Автори: Парк Джунг-Гью, Чанг Хьє-Кьюн, Джеонг Хі-Кьюнг, Лі Кью-Воонг, Чой Хьєон-Воок, Кім Соо-Хьєон, Парк Хи-Донг, Кім Ае-Рі, Кім Сунг-Суб, Лі Джае-Хоон, Парк Чеол-Вон, Парк Тае-Кйо, Лі Санг-Кьюн, Парк Мі-Джеонг, Кім Хо-Джун, Джанг Йонг-Джін, Хео Тае-Хо, Лі Тае-Соо, Лі Сун-Хва, Кім Хва-Донг, Мін Кьєонг-Сік, Квон Тае-Сік, Парк Кі-Соок, Кім Мін-Джунг, Ох Йеонг-Соо, Шин Хьюн-Ік
Формула / Реферат
1. Сполука за формулою (1)
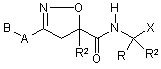 , (1)
, (1)
де:
І) R означає Н, простий алкільний ланцюг (-SAC), простий циклоалкільний ланцюг (-SCAC), арильну групу (-Аr) або простий алкільний ланцюг, заміщений арилом (-SAC-Ar);
II) R1 означає -SAC, -SCAC, -Аr, -SAC-Ar або бічноланцюговий залишок будь-якої природної амінокислоти; і сполука за формулою (1) може існувати у специфічній діастереомерній формі або її суміші, коли атом вуглецю, до якого приєднаний R1 стає стереоцентром завдяки групі R1; або сполука за формулою (1) може мати захисну групу у формі естеру (-CO2R3, де R3 є -SAC) або сульфонаміду (-CONHSO2R4, де R4 є -SAC), або може існувати у формі фармацевтично прийнятної солі, коли R1 є бічноланцюговий залишок амінокислоти, що містить карбоксильну частину; або ж сполука за формулою (1) може існувати також у формі фармацевтично прийнятної солі, коли R1 є бічноланцюговий залишок амінокислоти, що містить основну частину;
III) R2 означає -SAC, -SCAC, -Аr, -SAC-Ar або бічноланцюговий залишок природної амінокислоти; і сполука за формулою (1) може існувати у специфічній діастереомерній формі або її суміші, коли атом вуглецю, до якого приєднаний R2 стає стереоцентром завдяки групі R2; сполука за формулою (1) може мати захисну групу у формі естеру (-CО2R5, де R5 є -SAC) або сульфонаміду (-CONHSO2R6, де R6 є -SAC), або може існувати у формі фармацевтично прийнятної солі, коли R2 є бічноланцюговий залишок амінокислоти, що містить карбоксильну частину; або сполука за формулою (1) може існувати також у формі фармацевтично прийнятної солі, коли R2 є бічноланцюговий залишок амінокислоти, що містить основну частину, або
R2 означає, крім того, Н; -(CH2)nOR7, де R7 є -SAC, -SCAC, -Аr або -SAC-Ar, а n = 1 або 2; або -(CH2)nOC(=O)R8, де R8 є -SAC, -SCAC, -Аr або -SAC-Ar, а n = 1 або 2;
IV) А означає -(CH2)n- (n = 0-4), -O-(СН2)n- (n = 0-4) або -NR9-(CH2)n- (n = 0-4), де R9 є -SAC, -SCAC, -Аr або -SAC-Ar;
V) В означає Н, -SAC, -SCAC, -Аr або -SAC-Ar; або
VI) R і R1 можуть утворювати цикл разом з атомом вуглецю, до якого вони приєднані, де -R-R1- є -(СН2)n-, -(СН2)n-O-(СН2)m- або -(CH2)nNR10-CH2)m-, де n + m < 9, a R10 є -SAC, -SCAC, -Аr, -SAC-Ar, -C(=O)-SAC, -C(=O)-SCAC, -C(=O)-Ar або -C(=O)-SAC-Ar;
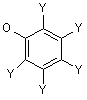
VII) Х означає -C(=O)CH2OR11, де R11 є -SAC, -SCAC, -Аr або -SAC-Ar; -C(=O)CH2OC(=O)R12, де R12 є -SAC, -SCAC, -Аr або -SAC-Ar; -СH-СН-СО2R-, де R13 є -SAC, -SCAC, -Аr або -SAC-Ar; -CH=CH-SO2R14, де R14 є -SAC, -SCAC, -Аr або -SAC-Ar; -C(=O)CH=CH2; або -COCH2-W, де W є -N2, -F, -Сl, -Вr, -І, -NR15R16 (де R15 і R16 кожний незалежно є -SAC, -SCAC, -Аr або -SAC-Ar або разом можуть утворювати 3-6-членну насичену або ненасичену циклічну групу), -SR17 (де R17 є -SAC, -SCAC, -Аr або -SAC-Ar) або є групою, що визначається такими формулами:
 ,
, 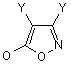 ,
,  ,
, 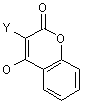 ,
, 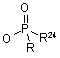 ,
,  ,
,
де:
Y є Н, -ОН, -OR18 (де R18 є -SAC або -SCAC), -C(=O)R19 (де R19 є -Н, -SAC або -SCAC), -F, -Сl, -Br, -I, -CN, -NC, -N3, -CO2H, CF3, -CO2R20 (де R20 є -SAC або -SCAC), -C(=O)NHR21 (де R21 є -SAC або -SCAC) або -C(=O)NR22R23 (де R22 і R23 кожний незалежно є -SAC, -SCAC,-Ar або -SAC-Ar),
R24 є Н, -SAC, -SAC-Ar або -Аr, сіль або стереоізомер вищезазначеного.
2. Сполука за п. 1, де R означає Н.
3. Сполука за п. 1, де R1 означає -СH2СООН, -CH2COOR3 (де R3 є SAC) або -CH2CNHSO2R4 (де R4 є SAC).
4. Сполука за п. 1, де R2 означає Н, -SAC, -Аr або -(CH2)nOR7 (де R7 є -SAC, -SCAC, -Аr або -SAC-Ar, n = 1 або 2).
5. Сполука за п. 1, де Х означає -С(=O)СН2OАr, -С(=O)СН2OС(=O)Аr або -COCH2-W, де W є -N2, -F, -Сl, -Br, -I, -NR15R16 (де R15 і R16 кожний незалежно є -SAC, -SCAC, -Аr або -SAC-Ar, або разом можуть утворювати 3-6-членну насичену або ненасичену циклічну групу) або -SR17 (де R17 є -SAC, -SCAC, -Аr або -SAC-Ar).
6. Сполука за п. 1, де:
І) R означає Н;
II) R1 означає -СН2СООН, -CH2COOR3 (де R3 SAC) або -CH2CONHSO2R4 (де R4 є SAC);
III) R2 означає Н, -SAC, -Аr або -(CH2)nOR7 (R7 = -SAC, -SCAC, -Аr або - SAC-Ar, a n = 1 або 2);
IV) А означає -(СН2)n- (n = 0-4) або -O-(СН2)n- (n = 0-4);
V) В означає Н, -SAC, -SCAC, -Аr або -SAC-Ar;
VI) Х означає -COCH2N2, -COCH2F, -СОСН2Сl, -СОСН2Вr, -СОСН2І, - СОСН2OАr, -СОСН2OСОАr або -COCH2SR17 (де R17 є -SAC, -SCAC, -Аr або -SAC-Ar).
7. Сполука за п. 1, вибрана із такої групи:
(1) (3S)-5-[(2,6-дихлорбензоїл)окси]-3-({[5-метил-3-феніл-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанова кислота (Іаа);
(2) (3S)-3-({[5-метил-3-феніл-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-феноксипентанова кислота (Іbb);
(3) (3S)-3-({[5-етил-3-феніл-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентанова кислота (Ісс);
(4) (3S)-3-({[5-етил-3-(1-нафтил)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентанова кислота (Idd);
(5) (3S)-3-({[5-етил-3-(2-нафтил)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентанова кислота (Іее);
(6) (3S)-3-({[5-етил-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентанова кислота (Iff);
(7) 3-({[5-етил-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іgg);
(8) етил-3-({[5-етил-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентаноат (Ihh);
(9) 5-фтор-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанова кислота (Ііі);
(10) 3-({[5-етил-3-(4-хінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Ijj);
(11) 3-({[3-(бензотіофен-2-іл)-5-етил-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Ikk);
(12) (3S)-3-({[3-(1,3-диметил-1Н-індол-2-іл)-5-етил-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентанова кислота (Ill);
(13) 3-({[3-(1,3-диметил-1Н-індол-2-іл)-5-етил-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Imm);
(14) (38)-3-({[5-етил-3-(1-нафтилметил)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентанова кислота (Inn);
(15) (35)-5-[(2,6-дихлорбензоїл)окси]-3-[({5-етил-3-[2-(1-нафтил)етил]-4,5-дигідро-5-ізоксазоліл}карбоніл)аміно]-4-оксопентанова кислота (loo);
(16) (35)-3-[({5-етил-3-[(1-нафтилокси)метил]-4,5-дигідро-5-ізоксазоліл}карбоніл)аміно]-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентанова кислота (Ірр);
(17) (3S)-3-{[(3-{[(4-xлop-1-нафтил)окси]метил}-5-етил-4,5-дигідро-5-ізоксазоліл)карбоніл]аміно}-4-оксо-5-(2,3,5,6-тетрафторфенокси)пентанова кислота (Iqq);
(18) (35,4Е)-6-етокси-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-6-оксо-4-гексенова кислота (Іrr);
(19) (35,4Е)-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-(метилсульфоніл)-4-пентенова кислота (Iss);
(20)5-фтор-3-({[(5S)-3-(1-ізохінолініл)-5-пропіл-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанова кислота (Itt);
(21) 3-({[(5S)-5-етил-3-(1-нафтил)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (luu);
(22) 3-({[(5S)-5-етил-3-(2-хінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Ivv);
(23) 3-({[(5R)-5-етил-3-(3-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Iww);
(24) 3-({[5-етил-3-(8-хінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іхх);
(25) 3-({[5-етил-3-(3-хінолініл-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іуу);
(26) 5-фтор-3-({[(5R)-5-ізопропіл-3-(2-хінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанова кислота (Izz);
(27) 3-({[5-етил-3-(2-ізопропілфеніл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іаа1);
(28) 3-[({3-[3-(трет-бутил)феніл]-5-етил-4,5-дигідро-5-ізоксазоліл}карбоніл)аміно]-5-фтор-4-оксопентанова кислота (Іаа2);
(29) 3-[({3-[4-(трет-бутил)феніл]-5-етил-4,5-дигідро-5-ізоксазоліл}карбоніл)аміно]-5-фтор-4-оксопентанова кислота (Іаа3);
(30) 5-фтop-3-({[(5R)-5-iзoпpoпiл-3-(2-iзoпpoпiлфeнiл)-4,5-дигiдpo-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанова кислота (Іаа4);
(31) 3-[({(5R)-3-[3-(трет-бутил)феніл]-5-ізопропіл-4,5-дигідро-5-ізоксазоліл}карбоніл)аміно]-5-фтор-4-оксопентанова кислота (Іаа5);
(32) 3-{[(3-[1,1’-біфеніл]-3-іл-5-ізопропіл-4,5-дигідро-5-ізоксазоліл)карбоніл]аміно}-5-фтор-4-оксопентанова кислота (Іаа6);
(33) 3-({[5-етил-3-(2-піридиніл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іаа7);
(34) 3-[({3-[4-(трет-бутил)-2-піридиніл]-5-етил-4,5-дигідро-5-ізоксазоліл}карбоніл)аміно]-5-фтор-4-оксопентанова кислота (Іаа8);
(35) 3-[({(5R)-3-[4-(трет-бутил)-2-піридиніл]-5-ізопропіл-4,5-дигідро-5-ізоксазоліл}карбоніл)аміно]-5-фтор-4-оксопентанова кислота (Іаа9);
(36) 3-({[5-етил-3-(4-ізобутил-2-піридиніл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іаа10);
(37) 3-({[3-(4-ацетил-2-піридиніл)-5-етил-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іаа11);
(38) 3-({[3-(4-циклопропіл-2-піридиніл)-5-етил-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іаа12);
(39) 3-({[3-(4-циклопентил-2-піридиніл)-5-етил-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іаа13);
(40) 3-([[(5R)-3-(4-циклопентил-2-піридиніл)-5-ізопропіл-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іаа14);
(41) 3-({[3-(4-циклогексил-2-піридиніл)-5-етил-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іаа15);
(42) 3-({[5-етил-3-(5,6,7,8-тетрагідро-1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іаа16);
(43) 5-фтор-3-({[5-ізопропіл-3-(4-феніл-2-піридиніл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанова кислота (Іаа17);
(44) (3S)-5-[(дифенілфосфорил)окси]-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанова кислота (Іаа18);
(45) (3S)-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно-4-оксо-54[1-феніл-5-(трифторметил)-1H-піразол-5-іл]окси}пентанова кислота (ІааІ9);
(46) (3S)-5-[(4-бензил-5-оксо-2,5-дигідро-3-фураніл)окси-3-({[(5R)-5-ізопропіл-3-(1-ізохіноліл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанова кислота (Іаа20);
(47) (3S)-5-(ізобутирилоксі)-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанова кислота (Іаа21);
(48)(3S)-3-({[(5R)-5-ізопропіл-5-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-гексенова кислота (Іаа22);
(49) (3S)-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2-піридинілокси)пентанова кислота (Іаа23);
(50) (35)-3-({[5-етил-3-(2-ізопропілфеніл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2-піридинілокси)пентанова кислота (Іаа24);
(51) 2-{[(3S)-4-карбоксі-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-2-оксобутил]окси}-1-метилпіридинійтрифторметансульфонат (Іаа25);
(52) 2-{[(3S)-4-карбоксі-3-({[5-етил-3-(2-ізопропілфеніл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-2-оксобутил]окси}-1-метилпіридинійтрифторметансульфонат (Іаа26);
(53) 3-({[3-(5-хлор-1-метил-1H-індол-2-іл)-5-ізопропіл-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іаа27);
(54) 3-({[3-(1,5-диметил-1Н-індол-2-іл)-5-ізопропіл-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4-оксопентанова кислота (Іаа28); і
(55) (35)-5-фтор-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанова кислота (Ііі-1).
8. Сполука за п. 1, якою є 5-фтop-3-({[(5R)-5-iзoпpoпiл-3-(1-iзoxiнoлiнiл)-4,5-дигiдpo-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанова кислота (Ііі).
9. Сполука за формулою (1а):
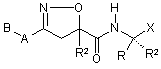 , (1a)
, (1a)
де:
А, В, R, R1, R2 і Х є такими, як визначено в п. 1.
10. Сполука за п. 9, якою є (33)-5-фтор-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанова кислота (Ііі-1).
11. Спосіб одержання сполуки (Ііі-1), визначеної в п. 10, який включає у себе стадії розчиняння суміші (35)-5-фтор-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанової кислоти і (3R)-5-фтор-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанової кислоти в метил-трет-бутиловому етері, додавання невеликої кількості кристалічної (3R)-5-фтор-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксопентанової кислоти як зародкового матеріалу для утворення кристалу, і рекристалізації цього кристалу із етилацетат/n-гексанового розчинника.
12. Терапевтичний склад для запобігання запаленню і апоптозу, який містить сполуку за формулою (1), що є інгібітором каспази, її сіль або стереоізомер, згідно з визначеним у п. 1, як активний інгредієнт разом з фармацевтично прийнятним носієм.
13. Склад за п. 12 для лікування деменції, інсульту, ушкодження мозку внаслідок СНІДу, діабету, виразки шлунку, церебральних ушкоджень внаслідок гепатиту, викликаних гепатитом хвороб печінки, гострого гепатиту, швидкоплинних уражень печінки, цирозу печінки, сепсису, відторгнення трансплантатів, ревматоїдного артриту й апоптозу клітин серця внаслідок ішемічних хвороб серця.
14. Склад за п. 12 для лікування гострого гепатиту, цирозу печінки.
15. Склад за п. 12 для лікування ревматоїдного артриту.
16. Склад за п. 12, у формі препарату для перорального введення, препарату для ін'єкцій або пластиру.
17. Склад за п. 12, який містить як активний інгредієнт сполуку (Ііі), визначену в п. 8.
18. Склад за п. 12, який містить як активний інгредієнт сполуку (Ііі-1), визначену в п. 10.
19. Спосіб одержання терапевтичного складу для запобігання запаленню й апоптозу згідно з визначеним у п. 12, який включає у себе змішування як інгібітору каспази сполуки за формулою (1), її солі або стереоізомеру, визначених у п. 1, з фармацевтично прийнятним носієм.
20. Спосіб запобігання запаленню й апоптозу, який включає у себе введення ефективної кількості інгібітору каспази, якою є сполука за формулою (1), її сіль або стереоізомер, визначені в п. 1, пацієнту, що страждає на запалення й апоптоз.
Текст
1. Сполука за формулою (1) N O H C2 2 (19) 1 3 83240 4 (3) (3S)-3-({[5-етил-3-феніл-4,5-дигідро-5ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,6тетрафтор фенокси)пентанова кислота (Ісс); Y Y (4) (3S)-3-({[5-етил-3-(1-нафтил)-4,5-дигідро-5N ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,6O N тетрафтор фенокси)пентанова кислота (Idd); N (5) (3S)-3-({[5-етил-3-(2-нафтил)-4,5-дигідро-5O R24 O , , ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,6O тетрафтор фенокси)пентанова кислота (Іее); R24 O (6) (3S)-3-({[5-етил-3-(1-ізохінолініл)-4,5-дигідро-5Y O ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,6тетрафтор фенокси)пентанова кислота (Iff); O (7) 3-({[5-етил-3-(1-ізохінолініл)-4,5-дигідро-5O O ізоксазоліл]карбоніл}аміно)-5-фтор-4оксопентанова кислота (Іgg); R24 R24 , , (8) етил-3-({[5-етил-3-(1-ізохінолініл)-4,5-дигідро-5Y ізоксазоліл]карбоніл}аміно)-5-фтор-4оксопентаноат (Ihh); O Y (9) 5-фтор-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)O 4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4оксопентанова кислота (Ііі); Y P Y R 24 O (10) 3-({[5-етил-3-(4-хінолініл)-4,5-дигідро-5R Y ізоксазоліл]карбоніл}аміно)-5-фтор-4, , оксопентанова кислота (Ijj); де: (11) 3-({[3-(бензотіофен-2-іл)-5-етил-4,5-дигідро-5Y є Н, -ОН, -OR18 (де R18 є -SAC або -SCAC), ізоксазоліл]карбоніл}аміно)-5-фтор-4C(=O)R19 (де R19 є -Н, -SAC або -SCAC), -F, -Сl, оксопентанова кислота (Ikk); Br, -I, -CN, -NC, -N 3, -CO2H, CF3, -CO2R20 (де R20 є (12) (3S)-3-({[3-(1,3-диметил-1Н-індол-2-іл)-5-етилSAC або -SCAC), -C(=O)NHR 21 (де R21 є -SAC або 4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5SCAC) або -C(=O)NR 22R23 (де R22 і R23 кожний не(2,3,5,6-тетрафторфенокси)пентанова кислота (Ill); залежно є -SAC, -SC AC,-Ar або -SAC-Ar), (13) 3-({[3-(1,3-диметил-1Н-індол-2-іл)-5-етил-4,5R24 є Н, -SAC, -SAC-Ar або -Аr, сіль або стереоізодигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4мер вищезазначеного. оксопентанова кислота (Imm); 2. Сполука за п. 1, де R означає Н. (14) (38)-3-({[5-етил-3-(1-нафтилметил)-4,53. Сполука за п. 1, де R1 означає -СH2СООН, дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5CH2COOR3 (де R3 є SAC) або -CH2CNHSO2R4 (де (2,3,5,6-тетрафторфенокси)пентанова кислота R4 є SAC). (Inn); 4. Сполука за п. 1, де R2 означає Н, -SAC, -Аr або (15) (35)-5-[(2,6-дихлорбензоїл)окси]-3-[({5-етил-3(CH2)nOR7 (де R7 є -SAC, -SC AC, -Аr або -SAC-Ar, n [2-(1-нафтил)етил]-4,5-дигідро-5= 1 або 2). ізоксазоліл}карбоніл)аміно]-4-оксопентанова кис5. Сполука за п. 1, де Х означає -С(=O)СН2OАr, лота (loo); С(=O)СН2OС(=O)Аr або -COCH2-W, де W є -N2, -F, (16) (35)-3-[({5-етил-3-[(1-нафтилокси)метил]-4,5-Сl, -Br, -I, -NR15R16 (де R15 і R16 кожний незалежно дигідро-5-ізоксазоліл}карбоніл)аміно]-4-оксо-5є -SAC, -SCAC, -Аr або -SAC-Ar, або разом можуть (2,3,5,6-тетрафторфенокси)пентанова кислота утворювати 3-6-членну насичену або ненасичену (Ірр); циклічну гр упу) або -SR17 (де R17 є -SAC, -SC AC, (17) (3S)-3-{[(3-{[(4-xлop-1-нафтил)окси]метил}-5Аr або -SAC-Ar). етил-4,5-дигідро-5-ізоксазоліл)карбоніл]аміно}-46. Сполука за п. 1, де: оксо-5-(2,3,5,6-тетрафторфенокси)пентанова кисІ) R означає Н; лота (Iqq); II) R1 означає -СН2СООН, -CH2COOR3 (де R3 SAC) (18) (35,4Е)-6-етокси-3-({[(5R)-5-ізопропіл-3-(1або -CH2CONHSO2R4 (де R4 є SAC); ізохінолініл)-4,5-дигідро-5III) R2 означає Н, -SAC, -Аr або -(CH2)nOR7 (R7 = ізоксазоліл]карбоніл}аміно)-6-оксо-4-гексенова SAC, -SC AC, -Аr або - SAC-Ar, a n = 1 або 2); кислота (Іrr); IV) А означає -(СН2)n- (n = 0-4) або -O-(СН2)n- (n = (19) (35,4Е)-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)0-4); 4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5V) В означає Н, -SAC, -SC AC, -Аr або -SAC-Ar; (метилсульфоніл)-4-пентенова кислота (Iss); VI) Х означає -COCH2N2, -COCH2F, -СОСН2Сl, (20)5-фтор-3-({[(5S)-3-(1-ізохінолініл)-5-пропіл-4,5СОСН2Вr, -СОСН2І, - СОСН2OАr, -СОСН2OСОАr дигідро-5-ізоксазоліл]карбоніл}аміно)-4або -COCH2SR17 (де R17 є -SAC, -SC AC, -Аr або оксопентанова кислота (Itt); SAC-Ar). (21) 3-({[(5S)-5-етил-3-(1-нафтил)-4,5-дигідро-57. Сполука за п. 1, вибрана із такої групи: ізоксазоліл]карбоніл}аміно)-5-фтор-4(1) (3S)-5-[(2,6-дихлорбензоїл)окси]-3-({[5-метил-3оксопентанова кислота (luu); феніл-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4(22) 3-({[(5S)-5-етил-3-(2-хінолініл)-4,5-дигідро-5оксопентанова кислота (Іаа); ізоксазоліл]карбоніл}аміно)-5-фтор-4(2) (3S)-3-({[5-метил-3-феніл-4,5-дигідро-5оксопентанова кислота (Ivv); ізоксазоліл]карбоніл}аміно)-4-оксо-5феноксипентанова кислота (Іbb); R24 Y 5 83240 6 (23) 3-({[(5R)-5-етил-3-(3-ізохінолініл)-4,5-дигідро-5ізоксазоліл]карбоніл}аміно)-4-оксопентанова кисізоксазоліл]карбоніл}аміно)-5-фтор-4лота (Іаа17); оксопентанова кислота (Iww); (44) (3S)-5-[(дифенілфосфорил)окси]-3-({[(5R)-5(24) 3-({[5-етил-3-(8-хінолініл)-4,5-дигідро-5ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5ізоксазоліл]карбоніл}аміно)-5-фтор-4ізоксазоліл]карбоніл}аміно)-4-оксопентанова кисоксопентанова кислота (Іхх); лота (Іаа18); (25) 3-({[5-етил-3-(3-хінолініл-4,5-дигідро-5(45) (3S)-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл-4,5ізоксазоліл]карбоніл}аміно)-5-фтор-4дигідро-5-ізоксазоліл]карбоніл}аміно-4-оксо-54[1оксопентанова кислота (Іуу); феніл-5-(трифторметил)-1H-піразол-5(26) 5-фтор-3-({[(5R)-5-ізопропіл-3-(2-хінолініл)-4,5іл]окси}пентанова кислота (ІааІ9); дигідро-5-ізоксазоліл]карбоніл}аміно)-4(46) (3S)-5-[(4-бензил-5-оксо-2,5-дигідро-3оксопентанова кислота (Izz); фураніл)окси-3-({[(5R)-5-ізопропіл-3-(1-ізохіноліл)(27) 3-({[5-етил-3-(2-ізопропілфеніл)-4,5-дигідро-54,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4ізоксазоліл]карбоніл}аміно)-5-фтор-4оксопентанова кислота (Іаа20); оксопентанова кислота (Іаа1); (47) (3S)-5-(ізобутирилоксі)-3-({[(5R)-5-ізопропіл-3(28) 3-[({3-[3-(трет-бутил)феніл]-5-етил-4,5-дигідро(1-ізохінолініл)-4,5-дигідро-55-ізоксазоліл}карбоніл)аміно]-5-фтор-4ізоксазоліл]карбоніл}аміно)-4-оксопентанова кисоксопентанова кислота (Іаа2); лота (Іаа21); (29) 3-[({3-[4-(трет-бутил)феніл]-5-етил-4,5-дигідро(48)(3S)-3-({[(5R)-5-ізопропіл-5-(1-ізохінолініл)-4,55-ізоксазоліл}карбоніл)аміно]-5-фтор-4дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5оксопентанова кислота (Іаа3); гексенова кислота (Іаа22); (30) 5-фтop-3-({[(5R)-5-iзoпpoпiл-3-(2(49) (3S)-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5iзoпpoпiлфeнiл)-4,5-дигiдpo-5дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2ізоксазоліл]карбоніл}аміно)-4-оксопентанова киспіридинілокси)пентанова кислота (Іаа23); лота (Іаа4); (50) (35)-3-({[5-етил-3-(2-ізопропілфеніл)-4,5(31) 3-[({(5R)-3-[3-(трет-бутил)феніл]-5-ізопропілдигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-(24,5-дигідро-5-ізоксазоліл}карбоніл)аміно]-5-фтор-4піридинілокси)пентанова кислота (Іаа24); оксопентанова кислота (Іаа5); (51) 2-{[(3S)-4-карбоксі-3-({[(5R)-5-ізопропіл-3-(1(32) 3-{[(3-[1,1’-біфеніл]-3-іл-5-ізопропіл-4,5ізохінолініл)-4,5-дигідро-5дигідро-5-ізоксазоліл)карбоніл]аміно}-5-фтор-4ізоксазоліл]карбоніл}аміно)-2-оксобутил]окси}-1оксопентанова кислота (Іаа6); метилпіридинійтрифторметансульфонат (Іаа25); (33) 3-({[5-етил-3-(2-піридиніл)-4,5-дигідро-5(52) 2-{[(3S)-4-карбоксі-3-({[5-етил-3-(2ізоксазоліл]карбоніл}аміно)-5-фтор-4ізопропілфеніл)-4,5-дигідро-5оксопентанова кислота (Іаа7); ізоксазоліл]карбоніл}аміно)-2-оксобутил]окси}-1(34) 3-[({3-[4-(трет-бутил)-2-піридиніл]-5-етил-4,5метилпіридинійтрифторметансульфонат (Іаа26); дигідро-5-ізоксазоліл}карбоніл)аміно]-5-фтор-4(53) 3-({[3-(5-хлор-1-метил-1H-індол-2-іл)-5оксопентанова кислота (Іаа8); ізопропіл-4,5-дигідро-5(35) 3-[({(5R)-3-[4-(трет-бутил)-2-піридиніл]-5ізоксазоліл]карбоніл}аміно)-5-фтор-4ізопропіл-4,5-дигідро-5оксопентанова кислота (Іаа27); ізоксазоліл}карбоніл)аміно]-5-фтор-4(54) 3-({[3-(1,5-диметил-1Н-індол-2-іл)-5-ізопропілоксопентанова кислота (Іаа9); 4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4(36) 3-({[5-етил-3-(4-ізобутил-2-піридиніл)-4,5оксопентанова кислота (Іаа28); і дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4(55) (35)-5-фтор-3-({[(5R)-5-ізопропіл-3-(1оксопентанова кислота (Іаа10); ізохінолініл)-4,5-дигідро-5(37) 3-({[3-(4-ацетил-2-піридиніл)-5-етил-4,5ізоксазоліл]карбоніл}аміно)-4-оксопентанова кисдигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4лота (Ііі-1). оксопентанова кислота (Іаа11); 8. Сполука за п. 1, якою є 5-фтop-3-({[(5R)-5(38) 3-({[3-(4-циклопропіл-2-піридиніл)-5-етил-4,5iзoпpoпiл-3-(1-iзoxiнoлiнiл)-4,5-дигiдpo-5дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4ізоксазоліл]карбоніл}аміно)-4-оксопентанова кисоксопентанова кислота (Іаа12); лота (Ііі). (39) 3-({[3-(4-циклопентил-2-піридиніл)-5-етил-4,59. Сполука за формулою (1а): дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4N O H оксопентанова кислота (Іаа13); B N X (40) 3-([[(5R)-3-(4-циклопентил-2-піридиніл)-5(1a) A ізопропіл-4,5-дигідро-5R2 R2 R O ізоксазоліл]карбоніл}аміно)-5-фтор-4, оксопентанова кислота (Іаа14); де: (41) 3-({[3-(4-циклогексил-2-піридиніл)-5-етил-4,5А, В, R, R 1, R 2 і Х є такими, як визначено в п. 1. дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-410. Сполука за п. 9, якою є (33)-5-фтор-3-({[(5R)-5оксопентанова кислота (Іаа15); ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5(42) 3-({[5-етил-3-(5,6,7,8-тетрагідро-1-ізохінолініл)ізоксазоліл]карбоніл}аміно)-4-оксопентанова кис4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4лота (Ііі-1). оксопентанова кислота (Іаа16); 11. Спосіб одержання сполуки (Ііі-1), визначеної в (43) 5-фтор-3-({[5-ізопропіл-3-(4-феніл-2п. 10, який включає у себе стадії розчиняння суміпіридиніл)-4,5-дигідро-5ші (35)-5-фтор-3-({[(5R)-5-ізопропіл-3-(1ізохінолініл)-4,5-дигідро-5 7 83240 8 ізоксазоліл]карбоніл}аміно)-4-оксопентанової кистрансплантатів, ревматоїдного артриту й апоптозу лоти і (3R)-5-фтор-3-({[(5R)-5-ізопропіл-3-(1клітин серця внаслідок ішемічних хвороб серця. ізохінолініл)-4,5-дигідро-514. Склад за п. 12 для лікування гострого гепатиту, ізоксазоліл]карбоніл}аміно)-4-оксопентанової кисцирозу печінки. лоти в метил-трет-бутиловому етері, додавання 15. Склад за п. 12 для лікування ревматоїдного невеликої кількості кристалічної (3R)-5-фтор-3артриту. ({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-516. Склад за п. 12, у формі препарату для перораізоксазоліл]карбоніл}аміно)-4-оксопентанової кисльного введення, препарату для ін'єкцій або пласлоти як зародкового матеріалу для утворення критиру. сталу, і рекристалізації цього кристалу із етилаце17. Склад за п. 12, який містить як активний інгретат/n-гексанового розчинника. дієнт сполуку (Ііі), визначену в п. 8. 12. Терапевтичний склад для запобігання запа18. Склад за п. 12, який містить якактивний інгреленню і апоптозу, який містить сполуку за формудієнт сполуку (Ііі-1), визначену в п. 10. лою (1), що є інгібітором каспази, її сіль або сте19. Спосіб одержання терапевтичного складу для реоізомер, згідно з визначеним у п. 1, як активний запобігання запаленню й апоптозу згідно з визнаінгредієнт разом з фармацевтично прийнятним ченим у п. 12, який включає у себе змішування як носієм. інгібітору каспази сполуки за формулою (1), її солі 13. Склад за п. 12 для лікування деменції, інсульабо стереоізомеру, визначених у п. 1, з фармацевту, ушкодження мозку внаслідок СНІДу, діабету, тично прийнятним носієм. виразки шлунку, церебральних ушкоджень внаслі20. Спосіб запобігання запаленню й апоптозу, який док гепатиту, викликаних гепатитом хвороб печінвключає у себе введення ефективної кількості інгіки, гострого гепатиту, швидкоплинних уражень бітору каспази, якою є сполука за формулою (1), її печінки, цирозу печінки, сепсису, відторгнення сіль або стереоізомер, визначені в п. 1, пацієнту, що страждає на запалення й апоптоз. Даний винахід стосується ізоксазолінової похідної, яка може служити інгібітором різноманітних каспаз, включаючи каспазу-1 (фермент, що перетворює інтерлейкін-1b, ICE: interleukin-1b converting enzyme) і каспазу-3 (апопаїн/СРР-32), процесу для її виготовлення і терапевтичного складу, що її містить, для профілактики запалення і апоптозу. Каспаза являє собою новий вид цистеїнової протеази у формі a 2b 2, дослідження якої ведуться на протязі останніх 10 років. На сьогоднішній день відомо близько 14 її видів. Один із них, каспаза-1 (ICE), є виду цитокінів і бере участь у перетворенні неактивного проінтерлейкіну-1b на активний інтерлейкін-1b. Інтерлейкін-1 складається із інтерлейкіну-1a й інтерлейкіну-1b, що синтезуються в моноцитах у формі прекурсору масою 31кДа. ІСЕферментом активується тільки проінтерлейкін-1b. Положеннями, що гідролізуються каспазою-1, є Asp27-Gl y28 і Asp116-Ala117. Внаслідок гідролізу останнього з цих положень утворюється інтерлейкін-1b. Про інтерлейкін-1b повідомлялося [1, 3] як про важливий медіатор індукції запалення. Каспаза-1 була відкрита в 1989 році двома незалежними групами вчених, а її тримірна структура була встановлена за допомогою рентгенівської кристалографії. Широкі дослідження щодо ролі та механізму дії каспази-3(СРР-32), а також визначення її тримірної структури були проведені в 1996 році [2]. Каспаза-3 (апопаїн), активована прокаспазою-3, гідролізує мотив (P4)Asp-X-X-Asp(P1), а до числа відомих субстратів входять полі(АDРрибоза)полімераза, U1 70000 Mr малий рибонуклеопротеїд ядра, каталітична субодиниця 460000 Mr ДНК-залежної протеїнкінази і т.д. Рентгенографічна стр уктура каспази-7 виявилася дуже подібною до рентгенографічної структури каспази-3 [4]. Каспаза-8 і каспаза-9 займають положення у правій частині послідовності каспаз-3, 6, 7, про які відомо, що вони беруть участь в апоптозному шляху. Рентгенографічна структура каспази-8 була визначена у 1999р. [5]. Отже її інгібітори можуть ефективно використовуватися в лікуванні хвороб, пов'язаних з втратою клітин. Інгібіторами каспази, за їх визначенням, є сполуки, що інгібують каспазну активність і в цей спосіб впливають на такі симптоми, як запалення, апоптоз та інші, що викликаються каспазною активністю. До числа хвороб та симптомів, які можуть лікуватися або пом'якшуватися шляхом уведення цих інгібіторів, належать: ревматоїдний артрит, запальна хвороба кишечнику, реакція "трансплантат проти хазяїна", сепсіс, остеоартрит, остеопороз, гостра і хронічна мієлогенна лейкемія, менінгіт, сальпінгіт, септичний шок, холангіт, еоліт, енцефаліт, ендокардит, гломерулонефрит, гепатит, міокардит, панкреатит, цукровий діабет І типу, множинний склероз, хвороба Альцгеймера, хвороба Паркінсона, цироз печінки [6]. Серед відомих на сьогоднішній день інгібіторів каспази найбільш помітними є необоротні інгібітори, наприклад: Активність обох цих інгібіторів базується на загальному механізмі, під дією якого відбувається необоротна інактивація даного ферменту і, отже, придушення апоптозу клітин (необоротний інгібітор широкого спектра дії). У роботі [7] повідомлялося, що необоротний інгібітор має значно більш ефек 9 83240 10 тивну інгібіторну активність, ніж оборотні інгібітори. гом 1 тижня через 1 тиждень від дня лігування Обидва вищезазначені інгібітори, IDN-1965 виробжовчної протоки. ництва фірми DDUN Co. і МХ-1013 виробництва На Фіг.2 показана інгібіторна активність сполуфірми Maxim Co., продемонстрували свою активки (Ііі) проти апоптозу клітин печінки внаслідок станість на моделі апоптозу клітин у випадку гепатичгнації жовчі: "а)" випадку симульованої операції; ного розладу [8, 9]. Сьогодні ці сполуки проходять "b)" у випадку BDL операції, коли після лігування передклінічні випробування. Крім того, сьогодні жовчної протоки вводили тільки носій; "с)" у випадфазу II клінічних випробувань як терапевтичний ку, коли сполуку (Ііі) вводили пероральним шляхом засіб для лікування гепатичних розладів [10, 11] з дозою 3мг/кг двічі на день протягом 1 тижня чепроходить необоротний інгібітор IDN-6556, струкрез 1 тиждень від дня лігування жовчної протоки; тура якого була нещодавно досліджена. "d)" у випадку, коли сполуку (Ііі) вводили пероральним шляхом з дозою 10мг/кг двічі на день протягом 1 тижня через 1 тиждень від дня лігування жовчної протоки; і "e)" зображений графік кількості клітин печінки, залучених до апоптозу в кожній групі обробки. Перед тим, як перейти до детальної ілюстрації даного винаходу, тут будуть подані значення декількох важливих термінів, використовуваних у даному описі. a) Термін «простий алкільний ланцюг" (у подаАвторами винаходу були розроблені і синтельшому: SAC, Simple Alkyl Chain) означає вуглезовані нові сполуки, які можуть використовуватися водень, який має від 1 до 8 атомів вуглецю в пряяк ефективні інгібітори каспаз і мають особливу молінійній або розгалуженій ізомерній формі. структур у і високу селективність до подібних ферb) Термін "простий циклоалкільний ланцюг" (у ментів, а також визначена їхня здатність зв'язуваподальшому: SCAC, Simple Цикло Alkyl Chain) тися з каспазами та інгібувати каспазну активність. означає циклічний радикал, що має від 3 до 10 Однією з таких сполук, що мають зазначені власатомів вуглецю. тивості і, таким чином, дозволяють здійснити даc) Термін "арильна група" (у подальшому: Аr) ний винахід, є сполука, яка відповідає формулі (1): стосується як ароматичних, так і гетероароматичних гр уп. При цьому під ароматичною групою тут мається на увазі 5-15-членний поодинокий або злитий ненасичений цикл. Один або більше атомів водню в цій групі можуть бути заміщені групою (або групами), вибраними серед ацилу, аміно, карбоалкокси, карбокси, карбоксіаміно, ціано, галоїду, гідрокси, нітро, тіолу, алкілу, циклоалкілу, алкокси, арилокси, сульфокси і гуанідогрупи. Під де гетероароматичною групою тут мається на увазі 1 2 А, В, R, R , R і X мають значення, подані нижароматична група, яка містить від 1 до 5 гетероче. атомів, вибраних із сукупності, що складається із Отже, даним винаходом створена нова ізоксасірки й азоту. Тут також один або більше атомів золінова похідна за формулою (1), її сіль або стеводню можуть бути заміщені групою (або групами), реоізомер, що мають інгібіторну активність по відвибраними серед ацилу, аміно, карбоалкокси, карношенню до каспаз. бокси, карбоксіаміно, ціано, галоїду, гідрокси, нітІншою метою даного винаходу є створення ро, тіолу, алкілу, циклоалкілу, алкокси, арилу, ариспособу для виготовлення сполуки за формулою локси, сульфокси і гуанідогрупи. Або, наприклад, у (1), її солі або стереоізомеру. випадку піридилу алкільна група може бути додаМетою даного винаходу є також створення на до атому азоту з перетворенням піридильної складу, процесу застосування або інгібування касгрупи на піридинієву груп у, яка має (+) заряд на паз і, зокрема, терапевтичного складу, процесу атомі азоту. його застосування або процесу профілактики за До числа арильних груп належать феніл, бійого допомогою запалення й апоптозу, що містить феніл, 1-нафтил, 2-нафтил, піридиніл, Nсполуку за формулою (1), її сіль або стереоізомер алкілпіридиній, піримідиніл, хінолініл, бензотієніл, як активний інгредієнт разом із фармацевтично індоліл, піразиніл, ізоіндоліл, ізохіноліл, хіназоліприйнятним носієм. ніл, хіноксалініл, фталазиніл, імідазолініл, ізоксаНа Фіг.1 показана інгібіторна активність сполузоліл, піразоліл, оксазоліл, тіазоліл, індолізиніл, ки (Ііі) проти фіброзу печінки, зумовленого стагнаіндазоліл, бензотіазоліл, бензімідазоліл, бензофуцією жовчі: "а)" у випадку симульованої операції; раніл, тієніл, пірроліл, оксадіазоліл, тіадіазоліл, "b)" у випадку BDL операції, коли після лігування триазоліл, тетразоліл, оксазолопіридиніл, імідазожовчної протоки вводили тільки носій; "с)" у випадпіридиніл, ізотіазоліл, цинолініл, карбазоліл, ізоку, коли сполуку (Ііі) вводили пероральним шляхом хроманіл, хроманіл, тетрагідроізохінолініл, ізоіндоз дозою 3мг/кг двічі на день протягом 1 тижня челініл, ізобензотетрагідрофураніл, рез 1 тиждень від дня лігування жовчної протоки; ізобензотетрагідротієніл, ізобензотієніл, бензокса"d)" у випадку, коли сполуку (liі) вводили пероразоліл, піридопіридиніл, бензотетрагідрофураніл, льним шляхом з дозою 10мг/кг двічі на день протябензотетрагідротієніл. пуриніл, бензодіоксоліл, 11 83240 12 триазиніл, феноксазиніл, фенотіазиніл, птеридиколи R1 є бічноланцюговий залишок амінокислоти, ніл, бензотіазоліл, імідазопіридиніл, імідазотіазощо містить карбоксильну частину; або ж сполука ліл, дигідробензізоксазиніл, бензізоксазиніл, бенза формулою (1) може існувати також у формі фазоксазиніл, дигідробензізотіопіраніл, бензопіраніл, рмацевтично прийнятної солі, коли R1 є бічноланбензотіопіраніл, кумариніл, ізокумариніл, хромоніл, цюговий залишок амінокислоти що містить основхроманоніл, піридиніл-N-оксид, тетрагідрохіноліну частин у. ніл-N-оксид, дигідрохінолініл, дигідрохінолініл, диIII) R2 означає -SAC, -SC AC, -Ar, -SAC-Ar або гідроізохіноліноніл, дигідрокумариніл, дигідроізобічноланцюговий залишок природної амінокислокумариніл, ізоіндоліноніл, бензодіоксаніл, ти; і сполука за формулою (1) може існувати у бензоксазоліноніл, N-алкілпіридій, піроліл-N-оксид, специфічній діастереомерній формі або її суміші, піримідиніл-N-оксид, піразиніл-N-оксид, хінолінілколи атом вуглецю, до якого приєднаний R2 стає N-оксид, індоліл-N-оксид, індолініл-N-оксид, ізохістереоцентром завдяки групі R2; або сполука за ноліл-N-оксид, хіназолініл-N-оксид, хіноксалініл-Nформулою (1) може мати захисну гр упу у формі оксид, фталазиніл-N-оксид, імідазолініл-N-оксид, естеру (-CO2R5, де R5 є -SAC) або сульфонаміду (ізоксазоліл-N-оксид, оксазоліл-N-оксид, тіазоліл-NCONHSO2R6, де R6 є -SAC), або може існувати у оксид, індолізиніл-N-оксид, індазоліл-N-оксид, бенформі фармацевтично прийнятної солі, коли R2 є зотіазоліл-N-оксид, бензімідазоліл-N-оксид, піробічноланцюговий залишок амінокислоти, що місліл-N-оксид, оксадіазоліл-N-оксид, тіадіазоліл-Nтить карбоксильну частину; або сполука за фороксид, триазоліл-N-оксид, тетразоліл-N-оксид, і мулою (1) може існувати також у формі фармацевт.д. тично прийнятної солі, коли R2 є бічноланцюговий d) Термін "простий алкільний ланцюг, заміщезалишок амінокислоти що містить основну частиний арилом" (у подальшому: SAC-Ar) означає ну, або прямолінійний або розгалужений алкіл, який має R2 означає, крім того, Н; -(CH2)nOR7 де R7 є від 1 до 8 атомів вуглецю і є заміщений однією із SAC, -SC AC, -Ar або -SAC-Ar, a n=1 або 2; або вищеперелічених арильних гр уп. (CH2)nOC(=O)R8, де R 8 є -SAC, -SC AC, - Ar або e) Термін "природна амінокислота" охоплює SAC-Ar, a n=1 або 2. своїм значенням такі амінокислоти: гліцин, аланін, IV) А означає -(СН2)n- (n=0-4), -О-(СН2)П- (n=0валін, лейцин, ізолейцин, серин, треонін, цистеїн, 4) або -NR9-(CH2)n- (n=0-4), де R9 є -SAC, -SC AC, метіонін, пролін, аспартанову кислоту, аспарагін, Ar або -SAC-Ar. глутамінову кислоту, глутамін, лізин, аргінін, гістиV) В означає Н, -SAC, -SCAC, -Ar або -SAC-Ar, дин, фенілаланін, тирозин і триптофан. або f) Захисною групою у формі естеру є вуглевоVI) R і R1 можуть утворювати цикл разом з день, який має від 1 до 8 атомів вуглецю у прямоатомом вуглецю, до якого вони приєднані, де -Rлінійній або розгалуженій ізомерній формі. R1- є -(CH2)n-, -(CH2)n-O-(CH2) m- або -(CH2)n-NR10У даному описі використовуються такі скоро(CH2)m-, де n+m700мл), промили водою, просушили (безводний (3S)-5-(трет-бутокси)-3-{[(5-метил-3-феніл-4,5Na2SO4) і концентрували під зниженим тиском, дигідро-5-ізоксазоліл)карбоніл]аміно}-2,5одержавши зазначену в заголовку сполуку (4,77г, діоксопентил-2,6-дихлорбензоат (Іа) вихід 95%) у вигляді білого порошку. Цю сполуку Суміш карбокислотної похідної, одержаної в використовували в наступній реакції без подальДосліді 4 з виготовлення (VIla, 300мг, 1,46ммоль), шого очищання. аміноспиртової похідної, одержаної у Досліді 6 з Дослід 5 з виготовлення виготовлення (VIlla, 667мг, 1,1екв.) і HATU (722мг, (3S)-3-{[(бензилокси)карбоніл]аміно}-5-(трет1,3екв.) охолодили до 0°С, додали до неї розчин бутокси)-2-гідроксі-5-оксопентил-2,6триетиламіну (0,82мл, 4,0екв.) в DMF (5мл), і продихлорбензоат (ХІІа) вели реакцію утвореної суміші протягом 5 годин. 23 83240 24 Розчинник відігнали під зниженим тиском, а залидодали KF(4,53г, 2,5екв.) i суміш перемішали протягом двох годин, отримавши феноксиметилкетошок екстрагували етилацетатом (200мл´2), промили водою, водним розчином бікарбонату натрію нову похідну (ХІb). Цю сполуку розчинили в суміші метанолу (40мл) з THF (100мл) i провели її реакі водним розчином хлориду натрію, просушили цію з розчином NaBH4 (2,35г) у метанолі (40мл) (безводний Na 2SO4), концентрували під зниженим (при температурі в інтервалі від -10°С до кімнатної тиском і очистили на хроматографічній колонці, температури протягом двох годин). Реакцію зупиодержавши сполуку (ІХа) (810мг, ви хід 98%). До цієї сполуки в суміші з реагентом Деса-Мартена нили оцтовою кислотою і реакційну суміш піддали дистиляції під зниженим тиском для видалення (Dess-Martin) (1,70г, 3,0екв.) додали сухий ди хлометанолу Залишок екстрагували етилацетатом рметан (25мл), і суміш перемішали протягом однієї години при кімнатній температурі. Реакцію зупини(50мл´2), промили водою i водним розчином хлоли ізопропіловим спиртом (3мл). Тверду речовину риду натрію, просушили (безводний Na2SO4), конвидалили шляхом фільтрації під зниженим тиском центрували під зниженим тиском, i очистили розчерез целіт, і фільтрат екстрагували етилацетатом ділянням на хроматографічній колонці (етилацетат/гексан, 1:7), одержавши сполуку ХІІb (20мл´2), промили водою, насиченим водним роз(6,50г, вихід 50%) у діастереомерній формі, аміночином бікарбонату натрію і водним розчином хлогрупа якої, була захи щена бензилоксикарбонілом. риду натрію, просушили (безводний Na2SO4), кон1 центрували під зниженим тиском і провели Н-ЯМР (400МГц, CDCI3) d 7,3-7,2(m, 8H), попередню очистку методом колонкової хроматог5,9(m, 1H), 5,2(m, 4H), 4,7(m, 1H), 2,9(m, 1H),2,7(m, рафії (36% етилацетат/гексан), одержавши зазна1H), 1,4(s, 9H) чену в заголовку діастереомерну сполуку (780мг). Бензилоксикарбонільну гр упу отриманої таким 1 чином сполуки видалили (Pd/C) витримуванням в Н-ЯМР (400МГц, CDCI3 ) d 7,8(m, NH, 1H), атмосфері балонного водню, і в результаті одер7,6(m, 2H), 7,3(m, 3H), 7,2(m, 3H), 5,1-5,0(m, 2H), жали зазначену в заголовку сполуку в кількості 4,8(m, 1H), 3,8(m, 1H), 3,2(m, 1H), 2,9-2,8(m, 2H), 4,16г (вихід 95%). 1,7(s, 3H), 1,4(s, 9Н) 1 Приклад 2 Н-ЯМР (400МГц, D MSO-d 6) d 8,1(розшир., 2Н), (3S)-5-[(2,6-діхлорбензоїл)окси]-3-{[(5-метил-37,3(m, 5H), 5,6(m, 1H), 4,1-4,0 (m, 3H), 2,6(m, 2H), феніл-4,5-дигідро-5-ізоксазоліл)карбоніл]аміно}-41,4(s, 9H) оксопентанова кислота (Іаа) Приклад 3 Сполуку, одержану у Прикладі 1 (44мг) розчиТрет-бутил-(3S)-3-{[(5-метил-3-феніл-4,5нили в дихлорметані (2мл) і додали трифтороцтодигідро-5-ізоксазоліл)карбоніл]аміно}-4-оксо-5ву кислоту (1мл) при 0°С. Суміш перемішали профеноксипентаноат (Іb) тягом двох годин доти, аж поки вона повільно не Суміш карбокислотної похідної, одержаної в відігрілась до кімнатної температури, і потім конДосліді 4 з виготовлення (Vlla, 273мг, 1,33ммоль), центрували під зниженим тиском, одержавши в аміноспиртової похідної, одержаної в Досліді 7 з результаті зазначену в заголовку сполуку (Іаа) у виготовлення (Vlllb, 412мг, 1,1екв.) і HATU (657мг, стехіометричній кількості. 1,3екв.), охолодили до 0°С, додали до неї розчин 1 триетиламіну (0,74мл, 4,0екв.) в DMF (5мл), і проН-ЯМР (500МГц, CDCI3) d 8,1 (m, 1H), 7,5((m, вели реакцію утвореної суміші протягом 5 годин. 2H), 7,3(m, 3H), 7,2(m, 3H), 5,1-4,9(m, 2H), 4,9Розчинник видалили шляхом дистиляції під зни4,8(m, 1H), 3,8(m, 1H), 3,2(m, 1H), 1,7(m, 3H) женим тиском, а залишок екстрагували етилацетаДослід 7 з виготовлення Трет-бутил-(SS)-3-аміно-4-гідрокси-5том (200мл´2), промили водою, водним розчином феноксипентаноат (Vlllb) бікарбонату натрію і водним розчином хлориду натрію, просушили (безводний Na2SO4), концентДо N-бензилоксикарбоніл-b-третрували під зниженим тиском i очистили методом бутиласпартанової кислоти (10,0г, 31,0ммоль) і NMM (3,75мл, 1,1екв.) в атмосфері азоту додали колонкової хроматографії (30-40% Етилацетат/гексан), одержавши сполуку (ІХb) в кількості сухий тетрагідрофуран (120мл), і суміш витримали 545мг (вихід 88%). До цієї сполуки в суміші з реапри температурі -15°С. Після цього до неї додали гентом Деса-Мартена (Dess-Martin) (1,43г, 3,0екв.) ізобутилхлорформіат (4,22мл, 1,05екв.), і суміш додали сухий дихлорметан (25мл), і суміш переперемішали протягом приблизно 20 хвилин. Реагенти витримали в суміші при 0°С, а потім змішали мішали протягом однієї години при кімнатній температурі. Реакцію зупинили ізопропіловим спиртом (приблизно 30 хвилин) з розчином діазометану в (2мл). Тверду речовину видалили шляхом фільтетері (синтезованого із 2,0екв. 1-метил-3-нітро-1рації під зниженим тиском через целіт, а фільтрат нітрозогуанідину, 60мл), в результаті чого була утворена діазокетонова похідна. До суміші додали екстрагували етилацетатом (20мл´2), промили 30% НВr/АсОН (12,83мл, 2,0екв.), і через 30-60 водою, насиченим водним розчином бікарбонату хвилин утворилася бромметилкетонова похідна. натрію і водним розчином хлориду натрію, просуПродукт екстрагували етилацетатом, промили шили (безводний Na 2SO4), концентрували під знидвічі насиченим водним розчином бікарбонату женим тиском і піддали попередньому очищенню натрію і водним розчином хлориду натрію, просуметодом колонкової хроматографії (елюент: 25% шили (безводний Na 2SO4) і концентрували під етилацетат/гексан), отримавши зазначену в загозниженим тиском, одержавши бромметилкетонову ловку діастереомерну сполуку (540мг, вихід 99%). 1 похідну (12,9г) у стехіометричній кількості. Н-ЯМР (400МГц, CDCI3) d 7,8(ΝΗ, 1Η), 7,5(m, Одержану таким чином бромметилкетонову 2H), 7,3(m, 3H), 7,3(m, 1H), 7,1(m, 1H), 6,8(m, 2H), похідну (X, 12,9г, 31,0ммоль)і фенол (3,23г, 6,7(m, 1H), 4,9(s, 1H), 4,7-4,6(m, 2H), 3,7(d, J=17Гц, 1,2екв) розчинили в диметилформаміді (30мл), 25 83240 26 1H), 3,2(d, J=17Гц, 1Η), 2,9(m, 1H), 2,8(m, 1H), в Дослідах 5 і 6 з виготовлення, одержавши в ре1,7(s, 3H), 1,4(s, 9H). зультаті зазначену в заголовку сполуку із загальПриклад 4 ним виходом 72%. 1 (3S)-3-{[(5R)-метил-5-феніл-4,5-дигідро-5Н-ЯМР (400МГц, D MSO-d 6) d 8,2(розшир., 2Н), ізоксазоліл)карбоніл]аміно}-4-оксо-57,6-7,5(m, 1H), 5,9(m, 1H), 4,3-4,1(m, 3H), 3,6(m, феноксипентанова кислота (Ibb) 1H), 2,7(m, 1H), 1,4(s, 9H). Сполуку, одержану у Прикладі 3, (530мг, Приклад 5 1,136ммоль) розчинили в дихлорметані (6мл), і Трет-бутил-(3S)-3-5-{[(5-етил-5-феніл-4,5при 0°С додали трифтороцтову кислоту (3мл). Судигідро-5-ізоксазоліл)карбоніл]аміно}-4-оксо-5міш перемішали протягом двох годин доти, аж (2,3,5,6-тетрафторфенокси)пентаноат (Іс) поки вона повільно не відігрілась до кімнатної теСполуки із Дослідів 9 і 10 з виготовлення були мператури, і концентрували під зниженим тиском, піддані реакціям у відповідності з процесами, анаодержавши зазначену в заголовку сполуку (Ibb) логічними застосованим у Досліді 4 з виготовлен(465мг) зі стехіометричним виходом. ня і Прикладі 1, у результаті чого була одержана 1 Н-ЯМР (400МГц, CDCI3) d 7,5(m, 2H), 7,3(m, зазначена в заголовку сполука. 1 3H), 7,1(NH, 1H), 6,7(m, 5H), 5,0-4,6(m, 2H), 4,2(m, Н-ЯМР (400МГц, CDCI3) d 7,6(dd, J=3,6, 1,6Гц, 1H), 3,8(m, 1H), 3,2(m, 1H), 3,0-2,7(m, 2H), 1,6(s, 1H), 7,6(m, 2H), 7,4-7,3(m, 3H), 6,7(m, 1H), 5,13H) 4,9(m, 2H), 4,9-4,8(m, 1H), 3,7(dd, J=17,6, 17,2Гц, Дослід 8 з виготовлення 1Н), 3,3(1H, d, J=17,2Гц), 3,0-2,8(m, 1H), 2,8-2,7(m, Етил-2-етилакрилат (XVb) 1H), 2,1(m, 1H), 1,9(m, 1H), 1,4-1,3(два s, 9H), До CuCN (26,9г, попередньо просушеного під 1,0(m, 3H). вакуумом) додали в атмосфері азоту приблизно Приклад 6 500мл сухого тетрагідрофурану. С уміш витримали (3S)-3-{[(5-етил-3-феніл-4,5-дигідро-5при температурі -78°С, і до неї повільно, при меізоксазоліл)карбоніл]аміно}-4-оксо-5-(2,3,5,6ханічному перемішуванні додали 100мл метилматетрафтор фенокси)пентанова кислота (Ісс) гнійброміду (3,0Μ розчин у діетиловому етері). Сполуку Приклад 5 піддали реакції у відповідУтворену густу суміш перемішали протягом приності з процесом, аналогічним застосованому в близно 30 хвилин при -78°С. До суміші повільно Приклад 2, у результаті чого була одержана задодали етил-2-бромметилакрилат (28,9г, значена в заголовку сполука. 1 150ммоль, метод синтезу описаний у [Villieras, J, Н-ЯМР (400МГц, D MSO-d 6) d 7,6(розшир., 1Н), and Rambaud, M. Synthesis, 1982, 914], розчинений 7,6-7,5(m, 2Н), 7,4-7,3(m, 3H), 6,8-6,7(m, 1Н), 4,9приблизно в 30мл сухого те трагідрофурану. Тем4,8(m, 1Н), 4,5(розшир., 2Н), 3,7(d, J=16Гц, 1Н), пературу реакційної суміші протягом двох годин 3,3(d, J=16Гц, 1Н), 3,3-3,0(m, 1H), 2,8-2,7(m, 1H), повільно підвищили до рівня кімнатної. Реакцію 2,1(m, 1H), 2,0-1,9(m, 1H), 1,0(m, 3H) завершили повільним додаванням насиченого Мас-спектр: MS [M+H]+ 497 розчину хлориду амонію (~50мл). Реакційну суміш Дослід 11 з виготовлення профільтрували через целіт для видалення осаду, Етил-5-етил-3-(1-нафтил)-4,5-дигідро-5і потім промили діетиловим етером. Органічний ізоксазолкарбоксилат (VІс) шар промили водою і насиченим розчином бікар1-Нафтальдегід та етил-2-етилакрилат піддабонату натрію (300мл´2), просушили (безводний вали реакціям у відповідності з процесами, аналоNa2SO4) і концентрували під зниженим тиском, гічними застосованим у Дослідах 1, 2, i 3 з виготоодержавши 26,7г (стехіометричний вихід) прозорої влення, у результаті чого була одержана рідини. Рідину ідентифікували за допомогою 1Нзазначена в заголовку сполука 1 ЯМР-аналізу (500МГц, CDCI3), який підтвердив, що Н-ЯМР (400МГц, CDCI3) d 8,9(d, J=8,8Гц, 1H), отриманим продуктом була зазначена в заголовку 7,9-7,8(m, 2H), 7,6-7,4(m, 4H), 4,3-4,2(m, 2H), 4,0(d, сполука чистотою приблизно 75%(мас). J=17,2Гц, 1Н), 3,4(d, J=17,2Гц, 1 Η), 2,1-2,0(m, 2H), 1 Н-ЯМР (500МГц, CDCI3) d 6,12(1H, S), 1,3(t, 3H), 1,0(t, 3H) 5,50(1Η, S), 4,20(2H, q, J=7,3Гц), 2,31(2H, qt), Приклад 7 1,28(3H, t, J=7,3Гц), 1,07(3H, t, J=7,8Гц). Трет-бутил (3S)-3-({[5-етил-3-(1-нафтил)-4,5Дослід 9 з виготовлення дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5Етил-5-етил-3-феніл-4,5-дигідро-5(2,3,5,6-тетрафторфенокси)пентаноат (Id) ізоксазолкарбоксилат (VIb) Сполуки із Дослідів 11 і 10 з виготовлення підСполуку (XVa) Досліду 8 з виготовлення піддали реакціям у відповідності з процесами, аналодали реакції у відповідності з процесом, аналогічгічними застосованим у Досліді 4 з виготовлення і ним застосованому в Досліді 3 з виготовлення, Прикладі 1, у результаті чого була одержана заодержавши в результаті зазначену в заголовку значена в заголовку сполука. 1 сполуку. Н-ЯМР (400МГц, CDCI3) d 8,9(m, 1H), 7,91 Н-ЯМР (400МГц, CDCI3) d 7,6(m, 2H), 7,47,8(m, 3H), 7,6-7,4(m, 4H), 6,5-6,9(m, 1H), 5,1-4,9(m, 7,3(m, 3H), 4,3-4,2(m, 2H), 4,0(d, J=17,2Гц, 1H), 2H), 4,9(m, 1H), 3,9(dd, 1H), 3,5(d, J=17,2Γ4, 1Η), 3,4(d, J=17,2Гц, 1H), 2,1-2,0(m, 2H), 1,3(t, 3H), 1,0(t, 3,0-2,9(m, 1H), 2,8(m, 1H), 2,2(m, 1Н), 2,0(m, 1Н), 3H). 1,4-1,3(два s, 9Н), 1,1 (m, 3H). Дослід 10 з виготовлення Приклад 8 Трет-бутил-(3S)-3-аміно-4-гідрокси-5-(2,3,5,6(3S)-3-({[5-етил-3-(1-нафтил)-4,5-дигідро-5тетрафтор фенокси)пентаноат (Vlllc) ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,62,3,5,6-Тетрафторфенол піддали реакції у відтетрафтор фенокси)пентанова кислота (Idd) повідності з процесом, аналогічним застосованому 27 83240 28 Сполуку із Прикладу 7 піддали реакції у відполення. Утворена в результаті цільова сполука в відності з процесом, аналогічним застосованому в активній хіральній ізомерній формі була відділена Прикладі 2, у результаті чого була одержана заза допомогою HPLC-рідинної хроматографії висозначена в заголовку сполука. кого розрізняння на хіральній OD-колонці (Daicel 1 Н-ЯМР (400МГц, CDCI3) d 8,8(m, 1H), 7,9Chemical Industries, 2,00см´25 см, ODOOCJ-IC005, 7,7(m, 3H), 7,6-7,4(m, 4H), 6,7 (m, 1H), 4,9(m, 1H), 3% і-PrOH у гексані, 220нм) і використовувалася в 4,5(розшир., 2Н), 3,9(d, J=17,2Гц, 1Н), 3,5(d, наступній реакції. 1 J=17,2Гц, 1Н), 3,1-2,9(m, 1H), 2,8-2,7(m, 1Н), 2,2(m, Н-ЯМР (400МГц, CDCI3) d 9,25(m, 1H), 8,55(d, 1Н), 2,0(m, 1Н), 1,0(m, 3H) 1H), 7,85(d, 1H), 7,74-7,65(m, 3H), 4,29(m, 2H), Мас-спектр: [M+MeOH+Na]+, 601 4,13(d, 1H), 3,71(d, 1H), 2,11 (m, 2H), 1,33(t, 3H), Дослід 12 з виготовлення 1,06(t, 3H) Етил-5-етил-3-(2-нафтил)-4,5-дигщро-5Приклад 11 13оксазолкарбоксилат (VId) Трет-бутил-(3S)-3-({[5-етил-3-(1-ізохінолініл)2-Нафтальдегід і етил 2-етилакрилат піддали 4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5реакціям у відповідності з процесами, аналогічни(2,3,5,6-тетрафторфенокси)пентаноат (Іf) ми застосованим у Дослідах 1, 2 і 3 з виготовленСполуки із Дослідів 13 і 10 з виготовлення підня, у результаті чого була одержана зазначена в дали реакціям у відповідності з процесами, аналозаголовку сполука. гічними застосованим у Досліді 4 з виготовлення i 1 Н-ЯМР (500МГц, CDCI3) d 8,7(d, J=8,8Гц, 1Н), Прикладі 1, у результаті чого була одержана за7,8-7,7(m, 2H), 7,5-7,3 (m, 4H), 4,3-4,2(m, 2H), 4,0(d, значена в заголовку сполука 1 J=17,2Гц, 1Н), 3,4(d, J=17,2Гц, 1Н), 2,1-2,0(m, 2H), Н-ЯМР (400МГц, CDCI3) d 9,14(m, 1H), 8,53(m, 1,3(t, 3H), 1,0(t, 3H) 1H), 7,91-7,85(m, 2H), 7,74-7,64(m, 3H), 6,73Приклад 9 6,62(m, 1H}, 5,30-4,91 (m, 3H), 4,09(два d, 1H), Трет-бутил-(3І)-3-({[5-етил-3-(2-нафтил)-4,53,72(два d, 1H), 3,04-2,76(m, 2H), 2,24(m, 1H), дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-52,04(m, 1H), 1,45 і 1,35(два s, 9H), 1,08(два t, 3H). (2,3,5,6-тетрафторфенокси)пентаноат (Iе) Приклад 12 Сполуки із Дослідів 12 і 10 з виготовлення під(3S)-3-({[5-етил-3-(1-ізохінолініл)-4,5-дигідро-5дали реакціям у відповідності з процесами, аналоізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,6гічними застосованим у Досліді з виготовлення 4 і тетрафтор фенокси)пентанова кислота (Iff) Прикладі 1, отримавши зазначену в заголовку Сполуку із Прикладу 11 піддали реакції у відсполуку. повідності з процесом, аналогічним застосованому 1 в Прикладі 2, у результаті чого отримали зазначеН-ЯМР (400МГц, CDCI3) d 7,8-7,7(m, 6H), 7,5(m, 2H), 6,7 і 6,5 (m, 1Н), 5,1-4,9(m, 2Н), 4,9ну в заголовку сполуку. 1 4,8(m, 2H), 3,8(dd, J=16Гц, 1Н), 3,4(d, J=16Гц, 1Н), Н-ЯМР (400МГц, DMSO-d6) d 9,02(m, 1H), 3,0(m, 1H), 2,8(m, 1H), 2,8-2,7(m, 1H), 2,2-2,1(m, 8,76(m, 1H), 8,59(m, 1H), 8,08-7,73(m, 4H), 7,611H), 2,0(m, 1H), 1,4-1,3 (два s, 9H), 1,1-1,0(m, 3H) 7,32(m, 1H), 5,19-5,10(m, 2H), 4,93-4,65(m, 1H), Приклад 10 3,91 (два d, 1Н), 3,68(два d, 1H), 2,91-2,52(m, 2H), (3S)-3-({[5-етил-3-(2-нафтил)-4,5-дигідро-52,10-1,94(m, 2H), 0,94(два t, 3H). ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3р,6Мас-спектр: М+Н 548 тетрафтор фенокси)пентанова кислота (lee) Приклад 13 Сполуку із Прикладу 9 позбавили захисту у Трет-бутил-3-({[(5-етил-3-(1-ізохінолініл)-4,5відповідності з процесом, аналогічним описаному дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4в Прикладі 2, і утворені ізомери були розділені за оксопентаноат (Іg) допомогою препаративної тонкошарової хроматоСполуку із Досліду 13 з виготовлення і третграфї (TLC), в результаті чого були одержані такі бутил-3-аміно-5-фтор-4-гідроксипентаноат піддали дві сполуки. реакціям у відповідності з процесом, аналогічним Слабкополярний діастереомер: застосованому в Досліді 4 з виготовлення і При1 Н-ЯМР (400МГц, D MSO-d6) d 12,4(розшир., кладі 1 у результаті чого була одержана зазначена 1Н), 8,7(розшир., 1Н), 8,1(s, 1H), 7,9-8,0(m, 3H), в заголовку сполука. 1 7,8-7,9(m, 1Н), 7,5-7,6(m, 3H), 5,2(розшир., 2Н), Н-ЯМР (400МГц, CDCI3) d 9,15(m, 1H), 8,55(d, 4,7(розшир., 1Н), 3,8(d, J=17,2Гц, 1Н), 3,5(d, 1H), 7,87-7,66(m, 5H), 5,22-4,89(m, 3H), 4,12(два d, J=17,6Гц, 1Н), 2,7(m, 1Н), 2,5(m, 1Н), 2,0(m, 1Н), 1H), 3,72(два d, 1H), 3,05-2,75(m, 2H), 2,22 (m, 1H), 1,9(m, 1Н), 0,9-0,8(m, 3H). 2,04(m, 1H), 1,45 і 1,34(два s, 9Н), 1,07(два t, 3H) Мас-спектр. MS [M+H]+ 547 Приклад 14 Високополярний діастереомер: 3-({[5-Етил-3-(1-ізохінолініл)-4,5-дигідро-51 ізоксазоліл]карбоніл}аміно)-5-фтор-4Н-ЯМР (400МГц, D MSO-d 6) d 8,6(розшир., 1Н), 8,2(s, 1H), 8,0-7,9(m, 3H), 7,9(m, 1Н), 7,6(m, 2Н), оксопентанова кислота (Igg) 7,4(m, 1Н), 5,0(розшир., 2Н), 4,8(m, 1Н), 3,9(d, Сполуку із Прикладу 13 піддали реакції у відJ=17,6Гц, 1Н,), 3,6(d, J=17,6Гц, 1Н,), 2,9-2,7(m, 2Н), повідності з процесом, аналогічним застосованому 2,1-2,0(m, 1Н), 2,0-1,9(m, 1Н), 0,9(m, 3H) в Прикладі 2, в результаті чого була одержана Дослід 13 з виготовлення зазначена в заголовку сполука 1 Етил-5-етил-3-(1-ізохінолініл)-4,5-дигідро-5Н-ЯМР (400МГц, DMSO-d6) d 9,03(m, 1H), ізоксазолкарбоксилат (VIe) 8,67-8,59(m, 2Н), 8,08(d, 1H), 7,97-7,78(m, 3H), 1-Ізохінолінальдегід і етил-2-етилакрилат під5,26-5,07(m, 2H), 4,75(m, 1H), 3,94(два d, 1H), дали реакціям у відповідності з процесами, анало3,67(два d, 1H), 2,88-2,58(m, 2Н), 2,07-1,94(m, 2Н), гічними застосованим у Дослідах 1, 2 і 3 з виготов0,96(два t, 3H) 29 83240 30 Мас-спектр: М+Н 402 Дослід 15 з виготовлення Приклад 15 Етил-5-етил-3-(4-хінолініл)-4,5-дигідро-5Етил-3-({[5-етилІ-3-(1-ізохінолініл)-4,5-дигідроізоксазолкарбоксилат (Vlg) 5-ізоксазоліл]карбоніл}аміно)-5-фтор-44-Хінолінальдегід і етил-2-етилакрилат були оксопентаноат (Ihh) піддані реакціям у відповідності з процесами, анаСполуку із Прикладу 14 піддали реакціям у логічними застосованим в Дослідах 1, 2, і 3 з виговідповідності з методом, описаним у [Tetrahedron товлення, в результаті чого була одержана зазнаLetters, 1994, 35(52), 9693-9696], у результаті чого чена в заголовку сполука. 1 одержали зазначену в заголовку сполук у. Н-ЯМР (400МГц, CDCI3) d 8,95(d, 1H), 8,89(m, 1 Н-ЯМР (400МГц, CDCI3) d 9,15(m, 1H), 8,55(d, 1H), 8,11(d, 1H), 7,83(m, 1H), 7,71(m, 1H), 7,65(d, 1H), 7,89-7,67(m, 5H), 5,23-4,94(m, 3H), 4,18(m, 1H), 4,27(m, 2H), 4,01 (d, 1H), 3,67(d, 1H), 2,10 (m, 2H), 4,11(два d, 1Н), 3,72(два d, 1H), 3,08-2,82 (m, 2H), 1,31(t, 3H), 1,02(t, 3H) 2H), 2,22(m, 1H), 2,05(m, 1Н), 1,29-1,04(m, 6H). Прикладів Дослід 14 з виготовлення Трет-бутил-3-({[5-етил-3-{4-хінолініл)-4,5Метил-5-ізопропіл-3-(1-ізохінолініл)-4,5дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4дигідро-5-ізоксазолкарбоксилат) і розділяння (Vlf) оксопентаноат (Іі) Були проведені реакції 1-ізохінолінальдегіду і Сполука із Досліду 15 з виготовлення і третметил-2-ізопропілакрилату у відповідності з процебутил-3-аміно-5-фтор-4-гідроксипентаноат були сами, аналогічними застосованим у Дослідах з піддані реакціям у відповідності з процесами, анавиготовлення 1,2 і 3, у результаті чого була одерлогічними застосованим у Досліді з виготовлення жана зазначена в заголовку сполука. Із цієї сполу4 і Прикладі 1, у результаті чого була одержана ки за допомогою препаративної HPLCзазначена в заголовку сполука. 1 хроматографії на хіральній OD-колонці (Daicel Н-ЯМР (400МГц, CDCI3) d 8,97(d, 1H), 8,89(m, Chemical Industries, 2,00см´25см, 1H), 8,17(d, 1H), 7,87-7,64(m, 3H), 7,36(d, 1H), 5,21ODOOCMC005,5% і-PrOH у гексані, 14мл/хв., 4,93(m, 3H), 3,93(два d, 1Н), 3,48(два d, 1H), 3,05220нм) був виділений (5R)-активний хіральний 2,78(m, 2H), 2,24(m, 1H), 2,03(m, 1H), 1,46 і ізомер (час витримування: 9,7хв.-11,7 хв.) (інший 1,33(два s, 9H), 1,06(два t, 3H). (5S)-ізомер був елюйований протягом часу витриПриклад 19 мування 15,3-20,1хв.), який використовувався в 3-({[5-Етил-3-(4-хінолініл)-4,5-дигідро-5наступній реакції (див. Дослід 23 з виготовлення у ізоксазоліл]карбоніл}аміно)-5-фтор-4випадку розділяння після гідролізу). оксопентанова кислота (Ijj) 1 Сполуку із Прикладу 18 піддали реакції у відН-ЯМР (500МГц; CDCI3) d 9,24(m, 1H), 8,55(d, повідності з процесом, аналогічним застосованому 1H), 7,85(d, 1H), 7,72(t, 3H), 7,67(m, 2H), 4,11(d, в Прикладі 2, у результаті чого була одержана 1H), 3,83(s, 3H), 3,74(d, 1H), 2,50(септет, 1Н), зазначена в заголовку сполука. 1,07(d, 3H), 1,02(d, 3H). 1 Приклад 16 Н-ЯМР (400МГц, DMSO-d6) d 9,16-9,10(m, 2H), Трет-бутил-5-фтор-3-({[(5R)-5-ізопропіл-3-(18,25-7,86(m, 5H), 5,20(розшир , 2Н), 4,75(m, 1Н), ізохінолініл)-4,5-дигідро-54,00-3,89(два d, 1Н), 3,73(два d, 1Н), 2,87-2,71 (m, ізоксазоліл]карбоніл}аміно)-4-оксопентаноат (Ih) 2Н), 2,26-2,05(m, 2Н), 1,07(два t, 3H). Сполуку із Досліду 14 з виготовлення і третМас-спектр: М+Н 402 бутил-3-аміно-5-фтор-4-гідроксипентаноат піддали Дослід з виготовлення 16 реакціям у відповідності з процесами, аналогічниЕтил-3-(бензотіофен-2-іл)-5-етил-4,5-дигідроми застосованим у Досліді 4 з виготовлення і При5-ізоксазолкарбоксилат (VIh) клад 1, у результаті чого була одержана зазначена Бензотіофен-2-альдегідоксимну похідну в заголовку сполука. (400мг, 2,26ммоль), виготовлену у відповідності з 1 процесом, аналогічним описаному в Досліді 1 з Н-ЯМР (500МГц, CDCI3) d 9,14(m, 1H), 8,55(d, виготовлення, розчинили в THF (25мл) і суміш ви1H), 7,87-7,65(m, 5H), 5,23-4,93(m, 2Н), 4,90(m, тримали при температурі 0°С. Етил-2-етилакрилат 1Н), 4,05-4,00(два d, 1Н), 3,84-3,79(два, 1Н), 3,06(434мг, 1,5екв.) i триетиламін (7 крапель) розчини2,74(m, 2Н), 2,40(m, 1Н), 1,45 і 1,34(два s, 9Н), ли в THF (5мл). Приготований таким чином розчин 1,12-1,07(m, 6Н) повільно додали до суміші, описаної вище. Крім Приклад 17 того, до цієї суміші додали розчин гіпохлориту на5-Фтор-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)трію (6,0мл). Приготований таким чином реакцій4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4ний розчин нагріли до кімнатної температури і пеоксопентанова кислота (liі) ремішували протягом 4 годин. Потім додали воду Сполуку із Прикладу 16 піддали реакції у від(20мл), і суміш екстрагували етилацетатом повідності з процесом, аналогічним застосованому в Прикладі 2, у результаті чого була одержана (40мл´2), промили водним розчином хлориду назазначена в заголовку сполука ((5S)-ізомер, lii-u, трію (20мл), просушили над сульфатом магнію, був отриманий за допомогою такого самого процепрофільтрували і концентрували під зниженим су). тиском. Залишок очистили колонковою хроматог1 рафією (20% етилацетат/гексан), у результаті чого Н-ЯМР (400МГц, DMSO-d6) d 9,00(m, 1H), була одержана зазначена в заголовку сполука 8,63-8,48(m, 2H), 8,08(d, 1H), 7,97(m, 1H), 7,87(121мг, вихід 18%). 7,76(m, 2H), 5,31-4,82(розшир., 2Н), 4,74(m, 1Н), 1 3,91(два d, 1 Η), 3,73(два d, 1H), 2,88-2,61 (m, 2H), Н-ЯМР (400МГц, CDCI3) d 7,82-7,75(m, 2H), 2,33(m, 1H), 0,98(m, 6H). 7,40-7,32(m, 3H), 4,28(m, 2H), 3,90(d, 1H), 3,31(d, Мас-спектр: М+Н 416 1H), 2,07(m, 2H), 1,33(t, 3H), 1,01(t, 3H) 31 83240 32 1 Приклад 20 Н-ЯМР (400МГц, CDCI3) d 7,85-7,79(m, 1H), Трет-бутил-3-({[3-(бензотіофен-2-іл)-5-етилІ7,57(m, 1H), 7,37-7,26(m, 2H), 7,13(m, 1H), 6,754,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-46,49(m, 1H), 5,12-4,90(m,3H), 3,95(два d, 1H), 3,89 оксопентаноат (Іj) (два s, 3H), 3,45(два d, 1H), 3,03-2,79(m, 2Н), Сполуку із Досліду з виготовлення 16 і трет2,44(два s, 3H), 2,22(m, 1Н), 2,01 (m, 1Н), 1,58 i бутил-3-аміно-5-фтор-4-гідроксипентаноат піддали 1,37(два s,9H), 1,05 (два t, 3H). реакціям у відповідності з процесами, аналогічниПриклад 23 ми застосованим у Досліді 4 з виготовлення 4 і (3S)-3-({[3-(1,3-диметил-1H-індол-2-іл)-5-етилПрикладі 1, у результаті чого була одержана за4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5значена в заголовку сполука. (2,3,5,6-тетрафторфенокси)пентанова кислота (III) 1 Н-ЯМР (400МГц, CDCI3) d 7,83-7,68(m, 3H), Сполуку із Прикладу 22 піддали реакції у від7,42-7,35(m, 3H), 5,21-4,88 (m, 3H), 3,80(два d, 1H), повідності з процесом, аналогічним застосованому 3,38(два d, 1H), 3,03-2,78(m, 2H), 2,17(m, 1H), 2,01 в Прикладі 2, у результаті чого була одержана (m, 1H), 1,46 і 1,38(два s, 9Н), 1,03(два t, 3H) сполука, зазначена в заголовку. 1 Приклад 21 Н-ЯМР (400МГц, D MSO-d6) d 8,67(розшир., 3-({[3-(бензотіофен-2-іл)-5-етилІ-4,5-дигідро-51Η), 7,61-7,43(m, 3H), 7,27(m, 1H), 7,08(m, 1Н), ізоксазоліл]карбоніл}аміно)-5-фтор-45,20(розшир., 2Н), 4,83(m, 1Н), 3,84(два s, 3H), оксопентанова кислота 3,76(два d, 1Н), 3,59(два d,1H), 2,91-2,60(m, 2H), (3-({[3-(бензотіофен-2-іл)-5-етил-4,5-дигідро-52,50(два s, 3H), 2,07-L91(m, 2H), 0,95(два t, 3H) ізоксазоліл]карбоніл}аміно)-5-фтор-4Приклад 24 оксопентанова кислота) (Ikk) Трет-бутил-3-({[3-(1,3-диметил-1H-індол-2-іл)Сполуку із Прикладу 20 піддали реакції у від5-етил-4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5повідності з процесом, аналогічним застосованому фтор-4-оксопентаноат (ІІ) в Прикладі 2, у результаті чого була одержана Сполуку із Досліду 17 з виготовлення і третзазначена в заголовку сполука бутил3-аміно-5-фтор-4-гідроксипентаноат піддали 1 Н-ЯМР (400МГц, DMSO-d6) d 8,63(m, 1H), реакціям у відповідності з процесом, аналогічним 8,11-7,79(m, 3H), 7,47-7,36(m, 2H), 5,24-5,06(m, застосованому в Досліді 4 з виготовлення і При2H), 4,73(m, 1H), 3,79(два d, 1H), 3,53(два d, 1H), кладі 1, у результаті чого була одержана сполука, 2,83-2,58(m, 2H), 2,03-1,86(m, 2Н), 0,91 (два t, 3H). зазначена в заголовку. 1 Мас-спектр: М+Н 407 Н-ЯМР (400МГц, CDCI3) d 7,79(m, 1H), 7,60(m, Дослід 17 з виготовлення 1H), 7,32(m, 2H), 7,13(m, 1H), 5,20-4,90(m,3H), Етил-3-(1,3-диметил-1Н-індол-2-іл)-5-етил-4,53,97-3,89(m, 4H), 3,46(два d, 1H), 3,03-2,77(m, 2H), дигідро-5-ізоксазолкарбоксилат (Vli) 2,21 (m, 1H), 2,01 (m, 1H), 1,46 11,38(два s, 9H), 1,3-Диметил-1Н-індол-2-альдегідоксимну похі1,05(два t, 3H). дну (356мг, 2,07ммоль) розчинили в дихлорметані Приклад 25 (20мл) і суміш витримали при температурі 0°С. 3-({[3-(1,3-Диметил-1H-індол-2-іл)-5-етил-4,5Етил-2-етилакрилат (345мг, 1,3екв.) і триетиламін дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4(6 крапель) розчинили в дихлорметані (5мл). оксопентанова кислота (Imm) Отриманий таким чином розчин повільно додали Сполуку із Прикладу 24 піддали реакції у віддо розчину, описаного вище. Крім того, до нього повідності з процесом, аналогічним застосованому додали розчин гіпохлориту натрію (5,5мл). Пригов Прикладі 2, у результаті чого була одержана тований таким чином реакційний розчин нагріли до сполука, зазначена в заголовку. 1 кімнатної температури і перемішували протягом 4 Н-ЯМР (400МГц, DMSO-d6 ) d 8,68(розшир., годин. До нього додали воду (20мл), і суміш екст1Н), 7,60(m, 1H), 7,45(m, 1H), 7,26(m, 1Н), 7,07(m, рагували дихлорметаном (40мл´2), промили вод1Н), 5,20(розшир., 2Н), 4,81 (m, 1Н), 3,84(два s, ним розчином хлориду натрію (20мл), просушили 3H), 3,76 (два d, 1Н), 3,59(два d, 1Н), 2,94-2,59(m, над сульфатом магнію, профільтрували і концент2Н), 2,38(два s, 3H), 2,07-1,91 (m, 2Н), 0,95(два t, рували під зниженим тиском. Залишок очистили за 3H) допомогою колонкової хроматографії (15% етилаМас-спектр: М+Н 418 цетат/гексан), у результаті чого була одержана Дослід 18 з виготовлення Етил-5-етил-3-(1зазначена в заголовку сполука (230мг, вихід 35%). нафтилметил)-4,5-дигідро-5-ізоксазолкарбоксилат 1 Н-ЯМР (400МГц, CDCI3) d 7,60(d, 1H), 7,31(m, (Vlj) 2H), 7,12(m, 1H), 4,29(m, 2H), 3,98(d, 1H), 3,94(s, 1-Нафтилацетальдегід і етил 2-етилакрилат 3H), 3,40(d, 1H), 2,47(s, 3H), 2,08(m, 2H), 1,34(t, піддали реакціям у відповідності з процесами, 3H), 1,04(t, 3H) аналогічними застосованим у Дослідах 1, 2, i 3 з Мас-спектр: М+Н 315 виготовлення, у результаті чого була одержана Приклад 22 зазначена в заголовку сполука 1 Трет-бутил-(3S)-3-({[3-(1,3-диметил-1Н-індолН-ЯМР (500МГц, CDCI3) d 8,1-8,0(d, J=8Гц, 2-іл)-5-етил-4,5-дигідро-51Н), 7,8(d, J=7,6Гц, 1Н,), 7,8-7,7(d, J=8Гц, 1Н), 7,5ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,67,4(m, 2Н), 7,4-7,3(m, 2Н), 4,1-4,0(m, 4Н), 3,1(d, тетрафтор фенокси)пентаноат (Ік) J=17,6Гц, 1Н), 2,6(d, J=17,6Гц, 1Н), 1,8-1,7(m, 2Н), Сполуки із Дослідів 17 і 10 з виготовлення під1,2(t, 3H), 0,7(t, 3H). дали реакціям у відповідності з процесами, аналоПриклад 26 гічними застосованим у Досліді 4 з виготовлення і Трет-бутил-(3S)-3-({[5-етил-3-(1Прикладі 1, у результаті чого була одержана занафтилметил)-4,5-дигідро-5значена в заголовку сполука 33 83240 34 ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2,3,5,6DMF, 82%). У результаті була одержана зазначена тетрафтор фенокси)пентаноат (Im) в заголовку сполука. 1 Сполуки із Дослідів 18 i 10 з виготовлення підН-ЯМР (500МГц, CDCI3) d 8,20(m, 1H), 7,81 (d, дали реакціям у відповідності з процесами, анало1H), 7,55-7,42(m, 3H), 7,36(m, 1H), 6,88(d, 1H), 5,01 гічними застосованим у Досліді з виготовлення 4 і (dd, 2H), 4,22(m, 2H), 3,61 (d, 1H), 3,07(d, 1H), Прикладі 1, у результаті чого була одержана за1,97(m, 2H), 1,27(t, 3H), 0,93(t, 3H). значена в заголовку сполука. Приклад 30 1 (3S)-3-[({5-Етил-3-[(1-нафтилокси)метил]-4,5Н-ЯМР (400МГц, CDCI3) d 8,0(m, 1H), 7,8(m, 1H), 7,8(m, 1H), 7,7(m, 1H), 7,5(m, 2H), 7,4-7,3(m, дигідро-5-ізоксазоліл}карбоніл)аміно]-4-оксо-52H), 6,7(m, 1H), 5,0-4,9(m t 2H), 4,9-4,8(m, 1H), 4,2(2,3,5,6-тетрафторфенокси)пентанова кислота 4,0(m, 2H), 3,1 (dd, J=24,8Гц, 1H), 2,9-2,6(m, 3H), (Ірр) 1,9(m, 1H), 1,7(m, 1H), 1,4(два s, 9H), 0,8(m, 3H). Сполуки із Дослідів з виготовлення 19 і 10 підПриклад 27 дали реакціям у відповідності з процесом, аналогі(3S)-3-({[5-етил-3-(1-нафтилметил)-4,5чним застосованому в Досліді 4 з ви готовлення і дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5Прикладах 1 і 2, у результаті чого була одержана (2,3,5,6-тетрафторфенокси)пентанова кислота сполука, зазначена в заголовку. 1 (Inn) Н-ЯМР (400МГц, D MSO-d6) d 8,51(розшир., Сполуку із Прикладу 26 піддали реакції у від1Н), 8,13(m, 1H), 7,87(m, 1H), 7,54-7,38(m, 5Н), повідності з процесом, аналогічним застосованому 7,02(m, 1Н), 5,18-4,97(m, 4Н), 4,71 (m, 1Н), в Приклад 2, у результаті чого була одержана за3,58(два d, 1H), 3,21 (два d, 1H), 2,68(m, 2Н), значена в заголовку сполука. 1,97(m, 1Н), 1,81(m, 1Н), 0,86(два t, 3H) 1 Н-ЯМР (400МГц, D MSO-d6) d 12,3(розшир., Мас-спектр: М+Н 577 1Н), 8,4(розшир., 1Н), 8,0(m, 1H), 7,9(m, 1Н), 7,8(m, Приклад 31 1Н), 7,5-7,4(m, 5Н), 5,0(розшир., 2Н), 4,7(m, 1Н), (3S)-3-{[(3-{[(4-Хлор-1-нафтил)окси]метил}-54,0(s, 2Н), 3,3(m, 1Н), 3,1(m, 1Н), 2,8(m, 2Н), 2,5(m, етил-4,5-дигідро-5-ізоксазоліл)карбоніл]аміно}-41Н), 1,8(m, 1Н), L7(m, 1H), 0,8(m, 3H). оксо-5-(2,3,5,6-тетрафторфенокси)пентанова кисMS [M+H]+ 561 лота (Iqq) Приклад 28 Була проведена реакція похідної брому, отри(3S)-5-(трет-бутокси)-3-[({5-етил-3-[2-(1маної як проміжний продукт підчас проведення нафтил)етил]-4,5-дигідро-5Досліду 19 з виготовлення, і 4-хлор-1-нафтолу у ізоксазоліл}карбоніл)аміно]-2,5-діоксопентил-2,6відповідності з процесом, аналогічним застосовадихлорбензоат (Іn) ному в Досліді 19 з виготовлення. У результаті був 1-Нафтилпропіональдегід і сполуку з Досліду 6 отриманий етил-5-етил-3-[(4-хлор-1з виготовлення піддали реакціям у відповідності з нафтилокси)етил]-4,5-дигідро-5процесом, аналогічним застосованому в Дослідах ізоксазолекарбоксилат, який піддавали наступним 1, 2, 3 і 4 з виготовлення і Прикладі 1, у результаті реакціям у відповідності з процесом, аналогічним чого була одержана зазначена в заголовку сполуописаному в Досліді 4 з виготовлення ι Прикладах ка. 1 i 2, у результаті чого була одержана зазначена в 1 заголовку сполука. Н-ЯМР (400МГц, CDCI3) d 8,00(d, 1H), 7,85(m, 1 1H), 7,76(m, 2H), 7,57-7,28(m, 7H), 7,34-7,27(m, Н-ЯМР (400МГц, DMSO-d6) d 8,65(m, 1H), 3H), 5,20-5,05(m, 2H), 4,94 і 4,88(два m, 1H), 3,398,24-8,09(m, 2H), 7,78-7,35(m, 4H), 7,06(m, 1H), 3,27(m, 3H), 2,97-2,72(m, 5Н), 2,07(m, 1H), 1,86(m, 5,17-5,07(m, 4H), 4,82-4,69(m, 1H), 3,45(два d, 1Н), 1H), 1,46 і 1,45(два s, 9H), 1,00 і 0,96(два t,3H). 3,23(два d, 1H), 2,83-2,52(m, 2Н), 1,96-1,79(m, 2Н), Приклад 29 0,86(два t, 3H) (3S)-5-[(2,6-діхлорбензоїл)окси]-3-[({5-етил-3Мас-спектр· М+Н 611 [2-(1-нафтил)етил]-4,5-дигідро-5Дослід 20 з виготовлення ізоксазоліл}карбоніл)аміно]-4-оксопентанова кисТрет-бутил-(3S)-3-аміно-4-гідроксибутаноат лота (Іоо) До N-бензилоксикарбоніл-b-третСполуку з Прикладу 28 піддали реакції у відбутиласпартанової кислоти (3,0г, 9,28ммоль) і повідності з процесом, аналогічним застосованому NMM (1,12мл, 1,1екв.) додали сухий тетрагідрофув Прикладі 2, у результаті чого була одержана ран (20мл) в атмосфері азоту. Реакційний розчин сполука, зазначена в заголовку. витримали при температурі 0°С. До розчину дода1 Н-ЯМР (400МГц, D MSO-d 6) d 8,45(bd, 1H), ли ізобутилхлорформіат (1,26мл, 1,05екв.), і утво8,06(d, 1H), 7,90(d, 1H), 7,77(d, 1H), 7,60-7,37(m, рену суміш перемішали протягом приблизно 40 7H), 5,21-5,03(m, 2H), 4,73(m, 1H), 3,06(m, 2H), хвилин. Отриману таким чином суспензію профі2,65(bd, 4H), 1,91 i 1,74(два m, 2H), 0,84(m, 3H). льтрували в атмосфері азоту, і утворений розчин Дослід 19 з виготовлення додали до розчину NaBH4 (702мг, 2,0екв.) [метаЕтил-5-етил-3-[(1-нафтилокси)метил]-4,5нол (10мл)-сухий тетрагідрофуран (20мл)] при дигідро-5-ізоксазолкарбоксилат (\/ІІ) 78°С. Утворену суміш повільно підігріли до кімнатБула проведена реакція похідної 2ної температури (протягом двох годин). Реакцію нітроетанолпіранілу [Synthesis, 1993, 72, 1206зупинили оцтовою кислотою (2,3мл), і реакційний 1208] з етил-2-етилакрилатом, а її продукт позбарозчин піддали дистиляції під зниженим тиском вили захисту, отримавши етил-5-етил-(3для видалення метанолу. Залишок екстрагували гідроксиметил)-4,5-дигідро-5-ізоксазолкарбоксилат етилацетатом (50мл´2), промили водою і водним (23%). Цю сполуку піддали бромуванню (CBr4, розчином хлориду натрію, просушили (безводний PPh3l 94%), а потім - реакції з 1-нафтолом (NaH, Na2SO4), концентрували під зниженим тиском, і 35 83240 36 очистили сепарацією на хроматографічній колонці 2Н), 4,02(d, 1Н), 3,81(d, 1Н), 2,58(m, 2H), 2,43(m, (етилацетат/гексан, 1:5) отримавши спиртову спо1H), 1,36(s, 9H), 1,27(t, 3H), 1,07 і 1,06(два d, 6H). луку (2,52г, ви хід 88%). Приклад 33 Бензилоксикарбонільну гр упу отриманої таким (3S,4Е)-6-етокси-3-({[(5R)-5-ізопропіл-3-(1чином сполуки видалили (Pd/C) в атмосфері баізохінолініл)-4,5-дигідро-5лонного водню протягом однієї години, у результаізоксазоліл]карбоніл}аміно)-6-оксо-4-гексенова ті чого була одержана зазначена в заголовку спокислота (Іrr) лука (Вихід 100%). Сполуку з Прикладу 32 піддали реакції у від1 повідності з процесом, аналогічним застосованому Н-ЯМР (400МГц, DMSO-d6) d 4,60(bs, 1H), в Прикладі 2, у результаті чого була одержана 3,2l(m, 2H), 2,96(m, 1H), 2,41 (dd, 1H), 2,03(dd, 1H), зазначена в заголовку сполука. 1,40(s, 9H). 1 Н-ЯМР (500МГц, MeOD-d3) головного ізомеру Дослід 21 з виготовлення Трет-бутил-(3S)-4-гідрокси-3-({[(5R)-5d 9,04(d, 1H), 8,61 (d, 1H), 8,52(d, 1Н), 7,95(4 1Н), ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-57,81-7,68(m, 3H), 6,94(dd, 1Н), 6,00(dd, 1Н), 5,01(m, ізоксазоліл]карбоніл}аміно)бутаноат (XVI) 1Н), 4,17(qt, 2H), 3,90(d, 1H), 3,82(d, 1H), 2,71 (d, Сполуку з Досліду 14 з виготовлення піддали 2H), 2,39(septet, 1H), 1,26(t, 3H), 1,07 11,06(два d, реакції у відповідності з процесом, аналогічним 6H). застосованому в Досліді 4 з виготовлення, в реМас-спектр: Μ+Η 454 зультаті чого одержали активну карбокислотну Приклад 34 похідну (Vllf). Суміш цієї активної карбокислотної Трет-бутил-(3S,4E)-3-({[(5R)-5-ізопропіл-3-(1похідної (Vllf, 224мг, 0,79ммоль), аміноспиртової ізохінолініл]карбоніл}аміно)-5-(метилсульфоніл)-4похідної, одержаної в Досліді 20 з виготовлення пентеноат (Ir) (166мг, 1,2екв.) i HATU (390мг, 1,3екв ) охолодили До сполуки з Прикладу 21 (109мг, 0,25ммоль) i до 0°С, додали до неї триетиламін (0,33мл, реагенту Деса-Мартена (Dess-Martin) (157мг, 3,0екв.) в DMF(5мл) як розчиннику і провели реак1,5екв.) додали безводний дихлорметан (4мл), цію утвореної суміші протягом двох годин. Розчинсуміш перемішали протягом однієї години при кімник відігнали під зниженим тиском, а залишок екснатній температурі і концентрували під зниженим тиском. Реакцію зупинили ізопропіловим спиртом трагували етилацетатом (50мл´2), промили (0,5мл). Тверду речовину видалили шляхом фільводою, водним розчином бікарбонату натрію i водтрації через целіт під зниженим тиском. Фільтрат ним розчином хлориду натрію, просушили (безводний Na2SO4), концентрували під зниженим тиском екстрагували етилацетатом (20мл´2), промили i очистили на хроматографічній колонці (60-70% водою, насиченим водним розчином бікарбонату етилацетат/гексан). У результаті була одержана натрію і водним розчином хлориду натрію, просузазначена в заголовку сполука в кількості 330мг шили (безводний Na 2SO4) і концентрували під (вихід 95%). зниженим тиском, отримавши альдегід (540мг, 1 вихід 99%). Н-ЯМР (400МГц, CDCI3) d 9,16(d, 1Н), 8,55(d, 1Н), 7,85(d, 1Н), 7,73-7,70(m, 3H), 7,56(NH, d, 1H), Діетилметилсульфонметанфосфонат (113мг, 2,0екв. [Synthesis, 1969, 170]) розчинили у THF 4,26(m, 1H), 4,12(d, 1H), 4,04(d, 1H), 3,79(d, 1H), (3мл), NaH (60% у мінеральному маслі, 20мг, 3,75(t, 2H), 2,94(bs, 1H), 2,57(m, 2H), 2,41(m, 1H), 2,0екв.), до розчину додали одержаний, як описа1,10 i 1,07(два d, 6H). но вище, альдегід, і суміш кип'ятили з оберненим Приклад 32 6-(Трет-бутил)-1-етил(2Е,4S)-4-({[(5R)-5холодильником протягом двох годин. Після екстізопропіл-3-(1-ізохінолінІл)-4,5-дигідро-5рагування етилацетатом (20мл´2) екстракт проізоксазоліл]карбоніл}аміно)-2-гексендіоат (Іq) мили водою, насиченим водним розчином бікарДо сполуки з Досліду 21 з виготовлення бонату натрію і водним розчином хлориду натрію, (107мг, 0,24ммоль) і реагенту Деса-Мартена просушили (безводний Na2SO4), концентрували під (Dess-Martin) (153мг, 1,5екв.) додали сухий ди хлозниженим тиском і очистили за допомогою препарметан (4мл), суміш перемішали протягом однієї ративної хроматографії (60% етилацетат/гексан). години при кімнатній температурі і концентрували У результаті була одержана зазначена в заголовку під зниженим тиском. До залишку добавили сухий сполука (52мг, 41%) з діастереомерним співвідноTHF (3мл) і (карбоетоксиметишенням 4:1. 1 лен)трифенілфосфоран) (108мг, 1,3екв.), i суміш Н-ЯМР (500МГц, CDCI3) головного діастереокип'ятили з оберненим холодильником протягом меру d 9,14(d, 1H), 8,55(d, 1H), 7,86(d, 1Н), 7,76двох годин. Далі реакційну суміш екстрагували 7,65(m, 4Н), 6,92(dd, 1Н), 6,57(dd, 1Н), 5,03(m, 1Н), етилацетатом (20мл´2), промили водою, насиче4,02(d, 1Н), 3,81 (d, 1Н), 2,94(s, 3H), 2,61 (m, 2H), ним водним розчином бікарбонату натрію і водним 2,41 (septet, 1H), 1,36(s, 9H), 1,10 і 1,08 (дві серії d, розчином хлориду натрію, просушили (безводний 6H). Na2SO4), концентрували під зниженим тиском і Приклад 35 попередньо очистили за допомогою препаративної (3S,4E)-3-({[(5R)-5-ізопропіл-3-(ізохінолініл)хроматографії (40% етилацетат/гексан). У резуль4,5-дигідро-5-ізоксазоліл}карбоніл}аміно)-5таті була одержана зазначена в заголовку сполука (метилсульфоніл)-4-пентенова кислота (Iss) (98мг, 80%) з діастереомерним співвідношенням Сполуку з Прикладу 34 піддали реакції у від3:1. повідності з процесом, аналогічним застосованому 1 у Прикладі 2, у результаті чого одержали зазначеН-ЯМР (500МГц, CDCI3) головного ізомеру d ну в заголовку сполуку. 9,15(d, 1H), 8,54(d, 1H), 7,86(d, 1H), 7,74-7,62(m, 4Н), 6,93(dd, 1Н), 6,00(dd, 1Н), 4,98(m, 1Н), 4,19(qt, 37 83240 38 Н-ЯМР (500МГц, MeOD-d3) головного ізомеру Мас-спектр: М+Н 402 Приклад 40 d 9,04(d, 1H), 8,52(d, 1H), 7,95(d, 1Н), 7,82-7,69(m, 3H), 6,90(dd, 1Н), 6,71 (dd, 1Н), 5,06(m, 1Н), 3,86(m, 3-({[5-етилІ-3-(8-хінолініл)-4,5-дигідро-5ізоксазоліл]карбоніл}аміно)-5-фтор-42Н), 2,98(s, 3H), 2,76(d, 2H), 2,39(m, 1H), 1,08 і оксопентанова кислота) (Іхх) 1,06(дві серії d, 6H). 1 Мас-спектр: Μ+Η 460 Н-ЯМР (500МГц, СЕСІ3) d 8,98 і 8,93(два m, Дослід з виготовлення згідно з процесом за 1Н), 8,56-8,21 (m, 1Н), 8,03-7,94(m, 2Н), 7,73(bs, Прикладами 36-42 1Н), 7,6О(m, 1Н), 7,53-7,48(два m, 1Н), 4,94Сполуки, отримані за допомогою реакції 4,64(m, 3H), 4,27-4,22(два d, 1H), 3,77(d, 1Н), 3,07 і (ізо)хінолінальдегіду (або 1- чи 2-нафтальдегіду) з 2,92(два m, 2Н), 2,31-2,22(m, 1Н), 2,12-2,05 (m, етил-2-етилакрилатом (або етил-21Н), 1,10(t, 3H). пропілакрилатом) у відповідності з процесом, анаМас-спектр: М+Н 402 логічним описаному в Дослідах 1, 2 i 3 з виготовПриклад 41 лення (або в Дослідах 1 i 16 з виготовлення), очи3-({[5-етил-3-(3-хінолініл)-4,5-дигідро-5щалися, в разі необхідності, за допомогою ізоксазоліл]карбоніл}аміно)-5-фтор-4препаративної HPLC-хроматографії на хіральній оксопентанова кислота) (Іуу) 1 OD колонці для відділяння активних хіральних Н-ЯМР (400МГц, CDCI3) d 9,32 і 9,25(два d, ізомерів. 1Н), 8,16-8,03(m, 2Н), 7,83-7,73(m, 3H), 7,62Ізольовані активні хіральні ізомери або неак7,55(m, 1Н), 4,95-4,76(m, 3H), 3,86(два d, 1Н), 3,45тивні хіральні ізомери піддавалися гідролізу у від3,39(два d, 1Н), 3,17-3,01 (два m, 1Н), 2,90-2,82(m, повідності з процесом, аналогічним описаному в 1Н), 2,27-2,20(m, 1Н), 2,09-2,00(m, 1Н), 1,10Досліді 4 з виготовлення, а утворювані в результа1,05(m, 3H). ті сполуки приводили у взаємодію з трет-бутил-3Мас-спектр: М+Н 402 аміно-5-фтор-4-гідроксипентаноатом у відповідноПриклад 42 сті з процесом, аналогічним описаному в Прикла5-Фтор-3-({[(5R)-5-ізопропіл-3-(2-хінолініл)-4,5дах 1 і 2. У результаті одержували сполуки, зазнадигідро-5-ізоксазоліл]карбоніл}аміно)-4чені в заголовках Прикладів 36-42. оксопентанова кислота) (Izz) 1 Приклад 36 Н-ЯМР (400МГц, СЕСІ3) d 8,24(m, 1H), 8,14(m, 5-Фтор-3-({[(5S)-3-(1-ізохінолініл)-5-пропіл-4,51H), 8,04(d, 1H), 7,88(d, 1H), 7,79(m, 1Н), 7,65(m, дигідро-5-ізоксазоліл]карбоніл}аміно)-41H), 7,51 (bs, 1H), 5,13-4,35(m,3H), 4,05-4,00(два d, оксопентанова кислота) (Itt) 1H), 3,73(d, 1H), 3,05-2,82(m, 2H), 2,42(m, 1H), 1 Н-ЯМР (500МГц, DMSO-d6) d 9,02(t, 1H), 8,61 1,10(m, 6H). (m, 2H), 8,08(d, 1H), 7,96(m, 1H), 7,85(t, 1H), Мас-спектр: М+Н 416 7,78(m, 1H), 5,05(bs, 2H), 4,73(m, 1H), 3,97-3,92(dd, Дослід з виготовлення згідно з процесом за 1H), 3,70-3,65(два d, 1H), 2,90-2,70(два m, Прикладами 43-48 2H),2,03(m, 1H), 1,91(m, 1H), 1,48(m, 1H), 1,32(m, Сполуки, отримані шляхом приведення в реа1H), 0,93(m, 3H). кцію ароматичного альдегіду [Bioorg. Med. Chem. Мас-спектр: М+Н 416 Lett., 1996, 6, p.2173, J. Org. Chem., 1978, 43,1372] Приклад 37 та етил-2-етилакрилату (або етил-2(3-({[(5S)-5-етил-3-(1-нафтил)-4,5-дигідро-5ізопропілакрилату) у відповідності з процесом, ізоксазоліл]карбоніл}аміно)-5-фтор-4аналогічним описаному в Дослідах 1, 2 і 3 з вигооксопентанова кислота) (luu) товлення (Дослідах 1 і 16 з виготовлення), очища1 Н-ЯМР (500МГц, DMSO-d 6) d 8,84(s, 1H), лися, в разі необхідності, за допомогою препара8,59(bs, 1H), 8,02(m, 2H), 7,75(s, 1H), 7,60(m, 3H), тивної HPLC на хіральній OD колонці для 5,01 (bs, 2H), 4,73(m, 1H), 3,87-3,82(dd, 1H), 3,70відділяння активних хіральних ізомерів. Ізольовані 3,65(два d, 1H), 2,82-2,73(два m, 2H), 2,05(m, 1H), активні хіральні ізомери або неактивні хіральні 1,95(m, 1H), 0,96(m, 3H). ізомери піддавалися гідролізу у відповідності з Мас-спектр: М+Н 401 процесом, аналогічним описаному в Досліді 4 з Приклад 38 виготовлення, а утворювані сполуки приводилися (3-({[(5S)-5-етил-3-(2-хінолініл)-4,5-дигідро-5у взаємодію з трет-бутил-3-аміно-5-фтор-4ізоксазоліл]карбоніл}аміно)-5-фтор-4гідроксипентаноатом у відповідності з процесом, оксопентанова кислота) (Ivv) аналогічним описаному в Прикладах 1 і 2. У ре1 зультаті одержували сполуки, зазначені в заголовН-ЯМР (500МГц, DMSO-d6) d 8,61 (dd, 1H), ках наведених нижче Прикладів 43-48. 8,41 (m, 1H), 8,02(m, 3H), 7,79(t, 1H), 7,65(t, 1H), Приклад 43 5,22-5,06(m, 1H), 4,72(m, 1H), 4,49428(m, 1H), 3-({[5-Етил-3-(2-ізопропілфеніл)-4,5-дигідро-53,84(m, 1H), 3,54(m, 1H), 2,99-2,54(два m, 2Н), ізоксазоліл]карбоніл}аміно)-5-фтор-42,01(m, 1 Η), 1,91(m, 1H), 0,91(m, 3H). оксопентанова кислота (Іаа1) Мас-спектр: М+Н 402 1 Приклад 39 (3-({[(5R)-5-етил-3-(3-ізохінолініл)Н-ЯМР (500МГц, DMSO-d6) d 8,53(bs, 1H), 4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-47,40(m, 2H), 7,32(m, 1H), 7,25(m, 1H), 5,02(bs, 2H), оксопентанова кислота) (Iww) 4,72(m, 1H), 3,60-3,54(два d, 1Н), 3,46-3,43(два d, 1 1H), 3,40(m, 1H), 2,78-2,60(два m, 2Н) 1,95(m, 1Н), Н-ЯМР (400МГц, CDCI3) d (9,25 і 9,16(два s, 1,85(m, 1Н), 1,14(s, 6H), 0,88(m, 3H) 1H), 8,03-7,64(m, 5H), 4,90-4,84(m, 1Н), 4,79Мас-спектр М+Н 393 4,54(m, 2H), 4,01-3,93(два d, 1H), 3,54(d, 1H), 3,03Приклад 44 2,87(m, 2H), 2,27-2,19 і 2,10-2,01(два m, 2Н), 1,101,06(m, 3H). 1 39 83240 40 3-[({3-[3-(Трет-бутил)фенілІ-5-етил-4,5-дигідровідповідності з процесом, аналогічним описаному 5-ізоксазолілікарбоніл)аміно]-5-фтор-4в Досліді 4 з виготовлення, а утворювані в резульоксопентанова кислота (Іаа2) таті сполуки приводилися у взаємодію з трет1 бутил-3-аміно-5-фтор-4-гідроксипентаноатом у Н-ЯМР (400МГц, D MSO-d 6) d 8,56(dd, 1H), відповідності з процесом, аналогічним описаному 7,67(s, 1H), 7,48(m, 1H), 7,38(d, 2H), 5,24-5,12(q, в Прикладах 1 і 2. У результаті одержували сполу1Н), 4,76-4,69(m, 1Н), 4,59-4,26(m, 1Н), 3,68(m, ки, зазначені в заголовках наведених нижче При1Н), 3,49-3,43(два d, 1H), 2,96-2,56(два m, 2Н), 1,98(m, 1Н), 1,85(m, 1Н), 1,29(s, 9H), 0,89(d, 3H) кладів 49-59. Приклад 49 Мас-спектр М+Н 407 3-({[5-Етил-3-(2-піридиніл)-4,5-дигідро-5Приклад 45 ізоксазоліл]карбоніл}аміно)-5-фтор-43-[({3-[4-(Трет-бутил)феніл]-5-етилІ-4,5оксопентанова кислота (Іаа7) дигідро-5-ізоксазоліл}карбоніл)аміно]-5-фтор-41 оксопентанова кислота (Іаа3) Н-ЯМР (500МГц, D MSO-d6) d 12,41(bs, 1H), 1 8,61 (s, 1H), 8,59-8,53(dd, 1H), 7,87(m, 1H), 7,44(m, Н-ЯМР (500МГц, DMSO-d6) d 8,52(bs, 1H), 1H), 5,19-5,04(два d, 1H), 4,70(m, 1H), 4,45-4,27(m, 7,58(m; 2H), 7,43(dd, 2H), 5,10(bs, 2H), 4,71-4,65(m, 1H), 3,67(m, 1H),3,42(m, 1H), 2,95-2,53 (два m, 2Н), 1Н), 3,65-3,59(два d, 1H), 3,40-3,35(два d, 1H), 1,96(m, 1Н), 1,86(m, 1Н), 0,85(m, 3H). 2,86-2,60(два m, 2H), 1,94(m, 1Н), 1,82(m, 1Н), Мас-спектр: М+Н 352 1,24(s, 9H), 0,86(m, 3H) Приклад 50 Мас-спектр М+Н 407 3-[({3-[4-(Трет-бутил)-2-піридиніл]-5-етил-4,5Приклад 46 дигідро-5-ізоксазоліл}карбоніл)аміно]-5-фтор-45-Фтор-3-({[(5R)-5-ізопропіл-3-(2оксопентанова кислота (Іаа8) ізопропілфеніл)-4,5-дигідро-51 ізоксазоліл]карбоніл}аміно)-4-оксопентанова кисН-ЯМР (400МГц, CDCI3) d 8,58(d, 1H), 7,90(s, лота (1аа4) 1H), 7,65(bs, 1H), 7,45-7,39(m, 1H), 4,98-4,68(m, 1 3H), 3,92 і 3,88(два d, 1Н), 3,52 і 3,47(два d, 1H), Н-ЯМР (500МГц, CDCI3) d 7,60-7,53(m, 1H), 3,05-2,86(m, 2H), 2,23-2,18(m, 1Н), 2,08-2,00(m, 7,41(m, 2H), 7,27-7,23(m, 2H), 5,20-4,91(m, 1Н), 4,71(m, 1Н), 4,54-4,42(m, 1Н), 3,69-3,64(два d, 1H), 1Н), 1,38(s, 9H), 1,05(1,3H). Мас-спектр: М+Н 408 3,45-3,38(m, 2H), 3,12-2,77(m, 2Н), 2,32(m, 1Н), Приклад 51 1,22(d, 6H), 1,05(d, 6H) 3-[({(5R)-3-[4-(Трет-бутил)-2-піридиніл]-5Мас-спектр М+Н 407 ізопропіл-4,5-дигідро-5Приклад 47 3-[({(5R)-3-[3-(Трет-бутил)феніл]-5-ізопропілізоксазоліл}карбоніл)аміно]-5-фтор-4оксопентанова кислота (Іаа9) 4,5-дигідро-5-ізоксазоліл}карбоніл)аміно]-5-фтор-41 оксопентанова кислота (Іаа5) Н-ЯМР (400МГц, CDCI3) d 8,58(d, 1H), 7,88(d, 1 1H), 7,61 (bs, 1H), 7,43(m, 1H), 4,84(m, 1H), 4,60(bs, Н-ЯМР (500МГц, CDCI3) d 7,69(s, 1H), 7,48(d, 2H), 3,89-3,82(два d, 1H), 3,60-3,55(два d, 1H), 1H), 7,41 (d, 1H), 7,35(t, 1H), 4,74-4,50(m, 3H), 3,04-2,86(m, 2H), 2,38(m, 1H), 1,38(s, 9H), 1,07(m, 3,69(d, 1H), 3,40(d, 1H), 3,06-2,77(m, 2H), 2,32(m, 6H). 1H), 1,33(s, 9H), 1,04(m, 6H) Мас-спектр: М+Н 422 Мас-спектр М+Н 421 Приклад 52 Приклад 48 3-({[5-Етил-3-(4-ізобутил-2-піридиніл)-4,53-{[(3-[1,1'-біфеніл]-3-іл-5-ізопропіл-4,5-дигідродигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-45-ізоксазоліл)карбоніл]аміно}-5-фтор-4оксопентанова кислота (Іаа10) оксопентанова кислота (Іаа6) 1 Як вихідний матеріал використовували 3Н-ЯМР (500МГц, D MSO-d6) d 8,58-8,52(dd, біфенілкарбоксальдегід (див. [Synthesis, 2003, 1H), 8,49(s, 1H), 7,68(s, 1H), 7,27(s, 1H), 5,19337]). У результаті була одержана зазначена в 5,04(m, 1H), 4,69(m, 1H), 4,46-4,29(m, 1H), 3,68(m, заголовку сполука. 1H), 3,41-3,37(dd, 1H), 2,93-2,46(ηη, 4Η), 1,951 1,85(два m, 3H), 0,86-0,82(m, 9H). Н-ЯМР (500МГц, DMSO-d6) d 8,42(bs, 1H), Мас-спектр: М+Н 408 7,87(d, 1H), 7,73-7,69(m, 4H), 7,52(m, 1H), 7,45(m, Приклад 53 2H), 7,38(m, 1H), 5,03(bs, 2H), 4,63(m, 1H), 3,733,57(m, 2H), 2,67-2,63(два m, 2Н), 2,22(m, 1H), 3-({[3-(4-Ацетил-2-піридиніл)-5-етил-4,5дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-40,89(m, 6H). оксопентанова кислота (Iаа11) Мас-спектр: М+Н 441 1 Дослід з виготовлення згідно з процесом за Н-ЯМР (500МГц, CDCI3) d 8,79(d, 1H), 8,35(s, Прикладами 49-59 1H), 7,76(d, 1H), 7,46(bs, 1H), 4,84-4,40(m, 3H), 4-Заміщені піридин-2-карбоксальдегіди отри3,90-3,85(два d, 1H), 3,51-3,46(два d, 1H), 3,04мувалися за допомогою процесу, описаного в [US 2,84(m, 2H), 2,65(s, 3H), HHHkdkdk 2,16(m, 1Н), 6043248, JOC 1982, 47, p.4315], і піддавалися реа2,02(m, 1Н), 1,03(m, 3H). кціям у відповідності з процесом, аналогічним заМас-спектр: М+Н 394 стосованому в Дослідах 1, 2 і 3 з виготовлення Приклад 54 (або в Дослідах 1 і 16 з виготовлення). Утворювані 3-({[3-(4-Циклопропіл-2-піридинілІ)-5-етил-4,5в результаті сполуки очищалися, в разі необхіднодигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4сті, за допомогою препаративної HPLC на хіральоксопентанова кислота (Iаа12) 1 ній OD колонці для відділяння активних хіральних Н-ЯМР (500МГц, D MSO-d6) d 12,39(bs, 1Н), ізомерів. Ізольовані активні хіральні ізомери або 8,41(1,1Н), 7,56(d, 1H), 7,12(m, 1H), 5,19-5,04(m, неактивні хіральні ізомери піддавалися гідролізу у 1Н), 4,72-4,66(m, 1Н), 4,46-4,27(m, 1Н), 3,69 41 83240 42 3,63(m, 1Н), 3,39-3,35(два d, 1H), 2,80-2,74(m, 1Н), сом, аналогічним застосованому в Досліді 5 з ви2,63-2,52(m, 1Н), 2,00-1,80(m, 3H), 1,06(m, 2Н), готовлення. У результаті одержали бромметилке0,86-0,80(m, 5Н). тонову похідну - (Трет-бутил-(3S)-5-бром-3-({[(5R)Мас-спектр: М+Н 392 5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5Приклад 55 ізоксазоліл]карбоніл}аміно)-оксопентаноат). Цю 3-({[3-(4-Циклопентил-2-піридинілІ)-5-етил-4,5бромметилкетонову похідну піддали реакції з дидигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4фенілфосфоновою кислотою в KF/DMF (див. Дооксопентанова кислота (Іаа13) слід 5 з виготовлення), отримавши дифенілфос1 форилоксиметилкетон, який після цього обробили Н-ЯМР (500МГц, CDCI3) d 8,50(d, 1H), 7,67(m, у відповідності з процесом, аналогічним описаному 2H), 7,26(m, 1H), 4,88-4,82(m, 1H), 4,65(bs, 2H), в Прикладі 2. У результаті одержали сполуку, за3,88-3,81 (два d, 1H), 3,45-3,41 (два d, 1H), 3,05(m, значену в заголовку Прикладу 60. 1H), 2,96-2,80(m,2Н), 2,20-2,12(m, 3H), 2,02-1,96(m, 1H), 1,83(m, 2H), 1,72(m, 2H), 1 60(m, 2H),1,01(t, Сполуки за Прикладами 61-63 були виготовлені, відповідно, із 1-феніл-3-(трифторметил)-1H3H) піразол-5-олу, 3-бензил-4-гідрокси-2(5H)-фуранону Мас-спектр: М+Н 420 та ізомасляної кислоти за допомогою процесу, Приклад 56 аналогічного описаному в попередньому абзаці. 3-({[(5R)-3-(4-циклопентил-2-піридиніл)-5ізопропіл-4,5-дигідро-5Приклад 60 (3S)-5-[(дифенілфосфорил)окси]-3-({[(5R)-5ізоксазоліл]карбоніл}аміно)-5-фтор-4ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5оксопентанова кислота (Іаа14) 1 ізоксазоліл]карбоніл}аміно)-4-оксопентанова кисН-ЯМР (400МГц, CDCI3) d 8,58(m, 1H), 7,74(d, лота (Іаа18) 1H), 7,63(bs, 1H), 7,38-7,32(dd, 1H), 4,88-4,81 (m, 1 1H), 4,53(bs, 2H), 3,87-3,79(два d, 1Н), 3,56Н-ЯМР (500МГц, DMSO-d6) d 8,92(m, 1H), 8,58(m, 1H), 8,05(m, 1H), 7,94(m, 1H), 7,81 (m, 1H), 3,53(два d, 1H), 3,12-3,04(m, 1H), 3,02-2,85(m, 2H), 7,75-7,72(m, 3H), 7,57(m, 3H), 7,49(m, 4H), 7,35(m, 2,38(m, 1H), 2,16(m, 2H), 1,88(m, 2H), 1,78(m, 2H), 2H), 4,90-4,65(два m, 3H), 3,79-3,75(два d, 1Н), 1,65(m, 2H), 1,07(m, 6Н). 3,69-3,67(два d, 1Н), 2,65(два m, 2Н), 2,22(m, 1Н), Мас-спектр: М+Н 434 0,84(m, 6Н). Приклад 57 Мас-спектр: М+Н 614 3-({[3-(4-Циклогексил-2-піридиніл)-5-етил-4,5Приклад 61 дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4(3S)-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5оксопентанова кислота (Іаа15) 1 дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-{[1Н-ЯМР (400МГц, CDCI3) d 8,61 (m, 1H), 7,75 феніл-3-(трифторметил)-1Н-піразол-5(d, 1H), 7,64(bs, 1H), 7,39-7,33(dd, 1H), 4,86іл)окси)пентанова кислота (Іаа19) 4,53(два m, 3H), 3,87(t, 1H), 3,50-3,45(dd, 1H), 3,051 Н-ЯМР (500МГц, DMSO-d6) d 8,95(m, 1H), 2,85(два m, 2H), 2,63(m, 1H), 2,22(m, 1H), 2,03(m, 8,83(d, 1H), 8,57(m, 1H), 8,03(d, 1H), 7,92(d, 1H), 1H), 1,93-1,80(два m, 5H), 1,44(m, 5Н), 1,05(t, 3H). Мас-спектр: М+Н 434 7,80(m, 1H), 7,74(m, 1H), 7,65(d, 1H), 7,57(m, 1H), 7,51-7,34(m, 3H), 6,27(s, 1H), 5,29-5,15(m, 2H), Приклад 58 4,76(m, 1H), 3,92-3,88(m, 1H), 3,75-3,69(m, 1H), 3-({[5-Етил-3-(5,6,7,8-тетрагідро-1-ізохінолініл)2,84-2,60(m, 2H), 2,33(m, 1H),0,96(m, 6H). 4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4Мас-спектр: М+Н 624 оксопентанова кислота (Iаа16) 1 Приклад 62 Н-ЯМР (500МГц, D MSO-d6) d 8,60-8,53(dd, (3S)-5-[(4-бензил-5-оксо-2,5-дігідро)-31H), 8,30(d, 1H), 7,15(d, 1H), 5,20-5,05(m, 1H), 4,74фураніл)окси]-3-({[(5R)-5-ізопропіл-3-(14,66(m, 1H), 4,45-4,25(m, 1H), 3,75-3,68(m, 3,47ізохінолініл)-4,5-дигідро-53,41 (m, 1H), 2,94-2,88(m, 2H), 2,80-2,72(m, 3H), ізоксазоліл]карбоніл}аміно)-4-оксопентанова кис2,62-2,53(m, 1Н), 1,99-1,93(m, 1Н), 1,88-1,80(m, лота (Іаа20) 1Н), 1,71-1,69(m, 4Н), 0,88-0,84(m, 3H). 1 Н-ЯМР (500МГц, D MSO-d 6) d 8,97(t, 1H), Мас-спектр: М+Н 406 8,58(d, 1H), 8,04(d, 1H), 7,92(d, 1H), 7,81 (m, 1H), Приклад 59 7,73(m, 1H), 7,23-7,07(m, 6H), 7,51 (m, 1H), 4,795-Фтор-3-({[5-ізопропіл-3-(4-феніл-24,65(m, 3H), 3,92-3,87(два d, 1H), 3,74-3,68(два d, піридинілІ)-4,5-дигідро-51H), 2,82-2,58(m, 2H), 2,31 (m, 1H), 0,95(m, 6H). ізоксазоліл]карбоніл}аміно)-4-оксопентанова кисМас-спектр: М+Н 586 лота (Iаа17) 1 Приклад 63 Н-ЯМР (400МГц, CDCI3) d 8,68(d, 1H), 8,14(s, (3S)-5-(ізобутирилокси)-3-({[(5R)-5-ізопропіл-31H), 7,68(m, 1H), 7,58(m, 1H), 7,54-7,43(m, 5Н), (1-ізохінолініл)-4,5-дигідро-54,86-4,60(m, 3H), 3,92-3,87(два d, 1H), 3,62(d, 1H), ізоксазоліл]карбоніл}аміно)-4-оксопентанова кис3,09-2,86(m, 2H), 2,39(01,1H),1,11-1,06(m,6H). лота (Iаа21) Мас-спектр: М+Н 442 1 Н-ЯМР (500МГц, D MSO-d6) d 12,39(bs, 1H), Дослід з виготовлення згідно з процесом за 8,96(t, 1H), 8,73(m, 1H), 8,58(dd, 1H), 8,04(d, 1H), Прикладами 60-63 (2S)-4-(Трет-бутокси)-2-({[(5R)-5-ізопропіл-3-(17,92(d, 1H), 7,81(t, 1H), 7,73(m, 1H), 4,78(m, 2H), 4,68(m, 1H), 3,87(t, 1H), 3,73-3,68(два d, 1H), 2,79ізохінолініл)-4,5-дигідро-52,60(два m, 2H), 2,56(m, 1H), 2,3L(m, 1H), 1,05(d, ізоксазоліл]карбоніл}аміно)-4-оксобутанову кисло3H), 0,95(m, 9H). ту (отриману за допомогою реакції зв'язування Мас-спектр: М+Н 484 сполуки (Vllf) з Asp(O-трет-Bu)-OMe і наступного гідролізу) піддали реакції у відповідності з процеПриклад 64 43 83240 44 (3S)-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5(3S)-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2гексенова кислота (Іаа22) піридинілокси)пентанова кислота (Іаа23) 1 Була проведена реакція амідної похідної ВайН-ЯМР (500МГц, MeOH-d4) d 9,04(d, 1H), нреба (Weinreb) (2S)-4-(трет-бутокси)-2-({[(5R)-58,50(d, 1H), 7,95(d, 1H), 7,81 (d, 1H), 7,77(t, 1H), ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-57,69(t, 1H), 7,59(m, 1H), 6,85-6,80(m, 2H), 6,67(bs, ізоксазоліл]карбоніл}аміно)-4-оксобутанової кисло1H), 5,07(bs, 1H), 4,95(t, 1H), 4,84(m, 1H), 3,94ти (похідна, сконденсована з Ν,Ο3,79(Abq, 2H), 2,92-2,80(m, 2H), 2,39(m, 1H), диметилгідроксиламіном) з вінілмагнійбромідом, і 1,09(m, 6H). отриману сполуку піддали реакції у відповідності з Мас-спектр: М+Н 491 процесом, аналогічним застосованому в Прикладі Приклад 66 2. У результаті була одержана сполука, зазначена (3S)-3-({[5-етил-3-(2-ізопропілфеніл)-4,5в заголовку. дигідро-5-ізоксазоліл]карбоніл}аміно)-4-оксо-5-(21 Н-ЯМР (400МГц, D MSO-d6) d 12,27(bs, 1H), піридинілокси)пентанова кислота (Іаа24) 1 8,95(t, 1H), 8,74-8,67(два d, 1H), 8,58(m, 1H), Н-ЯМР (500МГц, DMSO-d6) 8,71 (bs, 1H), 8,028,04(d, 1H), 7,92(d, 1H), 7,83-7,72(m, 2H), 6,47(m,7,94(два bs, 1H), 7,71-7,64(m, 1H), 7,42-7,18(m, 1H), 6,22-6,11 (два dd, 1H), 5,71-5,62(два dd, 1Н), 4H), 6,96-6,90(два t, 1H), 6,85-6,80(два d, 1H), 4,77(m, 1Н), 3,90-3,79(m, 1Н), 3,72-3,64(m, 1Н), 4,99(bs, 2H), 4,86-4,78(m, 1H), 3,58(два d, 1Н), 2,82(m, 1Н), 2,62-2,49(m, 1Н), 2,30(m, 1Н), 0,94(m, 3,48(два d, 1Н), 3,36(m, 1Н), 2,81-2,61(m, 2Н), 2,056Н). 1,80(два m, 2Н), 1,14-1,03(m, 6Н), 0,93-0,88(m, 3H). Мас-спектр: М+Н 410 Мас-спектр: М+Н 468,21 Дослід 22 з виготовлення Приклад 67 Трет-бутил-(3S)-3-аміно-4-гідрокси-5-(22-{[(3S)-4-карбокси-3-({[(5R)-5-ізопропіл-3-(1піридинілокси)пентаноат (VІІІf) ізохінолініл)-4,5-дигідро-5Бромметилкетонову похідну X (3,2г, ізоксазоліл]карбоніл}аміно)-2-оксобутил]окси}-17,93ммоль), проміжний продукт із Досліду 5 з вигометилпіридинійтрифторметансульфонат (Іаа25) товлення, розчинили в бензолі (30мл) і до розчину Проміжний продукт, трет-бутил ((3S)-3-({[(5R)додали Аg2СО3 (2,62г, 1,2екв.) і 2-гідроксипіридин 5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5(0,93г, 1,2екв.). Утворену суміш перемішували в ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2умовах кипіння з оберненим холодильником при піридинілокси)пентаноат (49мг, 90 мкмоль), отритемпературі 80°С протягом 3 днів. Реакційну суміш маний у результаті проведення реакції окислення профільтрували через целіт, концентрували під за Десом-Мартеном (Dess-Martin) у Прикладі 65, зниженим тиском і очистили методом колонкової розчинили в дихлорметані (2мл), додали метилхроматографії, одержавши 2трифторметансульфонат (1,1екв., 10,1мкл), і супіридинілоксиметилкетонову похідну (Xlf) (466мг, міш перемішували протягом одного дня при кімнавихід 14%). тній температурі. Після концентрування під Одержану таким чином 2зниженим тиском залишок піддали обробці за тапіридинілоксиметилкетонову похідну (Xlf) (227мг, ким самими процесом, як у Прикладі 2, у резуль0,548ммоль) розчинили у 10мл суміші розчинників таті чого була одержана зазначена в заголовку тетрагідрофуран/метанол (3:2, об.), додали NaBH4 сполука (60мг). 1 (43мг, 2,0екв.) при 0°С, і суміш перемішали протяН-ЯМР (500МГц, D MSO-d6) d 9,00-8,91 (m, гом 30 хвилин при кімнатній температурі. Реакцію 2H), 8,76-8,57(m, 2H), 8,42(m, 1H), 8,04(m, 1H), зупинили насиченим розчином хлориду амонію, і 7,93(m, 1H), 7,80(m, 1H), 7,75(m, 1H), 7,54(m, 1H), реакційний розчин концентрували під зниженим 5,77-5,48(m, 2H), 4,85-4,81 (m, 1H), 4,00(s, 3H), тиском Залишок екстрагували етилацетатом, про3,94-3,69(m, 2H), 2,87-2,60(m, 2H), 2,33(m, 1H), мили водою і водним розчином хлориду натрію, 0,98 і 0,94(два d, 6Н). просушили (безводний Na2SO4), і потім концентруМас-спектр: М+ 505,20 вали під зниженим тиском, одержавши сполуку Приклад 68 (XIIf) (230мг), у котрій кетонова група була віднов2-{[(3S)-4-карбокси-3-({[5-етил-3-(2лена до гідроксильної групи. ізопропілфеніл)-4,5-дигідро-5Бензилоксикарбонільну груп у приготованої таізоксазоліл]карбоніл}аміно)-2-оксобутил]окси}-1ким чином сполуки видалили обробкою (Pd/C) в метилпіридинійтрифторметансульфонат (Іаа26) атмосфері балонного водню протягом 40 хвилин, Проміжний продукт, трет-бутил (3S)-3-({[5отримавши в результаті сполуку, зазначену в назві етил-3-(2-ізопропілфеніл)-4,5-дигідро-5(155мг, 99%). ізоксазоліл]карбоніл}аміно)-4-оксо-5-(2Процес виготовлення сполук у Прикладах 65піридинілокси)пентаноат (55мг, 0,105ммоль), 66 отриманий у результаті проведення реакції окисСполуки, зазначені в заголовках Прикладів 65лення за Десом-Мартеном (Dess-Martin) у Прикла66, були одержані шляхом проведення реакцій ді 66, розчинили в дихлорметані (2мл), додали сполуки Vllf (або Vllu) зі сполукою Vlllf у відповіднометилтрифторметансульфонат (1,1екв., 13мкл), і сті з процесом, аналогічним застосованому в Присуміш перемішували протягом одного дня при кімкладах 1 і 2; тут Vllu означає 5-етил-3-(2натній температурі. Після концентрування під зниізопропілфеніл)-4,5-дигідро-5-ізоксазолкарбонову женим тиском, залишок піддали обробці за таким кислоту. самими процесом, як у Прикладі 2, у результаті Приклад 65 чого була одержана зазначена в заголовку сполука (59мг, 94%). 45 83240 46 нолу і трифтороцтової кислоти (92:8:0,1) з витраН-ЯМР (500МГц, DMSO-d6) d 8,80-8,73(два d, тою 1мл/хв. Температура колонки становила 40°С, 1H), 8,65(m, 1H), 8,45-8,38(m, 1H), 7,56-7,51(m, 2H), 7,43-7,31(m, 3H), 7,24-7,12(m, H), 5,72-5,48(m, а довжина хвилі детектування - 225нм. Спостерігалися два оптичні ізомери - R ізомер при періоді 2H), 4,91(m, 1H), 4,01 і 3,99(два s, 3H), 3,64(два d, витримування 7,8хв. і S ізомер при періоді витри1Н), 3,48(два d, 1H), 3,42(m, 1H), 2,90-2,62(m, 2H), мування 21,1хв. 2,05-1,80(два m, 2Н), 1,15-1,03(m, 6Н), 0,93-0,88(m, Приклад 71 3H). Мас-спектр: М+ 482,17 Виділення сполуки (Ііі-1) 1) Виділення зародкової сполуки Процес виготовлення сполук у Прикладах 69Два діастереомери із Прикладу 16 були розді70 лені за допомогою препаративної рідинної хромаПроводили реакції оксимової похідної 5-хлортографічної колонки з силікагелем (діаметром 1-метил-1Н-індол-2-альдегіду або 1,5-диметил-1Hіндол-2-альдегіду з трет-бутил-3-аміно-5-фтор-440мм, DYNAMAX-100A). Рухомою фазою при цьому служила суміш n-гексану, етанолу і трифтороцгідроксипентаноатом у відповідності з процесами, тової кислоти (4000:32:2) з витратою 50мл/хв. Бааналогічними описаним у Дослідах 1, 17 і 4 з вигожаний діастереомер збирали зі співвідношенням товлення і Прикладах 1, 2, одержуючи в результаті 99:1 протягом періоду витримування 62-66 хв. при сполуки, зазначені в заголовках Прикладів 69-70. Приклад 69 детектуванні на хвилі завдовжки 227нм (два діастереомери широко елюювалися при безперервно3-({[3-(5-хллор-1-метил-1H-індол-2-іл)-5му змінюванні співвідношення протягом часу до ізопропіл-4,5-дигідро-586хв.). Отриманий таким чином діастереомер зі ізоксазоліл]карбоніл}аміно)-5-фтор-4співвідношенням 99:1 позбавили захисту і викориоксопентанова кислота (Іаа27) 1 стовували як зародковий матеріал для відділяння. Н-ЯМР (500МГц, CDCI3) d 7,59(s, 1H), 7,46Оптичну чистоту оцінювали за допомогою ко7,39(два d, 1Н), 7,30-7,23(m, 3H), 5,01 (m, 1H), лонки Atlantis С18 (4,6´250мм, 5мм). Рухомою фа4,75-4,46(m, 2H), 4,02(d, 1H), 3,95(s, 3H), 3,71(d, зою при цьому служила суміш ацетонітрилу, води і 1H), 2,95(m, 1H), 2,77(m, 1H), 2,35(m, 1H), 1,04(m, трифтороцтової кислоти при витраті 1мл/хв. за 6H). таким градієнтом: Мас-спектр: М+Н 452 t= 0хв., 0:100:0,1 Приклад 70 3хв., 20:80:0,1 3-({[3-(1,5-диметил-1H-індол-2-іл)-5-ізопропіл50хв., 100:0:0,1 4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-5-фтор-4На довжині хвилі детектування 227нм спостеоксопентанова кислота) (Іаа28) 1 рігалися два оптичні ізомери: при періоді витримуН-ЯМР (500МГц, CDCI3) d 7,48(bs, 1H), 7,39(d, вання 36,6хв. (3R, 5R ізомер) і при періоді витри1H), 7,23-7,14(m, 3H), 4,76(m, 1H), 4,70-4,50(m, мування 37,1хв. (3S, 5R ізомер). 2Н), 4,07-4,02(два d, 1Н), 3,99-3,94 i 3,93(три s, (3S, 5R ізомер): Трет-бутил-(3S)-5-фтор-33H), 3,75-3,48(m, 1H), 2,94-2,82(два m, 1Н), 2,46({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-52,43(два s, 3H), 2,34(m, 1Н), 1,05(m, 6Н). ізоксазоліл]карбоніл}аміно)-4-оксопентаноат Мас-спектр: М+Н 432 1 Н-ЯМР (500МГц, CDCI3) d 9,13(d, 1H), 8,55(d, Дослід 23 з виготовлення 1H), 7,85(d, 1H), 7,78-7,65(m, 4H), 5,22-5,02(два m, Виділення (5R)-5-ізопропіл-3-(1-ізохінолініл)2H), 4,90(m, 1H), 4,02(d, 1H), 3,80(d, 1H), 2,924,5-дигідро-5-ізоксазолкарбонової кислоти 5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-52,88(dd, 1H), 2,79-2,75(dd, 1Н), 2,41 (m, 1H), 1,34(s, 9H), 1,09(m, 6H). ізоксазолкарбонову кислоту розчинили в ацетоні Мас-спектр: М+Н 472 (190мл) в умах нагрівання при 60°С і до розчину (3R, SR ізомер): Трет-бутил-(3R)-5-фтор-3додали (S)-а-метилбензиламін (14,5мл, ({[(5R)-5-ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5112ммоль). Реакційну суміш о холодили до кімнатної температури і перемішували протягом 4 годин. ізоксазоліл]карбоніл}аміно)-4-оксопентаноат 1 Утворений осад профільтрували і тричі промили Н-ЯМР (400МГц, CDCI3) d 9,14(d, 1H), 8,56(d, ацетоном (40мл). 1H), 7,87(d, 1H), 7,77-7,64(m, 4H), 5,25-5,00(два q, Отриману таким чином (5)-а-метил2H), 4,90(m, 1H), 4,03(d, 1H), 3,82(d, 1H), 2,93(dd, бензиламінову сіль (5R)-5-ізопропіл-3-(11H), 2,77(dd, 1H), 2,42(m, 1H),1,35(s, 9H), 1,11(m, ізохінолініл)-4,5-дигідро-5-ізоксазолкарбонової 6H). кислоти розчинили в суміші (150мл) ацетону і води Мас-спектр: М+Н 472 (4:1) в умовах нагріву при 90°С, охолодили до кім(3S)-5-Фтор-3-({[(5R)-5-ізопропіл-3-(1натної температури і перемішували протягом 3 ізохінолініл)-4,5-дигідро-5годин. Утворений осад профільтрували і тричі ізоксазоліл]карбоніл}аміно)-4-оксопентанова киспромили ацетоном (40мл), одержавши чисту (S)-алота (Iii-1) 1 метилбензиламінову сіль (5R)-5-ізопропіл-3-(1Н-ЯМР (400МГц, CDCI3) d 9,07(d, 1H), 8,57(d, ізохінолініл)-4,5-дигідро-5-ізоксазолкарбонової 1H), 7,89(d, 1H), 7,78-7,69(m, 3H), 7,69(d, 1H), 4,88кислоти (12,8г, 24,3%, 99,8% ее (енатіомерний 4,79(m, 2H), 4,67(bs, 1H), 4,07(d, 1H), 3,81(d, 1H), надлишок)). 3,08-2,93(m, 1H), 2,91-2,82(m, 1H), 2,43(m, 1H), Оптичну чистоту (5R)-5-ізопропіл-3-(11,12(m, 6H). ізохінолініл)-4,5-дигідро-5-ізоксазолкарбонової Мас-спектр: М+Н 416 кислоти оцінювали за допомогою OD колонки (3r)-5-фтор-5-({[(5r)-5-ізопропіл-3-(1ChiralCel (4,6´250мм, 5мм). Як рухому фазу при ізохінолініл)-4,5-дигідро-5цьому використовували суміш n-гексану, ізопропа1 47 83240 48 ізоксазоліл]карбоніл}аміно)-4-оксопентанова кисБули синтезовані, очищені й активовані за долота (Ііі-2) помогою модифікованого методу, описаного в 1 [Thombeny, N A. et al., Nature. 1992, 356, 768. Н-ЯМР (500МГц, CDCI3) d 9,07(d, 1H), 8,55(d, Thornberry, N. A. Methods in Enzymology, 1994, 244, 1H), 7,87(d, 1H), 7,75-7,68(m, 3H), 7,52(bs, 1H), 615. Walker, N. P. С et al., Cell, 1994, 78, 343] кас5,20-4,35(m, 3H), 4,02(d, 1H), 3,80(d, 1H), 3,13паза-1 і каспаза-8, відомі як цистеїнові протеази, у 2,90(m, 2H), 2,39(m, 1H), 1,08(m, 6H). Мас-спектр: М+Н 416 формі a 2b 2. Аналогічним методом була також 2) Рекристалізація очищена каспаза-9. Були проведені випробування (3S)-5-фтор-3-({[(5R)-5-ізопропіл-3-(1на інгібіторну активність до цих каспаз. Коротко, ізохінолініл)-4,5-дигідро-5були експресовані субодиниці р10 і р20 ізоксазоліл]карбоніл}аміно)-4-оксопентанова кис[Thornberry, N A et al., Nature, 1992, 356, 768] в лота (Ііі-1) Е.соlі, які були очищені шляхом хроматографії на Вихідний трет-бутил-5-фтор-3-({[(5R)-5нікелевій та аніонообмінній колонках, у результаті ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5чого були отримані каспаза-1, каспаза-8 і каспазаізоксазоліл]карбоніл}аміно)-4-оксопентаноат (366г) 9. Для визначення специфічної активності синтерозчинили в хлористому метилені (1,9кг) і охолозованих інгібіторів щодо отриманих таким чином дили до 0°С. Добавили триетилсилан (235г) і трикаспаз використовували флуоресцентний субстрат фтороцтову кислоту (1,88кг), і суміш перемішували AcYVAD-AFC для каспази-1, субстрат AcDEVDпротягом однієї години при 0°С. Реакційну суміш AFC для каспази-8 і субстрат AcLEHD-AFC для відігнали під зниженим тиском, повторно розчиникаспази-9. Ферментативну реакцію проводили при ли в етилацетаті (2,4кг), і відрегулювали її, встанотемпературі 25°С і різних концентраціях інгібіторів вивши рН 5,2 додаванням 2Н водного розчину у буферному розчині, що містив 50мМ HEPES (рН гідроксиду натрію (3,1л). Органічний шар відділи7,50), 10%(мас./об.) цукрози, 0,1%( мас/об.) ли, а водяний шар екстрагували один раз етилаCHAPS, 100мМ NaCI, 1мМ EDTA і 10мМ DTT при цетатом (2,4кг). Об'єднаний органічний шар відінаявності 50мкМ AcYVAD-AFC для 10нМ каспазигнали під зниженим тиском, видаливши таким 1, 50мкМ AcDEVD-AFC для 2,1нМ каспази-8, і чином розчинник. Залишок, що утворився, розчи150мкМ AcLEHD-AFC для 200нМ каспази-9. Інгібінили в метил-трет-бутиловому етері (530г), і до торні константи Ki і Kobs інгібіторів визначали шлярозчину додали невелику кількість кристалічної хом вимірювання швидкості реакції протягом часу (3S)-5-фтор-3-({[(5R)-5-ізопропіл-3-(1-ізохінолініл)за допомогою флуоресцентного спектрометра і 4,5-дигідро-5-ізоксазоліл]карбоніл}аміно)-4отримування константи початкової швидкості. Ki оксопентанової кислоти. Після перемішування визначали шляхом обчислювання по графіку Лайпротягом 16 годин при кімнатній температурі утвонвівера-Барка (Lineweaver Burk), a Kobs - за рівнянрений осад профільтрували і промили сумішшю ням 1: 9:1 метил-трет-бутилового етеру і n-гексану Рівняння 1 (210мл) Kobs=-ln(1-At /A00)/t, Отриману таким чином (3S)-5-фтор-3-({[(5R)-5де ізопропіл-3-(1-ізохінолініл)-4,5-дигідро-5At є відсоток розщеплення (%) у момент часу t, ізоксазоліл]карбоніл}аміно)-4-оксопентанову кисa лоту розчинили в етилацетаті (240мл) в умовах А00 є максимальний відсоток розщеплення (%). нагріву при 50°С, повільно додали n-гексан Флуоресцентний спектрометр Spectra MAX (240мл) і розчин поступово охолодили до кімнатної GeminiXS фірми Molecular Device Co. працював на температури. Після перемішування протягом 24 хвиля х збудження 405нм та емісії 505нм. годин при кімнатній температурі утворений осад Інгібіторну активність in vivo інгібіторів визнапрофільтрували і промили сумішшю 1:1 етилацечали шляхом піддавання клітин Джеркета (Jurkat) тату з n-гексаном (30мл), у результаті чого була (Американська колекція типових культур АТСС одержана зазначена в заголовку сполука (Ііі-1, ТІВ-152) апоптозу Fas антитілом (Upstate Biotech 46,0г, 3S/3R=94/6,0). Оптичну чистоту оцінювали 05-201) і реєстрації зміни кольору за методом WST-1, описаним у [Francoeur A.M. and Assalian A. за допомогою колонки Luna (4,6´50мм, 5мм, Сn). (1996) Biochemica 3, 19-25], отримуючи таким чиЯк рухому фазу використовували суміш ацетонітном кількість клітин Джеркета (Jurkat), що вижили рил/20мМ NH4OAc (30:70, рН 6) з витратою 1мл/хв. в умовах обробки їх інгібітором. При цьому викоПри детектуванні на довжині хвилі 227 нм спостеристовувався спектрометр Spectra MAX 340 фірми рігалися два оптичні ізомери - ЗЯ ізомер з періMolecular Device Co. на хвилі поглинання 440нм. одом витримування 8,0хв. і 3S ізомер з періодом витримування 9,0хв. Експеримент 1 Визначення ефекту інгібування каспази 49 83240 * Сполукою lii-u є (5S) форма сполуки Ііі 50 51 83240 Експеримент 2 Терапевтичний ефекту випадку LPSіндукованого гострого гепатиту у миші Стадія 1. Приготування зразка крові Самки мишей Balb/c (6 тижнів, Лабораторія Charles River Laboratory, Осака, Японія) утримувалися в умовах температури 22°С, відносної вологості 55% і 12 годинних циклів чергування світла і темряви. Їжа і вода постачалися ad libitum. У безпірогенному сольовому розчині розчиняли LPS (ліпополісахарид) і D-галактозамін у концентраціях 0,4мг/мл і 280мг/мл, відповідно, і їх суміш 1:1 вводили шляхом ін'єкцій мишам у кількості 5мл/кг. Одразу після ін'єкції LPS і Dгалактозаміну носій (суміш РЕ3400:етанол:ТwееSО=15:7,5:2,5, п'ятикратно розбавлена сольовим розчином) з розчиненою в ньому випробуваною сполукою або в чистому стані вводили мишам шляхом інтраперитонеальних ін'єкцій. Через 8 годин після ін'єкцій із серця тварин відбирали зразки крові. Стадія 2. Визначення активності амінотрансферази плазми. ALT-активність плазми визначали на відібраних у Стадію 1 зразках крові за допомогою набору для ALT-аналізу (Asan Pharm. Co., Сеул, Корея) у відповідності з інструкцією виробника. Результати цього аналізу показали, що ін'єкції ліпополісахариду і D-галактозаміну круто підвищують активність ALT у плазмі, а випробувані сполуки інгібують цю підвищену ферментативну активність у ступені, залежному від дози. Величини ефективної дози ED50, обчисленої на основі цих результатів випробуваних сполук за допомогою програми Prism виробництва GraphPad Co., лежали в інтервалі 0,01-10мг/кг. Експеримент 3 Інгібіторний ефект щодо фіброзу печінки у щурів SD породи Стадія 1. Методика викликання фіброзу печінки і введення активних сполук. Самців щурів породи Spargue-Dawley (6 тижнів, постачальник "Korea Biolink") утримували при температурі 22°С, відносній вологості 55% і 12 годинних циклах чергування світла і темряви. їжа і вода постачалися ad libitum. Для лігування жовчних протоків щурів піддавали анестезії шляхом інгаляції 1% галотану, розрізали їм черевну порожнину, лігували дистальну і проксимальну жов 52 чні протоки, частини між місцями лігування відрізали, робили ін'єкції 2мл фізіологічного розчину і черевину зашивали. Тваринам уводили випробувану сполуку (Ііі) пероральним шляхом з дозою 3мг/кг або 10мг/кг двічі на день. Для цього сполуку розчиняли у змішаному розчиннику (PEG400:етанол:Tween 80=15:7,5:2,5), п'ятикратно розбавляли фосфатним буфером (рН 7,4) і робили ін'єкції цього розчину. Тваринам контрольної групи уводили розчин, що не містив випробуваної сполуки. Сполуки вводили протягом 1 тижня через 1 тиждень від дня лігування жовчної протоки. Стадія 2. Приготування тканинних зрізів і забарвлення їх Сиріус (Sirius)-червоним. Після введення сполук щурів умертвляли. Печінки тварин фіксували 10% нейтральним формаліном, і готували парафінові зрізи завтовшки 5мкм, які забарвлювали 0,1% Сиріус (Sirius)червоним (Конго червоний 80, Sigma). Приготовані зрізи тканин досліджували під оптичним мікроскопом, де спостерігалися забарвлені червоним колагенові волокна. Результати цих досліджень подані на Фіг.1. Експеримент 4 Інгібіторний ефект щодо апоптозу при стагнації жовчі у SD щурів Випробувану сполук у (Ііі) вводили SD щурам, жовчні протоки яких були ліговані у відповідності з процедурою, застосованою на Стадії 1 Експерименту 3. Через 2 тижні після операції щурів умертвляли. їхні печінки фіксували 10% нейтральним формаліном, і з них готували парафінові зрізи завтовшки 5мкм. Було здійснене TUNELзабарвлення зрізів за допомогою пероксидазного набору для виявлення апоптозу in situ "ApopTag Peroxidase In Situ Апоптоз Detection kit" (Chemicon) у відповідності з інструкцією виробника. Були виконані фотознімки більш ніж 10 ділянок TUNEL-забарвленої тканини печінки у 200кратному збільшенні, що не перекривалися. Результати цих досліджень подані на Фіг.2. Були підраховані і наведені в Табл.2 кількості втрачених клітин у кожній групі випробувань. У поданій нижче таблиці запис "Симульована операція" означає той випадок, коли жовчна протока була прооперована, але не була лігована. Запис "BDL операція" означає той випадок, коли після лігування жовчної протоки тварині вводили лише носій. Висновок TUNEL-забарвлення на моделі індукування фіброзу печінки внаслідок стагнації жовчі показа ло ефективне інгібування апоптозу (75% інгібування) сполукою (Ііі). Крім того, забарвлення Сиріус-червоним показало тяжкий фіброз у тварин 53 83240 54 контрольної групи, але майже повну його відсутрально вводився носій (суміш ність у групі тварин, яким уводили випробувану PEG400:етанол:Tween 80=15:7,5:2,5, десятикратсполуку (Ііі). Цей результат демонструє очевидно розбавлена фосфатним буфером) з розчинений інгібіторний ефект сполуки (Ііі) щодо фіброзу ною в ньому випробуваною сполукою або без неї. печінки у щурів, а отже дозволяє сподіватися на У фізіологічному розчині в концентрації 1% розте, що сполука (Ііі) здатна виявити фармакологіччинили караген (гамма), і щурам у праву задню ну активність у придушенні цирозу печінки інгібулапку були зроблені підшкірні ін'єкції цього розванням апоптозу її клітин в умовах клінічного зачину з дозою 100мкл. Через З години за допомостосування. Використання її може бути поширене гою плетизмометра знов виміряли об'єм правої не тільки на цироз печінки, зумовлений стагнацізадньої лапки тварин. Ефект випробуваної споєю жовчі, але також на різноманітні хвороби цьолуки проявив себе в інгібуванні набряку (%) (див. го органу, що включають апоптоз, зумовлений Табл.3). Інгібування набряку (%) обчислювали за фіброзом печінки. наведеним нижче рівнянням 2. Експеримент 5 Рівняння 2 Протизапальний ефект у щурів Інгібування набряку (%)=100´(Середнє знаСамці SD щурів (6 тижнів, Orient) утримувачення збільшеного об'єму лапки в групі тварин, лися при температурі 22°С, відносній вологості яким уводили носій - Збільшений об'єм лапки в 55% і 12 годинному циклі чергування світла з групі тварин, яким уводили випробувану сполуку)/ темрявою. Їжа і вода постачалися ad libitum. ПеСереднє значення збільшеного об'єму лапки в ред індукуванням набряку у кожної тварини за групі тварин, яким уводили носій. допомогою плетизмометра був виміряний об'єм лапки. Перед індукуванням набряку щурам перо Експеримент 6 Терапевтичний ефект при ревматоїдному артриті у щурів Самки щурів Льюїса (Lewis) (7 тижнів, Charles River, Японія) утримувалися при температурі 22°С, відносній вологості 55% і 12 годинному циклі чергування світла з темрявою. їжа і вода постачалися ad libitum. Колаген II типу (бичачий) розчинили в 0,05Μ оцтовій кислоті в концентрації 2мг/мл при 4°С, і для емульсіфікаци розчину до нього при температурі 4°С добавили таку саму кількість повного ад'юванту Фрейнда. У хвіст щурам Льюїса були зроблені підшкірні ін'єкції 0,1мл емульсіфікованого таким чином розчину. Через 7 днів таким самим чином були знов зроблені ін'єкції емульсіфікованого розчину. Від дня другої ін'єкції емульсіфікованого розчину щурам кожний день перорально уводили носій (суміш PEG400:етанол:Tween 80=15:7,5:2,5, десятикратно розбавлена фосфатним буфером) з розчине ною в ньому випробуваною сполукою та без неї. На 14 день від дати першої ін'єкції емульсіфікованого розчину, що містив колаген, у щурів за допомогою плетизмометра знову виміряли об'єм правої задньої лапки (див. Табл.4). Інгібування набряку (%) визначали за допомогою наведеного нижче рівняння 3. Рівняння 3 Інгібування набряку (%)=100´(Середнє значення збільшеного об'єму лапки на 14 день у групі тварин, яким уводили носій, - Збільшений об'єм лапки на 14 день в групі тварин, яким уводили випробувану сполуку)/Середнє значення збільшеного об'єму лапки на 14 день у групі тварин, яким уводили носій. Крім того, для підтвердження значущості отриманих результатів була обчислена імовірність ρ за допомогою t-тесту Ст'юдента за збільшеним об'ємом лапки на 14 день експерименту. 55 83240 56 У тесті з набряку лапки у щурів сполука (Ні) показала ефект дозозалежного інгібування набряку приблизно на 2, 21 i 23% при дозах 3, 30 i 100мг/кг, відповідно У моделі ревматоїдного артриту набряк лапки на 14-й день був значно зменшений (приблизно на 70%) у групі тварин, яким уводили сполуку (Іii), у той час як група негативного контролю показала максимальну величину набряку Таким чином, є цілком очевидним, що сполука (Іii) має інпбіторний ефект щодо розвитку процесу запалення в моделі запального захворювання і, отже, може використовуватися в лікуванні автоімунних запальних захворювань Експеримент 7 Порівняння з відомими сполуками Були проведені випробування сполуки (Ііі) згідно з даним винаходом і LB84068MP (сполуки 68), описаної в [PCT/KRO0/01047 (WO 01/21600)], результати яких подані в Табл.5. Із Табл.5 можна бачити, що сполука (Іii) згідно з даним винаходом, порівняно зі сполукою LB84068MP, демонструє інгібіторну активність, вищу в десятки разів щодо каспази-8 і клітин Джеркета (Jurkat), і приблизно в 100 разів щодо LPS-індукованоі моделі гострого гепатиту (у мишей). Крім того, фізико-хімічні властивості нової сполуки є більш стабільними, що робить її більш простою при застосуванні у препаратах для ін'єкцій. Інакше кажучи, сполука згідно з даним винаходом демонструє значно вищу е фективність у порівнянні зі сполукою LB84068MP як з погляду активності, так і з погляду фізико-хімічних властивостей. Посилання 1. Inflammation: Basic Principles and Clinical Correlates, 2nd ed., ed by Gallin, Goldstein and Snyderman. Raven Press Ltd., New York. 1992, pp.211-232; Blood, №96,87(6), 2095-2147. 2. Wilson, K. P. et al., Nature, 1994, 370. 270; Walker, N. P. С et al., Cell, 1994, 78, 343; Nature Structural Biology, 1996,3(7), 619. 3. Thornberry, N. A. et al, Nature, 1992, 355.768; Nature Biotechnology, 1996, 14, 297; Protein Science, 1995,4, 3; Nature, 1995, 376 (July 6), 37; Protein Science, 1995,4,2149. 4. Wei, Y. et al., Chemistry and Biology, 2000, 7, 423. 5. Blanchard H. et al, Structure, 1999, 7, 1125; Blanchard H. et al, J. Of МоI. Biol, 2000, 302, 9. 6. Посилання, що стосуються хвороб, пов'язаних з каспазою Деменція: Arch Neural. 2003 Mar, 60(3):369-76, Експресія каспззного гена в мозку як функція клінічного розвитку хвороби Альцгеймера. Pompl PN, Yemuf S, Xiang Z, Ho L, Haroutunian V, Purohit D, Mohs R, Pasinetti GM. Церебральний напад: Proc. Natl. Acad. Sci. USA 2002 Nov. 12;99(23): 15188-93, Активація каспази і нейрозахист у каспаза-3-дефіцитних мишей після церебральної ішемії in vi vo і киснево-глюкозної недостатності in vitro Le DA, Wu Υ, Huang Ζ, Matsushita К, Plesnifa Ν, Augustinack JC, Hyman ВТ, Yuan J, Kuida K, Flavel R A, Moskowitz MA. Ушкодження мозку внаслідок СНІДу: J Neurosci 2002 May 15;22(10):4015-24, Каспазні шляхи в імунодефіцитній вірусній нейродегенерації у людини. Garden GA, Budd SL, Tsai E, Hanson L, Kaul M, D'Emilia DM, Friedander RM, Yuan J, Masliah E, Upton SA. Діабет: Diabetes 2002 Jun; 51(6): 1938-48, Апоптоз у міокарді миші, викликаний гіперглікемією: 57 83240 58 шлях активації мітохондріальної цитохромної Срушених кардіоміоцитах людини. Todor A, Sharov опосередкованої каспази-3. Cai L, Li W, Wang G, VG, Tanhehco EJ, Silverman N, Bernabei A, Guo L, Jiang Y, Kang YJ. Sabbah HN. Виразка шлунку: J Ph ysiol Pharmacol 1998 Dec; Запалення: J Immunol 2003 Mar 15;170(6):338649(4):489-500, Роль базисного фактора росту 91, Інгібітор каспази широкого спектра дії пригніфібробластів у придушенні апоптотичної каспазичує алергічне запалення дихальних шля хів у під3 при лікуванні хронічної виразки шлунку. дослідних астматичних мишей. Iwata A, Nshio К, Slomiany BL, Piotrowski J, Slomiany A. Winn RK, Chi ΕΥ, Henderson WR Jr, Harlan JM. Церебральні ушкодження, викликані гепатитом: J Цироз: і) J Pharmacol Exp Ther. 2004 Viral Hepat 2003 Mar; 10(2):81-6, Церебральна Mar;3C8(3):1191-6, Іінгібітор ldn-6556 каспази придисфункція при інфекційному хронічному гепатиті гнічує ушкодження і фіброз печінки у мишей з С. Forton DM, Ta ylor-Robinson SD, Thomas HC. лігованими жовчними протоками. Canbay Α., Печінкова недостатність, що швидко розвиваєтьFledstein Α., Baskin-Bey Ε., Bronk FS. Gores GJ.; ii) ся: Gastroenterology 2000 Aug; 119(2):446-60, Hepatology. 2004 Feb;39(2):273-8, Апоптоз: зв'язок Альфа-фактор некрозу пухлин при патогенезі між ушкодженням печінки і фіброзом. Canbay A, печінкової недостатності у людей і мишей. Streetz Friedman S, Gores GJ.; iii) Hepatdogy. 2003 Nov; К, Leifeld L, Grundmann D, Ramakers J, Eckert K, 38(5): 1188-98, Поглинання апоптотичних тіл кліSpengler U, Brenner D, Manns M, Trautwein C. тинами Купфера стимулює експресію лігандів Ceпcic: Nat Immunol 2000 Dec; 1(6):496-501, Інгібісмерті і цитокінів. Canbay A, Feldstein АЕ, Higuchi тори каспази підвищують виживаність при сепсиΗ, Werneburg N, Grambihler A, Bronk SF, Gores сі: критична роль лімфоцитів. Hotchkiss RS, GJ. Chang КС, Swanson ΡΕ, Tinsley KW, Hui JJ, 7. Wu J. et al, Methods: A Companion to Methods in Klender P, Xanthoudakis S, Roy S, Black C, Grimm Enzymology, 1999, 77, 320. E, Aspiotis R, Han Y, Nicholson DW, Karl IE. 8. Hoglen N. C. et al, J. of Pharmacology and Відторгнення трансплантованих органів: Experimental therapeutics, 2001, 297, 811. Xenotransplantation 2001 May; 8(2): 115-24, Запо9. Jaeschke H. etal, Toxicology and Applied бігання in vitro клітинно-опосередкованому відтоPharmacology, 2000,169,77. ргненню ксенотрансплантату Fas/FasL-шляхом у 10. Hoglen N.C. et al, J. Pharmacol Exp. Ther., CrmA-трансдукованих клітинах нирки свині. Fujino 2004,309(2):634. Характеристики IDN-6556 (3-[2Μ, Li XK, Suda T, Hashimoto Μ, Okabe Κ, (2-трет-бутилфеніламінооксаліл)аміно]Yaginuma Η, Mikoshiba Κ, Guo L, Okuyama Τ, пропіоніламіно]-4-оксо-5-(2,3,5,6Enosawa S, Amemiya H, Amano T, Suzuki S. тетрафтор фенокси)пентанової кислоти): інгібітоРевматоїдний артрит: Prog Med Chem 2002;39:1ру каспази для лікування печінки; 72, Інгібітори каспази як протипухлинні і проти11. Canbay A et al, J. PharmacoL Exp. Then, 2004, апоптозні засоби. Graczyk PP. 308(3), 1191. Інгібітор IDN-6556 каспази полегшує Ішемічні хвороби серця: Am J Physiol Heart Circ ушкодження і фіброз печінки у мишей з лігованиPhysiol 2002 Sep; 283(3):H990-5, Викликане гіпоми жовчними протоками. ксією розщеплення каспази-3 і DFF45/ICAD у по 59 Комп’ютерна в ерстка О. Гапоненко 83240 Підписне 60 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCaspase inhibitors containing isoxazoline ring
Автори англійськоюChang Hye-Kyung, Oh Yeong-Soo, Park Cheol-Won, Jang Yong-Jin, Park Tae-Kyo, Kim Sung-Sub, Kim Min-Jung, Park Mi-Jeong, Park Jung-Gyu, Park Hee-Dong, Min Kyeong-Sik, Lee Tae-Soo, Lee Sang-Kyun, Kim Soo-Hyeon, Jeong Hee-Kyung, Lee Sun-Hwa, Kim Hwa-Dong, Kim Ae-Ri, Park Ki-Sook, Shin Hyun-Ik, Choi Hyeong-Wook, Lee Kyu-Woong, Lee Jae-Hoon, Heo Tae-Ho, Kim Ho-Jun, Kwon Tae-Sik
Назва патенту російськоюИнгибиторы каспази, которые содержат изоксазолиновое кольцо
Автори російськоюЧанг Хье-Кьюн, Ох Йеонг-Соо, Парк Чеол-Вон, Джанг Йонг-Джин, Парк Тае-Кйо, Ким Сунг-Суб, Ким Мин-Джунг, Парк Ми-Джеонг, Парк Джунг-Гью, Парк Хи-Донг, Мин Кьеонг-Сик, Ли Тае-Соо, Ли Санг-Кьюн, Ким Соо-Хьєон, Джеонг Хи-Кьюнг, Ли Сун-Хва, Ким Хва-Донг, Ким Ае-Ри, Парк Ки-Соок, Шин Хьюн-Ик, Чой Хьеон-Воок, Ли Кью-Воонг, Ли Джае-Хоон, Хео Тае-Хо, Ким Хо-Джун, Квон Тае-Сик
МПК / Мітки
МПК: C07D 261/04
Мітки: кільце, каспази, містять, інгібітори, ізоксазолінове
Код посилання
<a href="https://ua.patents.su/30-83240-ingibitori-kaspazi-shho-mistyat-izoksazolinove-kilce.html" target="_blank" rel="follow" title="База патентів України">Інгібітори каспази, що містять ізоксазолінове кільце</a>
Попередній патент: Спосіб визначення параметрів гравітаційного поля
Наступний патент: Спосіб автоматично керованого подрібнення макухи олійних культур та пристрій для його здійснення
Випадковий патент: Спосіб отримання паливних гранул з органічної сировини












