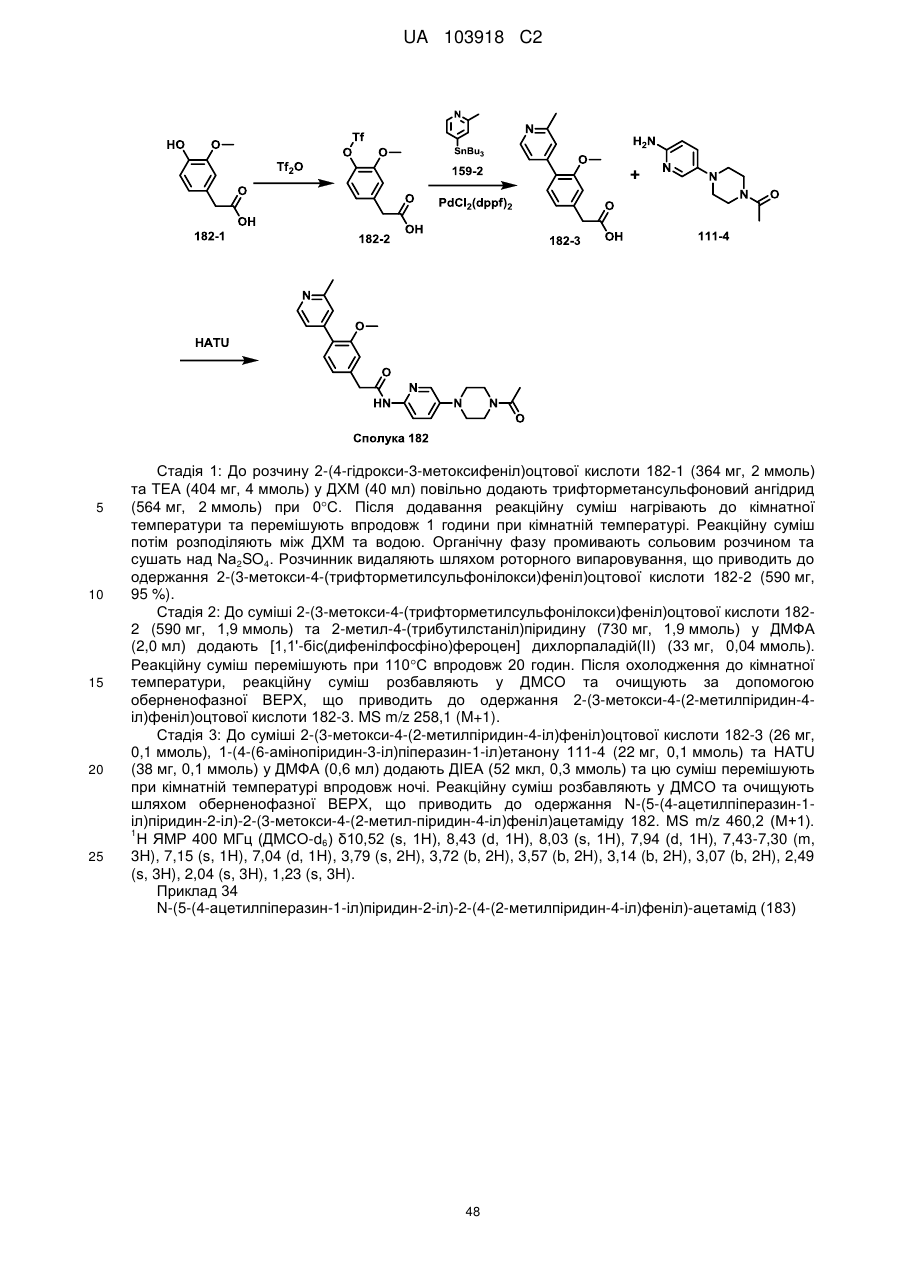
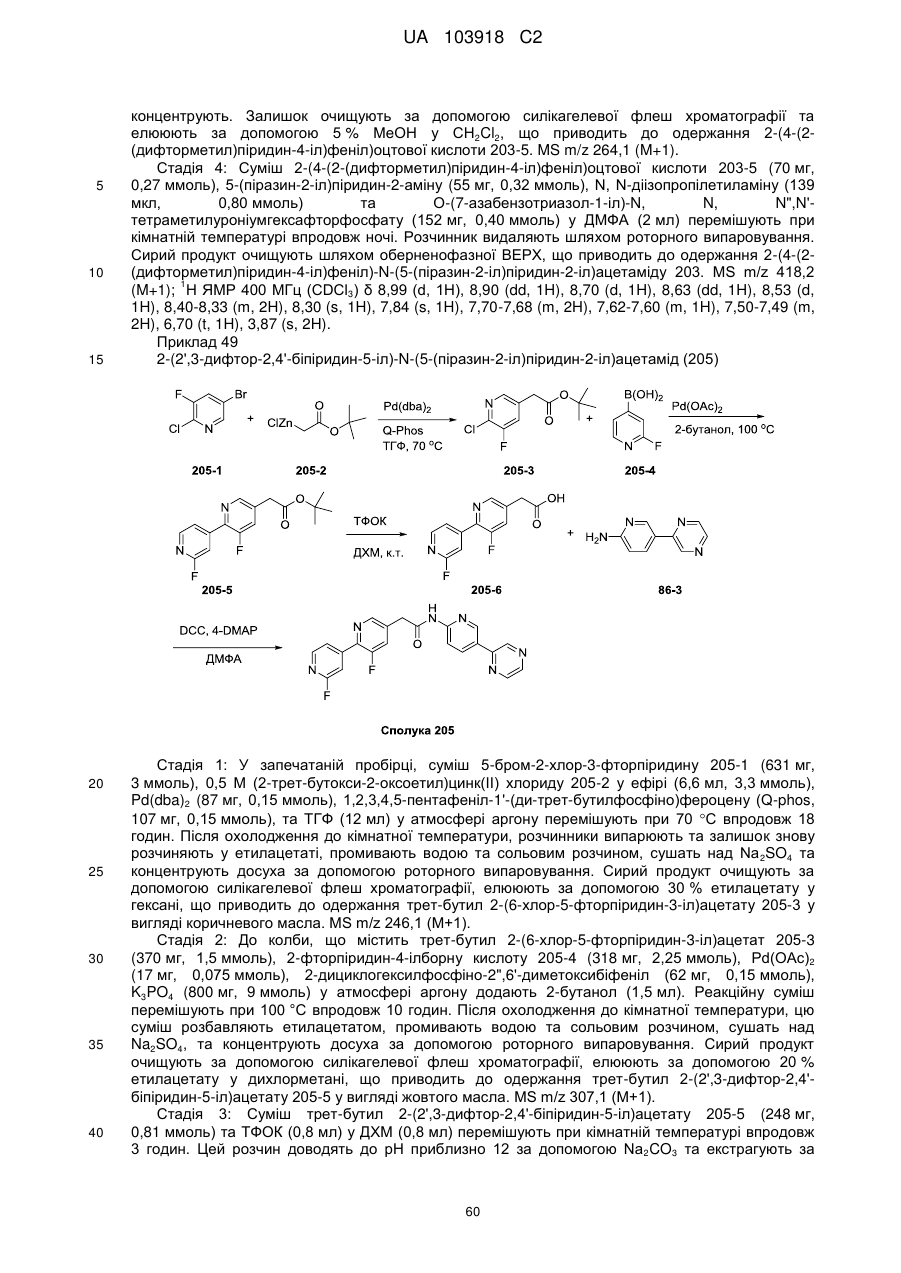
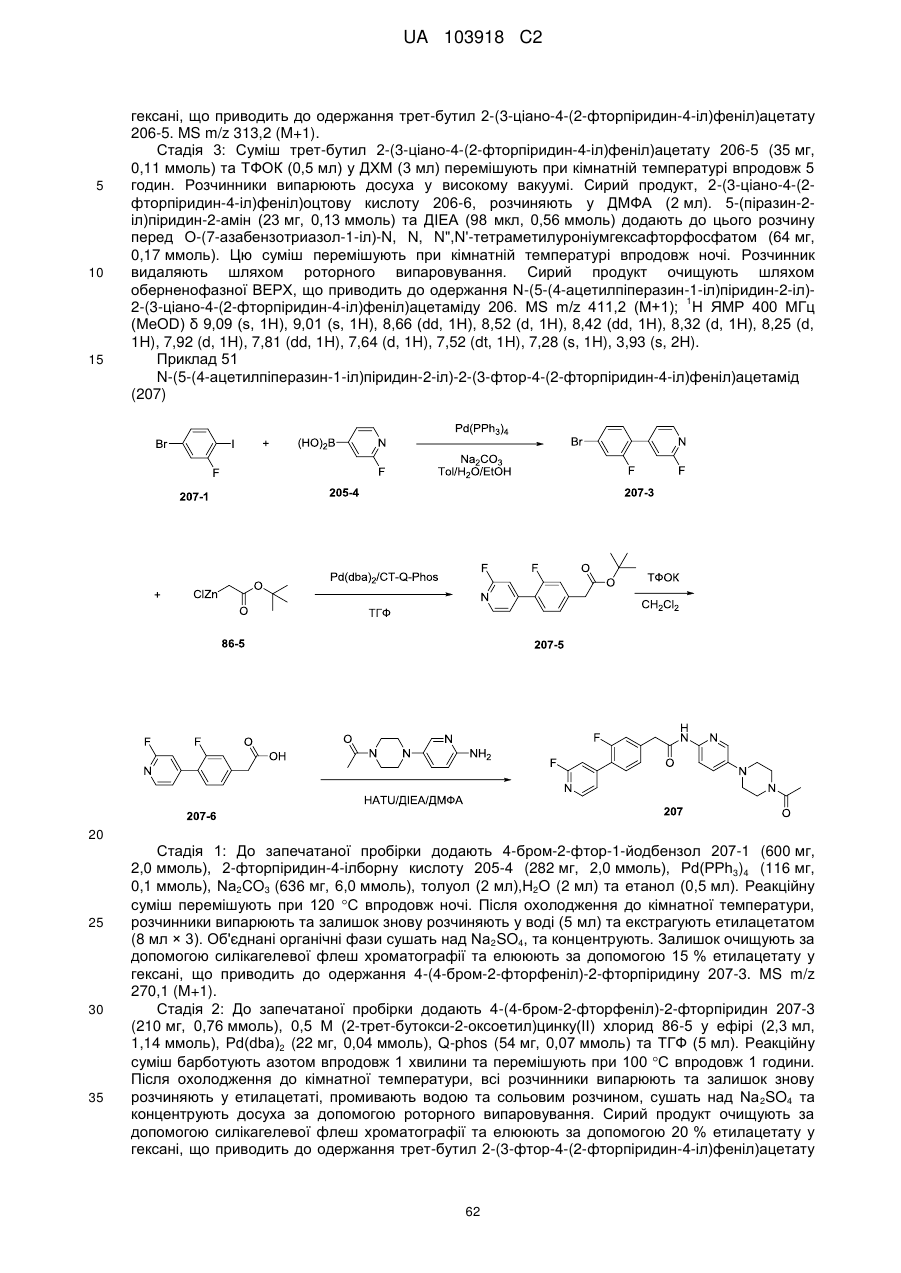
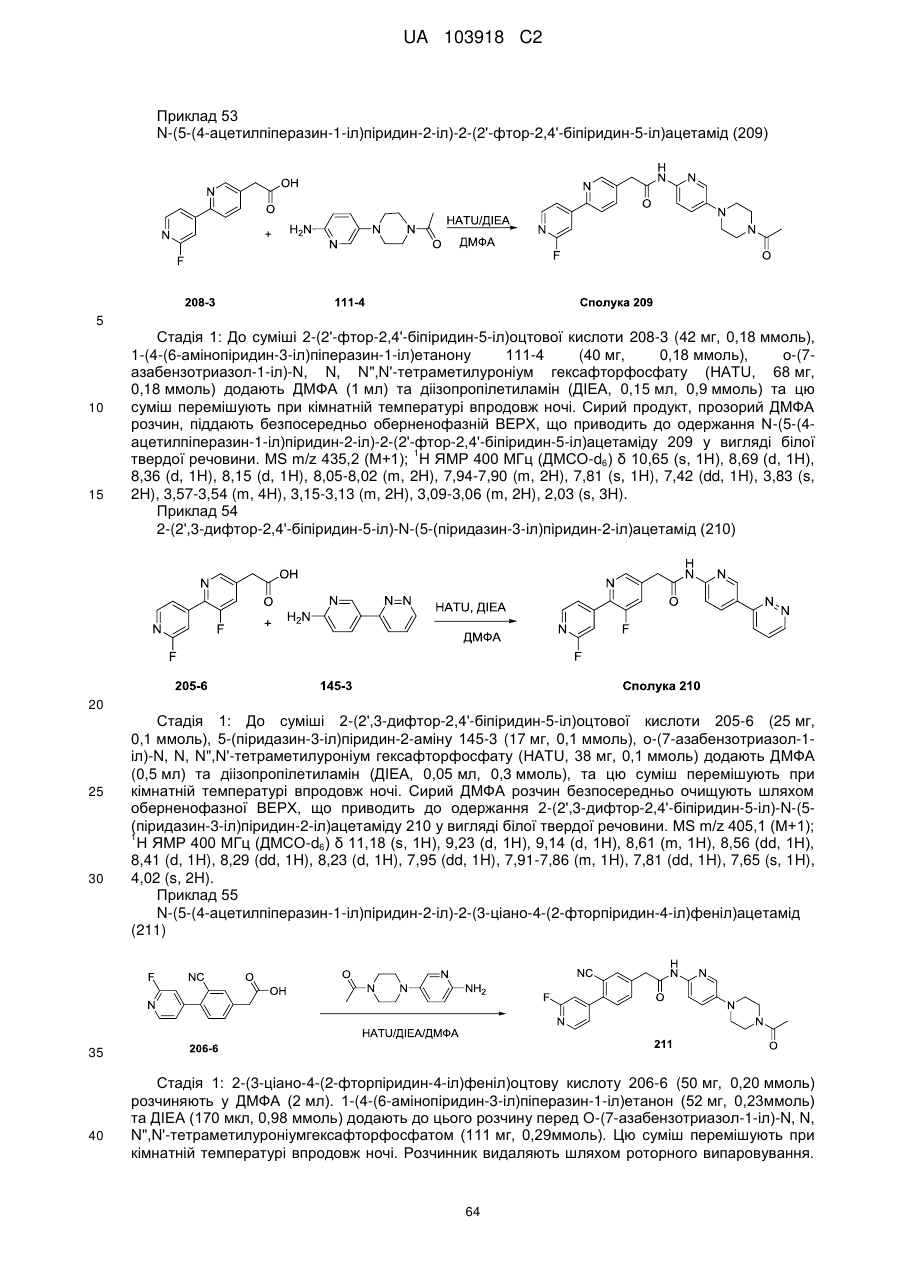
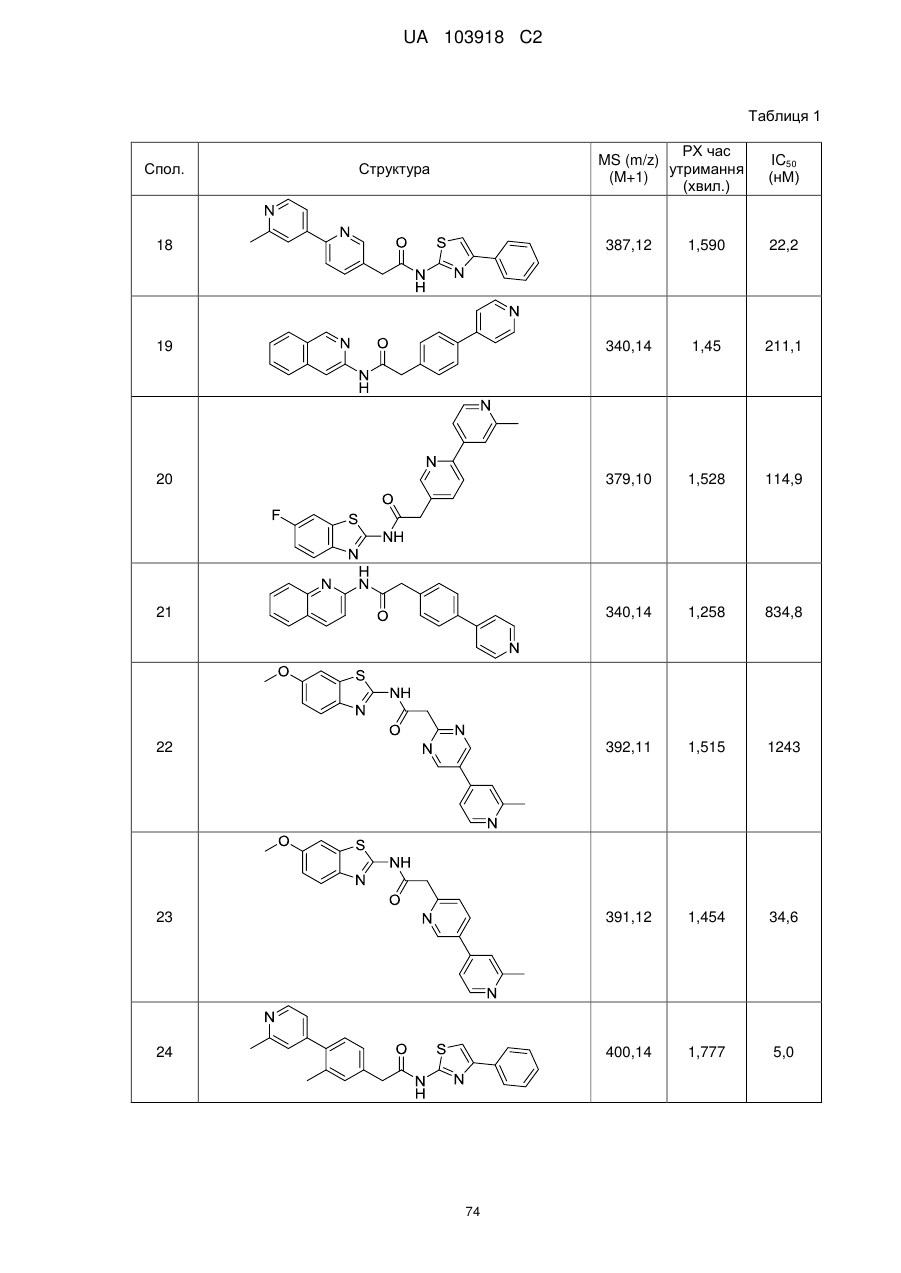
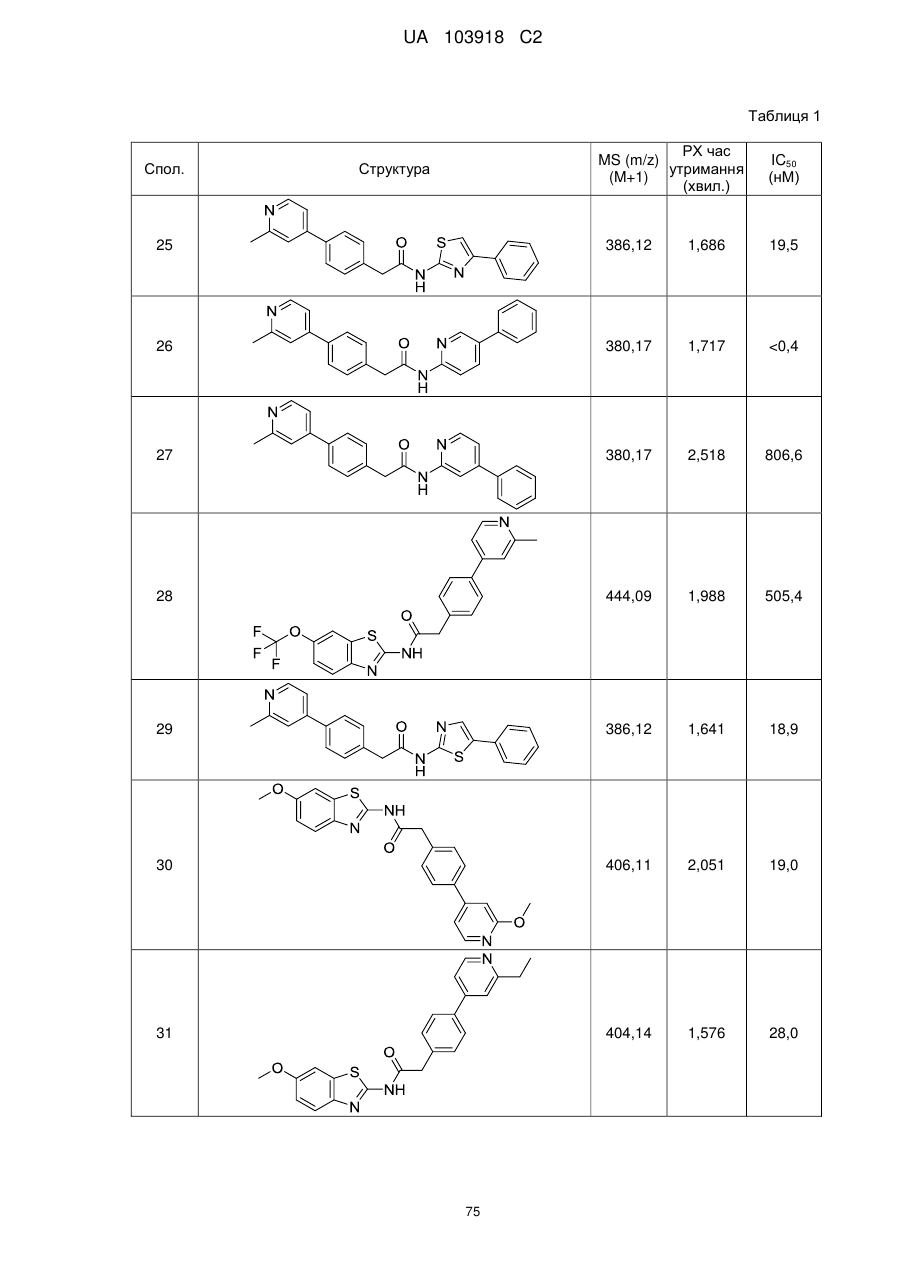
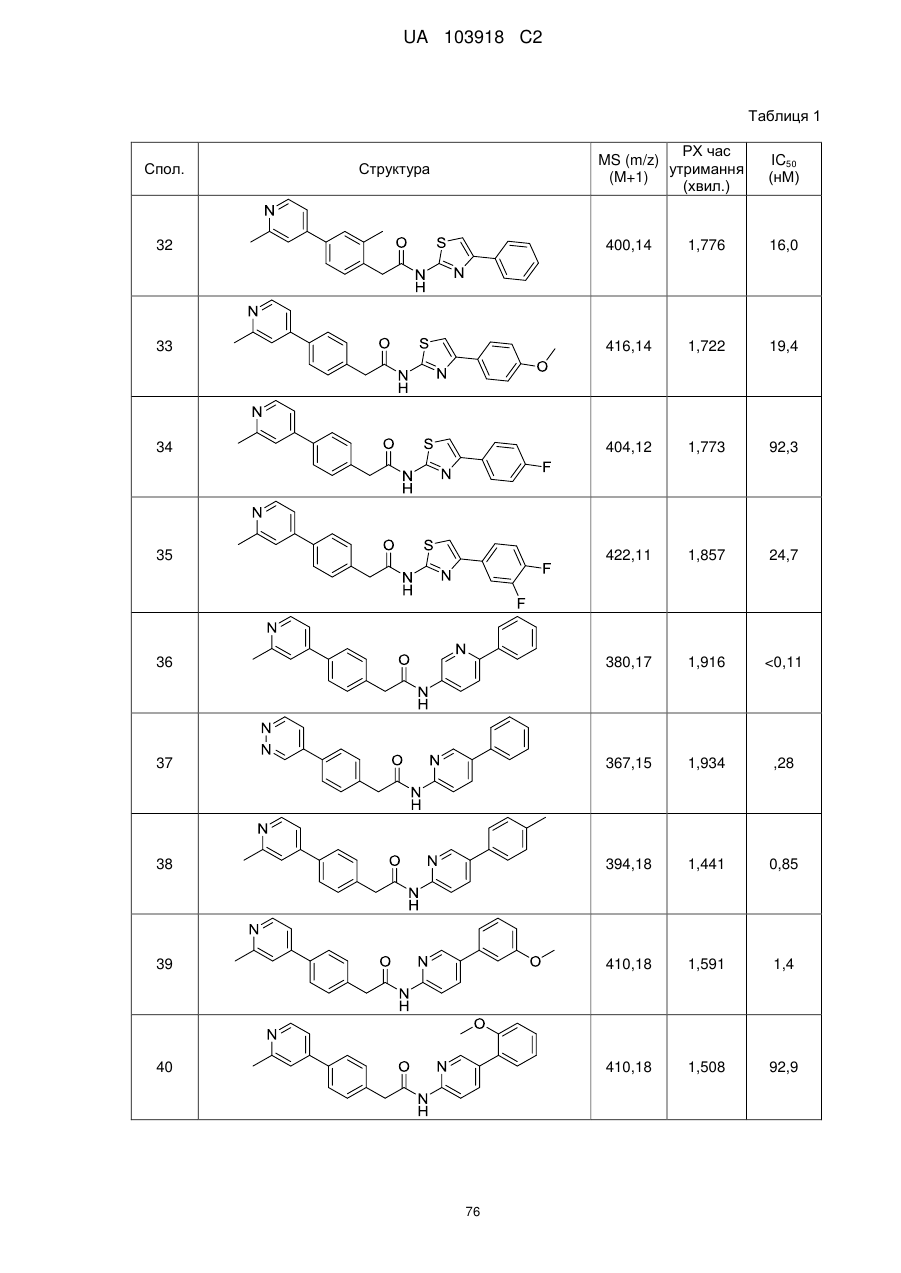
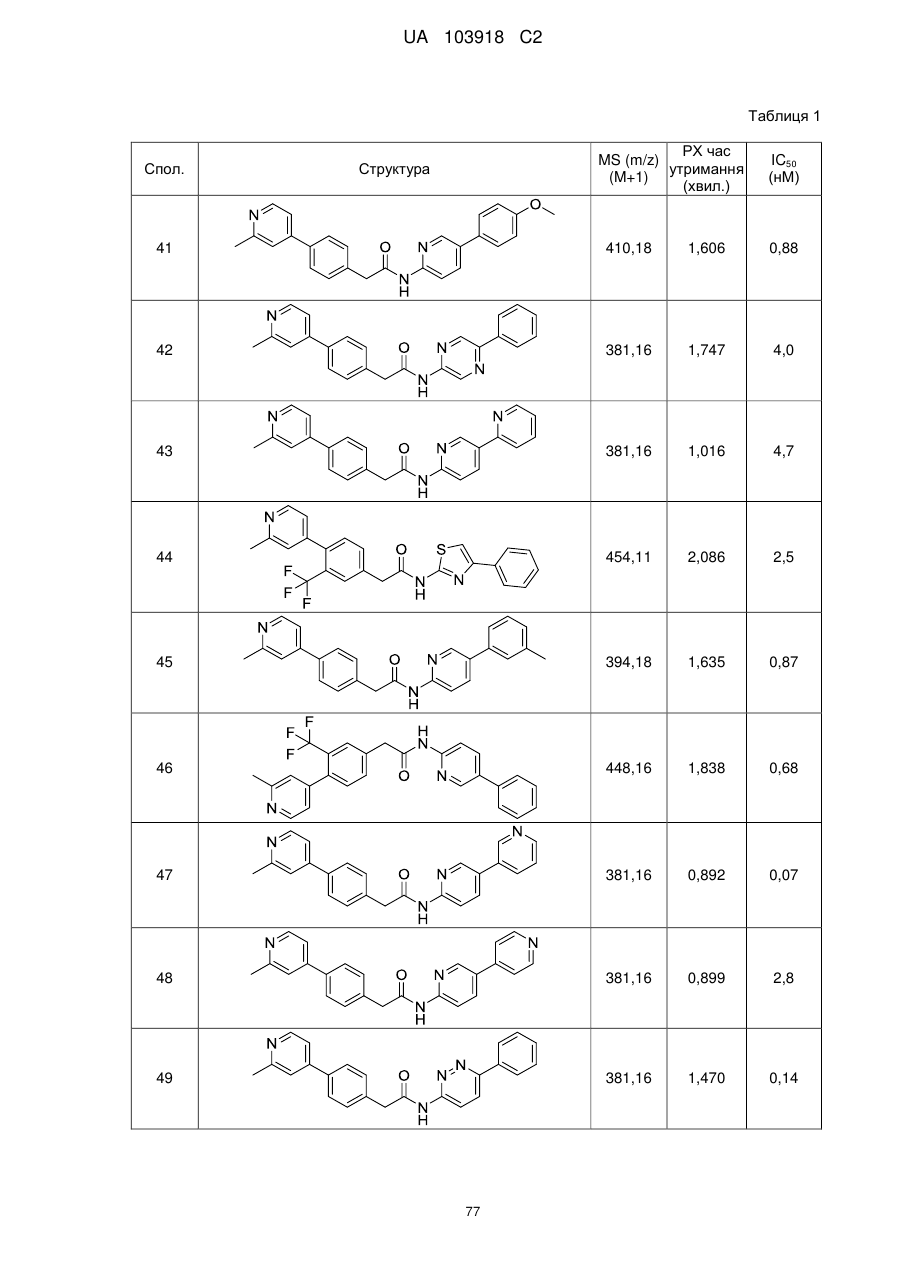
N-(гетеро)арил, 2-(гетеро)арилзаміщені ацетаміди для застосування як модуляторів wnt передачі сигналу
Номер патенту: 103918
Опубліковано: 10.12.2013
Автори: Ченг Деї, Хан Донг, Жанг Гуобао, Гао Венці, Пан Шіфенг
Формула / Реферат
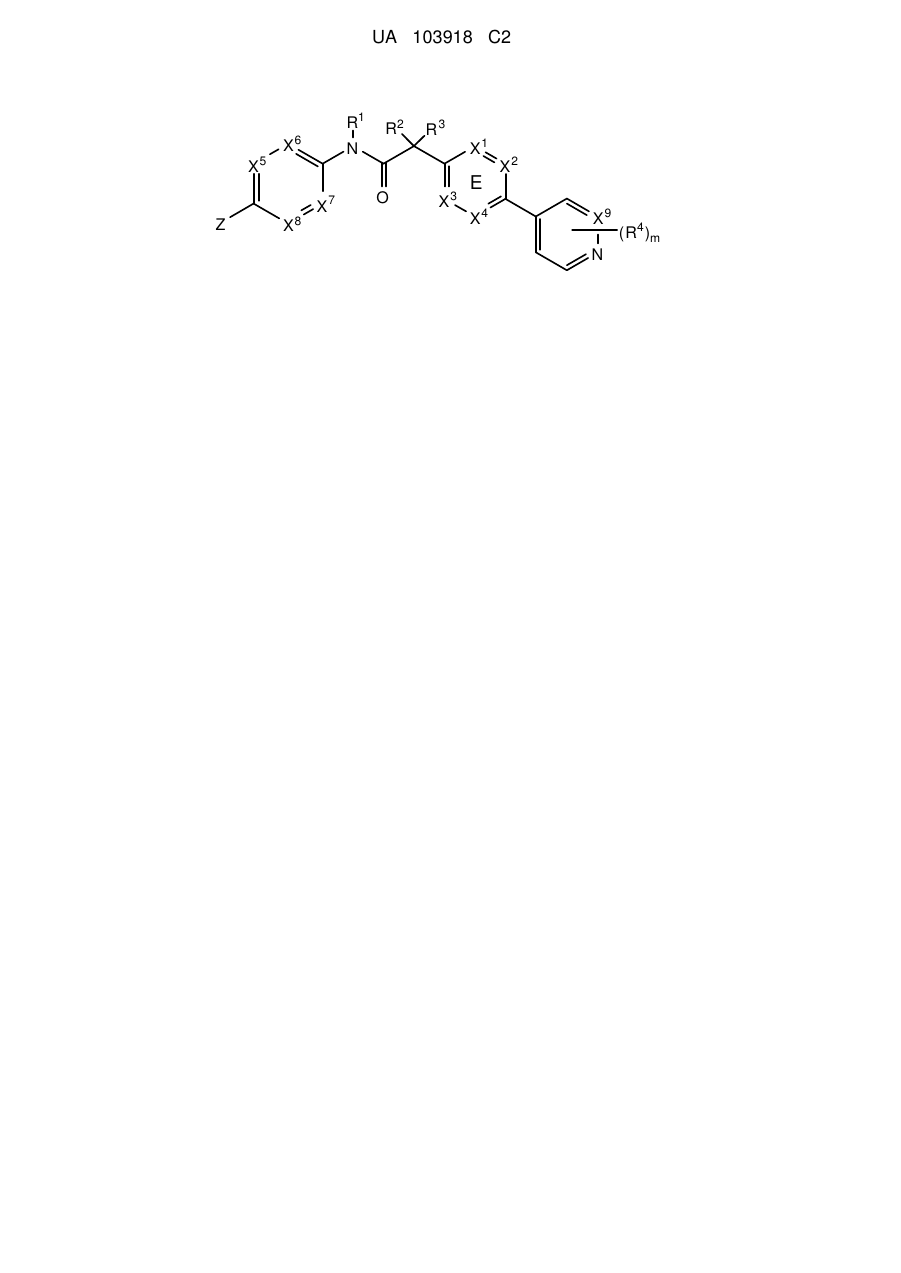
1. Сполука, що має Формулу (6):
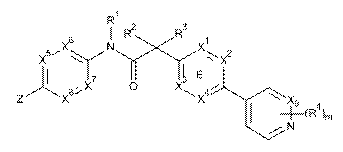 , (6)
, (6)
або її фізіологічно прийнятна сіль, у якій:
X1, X2, X3 та X4 вибирають з N та CR7;
один з X5, X6, X7 та X8 являє собою N та інші являють собою СН;
X9 вибирають з N та СН;
Z вибирають з таких як: феніл, піразиніл, піридиніл, піридазиніл та піперазиніл; де кожен феніл, піразиніл, піридиніл, піридазиніл або піперазиніл радикала Z необов'язково заміщений R6-групою;
R1, R2 та R3 являють собою водень;
m являє собою 1;
R4 вибирають з таких як: водень, галогрупа, дифторметил, трифторметил та метил;
R6 вибирають з таких як: водень, галогрупа та -C(O)R10; де R10 являє собою метил; та
R7 вибирають з таких як: водень, галогрупа, ціаногрупа, метил та трифторметил.
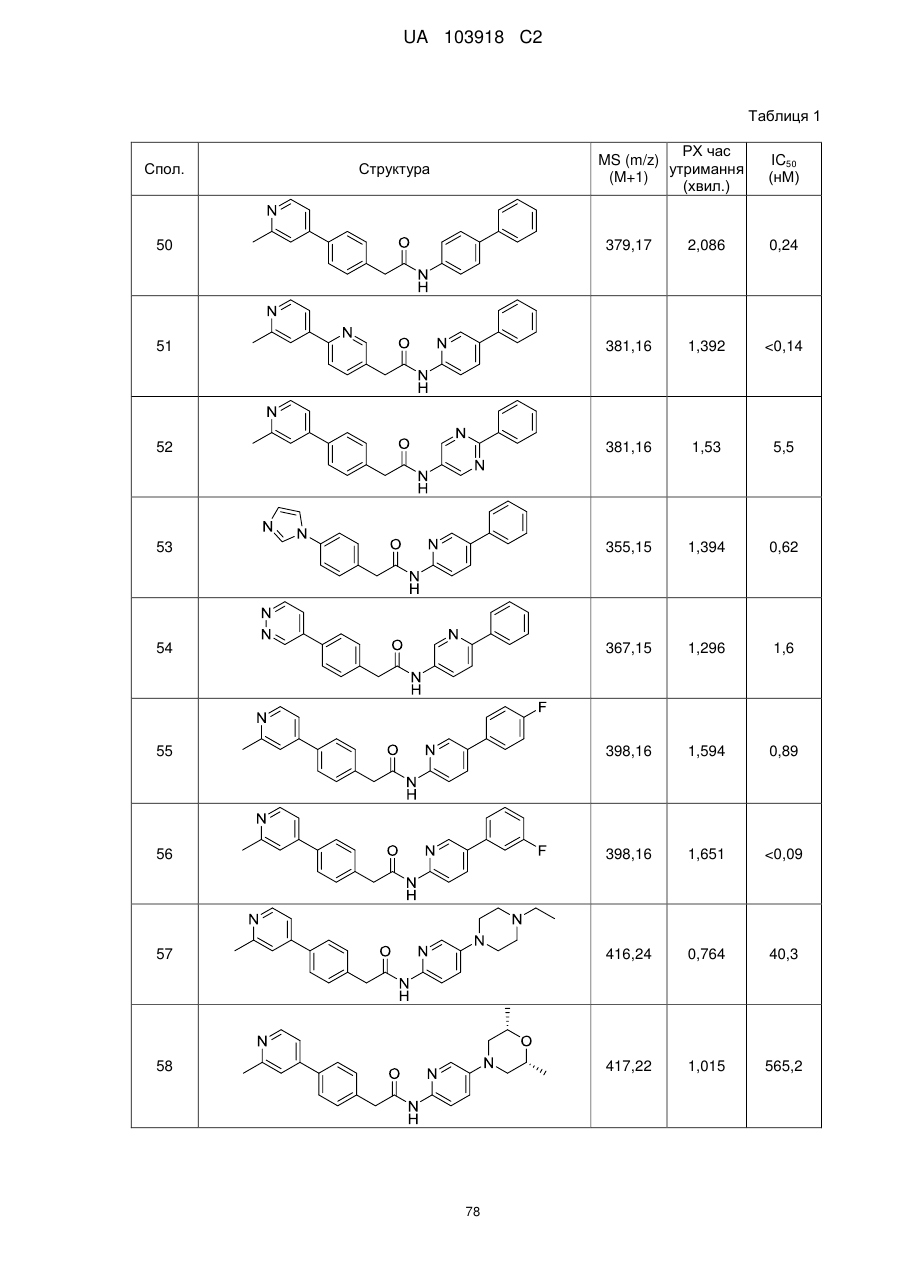
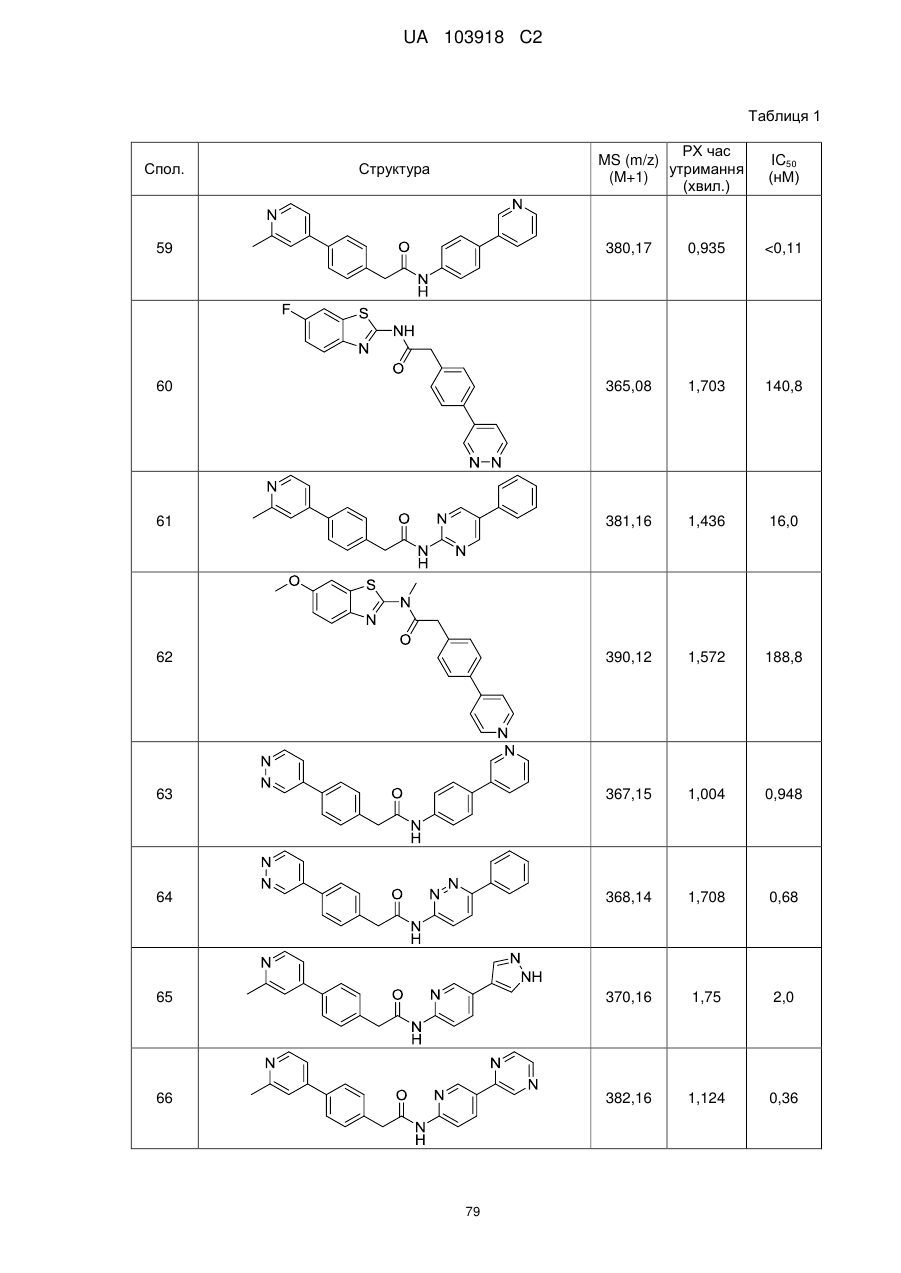
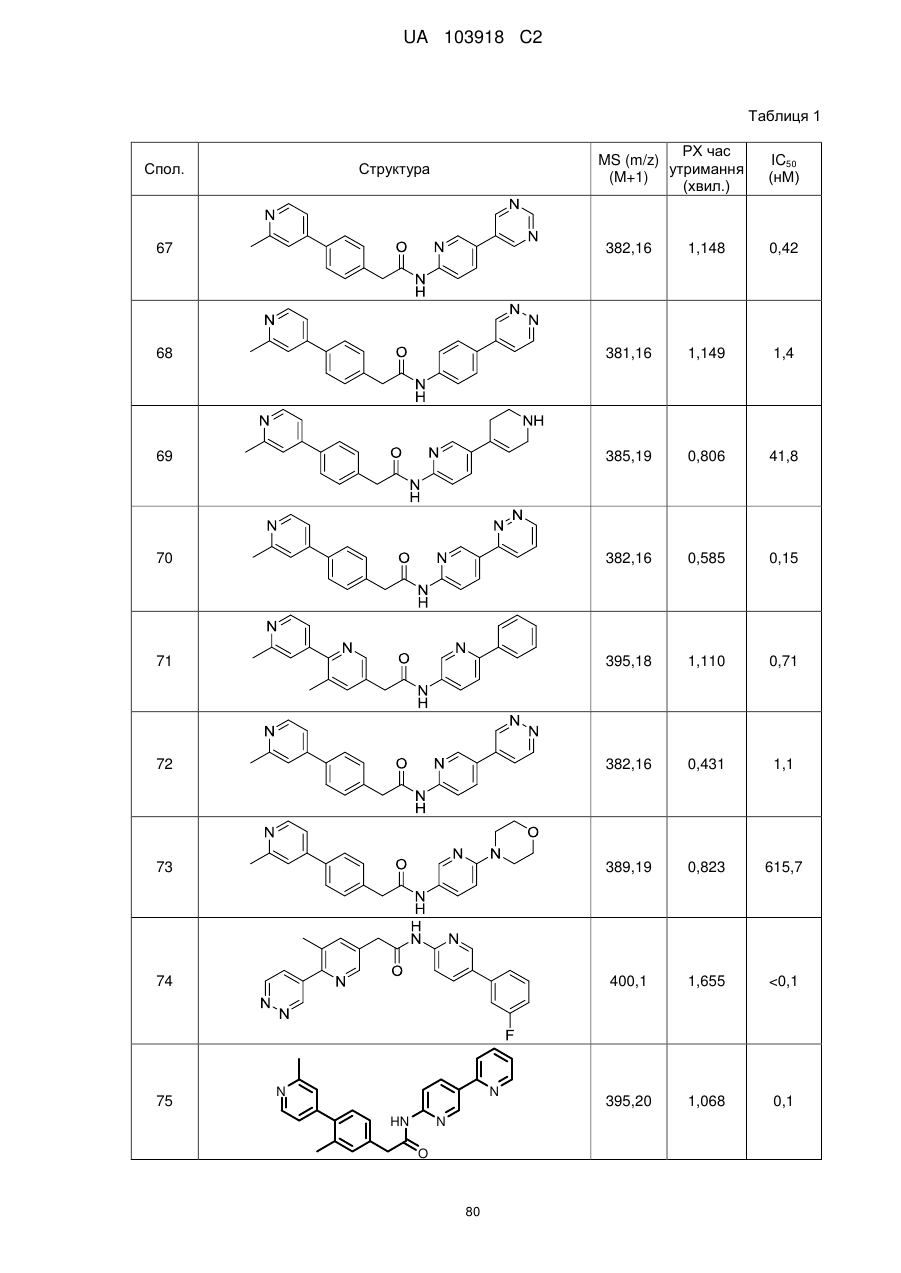
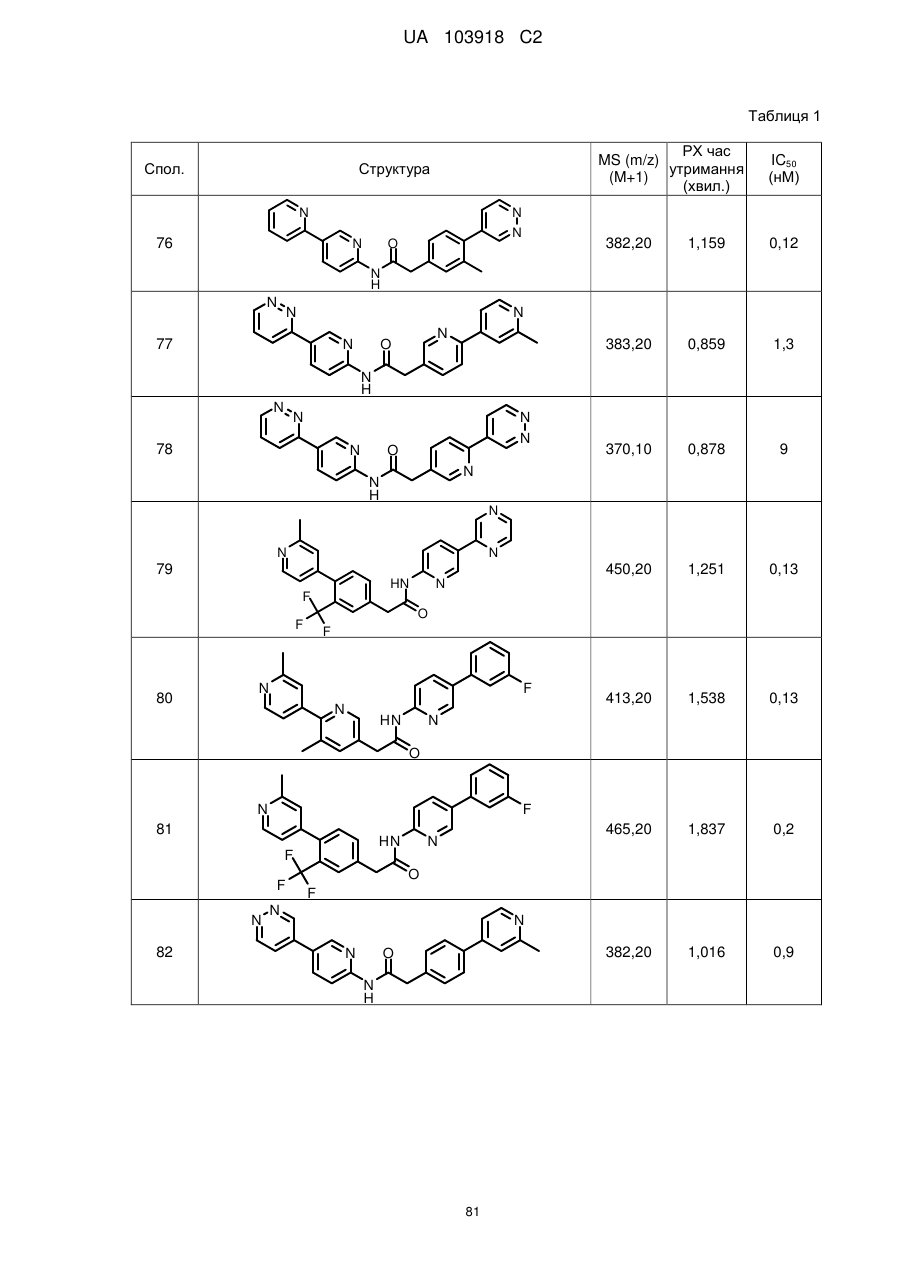
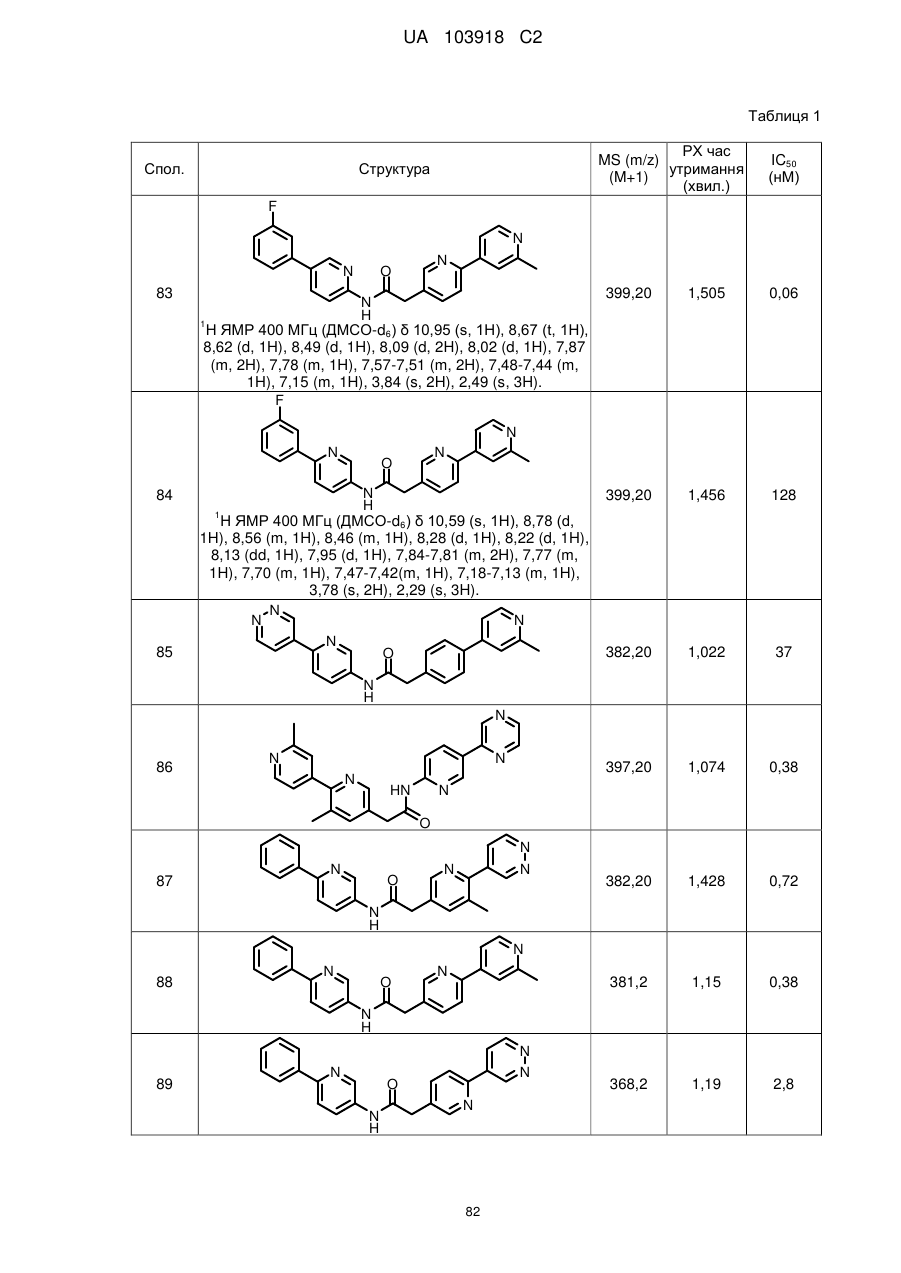
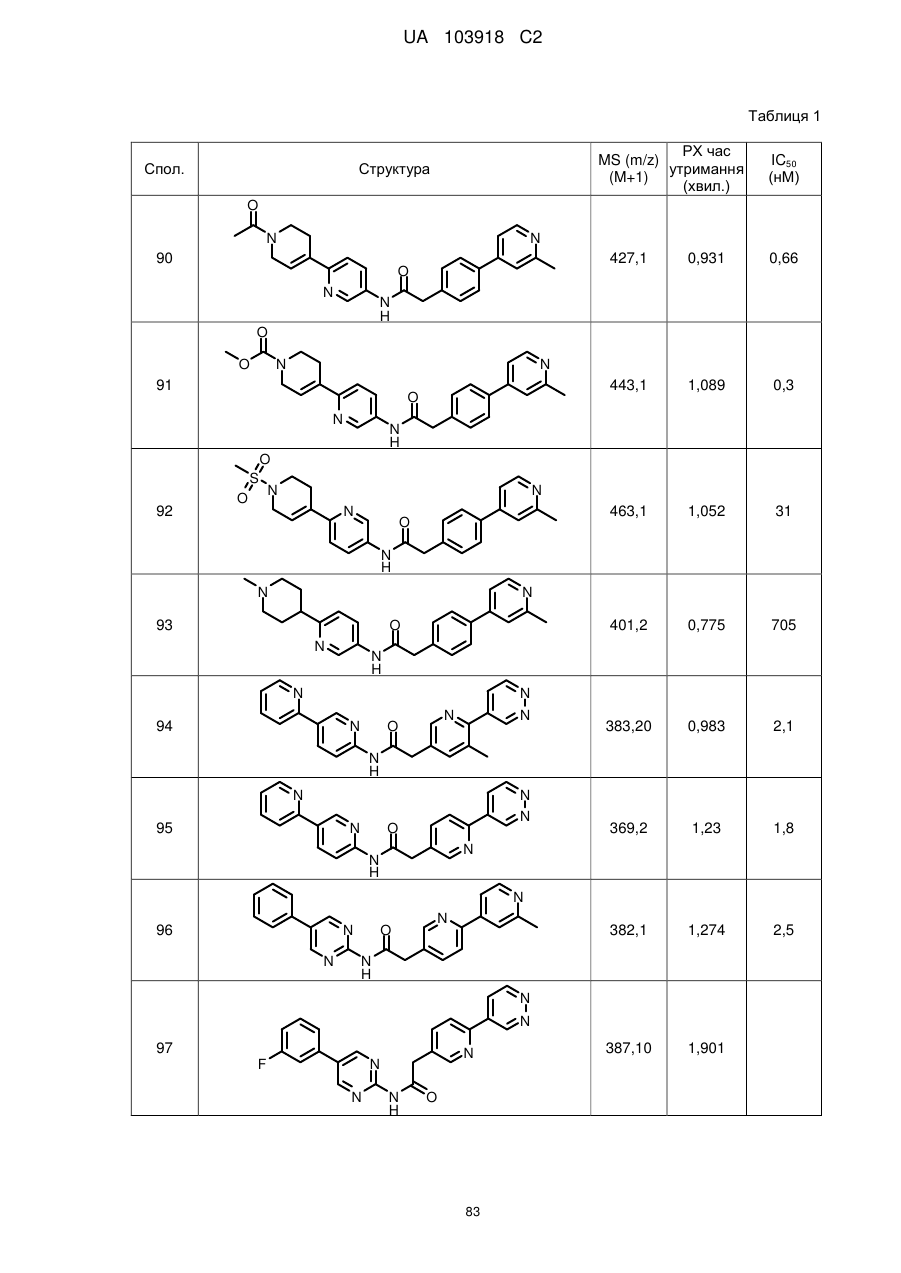
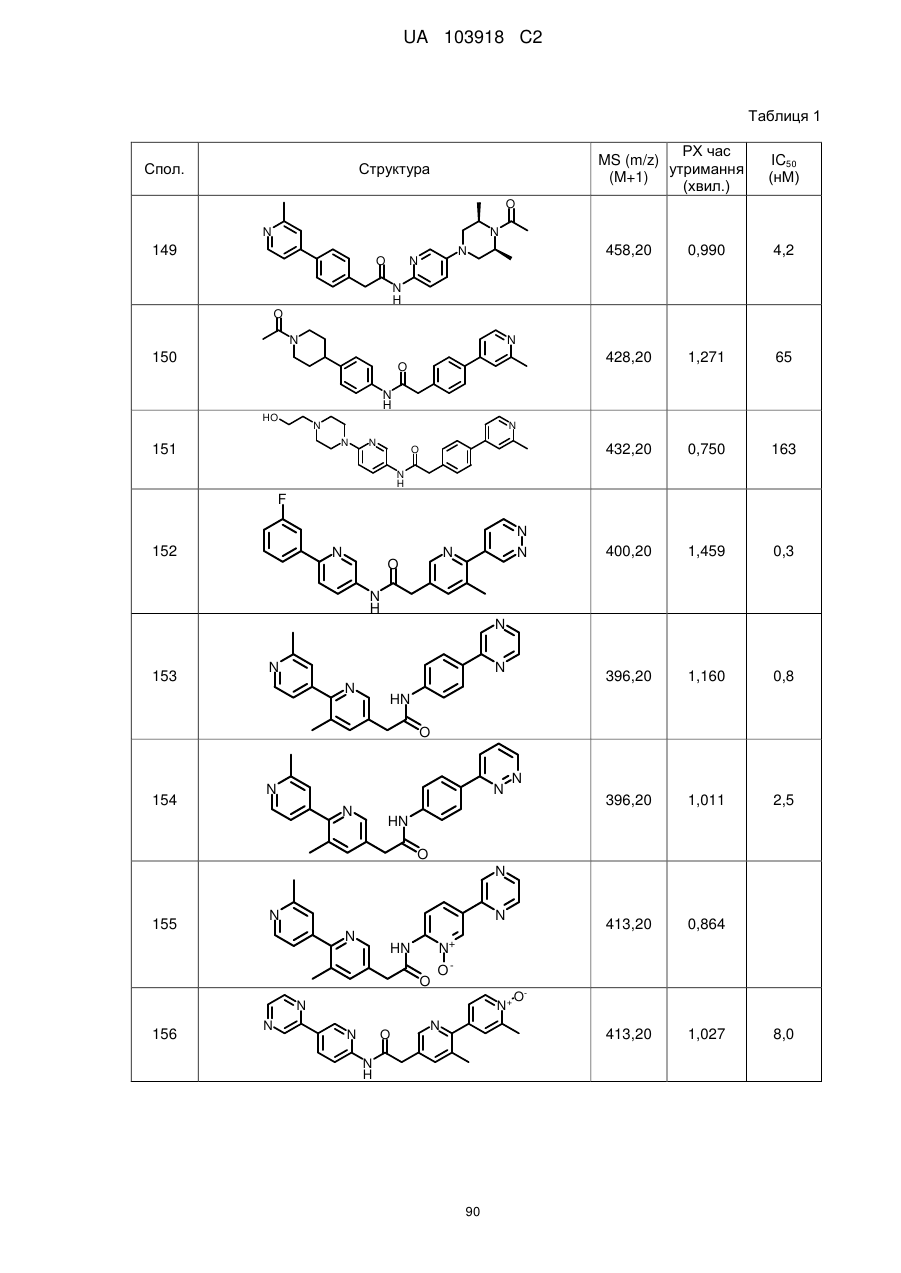
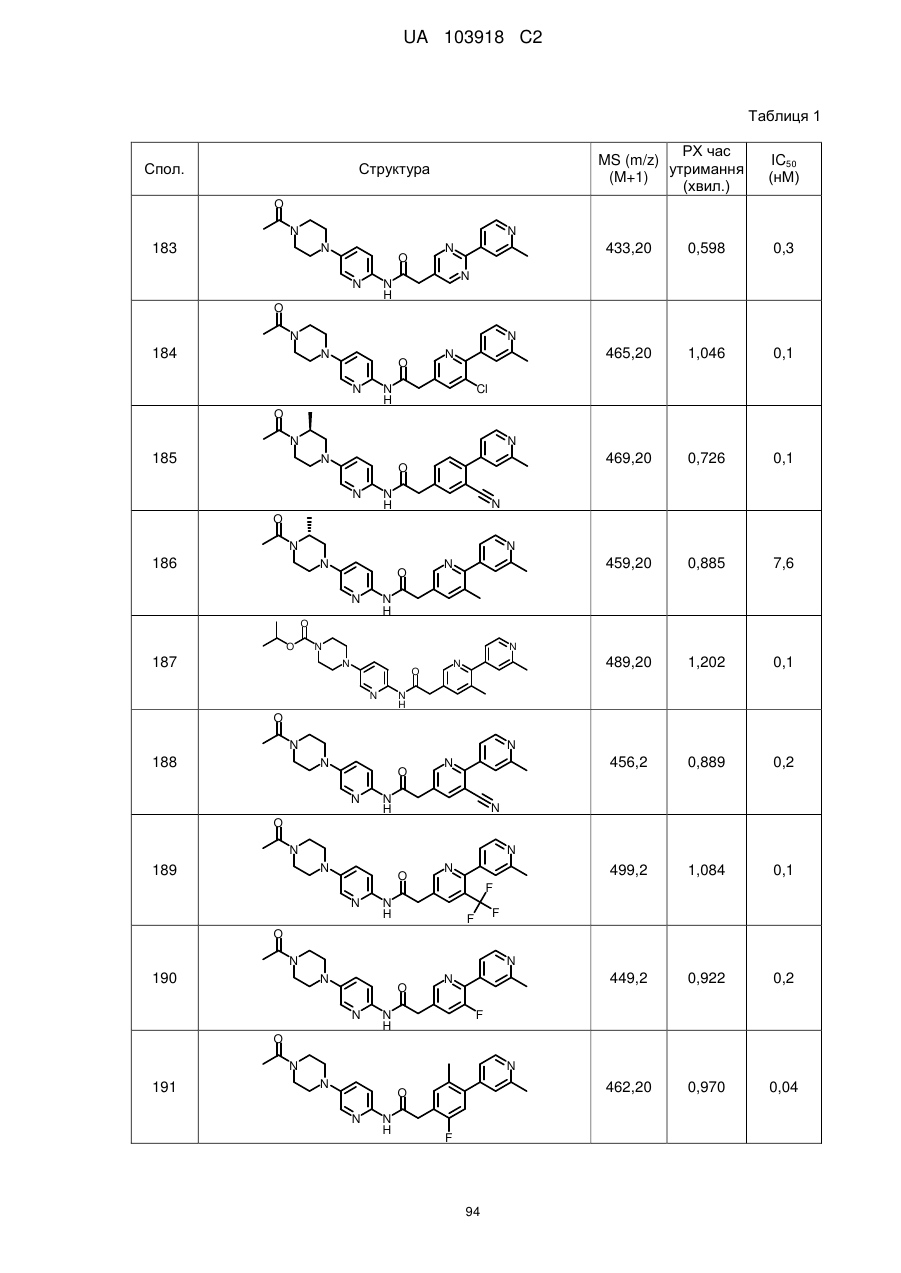
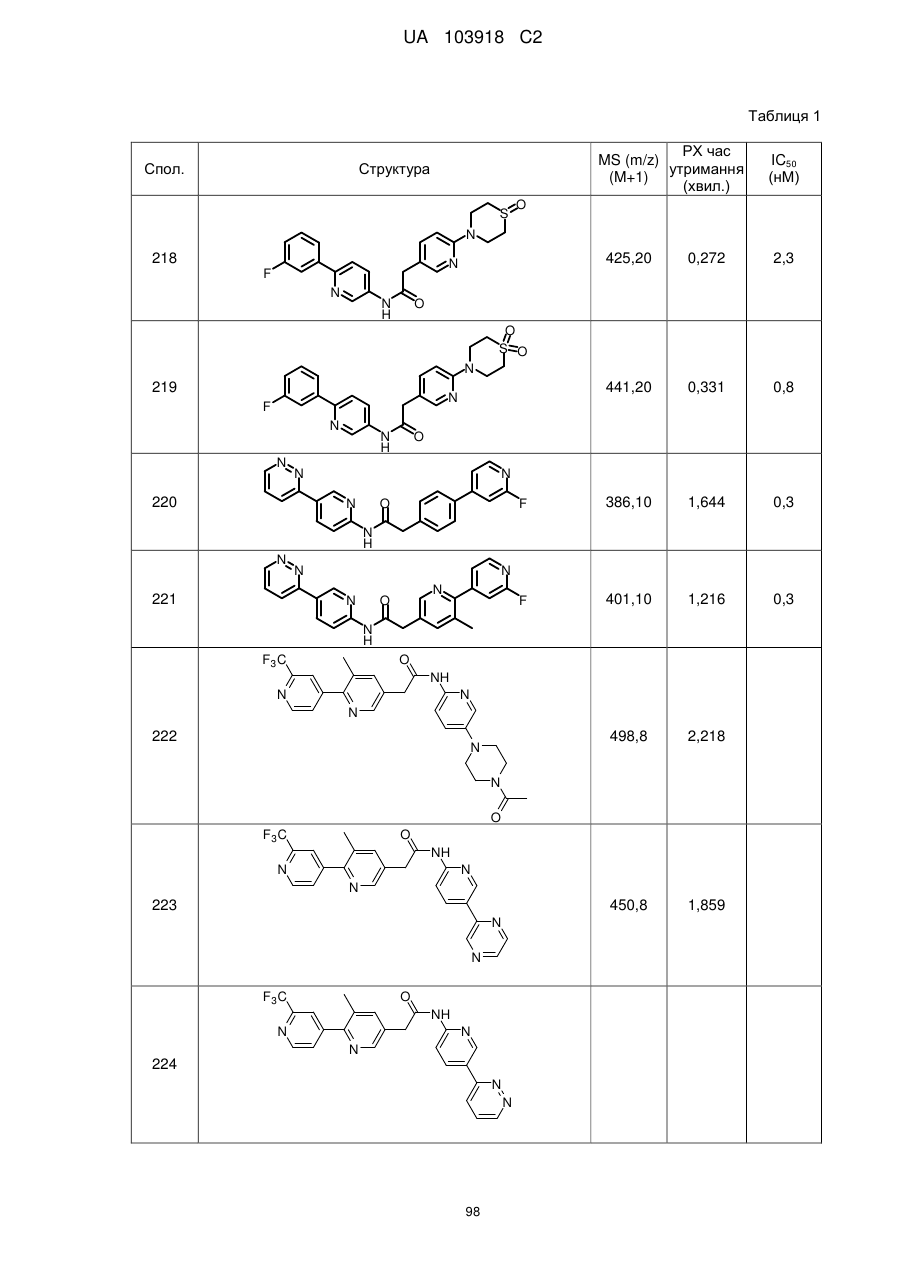
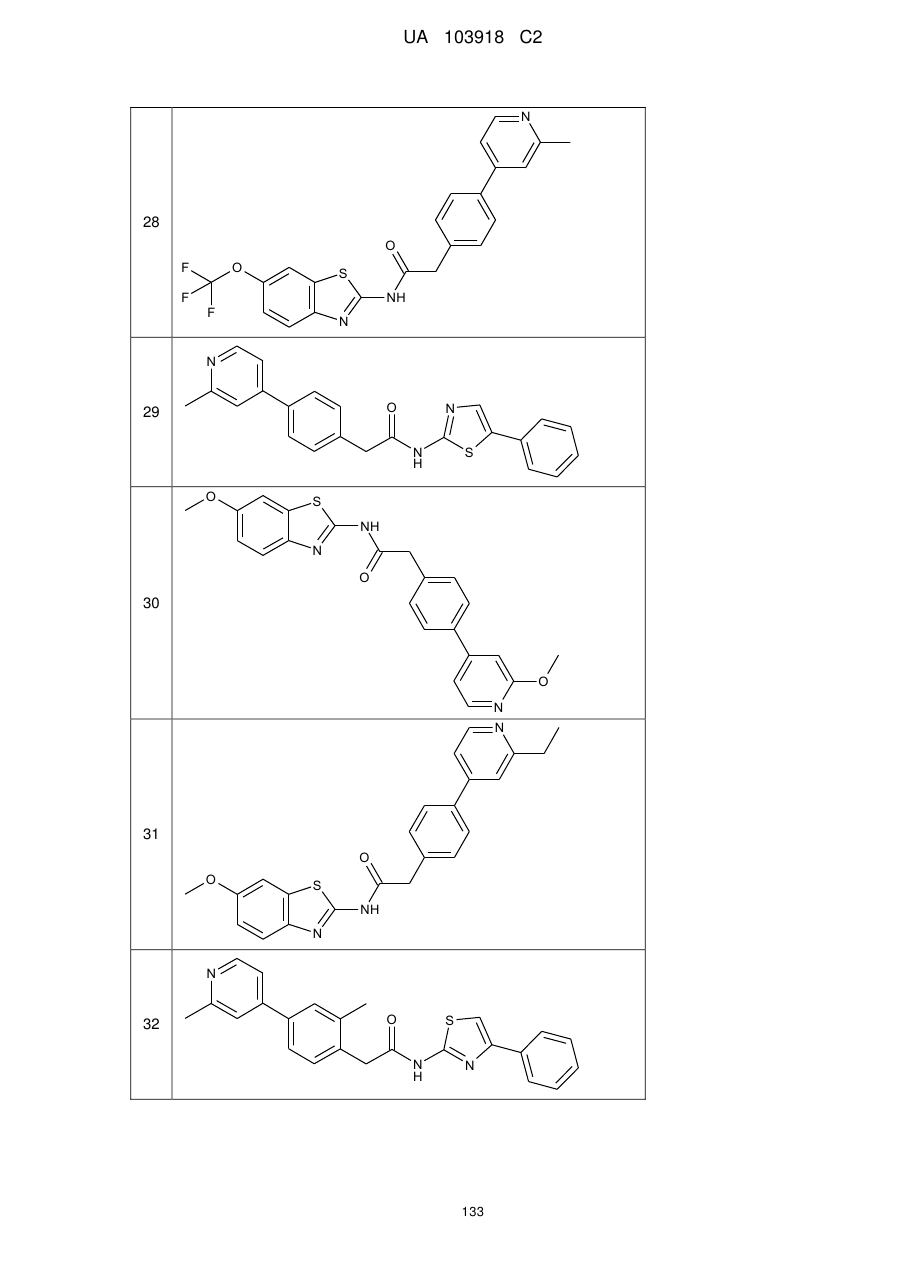
2. Сполука за п. 1, вибрана з таких як:
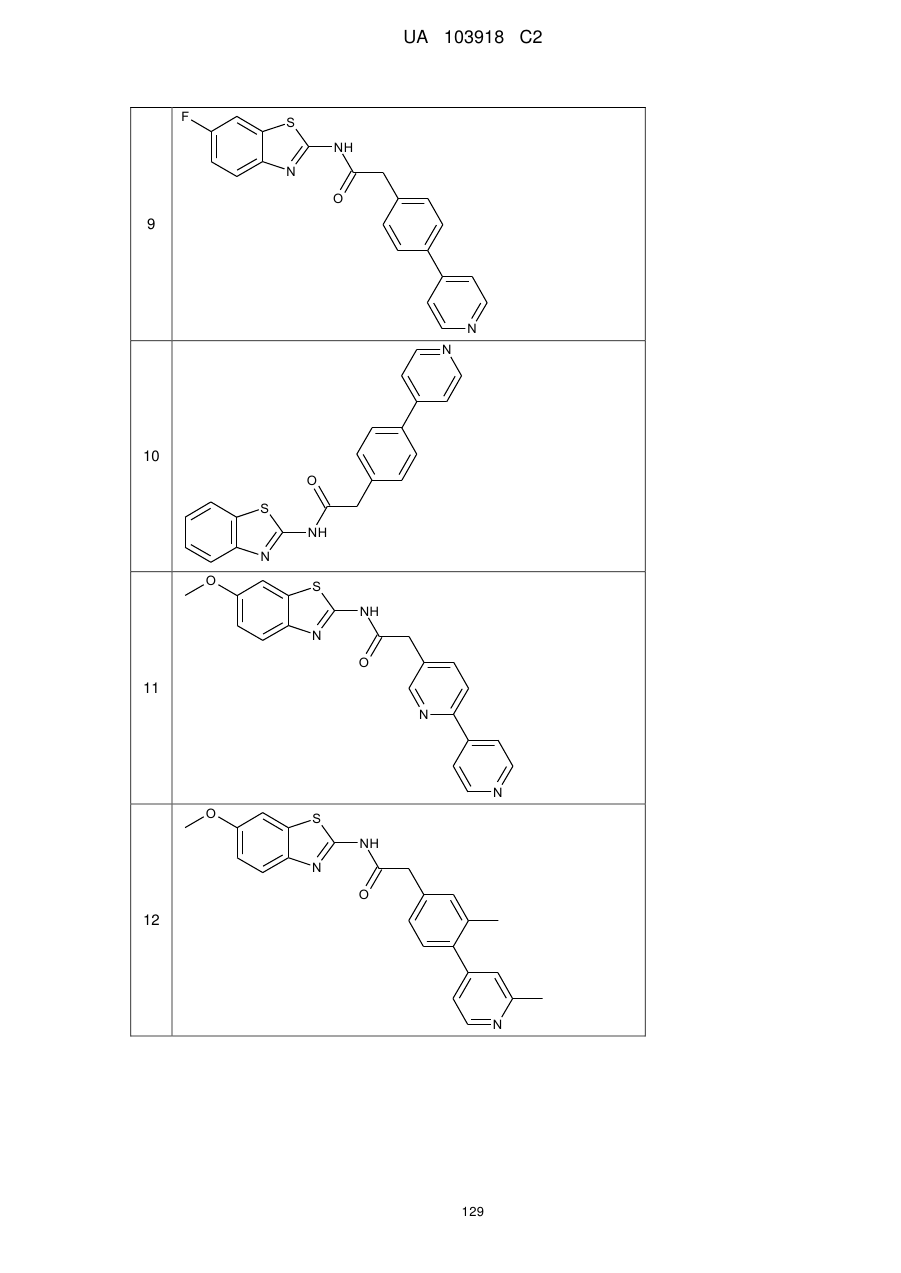
51
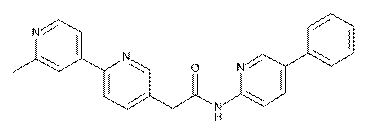
71
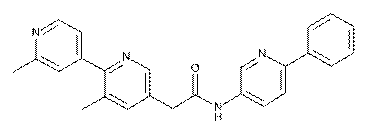
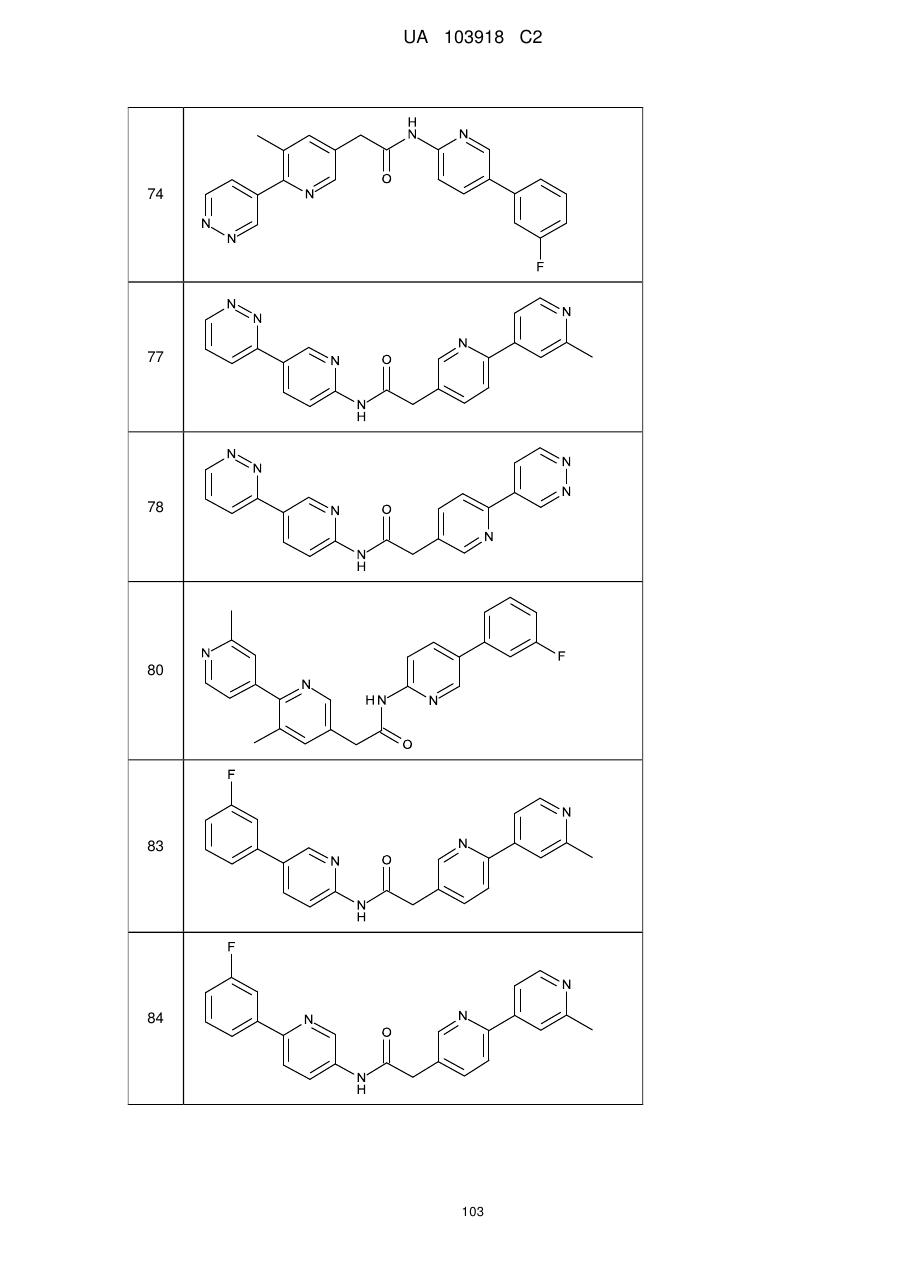
74
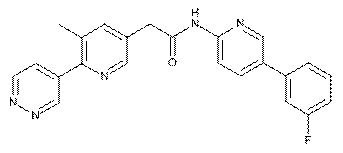
77
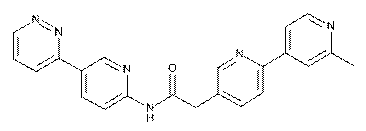
78
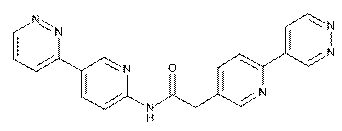
80
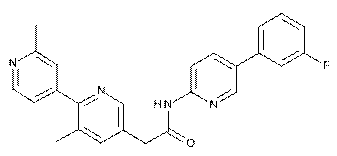
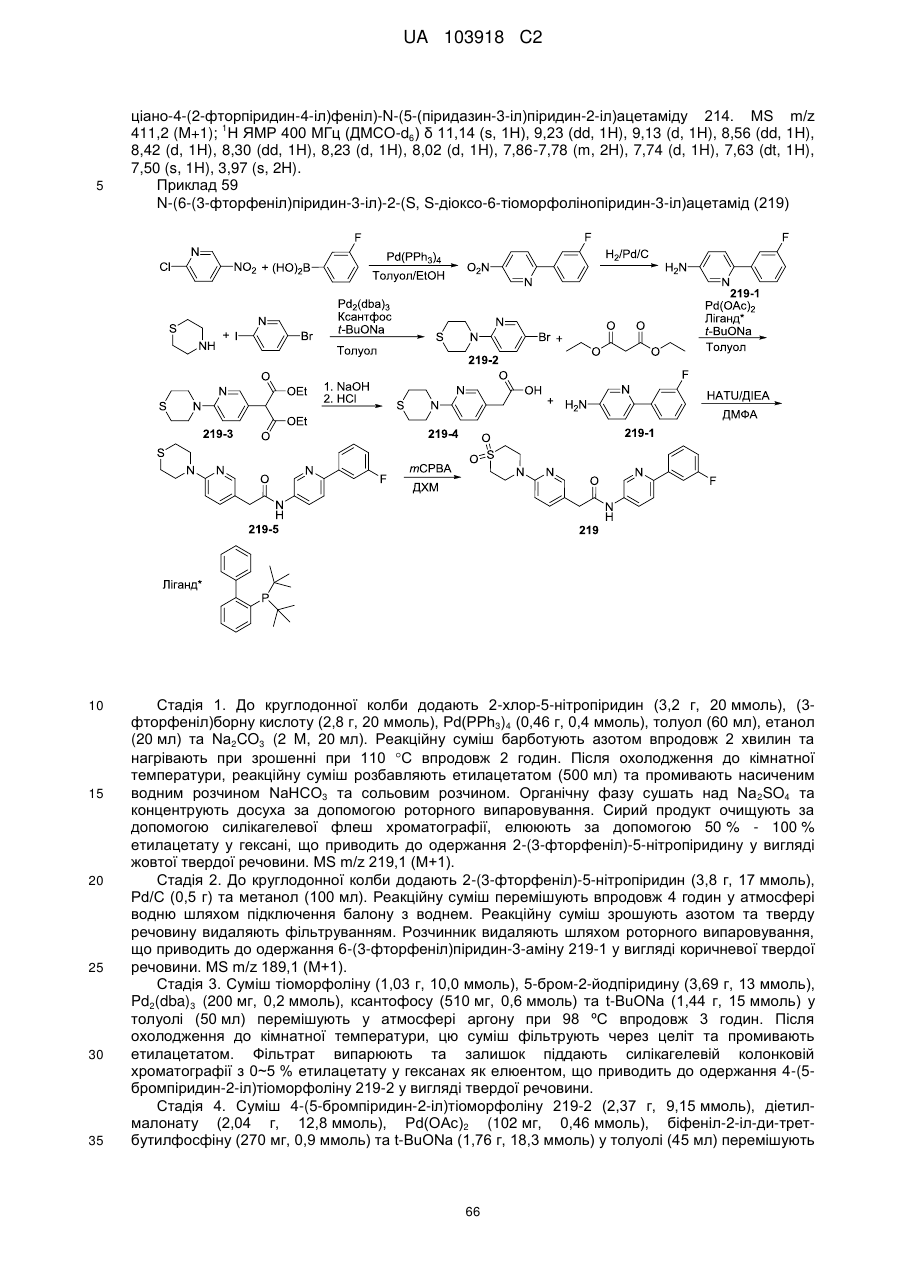
83
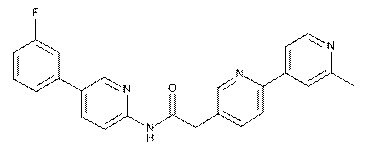
84
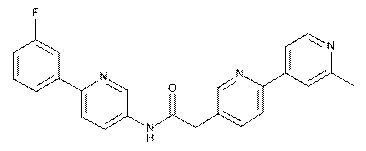
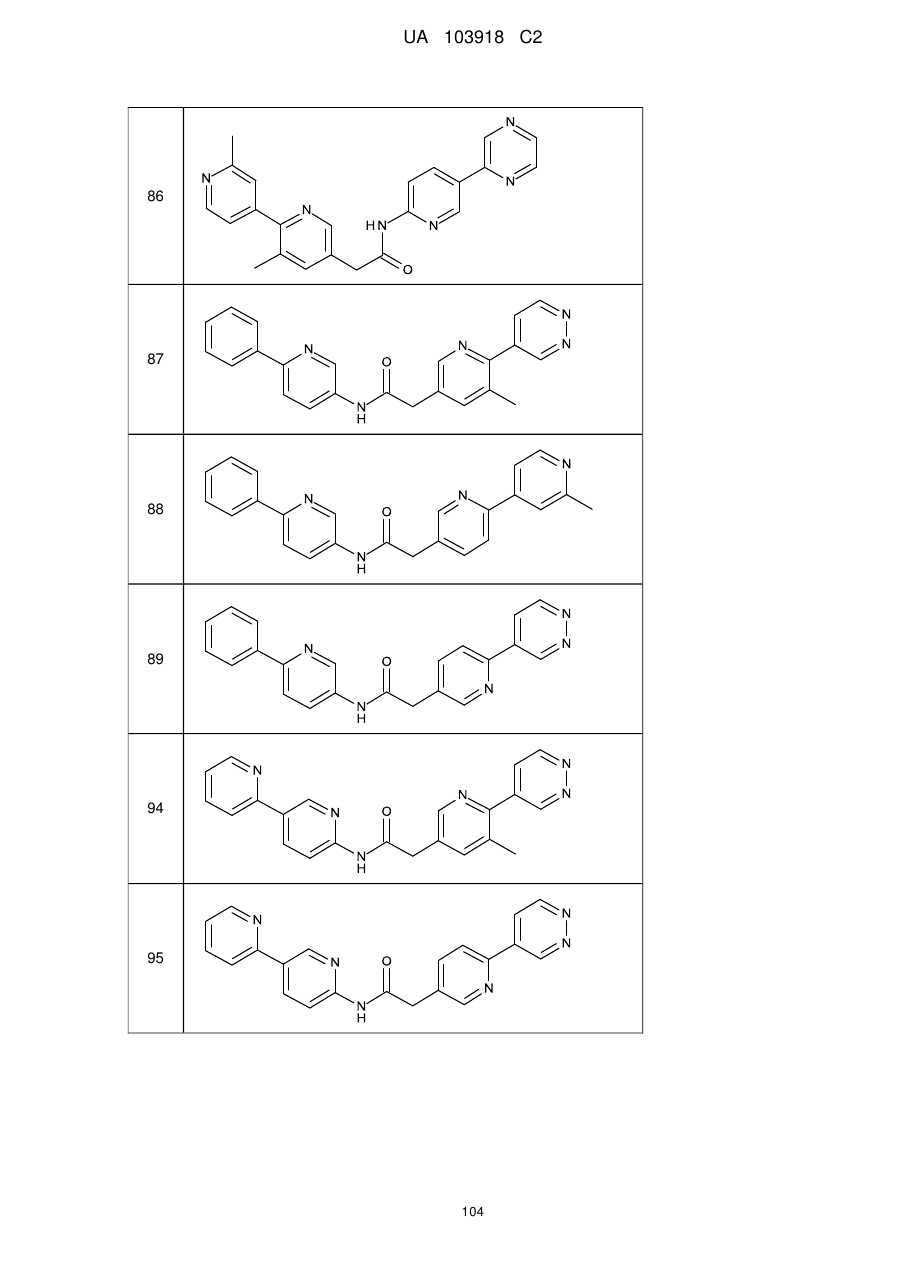
86
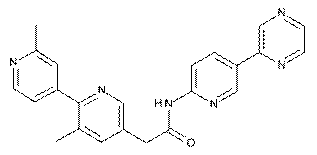
87
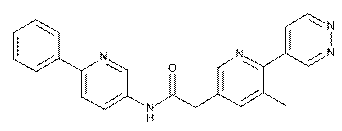
88
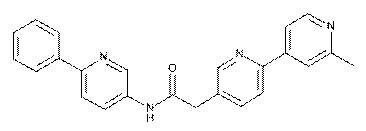
89
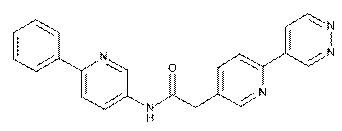
94
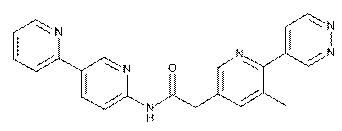
95
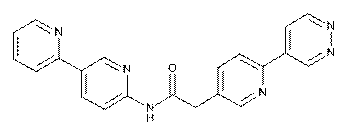
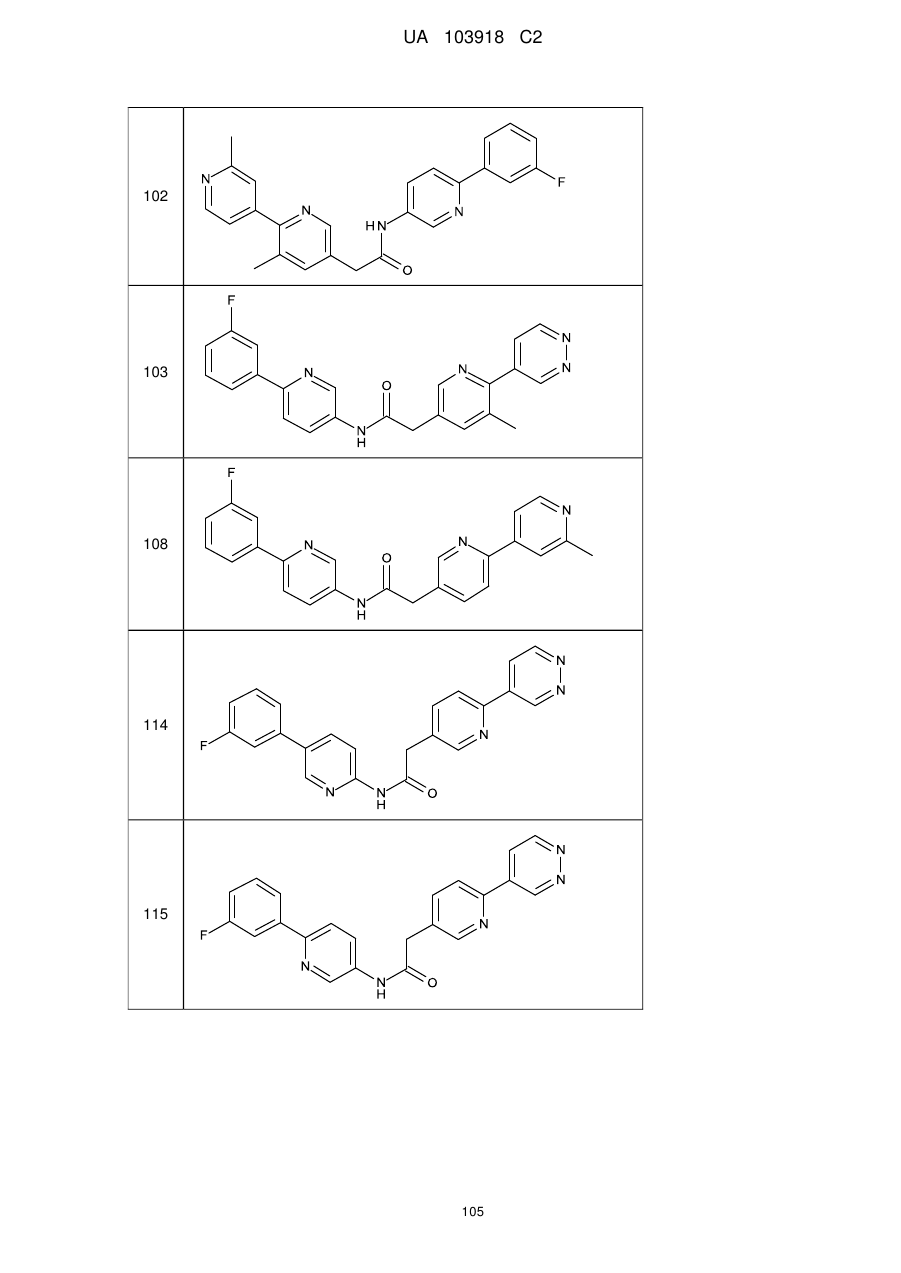
102
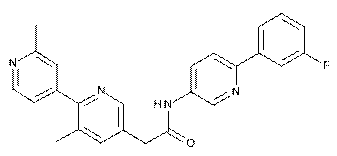
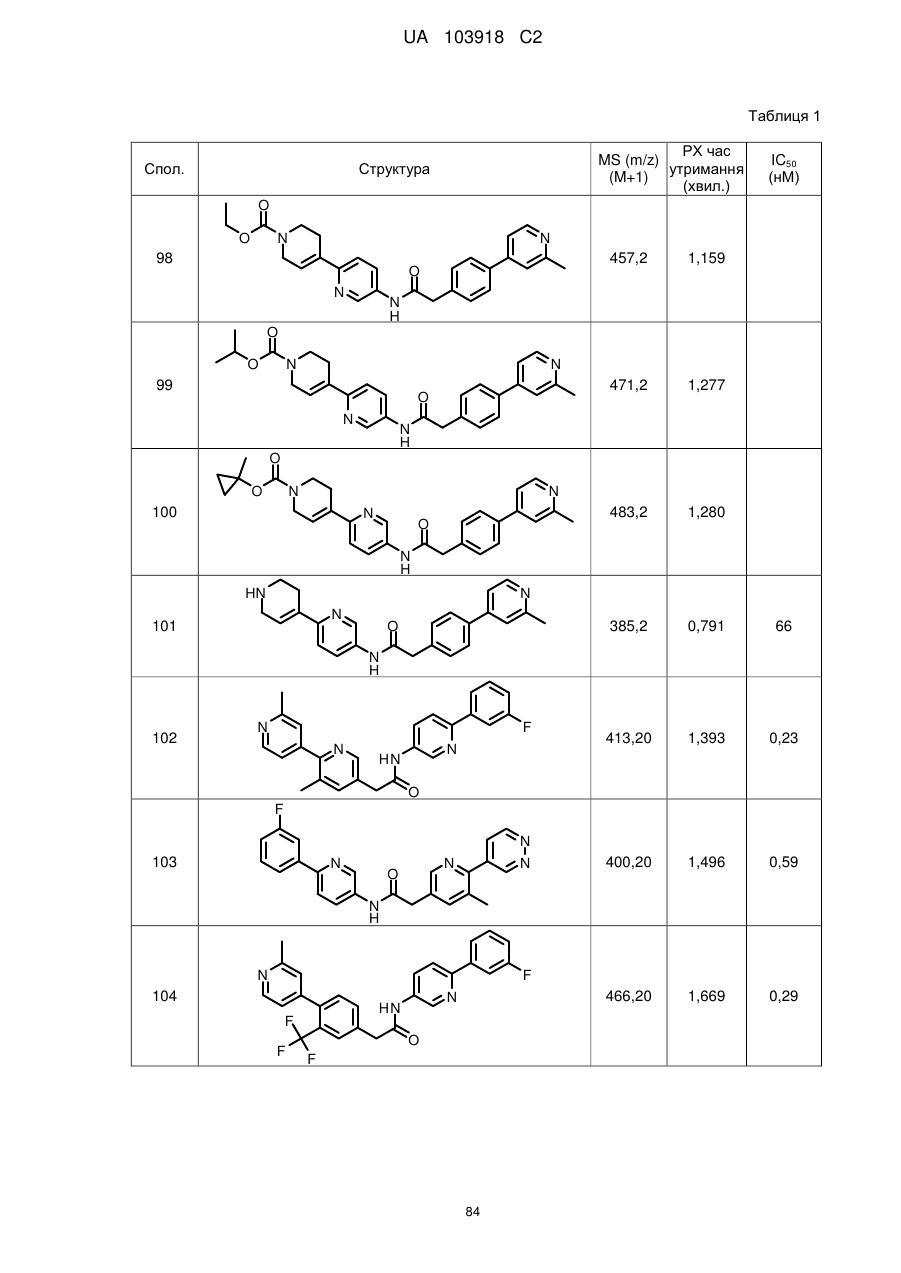
103
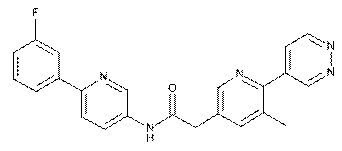
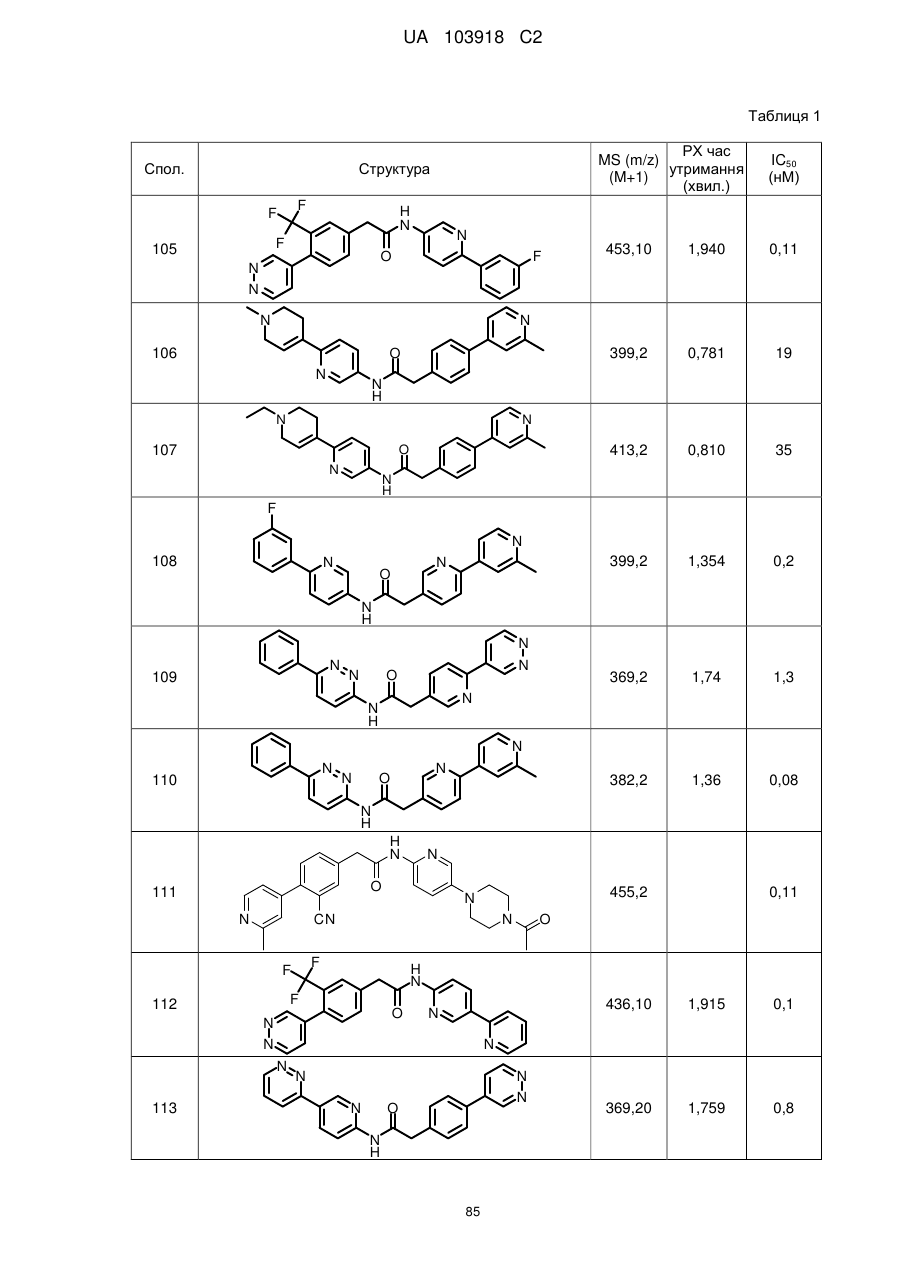
108

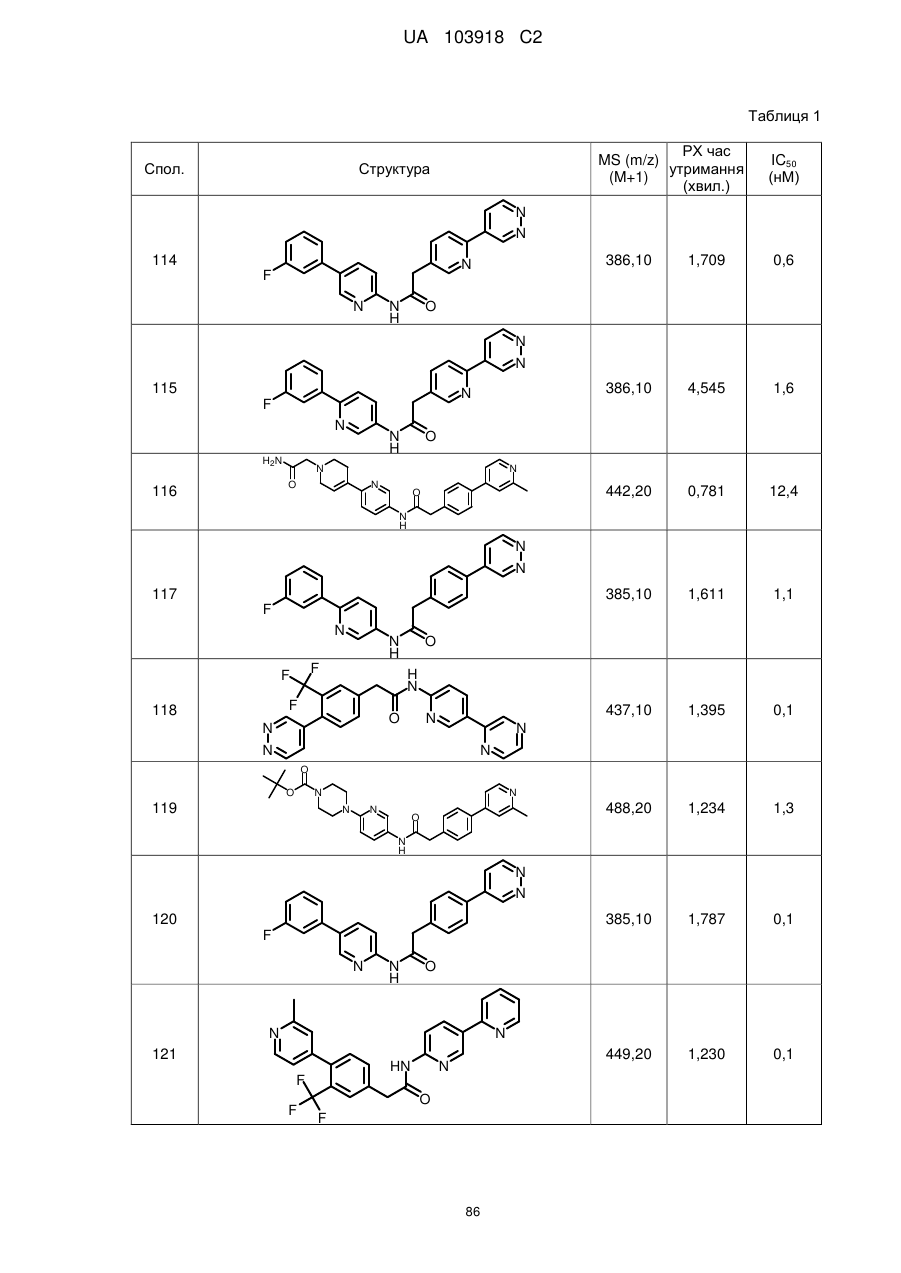
114
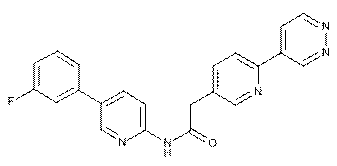
115
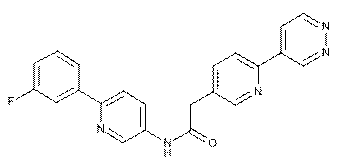
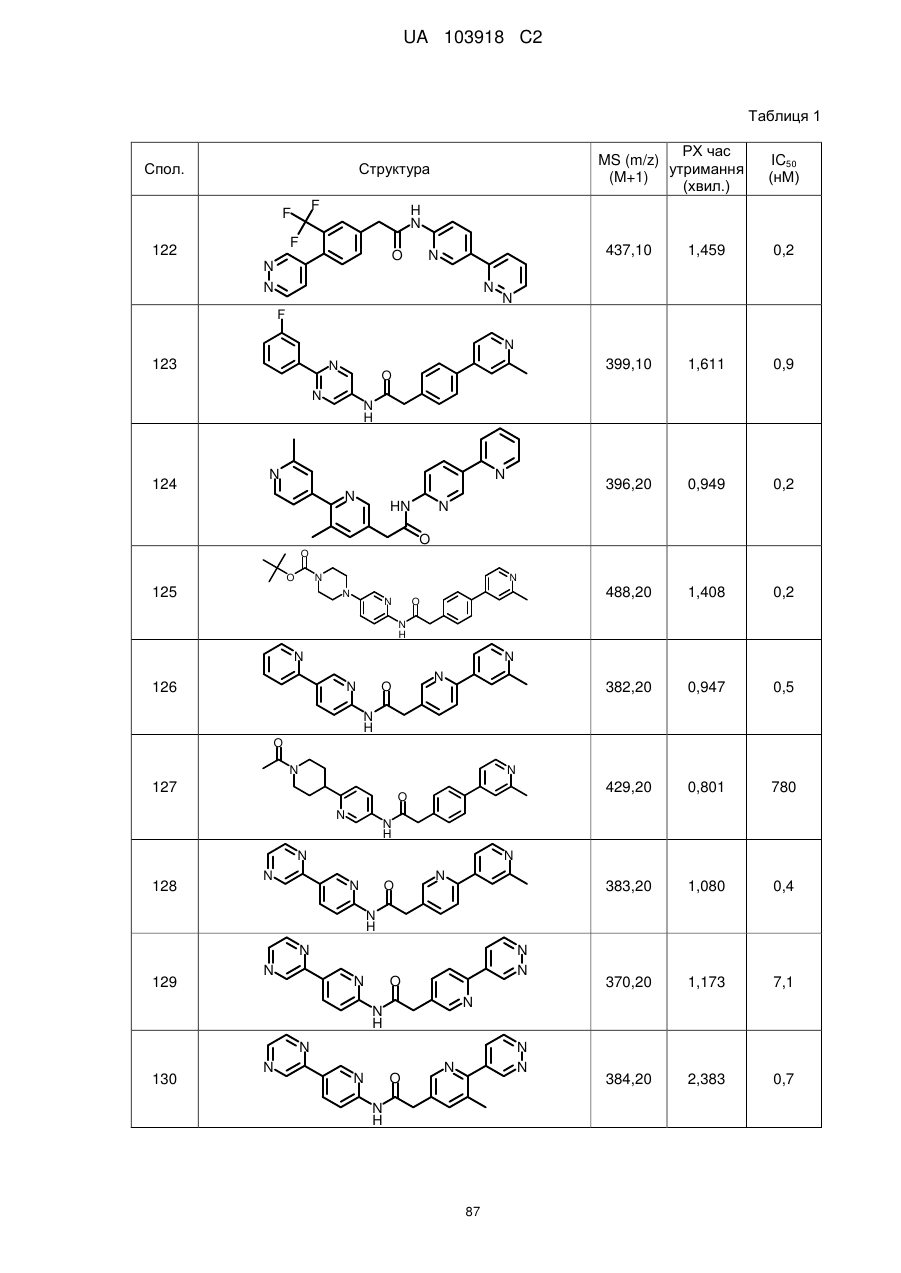
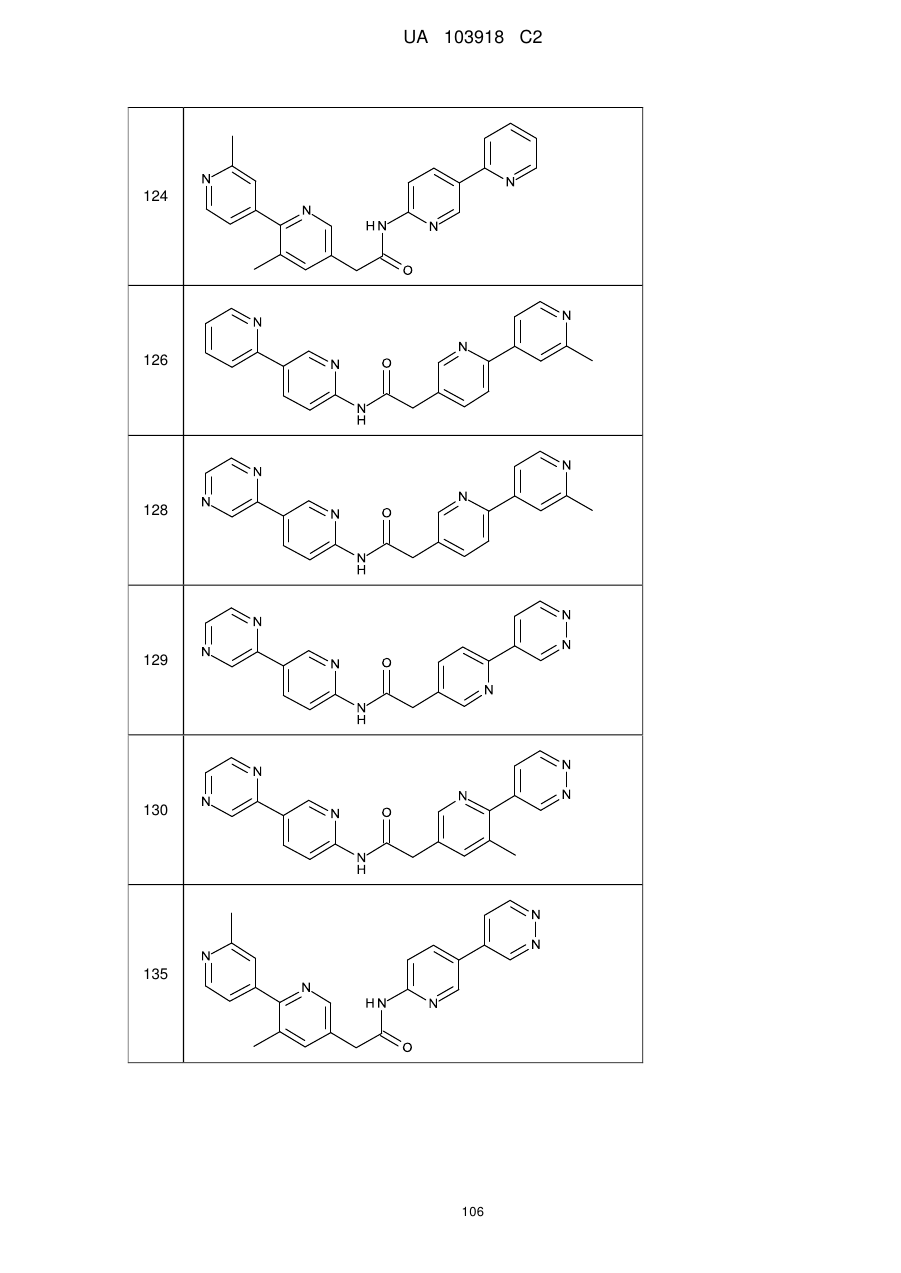
124
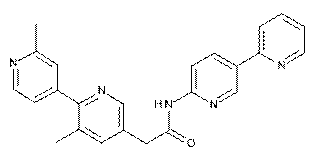
126
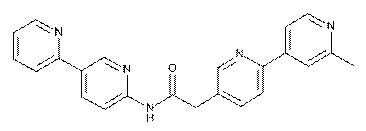
128
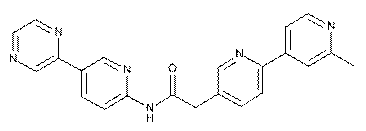
129
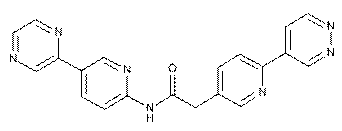
130
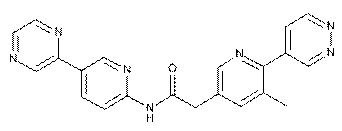
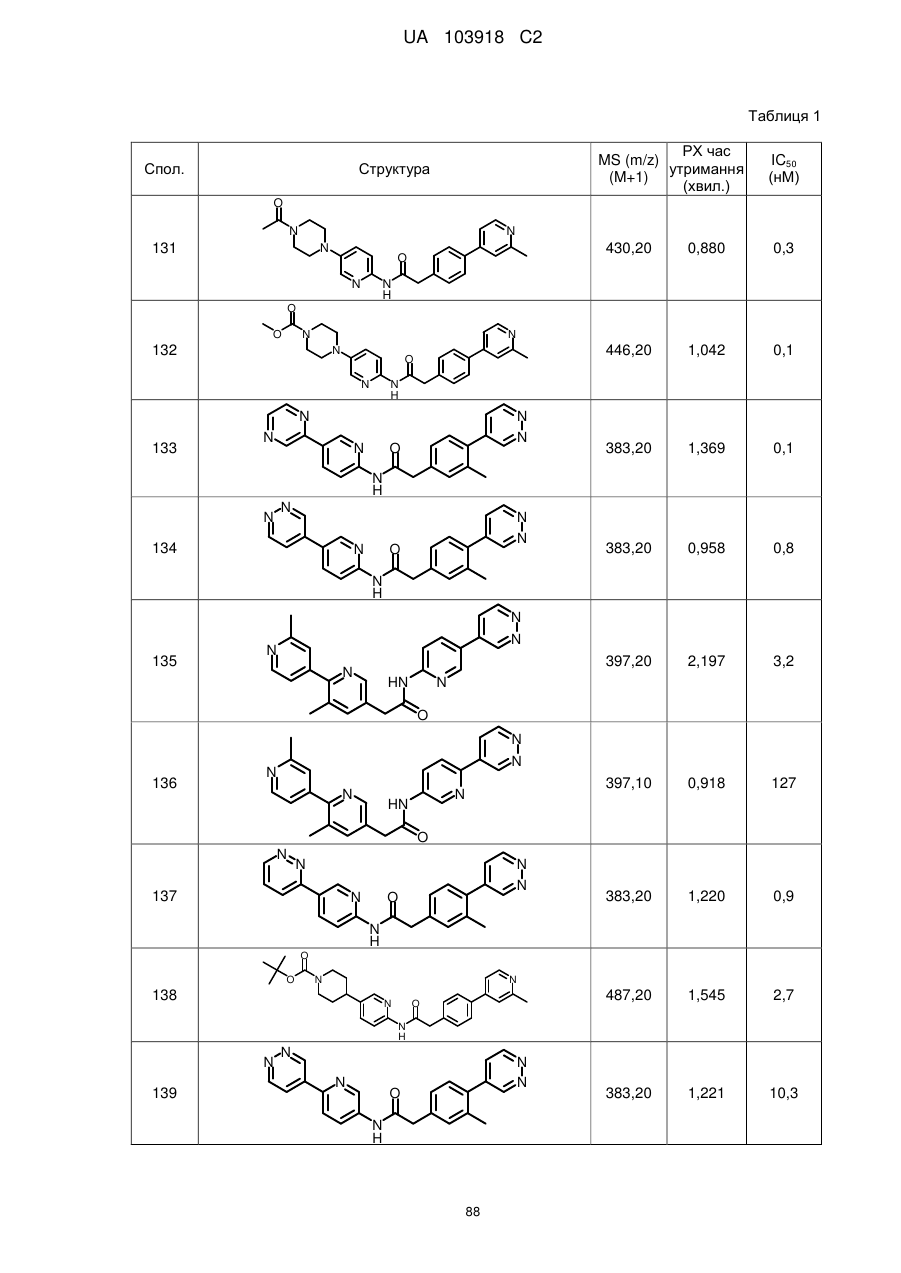
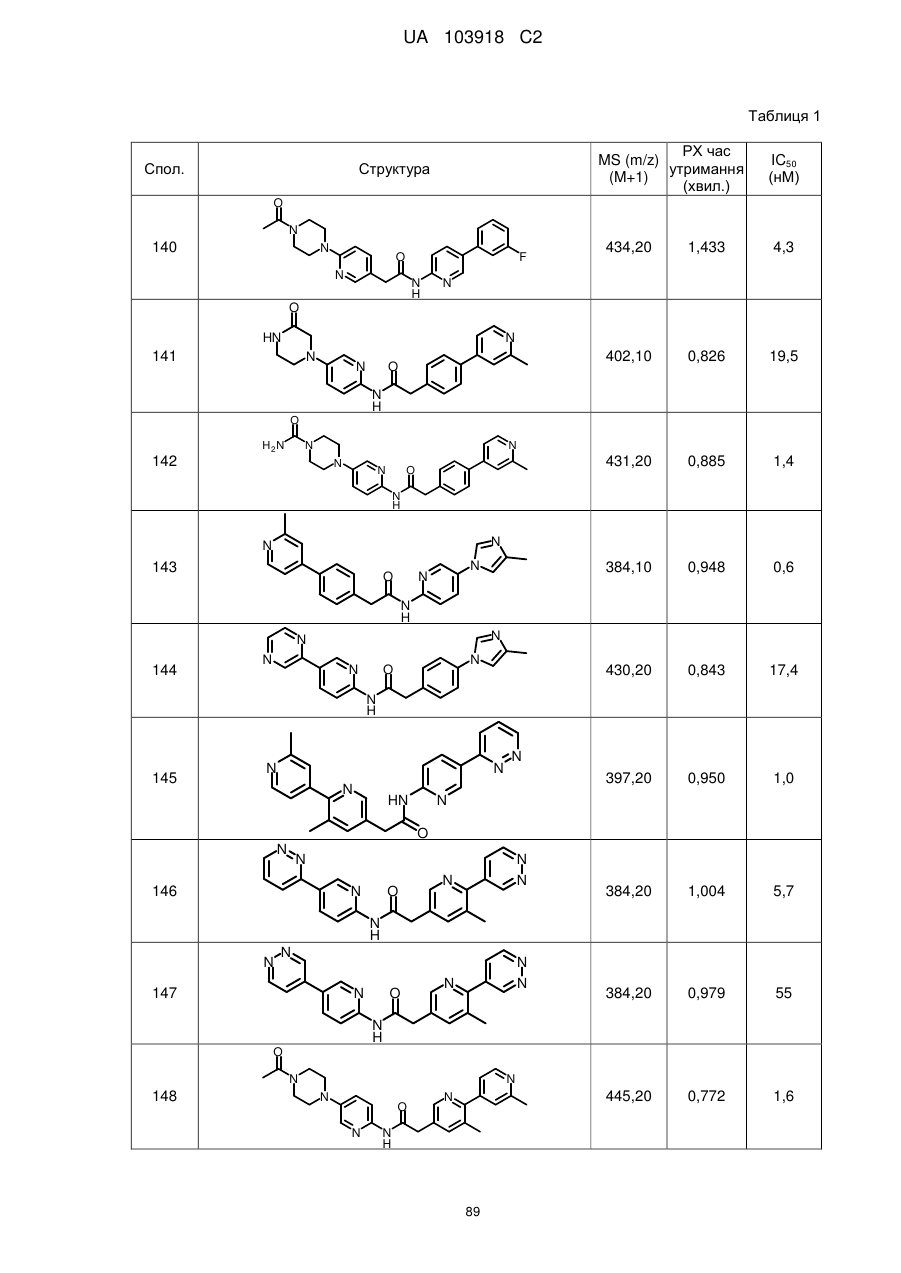
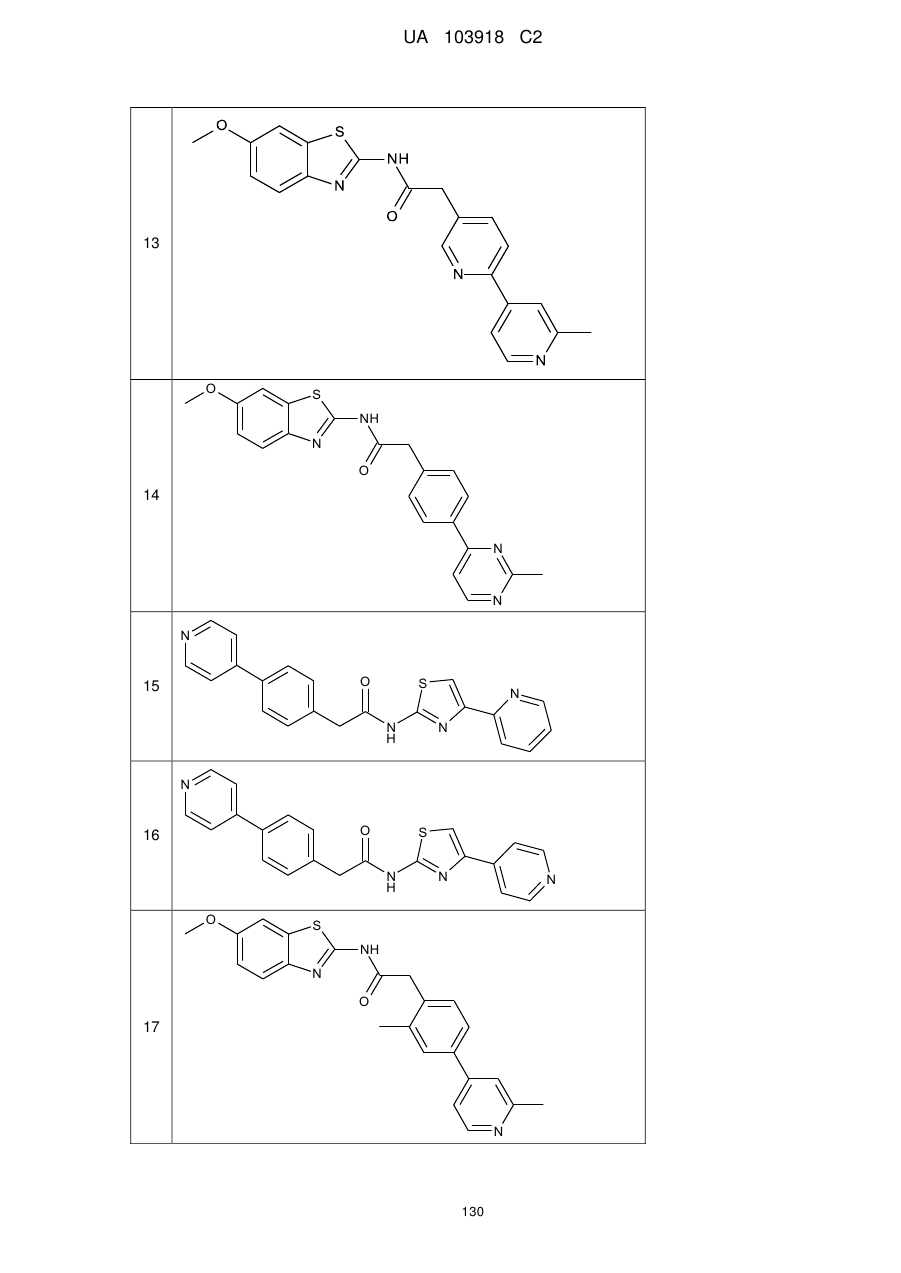
135
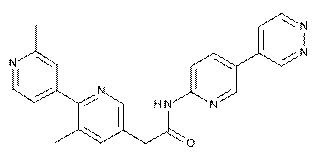
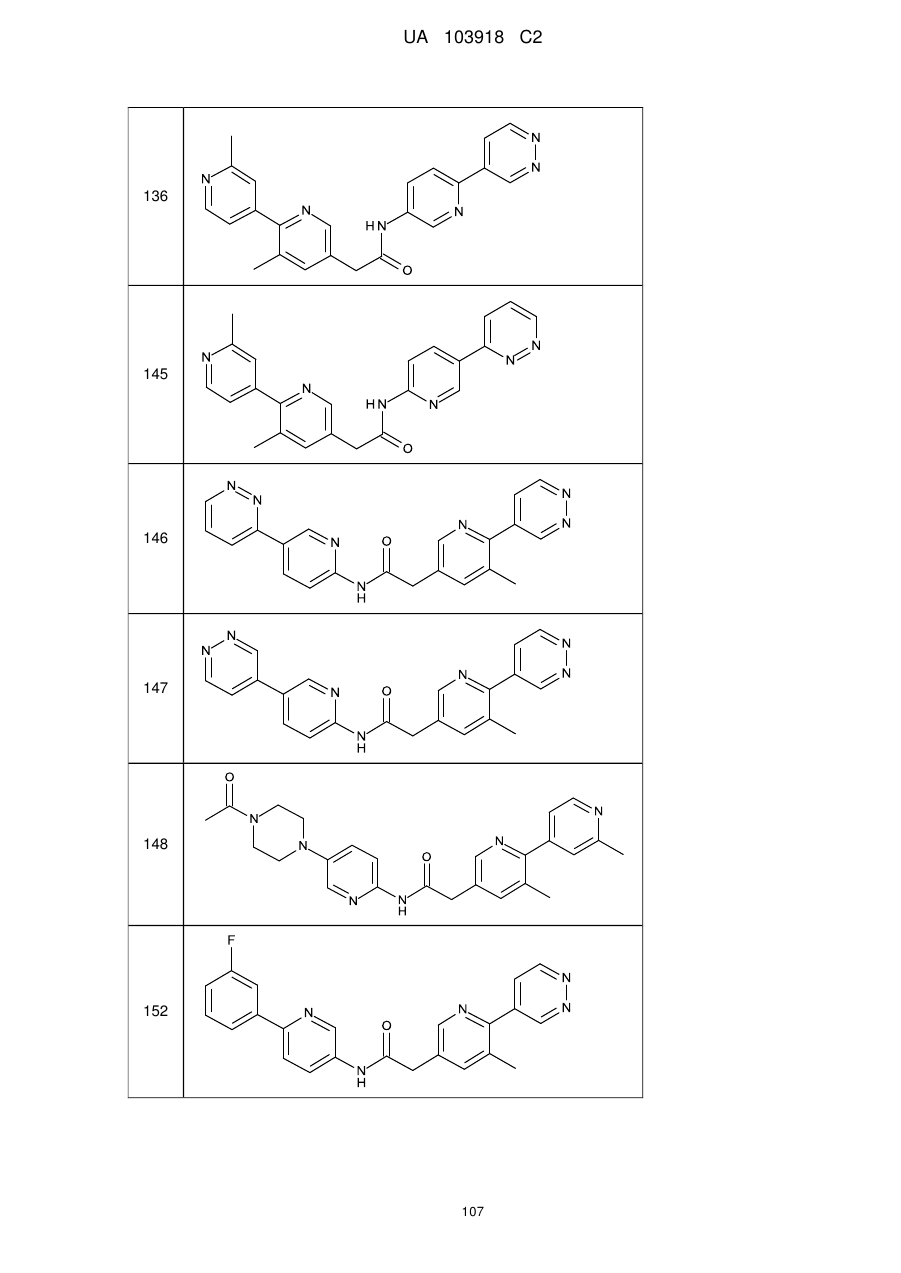
136
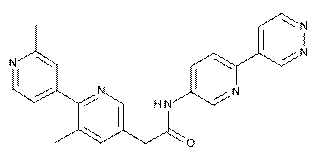
145
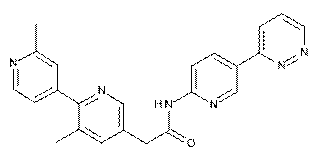
146
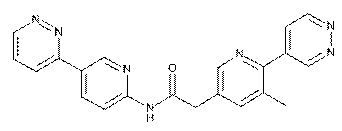
147
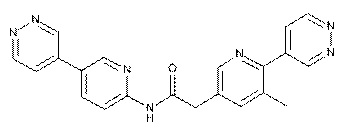
148
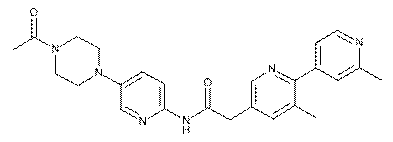
152

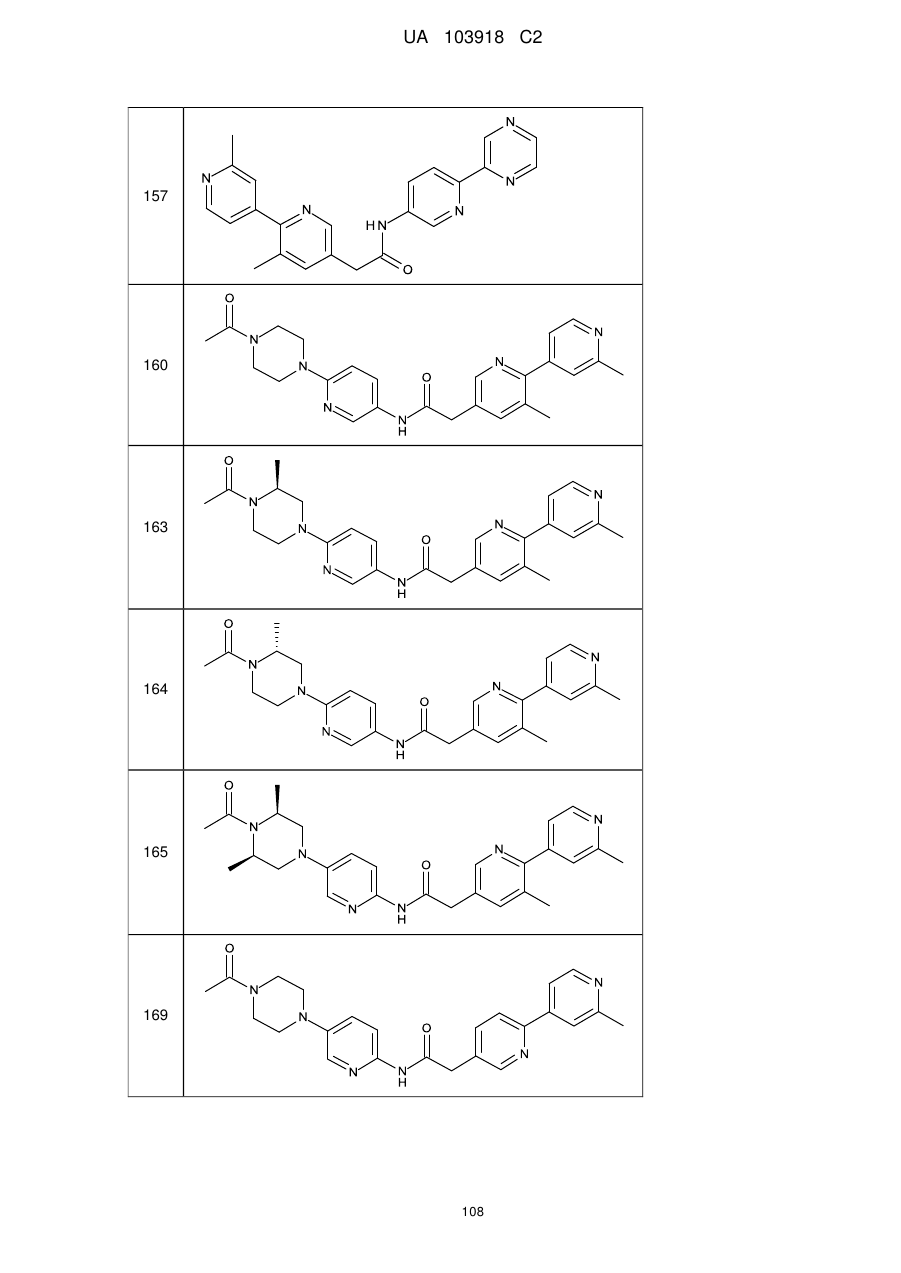
157
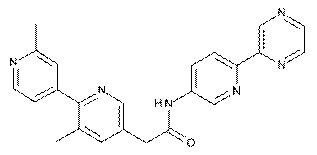
160
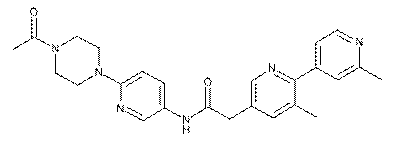
163
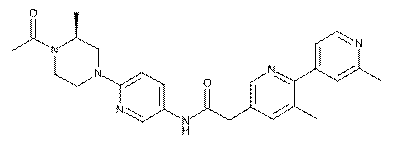
164
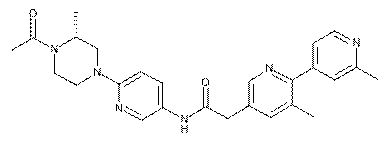
165
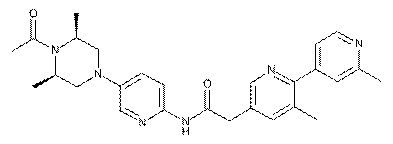
169
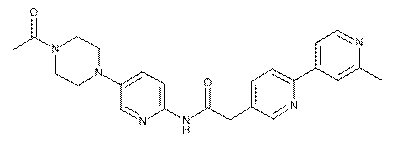
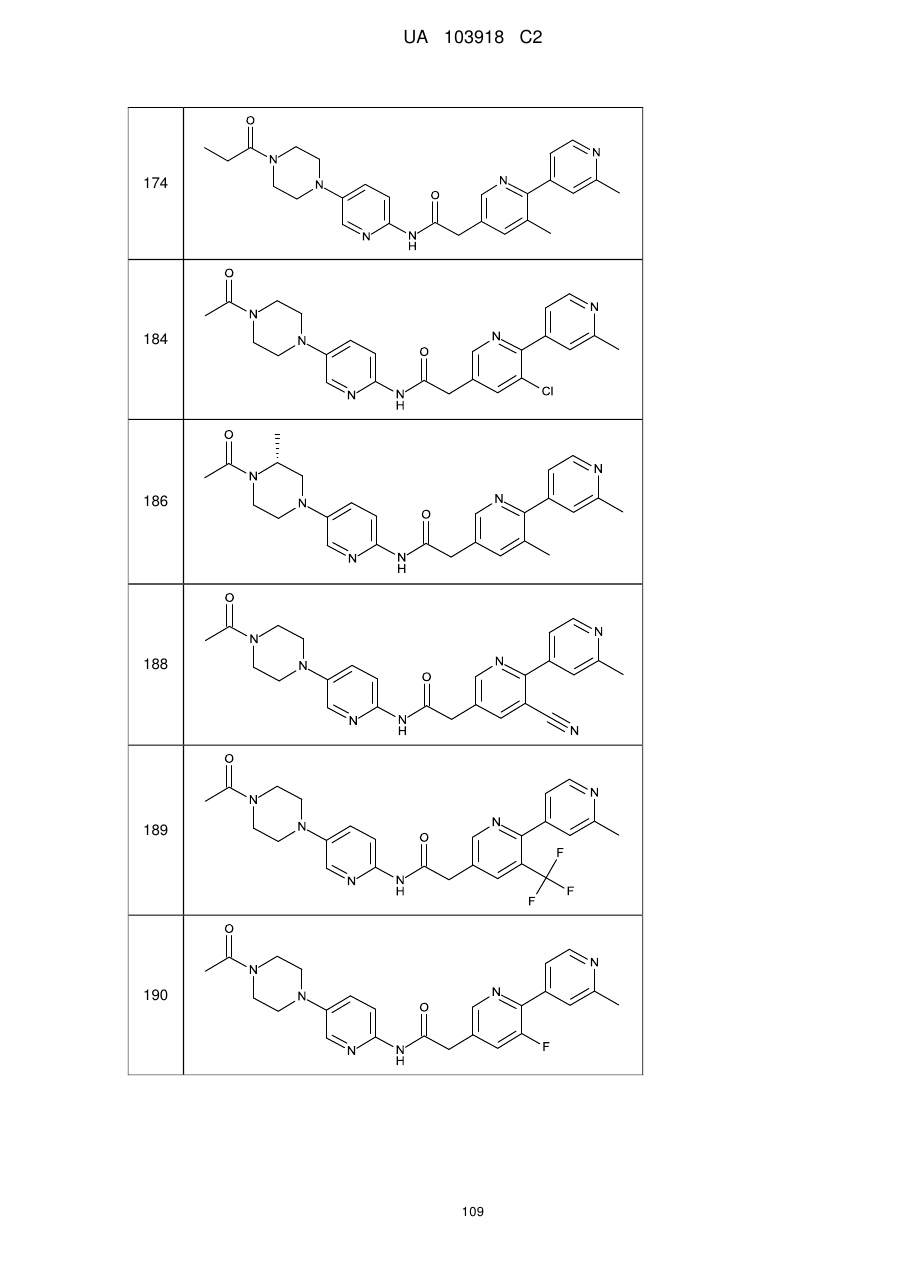
174
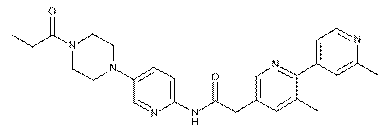
184
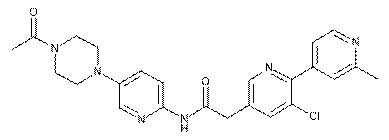
186
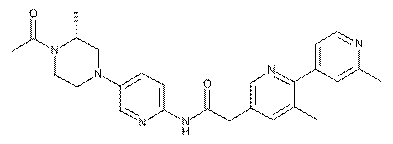
188
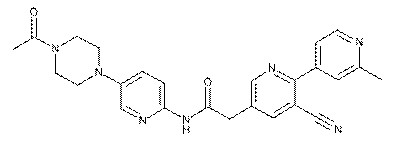
189
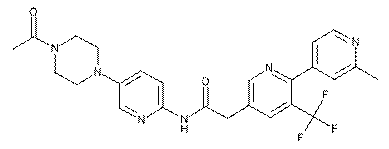
190
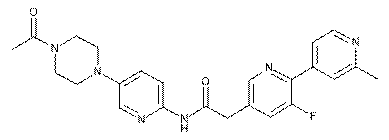
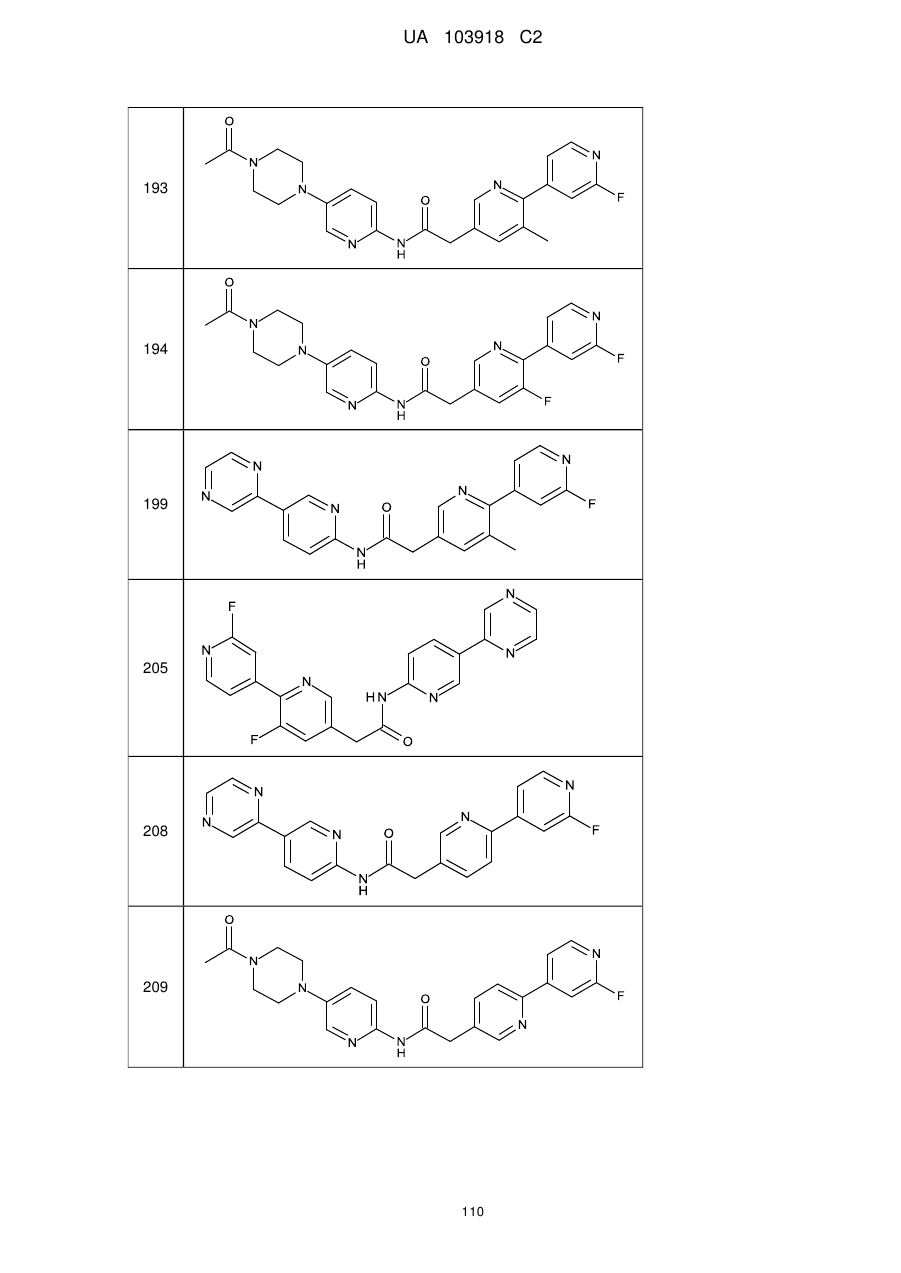
193
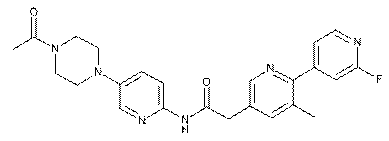
194
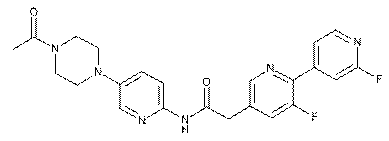
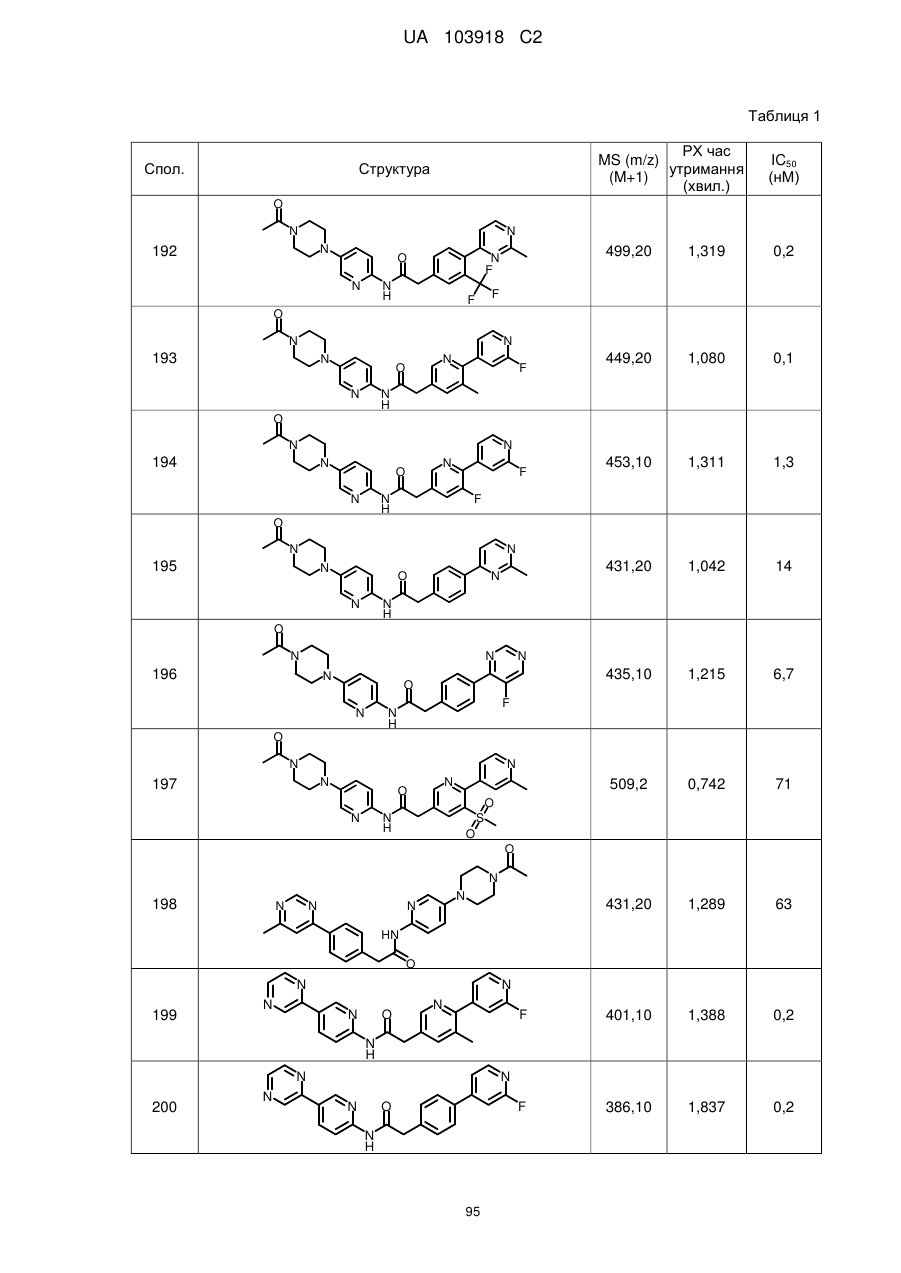
199
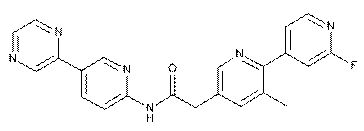
205
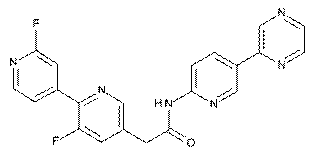
208
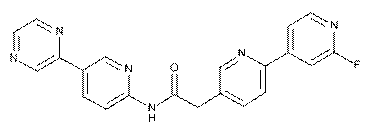
209
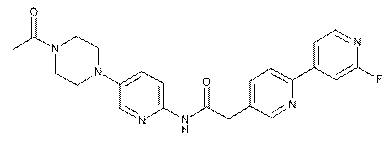
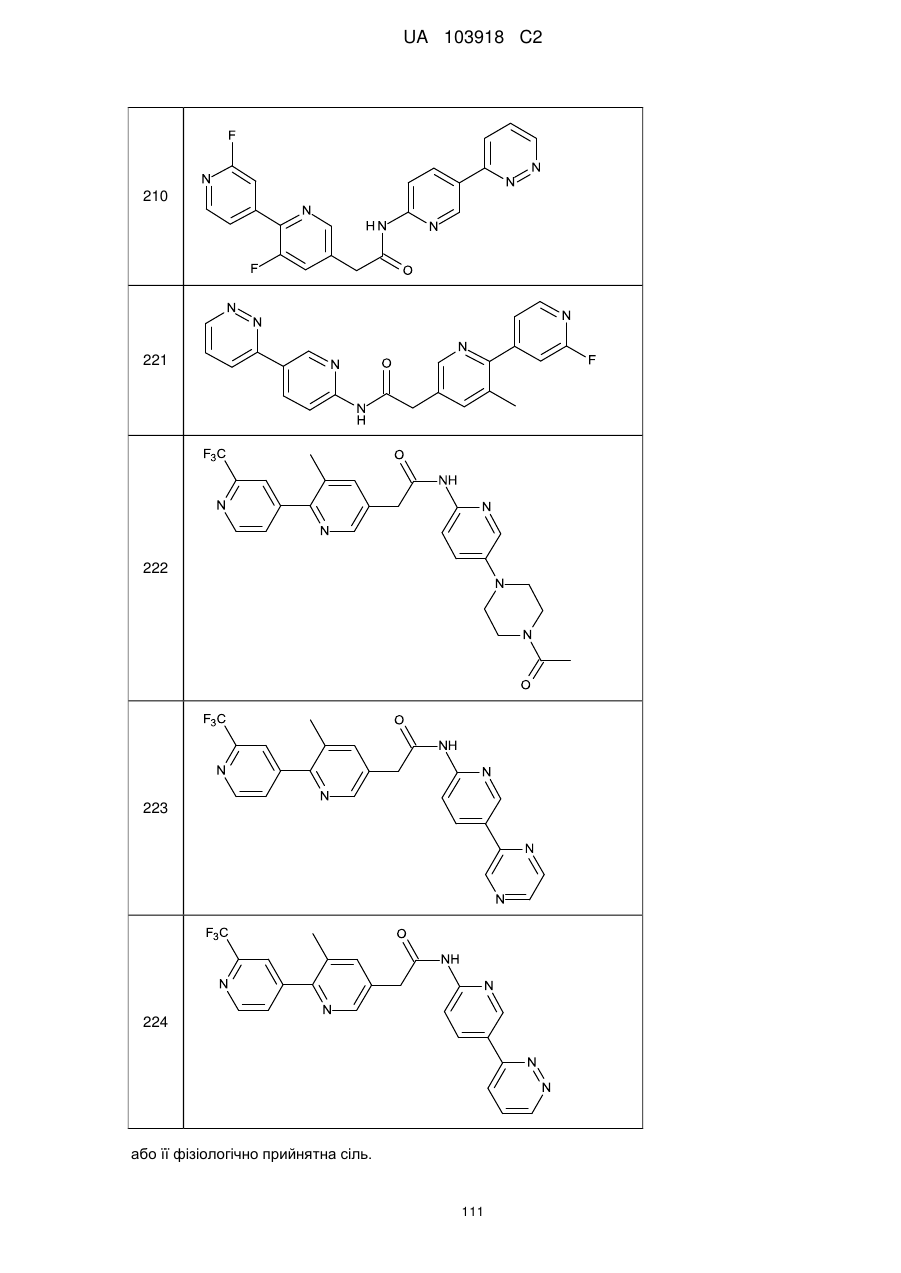
210
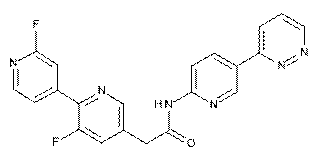
221
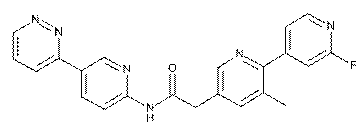
222
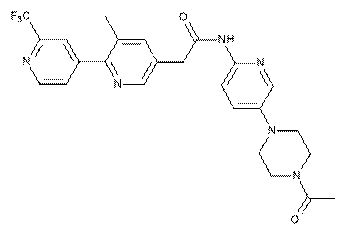
223
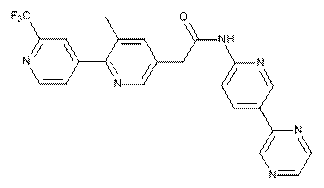
224
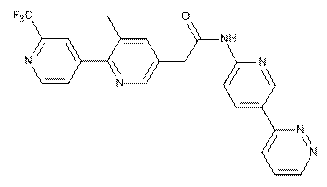
або її фізіологічно прийнятна сіль.
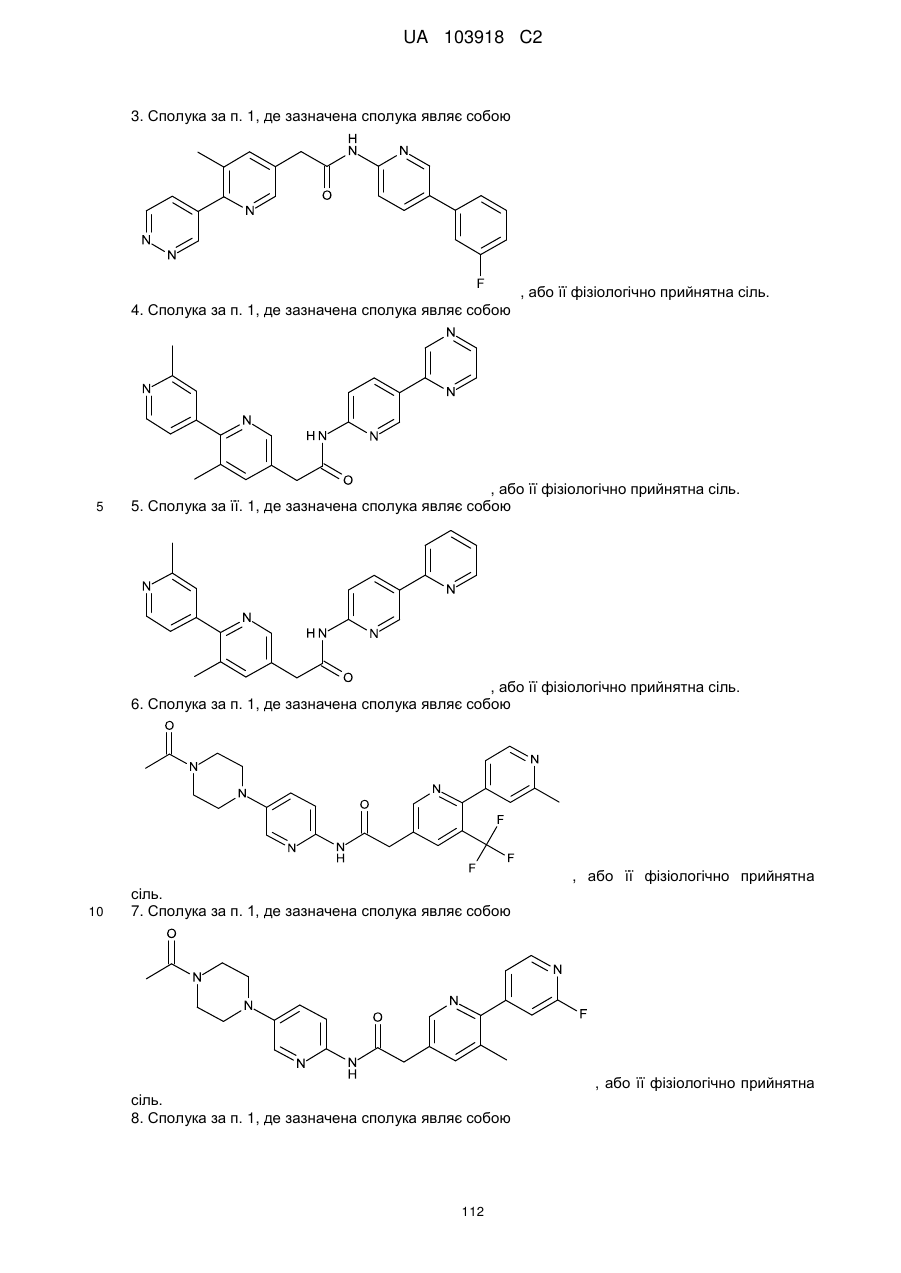
3. Сполука за п. 1, де зазначена сполука являє собою
 , або її фізіологічно прийнятна сіль.
, або її фізіологічно прийнятна сіль.
4. Сполука за п. 1, де зазначена сполука являє собою
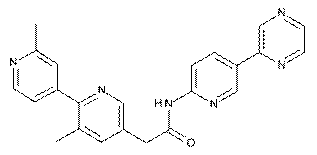 , або її фізіологічно прийнятна сіль.
, або її фізіологічно прийнятна сіль.
5. Сполука за її. 1, де зазначена сполука являє собою
 , або її фізіологічно прийнятна сіль.
, або її фізіологічно прийнятна сіль.
6. Сполука за п. 1, де зазначена сполука являє собою
 , або її фізіологічно прийнятна сіль.
, або її фізіологічно прийнятна сіль.
7. Сполука за п. 1, де зазначена сполука являє собою
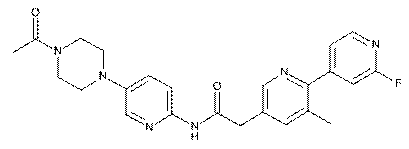 , або її фізіологічно прийнятна сіль.
, або її фізіологічно прийнятна сіль.
8. Сполука за п. 1, де зазначена сполука являє собою
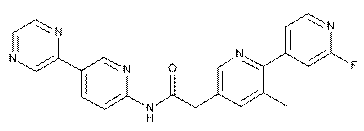 , або її фізіологічно прийнятна сіль.
, або її фізіологічно прийнятна сіль.
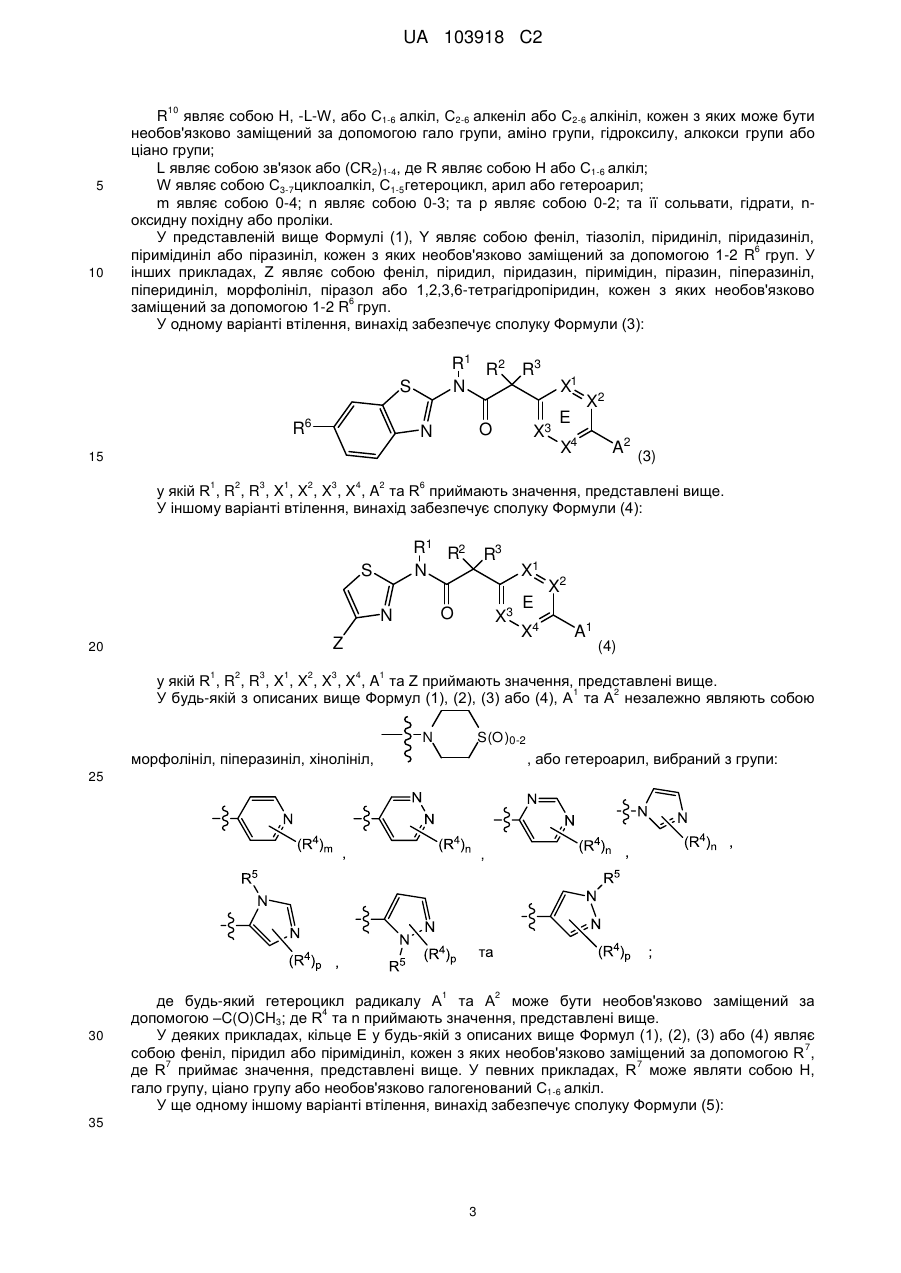
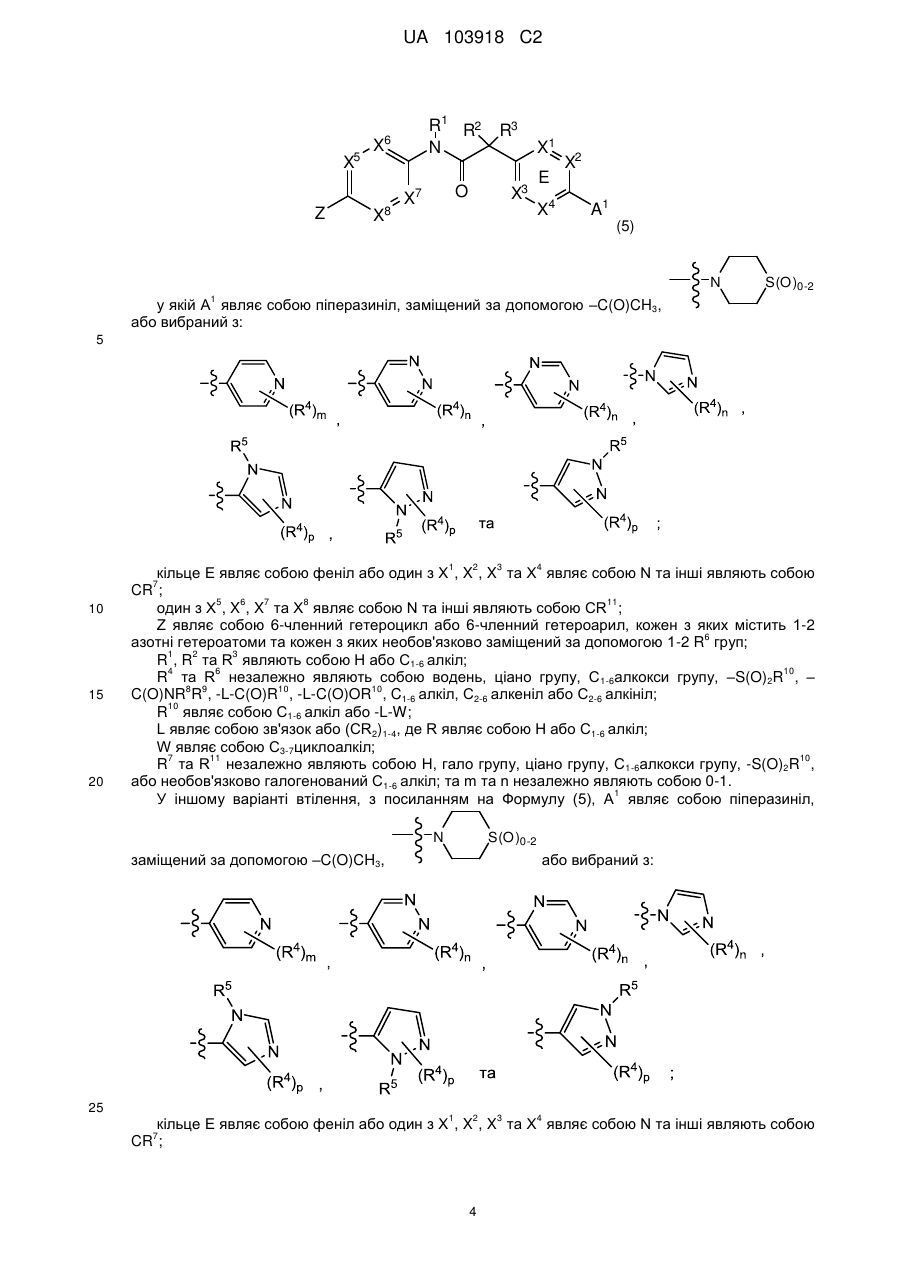
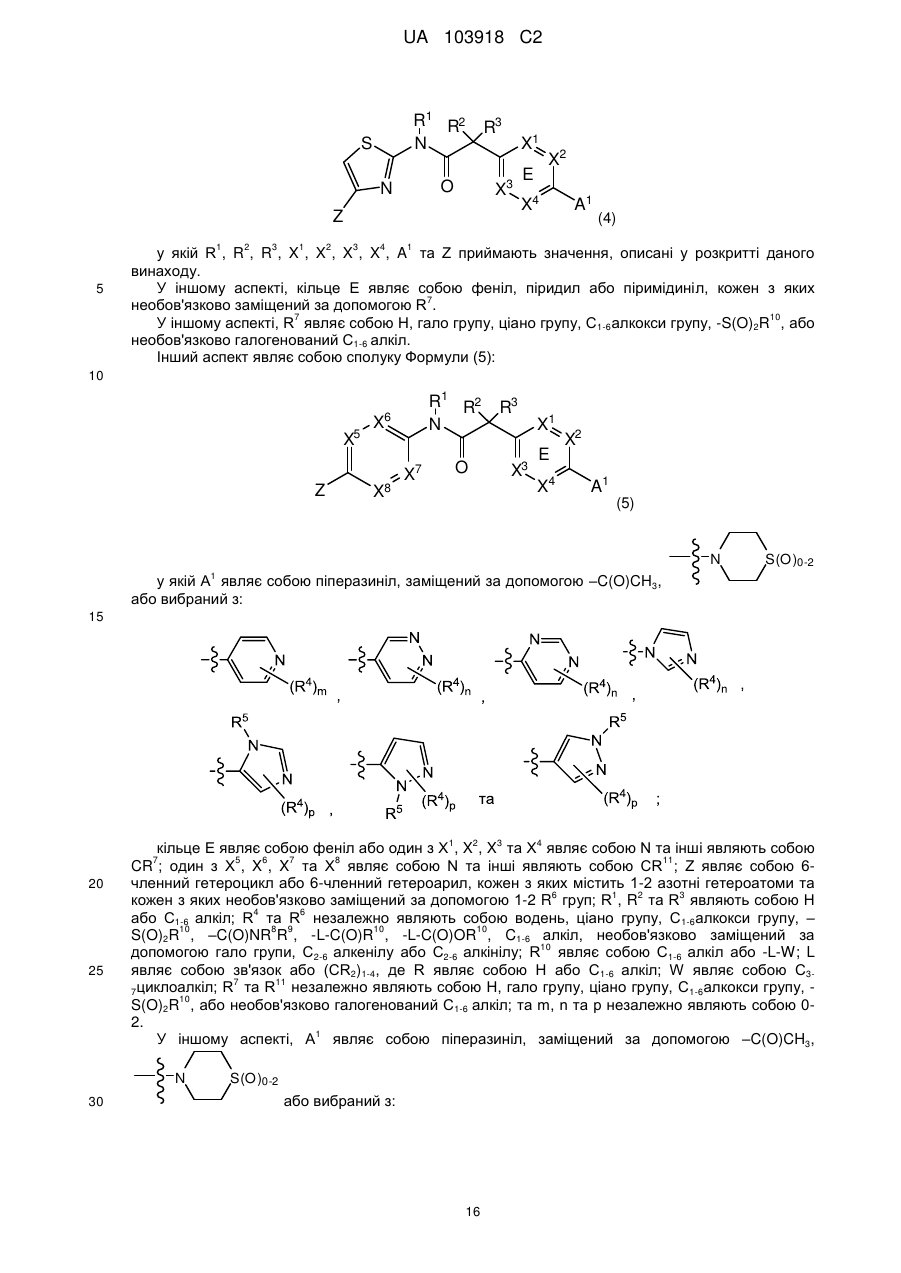
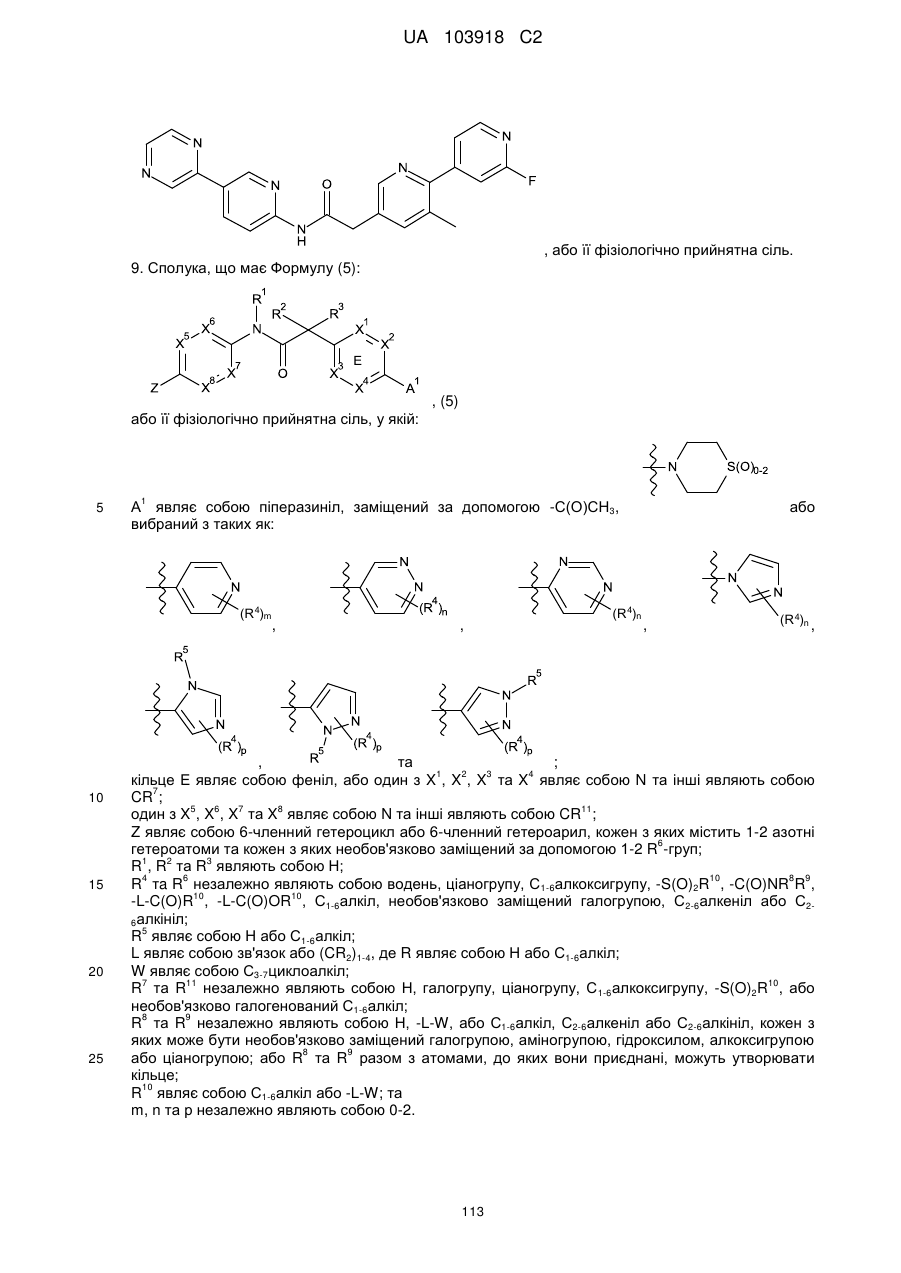
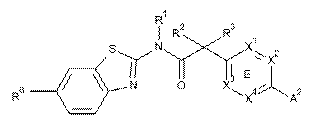
9. Сполука, що має Формулу (5):
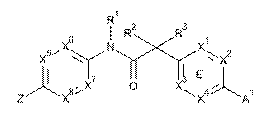 , (5)
, (5)
або її фізіологічно прийнятна сіль, у якій:
А1 являє собою піперазиніл, заміщений за допомогою -С(О)СН3, 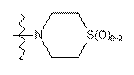 або вибраний з таких як:
або вибраний з таких як:
 ,
, 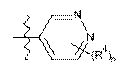 ,
,  ,
,  ,
, 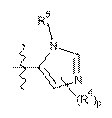 ,
, 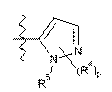 та
та 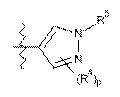 ;
;
кільце Е являє собою феніл, або один з X1, X2, X3 та X4 являє собою N та інші являють собою CR7;
один з X5, X6, X7 та X8 являє собою N та інші являють собою CR11;
Z являє собою 6-членний гетероцикл або 6-членний гетероарил, кожен з яких містить 1-2 азотні гетероатоми та кожен з яких необов'язково заміщений за допомогою 1-2 R6-груп;
R1, R2 та R3 являють собою Н;
R4 тa R6 незалежно являють собою водень, ціаногрупу, С1-6алкоксигрупу, -S(O)2R10, -C(O)NR8R9, -L-C(O)R10, -L-C(O)OR10, С1-6алкіл, необов'язково заміщений галогрупою, С2-6алкеніл або С2-6алкініл;
R5 являє собою Н або С1-6алкіл;
L являє собою зв'язок або (CR2)1-4, де R являє собою Н або С1-6алкіл;
W являє собою С3-7циклоалкіл;
R7 та R11 незалежно являють собою Н, галогрупу, ціаногрупу, С1-6алкоксигрупу, -S(O)2R10, або необов'язково галогенований С1-6алкіл;
R8 та R9 незалежно являють собою Н, -L-W, або С1-6алкіл, С2-6алкеніл або С2-6алкініл, кожен з яких може бути необов'язково заміщений галогрупою, аміногрупою, гідроксилом, алкоксигрупою або ціаногрупою; або R8 та R9 разом з атомами, до яких вони приєднані, можуть утворювати кільце;
R10 являє собою С1-6алкіл або -L-W; та
m, n та р незалежно являють собою 0-2.
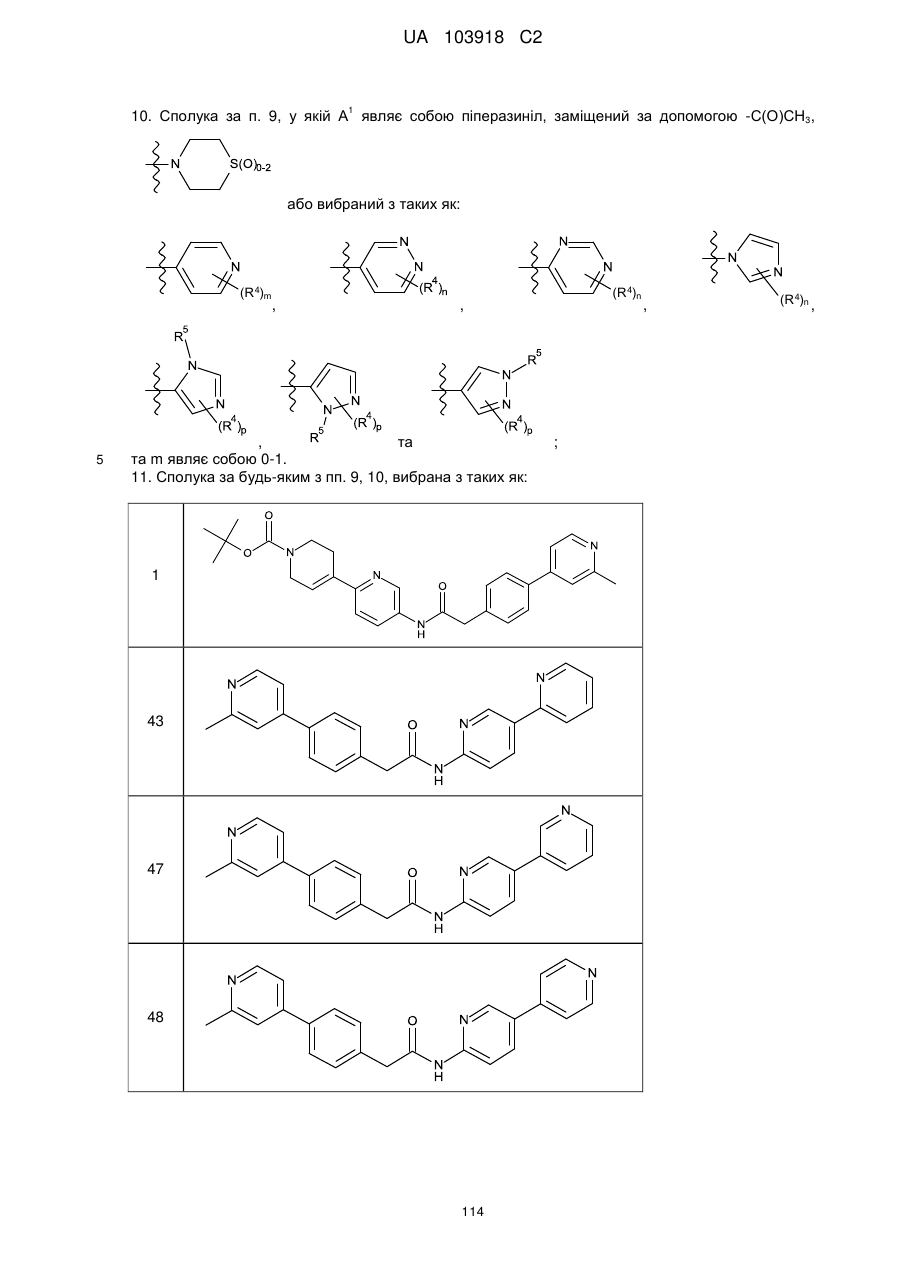
10. Сполука за п. 9, у якій А1 являє собою піперазиніл, заміщений за допомогою -С(О)СН3, 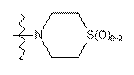 або вибраний з таких як:
або вибраний з таких як:
 ,
,  ,
,  ,
,  ,
,  ,
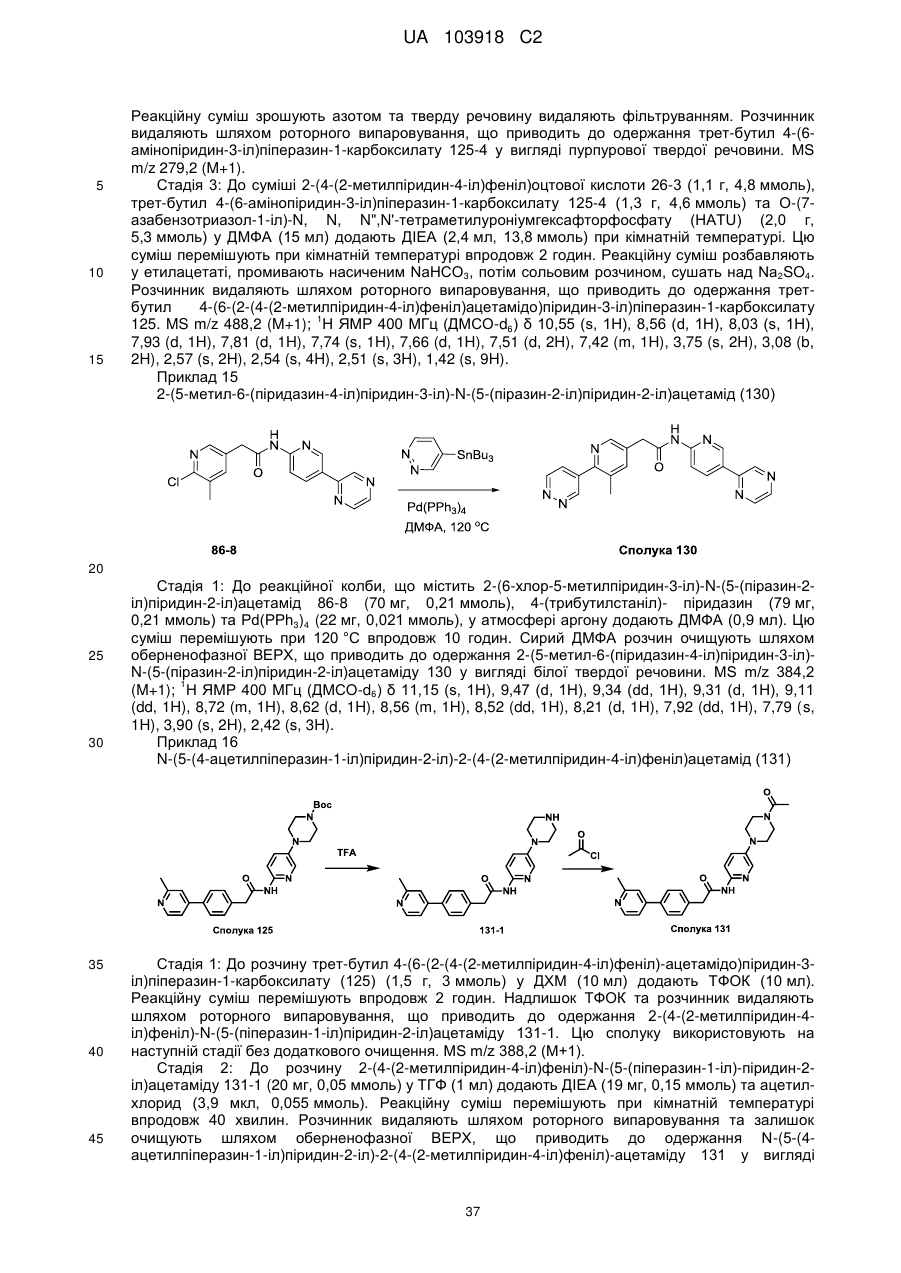
,  та
та  ;
;
та m являє собою 0-1.
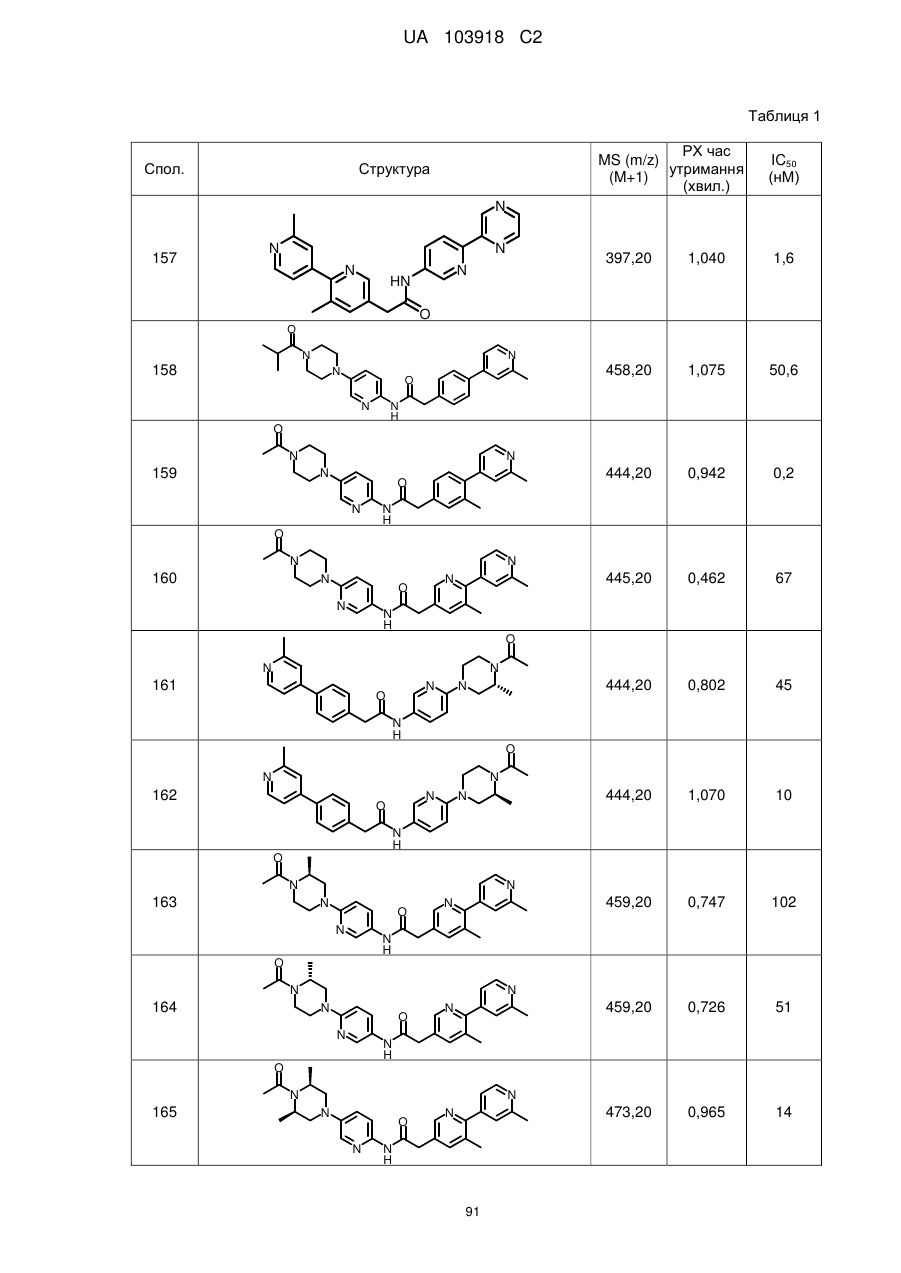
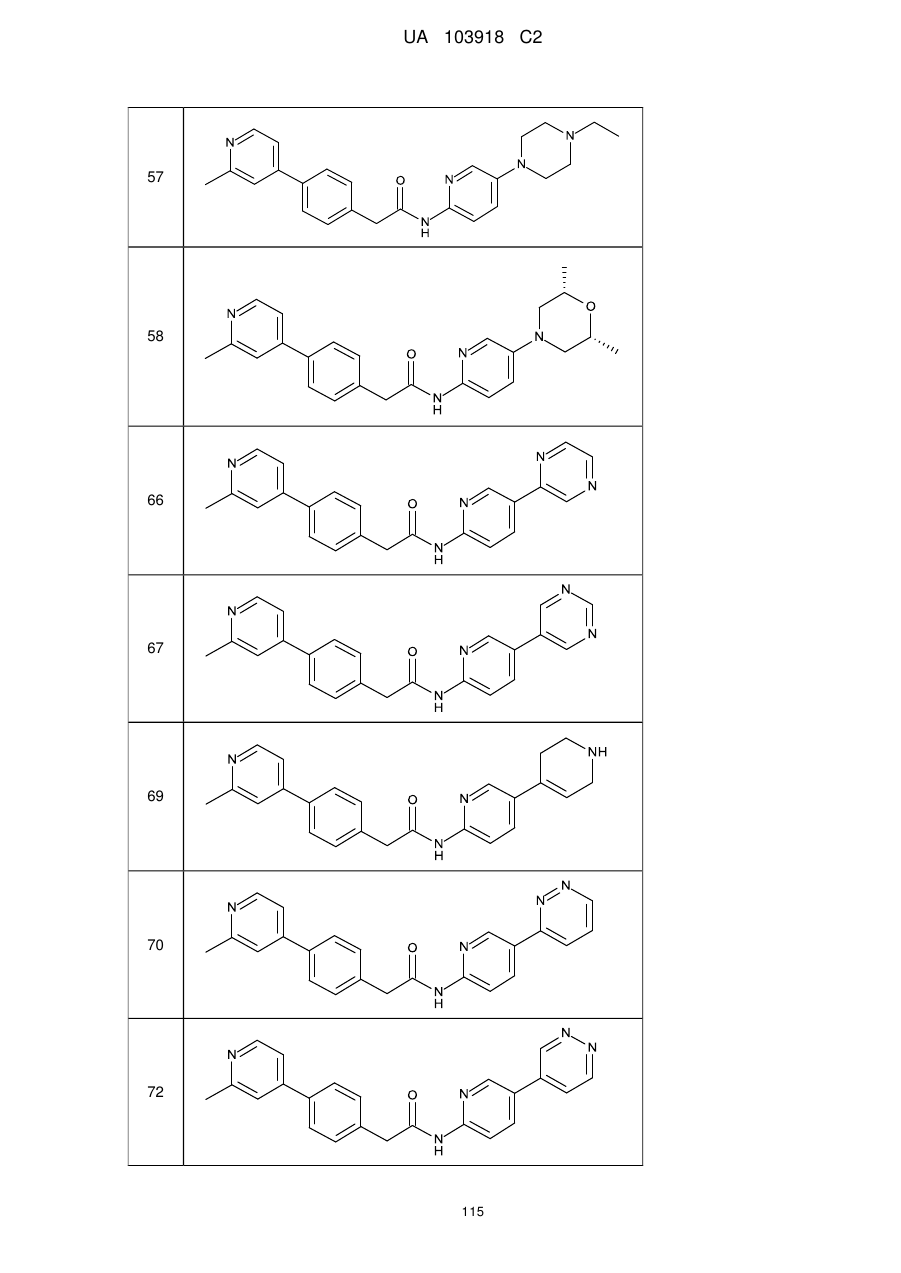
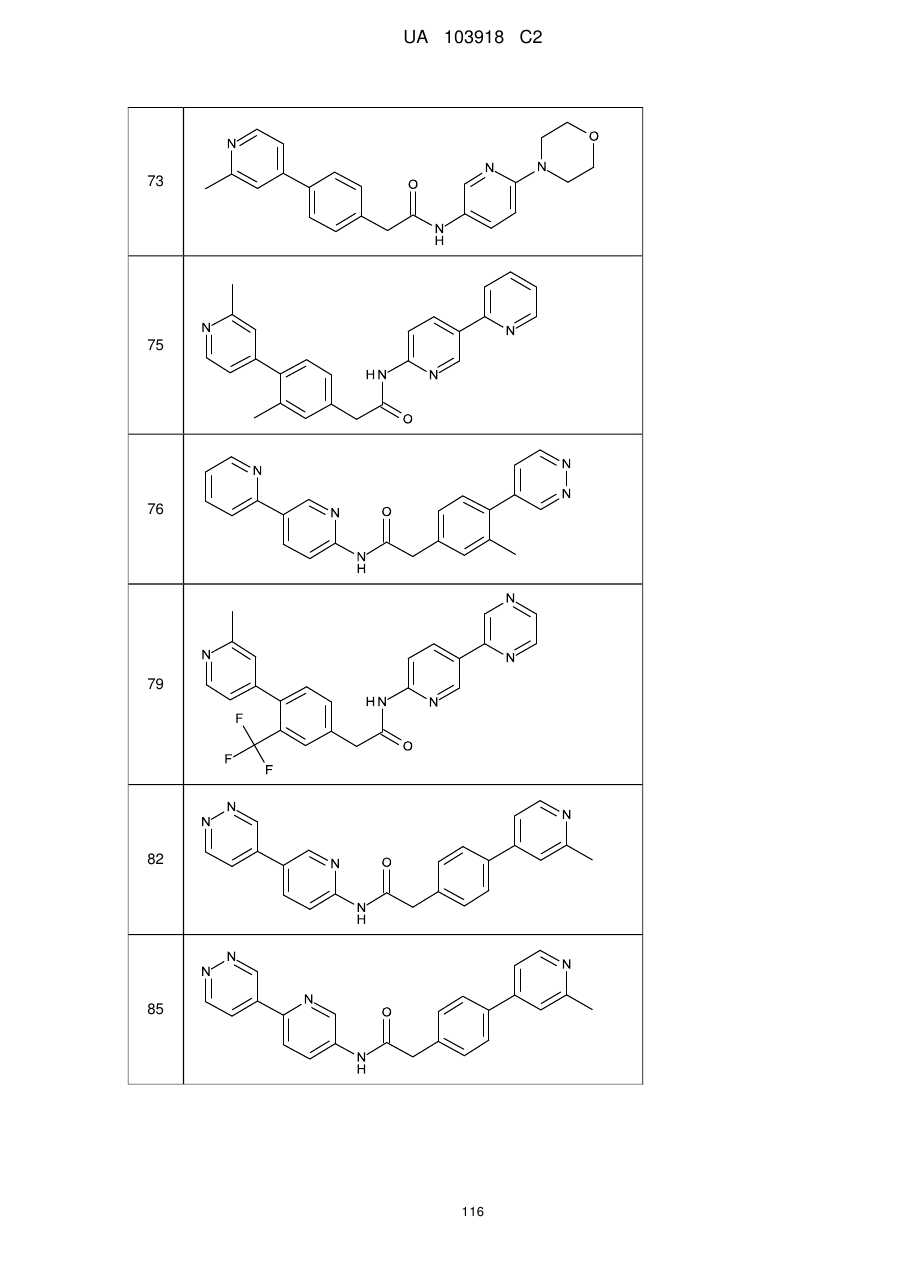
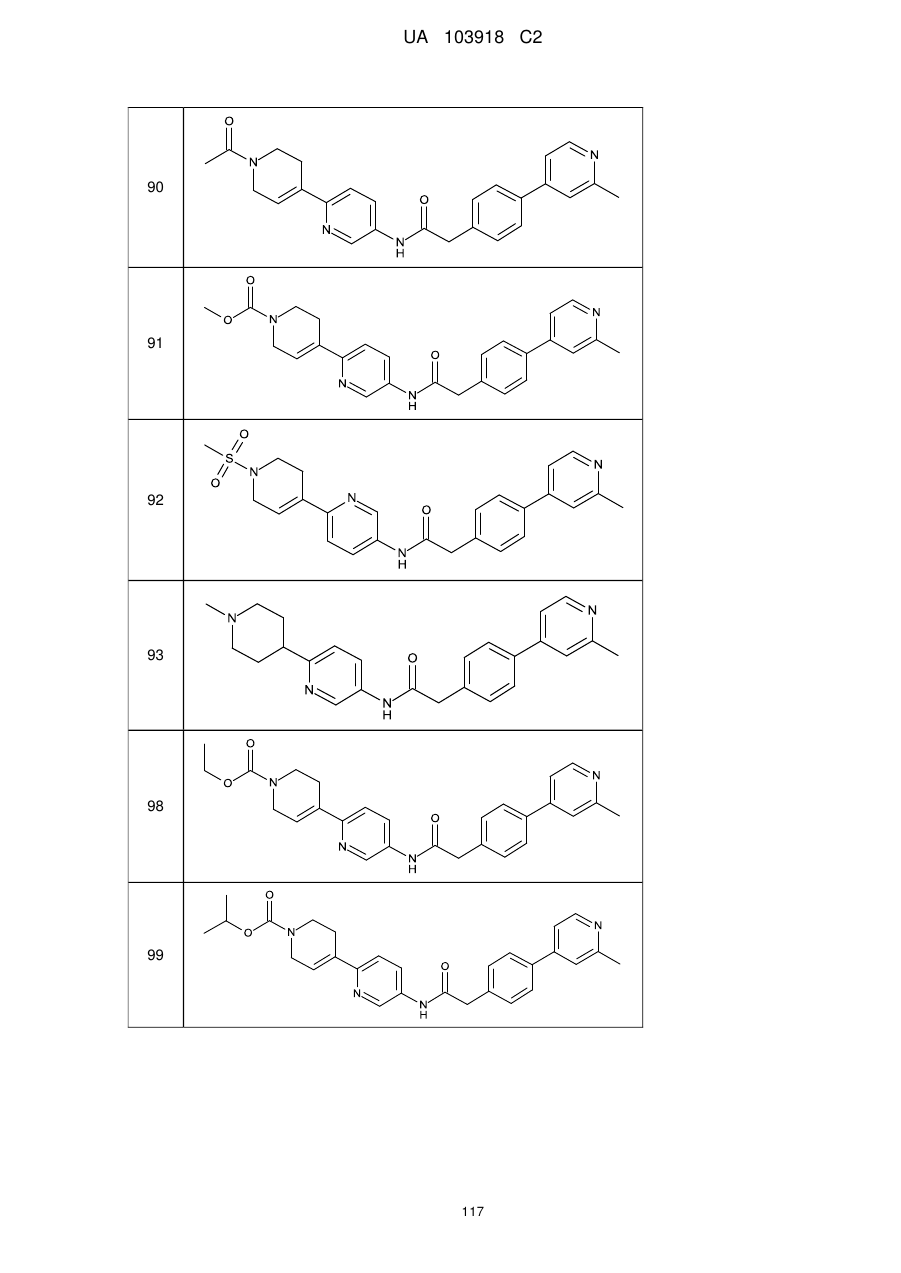
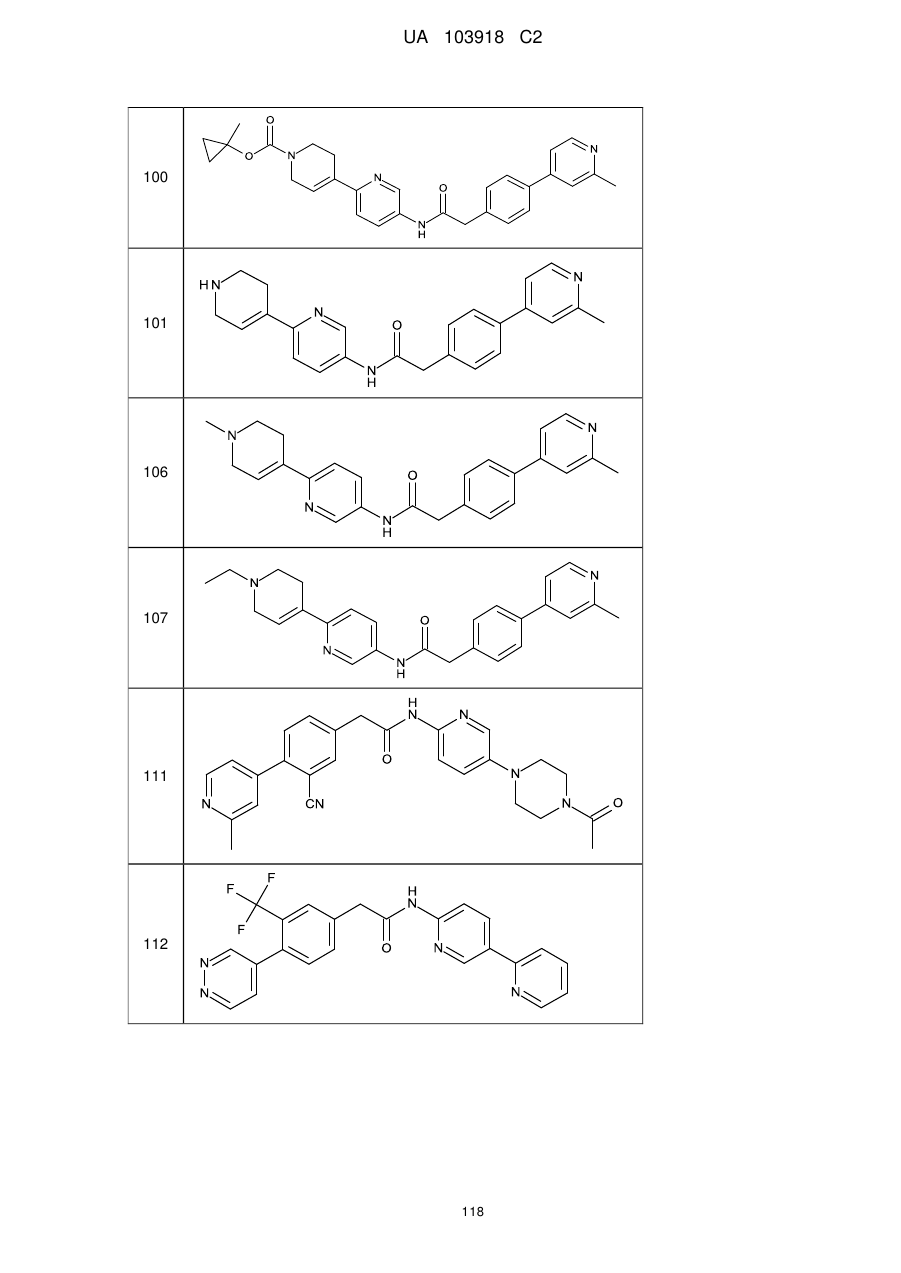
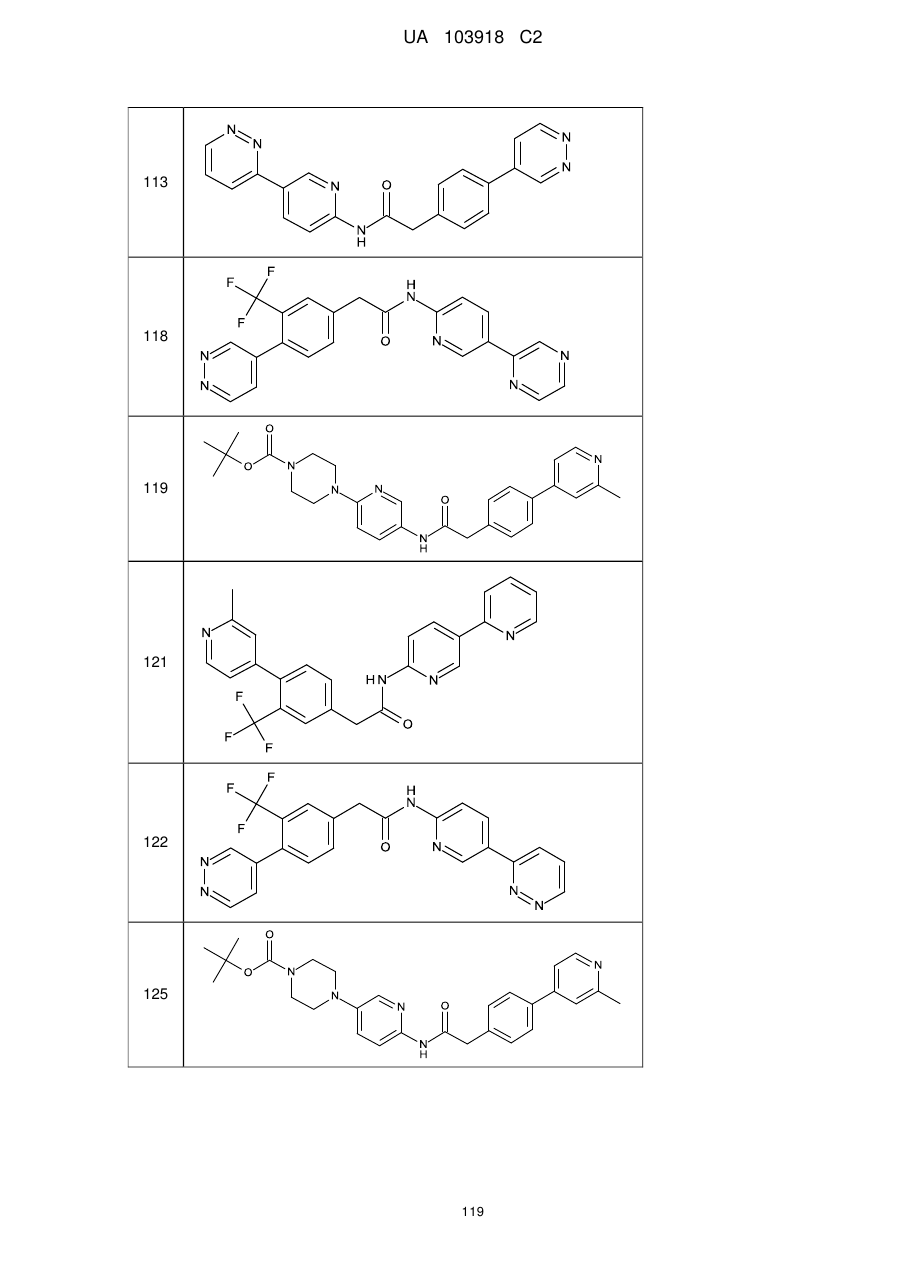
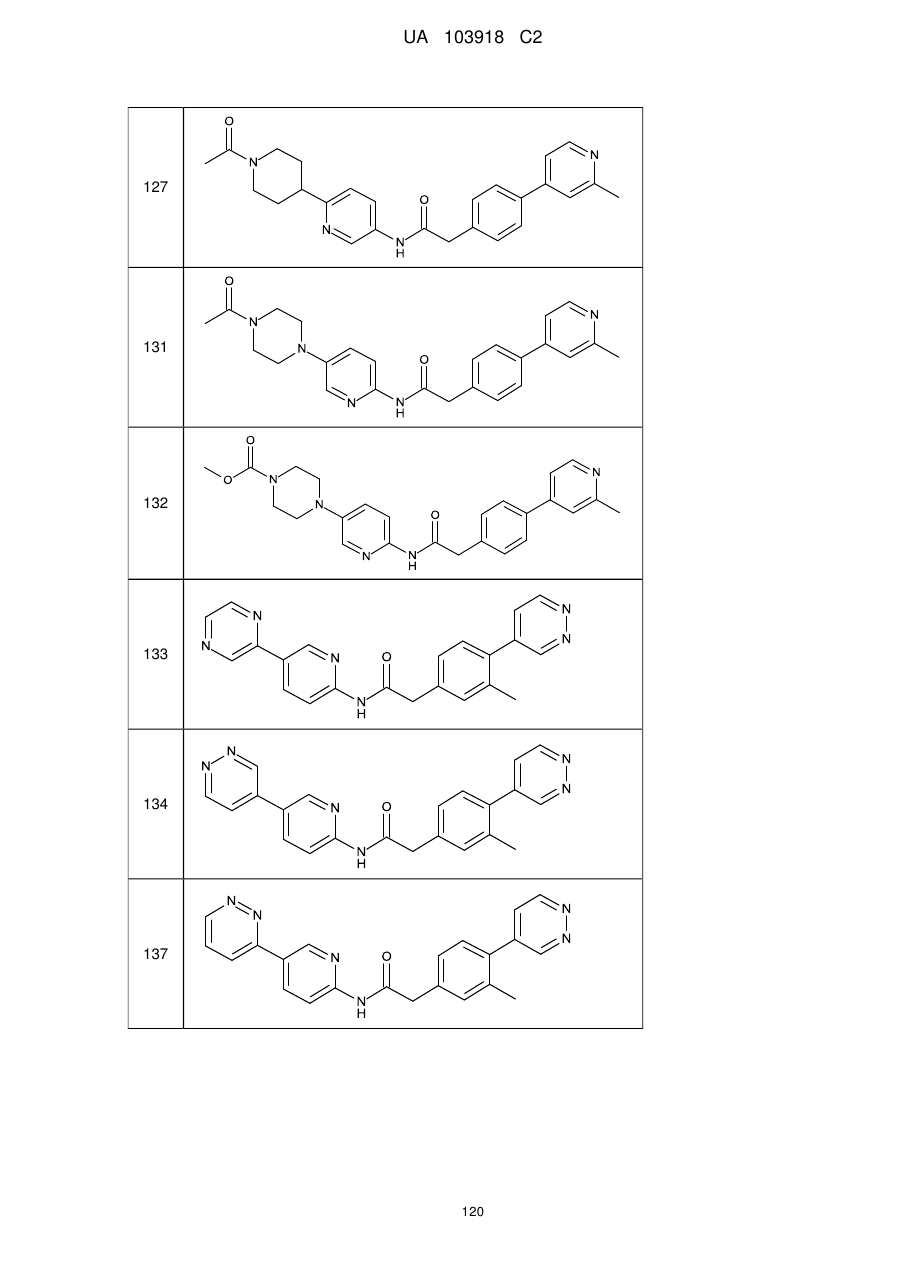
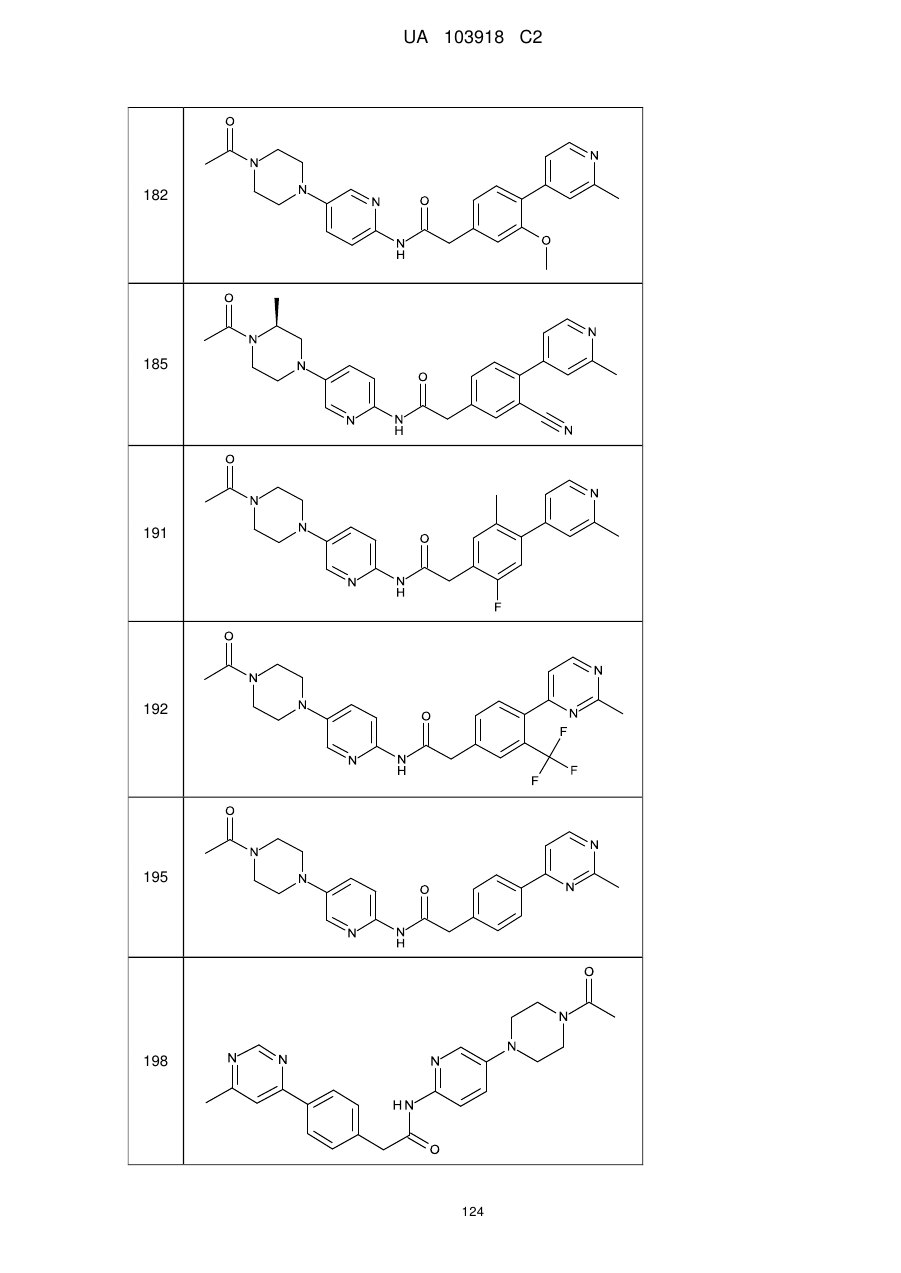
11. Сполука за будь-яким з пп. 9, 10, вибрана з таких як:
1
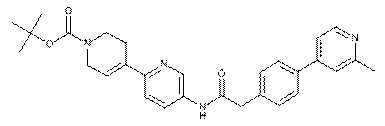
43
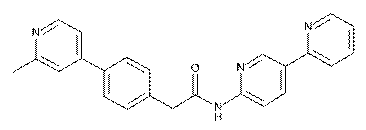
47
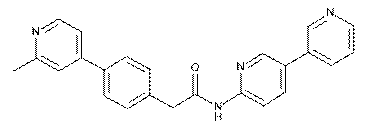
48
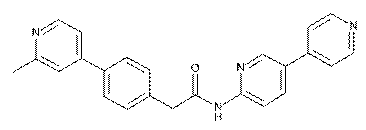
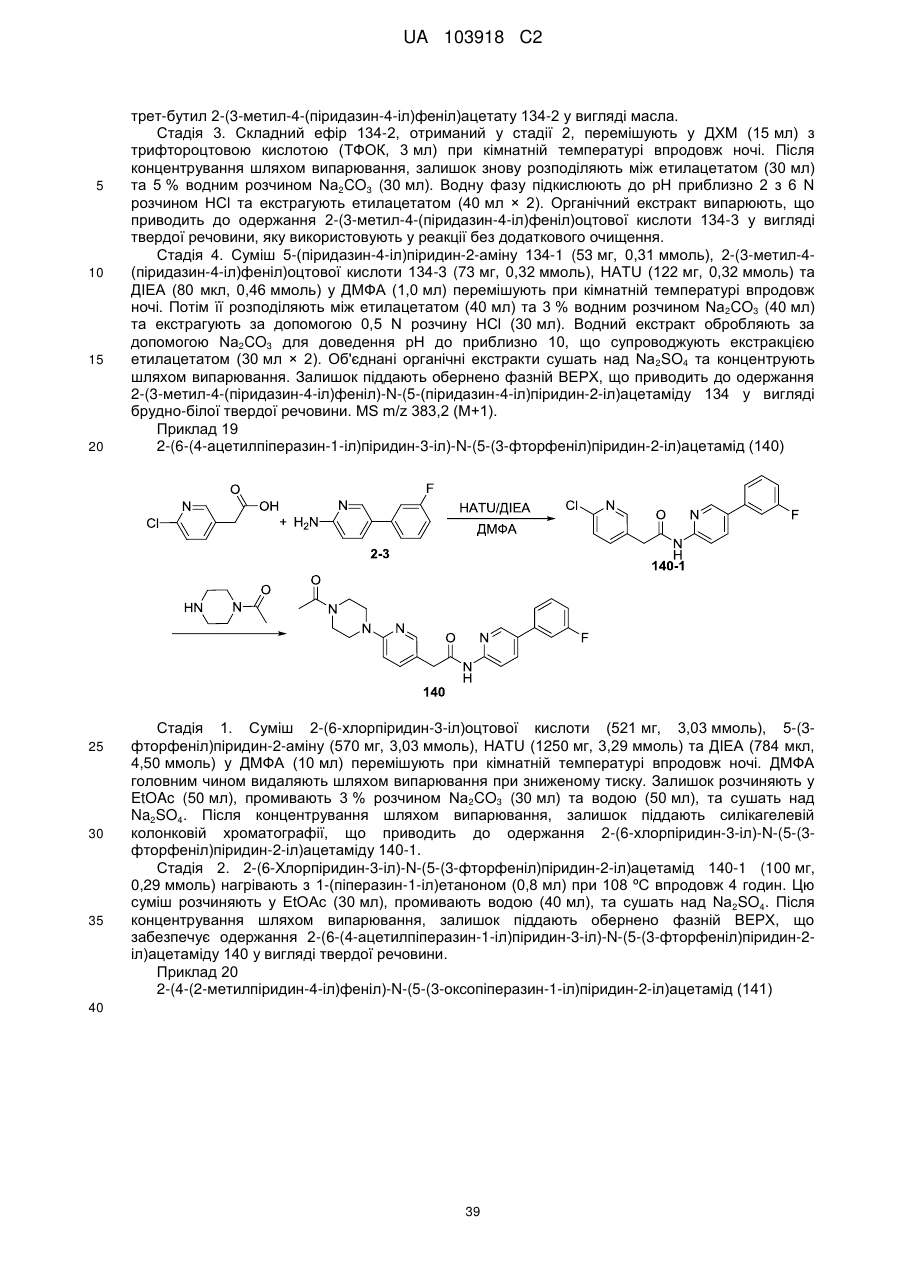
57
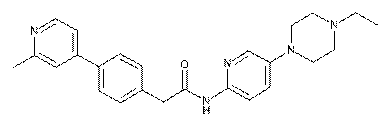
58
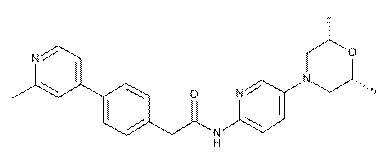
66
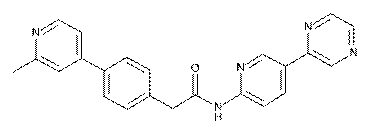
67
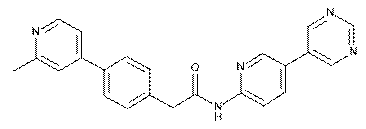
69
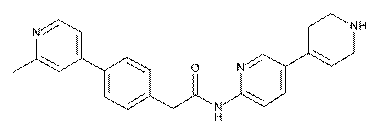
70
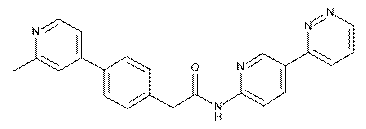
72
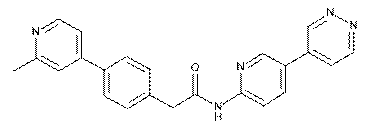
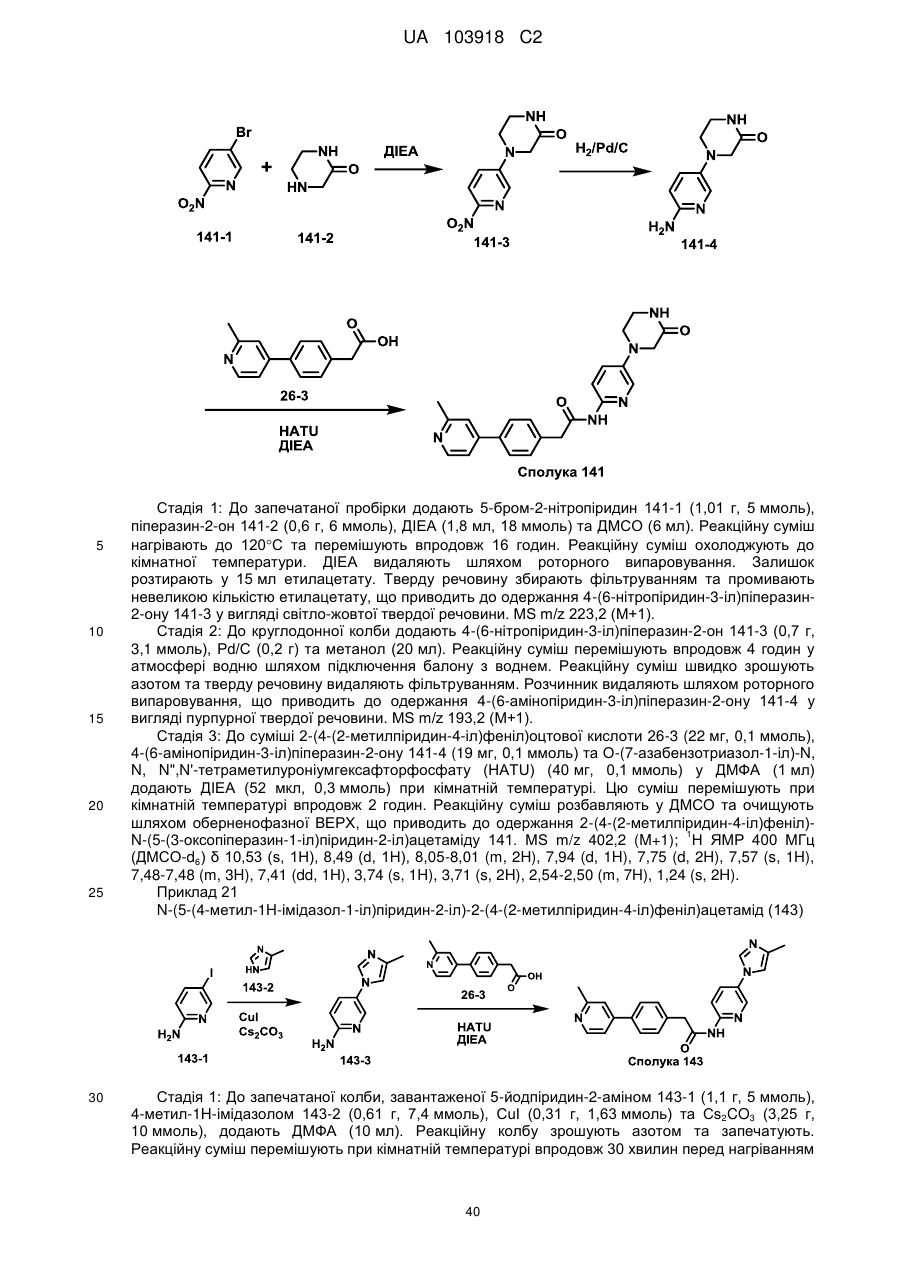
73
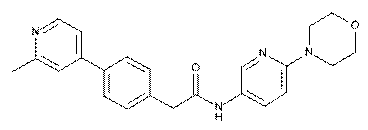
75
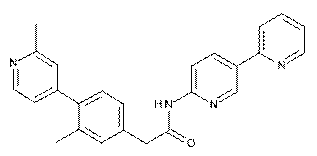
76
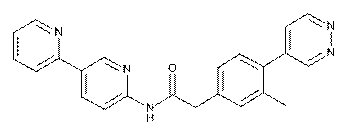
79
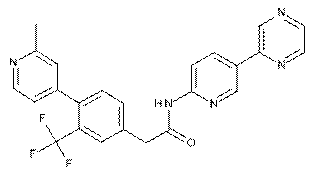
82
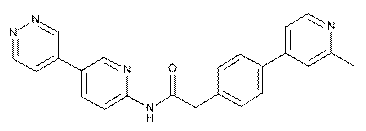
85
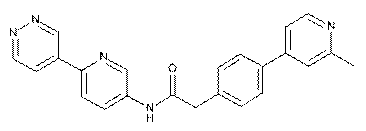
90
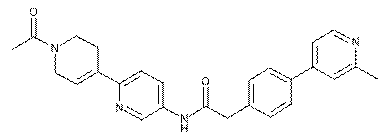
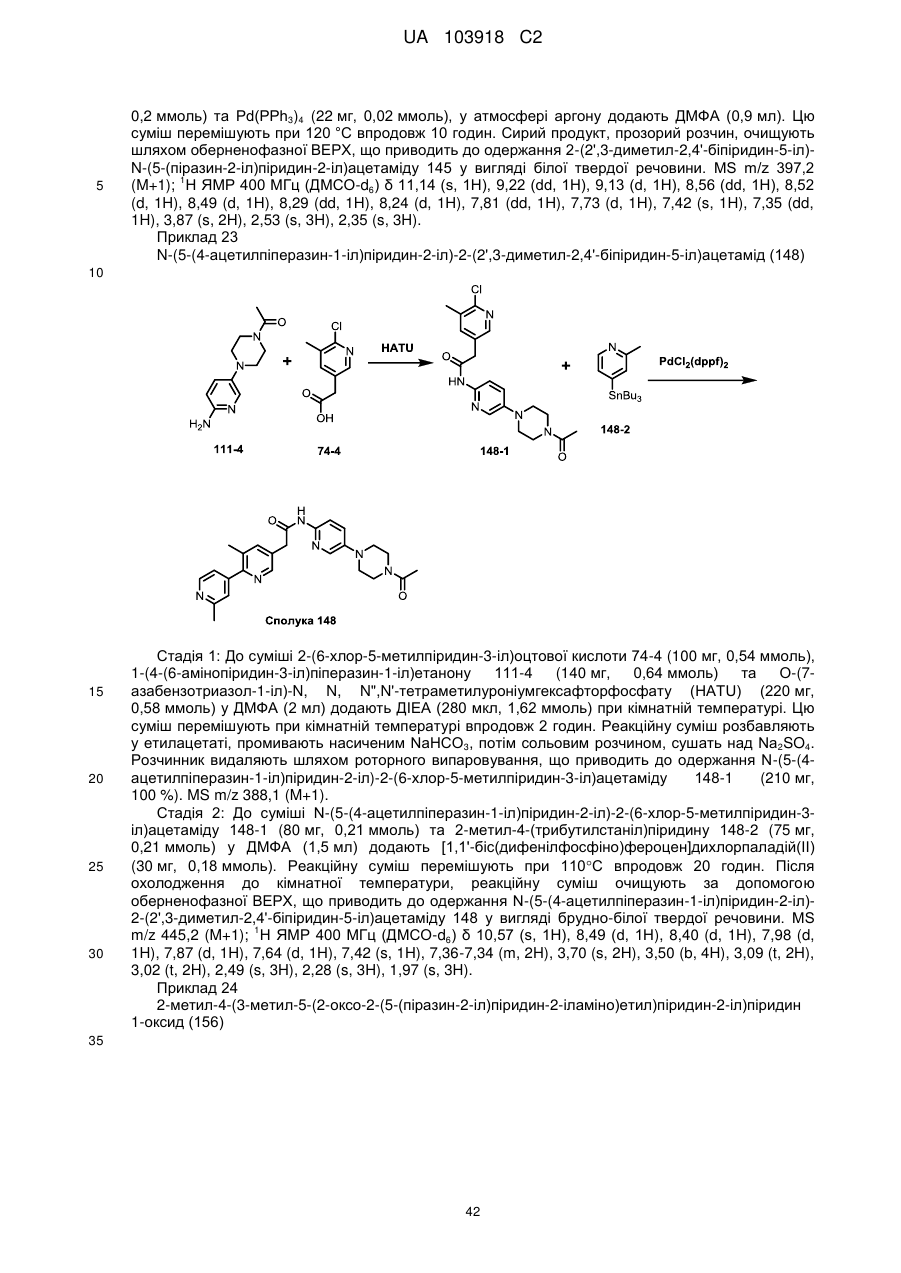
91
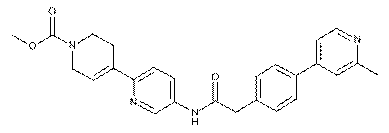
92
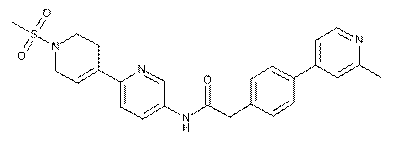
93
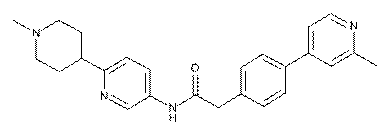
98
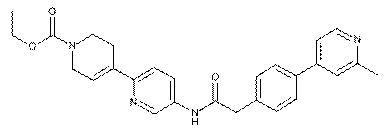
99
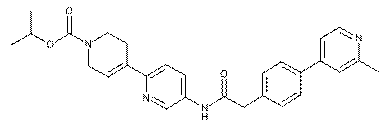
100
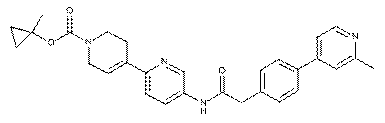
101
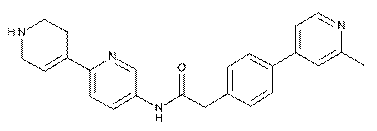
106
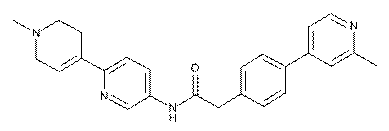
107
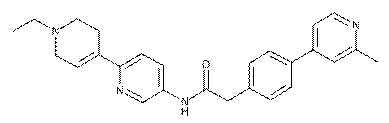
111
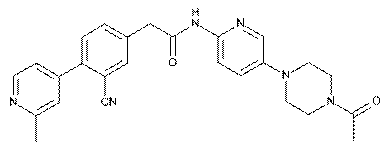
112
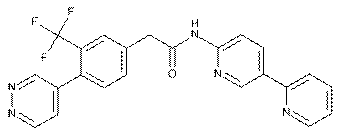
113
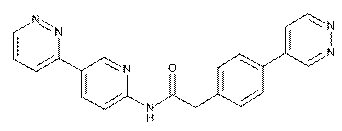
118
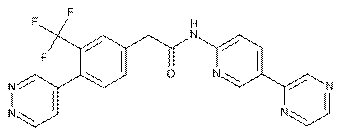
119
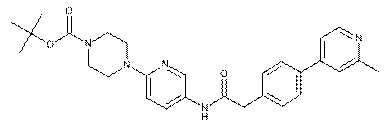
121
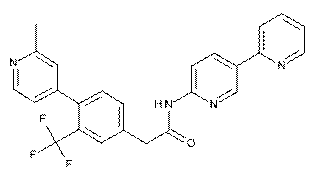
122
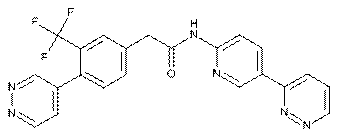
125
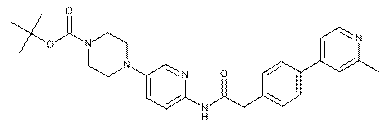
127
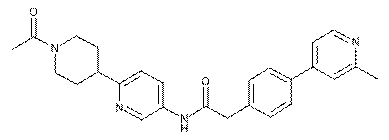
131
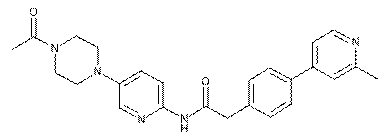
132
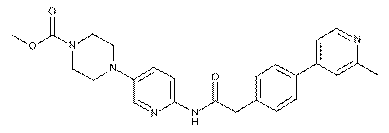
133
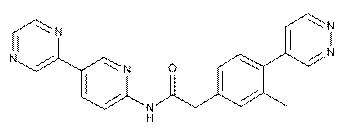
134
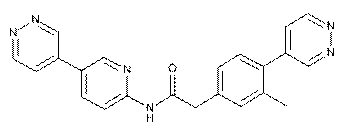
137
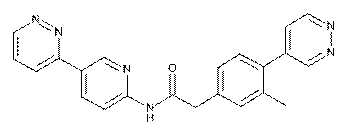
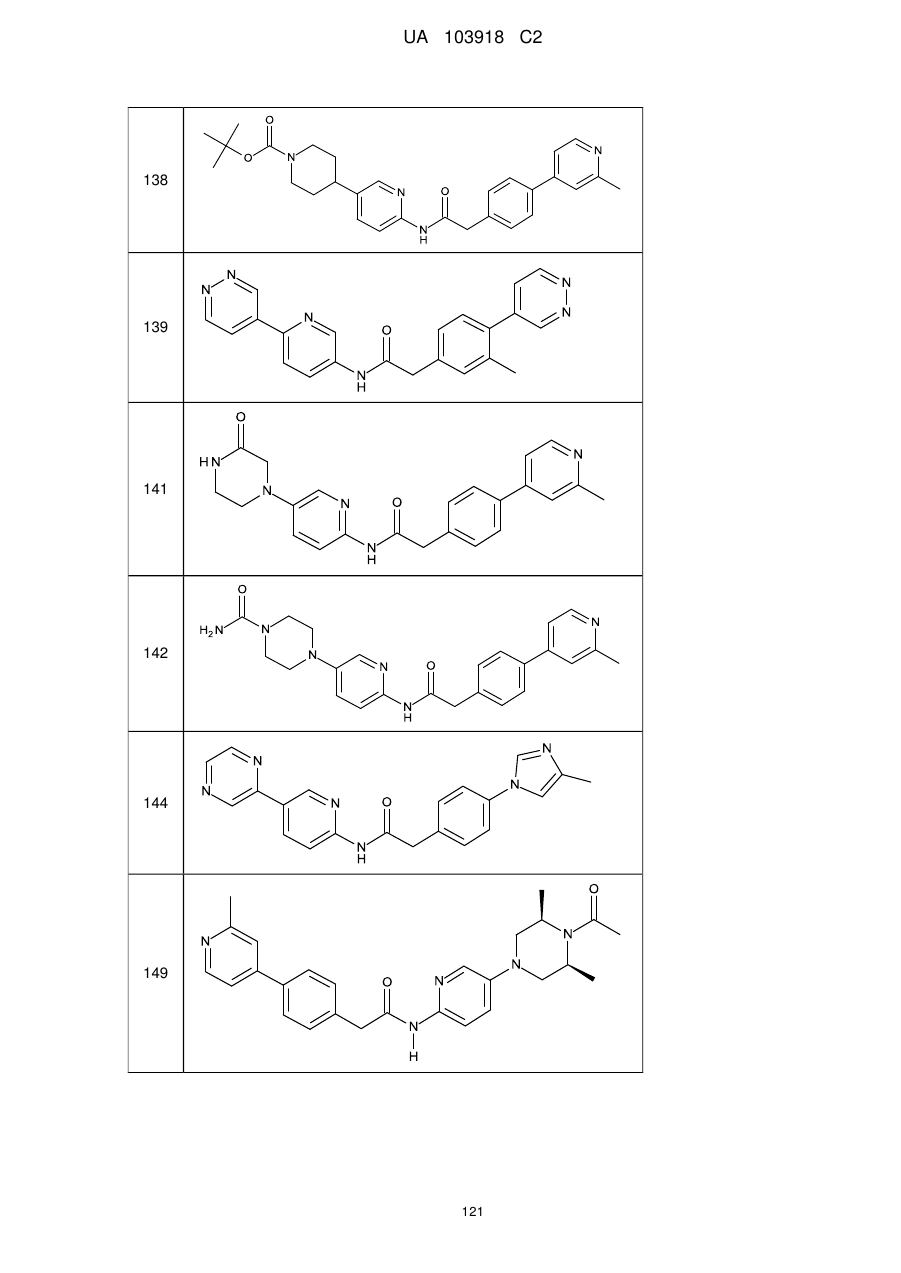
138
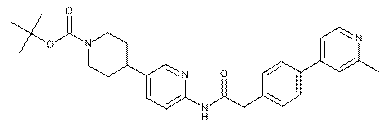
139
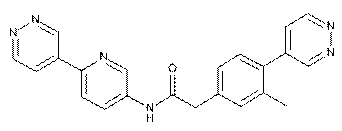
141
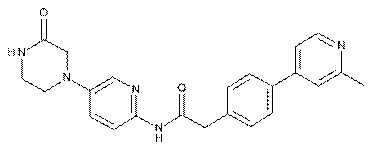
142
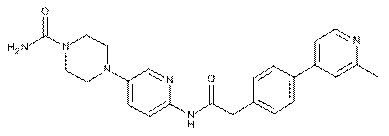
144
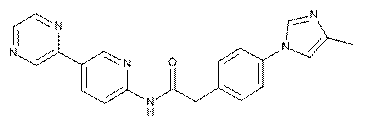
149
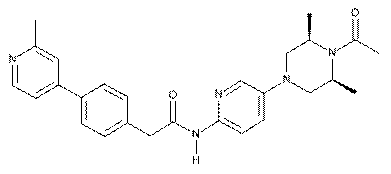
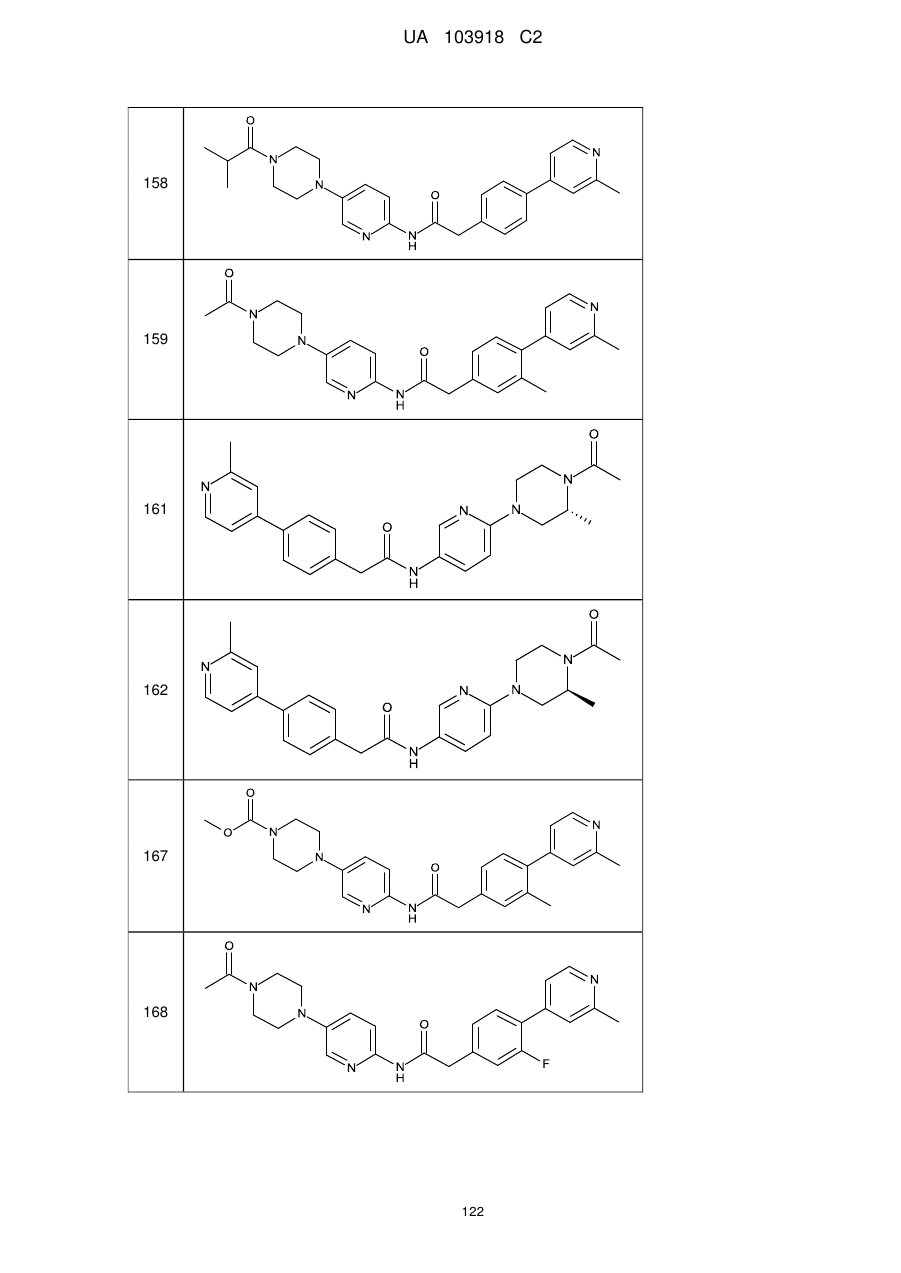
158
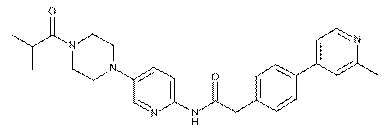
159
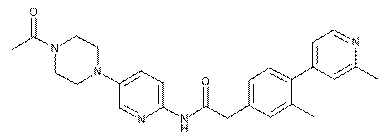
161
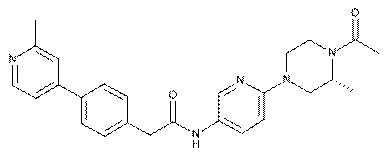
162
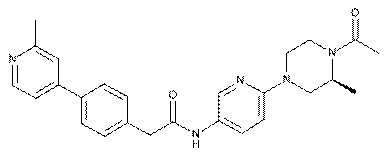
167
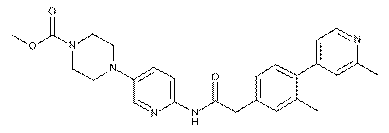
168
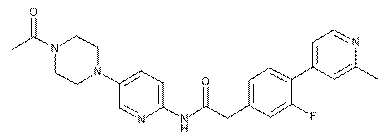
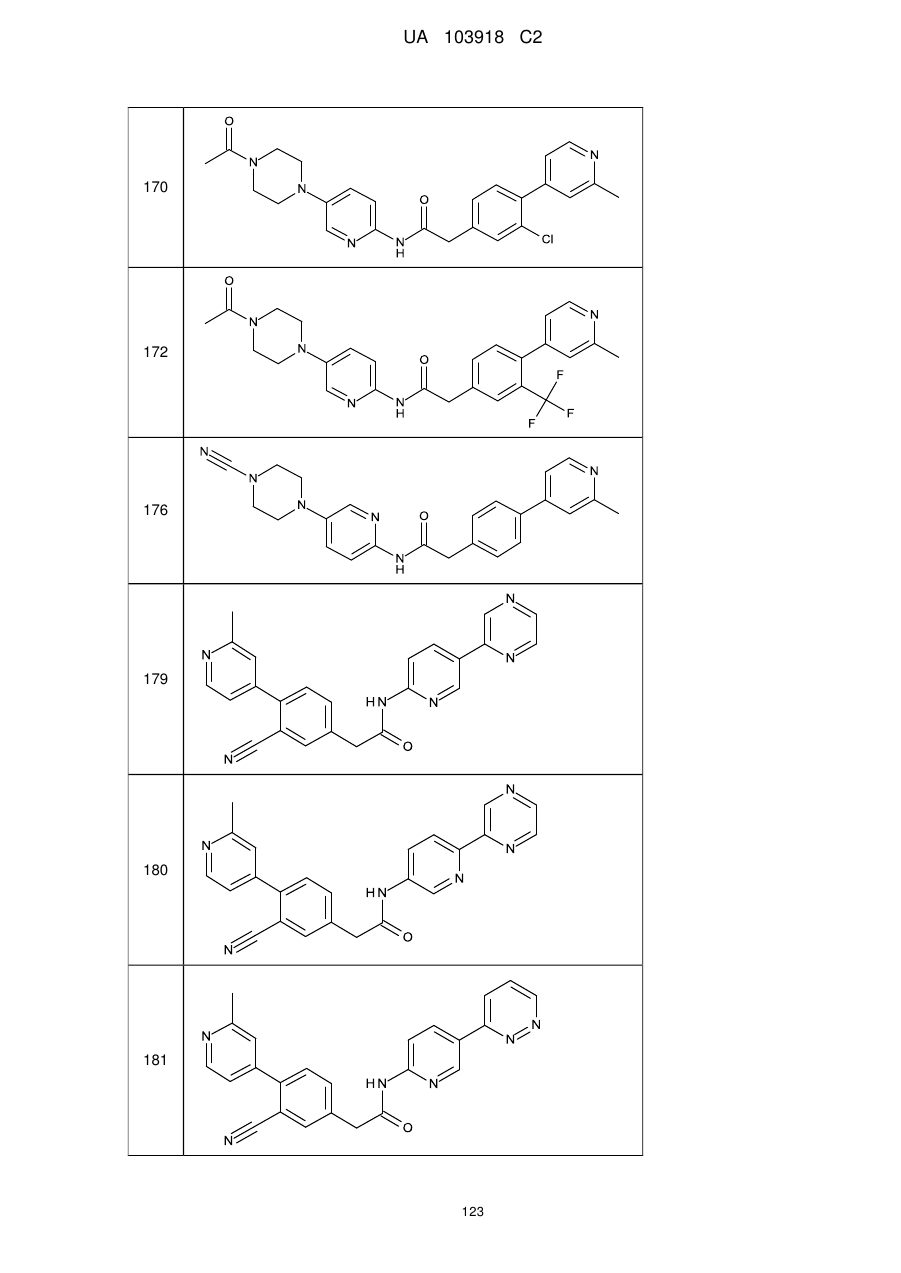
170
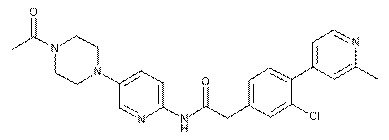
172
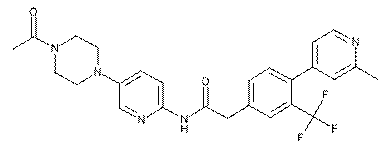
176
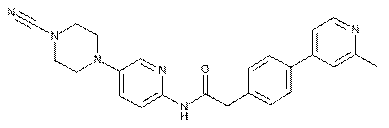
179
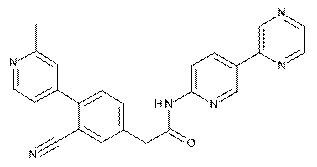
180
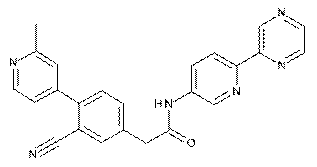
181
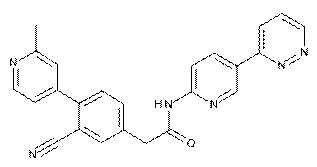
182
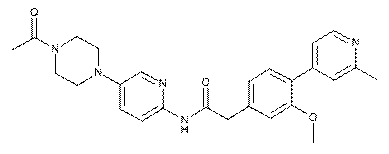
185
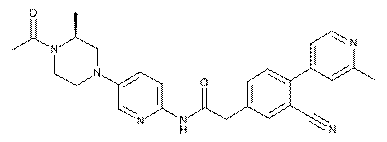
191
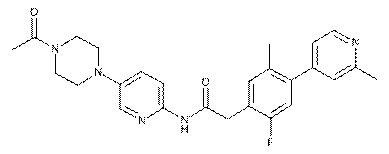
192
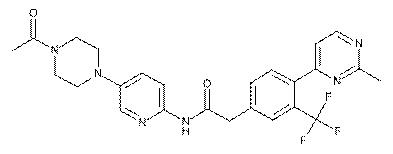
195
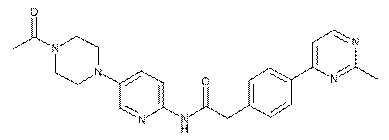
198
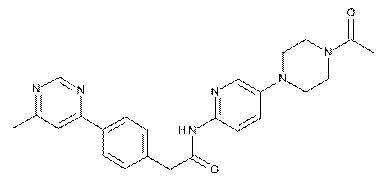
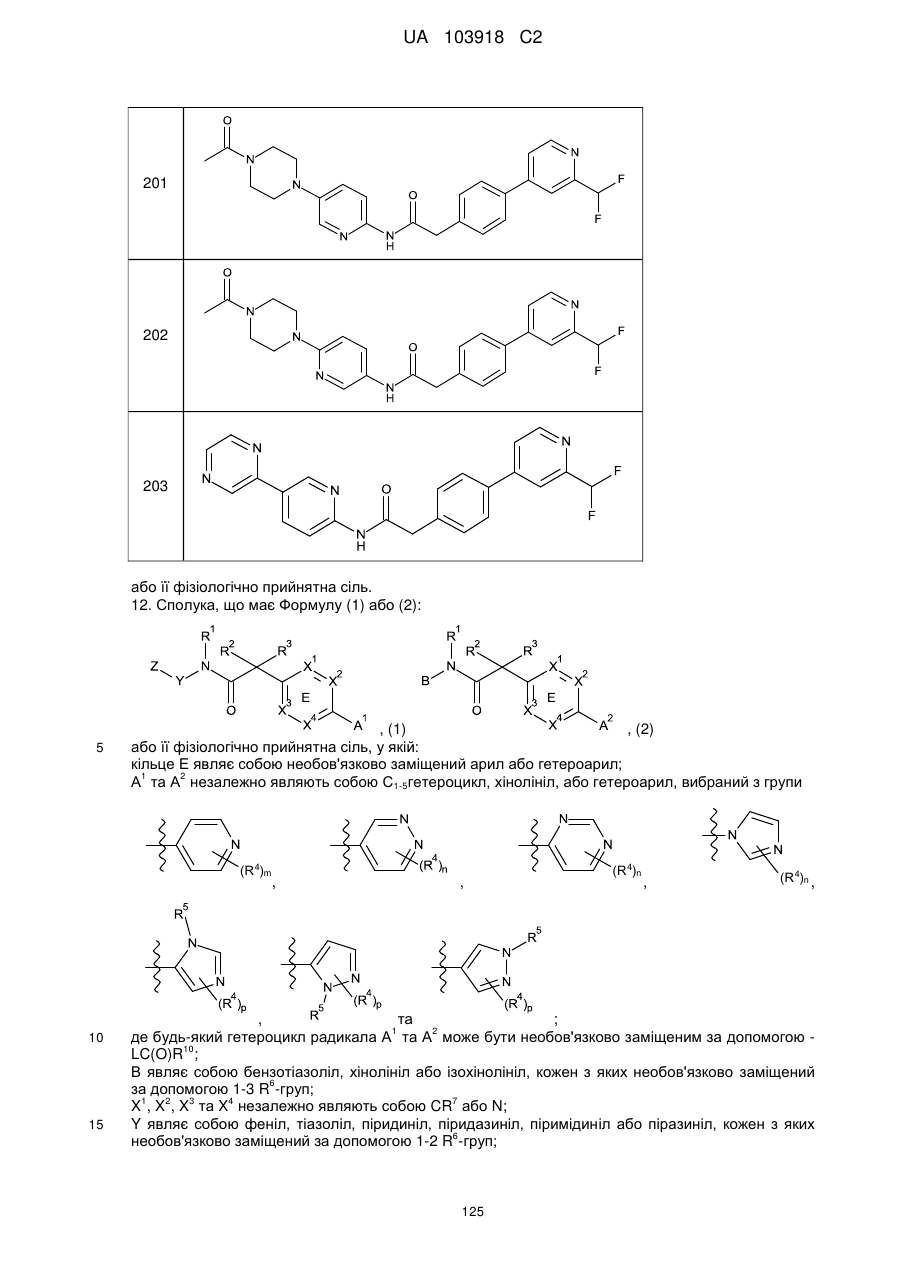
201
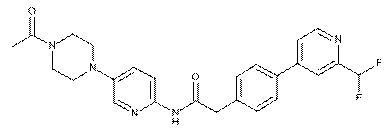
202
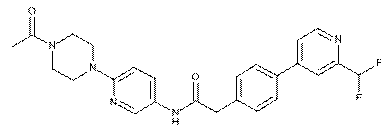
203
або її фізіологічно прийнятна сіль.
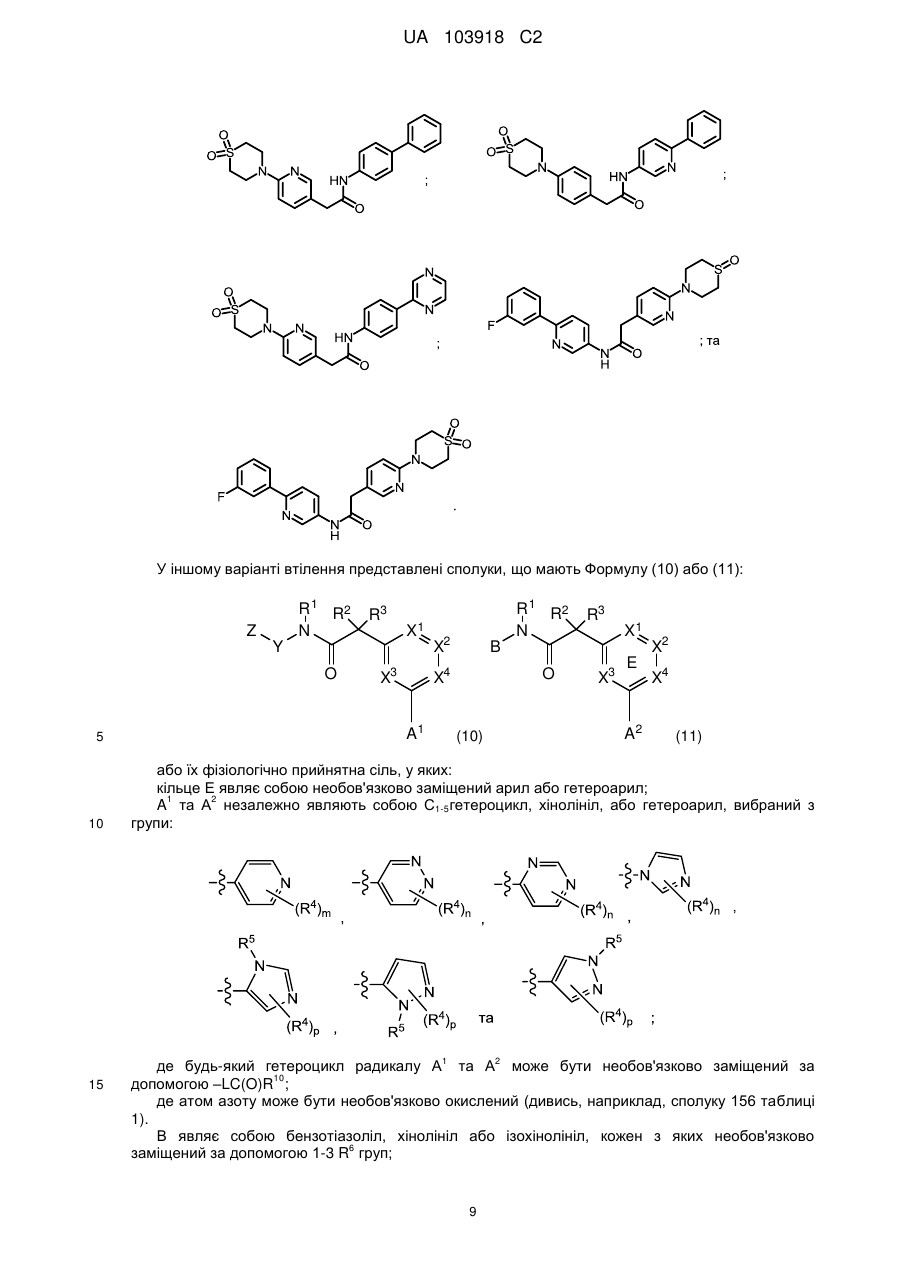
12. Сполука, що має Формулу (1) або (2):
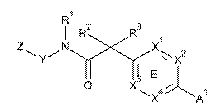 , (1)
, (1) 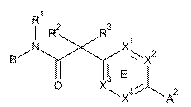 , (2)
, (2)
або її фізіологічно прийнятна сіль, у якій:
кільце Е являє собою необов'язково заміщений арил або гетероарил;
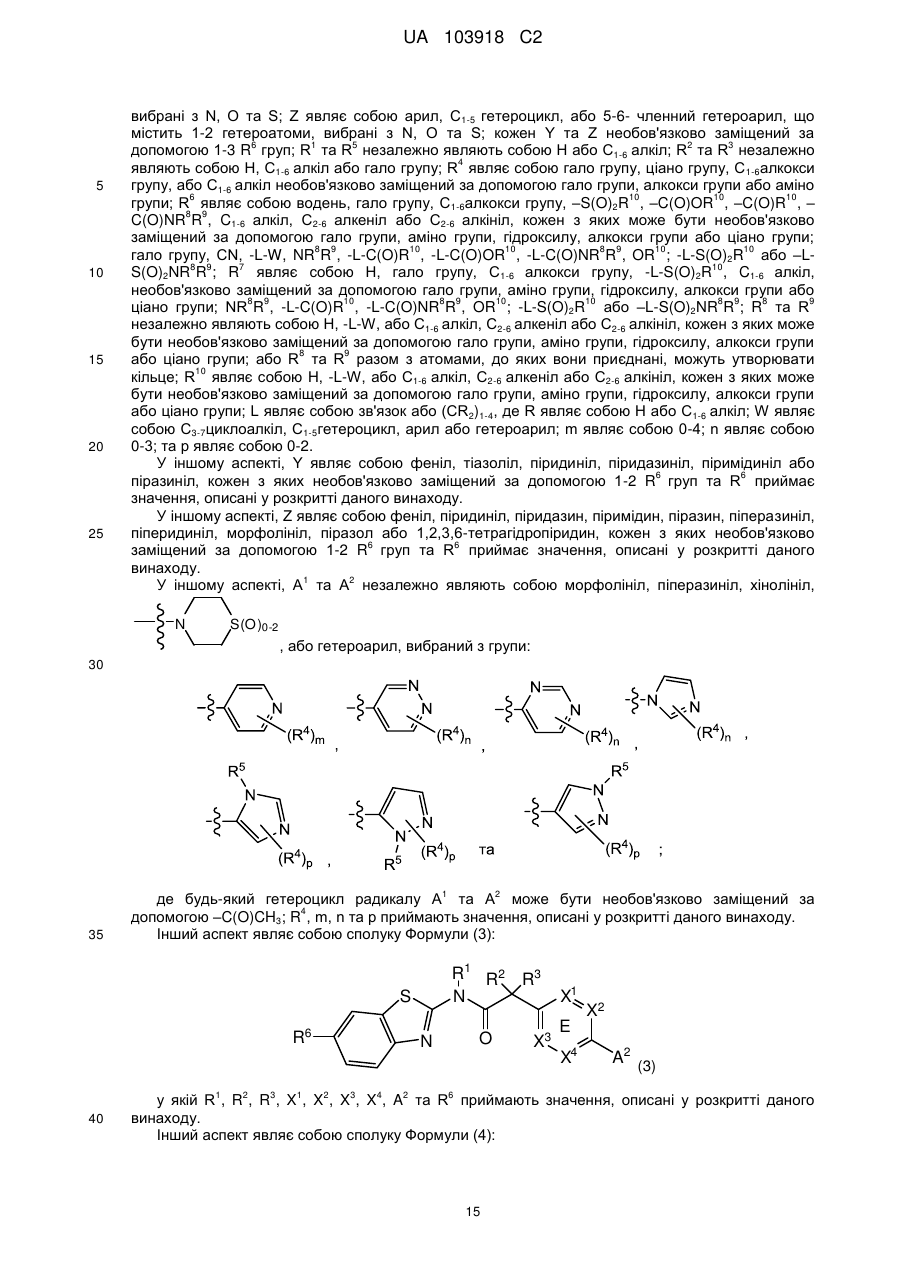
А1 та А2 незалежно являють собою С1-5гетероцикл, хінолініл, або гетероарил, вибраний з групи
 ,
,  ,
,  ,
,  ,
,  ,
,  та
та  ;
;
де будь-який гетероцикл радикала А1 та А2 може бути необов'язково заміщеним за допомогою -LC(O)R10;
В являє собою бензотіазоліл, хінолініл або ізохінолініл, кожен з яких необов'язково заміщений за допомогою 1-3 R6-груп;
X1, X2, X3 та X4 незалежно являють собою CR7 або N;
Y являє собою феніл, тіазоліл, піридиніл, піридазиніл, піримідиніл або піразиніл, кожен з яких необов'язково заміщений за допомогою 1-2 R6-груп;
Z являє собою арил, С1-5гетероцикл або 5-6 членний гетероарил, що містить 1-2 гетероатоми, вибрані з N, О та S;
кожен Y та Z необов'язково заміщений за допомогою 1-3 R6-груп;
R1 та R5 незалежно являють собою Н або С1-6алкіл;
R2 та R3 незалежно являють собою Н, С1-6алкіл або галогрупу;
R4 являє собою галогрупу, ціаногрупу, С1-6алкоксигрупу або С1-6алкіл, необов'язково заміщений галогрупою, алкоксигрупою або аміногрупою;
R6 являє собою водень, галогрупу, С1-6алкоксигрупу, -S(O)2R10, -C(O)OR10, -C(O)R10, -C(O)NR8R9, С1-6алкіл, С2-6алкеніл або С2-6алкініл, кожен з яких може бути необов'язково заміщений галогрупою, аміногрупою, гідроксилом, алкоксигрупою або ціаногрупою; галогрупу, CN, -L-W, NR8R9, -L-C(O)R10, -L-C(O)OR10, -L-C(O)NR8R9, OR10; -L-S(O)2R10 або -L-S(O)2NR8R9;
R7 являє собою Н, галогрупу, С1-6алкоксигрупу, -L-S(O)2R10, С1-6алкіл, необов'язково заміщений галогрупою, аміногрупою, гідроксилом, алкоксигрупою або ціаногрупою; NR8R9, -L-C(O)R10, -L-C(O)NR8R9, OR10; -L-S(O)2R10 або -L-S(O)2NR8R9;
R8 тa R9 незалежно являють собою H, -L-W, або С1-6алкіл, С2-6алкеніл або С2-6алкініл, кожен з яких може бути необов'язково заміщений галогрупою, аміногрупою,гідроксилом, алкоксигрупою або ціаногрупою; або R8 та R9 разом з атомами, до яких вони приєднані, можуть утворювати кільце;
R10 являє собою Н, -L-W, або С1-6алкіл, С2-6алкеніл або С2-6алкініл, кожен з яких може бути необов'язково заміщений галогрупою, аміногрупою, гідроксилом, алкоксигрупою або ціаногрупою;
L являє собою зв'язок або (CR2)1-4, де R являє собою Н або С1-6алкіл;
W являє собою С3-7циклоалкіл, С1-5гетероцикл, арил або гетероарил;
m являє собою 0-4;
n являє собою 0-3; та
р являє собою 0-2.
13. Сполука за п. 12, у якій Z являє собою феніл, піридиніл, піридазин, піримідин, піразин, піперазиніл, піперидиніл, морфолініл, піразол або 1,2,3,6-тетрагідропіридин, кожен з яких необов'язково заміщений за допомогою 1-2 R6-груп та R6 приймає значення, визначені у п. 1.
14. Сполука за п. 12, у якій А1 та А2 незалежно являють собою морфолініл, піперазиніл, хінолініл, 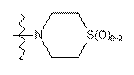 або гетероарил, вибраний з групи:
або гетероарил, вибраний з групи:
 ,
,  ,
,  ,
,  ,
,  ,
,  та
та  ;
;
де будь-який гетероцикл радикала А1 та А2 може бути необов'язково заміщений за допомогою -С(О)СН3;
R4 та n приймають значення, описані у п. 1.
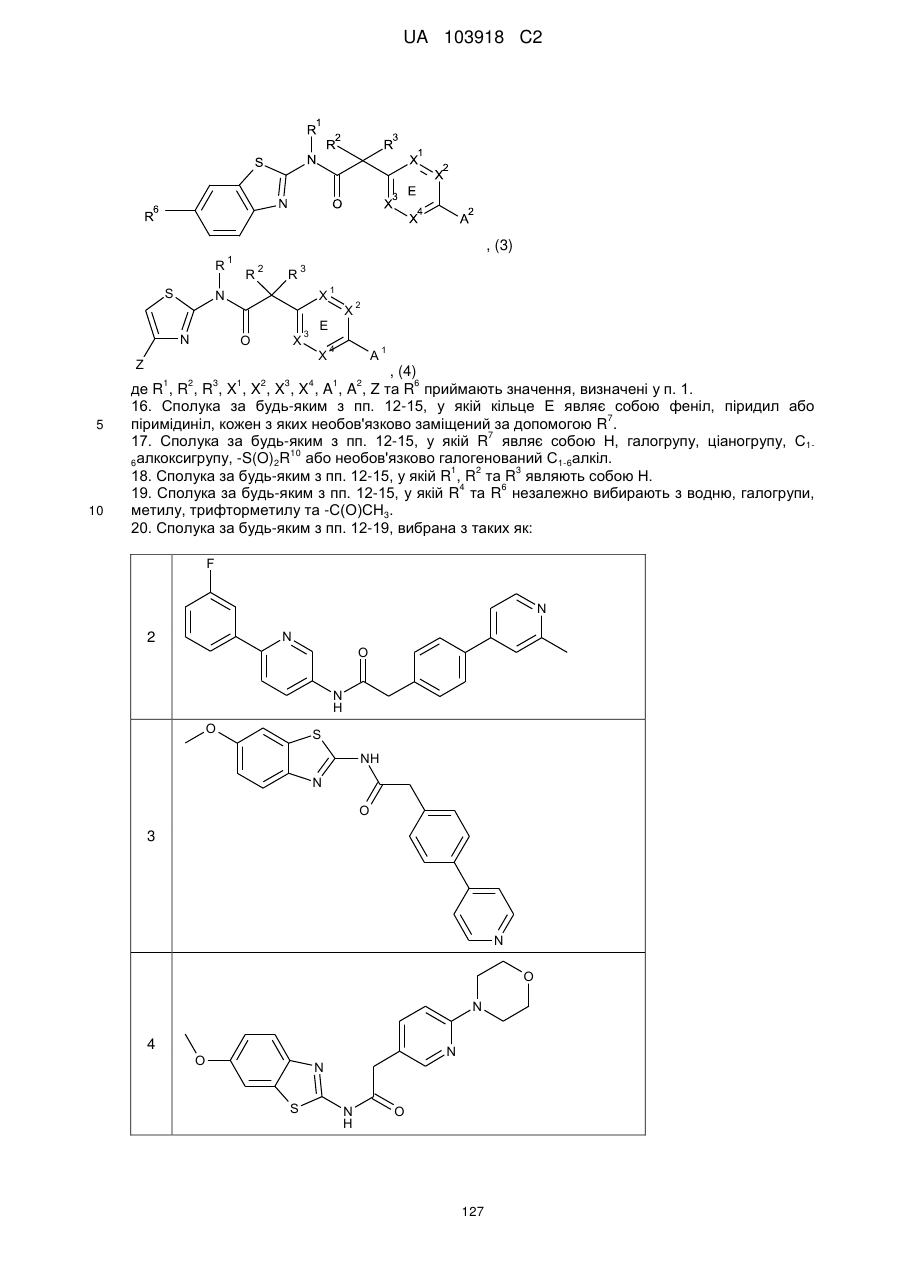
15. Сполука за п. 12, де зазначена сполука має Формулу (3) або Формулу (4):
 , (3)
, (3)
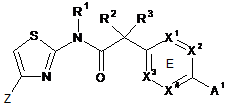 , (4)
, (4)
де R1, R2, R3, X1, X2, X3, X4, A1, A2, Z та R6 приймають значення, визначені у п. 1.
16. Сполука за будь-яким з пп. 12-15, у якій кільце Е являє собою феніл, піридил або піримідиніл, кожен з яких необов'язково заміщений за допомогою R7.
17. Сполука за будь-яким з пп. 12-15, у якій R7 являє собою Н, галогрупу, ціаногрупу, С1-6алкоксигрупу, -S(O)2R10 або необов'язково галогенований С1-6алкіл.
18. Сполука за будь-яким з пп. 12-15, у якій R1, R2 та R3 являють собою Н.
19. Сполука за будь-яким з пп. 12-15, у якій R4 та R6 незалежно вибирають з водню, галогрупи, метилу, трифторметилу та -С(О)СН3.
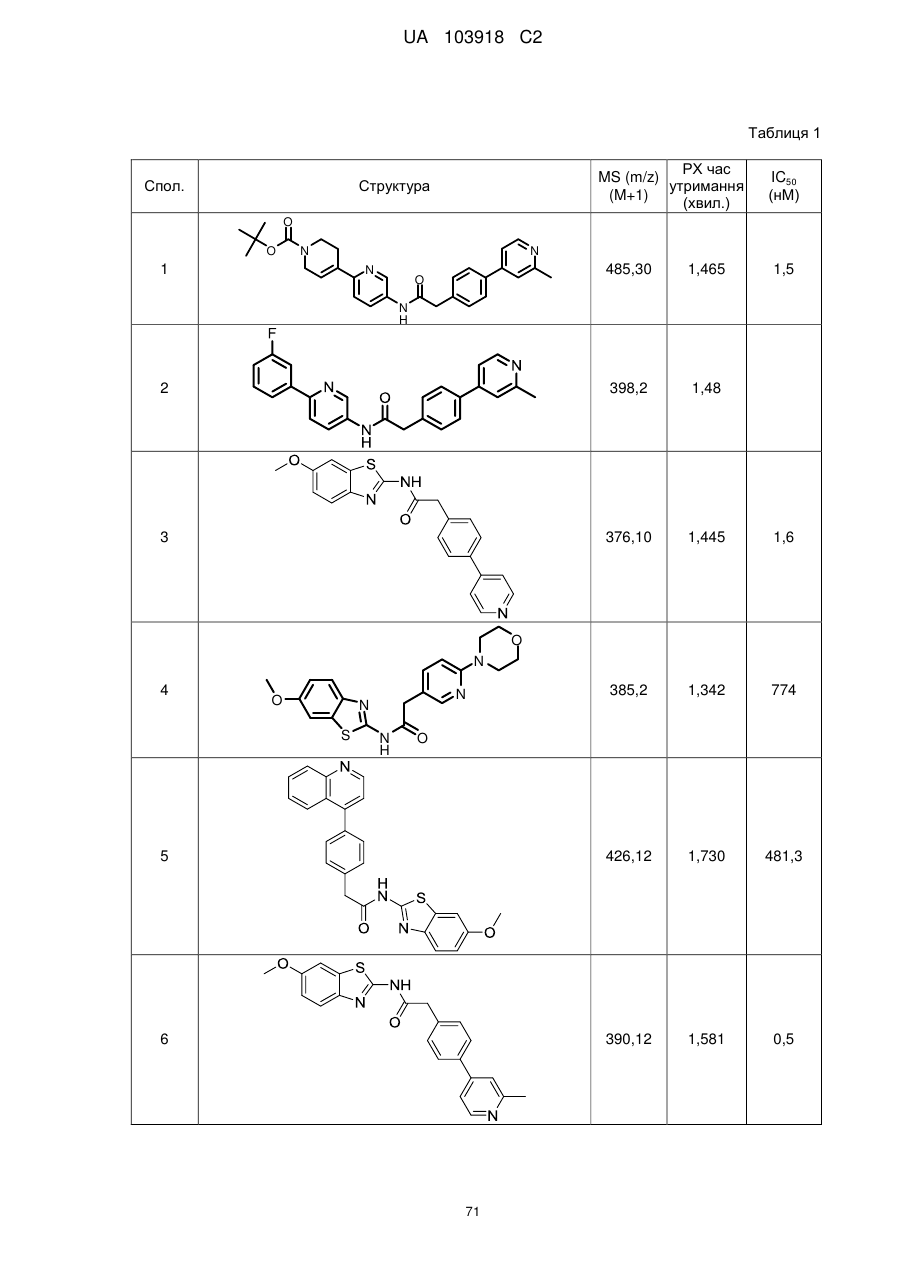
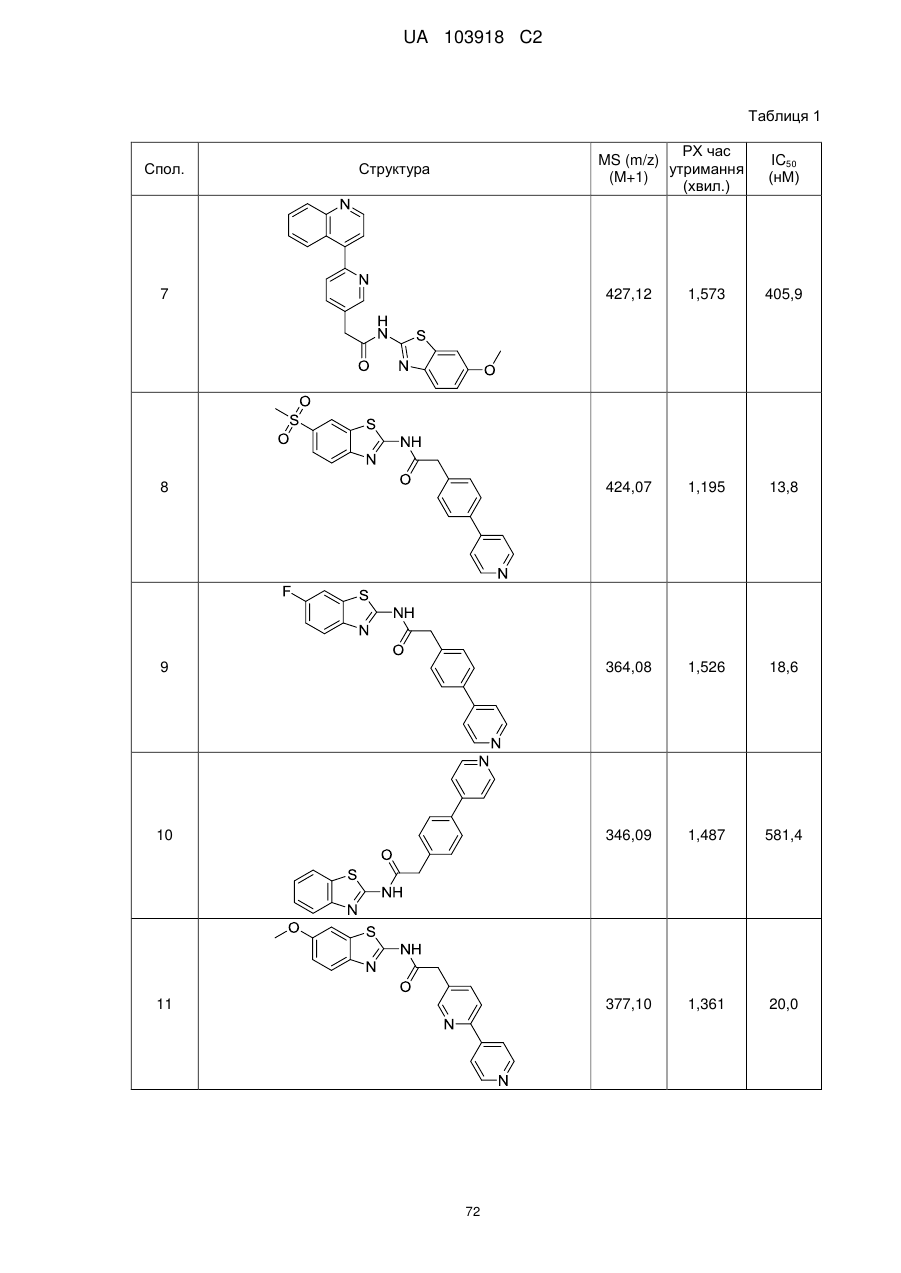
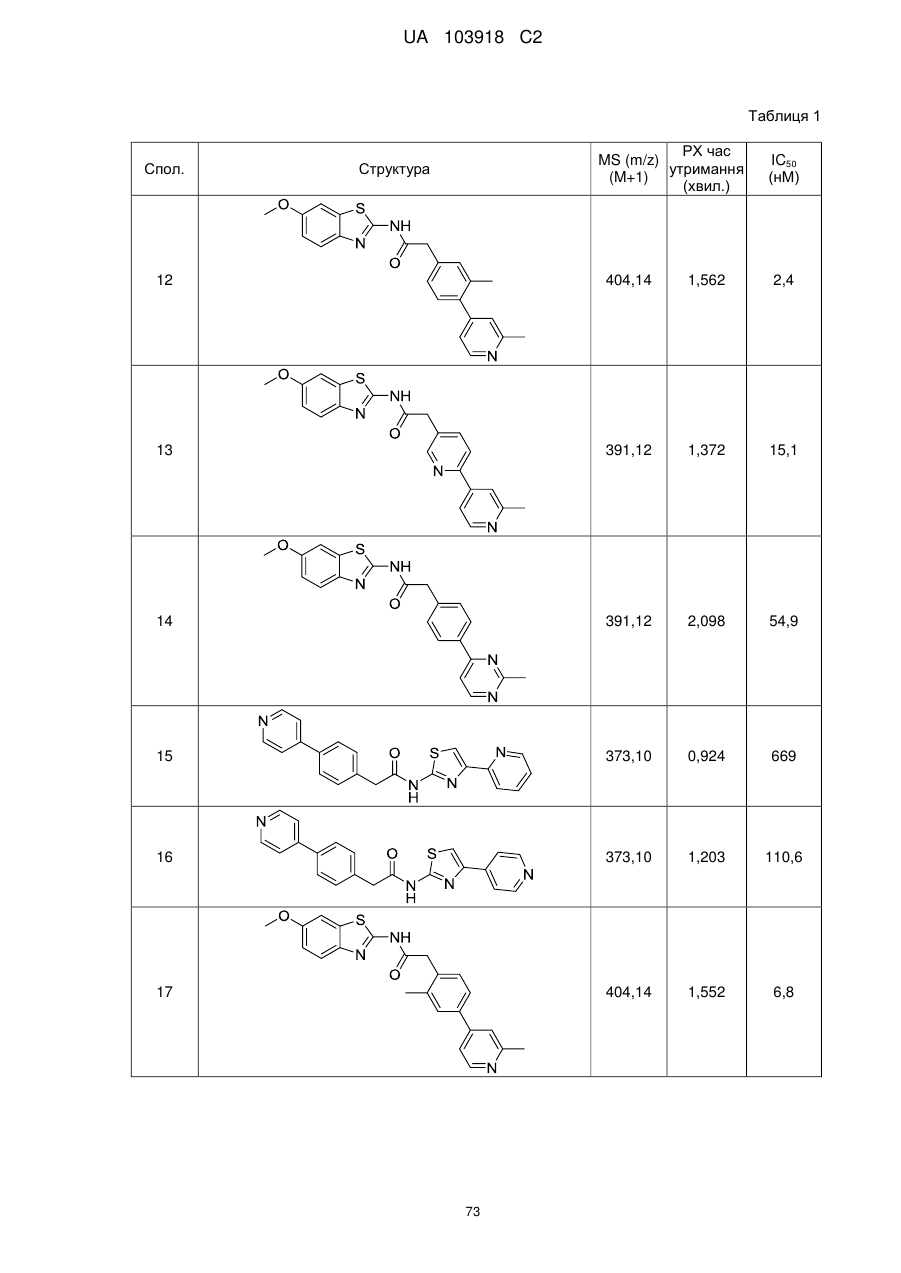
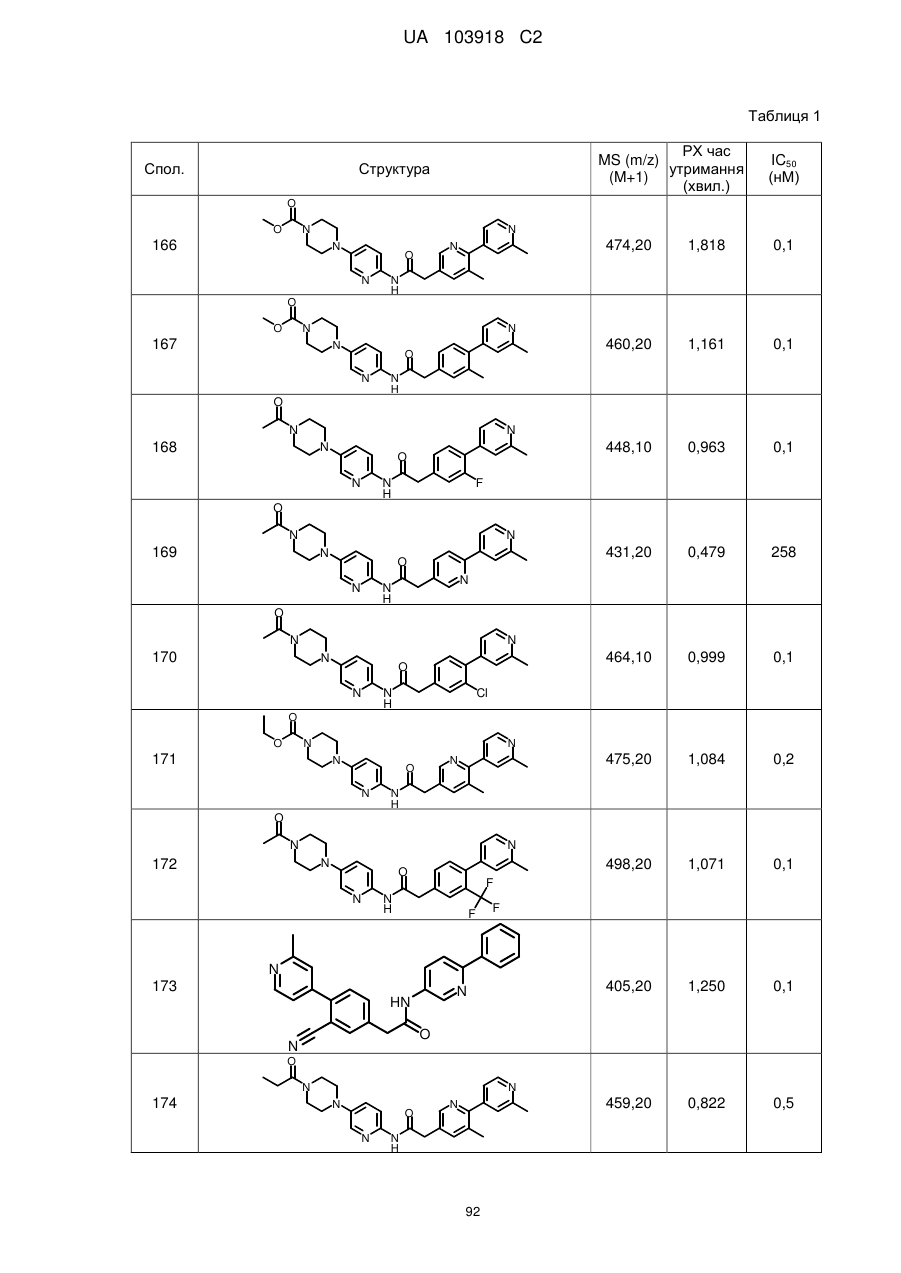
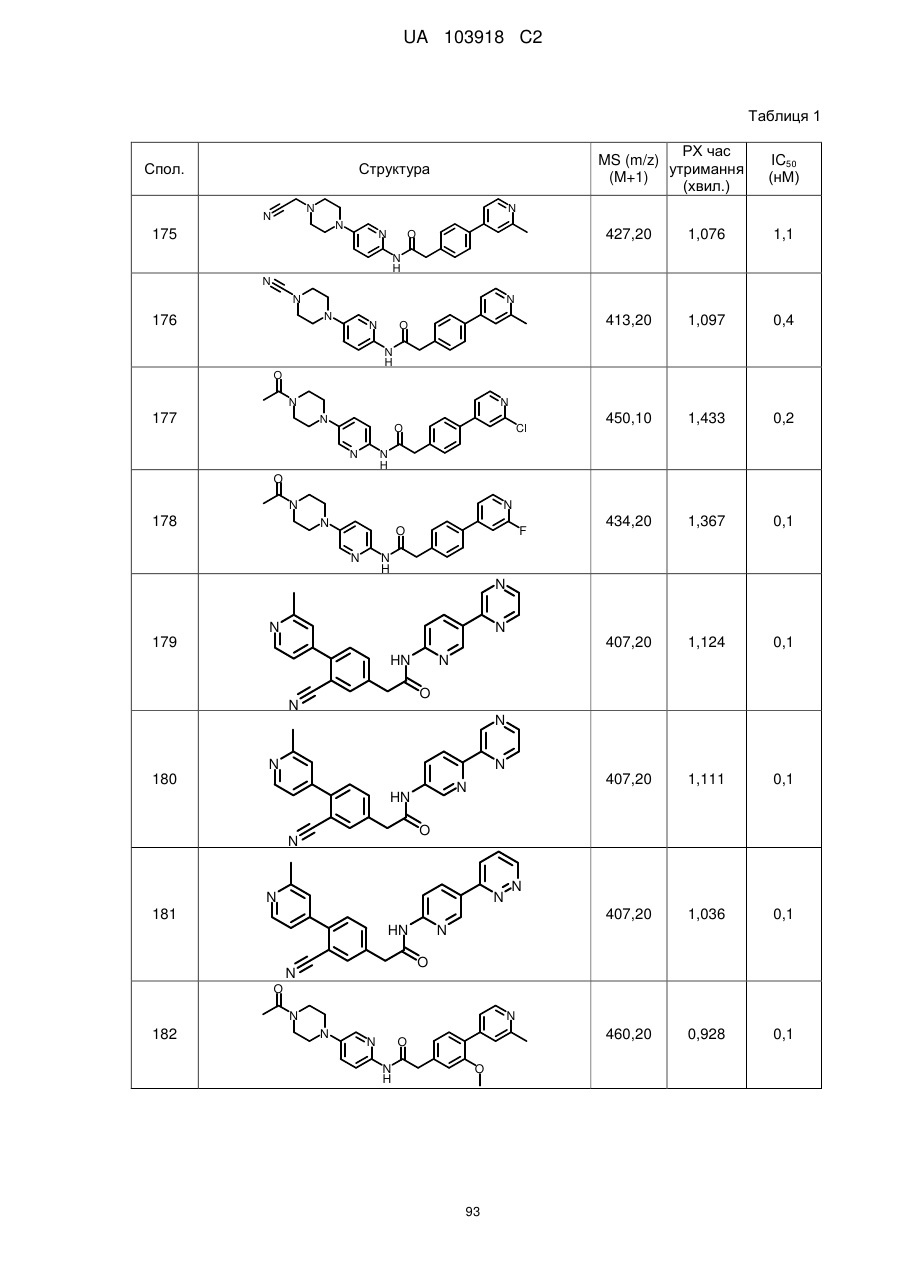
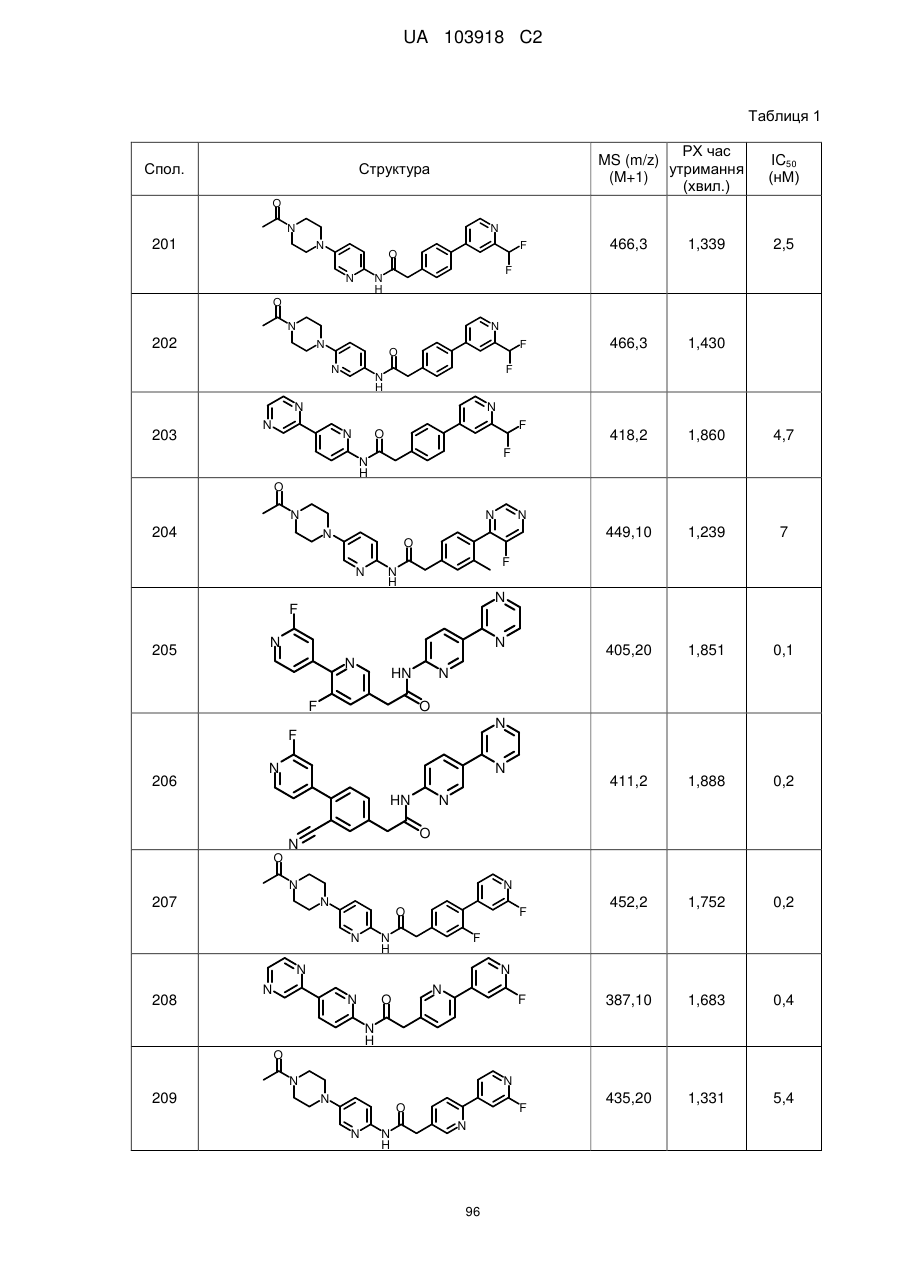
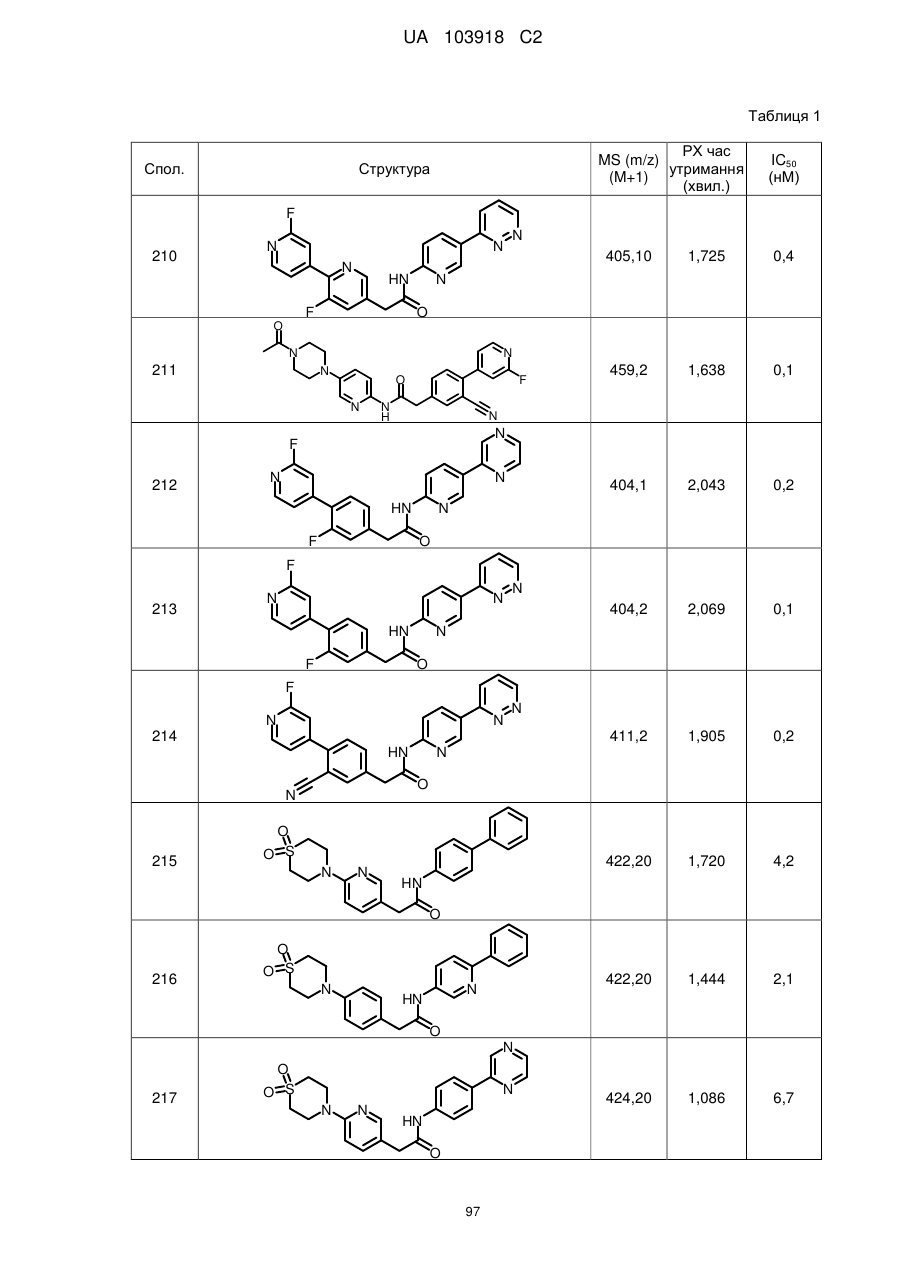
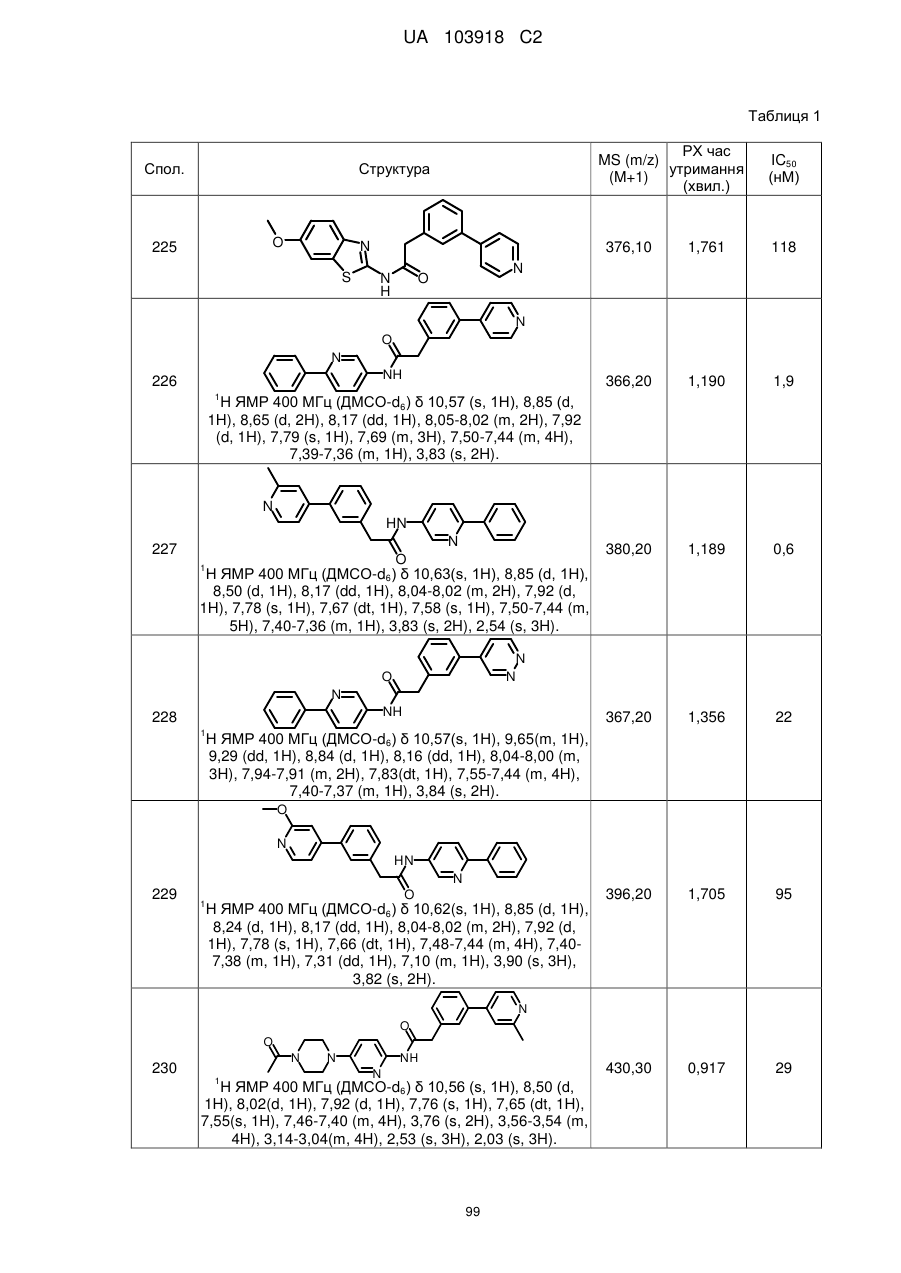
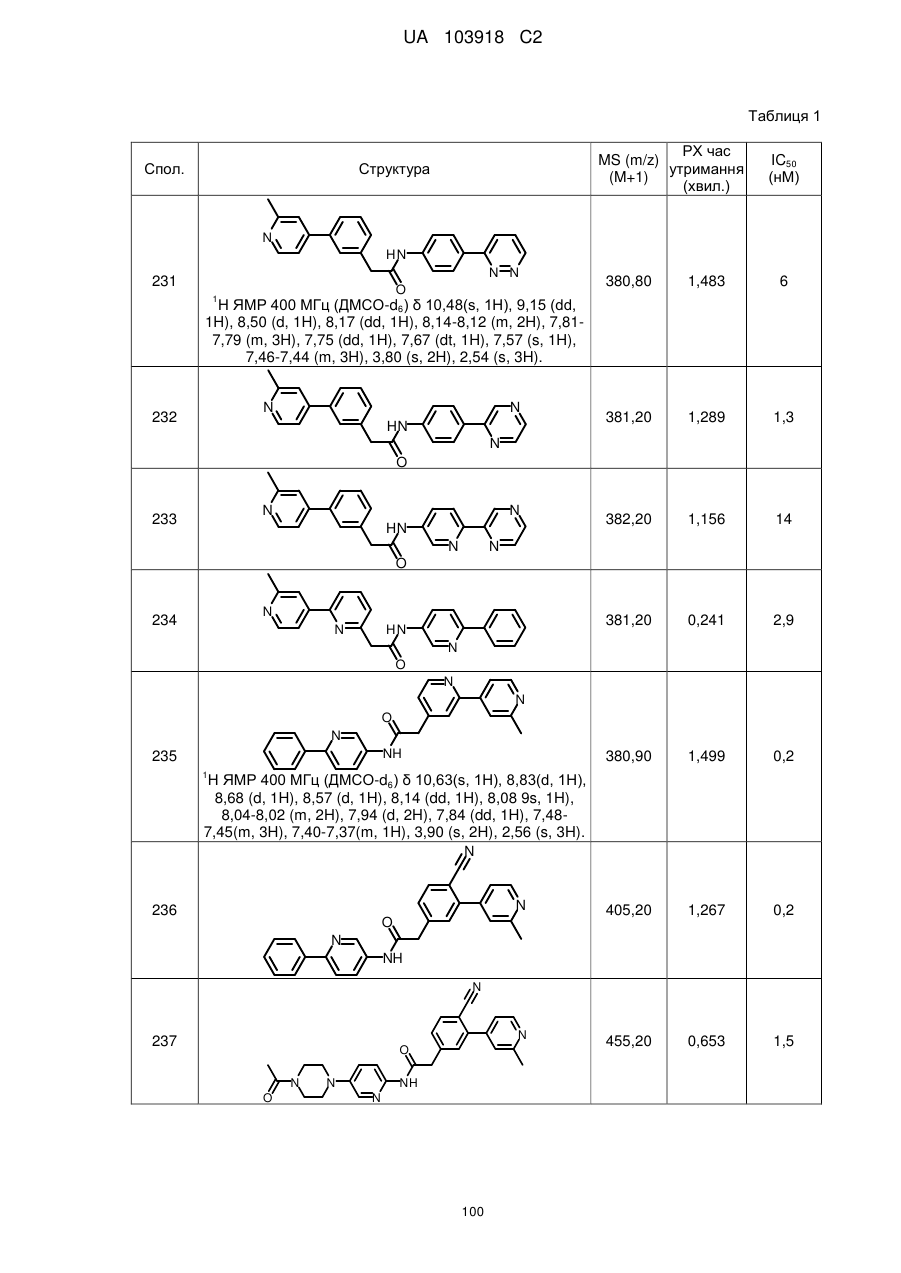
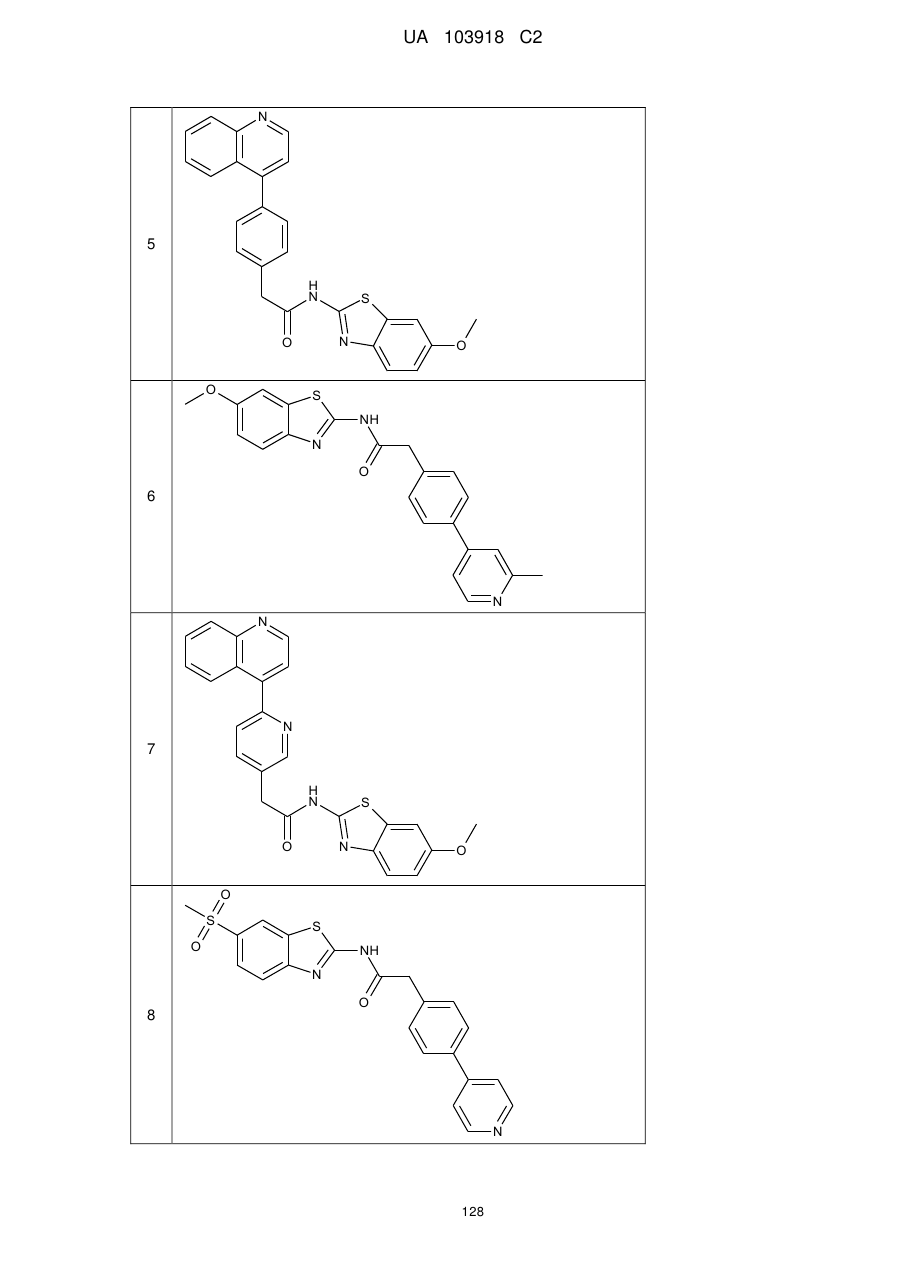
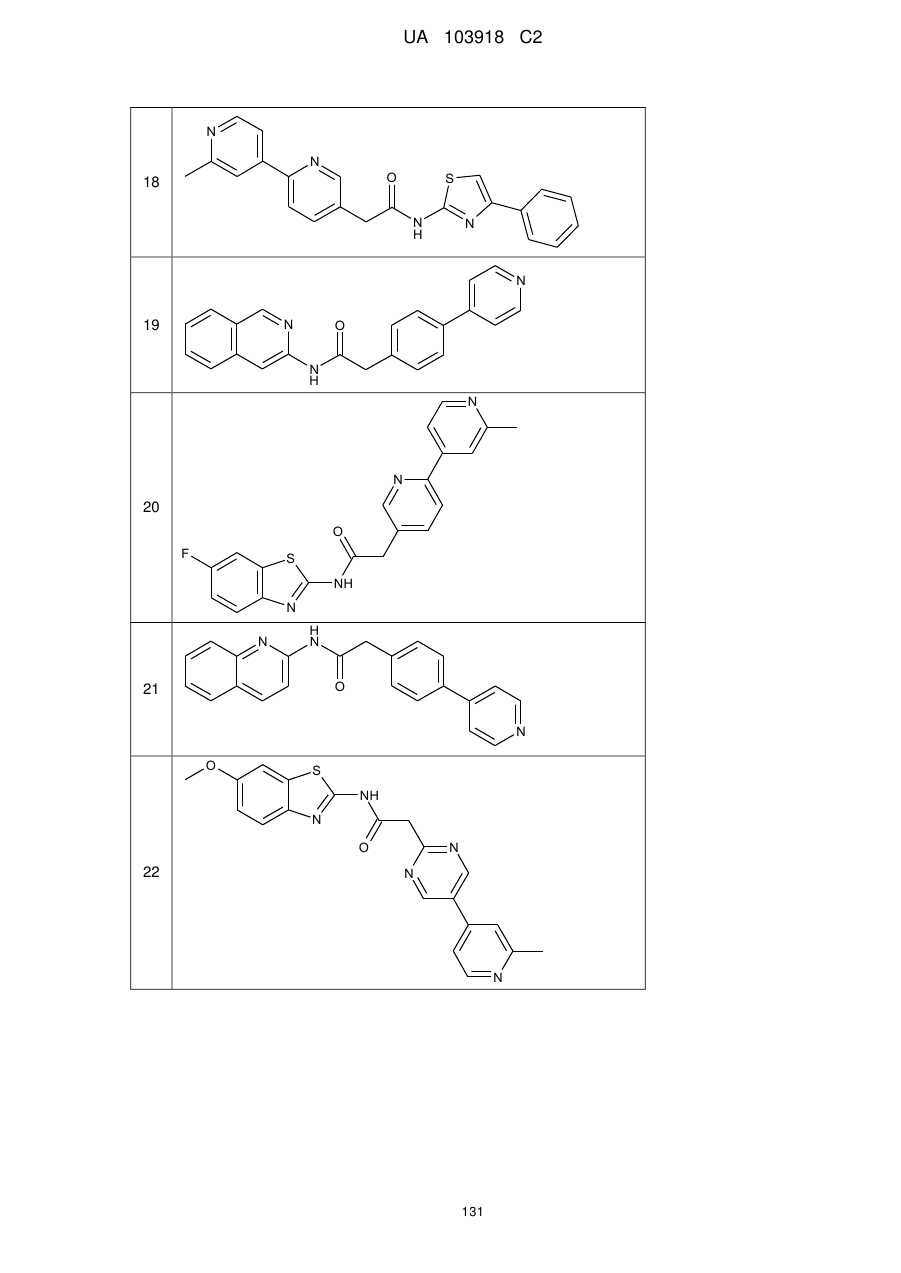
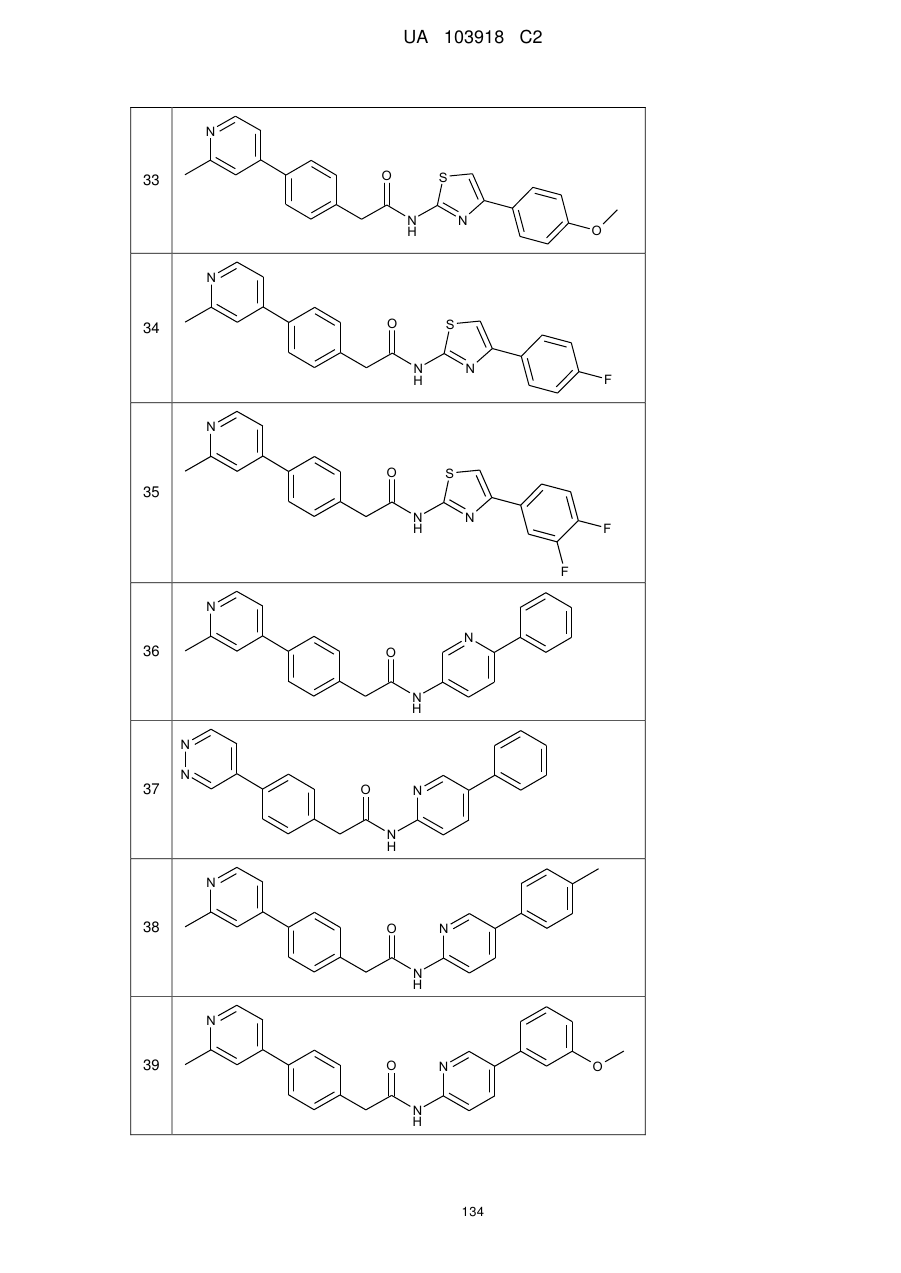
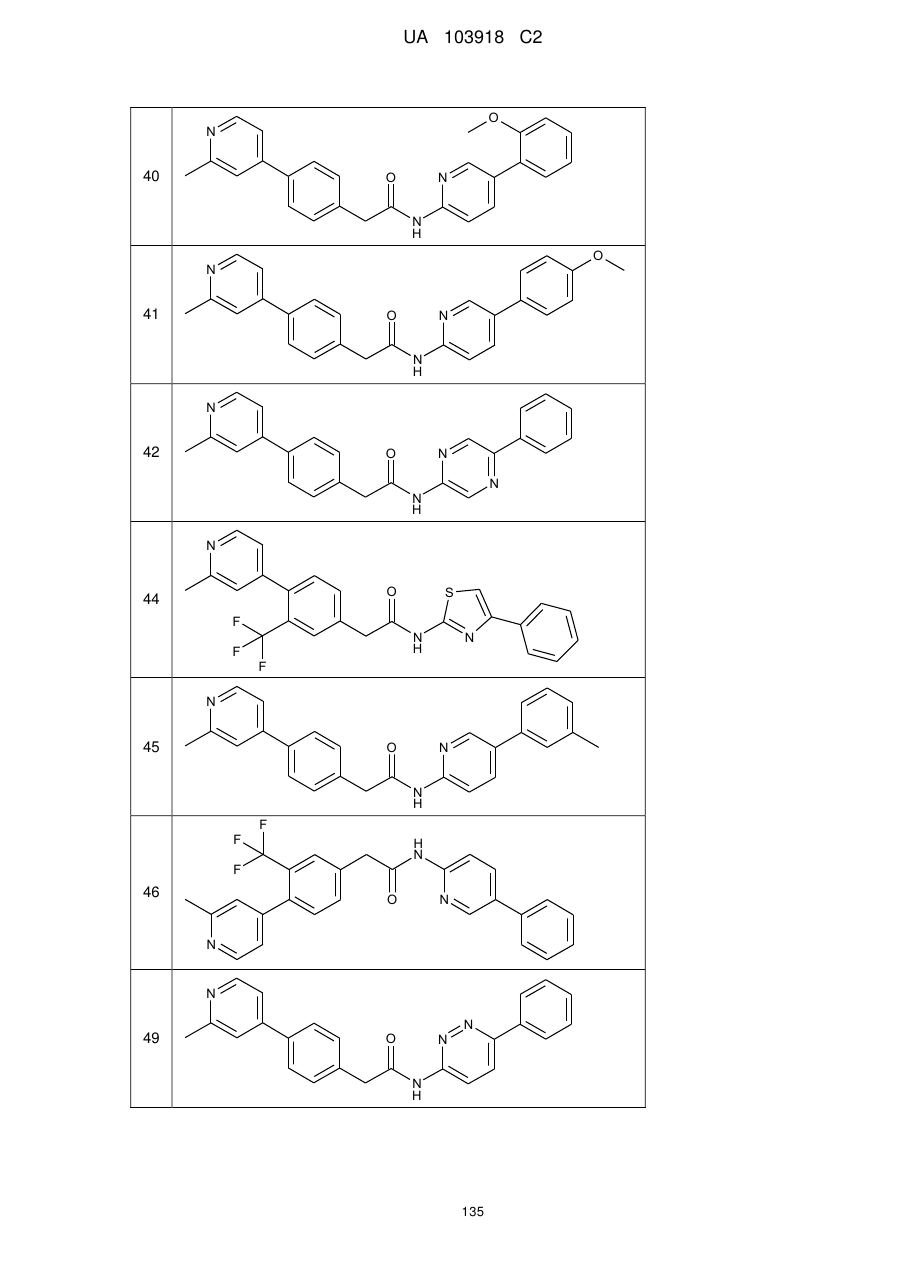
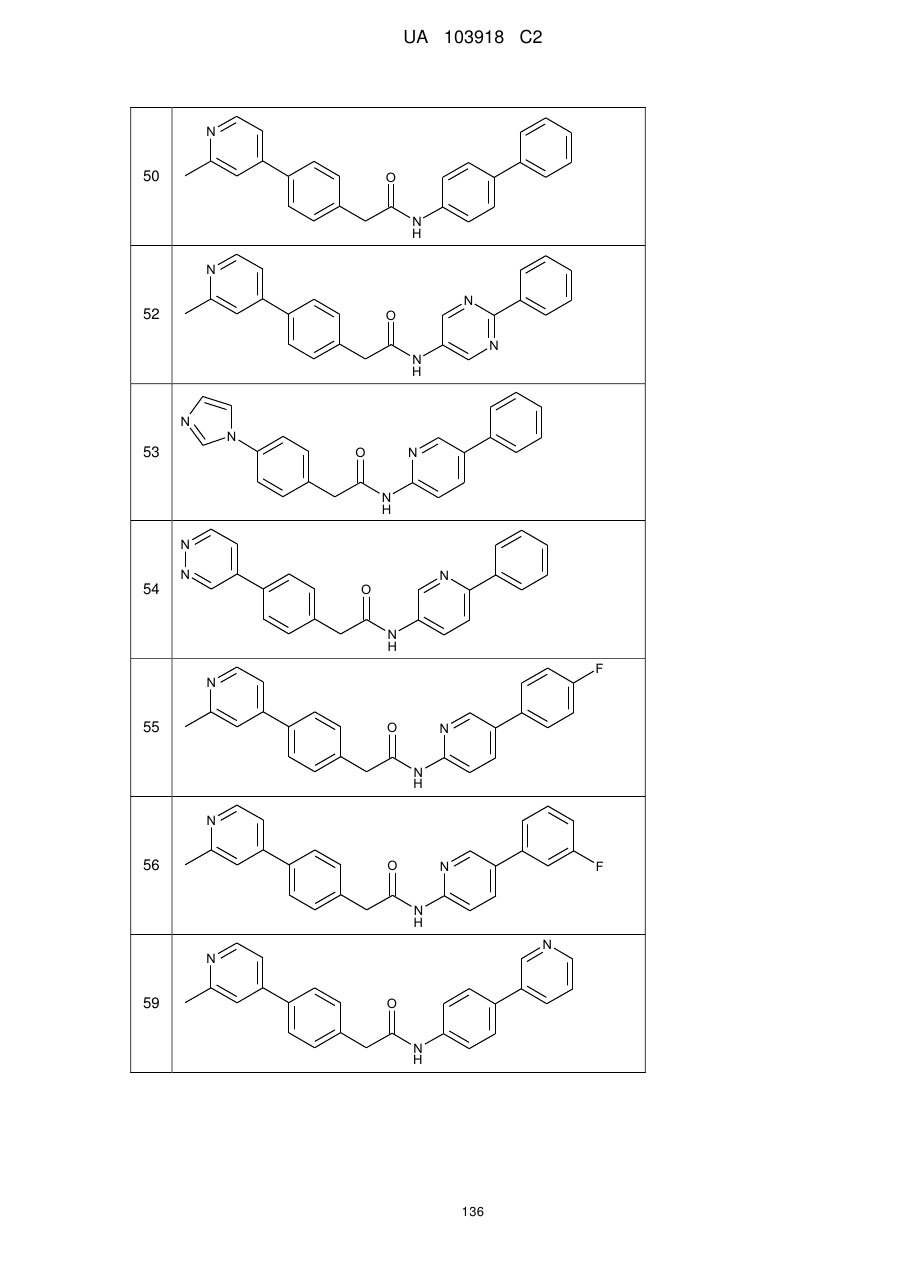
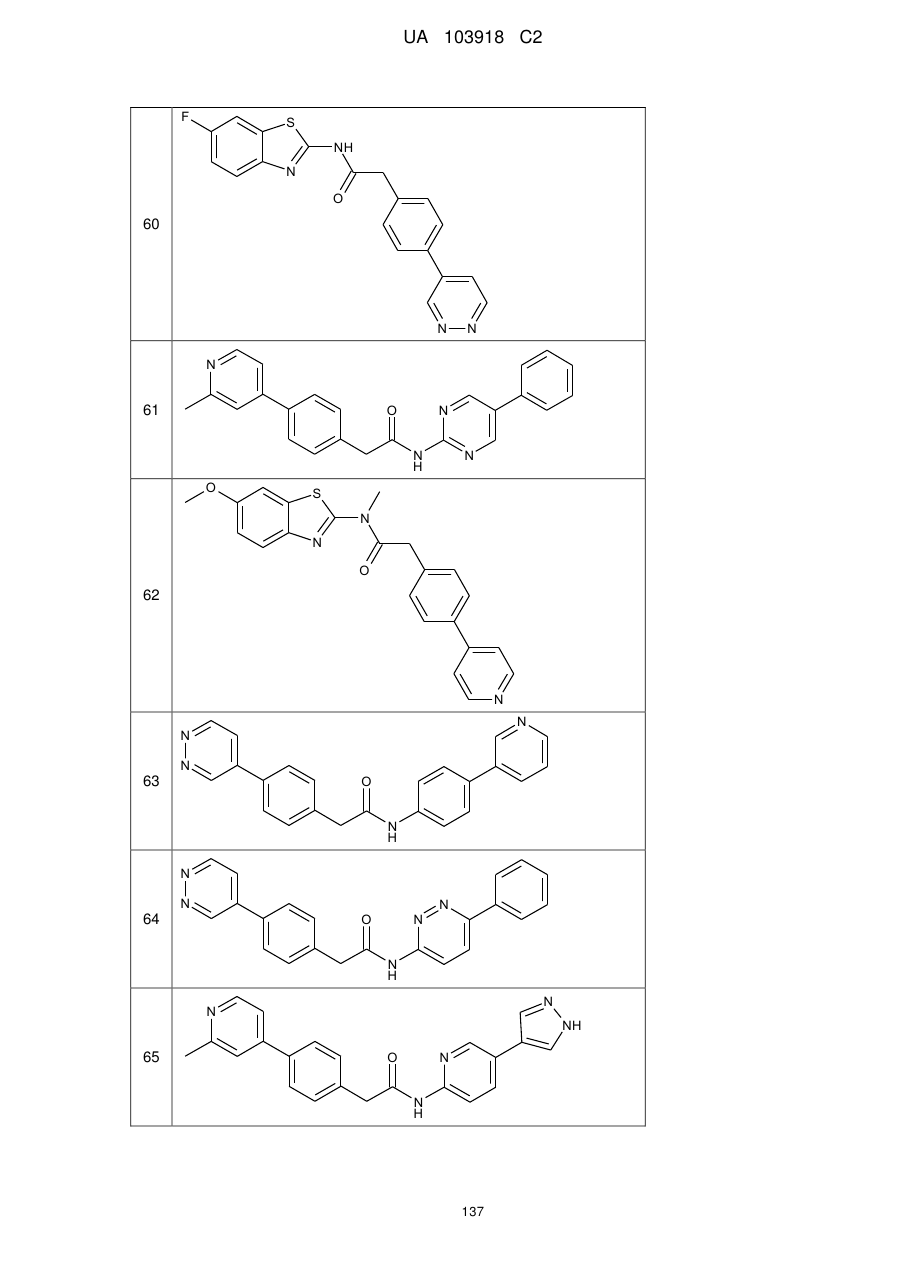
20. Сполука за будь-яким з пп. 12-19, вибрана з таких як:
2

3

4

5

6

7

8
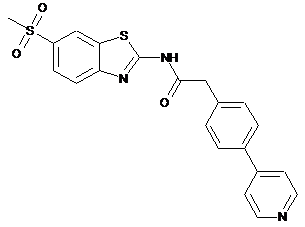
9
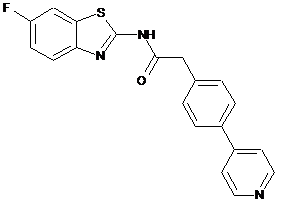
10

11
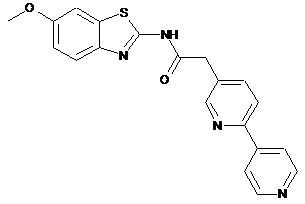
12

13
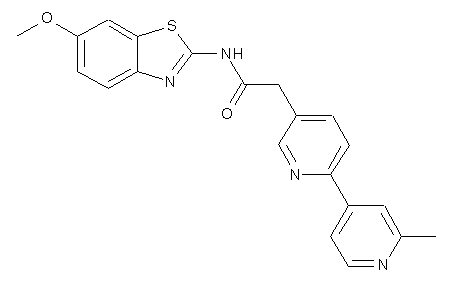
14

15
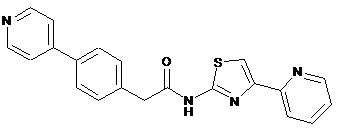
16
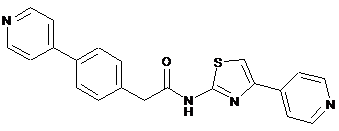
17

18
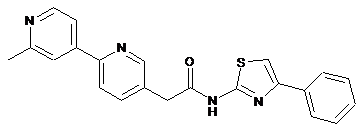
19
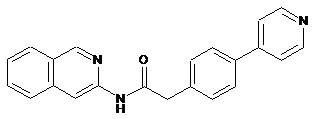
20

21

22
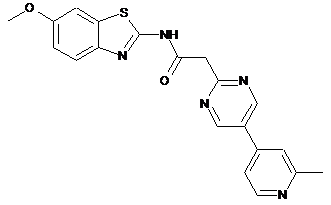
23
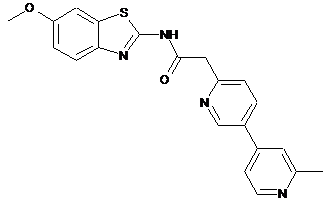
24
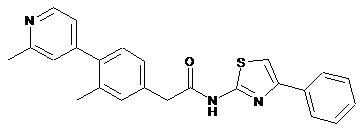
25
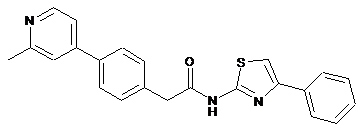
26
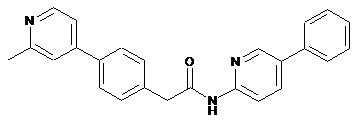
27
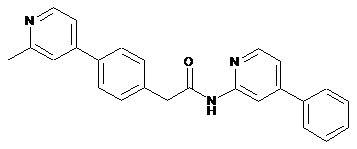
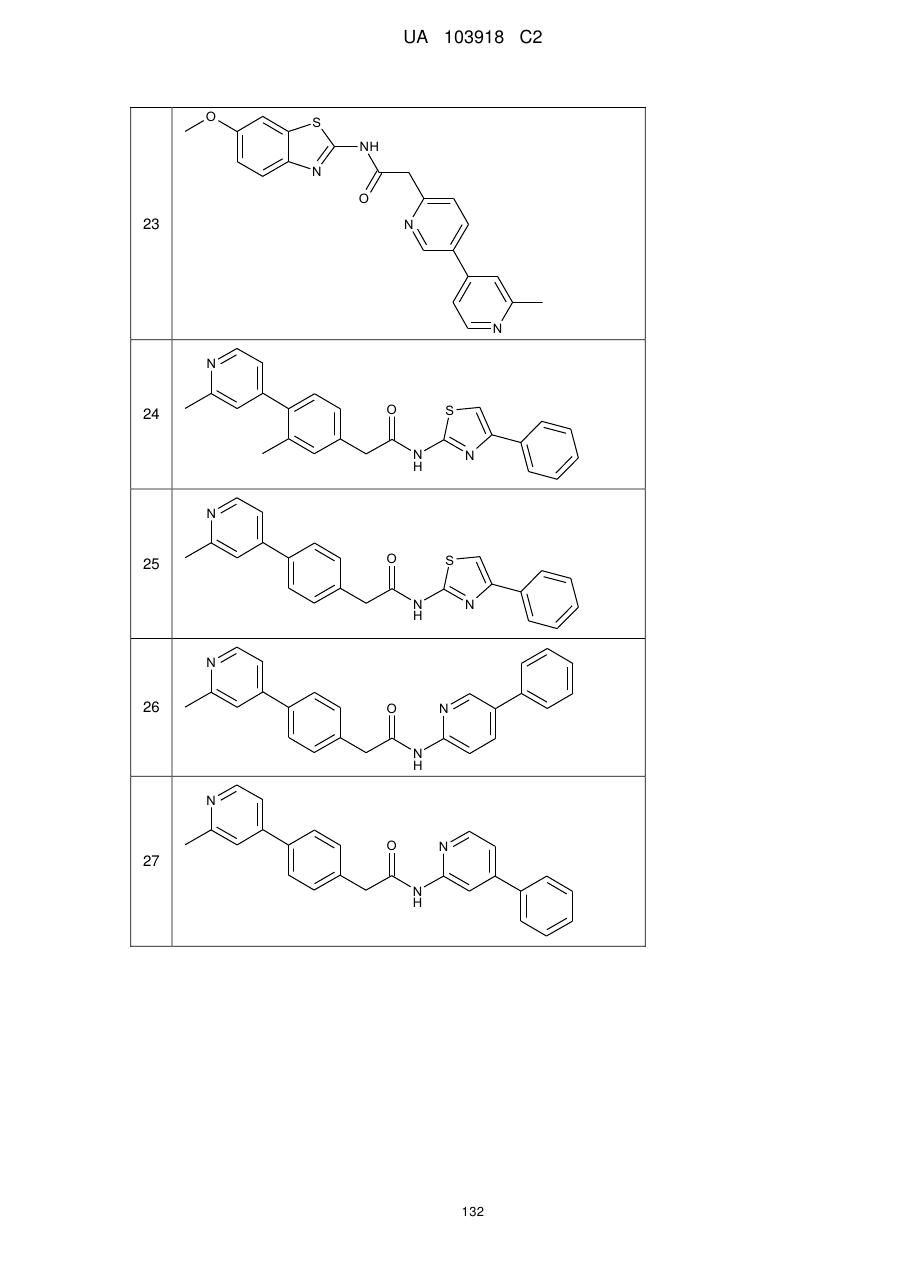
28

29
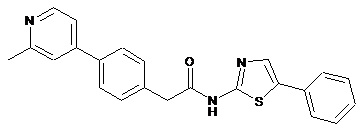
30

31

32
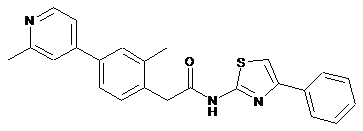
33
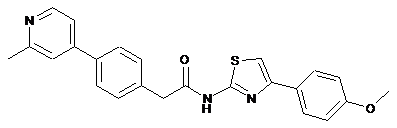
34
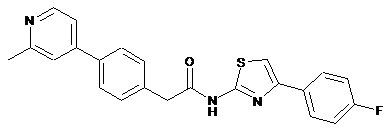
35
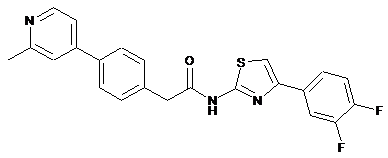
36
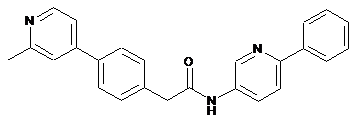
37
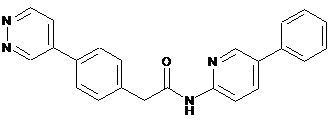
38
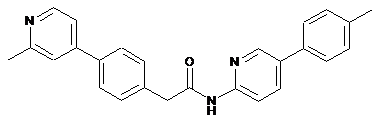
39
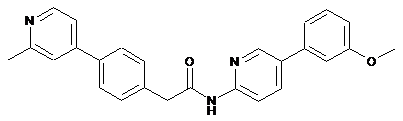
40
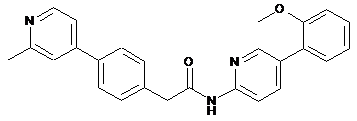
41
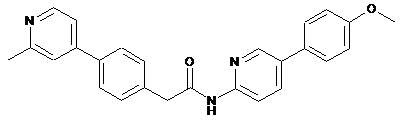
42
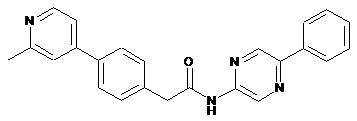
44
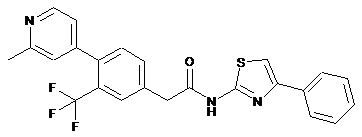
45
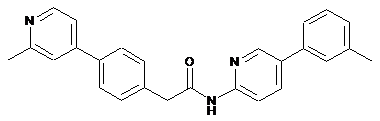
46
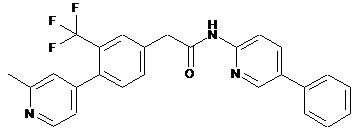
49
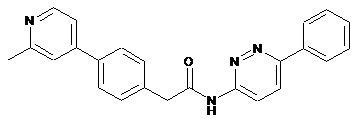
50
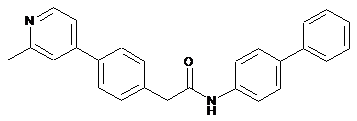
52
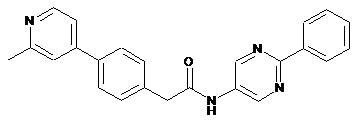
53
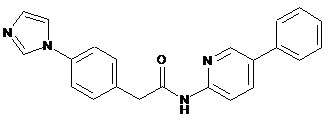
54

55

56

59

60
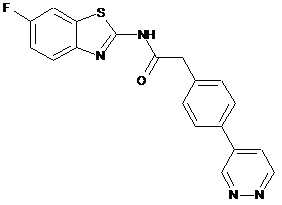
61
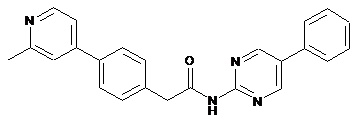
62
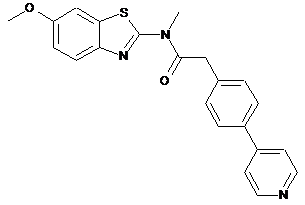
63

64
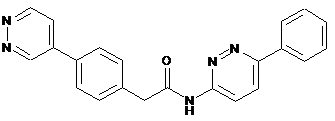
65

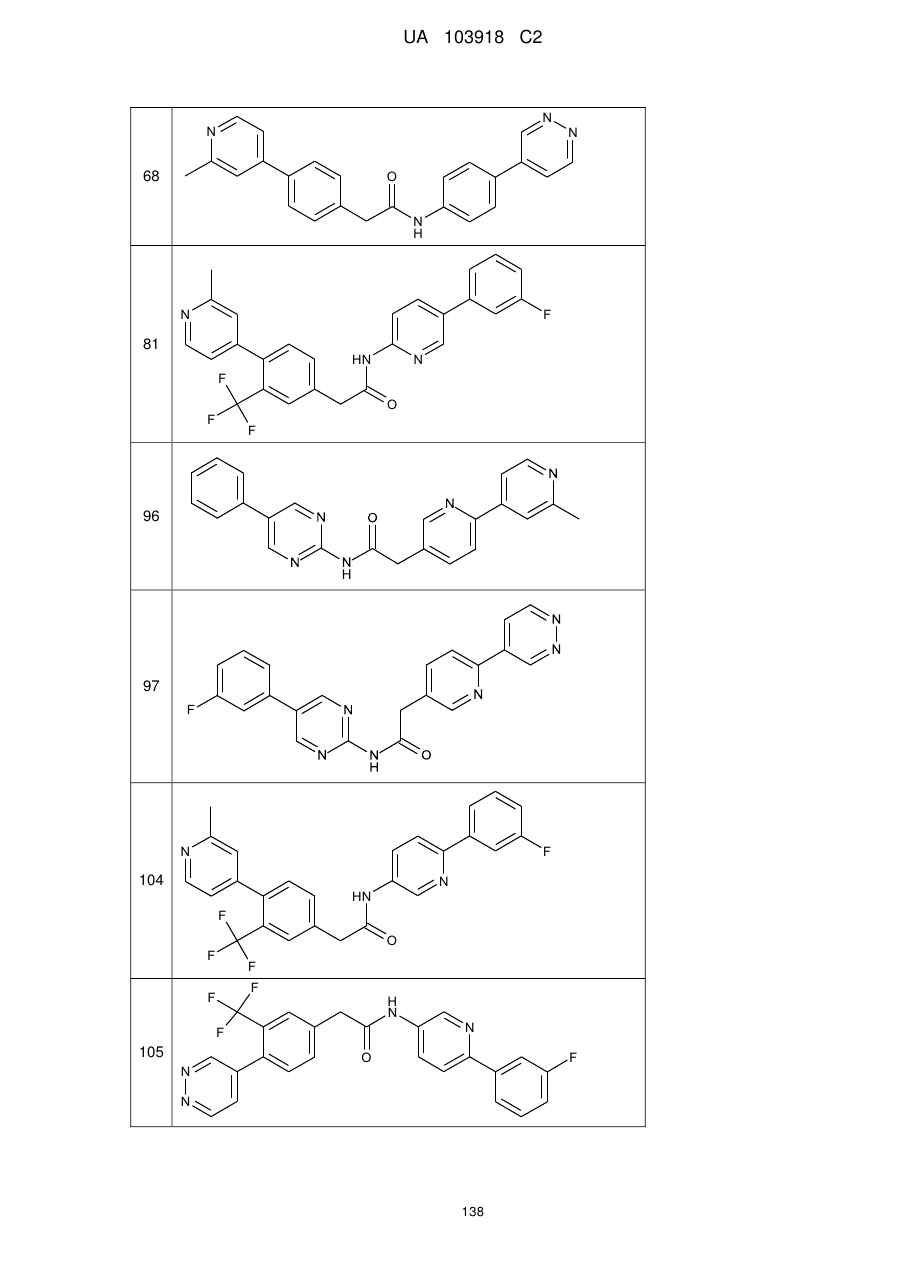
68

81
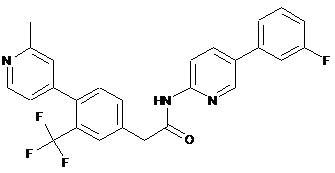
96
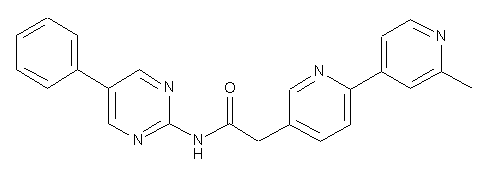
97
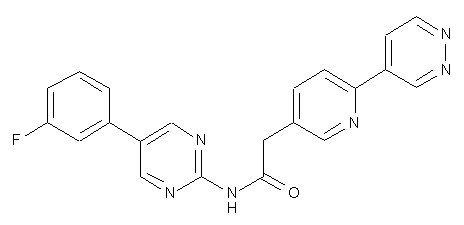
104

105
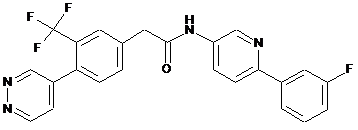
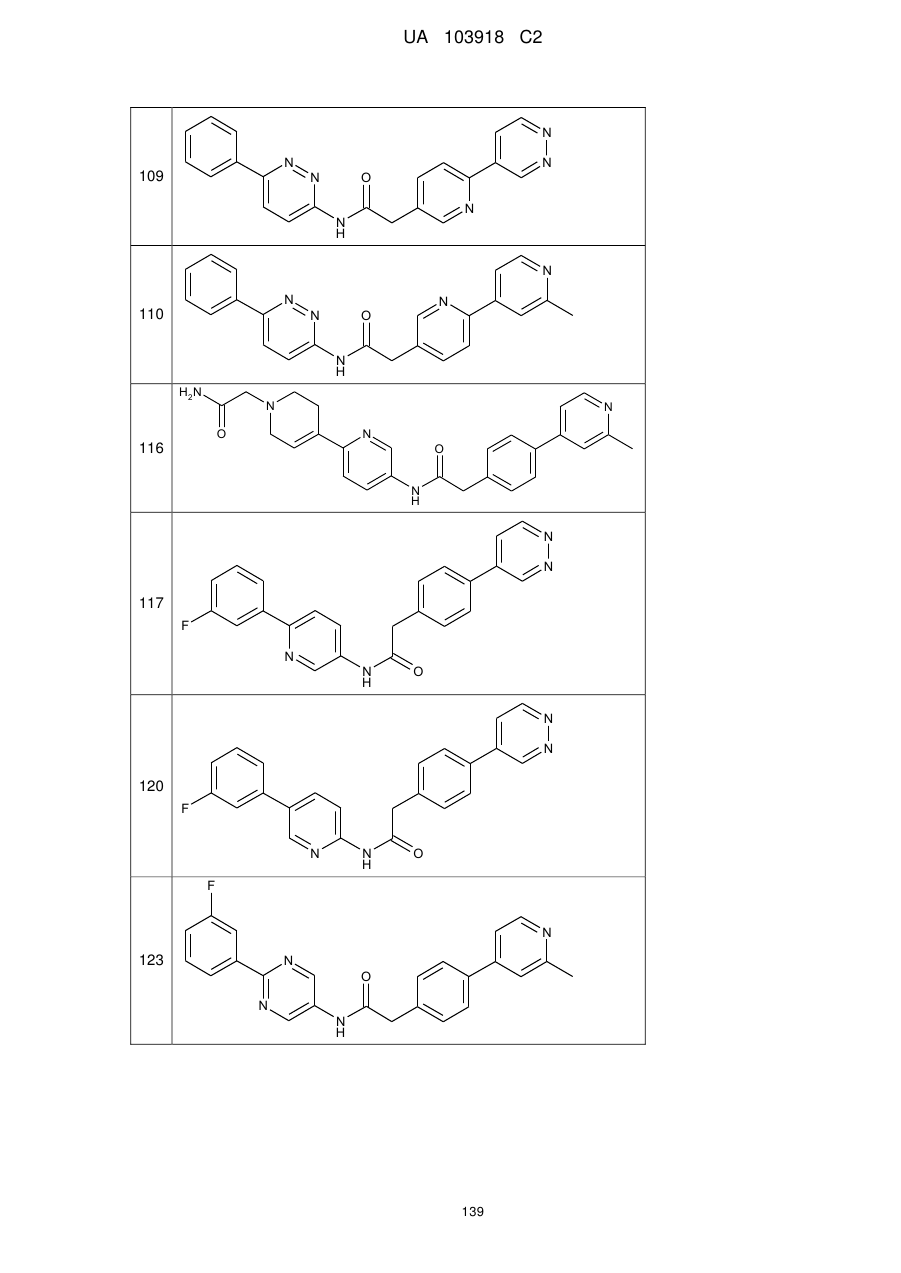
109
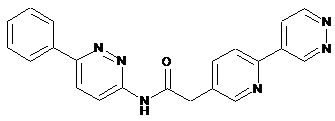
110
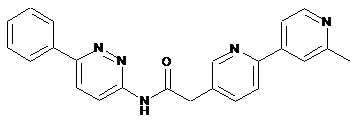
116

117

120

123

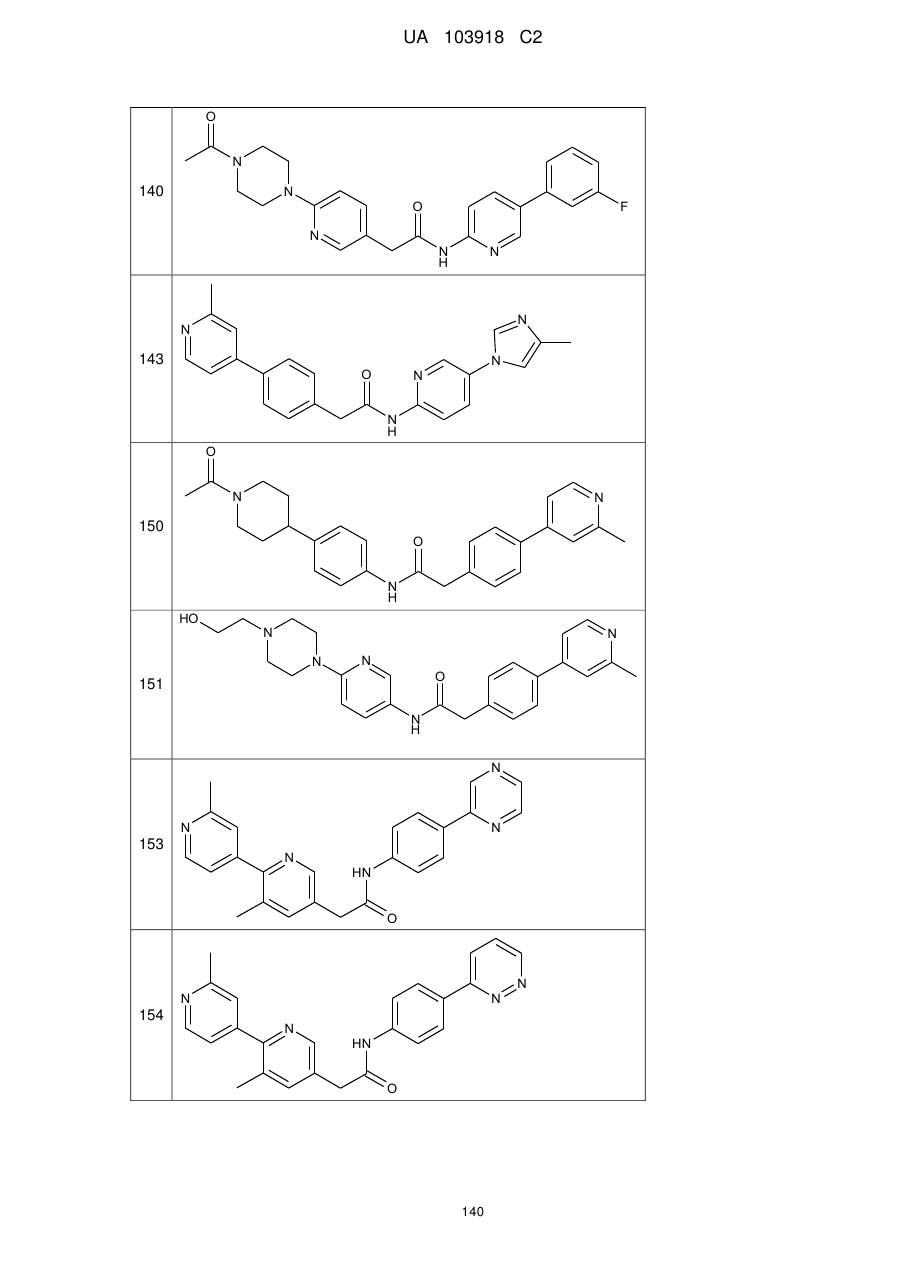
140

143

150

151
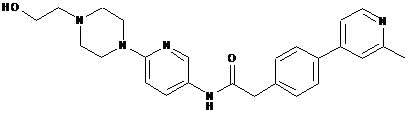
153

154

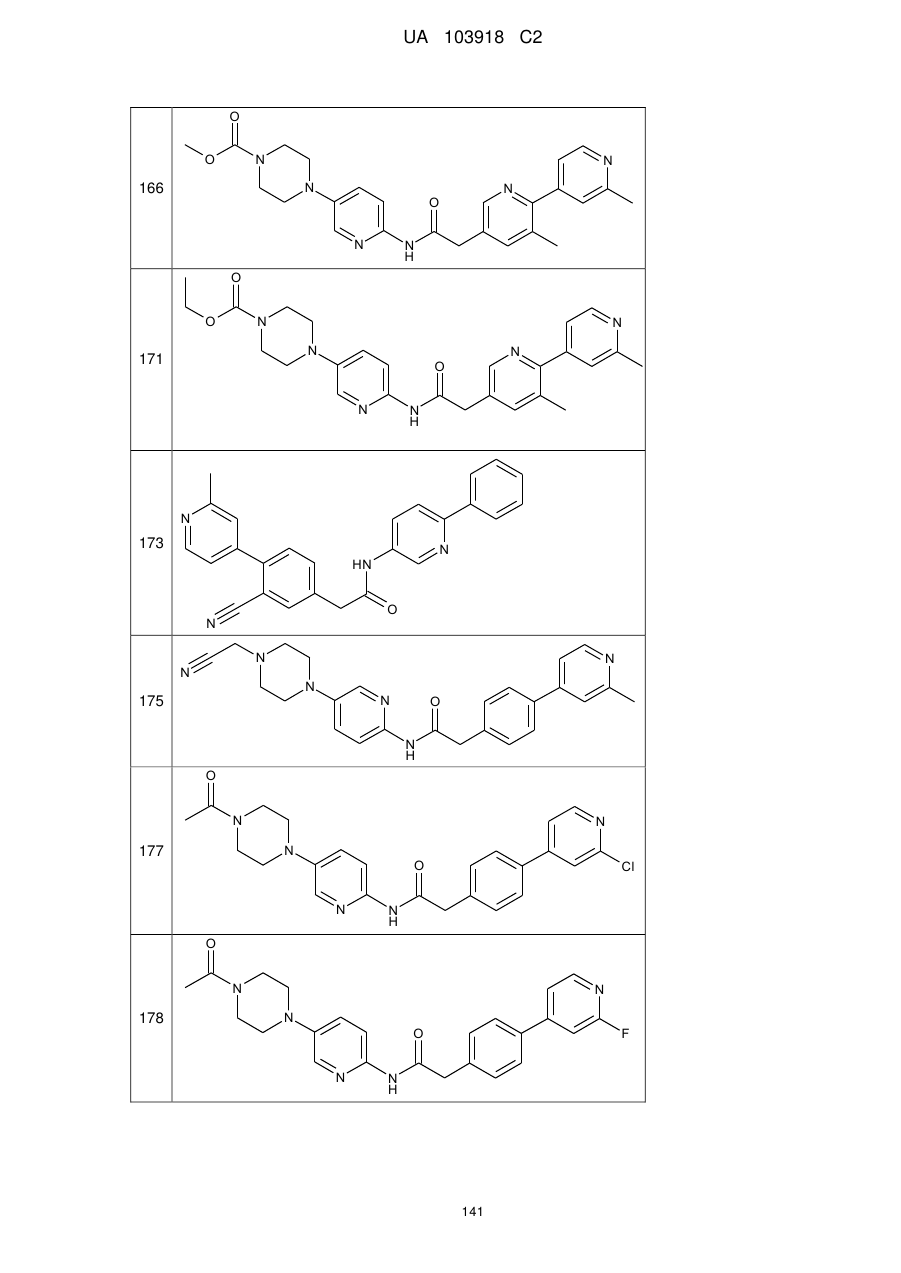
166
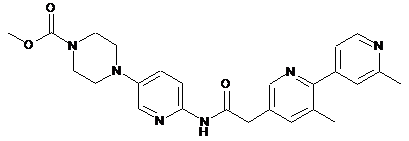
171

173

175
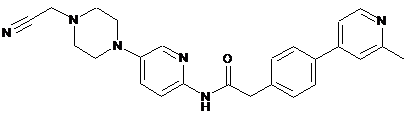
177
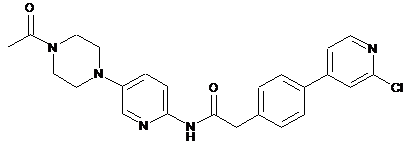
178
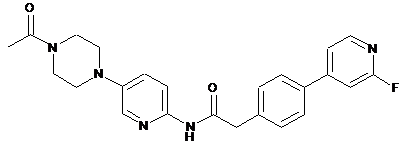
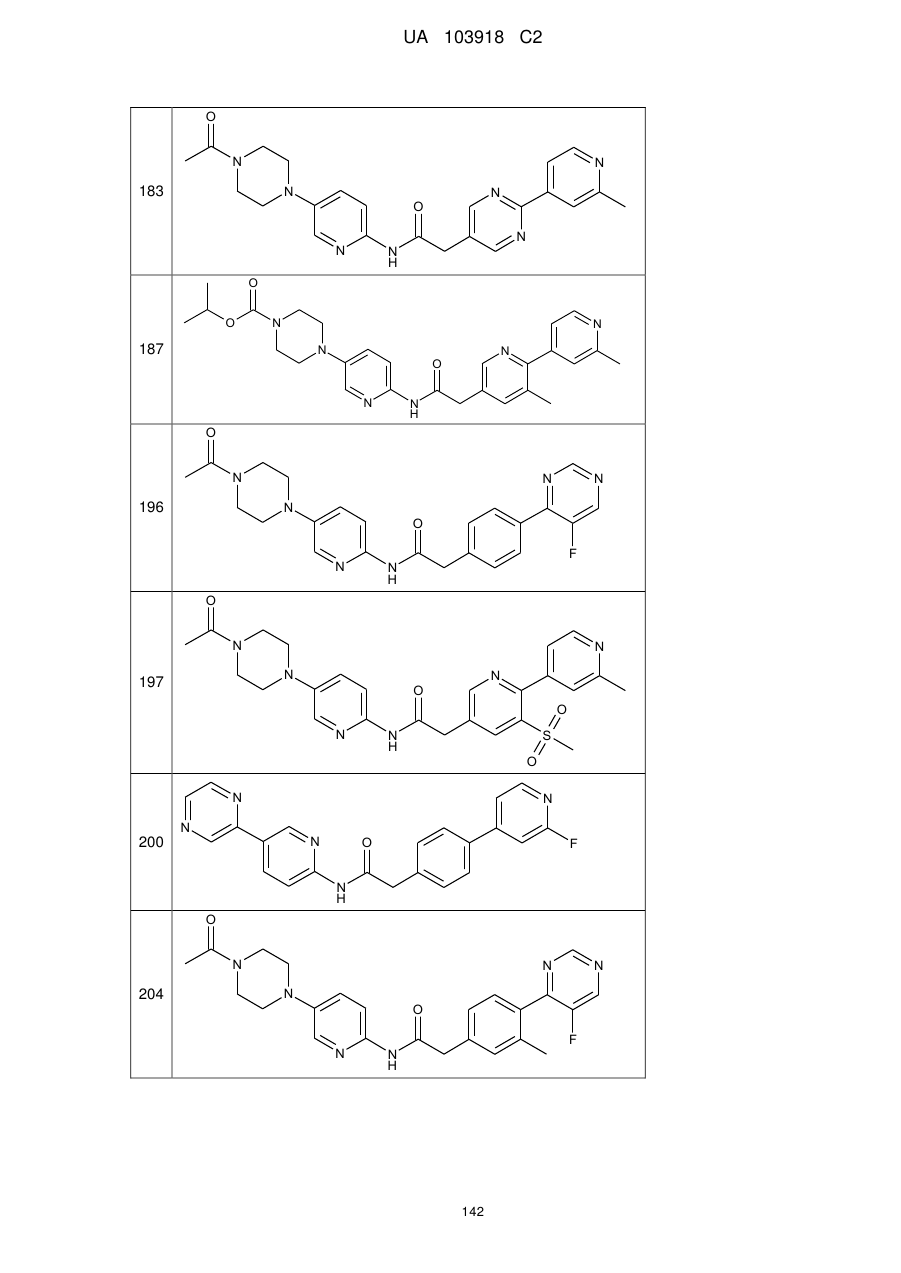
183
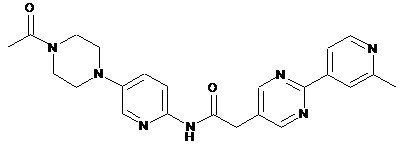
187

196

197
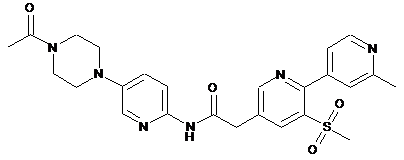
200
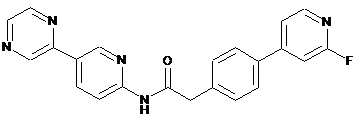
204

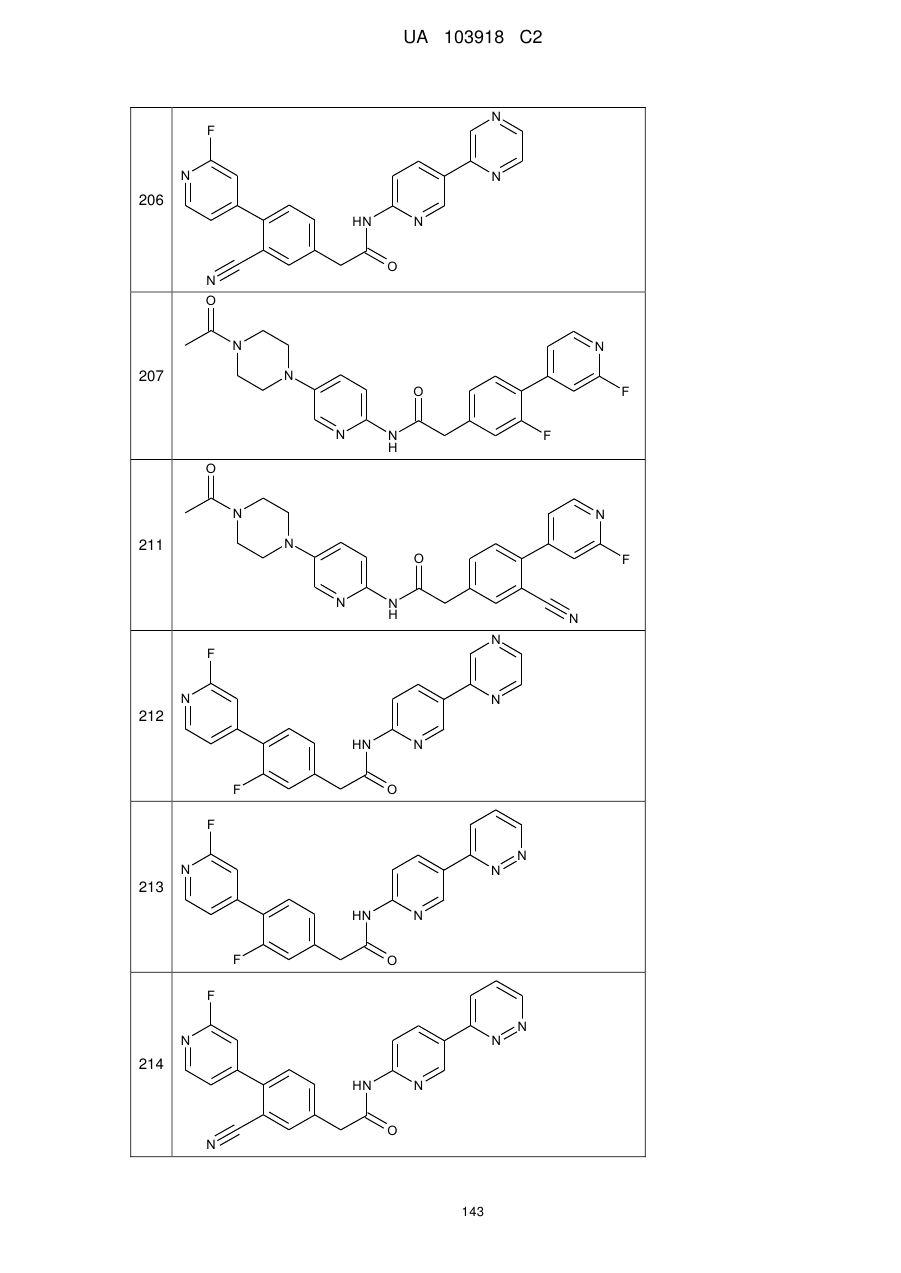
206

207
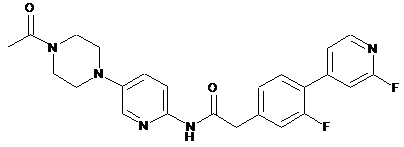
211

212

213

214

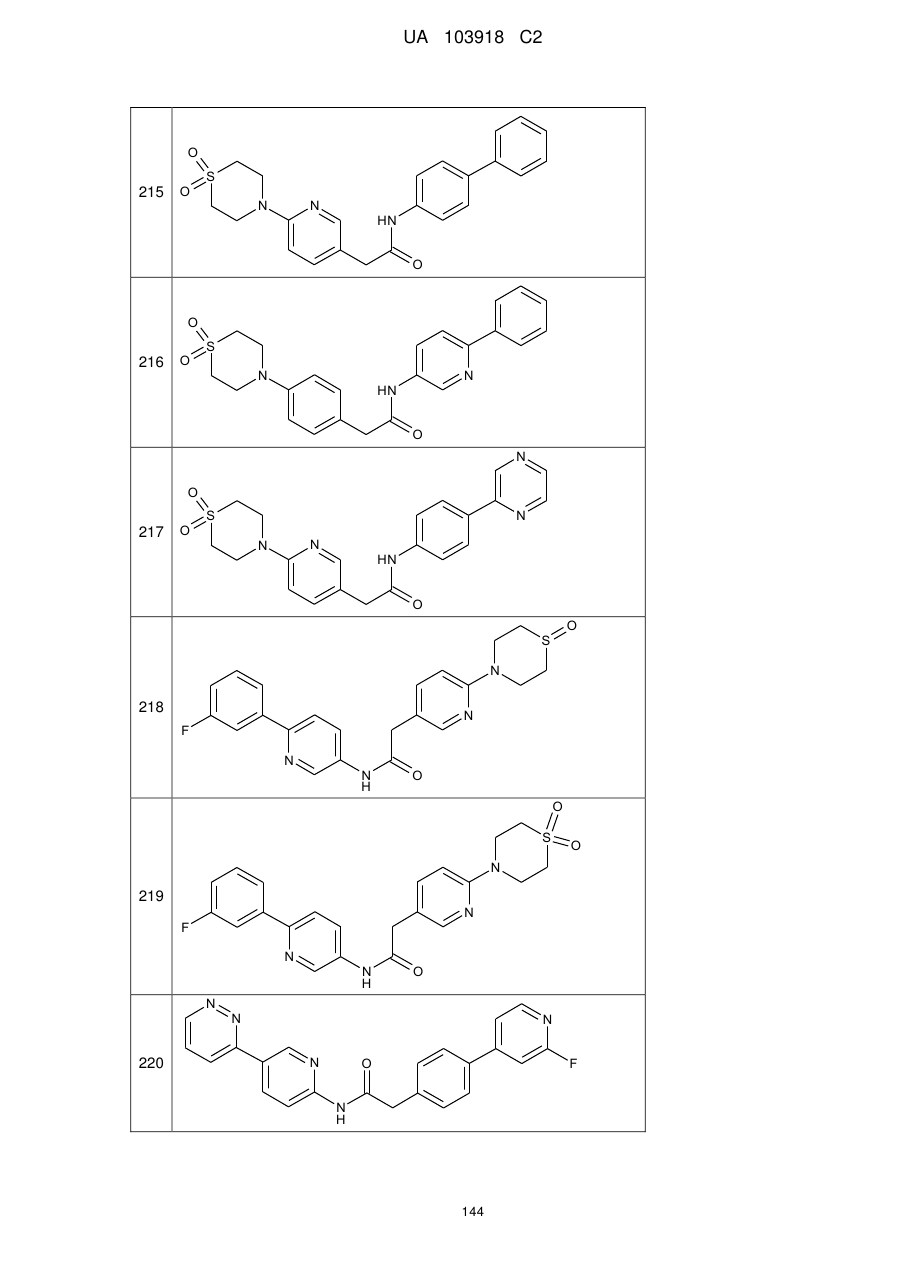
215
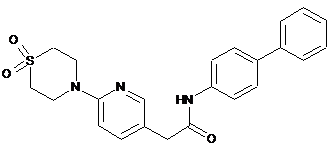
216
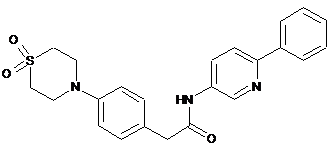
217
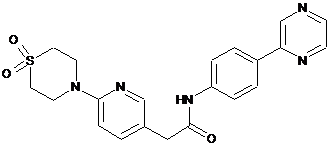
218

219

220
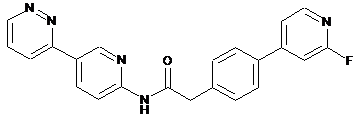
або її фізіологічно прийнятна сіль.
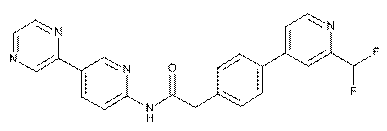
21. Сполука за п. 12, де зазначена сполука являє собою
 , або її фізіологічно прийнятна сіль.
, або її фізіологічно прийнятна сіль.
22. Сполука, вибрана з таких як: N-(6-метоксибензо[d]тіазол-2-іл)-2-(3-(піридин-4-іл)феніл)ацетамід; N-(6-фенілпіридин-3-іл)-2-(3-(піридин-4-іл)феніл)ацетамід; 2-(3-(2-метилпіридин-4-іл)феніл)-N-(6-фенілпіридин-3-іл)ацетамід; N-(6-фенілпіридин-3-іл)-2-(3-(піридазин-4-іл)феніл)ацетамід; 2-(3-(2-метоксипіридин-4-іл)феніл)-N-(6-фенілпіридин-3-іл)ацетамід; N-(5-(4-aцeтилпiпepaзин-1-іл)пipидин-2-iл)-2-(3-(2-метилпіридин-4-іл)феніл)ацетамід; 2-(3-(2-метилпіридин-4-іл)феніл)-N-(4-(піридазин-3-іл)феніл)ацетамід; 2-(3-(2-метилпіридин-4-іл)феніл)-N-(4-(піразин-2-іл)феніл)ацетамід; 2-(3-(2-метилпіридин-4-іл)феніл)-N-(6-(піразин-2-іл)піридин-3-іл)ацетамід; 2-(2'-метил-2,4'-біпіридин-6-iл)-N-(6-фенілпіридин-3-іл)ацетамід; 2-(2'-метил-2,4'-біпіридин-4-іл)-N-(6-фенілпіридин-3-іл)ацетамід; 2-(4-ціано-3-(2-метилпіридин-4-іл)феніл)-N-фенілпіридин-3-іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(4-ціано-3-(2-метилпіридин-4-іл)феніл)ацетамід; 2-(2'-метил-2,4'-біпіридин-4-іл)-N-(5-(піразин-2-іл)піридин-2-іл)ацетамід; N-(5-(4-ацетилпiперазин-1-іл)піридин-2-іл)-2-(2'-метил-2,4'-біпіридин-4-іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(2-ціано-2'-метил-3,4'-біпіридин-5-іл)ацетамід; 2-(2-(2',3-диметил-2,4'-біпіридин-5-іл)ацетамідо)-5-(піразин-2-іл)піридин 1-оксид та 2',3-диметил-5-(2-оксо-2-(5-(піразин-2-іл)піридин-2-іламіно)етил)-2,4'-біпіридин 1'-оксид; або її фармацевтично прийнятна сіль.
23. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-22 та фізіологічно прийнятний носій.
24. Спосіб інгібування Wnt сигналювання у клітині, що включає контактування клітини з ефективною кількістю сполуки за будь-яким з пп. 1-22 або її фармацевтичної композиції.
25. Спосіб інгібування гену Porcupine у клітині, що включає контактування клітини з ефективною кількістю сполуки за будь-яким з пп. 1-22 або її фармацевтичної композиції.
26. Спосіб лікування Wnt-опосередкованого розладу у ссавця, що страждає від нього, який включає введення ссавцю терапевтично ефективної кількості сполуки за будь-яким з пп. 1-22 або її фармацевтичної композиції та необов'язково у комбінації з другим терапевтичним агентом.
27. Спосіб за п. 26, у якому зазначений Wnt-опосередкований розлад являє собою келоїди, фіброз, протеїнурію, відторгнення трансплантата нирки, остеоартрит, хворобу Паркінсона, кістозний макулярний набряк, ретинопатію, макулярну дистрофію або клітинопроліферативний розлад, пов'язаний з аберантною Wnt сигнальною активністю.
28. Спосіб за п. 27, у якому зазначений розлад являє собою клітинопроліферативний розлад, вибраний з групи, що включає колоректальний рак, рак молочної залози, плоскоклітинну карциному голови та шиї, плоскоклітинну карциному стравоходу, недрібноклітинний рак легені, рак шлунка, рак підшлункової залози, лейкемію, лімфому, нейробластому, ретинобластому, саркому, остеосаркому, хондросаркому, саркому Юінга, рабдоміосаркому, пухлину мозку, пухлину Вілма, базальноклітинний рак, меланому, рак голови та шиї, рак шийки матки та рак передміхурової залози.
29. Застосування сполуки за будь-яким з пп. 1-22 або її фармацевтичної композиції для інгібування Wnt сигналювання.
30. Застосування сполуки за будь-яким з пп. 1-22 або її фармацевтичної композиції для виробництва лікарського засобу для лікування Wnt-опосередкованого розладу.
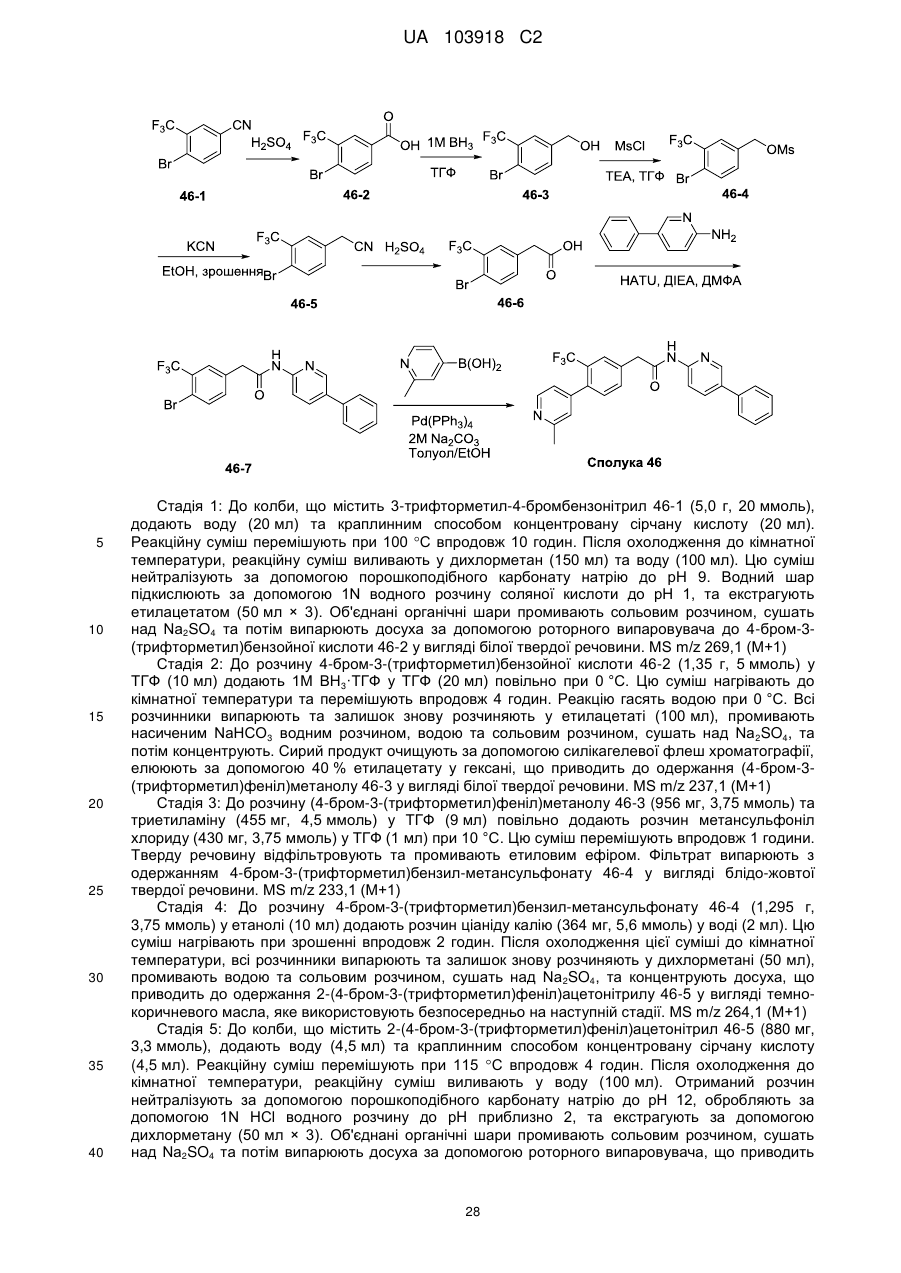
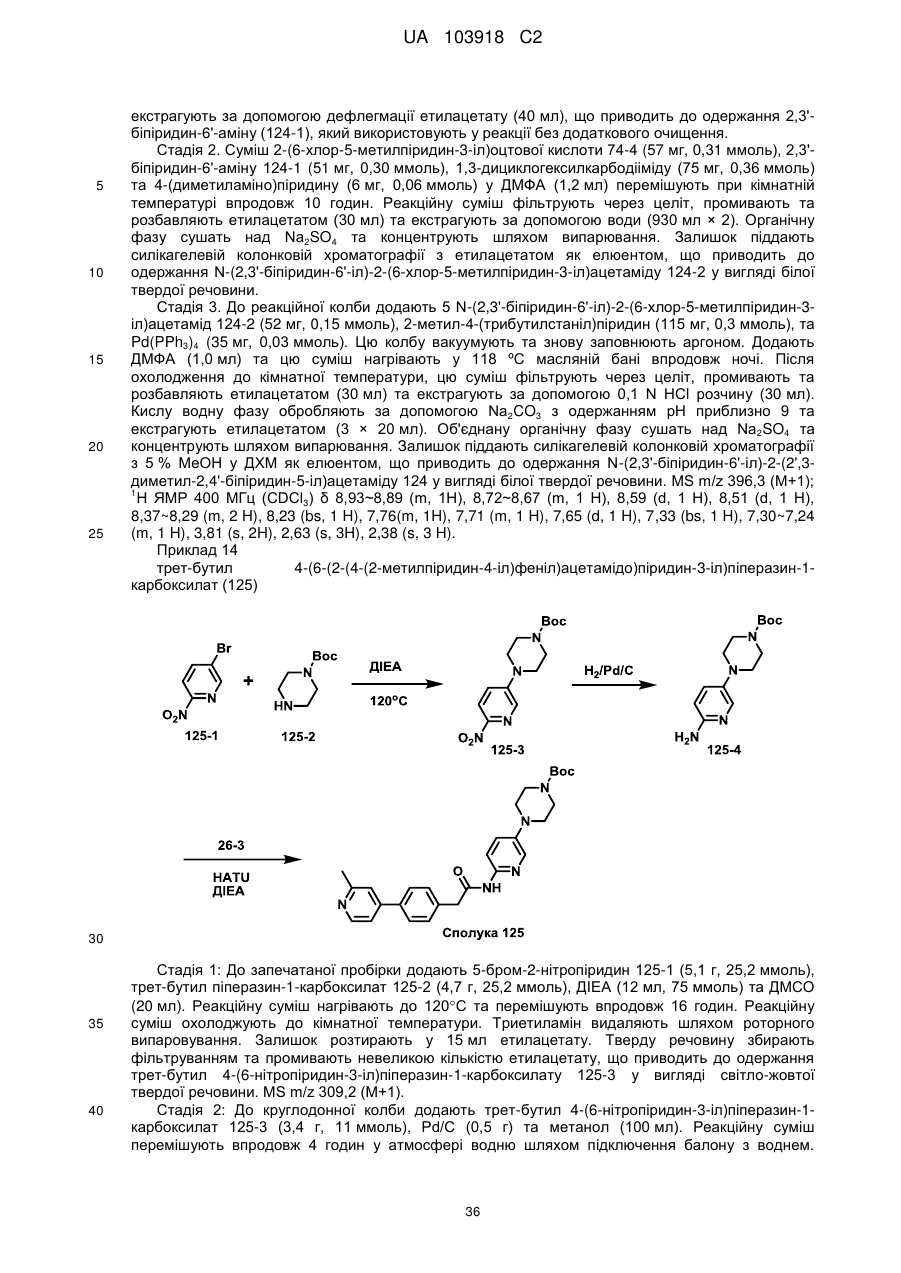
Текст
Реферат: Даний винахід стосується композицій та способів модулювання Wnt сигнального шляху. ЯК UA 103918 C2 (12) UA 103918 C2 R1 X6 X X8 R3 N 5 X Z R2 7 O X3 X1 E X4 X2 X9 N (R4)m UA 103918 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресні посилання до зв'язаних заявок Дана заявка заявляє пріоритет до Попередньої заявки США серійний номер 61/156,599, поданої 2 березня 2009 року; та Попередньої заявки США серійний номер 61/245,187, поданої 23 вересня 2009 року; кожна з яких включена у даний опис шляхом посилання у її повноті. Галузь винаходу Даний винахід відноситься до композицій та способів модулювання Wnt сигнального шляху. Передумови створення винаходу Wnt генне сімейство кодує великий клас секретованих білків, пов'язаних з Int1/Wnt1 протоонкогеном та wingless (безкрилий) дрозофіл ("Wg"), гомологом Wnt1 дрозофіли (Cadigan et al. (1997) Genes & Development 11:3286-3305). Wnt експресуються у різних тканинах та органах та відіграють головну роль у багатьох процесах розвитку, включаючи сегментацію у дрозофілі; розвиток ендодерми у C. elegans; та появу полярності кінцівок, диференціацію нервового гребня, морфогенез нирки, визначення статі, та розвинення мозку у ссавців (Parr, et al. (1994) Curr. Opinion Genetics & Devel. 4:523-528). Wnt шлях являє собою основний регулятор у розвитку тварини, як у процесі ембріогенезу, так і у зрілому організмі (Eastman, et al. (1999) Curr Opin Cell Biol 11: 233-240; Peifer, et al. (2000) Science 287: 1606-1609). Wnt сигнали перетворюються Frizzled ("Fz") сімейством семи рецепторів трансмембранних доменів (Bhanot et al. (1996) Nature 382:225-230). Wnt ліганди зв'язуються з Fzd, та тим самим, активують цитоплазматичний білок Dishevelled (Dvl-1, 2 та 3 у людей та мишей) (Boutros, et al. (1999) Mech Dev 83: 27-37) та фосфорилюють LRP5/6. Таким чином створюється сигнал, який запобігає фосфорилюванню та розкладанню Armadillo/β(бета)-катеніну, що у свою чергу веде до стабілізації β-катеніну (Perrimon (1994) Cell 76:781-784). Ця стабілізація викликається асоціацією Dvl з axin (Zeng et al. (1997) Cell 90:181-192), підтримуючий білок, який складає різні білки разом, включаючи GSK3, APC, CK1, та β-катенін, з утворенням β-катенін-деструкційного комплексу. Шлях рецептору білку Frizzled Wingless-типу (Wnt) включає важливі регуляторні гени, як несуть поліморфізми, пов'язані з первинними карциномами. У процесі нижнього сигналювання, цитозольний β-катенін накопичується, переміщується у ядро, та потім посилює генну експресію шляхом комплексування з іншими транскрипційними факторами Uthoff et al., Mol Carcinog, 31:56-62 (2001). За відсутності Wnt сигналів, вільний цитозольний β-катенін включається у комплекс, що складається з Axin, генного продукту аденоматозного поліпозу товстої кишки (APC), та глікоген-синтаза-кінази (GSK)-3β. Кон'югаційне фосфорилювання Axin, APC, та βкатеніну за допомогою GSK-3β позначає β-катенін для убіквітинового шляху та розкладання за допомогою протеасом Uthoff et al., Mol Carcinog, 31:56-62 (2001); Matsuzawa et al., Mol Cell, 7:915-926 (2001). Disheveled (Dvl) являє собою позитивний медіатор Wnt сигналювання, розташований нижче frizzled рецепторів та вище β-катеніну. GSK-3 фосфорилює декілька білків у Wnt шляху та є ефективним у знижуючому регулюванні β-катеніну. Мутації у гені APC являють собою ініціюючий фактор як для спорадичного, так і для спадкового колоректального онкогенезу. APC мутанти є релевантними у онкогенезі, так як аберантний білок являє собою невід'ємну частину Wnt-сигнального каскаду. Білковий продукт містить декілька функціональних доменів, що діють як сайти зв'язування та розкладання для β-катеніну. Мутації, які відбуваються у аміно-кінцевому сегменті β-катеніну, зазвичай залучаються у залежне від фосфорилювання, убіквітинопосередковане розкладання й, таким чином, стабілізують β-катенін. Коли стабілізований цитоплазматичним катенін накопичується, він переноситься у ядро, взаємодіючи з Tcf/Lef групою транскрипційних факторів високої рухливості, що модулює експресію онкогенів, таких як c-myc. Відомо, що Wnt/β-катенінове сигналювання покращує виживання клітин у різних типів клітин Orford et al., J Cell Biol, 146:855-868 (1999); Cox et al., Genetics, 155:1725-1740 (2000); Reya et al., Immunity, 13:15-24 (2000); Satoh et al., Nat Genet, 24:245-250 (2000); Shin et al., Journal of Biological Chemistry, 274:2780-2785 (1999); Chen et al., J Cell Biol, 152:87-96 (2001); Ioannidis et al., Nat Immunol, 2:691-697 (2001). Також вважається, що Wnt сигнальний шлях пов'язаний з розвиненням та/або прогресуванням пухлини (Polakis et al., Genes Dev, 14:1837-1851 (2000); Cox et al., Genetics, 155:1725-1740 (2000); Bienz et al., Cell, 103:311-320 (2000); You et al., J Cell Biol, 157:429-440 (2002)). Аберантна активація Wnt сигнального шляху пов'язана з множиною раків людини, корелюючись з надекспресуванням або ампліфікацією c-Myc (Polakis et al., Genes Dev, 14:1837-1851 (2000); Bienz et al., Cell, 103:311-320 (2000); Brown et al., Breast Cancer Res, 3:351-355 (2001); He et al., Science, 281:1509-1512 (1998); Miller et al., Oncogene, 18:7860-7872 (1999). Крім того, c-Myc ідентифікований як одна з транскрипційних цілей β-катенін/Tcf у колоректальних ракових клітинах (He et al., Science, 281:1509-1512 (1998); de La Coste et al., 1 UA 103918 C2 5 Proc Natl Acad Sci USA, 95:8847-8851 (1998); Miller et al., Oncogene, 18:7860-7872 (1999); You et al., J Cell Biol, 157:429-440 (2002)). Таким чином, існує необхідність у агентах та способах модулювання Wnt сигнального шляху, таким чином лікуючи, діагностуючи, попереджаючи та/або полегшуючи розлади, пов'язані з Wnt сигналюванням. Розкриття винаходу Даний винахід відноситься до композицій та способів модулювання Wnt сигнального шляху. У одному аспекті, даний винахід забезпечує сполуку, що має Формулу (1) або (2): Z Y R1 R2 R3 N O 10 X3 1 X X2 B E X4 R1 R2 N O A1 (1) R3 X3 X1 X2 E X4 A2 (2) або її фізіологічно прийнятну сіль, у якій: кільце E являє собою необов'язково заміщений арил або гетероарил; 1 2 A та A незалежно являють собою C1-5гетероцикл, хінолініл, або гетероарил, вибраний з: 15 1 20 25 30 35 40 45 2 де будь-який гетероцикл радикалу A та A може бути необов'язково заміщений за 10 допомогою –LC(O)R ; де атом азоту може бути необов'язково окислений (дивись, наприклад, сполуку 156 таблиці 1). B являє собою бензотіазоліл, хінолініл або ізoхінолініл, кожен з яких необов'язково 6 заміщений за допомогою 1-3 R груп; 1 2 3 4 7 X , X , X та X незалежно являють собою CR або N; Y являє собою феніл або 5-6 членний гетероарил, що містить 1-2 гетероатоми, вибрані з N, O та S; Z являє собою арил, C1-5 гетероцикл, або 5-6 членний гетероарил, що містить 1-2 гетероатоми, вибрані з N, O та S; 6 кожен Y та Z необов'язково заміщений за допомогою 1-3 R груп; 1 5 R та R незалежно являють собою H або C1-6 алкіл; 2 3 R та R незалежно являють собою H, C1-6 алкіл або гало групу; 4 R являє собою гало групу, ціано групу, C1-6алкокси групу, або C1-6 алкіл, необов'язково заміщений за допомогою гало групи, алкокси групи або аміно групи; 6 10 10 10 R являє собою водень, гало групу, C1-6алкокси групу, –S(O)2R , –C(O)OR , –C(O)R , – 8 9 C(O)NR R , C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл, кожен з яких може бути необов'язково заміщений за допомогою гало групи, аміно групи, гідроксилу, алкокси групи або ціано групи; 8 9 10 10 8 9 10 10 гало групу, CN, -L-W, NR R , -L-C(O)R , -L-C(O)OR , -L-C(O)NR R , OR ; -L-S(O)2R або –L8 9 S(O)2NR R ; 7 10 R являє собою H, гало групу, C1-6 алкокси групу, -L-S(O)2R , ціано групу, C1-6 алкокси групу, C1-6 алкіл, необов'язково заміщений за допомогою гало групи, аміно групи, гідроксилу, алкокси 8 9 10 8 9 10 10 8 9 групи або ціано групи; NR R , -L-C(O)R , -L-C(O)NR R , OR ; -L-S(O)2R або –L-S(O)2NR R ; 8 9 R та R незалежно являють собою H, -L-W, або C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл, кожен з яких може бути необов'язково заміщений за допомогою гало групи, аміно групи, гідроксилу, 8 9 алкокси групи або ціано групи; або R та R разом з атомами, до яких вони приєднані, можуть утворювати кільце; 2 UA 103918 C2 10 5 10 R являє собою H, -L-W, або C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл, кожен з яких може бути необов'язково заміщений за допомогою гало групи, аміно групи, гідроксилу, алкокси групи або ціано групи; L являє собою зв'язок або (CR2)1-4, де R являє собою H або C1-6 алкіл; W являє собою C3-7циклоалкіл, C1-5гетероцикл, арил або гетероарил; m являє собою 0-4; n являє собою 0-3; та p являє собою 0-2; та її сольвати, гідрати, nоксидну похідну або проліки. У представленій вище Формулі (1), Y являє собою феніл, тіазоліл, піридиніл, піридазиніл, 6 піримідиніл або піразиніл, кожен з яких необов'язково заміщений за допомогою 1-2 R груп. У інших прикладах, Z являє собою феніл, піридил, піридазин, піримідин, піразин, піперазиніл, піперидиніл, морфолініл, піразол або 1,2,3,6-тетрагідропіридин, кожен з яких необов'язково 6 заміщений за допомогою 1-2 R груп. У одному варіанті втілення, винахід забезпечує сполуку Формули (3): R 1 R 2 R3 N S R6 X3 O N 15 1 2 3 1 2 3 4 2 X1 X2 E X4 A2 (3) 6 у якій R , R , R , X , X , X , X , A та R приймають значення, представлені вище. У іншому варіанті втілення, винахід забезпечує сполуку Формули (4): R1 R2 N S R3 X3 O N Z 20 1 2 3 1 2 3 4 X1 X2 E X4 A1 (4) 1 у якій R , R , R , X , X , X , X , A та Z приймають значення, представлені вище. 1 2 У будь-якій з описаних вище Формул (1), (2), (3) або (4), A та A незалежно являють собою N S(O)0-2 морфолініл, піперазиніл, хінолініл, , або гетероарил, вибраний з групи: 25 1 30 2 де будь-який гетероцикл радикалу A та A може бути необов'язково заміщений за 4 допомогою –C(O)CH3; де R та n приймають значення, представлені вище. У деяких прикладах, кільце E у будь-якій з описаних вище Формул (1), (2), (3) або (4) являє 7 собою феніл, піридил або піримідиніл, кожен з яких необов'язково заміщений за допомогою R , 7 7 де R приймає значення, представлені вище. У певних прикладах, R може являти собою H, гало групу, ціано групу або необов'язково галогенований C1-6 алкіл. У ще одному іншому варіанті втілення, винахід забезпечує сполуку Формули (5): 35 3 UA 103918 C2 R1 R2 N 6 X5 Z X X8 R3 X3 O X7 X1 E X4 X2 A1 (5) N S(O)0-2 1 у якій A являє собою піперазиніл, заміщений за допомогою –C(O)CH3, або вибраний з: 5 1 2 3 4 кільце E являє собою феніл або один з X , X , X та X являє собою N та інші являють собою CR ; 5 6 7 8 11 один з X , X , X та X являє собою N та інші являють собою CR ; Z являє собою 6-членний гетероцикл або 6-членний гетероарил, кожен з яких містить 1-2 6 азотні гетероатоми та кожен з яких необов'язково заміщений за допомогою 1-2 R груп; 1 2 3 R , R та R являють собою H або C1-6 алкіл; 4 6 10 R та R незалежно являють собою водень, ціано групу, C1-6алкокси групу, –S(O)2R , – 8 9 10 10 C(O)NR R , -L-C(O)R , -L-C(O)OR , C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл; 10 R являє собою C1-6 алкіл або -L-W; L являє собою зв'язок або (CR2)1-4, де R являє собою H або C1-6 алкіл; W являє собою C3-7циклоалкіл; 7 11 10 R та R незалежно являють собою H, гало групу, ціано групу, C1-6алкокси групу, -S(O)2R , або необов'язково галогенований C1-6 алкіл; та m та n незалежно являють собою 0-1. 1 У іншому варіанті втілення, з посиланням на Формулу (5), A являє собою піперазиніл, 7 10 15 20 N S(O)0-2 заміщений за допомогою –C(O)CH3, 25 або вибраний з: 1 2 3 4 кільце E являє собою феніл або один з X , X , X та X являє собою N та інші являють собою CR ; 7 4 UA 103918 C2 5 5 10 6 7 8 11 один з X , X , X та X являє собою N та інші являють собою CR ; Z являє собою 6-членний гетероцикл або 6-членний гетероарил, кожен з яких містить 1-2 азотні гетероатоми та кожен з 6 1 2 3 яких необов'язково заміщений за допомогою 1-2 R груп; R , R та R являють собою H або C1-6 4 6 10 алкіл; R та R незалежно являють собою водень, ціано групу, C1-6алкокси групу, –S(O)2R , – 8 9 10 10 C(O)NR R , -L-C(O)R , -L-C(O)OR , C1-6 алкіл, необов'язково заміщений за допомогою гало 10 групи, C2-6 алкеніл або C2-6 алкініл; R являє собою C1-6 алкіл або -L-W; L являє собою зв'язок 7 11 або (CR2)1-4, де R являє собою H або C 1-6 алкіл; W являє собою C3-7циклоалкіл; R та R 10 незалежно являють собою H, гало групу, ціано групу, C 1-6алкокси групу, -S(O)2R , або необов'язково галогенований C1-6 алкіл; та m та n незалежно являють собою 0-2. 10 У деяких прикладах, R у Формулі (5) являє собою C1-6 алкіл. У інших прикладах, Z у Формулі (5) являє собою 6-членний гетероарил, що містить 2 азотні гетероатоми, або 6-членний 1 2 3 C4 гетероцикл, що містить 2 азотні гетероатоми. У ще одних інших прикладах, один з X , X , X 4 7 та X являє собою N та інші являють собою CR . У ще одному іншому варіанті втілення, винахід забезпечує сполуку Формули (6): 15 R1 X6 X R2 R3 N 5 X7 O X3 X8 Z X1 E X2 X4 X9 (R4)m N 1 20 25 30 35 40 45 50 2 3 4 5 6 7 (6) 8 де X , X , X та X вибирають з N та CR7; один з X , X , X та X являє собою N та інші 9 являють собою CH; X вибирають з N та CH; Z вибирають з таких як: феніл, піразиніл, піридиніл та піперазиніл; де кожен феніл, піразиніл, піридиніл або піперазиніл радикалу Z необов'язково 6 1 2 3 4 заміщений за допомогою R групи; R , R та R являють собою водень; m являє собою 1; R 6 вибирають з таких як: водень, гало група, дифторметил, трифторметил та метил; R вибирають 10 10 7 з таких як: водень, гало група та -C(O)R ; де R являє собою метил; та R вибирають з таких як: водень, гало група, ціано група, метил та трифторметил. 1 2 3 У будь-якій з описаних вище Формул (1), (2), (3), (4), (5) або (6), R , R та R може являти 4 6 собою H. У інших прикладах, R та R незалежно вибирають з таких як: водень, гало група, трифторметил, метил та -C(O)CH3. Приклади сполук даного винаходу включають, не обмежуючись наведеними: трет-бутил 4(5-{2-[4-(2-метилпіридин-4-іл)феніл]ацетамідо}піридин-2-іл)-1,2,3,6-тетрагідропіридин-1карбоксилат; N-[6-(3-фторфеніл)піридин-3-іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; N-(6метокси-1,3-бензотіазол-2-іл)-2-[4-(піридин-4-іл)феніл]ацетамід; N-(6-метокси-1,3-бензотіазол-2іл)-2-[6-(морфолін-4-іл)піридин-3-іл]ацетамід; N-(6-метокси-1,3-бензотіазол-2-іл)-2-[4-(хінолін-4іл)феніл]ацетамід; N-(6-метокси-1,3-бензотіазол-2-іл)-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; N-(6-метокси-1,3-бензотіазол-2-іл)-2-[6-(хінолін-4-іл)піридин-3-іл]ацетамід; N-(6-метансульфоніл1,3-бензотіазол-2-іл)-2-[4-(піридин-4-іл)феніл]ацетамід; N-(6-фтор-1,3-бензотіазол-2-іл)-2-[4(піридин-4-іл)феніл]ацетамід; N-(1,3-бензотіазол-2-іл)-2-[4-(піридин-4-іл)феніл]ацетамід; N-(6метокси-1,3-бензотіазол-2-іл)-2-[6-(піридин-4-іл)піридин-3-іл]ацетамід; N-(6-метокси-1,3бензотіазол-2-іл)-2-[3-метил-4-(2-метилпіридин-4-іл)феніл]ацетамід; N-(6-метокси-1,3бензотіазол-2-іл)-2-[6-(2-метилпіридин-4-іл)піридин-3-іл]ацетамід; N-(6-метокси-1,3-бензотіазол2-іл)-2-[4-(2-метилпіримідин-4-іл)феніл]ацетамід; N-[4-(піридин-2-іл)-1,3-тіазол-2-іл]-2-[4(піридин-4-іл)феніл]ацетамід; N-[4-(піридин-4-іл)-1,3-тіазол-2-іл]-2-[4-(піридин-4іл)феніл]ацетамід; N-(6-метокси-1,3-бензотіазол-2-іл)-2-[2-метил-4-(2-метилпіридин-4іл)феніл]ацетамід; 2-[6-(2-метилпіридин-4-іл)піридин-3-іл]-N-(4-феніл-1,3-тіазол-2-іл)ацетамід; N-(ізохінолін-3-іл)-2-[4-(піридин-4-іл)феніл]ацетамід; N-(6-фтор-1,3-бензотіазол-2-іл)-2-[6-(2метилпіридин-4-іл)піридин-3-іл]ацетамід; 2-[4-(піридин-4-іл)феніл]-N-(хінолін-2-іл)ацетамід; N-(6метокси-1,3-бензотіазол-2-іл)-2-[5-(2-метилпіридин-4-іл)піримідин-2-іл]ацетамід; N-(6-метокси1,3-бензотіазол-2-іл)-2-[5-(2-метилпіридин-4-іл)піридин-2-іл]ацетамід; 2-[3-метил-4-(2метилпіридин-4-іл)феніл]-N-(4-феніл-1,3-тіазол-2-іл)ацетамід; 2-[4-(2-метилпіридин-4-іл)феніл]N-(4-феніл-1,3-тіазол-2-іл)ацетамід; 2-[4-(2-метилпіридин-4-іл)феніл]-N-(5-фенілпіридин-2іл)ацетамід; 2-[4-(2-метилпіридин-4-іл)феніл]-N-(4-фенілпіридин-2-іл)ацетамід; 2-[4-(2метилпіридин-4-іл)феніл]-N-[6-(трифторметокси)-1,3-бензотіазол-2-іл]ацетамід; 2-[4-(2метилпіридин-4-іл)феніл]-N-(5-феніл-1,3-тіазол-2-іл)ацетамід; N-(6-метокси-1,3-бензотіазол-2 5 UA 103918 C2 5 10 15 20 25 30 35 40 45 50 55 60 іл)-2-[4-(2-метоксипіридин-4-іл)феніл]ацетамід; 2-[4-(2-етилпіридин-4-іл)феніл]-N-(6-метокси-1,3бензотіазол-2-іл)ацетамід; 2-[2-метил-4-(2-метилпіридин-4-іл)феніл]-N-(4-феніл-1,3-тіазол-2іл)ацетамід; N-[4-(4-метоксифеніл)-1,3-тіазол-2-іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; N[4-(4-фторфеніл)-1,3-тіазол-2-іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; N-[4-(3,4дифторфеніл)-1,3-тіазол-2-іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; 2-[4-(2-метилпіридин-4іл)феніл]-N-(6-фенілпіридин-3-іл)ацетамід; N-(5-фенілпіридин-2-іл)-2-[4-(піридазин-4іл)феніл]ацетамід; N-[5-(4-метилфеніл)піридин-2-іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; N-[5-(3-метоксифеніл)піридин-2-іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; N-[5-(2метоксифеніл)піридин-2-іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; N-[5-(4метоксифеніл)піридин-2-іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; 2-[4-(2-метилпіридин-4іл)феніл]-N-(5-фенілпіразин-2-іл)ацетамід; 2-[4-(2-метилпіридин-4-іл)феніл]-N-[5-(піридин-2іл)піридин-2-іл]ацетамід; 2-[4-(2-метилпіридин-4-іл)-3-(трифторметил)феніл]-N-(4-феніл-1,3тіазол-2-іл)ацетамід; N-[5-(3-метилфеніл)піридин-2-іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; 2-[4-(2-метилпіридин-4-іл)-3-(трифторметил)феніл]-N-(5-фенілпіридин-2-іл)ацетамід; 2-[4-(2метилпіридин-4-іл)феніл]-N-[5-(піридин-3-іл)піридин-2-іл]ацетамід; 2-[4-(2-метилпіридин-4іл)феніл]-N-[5-(піридин-4-іл)піридин-2-іл]ацетамід; 2-[4-(2-метилпіридин-4-іл)феніл]-N-(6фенілпіридазин-3-іл)ацетамід; 2-[4-(2-метилпіридин-4-іл)феніл]-N-(4-фенілфеніл)ацетамід; 2-[6(2-метилпіридин-4-іл)піридин-3-іл]-N-(5-фенілпіридин-2-іл)ацетамід; 2-[4-(2-метилпіридин-4іл)феніл]-N-(2-фенілпіримідин-5-іл)ацетамід; 2-[4-(1H-імідазол-1-іл)феніл]-N-(5-фенілпіридин-2іл)ацетамід; N-(6-фенілпіридин-3-іл)-2-[4-(піридазин-4-іл)феніл]ацетамід; N-[5-(4фторфеніл)піридин-2-іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; N-[5-(3-фторфеніл)піридин-2іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; N-[5-(4-етилпіперазин-1-іл)піридин-2-іл]-2-[4-(2метилпіридин-4-іл)феніл]ацетамід; N-{5-[(2R, 6S)-2,6-диметилморфолін-4-іл]піридин-2-іл}-2-[4(2-метилпіридин-4-іл)феніл]ацетамід; 2-[4-(2-метилпіридин-4-іл)феніл]-N-[4-(піридин-3іл)феніл]ацетамід; N-(6-фтор-1,3-бензотіазол-2-іл)-2-[4-(піридазин-4-іл)феніл]ацетамід; 2-[4-(2метилпіридин-4-іл)феніл]-N-(5-фенілпіримідин-2-іл)ацетамід; N-(6-метокси-1,3-бензотіазол-2-іл)N-метил-2-[4-(піридин-4-іл)феніл]ацетамід; 2-[4-(піридазин-4-іл)феніл]-N-[4-(піридин-3іл)феніл]ацетамід; N-(6-фенілпіридазин-3-іл)-2-[4-(піридазин-4-іл)феніл]ацетамід; 2-[4-(2метилпіридин-4-іл)феніл]-N-[5-(1H-піразол-4-іл)піридин-2-іл]ацетамід; 2-[4-(2-метилпіридин-4іл)феніл]-N-[5-(піразин-2-іл)піридин-2-іл]ацетамід; 2-[4-(2-метилпіридин-4-іл)феніл]-N-[5(піримідин-5-іл)піридин-2-іл]ацетамід; 2-[4-(2-метилпіридин-4-іл)феніл]-N-[4-(піридазин-4іл)феніл]ацетамід; 2-[4-(2-метилпіридин-4-іл)феніл]-N-[5-(1,2,3,6-тетрагідропіридин-4-іл)піридин2-іл]ацетамід; 2-[4-(2-метилпіридин-4-іл)феніл]-N-[5-(піридазин-3-іл)піридин-2-іл]ацетамід; 2-[5метил-6-(2-метилпіридин-4-іл)піридин-3-іл]-N-(6-фенілпіридин-3-іл)ацетамід; 2-[4-(2метилпіридин-4-іл)феніл]-N-[5-(піридазин-4-іл)піридин-2-іл]ацетамід; 2-[4-(2-метилпіридин-4іл)феніл]-N-[6-(морфолін-4-іл)піридин-3-іл]ацетамід; N-[5-(3-фторфеніл)піридин-2-іл]-2-[5-метил6-(піридазин-4-іл)піридин-3-іл]ацетамід; 2-[3-метил-4-(2-метилпіридин-4-іл)феніл]-N-[5-(піридин2-іл)піридин-2-іл]ацетамід; 2-[3-метил-4-(піридазин-4-іл)феніл]-N-[5-(піридин-2-іл)піридин-2іл]ацетамід; 2-[6-(2-метилпіридин-4-іл)піридин-3-іл]-N-[5-(піридазин-3-іл)піридин-2-іл]ацетамід; N-[5-(піридазин-3-іл)піридин-2-іл]-2-[6-(піридазин-4-іл)піридин-3-іл]ацетамід; 2-[4-(2метилпіридин-4-іл)-3-(трифторметил)феніл]-N-[5-(піразин-2-іл)піридин-2-іл]ацетамід; N-[5-(3фторфеніл)піридин-2-іл]-2-[5-метил-6-(2-метилпіридин-4-іл)піридин-3-іл]ацетамід; N-[5-(3фторфеніл)піридин-2-іл]-2-[4-(2-метилпіридин-4-іл)-3-(трифторметил)феніл]ацетамід; 2-[4-(2метилпіридин-4-іл)феніл]-N-[5-(піридазин-4-іл)піридин-2-іл]ацетамід; N-[5-(3-фторфеніл)піридин2-іл]-2-[6-(2-метилпіридин-4-іл)піридин-3-іл]ацетамід; N-[6-(3-фторфеніл)піридин-3-іл]-2-[6-(2метилпіридин-4-іл)піридин-3-іл]ацетамід; 2-[4-(2-метилпіридин-4-іл)феніл]-N-[6-(піридазин-4іл)піридин-3-іл]ацетамід; 2-[5-метил-6-(2-метилпіридин-4-іл)піридин-3-іл]-N-[5-(піразин-2іл)піридин-2-іл]ацетамід; 2-[5-метил-6-(піридазин-4-іл)піридин-3-іл]-N-(6-фенілпіридин-3іл)ацетамід; 2-[6-(2-метилпіридин-4-іл)піридин-3-іл]-N-(6-фенілпіридин-3-іл)ацетамід; N-(6фенілпіридин-3-іл)-2-[6-(піридазин-4-іл)піридин-3-іл]ацетамід; N-[6-(1-ацетил-1,2,3,6тетрагідропіридин-4-іл)піридин-3-іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; метил 4-(5-{2-[4(2-метилпіридин-4-іл)феніл]ацетамідо}піридин-2-іл)-1,2,3,6-тетрагідропіридин-1-карбоксилат; N[6-(1-метансульфоніл-1,2,3,6-тетрагідропіридин-4-іл)піридин-3-іл]-2-[4-(2-метилпіридин-4іл)феніл]ацетамід; N-[6-(1-метилпіперидин-4-іл)піридин-3-іл]-2-[4-(2-метилпіридин-4іл)феніл]ацетамід; 2-[5-метил-6-(піридазин-4-іл)піридин-3-іл]-N-[5-(піридин-2-іл)піридин-2іл]ацетамід; 2-[6-(піридазин-4-іл)піридин-3-іл]-N-[5-(піридин-2-іл)піридин-2-іл]ацетамід; 2-[6-(2метилпіридин-4-іл)піридин-3-іл]-N-(5-фенілпіримідин-2-іл)ацетамід; N-[5-(3фторфеніл)піримідин-2-іл]-2-[6-(піридазин-4-іл)піридин-3-іл]ацетамід; етил 4-(5-{2-[4-(2метилпіридин-4-іл)феніл]ацетамідо}піридин-2-іл)-1,2,3,6-тетрагідропіридин-1-карбоксилат; пропан-2-іл 4-(5-{2-[4-(2-метилпіридин-4-іл)феніл]ацетамідо}піридин-2-іл)-1,2,3,6 6 UA 103918 C2 5 10 15 20 25 30 35 40 45 50 55 60 тетрагідропіридин-1-карбоксилат; 1-метилциклопропіл 4-(5-{2-[4-(2-метилпіридин-4іл)феніл]ацетамідо}піридин-2-іл)-1,2,3,6-тетрагідропіридин-1-карбоксилат; 2-[4-(2-метилпіридин4-іл)феніл]-N-[6-(1,2,3,6-тетрагідропіридин-4-іл)піридин-3-іл]ацетамід; N-[6-(3фторфеніл)піридин-3-іл]-2-[5-метил-6-(2-метилпіридин-4-іл)піридин-3-іл]ацетамід; N-[6-(3фторфеніл)піридин-3-іл]-2-[5-метил-6-(піридазин-4-іл)піридин-3-іл]ацетамід; N-[6-(3фторфеніл)піридин-3-іл]-2-[4-(2-метилпіридин-4-іл)-3-(трифторметил)феніл]ацетамід; N-[6-(3фторфеніл)піридин-3-іл]-2-[4-(піридазин-4-іл)-3-(трифторметил)феніл]ацетамід; N-[6-(1-метил1,2,3,6-тетрагідропіридин-4-іл)піридин-3-іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; N-[6-(1етил-1,2,3,6-тетрагідропіридин-4-іл)піридин-3-іл]-2-[4-(2-метилпіридин-4-іл)феніл]ацетамід; N-[6(3-фторфеніл)піридин-3-іл]-2-[6-(2-метилпіридин-4-іл)піридин-3-іл]ацетамід; N-(6фенілпіридазин-3-іл)-2-[6-(піридазин-4-іл)піридин-3-іл]ацетамід; 2-[6-(2-метилпіридин-4іл)піридин-3-іл]-N-(6-фенілпіридазин-3-іл)ацетамід; та N-(5-(4-ацетилпіперазин-1-іл)піридин-2іл)-2-(3-ціано-4-(2-метилпіридин-4-іл)феніл)ацетамід; N-(2,3'-біпіридин-6'-іл)-2-(4-(піридазин-4іл)-3-(трифторметил)феніл)ацетамід; N-(5-(піридазин-3-іл)піридин-2-іл)-2-(4-(піридазин-4іл)феніл)ацетамід; N-(5-(3-фторфеніл)піридин-2-іл)-2-(6-(піридазин-4-іл)піридин-3-іл)ацетамід; N-(6-(3-фторфеніл)піридин-3-іл)-2-(6-(піридазин-4-іл)піридин-3-іл)ацетамід; N-(6-(1-(2-аміно-2оксоетил)-1,2,3,6-тетрагідропіридин-4-іл)піридин-3-іл)-2-(4-(2-метилпіридин-4-іл)феніл)ацетамід; N-(6-(3-фторфеніл)піридин-3-іл)-2-(4-(піридазин-4-іл)феніл)ацетамід; N-(5-(піразин-2-іл)піридин2-іл)-2-(4-(піридазин-4-іл)-3-(трифторметил)феніл)ацетамід; трет-бутил 4-(5-(2-(4-(2метилпіридин-4-іл)феніл)ацетамідо)піридин-2-іл)піперазин-1-карбоксилат; N-(5-(3фторфеніл)піридин-2-іл)-2-(4-(піридазин-4-іл)феніл)ацетамід; N-(2,3'-біпіридин-6'-іл)-2-(4-(2метилпіридин-4-іл)-3-(трифторметил)феніл)ацетамід; N-(5-(піридазин-3-іл)піридин-2-іл)-2-(4(піридазин-4-іл)-3-(трифторметил)феніл)ацетамід; N-(2-(3-фторфеніл)піримідин-5-іл)-2-(4-(2метилпіридин-4-іл)феніл)ацетамід; N-(2,3'-біпіридин-6'-іл)-2-(2',3-диметил-2,4'-біпіридин-5іл)ацетамід; трет-бутил 4-(6-(2-(4-(2-метилпіридин-4-іл)феніл)ацетамідо)піридин-3-іл)піперазин1-карбоксилат; N-(2,3'-біпіридин-6'-іл)-2-(2'-метил-2,4'-біпіридин-5-іл)ацетамід; N-(6-(1ацетилпіперидин-4-іл)піридин-3-іл)-2-(4-(2-метилпіридин-4-іл)феніл)ацетамід; 2-(2'-метил-2,4'біпіридин-5-іл)-N-(5-(піразин-2-іл)піридин-2-іл)ацетамід; N-(5-(піразин-2-іл)піридин-2-іл)-2-(6(піридазин-4-іл)піридин-3-іл)ацетамід; 2-(5-метил-6-(піридазин-4-іл)піридин-3-іл)-N-(5-(піразин-2іл)піридин-2-іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(4-(2-метилпіридин-4іл)феніл)ацетамід; метил 4-(6-(2-(4-(2-метилпіридин-4-іл)феніл)ацетамідо)піридин-3іл)піперазин-1-карбоксилат; 2-(3-метил-4-(піридазин-4-іл)феніл)-N-(5-(піразин-2-іл)піридин-2іл)ацетамід; 2-(3-метил-4-(піридазин-4-іл)феніл)-N-(5-(піридазин-4-іл)піридин-2-іл)ацетамід; 2(2',3-диметил-2,4'-біпіридин-5-іл)-N-(5-(піридазин-4-іл)піридин-2-іл)ацетамід; 2-(2',3-диметил-2,4'біпіридин-5-іл)-N-(6-(піридазин-4-іл)піридин-3-іл)ацетамід; 2-(3-метил-4-(піридазин-4-іл)феніл)N-(5-(піридазин-3-іл)піридин-2-іл)ацетамід; трет-бутил 4-(6-(2-(4-(2-метилпіридин-4іл)феніл)ацетамідо)піридин-3-іл)піперидин-1-карбоксилат; 2-(3-метил-4-(піридазин-4-іл)феніл)N-(6-(піридазин-4-іл)піридин-3-іл)ацетамід; 2-(6-(4-ацетилпіперазин-1-іл)піридин-3-іл)-N-(5-(3фторфеніл)піридин-2-іл)ацетамід; 2-(4-(2-метилпіридин-4-іл)феніл)-N-(5-(3-оксопіперазин-1іл)піридин-2-іл)ацетамід; 4-(6-(2-(4-(2-метилпіридин-4-іл)феніл)ацетамідо)піридин-3іл)піперазин-1-карбоксамід; N-(5-(4-метил-1H-імідазол-1-іл)піридин-2-іл)-2-(4-(2-метилпіридин-4іл)феніл)ацетамід; 2-(4-(4-метил-1H-імідазол-1-іл)феніл)-N-(5-(піразин-2-іл)піридин-2іл)ацетамід; 2-(2',3-диметил-2,4'-біпіридин-5-іл)-N-(5-(піридазин-3-іл)піридин-2-іл)ацетамід; 2-(5метил-6-(піридазин-4-іл)піридин-3-іл)-N-(5-(піридазин-3-іл)піридин-2-іл)ацетамід; 2-(5-метил-6(піридазин-4-іл)піридин-3-іл)-N-(5-(піридазин-4-іл)піридин-2-іл)ацетамід; N-(5-(4ацетилпіперазин-1-іл)піридин-2-іл)-2-(2',3-диметил-2,4'-біпіридин-5-іл)ацетамід; N-(5-((3S, 5R)-4ацетил-3,5-диметилпіперазин-1-іл)піридин-2-іл)-2-(4-(2-метилпіридин-4-іл)феніл)ацетамід; N-(4(1-ацетилпіперидин-4-іл)феніл)-2-(4-(2-метилпіридин-4-іл)феніл)ацетамід; N-(6-(4-(2гідроксиетил)піперазин-1-іл)піридин-3-іл)-2-(4-(2-метилпіридин-4-іл)феніл)ацетамід; N-(6-(3фторфеніл)піридин-3-іл)-2-(5-метил-6-(піридазин-4-іл)піридин-3-іл)ацетамід; 2-(2',3-диметил2,4'-біпіридин-5-іл)-N-(4-(піразин-2-іл)феніл)ацетамід; 2-(2',3-диметил-2,4'-біпіридин-5-іл)-N-(4(піридазин-3-іл)феніл)ацетамід; 2-(2-(2',3-диметил-2,4'-біпіридин-5-іл)ацетамідо)-5-(піразин-2іл)піридин 1-оксид; 2',3-диметил-5-(2-оксо-2-(5-(піразин-2-іл)піридин-2-іламіно)етил)-2,4'біпіридин 1'-оксид; 2-(2',3-диметил-2,4'-біпіридин-5-іл)-N-(6-(піразин-2-іл)піридин-3-іл)ацетамід; N-(5-(4-ізобутирилпіперазин-1-іл)піридин-2-іл)-2-(4-(2-метилпіридин-4-іл)феніл)ацетамід; N-(5-(4ацетилпіперазин-1-іл)піридин-2-іл)-2-(3-метил-4-(2-метилпіридин-4-іл)феніл)ацетамід; N-(6-(4ацетилпіперазин-1-іл)піридин-3-іл)-2-(2',3-диметил-2,4'-біпіридин-5-іл)ацетамід; (R)-N-(6-(4ацетил-3-метилпіперазин-1-іл)піридин-3-іл)-2-(4-(2-метилпіридин-4-іл)феніл)ацетамід; (S)-N-(6(4-ацетил-3-метилпіперазин-1-іл)піридин-3-іл)-2-(4-(2-метилпіридин-4-іл)феніл)ацетамід; (S)-N(6-(4-ацетил-3-метилпіперазин-1-іл)піридин-3-іл)-2-(2',3-диметил-2,4'-біпіридин-5-іл)ацетамід; 7 UA 103918 C2 5 10 15 20 25 30 35 40 45 50 (R)-N-(6-(4-ацетил-3-метилпіперазин-1-іл)піридин-3-іл)-2-(2',3-диметил-2,4'-біпіридин-5іл)ацетамід; N-(5-((3S, 5R)-4-ацетил-3,5-диметилпіперазин-1-іл)піридин-2-іл)-2-(2',3-диметил2,4'-біпіридин-5-іл)ацетамід; метил 4-(6-(2-(2',3-диметил-2,4'-біпіридин-5-іл)ацетамідо)піридин-3іл)піперазин-1-карбоксилат; метил 4-(6-(2-(3-метил-4-(2-метилпіридин-4іл)феніл)ацетамідо)піридин-3-іл)піперазин-1-карбоксилат; N-(5-(4-ацетилпіперазин-1-іл)піридин2-іл)-2-(3-фтор-4-(2-метилпіридин-4-іл)феніл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2іл)-2-(2'-метил-2,4'-біпіридин-5-іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(3-хлор4-(2-метилпіридин-4-іл)феніл)ацетамід; етил 4-(6-(2-(2',3-диметил-2,4'-біпіридин-5іл)ацетамідо)піридин-3-іл)піперазин-1-карбоксилат; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2(4-(2-метилпіридин-4-іл)-3-(трифторметил)феніл)ацетамід; 2-(3-ціано-4-(2-метилпіридин-4іл)феніл)-N-(6-фенілпіридин-3-іл)ацетамід; 2-(2',3-диметил-2,4'-біпіридин-5-іл)-N-(5-(4пропіонілпіперазин-1-іл)піридин-2-іл)ацетамід; N-(5-(4-(ціанометил)піперазин-1-іл)піридин-2-іл)2-(4-(2-метилпіридин-4-іл)феніл)ацетамід; N-(5-(4-ціанопіперазин-1-іл)піридин-2-іл)-2-(4-(2метилпіридин-4-іл)феніл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(4-(2хлорпіридин-4-іл)феніл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(4-(2фторпіридин-4-іл)феніл)ацетамід; 2-(3-ціано-4-(2-метилпіридин-4-іл)феніл)-N-(5-(піразин-2іл)піридин-2-іл)ацетамід; 2-(3-ціано-4-(2-метилпіридин-4-іл)феніл)-N-(6-(піразин-2-іл)піридин-3іл)ацетамід; 2-(3-ціано-4-(2-метилпіридин-4-іл)феніл)-N-(5-(піридазин-3-іл)піридин-2-іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(3-метокси-4-(2-метилпіридин-4-іл)феніл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(3-хлор-2'-метил-2,4'-біпіридин-5-іл)ацетамід; (S)-N(5-(4-ацетил-3-метилпіперазин-1-іл)піридин-2-іл)-2-(3-ціано-4-(2-метилпіридин-4іл)феніл)ацетамід; (R)-N-(5-(4-ацетил-3-метилпіперазин-1-іл)піридин-2-іл)-2-(2',3-диметил-2,4'біпіридин-5-іл)ацетамід; ізопропіл 4-(6-(2-(2',3-диметил-2,4'-біпіридин-5-іл)ацетамідо)піридин-3іл)піперазин-1-карбоксилат; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(3-ціано-2'-метил-2,4'біпіридин-5-іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(2'-метил-3(трифторметил)-2,4'-біпіридин-5-іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(3фтор-2'-метил-2,4'-біпіридин-5-іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(2-фтор5-метил-4-(2-метилпіридин-4-іл)феніл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(4(2-метилпіримідин-4-іл)-3-(трифторметил)феніл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин2-іл)-2-(2'-фтор-3-метил-2,4'-біпіридин-5-іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)2-(2',3-дифтор-2,4'-біпіридин-5-іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(4-(2метилпіримідин-4-іл)феніл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(4-(5фторпіримідин-4-іл)феніл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(2'-метил-3(метилсульфоніл)-2,4'-біпіридин-5-іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(4(6-метилпіримідин-4-іл)феніл)ацетамід; 2-(2'-фтор-3-метил-2,4'-біпіридин-5-іл)-N-(5-(піразин-2іл)піридин-2-іл)ацетамід; 2-(4-(2-фторпіридин-4-іл)феніл)-N-(5-(піразин-2-іл)піридин-2іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(4-(2-(дифторметил)піридин-4іл)феніл)-ацетамід; N-(6-(4-ацетилпіперазин-1-іл)піридин-3-іл)-2-(4-(2-(дифторметил)-піридин-4іл)феніл)ацетамід; 2-(4-(2-(дифторметил)піридин-4-іл)феніл)-N-(5-(піразин-2-іл)піридин-2іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(4-(5-фторпіримідин-4-іл)-3метилфеніл)ацетамід; 2-(2',3-дифтор-2,4'-біпіридин-5-іл)-N-(5-(піразин-2-іл)піридин-2іл)ацетамід; 2-(3-ціано-4-(2-фторпіридин-4-іл)феніл)-N-(5-(піразин-2-іл)піридин-2-іл)ацетамід; N(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(3-фтор-4-(2-фторпіридин-4-іл)феніл)ацетамід; 2-(2'фтор-2,4'-біпіридин-5-іл)-N-(5-(піразин-2-іл)піридин-2-іл)ацетамід; N-(5-(4-ацетилпіперазин-1іл)піридин-2-іл)-2-(2'-фтор-2,4'-біпіридин-5-іл)ацетамід; 2-(2',3-дифтор-2,4'-біпіридин-5-іл)-N-(5(піридазин-3-іл)піридин-2-іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(3-ціано-4-(2фторпіридин-4-іл)феніл)ацетамід; 2-(3-фтор-4-(2-фторпіридин-4-іл)феніл)-N-(5-(піразин-2іл)піридин-2-іл)ацетамід; 2-(3-фтор-4-(2-фторпіридин-4-іл)феніл)-N-(5-(піридазин-3-іл)піридин-2іл)ацетамід; 2-(3-ціано-4-(2-фторпіридин-4-іл)феніл)-N-(5-(піридазин-3-іл)піридин-2-іл)ацетамід; 2-(4-(2-фторпіридин-4-іл)феніл)-N-(5-(піридазин-3-іл)піридин-2-іл)ацетамід; та 2-(2'-фтор-3метил-2,4'-біпіридин-5-іл)-N-(5-(піридазин-3-іл)піридин-2-іл)ацетамід; або їх фізіологічно прийнятні солі. У іншому варіанті втілення представлені сполуки, вибрані з групи, що складається з таких як: 55 8 UA 103918 C2 У іншому варіанті втілення представлені сполуки, що мають Формулу (10) або (11): R1 R2 N Z R3 X1 Y O 5 10 X3 R1 R2 N X2 O X3 E A2 (10) X2 X4 (11) або їх фізіологічно прийнятна сіль, у яких: кільце E являє собою необов'язково заміщений арил або гетероарил; 1 2 A та A незалежно являють собою C1-5гетероцикл, хінолініл, або гетероарил, вибраний з групи: 1 15 X1 B X4 A1 R3 2 де будь-який гетероцикл радикалу A та A може бути необов'язково заміщений за 10 допомогою –LC(O)R ; де атом азоту може бути необов'язково окислений (дивись, наприклад, сполуку 156 таблиці 1). B являє собою бензотіазоліл, хінолініл або ізoхінолініл, кожен з яких необов'язково 6 заміщений за допомогою 1-3 R груп; 9 UA 103918 C2 1 5 10 15 20 25 30 35 40 45 50 55 2 3 4 7 X , X , X та X незалежно являють собою CR або N; Y являє собою феніл або 5-6 членний гетероарил, що містить 1-2 гетероатоми, вибрані з N, O та S; Z являє собою арил, C1-5 гетероцикл, або 5-6 членний гетероарил, що містить 1-2 гетероатоми, вибрані з N, O та S; 6 кожен Y та Z необов'язково заміщений за допомогою 1-3 R груп; 1 5 R та R незалежно являють собою H або C1-6 алкіл; 2 3 R та R незалежно являють собою H, C1-6 алкіл або гало групу; 4 R являє собою гало групу, ціано групу, C 1-6алкокси групу, або C1-6 алкіл, необов'язково заміщений за допомогою гало групи, алкокси групи або аміно групи; 6 10 10 10 R являє собою водень, гало групу, C1-6алкокси групу, –S(O)2R , –C(O)OR , –C(O)R , – 8 9 C(O)NR R , C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл, кожен з яких може бути необов'язково заміщений за допомогою гало групи, аміно групи, гідроксилу, алкокси групи або ціано групи; 8 9 10 10 8 9 10 10 гало групу, CN, -L-W, NR R , -L-C(O)R , -L-C(O)OR , -L-C(O)NR R , OR ; -L-S(O)2R або –L8 9 S(O)2NR R ; 7 10 R являє собою H, гало групу, C1-6 алкокси групу, -L-S(O)2R , ціано групу, C1-6 алкокси групу, C1-6 алкіл, необов'язково заміщений за допомогою гало групи, аміно групи, гідроксилу, алкокси 8 9 10 8 9 10 10 8 9 групи або ціано групи; NR R , -L-C(O)R , -L-C(O)NR R , OR ; -L-S(O)2R або –L-S(O)2NR R ; 8 9 R та R незалежно являють собою H, -L-W, або C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл, кожен з яких може бути необов'язково заміщений за допомогою гало групи, аміно групи, гідроксилу, 8 9 алкокси групи або ціано групи; або R та R разом з атомами, до яких вони приєднані, можуть утворювати кільце; 10 R являє собою H, -L-W, або C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл, кожен з яких може бути необов'язково заміщений за допомогою гало групи, аміно групи, гідроксилу, алкокси групи або ціано групи; L являє собою зв'язок або (CR2)1-4, де R являє собою H або C1-6 алкіл; W являє собою C3-7циклоалкіл, C1-5гетероцикл, арил або гетероарил; m являє собою 0-4; n являє собою 0-3; та p являє собою 0-2; та їх сольвати, гідрати, Nоксидна похідна або проліки. У іншому варіанті втілення представлені сполуки Формул 10 та 11, вибрані з групи, що складається з таких як: N-(6-метоксибензо[d]тіазол-2-іл)-2-(3-(піридин-4-іл)феніл)ацетамід; N-(6фенілпіридин-3-іл)-2-(3-(піридин-4-іл)феніл)ацетамід; 2-(3-(2-метилпіридин-4-іл)феніл)-N-(6фенілпіридин-3-іл)ацетамід; N-(6-фенілпіридин-3-іл)-2-(3-(піридазин-4-іл)феніл)ацетамід; 2-(3(2-метоксипіридин-4-іл)феніл)-N-(6-фенілпіридин-3-іл)ацетамід; N-(5-(4-ацетилпіперазин-1іл)піридин-2-іл)-2-(3-(2-метилпіридин-4-іл)феніл)ацетамід; 2-(3-(2-метилпіридин-4-іл)феніл)-N-(4(піридазин-3-іл)феніл)ацетамід; 2-(3-(2-метилпіридин-4-іл)феніл)-N-(4-(піразин-2іл)феніл)ацетамід; 2-(3-(2-метилпіридин-4-іл)феніл)-N-(6-(піразин-2-іл)піридин-3-іл)ацетамід; 2(2'-метил-2,4'-біпіридин-6-іл)-N-(6-фенілпіридин-3-іл)ацетамід; 2-(2'-метил-2,4'-біпіридин-4-іл)-N(6-фенілпіридин-3-іл)ацетамід; 2-(4-ціано-3-(2-метилпіридин-4-іл)феніл)-N-(6-фенілпіридин-3іл)ацетамід; N-(5-(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(4-ціано-3-(2-метилпіридин-4іл)феніл)ацетамід; 2-(2'-метил-2,4'-біпіридин-4-іл)-N-(5-(піразин-2-іл)піридин-2-іл)ацетамід; N-(5(4-ацетилпіперазин-1-іл)піридин-2-іл)-2-(2'-метил-2,4'-біпіридин-4-іл)ацетамід; та N-(5-(4ацетилпіперазин-1-іл)піридин-2-іл)-2-(2-ціано-2'-метил-3,4'-біпіридин-5-іл)ацетамід, або їх фармацевтично прийнятна сіль. У іншому аспекті, даний винахід забезпечує фармацевтичні композиції, що містять сполуку, що має Формулу (1), (2), (3), (4), (5) або (6), та фізіологічно прийнятний носій. У ще одному іншому аспекті, даний винахід забезпечує способи інгібування Wnt сигналювання у клітині, що включає контактування клітини з ефективною кількістю сполуки, що має Формулу (1), (2), (3), (4), (5) або (6), або її фармацевтичною композицією. У ще одному іншому аспекті, даний винахід забезпечує способи інгібування гену Porcupine у клітині, що включає контактування клітини з ефективною кількістю сполуки, що має Формулу (1), (2), (3), (4), (5) або (6), або її фармацевтичною композицією. Даний винахід також забезпечує способи лікування, полегшення або профілактики Wntопосередкованого розладу у ссавця, що страждає на нього, що включає введення ссавцю терапевтично ефективної кількості сполуки, що має Формулу (1), (2), (3), (4), (5) або (6), або її фармацевтичної композиції, та необов'язково у комбінації з другим терапевтичним агентом. Альтернативно, даний винахід забезпечує застосування сполуки, що має Формулу (1), (2), (3), (4), (5) або (6), та необов'язково у комбінації з другим терапевтичним агентом, у виробництві лікарського засобу для лікування Wnt-опосередкованого розладу. 10 UA 103918 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки даного винаходу можуть бути введені, наприклад, ссавцю, що страждає від Wntопосередкованого розладу, вибраного з таких як: келоїди, фіброз, такий як фіброз шкіри, ідіопатичний легеневий фіброз, нирковий інтерстиціальний фіброз та фіброз печінки; протеїнурія, відторгнення трансплантату нирки, остеоартрит, хвороба Паркінсона, кистозний макулярний набряк (CME), такий як увеїт-асоційований CME; ретинопатія, така як діабетична ретинопатія або ретинопатія недоношених; макулярна дистрофія та клітино-проліферативний розлад, пов'язаний з аберантною Wnt сигнальною активністю. У певних прикладах, сполуки даного винаходу можуть бути використані окремо або у комбінації з хіміотерапевтичним агентом для лікування клітино-проліферативного розладу, включаючи, не обмежуючись наведеними, такі як: колоректальний рак, рак молочної залози, плоскоклітинна карцинома голови та шиї, плоскоклітинна карцинома стравоходу, недрібноклітинний рак легені, рак шлунку, рак підшлункової залози, лейкемія, лімфома, нейробластома, ретинобластома, саркома, остеосаркома, хондросаркома, саркома Юінга, рабдоміосаркома, пухлина мозку, пухлина Вілма, базально-клітинний рак, меланома, рак голови та шиї, рак шийки матки та рак передміхурової залози. Визначення "Алкіл", як група або як структурний елемент інших груп, наприклад, таких як галозаміщений-алкіл та алкокси група, може бути лінійно-ланцюговим або розгалуженим. Необов'язково заміщений алкіл, алкеніл або алкініл, як використано у цьому описі, може бути необов'язково галогенований (наприклад, CF3), або може мати один або більшу кількість атомів вуглецю, які заміщені або замінені гетероатомом, таким як NR, O або S (наприклад, – OCH2CH2O–, алкілтіоли, тіоалкокси групи, алкіламіни, тощо). "Карбоциклічне кільце", як використано у цьому описі, відноситься до насиченого або частково ненасиченого, моноциклічного, сконденсованого біциклічного або місткового поліциклічного кільця, що містить атоми вуглецю, які можуть бути необов'язково заміщені, наприклад, за допомогою =O. Приклади карбоциклічних кілець включають, не обмежуючись наведеними, циклопропіл, циклобутил, циклопентил, циклогексил, циклопропілен, циклогексанон, тощо. "Гетероциклічне кільце", як використано у цьому описі, визначається як описано вище для карбоциклічного кільця, де один або більша кількість кільцевих атомів вуглецю являють собою гетероатом. Наприклад, гетероциклічне кільце може містити N, O, S, -N=, C(O) (дивись, наприклад, сполуку 141, таблиця 1), -S-, -S(O), -S(O)2-, або -NR-, де R може являти собою водень, C1-4алкіл або захисну групу. Приклади гетероциклічних кілець включають, не обмежуючись наведеними, морфоліно, піролідиніл, піролідиніл-2-он, піперазиніл, піперидиніл, піперидинілон, 1,4-діокса-8-аза-спіро[4.5]дец-8-ил, тощо. Як використано у цьому описі, H атом у будь-яких групах-замісниках (наприклад, CH2) 2 3 охоплює всі придатні ізотопні варіанти, наприклад, H, H та H. "Wnt білок" являє собою ліганд компоненту Wnt сигнального шляху, який зв'язується з пов'язаним з опіком рецептором, таким чином, щоб активувати Wnt сигналювання. Специфічні приклади Wnt білків включають, щонайменше 19 членів, включаючи: Wnt-1 (RefSeq.: NM— 005430), Wnt-2 (RefSeq.: NM—003391), Wnt-2B (Wnt-13) (RefSeq.: NM—004185), Wnt-3 (ReSeq.: NM—030753), Wnt3a (RefSeq.: NM—033131), Wnt-4 (RefSeq.: NM—030761), Wnt-5A (RefSeq.: NM— 003392), Wnt-5B (RefSeq.: NM—032642), Wnt-6 (RefSeq.: NM—006522), Wnt-7A (RefSeq.: NM— 004625), Wnt-7B (RefSeq.: NM—058238), Wnt-8A (RefSeq.: NM—058244), Wnt-8B (RefSeq.: NM— 003393), Wnt-9A (Wnt-14) (RefSeq.: NM—003395), Wnt-9B (Wnt-15) (RefSeq.: NM—003396), Wnt10A (RefSeq.: NM—025216), Wnt-10B (RefSeq.: NM—003394), Wnt-11 (RefSeq.: NM—004626), Wnt16 (RefSeq.: NM—016087)). В той час як кожен член має різні ступені ідентичності послідовності, кожен містить 23-24 консервативних цистеїнових залишки, які показують високо консервативне розташування. McMahon, A P et al, Trends Genet. 8: 236-242 (1992); Miller J R., Genome Biol. 3(1): 3001.1-3001.15 (2002). Для цілей даного винаходу, Wnt білок та його активні варіанти являє собою білок, який зв'язує пов'язаним з опіком ECD або CRD компонент такого Frz ECD. "Wnt-опосередкований розлад" являє собою розлад, стан або хворобливий стан, що характеризується аберантним Wnt сигналюванням. У специфічному аспекті, аберантне Wnt сигналювання являє собою рівень Wnt сигналювання у клітині або тканині, що, як підозрюють, є хворобливою, що перевищує рівень Wnt сигналювання у подібній незахворілій клітині або тканині. У специфічному аспекті, Wnt-опосередкований розлад включає рак. Термін "рак" відноситься до фізіологічного стану у ссавців, що, як правило, характеризується неконтрольованим ростом/проліферацією клітин. Приклади раку включають, не обмежуючись наведеними, такі як: карцинома, лімфома, бластома, та лейкемія. Більш особливі приклади раків включають, не обмежуючись наведеними, такі як: хронічний лімфолейкоз (CLL), рак легені, 11 UA 103918 C2 5 10 15 20 25 30 35 40 45 50 55 60 включаючи недрібноклітинний рак (NSCLC), рак молочної залози, рак яєчників, рак шийки матки, рак ендометрію, рак передміхурової залози, колоректальний рак, інтерстиціальний карциноїд, рак сечового міхура, рак шлунку, рак підшлункової залози, печінковий (гепатоцелюлярний) рак, гепатобластома, рак стравоходу, легенева аденокарцинома, мезотеліома, синовіальна саркома, остеосаркома, плоскоклітинна карцинома голови та шиї, ювенільні назофарінгеальні ангіофіброми, ліпосаркома, рак щитовидної залози, меланома, базально-клітинний рак (BCC), медулобластома та десмоїд. "Виліковування" або "лікування" або "полегшення симптомів" відноситься як до терапевтичного лікування, так і до профілактичних або запобіжних заходів, де ціль полягає у запобіганні або уповільненні (зменшенні) цільової патологічної хвороби або стану або розладу. Ті, що потребують такого лікування, включають тих, що вже мають розлад, а також тих, які схильні мати розлад, або тих, у яких намагаються запобігти появі цього розладу (профілактика). Коли Wnt-опосередкований розлад являє собою рак, суб'єкт або ссавець успішно "лікується" або показує зменшене пухлинне навантаження, якщо, після отримання терапевтичної кількості Wnt антагоністу відповідно до способів даного винаходу, пацієнт показує помітне та/або вимірне зниження у або відсутність однієї або більшої кількості наступних ознак: зменшення кількості ракових клітин або відсутність ракових клітин; зменшення розміру пухлини; інгібування інфільтрації ракових клітин у периферичні органи, включаючи розповсюдження раку у м'які тканини та кістки; інгібування метастазування пухлин; інгібування, до деякого ступеню, росту пухлини; та/або полегшення до деякого ступеню, одного або більшої кількості симптомів, пов'язаних із специфічним раком; знижена захворюваність та смертність, та покращення якості життя. Наскільки можливо Wnt антагоніст може запобігати росту та/або знищувати існуючі ракові клітини, він може бути цитостатичним та/або цитотоксичним. Зменшення цих ознак або симптомів також може відчувати пацієнт. "Ссавець" відноситься до будь-якої тварини, що класифікується як ссавець, включаючи людей, домашніх та сільськогосподарських тварин, та тварин, що утримуються у зоопарках, тварин, що пов'язані із спортом, або тварин – домашніх улюбленців, таких як собаки, коти, велика рогата худоба, коні, вівці, свині, кози, кролики, тощо. У специфічних варіантах втілення, ссавцем є людина. Введення "у комбінації з" одним або більшою кількістю додаткових терапевтичних агентів включає одночасне (супутнє) та послідовне введення у будь-якому порядку. Термін "фармацевтична комбінація", як використано у цьому описі, означає продукт, який одержують після змішування або об'єднання активних інгредієнтів та включає як фіксовані, так і нефіксовані комбінації активних інгредієнтів. Термін "фіксована комбінація" означає, що активні інгредієнти, наприклад, сполуку Формули (1) та спів-агент, обидва вводять пацієнту одночасно у формі однієї одиниці або дози. Термін "нефіксована комбінація" означає, що активні інгредієнти, наприклад, сполуку Формули (1) та спів-агент, обидва вводять пацієнту як окремі одиниці або одночасно, паралельно або послідовно без специфічних обмежень часу, де таке введення забезпечує терапевтично ефективні рівні активних інгредієнтів у організмі пацієнта. Останню також застосовують для лікування сумішами, наприклад, введення трьох або більшої кількості активних інгредієнтів. "Носії" при використанні в даному винаході включають фармацевтично прийнятні носії, наповнювачі та стабілізатори, які є нетоксичними по відношенню до клітин або ссавця, що зазнають їх впливу, при використовуваних дозах та концентраціях. Часто фізіологічно прийнятним носієм є водний pH забуферений розчин. Приклади фізіологічно прийнятних носіїв включають буфери, такі як фосфатний, цитратний та основані на інших органічних кислотах; антіоксиданти, включаючи аскорбінову кислоту; поліпептиди, що мають невелику молекулярну масу (менше приблизно 10 залишків); білки, такі як сироватковий альбумін, желатин або імуноглобуліни; гідрофільні полімери, такі як полівінілпіролідон; амінокислоти, такі як гліцин, глутамін, аспарагін, аргінін або лізин; моносахариди, дисахариди та інші вуглеводні, у тому числі глюкоза, маноза або декстрини; хелатні реагенти, такі як етилендіамінтетраоцтова кислота (EDTA); гідроксицукри, такі як маніт або сорбіт; солеутворюючі протиіони, такі як іон натрію; та/або неіоногенні поверхнево-активні речовини, такі як TWEEN®, поліетиленгліколь ® (ПЕГ) та PLURONICS . "Ефективна кількість" сполуки (наприклад, Wnt антагоніст) являє собою кількість, достатню для виконання специфічно заданої цілі. "Ефективна кількість" може бути визначена емпірично та рутинним способом, у відношенні заданої цілі. Термін "терапевтично ефективна кількість" відноситься до кількості Wnt антагоністу, ефективної для "лікування" Wnt-опосередкованого розладу у суб'єкта або ссавця. У випадку раку, терапевтично ефективна кількість лікарського засобу може знижувати кількість ракових 12 UA 103918 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітин; зменшувати розмір пухлини; інгібувати (тобто уповільнювати до деякого ступеню або зупиняти) інфільтрацію ракових клітин у периферичних органах; інгібувати метастазування пухлини; інгібувати, до деякого ступеню, ріст пухлини; та/або полегшувати до деякого ступеню один або більшу кількість симптомів, пов'язаних з раком. Дивись визначення терміну "лікування" у цьому описі. У випадках, коли лікарський засіб може запобігати росту та/або знищувати існуючі ракові клітини, він може бути цитостатичним та/або цитотоксичним. "Хіміотерапевтичний агент" являє собою хімічну сполуку, яка є корисною у лікуванні раку. Приклади хіміотерапевтичних агентів включають такі як: алкілуючі агенти, такі як тіотепа та CYTOXAN® циклофосфамід; алкіл-сульфонати, такі як бусульфан, імпросульфан та піпосульфан; азиридини, такі як бензодопа, карбоквон, метуредопа, та уредопа; етиленіміни та метиламельаміни, включаючи альтретамін, триетиленемельамін, триетиленфосфорамід, триетиїлентіофосфорамід та триметилоломеламін; ацетогеніни (особливо буллатацин та буллатацинон); дельта-9-тетрагідроканнабінол (дронабінол, MARINOL®); бета-лапахон; лапахол; колхіцини; бетулінова кислота; камптотецин (включаючи синтетичний аналог топотекан (HYCAMTIN®), CPT-11 (іринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин, та 9-амінокамптотецин); бріостатин; каллістатин; CC-1065 (включаючи його синтетичні аналоги - адозелесин, карзелесин та бізелесин); подофілотоксин; подофілінова кислота; теніпозид; криптофіцини (особливо криптофіцин 1 та криптофіцин 8); доластатин; дуокарміцин (включаючи синтетичні аналоги, KW-2189 та CB1-TM1); елеутеробін; панкратистатин; саркодиктиїн; спонгістатин; азотистий іприт, такий як хлорамбуцил, хлорнафазин, холофосфамід, естрамустин, іфосфамід, мехлоретамін, мехлоретаміну оксид гідрохлорид, мелфалан, новембіхін, фенестерин, преднімустин, трофосфамід, урамустин; нітрозсечовини, такі як кармустин, хлорзотоцин, фотемустин, ломустин, німустин, та ранімнустин; антибіотики, такі як енедіінові антибіотики (наприклад, каліхеаміцин, особливо каліхеаміцин гама1I та каліхеаміцин омегаI1 (дивись, наприклад, Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); динеміцин, включаючи динеміцин A; еспераміцин; а також неокарзиностатин хромофор та зв'язані хромопротеїн енедіінові антибіотичні хромофори), аклациномізини, актиноміцин, аутраміцин, азасерін, блеоміцини, кактиноміцин, карабіцин, каміноміцин, карзинофілін, хромоміцини, дактиноміцин, даунорубіцин, деторубіцин, 6-діазо-5-оксо-Lнорлейцин, АДРІАМІЦИН® доксорубіцин (включаючи морфоліно-доксорубіцин, ціаноморфолінодоксорубіцин, 2-піроліно-доксорубіцин та деоксидоксорубіцин), епірубіцин, езорубіцин, ідарубіцин, марцелломіцин, мітоміцини, такі як мітоміцин C, мікофенольна кислота, ногаламіцин, олівоміцини, пепломіцин, потфіроміцин, пуроміцин, квеламіцин, родорубіцин, стрептонігрін, стрептозоцин, туберцидин, убенімекс, зиностатин, зорубіцин; анти-метаболіти, такі як метотрексат та 5-фторурацил (5-FU); аналоги фолієвої кислоти, такі як деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурину, такі як флударабін, 6-меркаптопурин, тіаміприн, тіогуанін; аналоги піримідину, такі як анцитабін, азацитидин, 6-азауридин, кармофур, цитарабін, дидеоксиуридин, доксифлуридин, еноцитабін, флоксуридин; андрогени, такі як калустерон, дромостанолон пропіонат, епітіостанол, мепітіостан, тестолактон; анти-адренали, такі як аміноглутетимід, мітотан, трилостан; поповнювач фолієвої кислоти, такий як фролінова кислота; ацеглатон; альдофосфамід глікозид; амінолевулінова кислота; енілурацил; амсакрин; бестрабуцил; бізантрен; едатраксат; дефофамін; демеколцин; діазиквон; елфомітин; елліптиніум ацетат; епотилон; етоглюцид; нітрат галію; гідроксисечовина; лентінан; лонідаінін; мейтанзиноїди, такі як мейтанзин та ансамітоцини; мітогуазон; мітоксантрон; мопіданмол; нітраерин; пентостатин; фенамет; пірарубіцин; лозоксантрон; 2-етилгідразид; прокарбазин; PSK® полісахаридний комплекс (JHS Natural Products, Eugene, Oreg.); разоксан; різоксин; сизофуран; спірогерманій; тенуазонова кислота; триазиквон; 2,2′,2″-трихлортриетиламін; трихотецени (особливо T-2 токсин, верракурин A, роридин A та ангуідин); уретан; віндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; мітобронітол; мітолактол; піпоброман; гацитозин; арабінозид ("Ara-C"); тіотепа; таксоїди, наприклад, TAXOL® паклітаксел (BristolMyers Squibb Oncology, Princeton, N.J.), ABRAXANE™ вільний від кремофору, альбумінспроектована наночасткова композиція паклітакселу (American Pharmaceutical Partners, Schaumberg, Ill.), та TAXOTERE® доксетаксел (Rhône-Poulenc Rorer, Antony, France); хлоранбуцил; гемцитабін (GEMZAR®); 6-тіогуанін; меркаптопурин; метотрексат; аналоги платини, такі як цисплатин та карбоплатин; вінбластин (VELBAN®); платина; етопозид (VP-16); іфосфамід; мітоксантрон; вінкристин (ONCOVIN®); оксаліплатин; лейкововін; вінорелбін (NAVELBINE®); новантрон; едатрексат; дауноміцин; аміноптерин; ібандронат; інгібітор топоізомерази RFS 2000; дифторметилорнітин (DMFO); ретиноїди, такі як ретиноєва кислота; капецитабін (XELODA®); фармацевтично прийнятні солі, кислоти або похідні будь-якого з описаних вище; а також комбінації двох або більшої кількості описаних вище, такі як CHOP, 13 UA 103918 C2 5 10 15 20 25 30 абревіатура для комбінованої терапії циклофосфаміду, доксорубіцину, вінкристину, та преднізолону, та FOLFOX, абревіатура для лікувального режиму з оксаліплатином (ELOXATIN™), об'єднаним з 5-FU та лейкововіном. Більш того, "хіміотерапевтичний агент" може включати проти-гормональні агенти, які діють для регулювання, зменшення, блокування, або інгібування ефектів гормонів, які можуть промотувати ріст раку, та часто знаходиться у формі системного, або загального лікування. Вони самі можуть бути гормонами. Приклади включають анти-естрогени та селективні модулятори естрогенових рецепторів (SERM), включаючи, наприклад, тамоксифен (включаючи NOLVADEX® тамоксифен), EVISTA® ралоксифен, дролоксифен, 4-гідрокситамоксифен, тріоксифен, кеоксифен, LY117018, онапрістон, та FARESTON® тореміфен; анти-прогестерони; даун-регулятори естрогенових рецепторів (ERD); агенти, які функціонують для пригнічення або зупинення роботи яєчників, наприклад, агоністи лейтинізуючого гормон-вивільнюючого гормону (LHRH), такі як LUPRON® та ELIGARD® лейпролід ацетат, госерелін ацетат, бусерелін ацетат та триптерелін; інші анти-андрогени, такі як флутамід, нілутамід та бікалутамід; та інгібітори ароматази, які інгібують фермент ароматазу, яка регулює вироблення естрогену у надниркових залозах, такі як, наприклад, 4(5)-імідазоли, аміноглутетимід, MEGASE® мегестрол ацетат, AROMASIN® екземестан, форместан, фадрозол, RIVISOR® ворозол, FEMARA® летрозол, та ARIMIDEX® анастрозол. Крім того, таке визначення хіміотерапевтичних агентів включає бісфосфонати, такі як клодронат (наприклад, BONEFOS® або OSTAC®), DIDROCAL® етидронат, NE-58095, ZOMETA® золедронова кислота/золедронат, FOSAMAX® алендронат, AREDIA® памідронат, SKELID® тилудронат, або ACTONEL® різедронат; а також троксацитабін (1,3-діоксолан нуклеозид цитозиновий аналог); антисмислові олігонуклеотиди, особливо ті, які інгібують експресію генів у сигнальних шляхах, залучених у проліферацію адгезивних клітин, такі як, наприклад, PKC-альфа, Raf, H-Ras, та рецептор епідермального фактору росту (EGF-R); вакцини, такі як THERATOPE® вакцина та вакцини генної терапії, наприклад, ALLOVECTIN® вакцина, LEUVECTIN® вакцина, та VAXID® вакцина; LURTOTECAN® інгібітор топоізомерази 1; ABARELIX® rmRH; лапатиніб дитозилат (ErbB-2 та EGFR подвійний тирозин-кіназний дрібноклітинний інгібітор, також відомий як GW572016); та фармацевтично прийнятні солі, кислоти або похідні будь-якого з описаних вище. Способи здійснення винаходу Даний винахід відноситься до композицій та способів модулювання Wnt сигнального шляху. У одному аспекті, даний винахід забезпечує сполуку, що має Формулу (1) або (2): Z Y R1 R2 R3 N O X3 1 X X2 B E X4 R1 R2 N O A1 (1) R3 X3 X1 X2 E X4 A2 (2) 35 або її фізіологічно прийнятну сіль, у якій: кільце E являє собою необов'язково заміщений 1 2 арил або гетероарил; A та A незалежно являють собою C1-5гетероцикл, хінолініл, або гетероарил, вибраний з групи: 40 1 45 2 де будь-який гетероцикл радикалу A та A може бути необов'язково заміщений за 10 допомогою –LC(O)R ; B являє собою бензотіазоліл, хінолініл або ізoхінолініл, кожен з яких 6 1 2 3 4 необов'язково заміщений за допомогою 1-3 R груп; X , X , X та X незалежно являють собою 7 CR або N; Y являє собою феніл або 5-6-членний гетероарил, що містить 1-2 гетероатоми, 14 UA 103918 C2 5 10 15 20 25 вибрані з N, O та S; Z являє собою арил, C 1-5 гетероцикл, або 5-6- членний гетероарил, що містить 1-2 гетероатоми, вибрані з N, O та S; кожен Y та Z необов'язково заміщений за 6 1 5 2 3 допомогою 1-3 R груп; R та R незалежно являють собою H або C1-6 алкіл; R та R незалежно 4 являють собою H, C1-6 алкіл або гало групу; R являє собою гало групу, ціано групу, C 1-6алкокси групу, або C1-6 алкіл необов'язково заміщений за допомогою гало групи, алкокси групи або аміно 6 10 10 10 групи; R являє собою водень, гало групу, C1-6алкокси групу, –S(O)2R , –C(O)OR , –C(O)R , – 8 9 C(O)NR R , C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл, кожен з яких може бути необов'язково заміщений за допомогою гало групи, аміно групи, гідроксилу, алкокси групи або ціано групи; 8 9 10 10 8 9 10 10 гало групу, CN, -L-W, NR R , -L-C(O)R , -L-C(O)OR , -L-C(O)NR R , OR ; -L-S(O)2R або –L8 9 7 10 S(O)2NR R ; R являє собою H, гало групу, C1-6 алкокси групу, -L-S(O)2R , C1-6 алкіл, необов'язково заміщений за допомогою гало групи, аміно групи, гідроксилу, алкокси групи або 8 9 10 8 9 10 10 8 9 8 9 ціано групи; NR R , -L-C(O)R , -L-C(O)NR R , OR ; -L-S(O)2R або –L-S(O)2NR R ; R та R незалежно являють собою H, -L-W, або C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл, кожен з яких може бути необов'язково заміщений за допомогою гало групи, аміно групи, гідроксилу, алкокси групи 8 9 або ціано групи; або R та R разом з атомами, до яких вони приєднані, можуть утворювати 10 кільце; R являє собою H, -L-W, або C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл, кожен з яких може бути необов'язково заміщений за допомогою гало групи, аміно групи, гідроксилу, алкокси групи або ціано групи; L являє собою зв'язок або (CR2)1-4, де R являє собою H або C1-6 алкіл; W являє собою C3-7циклоалкіл, C1-5гетероцикл, арил або гетероарил; m являє собою 0-4; n являє собою 0-3; та p являє собою 0-2. У іншому аспекті, Y являє собою феніл, тіазоліл, піридиніл, піридазиніл, піримідиніл або 6 6 піразиніл, кожен з яких необов'язково заміщений за допомогою 1-2 R груп та R приймає значення, описані у розкритті даного винаходу. У іншому аспекті, Z являє собою феніл, піридиніл, піридазин, піримідин, піразин, піперазиніл, піперидиніл, морфолініл, піразол або 1,2,3,6-тетрагідропіридин, кожен з яких необов'язково 6 6 заміщений за допомогою 1-2 R груп та R приймає значення, описані у розкритті даного винаходу. 1 2 У іншому аспекті, A та A незалежно являють собою морфолініл, піперазиніл, хінолініл, N S(O)0-2 , або гетероарил, вибраний з групи: 30 1 35 R 1 R 2 R3 N S R6 1 40 2 де будь-який гетероцикл радикалу A та A може бути необов'язково заміщений за 4 допомогою –C(O)CH3; R , m, n та p приймають значення, описані у розкритті даного винаходу. Інший аспект являє собою сполуку Формули (3): 2 3 1 O N 2 3 4 2 6 X3 X1 X2 E X4 A2 (3) у якій R , R , R , X , X , X , X , A та R приймають значення, описані у розкритті даного винаходу. Інший аспект являє собою сполуку Формули (4): 15 UA 103918 C2 R1 R2 N S R3 X3 O N X1 Z 1 5 2 3 1 2 3 4 X2 E X4 A1 (4) 1 у якій R , R , R , X , X , X , X , A та Z приймають значення, описані у розкритті даного винаходу. У іншому аспекті, кільце E являє собою феніл, піридил або піримідиніл, кожен з яких 7 необов'язково заміщений за допомогою R . 7 10 У іншому аспекті, R являє собою H, гало групу, ціано групу, C1-6алкокси групу, -S(O)2R , або необов'язково галогенований C1-6 алкіл. Інший аспект являє собою сполуку Формули (5): 10 R1 R2 N 6 X5 Z X X8 R3 X3 O X7 X1 E X4 X2 A1 (5) N S(O)0-2 1 у якій A являє собою піперазиніл, заміщений за допомогою –C(O)CH3, або вибраний з: 15 1 2 20 25 N 30 3 4 кільце E являє собою феніл або один з X , X , X та X являє собою N та інші являють собою 5 6 7 8 11 CR ; один з X , X , X та X являє собою N та інші являють собою CR ; Z являє собою 6членний гетероцикл або 6-членний гетероарил, кожен з яких містить 1-2 азотні гетероатоми та 6 1 2 3 кожен з яких необов'язково заміщений за допомогою 1-2 R груп; R , R та R являють собою H 4 6 або C1-6 алкіл; R та R незалежно являють собою водень, ціано групу, C 1-6алкокси групу, – 10 8 9 10 10 S(O)2R , –C(O)NR R , -L-C(O)R , -L-C(O)OR , C1-6 алкіл, необов'язково заміщений за 10 допомогою гало групи, C2-6 алкенілу або C2-6 алкінілу; R являє собою C1-6 алкіл або -L-W; L являє собою зв'язок або (CR2)1-4, де R являє собою H або C1-6 алкіл; W являє собою C37 11 незалежно являють собою H, гало групу, ціано групу, C 1-6алкокси групу, 7циклоалкіл; R та R 10 S(O)2R , або необов'язково галогенований C1-6 алкіл; та m, n та p незалежно являють собою 02. 1 У іншому аспекті, A являє собою піперазиніл, заміщений за допомогою –C(O)CH3, 7 S(O)0-2 або вибраний з: 16 UA 103918 C2 5 та m являє собою 0-2; n являє собою 0-2; та p являє собою 0-1. 1 2 3 4 7 У подальшому аспекті, один з X , X , X та X являє собою N та інші являють собою CR . Інший аспект являє собою сполуку Формули (6): R1 X6 X R2 R3 N 5 X7 O X3 X8 Z X1 E X2 X4 X9 (R4)m N 1 10 15 20 25 30 35 40 2 3 4 5 6 7 (6) 8 у якій X , X , X та X вибирають з N та CR7; один з X , X , X та X являє собою N та інші 9 являють собою CH; X вибирають з N та CH; Z вибирають з таких як: феніл, піразиніл, піридиніл та піперазиніл; де кожен феніл, піразиніл, піридиніл або піперазиніл радикалу Z є необов'язково 6 1 2 3 4 заміщеним за допомогою R групи; R , R та R являють собою водень; m являє собою 1; R 6 вибирають з таких як: водень, гало група та метил; R вибирають з таких як: водень, гало група 10 10 7 та -C(O)R ; де R являє собою метил; та R вибирають з таких як: водень, метил та трифторметил. 1 2 3 4 6 У іншому аспекті, R , R та R являють собою H; та R та R незалежно вибирають з водню, гало групи, метилу та -C(O)CH3. У кожній з описаних вище формул, будь-які асиметричні атоми вуглецю можуть бути присутні у (R)-, (S)- або (R, S)-конфігурації. Таким чином, сполуки можуть бути присутніми у вигляді суміші ізомерів або у вигляді чистих ізомерів, наприклад, у вигляді чистих енантіомерів або діастереомерів. Даний винахід додатково охоплює можливі таутомери сполук даного винаходу. Даний винахід також включає всі прийнятні ізотопні варіанти сполук даного винаходу, або їх фармацевтично прийнятні солі. Ізотопний варіант сполуки даного винаходу або його фармацевтично прийнятна сіль визначається як варіант, у якому щонайменше один атом заміщений на атом, що має такий же атомний номер, але атомну масу, що відрізняється від атомної маси, що звичайно виявляється у природі. Приклади ізотопів, які можуть бути включені у сполуки даного винаходу та їх фармацевтично прийнятні солі включають, не обмежуючись 2 3 11 13 14 15 17 18 наведеними, ізотопи водню, вуглецю, азоту та кисню, такі як H, H, C, C, C, N, O, O, 35 18 36 123 S, F, Cl та I. Певні ізотопні варіанти сполук даного винаходу та їх фармацевтично 3 14 прийнятні солі, наприклад, ті, у яких радіоактивний ізотоп, такий як H або C, є включеним, є корисними у дослідженнях лікарських засобів та/або розподілення субстрату у тканині. 2 3 14 У певних прикладах, H, H та C ізотопи можуть бути використані для легкості їх одержання 2 та визначення. У інших прикладах, заміщення ізотопами, такими як H, може забезпечити одержання деяких терапевтичних переваг, що приводять до більшої метаболічної стабільності, таких як збільшений період in vivo напіввиведення або знижених потреб дози. Ізотопні варіанти сполук даного винаходу або їх фармацевтично прийнятних солей в основному можуть бути одержані за звичайними процедурами, використовуючи відповідні ізотопні варіанти прийнятних реагентів. Ізотопні варіанти сполук мають потенціал змінювати метаболічний шлях сполуки та/або робити невеликі зміни у фізичних властивостях, таких як гідрофобність, та подібні. Ізотопний варіант має потенціал покращувати ефективність та безпеку, покращувати біодоступність та період напіввиведення, змінювати зв'язування білку, змінювати локалізацію в 17 UA 103918 C2 5 10 15 20 25 30 35 40 45 50 55 60 організмі, збільшувати співвідношення активних метаболітів та/або зменшувати утворення реакційноздатних або токсичних метаболітів. Даний винахід також забезпечує спосіб інгібування Wnt-сигналювання у клітині, що включає контактування клітини з ефективною кількістю Wnt антагоністу. У одному варіанті втілення, клітина міститься всередині ссавця, та введена кількість являє собою терапевтично ефективну кількість. У одному варіанті втілення, інгібування Wnt сигналювання додатково приводить до інгібування росту клітини. У додатковому варіанті втілення, клітина являє собою ракову клітину. Інгібування клітинної проліферації вимірюють, використовуючи способи, відомі спеціалісту, кваліфікованому у даній галузі техніки. Наприклад, підходящим аналізом для вимірювання клітинної проліферації є набір CellTiter-Glo™ Luminescent Cell Viability Assay, який є комерційно доступним від компанії Promega (Madison, Wis.). Це дослідження визначає кількість життєздатних клітин у культурі базуючись на кількісному визначенні присутніх АТФ, яке є показником метаболічно активних клітин. Дивись Crouch et al (1993) J. Immunol. Meth. 160:81-88, U.S. Pat. No. 6,602,677. Це дослідження може бути проведене у 96- або 384-лунковому планшеті, що дає можливість зчитувати їх у високопродуктивному скринінгу (HTS). Дивись Cree et al. (1995) AntiCancer Drugs 6:398-404. Процедура дослідження включає додавання одного реагенту (CellTiter-Glo® реагент) безпосередньо до культивованих клітин. Це приводить до лізису клітин та створення люмінесцентного сигналу, що викликається люциферазною реакцією. Люмінесцентний сигнал є пропорційним кількості присутніх АТФ, яка є безпосередньо пропорційною кількості життєздатних клітин у культурі. Дані можуть бути записані за допомогою люмінометру або CCD фотокамери. Дані люмінесценції виражають як відносні світлові одиниці (RLU). Інгібування клітинної проліферації також може бути виміряне, використовуючи дослідження колонієутворення, відомі у даній галузі техніки. Більш того, даний винахід забезпечує способи лікування Wnt-опосередкованого розладу у ссавця, що страждає від нього, що включає введення ссавцю терапевтично ефективної кількості Wnt антагоністу. У одному варіанті втілення, цей розлад являє собою клітино-проліферативний розлад, пов'язаний з аберантною, наприклад, підвищеною, експресією активності Wnt сигналювання. У іншому варіанті втілення, цей розлад є результатом підвищеної експресії Wnt білку. У ще одному іншому варіанті втілення, клітинно-проліферативний розлад являє собою рак, такий як, наприклад, рак кишечнику, колоректальний рак, рак молочної залози, рак, пов'язаний з різними розладами, що стосуються HSC (гематопоетичних стовбурових) клітин, такий як лейкемії та різні інші види раку, пов'язані з кров'ю, та рак, пов'язаний з нейрональними проліферативними розладами, включаючи пухлини мозку, такі як гліоми, астроцитоми, менінгіоми, шванноми, пухлини гіпофізу, примітивні нейроектодермальні пухлини (PNET), медулобластоми, краніофарінгіоми, пухлини шишковидного тіла, та раки шкіри, включаючи базально-клітинний рак та плоскоклітинну карциному. Лікування клітинно-проліферативного розладу шляхом введення Wnt антагоністу приводить до помітного та/або вимірного зниження у або відсутності одного або більшої кількості з наступних: зменшення у кількості ракових клітин або відсутність ракових клітин; зменшення у розмірі пухлини; інгібування інфільтрації ракових клітин у периферичні органи, включаючи розповсюдження раку у м'які тканини та кістки; інгібування метастазування пухлин; інгібування, до деякого ступеню, росту пухлини; та/або полегшення, до деякого ступеню, одного або більшої кількості симптомів, пов'язаних із специфічним раком; знижена хворобливість та смертність, та покращення у якості життя. У тих випадках, коли Wnt антагоніст може запобігати росту та/або знищувати існуючі ракові клітини, він може бути цитостатичним та/або цитотоксичним. Зменшення цих ознак або симптомів також може відчуватися пацієнтом. Описані вище параметри оцінки успішного лікування та покращення у хворобі є легко вимірними за допомогою рутинних процедур, відомих лікарю. Для терапії раку, ефективність може бути виміряна, наприклад, шляхом оцінювання часу до прогресування захворювання (TDP) та/або вимірювання ефективності терапії (RR). Метастазування може бути визначене за допомогою визначення стадії захворювання та за допомогою сканування кісток скелету та досліджень рівня кальцію та інших ферментів для визначення розповсюдження у кістках. CT скани також можуть бути зроблені для того, щоб побачити розповсюдження на ниркові лоханки та лімфовузли у цій області. Рентгенографію грудної клітки та вимірювання рівнів печінкових ферментів за допомогою відомих способів використовують для виявлення метастаз у легенях та печінці, відповідно. Інші рутинні способи для моніторингу хвороби включають трансректальне ультразвукове дослідження (TRUS) та трансректальну пунційну біопсію (TRNB). У специфічному варіанті втілення, введення Wnt антагоністу знижує пухлинну масу (наприклад, знижує розмір або важкість раку). У ще одному іншому специфічному варіанті втілення, введення Wnt антагоністу знищує рак. 18UA 103918 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармакологія та застосування Даний винахід відноситься до композицій та способів модулювання Wnt сигнального шляху. У певних варіантах втілення, даний винахід забезпечує композиції та способи, які інгібують Wnt сигнальну трансдукційну активність шляхом модулювання активації Wnt шляху, таким чином, лікуючи, діагностуючи, запобігаючи появі та/або полегшуючи симптоми розладів, пов'язаних з Wnt сигналюванням. Сучасна концепція для розробки терапії для розладів, пов'язаних з Wnt сигналювання, базується на націлюванні на β-cat або компоненти Wnt шляху, що знаходяться нижче β-cat. Однак, нещодавні дослідження показують, що інгібування компоненту позаклітинної взаємодії ліганд-рецептор є ефективним у зменшенні онкогенності, навіть незважаючи на те, що явище, що ініціює Wnt сигналювання, може відбуватися нижче. Більше того, трансфекція недіючого frizzled рецептору (Frz7 позаклітинна частину вірусу) у клітинну лінію карциноми (SK-CO-1) відновлює нормальний β-катеніновий фенотип. Ця клітинна лінія має активне Wnt сигналювання −/− завдяки гомозиготній APC мутації. Такі клітини також не показують утворення пухлини при переносі in vivo. Vincan et al., Differentiation 2005; 73: 142-153. Це показує, що інгібування Wnt сигналювання на позаклітинному рівні може регулювати у бік зниження Wnt сигналювання, що є результатом активації компоненту нижнього позаклітинного Wnt сигнального шляху. Це додатково показує, що інгібітори Wnt сигнального шляху можуть бути використані у лікуванні будь-якого Wnt-опосередкованого розладу, незалежно від певного способу, у який Wnt сигналювання було активоване. Розлади, пов'язані з Wnt сигнальною активністю Розрегулювання Wnt сигнального шляху може бути спричинене соматичними мутаціями у генах, кодуючи різні компоненти Wnt сигнального шляху. Наприклад, аберантна Wnt сигнальна активність пов'язана з надекспресією Wnt ліганду при недрібноклітинному раку легенів (NSCLC) [You et al., Oncogene 2004; 23: 6170-6174], хронічному лімфолейкозі (CLL) [Lu et al., Proc. Natl. Acad. Sci. USA 2004; 101: 3118-3123], раку шлунку [Kim et al., Exp. Oncol. 2003; 25: 211-215; Saitoh et al., Int. J. Mol. Med. 2002; 9: 515-519], плоскоклітинній карциномі голови та шиї (HNSCC) [Rhee et al., Oncogene 2002; 21: 6598-6605], колоректальному раку [Holcombe et al., J. Clin. Pathol—Mol. Pathol. 2002; 55: 220-226], раку яєчників [Ricken et al., Endocrinology 2002; 143: 2741-2749], базально-клітинному раку (BCC) [Lo Muzio et al., Anticancer Res. 2002; 22: 565-576] та раку молочної залози. Більше того, зниження різних регуляторних молекул Wnt ліганду, таких як sFRP та WIF-1, пов'язане з раком молочної залози [Klopocki et al., Int. J. Oncol. 2004; 25: 641649; Ugolini et al., Oncogene 2001; 20: 5810-5817; Wissmann et al., J. Pathol 2003; 201: 204-212], раком сечового міхура [Stoehr et al., Lab Invest. 2004; 84: 465-478; Wissmann et al., supra], мезотеліомою [Lee et al., Oncogene 2004; 23: 6672-6676], колоректальним раком [Suzuki et al., Nature Genet. 2004; 36: 417-422; Kim et al., Mol. Cancer Ther. 2002; 1: 1355-1359; Caldwell et al., Cancer Res. 2004; 64: 883-888], раком передміхурової залози [Wissman et al., supra], NSCLC [Mazieres et al., Cancer Res. 2004; 64: 4717-4720], та раком легенів [Wissman et al., вище]. Аберантне Wnt сигналювання, що є результатом надекспресії різних компонентів комплексу рецептору Frz-LRP, також пов'язане з певними видами раку. Наприклад, LRP5 надекспресія пов'язана з остеосаркомою [Hoang et al., Int. J. Cancer 2004; 109: 106-111], в той час як Frz надекспресія пов'язана з раками, такими як рак передміхурової залози [Wissmann et al., вище], HNSCC [Rhee et al., Oncogene 2002; 21: 6598-6605], колоректальний рак [Holcombe et al., вище], рак яєчнику [Wissman et al., вище], рак стравоходу [Tanaka et al., Proc. Natl. Acad. Sci. USA 1998; 95: 10164-10169] та рак шлунку [Kirikoshi et al., Int. J. Oncol. 2001; 19: 111-115]. Крім того, надекспресія компонентів Wnt сигнального шляху, таких як Dishevelled, пов'язана з раками, такими як рак передміхурової залози [Wissman et al, вище], рак молочної залози [Nagahata et al., Cancer Sci. 2003; 94: 515-518], мезотеліома [Uematsu et al., Cancer Res. 2003; 63: 4547-4551] та рак шийки матки [Okino et al, Oncol Rep. 2003; 10: 1219-1223]. Frat-1 надекспресія пов'язана з раками, такими як рак підшлункової залози, стравоходу, шийки матки, молочної залози та шлунку. [Saitoh et al., Int. J. Oncol. 2002; 20: 785-789; Saitoh et al., Int. J. Oncol 2001; 19: 311-315]. Axin мутації з втратою функції (LOF) пов'язані з печінково-клітинним раком [Satoh et al., Nature Genet. 2000; 24: 245-250; Taniguchi et al., Oncogene 2002; 21: 4863-4871] та медулобластомою [Dahmen et al., Cancer Res. 2001; 61: 7039-7043; Yokota et al., Int. J. Cancer 2002; 101: 198-201]. Більше того, множина раків пов'язана з активуванням β-катеніну через порушення "деструкційного комплексу", таке як мутації з набуттям функцій у β-катеніні або мутації з втратою функцій у APC. Зниження у розкладанні β-катуніну приводить до більших кількостей функціонального β-катеніну у клітині, що потім спричиняє підвищену транскрипцію цільових генів, що приводить до аберантної клітинної проліферації. Наприклад, мутації у гені, що кодує βкатенін (тобто CTNNB1), пов'язані з раками, такими як рак шлунку [Clements et al., Cancer Res. 19 UA 103918 C2 5 10 15 20 25 30 35 40 45 50 55 60 2002; 62: 3503-3506; Park et al., Cancer Res. 1999; 59: 4257-4260], коло ректальний рак [Morin et al., Science 1997; 275: 1787-1790; Ilyas et al., Proc. Natl. Acad. Sci. USA 1997; 94: 10330-10334], шлунково-кишковий карциноїд [Fujimori et al., Cancer Res. 2001; 61: 6656-6659], рак яєчнику [Sunaga et al., Genes Chrom. Cancer 2001; 30: 316-321], легенева аденокарцинома [Sunaga et al., вище], рак ендометрію [Fukuchi et al., Cancer Res. 1998; 58: 3526-3528; Kobayashi et al., Japan. J. Cancer Res. 1999; 90: 55-59; Mirabelli-Primdahl et al., Cancer Res. 1999; 59: 3346-3351], печінковоклітинний рак [Satoh et al., supra.; Wong et al., Cancer 2001; 92: 136-145], гепатобластома [Koch et al., Cancer Res. 1999; 59: 269-273], медулобластома [Koch et al., Int. J. Cancer 2001; 93: 445449], рак підшлункової залози [Abraham et al., Am. J. Pathol 2002; 160: 1361-1369], рак щитовидної залози [Garcia-Rostan et al., Cancer Res. 1999; 59: 1811-1815; Garcia-Rostan et al., Am. J. Pathol 2001; 158: 987-996], рак передміхурової залози [Chesire et al., Prostate 2000; 45: 323-334; Voeller et al., Cancer Res. 1998; 58: 2520-2523], меланома [Reifenberger et al., Int. J. Cancer 2002; 100: 549-556], піломатрікома [Chan et al., Nature Genet. 1999; 21: 410-413], пухлина Вільмса [Koesters et al., J. Pathol 2003; 199: 68-76], панкреатобластоми [Abraham et al., Am. J. Pathol 2001; 159: 1619-1627], ліпосаркоми [Sakamoto et al., Arch. Pathol. Lab Med. 2002; 126: 1071-1078], ювенільні назофарінгеальні ангіофіброми [Abraham et al., Am. J. Pathol. 2001; 158: 1073-1078], десмоїд [Tejpar et al., Oncogene 1999; 18: 6615-6620; Miyoshi et al., Oncol. Res. 1998; 10: 591-594], синовіальна саркома [Saito et al., J. Pathol 2000; 192: 342-350]. При цьому мутації з втратою функцій пов'язані з раками, такими як коло ректальний рак [Fearon et al., Cell 1990; 61: 759-767; Rowan et al., Proc. Natl. Acad. Sci. USA 2000; 97: 3352-3357], меланома [Reifenberger et al., Int. J. Cancer 2002; 100: 549-556; Rubinfeld et al., Science 1997; 275: 1790-1792], медулобластома [Koch et al., Int. J. Cancer 2001; 93: 445-449; Huang et al., Am. J. Pathol 2000; 156: 433-437] та десмоїди [Tejpar et al., Oncogene 1999; 18: 6615-6620; Alman et al., Am J. Pathol. 1997; 151: 329-334]. Інші розлади, пов'язані з аберантним Wnt сигналюванням, включають, не обмежуючись наведеними, остеопороз, остеоартрит, полікистоз нирок, діабет, шизофренію, хворобу судин, серцеву хворобу, неонкогенні проліферативні захворювання, та нейродегенеративні захворювання, такі як хвороба Альцгеймера. Аберантне Wnt сигналювання при раках та лейкемії Активація аберантного Wnt шляху, через стабілізацію β-катеніну, відіграє головну роль у онкогенезі багатьох колоректальних карцином. Згідно з оцінками, 80 % колоректальних карцином (CRCs) мають інактивуючі мутації у пухлинному репресорі APC, що дозволяє одержати безперервне Wnt сигналювання. Більш того, існує зростаюча сукупність доказів, які передбачають, що активація Wnt-шляху може бути залучена у меланому, рак молочної залози, печінки, легені, рак шлунку та інші види раку. Нерегульована активація Wnt сигнального шляху також являє собою попередник до розвитку лейкемії. Існує експериментальний доказ того, що онкогенний ріст як мієлоїдної, так і лімфоїдної лінії диференціювання залежить від Wnt сигналювання. Wnt сигналювання залучене у регулювання як хронічної, так і гострої форми мієлоїдної лейкемії. Гранулоцит-макрофагальні попередники (GMP-и) від пацієнтів з хронічною мієлогенною лейкемією та клітини бластного кризу від пацієнтів, стійких до терапії, показують активоване Wnt сигналювання. Більше того, інгібування β-катеніну через ектопічне експресування Axin знижує здатність до реінокуляції лейкемічних клітин in vitro, передбачаючи, що попередники хронічної мієлогенної лейкемії залежать від Wnt сигналювання що стосується росту та відновлення. Wnt надекспресія також приводила до того, що GMP-и набували подібних до стовбурових клітин властивостей довготривалого самооновлення, підтримуючи гіпотезу про те, що Wnt сигналювання є важливим для нормального розвитку ліній диференціювання клітин крові, але що аберантне Wnt сигналювання приводить до трансформації клітин-попередників. Нещодавні дослідження також показують, що на лімфоїдні неоплазії також може впливати Wnt сигналювання. Wnt-16 надекспресується у клітинних лініях лейкемічних B-клітинпопередників, що несуть E2A-PbX транслокацію, передбачаючи, що аутокринна Wnt активність може робити свій внесок у онкогенез. McWhirter, et al., Proc. Natl. Acad. Sci. USA 96: 11464-11469 (1999). Роль Wnt сигналювання у рості та виживанні нормальних B-клітин-попередників додатково підтримує цю точку зору. Reya et al., Immunity 13: 15-24 (2000); Ranheim et al., Blood 105: 2487-2494 (2005). Аутокринна залежність від Wnt також запропонована для регулювання росту множинної мієломи, раку кінцево диференційованих B-клітин. Derksen et al., Proc. Natl. Acad. Sci. USA 101: 6122-6127 (2004). Також знайдено, що первинні мієломи та мієломні клітинні лінії експресуються стабілізованими (тобто незалежно від деструкційного комплексу). Хоча не присутньо ніяких мутацій у компонентах Wnt сигналювання, надекспресія декількох компонентів, включаючи Wnt-5A та Wnt-10B, передбачає, що пухлинна залежність та самооновлення раку 20 UA 103918 C2 5 10 15 20 25 30 35 40 45 50 55 60 необов'язково залежить від мутацій, що виявляються у компонентах Wnt сигнального шляху, але скоріше тільки від конститутивної активації самого шляху. Переміщення самооновлюючих, плюрипотенційних стовбурових клітин до мієлоїдних попередників супроводжується знищуючою регуляцією Wnt сигналювання. Reya et al, Nature 423: 409-414 (2003). Аналогічно, стабільна експресія β-катеніну у лімфоїдних попередниках відновила множинні диференціацій ні характеристики, хоча таким клітинам не вистачає маркерів, що, як правило, пов'язані з будь-яким типом клітин. Baba et al, Immunity 23: 599-609 (2005). Аберантне Wnt сигналювання при нервових розладах Також помічено, що активація Wnt сигналювання через β-катенін може підвищити швидкість проходження циклу та розмноження нервових попередників, та що втрата такого сигналювання може приводити до втрати компартменту попередника. Chenn et al., Science 297: 365-369 (2002); Zechner et al., Dev. Biol. 258: 406-418 (2003). Так само як нормальна активація Wnt сигналювання може самооновлювати нервові стовбурові клітини, активація аберантного Wnt шляху може бути онкогенною у нервовій системі. Експериментальний доказ, що підтримує цей висновок, являє собою відкриття, що медулобластома, педіатрична мозкова пухлина мозочку, містить мутації як у β-катеніні, так і у Axin—таким чином, передбачаючи, що медулобластоми виникають з примітивних попередників, які стають трансформованими у відповідь на неконтрольоване Wnt сигналювання. Zurawel et al., Cancer Res. 58: 896-899 (1998); Dahmen et al., Cancer Res. 61: 7039-7043 (2001); Baeza et al., Oncogene 22: 632-636 (2003). Таким чином, переконливо вказано на те, що інгібування Wnt сигналювання Wnt антагоністами даного винаходу може бути ефективним терапевтичним засобом у лікуванні різних нервових проліферативний розладів, включаючи пухлини мозку, такі як гліоми, астроцитоми, менінгіоми, шванноми, пухлини гіпофізу, примітивні нейроектодермальні пухлини (PNET), медулобластоми, краніофарінгіома, пухлини шишковидного тіла, та не злоякісні нейрофіброматози. Wnt сигналювання у кровотворних стовбурових клітинах Кровотворні стовбурові клітини забезпечують появу дорослих клітин крові системи кровообігу у процесі одержання росток-комітованих клітин-попередників з поліфункціональних кровотворних стовбурових клітин (HSC). Також зрозуміло, що Wnt сигналювання робить свій внесок у самооновлення та підтримання HSC клітин, та що дисфункціональне Wnt сигналювання відповідальне за різні розлади, що походять від HSC клітин, такі як лейкемії та різні інші пов'язані з кров'ю види раку. Reya et al., Nature 434: 843-850 (2005); Baba et al., Immunity 23: 599-609 (2005); Jamieson et al., N. Engl. J. Med. 351(7): 657-667 (2004). Wnt сигналювання у нормі знижене, так як стовбурові клітини перетворюються у комітовані мієлоїдні клітини-попередники. Reya et al., Nature 423: 409-414 (2003). Не тільки є Wnt ліганди самі, одержані за допомогою HSC клітин, але Wnt сигналювання є також активним, таким чином, передбачаючи аутокринне або паракринне регулювання. Rattis et al., Curr. Opin. Hematol. 11: 88-94 (2004); Reya et al., Nature 423: 409-414 (2003). Крім того, як βкатенін, так і Wnt3a, промотують самооновлення мишачих HSC клітин та клітин-попередників, в той час як застосування Wnt-5A до людських кровотворних попередників промотує розмноження недиференційованих попередників in vitro. Reya et al., supra.; Willert et al., Nature 423: 448-452 (2003); Van Den Berg et al., Blood 92: 3189-3202 (1998). Окрім HSC клітин, зрозуміло, що ембріональні стовбурові клітини, епідермальні стовбурові клітини та епітеліальні стовбурові клітини відповідають або залежать від Wnt сигналювання для підтримання у недиференційованому, проліферуючому стані. Willert et al., вище; Korinek et al., Nat. Genet. 19: 379-383 (1998); Sato et al., Nat. Med. 10: 55-63 (2004); Gat et al., Cell 95: 605-614 (1998); Zhu et al., Development 126: 2285-2298 (1999). Тому інгібування Wnt сигналювання Wnt антагоністами даного винаходу може бути терапевтичним засобом у лікуванні розладів, що є результатом дисфункціонального кровотворення, таких як лейкемії та різні пов'язані з кров'ю види раку, такі як гостра, хронічна, лімфоїдна та мієлогенна лейкемії, мієлодисплатичний синдром та мієлопроліферативні розлади. Вони включають мієлому, лімфому (наприклад, ходжкінську та неходжкінську) хронічну та не прогресуючу анемію, прогресуючу та симптоматичну недостатності кров'яних клітин, справжню поліцитемію, есенціальну або первинну тромбоцитемію, ідіопатичний мієлофіброз, хронічний мієломоноцитарний лейкоз (CMML), лімфому мантійної тканини, шкірну T-клітинну лімфому, макроглобулінемію Вальденстрема. Wnt сигналювання при старінні Wnt сигнальний шлях також може грати критичну роль у старінні та пов'язаних з віком розладах. Як описано у Brack A S, et al., Science, 317(5839):807-10 (2007), м'язові стовбурові клітини зі старих мишей, як видно, перетворюються від міогенного до фіброгенного клітинного 21 UA 103918 C2 5 10 15 20 25 30 35 40 45 50 55 60 покоління, коли вони починають проліферувати. Це перетворення пов'язане з підвищенням у активності класичного Wnt сигнального шляху у старих міогенних клітинах-попередниках та може бути пригнічене за допомогою Wnt інгібіторів. Крім того, компоненти сироватки від старих мишей пов'язані з Frizzled білками та можуть обумовлювати підвищене Wnt сигналювання у старих клітинах. ВведенняWnt3A у молодий регенеруючий м'яз знизило проліферацію та підвищило відкладання сполучної тканини. Wnt сигнальний шлях додатково залучений у процес старіння у дослідженнях, використовуючи Клото мишачу модель прискореного старіння, у якій визначено, що Клото білок фізично взаємодіяв з та інгібував Wnt білки. Liu H, et al., Science, 317(5839): 803-6 (2007). У модельній клітинній культурі, Wnt-Клото взаємодія приводить до пригнічення Wnt біологічної активності, в той час як тканини та органи з тварин з недостатністю Клото показали доказ підвищеного Wnt сигналювання. Введення та фармацевтичні композиції Загалом, сполуки даного винаходу будуть вводитися у терапевтично ефективних кількостях через будь-який із звичайних та прийнятних способів, відомих у даній галузі техніки, або окремо або у комбінації з одним або більшою кількістю терапевтичних агентів. Терапевтично ефективна кількість може змінюватися у широких межах в залежності від серйозності хвороби, віку та відносного стану здоров'я суб'єкта, ефективності використовуваної сполуки та інших факторів. Загалом, показано, що задовільні результати отримують систематично при щоденних дозах від приблизно 0,03 до 2,5 мг/кг маси тіла. Показана щоденна доза у великого ссавця, наприклад, людей, знаходиться у інтервалі від приблизно 0,5 мг до приблизно 100 мг, при зручному введенні, наприклад, у розділених дозах до чотирьох разів на день або у формі уповільненого вивільнення. Прийнятні одиничні лікарські форми для перорального введення включають від приблизно 1 до 50 мг активного інгредієнта. Сполуки даного винаходу можуть бути введені як фармацевтичні композиції будь-яким зручним шляхом, зокрема ентерально, наприклад, перорально, наприклад, у формі таблеток або капсул, або парентерально, наприклад, у формі ін'єкційних розчинів або суспензій, місцево, наприклад, у формі лосьйонів, гелів, мазей або кремів, або у назальній формі або у формі супозиторію. Фармацевтичні композиції, що включають сполуку даного винаходу у вільній формі або у формі фармацевтично прийнятної солі у поєднанні з щонайменше одним фармацевтично прийнятним носієм або розріджувачем, можуть бути вироблені звичайним способом шляхом змішування, гранулювання або нанесення покриття. Наприклад, пероральні композиції можуть являти собою таблетки або желатинові капсули, що включають активний інгредієнт разом з такими як: a) розріджувачі, наприклад, лактоза, декстроза, сахароза, маніт, сорбіт, целюлоза та/або гліцин; b) любриканти, наприклад, кремнезем, тальк, стеаринова кислота, її магнієва або кальцієва сіль та/або поліетиленгліколь; для таблеток також c) зв'язуючі речовини, наприклад, алюмосилікат магнію, крохмальна паста, желатин, трагакант, метилцелюлоза, карбоксиметилцелюлоза натрію та/або полівінілпіролідон; при бажанні, d) дезінтегранти, наприклад, крохмалі, агар-агар, альгінова кислота або її натрієва сіль, або шипучі суміші; та/або e) абсорбенти, барвники, ароматизатори та підсолоджувачі. Ін'єкційні композиції можуть являти собою водні ізотонічні розчини або суспензії, та супозиторії можуть бути одержані з жирних емульсій або суспензій. Композиції можуть бути стерилізовані та/або можуть містити допоміжні речовини, такі як консерванти, стабілізатори, зволожуючі або емульгуючі агенти, промотори розчинення, солі для регулювання осмотичного тиску та/або буфери. Крім того, вони також можуть містити інші терапевтично цінні речовини. Прийнятні композиції для крізьшкірного застосування включають ефективну кількість сполуки даного винаходу з носієм. Носій може включати фармакологічно прийнятні розчинники, що можуть бути абсорбовані, для сприяння проходженню через шкіру хазяїна. Наприклад, крізьшкірні засоби знаходяться у формі перев'язочного матеріалу, що включає основу, резервуар, що містить сполуку необов'язково з носіями, необов'язково бар'єр, що контролює швидкість, для доставки сполуки до шкіри хазяїна при контрольованій та завчасно визначеній швидкості впродовж тривалого періоду часу, та засіб для утримання пристрою на шкірі. Також можуть бути використані матриксні крізьшкірні композиції. Прийнятні композиції для місцевого застосування, наприклад, до шкіри та очей, переважно являють собою водні розчини, мазі, креми або гелі, добре відомі у даній галузі техніки. Вони можуть містити солюбілізатори, стабілізатори, агенти, що посилюють тонічність, буфери та консерванти. Сполуки даного винаходу можуть бути введені у терапевтично ефективних кількостях у комбінації з одним або більшою кількістю терапевтичних агентів (фармацевтичні комбінації). Наприклад, синергетичні ефекти можуть зустрічатися, коли сполуку даного винаходу 22 UA 103918 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовують у комбінації з хіміотерапевтичним агентом. Коли сполуки даного винаходу вводять у поєднанні з іншими терапіями, дози сполук, що спільно вводять, звичайно будуть змінюватися в залежності від типу спів-використовуваного лікарського засобу, від специфічного використовуваного лікарського засобу, від стану, що лікують, і так далі. Даний винахід також забезпечує фармацевтичні комбінації, наприклад, набір, що включає a) перший агент, який являє собою сполуку даного винаходу, як розкрито у цьому описі, у вільній формі або у формі фармацевтично прийнятної солі, та b) щонайменше один співагент. Набір може включати інструкції для його введення. Способи одержання сполук даного винаходу Загалом сполуки, що мають Формулу (1), можуть бути одержані слідуючи будь-якій з методологій синтезу, описаній у Прикладах, представлених вище. У описаних реакціях, реакційно-здатні функціональні групи, наприклад, гідрокси, аміно, іміно, тіо або карбокси групи, коли вони є бажаними у кінцевому продукті, можуть бути захищені для уникнення їх небажаної участі у реакціях. Звичайні захисні групи можуть бути використані у відповідності до стандартної практики (дивись, наприклад, T.W. Greene та P. G. M. Wuts у "Protective Groups in Органічний Chemistry", John Wiley та Sons, 1991). Прийнятні відхідні групи для застосування у описаних способах синтезу включають галогенові відхідні групи (наприклад, хлор або бром), та інші звичайно використовувані відхідні групи, відомі спеціалістам, кваліфікованим у даній галузі техніки. Сполуки даного винаходу, включаючи їх солі, також можуть бути одержані у формі гідратів, або їх кристали можуть включати, наприклад, розчинник, що використовують для кристалізації (у цьому описі - сольвати). Солі, як правило, можуть бути перетворені у сполуки у вільній формі, наприклад, шляхом обробки з прийнятними основними агентами, наприклад, з карбонатами лужних металів, гідрокарбонатами лужних металів, або гідроксидами лужних металів, такими як карбонат калію або гідроксид натрію. Сполука даного винаходу у формі солі приєднання основи може бути перетворена у відповідну вільну кислоту шляхом обробки підходящою кислотою (наприклад, соляною кислотою, тощо). Приймаючи до уваги тісний зв'язок між новими сполуками у вільній формі та сполуками у формі їх солей, включаючи ті солі, які можуть бути використані як проміжні сполуки, наприклад, у очищенні або ідентифікації нових сполук, будьяке посилання на вільні сполуки у цьому описі вище та нижче слід розуміти як посилання також на відповідні солі, якщо прийнятно. Солі сполук даного винаходу з солеутворюючими групами можуть бути одержані за способом, відомим per se. Солі приєднання кислоти сполук Формули (1), (2), (3), (4) або (5), таким чином, можуть бути одержані шляхом обробки кислотою або прийнятним аніонообмінним реагентом. Фармацевтично прийнятні солі сполук даного винаходу можуть бути утворені, наприклад, як солі приєднання кислоти, з органічними або неорганічними кислотами, зі сполук Формули (1), (2), (3), (4) або (5), з основним атомом азоту. Прийнятні неорганічні кислоти включають, не обмежуючись наведеними, галогенові кислоти, такі як соляна кислота, сірчана кислота, або фосфорна кислота. Прийнятні органічні кислоти включають, не обмежуючись наведеними, такі як карбонова, фосфорна, сульфонова або сульфамінова кислоти, наприклад, оцтова кислота, пропіонова кислота, каприлова кислота, капринова кислота, додеканова кислота, гліколева кислота, молочна кислота, фумарова кислота, бурштинова кислота, адипінова кислота, пімелінова кислота, суберинова кислота, азелаїнова кислота, яблучна кислота, винна кислота, лимонна кислота, аміно кислоти, такі як глутамінова кислота або аспарагінова кислота, малеїнова кислота, гідроксималеїнова кислота, метилмалеїнова кислота, циклогексанкарбонова кислота, адамантанкарбонова кислота, бензойна кислота, саліцилова кислота, 4-аміносаліцилова кислота, фталева кислота, фенілоцтова кислота, мигдальна кислота, корична кислота, метан- або етан-сульфонова кислота, 2-гідроксиетансульфонова кислота, етан-1,2-дисульфонова кислота, бензолсульфонова кислота, 2-нафталінсульфонова кислота, 1,5-нафталін-дисульфонова кислота, 2-, 3- або 4 метилбензолсульфонова кислота, метилсірчана кислота, етилсірчана кислота, додецилсірчана кислота, N-циклогексилсульфамінова кислота, N-метил-, N-етил- або N-пропіл-сульфамінова кислота, або інші органічні протонні кислоти, такі як аскорбінова кислота. Для виділення та очищення, також можна використовувати фармацевтично неприйнятні солі, наприклад, пікрати або перхлорати. Для терапевтичного застосування використовують тільки фармацевтично прийнятні солі або вільні сполуки (де прийнятно у формі фармацевтичних препаратів). Сполуки даного винаходу у неокисленій формі можуть бути одержані з N-оксидів сполук даного винаходу шляхом обробки відновлюючим агентом (наприклад, таким як сірка, діоксид сірки, трифеніл-фосфін, боргідрид літію, боргідрид натрію, фосфору трихлорид, трибромід, або 23 UA 103918 C2 5 10 15 20 25 30 35 40 45 50 55 подібні) у прийнятному інертному органічному розчиннику (наприклад, ацетонітрил, етанол, водний діоксан, або подібні) при 0-80 °C. Похідні проліків сполук даного винаходу можуть бути одержані за способами, відомими спеціалістам, кваліфікованим у даній галузі техніки (наприклад, для більш детального опису дивись Saulnier et al., (1994), Bioорганічний та Medicinal Chemistry Letters, том 4, стор. 1985). Наприклад, відповідні пролікарські засоби можуть бути одержані шляхом введення у реакцію недериватизованої сполуки даного винаходу з прийнятним карбамілізуючим агентом (наприклад, 1,1-ацилоксиалкіл-карбано-хлоридат, пара-нітрофеніл карбонат, або подібні). Захищені похідні сполук даного винаходу можуть бути одержані за допомогою засобів, відомих спеціалістам, кваліфікованим у даній галузі техніки. Детальний опис технологій, застосовних для створення захисних груп та їх видалення, може бути знайдений у T. W. Greene, тє "Protecting Groups in Органічний Chemistry", 3 видання, John Wiley та Sons, Inc., 1999. Сполуки даного винаходу можуть бути одержані у вигляді їх окремих стереоізомерів шляхом введення у реакцію рацемічної суміші сполуки з оптично активним розділюючим агентом з утворенням пари діастереоізомерних сполук, розділення діастереоізомерів та відновлення оптично чистих енантіомерів. Хоча розділення енантіомерів може бути виконане, використовуючи ковалентні діастереомерні похідні сполук даного винаходу, кращими є комплекси, що дисоціюються (наприклад, кристалічні діастереомерні солі). Діастереомери мають відмінні фізичні властивості (наприклад, точки плавлення, точки кипіння, розчинності, реакційну здатність, тощо) та можуть бути легко розділені, приймаючи до уваги перевагу цих відмінностей. Діастереомери можуть бути розділені за допомогою фракційної кристалізації, хроматографії, або за допомогою технологій розділення/відділення, основаних на різницях у розчинності. Оптично чистий енантіомер потім відновлюють, з розділюючим агентом, шляхом будь-яких практичних засобів, які не будуть приводити до рацемізації. Більш детальний опис технологій, застосовний для розділення стереоізомерів сполук з їх рацемічної суміші, може бути знайдений у Jean Jacques, Andre Collet, Samuel H. Wilen, "Enantiomers, Racemates та Reрозчинs", John Wiley та Sons, Inc., 1981. Коротко, сполуки даного винаходу можуть бути одержані за способом, як описано у Прикладах; та: (a) необов'язково перетворюючи сполуку даного винаходу у фармацевтично прийнятну сіль; (b) необов'язково перетворюючи сольову форму сполуки даного винаходу у не-сольову форму; (c) необов'язково перетворюючи неокислену форму сполуки даного винаходу у фармацевтично прийнятний N-оксид; (d) необов'язково перетворюючи N-оксидну форму сполуки даного винаходу у її неокислену форму; (e) необов'язково відділюючи окремий ізомер сполуки даного винаходу від суміші ізомерів; (f) необов'язково перетворюючи недериватизовану сполуку даного винаходу у фармацевтично прийнятну пролікарську похідну; та (g) необов'язково перетворюючи пролікарську похідну сполуки даного винаходу у її недериватизовану форму. Оскільки вироблення вихідних матеріалів особливо не описане, сполуки є відомими або можуть бути одержані аналогічно до способів, відомих у даній галузі техніки або як розкрито у Прикладах, представлених нижче. Спеціаліст, кваліфікований у даній галузі техніки, зрозуміє, що описані вище перетворення є тільки типовими прикладами способів для одержання сполук даного винаходу, та що інші добре відомі способи можуть бути використані аналогічно. Даний винахід додатково описаний, без обмеження, наступними Прикладами, які ілюструють одержання сполук даного винаходу. Приклад 1 N-(6-метоксибензо[d]тіазол-2-іл)-2-(4-(піридин-4-іл)феніл)ацетамід (3) До суміші 2-(4-(піридин-4-іл)феніл)оцтової кислоти 3-1 (45 мг, 0,21 ммоль), 6метоксибензо[d]тіазол-2-аміну 3-2 (36 мг, 0,20 ммоль), та ДІЕА (32 мг, 0,25 ммоль) у ДМФА (0,5 мл) при перемішуванні додають HATU (84 мг, 0,22 ммоль). Цей розчин перемішують 24 UA 103918 C2 5 10 15 20 25 30 35 40 45 впродовж 2 годин перед тим, як піддати обернено-фазній ВЕРХ для очищення, що приводить 1 до одержання сполуки 3 у вигляді білої твердої речовини. MS m/z 376,1 (M+1); H ЯМР 400 MГц (ДМСО-d6) δ 12,60 (s, 1H), 8,70 (m, 2H), 7,87 (m, 2H), 7,78 (m, 2H), 7,72 (d, 1H, J=8,8Гц), 7,63 (d, 1H, J=2,8 Гц), 7,58 (m, 2H), 7,11 (dd, 1H, J1=8,8 Гц, J2=2,4Гц), 3,96 (s, 2H), 3,86 (s, 3H). Приклад 2 2-(3-метил-4-(2-метилпіридин-4-іл)феніл)-N-(4-фенілтіазол-2-іл)ацетамід (24) Стадія 1: До суспензії 3-метил-4-бромбензойної кислоти 24-1 (2,15 г, 10 ммоль) у толуолі (15 мл, безводний) додають SOCl2 (1,4 мл, ~1,9 екв.) та 3 краплі ДМФА при кімнатній температурі. Цю суміш нагрівають при зрошенні 2 години з перемішуванням. Після охолодження до кімнатної температури, реакційну суміш концентрують при зниженому тиску. Отриманий залишок розчиняють у ТГФ (25 мл, безводний) та потім при 0 ºC додають NEt 3 (2,2 мл) та TMSCHN2 (8,2 мл × 2,0 M у гексанах). Через 12 годин перемішування цю суміш виливають у насичений NaHCO3 розчин (60 мл) та екстрагують етилацетатом (3 × 60 мл). Об'єднані екстракти промивають сольовим розчином, сушать над Na 2SO4 та випарюють, що приводить до одержання сирої проміжної речовини 24-3. Цю сиру проміжну речовину додають невеликими частинами до зрошуваного розчину NEt3 (4,2 мл), PhCO2Ag (0,70 г) у т-бутанолі (50 мл) та толуолі (20 мл) з перемішуванням. Через 1 годину нагрівання при зрошуванні, реакційну суміш охолоджують до кімнатної температури. Порошок активованого вугілля додають до реакційної суміші, яку потім фільтрують через Целіт. Фільтрат розбавляють етилацетатом (100 мл) та промивають сольовим розчином. Після висушування над Na 2SO4, отриманий розчин концентрують при зниженому тиску. Залишок очищують за допомогою колонкової хроматографії на силікагелі з ДХМ-EtOAc (30:1) як елюентом, що забезпечує одержання трет-бутилового складного ефіру 24-4. Стадія 2: Складний ефір 24-4 (810 мг, 2,84 ммоль) розчиняють у ДХМ (16 мл) та додають трифтороцтову кислоту (2 мл). Цю суміш перемішують при кімнатній температурі впродовж ночі. Розчинник ДХМ випарюють та залишок розчиняють у етилацетаті (50 мл) та цей органічний розчин екстрагують за допомогою Na2CO3 розчину (10 % водний, 50 мл). Водну фазу підкислюють за допомогою HCl розчину до pH 2 та осад екстрагують етилацетатом (50 мл). Після висушування над Na2SO4, органічний розчинник випарюють, що приводить до одержання кислоти 24-5. Стадія 3: До суміші сполуки 24-5 (92 мг, 0,4 ммоль), 4-феніл-2-амінотіазолу 24-6 (76 мг, 0,44 ммоль) та HATU (167 мг, 0,44 ммоль) у ДМФА (1,6 мл) додають ДІЕА (100 мкл, 0,58 ммоль) та цю суміш перемішують при кімнатній температурі впродовж ночі. Потім її розподіляють між етилацетатом (50 мл) та водою (40 мл). Органічну фазу сушать над Na 2SO4 та розчинник випарюють. Залишок піддають хроматографії на силікагелі, що приводить до одержання сполуки 24-7. Стадія 4: Суміш сполуки 24-7 (33 мг, 0,085 ммоль), 2-метилпіридин-4-ілборної кислоти (23 мг, 0,17 ммоль), Pd(PPh3)4 (9,8 мг, 0,0085 ммоль) та K3PO4 (36 мг, 0,17 ммоль) у діоксані (0,6 мл) та воді (0,06 мл) у атмосфері аргону перемішують при 96 ºC впродовж ночі. Після охолодження до кімнатної температури, реакційну суміш фільтрують через целіт, розбавляють етилацетатом (50 мл) та органічний розчин промивають водою (50 млx2) та сушать над Na2SO4. Після випарювання, отриманий залишок піддають оберненофазній ВЕРХ, що приводить до 1 одержання сполуки 24 у вигляді білої твердої речовини. MS m/z 400,14 (M+1); H ЯМР 400 MГц 25 UA 103918 C2 (ДМСО-d6) δ 12,58 (s, 1H), 8,56 (d, 1H, J=5,6 Гц), 7,92 (m, 2H), 7,63 (s, 1H), 7,46 (m, 2H), 7,36 (m, 1H), 7,33 (m, 4H), 7,24 (d, 1H, J=8,0 Гц), 3,83 (s, 2H), 2,56 (s, 3H), 2,27 (s, 3H). Приклад 3 2-(4-(2-метилпіридин-4-іл)феніл)-N-(5-фенілпіридин-2-іл)ацетамід (26) 5 10 15 20 25 30 35 Стадія 1: До запечатаної пробірки додають 2-метил-4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)піридин (2,2 г, 10 ммоль), етил 2-(4-йодфеніл)ацетат 26-1 (2,9 г, 10 ммоль), Pd(PPh3)4 (0,231 г, 0,2 ммоль), толуол (30 мл), етанол (10 мл) та 2M Na2CO3 (10 мл). Реакційну суміш зрошують азотом та перемішують при 90C впродовж 10 годин. Після охолодження до кімнатної температури, реакційну суміш розбавляють у 200 мл етилацетату та промивають насиченим розчином бікарбонату натрію та потім сольовим розчином. Органічну фазу сушать над Na2SO4 та потім випарюють досуха за допомогою роторного випаровувача. Сирий продукт очищують за допомогою силікагелевої флеш хроматографії, елююють за допомогою 50 % етилацетату у гексані, що приводить до одержання етил 2-(4-(2-метилпіридин-4іл)феніл)ацетату 26-2 у вигляді масла. MS m/z 256,1 (M+1). Стадія 2: Суміш етил 2-(4-(2-метилпіридин-4-іл)феніл)ацетату 26-2 (1,81 г, 7,1 ммоль), LiOH (0,17 г, 7,1 ммоль) у ТГФ (30 мл), метанолу (10 мл) та H2O (10 мл) перемішують при 60 C впродовж 1 години. Після охолодження до 0 C, цю суміш нейтралізують за допомогою 1 N HCl при 0 C та потім випарюють досуха за допомогою роторного випаровувала, що приводить до одержання 2-(4-(2-метилпіридин-4-іл)феніл)оцтової кислоти 26-3. Продукт використовують на наступній стадії без додаткового очищення. MS m/z 228,1 (M+1). Стадія 3: До суміші 2-(4-(2-метилпіридин-4-іл)феніл)оцтової кислоти 26-3 (50 мг, 0,2 ммоль), 5-фенілпіридин-2-аміну (41 мг, 0,24 ммоль) та O-(7-азабензотриазол-1-іл)-N, N, N",N'тетраметилуроніумгексафторфосфату (HATU) (114 мг, 0,3 ммоль) у 1,5 мл ДМФА додають N, Nдіізопропілетиламін (ДІЕА, 104 мкл, 0,6 ммоль) при кімнатній температурі. Цю суміш перемішують при кімнатній температурі впродовж 2 годин. Розчинник видаляють шляхом роторного випаровування. Сирий продукт очищують шляхом оберненофазної ВЕРХ, що приводить до одержання 2-(4-(2-метилпіридин-4-іл)феніл)-N-(5-фенілпіридин-2-іл)ацетаміду 26 1 у вигляді білої твердої речовини. MS m/z 380,17 (M+1); H ЯМР 400 MГц (ДМСО-d6) δ 10,84 (s, 1H), 8,60 (d, 1H, J=2,4 Гц), 8,42 (d, 1H, J=6,4 Гц), 8,10 (d, 1H, J=8,8 Гц), 8,04 (dd, 1H, J 1=8,8Гц, J2=2,4 Гц), 7,70 (m, 2H), 7,65 (m, 2H), 7,51 (m, 1H), 7,44 (m, 5H), 7,33 (m, 1H), 3,76 (s, 2H), 2,46 (s, 3H). Приклад 4 N-(5-фенілпіридин-2-іл)-2-(4-(піридазин-4-іл)феніл)ацетамід (37) 26 UA 103918 C2 5 10 15 20 25 30 Стадія 1: До запечатаної пробірки додають 4-(2-етокси-2-оксоетил)фенілборну кислоту 37-2 (310 мг, 1,5 ммоль), 4-бромпіридазин 37-1 (158 мг, 1 ммоль), Pd(PPh3)4 (70 мг, 0,1 ммоль), толуол (4 мл), етанол (1 мл) та 2M Na2CO3 (1,5 мл). Реакційну суміш барботують азотом впродовж 2 хвилин та перемішують при 90 C впродовж 10 годин. Після охолодження до кімнатної температури, реакційну суміш розбавляють етилацетатом (50 мл), промивають насиченим водним розчином бікарбонату натрію та сольовим розчином. Органічну фазу сушать над Na2SO4 та потім концентрують досуха за допомогою роторного випаровування. Сирий продукт очищують за допомогою силікагелевої флеш хроматографії, елююють за допомогою 50 % етилацетату у гексані, що приводить до одержання етил 2-(4-(піридазин-4іл)феніл)ацетату 37-3 у вигляді блідо-жовтої твердої речовини. MS m/z 243,1 (M+1) Стадія 2: Етил 2-(4-(піридазин-4-іл)феніл)ацетат 37-3 (150 мг, 0,62 ммоль) та NaOH (120 мг, 3 ммоль) змішують у діоксані (1,5 мл) та H2O (1,5 мл) та перемішують при 80 C впродовж 1 години. Після охолодження до 0 C, цю суміш обробляють за допомогою 1 N HCl водного розчину до pH 1, та випарюють досуха за допомогою роторного випаровування. Сирий продукт екстрагують етилацетатом (100 мл × 3). Об'єднані органічні фази концентрують, що приводить до одержання 2-(4-(піридазин-4-іл)феніл)оцтової кислоти 37-4 у вигляді блідо-жовтої твердої речовини. MS m/z 215,1 (M+1) Стадія 3: До суміші 2-(4-(піридазин-4-іл)феніл)оцтової кислоти 37-4 (43 мг, 0,2 ммоль), 5фенілпіридин-2-аміну (41 мг, 0,24 ммоль) та O-(7-азабензотриазол-1-іл)-N, N, N",N'тетраметилуроніумгексафторфосфату (HATU) (117 мг, 0,3 ммоль) у ДМФА (1 мл) додають ДІЕА (104 мкл, 0,6 ммоль) при кімнатній температурі. Цю суміш перемішують при кімнатній температурі впродовж 2 годин. Сирий продукт очищують шляхом оберненофазної ВЕРХ, що приводить до одержання N-(5-фенілпіридин-2-іл)-2-2(4-піридазин-4-іл)феніл)ацетаміду 37 у 1 вигляді білої твердої речовини. MS m/z 367,1 (M+1); H ЯМР 400 MГц (CDCl3) δ 9,45-9,44 (m, 1H), 9,22 (dd, 1H, J1=1,2 Гц, J2=11,2 Гц), 8,44 (d, 1H, J=2,4 Гц), 8,29 (d, 1H, J=8,8 Гц), 7,92 (dd, 1H, J1=16,8 Гц, J2=2,4 Гц), 7,70-7,66 (m, 3H), 7,56-7,51 (m, 4H), 7,46-7,43 (m, 2H), 7,39-7,35 (m, 1H), 3,85 (s, 2H). Приклад 5 2-(4-(2-метилпіридин-4-іл)-3-(трифторметил)феніл)-N-(5-фенілпіридин-2-іл)ацетамід (46) 27 UA 103918 C2 5 10 15 20 25 30 35 40 Стадія 1: До колби, що містить 3-трифторметил-4-бромбензонітрил 46-1 (5,0 г, 20 ммоль), додають воду (20 мл) та краплинним способом концентровану сірчану кислоту (20 мл). Реакційну суміш перемішують при 100 C впродовж 10 годин. Після охолодження до кімнатної температури, реакційну суміш виливають у дихлорметан (150 мл) та воду (100 мл). Цю суміш нейтралізують за допомогою порошкоподібного карбонату натрію до pH 9. Водний шар підкислюють за допомогою 1N водного розчину соляної кислоти до pH 1, та екстрагують етилацетатом (50 мл × 3). Об'єднані органічні шари промивають сольовим розчином, сушать над Na2SO4 та потім випарюють досуха за допомогою роторного випаровувача до 4-бром-3(трифторметил)бензойної кислоти 46-2 у вигляді білої твердої речовини. MS m/z 269,1 (M+1) Стадія 2: До розчину 4-бром-3-(трифторметил)бензойної кислоти 46-2 (1,35 г, 5 ммоль) у ТГФ (10 мл) додають 1M BH3·ТГФ у ТГФ (20 мл) повільно при 0 °C. Цю суміш нагрівають до кімнатної температури та перемішують впродовж 4 годин. Реакцію гасять водою при 0 °C. Всі розчинники випарюють та залишок знову розчиняють у етилацетаті (100 мл), промивають насиченим NaHCO3 водним розчином, водою та сольовим розчином, сушать над Na 2SO4, та потім концентрують. Сирий продукт очищують за допомогою силікагелевої флеш хроматографії, елююють за допомогою 40 % етилацетату у гексані, що приводить до одержання (4-бром-3(трифторметил)феніл)метанолу 46-3 у вигляді білої твердої речовини. MS m/z 237,1 (M+1) Стадія 3: До розчину (4-бром-3-(трифторметил)феніл)метанолу 46-3 (956 мг, 3,75 ммоль) та триетиламіну (455 мг, 4,5 ммоль) у ТГФ (9 мл) повільно додають розчин метансульфоніл хлориду (430 мг, 3,75 ммоль) у ТГФ (1 мл) при 10 °C. Цю суміш перемішують впродовж 1 години. Тверду речовину відфільтровують та промивають етиловим ефіром. Фільтрат випарюють з одержанням 4-бром-3-(трифторметил)бензил-метансульфонату 46-4 у вигляді блідо-жовтої твердої речовини. MS m/z 233,1 (M+1) Стадія 4: До розчину 4-бром-3-(трифторметил)бензил-метансульфонату 46-4 (1,295 г, 3,75 ммоль) у етанолі (10 мл) додають розчин ціаніду калію (364 мг, 5,6 ммоль) у воді (2 мл). Цю суміш нагрівають при зрошенні впродовж 2 годин. Після охолодження цієї суміші до кімнатної температури, всі розчинники випарюють та залишок знову розчиняють у дихлорметані (50 мл), промивають водою та сольовим розчином, сушать над Na 2SO4, та концентрують досуха, що приводить до одержання 2-(4-бром-3-(трифторметил)феніл)ацетонітрилу 46-5 у вигляді темнокоричневого масла, яке використовують безпосередньо на наступній стадії. MS m/z 264,1 (M+1) Стадія 5: До колби, що містить 2-(4-бром-3-(трифторметил)феніл)ацетонітрил 46-5 (880 мг, 3,3 ммоль), додають воду (4,5 мл) та краплинним способом концентровану сірчану кислоту (4,5 мл). Реакційну суміш перемішують при 115 C впродовж 4 годин. Після охолодження до кімнатної температури, реакційну суміш виливають у воду (100 мл). Отриманий розчин нейтралізують за допомогою порошкоподібного карбонату натрію до pH 12, обробляють за допомогою 1N HCl водного розчину до pH приблизно 2, та екстрагують за допомогою дихлорметану (50 мл × 3). Об'єднані органічні шари промивають сольовим розчином, сушать над Na2SO4 та потім випарюють досуха за допомогою роторного випаровувача, що приводить 28
ДивитисяДодаткова інформація
Назва патенту англійськоюN-(hetero)aryl, 2-(hetero)aryl-substituted acetamides for use as wnt signaling modulators
Автори англійськоюCheng, Dai, Zhang, Guobao, Han, Dong, Gao, Wenqi, Pan, Shifeng
Автори російськоюЧенг Деи, Жанг Гуобао, Хан Донг, Гао Венци, Пан Шифенг
МПК / Мітки
МПК: A61K 31/44, C07D 401/14, A61P 35/00, C07D 413/14, C07D 403/12, C07D 213/75, C07D 401/12, C07D 417/12, C07D 417/14
Мітки: сигналу, ацетаміди, модуляторів, 2-(гетеро)арилзаміщені, застосування, передачі, n-(гетеро)арил
Код посилання
<a href="https://ua.patents.su/147-103918-n-geteroaril-2-geteroarilzamishheni-acetamidi-dlya-zastosuvannya-yak-modulyatoriv-wnt-peredachi-signalu.html" target="_blank" rel="follow" title="База патентів України">N-(гетеро)арил, 2-(гетеро)арилзаміщені ацетаміди для застосування як модуляторів wnt передачі сигналу</a>
Попередній патент: Застосування sns-595 для лікування суб’єктів з онкологічними захворюваннями, які мають знижену активність brca2
Наступний патент: Контейнер подачі проявника і система подачі проявника
Випадковий патент: Шворневий вузол візка пасажирського вагона