Аралкіламіни фуропіридинів, фармацевтична композиція на їх основі, спосіб їх одержання та похідні фуропіридину
Формула / Реферат
1. Аралкіламіни фуропіридинів формули I
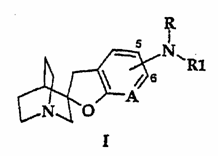 ,
,
де
NRR1 приєднаний у 5- або 6-положенні кільця фуропіридину;
R являє собою водень, С1-С4-алкіл, COR2;
R1 являє собою (CH2)nAr, CH2CH=CHAr або CH2C![]() CAr;
CAr;
n дорівнює числу 0-3;
А являє собою N або NO;
Аr являє собою 5- або 6-членне ароматичне або гетероароматичне кільце, яке містить 0-4 атоми азоту, 0-1 атом кисню та 0-1 атом сірки;
або 8-, 9- або 10-членну конденсовану ароматичну або гетероароматичну циклічну систему, яка містить 0-4 атоми азоту, 0-1 атом кисню та 0-1 атом сірки;
будь-який з них може бути, необов’язково, заміщений 1-2 замісниками, незалежно вибраними з галогену, трифторметилу або С1-С4-алкілу;
R2 являє собою водень; С1-С4-алкіл; С1-С4-алкокси або фенільне кільце, необов’язково заміщене 1-3 з наступних замісників: галоген, С1-С4-алкіл, С2-С4-алкеніл, С2-С4-алкініл, ОН, ОС1-С4-алкіл, CO2R5, -CN, -NO2, -NR3R4 або -CF3;
R3, R4 та R5 незалежно являють собою водень; С1-С4-алкіл або фенільне кільце, необов’язково заміщене 1-3 з наступних замісників: галоген, С1-С4-алкіл, С2-С4-алкеніл, С2-С4-алкініл, ОН, ОС1-С4-алкіл, CO2R2, -CN, -NO2 або -CF3;
або їх енантіомер та їх фармацевтично прийнятні солі.
2. Сполука за п.1, де А являє собою N, або її енантіомер та її фармацевтично прийнятні солі.
3. Сполука за п. 1 або 2, де R1 являє собою (СН2)nАr, або її енантіомер та її фармацевтично прийнятні солі.
4. Сполука за п. 1 або 2, де R1 являє собою СН2СН=СНАr, або її енантіомер та її фармацевтично прийнятні солі.
5. Сполука за п. 1 або 2, де R1 являє собою СН2С![]() САr, або її енантіомер та її фармацевтично прийнятні солі.
САr, або її енантіомер та її фармацевтично прийнятні солі.
6. Сполука за будь-яким одним з пп. 1-5, де Аr вибирають з групи, яка включає: фенільне кільце, необов’язково заміщене 1-3 з наступних замісників: галоген, С1-С4-алкіл, С2-С4-алкеніл, С2-С4-алкініл, ОН, ОС1-С4-алкіл, CO2R5, -CN, -NO2, -NR3R4 та -СF3; 2-, 3- або 4-піридил; 2- або 3-фураніл; 2- або 3-тієніл; 2- або 4-імідазоліл, 1-, 2- або 3-піроліл, 2- або 4-оксазоліл; та 3- або 4-ізоксазоліл, або її енантіомер та її фармацевтично прийнятні солі.
7. Сполука за будь-яким одним з пп. 1-5, де Аr вибирають з групи, яка включає: 1- або 2-нафтил; 2-, 3-, 4-, 5-, 6-, 7- або 8-хіноліл; 1-, 3-, 4-, 5-, 6-, 7- або 8-ізохіноліл; 2-, 4-, 5-, 6- або 7-бензоксазоліл; та 3-, 4-, 5-, 6- або 7-бензизоксазоліл;
або її енантіомер та її фармацевтично прийнятні солі.
8. Сполука за будь-яким одним з пп. 1-6, де R3, R4 та R5 являють собою, незалежно, водень або С1-С4-алкіл, або її енантіомер та її фармацевтично прийнятні солі.
9. Сполука за будь-яким одним з пп. 1-8, де n дорівнює 1.
10. Сполука за будь-яким одним з пп. 1-8, де R являє собою водень.
11. Сполука за будь-яким одним з пп. 1-8, де Аr являє собою гетероароматичне кільце.
12. Сполука за будь-яким одним з пп. 1-8, де n дорівнює 1; R являє собою водень і Аr являє собою гетероароматичне кільце.
13. Сполука за п. 1, яка являє собою:
R-(-)-5'-N-(фенілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-(2-піридилметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-(3-піридилметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-(4-піридилметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-(2-фуранілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-(3-фуранілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-(2-тієнілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-(2-імідазолілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(4-метоксифенілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(4-хлорфенілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(4-метилфенілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(3,4-дихлорфенілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-ацетил-N-(фенілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-метил-N-(фенілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(3-піридил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'(3’Н)-фуро[2,3-b]піридин];
R-(-)-6'-N-(фенілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'(3’Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(3-тієнілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(2-фенілетил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(3-фенілпропіл)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(хінолін-3-ілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(хінолін-4-ілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(1,4-бензодіоксан-6-ілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(імідазол-4-ілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(транс-3-фенілпроп-2-еніл)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(тіазол-2-ілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(3-метилфенілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(2-хлорфенілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(3-хлорфенілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(3-фенілпропініл)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(3-гідроксифенілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(4-гідроксифенілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-[транс-3-(4-піридиніл)проп-2-еніл]аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-ацетил-N-(3-тієнілметил)аміноспіро[1-азабіцикло[2.2-2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-метил-N-(4-піридилметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-метил-N-(3-піридилметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-N-(2-гідроксіетил)-N-(3-тієнілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин], та їх енантіомери та їх фармацевтично прийнятні солі.
14. Сполука за п. 1, яка являє собою собою:
R-(-)-5'-(3-піридилметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин];
R-(-)-5'-(4-піридилметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин],
або її енантіомер та її фармацевтично прийнятні солі.
15. Сполука за будь-яким одним з пп. 1-14 для використання у терапії.
16. Сполука за будь-яким одним з пп.1-14, яка використовується для виготовлення лікарського препарату для лікування або профілактики психотичних порушень або порушень інтелектуальної здатності.
17. Сполука за будь-яким одним з пп. 1-14, яка використовується при виготовленні лікарського препарату для лікування або профілактики захворювань або станів людини, для яких корисна активація нікотинового рецептора a7.
18. Сполука за п.16 або 17, де стан або порушення являє собою хворобу Альцгеймера, дефіцит здатності навчання, дефіцит пізнавальної здатності, дефіцит уваги, втрату пам'яті, дефіцит уваги, який характеризується гіперактивністю, деменцію Lewy Body, тривожні стани, шизофренію, манію або маніакальну депресію, хворобу Паркінсона, хворобу Хантінгтона, хворобу Туретта, нейродегенеративні порушення, при яких відбувається втрата холінергічного синапсу, розлад нормального циркадного ритму, стан при припиненні паління, нікотинову залежність, включаючи залежність, яка є результатом впливу продуктів, що містять нікотин, біль або неспецифічний виразковий коліт.
19. Фармацевтична композиція, яка містить сполуку за будь-яким одним з пп. 1-14, у суміші з інертним фармацевтично прийнятним розріджувачем або носієм.
20. Фармацевтична композиція за п.19, яку використовують для лікування або профілактики психотичних порушень або порушень інтелектуальних здатностей.
21. Фармацевтична композиція за п. 19, яку використовують для лікування або профілактики хвороби Альцгеймера, дефіциту здатності навчання, дефіциту пізнавальної здатності, дефіциту уваги, втрати пам'яті, дефіциту уваги, який характеризується гіперактивністю, деменції Lewy Body, тривожних станів, шизофренії, манії або маніакальної депресії, хвороби Паркінсона, хвороби Хантінгтона, хвороби Туретта, нейродегенеративних порушень, при яких відбувається втрата холінергічного синапсу, розладу нормального циркадного ритму, стану при припиненні паління, нікотинової залежності, включаючи залежність, яка є результатом впливу продуктів, які містять нікотин, болю або неспецифічного виразкового коліту.
22. Фармацевтична композиція за п. 21, яку використовують для лікування або профілактики тривожних станів, шизофренії, манії або маніакальної депресії.
23. Фармацевтична композиція за п. 21, яку використовують для лікування або профілактики хвороби Паркінсона, хвороби Хантінгтона, хвороби Туретта або нейродегенеративних порушень, при яких відбувається втрата холінергічних синапсів.
24. Фармацевтична композиція за п. 21, яку використовують для лікування або профілактики розладу нормального циркадного ритму, нікотинової залежності, включаючи залежність, яка є результатом впливу продуктів, що містять нікотин, болю або неспецифічного виразкового коліту.
25. Спосіб одержання сполуки формули I, у якій NRR1 знаходиться у 5'-положенні фуропіридину, за будь-яким одним з пп. 1-14, або її енантіомера та її фармацевтично прийнятних солей, який включає алкілування або ацилювання сполук формули VI, де Е являє собою галоген, NО2 або NHR, R і R1 мають значення, визначені в п.1, у відповідному розчиннику:
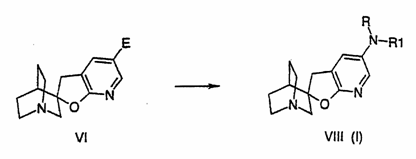 .
.
26. Похідне фуропіридину формули
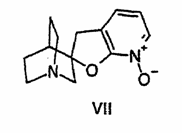 .
.
27. Похідне фуропіридину формули
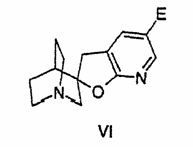 ,
,
де Е являє собою NО2, NHR або галоген, R приймає значення, визначені в п.1.
Текст
1. Аралкіламіни фуропіридинів формули I 2 (19) 1 3 71598 4 12. Сполука за будь-яким одним з пп. 1-8, де n R-(-)-5'-N-(хінолін-4-ілметил)аміноспіро[1дорівнює 1; R являє собою водень і Аr являє соазабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3бою гетероароматичне кільце. b]піридин]; 13. Сполука за п. 1, яка являє собою: R-(-)-5'-N-(1,4-бензодіоксан-6R-(-)-5'-N-(фенілметил)аміноспіро[1ілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3(3'Н)-фуро[2,3-b]піридин]; b]піридин]; R-(-)-5'-N-(імідазол-4-ілметил)аміноспіро[1R-(-)-5'-(2-піридилметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-(транс-3-фенілпроп-2-еніл)аміноспіро[1R-(-)-5'-(3-піридилметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-(тіазол-2-ілметил)аміноспіро[1R-(-)-5'-(4-піридилметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-(3-метилфенілметил)аміноспіро[1R-(-)-5'-(2-фуранілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-(2-хлорфенілметил)аміноспіро[1R-(-)-5'-(3-фуранілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-(3-хлорфенілметил)аміноспіро[1R-(-)-5'-(2-тієнілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-(3-фенілпропініл)аміноспіро[1R-(-)-5'-(2-імідазолілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-(3-гідроксифенілметил)аміноспіро[1R-(-)-5'-N-(4-метоксифенілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-(4-гідроксифенілметил)аміноспіро[1R-(-)-5'-N-(4-хлорфенілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-[транс-3-(4-піридиніл)проп-2R-(-)-5'-N-(4-метилфенілметил)аміноспіро[1еніл]аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3фуро[2,3-b]піридин]; b]піридин]; R-(-)-5'-N-ацетил-N-(3-тієнілметил)аміноспіро[1R-(-)-5'-N-(3,4-дихлорфенілметил)аміноспіро[1азабіцикло[2.2-2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-метил-N-(4-піридилметил)аміноспіро[1R-(-)-5'-N-ацетил-N-(фенілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-метил-N-(3-піридилметил)аміноспіро[1R-(-)-5'-N-метил-N-(фенілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-(2-гідроксіетил)-N-(3R-(-)-5'-N-(3-піридил)аміноспіро[1тієнілметил)аміноспіро[1-азабіцикло[2.2.2]октаназабіцикло[2.2.2]октан-3,2'(3’Н)-фуро[2,33,2'-(3'Н)-фуро[2,3-b]піридин], та їх енантіомери та b]піридин]; їх фармацевтично прийнятні солі. R-(-)-6'-N-(фенілметил)аміноспіро[114. Сполука за п. 1, яка являє собою собою: азабіцикло[2.2.2]октан-3,2'(3’Н)-фуро[2,3R-(-)-5'-(3-піридилметил)аміноспіро[1b]піридин]; азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3R-(-)-5'-N-(3-тієнілметил)аміноспіро[1b]піридин]; азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3R-(-)-5'-(4-піридилметил)аміноспіро[1b]піридин]; азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3R-(-)-5'-N-(2-фенілетил)аміноспіро[1b]піридин], азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3або її енантіомер та її фармацевтично прийнятні b]піридин]; солі. R-(-)-5'-N-(3-фенілпропіл)аміноспіро[115. Сполука за будь-яким одним з пп. 1-14 для азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3використання у терапії. b]піридин]; 16. Сполука за будь-яким одним з пп.1-14, яка виR-(-)-5'-N-(хінолін-3-ілметил)аміноспіро[1користовується для виготовлення лікарського преазабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3парату для лікування або профілактики психотичb]піридин]; них порушень або порушень інтелектуальної здатності. 5 71598 6 17. Сполука за будь-яким одним з пп. 1-14, яка 23. Фармацевтична композиція за п. 21, яку виковикористовується при виготовленні лікарського ристовують для лікування або профілактики хвопрепарату для лікування або профілактики захвороби Паркінсона, хвороби Хантінгтона, хвороби рювань або станів людини, для яких корисна актиТуретта або нейродегенеративних порушень, при яких відбувається втрата холінергічних синапсів. вація нікотинового рецептора a7. 24. Фармацевтична композиція за п. 21, яку вико18. Сполука за п.16 або 17, де стан або порушення ристовують для лікування або профілактики розявляє собою хворобу Альцгеймера, дефіцит здатності навчання, дефіцит пізнавальної здатності, ладу нормального циркадного ритму, нікотинової залежності, включаючи залежність, яка є резульдефіцит уваги, втратупам'яті, дефіцит уваги, який татом впливу продуктів, що містять нікотин, болю характеризується гіперактивністю, деменцію Lewy або неспецифічного виразкового коліту. Body, тривожні стани, шизофренію, манію або ма25. Спосіб одержання сполуки формули I, у якій ніакальну депресію, хворобу Паркінсона, хворобу Хантінгтона, хворобу Туретта, нейродегенеративні NRR1 знаходиться у 5'-положенні фуропіридину, за будь-яким одним з пп. 1-14, або її енантіомера та її порушення, при яких відбувається втрата холінерфармацевтично прийнятних солей, який включає гічного синапсу, розлад нормального циркадного алкілування або ацилювання сполук формули VI, ритму, стан при припиненні паління, нікотинову де Е являє собою галоген, NО2 або NHR, R і R1 залежність, включаючи залежність, яка є результатом впливу продуктів, що містять нікотин, біль мають значення, визначені в п.1, у відповідному розчиннику: або неспецифічний виразковий коліт. 19. Фармацевтична композиція, яка містить сполуку за будь-яким одним з пп. 1-14, у суміші з інертним фармацевтично прийнятним розріджувачем або носієм. 20. Фармацевтична композиція за п.19, яку використовують для лікування або профілактики психотичних порушень або порушень інтелектуальних . здатностей. 26. Похідне фуропіридину формули 21. Фармацевтична композиція за п. 19, яку використовують для лікування або профілактики хвороби Альцгеймера, дефіциту здатності навчання, дефіциту пізнавальної здатності, дефіциту уваги, втрати пам'яті, дефіциту уваги, який характеризується гіперактивністю, деменції Lewy Body, тривожних станів, шизофренії, манії або маніакальної . депресії, хвороби Паркінсона, хвороби Хантінгто27. Похідне фуропіридину формули на, хвороби Туретта, нейродегенеративних порушень, при яких відбувається втрата холінергічного синапсу, розладу нормального циркадного ритму, стану при припиненні паління, нікотинової залежності, включаючи залежність, яка є результатом впливу продуктів, які містять нікотин, болю або неспецифічного виразкового коліту. 22. Фармацевтична композиція за п. 21, яку використовують для лікування або профілактики три, вожних станів, шизофренії, манії або маніакальної де Е являє собою NО2, NHR або галоген, R придепресії. ймає значення, визначені в п.1. Даний винахід відноситься до нових заміщених амінів спірофуропіридинів або їх фармацевтично прийнятних солей, способів їх отримання, фармацевтичних композицій, що містять їх, та їх застосуванню у терапії. Наступною ціллю є забезпечення активних сполук, які є сильнодіючими лігандами для нікотинових рецепторів ацетилхоліну (nAChR's). Використання сполук, які зв'язують нікотинові рецептори ацетилхоліну, при лікуванні ряду захворювань, зв'язаних із зниженою холінергічною функцією, таких як хвороба Альцгеймера, розлад пі знавальної здатності або уваги, тривога, депресія, стан при припиненні паління, нейропротективна дія, шизофренія, аналгезія, синдром Туретта та хвороба Паркінсона, обговорювалося McDonald et al. (1995) "Nicotinic Acetylcholine Receptors: Molecular Biology, Chemistry and Pharmacology", Chapter 5 in Annual Reports in Medicinal Chemistry, vol.30, pp.41-50, Academic Press Inc., San Diego, CA; Williams et al. (1994) "Neuronal Nicotinic Acetylchoiine Receptors", Drug News and Perspectives, vol.7, pp.205-223; and Lin and Meyer, "Recent Developments in Neuronal Nicotinic 7 71598 8 Acetylchoiine Receptor Modulators", Exp. Opin. Ther. також бути циклічними, наприклад, циклопропіл, Patents (1998), 8(8): 991-1015. циклобутил. У патенті США 5468875 описуються 1Якщо не зазначено інше, С1-С4-алкоксигрупи, азабіцикло[2.2.1]-гепт-3-ілові ефіри Nзазначені в описі, наприклад, метокси, етокси, налкілкарбамінової кислоти, які є активними для пропокси, ізопропокси, н-бутокси, ізобутокси, третцентральної нервової системи мускариновими бутокси, втор-бутокси, можуть бути нерозгалужеагентами, корисними при лікуванні хвороби Альцними або розгалуженими. геймера та інших порушень. Якщо не зазначено інше, С2-С4-алкенільні гру1-Азабіцикло[2.2.2]октан-3-ілові ефіри N-(2пи, зазначені в описі, можуть містити один або два алкоксифеніл)карбамінових кислот описуються у подвійні зв'язки, наприклад, етеніл, ізопропеніл, нPharmazie, vol.48, 465-466 (1993) разом із їх місцебутеніл, ізобутеніл, аліл, 1,3-бутадієніл. вою анестезуючою активністю. 1Якщо не зазначено інше, С2-С4-алкінільні груАзабіцикло[2.2.2]октан-3-ілові ефіри N-фенілпи, зазначені в описі, можуть містити один потрійкарбамінових кислот, заміщених в орто-положенні ний зв'язок, наприклад, етиніл, пропиніл, 1- або 2фенільного кільця, описуються як місцеві анестебутиніл. тики у Acta Pharm. Suecica, 7, 239-246 (1970). Галоген, зазначений в описі, може бути фтоФуропіридини, які можна використовувати для ром, хлором, бромом або йодом. регулювання синаптичної передачі, описуються у Якщо не зазначено інше, (заміщений) феніл WO 97/05139. відноситься до фенільного кільця, необов'язково Відповідно до даного винаходу, було виявлезаміщеного 1-3 з наступних замісників: водень, но, що сполуки формули І галоген, С1-С4-алкіл, С2-С4-алкеніл, С2-С4-алкініл, ОН, ОС1-С4-алкіл, CO2R5, -CN, -NO2 , -NR 3R4, -CF3. Переважними сполуками винаходу є сполуки формули І, де А представляє N. Переважними сполуками винаходу є сполуки формули І, де R1 представляє (СН2)n Аr. Переважними сполуками винаходу є сполуки формули І, де R1 представляє СН 2СН=СНАr. Переважними сполуками винаходу є сполуки формули І, де R1 представляє СН 2ОСАr. де Переважними сполуками винаходу є сполуки NRR1 приєднаний у 5- або 6-положенні кільця формули І, де Аr вибирають з групи: фенільне кіфуропіридину; льце, необов'язково заміщене 1-3 з наступних заR представляє водень, С1-С4-алкіл, COR2; місників: галоген, С1-С4-алкіл, С2-С4-алкеніл, С2-С4R, представляє (СН2)nАr, СН2СН=СНА r або алкініл, ОН, ОС1-С4-алкіл, CO2R5, -CN, -NO2, СН2ОСАr; NR3R4 та -CF3; 2-,3-або 4-піридил; 2- або 3n дорівнює числу від 0 до 3; фураніл; 2- або 3-тієніл; 2- або 4-імідазоліл; 1-, 2А представляє N або NO; або 3-піроліл, 2-або 4-оксазоліл; та 3- або 4Аr представляє 5- або 6-членне ароматичне ізоксазоліл. або гетероароматичне кільце, яке містить 0-4 атоПереважними сполуками винаходу є сполуки ма азоту, 0-1 атом кисню та 0-1 атом сірки; формули І, де Аr вибирають з групи: 1-або 2або 8-, 9- або 10-членну конденсовану ароманафтил; 2-, 3-, 4-, 5-, 6-, 7- або 8-хіноліл; 1-, 3-, 4-, тичну або гетероароматичну циклічну систему, яка 5-, 6-, 7- або 8-ізохіноліл; 2-, 4-, 5-, 6- або 7містить 0-4 атома азоту, 0-1 атом кисню та 0-1 бензоксазоліл; і 3-, 4-, 5-, 6- або 7-бензизоксазоліл. атом сірки; будь-який з них може бути, необов'язПереважними сполуками винаходу є сполуки ково, заміщений 1-2 замісниками, незалежно, вибформули І, де R3, R4 та R5, незалежно, представраними з галогену, трифторметилу або С 1-С4ляють водень або С1-С4-алкіл. алкілу; Переважними сполуками винаходу є сполуки R2 представляє водень; С1-С4алкіл; С1-С4формули І, де n дорівнює 1. алкокси; або фенільне кільце, необов'язково заміПереважними сполуками винаходу є сполуки щене 1-3 з наступних замісників: галоген, С1-С4формули І, де R представляє водень. алкіл, С2-С4-алкеніл, С2-С4-алкініл, ОН; ОС1-С4Переважними сполуками винаходу є сполуки алкіл, CO2R5, -CN, -NO2, -NR3R4 або -CF3; формули І, де Аr представляє гетероароматичне R3, R4 та R5 незалежно представляють водень; кільце. С1-С4-алкіл або фенільне кільце необов'язково Переважними сполуками винаходу є сполуки заміщене 1-3 з наступних замісників: галоген, С1формули І, де n дорівнює 1, R представляє водень С4-алкіл, С2-С4-алкеніл, С2-С4-алкініл, ОН, ОС1-С4та Аr представляє гетероароматичне кільце. алкіл, CO2R2, -CN; -NO2 або -CF3 ; Переважні сполуки винаходу включають наабо їх енантіомери та їх фармацевтично приступні сполуки: йнятні солі, є сильнодіючими лігандами для нікоR-(-)-5'-N-(фeнiлмeтил)aмiнocпipo[1тинових рецепторів ацетилхоліну. aзaбiциклo[2.2.2]oктaн-3,2'-(3'H)-фypo[2,3Якщо не зазначено інше, С1-С4-алкільні групи, b]піридин]; зазначені в описі, наприклад, метил, етил, нR-(-)-5'-(2-піридилметил)аміноспіро[1пропіл, н-бутил, ізопропіл, ізобутил, трет-бутил, азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3втор-бутил, можуть бути нерозгалуженими або b]піридин]; розгалуженими та С 3-С4-алкільні групи можуть R-(-)-5'-(3-піридилмєтил)аміноспіро[1 9 71598 10 азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5’-(4-п-піридилметил)аміноспіро[1R-(-)-5'-N-(3-метилфенілметил)аміноспіро[1азабіцикло[2.2.2]-октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-(2-фуранілметил)аміноспіро[1R-(-)-5'-N-(2-хлорфенілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-(3-фуранілметил)аміноспіро[1R-(-)-5'-N-(3-хлорфенілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-(2-тієнілметил)аміноспіро[1R-(-)-5'-N-(3-фенілпропініл)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-(2-імідазолілметил)аміноспіро[1R-(-)-5'-N-(3-гідроксифенілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-(4-метоксифенілметил)аміноспіро[1R-(-)-5'-N-(4-гідроксифенілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-N-(4-xлopфeнiлмeтил)аміноспіро[1R-(-)-5'-N-[транс-3-(4-піридиніл)проп-2aзaбiциклo[2.2.2]oктaн-3,2'-(3’Н)-фуро[2,3еніл]аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)b]піридин]; фуро[2,3-b]піридин]; R-(-)-5'-N-(4-мeтилфeнiлмeтил)аміноспіро[1R-(-)-5'-N-ацетил-N-(3азабіцикло[2.2.2]oктaн-3,2'-(3’Н)-фуро[2,3тієнілметил)аміноспіро[1-азабіцикло[2.2.2]октанb]піридин]; 3,2'-(3'Н)-фуро[2,3-b]піридин]; R-(-)-5'-N-(3,4-дихлорфенілметил)аміноспіро[1R-(-)-5'-N-метил-N-(4азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3піридилметил)аміноспіро[1-азабіцикло[2.2.2]октанb]піридин]; 3,2'-(3'Н)-фуро[2,3-b]піридин]; R-(-)-5'-N-ацетил-R-(фенілметил)аміноспіро[1R-(-)-5'-N-метил-N-(3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3піридилметил)аміноспіро[1-азабіцикло[2.2.2]октанb]піридин]; 3,2'-(3'Н)-фуро[2,3-b]піридин]; R-(-)-5'-N-метил-R-(фенілметил)аміноспіро[1R-(-)-5'-N-(2-гідроксіетил)-N-(3азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3тієнілметил)аміноспіро[1-азабіцикло[2.2.2]октанb]піридин]; 3,2'-(3'Н)-фуро[2,3-b]піридин] та їх енантіомери та R-(-)-5'-N-(3-піридил)аміноспіро[1їх фармацевтично прийнятні солі. азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3Найпереважнішими сполуками винаходу є b]піридин]; сполуки формули І, де n дорівнює1; R представляє R-(-)-6'-N-(фенілметил)аміноспіро[1водень та Аr представляє гетеро ароматичне кільазабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3це, включаючи наступні сполуки: b]піридин]; R-(-)-5'-(3-піридилметил)аміноспіро[1R-(-)-5’-N-(3-тієнілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2.2.2]октан-3,21-(3'Н)-фуро[2,3b]піридин]; b]піридин]; R-(-)-5'-(4-піридилметил)аміноспіро[1R-(-)-5’-N-(2-фeнiлeтил)аміноспіро[1азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3aзaбiциклo[2.2.2]oктaн-3,2'-(3’Н)-фypo[2,3b]піридин] та їх енантіомери та їх фармацевтично b]піридин]; прийнятні солі. R-(-)-5'-N-(3-фенілпропіл)аміноспіро[1Сполуки винаходу мають перевагу, яка поляазабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3гає у тому, що вони можуть бути менш токсичниb]піридин]; ми, більш ефективними, більш довгодіючими, маR-(-)-5'-N-(хінолін-3-ілметил)аміноспіро[1ють більш широкий діапазон активності, можуть азабіцикло[2.2.2]октан-3,2'-(3’Н)-фуро[2,3бути більш сильнодіючими, викликають менше b]піридин]; побічних ефектів та легше поглинаються або маR-(-)-5'-N-(хінолін-4-ілметил)аміноспіро[1ють інші корисні фармакологічні властивості. азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3Способи отримання b]піридин]; У наведених нижче схемах реакцій та тексті, R R-(-)-5'-N-(1,4-бензодіоксан-6та R1, якщо не зазначено інше, мають значення, ілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'вказані вище для формули І. Сполука формули VIII (3’Н)-фуро[2,3-b]піридин]; являє собою сполуку формули І, де NRR1 приєдR-(-)-5'-N-(імідазол-4-ілметил)аміноспіро[1наний у 5-положенні кільця фуропіридину. Сполука азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3формули IX являє собою сполуку формули 1, де b]піридин]; NRR1 приєднаний у 6-положенні кільця фуропіриR-(-)-5'-N-(транс-3-фенілпроп-2дину. А представляє Ν; Ε представляє галоген, еніл)аміноспіро[1-азабіцикло[2.2.2]октан-3,2'-(3'Н)ΝΟ2 або NHR. Сполуки формули І можна отримати фуро[2,3-b]піридин]; за способами, зазначеними у схемі 1. R-(-)-5'-N-(тіазол-2-ілметил)аміноспіро[1 11 71598 Сполуки формули І, де А представляє NО, можна отримати з сполук формули І, де А представляє N, окисненням пероксидним реагентом у відповідному розчиннику з наступним відновленням оксидів третинних амінів у відповідному розчиннику. Окиснюючі агенти включають пероксид водню, м-хлорпербензойну кислоту, пероцтову кислоту або монопероксифталат магнію. Переважним окисником є м-хлорпербензойна кислота. Відповідні інертні розчинники включають хлороформ, метиленхлорид та 1,2-дихлоретан. Переважним розчинником є дихлорметан. Взаємодію звичайно проводять при температурі від -20°С до 66°С, переважно, від 0°С до 20°С. Відновні агенти включають діоксид сірки та трифенілфосфін. Переважним агентом є діоксид сірки. Відповідні інертні розчинники включають воду та спирти. Переважним розчинником є етанол. Взаємодію звичайно проводять при температурі від -20°С до 50°С, переважно, від 0°С до 25°С. Сполуки формули І, де R представляє CОR2, можна отримати зі сполук формули І, де R представляє водень, з використанням відповідної методики ацилювання. Типові методики ацилювання включають обробку карбоновою кислотою та агентом сполучення, наприклад, дициклогексилкарбодіімідом, у відповідному розчиннику, наприклад, тетрагідрофурані, або обробку хлорангідридом або ангідридом карбонової кислоти у присутності основи. Переважним способом є обробка ангідридом карбонової кислоти. Відповідні основи включають триетиламін, 4-(N,N-диметиламіно)піридин або піридин. Переважною основою є піридин. Реакцію звичайно проводять при температурі від 0°С до 120°С, переважно, від 80°С до 100°С. Сполуки IX можна отримати зі сполуки VII взаємодією з галогеногенуючим реагентом таким як оксихлорид фосфору, оксибромід фосфору, пентахлорид фосфор у або пентабромід фосфору, з наступною взаємодією з аміном в інертному розчиннику. Переважним галогенуючим реагентом є оксихлорид фосфору. Реакцію галогенування звичайно проводять при температурі від 0°С до 150°С, переважно, від 80°С до 120°С. Аміновим компонентом може бути будь-який амін HNRR1, визначений вище. Відповідні інертні розчинники 12 включають спиртові розчинники, такі як метанол та етанол, а також ароматичні розчинники, такі як бензол, толуол або ксилол. Переважним інертним розчинником є етанол. Взаємодію звичайно проводять при температурі від 20°С до 200°С, переважно, від 100°С до 170°С. Взаємодію з аміном можна полегшити присутністю відповідного металоорганічного каталізатора та основи. Відповідні металоорганічні каталізатори включають комплекси паладію та фосфінів, які можна отримати in situ з джерела паладію та відповідного фосфіну. Переважним джерелом паладію є трис(дибензиліденацетондипаладій(0). Переважним фосфіном є 2,2'-бис(дифенілфосфіно)-1,1’бінафтил. Відповідні основи включають біс(триметилсиліл)амід літію або трет-бутоксид натрію, переважно, трет-бутоксид натрію. Відповідні інертні розчинники для взаємодії у присутності металоорганічного каталізатора включають тетрагідрофуран, 1,2-диметоксиетан або 1,4-діоксан, переважно, 1,2-диметоксіетан, і реакцію звичайно проводять при температурі від 60°С до 120°С, переважно від 80°С до 110°С. Сполуки формули VIII можна отримати з сполук формули VI, де Ε представляє NHR, відповідною методикою алкілування. Типові методики алкілування включають обробку відповідним алкілгалогенідом або сульфонатним ефіром та основою, наприклад, гідридом натрію, у відповідному розчиннику, наприклад, ДМФ, або відновне алкілування з використанням відповідного ароматичного альдегіду разом з відповідним відновним агентом в інертному розчиннику. Переважним способом є спосіб відновного алкілування. Відповідні ароматичні альдегіди включають Ar(CH2)mCHO, ArCH=CHCHO або АrºССНО, де m може дорівнювати 0-2 та Аr має вказані вище значення. Відповідні відновні алкілуючі агенти включають борогідрид натрію і ціаноборогідрид натрію. Переважним відновним агентом є борогідрид натрію. Відповідні інертні розчинники включають воду, метанол або етанол. Переважним розчинником є метанол. Взаємодію звичайно проводять при температурі від 0°С до 100°С, переважно, від 20°С до 65°С. Сполуки формули VIII можна отримати зі сполук формули VI, де Ε представляє галоген, взаємодією з аміном формули RR1NH у присутності відповідного металоорганічного каталізатора, основи та розчинника. Відповідні металоорганічні каталізатори включають комплекси паладію та фосфінів, які можна отримати in situ з джерела паладію та відповідного фосфіну. Переважним джерелом паладію є трис(дибензиліденацетон)дипаладій(0). Переважним фосфіном є 2,2'-біс(дифенілфосфіно)-1,1’бінафтил. Відповідні основи включають біс(триметилсиліл)амід літію або трет-бутоксид натрію, переважно, трет-бутоксид натрію. Відповідні інертні розчинники включають тетрагідрофуран, 1,2-диметоксіетан або 1,4-діоксан. Переважним розчинником є 1,2-диметоксіетан. Реакцію звичайно проводять при температурі від 60°С до 120°С, переважно, від 80°С до 110°С. Сполуки VII можна отримати зі сполуки V окисненням пероксидним реагентом у відповідному 13 71598 14 розчиннику з наступним відновленням оксидів третрію, амід натрію, гідрид калію, трет-амілат калію, тинних амінів у відповідному розчиннику. Окиснютрет-бутоксид калію та біс(триметилсиліл)амід ючі агенти включають пероксид водню, мкалію. Переважною основою є гідрид натрію. Відхлорпербензойну кислоту, пероцтову кислоту або повідні інертні розчинники включають Ν,Νмонопероксифталат магнію. Переважним окиснидиметилформамід, N-метилпіролідин-2-он, прості ком є м-хлорпербензойна кислота. Відповідні інерефіри, такі як діетиловий ефір, тетрагідрофуран та тні розчинники включають хлороформ, метилен1,4-діоксан, та диметил-сульфоксид. Переважним хлорид та 1,2-дихлоретан. Переважним інертним розчинником є Ν,Ν-диметилформамід. розчинником є дихлорметан. Взаємодію звичайно Взаємодію звичайно проводять при температурі проводять при температурі від -20°С до 66°С, певід -10°С до 100°С, переважно, від 20°С до 66°С. реважно, від 0°С до 20°С. Відновні агенти включаВідповідні кислоти для зняття захисту у цикліють діоксид сірки та трифенілфосфін. Переважним зованої сполуки включають мінеральні, органічні агентом є діоксид сірки. Відповідні інертні розчинкислоти та кислоти Льюїса, наприклад, хлористоники включають воду та спирти. Переважним розводневу та бромістоводневу кислоту, сірчану кисчинником є етанол. Взаємодію звичайно проволоту, трифторметансульфонову кислоту, метансудять при температурі від -20°С до 50°С, льфонову кислоту та ефірат трифториду бору. переважно, від 0°С до 25°С. Переважною кислотою є бромистоводнева кислоСполуки формули VI, де Ε представляє NHR та. Відповідні розчинники включають ацетон, бута R представляє алкільну гр упу, можна отримати танон, етанон та пінаколон. Переважним розчинзі сполук формули VI, де Ε представляє ΝΗ2, відником є ацетон. Взаємодію звичайно проводять повідною методикою алкілування. Типові методики при температурі від -10°С до 100°С, переважно, алкілування включають обробку відповідним алкілвід 0°С до 60°С. У альтернативному випадку знятгалогенідом або сульфонатним ефіром та оснотя захисту можна проводити нагріванням комплеквою, наприклад, гідридом натрію у відповідному су борану у спиртових розчинниках. Переважним розчиннику, наприклад, ДМФ або відновне алкілуспособом є кип'ятіння зі зворотним холодильником вання з використанням відповідного альдегіду або комплексу у розчині етанолі. кетону разом з відповідним відновним агентом в Сполуки IV можна отримати зі сполуки III з виінертному розчиннику. Переважним способом є користанням літієвої основи та агента переносу відновне алкілування. Відповідні відновні агенти протонів у інертному розчиннику. Відповідні основключають борогідрид натрію та ціаноборогідрид ви літію включають діізопропіламід літію, ннатрію. Переважним відновним агентом є борогідбутиллітій, втор-бутиллітій, трет-бутиллітій та ферид натрію. Відповідні інертні розчинники включаніллітій. Переважною літієвою основою є фенілліють воду, метанол або етанол. Переважним розтій. Відповідні агенти переносу протонів включачинником є метанол. Взаємодію звичайно ють (стерично) утруднені вторинні аміни, такі як проводять при температурі від 0°С до 100°С, педіізопропіламін та 2,2,6,6-тетраметилпіперидин. реважно, від 20°С до 65°С. Переважним агентом переносу протонів є діізопСполуки формули VI, де Ε представляє ΝΗ 2, ропіламін. Відповідні інертні розчинники включаможна отримати зі сполук формули VI, де Е предють діетиловий простий ефір, тетрагідрофуран та ставляє ΝΟ2, відновленням у відповідному роз1,4-діоксан. Переважним інертним розчинником є чиннику. Відповідні відновні агенти включають тетрагідрофуран. Реакцію звичайно проводять при водень у присутності каталізатора, наприклад, 5температурі від -100°С до 0°С, переважно, від 10% паладію на вугіллі, оксиду платини або родію 78°С до -25°С. на вугіллі. Переважним відновним агентом є воСполуки III можна отримати взаємодією сполудень у присутності 10% паладію на вугіллі. Відпоки II з аніоном реагенту, добре відомого у даній відні інертні розчинники включають воду, метанол області для отримання оксиранів з кетонів (див., або етанол. Переважним розчинником є метанол. наприклад, реакції, зазначені у J. March, "Ad vanced Взаємодію звичайно проводять при температурі Organic Chemistry" (1992) 4 th Edition, pages 974від 0°С до 65°С, переважно, від 15°С до 30°С. 975) із наступною взаємодією з бораном (ВН3 або Сполуки VI, де Ε представляє ΝΟ2, можна В2Н6) в інертному розчиннику, переважно, бораотримати зі сполуки V взаємодією з нітруючим ном у тетрагідрофурані. Відповідні інертні розчинагентом у відповідному розчиннику. Переважним ники включають діетиловий простий ефір, тетрагінітруючим агентом є азотна кислота; переважним дрофуран та 1,4-діоксан. Переважним інертним розчинником є сірчана кислота. Взаємодію звирозчинником є тетрагідрофуран. Взаємодію звичайно проводять при температурі від -10°С до чайно проводять при температурі від -10°С до 100°С, переважно, від 50°С до 80°С. 66°С, переважно, від 0°С до 20°С. Відповідні епокСполуки формули VI, де Ε представляє галосидуючі агенти включають йодид триметилсульген, можна отримати зі сполуки V взаємодією з фоксонію, йодид триметилсульфонію та діазомегалогенуючим агентом у відповідному розчиннику, тан. Переважним агентом є йодид наприклад, бромом в оцтовій кислоті. Взаємодію триметилсульфоксонію. Відповідні інертні розчинзвичайно проводять при температурі від 0°С до ники включають диполярні апротоні розчинники. 110°С, переважно, від 60°С до 110°С. Переважним розчинником є диметилсульфоксид. Сполуки V можна отримати циклізацією сполуВзаємодію звичайно проводять при температурі ки IV у присутності основи в інертному розчиннику від -10°С до 100°С, переважно, від 50°С до 75°С. з наступним зняттям захисту у циклізованої сполуКоли необхідно, гідрокси, аміно або інші реакки з використанням кислоти у відповідному розційноздатні групи можна захистити з використанчиннику. Відповідні основи включають гідрид наням захисної групи, як описано у стандартній мо 1571598 16 нографії "Protecting groups in Organic Synthesis", 2nd Edition (1991) by Greene and Wilts. Вищеописані реакції, якщо не зазначено інше, звичайно проводять при тиску від однієї до трьох атмосфер, переважно, при тиску навколишнього середовища (приблизно, одна атмосфера). Якщо не зазначено інше, вищеописані реакції проводять в інертній атмосфері, переважно, в атмосфері Проміжні сполуки також існують у енантіомеразоту. них формах і можуть бути використані у вигляді Сполуки винаходу та проміжні продукти можна очищених енантіомерів, рацематів або сумішей. виділити з їх реакційних сумішей стандартними Використання сполук VI та VII як проміжних способами. продуктів у синтезі ліганду для нікотинових рецепКислотно-адитивні солі сполук формули І, які торів ацетилхоліну є іншим аспектом винаходу. можуть бути вказані, включають солі мінеральних Фармацевтичні композиції кислот, наприклад, гідрохлоридні та гідробромідні Наступний аспект винаходу відноситься до солі, та солі, утворені органічними кислотами, такі фармацевтичної композиції для лікування або як форміатна, ацетатна, малеатна, бензоатна, профілактики стану або порушення, приклади яких тартратна та фумаратна солі. наводяться нижче, що є результатом дисфункції Кислотно-адитивні солі сполук формули І монейропереносу нікотинового рецептора ацетилхожна отримати взаємодією вільної основи або її ліну у ссавця, переважно, людини, яка містить солі, енантіомера або захищеного похідного з одкількість сполуки формули І, її енантіомера та її ним або декількома еквівалентами відповідної фармацевтично прийнятної солі, ефективну для кислоти. Взаємодію можна проводити у розчиннилікування або профілактики такого порушення або ку або середовищі, в якому сіль нерозчинна, або у стану, і інертний фармацевтично прийнятний розчиннику, у якому сіль розчинна, наприклад, носій. воді, діоксані, етанолі, тетрагідрофурані або діеДля вищевказаних застосувань введена доза, тиловому ефірі, або суміші розчинників, які можна буде, звичайно, змінюватися в залежності від вивидалити у вакуумі або сушінням виморожуванкористовуваної сполуки, способу введення та неням. Реакція може бути метатезисним процесом обхідного лікування. Однак, загалом, задовільні або її можна проводити на іонообмінній смолі. результати будуть отримані, коли сполуки винахоСполуки формули І існують у таутомерних або ду вводять при добовій дозі від 0,1мг до 20мг на кг енантіомерних формах, усі з яких включені в обсяг маси тіла ссавця, переважно, даної у вигляді розвинаходу. Різні оптичні ізомери можна виділити ділених доз від 1 до 4 разів у день або у формі з поділом рацемічної суміші сполук з використанням тривалим вивільненням (пролонгованою дією). звичайних методик, наприклад, фракційної крисДля людини загальна добова доза знаходиться у талізації або хіральної ВЕЖХ. У альтернативному діапазоні від 5мг до 1400мг, більш переважно, від випадку, індивідуальні енантіомери можна отри10мг до 100мг, і одинична дозована форма, яка мати взаємодією відповідних оптично активних підходить для перорального введення, включає вихідних матеріалів в умовах реакції, які не викливід 2мг до 1400мг сполуки, змішаної з твердим або кають рацемізацію. рідким фармацевтичним носієм або розрідПроміжні продукти жувачем. Наступний аспект винаходу відноситься до ноСполуки формули І або її енантіомер або її вих проміжних продуктів. Особливий інтерес серед фармацевтично прийнятні солі можна використоцих нових проміжних продуктів представляють вувати так або у формі відповідних лікарських сполуки формули VI та VII на схемі І. Ці проміжні препаратів для ентерального, парентерального, продукти можна використовувати для синтезу споперорального, ректального або назального ввелук формули І, але їх використання не обмежуєтьдення. У відповідності з наступним аспектом винася синтезом зазначених сполук. Формули для цих ходу, пропонується фармацевтична композиція, сполук подані нижче: переважно, яка містить менше, ніж 80%, і, більш Сполуки формули VI переважно, менше, ніж 50% мас. сполуки винаходу, у суміші з інертним фармацевтично прийнятним розріджувачем або носієм. Прикладами відповідних розріджувачів та носіїв є: - для таблеток та драже; лактоза, крохмаль, тальк, стеаринова кислота; для капсул: винна кислота або лактоза; - для ін'єкційних розчинів: вода, спирти, гліцерин, рослинні олії; для суппозиторієв: природні або де Ε представляє ΝΟ2, NHR або галоген; та гідрогенізовані жири або воски. сполуки формули VII Пропонується також спосіб отримання такої фармацевтичної композиції, якавключає змішування інгредієнтів одночасно або послідовно. Застосування Наступним аспектом винаходу є застосування сполуки за даним винаходом або її енантіомера та 17 71598 18 її фармацевтично прийнятної солі при виготовленаміноетиловий ефір) етиленгліколю] протягом 2 ні лікарського препарату для лікування або профігодин при 21°С і потім фільтрували та промивали лактики одного з нижчевказаних захворювань або 4 рази на фільтрах Ватману зі скляних волокон станів; і спосіб лікування або профілактики одного (товщина С) з використанням збірника клітин Браз нижчевказаних захворювань або станів, який нделя. Попередня обробка фільтрів протягом 3 включає введення терапевтично ефективної кільгодин 1% розчином (АБС/0,01% РЕІ (поліетиленікості сполуки за винаходом або її енантіомера, та мін)) у воді була критичною для низьких контролів її фармацевтично прийнятної солі пацієнту. фільтрів (0,07% загальної кількості у хвилину). Сполуки за даним винаходом є агоністами ніНеспецифічне зв'язування описували 100мкМ (-)котинових рецепторів ацетилхоліну. Не обмежуюнікотином, і специфічне зв'язування у типовому чись теорією, вважають, що агоністи nAChR (ніковипадку було 75%. тинового рецептора ацетилхоліну) підтипу a7 Дослід В - Аналіз на афінність до підтипу a4 повинні бути корисними для лікування або профіnAChR лактики психотичних порушень та порушень інтеЗв'язування [3Н]-(-)-нікотину. З використанням лектуальних здатностей, і мають переваги у порівпроцедури, модифікованої за Martino-Barrows та нянні зі сполуками, які є або також є агоністами Kellar (МоI. Pharm (1987) 31:169-174), головний мозок (кору та гіпокамп) пацюків гомогенізували, як nAChR підтипу a4. Отже, сполуки, що є селективв аналізі зв'язування [125 І]-a-ВТХ, центрифугували ними для підтипу a7 nAChR, є переважними. Спопротягом 20 хвилин при 12000g, промивали два луки винаходу є селективними для підтипу a7 рази і потім повторно суспендували у НВ, яка місnAChR. Як фармацевтичні засоби сполуки винахотить 100мкМ діізопропілфторфосфату. Через 20 ду призначаються, зокрема, для лікування або хвилин при 4°С мембрани (приблизно, 0,5мг) інкупрофілактики психотичних порушень і порушень бували з 3нМ [3Н]-(-)-нікотином, випробуваним інтелектуальних здатностей. Приклади психотичлікарським засобом, 1мкМ атропіну та або 2мМ них порушень включають шизофренію, манію або СаСI2, або 0,5мМ EGTA протягом 1 години при 4°С маніакальну депресію та тривожні стани. Приклата потім фільтрували через фільтри Ватману зі ди порушень інтелектуальних здатностей включаскляних волокон (товщина С) (попередньо обробють хворобу Альцгеймера, дефіцит здатності налені протягом 1 години 0,5% РЕІ) з використанням вчання, дефіцит пізнавальних здатностей, дефіцит збірника клітин Бранделя. Неспецифічне зв'язууваги, втрату пам'яті, деменцію Lewy Body та девання описували 100мкМ карбахолом та специфіфіцит уваги , який характеризується гіперактивнісчне зв'язування у типовому випадку було 84%. тю. Сполуки винаходу можуть бути також корисАналіз даних зв'язування для дослідів А та В ними як аналгетики при лікуванні болю Розміри IC50 та псевдокоефіцієнти Хілла (nH) (включаючи хронічний біль) та для лікування або обчислювали з використанням програми ALLFIT профілактики хвороби Паркінсона, хвороби Хантіннелінійної апроксимації кривої (DeLean A, Munson гтона, хвороби Туретта та нейродегенеративних P.J. and Rodbard D. (1977) Am. J. Physiol., 235:E97порушень, при яких відбувається втрата холінергіE102). Криві насичення були апроксимовані для чних синапсів. Сполуки винаходу можуть бути доодносторонньої моделі з використанням програми датково показані для лікування або профілактики ENZFITTER нелінійної регресії (Leatherbarrow, R.J. розладу нормального циркадного ритму, для вико(1987)), що давало розміри КD 1,67 та 1,70нМ для ристання в індукуванні припинення паління та для лігандів 125І-a-ВТХ та [ 3Н]-(-)-нікотину, відповідно. лікування або профілактики нікотинової залежності Розміри Кі обчислювали з використанням загаль(включаючи залежність, яка є результатом впливу ного рівняння Cheng-Prusoff: продуктів, які містять нікотин). Кі-[IC50]/((2+([ліганд]/[КD] n])1/n-1) Вважається також, що сполуки за винаходом де величину n=1 використовували кожен раз, корисні для лікування та профілактики неспецифіколи nH10 (сполуки IV) з використанням твердого карбонату натрію, і розРозчин феніллітію (1,8Μ у суміші циклогекчин, що утворився, екстрагують хлороформом сан/ефір [7:3], 167мл, 0,3моль, 3еквів.) додають за (3x100мл). Органічні екстракти об'єднують, сушать допомогою канюлі до безводного тетрагідрофура(MgSO4), фільтр ують та упарюють при зниженому ну (350мл) при -60°С в атмосфері азоту. Потім потиску з отриманням вищевказаної сполуки VI краплях додають діізопропіламін (0,7мл, 5ммоль) з (11,2г, 51,8ммоль, 98%, загальний вихід 54%) у наступним додаванням по краплях 2-хлорпіридину вигляді не зовсім білої твердої речовини: МС з (28,4мл, 0,3моль, 3еквів.) протягом десятьох хвиелектророзпиленням 217 ([МН]+, 72). лин. Розчин, що утворився, перемішують при Зазначену у заголовку сполуку розділяють на 40°С в атмосфері азоту протягом 1,5 години. Розїї (R)- та (S)-енантіомери одним з наступних спочин потім прохолоджують до -60°С і по краплях собів: додають розчин комплексу спіро[1Спосіб А - 250мг зазначеної у заголовку сполуазабіцикло[2.2.2]октан-3,2'-оксиран]-N-боран ки розділяють хіральною ВЕЖХ з використанням (15,3г, 0,1моль) у тетрагідрофурані (75мл). Реакколонки 2см x 25см CHIRALCEL-OD на системі для ційну суміш, що утворилася, потім перемішують препаративної хроматографії Waters Delta Prep. при -40°С в атмосфері азоту. Через 3 години пові3000 з елююванням сумішшю 2,2,4льно додають насичений розчин бікарбонату натриметилпентан/етанол (від 92:8 до 9:1) при швидтрію (150мл), потім воду (400мл), і водній суміші, кості потоку 20-мл/хв. Це дає 111мг (S)що утворилася, дають можливість нагрітися до енантіомера ([a]23=+59,7 (с=1, метанол)) та 90мг кімнатної температури. Шари розділяють, і водну (R)-енантюмера ([a]23=-63,9 (с=1, метанол)). фазу екстрагують етилацетатом (3х100мл). ОргаСпосіб В - 1г (4,62ммоль) зазначеної у заголонічні шари об'єднують, суша ть (MgSO4), фільтрувку сполуки обробляють L-(+)-винною кислотою ють та упарюють при зниженому тиску. Колоночна (694мг; 4,62ммоль) у 15% водному етанолі (10мл) хроматографія з використанням силікагелю та та перекристалізовують три рази з отриманням Lелюювання сумішшю етилацетат/гексани [3:2] дає (+)-тартрата (S)-енантіомера (650мг; 1,77ммоль; вищевказану сполуку IV у вигляді рудува то[a]23=+57,7 (с=2, Н2О)). Фільтрати концентрують коричневої твердої речовини (17,5г, 65,6ммоль, при зниженому тиску і водний залишок підлугову66%): МС з електророзпиленням 269 ([МН]+ с 37СІ, ють до рН>10 з використанням твердого карбонату + 35 10), 267 ([МН] с СІ, 26). натрію. Суміш, що утворилася, екстрагують хло 21 71598 22 роформом (3x25мл) та об'єднані екстракти сушать силікагелю з використанням суміші 9:1 хлорофор(MgSO4) та упарюють при зниженому тиску. Залиму та 2,0Μ аміаку у метанолі як елюенті з отришок (650мг; 3ммоль) обробляють D-(-)-винною манням 1,30г (60%) зазначеної у заголовку сполукислотою (452мг; 3ммоль) та перекристалізовують, ки після кристалізації з суміші етилацетат/гексан як описано вище, з отриманням D-(-)-тартрата(R)(1:1): ([a]23=-56,82° (с=1,09, EtOH), MC з електроенантіомера (775мг; 2,11ммоль; ([a]23=-58,2° (с=2, розпиленням 233 [МН]+, 100). Н2О)). Отримання 7А Отримання 4 5'-бромспіро[1-азабіцикло[2.2.2]октан-3,2(3'H)(R)-(-)-5'-нітроспіро[1-азабіцикло[2.2.2]октанфуро[2,3-b]-піридин] 3,2'(3'Н)-фуро[2,3-b]піридин (сполука VI, Ε=Вr) (сполука VI, Ε=NO 2) Розчин спіро[1-азабіцикло[2.2.2]октан-3,2'(3'Н)(R)-(-)-спіро[1-азабіцикло[2.2.2]октан-3,2'(3'Н)фуро[2,3-b]піридину] (100мг, 0,462ммоль) та ацефуро-[2,3-b]піридин (3,03г, 14ммоль) розчиняють у тату натрію (410мг, 5ммоль) у 50% водній оцтовій концентрованій сірчаній кислоті (7мл) при 0-5°С, кислоті (4мл) нагрівають до 60°С. Через шприц протягом 10 хвилин додають азотну кислоту, яка протягом 10 хвилин додають бром (0,100мл, димить, (3,3мл, 70,2ммоль), суміш перемішують 1,94ммоль), і розчин потім нагрівають при кип'ятінпротягом 1 години та нагрівають при 65-70°С проні зі зворотним холодильником протягом 1 години. тягом 24 годин, прохолоджують, виливають у лід Суміші дають можливість охолонути до темпера(200г), додають 300мл води, підлуговують до рН тури навколишнього середовища, підлуговують до 10 твердим карбонатом калію, перемішують протярН>10 карбонатом натрію та екстрагують хлорогом 1 години, фільтрують та сушать з отриманням формом (3x15мл). Об'єднані екстракти сушать твердого зазначеної у заголовку сполуки (3,6г, (MgSO4), фільтр ують та упарюють при зниженому 13,8ммоль, 98%): МС з електророзпиленням 262 тиску з отриманням зазначеної у заголовку сполу([МН]+ 100). ки (110мг, 0,37ммоль, 81%) у вигляді не зовсім Отримання 5 білої твердої речовини: МС з електророзпиленням (R)-(-)-5'-аміноспіро[1-азабіцикло[2.2.2]октан295 ([МН]+ с 79Вr, 100), 297 ([МН]+ с 81Вr, 98). 3,2'(3'H)-фуро[1,3-b]піридин Отримання 7В (сполука VI, E=NH 2) (R)-(-)-5'-бромспіро[1-азабіцикло[2.2.2]октанСуміш енантіомера (R)-(-)-5'-нітроспіро[13,2'(3'H)-фуро-[2,3-b]піридин] азабіцикло-[2.2.2]октан-3,2'(3'Н)-фуро[2,3(сполука VI, Ε=Вr) b]піридину (3,8г, 13,3моль), та 10% паладію на Енантіомер (R)-(-)-спіро[1вугіллі (48% вологість, 270г) у метанолі (90мл) азабіцикло[2.2.2]октан-3,2'(3'Н)-фуро[2,3-b]піридин] гідрують протягом 1 години при тиску водню (1,95г, 9ммоль) обробляють таким самим чином, 344кПа (50 фунтів на кв. дюйм). Каталізатор відояк описано в отриманні 7А, з отриманням зазначекремлюють фільтруванням через шар целіту, і ної у заголовку сполуки (1,77г, 6ммоль, 67%) розчинник випарюють при зниженому тиску; зали([a]23=-45,5° (с=1, МеОН)). шок очищають, флеш-хроматографією (елююванПриклад 1 ня сумішшю, що містить аміак(R)-(-)-5'-N-(фенілметил)аміноспіро[1хлороформ/метанол, від 95:5 до 85:15) з отриманазабіцикло[2.2.2]Октан-3,2'-(3’Н)-фуро[2,3ням зазначеної у заголовку сполуки (2,5г, b]піридин] 10,8ммоль, 81%): МС з електророзпиленням (m/z, Сферичні частинки натрію блотують досуху від відносна інтенсивність) 232 ([МН]+, 100). уайт-спириту, зважують (100мг, 4,3ммоль) і постуОтримання 6 пово додають до 2мл безводного метанолу при (R)-(-)-спіро[1-азабіцикло[2.2.2]октан-3,2'(3'H)перемішуванні в атмосфері азоту при 0°С. Реакфуро[2,3-b]-піридин-N-оксид] ційну суміш перемішують при 0°С протягом 25 (сполуки VII) хвилин, причому за цей час припиняється енергійРозчин 2,03г (9,38ммоль) (R)-(-)-спіро[1не виділення пухирців і майже уся тверда частина азабіцикло-[2.2.2]октан-3,2'(3'Н)-фуро[2,3розчиняється. Додають 5'-аміноспіро[1b]піридину] у 100мл метиленхлориду охолоджують азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3на крижаній бані, і до нього додають по частинах b]піридин] (230мг, 1,0ммоль) і бензальдегід 6,90г (22,8ммоль) 57-86% м-хлорпербензойної (0,23мл, 1,0ммоль), крижану баню видаляють та кислоти протягом 5 хвилин. Реакційній суміші дадодають додаткові 2мл безводного метанолу. Розють можливість нагрітися поступово до темперачин перемішують при кімнатній температурі протятури навколишнього середовища та перемішують гом двох днів, потім нагрівають до 50°С протягом 2 протягом усього 24 годин. Розчинник видаляють у годин. Додають борогідрид натрію (106мг, вакуумі і твердий залишок розчиняють у 100мл 2,8ммоль), і реакційну суміш нагрівають при кип'я абсолютного етанолу, охолоджують на крижаній тінні зі зворотним холодильником протягом 90 бані і через розчин барботують діоксид сірки доти, хвилин. Після охолодження до температури надоки розчин не стане мутним. Реакційну суміш вколишнього середовища метанол видаляють у перемішують протягом 4 годин, потім розчинник вакуумі і залишок розподіляють між 8мл хлорофовидаляють у вакуумі. Твердий залишок розчинярму та 2мл води. Водний шар екстрагують ще два ють у 150мл суміші 9:1 хлороформу та метанолу, рази 8мл хлороформу, і органічні шари об'єднують потім екстрагують 50мл 10% водного гідроксиду і суша ть над сульфатом магнію. Хлороформ випанатрію. Органічний шар сушать над сульфатом рюють у вакуумі, і сирий продукт очищають на магнію, концентрують у вакуумі і флешфлеш-колонці з діоксидом кремнію з використанхроматографують за допомогою нейтрального ням градієнту 0-10% розчин аміаку у метано 23 71598 24 лі/хлороформ, отримуючи 0,25г (77%) зазначеної у процедурою, яка використана у прикладі 1, з 50мг заголовку сполуки у вигляді білого порошку: МС з (0,22ммоль) 5'-аміноспіро[1-азабіцикло[2.2.2]октанелектророзпиленням 322 ([МН]+, 100). 3,2'-(3'Н)-фуро[2,3-b]піридину та 2Приклад 2 тіофенкарбоксальдегіду з отриманням 9мг зазна(R)-(-)-5'-N-(2-піридилметил)аміноспіро[1ченої у заголовку сполуки: МС з електророзпиленазабіцикло[2.2.2]-октан-3,2’-(3'Н)-фуро[2,3ням 328 ([МН]+, 100). b]піридин] Приклад 8 Зазначену у заголовку сполук у отримують (R)-(-)-5'-N-[4процедурою, яка використана у прикладі 1, з 115мг метоксифенілметил)аміноспіро[1-азабіцикло(0,5ммоль) 5'-аміно-спіро[1-азабіцикло[2.2.2]октан[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин] 3,2'-(3'Н)-фуро[2,3-b]піридину] та 0,114мл Зазначену у заголовку сполук у отримують (1,2ммоль) 2-піридинкарбоксальдегіду з отриманпроцедурою, яка використана у прикладі 1, з 50мг ням 84мг зазначеної у заголовку сполуки у вигляді (0,22ммоль) 5'-аміноспіро[1-азабіцикло[2.2.2]октанбежевого порошку (52%): МС з електророзпилен3,2'-(3'Н)-фуро[2,3-b]піридину та 4ням 323 ([МН]+, 100). метоксибензальдегіду з отриманням 18мг зазнаПриклад 3 ченої у заголовку сполуки: МС з електророзпилен(R)-(-)-5'-N-[3-піридилметил)аміноспіро[1ням 352 ([МН]+ 100). азабіцикло[2.2.2]-октан-3,2'-(3'Н)-фуро[2,3Приклад 9 b]піридин] (R)-(-)-5'-N-(4-хлорфенілметил)аміноспіро[1Зазначену у заголовку сполук у отримують азабіцикло-[2.2.2]октан-3,2'-(3'H)-фуро[2,3процедурою, яка використана у прикладі 1, з 115мг b]піридин] (0,5ммоль) 5'-аміно-спіро[1-азабіцикло[2.2.2]октанЗазначену у заголовку сполук у отримують 3,2'-(3'Н)-фуро[2,3-b]піридину] та 3процедурою, яка використана у прикладі 1, з 50мг піридинкарбоксальдегіду з отриманням 81мг (50%) (0,22ммоль) 5'-аміноспіро[1-азабіцикло[2.2.2]октанзазначеної у заголовку сполуки у вигляді бежевого 3,2'-(3'Н)-фуро[2,3-b]піридину та 4порошку: МС з електророзпиленням 323 хлорбензальдегіду з отриманням 62мг зазначеної ([МН]+, 100). у заголовку сполуки: МС з електророзпиленням Приклад 4 356 [МН]+, 37Сi 358. (R)-(-)-5'-N-(4-піридилметил)аміноспіро[1Приклад 10 азабіцикло[2.2.2]-октан-3,2'-(3'H)-фуро[2,3(R)-(-)-5'-N-(4-метилфенілметил)аміноспіро[1b]піридин] азабіцикло-[2.2.2]октан-3,2'-(3'H)-фуро[2,3Зазначену у заголовку сполук у отримують b]піридин] процедурою, яка використана у прикладі 1, з 115мг Зазначену у заголовку сполук у отримують (0,5ммоль) 5'-аміноспіро[1-азабіцикло[2.2.2]октанпроцедурою, яка використана у прикладі 1, з 50мг 3,2'-(3'Н)-фуро[2,3-b]піридину] та 4(0,22ммолъ) 5'-аміноспіро[1піридинкарбоксальдегіду з отриманням 84мг (52%) азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3зазначеної у заголовку сполуки у вигляді ясноb]піридину та 4-толуальдегіду з отриманням 6мг жовтого порошку: МС з електророзпиленням 323 зазначеної у заголовку сполуки: МС з електророз([МН]+ 100). пиленням 336 ([МН]+, 100). Приклад 5 Приклад 11 (R)-(-)-5'-N-(2-фуранілметил)аміноспіро[1(R)-(-)-5'-N-(3,4азабіцикло[2.2.2]-октан-3,2'-(3'Н)-фуро[2,3дихлорфенілметил)аміноспіро[1-азабіциклоb]піридин] [2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин] Зазначену у заголовку сполук у отримують Зазначену у заголовку сполук у отримують процедурою, яка використана у прикладі 1, з 50мг процедурою, яка використана у прикладі 1, з 50мг (0,22ммоль) 5'-аміноспіро[1-азабіцикло[2.2.2]октан(0,22ммоль) 5'-аміно-спіро[13,2'-(3'Н)-фуро[2,3-b]піридину та 2-фуральдегіду азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3(43мл, 0,52ммоль) з отриманням 30мг зазначеної у b]піридину та 3,4-дихлорбензальдегіду з отриманзаголовку сполуки у вигляді темно-жовтого напівням 19мг зазначеної у заголовку сполуки: МС з твердої речовини: МС з електророзпиленням 312 електророзпиленням 390 [МН]+, 37Сl1 392, + 37 ([МН] , 100). Сl2 394. Приклад 6 Приклад 12 (R)-(-)-5'-N-(3-фуранілметил)аміноспіро[1(R)-(-)-5'-N-(2-імідазолілметил)аміноспіро[1азабіцикло[2.2.2]-октан-3,2'-(3'H)-фуро[2,3азабіцикло-[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин] b]піридин] Зазначену у заголовку сполук у отримують Зазначену у заголовку сполук у отримують процедурою, яка використана у прикладі 1, з 50мг процедурою, яка використана у прикладі 1, з 50мг (0,22ммоль) 5'-аміноспіро[1-азабіцикло[2.2.2]октан(0,22ммоль) 5'-аміноспіро[1-азабіцикло[2.2.2]октан3,2'-(3'Н)-фуро[2,3-b]піридину та 3-фуральдегіду з 3,2'-(3'Н)-фуро[2,3-b]піридину та 2отриманням 25мг зазначеної у заголовку сполуки: імідазолкарбоксальдегіду з отриманням 57мг заМС з електророзпиленням 312 ([МН]+, 100). значеної у заголовку сполуки: МС з електророзпиПриклад 7 ленням 312 ([МН]+, 100). (R)-(-)-5'-N-[2-тієнілметил)аміноспіро[1Приклад 13 азабіцикло[2.2.2]-октан-3,2'-(3'H)-фуро[2,3(R)-(-)-5'-N-ацетил-Nb]піридин] (фенілметил)аміноспіро[1-азабіцикло-[2.2.2]октанЗазначену у заголовку сполук у отримують 3,2'-(3'H)-фуро[2,3-b]піридин] 25 71598 26 Оцтовий ангідрид (25мкл, 0,26ммоль) додають містить 5г діоксиду кремнію. Сирий продукт елюдо розчину (R)-(-)-5'-N-(фенілметил)аміноспіро[1ють з картриджа сумішшю 1:1 (об./об.) розчину азабіцикло-[2.2.2]октан-3,2'-(3'Н)-фуро[2,3аміаку у метанолі/хлороформ; розчин, що утвориb]піридину] (50мг, 0,22ммоль) у 1мл безводного вся, упарюють. Залишок очищають ВЕЖХ з зверпіридину в атмосфері азоту. Реакційну суміш наненою фазою на колонку з С-18 і використанням грівають при 95°С на масляній бані, потім прохоградієнту 0-50% ацетонітрил та 0,1% водна трилоджують до температури навколишнього середофтороцтова кислота як елюент. Фракції, які містять вища та виливають у насичений карбонат натрію. продукт, упарюють, і продукт розчиняють у невеПродукт екстрагують чотирма порціями хлорофоликому об'ємі метанолу (приблизно, 5мл) і додарму. Органічні шари об'єднують, сушать над сульють надлишковий хлорид водню (1Μ розчин в ефіфатом магнію та упарюють у вакуумі. Сирий прорі, приблизно 5мл). Розчин знову упарюють з дукт пропускають через Supeico Visiprep з отриманням зазначеної у заголовку сполуки (54мг, використанням хлороформу і потім з використан0,13ммоль) у вигляді гідрохлоридної солі: МС з ням градієнту 5-15% розчин аміаку у метаноелектророзпиленням 309 ([МН]+, 100); [a]589нм =лі/хлороформ. Розчинники видаляють у вакуумі, і 42,0 (с=0,1, МеОН). очищений продукт розчиняють у метанолі та підПриклад 16 кислюють 0,9мл 1,0Μ хлориду водню в ефірі з (R)-(-)-6'-N-(фенілметил)аміноспіро[1отриманням 59мг (61%) зазначеної у заголовку азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3сполуки у вигляді білої напівтвердої речовини: МС b]піридин] з електророзпиленням 364 ([МН]+, 100). (R)-(-)-спіро[1-азабіцикло[2.2.2]октан-3,2'(3'Н)Приклад 14 фуро[2,3-b]піридин-N-оксид] (VII) [970мг (R)-(-)-5'-N-метил-N-(фенілметил)аміноспіро[1(4,20ммоль)] розчиняють у 10мл оксихлориду фоазабіцикло-[2.2.2]октан-3,2'-(3'Н)-фуро[2,3сфору при перемішуванні на крижаній бані. Суb]піридин] спензію потім нагрівають при кип'ятінні зі зворотВ атмосфері азоту ціаноборогідрид натрію ним холодильником і перемішують протягом 5 (39мг, 0,62ммоль) додають до розчину 50мг годин. Після охолодження до температури навко(0,22ммоль) (R)-(-)-5'-N-(фенілметил)аміноспіро[1лишнього середовища реакційну суміш виливають азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3на 100г льоду, розбавляють 100мл води, підлугоb]піридину] та 165мкл (2,2ммоль) 37% водного вують карбонатом калію та екстрагують хлорофоформальдегіду у 1мл деіонізованої води, доведермом (3x50мл). Об'єднаний органічний екстракт ної до рН 3 з використанням концентрованої хлосушать над безводним сульфатом магнію, конценристоводневої кислоти. Реакційну суміш перемітрують у вакуумі і флеш-хроматографують за дошують при кімнатній температурі, додають кислоту помогою нейтрального силікагелю з використандля доведення рН, кожний раз, коли його значення ням суміші 95:5 хлороформу та 2,0н аміаку у підвищується вище 6. Через 1 годину реакційну метанолі з отриманням 700мг (R)-(-)-6-хлорспіро[1суміш виливають у насичений карбонат натрію, і азабіцикло[2.2.2]октан-3,2'(3'Н)-фуро-[2,3суміш екстрагують чотирма порціями хлороформу. b]піридину] у вигляді не зовсім білої твердої речоОрганічні шари об'єднують, суша ть над сульфатом вини. магнію та упарюють у вакуумі. Залишок пропускаРозчин 85мг (0,34ммоль) хлориду у 3,0мл бенють через Supeico Visiprep з використанням градізиламіну нагрівають при кип'ятінні зі зворотним єнту 5-15% розчин аміаку у метанолі/хлороформ. холодильником в атмосфері азоту протягом 23 Розчинники видаляють у вакуумі та залишок розгодин. Після охолодження до температури навкочиняють у метанолі та підкислюють 0,9мл 1,0Μ лишнього середовища розчин флешхлориду водню в е фірі. Видалення розчинника у хроматографують за допомогою нейтрального вакуумі дає 64мг (98%) солі з НСl зазначеної у силікагелю з використанням суміші 9:1 хлорофорзаголовку сполуки у вигляді ясно-жовтого напівму та 2,0н аміаку у метанолі з отриманням 22мг твердої речовини: МС з електророзпиленням 336 (20%) зазначеної у заголовку сполуки, МС з елект([МН]+, 100). ророзпиленням 322 ([МН]+, 100). Приклад 15 Приклад 17 (R)-(-)-5'-N-(3-піридиламіно)спіро[1(R)-(-)-5'-N-(3-тіенілметил)аміноспіро[1азабіцикло[2.2.2]октан-3,2’(3'Н)-фуро[2,3азабіцикло[2.2.2]-октан-3,2'-(3'Н)-фуро[2,3b]піридин] b]піридин] У запаяній трубці високого тиску в атмосфері Зазначену у заголовку сполук у отримують азоту, (R)-(-)5'-бромспіро[1-азабіцикло[2.2.2]октанпроцедурою, яка використана у прикладі 1, з 50мг 3,2'(3'Н)-фуро[2,3-b]піридин] (105,1мг, 0,36ммоль), (0,22ммоль) (R)-(-)-5'-аміноспіро[13-амінопіридин (69мг, 0,73ммоль), азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3трис(дибензилідінацетон)дипаладій(0) (21мг, b]піридину] та 3-тіофенкарбоксальдегіду з отри0,023ммоль), рацемічний 2,2'манням 61мг (85%) зазначеної у заголовку сполубіс(дифенілфосфіно)-1,1’-бінафтил (34мг, ки: МС з електророзпиленням 328 ([МН]+ 100). 0,055ммоль), трет-бутоксид натрію (0,105г, Приклад 18 1,09ммоль) та 1,2-диметоксіетан (5мл) нагрівають (R)-(-)-5'-N-(2-фенілетил)аміностро[1та перемішують при 100°С. Через 3 дні розчину азабіцикло[2.2.2]-октан-3,2'-(3'H)-фуро[2,3дають можливість охолонути і розподіляють між b]піридин] водою та хлороформом. Шар хлороформу потім Зазначену у заголовку сполук у отримують сушать додаванням сульфату магнію і фільтрують процедурою, яка використана у прикладі 1, з 50мг через картридж для екстракції твердої фази, яка (0,22ммоль) (R)-(-)-5'-аміноспіро[1 27 71598 28 азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридину] та фенілацетальдегіду з отриманням піридину] та коричного альдегіду з отриманням 31мг зазначеної у заголовку сполуки: МС з елект43мг зазначеної у заголовку сполуки: МС з електророзпиленням 336 ([МН]+, 100). ророзпиленням 348 ([МН]+ 100). Приклад 19 Приклад 25 (R)-('-)-5'-N-(3-фенілпропіл)аміностро[1(R)-(-)-5’-N-(тіазол-2-ілметил)аміноспіро[1азабіцикло[2.2.2]-октан-3,2'-(3'Н)-фуро[2,3азабіцикло-[2.2.2]октан-3,2’-(3’H)-фуро[2,3b]піридин] b]піридин] Зазначену у заголовку сполук у отримують Зазначену у заголовку сполук у отримують процедурою, яка використана у прикладі 1, з 50мг процедурою, яка використана у прикладі 1, з 50мг (0,22ммоль) (R)-(-)-5'-аміноспіро[1(0,22ммоль) (R)-(-)-5'-аміноспіро[1азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3піридину] та 3-фенілпропіональдегіду з отриманb]піридину] та 2-тіазолкарбоксальдегіду з отриням 42мг зазначеної у заголовку сполуки: МС з манням 13мг зазначеної у заголовку сполуки: МС з електророзпиленням 350 ([МН]+, 100). електророзпиленням 329 ([МН]+, 100). Приклад 20 Приклад 26 (R)-(-)-5'-N-(хінолін-3-ілметил)аміноспіро[1(R)-(-)-5'-N-(3-метилфенілметил)аміноспіро[1азабіцикло-[2.2.2]октан-3,2'-(3'H)-фуро[2,3азабіцикло-[2.2.2]октан-3,2'-(3'Н)-фуро[2,3b]піридин] b]піридин] Зазначену у заголовку сполук у отримують Тетрахлорид титану (0,5мл 1,0Μ розчину у дипроцедурою, яка використана у прикладі 1, з 50мг хлорметані) додають до розчину 50мг (0,22ммоль) (0,22ммоль) (R)-(-)-5'-аміноспіро[1(R)-(-)-5'-аміноспіро[1-азабіцикло[2.2.2]октан-3,2'азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b](3'Н)-фуро[2,3-b]піридину], 0,066мл (0,4ммоль) піридину] та 3-хінолінкарбоксальдегіду з отримантриетиламіну та 0,026мл (0,22ммоль) мням 47мг зазначеної у заголовку сполуки: МС з толуальдегіду у 2мл хлороформи в атмосфері електророзпиленням 373 ([МН]+, 100). азоту. Після перемішування протягом 16 годин Приклад 21 додають розчин 0,65ммоль ціаноборогідриду на(R)-(-)-5'-N-(хінолін-4-ілметил)аміноспіро[1трію у 0,55мл метанолу; розчин, що утворився, азабіцикло-[2.2.2]октан-3,2’-(3'Н)-фуро[2,3перемішують протягом 20хв., потім виливають у b]піридин] 20мл водного карбонату натрію та екстрагують Зазначену у заголовку сполук у отримують хлороформом (4x10мл). Об'єднаний органічний процедурою, яка використана у прикладі 1, з 50мг екстракт сушать над сульфатом магнію, концент(0,22ммоль) (R)-(-)-5'-аміноспіро[1рують у вакуумі та фле ш-хроматографують за доазабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]помогою нейтрального силікагелю з використанпіридину] та 4-хінолінкарбоксальдегіду з отриманням градієнту 0-15% розчин аміаку у ням 3мг зазначеної у заголовку сполуки: МС з елеметанолі/хлороформ з отриманням 60мг (81%) ктророзпиленням 373 ([МН]+ 100). зазначеної у заголовку сполуки, МС з електророзПриклад 22 пиленням 336 ([МН]+ 100). (R)-(-)-5'-N-(1,4-бензодюксан-6Приклад 27 ілметил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2’(R)-(-)-5'-N-(2-хлорфенілметил)аміноспіро[1(3’Н)-фуро[2,3-b]піридин] азабіцикло-[2.2.2]октан-3,2’-(3’H)-фуро[2,3Зазначену у заголовку сполук у отримують b]піридин] процедурою, яка використана у прикладі 1, з 50мг Зазначену у заголовку сполук у отримують (0,22ммоль) (R)-(-)-5'-аміноспіро[1процедурою, яка використана у прикладі 26, з 50мг азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b](0,22ммоль) (R)-(-)-5'-аміноспіро[1піридину] та 1,4-бензодіоксан-6-ілкарбоксальдегіду азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3з отриманням 31мг зазначеної у заголовку сполуb]піридину] та 2-хлорбензальдегіду з отриманням ки: МС з електророзпиленням 380 ([МН]+, 100). 63мг зазначеної у заголовку сполуки: МС з електПриклад 23 ророзпиленням 356 ([МН]+, 100). (R)-(-)-N-(імідазол-4-ілметил)аміноспіро[1Приклад 28 азабіцикло[2.2.2]-октан-3,2'-(3'Н)-фуро[2,3(R)-(-)-5'-N-('3-хлорфенілметил)аміноспіро[1b]піридин] азабіцикло-[2.2.2]октан-3,2'-(3’H)-фуро[2,3Зазначену у заголовку сполук у отримують b]піридин] процедурою, яка використана у прикладі 1, з 50мг Зазначену у заголовку сполук у отримують (0,22ммоль) (R)-(-)-5'-аміноспіро[1процедурою, яка використана у прикладі 26, з 50мг азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b](0,22ммоль) (R)-(-)-5'-аміноспіро[1піридину] та 4(5)-імідазолкарбоксальдегіду з отриазабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]манням 1мг зазначеної у заголовку сполуки: МС з піридину] та 2-хлорбензальдегіду з отриманням електророзпиленням 312 ([МН]+, 100). 50мг зазначеної у заголовку сполуки: МС з електПриклад 24 ророзпиленням 356 ([МН]+ 100). (R)-(-)-5'-N-(транс-3-піридинілпроп-2Приклад 29 еніл)аміноспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’H)(R)-(-)-5'-N-(3-фенілпропініл)аміноспіро[1фуро[2,3-b]піридин] азабіцикло-[2.2.2]октан-3,2'-(3'Н)-фуро[2,3Зазначену у заголовку сполук у отримують b]піридин] процедурою, яка використана у прикладі 1, з 50мг Зазначену у заголовку сполук у отримують (0,22ммоль) (R)-(-)-5'-аміноспіро[1процедурою, яка використана у прикладі 26, з 29 71598 30 400мг (1,76ммоль) (R)-(-)-5'-аміноспіро[13,2'-(3'H)-фуро[2,3-b]піридин] азабiцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]Зазначену у заголовку сполук у отримують піридину] та 3-фенілпропаргілового альдегіду з процедурою, яка використана у прикладі 13, з отриманням 212мг зазначеної у заголовку сполуки: 100мг (R)-(-)-5'-N-(3-тієнілметил)аміноспіро[1МС з електророзпиленням 346 ([МН]+, 100; азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3Приклад 30 b]піридину] та оцтового ангідриду з отриманням (R)-(-)-5'-N-(325мг зазначеної у заголовку сполуки: МС з електгідроксифенілметил)аміноспіро[1-азабіциклоророзпиленням 370 ([МН]+, 100). [2.2.2]октан-3,2'-(3'H)-фуро[2,3-b]піридин] Приклад 34 Зазначену у заголовку сполук у отримують (R)-(-)-5’-N-метил-N-(4процедурою, яка використана у прикладі 26, з пiридилметил)аміноспіро[1-азабіцикло250мг (1,10ммоль) (R)-(-)-5'-аміноспіро[1[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин] азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3Зазначену у заголовку сполук у отримують b]піридину] та 3-гідроксибензальдегіду з отриманпроцедурою, яка використана у прикладі 14, з ням 117мг зазначеної у заголовку сполуки: МС з 100мг (R)-(-)-5'-N-(4-піридилметил)аміноспіро[1електророзпиленням 338 ([МН]+ 100). азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3Приклад 31 b]піридину] та 37% водного формальдегіду з (R)-(-)-5'-N-(4отриманням 26мг зазначеної у заголовку сполуки: гідроксифенілметил)аміноспіро[1-азабіциклоМС з електророзпиленням 337 ([МН]+, 100). [2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин] Приклад 35 Зазначену у заголовку сполук у отримують (R)-(-)-5'-N-метил-N-(3процедурою, яка використана у прикладі 26, з піридилметил)аміноспіро[1-азабіцикло250мг (1,10ммоль) (R)-(-)-5'-аміноспіро[1[2.2.2]октан-3,2'-(3'Н)-фуро[2,3-b]піридин] азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3Зазначену у заголовку сполук у отримують b]піридину] та 4-гідроксибензальдегіду з отриманпроцедурою, яка використана у прикладі 14, з ням 31мг зазначеної у заголовку сполуки: МС з 200мг (R)-(-)-5'-N-(3-піридилметил)аміноспіро[1електророзпиленням 338 ([МН]+ 100). азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3Приклад 32 b]піридину] та 37% водного формальдегіду з (R)-(-)-5'-N-[транс-3-(4-піридиніл)проп-2отриманням 190мг зазначеної у заголовку сполуки: еніл]аміноспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’H)МС з електророзпиленням 337 ([МН]+ 100). фуро[2,3-b]піридин] Приклад 36 Зазначену у заголовку сполук у отримують (R)-(-)-5’-N-(2-гідроксіетил)-N-(3процедурою, яка використана у прикладі 26, з тієнілметил)аміноспіро[1-азабіцикло[2.2.2]октан250мг (1,10ммоль) (R)-(-)-5’-аміноспіро-[13,2’-(3’Н)-фуро[2,3-b]піридин] азабіцикло[2.2.2]oктaн-3,2’-(3’Н)-фуро[2,3Зазначену у заголовку сполук у отримують b]піридину] та транс-3-піридилпропеналю з отрипроцедурою, яка використана у прикладі 14, з манням 77мг зазначеної у заголовку сполуки: МС з 100мг (R)-(-)-5'-N-(3-тієнілметил)аміноспіро[1електророзпиленням 349 ([МН]+, 100). азабіцикло[2.2.2]октан-3,2'-(3'Н)-фуро[2,3Приклад 33 b]піридину] та гліоксалю з отриманням 54мг зазна(R)-(-)-5'-N-ацетил-N-(3ченої у заголовку сполуки: МС з електророзпилентієнілметил)аміноспіро[1-азабіцикло-[2.2.2]октанням 372 ([МН]+ 100). Комп’ютерна в ерстка О. Гапоненко Підписне Тираж 37 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюFuropiridines aralkilamines, a pharmaceutical composition based thereon, a method for the preparation thereof and furopiridine derivatives
Автори англійськоюMullen George
Назва патенту російськоюАралкиламины фуропиридинов, фармацевтическая композиция на их основе, способ их получения и производные фуропиридина
Автори російськоюМаллен Джордж
МПК / Мітки
МПК: A61K 31/439, A61P 1/04, A61P 25/20, A61P 25/18, A61P 25/34, A61P 25/00, A61P 25/28, A61P 43/00, C07D 491/22, A61P 25/22, C07B 61/00, A61P 25/04, A61P 25/24
Мітки: похідні, основі, фуропіридинів, одержання, фармацевтична, спосіб, аралкіламіни, фуропіридину, композиція
Код посилання
<a href="https://ua.patents.su/15-71598-aralkilamini-furopiridiniv-farmacevtichna-kompoziciya-na-kh-osnovi-sposib-kh-oderzhannya-ta-pokhidni-furopiridinu.html" target="_blank" rel="follow" title="База патентів України">Аралкіламіни фуропіридинів, фармацевтична композиція на їх основі, спосіб їх одержання та похідні фуропіридину</a>
Попередній патент: Бензогетероцикли і їх застосування як мек інгібіторів
Наступний патент: Рибальське грузило
Випадковий патент: Екстрактор-стікач












