Ізохінолінові сполуки, спосіб їх одержання і фармацевтична композиція, яка їх містить
Номер патенту: 81610
Опубліковано: 25.01.2008
Автори: Валле Валері, Одіно Валері, Делягранж Філіп, Гаснеро Анрі, Ренар Пьєр, Пуассоньє-Дюрьє Софі, Лезьє Даніель, Беннежан Каролін, Ію Саід, Бутен Жан, Альбер
Формула / Реферат
1. Сполука формули (І):
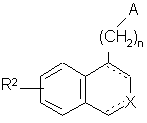 , (I)
, (I)
де:
n являє собою 1, 2 або 3,
А являє собою групу
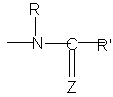 ,
, 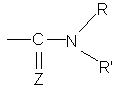 або групу
або групу 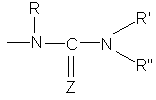 , де:
, де:
Z являє собою атом сірки або атом кисню,
R і R", які можуть бути однаковими або різними, кожний являє собою атом водню або лінійну або розгалужену (С1-С6)алкілгрупу,
і R' являє собою лінійну або розгалужену (С1-С6)алкілгрупу, лінійну або розгалужену (С2-С6)алкенілгрупу, лінійну або розгалужену (С2-С6)алкінілгрупу, (С3-С8)циклоалкілгрупу, (С3-С8)циклоалкіл(С1-С6)алкілгрупу, в якій алкільна частина лінійна або розгалужена, арилгрупу, арил-(С1-С6)алкілгрупу, в якій алкільна частина лінійна або розгалужена, гетероарилгрупу або гетероарил-(С1-С6)алкілгрупу, в якій алкільна частина лінійна або розгалужена,
X являє собою атом азоту або групу N-R1, де R1 являє собою атом водню або лінійну або розгалужену (С1-С6)алкілгрупу, (С3-С8)циклоалкілгрупу, (С3-С8)циклоалкіл-(С1-С6)алкілгрупу, в якій алкільна частина лінійна або розгалужена, арилгрупу, ароїлгрупу, арил-(С1-С6)алкілгрупу, в якій алкільна частина лінійна або розгалужена, гетероарилгрупу, гетероароїлгрупу або гетероарил-(С1-С6)алкілгрупу, в якій алкільна частина лінійна або розгалужена,
R2 являє собою лінійну або розгалужену (С1-С6)алкоксигрупу, (С3-С8)циклоалкілокси або (С3-С8)циклоалкіл-(С1-С6)алкілоксигрупу, в якій половина алкілокси лінійна або розгалужена,
зображення ![]() означає, що зв'язок одинарний або подвійний, за умови, що валентність атомів дотримується,
означає, що зв'язок одинарний або подвійний, за умови, що валентність атомів дотримується,
де:
- термін "арил", як повинно розумітись, означає фенільну або нафтильну групу, які незаміщені або заміщені від однієї до трьох однаковими або різними групами, які вибирають з лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)алкокси, ОН, СООН, алкоксикарбонілу, в якому половина алкокси лінійна або розгалужена, формілу, нітро, ціано, гідроксиметилу, аміно (необов'язково заміщеного однією або двома лінійними або розгалуженими (С1-С6)алкілгрупами) і атомів галогену,
- термін "гетероарил", як повинно розумітись, означає будь-яку моно- або біциклічну групу, яка містить від 5 до 10 кільцевих членів і може містити від 1 до 3 гетероатомів, вибраних з кисню, сірки і азоту, як, наприклад, групи фурану, тіофену, піролу, імідазолу, піридину, хіноліну, ізохіноліну, хроману, індолу, бензотіофену або бензофурану, з можливістю для цих груп бути частково гідрогенізованими, незаміщеними або заміщеними від однієї до трьох однаковими або різними групами, вибраними з лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)алкокси, ОН, СООН, алкоксикарбонілу, в якому половина алкокси лінійна або розгалужена, формілу, нітро, ціано, аміно (необов'язково заміщеного однією або двома лінійними або розгалуженими (С1-С6)алкілгрупами), гідроксиметилу і атомів галогену,
її енантіомери і діастереоізомери, і також її адитивні солі з фармацевтично прийнятною кислотою або основою.
2. Сполуки формули (І) за п. 1, де n являє собою 2 і А являє собою -NHCOR'-групу, їх енантіомери і діастереоізомери, і також їх адитивні солі з фармацевтично прийнятною кислотою або основою.
3. Сполуки формули (І) за п. 1, де n являє собою 3 і А являє собою -CONHR'-групу, їх енантіомери і діастереоізомери, і також їх адитивні солі з фармацевтично прийнятною кислотою або основою.
4. Сполуки формули (І) за п. 1, де R2 являє собою метоксигрупу, їх енантіомери і діастереоізомери, і також їх адитивні солі з фармацевтично прийнятною кислотою або основою.
5. Сполуки формули (І) за п. 1, де X являє собою атом азоту, їх енантіомери і діастереоізомери, і також їх адитивні солі з фармацевтично прийнятною кислотою або основою.
6. Сполуки формули (І) за п. 1, де X являє собою NPh або NBz групу, їх енантіомери і діастереоізомери, і також їх адитивні солі з фармацевтично прийнятною кислотою або основою.
7. Сполука формули (І) за п. 1, що являє собою N-[2-(6-метоксі-4-ізохінолініл)етил]ацетамід, а також її адитивні солі з фармацевтично прийнятною кислотою.
8. Сполука формули (І) за п. 1, що являє собою N-[2-(6-метоксі-4-ізохінолініл)етил]бутанамід, а також її адитивні солі з фармацевтично прийнятною кислотою.
9. Сполука формули (І) за п. 1, що являє собою N-[2-(6-мeтoкci-4-ізохінолініл)етил]пропанамід, а також її адитивні солі з фармацевтично прийнятною кислотою.
10. Сполука формули (І) за п. 1, що являє собою N-[2-(6-метоксі-4-ізохінолініл)етил]циклопропанкарбоксамід, а також її адитивні солі з фармацевтично прийнятною кислотою.
11. Сполука формули (І) за п. 1, що являє собою 4-(6-метоксі-4-ізохінолініл)-N-метилбутанамід, а також її адитивні солі з фармацевтично прийнятною кислотою.
12. Сполука формули (І) за п. 1, що являє собою N-[2-(6-метокси-2-феніл-1,2,3,4-тетрагідро-4-ізохінолініл)етил]ацетамід, а також її адитивні солі з фармацевтично прийнятною кислотою.
13. Сполука формули (І) за п. 1, що являє собою N-[2-(2-бензил-6-метокси-1,2,3,4-тетрагідро-4-ізохінолініл)етил]ацетамід, а також її адитивні солі з фармацевтично прийнятною кислотою.
14. Сполука формули (І) за п. 1, що являє собою N-{2-[2-(циклопропілметил)-6-метокси-1,2,3,4-тетрагідро-4-ізохінолініл]етил}ацетамід, а також її адитивні солі з фармацевтично прийнятною кислотою.
15. Спосіб одержання сполук формули (І) за п. 1, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (II):
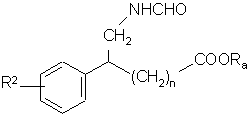 , (II)
, (II)
де R2 і n є такими, як визначено для формули (І), і Ra являє собою лінійну або розгалужену (С1-С6)алкілгрупу, яку піддають дії РОСl3 з одержанням сполуки формули (III):
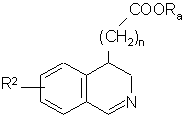 , (ІІІ)
, (ІІІ)
де R2, n і Ra є такими, як визначено вище, яку:
- окислюють у присутності паладію-на-вугіллі з одержанням сполуки формули (IV):
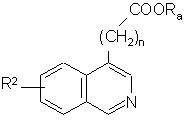 , (IV)
, (IV)
де R2, n і Ra є такими, як визначено вище,
- або яку гідрогенізують у присутності паладію-на-вугіллі з одержанням сполуки формули (V):
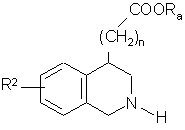 , (V)
, (V)
де R2, n і Ra є такими, як визначено вище,
сполуку формули (V) конденсують зі сполукою формули G-R'1, де G являє собою відхідну групу і R'1 може мати будь-які значення, визначені для R1, за винятком атома водню, з одержанням сполуки формули (VI):
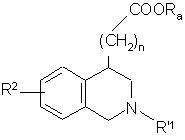 , (VI)
, (VI)
де R2, R'1, n і Ra є такими, як визначено вище, сполуки формул (III)-(VI), представлені сполукою формули (VII):
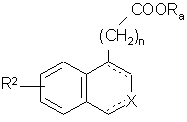 , (VII)
, (VII)
де R2, n і Ra є такими, як визначено вище, і X і зображення ![]() є такими, як визначено для формули (І),
є такими, як визначено для формули (І),
яку конденсують з аміном формули HNRR', де R і R' є такими, як визначено для формули (І), з одержанням сполуки формули (І/а), яка є варіантом сполуки формули (І):
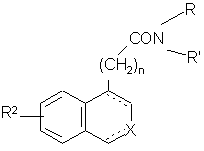 , (І/а)
, (І/а)
де R2, R, R', X, n і зображення ![]() є такими, як визначено вище,
є такими, як визначено вище,
або сполуку формули (VII) піддають дії NaOBr, і після гідролізу одержують сполуку формули (VIII):
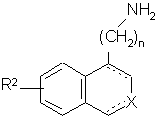 , (VIII)
, (VIII)
де R2, X, n і зображення ![]() є такими, як визначено вище, яку:
є такими, як визначено вище, яку:
або піддають реакції з ацилхлоридом ClCOR' або відповідним змішаним або симетричним ангідридом, де R' є таким, як визначено вище, з одержанням сполуки формули (І/b), яка є варіантом сполуки формули (І):
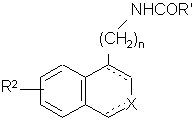 , (I/b)
, (I/b)
де R2, R', X, n і зображення ![]() є такими, як визначено вище, необов'язково з наступною дією сполуки формули R'a-J, де R'a може мати будь-які значення R', і J являє собою відхідну групу, таку як атом галогену або тозильна група, з одержанням сполуки формули (I/с), яка є варіантом сполуки формули (І):
є такими, як визначено вище, необов'язково з наступною дією сполуки формули R'a-J, де R'a може мати будь-які значення R', і J являє собою відхідну групу, таку як атом галогену або тозильна група, з одержанням сполуки формули (I/с), яка є варіантом сполуки формули (І):
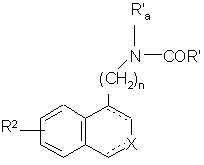 , (I/c)
, (I/c)
де R2, R', Ra', X, n і зображення ![]() є такими, як визначено вище,
є такими, як визначено вище,
- або піддають дії сполуки формули (IX):
O = C=N-R', (IX)
де R' є таким, як визначено вище, необов'язково з наступною дією сполуки формули R'a-J, як визначено вище, з одержанням сполуки формули (I/d), яка є варіантом сполуки формули (І):
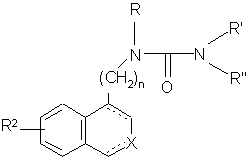 , (I/d)
, (I/d)
де R2, R, R', n, X і зображення ![]() є такими, як визначено вище, і R" є таким, як визначено для формули (І),
є такими, як визначено вище, і R" є таким, як визначено для формули (І),
сполуки формул (I/a)-(I/d) можуть бути піддані дії агента тіонізації, такого як, наприклад, реактив Лавесcона, з одержанням сполуки формули (І/е), яка є варіантом сполуки формули (І):
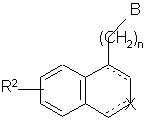 , (I/e)
, (I/e)
де R2, n і зображення ![]() є такими, як визначено вище, і В являє собою C(S)NRR', N(R)C(S)R' або N(R)C(S)NR'R"-групу, де R, R1 і R" є такими, як визначено вище,
є такими, як визначено вище, і В являє собою C(S)NRR', N(R)C(S)R' або N(R)C(S)NR'R"-групу, де R, R1 і R" є такими, як визначено вище,
сполуки (І/а)-(І/е), які утворюють сукупність сполук формули (І), сполуки якої можуть бути очищені відповідно до звичайної техніки розділення, перетворюють, якщо бажано, в адитивні солі з фармацевтично прийнятною кислотою або основою, і необов'язково розділяють на ізомери відповідно до звичайної техніки розділення.
16. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким з пп. 1-14 або її адитивну сіль з фармацевтично прийнятною кислотою або основою в комбінації з одним або більше фармацевтично прийнятними ексципієнтами.
17. Фармацевтична композиція за п. 16 для застосування у виробництві ліків для лікування розладів мелатонінергічної системи.
18. Фармацевтична композиція за п. 16 для застосування у виробництві ліків для лікування розладів сну, стресу, тривоги, сезонних афективних розладів або суворої депресії, серцево-судинних патологій, патологій травної системи, безсоння і втоми внаслідок порушення добового ритму організму, шизофренії, станів з реакцією паніки, меланхолії, розладів апетиту, ожиріння, безсоння, психотичних розладів, епілепсії, діабету, хвороби Паркінсона, старечого недоумства, різних розладів, пов'язаних з нормальним або патологічним старінням, мігрені, втрати пам'яті, хвороби Альцгеймера, розладів мозкового кровообігу, а також статевої дисфункції, як інгібіторів овуляції, імуномодуляторів, і у лікуванні різних типів раку.
Текст
1. Сполука формули (І): 2 81610 1 (13) (54) ІЗОХІНОЛІНОВІ СПОЛУКИ, СПОСІБ ЇХ ОД ЕРЖАННЯ І ФАРМАЦ ЕВТИЧНА КОМПОЗИЦІЯ, ЯКА ЇХ МІСТИТЬ C2 ДО ПАТЕНТУ НА ВИНАХІД (19) ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ 3 81610 R N R C Z R N C R' , Z N R' R' C N R'' Z або групу , де: Z являє собою атом сірки або атом кисню, R і R", які можуть бути однаковими або різними, кожний являє собою атом водню або лінійну або розгалужену (С1-С6)алкілгрупу, і R' являє собою лінійну або розгалужену (С1-С6)алкілгрупу, лінійну або розгалужену (С2С6)алкенілгрупу, лінійну або розгалужену (С2С6)алкінілгрупу, (С3-С8)циклоалкілгрупу, (С3С8)циклоалкіл(С 1-С6)алкілгрупу, в якій алкільна частина лінійна або розгалужена, арилгрупу, арил(С1-С6)алкілгрупу, в якій алкільна частина лінійна або розгалужена, гетероарилгрупу або гетероарил-(С1-С6)алкілгрупу, в якій алкільна частина лінійна або розгалужена, X являє собою атом азоту або групу N-R1, де R1 являє собою атом водню або лінійну або розгалужену (С1-С6)алкілгрупу, (С3С8)циклоалкілгрупу, (С3-С8)циклоалкіл-(С1С6)алкілгрупу, в якій алкільна частина лінійна або розгалужена, арилгрупу, ароїлгрупу, арил-(С1С6)алкілгрупу, в якій алкільна частина лінійна або розгалужена, гетероарилгрупу, гетероароїлгрупу або гетероарил-(С1-С6)алкілгрупу, в якій алкільна частина лінійна або розгалужена, R2 являє собою лінійну або розгалужену (С1-С6)алкоксигрупу, (С3-С8)циклоалкілокси або (С3-С8)циклоалкіл-(С1-С6)алкілоксигрупу, в якій половина алкілокси лінійна або розгалужена, зображення означає, що зв'язок одинарний або подвійний, за умови, що валентність атомів дотримується, де: - термін "арил", як повинно розумітись, означає фенільну або нафтильну гр упу, які незаміщені або заміщені від однієї до трьох однаковими або різними групами, які вибирають з лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)алкокси, ОН, СООН, алкоксикарбонілу, в якому половина алкокси лінійна або розгалужена, формілу, нітро, ціано, гідроксиметилу, аміно (необов'язково заміщеного однією або двома лінійними або розгалуженими (С1-С6)алкілгрупами) і атомів галогену, - термін "гетероарил", як повинно розумітись, означає будь-яку моно- або біциклічну груп у, яка містить від 5 до 10 кільцевих членів і може містити від 1 до 3 гетероатомів, вибраних з кисню, сірки і азоту, як, наприклад, групи фурану, тіофену, піролу, імідазолу, піридину, хіноліну, 4 ізохіноліну, хроману, індолу, бензотіофену або бензофурану, з можливістю для цих гр уп бути частково гідрогенізованими, незаміщеними або заміщеними від однієї до трьох однаковими або різними групами, вибраними з лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)алкокси, ОН, СООН, алкоксикарбонілу, в якому половина алкокси лінійна або розгалужена, формілу, нітро, ціано, аміно (необов'язково заміщеного однією або двома лінійними або розгалуженими (С1С6)алкілгрупами), гідроксиметилу і атомів галогену, її енантіомери і діастереоізомери, і також її адитивні солі з фармацевтично прийнятною кислотою або основою. 2. Сполуки формули (І) за п. 1, де n являє собою 2 і А являє собою -NHCOR'-групу, їх енантіомери і діастереоізомери, і також їх адитивні солі з фармацевтично прийнятною кислотою або основою. 3. Сполуки формули (І) за п. 1, де n являє собою 3 і А являє собою -CONHR'-групу, їх енантіомери і діастереоізомери, і також їх адитивні солі з фармацевтично прийнятною кислотою або основою. 4. Сполуки формули (І) за п. 1, де R 2 являє собою метоксигрупу, їх енантіомери і діастереоізомери, і також їх адитивні солі з фармацевтично прийнятною кислотою або основою. 5. Сполуки формули (І) за п. 1, де X являє собою атом азоту, їх енантіомери і діастереоізомери, і також їх адитивні солі з фармацевтично прийнятною кислотою або основою. 6. Сполуки формули (І) за п. 1, де X являє собою NPh або NBz груп у, їх енантіомери і діастереоізомери, і також їх адитивні солі з фармацевтично прийнятною кислотою або основою. 7. Сполука формули (І) за п. 1, що являє собою N-[2-(6-метоксі-4-ізохінолініл)етил]ацетамід, а також її адитивні солі з фармацевтично прийнятною кислотою. 8. Сполука формули (І) за п. 1, що являє собою N-[2-(6-метоксі-4ізохінолініл)етил]бутанамід, а також її адитивні солі з фармацевтично прийнятною кислотою. 9. Сполука формули (І) за п. 1, що являє собою N-[2-(6-мeтoкci-4ізохінолініл)етил]пропанамід, а також її адитивні солі з фармацевтично прийнятною кислотою. 10. Сполука формули (І) за п. 1, що являє собою N-[2-(6-метоксі-4ізохінолініл)етил]циклопропанкарбоксамід, а також її адитивні солі з фармацевтично прийнятною кислотою. 11. Сполука формули (І) за п. 1, що являє собою 4-(6-метоксі-4-ізохінолініл)-Nметилбутанамід, а також її адитивні солі з фармацевтично прийнятною кислотою. 12. Сполука формули (І) за п. 1, що являє собою N-[2-(6-метокси-2-феніл-1,2,3,4-тетрагідро 5 81610 4-ізохінолініл)етил]ацетамід, а також її адитивні солі з фармацевтично прийнятною кислотою. 13. Сполука формули (І) за п. 1, що являє собою N-[2-(2-бензил-6-метокси-1,2,3,4-тетрагідро4-ізохінолініл)етил]ацетамід, а також її адитивні солі з фармацевтично прийнятною кислотою. 14. Сполука формули (І) за п. 1, що являє собою N-{2-[2-(циклопропілметил)-6-метокси1,2,3,4-тетрагідро-4-ізохінолініл]етил}ацетамід, а також її адитивні солі з фармацевтично прийнятною кислотою. 15. Спосіб одержання сполук формули (І) за п. 1, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (II): NHCHO CH 2 (CH 2)n R2 6 R'1 може мати будь-які значення, визначені для R1, за винятком атома водню, з одержанням сполуки формули (VI): COORa (CH2) n R2 N R'1 , (VI) де R2, R'1, n і Ra є такими, як визначено вище, сполуки формул (III)-(VI), представлені сполукою формули (VII): COORa COOR a , (II) де R2 і n є такими, як визначено для формули (І), і Ra являє собою лінійну або розгалужену (С1-С6)алкілгрупу, яку піддають дії РОСl3 з одержанням сполуки формули (III): COOR a (CH 2)n R2 (CH2)n R2 X , (VII) де R2, n і Ra є такими, як визначено вище, і X і зображення є такими, як визначено для формули (І), яку конденсують з аміном формули HNRR', де R і R' є такими, як визначено для формули (І), з одержанням сполуки формули (І/а), яка є варіантом сполуки формули (І): R N , (ІІІ) де R2, n і Ra є такими, як визначено вище, CON яку: - окислюють у присутності паладію-на-вугіллі з одержанням сполуки формули (IV): COOR a (CH2) n R' R2 X (CH 2)n , (І/а) 2 R2 N , (IV) де R2, n і Ra є такими, як визначено вище, - або яку гідрогенізують у присутності паладію-навугіллі з одержанням сполуки формули (V): де R , R, R', X, n і зображення є такими, як визначено вище, або сполуку формули (VII) піддають дії NaOBr, і після гідролізу одержують сполуку формули (VIII): NH2 (CH 2) n COORa (CH2)n R2 X , (VIII) R2 N 2 H , (V) де R , n і Ra є такими, як визначено вище, сполуку формули (V) конденсують зі сполукою формули G-R'1, де G являє собою відхідну групу і 2 де R , X, n і зображення є такими, як визначено вище, яку: або піддають реакції з ацилхлоридом ClCOR' або відповідним змішаним або симетричним ангідридом, де R' є таким, як визначено вище, з одержанням сполуки формули (І/b), яка є варіантом сполуки формули (І): 7 81610 8 сполуки формул (I/a)-(I/d) можуть бути піддані дії агента тіонізації, такого як, наприклад, реактив Лавесcона, з одержанням сполуки формули (І/е), яка є варіантом сполуки формули (І): NHCOR' (CH2) n B R2 X (CH2)n , (I/b) де R2, R', X, n і зображення є такими, як визначено вище, необов'язково з наступною дією сполуки формули R'a-J, де R'a може мати будь-які значення R', і J являє собою відхідну груп у, таку як атом галогену або тозильна група, з одержанням сполуки формули (I/с), яка є варіантом сполуки формули (І): R'a N (CH 2) n COR' R2 X , (I/c) 2 де R , R', Ra', X, n і зображення є такими, як визначено вище, - або піддають дії сполуки формули (IX): O = C=N-R', (IX) де R' є таким, як визначено вище, необов'язково з наступною дією сполуки формули R'a-J, як визначено вище, з одержанням сполуки формули (I/d), яка є варіантом сполуки формули (І): R R' N (CH 2) n N O R'' R2 X , (I/d) R2 X , (I/e) 2 де R , n і зображення є такими, як визначено вище, і В являє собою C(S)NRR', N(R)C(S)R' або N(R)C(S)NR'R"-групу, де R, R1 і R" є такими, як визначено вище, сполуки (І/а)-(І/е), які утворюють сукупність сполук формули (І), сполуки якої можуть бути очищені відповідно до звичайної техніки розділення, перетворюють, якщо бажано, в адитивні солі з фармацевтично прийнятною кислотою або основою, і необов'язково розділяють на ізомери відповідно до звичайної техніки розділення. 16. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким з пп. 114 або її адитивну сіль з фармацевтично прийнятною кислотою або основою в комбінації з одним або більше фармацевтично прийнятними ексципієнтами. 17. Фармацевтична композиція за п. 16 для застосування у виробництві ліків для лікування розладів мелатонінергічної системи. 18. Фармацевтична композиція за п. 16 для застосування у виробництві ліків для лікування розладів сну, стресу, тривоги, сезонних афективних розладів або суворої депресії, серцево-судинних патологій, патологій травної системи, безсоння і втоми внаслідок порушення добового ритму організму, шизофренії, станів з реакцією паніки, меланхолії, розладів апетиту, ожиріння, безсоння, психотичних розладів, епілепсії, діабету, хвороби Паркінсона, старечого недоумства, різних розладів, пов'язаних з нормальним або патологічним старінням, мігрені, втрати пам'яті, хвороби Альцгеймера, розладів мозкового кровообігу, а такожстатевої дисфункції, як інгібіторів овуляції, імуномодуляторів, і у лікуванні різних типів раку. 2 де R , R, R', n, X і зображення є такими, як визначено вище, і R" є таким, як визначено для формули (І), Даний винахід відноситься до нових ізохінолінових сполук, способу їх приготування і фармацевтичних композицій, які їх містять. З літератури відомі ізохінолінові сполуки, які корисні як судинорозширювальні засоби [US 4 880 817, US 4 843 071, US 4 822 800], або корисні у зростанні рослин [Czasopismo Techniezne (Krakow), 1992, 89 (1), 7-12], як модулятори тирозинфосфатази [WO 99 46268] або також корисні у синтезі [Tetrahedron Letters, 2002, 43 (19), 3557-3560; Heterocycles, 2000, 52 (3), 1371-1383]. Сполуки за даним винаходом, беручи до уваги їх оригінальну структур у, є новими і володіють фармакологічними властивостями, які 9 81610 представляють великий інтерес по відношенню до мелатонінергічних рецепторів. За останні десять років численні дослідження продемонстрували провідну роль, яку відіграє мелатонін (N-ацетил-5-метокситриптамін) у множині фізіопатологічних явищ і у регулюванні циркадного ритму, але мелатонін має досить короткий час напівжиття, завдяки тому, що він дуже швидко метаболізується. Велика зацікавленість таким чином полягає у можливості створення доступних для клініциста аналогів мелатоніну, які більш стійкі до метаболізму і володіють агоністичною або антагоністичною властивістю, і очікується, що терапевтичний ефект від них буде ви ще, ніж від гормону безпосередньо. В доповнення до їх сприятливої дії у відношенні розладів циркадного ритму [J. Neurosurg. 1985, 63, pp.321-341] і розладів сну [Psychopharmacology, 1990, 100. pp.222-226], ліганди мелатонінергічної системи володіють корисними фармакологічними властивостями у відношенні центральної нервової системи, особливо анксіолітичними і антипсихотичними властивостями [Neuropharmacology of Pineal Secretions, 1990, 8 (3-4), pp.264-272], і аналізуючими властивостями [Pharmacopsychiat., 1987, 20, pp.222-223], і також для лікування хвороби Паркінсона [J. Neurosurg. 1985, 63, стор.321-341] і хвороби Альцгеймера [Brain Research, 1990, 528, pp.170-174]. Сполуки також продемонстрували активність у відношенні певних видів раку [Melatonin - Clinical Perspectives, Oxford University Press, 1988, pp.164-165], овуляції [Science 1987, 227, pp.714-720], діабетів [Clinical Endocrinology, 1986, 24, pp.359-364], і у лікуванні ожиріння [International Journal of Eating Disorders, 1996, 20 (4), pp.443-446]. Визначені різноманітні впливи викликаються через посередництво специфічних рецепторів мелатоніну. Дослідженнямолекулярної біології продемонстрували існування множини підтипів рецепторів, які здатні до зв'язування цього гормону [Trends Pharmacol. Sci., 1995, 16, p.50; WO 97.04094]. Це дало можливість виявити і охарактеризувати деякі з тих рецепторів для різних біологічних видів, включаючи ссавців. Для того, щоб краще зрозуміти фізіологічні функції таких рецепторів, переважно мати доступні селективні ліганди. Крім того такі сполуки, шляхом вибіркової взаємодії з тим або іншим з таких рецепторів, можуть виявитись відмінними ліками для клініциста у лікуванні патологій, пов'язаних з мелатонінергічною системою, деякі з яких були згадані вище. В доповнення до того, що вони є новими, сполуки за даним винаходом виявляють дуже сильну афінність до рецепторів мелатоніну і/або селективність до того або іншого підтипу мелатонінергічного рецептора. Даний винахід відноситься, більш конкретно, до сполук формули 10 (I) де: n являє собою 1, 2 або 3, А являє собою гр упу або групу де Ζ являє собою атом сірки або атом кисню, R і R", які можуть бути однаковими або різними, кожний являє собою атом водню або лінійну або розгалужену (С1-С6)алкіл груп у, і R1 являє собою лінійну або розгалужену (С1С6)алкіл групу, лінійну або розгалужену (С2С6)алкеніл групу, лінійну або розгалужену (С2С6)алкініл групу, (С3-С8)циклоалкіл групу, (С3С8)циклоалкіл-(С1-С6)алкіл групу, в якій алкільна частина лінійна або розгалужена, арил групу, арил-(С1-С6)алкіл групу, в якій алкільна частина лінійна або розгалужена, гетероарил групу або гетероарил-(С1-С6)алкіл групу, в якій алкільна частина лінійна або розгалужена, X являє собою атом азоту або групу N-R1, де 1 R являє собою атом водню або лінійну або розгалужену (С1-С6)алкіл групу, (С3-С8)циклоалкіл груп у, (С3-С8)циклоалкіл-(С1-С6)алкіл групу, в якій алкільна частина лінійна або розгалужена, арил груп у, ароїл груп у, арил-(С1-С6)алкіл групу, в якій алкільна частина лінійна або розгалужена, гетероарил групу, гетероароїл групу або гетероарил-(С1-С6)алкіл групу, в якій алкільна частина лінійна або розгалужена, R2 являє собою лінійну або розгалужену груп у (С1-С6)алкоксигрупу, (С3-С8)циклоалкілокси або (С3-С8)циклоалкіл-(С1-С6)алкілоксигрупу, в якій половина алкілокси лінійна або розгалужена, зображення означає, що зв'язок одинарний або подвійний, за умови, що валентність атомів дотримується, де: - термін "арил", як повинно розумітись, означає фенільну або нафтильну гр упу, які незаміщені або заміщені від однієї до трьох однаковими або різними групами, які вибирають з лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)алкокси, ОН, СООН, алкоксикарбонілу, в якому алкокси частина лінійна або розгалужена, формілу, нітро, ціано, гідроксиметилу, аміно (необов'язково заміщеного однією або двома лінійними або розгалуженими (С1-С6)алкіл групами) і атомів галогену, - термін "гетероарил", як повинно розумітись, означає будь-яку моно- або біциклічну групу, яка містить від 5 до 10 кільцевих членів і може містити 11 81610 від 1 до 3 гетероатомів, вибраних з кисню, сірки і азоту, як, наприклад, групи фурану, тіо фену, піролу, імідазолу, піридину, хіноліну, ізохіноліну, хроману, індолу, бензотіофену або бензофурану, з можливістю для цих груп бути частково гідрогенізованими, незаміщеними або заміщеними від однієї до трьох однаковими або різними групами, вибраними з лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1С6)алкокси, ОН, СООН, алкоксикарбонілу, в якому алкокси частина лінійна або розгалужена, формілу, нітро, ціано, аміно (необов'язково заміщеного однією або двома лінійними або розгалуженими (С1-С6)алкіл групами), гідроксиметилу і атомів галогену, і їх енантіомерів і діастереоізомерів, і також до їх адитивних солей з фармацевтично прийнятною кислотою або основою. До фармацевтично прийнятних кислот можуть бути віднесені, не маючи на увазі будь-яке обмеження, хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, фосфорна кислота, оцтова кислота, трифтороцтова кисла,молочна кислота, піровиноградна кислота, малонова кислота, янтарна кислота, глутарова кислота, фумарова кислота, винна кислота, малеїнова кисла, лимонна кислота, аскорбінова кислота, метансульфокислота, камфорна кислота і т.д. До фармацевтично прийнятних основ можуть бути віднесені, не маючи на увазі будь-яке обмеження, гідроксид натрію, гідроксид калію, триетиламін, трет-бутиламін і т.д. Переважними значеннями n є 2 і 3. Переважними сполуками винаходу є сполуки формули (І), де: η являє собою 2 і А являє собою -NHCOR' груп у і більш конкретно -NHCOR' групу, де R1 являє собою лінійну або розгалужену (С1-С6)алкіл груп у, таку як, наприклад, метил, етил, пропіл, ізопропіл, бутил, ізобутил, пентил або гексил, або (С3-С8)циклоалкіл групу, таку як, наприклад, циклопропіл, циклобутил, циклопентан або циклогексил, n являє собою 3 і А являє собою -CONHR' груп у і більш конкретно -CONHR' груп у, де R' являє собою лінійну або розгалужену (С1-С6)алкіл груп у, таку як, наприклад, метил, етил, пропіл, ізопропіл, бутил, ізобутил, пентил або гексил, або (С3-С8)циклоалкіл групу, таку як, наприклад, циклопропіл, циклобутил, циклопентил або циклогексил. Переважною R2 групою є алкоксигрупа і більш переважно - метоксигрупа. X являє собою переважно атом азоту або NR1 груп у, де R1 являє собою циклоалкільну групу, незаміщену або заміщену фенільну груп у, або бензильну груп у, в якій половина фенілу є заміщеною або незаміщеною. Навіть більш переважно, винахід відноситься до наступних сполук формули (І): -N-[2-(6-метоксі-4-ізохінолініл)етил]ацетамід, -N-[2-(6-метоксі-4-ізохінолініл)етил]бутанамід, -N-[2-(6-метоксі-4ізохінолініл)етил]пропанамід, 12 -N-[2-(6-метоксі-4ізохінолініл)етил]циклопропанкарбоксамід, -4-(6-метоксі-4-ізохінолініл)-N-метилбутанамід, -N-[2-(6-метоксі-2-феніл-1,2,3,4-тетрагідро-4ізохінолініл)етил]ацетамід, -N-[2-(2-бензил-6-метоксі-1,2,3,4-тетрагідро-4ізохінолініл)]етил]ацетамід, -N-{2-[2-(циклопропілметил)-6-метоксі-1,2,3,4тетрагідро-4-ізохінолініл]-етил}ацетамід. Енантіомери, діастереоізомери, а також адитивні солі з фармацевтично прийнятною кислотою або основою переважних сполук є невід'ємною чистиною винаходу. Даний винахід також відноситься до способу приготування сполук формули (І), який відрізняється тим, що як вихідний матеріал використовується сполука формули (II): (II) де R2 і n є такими, як визначено для формули (І), і Ra являє собою лінійну або розгалужену (С1С6)груп у, яку піддають дії РОСl3 для одержання сполуки формули (III): (III) де R2, n і Ra є такими, як визначено вище, яку вміщують: - у присутності паладію-на-вугіллі для одержання сполуки формули (IV): (IV) де R2, n і Ra є такими, як визначено вище, - або яку гідрогенізують у присутності паладіюна-вугіллі для одержання сполуки формули (V): (V) де R2, n і Ra є такими, як визначено вище, сполуку формули (V) конденсують зі сполукою формули G-R'1, де G являє собою відхідну гр упу, таку як атом галогену, або третбутоксикарбонільну гр упу, і R' 1 може мати будь-які значення, визначені для R1, за винятком атома водню, для одержання сполуки формули (VI): 13 81610 14 одержання сполуки формули випадку сполук формули (І): (I/с), окремого (VI) (I/c) 2 1 де R , R' , n і Ra є такими, як визначено вище, сполуки формул (III)-(VI), які утворюють сполуки формули (VII): (VII) де R2, n і Ra є такими, як визначено вище і X і зображення є такими, як визначено для формули (І), яку конденсують з аміном формули HNRR1, де R і R' є такими, як визначено для формули (І), для одержання сполуки формули (І/а), окремий випадок сполук формули (І): (I/a) де R2, R, R1, Χ, n і зображення є такими, як визначено вище, або сполуку формули (VII) піддають послідовності звичайних реакцій в органічній хімії для одержання сполуки формули (VIII): де R2, R1, Ra', Χ, n і зображення є такими, як визначено вище, - або піддають дії сполуки формули (IX): O=C=N-R' (IX) де R' є таким, як визначено вище, необов'язково з наступною дією сполуки формули R'a-J, як визначено вище, для одержання сполуки формули (I/d), окремого випадку сполук формули (І): (I/d) де R2, R, R', n, Χ і зображення є такими, як визначено вище, і R" є таким, як визначено для формули (І), що є можливим для сполук формул (I/a)-(I/d) бути підданими дії агента тіонізації, такого як, наприклад, реактив Лавессона, для одержання сполуки формули (І/е), окремого випадку сполук формули (І): (I/e) (VIII) де R2, Χ, n і зображення є такими, як визначено вище, яку: - або піддають реакції з ацилхлоридом ClCOR' або відповідним змішаним або симетричним ангідридом, де R' є таким, як визначено вище, для одержання сполуки формули (І/b), окремого випадку сполук формули (І): (I/b) де R2, R', Χ, n і зображення є такими, як визначено вище, необов'язково з наступною дією сполуки формули R'a-J, де R'a може мати будь-які значення R', і J являє собою відхідну групу, таку як, атом галогену або тозильна група, для де R2, n і зображення є такими, як визначено вище, і В являє собою C(S)NRR', N(R)C(S)R' або N(R)C(S)NR'R" групу, де R, R' і R" є такими, як визначено вище, сполуки (І/а)-(І/е), які утворюють сукупність сполук формули (І), сполуки якої можуть бути очищені відповідно до звичайної техніки розділення, перетворюють, якщо бажано, в адитивні солі з фармацевтично прийнятною кислотою або основою, і необов'язково розділяють на ізомери відповідно до звичайної техніки розділення. Вихідні сполуки (II) є або комерційно доступними або можуть бути легко одержані кваліфікованим фахівцем шляхом звичайних хімічних реакцій або хімічних реакцій, які описуються в літературі. Доведено, що сполуки винаходу і фармацевтичні композиції, які їх містять, є корисними у лікуванні розладів мелатонінергічної системи. Фармакологічні дослідження сполук згідно з винаходом фактично продемонстрували, що вони 15 81610 є нетоксичними, мають високу афінність відносно рецепторів мелатоніну і мають значну активність у відношенні центральної нервової системи і мікроциркуляції, що дає можливість визначити, що продукти згідно з винаходом корисні у лікуванні стресу, розладів сну, тривоги, глибокої депресії, сезонних афективних розладів, серцево-судинних патологій, патологій травної системи, безсоння і втоми внаслідок порушення добового ритму організму, шизофренії, станів з реакцією паніки, меланхолії, розладів апетиту, ожиріння, безсоння, болю, психотичних розладів, епілепсії, діабету, хвороби Паркінсона, старечого недоумства, різних розладів, пов'язаних з нормальним або патологічним старінням, мігрені, втрати пам'яті, хвороби Альцгеймера, і розладів мозкового кругообігу. В іншій полі діяльності, виявляється, що продукти згідно з винаходом можуть використовува тись у лікуванні статевої дисфункції, що вони мають інгібуючі овуляцію та імуномодулюючі властивості і можуть використовува тись у лікуванні раку різних типів. Переважно сполуки використовують у лікуванні глибокої депресії, сезонних афективних розладів, розладів сну, серцево-судинних патологій, безсоння і втоми внаслідок порушення добового ритму організму, розладів апетиту і ожиріння. Наприклад, сполуки можуть використовувати у лікуванні сезонних афективних розладів і розладів сну. Даний винахід також відноситься до фармацевтичних композицій, які містять щонайменше одну сполуку формули (І), як саму, так і в комбінації з одним або більше фармацевтично прийнятними ексципієнтами. Серед фармацевтичних композицій відповідно до винаходу можуть бути згадані більш конкретно ті, які придатні для орального, парентерального, назального, підшкірного або черезшкірного, ректального, під'язичного, очного або респіраторного введення, особливо таблетки або драже, під'язикові таблетки, саше, пакети, желатинові капсули, під'язикові драже, коржики, супозиторії, креми, мазі, шкірні гелі і придатні для пиття або ін'єктування ампули. Дозування змінюється відповідно до статі, віку і ваги пацієнта, шляху введення, природи показань до терапевтичного застосування або будь-яких суп утніх лікувань, і знаходиться в діапазоні від 0,01мг до 1г на добу одноразовим або багаторазовим введенням. Наступні приклади ілюструють винахід і не обмежують його будь-яким чином. Наступні приготування приводять до одержання сполук винаходу або синтезу проміжних сполук для застосування у приготуванні сполук винаходу. Приготування 1: Етил 4-(6-метокси-3,4дигідро-4-ізохінолініл)бутаноат гідро хлорид Стадія А: Етил 5-ціано-5-(3метоксифеніл)пентаноат Два грами (3-метоксифеніл)ацетонітрилу і 1,5мл етил 4-бромбутирату розчиняють в 50мл диметилформаміду при 0°С. Шістсот міліграмів 60% гідриду натрію (600мг; 15ммол) поступово 16 додають до розчину. Реакційну суміш перемішують при температурі навколишнього середовища протягом 4 годин, вміщують у 100мл підкисленої води і екстрагують ефіром. Органічну фазу потім сушать над сульфатом магнію, відфільтровують і випаровують при зниженому тиску. Одержану олію очищають на колонці (елюент: ефір/циклогексан 4/6) для одержання вказаного у заголовку продукту у формі жовтої олії. Стадія В: Етил 6-аміно-5-(3метоксифеніл)гексаноат гідрохлорид Сполуку, одержану на Стадії А (11,2г; 43ммол), розчинену заздалегідь в 150мл етанолу, виливають в автоклав, і потім додають нікель Ренея (10% за вагою). Суміш потім розміщують під тиском водню (10бар) і нагрівають при 50°С протягом 48 годин перемішуючи. Після видалення нікелю Ренея фільтруванням органічну фазу випаровують при зниженому тиску. Одержаний залишок вміщують в е фір, HCl(g) барботують у розчин, який потім перемішують доти, доки не випадає осад. Одержаний осад потім фільтрують під вакуумом і перекристалізовують з толуолу, і вказаний у заголовку продукт одержують у формі білої твердої речовини. Температура плавлення: 104-106°С Стадія С: Етил 6-(форміламіно)-5-(3метоксифеніл)гексаноат Амін, який одержують на Стадії В, у формі основи (6,4г; 27ммол), розчиняють у 60мл етилформіату. Реакційну суміш нагрівають із зворотним холодильником протягом 6 годин, перемішуючи, і потім випаровують при зниженому тиску. Одержаний залишок вміщують в ефір. Органічну фазу потім промивають послідовно підкисленою водою (IN HCl), водою і 10% розчином гідрокарбонату, потім сушать над сульфатом магнію, відфільтровують і випаровують при зниженому тиску для одержання вказаного у заголовку продукту у вигляді жовтої олії. Стадія D: Етил 4-(6-метоксі-3,4-дигідро-4ізохінолініл)бутаноат гідрохлорид Формальдегід, який одержують на Стадії С (6,8г; 23ммол), розчиняють у 100мл ацетонітрилу, потім реакційну суміш нагрівають до приблизно 60°С. Оксихлорид фосфору (7мл) додають до розчину, який нагрівають із зворотним холодильником протягом 6 годин, перемішуючи, і потім випаровують при зниженому тиску. Одержаний залишок двічі вміщують в етанол і випаровують при зниженому тиску, і потім вміщують у воду. Водну фазу промивають дихлорметаном і потім підлуговують насиченим розчином гідрокарбонату натрію і екстрагують дихлорметаном. Органічну фазу сушать над сульфатом магнію, відфільтровують і випаровують при зниженому тиску. Одержану олію вміщують в ефір, насичений HCl(g), і потім випаровують при зниженому тиску. Залишок вміщують в толуол в нагрітому стані і перемішують доти, доки не випаде осад. Одержаний осад потім відфільтровують під вакуумом і вказаний у заголовку продукт одержують у вигляді білої твердої речовини. 17 81610 Температура плавлення: 97-99°С Приготування 2: трет-Бутил 4-(2-аміноетил)-6метокси-3,4-дигідро-2(1H)-ізохінолінкарбоксилат Стадія А: Метил ціано(3-метоксифеніл)ацетат Двадцять п'ять грамів (3метоксифеніл)ацетонітрилу розчиняють в 200мл безводного ТГФ у довгогорлій колбі Ерленмеєра. 60% гідриду натрію (8,88г; 0,37мол) додають до розчину і реакційну суміш нагрівають із зворотним холодильником протягом 30 хвилин, перемішуючи. Диметилкарбонат (58мл; 0,6814мол) потім додають краплями протягом півгодини і реакційну суміш згодом нагрівають із зворотним холодильником протягом 2 годин, перемішуючи. Реакційну суміш виливають в холодну і злегка підкислену воду. Водну фазу екстрагують ефіром і потім ефірну фазу промивають водою перед тим, як випаровують. Розчин карбонату калію (47,15г; 0,34мол) додають до олії, одержаної вище. Після перемішування суміш промивають ефіром. Одержану ефірну фазу повторно промивають розчином карбонату калію (12,02г; 0,08мол). Дві водні фази об'єднують, одразу ацилюють і екстрагують ефіром. Одержану таким чином органічну фазу промивають 10% розчином гідрокарбонату натрію, висушують над сульфатом магнію і випаровують при зниженому тиску для одержання вказаного у заголовку продукту у вигляді світло-оранжевої жовтої олії. Стадія В: Ме тил 3-аміно-2-(3метоксифеніл)пропаноат гідрохлорид Сполуку, одержану на Стадії А (34,32г; 0,672мол), розчиняють в 150мл метанолу. Розчин виливають в автоклав і потім 50мл хлороформу і оксиду платини (10% за вагою) додають до розчину. Автоклав вміщують під водневий тиск (60 бар) при температурі навколишнього середовища і перемішують протягом 24 годин за допомогою магнітної мішалки. Після видалення каталізатора за допомогою фільтрування розчин випаровують при зниженому тиску. Одержану олію вміщують в ефір. Осад, який випав, фільтрують під вакуумом і перекристалізовують з ацетонітрилу для одержання вказаного у заголовку продукту у вигляді білої твердої речовини. Температура плавлення: 170-172°С Стадія С: Метил 3-(Форміламіно)-2-(3метоксифеніл)пропаноат Сполуку, одержану на Стадії В (20,25г; 0,08мол), у формі основи, розчиняють у 130мл етилформіату (1,81мол). Реакційну суміш нагрівають із зворотним холодильником протягом 6 годин і потім випаровують при зниженому тиску. Одержану олію вміщують в етилацетат. Органічну фазу промивають з основною водою (NaHCO3), сушать над сульфа том магнію, відфільтровують і випаровують для одержання вказаного у заголовку продукту у вигляді жовтої олії. Стадія D: Метил 6-метокси-3,4-дигідро-4ізохінолінкарбоксилат гідрохлорид Сполуку, одержану на Стадії С (8,03г; 0,03мол), розчиняють у 100мл ацетонітрилу і потім реакційну суміш нагрівають до приблизно 60°С. Оксихлорид фосфору (16мл; 0,17мол) додають до розчину, який потім нагрівають із зворотним 18 холодильником протягом 6 годин, перемішуючи, і потім випаровують при зниженому тиску. Одержаний залишок двічі вміщують в метанол і випаровують при зниженому тиску, і потім промивають мінімальною кількістю ацетону. Осад, який випав, потім відфільтровують під вакуумом для одержання вказаного у заголовку продукту у вигляді білої твердої речовини. Температура плавлення: 212-215°С Стадія Е: Метил 6-метокси-1,2,3,4-тетрагідро4-ізохінолінкарбоксилат гідрохлорид Сполуку, одержану на Стадії D (9,21g), у формі основи, розчиняють у 150мл метанолу і потім додають до розчину паладій-на-вугіллі (900мг). Реакційну суміш перемішують при температурі навколишнього середовища під воднем протягом 4 годин. Після видалення паладію-на-вугіллі шляхом фільтрування органічну фазу випаровують при зниженому тиску. Одержану олію вміщують в ефір, насичений НСl. Осад, що випав, відфільтровують під вакуумом і перекристалізовують з ацетонітрилу для одержання вказаного у заголовку продукту у вигляді білої твердої речовини. Температура плавлення: 191-193°С Стадія F: трет-Бутил 4-метил 6-метокси-3,4дигідро-2,4(1Н)-ізохінолін-дикарбоксилат Сполуку, одержану на Стадії Ε (4,02г; 15ммол), суспендують у 100мл дихлорметану і потім додають триетиламін (6,6мл). Коли розчинення завершене, додають ди-трет-бутил дикарбонат (4г; 18ммол) і реакційну суміш перемішують при температурі навколишнього середовища протягом 30 хвилин. Розчин виливають у 100мл води і надлишок триетиламіну нейтралізують підкисленою водою (0,1 NHCl). Після відділення водну фазу екстрагують дихлорметаном і об'єднані органічні розчини сушать над сульфа том магнію, відфільтровують і випаровують при зниженому тиску. Вказаний у заголовку продукт очищають хроматографією на силікагелі. Безбарвна олія. Стадія G: трет-Бутил 4-(гідроксиметил)-6метокси-3,4-дигідро-2(Ш)-ізохінолінкарбоксилат Алюмогідрид літію (5,62г; 148ммол) суспендують у 50мл безводного тетрагідрофурану. Розчин сполуки, одержаний на Стадії F (11,9г; 37ммол), розчинений заздалегідь в 50мл безводного тетрагідрофурану, потім додають краплями. Реакційну суміш потім перемішують при температурі навколишнього середовища протягом 2 годин. Мінімальну кількість розчину гідроксиду натрію (2N NaOH) додають до реакційної суміші доти, доки не припиняється виділення газу, для того, щоб утворити осади літію і гідроокисів алюмінію. Осади потім відфільтровують і промивають тетрагідрофураном. Органічну фазу випаровують при зниженому тиску. Вказану у заголовку сполуку очищають хроматографією на силікагелі. Світла жовта олія. Стадія Н: трет-Бутил 6-метокси-4{[(метилсульфоніл)окси]метил}-3,4-дигідро-2(1Н)ізохінолінкарбоксилат 19 81610 Сполуку, одержану на Стадії G (10,5г; 36ммол), розчиняють у 150мл дихлорметану і потім додають триетиламін (8,5мл). Розчин охолоджують до 0°С і метансульфоніл хлорид (4,8мл; 62ммол) додають краплями. Реакційну суміш перемішують при температурі навколишнього середовища протягом 2 годин і потім виливають у 150мл води. Розчин екстрагують дихлорметаном, сушать над сульфатом магнію, відфільтровують і випаровують при зниженому тиску. Вказану у заголовку сполуку очищають хроматографією на силікагелі. Жовта олія. Стадія І: трет-Бутил 4-(ціанометил)-6-метокси3,4-дигідро-2(1Н)-ізохінолінкарбоксилат Ціанід калію (5,52г; 85ммол) суспендують у 50мл DMSO і розчин нагрівають до 80°С. Сполуку, одержану на Стадії n (6,3г; 17ммол), розчинену заздалегідь в 50мл DMSO, поступово додають до попереднього розчину і потім реакційну суміш нагрівають знову при 80°С протягом 30 хвилин. Розчин виливають у 150мл води і екстрагують тричі дихлорметаном. Органічну фазу потім сушать над сульфа том магнію, відфільтровують і випаровують. Одержану темно-червону олію очищують хроматографією на силікагелі (елюент:циклогексан з поступовим додаванням етилацетату доти , доки не буде досягнуто пропорції 8/2) і одержану тверду речовину перекристалізовують з циклогексану для одержання вказаного у заголовку продукту у формі білої твердої речовини. Температура плавлення: 75-77°С Стадія J: трет-Бутил 4-(2-аміноетил)-6метокси-3,4-дигідро-2(Ш)-ізохінолінкарбоксилат Сполуку, одержану на Стадії І (6,3г; 21ммол), розчиняють у 150мл метанолу, насиченого NH3(g). Розчин виливають в автоклав і додають нікель Ренея (600мг). Реакційну суміш потім перемішують при 60°С і при тиску водню 50 бар протягом 6 годин. Після видалення каталізатора шляхом фільтрування розчин випаровують при зниженому тиску і вказану у заголовку сполуку у формі безбарвної олії. Приготування 3: (6-Метокси-4ізохінолініл)ацетонітрил гідрохлорид Стадія А: Метил 6-метокси-4-ізохінолінкарбоксилат гідрохлорид Сполуку, одержану на Стадії D Приготування 2 (1,56г; 0,006мол), у формі основи, розчиняють у 10мл декагідронафталіну і потім додають активований паладій-на-вугіллі (10% за вагою). Реакційну суміш нагрівають при 130°С протягом 24 годин, перемішуючи. Каталізатор відфільтровують в нагрітому стані і промивають етилацетатом. Після випаровування при зниженому тиску одержану олію вміщують в ефірний розчин, насичений HCl(g). Осад, який випав, фільтрують під вакуумом і перекристалізовують з ацетонітрилу для одержання вказаного у заголовку продукту у формі білої твердої речовини. Температура плавлення: 178-180°С Стадія В: (6-метокси-4-ізохінолініл)метанол гідрохлорид 20 Сполуку, одержану на Стадії А (0,395г; 0,0015мол), у формі основи, розчиняють у 200мл ефіру. Алюмогідрид літію (0,14г; 0,004мол) потім поступово додають протягом охолоджування колби на льоду. Реакційну суміш перемішують при температурі навколишнього середовища протягом одного тижня. Мінімум 30% розчину гідроксиду натрію (декілька крапель) додають до реакційної суміші для одержання осадів літію і гідроокисів алюмінію. Осади потім відфільтровують і промивають етилацетатом. Органічну фазу сушать над сульфа том магнію, відфільтровують і випаровують при зниженому тиску. Одержану олію вміщують в ефір, насичений HCl(g). Осад, який випав, фільтрують під вакуумом і перекристалізовують з ацетонітрилу для одержання вказаного у заголовку продукту у формі білої твердої речовини. Температура плавлення: 250-252°С Стадія С: 4-(Хлорметил)-6-метоксіізохінолін Гідрохлорид сполуки, одержаної на Стадії В (1,09г; 0,005мол), суспендують у 50мл хлороформу. Тіонілхлорид (2,80мл; 0,04мол) додають і потім реакційну суміш нагрівають із зворотним холодильником протягом 24 годин, перемішуючи. Після випаровування при зниженому тиску одержаний залишок вміщують в етиловий ефір. Осад, який випав, фільтрують під вакуумом і перекристалізовують з ацетонітрилу для одержання вказаної у заголовку сполуки у формі білої твердої речовини. Температура плавлення: 256-257°С Стадія D: (6-метоксі-4-ізохінолініл)ацетонітрил гідрохлорид Гідрохлорид сполуки, одержаної на Стадії С (0,60г; 0,0024мол), розчиняють у 10мл насиченого водного розчину карбонату калію і 40мл дихлорметану. Бромід тетрабутиламонію (2г; 0,006мол) і ціанід калію (0,80г; 0,012мол) потім додають до попереднього розчину. Реакційну суміш перемішують при температурі навколишнього середовища протягом 24 годин. Розчин екстрагують дихлорметаном і органічну фазу промивають водою, сушать над сульфатом магнію, відфільтровують і випаровують. Одержану олію вміщують в ацетон і в ефір, насичений HCl(g). Осад, який випав, фільтрують під вакуумом і перекристалізовують з толуолу/циклогексану, 5/5, для одержання вказаної у заголовку сполуки у формі твердого жовтого кольору. Температура плавлення: 114-115°С Приготування 4: трет-Бутил 4-(амінометил)-6метокси-3,4-дигідро-2(1Н)-ізохінолінкарбоксилат Стадія А: трет-Бутил 6-метокси-4{[(метилсульфоніл)окси]метил}-3,4-дигідро-2(1H)ізохінолінкарбоксилат Методика є такою ж, як і для Стадій А-Н Приготування 2. Стадія В: трет-Бутил 4-(азидометил)-6метокси-3,4-дигідро-2(1Н)-ізохінолінкарбоксилат Азид натрію (1,12г) суспендують в 40мл DMF і розчин нагрівають до 80°С. Сполуку, одержану на Стадії А (1,6г), розчинену заздалегідь в 10мл ДМФ, поступово додають до попереднього розчину і 21 81610 потім реакційну суміш нагрівають знову при 80°С протягом від 2 до 3 годин. Розчин виливають в 150мл води і екстрагують тричі етилацетатом. Органічну фазу потім сушать над сульфатом магнію, відфільтровують і випаровують. Одержану темно-червону олію очищують хроматографією на силікагелі (елюент: циклогексан з поступовим додаванням етилацетату доти , доки не буде досягнуто пропорції 5/5) для одержання вказаного у заголовку продукту у формі безбарвної олії. Стадія С: трет-Бутил 4-(амінометил)-6метокси-3,4-дигідро-2(1Н)-ізохінолінкарбоксилат Сполуку, одержану на Стадії В (1,14г), розчиняють у 100мл метанолу і потім паладій-навугіллі (120мг) додають до розчину. Реакційну суміш перемішують при температурі навколишнього середовища і під воднем протягом 3 годин. Після видалення паладію-на-вугіллі шляхом фільтрування органічну фазу випаровують при зниженому тиску. Одержаний залишок очищують хроматографією на силікагелі (елюент: циклогексан з поступовим додаванням етилацетату доки, доки не буде досягнуто пропорції 5/5) для одержання вказаного у заголовку продукту у формі безбарвної олії. Приклад 1: 4-(6-метокси-3,4-дигідро-4ізохінолініл)-N-метилбутанамід Сполуку, одержану у Приготуванні 1 (41ммол), у формі основи, розчиняють у 10мл етанолу. Додають 60мл водного метиламіну і реакційну суміш перемішують при температурі навколишнього середовища протягом 12 годин. Після випаровування при зниженому тиску фільтрат вміщують у 50мл води і екстрагують дихлорметаном. Органічну фазу промивають водою, сушать над сульфатом магнію, відфільтровують і випаровують при зниженому тиску. Вказаний у заголовку продукт одержують після хроматографії одержуваної в результаті олії на силікагелі. Жовта олія. Приклад 2: 4-(6-Метокси-1,2,3,4-тетрагідро-4ізохінолініл)-N-метилбутанамід Сполуку, одержану у Прикладі 1 (54ммол), у формі основи, розчиняють у 50мл метанолу і потім додають паладій-на-вугіллі (150мг) до розчину. Реакційну суміш перемішують при температурі навколишнього середовища і під воднем протягом 4 годин. Після видалення паладію-на-вугіллі шляхом фільтрування органічну фазу випаровують при зниженому тиску. Одержану олію очищують хроматографією на силікагелі для одержання вказаного у заголовку продукту у формі жовтої олії. Приклад 3: 4-(6-метоксі-4-ізохінолініл)-Nметилбутанамід; Стадія А: Етил 4-(6-метоксі-4ізохінолініл)бутаноат гідрохлорид Сполуку, одержану у Приготуванні 1 (1,6г; 5ммол) розчиняють, із застосуванням тепла, в 20мл толуолу, який містить триетиламін (0,9мл) і чистий етанол (2мл). Паладій-на-вугіллі (300мг) додають до реакційної суміші, яку потім нагрівають 22 із зворотним холодильником протягом 24 годин, перемішуючи. Після видалення паладію-на-вугіллі шляхом фільтрування органічну фазу випаровують при зниженому тиску. Одержаний залишок очищують хроматографією на силікагелі (елюент: дихлорметан з поступовим додаванням метанолу). Одержану олію перетворюють у форму гідрохлориду і потім осад, що випав, перекристалізовують з ацетонітрилу. Температура плавлення: 190-192°С Стадія В: 4-(6-метоксі-4-ізохінолініл)-Nметилбутанамід Сполуку, одержану на Стадії А (2,2г; 7ммол), розчиняють у 30мл метиламіну (40% у воді) і суміш нагрівають із зворотним холодильником протягом 3 годин, перемішуючи. Реакційну суміш вміщують в 50мл води і екстрагують е фіром. Органічну фаз у промивають водою, суша ть над сульфатом магнію, відфільтровують і випаровують при зниженому тиску. Одержану олію очищують хроматографією на силікагелі (елюент:дихлорметан з поступовим додаванням метанолу). Одержану олію випаровують при зниженому тиску і осад, який випав таким чином, перекристалізовують з толуолу для одержання вказаного у заголовку продукту у формі білої твердої речовини. Температура плавлення: 117-119°С Елементний мікроаналіз: Розраховано Знайдено С% 69,74 69,64 Н% 7,02 7,22 N% 10,84 10,83 Приклад 4: N-[2-(6-метокси-1,2,3,4-тетрагідро4-ізохінолініл)етил]-ацетамід гідрохлорид Сполуку, одержану на Стадії І Приготування 2 (6г; 20ммол), розчиняють у 100мл оцтового ангідриду і потім розчин виливають в автоклав. Потім додають до розчину нікель Ренея (600мг) і реакційну суміш перемішують при 60°С і під тиском водню 50бар протягом 6 годин. Після видалення каталізатора шляхом фільтрування розчин випаровують при зниженому тиску. Одержаний оранжевий залишок вміщують у 10% розчин гідроксиду натрію і перемішують протягом 15 хвилин, і потім екстрагують етиловим ацетатом (тричі). Органічну фаз у промивають один раз водою, сушать над сульфатом магнію, відфільтровують і випаровують при зниженому тиску. Одержану олію вміщують в 50мл метанолу. Газ гідрохлориду барботують у розчин, який потім перемішують протягом 24 годин із СаСl2 захистом. Розчин випаровують при зниженому тиску і осад, одержаний таким чином, перекристалізовують з ацетонітрилу для одержання вказаного у заголовку продукту у формі білої твердої речовини. Температура плавлення: 182-184°С Приклад 5: N-[2-(6-метокси-1,2,3,4-тетрагідро4-ізохінолініл)етил]-пропанамід гідрохлорид Сполуку, одержану у Приготуванні 2, і 2 еквіваленти карбонату калію розчиняють в 3/2 суміші етилацетат/вода. Пропаноїл хлорид (2 еквіваленти) потім додають краплями до розчину. 23 81610 Реакційну суміш перемішують при температурі навколишнього середовища протягом однієї години. Після розділення фаз органічну фазу промивають водою, сушать над сульфатом магнію, відфільтровують і випаровують при зниженому тиску. Одержану олію очищують хроматографією на силікагелі (елюент: етилацетат/циклогексан 5/5). Одержану олію вміщують в метанол. Газ гідрохлориду барботують у розчин, який потім перемішують протягом 24 годин із СаСl2 захистом. Розчин випаровують при зниженому тиску і вказану у заголовку сполуку одержують у формі білої твердої речовини. Приклад 6: N-[2-(6-метокси-1,2,3,4-тетрагідро4-ізохінолініл)етил]-бутанамід гідрохлорид Вказану у заголовку сполуку одержують відповідно до такої ж методики, яка описана у Прикладі 5, але із заміщенням пропаноїл хлориду на бутаноїл хлорид. Дуже гігроскопічна біла тверда речовина. Приклад 7: N-[2-(6-метокси-1,2,3,4-тетрагідро4-ізохінолініл)етил]-циклопропанкарбоксамід гідрохлорид Вказану у заголовку сполуку одержують відповідно до такої ж методики, яка описана у Прикладі 5, але із заміщенням пропаноїл хлориду на хлорид циклопропілкарбоциклічної кислоти. Біла тверда речовина. Температура плавлення: 215-217°С. Приклад 8: N-[2-(6-метокси-1,2,3,4-тетрагідро4-ізохінолініл)етил]-циклобутанкарбоксамід гідрохлорид Вказану у заголовку сполуку одержують відповідно до такої ж методики, яка описана у Прикладі 5, але із заміщенням пропаноїл хлориду на хлорид циклобутилкарбоциклічної кислоти. Біла тверда речовина. Температура плавлення: 130-132°С. Приклад 9: N-[2-(6-метокси-4ізохінолїніл)етил]ацетамід гідрохлорид Сполуку, одержану у Приготуванні 3 (0,30г; 0,0015мол), у формі основи, розчинену заздалегідь у 10мл оцтового ангідриду, виливають у автоклав і потім додають нікель Ренея (10% за вагою). Потім суміш утримують під тиском водню (60бар) і нагрівають при 60С° протягом 6 годин, перемішуючи. Після видалення нікелю Ренея шляхом фільтрування органічну фазу вміщують у 10% розчин гідроксиду натрію при температурі навколишнього середовища і перемішують за допомогою магнітної мішалки протягом 15 хвилин. Розчин екстрагують етилацетатом, органічну фазу промивають соляним розчином, сушать над сульфатом магнію, відфільтровують і випаровують при зниженому тиску. Одержану олію очищають на колонці (елюент: дихлорметан з поступовим додаванням метанолу доти, доки не буде досягнуто пропорції 9/1). Очищену олію вміщують в ефір, насичений з HCl(g). Осад, який випав, фільтрують під вакуумом і перекристалізовують з етанолу для одержання вказаного у заголовку продукту у формі білої твердої речовини. Температура плавлення: 212-214°С Приклад 10: N-[2-(6-метоксі-4ізохінолініл)етил]пропанамід гідрохлорид 24 Сполуку Прикладу 5 розчиняють у мінімальній кількості метанолу із застосуванням тепла і потім розбавляють толуолом. 1,5 еквіваленти триетиламіну потім додають до розчину і реакційну суміш згодом нагрівають із зворотним холодильником у присутності паладію-на-вугіллі (10% за вагою) протягом 3 годин. Після видалення каталізатора шляхом фільтрування розчин випаровують при зниженому тиску. Одержану олію очищують хроматографією на силікагелі (елюент: дихлорметан/метанол 9/1). Очищену олію вміщують в ефір, насичений HCl(g), і перемішують доти, доки не випаде осад. Осад, що випав таким чином, фільтрують під вакуумом і утримують під вакуумом в ексикаторі. Вказаний у заголовку продукт одержують у формі білої твердої речовини. Температура плавлення: 233-235°С Приклад 11: N-[2-(6-метоксі-4ізохінолініл)етил]бутанамід гідрохлорид Вказану у заголовку сполуку одержують відповідно до тієї ж методики, яка застосована у Прикладі 10, починаючи зі сполуки, одержаної у Прикладі 6. Температура плавлення: 195-197°С Приклад 12: N-[2-(6-метоксі-4ізохінолініл)етил]циклопропанкарбоксамід гідрохлорид Вказану у заголовку сполуку одержують відповідно до тієї ж методики, яка застосована у Прикладі 10, починаючи зі сполуки, одержаної у Прикладі 7. Температура плавлення: 195-197°С Приклад 13: N-[2-(6-метоксі-2-феніл-1,2,3,4тетрагідро-4-ізохінолініл)-етиліацетамід гідрохлорид Сполуку, одержану у Прикладі 4 (460мг; 1,8ммол), у формі основи, суспендують у ЗОмл дихлорметану. Потім додають трифенілвісмут (900мг; 2ммол) і ацетат міді Сu(ОАс)2 (190мг; 0,95ммол). Реакційну суміш утримують під аргоном і перемішують за допомогою магнітної мішалки протягом 18 годин при температурі навколишнього середовища. Суміш фільтрують, вміщують у воду і екстрагують етилацетатом. Органічну фазу сушать над сульфатом магнію, відфільтровують і випаровують при зниженому тиску. Одержаний залишок очищають хроматографією на силікагелі (елюент: етилацетат/циклогексан 2/8). Очищену олію вміщують в е фір, насичений HCl(g) і перемішують доти, доки не випаде осад, який потім фільтрують під вакуумом і утримують у вакуумі в ексикаторі для одержання вказаного у заголовку продукту у формі білої твердої речовини. Температура плавлення: 83-85°С. Приклад 14: Ν-[2-(2-бензил-6-метоксі-1,2,3,4тетрагідро-4-ізохінолініл)-етил]ацетамід Сполуку, одержану у Прикладі 4 (740мг; 2,5ммол), і карбонат калію (720мг; 5ммол) суспендують у 20мл ДМФ і потім додають до розчину бензилбромід (0,37мл; 3ммол). Реакційну суміш нагрівають при 125°С протягом 4 годин, перемішуючи. Розчин виливають у 50мл води, ацилюють 6N НСl і промивають етилацетатом. 25 81610 Водну фазу підлуговують карбонатом калію і екстрагують дихлорметаном. Органічну фазу сушать над сульфа том магнію, відфільтровують і випаровують при зниженому тиску. Одержаний таким чином залишок очищують хроматографією на силікагелі (елюент: дихлорметан з поступовим додаванням метанолу доти, доки не буде досягнуто пропорції 9/1). Очищена олія випадає в осад. Осад, що випав таким чином, перекристалізовують з суміші 7/3 толуол/циклогексан для одержання вказаного у заголовку продукту у формі білої твердої речовини. Температура плавлення: 123-125°С. Приклад 15: N-{2-[2-(3-формілфеніл)-6метоксі-1,2,3,4-тетрагідро-4ізохінолініл]етил}ацетамід Ацетат міді Сu(ОАс)2 (960мг; 5ммол) і триетиламін (1,5мл; 10,5ммол) суспендують у 60мл дихлорметану. Сполуку Прикладу 4 (1г; 3,5ммол), 3-формілфенілборонову кислоту (1,05г; 7ммол) і молекулярне сито потім додають підряд і поступово до розчину. Реакційну суміш перемішують при температурі навколишнього середовища протягом 2 годин. Суміш відфільтровують, промивають водою, сушать над сульфатом магнію, відфільтровують і випаровують при зниженому тиску. Одержаний залишок очищують хроматографією на силікагелі (елюент:дихлорметан з поступовим додаванням метанолу доти, доки не буде досягнуто пропорції 9/1) для одержання вказаного у заголовку продукту у формі жовтої олії. Приклад 16: N-[2-6-метоксі-2-метил-1,2,3,4тетрагідро-4-ізохінолінілі-етил]ацетамід гідрохлорид Мурашину кислоту (0,55мл) і 37% формальдегід (0,6мл) додають при 0°С до сполуки, одержаної у Прикладі 4 (1,8г; 7,2ммол), у формі основи. Реакційну суміш нагрівають в 80°С протягом 24 годин, перемішуючи. Після охолодження реакційної суміші до 0°С додають 10мл 6N НСl. Суміш потім промивають ефіром, підлуговують 2N NaOH і екстрагують ефіром. Органічну фазу сушать над сульфатом магнію, відфільтровують і випаровують при зниженому тиску. Одержану жовту олію очищують хроматографією на силікагелі (елюент:дихлорметан з поступовим додаванням метанолу доти, доки не буде досягнуто пропорції 9/1). Очищену олію вміщують в ефір, насичений з HCl(g), і перемішують доти, доки не випаде осад, який потім фільтрують під вакуумом і утримують під вакуумом в ексикаторі для одержання вказаного у заголовку продукту у формі дуже гігроскопічної білої твердої речовини. Температура плавлення: 59-61°С Приклад 17: N-(2-[2-(Циклопропілметил)-6метоксі-1,2,3,4-тетрагідро-4ізохінолін]етиліацетамід гідрохлорид Сполуку, одержану у Прикладі 4 (1,03г), і карбонат калію (1,25г) суспендують у 50мл ацетону. Розчин перемішують при температурі навколишнього середовища протягом 10 хвилин і потім метилциклопропан бромід (0,36мл) додають 26 до розчину. Реакційну суміш перемішують при температурі навколишнього середовища протягом 12 годин. Карбонат калію відфільтровують і відновлений розчин випаровують. Залишок вміщують у воду і водну фазу екстрагують ефіром. Органічну фазу сушать над сульфа том магнію, відфільтровують і випаровують при зниженому тиску. Одержаний таким чином залишок очищують хроматографією на силікагелі (елюент:дихлорметан з поступовим додаванням метанолу доти, доки не буде досягнуто пропорції 9/1). Очищену олію вміщують в ефір, насичений HCl(g), і перемішують доти, доки не випаде осад, який потім фільтрують під вакуумом і утримують під вакуумом в ексикаторі для одержання вказаного у заголовку продукту у формі гігроскопічної білої твердої речовини. Температура плавлення:
ДивитисяДодаткова інформація
Назва патенту англійськоюIsoquinoline derivatives, process for their preparation and pharmaceutical composition containing thereof
Автори англійськоюPoissonnier Durieux Sophie, Wallez Valerie, Gasnereau Anne, Yous Said, Lesieur Daniel, Delagrange Philippe, Renard Pierre, Bennejean Caroline, Boutin Jean Albert, Audinot Valerie
Назва патенту російськоюИзохинолиновые соединения, способ их получения и фармацевтическая композиция, которая их содержит
Автори російськоюПуассонье-Дюрье Софи, Валле Валери, Гаснеро Анри, Ию Саид, Лезье Даниэль, Делягранж Филлип, Ренар Пьер, Беннежан Каролин, Бутен Жан, Альбер, Одино Валери
МПК / Мітки
МПК: A61P 25/02, A61P 3/10, A61P 25/22, A61P 37/02, A61P 25/08, A61P 25/28, A61P 43/00, C07D 217/16, A61P 25/00, A61P 25/20, C07D 217/14, A61P 15/00, A61P 9/00, A61P 25/06, A61P 1/00, A61P 25/24, A61K 31/472, A61P 3/04, A61P 3/02, A61P 25/16, A61P 35/00
Мітки: яка, композиція, одержання, спосіб, сполуки, містить, ізохінолінові, фармацевтична
Код посилання
<a href="https://ua.patents.su/15-81610-izokhinolinovi-spoluki-sposib-kh-oderzhannya-i-farmacevtichna-kompoziciya-yaka-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Ізохінолінові сполуки, спосіб їх одержання і фармацевтична композиція, яка їх містить</a>












