Фармацевтично корисні солі похідних карбонової кислоти
Номер патенту: 81807
Опубліковано: 11.02.2008
Автори: Мінідіс Анна, Ліндстедт Альстермарк Ева-Лотт, Орелль Карл-Йоган, Ольссон Бенгт, Дальстром Мікаель, Стогле Еріка
Формула / Реферат
1. Сполука, яку вибирають з однієї або декількох наступних сполук:
солі (1R,2S)-2-гідроксііндан-1-аміну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
солі L-аргініну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
солі трет-бутиламіну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
солі холіну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
солі адамантиламіну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
солі N-бензил-2-фенілетанамоніуму та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
солі N-бензил-2-(бензиламіно)етанамоніуму та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
або
солі трис(гідроксиметил)метиламіну (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти.
2. Сполука за пунктом 1, де сполуку вибирають з однієї або декількох наступних сполук:
солі (1R,2S)-2-гідроксііндан-1-аміну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
солі L-аргініну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
солі трет-бутиламіну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
солі холіну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
або
солі трис(гідроксиметил)метиламіну (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти.
3. Сполука за пунктом 1, де сполуку вибирають з:
солі адамантиламіну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
солі N-бензил-2-фенілетанамоніуму та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
солі N-бензил-2-(бензиламіно)етанамоніуму та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти.
4. Сполука, яку вибирають з:
солі (1R,2S)-2-гідроксііндан-1-аміну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
солі L-аргініну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
солі трет-бутиламіну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти;
5. Сполука за будь-яким з пунктів 1-4, яка може бути у формі сольвату, гідрату, у суміші сольват/гідрат, несольвату або негідрату.
6. Сполука за будь-яким з пунктів 1-5, в кристалічній або частково кристалічній формі.
Текст
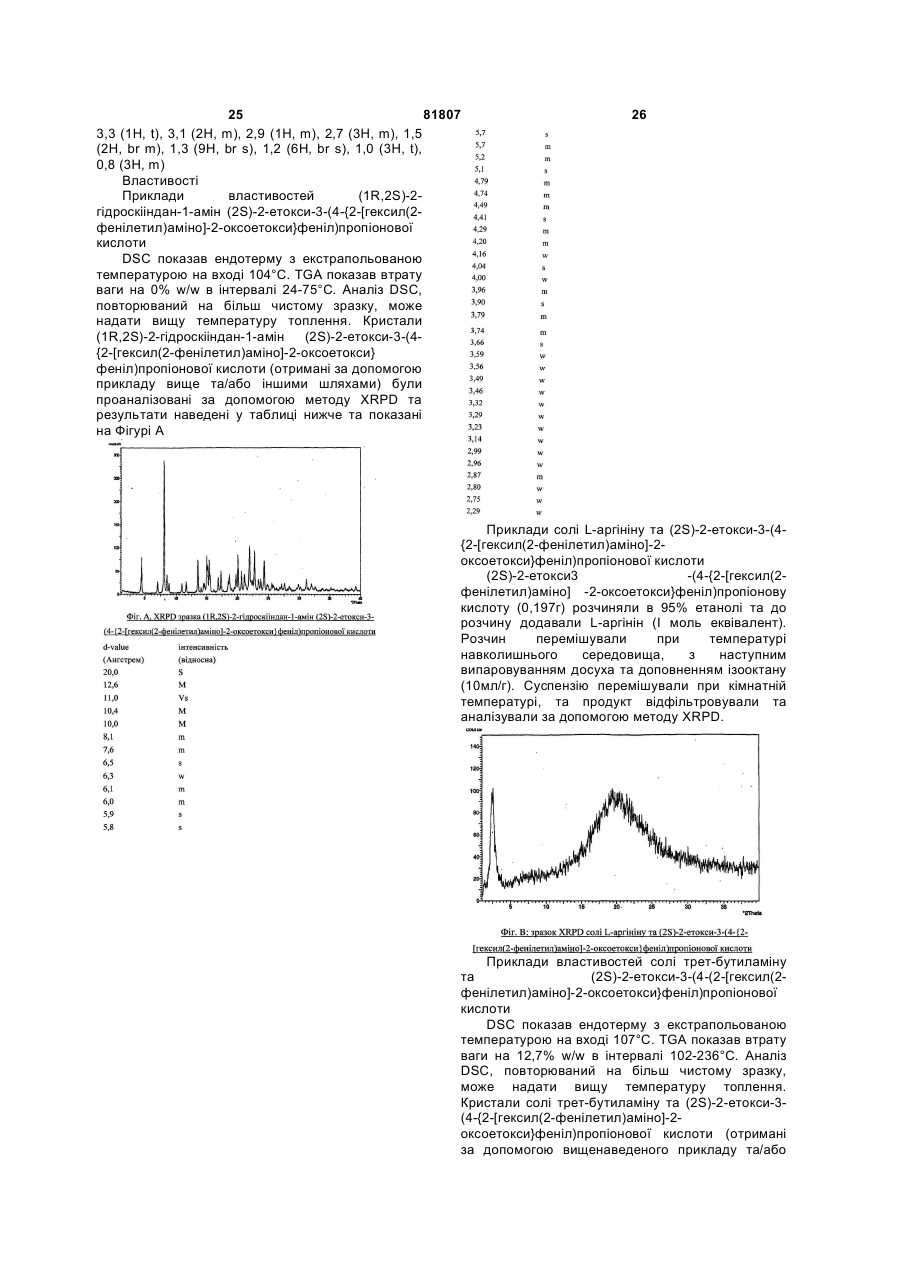
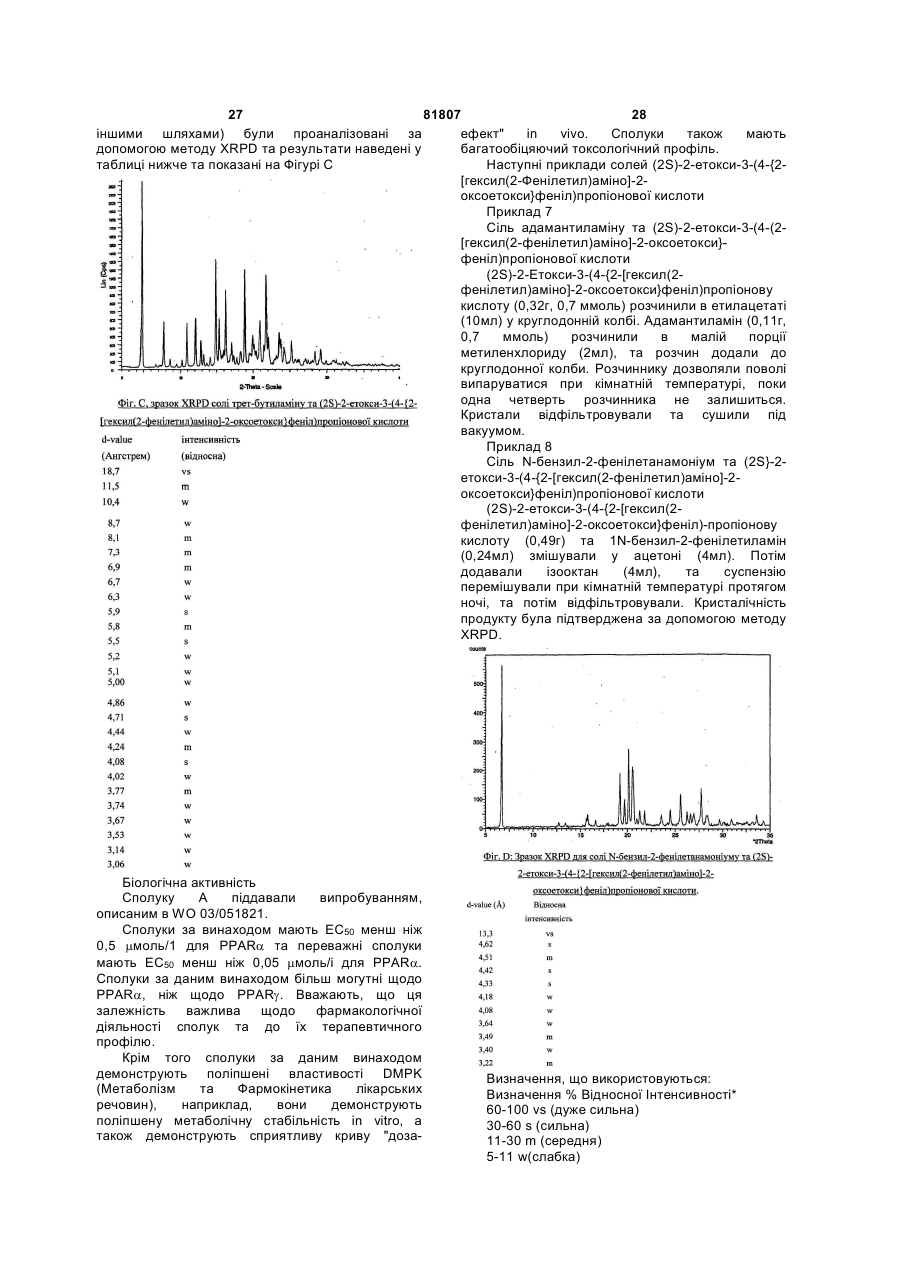
1. Сполука, яку вибирають з однієї або декількох наступних сполук: солі (1R,2S)-2-гідроксііндан-1-аміну та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти; солі L-аргініну та (2S)-2-етокси-3-(4-{2[гексил(2-фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти; солі трет-бутиламіну та (2S)-2-етокси-3-(4{2-[гексил(2-фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти; солі холіну та (2S)-2-етокси-3-(4-{2[гексил(2-фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти; солі адамантиламіну та (2S)-2-етокси-3-(4{2-[гексил(2-фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти; солі N-бензил-2-фенілетанамоніуму та (2S)-2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти; солі N-бензил-2(бензиламіно)етанамоніуму та (2S)-2-етокси-3-(4{2-[гексил(2-фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти; або солі трис(гідроксиметил)метиламіну (2S)2-етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти. 2. Сполука за пунктом 1, де сполуку вибирають з однієї або декількох наступних 2 3 Даний винахід відноситься до певних нових солей похідних (2S)-3-(4-{2-[аміно]-2оксоетокси}феніл)-2-етоксипропіонової кислоти, до способів одержання таких сполук, до їх корисності при лікування клінічних станів, включаючи ліпідні розлади (дисліпідемію), так або інакше пов'язані з резистентністю до інсуліну та інші прояви метаболічного синдрому, до способів їх терапевтичного використання та до фармацевтичних композицій, що їх містять. Метаболічний синдром, що включає цукровий діабет типу 2, відноситься до групи порушень, включаючи резистентність до інсуліну з супутньою гіперінсулінемією, можливо цукровий діабет типу 2, артеріальну гіпертензію, основне (внутрішнє) ожиріння, дисліпідемію, яка спостерігається у вигляді порушених рівнів ліпопротеїнів, що характеризуються підвищенням VLDL (ліпопротеїни дуже низької густини), малими щільними частками LDL та зменшенням концентрації HDL (ліпопротеїни високої густини) та зменшенням фібринолізу. Недавнє епідеміологічне дослідження документально підтвердило, що індивідууми з резистентністю до інсуліну мають значно збільшений ризик захворювань серцево-судинної системи та смертності, виключно страждаючи від інфаркту міокарду та удару. При цукровому діабеті типу 2 стани, пов'язані з атеросклерозом, викликають до 80% всіх смертей. В клінічній медицині усвідомлюють необхідність збільшення чутливості до інсуліну у хворих на метаболічний синдром та, таким чином усувати дисліпідемію, яка є причиною прискореного прогресу атеросклерозу. Проте, зараз це не є універсально загальноприйнятий діагноз з чіткими фармокотерапевтичними вказівками. Заявка на патент РСТ № PCT/GB02/05743 розкриває сполуки формули А де n є 1 або 2, та їх оптичні ізомери та рацемати, фармацевтично прийнятні солі, сольвати, кристалічні форми та проліки - це надзвичайно могутні PPARa модулятори. PPAR є модулятором рецепторів, активованих проліфераторами пероксисом [для огляду по PPAR див. Т.М. Willson et аі, J Med Chem 2000, Vol 43, 527]. Ці сполуки ефективні при лікуванні станів, що пов'язанні з резистентністю до інсуліну. Індивідуальні фармацевтично прийнятні солі сполук формули А не розкрити в PCT/GB02/05743. Більш того, ніяка інформація не забезпечує того, як кристалічні форми сполук формули А, та особливо їх солі, можуть бути одержані. В цій заявці сполуку, в якій n дорівнює 2, одержують як вільну кислоту. Проте, ця сполука - це сиропоподібна речовина, та тому вона не придатна для використання у фармацевтичних композиціях. Таким чином, виникає потреба у 81807 4 похідній цієї сполуки, яка має фізико-хімічні властивості, прийнятні для використання у фармацевтичних композиціях. Робили спроби, щоб одержати солі з багатьма різними протиіонами. Проте, як найбільше були незадовільні, наприклад, з наступних причин. Сіль не могла утворитися в твердому стані, або якщо утворювалася, то сіль була аморфною з низькою температурою склування. У складі лікарської композиції, це важливо для лікарської субстанції, щоб бути у формі, яку можна зручно обробляти та переробляти. Це важливо, не тільки з точки зору отримання комерційножиттєздатного виробничого способу, але і з точки зору подальшого виробництва фармацевтичних композицій, що містять активну сполуку. Додатково, у виробництві лікарських композицій, важливо, забезпечити надійний, відтворений та постійний концентраційний профіль плазми ліків, слідуючи призначенню ліків хворому. Хімічна стабільність, твердо-фазова стабільність, та "збереженість" активних інгредієнтів - це також дуже важливі чинники. Лікарська субстанція, та композиції, що містять її, повинні бажано припускати існування фактично збережених протягом значного періоду часу, без прояву істотної зміни у фізико-хімічних властивостях активного компоненту (наприклад, його хімічний склад, густина, гігроскопічність та розчинність). Крім того, також важливо, зуміти забезпечити ліки у формі, яка є хімічно чистою по мірі можливості. Кваліфікований фахівець в даній галузі техніки розуміє, що, звичайно, якщо ліки можуть бути легко одержані в стійкій формі, як наприклад, стійка кристалічна форма, забезпечуються переваги виходячи з легкості обробки, легкості одержання прийнятних фармацевтичних композицій, та більш надійного профілю розчинності. Даний винахід надає сполуку, вибрану з однієї або декількох наступних сполук: сіль (1R,2S)-2-гідроксііндан-1-аміну та (2S)-2етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти; сіль L-аргініну та (2S)-2-етокси-3-(4-{2[гексил(2-фенілетил)аміно]-2-оксоетокси} феніл)пропіонової кислоти; сіль трет-бутиламіну та (2S)-2-етокси-3-(4-{2[гексил(2-фенілетил)аміно]-2-оксоетокси} феніл)пропіонової кислоти; сіль холіну та (2S)-2-етокси-3-(4-{2-[гексил(2фенілетил)аміно]-2-оксоетокси} феніл )пропіонової кислоти; сіль адамантиламіну та (2S)-2-етокси-3-(4-{2[гексил(2-фенілетил)аміно]-2-оксоетокси} феніл)пропіонової кислоти; сіль N-бензил-2-фенілетанамоніуму та (2S)-2етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти; сіль N-бензил-2-(бензиламіно)етанамоніуму та (2S)-2-етокси-3-(4-{2-[гексил(2-феніл етил )аміно]2-оксоетокси}феніл)пропіонової кислоти; 5 81807 6 або 460лк UV/видиме світло на тривалі періоди (тобто сіль тріс(гідроксиметил)метиламіну (2S)-2більші ніж або дорівнюють шести місяців). При eтокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2таких умовах, сполуки за винаходом можуть бути оксоетокси} феніл)пропіонової кислоти. знайдені, щоб бути менш ніж на 15%, більш Ми знайшли, що певні сполуки за винаходом переважно менш ніж на 10%, та особливо менш мають перевагу, тому що вони можуть бути ніж на 5%, хімічно деградовані або розложені, або одержані в кристалічній формі. піддані твердо-фазомому перетворенню, Згідно подальшого аспекту винаходу, відповідним чином. Кваліфікований фахівець буде забезпечують сполуку винаходу здебільшого у враховувати, що вищенаведені верхні та нижчі кристалічній формі. ліміти для температури, тиску та відносної Хоча ми знайшли, що можливо синтезувати вологості являють крайнощі нормальних умов сполуки за винаходом у формах, які є більше ніж зберігання, та що певні комбінації цих крайнощів 80% кристалічними, в "здебільшого кристалічні", не будуть випробувані протягом нормального ми включаємо більше ніж 20%, переважно більше зберігання (наприклад температура 50°С та тиск ніж 30%, та більш переважно більше ніж 40% 0,1 барів). (наприклад більше ніж будь-які з 50, 60, 70, 80 або Є така можливість, щоб кристалізувати солі 90%) кристалічні. сполук формули А з або без присутності Згідно подальшого аспекту винаходу, також розчинювальної системи (наприклад, забезпечують сполуку винаходу в частково кристалізація може бути з розплаву, при кристалічній формі. В "частково кристалічні" ми суперкритичних умов, або досягнута сублімацією). включаємо 5% або між 5% та 20% кристалічності. Проте, ми вважаємо, щоб переважно кристалізація Ступінь (%) кристалічності може визначатися відбувалася з прийнятної розчинювальної кваліфікованим фахівцем, що використовує системи. рентгенівську порошкову дифрактометрію (XRPD). Згідно подальшого аспекту винаходу, Інші методи, як наприклад, твердо-фазовий ЯМR, забезпечують спосіб одержання кристалічної FT-IR, раман-спектроскопія, диференціальна сполуки за винаходом, який включає кристалізацію скануюча калориметрія (DSC) та сполуки за винаходом з прийнятної мікрокалориметрія, можуть також розчинювальної системи. використовуватися. Температура кристалізації та час кристалізації Сполуки за винаходом, та особливо залежать від солі, яку кристалізують, концентрації кристалічні сполуки за винаходом, можуть мати тієї солі в розчині, та розчинювальної системи, яка поліпшену стабільність у порівнянні зі сполуками, використовується. описаними в PCT/GB02/05743. Кристалізація може також ініціюватися та/або Термін "стабільність", як визначено тут, проводитися за допомогою стандартних методів, включає хімічну стабільність та твердо-фазову наприклад, з або без використання затравки стабільність. кристалів відповідної кристалічної сполуки за У "хімічну стабільність", ми включаємо винаходом. можливість зберігати сполуки за винаходом в Різні кристалічні форми сполук за винаходом ізольованій формі, або у формі композиції, в якій можна легко характеризувати, використовуючи надаються сполуки, у суміші з фармацевтично методи рентгенівської порошкової дифрактометрії прийнятними носіями, розріджувачами або (XRPD), наприклад як описано надалі. ад'ювантами (наприклад, в лікарській формі для Щоб забезпечити, належним чином, перорального застосування, як, наприклад, одержання індивідуальної кристалічної форми у таблетка, капсула, та т.п.), при нормальних умов відсутності інших кристалічних форм, кристалізації зберігання з незначним ступенем хімічної переважно здійснюють за допомогою введення деградації або розпаду. зародку та/або затравки кристалів бажаної У "твердо-фазову стабільність", ми кристалічної форми при власно кажучи повній включаємо, можливість зберігати сполуки за відсутності зародку та/або затравки кристалів винаходом в ізольованій твердій формі, або у інших кристалічних форм. формі твердої композиції, в якій надаються Затравки кристалів відповідної сполуки можуть сполуки, у суміші з фармацевтично прийнятними бути одержані, наприклад, за допомогою носіями, розріджувачами або ад'ювантами повільного випаровування розчинника з частини (наприклад, в лікарській формі для перорального розчину відповідної солі. застосування, як наприклад, таблетка, капсула, та Сполуки за винаходом можуть бути виділені, т.п.), при нормальних умов зберігання з незначним використовуючи методи, які добре відомі ступенем твердо-фазного перетворення кваліфікованим фахівцям в даній галузі техніки, (наприклад, кристалізація, рекристалізація, наприклад декантування, фільтрування або твердофазовий перехід, гідратація, дегідратація, центрифугування. сольватація або десольватація). Сполуки можуть бути висушені, Приклади "нормальних умов зберігання" використовуючи стандартні методи. включають температуру між мінус 80 та плюс 50°С Наступне очищення сполук за винаходом (переважно між 0 та 40°С та більш переважно може проводитися, використовуючи методи, які кімнатну температуру, як наприклад, від 15 до добре відомі кваліфікованим фахівцям в даній 30°С), тиск між 0,1 та 2 барів (переважно при галузі техніки. Наприклад, домішки можуть бути атмосферному тиску), відносну вологість між 5 та видалені за допомогою рекристалізації з 95% (переважно від 10 до 60%), та/або вплив відповідної розчинювальної системи. Прийнятні 7 81807 8 температура та час для рекристалізація залежать )пропіонової кислоти, що характеризується від концентрації солі в розчині, та від діаграмою рентгенівської порошкової розчинювальній системі, яка використовується. дифрактометрії, яка характеризується піками з dКоли сполуки за винаходом кристалізують або o рекристалізують, як описано в даній заявці, сіль, величинами при 18,7, 11,5, 5,9, 5,5, 4,71 та 4,08 A . що одержують у результаті, може знаходитися у Сіль трет-бутиламіну та (2S)-2-етокси-3-(4-{2формі, яка має поліпшену хімічну та/або твердо[гексил(2-фенілетил)аміно]-2фазову стабільність, як згадано вище. оксоетокси}феніл)пропіонової кислоти, що має Сполуки за винаходом мають перевагу, так діаграму XRPD по суті як показано на Фіг.С. вони можуть бути більш ефективними, бути менш Сіль адамантиламіну та (2S)-2-етокси-3-(4-{2токсичними, довше діяти, мати більш широкий ряд [гексил(2-фенілетил)аміно]-2-оксоетокси} активності, бути більш могутніми, викликати менш феніл)пропіонової кислоти. побічних ефектів, легше поглинатися, та/або мати Сіль N-бензил-2-фенілетанамоніуму та (2S)-2кращий фармакологічний профіль (наприклад, етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2вищу біодоступність при пероральному введені оксоетокси} феніл)пропіонової кислоти, що має препарату та/або більш низький кліренс), та/або діаграму XRPD по суті як показано на Фіг.D. мати інші корисні фармакологічні фізичні або Сіль N-бензил-2-(бензиламіно)етанамоніуму хімічні властивості ніж, сполуки, які відомі з та (2S)-2-етокси-3-(4-{2-[гексил(2попереднього рівня техніки. Сполуки за винаходом фенілетил)аміно]-2-оксоетокси}феніл)пропіонової можуть мати додаткову перевагу, тому що вони кислоти, що має діаграму XRPD по суті як можуть застосовуватися менш часто, ніж сполуки, показано на Фіг.Е. відомі з попереднього рівня техніки. Сполуки за винаходом одержують за Сполуки за винаходом можуть також мати допомогою розчинення (2S)-2-етокси-3 -(4- {2перевагу, тому що вони є у формі, яка надає [гексил(2-фенілетил)аміно] -2-оксоетокси} феніл поліпшену легкість обробки. Додатково, сполуки за )пропіонової кислоти в інертному розчиннику при винаходом мають перевагу, тому що вони можуть температурі в діапазоні 0-100°С, а потім додання бути одержані у форми, яка може мати поліпшену відповідного аміну або чистого, або у розчині хімічну та/або твердофазову стабільність інертного розчиннику, та виділення твердої солі. (включаючи, наприклад, обумовлену більш Сіль може бути видалена за допомогою низькою гігроскопічністю). Тому, такі сполуки за охолоджування реакційного розчину та, винаходом можуть бути стійкими, коли необов'язково, внесення затравки у розчин з зберігаються протягом тривалих періодів. кінцевим продуктом, та/або концентрування Сполуки за винаходом можуть також мати розчину. Необов'язково, продукт може бути перевагу, тому що вони можуть бути видалений за допомогою додавання кристалізовані з хорошим виходом, з високою антирозчинника до розчину продукту в інертному чистотою, швидко, зручно, та з низькою вартістю. розчиннику. Тверда фаза може бути зібрана Сполуки за даним винаходом застосовують як методами, які відомі з попереднього рівня техніки, ліки. Зокрема, ці сполуки - це надзвичайно могутні наприклад, фільтрування або центрифугуванням. В іншому аспекті даний винахід забезпечує агоністи PPARa. Крім того ці сполуки є також сполуку, одержану за допомогою реакції (2S)-2агоністами PPARg. Термін агоністи, який етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2використовується в даній заявці, включає часткові оксоетокси}феніл)пропіонової кислоти та третагоністи. бутиламіну в інертному розчиннику, особливо Також зрозуміло, що певні кристалічні сполуки ацетоні, та виділення продукту. Особливо за даним винаходом можуть існувати у формі використовується еквівалент трет-бутиламіну. сольвату, наприклад, гідрату, також як у В іншому аспекті даний винахід забезпечує несольватованій формі. Зрозуміло, що даний сполуку, одержану за допомогою реакції (2S)-2винахід охоплює всі такі сольватовані та етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2несольватовані форми. оксоетокси} феніл)пропіонової кислоти та (1R,2S)Даний винахід також надає наступні втілення. 2-гідроксііндан-1-аміну в інертному розчиннику, Сіль (1R,2S)-2-гідроксііндан-1-аміну та (2S)-2особливо етилацетаті, та виділення продукту. етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2Особливо використовується еквівалент (1R,2S) -2оксоетокси}феніл)пропіонової кислоти, що гідроксііндан-1-аміну. характеризується діаграмою рентгенівської В іншому аспекті даний винахід забезпечує порошкової дифрактометрії, яка характеризується сполуку, одержану за допомогою реакції (2S)-2піками з d-величинами при 20,0, 11,0, 6,5, 4,41 етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2,4,04 та 3,90. оксоетокси}феніл)пропіонової кислоти та (1R,2S)Сіль (1R,2S)-2-гідроксііндан-1-аміну та (2S)-22-гідроксііндан-1-аміну в інертному розчиннику, етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2особливо етилацетаті або ізопропілацетаті, та оксоетокси} феніл)пропіонової кислоти, що має виділення продукту. Особливо використовується діаграму XRPD по суті як показано на Фіг.А. еквівалент (1R,2S)-2-гідроксііндан-1-аміну. Сіль L-аргініну та (2S)-2-етокси-3-(4-{2В іншому аспекті даний винахід забезпечує [гексил(2-фенілетил)аміно]-2сполуку, одержану за допомогою реакції (2S)-2оксоетокси}феніл)пропіонової кислоти, що має етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2діаграму XRPD по суті як показано на Фіг.В. оксоетокси}феніл)пропіонової кислоти та L-аргініну Сіль трет-бутиламіну та (2S)-2-етокси-3-(4-{2в інертному розчиннику, особливо етанолі або [гексил(2-фенілетил)аміно]-2-оксоетокси} феніл 9 81807 10 пропан-2-олі та виділення продукту. Особливо щільних часток ліпопротеінів низької густини (LDL), використовується еквівалент L-аргініну. фенотипом В. В іншому аспекті даний винахід забезпечує Чекають, що сполуки за даним винаходом сполуку, одержану за допомогою реакції (2S)-2корисні при лікуванні пацієнтів на комбіновану або етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2змішану гіперліпідемію, або на різні ступені оксоетокси}феніл)пропіонової кислоти та холіну в гіпертригліцеридемії та постпрандіальної інертному розчиннику та виділення продукту. дисліпедемії з або без іншими проявами Особливо використовується еквівалент холіну. метаболічного синдрому. Чекають, що лікування В іншому аспекті даний винахід забезпечує даними сполуками, приведе до зниження сполуку, одержану за допомогою реакції (2S)-2захворювань серцево-судинної системи та етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2смертності, які пов'язані з атеросклерозом завдяки оксоетокси}феніл)пропіонової кислоти та їх антидисліпедемічним заодно і їх антизбудливим тріс(гідроксиметил)метиламіну та виділення властивостям. Серцево-судинні хворобливі стани продукту. Особливо використовується еквівалент включають макроангіопатії різних внутрішніх тріс(гідроксиметил)метиламіну. органів, викликаючи інфаркт міокарду, застійну Вираз "інертний розчинник" відноситься до серцеву недостатність, церебрально-васкулярну розчинника, який не реагує з вихідною речовиною, хворобу та периферійну артеріальна реагентами, інтермедіатами або продуктами до недостатність нижніх кінцівок. Також чекають, що, деякої міри що несприятливо впливає на вихід внаслідок їх інсулін сенсибілізуючого ефекту, бажаного продукту. сполуки формули І будуть попереджувати або Сполуки за винаходом звичайно уводять затримувати розвиток діабету типу 2 з перорально, парентерально, внутрішньовенно, метаболічного синдрому та діабету при вагітності. внутрішньом'язово, підшкірно або іншими шляхами Таким чином, чекають, що розвиток тривалих придатними для ін'єкцій, через рот, ректально, ускладнень, пов'язаних з хронічною гіперглікемією вагінально, трансдермально та/або через носовий при цукровому діабеті, таких як мікро-ангіопатії, які шлях та/або інгаляцією, у формі фармацевтичних викликають хвороби нирок, пошкодження сітківки препаратів у фармацевтично прийнятній дозованій та хворобу периферійних судин нижніх кінцівок, форм. В залежності від захворювання та пацієнта, буде затриманий. До того ж сполуки можуть бути який лікується, та шляху уведення, композиції корисні при лікуванні різних станів за межами можна уводити в дозах, які змінюються. серцево-судинної системи, так чи інакше Прийнятні щоденні дози сполуки за пов'язаних з резистентністю до інсуліну, подібних винаходом, при терапевтичному лікуванні людини, полікістозному синдрому яєчників, ожирінню, раку складають близько 0,0001-100мг/кг ваги тіла, та станам запальної хвороби, включаючи переважно 0,001-10мг/кг ваги тіла. нейродегенеративні розлади, такі як помірне З пероральних композицій надають перевагу когнітивне погіршення, хворобу Альцгеймера, особливо таблеткам або капсулам, які готують хворобу Паркінсона та розсіяний склероз. способами, які відомі кваліфікованому фахівцю з Чекають, що сполуки за даним винаходом рівня техніки, щоб забезпечити дози активної корисні в регулюванні рівня глюкози у пацієнтів, сполуки в межах від 0,5мг до 500мг, наприклад, що страждають від діабету типу 2. 1мг, 3мг, 5мг, 10мг, 25мг, 50мг,100мг та 250мг. Даний винахід забезпечує спосіб лікування Згідно подальшого аспекту винаходу або попередження дисліпедемії, синдрому надається фармацевтична композиція, що містить резистентності до інсуліну та/або метаболічних сполуку винаходу у суміші з фармацевтично розладів (як визначалося вище), при якому прийнятними ад'ювантами, розріджувачами та/або вводять сполуки за даним винаходом ссавцю носіями. (особливо людині), який потребує цього. Дані сполуки формули (І) корисні для Даний винахід забезпечує спосіб лікування профілактики та/або лікування клінічних станів, або попередження діабету типу 2, при якому пов'язаних зі вродженим або викликаним вводять ефективну кількість сполуки за даним зниженою чутливістю до інсуліну (резистентність винаходом ссавцю (особливо людині), який до інсуліну) та пов'язаних метаболічних розладів потребує цього. (також відомих як метаболічний синдром). Ці В подальшому аспекті даний винахід клінічні стани включають, але не обмежуються, забезпечує використання сполуки за даним загальне ожиріння, абдомінальне ожиріння, винаходом як ліків. артеріальну гіпертензію, гіперінсулінемію, В подальшому аспекті даний винахід гіперглікемію, діабет типу 2 та дисліпідемію, для забезпечує використання сполуки за даним яких характерна поява резистентністі до інсуліну. винаходом у виробництві ліків для лікування Ця дисліпідемія, також відома як атерогений резистентності до інсуліну та/або метаболічних ліпопротеїновий профіль, який відрізняється розладів. помірним підвищенням неетерифікованих жирних Сполуки за винаходом можна комбінувати з кислот, підвищенням ліпопротеїну дуже низької іншим терапевтичним агентом, який є корисним густини (VLDL), частками, збагаченими при лікуванні захворювань, пов'язаних з розвитком тригліцеридами, високими рівнями Аро В, та прогресом атеросклерозу, як наприклад, низькими рівнями ліпопротеінів високої густини гіпертензія, гіперліпідемія, дисліпідемія, діабет та (HDL), пов'язаними з низькими рівнями часток аро ожиріння. Сполуки за винаходом можна AI та високими рівнями Аро В в присутності малих, комбінувати з іншим терапевтичним агентом, який зменшує співвідношення LDL:HDL або з агентом, 11 81807 12 який викликає зменшення в циркулюючих рівнях глібенкламід (глібурид). Більш переважна LDL-холестерину. В хворих на цукровий діабету сульфонілсечовина - це глімепірид. Даний винахід сполуку винаходу можна також комбінувати з включає введення сполуки за даним винаходом в терапевтичними агентами, що використовуються, сполученні з одним, двома або більше існуючими у для лікування ускладнень, пов'язаних з терапії сполуками, які описані в цьому мікроангіопатією. Комбінаціїному розділі. Дози інших, існуючих у Сполуку за винаходом можна використовувати терапії, сполук для лікування діабету типу 2 та разом з іншими способами лікування розладу пов'язаних з ним ускладнень відомі з рівня техніки метаболічнго синдрому або діабету типу 2 та з ним та схвалені для використання регулюючим пов'язаними ускладненнями, це включає органом, наприклад FDA, та можуть бути знайдені бігуанідові ліки, наприклад, метформін, в Orange Book, опублікованій FDA. Альтернативні фенетилбігуанід та буформін, інсулін (синтетичні менші дози можуть використовуватися в аналоги інсуліну, амілін) та пероральні результаті переваг, отриманих від комбінації. антигіперглікемічні ліки (ці діляться на прандіальні Даний винахід також включає сполуку за даним регулятори глюкози та інгібітори альфавинаходом в комбінації з холестерин-знижуючим глюкозідази). Приклад інгібіторів альфаагентом. Холестерин-знижуючі агенти, які вказані в глюкозідази - це акарбоза або воглибоз, або цій заявці, включають, але не обмежуються, миглитол. Приклад прандіального регулятора інгібітори HMG-CoA редуктази (3-гідрокси-3глюкози - це репаглінід або натеглінід. метилглютарил коензим редуктази). Прийнятний В іншому аспекті винаходу сполуку формули І інгібітор HMG-CoA редуктази - це статин, який або її фармацевтично прийнятну сіль можна вибирають з групи, що складається з вводити разом з PPAR модулюючим агентом. аторвастатину, бервастатину, церивастатину, PPAR модулюючий агент включає, але не далвастатину, флувастатину, ітавастатину, обмежується, PPAR альфа та/або гамма, та/або ловастатину, мевастатину, нікостатину, дельта агоністи, або їх фармацевтично прийнятні нівастатину, правастатину та сімвастатину, або їх солі, сольвати, сольвати таких солей або проліки. фармацевтично прийнятної солі, особливо солі Прийнятні PPAR альфа та/або гамма агоністи, або натрію або кальцію, або сольвату, або сольвату їх фармацевтично прийнятні солі, сольвати, такої солі. Специфічний статин - це аторвастатин, сольвати таких солей або проліки добре відомі з або його фармацевтично прийнятна сіль, сольват, рівня техніки. Вони включають сполуки, розкриті в сольват такої солі або проліки. Більш специфічний WO 01/12187, WO 01/12612, WO 99/62870, WO статин – це сіль кальцію аторвастатину. 99/62872, WO 99/62871, WO 98/57941, WO Переважний специфічний статин - це сполука з 01/40170, WO 04/000790, WO 04/000295, WO хімічною назвою (Е)-7-[4-(4-фторфеніл)-604/000294, WO 03/051822, WO 03/051821, WO ізопропіл-2-[метил(метилсульфоніл)-амін]02/096863, WO 03/051826, WO 02/085844, WO піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енова 01/040172, J Med Chem, 1996, 39, 665, Expert кислота, [також відома як (Е)-7-[4-(4-фторфеніл)-6Opinion on Therapeutic Patents, 10 (5), 623-634 ізопропіл-2-[N-метил-N-(метилсульфоніл)(зокрема сполуки, розкриті в заявках на патент в аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6списку на сторінці 634) та J Med Chem, 2000, 43, енова кислота] або її фармацевтично прийнятна 527, які включені в дану заявку в повному обсязі за сіль або сольват, або сольват такої солі. Сполука допомогою посилання. Особливо PPAR альфа (Е)-7-[4-(4-фторфеніл)-6-ізопропіл-2-[метилта/або гамма, та/або дельта агоністи відносяться (метилсульфоніл)-аміно]-піримідин-5-іл](3R,5S)до мураглітазару (BMS 298585), рівоглітазону (CS3,5-дигідроксигепт-6-енова кислота та її солі 011), нетолітазону (МСС-555), балаглітазону (DRFкальцію, та натрію розкриті в Європейській Заявці 2593, NN-2344), клофібрату, фенофібрату, на Патент, Publication No. ЕР-А-0521471, та в безафібрату, гемфіброзилу ципрофібрату, Bioorganic and Medicinal Chemistry, (1997), 5(2), піоглітазону, росиглітазону, AVE-0847, AVE-8134, 437-444. Цей останній статин зараз відомий під CLX-0921, DRF-10945, DRF-4832, LY-518674, LYзагальною назвою росувастатин. 818, LY-929, 641597, GW-590735, GW-677954, GWВ цій заявці, термін "холестерин-знижуючий 501516, МВХ-102, ONO-5129, KRP-101, R-483 агент" також включає хімічні модифікації інгібіторів (BM131258), ТАК-559 або ТАК-654. Особливо HMG-CoA редуктази, як наприклад, ефіри, проліки PPAR альфа та/або гамма, та/або дельта агоністи та метаболіти, чи активні або інертні. відносяться до тесаглітазару ((S)-2-етокси-3-[4-(2Даний винахід також включає сполуку за {4-метансульфоніл-оксифеніл} даним винаходом в комбінації з секвестрантом етокси)феніл]пропіонової кислоти) та її жовчної кислоти, наприклад, холестипол або фармацевтично прийнятних солей. холестирамін, або холестагел. Крім того сполука за винаходом може Даний винахід також включає сполуку за використовуватися в сполученні з даним винаходом в комбінації із інгібітором сульфонілсечовиною, наприклад: глімепірид, жовчної кислоти підклубової транспортної системи глібенкламід (глібурид), гліклазид, гліпізид, (інгібітор IB AT ). глікуідон, хлорпропамід, толбутамід, Прийнятні сполуки, що мають ІВАТ інгібуючу ацетогексамід, глікопірамід, карбутамід, активність, були описані, дивись, наприклад, глібонурид, глісоксепід, глібутіазол, глібузол, сполуки, що описані в WO 93/16055, WO 94/18183, глігексамід, глімідін, гліпінамід, фенбутамід, WO 94/18184, WO 96/05188, WO 96/08484, WO толциламід та толазамід. Кращі з 96/16051, WO 97/33882, WO 98/07449, WO сульфонілсечовин це глімепірид або 98/03818, WO 98/38182, WO 99/32478, WO 13 81807 14 99/35135, WO 98/40375, WO 99/35153, WO 1,1-діоксо-3,3-дібутил-5-феніл-7-метилтіо-8-(N99/64409, WO 99/64410, WO 00/01687, WO {(R)-a-[N'-(2-карбоксіетил)карбамоїл]-400/47568, WO 00/61568, WO 00/62810, WO гідроксибензил}карбамоїлметокси)-2,3,4,501/68906, DE 19825804, WO 00/38725, WO тетрагідро-1,5-бензотіазепін; 00/38726, WO 00/38727, WO 00/38728, WO 1,1-дioкco-3-бyтил-3-eтил-5-фeнiл-7-мeтилтio00/38729, WO 01/68906, WO 01/66533, WO 8-(N-{(R)-a-[N'-(502/32428, WO 02/50051, EP 864582, карбоксипентил)карбамоїл]бензил}карбамоїлметок EP489423,EP549967, EP573848, EP624593, си)-2,3,4,5-тетрагідро-1,5-бензотіазепін; EP624594, EP624595 та EP624596, та зміст цих 1,1-дioкco-3,3-дибyтил-5-фeнiл-7-мeтилтio-8заявок на патент включений в дану заявку за (N-{(R)-a-[N'-(2допомогою посилання. Наступні прийнятні карбоксіетил)карбамоїл]бензил}карбамоїлметокси) сполуки, що мають IBАТ інгібуючу активність, були -2,3,4,5-тетрагідро-1,5-бензотіазепін; розкриті в WO 94/24087, WO 98/56757, WO 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-800/20392, WO 00/20393, WO 00/20410, WO (N-{a-[N'-(2-сульфоетил)карбамоїл]-200/20437, WO 01/34570, WO 00/35889, WO фторбензил}карбамоїлметокси)-2,3,4,5-тетрагідро01/68637, WO 02/08211, WO 03/020710, WO 1,5-бензотіазепін; 03/022825, WO 03/022830, WO 03/022286, WO 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо03/091232, WO 03/106482, JP 10072371, US 8-(N-{(R)-a-[N'-(R)-(2-гідрокси-15070103, EP 251 315, EP 417 725, EP 869 121, EP карбоксіетил)карбамоїл]бензил}карбамоїлметокси) 1 070 703 та ЕР 597 107, та зміст цих заявок на -2,3,4,5-тетрагідро-1,5-бензотіазепін; патент включений в дану заявку за допомогою 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8посилання. (N-{(R)-a-[N'-(R)-(2-гідрокси-1Специфічні класи інгібіторів ІВАТ, придатні для карбоксіетил)карбамоїл]бензил}карбамоїлметокси) використання в даному винаході, - це бензотієпіни, -2,3,4,5-тетрагідро-1,5-бензотіазепін; та сполуки, розкриті у формулах, особливо в пункті 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-81, WO 00/01687, WO 96/08484 та WO 97/33882, які {N-[(R)-a-(N'-{(R)-1-[N'-(R)-(2-гідрокси-1 включені в дану заявку за допомогою посилання. карбоксіетил)карбамоїл]-2Інші прийнятні класи інгібіторів ІВАТ - це 1,2гідроксіетил}карбамоїл)бензил]карбамоїлмето бензотіазепіни, 1,4-бензотіазепіни та 1,5кси}-2,3,4,5-тетрагідро-1,5-бензотіазепін; бензотіазепіни. Наступний прийнятний клас 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіоінгібіторів ІВАТ - це 1,2,5-бензотіадіазепіни. 8-(N-{a-[N'Одна специфічно прийнятна сполука, що має (карбоксиметил)карбамоїл]бензил}карбамоїлметок ІВАТ інгібуючу активність (3R,5R)-3-бутил-3-етилси)-2,3,4,5-тетрагідро-1,5-бензотіазепін; 1,1-діоксид-5-феніл-2,3,4,5-тетрагідро-1,41,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіобензотіазепін-8-іл-b-D-глюкопіранозидуронова 8-(N-{a-[Ν'-((етокси)(метил)фосфорилкислота (ЕР 864 582). Інші прийнятні ІВАТ метил)карбамоїл] бензил} карбамоїлметокси)інгібітори включають одну з наступних сполук: 2,3,4,5-тетрагідро-1,5-бензотіазепін; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-81,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо(N-{(R)-1'-феніл-1'-[N'8-{Ν-[(R)-a-(N'-{2-[(гідрокси) (метил)фософорил] (карбоксиметил)карбамоїл]метил}карбамоїлметокс етил } карбамоїл)бензил] карбамоїлметокси } и)-2,3,4,5-тетрагідро-1,5-бензотіазепін; 2,3,4,5-тетрагідро-1,5-бензотіазепін; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-81,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8(N-{(R)-a-[N'-(карбоксиметил)карбамоїл]-4(N-{(R)-a-[N'-(2-метилтіо-1-карбоксіетил)карбамоїл] гідроксибензил}карбамоїлметокси)-2,3,4,5бензил} карбамоїлметокси)-2,3,4,5-тетрагідро-1,5тетрагідро-1,5-бензотіазепін; бензотіазепін; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-81,1-дioкco-3,3-дибyтил-5-фeнiл-7-мeтилтio-8(N-{(R)-1'-феніл-1'-[N'-(2{N-[(R)-a-(N'-{2сульфоетил)карбамоїл]метил}карбамоїлметокси)[(метил)(етил)фосфорил]етил}карбамоїл)-42,3,4,5-тетрагідро-1,5-бензотіазепін; гідроксибензил]карбамоїлметокси}-2,3,4,51,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіотетрагідро-1,5-бензотіазепін; 8-(N-{(R)-1'-феніл-1'-[N'-(21,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8сульфоетил)карбамоїл]метил}карбамоїлметокси){N-[(R)-a-(N'-{2-[(метил)(гідрокси)фосфорил] етил} 2,3,4,5-тетрагідро-1,5-бензотіазепін; карбамоїл)-4-гідроксибензил] карбамоїлметокси} 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-82,3,4,5-тетрагідро-1,5-бензотіазепін; (N-{(R)-a-[N'-(2-сульфоетил)карбамоїл]-41,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8гідроксибензил}карбамоїлметокси)-2,3,4,5(N-{(R)-a-[(R)-N'-(2-метилсульфініл-1 тетрагідро-1,5-бензотіазепін; карбоксіетил)карбамоїл]бензил}карбамоїлметокси) 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-2,3,4,5-тетрагідро-1,5-бензотіазепін; 8-(N-{(R)-a-[N'-(2-сульфоетил)карбамоїл]-41,1-діоксо-3,3-дибутил-5-феніл-7-метокси-8-[Nгідроксибензил}карбамоїлметокси)-2,3,4,5{(R)-a-[N'-(2-сульфоетил)карбамоїл] -4тетрагідро-1,5-бензотіазепін; гідроксибензил } карбамоїлметокси] -2,3,4,5 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіотетрагідро-1,5-бензотіазепін; 8-(N-{(R)-a-[N'-21,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8карбоксіетил)карбамоїл]бензил}карбамоїлметокси) (N-{(R)-a-[N-((R)-1-карбокси-2-метилтіо-2,3,4,5-тетрагідро-1,5-бензотіазепін; етил)карбамоїл]-4 15 81807 16 пентагідроксигексил)карбамоїл]бензил}карбамоїлм гідроксибензил}карбамоїлметокси)-2,3,4,5етокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін; тетрагідро-1,2,5-бензотіадіазепін; або їх фармацевтично прийнятна сіль, 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8сольват, сольват такої солі або проліки. (К-{(К)a-[N-((8)-1-карбокси-2-(К)Додатково, згідно подальшого аспекту даного гідроксипропіл)карбамоїл]-4винаходу забезпечують комбінаційне лікування, гідроксибензил}карбамоїлметокси)-2,3,4,5при якому вводять ефективну кількість сполуки за тетрагідро-1,2,5-бензотіадіазепін; даним винаходом формули А, необов'язково 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8разом з фармацевтично прийнятним (N-{(R)-a-[N-((S)-1-карбокси-2розріджувачем або носієм, з одночасним, метилпропіл)карбамоїл]-4послідовним або роздільним введенням одного гідроксибензил}карбамоїлметокси)-2,3,4,5або більше наступних агентів, вибраних з: тетрагідро-1,2,5-бензотіадіазепін; інгібітору СЕТР (транспортній протеїн 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8холестирилового ефіру), наприклад, на нього є (N-{(R)-a-[N-((S)-1-карбоксибутил)карбамоїл]-4посилання та описаний він в WO 00/38725 сторінка гідроксибензил}карбамоїлметокси)-2,3,4,57, лінія 22 - сторінка 10, лінія 17, яка включена в тетрагідро- 1,2,5-бензотіадіазепін; дану заявку за допомогою посилання; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8антагоністу абсорбції холестерину, наприклад, (N-{(R)-a-[N-((S)-1-карбоксипропіл) азетидинони, такий як SCH 58235, та він описаний карбамоїл]бензил}карбамоїлметокси)-2,3,4,5в US 5,767,115, який включений в дану заявку за тетрагідро-1,2,5-бензотіадіазепін; допомогою посилання; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8інгібітору МТР (мікросомальний транспортній (N-{(R)-a-[N-((S)-1протеїн), наприклад, описаний в Science, 282, 751 карбоксіетил)карбамоїл]бензил}карбамоїлметокси) -54, 1998, який включений в дану заявку за -2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін; допомогою посилання; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8похідних нікотинової кислоти, включаючи (N-{(R)-a-[N-((S)-1-каpбoкcи-2-(R)повільно вивільнені та комбінаційні продукти, гiдpoкcипpoпiл)каpбамoїл]бeнзил}каpбамoїлмeтoкc наприклад, нікотинова кислота (ніацин), аципімокс и)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін; та ніцеритрол; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8сполук фітостерину, наприклад етаноли; (N-{(R)-a-[N-(2-сульфоетил)карбамоїл]-4пробуколу; гідроксибензил}карбамоїлметокси)-2,3,4,5жирних кислот омега-3, наприклад, Omacor™; тетрагідро-1,2,5-бензотіадіазепін; сполук проти ожиріння, наприклад, орлістат 1,1-діоксо-3,3-дибутил-5-феніл-метилтіо-(N'(ЕР 129,748) та сібутраміну (GB 2,184,122 та США {(R)-a-[N-((S)-1-карбоксіетил)карбамоїл]-44,929,629); гідроксибензил}карбамоїлметокси)-2,3,4,5протигіпертонічних сполук, наприклад, тетрагідро-1,2,5-бензотіадіазепін; ангіотензин-перетворюючий фермент (АСЕ); 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8інгібітору, антагоністу рецептора ангіотензин II, (N-(R)-a-[N-((R)-1-карбокси-2адреноблокатору, альфа-адреноблокатору, бетаметилтіоетил)карбамоїл]бензил}карбамоїлметокси адреноблокатору, наприклад, метопролол, суміші )-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін; альфа/бета адреноблокаторів, адреностимулятор, 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8блокатору кальцієва каналу, АТ-1 блокатору, (N-{(R)-a-[Ν-((S)-1-[N-((S)-2-гідрокси-1салуретик, діуретик або вазоділататор; карбоксіетил)карбамоїл] пропіл } карбамоїл] антагоністу СВ1 або зворотного агоністу, бензил} карбамоїлметокси)-2,3,4,5-тетрагідронаприклад, як описано в WO 01/70700 та ЕР 1,2,5-бензотіадіазепін; 65635; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8аспірину; (N-{(R)-a-[N-((S)-1-карбокси-2антагоністу меланінконцентруючого гормону метилпропіл)карбамоїл]бензил}карбамоїлметокси) (МСН); -2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін; інгібітору PDK; або 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8модуляторів ядернихрецепторів, наприклад (N-{(R)-a-[N-((S)-1-карбоксипропіл)карбамоїл]-4LXR, FXR, RXR, та RORальфа; гідроксибензил}карбамоїлметокси)-2,3,4,5або їх фармацевтично прийнятних солей, тетрагідро-1,2,5-бензотіадіазепін; сольватів, сольватів такої солі або проліків, 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8необов'язково разом з фармацевтично [N[-((R/S)-a-{N-[1-(R)-2-(S)-1-гідрокси-1-(3,4прийнятним розріджувачем або носієм, дигідроксифеніл)проп-2-іл]карбамоїл}-4теплокровній тварині, як наприклад, людина, яка гідроксибензил)карбамоїлметокси]-2,3,4,5потребує такого терапевтичного лікування. тетрагідро-1,2,5-бензотіадіазепін; Специфічні інгібітори АСЕ або їх 1,1-дioкco-3,3-дибyтил-5-фeнiл-7-мeтилтio-8фармацевтично прийнятні солі, сольвати, сольват (N-{(R)-a-[N-(2-(S)-3-(R)-4-(R)-5-(R)-2,3,4,5,6таких солей або проліки, включаючи активні пeнтaгiдpoкcигeкcил)кapбaмoїл]-4метаболіти, які можна використовувати в гідроксибензил}карбамоїлметокси)-2,3,4,5комбінації зі сполуками за винаходом, включають, тетрагідро-1,2,5-бензотіадіазепін; та але не обмежуються, наступні сполуки: 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8алацеприл, алатриоприл, кальцій алтіоприл, (N-{(R)-a-[N-(2-(S)-3-(R)-4-(R)-5-(R)-2,3,4,5,6анковенин, беназеприл, гідрохлорид беназеприлу, 17 81807 18 беназеприлат, бензоїлкаптоприл, каптоприл, прийнятну сіль, сольват, сольват такої солі або каптоприл-цистеїн, каптоприл-глутатіон, проліки, разом з фармацевтично прийнятним церанаприл, цераноприл, церонаприл, розріджувачем або носієм. цилазаприл, цилазаприлат, делаприл, делаприлЗгідно подальшого аспекту даного винаходу двокислий, еналаприл, еналаприлат, енаприл, забезпечують набір, який містить сполуку за даним епікаптоприл, фороксимітин, фостеноприл, винаходом та одну сполуку з решти сполук, фозеноприл, натрій фозеноприл, фозіноприл, описаних в цьому Комбінаційному розділі, або її натрій фозіноприл, фозіноприлат, фозіноприлова фармацевтично прийнятну сіль, сольват, сольват кислота, глюкоприл, геморфін-4, ідраприл, такої солі або проліки. імідаприл, індолаприл, індолаприлат, лібензаприл, Згідно подальшому аспекту даного винаходу лізіноприл, ліциумін, ліциумін В, міксанприл, забезпечують набір, який містить: моексиприл, моексиприлат, мовелтиприл, a) сполуку за даним винаходом в першій мурацеін, мурацеін В, мурацеін С, пентоприл, одиничній дозованій формі; періндоприл, періндоприлат, півалоприл, півоприл, b) одну з решти сполук, описаних в цьому квинаприл, квинаприл гідрохлорид, квинаприлат, Комбінаційному розділі, або її фармацевтично раміприл, раміприлат, спіраприл; спіраприл прийнятну сіль, сольват, сольват такої солі або гідрохлорид, спіраприлат, спіроприл, спіроприл проліки в другій одиничній дозованій формі; та гідрохлорид, темокаприл, темокаприл гідрохлорид, c) контейнерні засоби для вмісту зазначених тепротид, трандолаприл, трандолаприлат, першої та другої дозованих форм. утибаприл, забіциприл, забіциприлат, зофеноприл Згідно подальшого аспекту даного винаходу та зофеноприлат. Переважні інгібітори АСЕ для забезпечують набір, який містить: використання в даному винаході - це раміприл, a) сполуку за даним винаходом разом з раміприлат, лізіноприл, еналаприл та фармацевтично прийнятним розріджувачем або еналаприлат. Більш переважні інгібітори АСЕ для носієм в першій одиничній дозованій формі; використання в даному винаході - це раміприл та b) одну з решти сполук, описаних в цьому раміприлат. Комбінаційному розділі, або її фармацевтично Переважні антагоністи ангіотензину, їх прийнятну сіль, сольват, сольват такої солі або фармацевтично прийнятні солі, сольвати, проліки в другій одиничній дозованій формі; та сольвати таких солей або проліки для c) контейнерні засоби для вмісту зазначених використання в комбінації зі сполуками за першої та другої дозованих форм. винаходом включають, але не обмежуються, Згідно іншій особливості винаходу сполуки: кандесартан, кандесартан цилексетил, забезпечують використання сполуки за даним лосартан, валсартан, ірбесартан, тазосартан, винаходом та однієї сполуки з решти сполук, телмісартан та епросартан. Особливо переважні описаних в цьому Комбінаційному розділі, або її антагоністи ангіотензину II або їх фармацевтично фармацевтично прийнятної солі, сольвату, прийнятні похідні для використання в даному сольвату такої солі або проліків, у виготовленні винаході - це кандесартан та кандесартан ліків для використання при лікуванні цилексетил. метаболічного синдрому або діабету типу 2 та Таким чином додатковою ознакою винаходу є пов'язаних з ним ускладнень, у теплокровної забезпечення способу лікування діабету типу 2 та тварини, як наприклад, людини. пов'язаних з ним ускладнень у теплокровної Згідно іншій особливості винаходу тварини, як наприклад, людини, яка потребує забезпечують використання сполуки за даним такого лікування, при якому здійснюють введення винаходом та однієї сполуки з решти сполук, вказаній тварині ефективної кількості сполуки за описаних в цьому Комбінаційному розділі, або її даним винаходом з одночасним, послідовним або фармацевтично прийнятної солі, сольвату, роздільним введенням ефективної кількості однієї сольвату такої солі або проліків, у виготовленні сполуки з решти сполук, описаних в цьому ліків для використання при лікуванні Комбінаційному розділі, або її фармацевтично гіперліпідемічних станів у теплокровної тварини, як прийнятної солі, сольвату, сольвату такої солі або наприклад, людини. проліків. Згідно подальшого аспекту даного винаходу Таким чином додатковою ознакою винаходу є забезпечують комбінаційне лікування, при якому забезпечення способу лікування гіперлiпідемічних здійснюють введення ефективної кількості сполуки станів у теплокровної тварини, як наприклад, за даним винаходом необов'язково разом з людини, яка потребує такого лікування, при якому фармацевтично прийнятним розріджувачем або здійснюють введення вказаній тварині ефективної носієм, з одночасним, послідовним або роздільним кількості сполуки за даним винаходом з введенням ефективної кількості однієї сполуки з одночасним, послідовним або роздільним інших сполук, описаних в цьому Комбінаційному введенням з ефективною кількістю однієї сполуки розділі, або їх фармацевтично прийнятних солей, з решти сполук, описаних в цьому Комбінаційному сольватів, сольватів таких солей або проліків, розділі, або її фармацевтично прийнятної солі, необов'язково разом з фармацевтично сольвату, сольвату такої солі або проліків. прийнятним розріджувачем або носієм, Згідно подальшого аспекту винаходу теплокровній тварині, як наприклад, людина, яка забезпечують фармацевтичну композицію, яка потребує такого терапевтичного лікування. містить сполуку за даним винаходом та одну Експериментальна частина 1 Н ЯМР та 13С ЯМР дослідження виконували сполуку з решти сполук, описаних в цьому на спектрометрах Varian Mercury 300 або Varian Комбінаційному розділі, або її фармацевтично 19 81807 20 UNITY plus 400, 500 або 600, з робочими bs уширений синглет частотами 1Н 300, 400, 500 та 600Мгц, відповідно, Скорочення XRPD та з 13С частотами 75, 100, 125 та 150Мгц, XRPD рентгенівська порошкова відповідно. Вимірювання робилися у масштабі дифрактометрія d-value відстань між сусідніми паралельними дельти (d). hkl площинами в кристалічній гратці Якщо не заявлено інше, хімічний зсув регеструють у ррm відносно розчинника, як внутрішньго стандарту. Метод рентгенівської порошкової дифрактометрія (XRPD) виконували, використовуючи змінні розрізи на зразках, приготовлених згідно стандартних методів з та/або TGA термогравіметричний аналіз без використання внутрішнього стандарту. DSC диференціальна скануюча калориметрія Стандартні методи є, наприклад, описаними в Приклади Giacovazzo, C. et al (1995), Fundamentals of Одержання вихідної речовини Crystallography, Oxford University Press; Jenkins, R. Спосіб 1 and Snyder, R.L. (1996), Introduction to X-Ray (2S)-2-Етокси-3-(4-(2-[гексил(2Powder Diffractometry, John Wiley & Sons, New фенілетил)аміно]-2-оксоетокси}феніл)пропіонова York; Bunn, С.W. (1948), Chemical Crystallography, кислота Clarendon Press, London; or Klur, H.P. & Alexander, (і) Етил (2S)-3-(4-[2-(бензилокси]-2L.E. (1974), X-ray Diffraction Procedures, John Wiley оксоетокси]феніл}-2-етоксипропіонат and Sons, New York. Аналізи рентгенівського До розчину етил (2S)-2-етокси-3-(4променя виконували, використовуючи Siemens гідроксифеніл)пропіонату (23,8г, 100 ммоль, D5000 дифрактометр або Philips X'Pert MPD. одержаного, як описано в WO99/62872) в Аналізи рентгенівського променя виконували, ацетонітрилі (200мл) додавали безводний використовуючи Cu-випромінювання Siemens карбонат калію (31,9г, 231ммоль), з наступним D5000 дифрактометр та Philips X'Pert MPD. На доданням бензил бромацетату (17,4мл, графіках наведених нижче вісь абсцис X - це 2110ммоль), та реакційну суміш кип'ятили зі тетта та вісь Υ - це інтенсивність. зворотним холодильником протягом ночі. Диференціальну скануючу калориметрію Реакційну суміш охолоджували до кімнатної (DSC) виконували, використовуючи прилади температури, відфільтровували нерозчинні солі та Mettler DSC820, Mettler DSC820E або Perkin Elmer розчин концентрували під вакуумом. Залишок DSC 7, згідно стандартним методам, наприклад, розчиняли в етилацетаті (300мл), та органічну описаним в Höhne, G.W. Η. et al (1996), Differential фаза промивали водним NaHCO3 (3´100мл) та Scanning Calorimetry, Springer, Berlin. ропою (100мл), висушували над безводним Метод Термогравіметрії (TGA) виконували, MgSO4, та концентрували під вакуумом. Очищення використовуючи прилади Mettler Toledo TGA850, на силікагелі з хлоридом метилену, як елюентом, Mettler Toledo TG851 або Perkin Eimer TGA 7. та збирання чистих фракцій давало 22,4г (58%) Для кваліфікованого фахівця в даній галузі жовтого масла. техніки є зрозумілим, що кристалічні форми сполук 1 Н ЯМР (400 Мгц, CDCl3): d 1,16 (t, 3Н), 1,22 (t, за винаходом можуть бути одержані по аналогії зі 3Н), 2,93 - 2,97 (m, 2Н), 3,35 (m, 1Н), 3,60 (m, 1H), способами, описаними в даній заявці та/або 3,97 (m, 1H), 4,16 (q, 2H), 4,64 (s, 2H), 5,23 (s, 2H), відповідно до Прикладів нижче, та можуть 6,82 (d, 2H), 7,15 (d, 2H), 7,32 - 7,39 (m,5H). показати по суті ті ж зразки дифракції XRPD та/або 13 C ЯМР (100 Мгц, CDCl3): d 14,3, 15,2, 38,6, DSC, та/або TGA термограми, як описано в даній 60,9, 65,6, 66,3, 67,0, 80,4, 114,6, 128,5, 128,6, заявці. В поняття "по суті ті ж" зразки дифракції 128,7, 130,6, 135,3, 156,7, 169,0, 172,6. XRPD та/або DSC, та/або TGA термограми, ми (ii) {4-[(2S)2,3-Діетокси-3включаємо ті випадки, коли це зрозуміло з оксопропіл]фенoкси}оцтова кислота релевантних зразків та/або термограм (у межах До розчину етилу (2S)-3-{4-[2-(бензилокси)-2експериментальної помилки), що по суті та ж оксоетокси]феніл}-2-етоксипропіонату (22,33г, 57,8 кристалічна форма була сформована. При умові, ммоль) в свіжо дистильованому THF (290мл) що температура на вході DSC може змінитися в додавали Pd/C (10%, 3,1г) та реакційну суміш межах ±5°С (наприклад, ±2°С), та значення гідрогенізували при атмосферному тиску при відстані у XRPD може змінитися в межах ±2 в кімнатній температурі протягом ночі. Суміш останньому знаку після коми. Для кваліфікованого відфільтровували через целіт та фільтрат фахівця в даній галузі техніки є зрозумілим, що випаровували під вакуумом з одержанням 16,6г інтенсивність XRPD може змінюватись, коли (97%) ясно-жовтого масла. виміряно для, по суті, той же кристалічній формі з 1 Н ЯМР (400 Мгц, CDCl3): d 1,15 (t, 3Н), 1,21 (t, ряду причин, наприклад, переважної орієнтації. 3Н), 2,93 - 2,98 (m, 2Н), 3,35 (m, 1Н), 3,60 (m, 1H), Скорочення 3,97 (m, 1H), 4,16 (q, 2H), 4,65 (s, 2H), 6,84 (d, 2H), Скорочення для ЯМР 7,17 (d, 2H), 8,48 (bs, 1H). t триплет 13 C ЯМР (100 Мгц, CDCl3): d 14,3, 15,1, 38,5, s синглет 61,0, 65,1, 66,4, 80,3, 114,6, 130,7, 130,9, 156,4, d дублет 172,7, 173,7. q квартет m мультиплет 21 81807 22 а) Фенетиламін (30,0г) обробили 6М водним (iii) Етил (2S)-2-етокси-3-(4-[2-[гексил(2гідрооксидом натрію (61,5мл) в толуолі (100мл). фенілетил)аміно]-2-оксоетокси} феніл) пропіонат. Додавали розчин хлорацетилхлориду (28,0г) в До розчину {4-[(2S)-2,3-діетокси-3толуолі (50мл) при контролюванні температури. оксопропіл]фенокси}оцтової кислоти (0,110г, 0,37 Після завершення реакції реакційну суспензію ммоль) у метиленхлориді (3,7мл) додавали Nнагрівали до повного розчинення, та водну фазу гексил-2-фенілетиламін (0,080г, 0,39 ммоль) та відділяли. Органічну фазу промивали водним DMAP (0,045г, 0,37ммоль), з наступним доданням хлороводнем та водою. гідрохлориду 1-етил-3-(3Одержану фазу толуолу випарювали та диметиламінопропіл)карбодііміду (0,071г, додавали діізопропіловий ефір. Розчин 0,37ммоль), та реакційну суміш перемішували при охолоджували та 1 -хлор-N-фенетилацетамід кімнатній температурі протягом ночі. Суміш (42,3г) відфільтровували, промивали та розбавляли метиленхлоридом (25мл), та органічну висушували. Продукт аналізували за допомогою фазу промивали 5% НСl (3´25мл), водним LC (99,8% чистоти) та ЯМР. NaНСО3 (25мл) та ропою (25мл), висушували над 1 Н ЯМР dΗ (400 Мгц, CDCl3): d 2,88 (t, 2H), 3,60 Na2SO4, та випаровували під вакуумом. (dd, 2H), 4,05 (s, 2H), 6,62 (bs, 1H), 7,19 -7,58 (m, Очищення, на заповненій силікагелем колоні 5H). (Isolute® SPE Колона, 5г Si/25мл), з метанолом (0b) Суміш карбонату калію (31,5г), 1-хлор-N1% градієнт) у метиленхлориді, як елюенті, давало фенетилацетаміду (15,0г), етил (2S)-2-етокси-3-(40,125г (70%) безбарвного масла. 1 гідроксифеніл)пропіонату (18,1г) (дивись WO H ЯМР (400 Мгц, CDCl3): d 0,82 - 0,92 (m, 3Н), 99/62871) та ацетонітрилу (150мл) перемішували 1,16 (t, 3Н), 1,19 -1,33 (m, 9H), 1,45 -1,65 (m, 2H), та доводили до кипіння зі зворотним 2,82 - 2,90 (m, 2H), 2,91 - 2,98 (m, 2H), 3,12 - 3,21 холодильником. Після завершення реакції суміш та 3,29 - 3,42 (2m, 3Н, ротамери) 3,50 - 3,65 (m, охолоджували та неорганічні солі 3Н), 3,95 (m,1Н), 4,16 (q, 2Н), 4,39 та 4,65 (2s, 2H, відфільтровували та промивали ацетонітрилом. ротамери), 6,75 and 6,86 (2d, 2H, ротамери), 7,10 Маточник, зменшували дистиляцією та продукт 7,34 (m, 7H). 13 кристалізували з етилацетату та гексану. Етил С ЯМР (100 Мгц, CDCl3): d 14,0, 14,1, 14,3, (2S)-2-етокси-3-(4-{2-оксо-2-[(215,1, 22,6, 26,5, 26,7, 27,4, 29,0, 31,5, 31,6, 33,9, фенілетил)аміно]етокси}феніл)пропіонат (24,5г) 35,3, 38,5, 45,9, 48,1, 48,3, 48,9, 60,8, 66,2, 67,5, відфільтровували, промивали та сушили. Продукт 80,4, 114,5, 126,4, 126,9, 128,5, 128,9, 130,1, 130,2, проаналізували за допомогою LC (98,6% чистоти) 130,5, 130,5, 138,3, 139,2, 156,9, 157,0, 167,6, та ЯМР. 167,8, 172,5 (число піків є більшим, ніж число 1 Н ЯМР dΗ (400 Мгц, CDCl3): 1,18 (t, 3Н), 1,26 вуглецевих атомів завдяки ротамерам). (t, 3Н), 2,86 (t, 2H), 2,96 - 3,01 (m, 2H), 3,37 (dq, (iv) (2S)-2-Етокси-3-(4-(2-[гексил(21H), 3,58 - 3,68 (m, 3H), 4,00 (dd, IH), 4,20 (q, 2H), фенілетил)аміно1-2-оксоетокси}феніл) пропіонової 4,47 (s, 2H), 6,65 (bs, 1H), 6,79 (dm, 2H), 7,14 - 7,36 кислоти (m, 7H). До розчину етил (2S)-2-етокси-3-(4-{2c) Розчин етил (2S)-2-eтокси-3-(4-{2-oкco-2-[(2[гексил(2-фенілетил)аміно]-2фенілетил)аміно]етокси}- феніл)пропіонату (36,0г) оксоетокси}феніл)пропіонату (0,081г, 0,17 ммоль) в THF (270мл) додавали до розчину гідрооксиду в THF (8,6мл) додавали 4,3мл розчину 0,10 Μ літію (6,51г), розчиненого у воді (360мл). Суміш LiOH, та реакційну суміш перемішували при перемішували при кімнатній температурі. Після кімнатній температурі протягом ночі. Реакційну завершення реакції, суміш випаровували під суміш підкисляли 2М НСl та екстрагували зниженим тиском, щоб видігнати THF. Після етилацетатом (3´25mL). Об'єднану органічну фазу випаровування, реакційну суміш охолоджували до промивали ропою (25мл), висушували над Na2SO4, кімнатної температури та підкислювали та випарювали під вакуумом, з одержанням 0,073г хлористоводневою кислотою. Підкислений продукт (96%) безбарвного масла. 1 екстрагували етилацетатом. Етилацетатний Н ЯМР (400 Мгц, CDCl3): d 0,82 - 0,93 (m, 3Н), розчин промивали водою та випаровували до 1,15 (t, 3Н), 1,20 - 1,35 (m, 6Н), 1,47 -1,62 (m, 2Н), зменшеного об'єму. Продукт кристалізували з 2,80 - 2,99 (m, 3Н), 3,00 - 3,09 (m, 1H), 3,11 - 3,21 етилацетату та діізопропілового ефіру. (2S)-2та 3,31 - 3,44 (2m, 3Н, ротамери), 3,50 - 3,67 (m, Eтокси-3-(4-{2-oкco-2-[(23Н), 4,01 (m, 1Н), 4,40 та 4,66 (2s, 2H, ротамери), фенілетил)аміно]етокси}феніл)пропіонову кислоту 6,75 та 6,85 (2d, 2Н, ротамери), 7,10 - 7,35 (т, 7Н), (28,0г) відфільтровували та промивали 8,86 (bs, 1H). 13 діізопропіловим ефіром та висушували під С ЯМР (100 Мгц, CDCl3): d 14,0, 14,1, 15,1, вакуумом. 22,6, 22,6, 26,6, 26,7, 27,3, 28,9, 31,5, 31,6, 33,8, 1 Н ЯМР dΗ (400 Мгц, CDCl3): 1,20 (t, 3Н), 2,85 35,2, 38,1, 46,1, 48,3, 48,4, 49,0, 66,7, 67,4, 79,9, (t, 2H), 3,00 (dd, 1H), 3,10 (dd, 1H), 3,46 (dq, 1H), 114,6, 126,4, 127,0, 128,6, 128,9, 130,0, 130,1, 3,56 - 3,71 (m, 3Н), 4,07 (dd, 1H), 4,45 (s, 2H), 6,68 130,6, 130,7, 138,2, 139,1, 156,9, 157,0, 168,1, (bs, 1H), 6,78 (dm, 2H), 7,10 - 7,38 (m, 7H). 168,2, 175,6 (число піків є більшим, ніж число d) Диметилсульфоксид (DMSO) (2750мл), вуглецевих атомів завдяки ротамерам). порошок гідрооксиду калію (244г) та (2S)-2-етоксиСпосіб 2 3-(4-{2-оксо-2-[(2-фенілетил)аміно]етокси}феніл) (2S)-2-Етокси-3-(4-{2-[гексил(2пропіонову кислоту (250г) перемішували при (Фенілетил)аміно]-2-оксоетокси}феніл)пропіонової приблизно 18°С протягом 20 хвилин. 1-Бромгексан кислоти (344г=292мл) додавали за 2,5 години. Реакційну 23 81807 24 (2S)-2-Eтокси-3-(4-{2-[гексил(2суміш перемішували приблизно 10 хвилин. фенілетил)аміно]-2-оксоетокси}феніл)пропіонова Додавали діізопропіловий ефір (1000мл) з кислота (1,00г) та (1R,2S)-(+)-cis-1-aаміно-2наступним фільтруванням, екстракцією та інданол (0,27г) розчиняли в ізопропілацетаті сепарацією суміші. Потім шар DMSO екстрагували (40мл) та перемішували при кімнатній температурі. діізопропіловим ефіром (2´1000мл). Шар DMSO Коли сіль осаджувалася, суспензію підкислювали 4M НСl(вод.) (950мл). відфільтровували та тверду фазу, промивали Діізопропіловий ефір (3000мл) та воду (2500мл) ізопропілацетатом (20мл) та сушили при додавали з наступною екстракцією. Шари були пониженому тиску, щоб одержати 0,97г сполуки, відокремлені (рН~2 вод. шару) та шар зазначеної у заголовку. діізопропілового ефіру промивали водою (2500мл). Приклад 4 Шар діізопропілового ефіру випаровували під Сіль L-аргініну та (2S)-2-етокси-3-(4-(2вакуумом до одержання чистого, дуже густого [гексил(2-фенілетил)аміно]-2-оксоетокси} масла. Вихід 317г, проба 88,1%, вірний вихід (феніл)пропіонової кислоти 91,1%, LC-чистота 97,2%, е.е. 97,8%. LC-чистота L-Аргінін (11,32g) розчиняли в 25мл та kiral LC відповідно до контрольного зразка. 1 дистильованої води при 60°С. Гарячий прозорий Н ЯМР dH(400Mгц,CDCl3): 0,75 - 0,85 (m, 3Н), розчин L-аргініну у воді додавали при 1,10 (t, 3Н), 1,14-1,29 (m, 6Н), 1,40 -1,55 (m, 2Н), перемішуванні до розчину (2S)-2-етокси-3-(4-{22,76 - 2,93 (m, 3Н), 2,97 - 3,06 (m, 1H), 3,06 - 3,14 [гексил(2-фенілетил)аміно]-2та 3,28 - 3,43 (2m, 3Н, ротамери), 3,45 - 3,58 (m, оксоетокси}феніл)пропіонової кислоти (33г) в 23Н), 3,98 (m, 1H), 4,32 та 4,59 (2s, 2Н, ротамери), пропанолі (150мл). Одержаний розчин 6,68 and 6,80 (2dm, 2Н, ротамери), 7,02 - 7,31 (m, випаровували до масла, яке осаджували за 8Н). допомогою додавання 150мл ізопропілацетату при Приклад 1 перемішуванні. Аморфну сіль відфільтровували та Сіль (1R,2S)-2-гідроксііндан-1-аміну та (2S)-2сушили під вакуумом при 40°С. Вихід 36г. етокси-3-(4-(2-[гексил(2-фенілетил)аміно]-2Невелику кількість речовини розчиняли в гарячому оксоетокси)феніл)пропіонової кислоти бутилацетаті та повторно висаджували за (2S)-2-Етокси-3-(4-{2-[гексил(2-фенілетил)допомогою циклогексану. Цю речовину сушили під аміно]-2-оксоетокси}феніл)пропіонової кислоту вакуумом при 40°С та використовували для (1,51г) розчинили в етилацетаті (15мл/г) при аналізу ЯМР. кімнатній температурі. Потім до розчину додали 1 Н -ЯМР (400 Мгц, MeOD): (1R,2S)-(+)-cis-аміно-2-інданол (1 моль 7,2 (7Н, m), 6,9 (1H,d), 6,7 (1Н, d), 4,7 (1Н, s), еквівалент), з наступним доданням затравки. 4,4 (1H,s), 3,8 (1Н, m), 3,6 (4H, m), 3,4 (1H, t), 3,2 Суспензію перемішували при кімнатній (4H, m), 2,9 (4H, m), 1,9 (2H, m), 1,7 (2H, m), 1,6 температурі, та відфільтровували продукт (1,89г), (2H, br m), 1,3 (6H, br s), 1,1 (3H, t), 0,9 (3H, t) щоб одержати сполуку, зазначену у заголовку, яка Приклад 5 була підтверджена за допомогою методу XRPD та Сіль L-аргініну та (2S)-2-етокси-3-(4-(2ЯМР. 1 [гексил(2-фенілетил)аміно]-2Н -ЯМР (400 Мгц, CDCl3): оксоетокси)феніл)пропіонової кислоти 7,5 (1Н, d), 7,4 - 7,1 (10Н, m), 6,8 (1Н, d), 6,6 (2S)-2-Етокси-3-(4-{2-[гексил(2(1Н, d), 6,4 (4Н, br s), 4,6 (2Н, m), 4,4 (2Н, m), 3,9 фенілетил)аміно]-2-оксоетокси}феніл)пропіонову (1Н, m), 3,5 (3Н, m), 3,4 - 3,2 (2Н, m), 3,2 - 3,0 (3Н, кислоту (0,197г) розчиняли в 95% етанолі та m), 2,9 (4Н, m), 1,5 (2Н, br m), 1,3 (6Н, br s), 1,1 додавали L-аргінін (1 моль еквівалент) до розчину. (3Н, m), 0,9 (3Н, m). Розчин перемішували при температурі Приклад 2 навколишнього середовища, з наступним (1R, 2S)-2-Гідроксііндан-1-амін (2S)-2-етокси-3випаровуванням досуха та доданням ізооктану (4-(2-[гексил(2-фенілетил)аміно]-2-оксоетокси} (10мл/г). Суспензію перемішували при кімнатній феніл)пропіонової кислоти температурі, та продукт відфільтровували та (2S)-2-Етокси-3-(4-{2-[гексил(2аналізували за допомогою методу XRPD. фенілетил)аміно]-2-оксоетокси}феніл)пропіонова Приклад 6 кислота (109мг) та (1R,2S)-(+)-cis-1-аміно-2Сіль трет-бутиламіну та (2S)-2-етокси-3-(4-{2інданол (36мг) розчиняли в етилацетаті (1,4мл) та [гексил(2-фенілетил)аміно]-2перемішували при кімнатній температурі. Коли оксоетокси}феніл)пропіонової кислоти сіль осаджувалася, додавали етилацетат (3,2мл). (2S)-2-Eтокси-3-(4-{2-[гексил(2Суспензію перемішували при кімнатній фенілетил)аміно]-2-оксоетокси}феніл)пропіонова температурі, відфільтровували, та тверду фазу, кислоту (0,49г) та трет-бутиламін (0,077г) промивали етилацетатом (1мл) та сушили при змішували в ацетоні (8мл/г), з наступним пониженому тиску. Продукт був підтверджений як доданням ізооктану (8мл/г) та перемішували при (1R,2S)-2-гідроксііндан-1-амоніум (2S)-2-етокси-3кімнатній температурі. Продукт (0,36г) (4-{2-[гексил(2-фенілетил)аміно]-2відфільтровували та промивали ізооктаном (4мл/г) оксоетокси}феніл)пропіонат за допомогою LC та та сушили при кімнатній температурі. Продукт XRPD. підтверджували за допомогою методів ЯМР та Приклад 3 ХRРD. Сіль (1R,2S)-2-гідроксііндан-1-аміну та (2S)-21 Н -ЯМР (400 Мгц, CDCl3): етокси-3-(4-(2-[гексил(2-фенілетил)аміної-27,3 - 7,0 (7Н, m), 6,7 (1Н, d), 6,6 (1Н, d), 4,6 (1Н, оксоетокси}феніл)пропіонової кислоти s), 4,3 (1Н, s), 3,7 (1Н, m), 3,6 (1Н, m), 3,5 (2Н, m), 25 81807 3,3 (1Н, t), 3,1 (2Н, m), 2,9 (1Н, m), 2,7 (3Н, m), 1,5 (2Н, br m), 1,3 (9Н, br s), 1,2 (6Н, br s), 1,0 (3Н, t), 0,8 (3Н, m) Властивості Приклади властивостей (1R,2S)-2гідроскііндан-1-амін (2S)-2-етокси-3-(4-{2-[гексил(2фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти DSC показав ендотерму з екстрапольованою температурою на вході 104°С. TGA показав втрату ваги на 0% w/w в інтервалі 24-75°С. Аналіз DSC, повторюваний на більш чистому зразку, може надати вищу температуру топлення. Кристали (1R,2S)-2-гідроскііндан-1-амін (2S)-2-етокси-3-(4{2-[гексил(2-фенілетил)аміно]-2-оксоетокси} феніл)пропіонової кислоти (отримані за допомогою прикладу вище та/або іншими шляхами) були проаналізовані за допомогою методу XRPD та результати наведені у таблиці нижче та показані на Фігурі А 26 Приклади солі L-аргініну та (2S)-2-етокси-3-(4{2-[гексил(2-фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти (2S)-2-етокси3 -(4-{2-[гексил(2фенілетил)аміно] -2-оксоетокси}феніл)пропіонову кислоту (0,197г) розчиняли в 95% етанолі та до розчину додавали L-аргінін (І моль еквівалент). Розчин перемішували при температурі навколишнього середовища, з наступним випаровуванням досуха та доповненням ізооктану (10мл/г). Суспензію перемішували при кімнатній температурі, та продукт відфільтровували та аналізували за допомогою методу XRPD. Приклади властивостей солі трет-бутиламіну та (2S)-2-етокси-3-(4-(2-[гексил(2фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти DSC показав ендотерму з екстрапольованою температурою на вході 107°С. TGA показав втрату ваги на 12,7% w/w в інтервалі 102-236°С. Аналіз DSC, повторюваний на більш чистому зразку, може надати вищу температуру топлення. Кристали солі трет-бутиламіну та (2S)-2-етокси-3(4-{2-[гексил(2-фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти (отримані за допомогою вищенаведеного прикладу та/або 27 81807 28 ефект" in vivo. Сполуки також мають іншими шляхами) були проаналізовані за багатообіцяючий токсологічний профіль. допомогою методу XRPD та результати наведені у Наступні приклади солей (2S)-2-етокси-3-(4-{2таблиці нижче та показані на Фігурі С [гексил(2-Фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти Приклад 7 Сіль адамантиламіну та (2S)-2-етокси-3-(4-(2[гексил(2-фенілетил)аміно]-2-оксоетокси}феніл)пропіонової кислоти (2S)-2-Етокси-3-(4-{2-[гексил(2фенілетил)аміно]-2-оксоетокси}феніл)пропіонову кислоту (0,32г, 0,7 ммоль) розчинили в етилацетаті (10мл) у круглодонній колбі. Адамантиламін (0,11г, 0,7 ммоль) розчинили в малій порції метиленхлориду (2мл), та розчин додали до круглодонної колби. Розчиннику дозволяли поволі випаруватися при кімнатній температурі, поки одна четверть розчинника не залишиться. Кристали відфільтровували та сушили під вакуумом. Приклад 8 Сіль N-бензил-2-фенілетанамоніум та (2S}-2етокси-3-(4-{2-[гексил(2-фенілетил)аміно]-2оксоетокси}феніл)пропіонової кислоти (2S)-2-етокси-3-(4-{2-[гексил(2фенілетил)аміно]-2-оксоетокси}феніл)-пропіонову кислоту (0,49г) та 1N-бензил-2-фенілетиламін (0,24мл) змішували у ацетоні (4мл). Потім додавали ізооктан (4мл), та суспензію перемішували при кімнатній температурі протягом ночі, та потім відфільтровували. Кристалічність продукту була підтверджена за допомогою методу XRPD. Біологічна активність Сполуку А піддавали випробуванням, описаним в WO 03/051821. Сполуки за винаходом мають ЕС50 менш ніж 0,5 mмоль/1 для PPARa та переважні сполуки мають ЕС50 менш ніж 0,05 mмоль/і для PPARa. Сполуки за даним винаходом більш могутні щодо PPARa, ніж щодо PPARg. Вважають, що ця залежність важлива щодо фармакологічної діяльності сполук та до їх терапевтичного профілю. Крім того сполуки за даним винаходом демонструють поліпшені властивості DMPK (Метаболізм та Фармокінетика лікарських речовин), наприклад, вони демонструють поліпшену метаболічну стабільність in vitro, а також демонструють сприятливу криву "доза Визначення, що використовуються: Визначення % Відносної Інтенсивності* 60-100 vs (дуже сильна) 30-60 s (сильна) 11-30 m (середня) 5-11 w(слабка) 29 81807 30
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutically useful salts of carboxylic acid derivates
Автори англійськоюAurell Carl-Johan, Minidis Anna, Ohlsson Bengt, Stahle Erica
Назва патенту російськоюФармацевтически полезные соли производных карбоновой кислоты
Автори російськоюОрелль Карл-Йоган, Минидис Анна, Ольссон Бенгт, Стогле Эрика
МПК / Мітки
МПК: A61K 31/16, C07C 235/20, A61P 3/00
Мітки: фармацевтично, корисні, похідних, карбонової, кислоти, солі
Код посилання
<a href="https://ua.patents.su/15-81807-farmacevtichno-korisni-soli-pokhidnikh-karbonovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Фармацевтично корисні солі похідних карбонової кислоти</a>
Попередній патент: Гідромезилат 4-(4-транс-гідроксициклогексил)амін-2-феніл-7н-пірол[2,3-d]піримідину та його поліморфні форми
Наступний патент: Похідні піперидиніл- і піперазинілалкілкарбаматів, спосіб їх одержання (варіанти) і їх застосування в терапії
Випадковий патент: Спосіб лікування гастроезофагеальної рефлюксної хвороби у вагітних