Циклопропіл аміни як модулятори н3 рецепторів гістаміну
Номер патенту: 96424
Опубліковано: 10.11.2011
Автори: Еллісон Бретт Д., Летавік Майкл А., Каррутерс Ніколас І., Грайс Черіл А.
Формула / Реферат
1. Сполука, вибрана з групи, що включає:
(4-циклопропілпіперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанон,
(4-циклопропілпіперазин-1-іл)-[4-(4-фторпіперидин-1-ілметил)-феніл]-метанон,
(4-циклопропілпіперазин-1-іл)-(4-тіоморфолін-4-ілметилфеніл)-метанон та
(4-циклопропілпіперазин-1-іл)-[4-(2-гідроксиметилморфолін-4-ілметил)-феніл]-метанон
або їх енантіомери, гідрати, сольвати та фармацевтично прийнятні солі.
2. Сполука за п. 1, яка являє собою (4-циклопропілпіперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанон, або її енантіомер, гідрат, сольват або фармацевтично прийнятна сіль.
3. Сполука за п. 1, яка являє собою (4-циклопропілпіперазин-1-іл)-[4-(4-фторпіперидин-1-ілметил)-феніл]-метанон, або її енантіомер, гідрат, сольват або фармацевтично прийнятна сіль.
4. Сполука за п. 1, яка являє собою (4-циклопропілпіперазин-1-іл)-(4-тіоморфолін-4-ілметилфеніл)-метанон, або її енантіомер, гідрат, сольват або фармацевтично прийнятна сіль.
5. Сполука за п. 1, яка являє собою (4-циклопропілпіперазин-1-іл)-[4-(2-гідроксиметилморфолін-4-ілметил)-феніл]-метанон, або її енантіомер, гідрат, сольват або фармацевтично прийнятна сіль.
6. Сполука за п. 2, вибрана з групи, що включає: (4-циклопропілпіперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанон та дигідрохлорид (4-циклопропілпіперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанону.
7. Сполука за п. 2, яка являє собою (4-циклопропілпіперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанон.
8. Сполука за п. 2, яка являє собою дигідрохлорид (4-циклопропілпіперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанону.
9. Сполука за п. 2, яка являє собою цитрат (4-циклопропілпіперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанону.
10. Сполука за п. 1, яка являє собою цитрат (4-циклопропілпіперазин-1-іл)-[4-(4-фторпіперидин-1-ілметил)-феніл]-метанону або цитрат (4-циклопропілпіперазин-1-іл)-(4-тіоморфолін-4-ілметилфеніл)-метанону, або цитрат (4-циклопропілпіперазин-1-іл)-[4-(2-гідроксиметилморфолін-4-ілметил)-феніл]-метанону.
11. Фармацевтична композиція, яка містить фармацевтично прийнятний носій та ефективну кількість принаймні однієї сполуки, вибраної з групи, що включає:
(4-циклопропілпіперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанон,
(4-циклопропілпіперазин-1-іл)-[4-(4-фторпіперидин-1-ілметил)-феніл]-метанон,
(4-циклопропілпіперазин-1-іл)-(4-тіоморфолін-4-ілметилфеніл)-метанон та
(4-циклопропілпіперазин-1-іл)-[4-(2-гідроксиметилморфолін-4-ілметил)-феніл]-метанон
або їх енантіомери, гідрати, сольвати та фармацевтично прийнятні солі.
12. Застосування принаймні однієї сполуки, вибраної з групи, що включає:
(4-циклопропілпіперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанон,
(4-циклопропілпіперазин-1-іл)-[4-(4-фторпіперидин-1-ілметил)-феніл]-метанон,
(4-циклопропілпіперазин-1-іл)-(4-тіоморфолін-4-ілметилфеніл)-метанон та
(4-циклопропілпіперазин-1-іл)-[4-(2-гідроксиметилморфолін-4-ілметил)-феніл]-метанон
або їх енантіомери, гідрати, сольвати та фармацевтично прийнятні солі, для лікування або попередження розладу ЦНС, вибраного з групи, що включає: неврологічні розлади, включаючи розлади сон/неспання та пробудження/пильнування (наприклад безсоння та порушення добового ритму організму), синдром дефіциту уваги з гіперактивністю (ADHD), розлади навчання та пам'яті, когнітивну дисфункцію, мігрень, нейрогенне запалення, слабоумство, помірне когнітивне погіршення (передслабоумство), хворобу Альцгеймера, епілепсію, нарколепсію з або без супутньої катаплексії, катаплексію, гомеостазні розлади сон/неспання, ідіопатичну сонливість, надмірну денну сонливість (EDS), розлади циркадного ритму, розлади сну/утомленості, утомленість, дрімоту, пов'язану з апное уві сні, погіршення сну внаслідок перименопаузних гормональних зсувів, утомленість, пов'язану з хворобою Паркінсона, утомленість, пов'язану з MS, утомленість, пов'язану з депресією, утомленість, викликану хіміотерапією, розлади харчової поведінки, ожиріння, морську хворобу, запаморочення, шизофренію, зловживання алкоголем, біполярні розлади, маніакальні розлади та депресію у ссавців.
13. Застосування принаймні однієї сполуки, вибраної з групи, що включає:
(4-циклопропілпіперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанон,
(4-циклопропілпіперазин-1-іл)-[4-(4-фторпіперидин-1-ілметил)-феніл]-метанон,
(4-циклопропілпіперазин-1-іл)-(4-тіоморфолін-4-ілметилфеніл)-метанон та
(4-циклопропілпіперазин-1-іл)-[4-(2-гідроксиметилморфолін-4-ілметил)-феніл]-метанон або їх енантіомери, гідрати, сольвати та фармацевтично прийнятні солі, для лікування або попередження алергічної реакції верхніх дихальних шляхів, астми, сверблячки, закупорки носового каналу та алергічного риніту у ссавців.
14. Застосування а) принаймні однієї сполуки за п. 1 в комбінації з b) одним або більше антагоністами Н1 або Н2 гістаміну для лікування або попередження алергічного риніту, закупорки носового каналу та алергічного застою.
15. Застосування а) принаймні однієї сполуки за п. 1 в комбінації з b) одним або більше блокаторами повторного поглинання нейротрансмітерів для лікування або попередження депресії, розладів настрою або шизофренії.
16. Застосування а) принаймні однієї сполуки за п. 1 в комбінації з b) модафінілом для лікування або попередження нарколепсії, надмірної денної сонливості (EDS), хвороби Альцгеймера, депресії, розладу дефіциту уваги, утомленості, пов'язаної з MS, стану "сп'яніння" після анестезії, когнітивного погіршення, шизофренії, еластичності, пов'язаної з церебральним паралічем, когнітивного погіршення, пов'язаного з віком, ідіопатичної сонливості або порушення добового ритму організму.
17. Сполука за п. 1, яка являє собою ізотопно мічену сполуку для визначення за допомогою PET або SPECT.
18. Застосування 18F-міченої або 11С-міченої сполуки за п. 1 для дослідження розладів, опосередкованих гістаміном як молекулярним зондом в позитронно-емісійній томографії (PET).
19. Фармацевтична композиція за п. 11, яка додатково містить топірамат.
20. Застосування сполуки, вибраної з групи, що включає:
(4-циклопропілпіперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанон,
(4-циклопропілпіперазин-1-іл)-[4-(4-фторпіперидин-1-ілметил)-феніл]-метанон,
(4-циклопропілпіперазин-1-іл)-(4-тіоморфолін-4-ілметилфеніл)-метанон та
(4-циклопропілпіперазин-1-іл)-[4-(2-гідроксиметилморфолін-4-ілметил)-феніл]-метанон
або їх фармацевтично прийнятні солі, для лікування суб'єкта, який страждає від або в якого діагностовано хворобу, яка вибрана з групи, що включає: когнітивні розлади, розлади сну, психіатричні розлади та інші розлади.
21. Застосування за п. 20, де хвороба вибрана з групи, що включає: слабоумство, хворобу Альцгеймера, когнітивну дисфункцію, помірне когнітивне погіршення, передслабоумство, синдром дефіциту уваги з гіперактивністю, розлади дефіциту уваги та розлади навчання та пам'яті.
22. Застосування за п. 20, де хвороба вибрана з групи, що включає: погіршення здатності до навчання, погіршення пам'яті та втрату пам'яті.
23. Застосування за п. 20, де хвороба вибрана з групи, що включає: безсоння, порушений сон, нарколепсію з або без супутньої катаплексії, катаплексію, гомеостазні розлади сон/неспання, ідіопатичну сонливість, надмірну денну сонливість, розлади циркадного ритму, утомленість, летаргію та порушення добового ритму організму.
24. Застосування за п. 20, де хвороба вибрана з групи, що включає: апное уві сні, перименопаузні гормональні зсуви, хворобу Паркінсона, розсіяний склероз, депресію, хіміотерапію та позмінний режим роботи.
25. Застосування за п. 20, де хвороба вибрана з групи, що включає: шизофренію, біполярні розлади, маніакальні розлади, депресію, обсесивно-компульсивний розлад та посттравматичний стресовий розлад.
26. Застосування за п. 20, де хвороба вибрана з групи, що включає: хворобу руху, запаморочення, епілепсію, мігрень, нейрогенне запалення, розлади харчової поведінки, ожиріння та зловживання алкоголем.
27. Застосування за п. 20, де хвороба вибрана з групи, що включає: депресію, порушений сон, утомленість, летаргію, когнітивне погіршення, погіршення пам'яті, втрату пам'яті, погіршення здатності до навчання, розлади дефіциту уваги та розлади харчової поведінки.
28. Застосування за п. 20, де хвороба вибрана з групи, що включає: когнітивне погіршення, пов'язане з віком, розлад поведінки REM, постуральне запаморочення в легкій формі, дзвін у вухах, розлади руху, синдром втомлених ніг, розлади, пов'язані з очами, дегенерацію жовтої плями та пігментну дегенерацію сітківки.
Текст
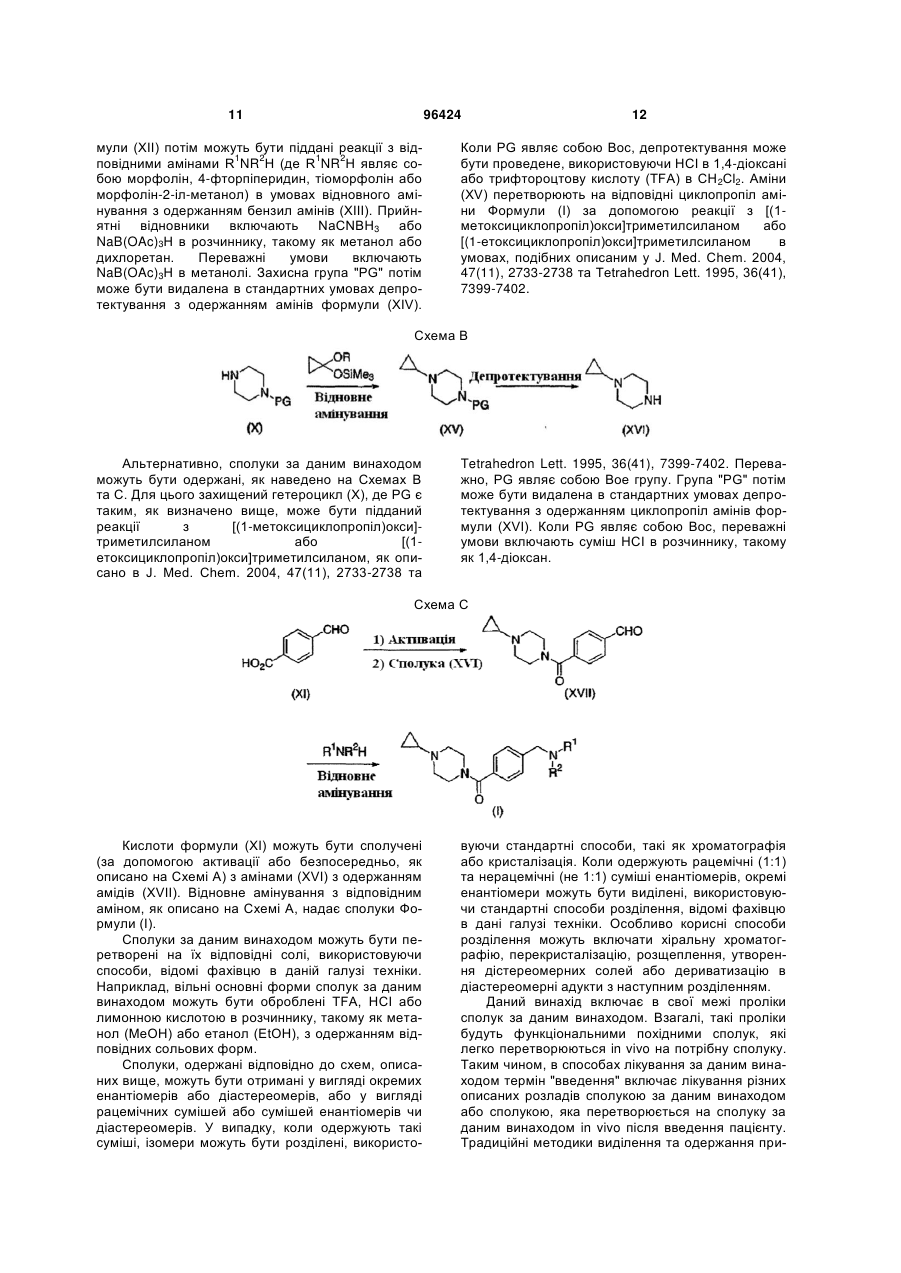
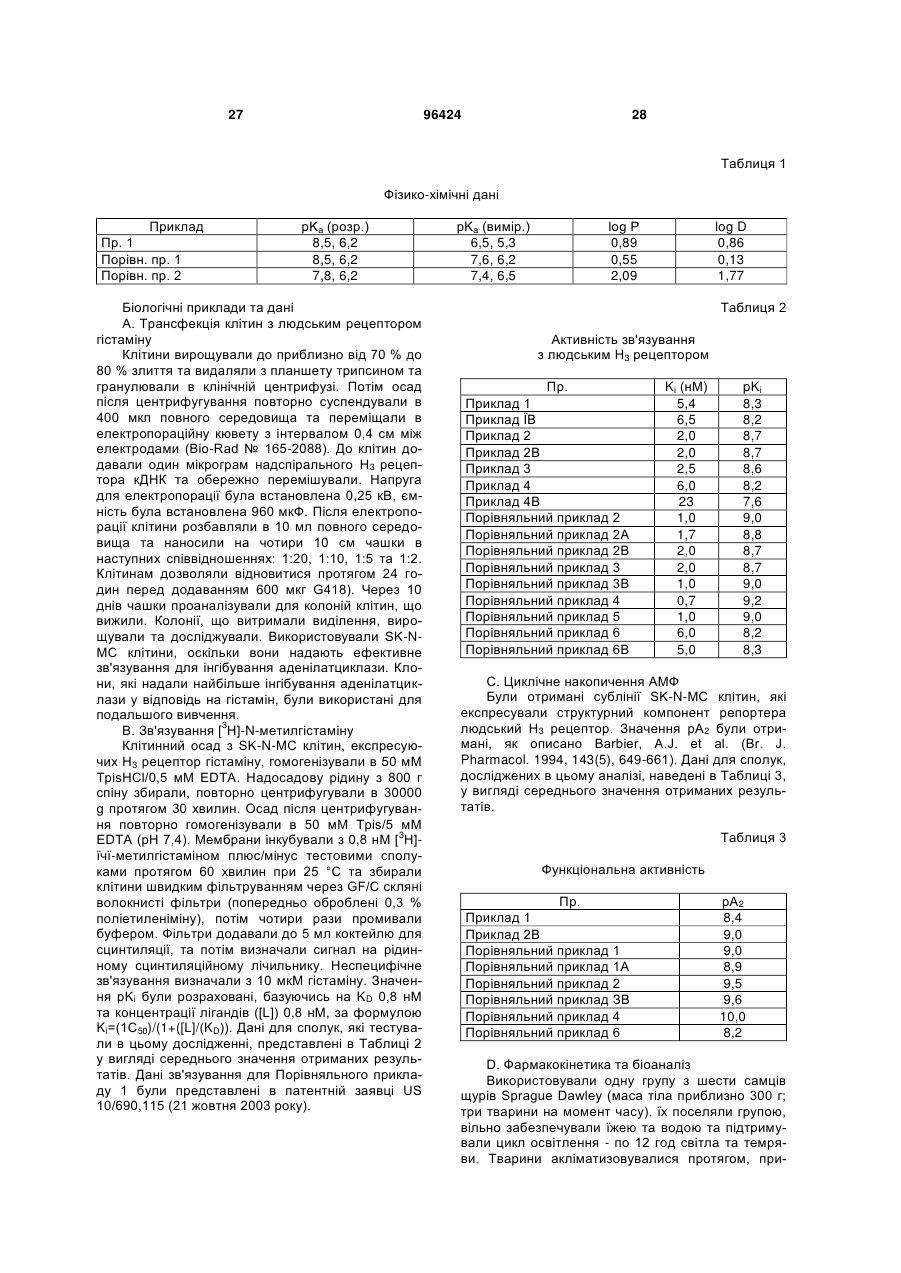
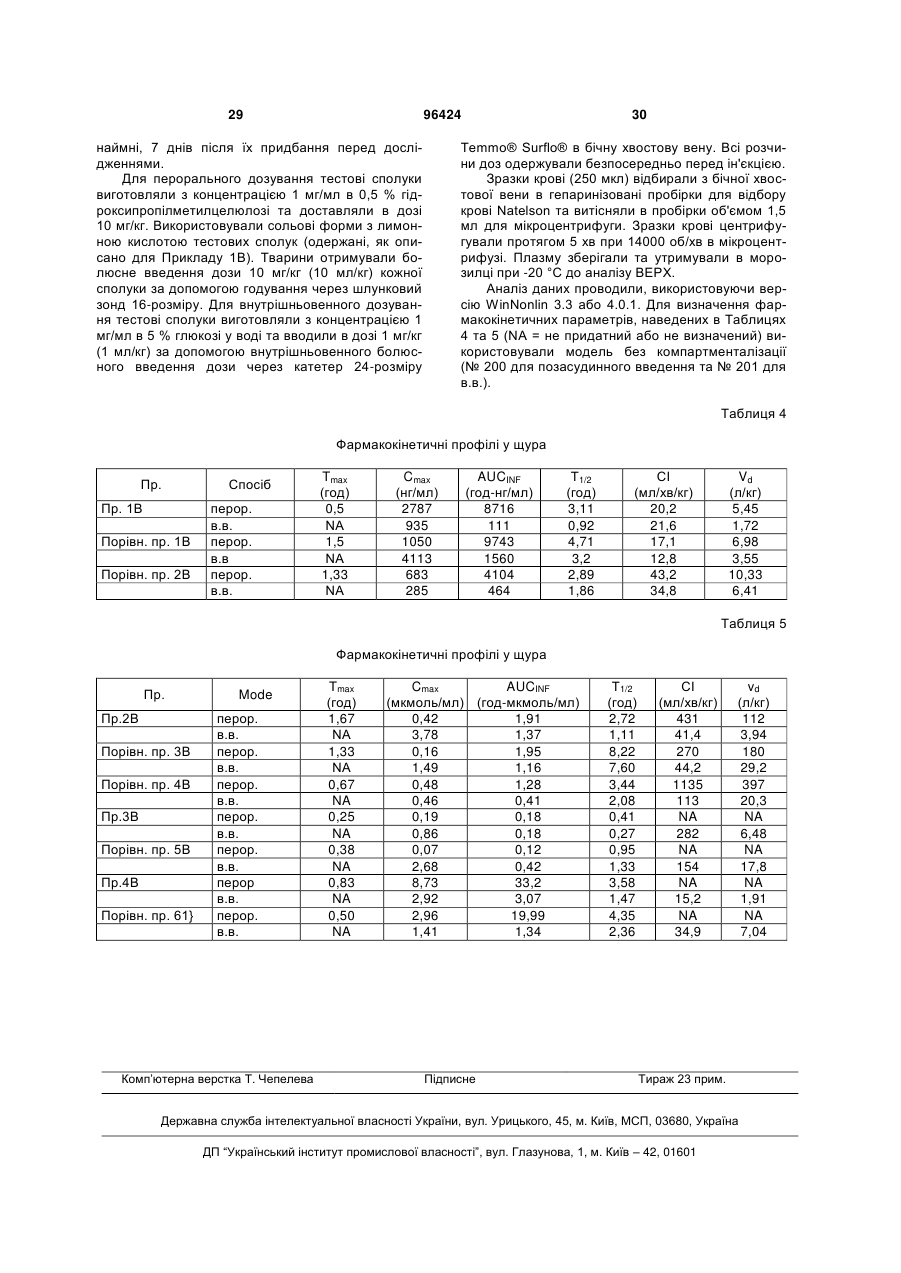
1. Сполука, вибрана з групи, що включає: (4-циклопропілпіперазин-1-іл)-(4-морфолін-4ілметилфеніл)-метанон, (4-циклопропілпіперазин-1-іл)-[4-(4фторпіперидин-1-ілметил)-феніл]-метанон, (4-циклопропілпіперазин-1-іл)-(4-тіоморфолін-4ілметилфеніл)-метанон та (4-циклопропілпіперазин-1-іл)-[4-(2гідроксиметилморфолін-4-ілметил)-феніл]метанон або їх енантіомери, гідрати, сольвати та фармацевтично прийнятні солі. 2. Сполука за п. 1, яка являє собою (4циклопропілпіперазин-1-іл)-(4-морфолін-4ілметилфеніл)-метанон, або її енантіомер, гідрат, сольват або фармацевтично прийнятна сіль. 3. Сполука за п. 1, яка являє собою (4циклопропілпіперазин-1-іл)-[4-(4-фторпіперидин-1ілметил)-феніл]-метанон, або її енантіомер, гідрат, сольват або фармацевтично прийнятна сіль. 4. Сполука за п. 1, яка являє собою (4циклопропілпіперазин-1-іл)-(4-тіоморфолін-4ілметилфеніл)-метанон, або її енантіомер, гідрат, сольват або фармацевтично прийнятна сіль. 5. Сполука за п. 1, яка являє собою (4циклопропілпіперазин-1-іл)-[4-(2гідроксиметилморфолін-4-ілметил)-феніл]метанон, або її енантіомер, гідрат, сольват або фармацевтично прийнятна сіль. 6. Сполука за п. 2, вибрана з групи, що включає: (4-циклопропілпіперазин-1-іл)-(4-морфолін-4ілметилфеніл)-метанон та дигідрохлорид (4циклопропілпіперазин-1-іл)-(4-морфолін-4ілметилфеніл)-метанону. 2 (19) 1 3 приклад безсоння та порушення добового ритму організму), синдром дефіциту уваги з гіперактивністю (ADHD), розлади навчання та пам'яті, когнітивну дисфункцію, мігрень, нейрогенне запалення, слабоумство, помірне когнітивне погіршення (передслабоумство), хворобу Альцгеймера, епілепсію, нарколепсію з або без супутньої катаплексії, катаплексію, гомеостазні розлади сон/неспання, ідіопатичну сонливість, надмірну денну сонливість (EDS), розлади циркадного ритму, розлади сну/утомленості, утомленість, дрімоту, пов'язану з апное уві сні, погіршення сну внаслідок перименопаузних гормональних зсувів, утомленість, пов'язану з хворобою Паркінсона, утомленість, пов'язану з MS, утомленість, пов'язану з депресією, утомленість, викликану хіміотерапією, розлади харчової поведінки, ожиріння, морську хворобу, запаморочення, шизофренію, зловживання алкоголем, біполярні розлади, маніакальні розлади та депресію у ссавців. 13. Застосування принаймні однієї сполуки, вибраної з групи, що включає: (4-циклопропілпіперазин-1-іл)-(4-морфолін-4ілметилфеніл)-метанон, (4-циклопропілпіперазин-1-іл)-[4-(4фторпіперидин-1-ілметил)-феніл]-метанон, (4-циклопропілпіперазин-1-іл)-(4-тіоморфолін-4ілметилфеніл)-метанон та (4-циклопропілпіперазин-1-іл)-[4-(2гідроксиметилморфолін-4-ілметил)-феніл]метанон або їх енантіомери, гідрати, сольвати та фармацевтично прийнятні солі, для лікування або попередження алергічної реакції верхніх дихальних шляхів, астми, сверблячки, закупорки носового каналу та алергічного риніту у ссавців. 14. Застосування а) принаймні однієї сполуки за п. 1 в комбінації з b) одним або більше антагоністами Н1 або Н2 гістаміну для лікування або попередження алергічного риніту, закупорки носового каналу та алергічного застою. 15. Застосування а) принаймні однієї сполуки за п. 1 в комбінації з b) одним або більше блокаторами повторного поглинання нейротрансмітерів для лікування або попередження депресії, розладів настрою або шизофренії. 16. Застосування а) принаймні однієї сполуки за п. 1 в комбінації з b) модафінілом для лікування або попередження нарколепсії, надмірної денної сонливості (EDS), хвороби Альцгеймера, депресії, розладу дефіциту уваги, утомленості, пов'язаної з MS, стану "сп'яніння" після анестезії, когнітивного погіршення, шизофренії, еластичності, пов'язаної з церебральним паралічем, когнітивного погіршення, пов'язаного з віком, ідіопатичної сонливості або порушення добового ритму організму. 17. Сполука за п. 1, яка являє собою ізотопно мічену сполуку для визначення за допомогою PET або SPECT. 18 11 18. Застосування F-міченої або С-міченої сполуки за п. 1 для дослідження розладів, опосередкованих гістаміном як молекулярним зондом в позитронно-емісійній томографії (PET). 96424 4 19. Фармацевтична композиція за п. 11, яка додатково містить топірамат. 20. Застосування сполуки, вибраної з групи, що включає: (4-циклопропілпіперазин-1-іл)-(4-морфолін-4ілметилфеніл)-метанон, (4-циклопропілпіперазин-1-іл)-[4-(4фторпіперидин-1-ілметил)-феніл]-метанон, (4-циклопропілпіперазин-1-іл)-(4-тіоморфолін-4ілметилфеніл)-метанон та (4-циклопропілпіперазин-1-іл)-[4-(2гідроксиметилморфолін-4-ілметил)-феніл]метанон або їх фармацевтично прийнятні солі, для лікування суб'єкта, який страждає від або в якого діагностовано хворобу, яка вибрана з групи, що включає: когнітивні розлади, розлади сну, психіатричні розлади та інші розлади. 21. Застосування за п. 20, де хвороба вибрана з групи, що включає: слабоумство, хворобу Альцгеймера, когнітивну дисфункцію, помірне когнітивне погіршення, передслабоумство, синдром дефіциту уваги з гіперактивністю, розлади дефіциту уваги та розлади навчання та пам'яті. 22. Застосування за п. 20, де хвороба вибрана з групи, що включає: погіршення здатності до навчання, погіршення пам'яті та втрату пам'яті. 23. Застосування за п. 20, де хвороба вибрана з групи, що включає: безсоння, порушений сон, нарколепсію з або без супутньої катаплексії, катаплексію, гомеостазні розлади сон/неспання, ідіопатичну сонливість, надмірну денну сонливість, розлади циркадного ритму, утомленість, летаргію та порушення добового ритму організму. 24. Застосування за п. 20, де хвороба вибрана з групи, що включає: апное уві сні, перименопаузні гормональні зсуви, хворобу Паркінсона, розсіяний склероз, депресію, хіміотерапію та позмінний режим роботи. 25. Застосування за п. 20, де хвороба вибрана з групи, що включає: шизофренію, біполярні розлади, маніакальні розлади, депресію, обсесивнокомпульсивний розлад та посттравматичний стресовий розлад. 26. Застосування за п. 20, де хвороба вибрана з групи, що включає: хворобу руху, запаморочення, епілепсію, мігрень, нейрогенне запалення, розлади харчової поведінки, ожиріння та зловживання алкоголем. 27. Застосування за п. 20, де хвороба вибрана з групи, що включає: депресію, порушений сон, утомленість, летаргію, когнітивне погіршення, погіршення пам'яті, втрату пам'яті, погіршення здатності до навчання, розлади дефіциту уваги та розлади харчової поведінки. 28. Застосування за п. 20, де хвороба вибрана з групи, що включає: когнітивне погіршення, пов'язане з віком, розлад поведінки REM, постуральне запаморочення в легкій формі, дзвін у вухах, розлади руху, синдром втомлених ніг, розлади, пов'язані з очами, дегенерацію жовтої плями та пігментну дегенерацію сітківки. 5 Даний винахід відноситься до групи циклопропіл амінів, їх синтезу та способів їх застосування для лікування розладів та станів, в які залучений Н3 рецептор гістаміну. В результаті цієї активності сполуки за даним винаходом будуть мати терапевтичну корисність для лікування різноманітних розладів, пов'язаних з ЦНС, включаючи, але не обмежуючись, нарколепсію, розлади сну, ожиріння, нейродегенеративні розлади, когнітивні розлади та гіперактивні розлади. Гістамін {2-(імідазол-4-іл)етиламін} являє собою біологічно-активну молекулу. Гістамін здійснює фізіологічний вплив за допомогою множинних різних G-протеїн зв'язаних рецепторів. Н3 рецептор гістаміну вперше був описаний як пресинаптичний ауторецептор в центральній нервовій системі (ЦНС) (Arrang, J.-M. et al., Nature 1983, 302:832837), який регулює синтез та вивільнення гістаміну. Останні знайдені дані показують, що Н3 рецептори також розміщені пресинаптично як гетерорецептори на серотонінергічних норадренергічних, дофамінергічних, холінергічних та ГАМК-ергічних (які містять гамма-аміномасляну кислоту) нейронах. Ці Н3 рецептори також недавно були ідентифіковані в периферійних тканинах, таких як судинні гладкі м'язи. Тому, існує багато потенційних терапевтичних застосувань для Н3 агоністів, антагоністів та зворотних агоністів гістаміну. (Див.: "The Histamine H3 Receptor-А Target for New Drugs", Leurs, R. and Timmerman, H., (Eds.), Elsevier, 1998; Morisset, S. et al., Nature 2000, 408, 860-864.) Деякі показання для Н3 антагоністів гістаміну та зворотних агоністів були так само запропоновані, базуючись на тваринних фармакологічних дослідах та інших експериментах з відомими Н3 антагоністами гістаміну (наприклад, тіоперамід). Вони включають слабоумство, хворобу Альцгеймера (Panula, P. et al., Soc. Neurosci. Abstr. 1995, 21:1977), епілепсію (Yokoyama, H. et al., Eur. J. Pharmacol. 1993, 234:129-133), нарколепсію, з або без катаплексії, катаплексію, гомеостазні розлади сон/неспання, ідіопатичну сонливість, надмірну денну сонливість (EDS), розлади циркадного ритму, розлади сну/утомленості, утомленість, дрімоту, пов'язану з апное уві сні, погіршення сну внаслідок періменопаузних гормональних зсувів, порушення добового ритму організму, утомленість, пов'язану з хворобою Паркінсона, утомленість, пов'язану з розсіяним склерозом (MS), утомленість, пов'язану з депресією, утомленість, викликану хіміотерапією, розлади харчової поведінки (Machidori, Η. et al., Brain Res. 1992, 590:180-186), морську хворобу, запаморочення, синдром дефіциту уваги з гіперактивністю (ADHD), розлади навчання та пам'яті (Barnes, J.C. et al., Soc. Neurosci. Abstr. 1993, 19:1813) та шизофренію (Schlicker, Ε. and Marr, 1., Naunyn-Schmiedeberg's Arch. Pharmacol. 1996, 353:290-294). (Також див.: Stark, Η. et al., Drugs Future 1996, 21(5):507-520; та Leurs, R. et al., Prog. Drug Res. 1995, 45:107-165 та посилання, цитовані в наведених документах). Описано, що Н3 антагоністи гістаміну, самі по собі або в комбінації з Ні антагоністами гістаміну корисні при лікуванні алергічної реакції верхніх дихальних шляхів (Патент US 5,217,986; 5,352,707 та 5,869,479). Більш недавній 96424 6 огляд цієї проблеми був представлений Tozer та Kalindjian (Exp. Opin. Ther. Patents 2000,10,1045). Для додаткового огляду див.: Celanire, S. Drug Discovery Today 2005, 10(23/24), 1613-1627; Hancock, A.A. Biochem. Pharmacol. 2006, 71, 11031113. Сполуки за даним винаходом виявляють активність в людському Н3 рецепторі, яку визначають за допомогою зв'язування рецептора з людським Н3 рецептором гістаміну (див. Lovenberg, T.W. et al., Моl. Pharmacol. 1999, 55, 1101-1107). Скринінг, використовуючи людський рецептор, є особливо важливим для встановлення нових терапій для лікування хвороб у людей. Наприклад, визначені традиційні аналізи зв'язування, використовуючи синаптосому щурів (Garbarg, Μ. et al., J. Pharmacol. Exp. Ther. 1992, 263(1), 304-310), кортикальні мембрани щурів (West, R.E. et al., Моl. Pharmacol. 1990, 38, 610-613) та мозок морської свинки (Korte, A. et al., Biochem. Biophys. Res. Commun. 1990, 168(3), 979-986). Були проведені лише обмежені дослідження перед використанням людської тканини або людського рецептора, але вони вказують на істотні відмінності у фармакології рецепторів гризуна та приматів (West, R.E. et al. Eur. J. Pharmacol. 1999, 377, 233-239; Ireland, D. et al. Eur. J. Pharmacol. 2001, 433, 141-150). Для досягнення бажаного фармакологічного ефекту сполука повинна виявляти активність проти біологічної мішені, а також прийнятний фармакокінетичний профіль. Перш за все, сполука повинна бути здатною до перенесення до місця її дії, або в ЦНС, що потребує відповідного проникнення через бар'єру крові-мозку, або в периферії. Абсорбція через різні біологічні мембрани залежить від фізичних властивостей лікарських засобів (зокрема, ступеня іонізації при фізіологічному рН, коефіцієнту розподілення, молекулярного розміру, серед інших чинників). Як тільки буде забезпечено бажаний фармакологічний ефект, лікарські засоби повинні бути виведені з організму з відповідною швидкістю. У випадку, коли процес виведення є дуже повільним, може відбуватися накопичення лікарських засобів, потенційно викликаючи небажані побічні ефекти. При різних Н3-опосередкованих хворобах можуть бути потрібні сполуки з чіткими та різними фармакокінетичними профілями. Зокрема, введення сполуки з коротким періодом напіввиведення забезпечує більший контроль над впливом та тривалістю дії лікарських засобів, які можуть бути корисними при лікуванні або попередженні конкретної хвороби або стану. Сполука з таким оптимізованим профілем дозволяє використання спеціально пристосованих препаратів, режимів дозування та/або стратегій доставки для досягнення цих результатів. Наприклад, сполука з послабленим фармакокінетичним профілем може забезпечувати більш короткий фармакодинамічний ефект, який може бути переважний при лікуванні певних хворобливих станів. На відміну від цього, сполука з тривалим періодом напіввиведення може бути переважною для станів, в яких бажаною є постійна дія лікарських засобів на мішень, без або тільки з 7 дуже незначними змінами в концентрації лікарського засобу. Різні піперазиніл бензаміди розкриті в публікації патентної заявки US - 2004-0110746-А1 (10 червня 2004 року), яка включена в дану заявку шляхом посилання. Особливості та переваги винаходу очевидні фахівцю в даній області техніки. Базуючись на цьому описі, включаючи короткий опис, детальний опис, передумови створення винаходу, приклади та формулу винаходу, фахівець в даній області техніки буде здатний здійснити модифікації та адаптації до різних умов та використань. Публікації, описані в даній заявці, включені шляхом посилання в повному обсязі. В даній заявці описані групи N-циклопропіл амінних сполук, які мають здатність модулювати активність рецептора гістаміну, особливо Н3 рецептора. Винахід розкриває сполуку, вибрану з групи, що включає: (4-циклопропіл-піперазин-1-іл)-(4морфолін-4-ілметил-феніл)-метанон, (4циклопропіл-піперазин-1-іл)-[4-(4-фтор-піперидин1-ілметил)-феніл]-метанон, (4-циклопропілпіперазин-1-іл)-(4-тіоморфолін-4-ілметил-феніл)метанон та (4-циклопропіл-піперазин-1-іл)-[4-(2гідроксиметил-морфолін-4-ілметил)-феніл]метанон, та їх енантіомери, гідрати, сольвати та фармацевтично прийнятні солі. В конкретних втіленнях, сполука являє собою дигідрохлорид цитрату (4-циклопропіл-піперазин1-іл)-(4-морфолін-4-ілметил-феніл)-метанону або цитрат (4-циклопропіл-піперазин-1-іл)-(4морфолін-4-ілметил-феніл)-метанону. В додаткових втіленнях, сполука являє собою цитрат (4циклопропіл-піперазин-1-іл)-[4-(4-фтор-піперидин1-ілметил)-феніл]-метанону, цитрат (4циклопропіл-піперазин-1-іл)-(4-тіоморфолін-4ілметил-феніл)-метанону або цитрат (4циклопропіл-піперазин-1-іл)-[4-(2-гідроксиметилморфолін-4-ілметил)-феніл]-метанону. Даний винахід забезпечує способи лікування або попередження хвороб та станів, опосередкованих активністю Н3 рецептора гістаміну. Винахід також розкриває фармацевтичні композиції, що містять такі сполуки, та способи застосування таких композицій при лікуванні або попередженні хвороб, опосередкованих активністю Н3 рецептора гістаміну. Даний винахід також розкриває спосіб лікування або попередження хвороби або стану, в які залучений гістамін, за допомогою комбінаційної терапії сполук за даним винаходом, введенням будь-якого засобу з наступного: Ні антагоністи гістаміну, Н2 антагоністи гістаміну, блокатори повторного поглинання нейротрансмітерів, селективні інгібітори повторного поглинання серотоніну (SSRI), інгібітори повторного поглинання серотоніну-норадреналіну, норадренергічні інгібітори повторного поглинання, неселективні інгібітори повторного поглинання серотоніну, допаміну або норадреналіну, модафініл та топірамат. рKа наданої сполуки впливає на ступінь іонізації при фізіологічному рН. Оскільки недиссоційовані форми є більш ліпофільними, вони більш легко можуть проходити крізь мембрани, включаючи 96424 8 гематоенцефалічний бар'єр. Хоча розраховані значення рKа для циклопропіл амінної сполуки за даним винаходом (Приклад 1) були подібні значенню, отриманому для ізопропілового аналога (Порівняльний приклад 1), виміряне значення рKа значно відрізнялося. Хоча це свідчило про те, що циклопропіл амін є приблизно в десять разів менш основним, ніж аліфатичні аміни (Zaragoza, et al. J. Med. Chem. 2004, 47, 2833-2838), не було повідомлено про жодну пряму експериментальну очевидність (Love, et al. J. Am. Chem. Soc. 1968, 90(10), 2455-2462). Таким чином, заміна аліфатичної групи на циклопропільну групу може надавати більшу фракцію непротонованого аміну при фізіологічному рН та, таким чином, сприяти покращенню проникності через мембрани (Zaragoza, et al. J. Med. Chem. 2005, 48, 306-311). Ці дані вказують на те, що циклопропіл аміни можуть мати схильність до більшої проникності та об'єму розповсюдження (Vd), ніж аліфатичні аміни подібної структури. Даний винахід забезпечує експериментальні докази, що демонструють істотне зменшення основності для Прикладу 1, циклопропіл амін, відносно його ізопропіл та циклобутил амінних аналогів. Проте, циклопропіл аміни за даним винаходом фактично показали фармакокінетичний профіль, який порівняний з результатами, передбаченими в літературі. Наприклад, Приклад ЇВ показав більш короткий період напіввиведення (Т1/2) та більш менший об'єм розповсюдження (Vd), ніж Порівняльні приклади 1В та 2В. Так само, Приклад 2В показав більш короткий Т1/2 та більш менший Vd, ніж Порівняльні приклади 3В та 4В; Приклад 3В показав більш короткий Т1/2 та більш менший Vd, ніж Порівняльний приклад 5В, та Приклад 4В показав більш короткий Т1/2 та більш менший Vd, ніж Порівняльний приклад 6В. Додаткові особливості та переваги винаходу будуть очевидні з детального опису та прикладів, наведених нижче, та доданої формули винаходу. Винахід може бути більш повно зрозумілий за допомогою посилання на наступний опис, включаючи наступний глосарій термінів та заключних прикладів. З метою стислості, розкриття публікацій, процитованих в даній заявці, включені шляхом посилання. Як використовується в даній заявці, терміни "включаючи", "містить" та "складається з" використовуються в їх відкритому, не обмежуючому значенні. Ізомерні форми сполук за даним винаходом та їх фармацевтично прийнятні солі включені в межі даного винаходу, та мається на увазі, що посилання в даній заявці на одну з таких ізомерних форм відноситься до, принаймні, однієї з таких ізомерних форм. Фахівець в даній галузі техніки визнає, що сполуки відповідно до даного винаходу можуть існувати, наприклад, в окремій ізомерній формі, тоді як інші сполуки можуть існувати у формі ізомерної суміші. Наприклад, даний винахід включає оптичні ізомери сполук, ι описаних в даній заявці, включаючи енантіомери та їх суміші. Крім того, певні сполуки, на які посилаються в даній заявці, можуть існувати в сольватованій або гідратованій формах, а також і в несольватованих фо 9 96424 рмах. Розуміють, що даний винахід включає всі такі сольватовані та несольватоваш форми сполук за даним винаходом. Сполуки за даним винаходом, які були модифіковані для визначення за допомогою деяких аналітичних способів, також включені в межі даного винаходу. Сполуки за даним винаходом можуть бути мічені радіоактивними елементами, такими як 125 18 11 64 3 14 І, F, C, Cu, Н, С та подібними, для використання при візуалізації або для радіоактивного лікування пацієнтів. Прикладом таких сполук є 18 ; ізотопічно мічена сполука, така як F ізотопічно мічена сполука, яка може бути використана як зонд у виявленні та/або візуалізації технологій, таких як позитронно-емісійна томографія (PET) та однофотонна емісійна комп'ютерна томографія (SPECT). Переважно, сполуки за даним винахо18 11 дом, мічені F або С, можуть бути використані як молекулярний зонд в позитронно-емісійній томографії (PET) для вивчення гістамінопосередкованих розладів. Альтернативно, сполу14 ки за даним винаходом, мічені С, можуть бути використані в метаболічних дослідженнях. Іншим прикладом таких сполук є ізотопічно мічена сполука, така як сполука, мічена дейтерієм та/або тритієм, яка може бути використана в кінетичних вивченнях реакцій. Сполуки, описані в даній заявці, можуть бути піддані реакції з відповідними функціоналізованими радіоактивними реагентами, використовуючи методики традиційної хімії, з отриманням мічених сполук. Сполуки, які описані вище, можуть бути одержані відповідно до способів, відомих фахівцю в даній галузі техніки та/або описаних на схемах та в прикладах, наведених далі. Для отримання різних сполук в даній заявці можуть бути використані ви 10 хідні речовини, які несуть в основі бажані замісники протягом усієї схеми реакції з або без захисту, як прийнятно. Це може бути досягнуто за допомогою традиційних захисних груп, таких як описано в "Protective Groups in Organic Chemistry", ed. J.F.W. McOmie, Plenum Press, 1973; та T.W. Greene & P.G.M. Wuts, "Protective Groups in Organic rd Synthesis", 3 td., John Wiley & Sons, 1999. Захисні групи можуть бути видалені на придатній подальшій стадії, використовуючи способи, відомі з рівня техніки. Альтернативно, може бути необхідним використання в місці кінцевого бажаного замісника прийнятної групи, яка може бути доведена до кінця схеми реакції та замінена, як прийнятно, на бажаний замісник. Такі сполуки, попередники або проліки також включені в межі даного винаходу. Реакції можуть бути проведені при температурі від температури плавлення до температури кипіння розчинника зі зворотним холодильником та переважно від 0 °С до температури кипіння розчинника зі зворотним холодильником. Сполуки, які описані вище, можуть бути одержані відповідно до Схем А - С, приведених нижче. Фахівці в даній галузі техніки визнають, що певні сполуки більш вигідно одержувати відповідно до однієї схеми в порівнянні з іншою. Крім того, послідовності синтезу, описані в патентній заявці US 10/690,115 включені в дану заявку шляхом посилання та можуть бути використані для одержання сполук за даним винаходом. Фахівець в даній галузі техніки визнає, що сполуки Формули (І), в яких 1 2 R R Nявляє собою морфолініл, 4фторпіперидиніл, тіоморфолініл або 2гідроксиметил-морфолін-4-іл, є сполуками за даним винаходом. Схема А Посилаючись на Схему А, аміни формули (X), в яких PG являє собою циклопропіл або прийнятну захисну групу, таку як бензил або третбутилкарбамоїл (Вос), можуть бути сполучені з бензойними кислотами формули (XI), або за допомогою активації кислоти до хлорангідриду кислоти чи фторангідриду кислоти, з наступною реак цією з аміном, або безпосередньо в умовах пептидного сполучення, таких як 1,1'-карбонілдіімідазол (CDI) або гідрохлорид 1-(3-диметиламінопропіл)-3етилкарбодііміду (EDC)/1-гідроксибензотриазол (HOBt). Переважно, реакції проводять з EDC/HOBt в присутності 4-(диметиламіно)піридину (DMAP), в розчиннику, такому як СН2Сl2. Бензальдегіди фор 11 96424 мули (XII) потім можуть бути піддані реакції з від1 2 1 2 повідними амінами R NR H (де R NR H являє собою морфолін, 4-фторпіперидин, тіоморфолін або морфолін-2-іл-метанол) в умовах відновного амінування з одержанням бензил амінів (XIII). Прийнятні відновники включають NaCNBH3 або NaB(OAc)3H в розчиннику, такому як метанол або дихлоретан. Переважні умови включають NaB(OAc)3H в метанолі. Захисна група "PG" потім може бути видалена в стандартних умовах депротектування з одержанням амінів формули (XIV). 12 Коли PG являє собою Вос, депротектування може бути проведене, використовуючи НСI в 1,4-діоксані або трифтороцтову кислоту (TFA) в СН2Сl2. Аміни (XV) перетворюють на відповідні циклопропіл аміни Формули (І) за допомогою реакції з [(1метоксициклопропіл)окси]триметилсиланом або [(1-етоксициклопропіл)окси]триметилсиланом в умовах, подібних описаним у J. Med. Chem. 2004, 47(11), 2733-2738 та Tetrahedron Lett. 1995, 36(41), 7399-7402. Схема В Альтернативно, сполуки за даним винаходом можуть бутиодержані, як наведено на Схемах В та С. Для цього захищений гетероцикл (X), де PG є таким, як визначено вище, може бути підданий реакції з [(1-метоксициклопропіл)окси]триметилсиланом або [(1етоксициклопропіл)окси]триметилсиланом, як описано в J. Med. Chem. 2004, 47(11), 2733-2738 та Tetrahedron Lett. 1995, 36(41), 7399-7402. Переважно, PG являє собою Вое групу. Група "PG" потім може бути видалена в стандартних умовах депротектування з одержанням циклопропіл амінів формули (XVI). Коли PG являє собою Вос, переважні умови включають суміш НСI в розчиннику, такому як 1,4-діоксан. Схема С Кислоти формули (XI) можуть бути сполучені (за допомогою активації або безпосередньо, як описано на Схемі А) з амінами (XVI) з одержанням амідів (XVII). Відновне амінування з відповідним аміном, як описано на Схемі А, надає сполуки Формули (І). Сполуки за даним винаходом можуть бути перетворені на їх відповідні солі, використовуючи способи, відомі фахівцю в даній галузі техніки. Наприклад, вільні основні форми сполук за даним винаходом можуть бути оброблені TFA, НСI або лимонною кислотою в розчиннику, такому як метанол (МеОН) або етанол (ЕtOН), з одержанням відповідних сольових форм. Сполуки, одержані відповідно до схем, описаних вище, можуть бути отримані у вигляді окремих енантіомерів або діастереомерів, або у вигляді рацемічних сумішей або сумішей енантіомерів чи діастереомерів. У випадку, коли одержують такі суміші, ізомери можуть бути розділені, використо вуючи стандартні способи, такі як хроматографія або кристалізація. Коли одержують рацемічні (1:1) та нерацемічні (не 1:1) суміші енантіомерів, окремі енантіомери можуть бути виділені, використовуючи стандартні способи розділення, відомі фахівцю в дані галузі техніки. Особливо корисні способи розділення можуть включати хіральну хроматографію, перекристалізацію, розщеплення, утворення дістереомерних солей або дериватизацію в діастереомерні адукти з наступним розділенням. Даний винахід включає в свої межі проліки сполук за даним винаходом. Взагалі, такі проліки будуть функціональними похідними сполук, які легко перетворюються in vivo на потрібну сполуку. Таким чином, в способах лікування за даним винаходом термін "введення" включає лікування різних описаних розладів сполукою за даним винаходом або сполукою, яка перетворюється на сполуку за даним винаходом in vivo після введення пацієнту. Традиційні методики виділення та одержання при 13 йнятних пролікарських похідних описані, наприклад, в "Design of Prodrugs", ed. H. Bundgaard, Elsevier, 1985. На додаток до солей, винахід забезпечує ефіри, аміди та інші захищені або дериватизовані форми описаних сполук. Для терапевтичного використання, солі сполук за даним винаходом є солями, які є фармацевтично прийнятними. Проте, солі кислот та основ, які не є фармацевтично прийнятними, також можуть знайти використання, наприклад, при одержанні або очищенні фармацевтично прийнятної сполуки. Всі солі, як фармацевтично прийнятні, так і ні, включені в межі даного винаходу. Фармацевтично прийнятні солі сполук за даним винаходом відносяться до тих сольових форм сполук за даним винаходом, які будуть очевидні для фармацевтичного хіміка, тобто, тих, які є нетоксичними та які будуть сприятливо впливали на фармакокінетичні властивості зазначених сполук за даним винаходом, такі як достатня смакова привабливість, абсорбція, поширення, метаболізм та виділення. Іншими факторами, більш практичними по природі, які також важливі при виділенні, є вартість сировини, легкість кристалізації, вихід, стабільність, гігроскопічність та текучість одержаних масових ліків. Приклади кислот, які можуть бути використані при одержанні фармацевтично прийнятних солей, включають наступні: оцтову кислоту, 2,2дихлороцтову кислоту, ацильовані амінокислоти, адипінову кислоту, альгінову кислоту, аскорбінову кислоту, L-аспарагінову кислоту, бензолсульфонову кислоту, бензойну кислоту, 4ацетамідобензойну кислоту, борну кислоту, (+)камфорну кислоту, камфорсульфонову кислоту, (+)-(1S)-камфор-10-сульфонову кислоту, капринову кислоту, капронову кислоту, каприлову кислоту, цинамінову кислоту, лимонну кислоту, цикламінову кислоту, циклогексансульфамінову кислоту, додецилсірчану кислоту, етан-1,2-дисульфонову кислоту, етансульфонову кислоту, 2-гідроксіетансульфонову кислоту, мурашину кислоту, фумарову кислоту, галактарову кислоту, гентизинову кислоту, глюкогептонову кислоту, D-глюконову кислоту, D-глюкуронову кислоту, L-глутамінову кислоту, α-оксо-глутарову кислоту, гліколеву кислоту, гіпурову кислоту, бромистоводневу кислоту, соляну кислоту, йодоводневу кислоту, (+)-Lмолочну кислоту, (±)-DL-молочну кислоту, лактобіонову кислоту, лауринову кислоту, малеїнову кислоту, (-)-L-яблучну кислоту, малонову кислоту, (±)DL-мигдальну кислоту, метансульфонову кислоту, нафталін-2-сульфонову кислоту, нафталін-1,5дисульфонову кислоту, 1-гідрокси-2-нафтойну кислоту, нікотинову кислоту, азотну кислоту, олеїнову кислоту, оротову кислоту, щавлеву кислоту, пальмітинову кислоту, памову кислоту, перхлорну кислоту, фосфорну кислоту, L-піроглутамінову кислоту, цукрову кислоту, саліцилову кислоту, 4саліцилову кислоту, себацинову кислоту, стеаринову кислоту, бурштинову кислоту, сірчану кислоту, дубильну кислоту, (+)-L-винну кислоту, тіоціанову кислоту, р-толуолсульфонову кислоту, ундециленову кислоту та валеріанову кислоту. 96424 14 Сполуки за даним винаходом, що містить кислотні протони, можуть бути перетворені на їх терапевтично активні нетоксичні адитивні сольові форми з металами або амінами обробкою відповідними органічними та неорганічними основами. Відповідні основні сольові форми включають, наприклад, солі амонію; солі лужних та лужноземельних металів (наприклад, солі літію, натрію, калію, магнію, кальцію, які можуть бути одержані обробкою, наприклад, гідроксидом магнію, гідроксидом кальцію, гідроксидом калію, гідроксидом цинку або гідроксидом натрію); та амінні солі, одержані з органічними основами (наприклад, первинними, вторинними та третинними аліфатичними та ароматичними амінами, такими як L-аргінін, бенетамін, бензатин, холін, деанол, діетаноламін, діетиламін, диметиламін, дипропіламін, діізопропіламін, 2-(діетиламіно)-етанол, етаноламін, етиламін, етилендіамін, ізопропіламін, N-метилглюкамін, гідрабамін, 1Н-імідазол, L-лізин, морфолін, 4-(2-гідроксіетил)-морфолін, метиламін, піперидин, піперазин, пропіламін, піролідин, 1-(2гідроксіетил)-піролідин, піридин, хінуклідин, хінолін, ізохінолін, вторинні аміни, триетаноламін, триметиламін, триетиламін, N-метил-О-глюкамін, 2-аміно-2-(гідроксиметил)-1,3-пропандіол та трометамін). Див., наприклад, S.M. Berge, et al., "Pharmaceutical Salts", J. Pharm. Sci., 1977, 66:1-19, та Handbook of Pharmaceutical Salts, Propertions, Selection, and Use; Stahl, P.H., Wermuth, C.G., Eds.; Wiley-VCH and VHCA: Zurich, 2002, які включені в дану заявку шляхом посилання. Сполуки за даним винаходом являют собою модулятори Н3 рецептора гістаміну, та, як такі, сполуки корисні при лікуванні хворобливих станів, опосередкованих активністю Н3 рецептора гістаміну. Таким чином, сполуки за даним винаходом можуть бути використані в способі лікування суб'єкта, який страждає від або в якого діагностовано хворобу, опосередковану активністю Н3 рецептора гістаміну, який включає введення суб'єкту, що потребує такого лікування, ефективної кількості сполуки за даним винаходом або її фармацевтично прийнятної солі. Особливо, сполуки можуть бути використані в способах лікування або попередження неврологічних або психоневрологічних розладів, включаючи розлади сон/неспання та пробудження/пильнування (наприклад безсоння та порушення добового ритму організму), синдром дефіциту уваги з гіперактивністю (ADHD), розлади навчання та пам'яті, когнітивну дисфункцію, мігрень, нейрогенне запалення, слабоумство, помірне когнітивне погіршення (передслабоумство), хворобу Альцгеймера, епілепсію, нарколепсію з або без супутньої катаплексії, катаплексію, гомеостазні розлади сон/неспання, ідіопатичну сонливість, надмірну денну сонливість (EDS), розлади циркадного ритму, розлади сну/утомленості, утомленість, дрімоту, пов'язану з апное уві сні, погіршення сну внаслідок періменопаузних гормональних зсувів, утомленість, пов'язану з хворобою Паркінсона, утомленість, пов'язану з MS, утомленість, пов'язану з депресією, утомленість, викликану хіміотерапією, розлади харчової поведінки, ожиріння, морську хворобу, запаморочення, ши 15 зофренію, зловживання алкоголем, біполярні розлади, маніакальні розлади та депресію, а також інші розлади, в які залучений Н3 рецептор гістаміну, такі як алергічна реакція верхніх дихальних шляхів, астма, сверблячка, закупорка носового каналу та алергічний риніт, у суб'єкта, що цього потребує. Наприклад, винахід розкриває способи попередження, інгібування розвитку або лікування алергічної реакції верхніх дихальних шляхів, астми, сверблячки, закупорки носового каналу та алергічного риніту. Надмірна денна сонливість (EDS) може відбуватися з або без супутніх апное уві сні, позмінного режиму роботи, фіброміалгії, MS та подібних. Сполуки за даним винаходом можуть бути використані в способах лікування або попередження хворобливих станів, вибраних з групи, що включає: когнітивні розлади, розлади сну, психіатричні розлади та інші розлади. Когнітивні розлади включають, наприклад, слабоумство, хворобу Альцгеймера (Panula, P. et al., Soc. Neurosci. Abstr. 1995, 21, 1977), когнітивну дисфункцію, помірне когнітивне погіршення (передслабоумство), синдром дефіциту уваги з гіперактивністю (ADHD), розлади дефіциту уваги та розлади навчання та пам'яті (Barnes, J.C. et al., Soc. Neurosci. Abstr. 1993, 19, 1813). Розлади навчання та пам'яті включають, наприклад, погіршення здатності до навчання, погіршення пам'яті, когнітивне погіршення, пов'язане з віком, та втрату пам'яті. Було показано, що антагоністи Н3 покращують пам'ять в різних тестах на пам'ять, включаючи піднятий хрестоподібний лабіринт у мишей (Miyazaki, S. et al. Life Sci. 1995, 57(23), 2137-2144), двопробну задачу розпізнавання місця (Orsetti, M. et al. Behav. Brain Res. 2001, 124(2), 235-242), пасивне дослідження реакції на уникнення у мишей (Miyazaki, S. et al. Meth. Find. Exp. Clin. Pharmacol. 1995, 17(10), 653-658) та радіальний лабіринт у щурів (Chen, Z. Ada Pharmacol. Sin. 2000, 21(10), 905-910). Також, було показано, що антагоністи Н3 покращують пам'ять у щура з мимовільною гіпертензією, тваринна модель для дослідження здатності до навчання при розладах дефіциту уваги (Fox, G.B. et al. Behav. Brain Res. 2002, 131(1-2), 151-161). Розлади сну включають, наприклад, безсоння, порушений сон, нарколепсію (з або без супутньої катаплексії), катаплексію, гомеостазні розлади сон/неспання, ідіопатичну сонливість, надмірну денну сонливість (EDS), розлади циркадного ритму, утомленість, летаргію, розлад поведінки REM та порушення добового ритму організму. Утомленість та/або погіршення сну можуть бути викликані або пов'язані з різними джерелами, такими як, наприклад, апное уві сні, періменопаузні гормональні зсуви, хвороба Паркінсона, розсіяний склероз (MS), депресія, хіміотерапія або позмінний режим роботи. Психіатричні розлади включають, наприклад, шизофренію (Schlicker, E. and Marr, I., NaunynSchmiedeberg's Arch. Pharmacol. 1996, 353, 290294), біполярні розлади, маніакальні розлади, депресію (Lamberti, С. et al. Br. J. Pharmacol. 1998, 123(7), 1331-1336; Perez-Garcia, C. et al. 96424 16 Psychopharmacology 1999, 142(2), 215-220) (Також див.: Stark, Η. et al., Drugs Future 1996, 21(5), 507520; and Leurs, R. et al., Prog. Drug Res. 1995, 45, 107-165 та посилання, процитовані в даній статті), обсесивно-компульсивний розлад та посттравматичний стресовий розлад. Інші розлади включають, наприклад, хворобу руху, запаморочення (включаючи запаморочення та постуральне запаморочення в легкій формі), дзвін у вухах, епілепсію (Yokoyama, Η. et al., Eur. J. Pharmacol. 1993, 234, 129-133), мігрень, нейрогенне запалення, розлади харчової поведінки (Machidori, Η. et al., Brain Res. 1992, 590, 180-186), ожиріння, зловживання алкоголем, розлади руху (наприклад, синдром втомлених ніг) та розлади, пов'язані з очами (наприклад, дегенерація жовтої плями та пігментна дегенерація сітківки). Зазначені способи лікування та попередження включають стадію введення ссавцю, що цього потребує, ефективної кількості, принаймні, однієї сполуки за даним винаходом. Даний винахід також включає спосіб лікування або попередження хвороби або стану, опосередкованих гістаміном, за допомогою комбінаційної терапії для лікування алергічного риніту, закупорки носового каналу та алергічного застою, який включає: а) введення ефективної кількості, принаймні, однієї сполуки за даним винаходом, та b) введення ефективної кількості одного або більше антагоністів Н1 або Н2 гістаміну. Прийнятні антагоністи Ні гістаміну включають: лоратидин (CLARITIN™), дезлоратидин (CLARINEX™), фексофенадин (ALLEGRA™) та цетирицин (ZYRTEC™). Даний винахід також включає спосіб лікування або попередження хвороби або стану, опосередкованих гістаміном, за допомогою комбінаційної терапії для лікування депресії, розладів настрою або шизофренії, який включає: а) введення ефективної кількості, принаймні, однієї сполуки за даним винаходом, та b) введення ефективної кількості одного або більше блокаторів повторного поглинання нейротрансмітерів. Прийнятні блокатори повторного поглинання нейротрансмітерів включають: селективні інгібітори повторного поглинання серотоніну (SSRI), інгібітори повторного поглинання серотоніну-норадреналіну, норадренергічні інгібітори повторного поглинання, неселективні інгібітори повторного поглинання серотоніну, допаміну або норадреналіну. Конкретні приклади блокаторів повторного поглинання нейротрансмітерів включають флуоксетин (PROZAC™), сертралін (ZOLOFT™), пароксетин (PAXIL™) та амітриптилін. Даний винахід також включає спосіб лікування або попередження хвороби або стану, опосередкованих гістаміном, за допомогою комбінаційної терапії для лікування нарколепсії, надмірної денної сонливості (EDS), хвороби Альцгеймера, депресії, розладу дефіциту уваги, утомленості, пов'язаної з MS, стану "сп'яніння" після анестезії, когнітивного погіршення, шизофренії, спастичності, пов'язаної з церебральним паралічем, когнітивного погіршення, пов'язаного з віком, ідіопатичної сонливості або порушення добового ритму організму, який включає: а) введення ефективної кількості, 17 принаймні, однієї сполуки за даним винаходом, та b) введення ефективної кількості модафінілу. В іншому втіленні, даний винахід включає спосіб лікування або попередження хвороби або стану, опосередкованих гістаміном, за допомогою комбінаційної терапії, який включає: а) введення ефективної кількості, принаймні, однієї сполуки за даним винаходом, та Ь) введення ефективної кількості топірамату (Тораmах). Зокрема, такі способи корисні для лікування ожиріння. Переважно, в комбінаційному способі використовують дози топірамату в діапазоні приблизно від 20 до 300 мг на дозу. Сполуки за даним винаходом можуть бути введені у фармацевтичних композиціях для лікування розладів, опосередкованих Н3 рецептором, у пацієнтів (людей та інших ссавців). Таким чином, винахід розкриває фармацевтичні композиції, що містять, принаймні, одну сполуку за даним винаходом та фармацевтично прийнятний носій. Композиція за винаходом може, крім того, містити, принаймні, один інший терапевтичний агент, такий як антагоністи Н1, SSRI, топірамат або модафініл (наприклад, комбінаційний препарат або комбінація по-різному виготовлених активних агентів для використання в способі комбінаційної терапії). Даний винахід також розкриває способи використання або одержання чи виготовлення таких фармацевтичних композицій. Фармацевтичні композиції можуть бути одержані, використовуючи традиційні фармацевтичні ексципієнти та методики складання суміші, відомі фахівцю в галузі одержання дозованих форм. Передбачають, що сполуки за винаходом можуть бути введені пероральним, парентеральним, ректальним, місцевим або окулярним шляхом, або за допомогою інгаляції. Препарати також можуть бути призначені для надання повільного вивільнення активного інгредієнта. Препарат може бути виготовлений у формі таблеток, капсул, саше, ампул, порошків, гранул, пастилок, порошків для розведення, рідких препаратів або супориторіїв. Переважно, сполуки можуть бути введені за допомогою внутрішньовенного вливання або місцевого введення, але більш переважно за допомогою перорального введення. Для перорального введення сполуки за винаходом можуть бути забезпечені у формі таблеток або капсул, або у вигляді розчину, емульсії або суспензії. Таблетки для перорального використання можуть включати активний інгредієнт, змішаний з фармацевтично прийнятними ексципієнтами, такими як інертні розріджувачі, агенти дезинтеграції, зв'язуючі агенти, змазуючі агенти, підсолоджуючі агенти, ароматизатори, барвники та консерванти. Прийнятні інертні розріджувачі включають карбонат натрію та кальцію, фосфат натрію та кальцію, лактозу, крохмаль, цукор, глюкозу, метил целюлозу, стеарат магнію, маніт, сорбіт та подібні; типові рідкі пероральні ексципієнти включають етанол, гліцерин, воду та подібні. Крохмаль, полівініл-піролідон, натрію крохмалю гліколат, мікрокристалічна целюлоза та альгінова кислота є прийнятними агентами дезінтеграції. Зв'язуючі агенти можуть включати крохмаль та желатин. Змазую 96424 18 чий агент, якщо присутній, звичайно являє собою стеарат магнію, стеаринову кислоту або тальк. Якщо бажано, таблетки можуть бути покриті речовиною, такою як гліцерил моностеарат або гліцерил дистеарат, щоб затримати абсорбцію в шлунково-кишковому тракті, або можуть бути покриті кишковою оболонкою. Капсули для перорального використання включають тверді желатинові капсули, в яких активний інгредієнт змішаний з твердим, напівтвердим або рідким розріджувачем, та м'які желатинові капсули, в яких активний інгредієнт змішаний з водою або маслом, таким як арахісова олія, оливкова олія, рідкий парафін, суміш монота ди-гліцеридів жирних кислот з коротким ланцюгом, поліетиленгліколь 400 або поліпропіленгліколь. Рідкі препарати для перорального введення можуть бути суспензіями, розчинами, емульсіями чи сиропами або можуть бути представлені у вигляді сухого продукту для розведення водою або іншими прийнятними засобами перед використанням. Композиції таких рідких препаратів можуть містити фармацевтично прийнятні ексципієнти, такі як суспендуючі агенти (наприклад, сорбіт, метил целюлоза, альгінат натрію, желатин, гідроксіетилцелюлоза, карбоксиметилцелюлоза, гель стеарату алюмінію та подібні); неводні засоби, які включають масла (наприклад, мигдалеву олію або фракціоновану кокосову олію), пропіленгліколь, етиловий спирт або воду; консерванти (наприклад, метил або пропіл р-гідроксибензоат або сорбінова кислота); речовини, що змочують, такі як лецитин; та, якщо потрібно, ароматизатори або барвники. Сполуки за даним винаходом також можуть бути введені непероральними шляхами. Композиції можуть бути виготовлені у вигляді супозиторію для ректального введення. Для парентерального використання, включаючи внутрішньовенний, внутрішньом'язовий, інтраперітонеальний або підшкірний шлях, сполуки за винаходом загалом будуть надані в вигляді стерильних водних розчинів або суспензій, буферизованих до відповідного рН та ізотонічності, або в парентерально прийнятному маслі. Прийнятні водні засоби включають розчин Рінгера та ізотонічний хлорид натрію. Такі форми будуть представлені у формі одиничного дозування, такій як ампули або доступні пристрої для ін'єкцій, у мультидозованих формах, таких як пляшечки, з яких може бути відібрана відповідна доза, або в твердій формі чи в попередньо концентрованій формі, яка може бути використана для приготування препарату для ін'єкції. Іншим способом використання сполук за винаходом може бути застосування препарату у форму пластиру, призначеного для трансдермальної доставки. Сполуки за даним винаходом також можуть бути введені за допомогою інгаляції, назальним або пероральним шляхом, використовуючи препарат у формі спрею, що містить сполуку за винаходом та прийнятний носій. З рівня техніки відомі способи визначення ефективних доз для терапевтичних (лікування) та профілактичних (попередження) цілей для фармацевтичних композицій або лікарських комбінацій за даним винаходом, виготовлених в єдиній або 19 окремих композиціях. Конкретний рівень дозування, що необхідний для будь-якого конкретного пацієнта, буде залежати від цілого ряду чинників, включаючи серйозність стану, що лікують, шлях введення, швидкість метаболізму та вагу пацієнта. Для терапевтичних цілей, "ефективна доза" або "ефективна кількість" відноситься до тієї кількості кожної активної сполуки або фармацевтичного агента, самого по собі або в комбінації, яка викликає біологічну або лікарську реакцію в тканинній системі, тварині або людині, яку шукає дослідник, ветеринар, медичний лікар або інший клінічний лікар, яка включає полегшення симптомів хвороби або розладу, які лікують. Для профілактичних цілей (тобто, попередження або інгібування початку чи розвитку розладу) термін "ефективна доза" або "ефективна кількість" відноситься до тієї кількості кожної активної сполуки або фармацевтичного агента, самого по собі або в комбінації, яка інгібує у суб'єкта початок або розвиток розладу, яку шукає дослідник, ветеринар, медичний лікар або інший клінічний лікар, затримка цього розладу опосередкована, принаймні частково, модуляцією Н3 рецептора гістаміну. Способи комбінаційної терапії включають спільне введення одного препарату, що містить всі активні агенти; по суті одночасне введення більше, ніж одного препарату; та введення двох або більше активних агентів, виготовлених окремо. Передбачають, що денна доза (введена як єдина доза або як розділені дози) буде знаходитися в діапазоні від 0,01 до 1000 мг на день, більш звичайно від 1 до 500 мг на день та найбільш звичайно від 10 до 200 мг на день. Виражена як дозування за одиницю ваги тіла, очікують, що типова доза складає від 0,0001 мг/кг до 15 мг/кг, особливо від 0,01 мг/кг до 7 мг/кг, та найбільш особливо від 0,15 мг/кг до 2,5 мг/кг. Переважно, дози для перорального введення знаходяться в діапазоні від приблизно 0,05 до 200 мг/кг щоденно, взяті в 1 - 4 окремих дозах. Деякі сполуки за винаходом можуть бути перорально дозовані в діапазоні від приблизно 0,05 до приблизно 50 мг/кг щоденно, інші можуть бути дозовані від 0,05 до приблизно 20 мг/кг щоденно, тоді як ще інші можуть бути дозовані від 0,1 до приблизно 10 мг/кг щоденно. Дози для вливання можуть знаходитися в діапазоні від приблизно 1 до 1000 мкг/кг/хв інгібітору, змішаного з фармацевтичним носієм протягом періоду від декількох хвилин до декількох днів. Для місцевого введення сполуки за даним винаходом можуть бути змішані з фармацевтичним носієм з концентрацією від приблизно 0,1 % до приблизно 10 % лікарського засобу до наповнювача. Приклади З метою ілюстрації винаходу включено наступні приклади. Дані приклади не обмежують винахід. Мається на увазі, що вони пропонують спосіб здійснення винаходу. Кваліфіковані фахівці в даній галузі техніки можуть знайти інші способи здійснення винаходу, які будуть їм очевидні. Проте, вважається, що ці способи включені в межі даного винаходу. 96424 20 Хімічні приклади та дані: Мас-спектри були отримані на Agilent серії 1100 MSD, використовуючи електророзпилювальну іонізацію (ESI) або в позитивному, або в негативному стані, як вказано. Спектри ядерного магнітного резонансу (ЯМР) були отримані на спектрометрі Bruker модель DPX400 (400 МГц), 1 DPX500 (500 МГц) або DPX600 (600 МГц). Дані Н ЯМР наведено у такому форматі: хімічний зсув в м.ч. відносно області тетраметилсилану (мультиплетність, коефіцієнт зв'язку J в Гц, інтеграція). Обернено-фазову високоефективну рідинну хроматографію (ВЕРХ) проводили на Hewlett Packard HPLC, колонка Zorbax Eclipse XDB-C8, 5 мкм, 4,6 × 150 мм, з градієнтом від 1 до 99 % ацетонітрил/вода/0,05 % TFA протягом 8 хв. Хімічні назви одержували, використовуючи ChemDraw Ultra 6.0.2 (CambridgeSoft Corp., Cambridge, MA). Приклад 1; (4-Циклопропіл-піперазин-1-іл)-(4морфолін-4-ілметил-феніл)-метанон. Стадія А. трет-Бутиловий ефір 4-(4-формілбензоїл)-піперазин-1-карбонової кислоти. Суспензію 4-карбоксибензальдегіда (3,10 г) в СН2СІ2 послідовно обробляли трет-бутиловим ефіром піперазин-1-карбонової кислоти (3,6 г), EDC (3,86 г), HOBt (2,68 г) та DMAP (-0,020 г). Через 18 год суміш екстрагували 1 N NaOH та потім 1 N НСI. Органічний шар сушили (Na2SO4) та концентрували, одержуючи зазначену у заголовку сполуку (5,11 г, 78 %). MS (ESI): маса, розрах. для C17H22N2O4, + 1 318,16; m/z знайдений, 219,3 [(М-100)+Н] . Н ЯМР (CDCI3): 10,04 (s, 1Н), 7,93 (d, J = 8,2, 2H), 7,54 (d, J = 8,1, 2H), 3,82 - 3,67 (m, 2H), 3,58 - 3,30 (m, 6H), 1,46 (s, 9H). Стадія В. трет-Бутиловий ефір 4-(4-морфолін4-ілметил-бензоїл)-піперазин-1-карбонової кислоти. Розчин трет-бутилового ефіру 4-(4-формілбензоїл)-піперазин-1-карбонової кислоти (2,06 г) в метанолі (100 мл) обробляли морфоліном (4 мл) та NaB(OAc)3H (6,98 г, порціями протягом 1 год). Через З год суміш розбавляли насич. водн. NaHCO3 та екстрагували СН2Сl2. Органічний шар сушили (Na2SO4) та концентрували. Залишок очищали за допомогою колоночної хроматографії (SiO2), одержуючи зазначену у заголовку сполуку (1,22 г, 48 %). MS (ESI): маса, розрах. для + C21H31N3O4, 389,23; m/z знайдений, 390,4 [М+Н] . 1 H ЯМР (CDCI3): 7,39-7,33 (m, 4Н), 3,75-3,66 (m, 21 6Н), 3,50 (s, 2Н), 3,51 - 3,33 (m, 6H), 2,45 - 2,41 (m, 4H), 1,46 (s, 9H). Стадія С. (4-Морфолін-4-ілметил-феніл)піперазин-1-іл-метанон. Розчин трет-бутилового ефіру 4-(4-морфолін-4-ілметил-бензоїл)-піперазин1-карбонової кислоти (1,163 г) в СН2Сl2 (10 мл) обробляли TFA (~4 мл). Через 30 хв додавали додатковий TFA (5 мл) та суміш перемішували протягом додаткових 2 год. Суміш розбавляли насич. водн. NaHCO3 та екстрагували СН2Сl2. Органічний шар сушили (Na2SO4) та концентрували. Залишок очищали за допомогою колоночної хроматографії (SiO2), одержуючи зазначену у заголовку сполуку (0,255 г, 30 %). MS (ESI): маса, розрах. для C16H23N3O2, 289,18; m/z знайдений, 290,4 + 1 [М+Н] . Н ЯМР (CDCI3): 7,41-7,35 (m, 4H), 3,95 3,70 (m, 6H), 3,52 (s, 2H), 3,09 - 2,80 (m, 6Н), 2,49 2,42 (m, 4H). Стадія D. Розчин (4-морфолін-4-ілметилфеніл)-піперазин-1-іл-метанону (0,128 г) в метанолі (7,5 мл) обробляли (і-етокси-циклопропокси)триметил-силаном (1,5 мл), оцтовою кислотою (0,2 мл) та NaBH3CN (~400 мг). Суміш нагрівали при 60 °С протягом 18 год та потім охолоджували до кт та концентрували. Залишок розбавляли 1N NaOH та екстрагували СН2Сl2. Органічний шар сушили (Na2SO4) та концентрували. Залишок очищали за допомогою колоночної хроматографії (SiO2), одержуючи зазначену у заголовку сполуку (0,0548 г, 38 %). MS (ESI): маса, розрах. для C19H27N3O2, + 1 329,21; m/z знайдений, 330,4 [М+Н] . Н ЯМР (CDCI3): 7,36 (s, 4H), 3,79 - 3,68 (m, 6H), 3,50 (s, 2H), 3,44 - 3,32 (m, 2H), 2,74 - 2,61 (m, 2H), 2,60 2,50 (s, 2H), 2,45 - 2,40 (m, 4Н), 1,66 - 1,62 (m, 1Н), 0,49 - 0,44 (m, 2H), 0,44 - 0,39 (m, 2H). Альтернативне одержання Прикладу 1. Стадія А. трет-Бутил 4-циклопропілпіперазин1-карбоксилат. Суміш трет-бутил. піперазин-1карбоксилату (75,0 г), тетрагідрофурану (THF) (500 мл), метанолу (500 мл), [(1етоксициклопропіл)окси]триметилсилану (161 мл), NaBH3CN (38,0 г) та оцтової кислоти (37 мл) нагрівали при 60 °С протягом 5 год. Суміш охолоджували до кт, обробляли водою (30 мл) та перемішували протягом 5 хв. Суміш потім обробляли 1 N NaOH (130 мл) та потім перемішували протягом 15 хв. Суміш концентрували та залишковий водний розчин екстрагували СН2Сl2 (500 мл). Органічний шар промивали 1 N NaOH (500 мл). Об'єднані водні шари екстрагували СН2Сl2 (150 мл). Об'єднані органічні шари промивали сольовим розчином (400 мл), сушили (Na2SO4) та концентрували, одержуючи зазначену у заголовку сполуку у вигляді білої твердої речовини (92 г, 100 %). MS (ESI): маса, розрах. для C12H22N2O2, 226,17; m/z знайде+ 1 ний, 227,2 [М+H ]. Н ЯМР (400 МГц, CDCI3): 3,39 (t, J = 5,0 Гц, 4Н), 2,55 (t, J = 4,9 Гц, 4H), 1,60 (ddd, 96424 22 J = 10,3, 6,5, 3,8 Гц, 1H), 1,46 (s, 9H), 0,49-0,38 (m, 4H). Стадія В. Дигідрохлорид 1циклопропілпіперазину. Розчин трет-бутил 4циклопропілпіперазин-1-карбоксилату (92 г) в 1,4діоксані (200 мл) обробляли НСI (4M в 1,4-діоксані, 500 мл) протягом 10 хв, одночасно підтримуючи температуру нижче 40 °С. Після завершення додавання, суміш нагрівали при 45 °С протягом 9 год та потім охолоджували до кт. Густу суспензію розбавляли гексанами (400 мл) та охолоджували до 10 °С. Одержану тверду речовину збирали фільтруванням, промивали гексанами та сушили, одержуючи зазначену у заголовку сполуку у вигляді білої твердої речовини (78 г, 96%). MS (ESI): маса, розрах. для C7H14N2, 126,12; m/z знайдений, 127,0 + 1 [М+Н ]. H ЯМР (400 МГц, D2O): 3,65 (br t, J = 4,7 Гц, 4Н), 3,47 (br t, J = 5,5 Гц, 4Н), 2,85 (br quintet, J = 5,8 Гц, 1H), 0,94 (br s, 2H), 0,92 (br s, 2H). Стадія С. 4-(4-Циклопропіл-піперазин-1карбоніл)-бензальдегід. Суміш 4-форміл-бензойної кислоти (54,4 г), толуолу (500 мл), Ν,Νдиметилформаміду (DMF) (3,6 мл) та тіоніл хлориду (30,4 мл) нагрівали при 60 °С протягом 2 год та потім охолоджували до 5 °С. В окремій колбі охолоджену до 5 °С суміш NaOH (50,7 г), води (550 мл) та толуолу (150 мл) обробляли порціями дигідрохлоридом 1-циклопропіл-піперазину (70,0 г), одночасно підтримуючи температуру нижче 10 °С. Після завершення додавання суміш охолоджували до 5 °С та обробляли розчином неочищеного ацил хлориду, отриманого, як описано вище, з такою швидкістю, що температура не перевищує 10 °С. Після завершення додавання суміш залишали нагріватися до кт та перемішували протягом ночі. Двофазну суміш підлужували до рН ~10 1 N NaOH (300 мл). Шари розділяли та водний шар екстрагували толуолом (100 мл × 2). Об'єднані органічні шари промивали сольовим розчином (200 мл), сушили (Na2SO4) та концентрували, одержуючи зазначену у заголовку сполуку у вигляді блідожовтого в'язкого масла (56,0 г, 62%). ВЕРХ: RT = 5,19 хв. MS (ESI): маса, розрах. для C15H18N2O2, + 1 258,14; m/z знайдений, 258,9 [М+H ]. Н ЯМР (400 МГц, CDCI3): 10,1 (s, 1Н), 7,94 (псевдо d, J = 8,2 Гц, 2Н), 7,56 (псевдо d, J = 8,1 Гц, 2H), 3,77 (br s, 2H), 3,33 (br s, 2H), 2,71 (br s, 2H), 2,55 (br s, 2H), 1,66 (ddd, J = 10,2, 6,6, 3,7 Гц, 1H), 0,52 - 0,46 (m, 2H), 0,45 - 0,40 (br s, 2H). Стадія D. (4-Циклопропіл-піперазин-1-іл)-(4морфолін-4-ілметил-феніл)-метанон. До розчину 4-(4-циклопропіл-піперазин-1-карбоніл)бензальдегіду (56,0 г) в 1,2-дихлоретані (550 мл) по краплям додавали морфолін (37,8 мл) протягом 5 хв. Суміш охолоджували до 10 °С та обробляли порціями NaB(OAc)3H (64,3 г) протягом 1 год. Че 23 рез додаткових 2 год суміш нагрівали до кт та використовували водяну баню для підтримання температури нижче 20 °С. Через 18 год додавали воду (60 мл), одночасно зберігаючи температуру нижче 20 °С за допомогою додавання невеликих кількостей льоду. Через 20 хв суміш підлужували до рН ~10 1 N NaOH (450 мл) та суміш перемішували протягом 10 хв. Шари розділяли та органічний шар промивали 1 N NaOH (150 мл). Об'єднані водні шари екстрагували СН2Сl2 (200 мл). Об'єднані органічні шари промивали сольовим розчином (200 мл), сушили (Na2SO4) та концентрували, одержуючи зазначену у заголовку сполуку у вигляді блідо-жовтого в'язкого масла (68,0 г, 95%). ВЕРХ: RT = 4,39 хв. MS (ESI): маса, розрах. Для + C19H27N3O2, 329,21; m/z знайдений, 330,2 [M+H ]. 1 H ЯМР (400 МГц, CDCI3): 7,35 (br s, 4H), 3,73 (br s, 2H), 3,69 (t, J = 4,6 Гц, 4H), 3,50 (s, 2H), 3,37 (br s, 2H), 2,67 (br s, 2H), 2,53 (br s, 2H), 2,43 (t, J = 4,2 Гц, 4Н), 1,63 (ddd, J = 10,3, 6,7, 3,7 Гц, 1H), 0,4913 0,43 (m, 2H), 0,42-0,39 (br s, 2H). C ЯМР (101 МГц, CDCI3): 170,6, 140,0, 135,1, 129,5, 127,5, 67,4, 63,4, 54,0, 38,7, 6,3. Приклад 1Α; Дигідрохлорид (4-циклопропілпіперазин-1-іл)-(4-морфолін-4-ілметил-феніл)метанону. Розчин (4-циклопропіл-піперазин-1-іл)-(4морфолін-4-ілметил-феніл)-метанону (68,0 г) в етанолі (400 мл) нагрівали до 60 °С та по краплям обробляли конц. НСI (37,8 мл) протягом 40 хв. Осад починав утворюватися після того, як було додано -20 мл НСI. Після завершення додавання густу суспензію повільно охолоджували до 20 °С протягом 3 год. Тверду речовину збирали фільтруванням, промивали етанолом та сушили при 50 °С протягом ночі у вакуумній сушильній шафі, одержуючи зазначену у заголовку сполуку у вигляді білої твердої речовини (56,2 г, 68 %). ВЕРХ: RT = 4,30 хв. MS (ESI): маса, розрах. для + C19H27N3O2, 329,21; m/z знайдений, 330,0 [М+Н ]. 1 H ЯМР (400 МГц, D2O): 7,64 (псевдо d, J = 8,3 Гц, 2Н), 7,58 (псевдо d, J = 8,3 Гц, 2Н), 4,44 (br s, 2Н), 4,20-3,10 (m, 16Н), 2,88 (ddd, J = 11,2, 6,6, 4,8 Гц, 13 1Н), 1,03 - 0,98 (m, 4H). С ЯМР (101 МГц, D2O): 172,1, 135,3, 132,2, 130,9, 128,0, 64,0, 60,5, 52,6, 52,4, 51,7, 44,8, 39,7, 39,5, 3,9. Приклад 1В; Цитрат (4-циклопропіл-піперазин1-іл)-(4-морфолін-4-ілметил-феніл)-метанону. Суміш (4-циклопропіл-піперазин-1-іл)-(4морфолін-4-ілметил-феніл)-метанону (0,476 г, 1,45 ммоль) та лимонної кислоти (0,281 г, 1,46 ммоль) розбавляли метанолом (-10 мл). Суміш нагрівали, поки вона стане гомогенною, та потім концентрували. Одержане масло розтирали в порошок з етил ацетатом та отриману тверду речовину під вакуумом, одержуючи цитрат (0,760 г). Сполуки в Прикладах 2-4 були одержані, використовуючи способи, аналогічні описаним в попередніх прикладах, з відповідними змінами замісників. 96424 24 Приклад 2; (4-Циклопропіл-піперазин-1-іл)-[4(4-фтор-піперидин-1-ілметил)-феніл]-метанон. MS (ESI): маса, розрах. для C20H28FN3O, + 1 345,22; m/z знайдений, 346,4 [М+Н ]. Н ЯМР (400 МГц, CDCI3): 7,39 - 7,33 (m, 4Н), 4,78 - 4,58 (m, 1Н), 3,82 - 3,66 (m, 2H), 3,51 (s, 2H), 3,46 - 3,33 (m, 2H), 2,77 - 2,49 (m, 6H), 2,43 - 2,32 (m, 2H), 1,97 - 1,82 (m, 4H), 1,68 - 1,63 (m, 1H), 0,52 - 0,38 (m, 4H). Приклад 2В; Цитрат (4-циклопропіл-піперазин1-іл)-[4-(4-фтор-піперидин-1-ілметил)-феніл]метанону. Приклад 3; (4-Циклопропіл-піперазин-1-іл)-(4тіоморфолін-4-ілметил-феніл)-метанон. MS (ESI): маса, розрах. для C19H27N3OS, + 1 345,19; m/z знайдений, 346 [М+H ]. H ЯМР (400 МГц, CDCI3): 7,37 - 7,32 (m, 4H), 3,86 - 3,60 (bm, 2H), 3,53 (s, 2Н), 3,53 - 3,25 (bm, 2Н), 2,75 - 2,61 (bm, 10Н), 2,61 - 2,45 (bm, 2H), 1,66 - 1,60 (m, 1Н), 0,51 - 0,44 (m, 2H), 0,44 - 0,38 (m, 6H). Приклад 3В; Цитарат (4-циклопропілпіперазин-1-іл)-(4-тіоморфолін-4-ілметил-феніл)метанону. Приклад 4; (4-Циклопропіл-піперазин-1-іл)-[4(2-гідроксиметил-морфолін-4-ілметил)-феніл]метанону. MS (ESI): маса, розрах. для C20H29N3O3, + 1 359,22; m/z знайдений, 360 [М+H ]. Н ЯМР (400 МГц, CDCI3): 7,39 - 7,34 (m, 4Н), 3,93 - 3,87 (m, 1Н), 3,85 - 3,25 (m, 10Н), 2,75 - 2,45 (bm, 6H), 2,25 - 2,15 (m, 1H), 2,05 - 1,93 (m, 2H), 1,67 - 1,60 (m, 1H), 0,52 - 0,45 (m, 2H), 0,45 - 0,40 (m, 2H). Приклад 4В; Цитрат (4-циклопропіл-піперазин1-іл)-[4-(2-гідроксиметил-морфолін-4-ілметил)феніл]-метанону. Порівняльний приклад 1; (4-Ізопропілпіперазин-1-іл)-(4-морфолін-4-ілметил-феніл)метанон. Спосіб одержання та аналітичні дані для зазначеної у заголовку сполуки представлені в патентній заявці US 10/690,115 (21 жовтня 2003 року). Відповідні сольові форми були одержані, як описано в Прикладах 1А та 1В. Порівняльний приклад 1А; Дигідрохлорид (4ізопропіл-піперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанону. 25 Порівняльний приклад 1В; Цитрат (4-ізопропілпіперазин-1-іл)-(4-морфолін-4-ілметил-феніл)метанону. Порівняльний приклад 2; (4-Циклобутилпіперазин-1-іл)-(4-морфолін-4-ілметил-феніл)метанон. Зазначену у заголовку сполуку одержували відповідно до способів, описаних в Прикладі 1. MS (ESI): маса, розрах. для C20H29N3O2, 343,23; m/z + 1 знайдений, 344,4 [М+H ]. H ЯМР (400 МГц, CDCI3): 7,39 - 7,32 (m, 4H), 3,87 - 3,65 (m, 6Н), 3,66 - 3,36 (m, 4Н), 2,80 - 2,69 (m, 1Н), 2,50 - 2,18 (m, 8H), 2,08 - 1,99 (m, 2H), 1,93 - 1,81 (m, 2H), 1,791,61 (m, 2H). Відповідні сольові форми були одержані, як описано для Прикладів 1А та 1В. Порівняльний приклад 2А; Дигідрохлорид (4циклобутил-піперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанону. Порівняльний приклад 2В; Цитрат (4циклобутил-піперазин-1-іл)-(4-морфолін-4-ілметилфеніл)-метанону. Сполуки в Порівняльних прикладах 3 - 6 та їх відповідні сольові форми були одержані, використовуючи способи, аналогічні описаним в попередніх прикладах, з відповідними змінами замісників Порівняльний приклад 3; [4-(4-Фтор-піперидин1-ілметил)-феніл]-(4-ізопропіл-піперазин-1-іл)метанон. MS (ESI): маса, розрах. для C20H30FN3O, + 1 347,24; m/z знайдений, 348,4 [М+Н ]. Н ЯМР (400 МГц, CDCI3): 7,36 - 7,33 (m, 4Н), 4,75 - 4,59 (m, 1Н), 3,84 - 3,71 (m, 2H), 3,50 (s, 2H), 3,49 - 3,38 (m, 2H), 2,71 (heptet, J = 6,6 Гц, 1Н), 2,64 - 2,31 (m, 8H), 1,94 - 1,82 (m, 4H), 1,04 (d, J= 6,3 Гц, 6Н). Порівняльний приклад 3В; Цитрат [4-(4-фторпіперидин-1-ілметил)-феніл]-(4-ізопропілпіперазин-1-іл)-метанону. Порівняльний приклад 4; (4-Циклобутилпіперазин-1-іл)-[4-(4-фтор-піперидин-1-ілметил)феніл]-метанон. 96424 26 MS (ESI): маса, розрах. для C21H30FN3O, + 1 359,24; m/z знайдений, 360,4 [М+Н ]. Н ЯМР (400 МГц, CDCI3): 7,38 - 7,34 (m 4Н), 4,77 - 4,60 (m, 1H), 3,88 - 3,72 (m, 2Н), 3,52 (s, 2Н), 3,51 - 3,37 (m, 2Н), 2,80 - 2,71 (m, 1Н), 2,63 - 2,54 (m, 2H), 2,46 - 2,20 (m, 6H), 2,09 - 2,01 (m, 2H), 1,97 - 1,64 (m, 8H). Порівняльний приклад 4В; Цитрат (4циклобутил-піперазин-1-іл)-[4-(4-фтор-піперидин1-ілметил)-феніл]-метанону. Порівняльний приклад 5; (4-Циклобутилпіперазин-1-іл)-(4-тіоморфолін-4-ілметил-феніл)метанон. MS (ESI): маса, розрах. для C20H29N3OS, + 1 359,20; m/z знайдений, 360 [М+H ]. H ЯМР (400 МГц, CDCI3): 7,37 - 7,32 (m, 4H), 3,88 - 3,65 (bm, 2H), 3,52 (s, 2H), 3,52 - 3,35 (bm, 2H), 2,80 - 2,63 (bm, 9H), 2,45-2,28 (bm, 4H), 2,10 - 1,98 (m, 2H), 1,95 - 1,79 (m, 2H), 1,78 - 1,65 (m, 2H). Порівняльний приклад 5В; Цитрат (4циклобутил-піперазин-1-іл)-(4-тіоморфолін-4ілметил-феніл)-метанону. Порівняльний приклад 6; [4-(2-Гідроксиметилморфолін-4-ілметил)-феніл]-(4-ізопропілпіперазин-1-іл)-метанон. MS (ESI): маса, розрах. для C20H31N3O3, + 1 361,24; m/z знайдений, 362 [М+H ]. Н ЯМР (400 МГц, CDCI3): 7,38 - 7,34 (m, 4Н), 3,93-3,87 (m, 1Н), 3,87 - 3,35 (m, 10Н), 2,73 (heptet, J = 6,6 Гц, 1H), 2,70 - 2,62 (m, 2H), 2,62 - 2,36 (bm, 4H), 2,24 - 2,15 (m, 1H), 2,05 - 1,92 (bm, 2H), 1,05 (d, J = 6,5 Гц, 6Н). Порівняльний Приклад 6В; Цитрат [4-(2гідроксиметил-морфолін-4-ілметил)-феніл]-(4ізопропіл-піперазин-1-іл)-метанону. Фізико-хімічні дані Виміряні значення рKа для Прикладу 1, циклопропіл аміну, були істотно нижчими, ніж передбачені значення за допомогою розрахунку (використовуючи комплект програмного забезпечення Pallas від CompuDrug, Inc.), а також були істотно нижчими, ніж значення, що спостерігали для Порівняльного прикладу 1 (ізопропіл амін). Виміряні значення рKа, log Ρ та log D були визначені за допомогою pION, Inc. (Woburn, Mass.). 27 96424 28 Таблиця 1 Фізико-хімічні дані Приклад Пр. 1 Порівн. пр. 1 Порівн. пр. 2 рKа (розр.) 8,5, 6,2 8,5, 6,2 7,8, 6,2 Біологічні приклади та дані A. Трансфекція клітин з людським рецептором гістаміну Клітини вирощували до приблизно від 70 % до 80 % злиття та видаляли з планшету трипсином та гранулювали в клінічній центрифузі. Потім осад після центрифугування повторно суспендували в 400 мкл повного середовища та переміщали в електропораційну кювету з інтервалом 0,4 см між електродами (Bio-Rad № 165-2088). До клітин додавали один мікрограм надспірального Н3 рецептора кДНК та обережно перемішували. Напруга для електропорації була встановлена 0,25 кВ, ємність була встановлена 960 мкФ. Після електропорації клітини розбавляли в 10 мл повного середовища та наносили на чотири 10 см чашки в наступних співвідношеннях: 1:20, 1:10, 1:5 та 1:2. Клітинам дозволяли відновитися протягом 24 годин перед додаванням 600 мкг G418). Через 10 днів чашки проаналізували для колоній клітин, що вижили. Колонії, що витримали виділення, вирощували та досліджували. Використовували SK-NMC клітини, оскільки вони надають ефективне зв'язування для інгібування аденілатциклази. Клони, які надали найбільше інгібування аденілатциклази у відповідь на гістамін, були використані для подальшого вивчення. 3 B. Зв'язування [ Н]-N-метилгістаміну Клітинний осад з SK-N-MC клітин, експресуючих Н3 рецептор гістаміну, гомогенізували в 50 мМ TpisHCl/0,5 мМ EDTA. Надосадову рідину з 800 г спіну збирали, повторно центрифугували в 30000 g протягом 30 хвилин. Осад після центрифугування повторно гомогенізували в 50 мМ Tpis/5 мМ 3 EDTA (рН 7,4). Мембрани інкубували з 0,8 нМ [ Н]їчї-метилгістаміном плюс/мінус тестовими сполуками протягом 60 хвилин при 25 °С та збирали клітини швидким фільтруванням через GF/C скляні волокнисті фільтри (попередньо оброблені 0,3 % поліетиленіміну), потім чотири рази промивали буфером. Фільтри додавали до 5 мл коктейлю для сцинтиляції, та потім визначали сигнал на рідинному сцинтиляційному лічильнику. Неспецифічне зв'язування визначали з 10 мкМ гістаміну. Значення рKi були розраховані, базуючись на KD 0,8 нМ та концентрації лігандів ([L]) 0,8 нМ, за формулою Ki=(1С50)/(1+([L]/(KD)). Дані для сполук, які тестували в цьому дослідженні, представлені в Таблиці 2 у вигляді середнього значення отриманих результатів. Дані зв'язування для Порівняльного прикладу 1 були представлені в патентній заявці US 10/690,115 (21 жовтня 2003 року). рKа (вимір.) 6,5, 5,3 7,6, 6,2 7,4, 6,5 log Ρ 0,89 0,55 2,09 log D 0,86 0,13 1,77 Таблиця 2 Активність зв'язування з людським Н3 рецептором Пр. Приклад 1 Приклад ЇВ Приклад 2 Приклад 2В Приклад 3 Приклад 4 Приклад 4В Порівняльний приклад 2 Порівняльний приклад 2А Порівняльний приклад 2В Порівняльний приклад 3 Порівняльний приклад 3В Порівняльний приклад 4 Порівняльний приклад 5 Порівняльний приклад 6 Порівняльний приклад 6В Kі (нМ) 5,4 6,5 2,0 2,0 2,5 6,0 23 1,0 1,7 2,0 2,0 1,0 0,7 1,0 6,0 5,0 pKi 8,3 8,2 8,7 8,7 8,6 8,2 7,6 9,0 8,8 8,7 8,7 9,0 9,2 9,0 8,2 8,3 С. Циклічне накопичення АМФ Були отримані сублінії SK-N-MC клітин, які експресували структурний компонент репортера людський Н3 рецептор. Значення рА2 були отримані, як описано Barbier, A.J. et al. (Br. J. Pharmacol. 1994, 143(5), 649-661). Дані для сполук, досліджених в цьому аналізі, наведені в Таблиці 3, у вигляді середнього значення отриманих результатів. Таблиця 3 Функціональна активність Пр. Приклад 1 Приклад 2В Порівняльний приклад 1 Порівняльний приклад 1А Порівняльний приклад 2 Порівняльний приклад ЗВ Порівняльний приклад 4 Порівняльний приклад 6 рА2 8,4 9,0 9,0 8,9 9,5 9,6 10,0 8,2 D. Фармакокінетика та біоаналіз Використовували одну групу з шести самців щурів Sprague Dawley (маса тіла приблизно 300 г; три тварини на момент часу). їх поселяли групою, вільно забезпечували їжею та водою та підтримували цикл освітлення - по 12 год світла та темряви. Тварини акліматизовувалися протягом, при 29 96424 наймні, 7 днів після їх придбання перед дослідженнями. Для перорального дозування тестові сполуки виготовляли з концентрацією 1 мг/мл в 0,5 % гідроксипропілметилцелюлозі та доставляли в дозі 10 мг/кг. Використовували сольові форми з лимонною кислотою тестових сполук (одержані, як описано для Прикладу 1В). Тварини отримували болюсне введення дози 10 мг/кг (10 мл/кг) кожної сполуки за допомогою годування через шлунковий зонд 16-розміру. Для внутрішньовенного дозування тестові сполуки виготовляли з концентрацією 1 мг/мл в 5 % глюкозі у воді та вводили в дозі 1 мг/кг (1 мл/кг) за допомогою внутрішньовенного болюсного введення дози через катетер 24-розміру 30 Temmo® Surflo® в бічну хвостову вену. Всі розчини доз одержували безпосередньо перед ін'єкцією. Зразки крові (250 мкл) відбирали з бічної хвостової вени в гепаринізовані пробірки для відбору крові Natelson та витісняли в пробірки об'ємом 1,5 мл для мікроцентрифуги. Зразки крові центрифугували протягом 5 хв при 14000 об/хв в мікроцентрифузі. Плазму зберігали та утримували в морозилці при -20 °С до аналізу ВЕРХ. Аналіз даних проводили, використовуючи версію WinNonlin 3.3 або 4.0.1. Для визначення фармакокінетичних параметрів, наведених в Таблицях 4 та 5 (NA = не придатний або не визначений) використовували модель безкомпартменталізації (№ 200 для позасудинного введення та № 201 для в.в.). Таблиця 4 Фармакокінетичні профілі у щура Пр. Пр. 1В Порівн. пр. 1В Порівн. пр. 2В Спосіб перор. в.в. перор. в.в перор. в.в. Tmax (год) 0,5 ΝΑ 1,5 ΝΑ 1,33 ΝΑ Cmax (нг/мл) 2787 935 1050 4113 683 285 AUCINF (год-нг/мл) 8716 111 9743 1560 4104 464 Τ1/2 (год) 3,11 0,92 4,71 3,2 2,89 1,86 СІ (мл/хв/кг) 20,2 21,6 17,1 12,8 43,2 34,8 Vd (л/кг) 5,45 1,72 6,98 3,55 10,33 6,41 Таблиця 5 Фармакокінетичні профілі у щура Пр. Пр.2В Порівн. пр. 3В Порівн. пр. 4В Пр.3В Порівн. пр. 5В Пр.4В Порівн. пр. 61} Mode перор. в.в. перор. в.в. перор. в.в. перор. в.в. перор. в.в. перор в.в. перор. в.в. Комп’ютерна верстка Т. Чепелева Tmax (год) 1,67 ΝΑ 1,33 ΝΑ 0,67 NA 0,25 NA 0,38 NA 0,83 NA 0,50 NA Cmax AUCINF (мкмоль/мл) (год-мкмоль/мл) 0,42 1,91 3,78 1,37 0,16 1,95 1,49 1,16 0,48 1,28 0,46 0,41 0,19 0,18 0,86 0,18 0,07 0,12 2,68 0,42 8,73 33,2 2,92 3,07 2,96 19,99 1,41 1,34 Підписне Τ1/2 (год) 2,72 1,11 8,22 7,60 3,44 2,08 0,41 0,27 0,95 1,33 3,58 1,47 4,35 2,36 СІ (мл/хв/кг) 431 41,4 270 44,2 1135 113 NA 282 NA 154 NA 15,2 NA 34,9 vd (л/кг) 112 3,94 180 29,2 397 20,3 NA 6,48 NA 17,8 NA 1,91 NA 7,04 Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCyclopropyl amines as modulators of the histamine h3 receptor
Автори англійськоюAllison Brett D., Carruthers Nicholas, Grice, Cheryl, A., Letavic Michael
Назва патенту російськоюЦиклопропил амины как модуляторы н3 рецепторов гистамина
Автори російськоюЭллисон Бретт Д., Каррутерс Николас И., Грайс Черил А., Летавик Майкл А.
МПК / Мітки
МПК: C07D 295/192
Мітки: гістаміну, модулятори, аміни, рецепторів, циклопропіл
Код посилання
<a href="https://ua.patents.su/15-96424-ciklopropil-amini-yak-modulyatori-n3-receptoriv-gistaminu.html" target="_blank" rel="follow" title="База патентів України">Циклопропіл аміни як модулятори н3 рецепторів гістаміну</a>
Попередній патент: Спосіб збагачення залізовмісної сировини
Наступний патент: Спосіб одержання амідів (варіанти), проміжні сполуки, їх застосування та спосіб одержання
Випадковий патент: Універсальний фундамент будинку /споруди/