Антагоністи рецепторів гістаміну-3
Номер патенту: 88719
Опубліковано: 10.11.2009
Автори: Батлер Тодд Вілл'ям, Чандрасекаран Рамалакшмі Єґна, Вейджер Тревіс Т.
Формула / Реферат
1. Сполука формули І
 І
І
або її фармацевтично прийнятна сіль, де:
R1 та R2, кожний незалежно, вибрані з групи:
гідроген;
С1-С8алкіл, необов'язково заміщений 1-4 галогенами;
С1-С4алкіл, необов'язково заміщений замісником, вибраним з ОН, одного-чотирьох С1-С4алкілів, С3-С7циклоалкілів, С1-С4діалкіламіно, С6-С14арилів, що необов'язково заміщено галогеном та необов'язково заміщено С6-С10арилоксилом, що необов'язково заміщено 1-2 галогенами, та 5-10-членним гетероарилом, що необов'язково заміщено С6-С10арилом та необов'язково заміщено одним-трьома С1-С4алкілами;
С3-С7циклоалкіл;
С6-С14арил;
-(С0-С3)алкіл-О-(С1-С3)алкіл, необов'язково заміщений (С1-С3)алкілом;
-(С1-С3)алкіл-С(=О)О-(С1-С3)алкіл;
3-8-членний гетероциклоалкіл, необов'язково заміщений одним або більше С1-С4алкілкарбонілами;
С6-С10арилсульфоніл, необов'язково заміщений одним або більше С1-С2алкілами;
5-10-членний гетероарил та
С6-С14арил-С0-С4алкілен-О-С0-С4алкіл, де кожний С0-С4алкіл та кожний С0-С4алкілен є необов'язково заміщеними одним-чотирма С1-С4алкілами;
або необов'язково R1 та R2 разом з нітрогеном, до котрого вони приєднані, утворюють 4-, 5-, 6- або 7-членне насичене або ненасичене аліфатичне кільце, де один з карбонів у вказаному аліфатичному кільці є необов'язково заміщеним О, S, NR3 або СО, та де вказане кільце є необов'язково конденсованим з С6-С10ариленом та є необов'язково заміщеним на кільцевому карбоні замісником, вибраним з групи: -ОН, 5-10-членний гетероарил, необов'язково заміщений одним або більше галогенами та необов'язково заміщений одним або більше С1-С2алкілами,
С1-С4алкоксил, необов'язково заміщений одним або більше C1-C2алкоксилами та необов'язково заміщений одним або більше С1-С4діалкіламінокарбонілами, та
один або два С1-С4алкіли, необов'язково та незалежно заміщені одним або більше С1-С2алкоксилами;
де R3 - гідроген;
C1-C8алкіл, необов'язково заміщений 1-4 галогенами;
5-10-членний гетероарил, необов'язково заміщений замісником, вибраним з групи: галоген, С1-С4алкіл, С1-С2алкоксил, С6-С10арил, С1-С4алкіламінокарбоніл та ціано;
С1-С4алкіл, необов'язково заміщений замісником, вибраним з групи: С1-С2алкоксикарбоніл, 5-10-членний гетероарил, необов'язково заміщений одним або більше С1-С2алкілами, одним-чотирма С1-С4алкілами, С3-С7циклоалкіл та С6-С14арил;
С6-С10арил, необов'язково заміщений одним або двома С1-С2алкілами;
С1-С4алкілкарбоніл;
або С6-С14арил-С0-С4алкілен-О-С0-С4алкіл, де кожний С0-С4алкіл та кожний С0-С4алкілен є необов'язково заміщеними одним-чотирма С1-С4алкілами;
R4 є незалежно вибраним з групи: гідроген, С1-С4алкіл, С1-С4алкоксил, галоген, нітрил, -SO2С1-С4, -SO2NHС1-С4 та -C(=O)NHС1-С4;
n дорівнює 0, 1, 2, 3 або 4;
R5 - ОН, -О(С1-С3)алкіл, галоген або гідроген;
R6 - гідроген, С1-С4алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкіл-С0-С4алкіл;
R7 - гідроген, С1-С8алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкіл-С0-С4алкіл, де кожний С0-С4алкіл є необов'язково заміщеним одним-чотирма С1-С4алкілами; а
R8 - гідроген, С1-С8алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкіл-С0-С4алкіл;
або необов'язково R7 та R8 разом з нітрогеном, до котрого вони приєднані, утворюють 4-, 5-, 6- або 7-членне гетероциклічне кільце, де вказане гетероциклічне кільце є необов'язково заміщеним одним або двома С1-С4алкілами; та де один з карбонів вказаного гетероциклічного кільця, що відділяється принаймні двома атомами від вказаного нітрогену у вказаному гетероциклічному кільці, є необов'язково заміщеним О, S, NR9 або С=О,
де R9 - гідроген, C1-C8алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкіл-С0-С4алкіл, та де кожний С0-С4алкіл є необов'язково заміщеним одним-чотирма С1-С4алкілами.
2. Сполука формули І за п. 1, де R7 та R8 разом з нітрогеном, до котрого вони приєднані, утворюють 4-, 5-, 6- або 7-членне гетероциклічне кільце, де вказане гетероциклічне кільце є необов'язково заміщеним одним або двома С1-С4алкілами; та де один з карбонів вказаного гетероциклічного кільця, що відділяється принаймні двома атомами від вказаного нітрогену у вказаному гетероциклічному кільці, є необов'язково заміщеним О, S, NR9 або С=О, де R9 - гідроген, С1-С8алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкіл-С0-С4алкіл, та де кожний С0-С4алкіл є необов'язково заміщеним одним-чотирма С1-С4алкілами.
3. Сполука формули І за п. 2, де R7 та R8 разом з нітрогеном, до котрого вони приєднані, утворюють 5- або 6-членний насичений гетероцикл.
4. Сполука формули І за п. 3, де вказаний насичений гетероцикл є піролідинілом.
5. Сполука формули І за п. 2, де R1 - гідроген; R4 та R5, незалежно, - гідроген або F; R6 - гідроген або С1-С6алкіл.
6. Сполука формули І за п. 1, де R5 - Н або F.
7. Сполука формули І за п. 2, де R5 - Н або F.
8. Цис-циклобутильний ізомер або транс-циклобутильний ізомер формули І за п. 1.
9. Цис-циклобутильний ізомер або транс-циклобутильний ізомер формули І за п. 2.
10. Сполука формули І за п. 1, яку вибрано з групи:
цис-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти диметиламід;
цис-[3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-піролідин-1-ілметанон;
цис-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етилметиламід;
цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти метиламід;
цис-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти метиламід;
цис-{3-[3-хлор-4-((R)-2-метилпіролідин-1-ілметил)-феніл]-циклобутил}-піролідин-1-ілметанон;
цис-3-(2,3-дихлор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти диметиламід;
цис-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етиламід;
цис-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти ізобутиламід;
цис-(3-азабіцикло[3,2,2]не3-іл)-[3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-метанон;
транс-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти диметиламід;
транс-[3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-піролідин-1-ілметанон;
транс-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етилметиламід;
транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти метиламід;
транс-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти метиламід;
транс-{3-[3-хлор-4-((R)-2-метилпіролідин-1-ілметил)-феніл]-циклобутил}-піролідин-1-ілметанон;
транс-3-(2,3-дихлор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти диметиламід;
транс-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етиламід;
транс-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти ізобутиламід;
транс-(3-азабіцикло[3,2,2]не3-іл)-[3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-метанон;
цис-[3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-піролідин-1-ілметанон;
цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти диметиламід;
цис-[3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутил]-піперидин-1-ілметанон;
цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти ізобутилметиламід;
цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти циклопропілметиламід;
цис-[3-(3,5-дифлуор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутил]-піролідин-1-ілметанон;
цис-3-(2,6-дифлуор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти метиламід;
цис-3-(5-хлор-2-флуор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти ізобутиламід;
цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти етиламід;
цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти метил-(тетрагідропіран-4-ілметил)-амід;
цис-3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти метиламід;
цис-{3-[3-хлор-4-((R)-2-метилпіролідин-1-ілметил)-феніл]-3-флуорциклобутил}-піролідин-1-ілметанон;
цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти циклопропілметилметиламід;
цис-3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти диметиламід;
цис-3-флуор-3-[3-флуор-4-((S)-2-метилпіролідин-1-ілметил)-феніл]-циклобутанкарбонової кислоти етиламід;
цис-[3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутил]-(2,3-дигідро-5Н-бензо[f][1,4]оксазепін-4-іл)-метанон;
цас-3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етиламід;
цис-3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етилметиламід;
цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти метил-(3-метилпіридин-2-ілметил)-амід;
цис-3-флуор-3-[3-флуор-4-((R)-2-метилпіролідин-1-ілметил)-феніл]-циклобутанкарбонової кислоти етиламід;
цис-3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти ізобутиламід;
цис-[3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-піролідин-1-ілметанон;
цис-[3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-піролідин-1-ілметанон;
цис-3-(2,3-дихлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти диметиламід;
транс-[3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-піролідин-1-ілметанон;
транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти диметиламід;
транс-[3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутил]-піперидин-1-ілметанон;
транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти ізобутилметиламід;
транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти циклопропілметиламід;
транс-[3-(3,5-дифлуор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутил]-піролідин-1-ілметанон;
транс-3-(2,6-дифлуор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти метиламід;
транс-3-(5-хлор-2-флуор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти ізобутиламід;
транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти етиламід;
транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти метил-(тетрагідропіран-4-ілметил)-амід;
транс-3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти метиламід;
транс-{3-[3-хлор-4-((R)-2-метилпіролідин-1-ілметил)-феніл]-3-флуорциклобутил}-піролідин-1-ілметанон;
транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти циклопропілметилметиламід;
транс-3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти диметиламід;
транс-3-флуор-3-[3-флуор-4-((S)-2-метилпіролідин-1-ілметил)-феніл]-циклобутанкарбонової кислоти етиламід;
транс-[3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутил]-(2,3-дигідро-5Н-бензо[f][1,4]оксазепін-4-іл)-метанон;
транс-3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етиламід;
транс-3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етилметиламід;
транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти метил-(3-метилпіридин-2-ілметил)-амід;
транс-3-флуор-3-[3-флуор-4-((R)-2-метилпіролідин-1-ілметил)-феніл]-циклобутанкарбонової кислоти етиламід;
транс-3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти ізобутиламід;
транс-[3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-піролідин-1-ілметанон;
транс-[3-флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-піролідин-1-іл-метанон та
транс-3-(2,3-дихлор-4-піролідин-1-ілметилфеніл)-3-флуорциклобутанкарбонової кислоти диметиламід.
11. Спосіб лікування розладу або стану, що можна лікувати протидією рецепторам гістаміну-3, який полягає у призначенні ссавцю, що потребує такого лікування, сполуки формули І за п. 1.
12. Спосіб за п. 11, який стосується розладу або стану, вибраного із групи: депресія, розлади настрою, шизофренія, розлади з компонентом тривоги, когнітивні розлади, хвороба Альцгеймера, розлад з дефіцитом уваги, розлад з дефіцитом уваги та гіперактивністю, психотичні розлади, розлади сну, ожиріння, запаморочення, епілепсія, морська хвороба, респіраторні хвороби, алергія, індуковані алергією реакції дихальних шляхів, алергічний риніт, назальний застій, алергічний застій, застій, гіпотензія, серцево-судинна хвороба, хвороби шлунково-кишкового тракту, гіпер- та гіпорухомість та кислотна секреція шлунково-кишкового тракту, спосіб полягає у призначенні ссавцю, що потребує такого лікування, сполуки формули І за п. 1.
13. Спосіб за п. 12, де розлад або стан є вибраними з групи: розлади з компонентом тривоги, розлад з дефіцитом уваги та гіперактивністю, розлад з дефіцитом уваги, респіраторні хвороби, ожиріння, когнітивні розлади та психотичні розлади.
14. Спосіб за п. 12, де розладом або станом є респіраторна хвороба, вибрана з групи: респіраторний дистрес-синдром дорослих, гострий респіраторний дистрес-синдром, бронхіт, хронічний бронхіт, хронічна обструктивна легенева хвороба, кістозний фіброз, астма, емфізема, риніт та хронічний синусит.
15. Спосіб отримання сполуки формули І за п. 1, в якому здійснюють реакцію сполуки формули 4
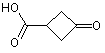 4
4
з металоорганічним реагентом, похідним від сполуки формули 2
 , 2
, 2
з наступним безпосереднім утворенням аміду, отримуючи сполуку формули І.
Текст
1. Сполука формули І C2 2 (19) 1 3 R5 - ОН, -О(С1-С3)алкіл, галоген або гідроген; R6 - гідроген, С1-С4алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкіл-С0-С4алкіл; R7 - гідроген, С1-С8алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкіл-С0-С4алкіл, де кожний С0-С4алкіл є необов'язково заміщеним одним-чотирма С1-С4алкілами; а R8 - гідроген, С1-С8алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкіл-С0-С4алкіл; або необов'язково R7 та R8 разом з нітрогеном, до котрого вони приєднані, утворюють 4-, 5-, 6- або 7членне гетероциклічне кільце, де вказане гетероциклічне кільце є необов'язково заміщеним одним або двома С1-С4алкілами; та де один з карбонів вказаного гетероциклічного кільця, що відділяється принаймні двома атомами від вказаного нітрогену у вказаному гетероциклічному кільці, є необов'язково заміщеним О, S, NR9 або С=О, де R9 - гідроген, C1-C8алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкіл-С0С4алкіл, та де кожний С0-С4алкіл є необов'язково заміщеним одним-чотирма С1-С4алкілами. 2. Сполука формули І за п.1, де R7 та R8 разом з нітрогеном, до котрого вони приєднані, утворюють 4-, 5-, 6- або 7-членне гетероциклічне кільце, де вказане гетероциклічне кільце є необов'язково заміщеним одним або двома С1-С4алкілами; та де один з карбонів вказаного гетероциклічного кільця, що відділяється принаймні двома атомами від вказаного нітрогену у вказаному гетероциклічному кільці, є необов'язково заміщеним О, S, NR9 або С=О, де R9 - гідроген, С1-С8алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкілС0-С4алкіл, та де кожний С0-С4алкіл є необов'язково заміщеним одним-чотирма С1-С4алкілами. 3. Сполука формули І за п.2, де R7 та R8 разом з нітрогеном, до котрого вони приєднані, утворюють 5- або 6-членний насичений гетероцикл. 4. Сполука формули І за п.3, де вказаний насичений гетероцикл є піролідинілом. 1 4 5. Сполука формули І за п.2, де R - гідроген; R та 5 6 R , незалежно, - гідроген або F; R - гідроген або С1-С6алкіл. 6. Сполука формули І за п.1, де R5 - Н або F. 7. Сполука формули І за п.2, де R5 - Н або F. 8. Цис-циклобутильний ізомер або трансциклобутильний ізомер формули І за п.1. 9. Цис-циклобутильний ізомер або трансциклобутильний ізомер формули І за п.2. 10. Сполука формули І за п.1, яку вибрано з групи: цис-3-(3-флуор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти диметиламід; цис-[3-(3-флуор-4-піролідин-1-ілметилфеніл)циклобутил]-піролідин-1-ілметанон; цис-3-(3-флуор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти етилметиламід; цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти метиламід; цис-3-(3-флуор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти метиламід; цис-{3-[3-хлор-4-((R)-2-метилпіролідин-1-ілметил)феніл]-циклобутил}-піролідин-1-ілметанон; цис-3-(2,3-дихлор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти диметиламід; 88719 4 цис-3-(3-флуор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти етиламід; цис-3-(3-флуор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти ізобутиламід; цис-(3-азабіцикло[3,2,2]не3-іл)-[3-(3-флуор-4піролідин-1-ілметилфеніл)-циклобутил]-метанон; транс-3-(3-флуор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти диметиламід; транс-[3-(3-флуор-4-піролідин-1-ілметилфеніл)циклобутил]-піролідин-1-ілметанон; транс-3-(3-флуор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти етилметиламід; транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти метиламід; транс-3-(3-флуор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти метиламід; транс-{3-[3-хлор-4-((R)-2-метилпіролідин-1ілметил)-феніл]-циклобутил}-піролідин-1ілметанон; транс-3-(2,3-дихлор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти диметиламід; транс-3-(3-флуор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти етиламід; транс-3-(3-флуор-4-піролідин-1-ілметилфеніл)циклобутанкарбонової кислоти ізобутиламід; транс-(3-азабіцикло[3,2,2]не3-іл)-[3-(3-флуор-4піролідин-1-ілметилфеніл)-циклобутил]-метанон; цис-[3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутил]-піролідин-1-ілметанон; цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти диметиламід; цис-[3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутил]-піперидин-1-ілметанон; цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти ізобутилметиламід; цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти циклопропілметиламід; цис-[3-(3,5-дифлуор-4-піролідин-1-ілметилфеніл)3-флуорциклобутил]-піролідин-1-ілметанон; цис-3-(2,6-дифлуор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти метиламід; цис-3-(5-хлор-2-флуор-4-піролідин-1ілметилфеніл)-3-флуорциклобутанкарбонової кислоти ізобутиламід; цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти етиламід; цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти метил(тетрагідропіран-4-ілметил)-амід; цис-3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутанкарбонової кислоти метиламід; цис-{3-[3-хлор-4-((R)-2-метилпіролідин-1-ілметил)феніл]-3-флуорциклобутил}-піролідин-1-ілметанон; цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти циклопропілметилметиламід; цис-3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутанкарбонової кислоти диметиламід; 5 цис-3-флуор-3-[3-флуор-4-((S)-2-метилпіролідин-1ілметил)-феніл]-циклобутанкарбонової кислоти етиламід; цис-[3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутил]-(2,3-дигідро-5Нбензо[f][1,4]оксазепін-4-іл)-метанон; цас-3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутанкарбонової кислоти етиламід; цис-3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутанкарбонової кислоти етилметиламід; цис-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти метил-(3метилпіридин-2-ілметил)-амід; цис-3-флуор-3-[3-флуор-4-((R)-2-метилпіролідин-1ілметил)-феніл]-циклобутанкарбонової кислоти етиламід; цис-3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутанкарбонової кислоти ізобутиламід; цис-[3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутил]-піролідин-1-ілметанон; цис-[3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутил]-піролідин-1-ілметанон; цис-3-(2,3-дихлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти диметиламід; транс-[3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутил]-піролідин-1-ілметанон; транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти диметиламід; транс-[3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутил]-піперидин-1-ілметанон; транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти ізобутилметиламід; транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти циклопропілметиламід; транс-[3-(3,5-дифлуор-4-піролідин-1ілметилфеніл)-3-флуорциклобутил]-піролідин-1ілметанон; транс-3-(2,6-дифлуор-4-піролідин-1ілметилфеніл)-3-флуорциклобутанкарбонової кислоти метиламід; транс-3-(5-хлор-2-флуор-4-піролідин-1ілметилфеніл)-3-флуорциклобутанкарбонової кислоти ізобутиламід; транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти етиламід; транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти метил(тетрагідропіран-4-ілметил)-амід; транс-3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутанкарбонової кислоти метиламід; транс-{3-[3-хлор-4-((R)-2-метилпіролідин-1ілметил)-феніл]-3-флуорциклобутил}-піролідин-1ілметанон; транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти циклопропілметилметиламід; 88719 6 транс-3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутанкарбонової кислоти диметиламід; транс-3-флуор-3-[3-флуор-4-((S)-2метилпіролідин-1-ілметил)-феніл]циклобутанкарбонової кислоти етиламід; транс-[3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутил]-(2,3-дигідро-5Нбензо[f][1,4]оксазепін-4-іл)-метанон; транс-3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутанкарбонової кислоти етиламід; транс-3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутанкарбонової кислоти етилметиламід; транс-3-(3-хлор-4-піролідин-1-ілметилфеніл)-3флуорциклобутанкарбонової кислоти метил-(3метилпіридин-2-ілметил)-амід; транс-3-флуор-3-[3-флуор-4-((R)-2метилпіролідин-1-ілметил)-феніл]циклобутанкарбонової кислоти етиламід; транс-3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутанкарбонової кислоти ізобутиламід; транс-[3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутил]-піролідин-1-ілметанон; транс-[3-флуор-3-(3-флуор-4-піролідин-1ілметилфеніл)-циклобутил]-піролідин-1-іл-метанон та транс-3-(2,3-дихлор-4-піролідин-1-ілметилфеніл)3-флуорциклобутанкарбонової кислоти диметиламід. 11. Спосіб лікування розладу або стану, що можна лікувати протидією рецепторам гістаміну-3, який полягає у призначенні ссавцю, що потребує такого лікування, сполуки формули І за п.1. 12. Спосіб за п.11, який стосується розладу або стану, вибраного із групи: депресія, розлади настрою, шизофренія, розлади з компонентом тривоги, когнітивні розлади, хвороба Альцгеймера, розлад з дефіцитом уваги, розлад з дефіцитом уваги та гіперактивністю, психотичні розлади, розлади сну, ожиріння, запаморочення, епілепсія, морська хвороба, респіраторні хвороби, алергія, індуковані алергією реакції дихальних шляхів, алергічний риніт, назальний застій, алергічний застій, застій, гіпотензія, серцево-судинна хвороба, хвороби шлунково-кишкового тракту, гіпер- та гіпорухомість та кислотна секреція шлунково-кишкового тракту, спосіб полягає у призначенні ссавцю, що потребує такого лікування, сполуки формули І за п.1. 13. Спосіб за п.12, де розлад або стан є вибраними з групи: розлади з компонентом тривоги, розлад з дефіцитом уваги та гіперактивністю, розлад з дефіцитом уваги, респіраторні хвороби, ожиріння, когнітивні розлади та психотичні розлади. 14. Спосіб за п.12, де розладом або станом є респіраторна хвороба, вибрана з групи: респіраторний дистрес-синдром дорослих, гострий респіраторний дистрес-синдром, бронхіт, хронічний бронхіт, хронічна обструктивна легенева хвороба, кістозний фіброз, астма, емфізема, риніт та хронічний синусит. 15. Спосіб отримання сполуки формули І за п.1, в якому здійснюють реакцію сполуки формули 4 7 88719 8 R7 HO O O 4 з металоорганічним реагентом, похідним від сполуки формули 2 Цей винахід стосується сполук формули І, описаних тут, фармацевтичної композиції, що містить такі сполуки, способів отримання таких сполук, та способів лікування розладів або станів, що можна лікувати протидією рецепторам гістаміну-3 (Н3), застосовуючи такі сполуки. Гістамін є добре відомим медіатором у реакціях гіперчутливості (наприклад, алергії, сінна лихоманка, та астма), що звичайно лікують антагоністами гістаміну або "антигістамінами." Також встановлено, що рецептори гістаміну існують у принаймні двох відмінних типах, позначених як рецептори Н1 та Н2. Третій рецептор гістаміну (Н3-рецептор), можна вважати, грає роль у нейротрансмісії у центральній нервовій системі, де Н3-рецептор, можна вважати, розташований пресинаптично на гістамінергічних нервових закінченнях (Nature, 302, S32837 (1983)). Існування Н3-рецептору підтверджено розробкою селективних агоністів та антагоністів Н3-рецептору (Nature, 327, 117-123 (1987)) та далі показано регулювання вивільнення нейротрансмітерів у центральній нервовій системі та периферійних органах, особливо легенях, серцевосудинній системі та шлунково-кишковому тракті. Ряд хвороб або станів можна лікувати лігандами рецептору гістаміну-3, де Н3-ліганд може бути антагоністом, агоністом або частковим агоністом, дивись: (Imamura et al., Circ. Res., (1996) 78, 475-481); (Imamura et. al., Circ. Res., (1996) 78, 863869); (Lin et al., Brain Res. (1990) 523, 325-330); (Monti et al., Neuropsychopharmacology (1996) 15, 31 35); (Sakai, et al., Life Sci. (1991) 48, 2397-2404); (Mazurkiewiez- Kwilecki and Nsonwah, Can. J. Physiol. Pharmacol. (1989) 67, 75-78); (Panula, P. et al., Neuroscience (1998) 44, 465-481); (Wada et al., Trends in Neuroscience (1991) 14, 415); (Monti et al., Eur. J. Pharmacol. (1991) 205, 283); (MazurkiewiczKwilecki and Nsonwah, Can. J. Physiol. Pharmacol. (1989) 67, 75-78); (Haas et al., Behav. Brain Res. (1995) 66, 41-44); (De Almeida and Izquierdo, Arch. Int. Pharmacodyn. (1986) 283, 193-198); (Kamei et al., Psychopharmacology (1990) 102, 312-318); (Kamei and Sakata, Japan. J. Pharmacol. (1991) 57, 437-482); (Schwartz et al., Psychopharmacology; The fourth Generation of Progress, Bloom and Kupfer (eds.), Raven Press, New York, (1995) 3 97); (Shaywitz et al., Psychopharmacology (1984) 82, 7377); (Dumery and Blozovski, Exp. Brain Res. (1987) 67, 61-69); (Tedford et al., J. Pharmacol. Exp. Ther. (1995) 275, 598-604); (Tedford et al., Soc. Neurosci. Abstr. (1996) 22, 22); (Yokoyama et al., Eur. J. N R8 Br R6 (R4)n ,2 з наступним безпосереднім утворенням аміду, отримуючи сполуку формули І. Pharmacol. (1993) 234,129); (Yokoyama and linuma, CNS Drugs (1996) 5, 321); (Onodera et al., Prog. Neurobiol. (1994) 42, 685); (Leurs and Timmerman, Prog. Drug Res. (1992) 39,127); (The Hi stamine Η 3 Receptor, Leurs and Timmerman (ed.), Elsevier Science, Amsterdam, The Netherlands (1998); (Leurs et al., Trends in Pharm. Sci. (1998) 19, 177-183); (Phillips et al., Annual Reports in Medicinal Chemistry (1998) 33, 31-40); (Matsubara et al., Eur. J. Pharmacol. (1992) 224, 145); (Rouleau et al., J. Pharmacol. Exp Ther. (1997) 281, 1085); (Adam Szelag, "Role of histamine H3-receptors in the proliferation of neoplastic cells in vitro", Med. Sci. Monit., 4(5): 747-755, (1998)); (Fitzsimons, C, H. Duran, F. Labombarda, B. Molinari and E. Rivera, "Histamine receptors signalling in epidermal tumor cell lines with H-ras gene alterations", Inflammation Res., 47 (Suppl. 1): S50-S51, (1998)); (R. Leurs, R.C. Vollinga and H. Timmerman, "The medicinal chemistry and therapeutic potentials of ligand of the histamine H3 receptor", Progress in Drug Research 45: 170-165, (1995)); (R. Levi and N.C.E. Smith, "Histamine H3-receptors: A new frontier in myocardial ischemia", J. Pharm. Exp. Ther., 292: 825-830, (2000)); (Hatta, Ε., K. Yasuda and R. Levi, "Activation of histamine H3 receptors inhibits carrier-mediated norepinephrine release in a human model of protracted myocardial ischemia", J. Pharm. Exp. Ther, 283: 494-500, (1997); (H. Yokoyama and K. linuma, "Histamine and Судоми: Implications for the treatment of epilepsy", CNS Drugs, 5(5); 321-330, (1995)); (K. Hurukami, H. Yokoyama, K. Onodera, K. linuma and T. Watanabe, AQ-0 145, "A newly developed histamine H3 antagonist, decreased seizure susceptibility of electrically induced convulsions in mice", Meth. Find. Exp. Clin. Pharmacol., 17(C): 70-73, (1995); (Delaunois Α., Gustin P., Garbarg M., and Ansay M., "Modulation of acetylcholine, capsaicin and substance Ρ effects by histamine H3 receptors in isolated perfused rabbit lungs", European Journal of Pharmacology 277(2-3): 243-50, (1995)); and (Dimitriadou, et al., "Functional relationship between mast cells and C- sensitive nerve f ibres evidenced by histamine H3-receptor modulation in rat lung and spleen", Clinical Science 87(2): 151-63, (1994). Такі хвороби або стани охоплюють серцево-судинні розлади, як-то гострий інфаркт міокарду; процеси пам'яті, деменція та когнитивні розлади, як-то хвороба Альцгеймера та розлад з дефіцитом уваги та гіперактивністю; неврологічні розлади, як-то хвороба Паркінсона, шизофренія, депресія, епілепсія, та судоми або кон 9 вульсії; рак, як-то шкірна карцинома, медулярнотиреоїдна карцинома та меланома; респіраторні розлади, як-то астма; розлади сну, як-то нарколепсія; вестибулярнa дисфункція, як-то хвороба Меньєре; шлунково-кишкові розлади, запалення, мігрень, морська хвороба, ожиріння, біль та септичний шок. Антагоністи рецепторів Н3 також попередньо описані, наприклад, у WO 03/050099, WO 02/0769252, WO 02/12224, та Патенті США №2005/0171181 А1. Рецептор гістаміну Н3 (H3R) регулює вивільнення гістаміну та інших нейротрансмітерів, охоплюючи серотонін та ацетилхолін. H3R є специфічним стосовно нейронів та інгібує вивільнення деяких моноамінів, як-то гістамін. Селективний антагонізм рецепторів H3R підвищує рівні гістаміну у мозку та інгібує такі активності як споживання їжі, у той же час мінімізуючи неспецифічні периферійні наслідки. Антагоністи рецептору збільшують синтез та вивільнення гістаміну та інших моноамінів мозку. Цим механізмом вони індукують пролонговану безсонницю, поліпшену когнітивну функцію, зменшення споживання їжі та нормалізацію вестибулярних рефлексів. Відповідно, рецептор є важливою ціллю для нових терапевтичних засобів у хворобі Альцгеймера, розладах настрою та когнітивних розладах, охоплюючи розлад з дефіцитом уваги та гіперактивністю (ADHD), розлад з дефіцитом уваги (ADD), когнітивні нестачі, ожиріння, запаморочення, шизофренію, епілепсію, розлади сну, нарколепсію та морську хворобу та різні форми тривожності. Більшість антагоністів рецепторів гістаміну Н3 зараз походять на гістамін у зберіганні імідазольного кільця, що може бути заміщеним, як описанo, наприклад, у WO 96/38142. Неімідазольні нейроактивні сполуки, як-то бета-гістаміни (Arrang, Eur. J. Pharm. 1985, 111: 72-84) демонстрували деяку активність рецептору гістаміну Н3, але зі слабкою потужністю. ЕР 978512 та ЕР 0982300А2 розкривають неімідазольні алкіламіни як антагоністи рецептору гістаміну Н3. WO 02/12224 (Ortho McNeil Pharmaceuticals) описує неімідазольні біциклічні похідні як ліганди рецептору гістаміну НЗ. Інші антагоністи рецепторів описані у WO 02/32893 та WO 02/06233. Сполуки цього винаходу є високоселективними стосовно Н3-рецептору (у порівнянні з іншими рецепторами гістаміну), та мають помітні властивості розподілу ліків (фармакокінетичні). Зокрема, сполуки цього винаходу селективно відрізняють H3R від інших підтипів рецепторів H1R, H2R. З точки зору збільшеного рівня агоністів, зворотних агоністів та антагоністів рецептору гістаміну Н3 у рівні техніки, нові сполуки, що взаємодіють з рецептором гістаміну НЗ, могли б бути високо бажаним внеском у рівень техніки. Заявлений винахід стосується такого внеску у рівень техніки на основі пошуку, нового класу циклобутильних зворотних амідів, що мають високу та специфічну афінність до рецептору гістаміну Н3 та мають набагато кращий профіль ліків. Цей винахід стосується сполуки формули І: 88719 10 або її фармацевтично прийнятної солі, де: R1 та R2, кожний незалежно, вибрані з групи: гідроген; C1-C8алкіл, необов'язково заміщений 1-4 галогенами; С1-С4алкіл, необов'язково заміщений замісником, вибраним з ОН, одного -чотирьох С1-С4 алкілу, С3-С7циклоалкілу, С1-C4діалкіламіно, С6С14арилу, що необов'язково заміщено галогеном, та необов'язково заміщено С6-С10арилоксилу, що необов'язково заміщено 1-2 галогенами, та 5-10членного гетероарилу, необов'язково заміщеного С6-С10арилом та необов'язково заміщеним одним трьома С1-С4алкілами; С3-С7 циклоалкіл; С6-С14арил; -(С0-С3)алкіл-О-(С1-С3)алкіл, необов'язково заміщений (С1-С3)алкілом; -(С1-С3)алкіл-С(=О)О-(С1-С3)алкіл; 3-8-членний гетероциклоалкіл, необов'язково заміщений одним або більше С1-С4алкілкарбонілами; С6-С10арилсульфоніл, необов'язково заміщений одним або більше С1-С2алкілами; 5-10-членний гетероарил; та С6-С1арил-С0-С4алкілен-О-С0-С4алкіл, де кожний С0-С4алкіл та кожний С0-С4алкілен є необов'язково заміщеними одним-чотирма С1-С4алкілами; або необов'язково R1 та R2 разом з нітрогеном, до котрого вони приєднані, утворюють 4-, 5-, 6-, або 7-членне насичене або ненасичене аліфатичне кільце, де один з карбонів у вказаному аліфатичному кільці є необов'язково заміщеним О, S, NR3 або СО, та де вказане кільце є необов'язково конденсованим з С6-С10ариленом та є необов'язково заміщеним на кільцевому карбоні замісником, вибраним з групи: -ОН, 5-10-членний гетероарил, необов'язково заміщений одним або більше галогенами та необов'язково заміщений одним або більше С1-С2алкілами, С1-С4алкоксил, необов'язково заміщений одним або більше С1-С2алкоксилами та необов'язково заміщений одним або більше С1С4діалкіламінокарбонілами, та один або два С1С4алкіла необов'язково та незалежно заміщені одним або більше С1-С2алкоксилами; де R3 - гідроген; С1-С8алкіл, необов'язково заміщений 1-4 галогенами; 5-10-членний гетероарил, необов'язково заміщений замісником, вибраним з групи: галоген, С1С4алкіл, С1-С2алкоксил, С6-С10арил, С1С4алкіламінокарбоніл та ціано; С1-С4алкіл, необов'язково заміщений замісником, вибраним з групи: С1-С2алкоксикарбоніл, 510-членний гетероарил, необов'язково заміщений одним або більше С1-С2алкіл, одним - чотирма С1С4алкілами, С3-С7циклоалкіл, та С6-С14арил; 11 С6-С10арил, необов'язково заміщений одним або двома С1-С2алкілами; С1-С4 алкілкарбоніл; або С6-С14арил-С0-С4алкілен-О-С0-С4алкіл, де кожний С0-С4алкіл та кожний С0-С4алкілен є необов'язково заміщеними одним - чотирма С1С4алкілами; R4 є незалежно вибраним з групи: гідроген, С1С4алкіл, С1-С4алкоксил, галоген, нітрил, -SO2С1-C4, -SO2NHС1-C4, та -C(=O)NHC1-C4; n дорівнює 0, 1, 2, 3, або 4; R5 - ОН, -О (С1-С3)алкіл, галоген або гідроген; R6 - гідроген, С1-C4алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкіл-С0С4алкіл; R7 - гідроген, С1-C8алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкіл-С0С4алкіл, де кожний С0-С4 є необов'язково заміщеним одним-чотирма С1-С4алкілами; та R8 - гідроген, С1-С8алкіл, необов'язково заміщений 1 - 4 галогенами, або С3-С7циклоалкіл-С0С4алкіл; або необов'язково R7 та R8 разом з нітрогеном, до котрого вони приєднані, утворюють 4-, 5-, 6-, або 7-членне гетероциклічне кільце, де вказане гетероциклічне кільце є необов'язково заміщеним одним або двома С1-С4алкілами; та де один з карбонів вказаного гетероциклічного кільця, що відділяється принаймні двома атомами від вказаного нітрогену у вказаному гетероциклічному кільці є необов'язково заміщеним О, S, NR9, або С=О, де R9 - гідроген, С1-С8алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкіл-С0-С4алкіл, та де кожний С0-С4алкіл є необов'язково заміщеним одним - чотирма С1-С4алкілами. Краще втілення винаходу охоплює ті сполуки формули І, де R7 та R8 разом з нітрогеном, до котрого вони приєднані, утворюють 4-, 5-, 6-, або 7членне гетероциклічне кільце, де вказане гетероциклічне кільце є необов'язково заміщеним одним або двома С1-С4алкілами; та де один з карбонів вказаного гетероциклічного кільця, що відділяється принаймні двома атомами від вказаного нітрогену у вказаному гетероциклічному кільці є необов'язково заміщеним О, S, NR9, або С=О, де R9 гідроген, С1-C8алкіл, необов'язково заміщений 1-4 галогенами, або С3-С7циклоалкіл-С0-С4алкіл, та де кожний С0-С4алкіл є необов'язково заміщеним одним-чотирма С1-С4алкілами. Ще краще втілення винаходу охоплює ті сполуки формули І, де R7 та R8 разом з нітрогеном, до котрого вони приєднані, утворюють 5- або бчленний насичений гетероцикл. Найкраще втілення винаходу охоплює ті сполуки формули І, де R7 та R8 разом з нітрогеном, до котрого вони приєднані, утворюють піролідиніл. Ще одне втілення винаходу охоплює ті сполуки формули І, де R1 - гідроген; R4 та R5, незалежно, - гідроген або F; R6 - гідроген або С1-С6алкіл. Ще одне втілення винаходу охоплює ті сполуки формули І, де R5 - Н. Ще одне втілення винаходу охоплює ті сполуки формули І, де R5 - F. Ще одне втілення винаходу охоплює цисциклобутильні ізомери формули І. 88719 12 Ще одне втілення винаходу охоплює трансциклобутильні ізомери формули І. Найкраще втілення заявленого винаходу охоплює наступні цис- та транс-сполуки формули І: 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти диметиламід; [3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутил]-піролідин-1-іл-метанон; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти етилметил-амід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти метиламід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти метиламід; {3-[3-Хлор-4-((R)-2-метил-піролідин-1iлметил)феніл]-циклобутил}-піролідин-1-ілметанон; 3-(2,3-Дихлор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти диметиламід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти етиламід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти ізобутил-амід; та (3-Аза-біцикло[3,2,2]неЗ-іл)-[3-(3-флуор-4піролідин-1-ілметил-феніл)-циклобутил]-метанон. [3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-піролідин-1-іл-метанон; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти диметиламід; [3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутил]-піперидин-1-іл-метанон; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти ізобутилметил-амід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти циклопропілметил-амід; [3-(3,5-Дифлуор-4-піролідин-1-ілметил-феніл)3-флуор-циклобутил]-піролідин-1-іл-метанон; 3-(2,6-Дифлуор-4-піролідин-1-ілметил-феніл)3-флуор-циклобутанкарбонової кислоти метиламід; 3-(5-Хлор-2-флуор-4-піролідин-1-ілметилфеніл)-3-флуор-циклобутанкарбонової кислоти ізобутил-амід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти етиламід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти метил(тетрагідро-піран-4-ілметил)-амід; 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти метиламід; {3-[3-Хлор-4-((R)-2-метил-піролідин-1-ілметил)феніл]-3-флуор-циклобутил}-піролідин-1-ілметанон; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти циклопропілметил-метил-амід; 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти диметиламід; 3-Флуор-3-[3-флуор-4-((S)-2-метил-піролідин1-ілметил)-феніл]-циклобутанкарбонової кислоти етиламід; 13 [3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутил]-(2,3-дигідро-5Нбензо[ґ][1,4]оксазепін-4-іл)-метанон; 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етиламід; 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етил-метиламід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти метил-(3метил-піридин-2-ілметил)-амід; 3-Флуор-3-[3-флуор-4-((R)-2-метил-піролідин1-ілметил)-феніл]-циклобутанкарбонової кислоти етиламід; 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти ізобутиламід; [3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-піролідин-1-іл-метанон; [3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-піролідин-1-іл-метанон; та 3-(2,3-Дихлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти диметиламід. Цей винахід також стосується фармацевтичної композиції для лікування розладу або стану, що можна лікувати протидією рецепторам гістаміну-3, композиція містить сполуку формули І та необов'язково фармацевтично прийнятний носій. Цей винахід також стосується способу лікування розладу або стану, що можна лікувати протидією рецепторам гістаміну-3, спосіб полягає у призначенні ссавцю, що потребує такого лікування, сполуки формули І. Цей винахід також стосується способу лікування розладу або стану, вибраного з групи: депресія, розлади настрою, шизофренія, розлади з компонентом тривоги, когнітивні розлади, хвороба Альцгеймера, розлад з дефіцитом уваги (ADD), розлад з дефіцитом уваги та гіперактивністю (ADHD), психотичні розлади, розлади сну, ожиріння, запаморочення, епілепсія, морська хвороба, респіраторні хвороби, алергія, індуковані алергією реакції дихальних шляхів, алергічний риніт, назальний застій, алергічний застій, застій, гіпотензія, серцево-судинна хвороба, хвороби шлунковокишкового тракту, гіпер та гіпорухомість та кислотна секреція шлунково-кишкового тракту, спосіб полягає у призначенні ссавцю, що потребує такого лікування, сполуки формули І. Цей винахід також стосується фармацевтичної композиції для лікування вибраного з групи: алергічний риніт, назальний застій або алергічний застій, яка містить: (а) антагоніст рецептору Н3 сполуку формули І або її фармацевтично прийнятну сіль; (b) антагоніст рецептору Н1 або його фармацевтично прийнятну сіль; та (с) фармацевтично прийнятний носій; де активні інгредієнти (а) та (b) вище є присутніми у кількості, що надає композиції ефективність у лікуванні алергічного риніту, назального застою або алергічного застою. Цей винахід також стосується фармацевтичної композиції для лікування вибраного з групи: ADD, ADHD, депресія, розлади настрою, або когнітивні розлади, що містить: (а) антагоніст рецептору Н3 88719 14 сполуку формули І або її фармацевтично прийнятну сіль; (b) блокатор перепоглинання нейротрансмітеру або його фармацевтично прийнятну сіль; (с) фармацевтично прийнятний носій; де активні інгредієнти (а) та (b) вище є присутніми у кількості, що надає композиції ефективність у лікуванні депресії, розладів настрою, та когнітивних розладів. Цей винахід також стосується способу отримання сполуки формули І, що має етап реакції сполуки формули 4, з металоорганічним реагентом, похідним від сполуки формули 2, а потім безпосереднім утворенням аміду, отримуючи сполуку формули І. У загальній формулі І згідно із заявленим винаходом, коли радикал є моно- або полізаміщеним, вказаний замісник може бути розташованим на будь-якій потрібній позиції, якщо не вказане інше. Також, коли радикал є полізаміщеними, вказані замісники можуть бути ідентичними або відмінними, якщо не вказане інше. Антагоністи рецепторів гістаміну-3 (Н3) винаходу є корисними для лікування, зокрема, ADD, ADHD, ожиріння, розлади з компонентом тривоги та респіраторні хвороби. Респіраторні хвороби, що можна лікувати згідно з заявленим винаходом, охоплюють респіраторний дистрес-синдром дорослих, гострий респіраторний дистрес-синдром, бронхіт, хронічний бронхіт, хронічну обструктивну легеневу хворобу, кистозний фіброз, астму, емфізему, риніт та хронічний синусит. Фармацевтичну композицію та спосіб цього винаходу можна також застосовувати для попередження рецидиву розладу або стану, описаних у попередніх розділах. Попередження такого рецидиву досягають призначенням ссавцю, що потребує такого попередження, сполуки формули І, яку описано вище. Розкриті сполуки можна також застосовувати як частину комбінаційної терапії, охоплюючи їх застосування як окремих компонентів або комбінованими у одиничній системі доставки, котра містить ефективну дозу антагоністу гістаміну Н3 сполуки загальної формули І та ефективну дозу антагоністу гістаміну Н1, як-то цетиризин (Zyrtec™), хлорфенірамін (Chlortrimeton™), лоратідин (Claritin™), фексофенадин (Allegra™), або деслоратадин (СІаrіnех™) для лікування алергічного риніту, назального застою та алергічного застою. Розкриті сполуки можна також застосовувати як частину комбінаційної терапії, охоплюючи їх застосування як окремих компонентів або комбінованими у одиничній системі доставки, котра містить ефективну дозу антагоністу гістаміну Н3 спо 15 луки загальної формули І та ефективну дозу блокатору перепоглинання нейротрансмітерів. Приклади блокаторів перепоглинання нейротрансмітерів охоплюють серотонін-селективні інгібітори перепоглинання (SSRI) типу сертраліну (Auroft™), флуоксетин (Prozac™), та пароксетин (РахіІ™), або неселективні інгібітори пере поглинання серотоніну, допаміну або норепінефрину для лікування ADD, ADHD, депресії, розладів настрою, або когнітивних розладів. Сполуки заявленого винаходу можуть мати оптичні центри та тому можуть бути у відмінних енантіомерних конфігураціях. Формула І охоплює усі енантіомери, діастереомери, та інші стереоізомери сполук формули І, а також рацемічні та інші їх суміші. Індивідуальні ізомери можна отримувати відомими способами, як-то оптичне розділення, оптично селективні реакції, або хроматографічне розділення, при отриманні кінцевого продукту або його інтермедіату. Заявлений винахід також стосується мічених ізотопами сполук, котрі є ідентичними описаним у формулі І, але в яких один або більше атомів є заміщеними атомом, що має атомну масу або масове число відмінні від атомної маси або масового числа, звичайно виявлених у природі. Приклади ізотопів, що можна уводити у сполуки заявленого винаходу, охоплюють ізотопи гідрогену, карбону, нітрогену, оксигену, фосфору, сульфуру, флуору та хлору, як-то 2Н, 3Н, 13С, 11С, 14С, 15N, 18О, 17О, 15 О, 31Р, 32Р, 35S, 18F, та 36СІ, 123І відповідно. Сполуки заявленого винаходу та фармацевтично прийнятні солі вказаних сполук, котрі містять вищезгадані ізотопи та/або інші ізотопи інших атомів, охоплені рамками цього винаходу. Деякі мічені ізотопами сполуки заявленого винаходу, наприклад, у котрі є уведеними радіоактивні ізотопи, якто 3Н та 14С, є корисними в аналізах розподілення ліків та/або субстратів тканин. Тритійовані ізотопи, тобто, з 3Н, та ізотопи з карбоном-14, тобто 14С, є особливо кращими стосовно легкості їх отримання та виявлюваності. Далі, заміщення важчими ізотопами, як-то дейтерій, тобто, 2Н, може давати деякі терапевтичні переваги, утворені від більшої метаболічної стабільності, наприклад, збільшеного напівперіоду in vivo або зменшених потреб дозування, а звідси, можуть бути кращими у деяких випадках. Заміщення ізотопами, що емітують позитрон,, як-то 11С, 18F, 15O та 13N, може бути корисним у дослідженнях позитронною емісійною томографією (PET) для визначення субстратної заселеності рецептору. Розлади з компонентом тривоги охоплюють, наприклад, генералізований розлад з компонентом тривоги, розлад панічного типу, посттравматичний стресовий розлад, та соціальний розлад з компонентом тривоги. Розлади настрою охоплюють, наприклад, депресивний настрій, змішані тривожність та депресивний настрій, порушення поведінки, та змішані порушення поведінки та депресивний настрій. Когнітивні розлади охоплюють, наприклад, на додаток до ADHD, розлад з дефіцитом уваги (ADD) або інші коректування уваги, або когнітивні розлади внаслідок загальних медичних 88719 16 станів. Психотичні розлади охоплюють, наприклад, шизоафективні розлади та шизофренію; розлади сну охоплюють, наприклад, нарколепсію та енурез. Приклади розладів або станів, котрі можна лікувати сполукою, композицією та способом цього винаходу, є також такими: депресія, охоплюючи, наприклад, депресію у пацієнтів з раком, депресію у пацієнтів з хворобою Паркінсона, депресію після інфаркту міокарду, депресію у пацієнтів з вірусом імунодефіциту людини (ВІЛ), субсиндромальну симптоматичну депресію, депресію у безплідних жінок, депресію у дітей, глибоку депресію, реактивну депресію, рецидивну депресію, індуковану поганим поводженням з дітьми депресію, депресію після пологів, DSM-IV-глибоку депресію, важко виліковну головну депресію, сувору депресію, психотичну депресію, депресію після інсульту, невропатичний біль, маніакально-депресивна хвороба, охоплюючи маніакально-депресивну хворобу зі змішаними епізодами та маніакально-депресивну хворобу з депресивними епізодами, сезонний афективний розлад, біполярну депресію І, біполярну депресію II, або головну депресію з психічною депресією; психічну депресію; фобії, охоплюючи, наприклад, агорафобію, соціальну фобію або легкі фобії; розлади харчування, охоплюючи, наприклад, нейрогенну втрату апетиту або нейрогенну булімію; хімічні залежності, охоплюючи, наприклад, залежність від спирту, кокаїну, амфетаміну та інших психостимуляторів, морфіну, героїну та інших опіоїдних агоністів, фенобарбіталу та інших барбітуратів, нікотину, діазепаму, бензодіазепінів та інших психоактивних речовин; хворобу Паркінсона, охоплюючи, наприклад, деменцію при хворобі Паркінсона, нейролептик-індукований паркінсонізм або пізні дискінезії; головний біль, охоплюючи, наприклад, головний біль, асоційований із васкулярними розладами; синдром відвикання; асоційовані з віком розлади навчання та розумові розлади; апатію; біполярний розлад; синдром хронічної втоми; хронічний або гострий стрес; розлад поведінки; циклотимічний розлад; соматоформні розлади, як-то соматизаційний розлад, суворий фізичний розлад, больовий розлад, іпохондрію, дисморфічний розлад, недиференційований розлад, та соматоформні NOS; нетримання; інгаляційні розлади; інтоксикаційні розлади; манію; периферійну невропатію; посттравматичний стресовий розлад; дисфоричний розлад пізньої лютеальної фази; специфічні розлади розвитку; нездатність пацієнта підтримувати задовільну реакцію на SSRI-терапію після вихідного періоду задовільної реакції; та розлади з судомами, охоплюючи хвороба Туретта. Як приклад, ссавець, що потребує лікування або попередження, може бути людиною. Як ще один приклад, ссавець, що потребує лікування або попередження, може не бути людиною. Фармацевтично прийнятні солі сполук формули І охоплюють їх кислотно-адитивні солі та солі основ. Придатні кислотно-адитивні солі утворюють з кислот, котрі утворюють нетоксичні солі. Приклади охоплюють ацетат, аспартат, бензоат, безилат, гідрокарбонат/карбонат, гідросульфат/сульфат, 17 борат, камзилат, цитрат, едизилат, езилат, форміат, фумарат, глюцептат, глюконат, глюкуронат, гексафлуорфосфат, гібензат, гідрохлорид/хлорид, гідробромід/бромід, гідройодид/йодид, ізетіонат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафталат, 2-напзилат, нікотинат, нітрат, оротат, оксалат, пальмітат, памоат, фосфат/гідрофосфат/дигідрофосфат, сахарат, стеарат, сукцинат, тартрат, тозилат та трифлуорацетат. Придатні солі основ утворюють з основ, котрі утворюють нетоксичні солі. Приклади охоплюють солі алюмінію, аргініну, бензатину, кальцію, холіну, діетиламіну, діоламіну, гліцину, лізину, магнію, меглумін, оламіну, калію, натрію, трометаміну та цинку. Гемісолі кислот та основ можуть бути утвореними також, наприклад, гемісульфати та гемікальцієві солі. Для огляду придатних солей, дивись "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" by Stahl and Wermuth (WileyVCH, Weinheim, Germany, 2002). Сполуки винаходу можуть існувати у несольватованій та сольватованій формах. Термін 'сольват' застосовують тут для опису молекулярного комплексу, що містить сполук винаходу та стехіометричну кількість одної або більше фармацевтично прийнятних молекул розчиннику, наприклад, етанолу. Термін 'гідрат' застосовують, коли вказаний розчинник є водою. Охоплені рамками винаходу є комплекси, як-то клатрати, комплекси включення ліки-хазяїн, де на відміну до вищезгаданих сольватів ліки та хазяїн є присутніми у стехіометричній або нестехіометричній кількості. Також охоплені комплекси ліків, що містять два або більше органічних та/або неорганічних компонентів, котрі можуть бути у стехіометричній або нестехіометричній кількості. Утворені комплекси можуть бути іонізованими, частково іонізованими або неіонізованими. Для огляду таких комплексів, дивись J Pharm Sci, 64 (8), 1269-1288 by Haleblian (August 1975). Далі усі посилання на сполуки формули І охоплюють посилання на їх солі, сольвати та комплекси та на сольвати та комплекси їх солей. Сполуки винаходу охоплюють сполуки формули І, що визначено вище, у тому числі усі їх поліморфи та кристалічні форми та їх ізомери (охоплюючи оптичні, геометричні та таутомерні ізомери), які визначено далі, та мічені ізотопами сполуки формули І. Сполуки формули І, що містять один або більше асиметричних атомів карбону можуть існувати як два або більше стереоізомерів. Де структурні ізомери є взаємоперетворюваними внаслідок низького енергетичного бар'єру, може відбуватися таутомерна ізомерія ('таутомерія'). Вона може приймати форму протонної таутомерії у сполуках формули І, що містять, наприклад, іміно, кето, або оксимогрупу, або так званої валентної таутомерії у сполук, котрі містять ароматичну групу. Ясно, що одинична сполука може виявляти більше, ніж один тип ізомерії. 88719 18 Охопленими рамками заявленого винаходу є усі стереоізомери, геометричні ізомери та таутомерні форми сполук формули І, охоплюючи сполуки, що виявляють більше, ніж один тип ізомерії, та суміші одно або більше їх. Також охоплені кислотно-адитивні солі або солі основ, де протиіон є оптично активним, наприклад, d-лактат або I-лізин, або рацемічним, наприклад, dl-тартрат або dlаргінін. Якщо не вказане інше, термін "галоген", як це застосовано тут, охоплює флуор, хлор, бром та йод. Якщо не вказане інше, термін "(С1-С4)алкіл", як це застосовано тут, охоплює насичену вуглеводневу групу з розгалуженим чи нерозгалуженим ланцюгом, що має від 1 до 4 атомів карбону та охоплює, наприклад, метил, етил, пропіл, і-пропіл, н-бутил, і-бутил, втор-бутил та т-бутил. Це також кажуть, якщо алкіл несе замісники або є замісником для ще одної групи, наприклад, у -О-(С1С4)алкілі та -С(О)(С1-С4)алкілі. Якщо не вказане інше, термін "(С1-С4)алкокси", як це застосовано тут, охоплює алкоксили з розгалуженим чи нерозгалуженим ланцюгом та охоплює, наприклад, метоксил, етоксил, н-пропоксил, іпропоксил, н-бутоксил, і-бутоксил, втор-бутоксил та т-бутоксил. Якщо не вказане інше, термін "(С2-С6)алкілен", як це застосовано тут, охоплює двовалентний радикал, похідний від алкану з розгалуженим чи нерозгалуженим ланцюгом, що містить від 2 до 6 атомів карбону. Прикладами (С2-С6)алкіленів є метилен, етилен (1,2-етилен або 1,1-етилен), триметилен (1,3-пропілен), тетраметилен (1,4бутилен), пентаметилен та гексаметилен. Якщо не вказане інше, термін "(С3С6)циклоалкіл", як це застосовано тут, охоплює насичений моноциклічний карбоцикл, що має 3-6 атомів карбону та охоплює, наприклад, циклопропіл, циклобутил, циклопентил та циклогексил. Якщо не вказане інше, термін "насичений гетероцикл", як це застосовано тут, охоплює насичені моноцикли, що мають 4-7 кільцевих членів, котрі містять 1 атом нітрогену. Прикладами насичених гетероциклів є азетидиніл, піролідиніл та піперидиніл. Якщо не вказане інше, термін "гетероароматичний", як це застосовано тут, охоплює моноциклічні або біциклічні гетероароматичні групи, що мають 5-9 та 5-10 кільцевих членів, котрі містять 1, 2, 3 або 4 гетероатомів, вибраних з групи нітроген, оксиген та сульфур. Гетероароматична група може бути незаміщеною, монозаміщеною або дизаміщеною. Приклади гетероарилів охоплюють, але без обмеження тіофеніл, фураніл, піроліл, піразоліл, імідазоліл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, триазоліл, оксадіазоліл, тіадіазоліл, тетразоліл, піраніл, піридиніл, піразиніл, піримідиніл, піридазиніл, триазиніл, тіадіазиніл, ізобензофураніл, бензофураніл, хроманіл, індолізиніл, ізоіндоліл, індоліл, індазоліл, пуриніл, хінолініл, ізохіноліл, цинолініл, фталазиніл, нафтаридиніл, хіназолініл, хіноксалініл, бензоксазоліл, бензотіазоліл, бензімідазоліл, бензофураніл, бензотіофе 19 88719 20 ніл, піролопіразиніл, піролопіридиніл, та імідазопіридиніл. Сполуку формули І згідно з винаходом можна отримувати загальним способом, показаним у схемі 1. У схемі 1, сполуки формули (І) є отримують таким чином. Етап А: Арилбромід загальної структури 2 перетворюють у металоорганічний реагент, як-то: літійорганічний, магнійорганічний галогенід, церійорганічний, титанорганічний, цинкорганічний, купруморганічний, або алюмоорганічний реагент. Магнійорганічний галогенід (реагент Гриньяра) або літійорганічний реагент є кращими. Наприклад літійорганічний реагент можна отримувати реакцією арилброміду (2) з H-BULI. Реакцію звичайно здійснюють у реакційно-інертному розчиннику, як-то тетрагідрофуран, при температурі приблизно між -78°С та кімнатною температурою. До цього літійорганічного реагенту приблизно при -78°С додають розчин 3оксоциклобутанкарбонової кислоти (J. Org. Chem 1988, 53, 3841 та J. Org. Chem. 1996, 61, 2174), попередньо охолодженої до -78°С, де кращим розчинником є тетрагідрофуран. Після повного додавання реакційній суміші дають повільно нагрітися до кімнатної температури, отримуючи сполуку загальної структури 3. Етап В: Інтермедіат загальної структури 3 може реагувати з первинним або вторинним аміном загальної формули HNR1R2 де R1 та R2 визначаено в описі амінів, у присутності реагенту сполучення, як-то дициклогексилкарбодіімід, карбонілдіімідазол, трипропілфосфоновий ангідрид, алкілхлорформіат, біс(2-оксо-3-оксазолідиніл)фосфінхлорид, бензотриазол-1-ілокси-трис(диметиламіно)фосфоній гексафлуорфосфат, або будь-які інші такі стандартні літературні реагенти у присутності триалкіламінової основи, як-то триетиламін або діізопропілетиламін, де трипропілфосфоновий ангідрид та триетиламін є кращою комбінацією у реакційноінертному розчиннику, де етилацетат є кращим, від -78°С до 40°С, де кімнатна температура є кращою, отримуючи N-ациловані сполуки загальної структури 4, сполуки формули І. Етап С: Усунення бензилового спирту (4) досягають реакцією (4) з кислотою, переважно з трифлуороцтовою кислотою, чистою або у реакційноінертному розчиннику, як-то метиленхлорид або 1,2-дихлоретан при температурі реакції приблизно від кімнатної температури до температури кипіння застосованого розчиннику, де приблизно 75°С є кращою температурою реакції, отримуючи сполуку загальної структури 5. Етап D: Відновлення циклобутену, (5) можна досягти реакцією (5) у реакційно-інертному розчиннику, де кращими розчинниками є етиловий спирт та етилацетат. Відновлення можна досягти, застосовуючи водень приблизно при 45 фунт/кв.дюйм та каталізатор, де кращими каталізаторами гідрогенування є каталізатор Уілкінсона [хлортрис(трифенілфосфін)родій(І)], або паладій, 510мас.% на активованому вугіллі, отримуючи (6), сполуку загальної формули І. Етап Е: 21 88719 22 Перетворення бензиламінів загальної структури (6) у бензилхлориди загальної структури (7) досягають, застосовуючи умови, описані у літературі, наприклад, (Nevill, C.R.; Fuchs, P.L; SYNCAV; Synth. Commun.; EN; 20; 5; 1990; 761-772). Реакція (6) з етилхлорформіатом у реакційно-інертному розчиннику, де 1,2-дихлоретан, або метиленхлорид є кращими при температурі реакції приблизно від -78°С до кімнатної температури, де кімнатна температура є кращою, дає бензилхлориди загальної структури (7). Етап F: Реакція бензилхлориду (7) з первинним або вторинним аміном загальної формули HNR1R2, де R1 та R2 визначено в описі амінів, у реакційноінертному розчиннику, де 1,2-дихлоретан або метиленхлорид є кращими, у присутності третинної амінової основи, де триетиламін є кращим, при температурі реакції приблизно від кімнатної температури до температури кипіння застосованого розчиннику, приблизно 55°С є кращими, дає (8), сполуку загальної формули І. У схемі 2, сполуки формули (І) є отримують таким чином Етап G: Етерифікації Фішера можна досягти, застосовуючи стандартні умови з літератури, відомі спеціалістам. Наприклад: реакція гідроксилу (4) з алкілгалогенідом, як-то: алкілхлорид, алкілбромід, або алкілйодид у присутності основи, де NaH є кращим, та у присутності Nal або NaBr, у реакційно інертному розчиннику, де диметилформамід є кращим, при температурі реакції від кімнатної температури до 100°С, де 65°С є кращими, дає (8), сполуку формули І. Етап Е: (Дивись Етап Ε вище) Етап F: (Дивись Етап F вище) У схемі 3, сполуки формули (І) отримують таким чином. Етап Н: Реакція сполуки загальної структури (4) з флуорувальним реагентом дає сполуки загальної формули 13. Кілька реагентів є доступними для перетворення спиртів у алкілфлуориди, наприклад, 23 Caldwell, Charles G; et al (Bioorg. Med. Chem. Lett.; EN; 14; 5; 2004; 1265-1268) застосовують BAST. Інші приклади у літературі застосовують DAST для безпосереднього перетворення спиртів в алкілфлуориди. Реакція гідроксилу (3) з біс(2метоксіетил)аміносульфур трифлуоридом у реакційно-інертному розчиннику, де метиленхлорид або тетрагідрофуран є кращими, при температурі реакції приблизно від -78°С до кімнатної температури дає (11), сполуку формули І. Етап Е: (дивись Етап Ε вище) Етап F: (дивись Етап F вище) Зразкові сполуки формули І згідно із заявленим винаходом є такими: N-Метил-2-піридин-3-іл-N-[3-(4-піролідин-1ілметил-фенокси)-циклобутилметил]-ацетамід; [3-Гідрокси-3-(4-піролідин-1-ілметил-феніл)циклобутил]-морфолін-4-іл-метанон; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти метиламід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти метиламід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти метиламід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти метиламід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти диметиламід; [3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутил]-піперидин-1-іл-метанон; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти ізобутилметил-амід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти циклопропілметил-амід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти метил(тетрагідро-піран-4-ілметил)-амід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти циклопропілметил-метил-амід; [3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутил]-(2,3-дигідро-5Нбензо[f][1,4]оксазепін-4-іл)-метанон; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти метил-(3метил-піридин-2-ілметил)-амід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти диметиламід; [3-(3-Флуор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутил]-піролідин-1-іл-метанон; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти ізобутиламід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти етиламід; 88719 24 3-(3-Флуор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти етилметил-амід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти диметиламід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти диметиламід; [3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутил]-піролідин-1-іл-метанон; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти ізобутил-амід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти етиламід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти етил-метил-амід; [3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутил]-піперидин-1-іл-метанон; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти ізобутилметил-амід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти циклопропілметил-амід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти метиламід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти метиламід; 3-(2,6-Дифлуор-4-піролідин-1-ілметил-феніл)3-флуор-циклобутанкарбонової кислоти метиламід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти метил(тетрагідро-піран-4-ілметил)-амід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти циклопропілметил-метил-амід; [3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутил]-(2,3-дигідро-5Нбензо[f][1,4]оксазепін-4-іл)-метанон; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти метил-(3метил-піридин-2-ілметил)-амід; [3-(3,5-Дифлуор-4-піролідин-1-ілі\летилфеніл)-3-гідрокси-циклобутил]-піролідин-1-ілметанон; [3-(3,5-Дифлуор-4-піролідин-1-ілметил-феніл)3-флуор-циклобутил]-піролідин-1-іл-метанон; 3-(5-Хлор-2-флуор-4-піролідин-1-ілметилфеніл)-3-гідрокси-циклобутанкарбонової кислоти ізобутил-амід; 3-(5-Хлор-2-флуор-4-пірол ідин-1-ілметилфеніл)-3-флуор-циклобутанкарбонової кислоти ізобутил-амід; 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти метиламід; 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти диметиламід; 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етиламід; 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етил-метиламід; 25 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти ізобутиламід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)-3метокси-циклобутанкарбонової кислоти етилметил-амід; [3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутил]-піролідин-1-іл-метанон; 3-(2,3-Дихлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти диметиламід; 3-(2,3-Дихлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти диметиламід; {3-[3-Хлор-4-((R)-2-метил-піролідин-1-ілметил)феніл]-3-гідрокси-циклобутил}-піролідин-1-ілметанон; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти етил амід; 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти етиламід; {3-[3-Хлор-4-((R)-2-метил-піролідин-1-ілметил)феніл]-3-флуор-циклобутил}-піролідин-1-ілметанон; {3-[3-Хлор-4-((R)-2-метил-піролідин-1-ілметил)феніл]-циклобутил}-піролідин-1-іл-метанон; 3-(2,3-Дихлор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти диметиламід; 3-Флуор-3-[3-флуор-4-((S)-2-метил-піролідин1-ілметил)-феніл]-циклобутанкарбонової кислоти етиламід; 3-Флуор-3-[3-флуор-4-((R)-2-метил-піролідин1-ілметил)-феніл]-циклобутанкарбонової кислоти етиламід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти етиламід; 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти ізобутил-амід; та 3-аза-біцикло[3,2,2]nоnаn-3-іл(3-(3-флуор-4(піролідин-1-ілметил)феніл)-3гідроксициклобутил)метанон. У прикладах нижче наступні терміни мають загальні значення: BAST: [біс(2-метоксіетил)аміно]сульфур трифлуорид Дезоксо-флуор: [біс(2метоксіетил)аміно]сульфур трифлуорид Т3Р: 2,4,6-трипропіл-1,3,5,2,4,6триоксатрифосфоринан-2,4,6-триоксид ДІПЕА: діізопропілетиламін ДМФ: диметилформамід MgSO4: магній сульфат DMA: диметилацетамід РХ-МС: мас-спектрометрія низького розділення ДХЕ 1,2-дихлоретан EtOAc: етилацетат J: стала сполучення (у ЯМР) LAH: літій алюмогідрид PPTs: піридиній п-толуолсульфонат TsO: п-толуолсульфонат Rf: фактор утримання (у хроматографії) Rt: час утримання (у хроматографії) s: синглет (ЯМР), t: триплет 88719 26 ТФОК: трифлуороцтова кислота ТФОА: трифлуороцтовий ангідрид ТГФ: тетрагідрофуран ТШХ тонко-шарова хроматографія Ts: тозил, п-толуолсульфоніл TsOH: п-толуолсульфонова кислота apt: видимий триплет Розчинники були отриманими та застосовуваними без очистки. Вихід розраховували для матеріалу оціненого гомогенним за допомогою тонкошарової хроматографії та ЯМР Тонко-шарову хроматографію було проведено на планшетах Merck Kieselgel 60 F 254, елюючи показаними розчинниками, візуалізована за допомогою УФ-лампи 254нм, та проявлено водним розчином KМnО4 або етанольним розчином 12-молібдофосфатної кислоти. Колонкову флеш-хроматографією, якщо не вказане інше, було проведено, застосовуючи попередньо упаковані колонки Biotage™ або ISCO. Спектри ядерного магнітного резонансу (ЯМР) були отримані на Unity 400 або 500 при 400МГц або 500МГц для 1Н, відповідно, та 100МГц або 125МГц для 13С ЯМР, відповідно. Хімічні зсуви для спектрів 1Н ЯМР показано у частинах на мільйон відносно синглету CDCI3 при 7,24млн-1. Хімічні зсуви для спектрів 13С ЯМР показано у частинах на мільйон відносно середньої лінії триплету CDCI3 при 77,0млн-1 Мас-спектральні аналізи були проведеними на спектрометрі АРСІ Gilson 215, micromass ZMD (50% Ацетонітрил/50% вод). ВЕРХ було проведено наступними способами: Спосіб А: Препаративні умови (Waters 600 & Waters 2767 Система керування зразками); Колонка: Waters Symmetry C18, 5мкм, 30×150мм стальна колонка, частина №WAT248000, серійний №М12921А01; розчинник А - 0,1% Трифлуороцтова кислота/вода; розчинник В - Ацетонітрил; об'єм ін'єкції: 850мкл; час 0,0, 100% розчинник А, 0% розчинник В, потік 20; час 2,0, 100% розчинник А, 0% розчинник В, потік 20; час 12,0, 0% розчинник А, 100% розчинник В, потік 20; час 15,0, 0% розчинник А, 100% розчинник В, потік 20; час 15,1, 100% розчинник А, 0% розчинник В, потік 20; час 20,0, 100% розчинник А, 0% розчинник В, потік 20. Mac-спектральні (micromassZO) умови; Капіляр (кВ): 3,0; Конус (V): 20; Екстрактор (V): 3,0; RFлінза (V): 0,5; Температура джерела. (°С): 120; Температура десольватації (°С): 360; Потік десольватаційного газу (л/годин): 450; Потік конусного газу (л/годин): 150; LM Розділення: 15; НМ Розділення: 15; Енергія іона: 0,2; Мультиплейєр: 550. температура де сольватації. Розподільник; РХ Packings, 1/10,000; Гольчатий клапан установки: 14; Насос (Waters 515) Потік (мл/хвил.): 1. PDA (Waters 996) Установки; Початок/Кінець довжин хвиль (нм): 200/600; Розділення: 1,2; Оцінка зразку: 1; Канали: TIC, 254нм та 220нм. Спосіб В: Препаративні умови (Waters 600 & Waters 2767 Система керування зразками); Колонка: Waters Xterra PrepMS С™, 5мкм, 30×150мм стальна колонка, частина №186001120, серійний №Т22881Т 09; розчинник А - 0,1% Трифлуороцтова кислота/вода; розчинник В - Ацетонітрил; об'єм ін'єкції: 1050мкл; час 0,0, 100% розчинник А, 0% 27 розчинник В, потік 20; час 2,0, 100% розчинник А, 0% розчинник В, потік 20; час 12,0, 0% розчинник А, 100% розчинник В, потік 20; час 14,0, 0% розчинник А, 100% розчинник В, потік 20; час 14,1, 100% розчинник А, 0% розчинник В, потік 20; час 19,1, 100% розчинник А, 0% розчинник В, потік 20. Mac-спектральні (micromassZO) умови; Капіляр (кВ): 3,0; Конус (V): 20; Екстрактор (V): 3,0; RFлінза (V): 0,5; Температура джерела. (°С): 120; Температура десольватації (°С): 360; Потік десольватаційного газу (л/годин): 450; Потік конусного газу (л/годин): 150; LM Розділення: 15; НМ Розділення: 15; Енергія іона: 0,2; Мультиплейєр: 550. Розподільник; РХ Packings, 1/10,000; Гольчатий клапан установки: 14; Насос (Waters 515) Потік (мл/хвил.): 1. PDA (Waters 996) Установки; Початок/Кінець довжин хвиль (нм): 200/600; Розділення: 1,2; Оцінка зразку: 1; Канали: TIC, 254нм та 220нм. Спосіб С: Препаративні умови (Waters 600 & Waters 2767 Система керування зразками); Колонка: Waters Symmetry C18, 5мкм, 30×150мм стальна колонка, частина №WAT248000, серійний №М12921А01; розчинник А - 0,1% Трифлуороцтова кислота/вода; розчинник В - Ацетонітрил; об'єм ін'єкції: 850мкл; час 0,0, 90% розчинник А, 10% розчинник В, потік 20; час 10,0, 0% розчинник А, 100% розчинник В, потік 20; час 12,0, 0% розчинникА, 100% розчинник В, потік 20. Mac-спектральні (micromassZO) умови; Капіляр (кВ): 3,0; Конус (V): 20; Екстрактор (V): 3,0; RFлінза (V): 0,5; Температура джерела. (°С): 120; Температура десольватації (°С): 360; Потік десольватаційного газу (л/годин): 450; Потік конусного газу (л/годин): 150; LM Розділення: 15; НМ Розділення: 15; Енергія іона: 0,2; Мультиплейєр: 550. Розподільник; РХ Packings, 1/10,000; Гольчатий клапан установки: 14; Насос (Waters 515) Потік (мл/хвил.): 1. PDA (Waters 996) Установки; Початок/Кінець довжин хвиль (нм): 200/600; Розділення: 1,2; Оцінка зразку: 1; Канали: TIC, 254нм та 220нм. Наступні інтермедіати можна отримувати показаними способами: Інтермедіат 1 1-(2,3-Дихлорбензил)піролідин. NaHB(OAc)3 (15,1г, 0,0714ммоль) було додано при енергійному перемішуванні порціями до розчину 2,3-дихлорбензальдегіду (10г, 0,057ммоль) та піролідину (5,97мл, 0,0714ммоль) у СН2СІ2 (200мл). Реакційну суміш енергійно перемішували протягом ночі. Тоді 5Η NaOH (50мл) було додано, та шари були відділеними. Продукт було екстраговано з водного шару СН2СІ2 (2×50мл). Комбіновані екстракти були промитими 5Η NaOH (50мл), водою, розсолом, висушеними безводним Na2SO4, та випареними. Залишок було відігнано у вакуумі, отримуючи заголовну сполуку (10,5г, 90%) як безбарвну рідину (тчк.кип.80-84°С/0,5MM Hg). Дані РХ/МС: 229,9, 230,9, 231,9 (М+Н) (розраховано для С11Н13Сl2N 230,14). 1Н ЯМР-дані (ДМСО-d6): δ 7,52 (dd, 1H, J1=1,5Гц, J2=7,8Гц), 7,46 (dd, 1H, J1=1,5Гц, J2=7,8Гц), 7,33 (t, 1H, J=7,8Гц), 3,70 (s, 2H), 2,46-2,52 (m, 4Н), 1,66-1,75 (m, 4Н). Приклад 1 88719 28 3-[2,3-Дихлор-4-(піролідин-1-ілметил)феніл]-3гідрокси-N,N-диметилциклобутанкарбоксамід. 1,3Μ розчин н-BuLi у циклогексані (3,7мл, 4,8ммоль) було додано протягом 5хвил. до розчину інтермедіату 1, 1-(2,3-дихлорбензил)піролідину (1,0г, 4,4ммоль) та TMEDA (0,73мл, 4,8ммоль) в абсолютному ТГФ (10мл) у потоці аргону при -90 -100°С. Реакційну суміш перемішували при -85 - 90°С протягом 30хвил. Тоді розчин 3оксоциклобутанкарбонової кислоти (250мг, 2,2ммоль), (J. Org Chem. 1988, 53, 3841 та J. Org. Chem. 1996, 61, 2174) у ТГФ (2мл) було додано краплями протягом 2хвил. при -100°С. Суміш тоді гріли до 0°С протягом 30хвил. та випарювали до сухого стану. Залишок було розчинено у ДМФ (10мл), та було додано диметиламін гідрохлорид (410мг, 5,0ммоль). Тоді було додано порціями ВОР (1,3г, 3,0ммоль) при охолодженні у льодяній бані. Реакційну суміш перемішували протягом 16 годин при кімнатній температурі. Зникнення вихідної гідроксикислоти було відстежено за допомогою РХ/МС. Реакційну масу було випарено до сухого стану під 1мм Hg. Вода (10мл), Et2O (15мл), та насичений розчин K2СО3 (5мл) були доданими. Шари були відділеними, та водний екстрагували Et2O (2×20мл). Комбінований органічний шар було висушено Na2SO4 та випарено. Залишок було очищено хроматографією (30мл силікагелю 63/100мкм, СНСІ3/МеОН 100:0→90:10). Фракції, що містять продукт, збирали, концентрували під зменшеним тиском, отримуючи заголовну сполуку (0,30г, 37%). Дані РХ/МС: 371,0, 372,0, 373,0 (М+Н) (розраховано для C18H24CI2N2O2 371,31); 1Н ЯМРдані (ДМСО-d6): δ 7,57 (d, 1H, АrН, J=8,0Гц), 7,43 (d, 1H, ArH, J=8,0Гц), 5,59 (s, 1H, ОН), 3,71 (s, 2H, СН2Аr), 2,88-2,97 (m, 2Н), 2,86 (s, 3Н NMe), 2,82 (s, 3Н, NMe), 2,67-2,78 (m, 1Н), 2,50-2,57 (m, 6Н+ДМСО), 1,67-1,77 (m, 4Н). Гідрохлорид було зроблено, застосовуючи НСІ, етер. Колбу з гвинтовою кришкою на 8мл завантажували 3-[2,3дихлор-4-(піролідин-1-ілметил)феніл]-3-гідроксиN,N-диметилциклобутанкарбоксамідом (60мг, 0,161ммоль) та 0,5мл МеОН. Тоді 0,2мл 2М НСІ в етері було додано, випарено та висушено, отримуючи оливу, котру було знов розчинено у 1мл ДХМ, випарено та висушено, отримуючи 62мг білого гігроскопічного твердого гідрохлориду. РХ-МС (М+Н): 371,1; 1Н ЯМР (300МГц, ДMCO-d6): δ 10,57 (br. s, 1H), 7,80 (d, J=8,1Гц, 1Н), 7,73 (d, J=8,2Гц, 1H), 4,57 (d, J=5,64Гц, 2H), 3,50-3,70 (m, 3H), 3,403,50 (m, 3H), 2,90-2,97 (m, 2H), 2,86 (s, 3H), 2,83 (s, 3H), 2,69-2,75 (m, 1H), 2,03-2,07 (m, 2H), 1,80-1,94 (m, 2H). Інтермедіат 2 3-[2,3-дихлор-4-(піролідин-1-ілметил)феніл]N,N-диметилциклобут-2-ен-1-карбоксамід, трифлуорацетат. Розчин 3-[2,3-дихлор-4-(піролідин-1ілметил)феніл]-3-гідрокси-N,Nдиметилциклобутанкарбоксаміду (250мг, 0,673ммоль) та ТФОК (1,04мл, 13,5ммоль) у 5мл ДХЕ кип'ятили під зворотним холодильником під аргоном протягом 6 годин, тоді додаткову кількість ТФОК (1,04мл, 13,5ммоль) було додано та суміш кип'ятили під зворотним холодильником протягом 29 20 годин. Суміш було випарено до сухого стану. Згідно з даними РХ-МС реакційна суміш містила до 70% заголовної сполуки (353, 354, 355 (М+Н) (розраховано для C18H22CI2N2O 353,29)). Суміш було застосовувано на наступному етапі без додаткової очистки. Приклад 2 транс-3-[2,3-Дихлор-4-(піролідин-1ілметил)феніл]-N,Nдиметилциклобутанкарбоксамід, гідрохлорид. До розчину інтермедіату 2, 3-[2,3-дихлор-4(піролідин-1-ілметил)феніл]-N,N-диметилциклобут2-ен-1-карбоксамід, трифлуорацетат (0,673ммоль) у 5мл етанолу було додано хлортрис(трифенілфосфін)родій(І) (63мг, 0,0673ммоль). Суміш гідрогенували (40 фунт/кв.дюйм Н2, 50°С) протягом 3 годин; реакційну суміш було відстежено за допомогою РХ-МС. Суміш було випарено до сухого стану, тоді було додано до залишку 5мл 1Η НСІ та розчин було екстраговано етилацетатом (2×5мл), органічні шари видаляли. 10Ν NaOH (1мл) було додано до водного шару та водний розчин було екстраговано етилацетатом (3×5мл). Органічні шари були висушеними та випареними у вакуумі. Залишок було очищено хроматографією (SiO2 63/100мкм, 10г, СНСІ3/гексан 80:20→100:0, СНСІ3/МеОН 100:0→90:10). Фракції, що містять продукт, були випареними. Залишок було розчинено у 2мл етеру та 0,1мл 4Η НСІ/діоксан було додано при перемішуванні. Суміш було випарено; залишок було висушено у вакуумі, отримуючи заголовну сполуку (74мг, 28%) як білий твердий матеріал. РХ-МС дані: 355, 356, та 357 (М+Н)+ (розраховано для C18H24CI2N2O 355,31). 1Н ЯМР-дані (CD3OD): δ 7,69 (d, 1Н, J=8,1Гц), 7,58 (d, 1H, J=8,1Гц), 4,62 (s, 2H), 3,88-3,98 (m, 1H), 3,54-3,63 (m, 2Н), 3,35-3,45 (m, 1H), 3,25-3,34 (m, 2H+MeOH), 2,99 (s, 6H), 2,71-2,79 (m, 2H), 2,42-2,52 (m, 2H), 2,16-2,27 (m, 2H), 1,98-2,12 (m, 2H). Приклад 3 3-[2,3-дихлор-4-(піролідин-1-ілметил)феніл]-3флуор-N,N-диметилциклобутанкарбоксамід гідрохлорид. Колбу з гвинтовою кришкою на 8мл, оснащену магнітною мішалкою та мембранною кришкою, завантажували Деоксо-Флуор (Aldrich, 85,5мг, 0,387ммоль) та 3мл безводного ДХМ під азотом. Тоді суміш було охолоджено до -75°С та було додано розчин прикладу 1,3-[2,3-дихлор-4-(піролідин1-ілметил)феніл]-3-гідрокси-N,Nдиметилциклобутанкарбокс-аміду (130мг, 0,350ммоль) у 2мл безводного ДХМ. Суміш перемішували протягом 1 години при -75°С, тоді відбирали зразок для РХ-МС, котра показала 60% перетворення. Тоді ще Деоксо-флуор (Aldrich, 85,5мг, 0,387ммоль) було додано, перемішувано при 75°С протягом 10хвил., це гріли до 0°С та гасили насиченим Na2CO3 (2мл). РХ-МС показала повне перетворення. Тоді було додано 1мл 2Η NaOH та шар ДХМ було відділено, висушено Na2SO4, та випарено. Сиру оливу було очищено на колонці (від ДХМ 99%, NH4OH 1% до ДХМ 98%, МеОН 1%, NH4OH 1%, Rf=0,51 у ДХМ 99%, NH4OH 1%), отримуючи 117мг (90%) продукту як безбарвну оливу. Цей матеріал було розчинено у 0,5мл Ме 88719 30 ОН, тоді було додано 0,3мл 2М НСІ в етері, випарено та висушено, отримуючи оливу, котру було знов розчинено у 1мл ДХМ, випарено та висушено, отримуючи заголовну сполуку (118мг) білого гігроскопічного твердого гідрохлориду. РХ-МС (М+Н): 373,3; 1Н ЯМР (300МГц, ДMCO-d6): δ 10,27 (br. s, 1Н), 7,81 (d, J=7,71Гц, 1H), 7,65 (dd, J1=8,1Гц, J2=2,07Гц, 1Н), 4,59 (d, J=5,64Гц, 2Н), 3,62-3,71 (m, 6Н), 3,45-3,50 (m, 2Н), 2,95 (s, 3Н), 2,85-2,88 (m, 1Н), 2,80 (s, 3H), 2,00-2,10 (т,2Н), 1,80-1,91 (m, 2Н). Інтермедіат 3 4-Бром-1-(бромметил)-2-хлорбензол. 4-Бром-2-хлор-1-метилбензол (CAS 89794-025, 30г, 0,15моль) та N-бромсукцинімід (26г, 0,15моль) були змішаними у ССІ4 (300мл). Азобіс(2-метилпропіонітрил) (~0,3г) було додано порціями при енергійному перемішуванні та кип'ятінні під зворотним холодильником. Суміш кип'ятили під зворотним холодильником протягом ЗОхвил. та охолоджували. Осад було відфільтровано та видалено. Фільтрат було випарено. Залишок було відігнано при 1мм Hg, тчк.кип.75°С, отримуючи заголовну сполуку (28г, 65%). 1Н ЯМР-дані (CDCI3): δ 7,57 (d, J=1,9Гц, 1Н ArH), 7,39 (dd, 1Н, J1=1,9Гц, J2=8,1Гц, АrН), 7,31 (d, 1H, J=1,9Гц, АrН), 4,53 (s, 2H, АrСН2). Інтермедіат 4 (2R)-1-(4-бром-2-хлорбензил)-2метилпіролідин. Інтермедіат 3, 4-бром-1-(бромметил)-2хлорбензол (15,4г, 55ммоль) було додано до суміші (2R)-2-метилпіролідину НВr (9,0г, 55ммоль), калій карбонату (18г, 130ммоль), та 150мл диметилформаміду при охолодженні льодом. Суміші давали досягти кімнатної температури, та перемішування продовжували протягом ночі. Суміш було випарено. Воду (400мл) було додано з наступним додаванням 5М NaHSO4 до рН~2. Органічний шар було відділено. Водну фазу було екстраговано Et2O (2×200мл). Органічні шари видаляли. Водну фракцію було підлужено K2СО3 до рН~12 та це екстрагували Et2O (2×300мл). Органічний шар було промито розсолом, висушено безводним Na2SO4 (100г), та випарено у вакуумі. Залишок було відігнано при 1мм Hg, тчк.кип.95°С, отримуючи заголовну сполуку (12,25г, 79%). Дані РХ/МС: 289,9 та 287,9 (М)+ (розраховано для C12H15BrCIN 288,6). 1Н ЯМР-дані (ДMCO-d6): δ 7,66 (d, 1Н, J=1,9Гц, Ar-H); 7,52 (dd, 1H, J,=1,9Гц, J2=8,0Гц, ArH), 7,43 (d, 1H, J=8,1Гц, Ar-H), 3,91 (d, 1H, J=14,4Гц), 2,28 (d, 2H, J=8,5Гц); 2,78-2,85 (m, 1H); 2,42-2,49 (m, 1H); 2,11 (dd, 1H, J,= 8,8Гц, J2=17,6Гц); 1,87-1,97 (m, 1H); 1,57-1,67 (m, 2H); 1,27-1,39 (m, 1H); 1,08 (d, 3H, J=5,9Гц). Інтермедіат 5 Піролідин гідрохлорид. 4Η НСІ/діоксан (70,5мл) було додано до розчину піролідину (20г, 0,28моль) у діоксані (20мл). Реакційну суміш було випарено Залишок було перекристалізовано з Et2O, відділено фільтруванням, промито етером та висушено, отримуючи заголовну сполуку (28,5г, 96%) як білі кристали. 1Н ЯМРдані (ДМСО-d6): δ 9,40 (br.s, 2Н, NH+); 3,00-3,13 (m, 4H); 1,77-1,85 (m, 4H). 31 Приклад 4 1-(3-Хлор-4-{[(2R)-2-метилпіролідин-1іл]метил}феніл)-3-(піролідин-1ілкарбоніл)циклобутанол. 2,7Μ розчин н-BuLi у гептан (3,6мл, 9,6ммоль) було додано протягом 5хвил. до розчину інтермедіату 4, (2R)-1-(4-бром-2-хлорбензил)-2метилпіролідину. (2,52г, 8,8ммоль) в абсолютному ТГФ (20мл) у потоці аргону при -78 - -80°С. Реакційну суміш перемішували при -78 - -80°С протягом 15хвил. Тоді розчин 3оксоциклобутанкарбонової кислоти (500мг, 4,4ммоль) в абсолютному ТГФ (4мл) було додано краплями протягом 5хвил. при -80°С. Суміш гріли до 0°С протягом 1 години та випарювали до сухого стану. Залишок було розчинено у ДМФ (10мл), було додано інтермедіат 5, піролідин НСІ (520мг, 4,8ммоль). Тоді було додано порціями ВОР (2,2г, 4,8ммоль) при охолодженні у льодяній бані протягом 16 годин при кімнатній температурі. Зникнення вихідної гідроксикислоти було відстежено за допомогою РХ/МС. Реакційну масу було випарено до сухого стану під 1мм Hg. Вода (100мл), ЕtOАс (50мл), та насичений розчин K2СО3 (до рН10) були доданими. Шари були відділеними, та водний екстрагували ЕtOАс (2×50мл). Комбінований органічний шар було промито водою (50мл), розсолом, висушено Na2SO4,Ta випарено. Залишок було очищено хроматографією (60мл силікагелю 63/100мкм, гексан/СНСІ3 20:80→0:100, тоді СНСІ3/МеОН 100:0→90:10). Фракцію з вмістом продукту збирали та концентрували, отримуючи заголовну сполуку (1,03г, 63%). Дані РХ/МС: 377,2 та 379,2 (М)+ (розраховано для C21H29CIN2O2 376,93). 1Н ЯМР-дані (ДМСО-d6): δ 7,51 (s, 1Н, АrН); 7,42-7,49 (m, 2Н, Ar-H), 5,75 (s, 1H, ОН); 3,96 (d, 1H, J=13,7Гц), 3,25-3,35 (m, ?H+H2O); 2,78-2,90 (m, 2Н); 2,53-2,60 (m, 2Н); 2,43-2,52 (m, 7Н+ДМСО); 2,06-2,16 (m, 1H); 1,88-1,97 (m, 1H); 1,80-1,87 (m, 2H); 1,72-1,79 (m, 2H); 1,57-1,67 (m, 2H); 1,29-1,40 (m, 1H); 1,11 (d, 3H, J=5,8Гц, СН3). Інтермедіат 6 (2R)-1-{2-хлор-4-[3-(піролідин-1ілкарбоніл)циклобут-1-ен-1-іл]бензил}-2метилпіролідин, трифлуорацетат. Розчин прикладу 4, 1-(3-Хлор-4-{[(2R)-2метилпіролідин-1-іл]метил}феніл)-3-(піролідин-1ілкарбоніл)циклобутанол (400мг, 1,06ммоль) та ТФОК (1,64мл, 21,2ммоль) у 4мл ДХЕ кип'ятили під зворотним холодильником під аргоном протягом 6 годин, тоді було додано додаткову кількість ТФОК (1,64мл, 21,2ммоль) та суміш кип'ятили під зворотним холодильником протягом 24 годин. Суміш було випарено до сухого стану. Згідно з даними РХ-МС реакційна суміш містила до 80% заголовної сполуки (359, 360, 361 (М+Н) (розраховано для C21H27CIN2O 358,92)). Утворену суміш було застосовувано на наступному етапі без додаткової очистки. Приклад 5 (2R)-1-{2-Хлор-4-[транс-3-(піролідин-1ілкарбоніл)циклобутил]бензил}-2-метилпіролідин гідрохлорид. До розчину інтермедіату 6, (2R)-1-{2-хлор-4-[3(піролідин-1-ілкарбоніл)циклобут-1-ен-1-іл]бензил} 88719 32 2-метилпіролідину, трифлуорацетату (1,06ммоль) у 5мл етанолу було додано хлортрис(трифенілфосфін)родій(І) (100мг, 0,106ммоль). Суміш гідрогенували (40 фунт/кв.дюйм Н2, при 50°С) протягом 3 годин. Реакційну суміш було відстежено за допомогою РХ-МС. Суміш було випарено до сухого стану, тоді 5мл 1Η НСІ було додано до залишку та розчин було екстраговано етилацетатом (2×5мл), органічні шари видаляли. 10Ν NaOH (1мл) було додано до водного шару та водний розчин було екстраговано етилацетатом (3×5мл). Органічні шари були висушеними та випареними у вакуумі. Залишок було очищено хроматографією (SiO2 63/100мкм, 10г, СНСІ3/гексан 80:20→100:0, СНСІ3/МеОН 100:0→90: 10). Фракції, що містять продукт, збирали та концентрували під зменшеним тиском Залишок було розчинено у 2мл етеру та 0,1мл суміші 4Η НСІ/діоксан було додано при перемішуванні. Розчинник було випарено; залишок було висушено у вакуумі, отримуючи гідрохлорид заголовної сполуки (80мг, 20%) як темножовтий аморфний твердий матеріал. РХ-МС дані: 361 та 363 (М+Н)+ (розраховано для C21H29CIN2O 360,93). 1Н ЯМР-дані (CD3OD): δ 7,63 (d, 1H, J=7,5Гц), 7,50 (s, 1H), 7,39 (d, 1H, J=7,5Гц), 4,75 (d, 1H, J=13,3Гц), 4,31 (d, 1H, J=13,3Гц), 3,63-3,77 (m, 2H), 3,34-3,52 (m, 7H), 2,64-2,75 (m, 2H), 2,33-2,49 (m, 3Н), 1,72-2,20 (m, 7Н), 1,51 (d, 3Н, J=6,3Гц). Приклад 6 (2R)-1-{2-Хлор-4-[цис-1-флуор-3-(піролідин-1ілкарбоніл)циклобутил]бензил}-2-метилпіролідин НСІ. Розчин прикладу 4, 1-(3-Хлор-4-{[(2R)-2метилпіролідин-1-іл]метил}феніл)-3-(піролідин-1ілкарбоніл)циклобутанол (250мг, 0,66ммоль) у 2мл СН2СІ2 було додано протягом 5хвил. до розчину Деоксо-флуору (282мг, 1,27ммоль) у СН2СІ2 (1мл) у потоці аргону при -78 - -80°С. Реакційну суміш перемішували при -78 - -80°С протягом 1 години. Суміші давали нагрітися до 0°С. Через 2 години, воду (50мл) було додано з наступним додаванням 10Η NaOH, рН~10. Шари були відділеними, та водний шар екстрагували СН2СІ2 (2×30мл). Комбінований органічний шар було промито розсолом, висушено Na2SO4, та випарено. Залишок було очищено хроматографією (10мл силікагелю 63/100мкм, гексан/СН2СІ2 20:80→0:100, тоді СН2СІ2/i-РrOН 100:0→95:5). Фракції, що містять продукт, збирали та концентрували. Залишок було розчинено в етері (3мл) та тоді було додано 4Η НСІ/діоксан (0,125мл), випарено та висушено у вакуумі, отримуючи гідрохлорид заголовної сполуки (158мг, 57%) як жовту оливу. Дані РХ/МС: 379,2 та 381,2 (М+Н)+ (розраховано для C21H28CIFN2O 378,92). 1Н ЯМР-дані (ДМСО-d6): δ 7,68-7,73 (m, 2Н, Аr-Н); 7,55-7,60 (m, 1Н, Ar-H); 4,34 (d, 1H, J=13,4Гц), 3,63-3,75 (m, 2H); 3,34-3,53 (m, 7H); 2,77-2,92 (m, 4H); 2,36-2,46 (m, 1H); 2,10-2,19 (m, 1H); 1,96-2,07 (m, 3Н); 1,87-1,94 (m, 2H); 1,72-1,84 (m, 1H); 1,52 (d, 3H, J=6,3Гц, СН3). Інтермедіат 7 3-(Морфолін-4-ілкарбоніл)циклобутанон. CDI (8,1г, 50ммоль) було додано до розчину 3оксо-циклобутанкарбонової кислоти (5г, 44ммоль) 33 при енергійному перемішуванні та охолодженні льодяною банею при 0°С протягом 5хвил. Реакційну суміш гріли до 25°С, перемішували при цій температурі протягом 1 години, охолоджували до °С, та було додано морфолін (4,5мл, 50ммоль). Реакційну суміш гріли до 25°С, перемішували при цій температурі протягом 3 годин, та випарювали у вакуумі. Залишок хроматографували на SiO2 (600мл, 40-63мм, ССІ4→СНСІ3→5% i-РrОН), отримуючи сполуку 4 (6,5г, 81%) як безбарвну оливу, котра тверднула у холодильнику. РХ МС - дані: М+ 184,1 та 185,1 (розраховано для C19H13NO4 183,21). 1Н-ЯМР (400МГц)-дані (ДMCO-d6): δ 3,543,60 (m, 4H), 3,43-3,52 (m, 5H), 3,16-3,32 (m, 4H). Приклад 7 [3-Гідрокси-3-(4-піролідин-1-ілметил-феніл)циклобутил]-морфолін-4-іл-метанон. При перемішуванні до розчину 1-(4-бромбензил)-піролідину (1,6г, 6,5ммоль) у ТГФ (20мл) при -78°С (баня ацетон/сухий лід) було додано повільно по стінці колби розчин н-ВuLі (2,6мл, 6,5ммоль, 2,5Μ ТГФ). Після 15 хвилин було повільно додано розчин інтермедіату 7, 3-(морфолін-4ілкарбоніл)циклобутанону (1,0г, 5,4ммоль, у 7мл ТГФ) попередньо охолодженого до -78°С. Після 30 хвилин реакцію гасили холодною 1Η НСІ (20мл). Цю суміш було розведено ЕtOАс та тоді шари були відділеними та органічний шар видаляли. Водний шар було підлужено 1Η NaOH та екстраговано СНСІ3/іРrОН (3:1). Органічний шар було висушено MgSO4, профільтровано та концентровано, отримуючи жовту оливу. Цей матеріал було очищено колонковою флеш-хроматографією, застосовуючи колонку 40г ISCO™, елюючи з градієнтом 3%, 5%, 10%, 20%, 30% МеОН/СНСІ3 із 0,1% NH4OH. Фракцію, що містить продукт збирали та концентрували під зменшеним тиском, отримуючи заголовну сполуку (379мг, 20% виходу): Rf=0,3 (30% МеОН/СН2СІ2); РХ-МС m/z. Розраховано для С20 Н28 N2 O3, 344,4, виявлено 345 (М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) δ 7,42 (d, J=8,3Гц, 2Н), 7,29 (d, J=8,3Гц, 2Н), 4,58 (brs, 1H), 3,62-3,55 (m, 8H), 3,343,32 (m, 2H), 2,87 (dddd, J=8,3, 8,3, 8,3, 8,3Гц, 1Н), 2,77-2,71 (m, 2H), 2,64-2,59 (m, 2H), 2,48-2,45 (m, 4H), 1,75-1,70 (m, 4Н); 100МГц 13С ЯМР (CDCI3) δ 173,8, 144,4, 137,8, 129,3, 125,3, 72,9, 67,0, 66,9, 60,3, 54,2, 46,0, 42,6, 40,9, 28,1, 23,5. Інтермедіат 8 1-(4-бром-2-флуорбензил)піролідин. Колбу RB на 4л, оснащену магнітною мішалкою, завантажували піролідином (363г, 426мл, 5,1моль) та ацетонітрилом (2750мл). Суміш було охолоджено льодяною банею до 10°С, тоді було додано 6 порціями твердий 4-бром-2флуорбензилбромід (MATRIX, Cat. №:1707, 375г, 1,4моль), тримаючи температуру нижче 20°С. Суміш перемішували при кімнатній температурі протягом 4 годин. Розчинник видаляли під вакуумом. Тоді 2л насиченого водного Na2CO3 та 500мл води було додано, та суміш було екстраговано ДХМ (3×700мл). Екстракт було висушено Na2SO4 та випарено. Утворену світло-жовту оливу було відігнано під вакуумом (~1мм, тчк.кип.125°С), отримуючи 324,5г (90%) продукту як безбарвну оливу. РХ-МС (М+Н): 258,5. 88719 34 1 Н ЯМР (300МГц, CDCI3): δ 7,19-7,31 (m, 3Н), 3,63 (m, 2H), 2,53 (m, 4H), 1,78 (m, 4H). Інтермедіат 9 3-[3-флуор-4-(піролідин-1-ілметил)феніл]-3гідроксициклобутанкарбонова кислота. Тригорлу колбу RB на 2л, оснащену механічною мішалкою, лійкою для додавання, термометром та впускним отвором для азоту завантажували Інтермедіат 8, 1-(4-бром-2флуорбензил)піролідин (69,86г, 0,27моль) та 700мл безводного ТГФ. Систему було продуто азотом та охолоджено до -85°С рідким азотом/етером/МеОН (1:1). Тоді н-BuLi (10М у гексані, 30мл, 0,298моль) було додано краплями через лійку для додавання при Т95% чистої заголовної сполуки. Концентрація менш чистої фракції дала ще 9,98г матеріалу ~85-90% чистоти: Rf=0,17 (20% МеОН/ЕtOАс), 1Н ЯМР (CDCI3) ~1:1 суміш ротамерів, δ 7,28-7,24 (m, частково затемнений СНСІ3, 1Н), 6,98-6,94 (m, 1Н), 6,92-6,88 (m, 1Н), 3,62 (d, J=0,8Гц, 2Н), 3,42-3,14 (перекриті мультиплети, 4Н), 2,92 та 2,89 (синглети, ЗН загалом), 2,58-2,35 (m, 8Н), 1,80-1,70 (m, 4Н), 1,14 та 1,08 (триплети, J=7,2Гц, 3Н загалом). Очищений матеріал (41,75г, 131,11ммоль) було розчинено у ЕtOАс (1л) та суміш 2 Η НСІ/етер (80мл, 160ммоль) було додано протягом приблизно 1хвил. при енергійному перемішуванні. Після 30 хвилин світло-оранжевий осад збирали, промивали ЕtOАс та сушили продуванням азотом, отримуючи відповідний гідрохлорид (36,15г). Цей матеріал було комбіновано з іншими партіями (39,72г загальна маса), та розчинено у суміші МеОН (30мл) та ЕtOАс (50мл) з обережним нагріванням Далі, ЕtOАс (550мл) було додано краплями до суміші протягом приблизно 15хвил. при перемішуванні. Після перемішування ще 15хвил. при кімнатній температурі, тверді матеріали були профільтрованими, промитими 200мл ЕtOАс та висушеними під азотом, отримуючи 32,98г гідрохлориду заголовної сполуки як білий кристалічний матеріал, тчк.пл 196-196,5°С; 1Н ЯМР (CDCI3) ~1:1 суміш ротамерів, δ 12,69 (br s, 1H), 7,79 (t, J=7,9Гц, 1H), 7,07-7,00 (m, 2H), 4,20 (d, J=5,4Гц, 2H), 3,64 41 3,57 (m, 2H), 3,47-3,53 (m, 2H), 3,30-3,16 (m, 2H), 2,91 та 2,88 (синглети, 3Н загалом), 2,85-2,79 (m, 2H), 2,60-2,50 (m, 2H), 2,46-2,34 (m, 2H), 2,26-2,14 (m, 2H), 2,06-1,95 (m, 2H), 1,14 та 1,07 (триплети, J=7,1Гц, 3Н загалом), 13С ЯМР (CDCI3) δ (суміш ротамерів) 173,29, 162,70,160,24, 150,57, 150,49, 133,62, 133,59, 123,99, 123,97,114,44, 114,30, 113,98, 113,77, 52,62, 49,92, 49,90, 44,07, 42,65, 35,33, 34,25, 33,45, 32,77, 32,40, 23,21, 14,07, 12,44; РХ-МС m/z. Розраховано для C19H27FN2O, 318,4, виявлено 319,4 (М+Н) ХІАТ; Аналіз:. Розраховано для C19H27FN2O.HCI: С 64,30, Η 7,95, Ν 7,89. Виявлено С 64,36, Η 8,02, Ν 7,97. Приклад 16 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етиламід. Розчин прикладу 12, 3-(3-флуор-4-піролідин-1ілметил-феніл)-3-гідрокси-циклобутанкарбонової кислоти етиламіду (48,7г, 152,0ммоль) у СН2СІ2 (450мл) було додано протягом 50хвил. по стінкам колби при -78°С до розчину біс(2метоксіетил)аміносульфур трифлуориду (42,0мл, 227,8ммоль) у СН2СІ2 (375мл). Після перемішування протягом 2,5 годин при -78°С, охолоджувальну баню видаляли та суміш перемішували протягом 16 годин при кімнатній температурі. При перемішуванні водн. NaHCO3 обережно додавали порціями, доки уся піна не спала. Твердий K2СО3 було тоді додано для гарантії, щоб рН був >8. Фази були відділеними та водну фазу було екстраговано двома додатковими порціями по 100мл СН2СІ2. Органічні фази були комбінованими, висушеними MgSO4 та концентрованими, отримуючи темно-оранжево-коричневу оливу (50,2г). Цей сирий матеріал було концентровано на 100г силікагелю та тоді очищено флеш-хроматографією на колонці 4"×6" з силікагелем, упакованим з EtOAc. Колонку було ельовано 3л кожного ЕtOАс та 10% МеОН/ЕtOАс. Очищені фракції були концентрованими, отримуючи 20,82г заголовної сполуки як оранжевуватий твердий матеріал, для котрого ГХ/МС показала чистоту ~94% з -6% відповідного транс ізомеру, повторна очистка цієї та менш чистої фракції була досягнута повторною MeOH/EtOAc колонковою хроматографією або хроматографією на колонці Chiralcel OD (10см×50см), застосовуючи 93:7 суміш гептан:ізопропіловий спирт при швидкості потоку 460мл/хвил. Ці хроматографовані матеріали тоді розтирали у порошок з 10% сумішшю етилетер/гексани (~8мл/г), отримуючи 28,21г (58%) 95+% чистої заголовної сполуки: Rf=0,23 (20% МеОН/ЕtOАс); 1Н ЯМР (CDCI3) δ 7,38 (t, J=7,7Гц, 1Н), 7,20 (d, J=8,3Гц, 1H), 7,13 (dd,J=10,8, 1,6Гц, 1Н), 5,43 (br s, 1Η), 3,66 (s, 2H), 3,33-3,18 (m, 3Н), 2,92-2,78 (m, 2H), 2,76-2,64 (m, 2H), 2,58-2,48 (m, 4H), 1,81-1,70 (m, 4H), 1,13 (t, J=7,3Гц, 3Н). Гідрохлорид заголовної сполуки було отримано додаванням 53мл 2Η суміші НСІ/етил-етер при перемішуванні до розчину вільної основи у 650мл ЕtOАс. Після перемішування протягом приблизно 2 годин, білий осад збирали, промивали ЕtOАс та сушили під струмом азоту: тчк.пл 196,5-197,5°С; 1Н ЯМР (МеОН-d4) δ 7,60 (t, J=7,7Гц, 1Н), 7,46-7,40 (m, 2Н), 4,46 (s, 2Н), 3,56-3,50 (m, 2Н), 3,37 (p, 88719 42 J=8,5Гц, 1Н), 3,24-3,17 (m, 4Н), 2,86-2,67 (m, 4Н), 2,22-2,10 (m, 2Н), 2,08-1,95 (m, 2Н), 1,10 (t, J=7,3Гц, 3Н); 13С ЯМР (CDCI3) δ 173,6, 161,3 (d, JC.F=248,0Гц), 147,1 (dd, JC.F=24,0, 7,7Гц), 134,0 (d, JC-F=2,3Гц), 121,9 (dd, JC-F=8,3, 2,7Гц), 116,4 (d, JCF=13,2Гц), 112,6 (dd, JC-F=24,1, 8,8Гц), 96,7 (d, JCF=197,3Гц), 52,83, 49,9 (d, JC-F=3,0Гц), 38,8 (d, JCF=24,8Гц), 34,8, 32,9, 23,3, 15,0; Аналіз:. Розраховано для C18H24F2N2O.HCI: С 60,25, Η 7,02, Ν 7,81. Виявлено С 60,15, Η 7,32, Ν 7,60. Інтермедіат 13 1-(4-бром-3,5-дифлуорбензил)піролідин. 3,5-Дифлуорбензальдегід (2,0мл, 18,24ммоль), піролідин (1,8мл, 21,56ммоль), та натрій триацетоксиборогідрид (5,8г, 27,4ммоль) перемішували у ТГФ (50мл) протягом 16 годин при кімнатній температурі. Насичений водний NaHCO3 (30мл) було додано та після перемішування протягом 30хвил. було додано ЕtOАс (50мл). Органічну фазу було відділено та промито розсолом, висушено MgSO4 та концентровано, отримуючи 2,65г (74%) 1-(3,5-дифлуорбензил)піролідину як трохи мутну оливу: 1Н ЯМР (CDCI3) δ 6,88-6,83 (m, 1H), 6,68-6,63 (m, 2H), 3,59 (s, 2H), 2,53-2,48 (m, 4H), 1,80-1,77 (m, 4Н). Інтермедіат 14 3-(2,6-дифлуор-4-(піролідин-1-ілметил)феніл)3-гідрокси-N-метилциклобутанкарбоксамід. 2,2,6,6-Тетраметилпіперидин (1,86мл, 11,0ммоль) було додано при -78°С до розчину нбутиллітію (2,5Μ у гексанах, 4,4мл, 11,0ммоль) у гексанах (12мл) та ТГФ (25мл). Утворену суміш перемішували протягом 10хвил. та тоді інтермедіат 13, 1-(3,5-дифлуорбензил)піролідин (2,17г, 11,0ммоль) у 3мл ТГФ було додано по стінкам колби протягом 1хвил. Після перемішування протягом 2,5 годин при -78°С розчин 3оксоциклобутанкарбонової кислоти (0,63г, 5,5ммоль) у ТГФ (10мл) було додано через канюлю у реакційну суміш. Цій суміші давали повільно нагрітися до кімнатної температури та перемішували протягом 16 годин. Метиламін (2,0М у ТГФ, 5,5мл, 11,0ммоль) та Т3Р (50мас.% у ЕtOАс, 3,9мл, 6,55ммоль) були тоді доданими. Через 2 години перемішування насичений водний NaHCO3 було додано та суміш було екстраговано в ЕtOАс, висушено MgSO4 та концентровано, отримуючи жовто-коричневу оливу. Флеш-хроматографія на силікагелі, застосовуючи спершу 3%, тоді 15% МеОН/СН2СІ2 дала 99мг (5,5%) заголовної сполуки, 3-(2,6-дифлуор-4-(піролідин-1-ілметил)феніл)3-гідрокси-N-метилциклобутанкарбоксаміду як білий воскоподібний матеріал: Rf=0,036 (СН2СІ2); 1 Н ЯМР (CDCI3) δ 6,84-6,78 (m, 2Н), 6,25-6,20 (br m, 1H), 3,52 (s, 2H), 3,01-2,95 (m, 2H), 2,90-2,84 (m, 1H), 2,79 (d, J=5,0Гц, 3Н), 2,58-,2,54 (m, 2H), 2,482,44 (m, 4H), 1,77-1,73 (m, 4H); 13C ЯМР (CDCI3) δ 222,6, 178,5, 161,2 (d, JC-F=240,5Гц), 142,2, 111,9 (dd, JC-F=25,6, 6,8Гц), 73,0, 59,7, 54,2, 40,8, 37,0, 26,8, 23,7. Приклад 17 3-(2,6-Дифлуор-4-піролідин-1-ілметил-феніл)3-флуор-циклобутанкарбонової кислоти метиламід. 43 Біс(2-метоксіетил)аміносульфур трифлуорид (0,070мл, 0,380ммоль) було додано при 0°С до розчину інтермедіату 14, 3-(2,6-дифлуор-4(піролідин-1-ілметил)феніл)-3-гідрокси-Nметилциклобутанкарбоксаміду (0,099г, 0,305ммоль) у СН2СІ2 (2мл) та утвореній суміші давали нагрітися до кімнатної температури та перемішували протягом 18 годин. Реакційну суміш виливали у насичений водний NaHCO3 та екстрагували СН2СІ2 (2×15мл), сушили MgSO4 та концентрували, отримуючи 92мг світло-жовтої оливи: Rf=0,21 (20% МеОН/ЕtOАс). Флеш-хроматографія на силікагелі, застосовуючи EtOAc та тоді 5% та 10% MeOH/EtOAc для елювання, дала 66мг (67% виходу) заголовної сполуки: РХ-МС m/z. Розраховано для C17H21F3N2O, 326,4, виявлено 327,4 (М+Н), 307,4 (M+H-HF) ХІАТ; 1Н ЯМР (CDCI3) δ 6,87 (d, J=8,7Гц, 2H), 5,42 (br s, 1H), 3,56 (m, 2H), 3,32 (ρ, J=8,5Гц, 1Н), 3,06-2,78 (m, 7H), 2,50 (br s, 4H), 1,79 (br s, 4H). Інтермедіат 15 3-(3-флуор-4-(піролідин-1-ілметил)феніл)-3гідроксициклобутанкарбонова кислота. н-Бутиллітій (2,5М/гексани, 78мл, 0,195моль) було додано по стінкам колби протягом 5хвил. при -78°С до розчину 1-(4-бром-2флуорбензил)піролідину (50,0г, 0,194моль) у ТГФ (500мл). Після перемішування при -78°С протягом 1 години, при -78°С розчин 3оксоциклобутанкарбонової кислоти (11,0г, 96,4ммоль) у ТГФ (150мл) було додано через канюлю протягом 10хвил. у реакційну суміш. Утворений темно-оранжевий розчин повільно гріли до кімнатної температури протягом 16 годин. РХ/МС суміші показала заголовну сполуку 294,2 (М+Н). Цей матеріал було застосовувано як сирий розчин без обробки, припускаючи концентрацію заголовної сполуки ~0,12М. Приклад 18 3-(3-Флуор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти метиламід. ТГФ-розчин приблизно 0,12М інтермедіату 15, 3-(3-флуор-4-(піролідин-1-ілметил)феніл)-3гідроксициклобутанкарбонової кислоти (160мл, 19,3ммоль) було комбіновано метиламіном (2,0М у ТГФ, 20мл, 40ммоль) та Т3Р (50мас.% у ЕtOАс, 13,8мл, 23,2ммоль) та перемішувано при кімнатній температурі протягом 20 годин. Суміш було зроблено основною насиченим водним NaHCO3 та було додано ЕtOАс (50мл). Фази були відділеними та водну фазу було екстраговано знов ЕtOАс. Комбіновані органічні продукти були промитими розсолом, висушеними MgSO4 та концентрованими, отримуючи оранжеву оливу (8,6г). Флешхроматографія на колонці 2"×4" з силікагелем, промиваючи спершу ЕtOАс (1л) та 10% МеОН/ЕtOАс (500мл) для видалення забруднення з вищим Rf, а потім елювання додатково 500мл 10% МеОН/ЕtOАс та 500мл 20% МеОН/ЕtOАс дали 3,14г (53%) заголовної сполуки як жирну оранжеву оливу, котра повільно твердне до воскоподібного твердого матеріалу: Rf=0,30, 20% МеОН/ЕtOАс; 1Н ЯМР (CDCI3) δ 7,35 (t, J=7,7Гц, 1H), 7,21-71,3 (m, 2Н), 5,73 (br s, 1H), 3,66 (d, JH-F=1,2Гц, 2H), 2,86 (d, 88719 44 J=4,6Гц, 3H), 2,85-2,73 (m, 3H), 2,55-2,45 (m, 6H), 1,79-1,60 (m, перекритий водою, 4H); 13C ЯМР (CDCI3) δ 177,5, 161,3 (d, JC-F=246,2Гц), 147,3 (d, JC-F=7,1Гц), 131,6 (d, JC-F=4,9Гц), 124,2 (d, JCF=15,0Гц), 120,6 (d, JC-F=3,3Гц), 112,3 (d, JCF=23,3Гц), 74,0 (d, JC-F=1,9Гц), 54,04, 52,6 (d, JCF=1,5Гц), 41,2, 32,9, 26,8, 23,6 ; PX-MC m/z. Розраховано для C17H23FN2O2, 306,4, виявлено 307,4 (M+H) XIAT. Приклад 19 3-(3-Флуор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти диметиламід. ТГФ-розчин ~0,12М інтермедіату 15, 3-(3флуор-4-(піролідин-1-ілметил)феніл)-3гідроксициклобутанкарбонової кислоти (160мл, 19,3ммоль) було комбіновано з диметиламіном (2,0М у ТГФ, 20мл, 40ммоль) та Т3Р (50мас.% у ЕtOАс, 13,8мл, 23,2ммоль) та перемішувано при кімнатній температурі протягом 20 годин. Суміш було зроблено основною насиченим водним NaHCO3 та було додано ЕtOАс (50мл). Фази були відділеними та водну фазу було екстраговано знов ЕtOАс. Комбіновані органічні продукти були промитими розсолом, висушеними MgSO4 та концентрованими, отримуючи оранжеву оливу (8,6г). Флеш-хроматографія на колонці 2"Х4" з силікагелем, промиваючи спершу ЕtOАс (1л) та 10% МеОН/ЕtOАс (500мл) для видалення забруднення з вищим Rf, а потім елювання додатково 500мл 10% МеОН/ЕtOАс та 500мл 20% МеОН/ЕtOАс дала 3,58г (58%) заголовної сполуки як жирну оранжеву оливу, котра повільно твердне до воскоподібного твердого матеріалу: Rf=0,17 (20% МеОН/ЕtOАс); 1 Н ЯМР (CDCI3) δ 7,36 (t, J=7,9Гц, 1H), 7,23-7,15 (m, 2Н), 4,70 (br s, 1H), 3,66 (s, 2H), 3,21-3,12 (m, 1H), 3,00 (З, 3Н), 2,99 (s, 3Н), 2,84-2,78 (m, 2H), 2,57-2,43 (m, 6Н), 1,80-1,74 (m, перекритий водою, 4Н); 13С ЯМР (CDCI3) δ 175,8, 161,3 (d, JCF=246,2Гц), 147,4 (d, JC-F=7,1Гц), 131,6 (d, JCF=4,5Гц), 124,3 (d, JC-F=15Гц), 120,7 (d, JC-F=3,0Гц), 112,4 (d, JC-F=23,3Гц), 73,3 (d, JC-F=1,1Гц), 54,03, 52,6 (d, JC-F=1,1Гц), 41,1, 37,4, 36,2, 28,5, 23,6; PXMC m/z. Розраховано для C18H25FN2O2, 320,4, виявлено 321,4(M+H) XIAT. Приклад 20 3-(3-Флуор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти ізобутиламід. ТГФ-розчин сирого ~0,12М інтермедіату 15, 3(3-флуор-4-(піролідин-1-ілметил)феніл)-3гідроксициклобутанкарбонової кислоти (160мл, 19,3ммоль) було комбіновано з ізобутиламіном (3,8мл, 38,2ммоль) та Т3Р (50мас.% у ЕtOАс, 13,8мл, 23,2ммоль) та перемішувано при кімнатній температурі протягом 20 годин. Суміш було зроблено основною насиченим водним NaHCO3 та було додано ЕtOАс (50мл). Фази були відділеними та водну фазу було екстраговано знов ЕtOАс. Комбіновані органічні продукти були промитими розсолом, висушеними MgSO4 та концентрованими, отримуючи оранжеву оливу. Флеш-хроматографія на колонці 2"×4" з силікагелем, промиваючи спершу ЕtOАс (1л) та 10% МеОН/ЕtOАс (500мл) для видалення забруднення з вищим Rf, а потім елю 45 вання додатково 500мл 10% МеОН/ЕtOАс та 500мл 20% МеОН/ЕtOАс дали 4,22г (63%) заголовної сполуки як оранжевий воскоподібний матеріал: Rf=0,3 (30% МеОН/ЕtOАс); 1Н ЯМР (CDCI3) δ 7,34 (t, J=7,9Гц, 1Н), 7,20-7,13 (m, 2Н), 5,84 (br s, 1H), 3,66 (d, JH-F=1,3Гц, 2Н), 3,11 (t, J=6,4Гц, 2Н), 2,84-2,76 (m, 3H), 2,55-2,45 (m, 6H), 1,81-1,72 (m, 4H), 0,91-0,87 (d@0,90 (J=6,6Гц, 6Н) перекритий m (1H)); PX-MC m/z. Розраховано для C20H29FN2O2, 348,5, виявлено 349,4 (M+H) ХІАТ. Приклад 21 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти метиламід. Біс(2-метоксіетил)аміносульфур трифлуорид (0,29мл, 1,57ммоль) було додано при 0°С до розчину прикладу 18, 3-(3-флуор-4-піролідин-1ілметил-феніл)-3-гідрокси-циклобутанкарбонової кислоти метиламіду (0,40г, 1,31ммоль) у СН2СІ2 (8мл). Цю суміш повільно гріли до кімнатної температури та перемішували протягом 18 годин та тоді виливали у насичений водний NaHCO3. Органічну фазу було відділено, висушено MgSO4 та концентровано, отримуючи оранжеву оливу (0,40г). Флеш-хроматографія на колонці 1,5"×2" з силікагелем, промиваючи спершу 200мл кожного ЕtOАс, 2% та 5% МеОН/ЕtOАс для видалення забруднення з вищим Rf, а потім елювання 400мл 10% МеОН/ЕtOАс та 200мл 20% МеОН/ЕtOАс дали 0,244г (61%) заголовної сполуки як оранжеву оливу: Rf=0,11 (20% МеОН/ЕtOАс). Гідрохлорид заголовної сполуки було отримано у ЕtOАс з 1,5 еквівалентами суміші 2Η НСІ/етил-етер. Гігроскопічний білий твердий матеріал збирали та сушили під азотом: 1Н ЯМР (MeOH-d4) δ 7,60 (t, J=7,9Гц, 1Н), 7,45-7,40 (m, 2H), 4,46 (s, 2H), 3,60-3,45 (m, 2Н), 3,37 (p, J=8,7 Гц , 1Η), 3,24-3,14 (m, 2H), 2,87-2,67 (s@2,72 (3H) перекритий мультиплет (4Н)), 2,22-2,10 (m, 2H), 2,021,97 (m, 2H); 13С ЯМР (MeOH-d4) δ 175,6, 161,5 (d, JC-F=248,8Гц), 147,4 (dd, JC-F=24,1, 7,1), 133,1 (d, JCF=2,6Гц), 121,4 (d, JC-F=4,9Гц), 117,6 (d, JCF=15,8Гц), 112,4 (dd, JC-F=23,3, 8,9Гц), 96,4 (d, JCF=195,4Гц), 54,0, 51,0, 38,3 (d, JC-F=25,2Гц), 32,2, 25,3, 22,7; PX-MC m/z. Розраховано для C17H22F2N2O, 308,4, виявлено 309,4 (M+H) XIAT. Приклад 22 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти диметиламід. Розчин прикладу 19, 3-(3-флуор-4-піролідин-1ілметил-феніл)-3-гідрокси-циклобутанкарбонової кислоти диметиламіду (0,40г, 1,25ммоль) у СН2СІ2 (4мл) було додано при -78°С до розчину біс(2метоксіетил)аміносульфур трифлуориду (0,28мл, 1,52ммоль) у СН2СІ2 (4мл). Через 1 годину, додаткову порцію біс(2-метоксіетил)аміносульфур трифлуориду (0,050мл) було додано та розчин перемішували протягом ще 15хвил., а тоді насичений водний NaHCO3 було додано та суміш перемішували при кімнатній температурі протягом 16 годин. Фази були відділеними та водний шар було екстраговано СН2СІ2. Комбіновані органічні продукти були висушеними MgSO4 та концентрованими, отримуючи 296мг світло-оранжевої оливи. Флеш 88719 46 хроматографія на колонці 1,5"×1,5" з силікагелем, промиваючи спершу 200мл ЕtOАс для видалення забруднення з вищим Rf, а потім елювання 200мл 20% МеОН/EtOAc дали 0,244г (61%) заголовної сполуки як світло-жовту оливу: Rf=0,10 (20% МеОН/ЕtOАс). Гідрохлорид заголовної сполуки було отримано у ЕtOАс з 1,5 еквівалентами суміші 2Η НСІ/етил-етер, отримуючи білий твердий матеріал: 1 Н ЯМР (MeOH-d4) δ 7,59 (t, J=7,9Гц, 1H), 7,38-7,32 (m, 2Н), 4,44 (s, 2Н), 3,75 (p, J=8,7Гц, 1Н), 3,55-3,45 (m, 2H), 3,22-3,15 (m, 2Н), 3,01 (s, 3Н), 2,92 (s, 3Н), 2,84-2,80 (m, 2H), 2,76 (d, J=8,7Гц, 2Н), 2,21-2,09 (m, 2H), 2,05-1,90 (m, 2H); 13С ЯМР (MeOH-d4) δ 174,2, 161,5 (d, JC-F=248,8Гц), 147,4 (dd, JC-F=24,1, 7,5Гц), 133,1 (d, JC-F=3,0Гц), 121,3 (dd, JC-F=7,9, 3,2Гц), 117,6 (d, JC-F=15,4Гц), 112,3 (dd, JC-F=23,3, 9,0Гц), 95,9 (dd, JC-F=197,3, 2,1Гц) 53,9, 50,7 (d, JCF=3,0Гц), 38,1 (d, JC-F=24,8Гц), 36,0, 34,8, 29,8, 22,6; PX-MC m/z. Розраховано для C18H24F2N2O, 322,4, виявлено 323,4 (M+H) XIAT. Приклад 23 3-Флуор-3-(3-флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти етил-метиламід. Розчин прикладу 14, 3-(3-Флуор-4-піролідин-1ілметил-феніл)-3-гідрокси-циклобутанкарбонової кислоти етил-метил-аміду (0,40г, 1,20ммоль) у СН2СІ2 (4мл) було додано при -78°С до розчину біс(2-метоксіетил)аміносульфур трифлуориду (0,27мл, 1,46ммоль) у СН2СІ2 (4мл). Через 1 годину, насичений водний NaHCO3 (10мл) було додано та суміш перемішували при кімнатній температурі протягом 16 годин. Фази були відділеними та водний шар було екстраговано СН2СІ2. Комбіновані органічні продукти були висушеними MgSO4 та концентрованими, отримуючи 296мг світлооранжевої оливи. Флеш-хроматографія на колонці 1,5"×1,5" з силікагелем, промиваючи спершу 200мл ЕtOАс для видалення забруднення з вищим Rf, а потім елювання 200мл кожного 10% та 20% МеОН/ЕtOАс дала 0,242г (61%) заголовної сполуки як світло-жовту оливу: Rf=0,24 (20% МеОН/ЕtOАс); РХ-МС m/z. Розраховано для C19H26F2N2O, 336,4, виявлено 337,4 (М+Н), 317,4 (M+H-HF) ХІАТ. Гідрохлорид заголовної сполуки було отримано у ЕtOАс з 1,5 еквівалентами суміші 2Η НСІ/етил-етер, отримуючи світло-жовтий твердий матеріал: 1Н ЯМР (МеОН-d4) δ ~1:1 суміш ротамерів, 7,58 (t, J=7,7Гц, 1Н), 7,40-7,33 (m, 2H), 4,44 (s, 2H), 3,79-3,67 (m, 1Н), 3,49 (br s, 2Н), 3,42-3,34 (m, 2Н), 3,21 (br s, 2H), 2,98 та 2,90 (синглети, 3Н загалом), 2,86-2,74 (m, 4Н), 2,23-1,90 (brm, 4Н), 1,18 та 1,07 (триплети, J=7,1Гц, 3Н загалом); 13С ЯМР (МеОН-d4) δ (суміш ротамерів) 173,87, 173,65, 162,73, 160,26, 147,56, 147,49, 147,33, 147,25, 133,11, 133,08, 121,34, 121,31, 121,26, 121,23, 117,74, 117,59, 112,48, 112,39, 112,25, 112,16, 97,12, 96,89, 95,18, 94,93, 53,88, 50,75, 50,72, 44,12, 42,75, 38,55, 38,30, 38,19, 37,94, 33,66, 32,21, 29,97, 29,46, 22,62, 12,86, 11,25; РХ-МС m/z. Розраховано для C19H26F2N2O, 336,4, виявлено 337,4 (М+Н) ХІАТ. 47 Приклад 24 3-(3-Флуор-4-піролідин-1-ілметил-феніл)-3метокси-циклобутанкарбонової кислоти етилметил-амід. Натрій гідрид (60мас.%, 0,040г, 1,00ммоль) було додано до розчину прикладу 14, 3-(3-Флуор4-піролідин-1-ілметил-феніл)-3-гідроксициклобутанкарбонової кислоти етил-метил-аміду (0,25г, 0,748ммоль) у ТГФ (5мл). Після перемішування протягом 15хвил., виділення газу припинилося та було додано метилйодид (0,06мл, 0,96ммоль). Утворену суміш перемішували при кімнатній температурі протягом 16 годин, тоді гасили водою та екстрагували в ЕtOАс. Екстракт було промито розсолом, висушено MgSO4 та концентровано, отримуючи заголовну сполуку як світло-жовту оливу (0,13г): Rf=0,16 (20% МеОН/ЕtOАс); РХ-МС m/z. Розраховано для C20H29FN2O2, 348,5, виявлено 349,4 (М+Н) ХІАТ. Гідрохлорид заголовної сполуки було отримано у ЕtOАс з 1,5 еквівалентами суміші 2Η НСІ/етил-етер, отримуючи білий твердий матеріал: 1 Н ЯМР (MeOH-d,) δ ~1:1 суміш ротамерів, 7,67 (t, J=7,7Гц, 1Н), 7,46 (d, J=8,3Гц, 1Н), 7,42 (dt, J=11,2, 1,9Гц, 1Н), 4,48 (s, 2Н), 3,55 (br s, 2H), 3,42-3,18 (мультиплети перекриті МеОН 4Н), 3,02-2,95 (m, 1Н), 2,94-2,90 (перекритий -ОСН3 синглет @2,94 та оптометричні -NCH3 синглети @2,94 та 2,90, 6Н загалом), 2,67-2,54 (m, 4Н), 2,18 (br s, 2Н), 2,03 (br s, 2H), 1,13 та 1,08 (триплети, J=7,3Гц, 3Н загалом); 13С ЯМР (МеОН-d4) δ (суміш ротамерів) 173,93, 173,84, 163,09, 160,61, 148,64, 148,57, 133,20, 133,18, 123,02, 117,39, 117,20, 114,13, 114,08, 113,91, 133,86, 76,72, 76,63, 53,88, 50,80, 50,77, 49,78, 43,97, 42,76, 36,58, 36,24, 33,64, 32,17, 27,87, 27,32, 22,67, 12,87, 11,28; РХ-МС m/z. Розраховано для C20H29FN2O2, 348,5, виявлено 349,4 (М+Н) ХІАТ. Інтермедіат 16 3-(3-флуор-4-((піролідин-1-іл)метил)феніл)-Nізобутилциклобут-2-енкарбоксамід. Розчин прикладу 20, 3-(3-Флуор-4-піролідин-1ілметил-феніл)-3-гідрокси-циклобутанкарбонової кислоти ізобутил-аміду (3,71г, 10,64ммоль) у трифлуороцтовій кислоті (20мл) та 1,2-дихлоретану (120мл) кип'ятили під зворотним холодильником протягом 21 годин та концентрували, отримуючи 8,6г сирого 3-(3-флуор-4-(піролідин-1ілметил)феніл)-N-ізобутилциклобут-2енкарбоксамід трифлуорацетату та залишкову ТФОК як темно-червоно-коричневу оливу. Діагностичні сигнали 1Н ЯМР: (CDCI3) δ 7,48 (t, J=7,7Гц, 1H), 7,23 (d, частково затемнений СНСІ3 сигнал, 1Н), 7,09 (dd, J =10,3, 1,5Гц, 1Н), 6,38 (d, J=0,8Гц, 1Н), 4,33 (d, J=5,0Гц, 1Н), 3,77 (br s, 2H), 3,68 (d, J=4,6Гц, 1H), 3,20-3,07 (m, 3 годин), 2,98 (br s, 2Н), 2,83 (dd, J=13,3, 1,7Гц, 1Н), 2,19-2,07 (m, 4Н), 0,90 (d,J=7,1 Η, 6Н). Приклад 25 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти ізобутил-амід. Сирий інтермедіат 16, 3-(3-флуор-4((піролідин-1-іл)метил)феніл)-М-ізобутилциклобут2-енкарбоксамід, отриманий вище, було розчинено 88719 48 у ЕtOН (100мл) та додано до колби для гідрогенування, що містить 10% паладій на вугіллі у ЕtOН (~5мл). Суміш струшували при кімнатній температурі при 45 фунт/кв.дюйм водню протягом 2 годин, фільтрували через діатомову землю з промивкою ЕtOН та концентрували, отримуючи оранжеву оливу. Це було розчинено у ЕtOАс (150мл) та промито водним K2СО3 та розсолом, висушено MgSO4 та концентровано, отримуючи 3,29г воскоподібного оранжевого твердого матеріалу. Флешхроматографія на колонці 2,5"×4" з силікагелем, елюючи 1000мл ЕtOАс та 500мл 10% МеОН/ЕtOАс дала 1,90г (54%) заголовної сполуки як жовтуватий твердий матеріал: Rf=0,26 (20% МеОН/ЕtOАс). Гідрохлорид заголовної сполуки було отримано додаванням ~1,2екв. суміші 2Η НСІ/етил-етеру до вільної основи у розчині ЕtOАс. Утворений гігроскопічний, склоподібний, світло-оранжевий твердий матеріал мав: 1Н ЯМР (MeOH-d4) δ 7,49 (t, J=8,1Гц, 1H), 7,20-7,17 (m, 2Н), 4,41 (s, 2Н), 3,553,45 (m, 3Н), 3,21-3,15 (m, 2H), 3,09 (ρ, 8,7Гц, 1Н), 2,98 (d, J=6,6Гц, 2Н), 2,57-2,50 (сим. мульт., 2Н), 2,31 (dq, J=9,7, 2,5Гц, 2Н), 2,22-2,10 (m, 2Н), 2,051,95 (m, 2Н), 1,75 (гепт, J=6,8Гц, 1Н), 0,88 (d, J=6,6Гц, 6H); 13С ЯМР (CDCI3) δ 176,1, 161,64 (d, JC-F=248,1Гц), 150,7 (d, JC-F=7,9Гц), 132,8 (d, JCF=3,4Гц), 123,2 (d, JC-F=3,0Гц), 115,7 (d, JC-F=5,4Гц), 113,8 (d, JC-F=21,8Гц), 53,73, 50,9, 50,8, 35,2, 34,9, 32,5, 28,4, 22,6, 19,3; PX-MC m/z. Розраховано для C20H29FN2O, 332,5, виявлено 333,5 (M+H) ХІАТ. Приклад 26 3-аза-біцикло[3,2,2]нонан-3-іл(3-(3-флуор-4(піролідин-1-ілметил)феніл)-3гідроксициклобутил)метанон. Розчин у ТГФ сирого інтермедіату 15, 3-(3флуор-4-(піролідин-1-ілметил)феніл)-3гідроксициклобутанкарбонової кислоти (~5,3ммоль, ~0,12М ТГФ) було комбіновано із 3аза-біцикло[3,2,2]нонаном (1,00г, 7,99ммоль) та Т3Р (50мас.% у ЕtOАс, 3,8мл, 6,38ммоль) та перемішувано при кімнатній температурі протягом 30хвил. Суміш було зроблено основною насиченим водним NaHCO3 та тоді було додано ЕtOАс (50мл). Фази були відділеними та водну фазу було екстраговано знов ЕtOАс. Комбіновані органічні шари були промитими розсолом, висушеними MgSO4 та концентрованими, отримуючи жирну оранжеву оливу (1,86г). Флеш-хроматографія на колонці 2"Х5" з силікагелем, промиваючи спершу ЕtOАс (500мл), а потім елювання 500мл 25% МеОН/ЕtOАс дали заголовну сполуку (0,59г 28% виходу) як воскоподібний жовтий твердий матеріал: PX-MC m/z. Розраховано для C24H33FN2O2, 400,5, виявлено 401,1 (М+Н) ХІАТ; 1Н ЯМР (CDCI3) δ 7,40 (t, J=7,5Гц, 1Н), 7,23-7,17 (m, 2H), 3,75 (d, J=4,6Гц, 2Н), 3,69 (s, 2H), 3,29 (d, J=3,7Гц, 2Н), 3,25-3,19 (m, 1H), 2,84-2,78 (m, 2H), 2,62-2,45 (m, 6H), 2,10-2,08 (m, 1H), 2,03-2,00 (m, 1H), 1,93-1,40 (m, 12H). Приклад 27 3-аза-біцикло[3,2,2]нонан-3-іл(3-(3-флуор-4(піролідин-1-ілметил)феніл)циклобутил)метанон. Розчин прикладу 26, 3-аза-біцикло[3,2,2]нонан3-іл(3-(3-флуор-4-(піролідин-1-ілметил)феніл)-3гідроксициклобутил)метанону (0,59г, 1,48ммоль) у 49 трифлуороцтовій кислоті (2,5мл) та 1,2дихлоретані (16мл) кип'ятили під зворотним холодильником протягом 20 годин та концентрували, отримуючи сирий 3-аза-біцикло[3,2,2]нонан-3-іл(3(3-флуор-4-(піролідин-1-ілметил)феніл)циклобут-2еніл)метанон трифлуорацетат як темнопурпурово-коричневу оливу, з залишковою ТФОК. Цей матеріал було розчинено у EtOH (40мл) та додано колби для гідрогенування, що містить 10% паладій на вугіллі (93мг) у ЕtOН (~3мл). Суміш струшували при кімнатній температурі при 48 фунт/кв.дюйм водню протягом 2 годин, фільтрували через діатомову землю з промивкою ЕtOН та концентрували, отримуючи оранжеву оливу. Це було розчинено у ЕtOАс та промито водним K2СО3 та розсолом, висушено MgSO4 та концентровано, отримуючи 0,38г світло-оранжевої оливи. Флешхроматографія на колонці 2"×3,5" з силікагелем, промиваючи 2% МеОН/ЕtOАс (500мл) та тоді, елюючи 500мл кожного 5% та 10% МеОН/ЕtOАс дала 0,256г (45%) заголовної сполуки як світлооранжеву оливу: Rf=0,21 (20% МеОН/ЕtOАс). Гідрохлорид було отримано додаванням 1,5екв. суміші 2Η НСІ/етил-етер до вільної основи у ЕtOАс. Утворений білий твердий матеріал збирали, та сушили, отримуючи гідрохлорид заголовної сполуки: 1Н ЯМР (CDCI3) δ 12,68 (br s, 1H), 7,80 (t, J=7,7Гц, 1H), 7,19-6,97 (m, 2H), 4,21 (d, J= 4,2Гц, 2H), 3,80-3,56 (m, 4H), 3,55-3,37 (m, 3Н), 3,28 (ρ, J=8,9Гц, 1Н), 2,83 (br s, 2H), 2,61-2,54 (m, 2H), 2,472,38 (m, 2H), 2,32-2,12 (m, 2Н), 2,12-1,92 (m, 4H), 1,77-1,54 (m, 8H); 13С ЯМР (CDCI3) δ 173,4, 161,5 (d, JC-F=248,4Гц), 150,6 (d, JC-F=7,5Гц), 133,6 (d, JCF=2,3Гц), 124,0 (d, JC-F=3,0Гц), 114,3 (d, JCF=13,9Гц), 113,8 (d, JC-F=21,8Гц), 54,3, 52,7, 50,3, 50,03, 50,0, 35,2, 33,9, 33,0, 30,4, 30,0, 25,0, 24,7, 23,3; PX-MC m/z. Розраховано для C24H33FN2O, 384,5, виявлено 385,5 (M+H) ХІАТ. Інтермедіат 17 3-(3-хлор-4-((піролідин-1-іл)метил)феніл)-3гідроксициклобутанкарбонова кислота. 2,5Μ розчин н-BuLi у гексанах (101мл, 254ммоль) було додано протягом 15 хвилин до розчину 1-(4-бром-2-хлорбензил)піролідину (69,6г, 254ммоль) в абсолютному ТГФ (450мл) під потоком азоту при -78°С. Реакційну суміш перемішували при -78°С протягом 30 хвилин. Тоді охолоджений до -78°С розчин 3-оксоциклобутанкарбонової кислоти (14,4г, 126,7ммоль) в абсолютному ТГФ (150мл) було додано краплями протягом 10хвил. при -78°С. Суміш повільно гріли до кімнатної температури та залишали при перемішуванні протягом 18 годин та утворений розчин було застосовувано. PX-MC m/z. Розраховано для C16H20NCIO3, 309,8, виявлено 308,1 (М-Н) ХІАТ. Приклад 28 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти метиламід. До сирого розчину інтермедіату 17, 3-(3-хлор4-((піролідин-1-іл)метил)феніл)-3гідроксициклобутанкарбонової кислоти (~666мл, ~121,5ммоль) було додано 2,0Μ метиламіну (95мл, 190ммоль, у ТГФ) та Т3Р (50мас.% розчин у ЕtOАс, 96,6мл, 152ммоль). Утворену реакційну 88719 50 суміш перемішували при кімнатній температурі протягом 1 години та тоді були доданими 300мл 1Η NaOH та 400мл ЕtOАс та шари були відділеними. Водний шар екстрагували ЕtOАс (2×500мл) знов та комбіновані органічні шари були висушеними MgSO4 та випареними. Залишок було очищено колонковою флеш-хроматографією, застосовуючи колонку на 75л Biotage™, елюючи з градієнтом 5%, 8%, 10%, 15% МеОН/СН2СІ2 із 0,25% NH4OH. Фракції, що містять продукт, збирали та концентрували під зменшеним тиском, отримуючи заголовну сполуку (18,9г, 48% виходу). Rf=0,35 (20% МеОН/СН2СІ2+0,2% NH4OH); РХ-МС m/z. Розраховано для С17 Н23 СІ N2 02, 322,2, виявлено 323,1 (М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) δ 7,47-7,45 (m, 2H), 7,33 (dd, J=7,9, 1,7Гц, 1Н), 5,94 (brs, 1H), 5,67 (brs, 1H), 3,75 (s, 3Н), 2,85 (d, J=4,9Гц, 3Н), 2,86-2,73 (m, 3Н), 2,62-2,56 (m, 4H), 2,54-2,47 (m, 2H), 1,84-1,76 (m 4H); 100МГц 13 С ЯМР (CDCI3) δ 177,6, 146,0, 135,5, 134,0, 130,8, 126,3, 123,6, 74,3, 56,8, 54,3, 41,1, 33,3, 26,9, 23,7. Приклад 29 та Приклад 30 Транс-3-(3-Хлор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти метиламід та Цис3-(3-Хлор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти метиламід. ТФОК (48мл, 627ммоль) було додано до розчину у ДХЕ (202мл) прикладу 28, 3-(3-хлор-4піролідин-1-ілметил-феніл)-3-гідроксициклобутанкарбонової кислоти метиламіду (10г, 31,4ммоль) та утворену суміш гріли до 75°С протягом 18 годин та концентрували для отримання трифлуорацетату 3-(3-хлор-4-(піролідин-1іл)метил)феніл)-N-метилциклобут-2енкарбоксаміду. Це було знов розчинено в абсолютному ЕtOН (130мл), було тоді додано каталізатор Уілкінсона (1,5г) та реакційну суміш гідрогенували при 60°С, застосовуючи 45 фунт/кв.дюйм Н2. Через 2 години реакції це було концентровано та залишок було знов розчинено у 1Η НСІ (100мл) та екстраговано двічі ЕtOАс (2×100мл). Водний шар було тоді підлужено 1Η NaOH (100мл) та екстраговано ЕtOАс (2×500мл). Комбіновані органічні фази були висушеними MgSO4, та концентрованими для отримання сирого матеріалу. Це було очищено флеш-хроматографією, застосовуючи колонку 120г ISCO™, елюючи з градієнтом 5%, 10% та 15% МеОН/ СН2СІ2 із 0,25% NH4OH. Фракції, що містять продукт, були комбінованими та концентрованими під зменшеним тиском, отримуючи суміш цис та транс ізомерів (4,6г, 48% виходу). Ізомери були відділеними препаративною хроматографією на колонці Chiralcel OD (10см×50см) при швидкості потоку 295мл/хвил, застосовуючи Гептан/ІПА (90/10) як елюент, отримуючи транс (3,6г) та цис (0,52г) ізомери. Приклад 29 Транс-3-(3-Хлор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти метиламід: Rf=0,50 (20% МеОН/СН2СІ2+0,2% NH4OH); РХ-МС m/z. Розраховано для С17 Н23 СІ N2 О, 306,8, виявлено 307,4(М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) δ 7,42 (d, J=7,8Гц, 1Н), 7,20 (d, J=1,6Гц, 1Н), 7,09 (dd, J=7,8, 1,2Гц, 1Н), 5,76 (brs, 1H), 3,83 (s, 2Н), 3,76-3,67 (m, 1H), 2,98-2,90 (m, 51 1H), 2,82 (d, J=5,1Гц, 3Н), 2,80-2,62 (m, 6H), 2,362,26 (m, 2H), 1,87-1,78 (m, 4H); 100МГц 13С ЯМР (CDCI3) δ 146,7, 134,2, 131,3,176,1 127,5, 125,3, 56,3, 54,3, 54,1, 36,5, 36,3, 32,1, 26,6, 23,6. Приклад 30 Цис-3-(3-Хлор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти метиламід: Rf=0,50 (20% МеОН/СН2СІ2+0,2% NH4OH); PX-MC m/z. Розраховано для С17 Н23 СІ N2 О, 306,8, виявлено 307,4(М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) δ 7,30 (d, J=7,9Гц, 1H), 7,15 (d, J=1,2Гц, 1H), 7,03 (dd, J=7,8, 1,2Гц, 1Н), 6,48 (brs, 1H), 3,63 (s, 2Н), 3,30-3,19 (m, 1H), 2,94-2,84 (m, 1H), 2,70 (d, J=5,0Гц, 3Н), 2,52-2,26 (m, 8H), 1,741,66 (m,4H). Приклад 31 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти диметиламід. До розчину сирого інтермедіату 17, 3-(3-хлор4-((піролідин-1-іл)метил)феніл)-3гідроксициклобутанкарбонової кислоти (~4,3мл, ~0,65ммоль) було додано диметиламін у ТГФ (0,65мл, 1,29ммоль, 2,0М ТГФ) та Т3Р (50мас.% розчин у ЕtOАс, 0,62мл, 0,97ммоль). Утворену реакційну суміш перемішували при кімнатній температурі протягом 1 години та тоді 25мл 1Η NaOH та 100мл ЕtOАс були доданими та шари були відділеними. Водний шар екстрагували ЕtOАс (2×60мл) знов та комбіновані органічні шари були висушеними MgSO4 та випареними. Залишок було очищено колонковою флеш-хроматографією, застосовуючи колонку на 40г ISCO™, елюючи сумішшю 5% МеОН/СН2СІ2, що містить 0,25% NH4OH. Фракції, що містять продукт, збирали та концентрували під зменшеним тиском, отримуючи заголовну сполуку (112мг, 52% виходу). Rf=0,65 (20% МеОН/СН2СІ2+0,2% NH4OH); PX-MC m/z. Розраховано для С18 Н25 СІ N2 02, 336,8, виявлено 337,1 (М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) δ (d, J=1,7Гц, 1Н1,7,46 7,40 (d, J=7,9Гц, 1Н), 7,33 (dd, J=7,9, 1,7Гц, 1Н), 3,68 (s, 2H), 3,06-2,96 (m, 1H), 2,92 (s, 6H), 2,78-2,68 (m, 2H), 2,62-2,46 (m, 6H), 1,76-1,68 (m, 4H); 100МГц 13С ЯМР (CDCI3) δ 175,5, 146,2, 135,5, 133,9, 130,7, 126,5, 123,7, 72,9, 56,8, 54,3, 40,9, 37,4, 36,1, 28,5, 23,7. Приклад 32 [3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутил]-піперидин-1-іл-метанон. До розчину сирого інтермедіату 17, 3-(3-хлор4-((піролідин-1-іл)метил)феніл)-3гідроксициклобутанкарбонової кислоти (~4,3мл, ~0,65ммоль) було додано піперидин (0,13мл, 1,29ммоль) та Т3Р (50мас.% розчин у ЕtOАс, 0,62мл, 0,97ммоль). Утворену реакційну суміш перемішували при кімнатній температурі протягом 1 години та тоді були доданими 25мл 1Η NaOH та 100мл ЕtOАс та шари були відділеними. Водний шар екстрагували EtOAc (2×60мл) знов та комбіновані органічні шари були висушеними MgSO4 та випареними. Залишок було очищено колонковою флеш-хроматографією, застосовуючи колонку на 40г ISCO™, елюючи сумішшю 5% МеОН/СН2СІ2, що містить 0,25% NH4OH. Фракції, що містять продукт, збирали та концентрували під зменшеним 88719 52 тиском, отримуючи заголовну сполуку (113мг, 46% виходу). Rf=0,80 (20% МеОН/СН2СІ2+0,2% NH4OH), РХ-МС m/z. Розраховано для С21 Н29 СІ N2 02, 376,9, виявлено 377,1 (М+1) ХІАТ, 400МГц 1Н ЯМР (CDCI3) δ 7,47 (d, J=2,1Гц, 1H), 7,42 (d, J=7,9Гц, 1Η), 7,34 (dd, J=7,9, 1,7Гц, 1Н), 3,70 (s, 2H), 3,543,48 (m, 2Н), 3,32-3,26 (m, 2H), 3,02-2,93 (m, 1H), 2,75-2,67 (m, 2H), 2,65-2,51 (m, 6H), 1,78-1,71 (m, 4H), 1,63-1,44 (m, 6H); 100МГц 13С ЯМР (CDCI3) δ 173,5, 146,3, 135,4, 133,9, 130,8, 126,5, 123,7, 72,9, 56,7, 54,3, 46,8, 43,5, 41,0, 28,4, 26,8, 25,8, 24,7, 23,7. Приклад 33 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти ізобутилметил-амід. До розчину сирого інтермедіату 17, 3-(3-хлор4-((піролідин-1-іл)метил)феніл)-3гідроксициклобутанкарбонової кислоти (~4,3мл, ~0,65ммоль) було додано Ν-метилізобутиламін (0,15мл, 1,29ммоль) та Т3Р (50мас.% розчин у ЕtOАс, 0,62мл, 0,97ммоль). Утворену реакційну суміш перемішували при кімнатній температурі протягом 1 години та тоді були доданими 25мл 1Η NaOH та 100мл ЕtOАс та шари були відділеними. Водний шар екстрагували ЕtOАс (2×60мл) знов та комбіновані органічні шари були висушеними MgSO4 та випареними. Залишок було очищено колонковою флеш-хроматографією, застосовуючи колонку на 40г ISCO™, елюючи сумішшю 5% МеОН/СН2СІ2, що містить 0,25% NH4OH. Фракції, що містять продукт, збирали та концентрували під зменшеним тиском, отримуючи заголовну сполуку (108мг, 44% виходу). Rf=0,80 (20% МеОН/СН2СІ2+0,2% NH4OH); РХ-МС m/z. Розраховано для С21 Н31 СІ N2 02, 378,9, виявлено 379,1 (М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) 1:1 суміш ротамерів, δ 7,47-7,45 (m, 1Н), 7,42 (d, J=7,9Гц, 1Н), 7,36-7,30 (m, 1H), 3,71 (s, 2H), 3,20-3,02 (m, 3Н), 2,92 & 2,90 (2s, ЗН загалом), 2,80-2,70 (m, 2H), 2,60-2,50 (m, 6H), 1,95-1,80 (m, 1H), 1,78-1,70 (m, 4H), 0,76-0,58 (m, 6H), 100МГц 13С ЯМР (CDCI3) 1:1 суміш ротамерів, δ 176,6, 175,8, 146,4, 135,2, 135,1, 134,0, 130,9, 130,8, 126,4, 123,7, 123,6, 73,5, 73,3, 57,9, 56,7, 55,6, 54,3, 41,4, 41,0, 36,1, 35,0, 29,0, 28,2, 27,9, 26,9, 23,7, 20,2, 20,1. Приклад 34 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбоновоі кислоти циклопропілметил-амід. До розчину сирого інтермедіату 17, 3-(3-хлор4-((піролідин-1-іл)метил)феніл)-3гідроксициклобутанкарбонової кислоти (~4,3мл, ~0,65ммоль) було додано амінометилциклопропан (0,112мл, 1,29ммоль) та Т3Р (50% розчин у ЕtOАс, 0,62мл, 0,97ммоль). Утворену реакційну суміш перемішували при кімнатній температурі протягом 1 години та тоді були доданими 25мл 1Η NaOH та 100мл ЕtOАс та шари були відділеними. Водний шар екстрагували ЕtOАс (2×60мл) знов та комбіновані органічні шари були висушеними MgSO4 та випареними. Залишок було очищено колонковою флеш-хроматографією, застосовуючи колонку на 40г ISCO™, елюючи сумішшю 5% МеОН/СН2СІ2, що містить 0,25% NH4OH. Фракції, що містять про 53 дукт, збирали та концентрували під зменшеним тиском, отримуючи заголовну сполуку (101мг, 43% виходу). Rf=0,80 (20% МеОН/СН2СІ2+0,2% NH4OH); PX-MC m/z. Розраховано для С20 Н27 СІ N2 02, 362,9, виявлено 363,2 (М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) δ 7,44-7,38 (m, 2Н), 7,28 (dd, J=7,9, 2,6Гц, 1H), 6,40 (br apt t, J=5,4Гц, 1H), 3,69 (s, 2H), 3,103,04 (m, 2H), 2,76-2,68 (m, 3H), 2,57-2,42 (m, 6H), 1,78-1,69 (m, 4H), 0,94-0,84 (m, 1H), 0,48-0,40 (m, 2H), 0,18-0,12 (m, 2H); 100МГц 13С ЯМР (CDCI3) δ 176,7, 146,1, 135,3, 133,9, 130,8, 126,3, 123,6, 74,0, 56,7, 54,3, 44,9, 41,1, 40,7, 33,1, 23,7, 10,8, 3,7. Приклад 35 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти метил(тетрагідро-піран-4-ілметил)-амід. До розчину сирого інтермедіату 17, 3-(3-хлор4-((піролідин-1-іл)метил)феніл)-3гідроксициклобутанкарбонової кислоти (~4,3мл, ~0,65ммоль) було додано метил-(тетрагідро-піран4-ілметил)-амін гідрохлорид (200мг, 1,21ммоль), триетиламін (0,108мл, 0,78ммоль) та Т3Р (50% розчин у ЕtOАс, 0,62мл, 0,97ммоль). Утворену реакційну суміш перемішували при кімнатній температурі протягом 1 години та тоді були доданими 25мл 1Η NaOH та 100мл ЕtOАс та шари були відділеними. Водний шар екстрагували ЕtOАс (2×60мл) знов та комбіновані органічні шари були висушеними MgSO4 та випареними. Залишок було очищено колонковою флеш-хроматографією, застосовуючи колонку на 40г ISCO™, елюючи сумішшю 5% МеОН/СН2СІ2, що містить 0,25% NH4OH. Фракції, що містять продукт, збирали та концентрували під зменшеним тиском, отримуючи заголовну сполуку (87мг, 32% виходу). Rf=0,80 (20% МеОН/СН2СІ2+0,2% NH4OH); PX-MC m/z. Розраховано для С23 Н33 СІ N2 О, 420,9, виявлено 421,3 (М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) суміш ротамерів, діагностичні піки, δ 3,98-3,88 (m, 2Н), 3,73 (s, 2Н), 2,95 (s, 3Н), 2,62-2,54 (m, 6Н), 1,70-1,46 (m, 2Н), 1,38-1,17 (m, 2Н). Приклад 36 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти циклопропілметил-метил-амід. До розчину сирого інтермедіату 17, 3-(3-хлор4-((піролідин-1-іл)метил)феніл)-3гідроксициклобутанкарбонової кислоти (~4,3мл, ~0,65ммоль) було додано циклопропілметилметил-амін гідрохлорид (61мг, 0,51ммоль), триетиламін (0,18мл, 1,29ммоль) та Т3Р (50% розчин у ЕtOАс, 0,62мл, 0,97ммоль). Утворену реакційну суміш перемішували при кімнатній температурі протягом 1 години та тоді 25мл 1Η NaOH та 100мл ЕtOАс були доданими та шари були відділеними. Водний шар екстрагували ЕtOАс (2×60мл) знов та комбіновані органічні шари були висушеними MgSO4 та випареними. Залишок було очищено колонковою флеш-хроматографією, застосовуючи колонку на 40г ISCO™, елюючи сумішшю 5% МеОН/СН2СІ2, що містить 0,25% NH4OH. Фракції, що містять продукт, збирали та концентрували під зменшеним тиском, отримуючи заголовну сполуку (71мг, 29% виходу). Rf=0,50 (15% МеОН/СН2СІ2+0,2% NH4OH); РХ-МС m/z. Розрахова 88719 54 но для С21 Н29 СІ N2 02, 376,9, виявлено 377,2 (М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) 1:1 суміш ротамерів, діагностичні піки, δ 3,75 (s, 2Н), 3,02 & 3,01 (2 синглети, 3Н загалом), 2,62-2,54 (m, 6Н), 1,82-1,74 (m, 4Н); 100МГц 13С ЯМР (CDCI3) 1:1 суміш ротамерів, δ 175,9, 175,7, 146,4, 146,3, 135,2, 134,0, 130,9, 130.8, 126,5, 126,4, 123,7, 73,7, 73,5, 56,7, 54,6, 54,3, 52,4, 41,3, 41,0, 35,5, 34,5, 29,0, 28,5, 23,7, 10,5, 9,5, 3,8, 3,6. Приклад 37 [3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутил]-(2,3-дигідро-5Нбензо[Ї][1,4]оксазепін-4-іл)-метанон. До розчину сирого інтермедіату 17, 3-(3-хлор4-((піролідин-1-іл)метил)феніл)-3гідроксициклобутанкарбонової кислоти (~4,3мл, ~0,65ммоль) було додано 2,3,4,5-тетрагідробензо[f][1,4]оксазепін гідрохлорид (239мг, 1,29ммоль), триетиламін (0,18мл, 1,29ммоль) та Т3Р (50% розчин у ЕtOАс, 0,62мл, 0,97ммоль). Утворену реакційну суміш перемішували при кімнатній температурі протягом 1 години та тоді були доданими 25мл 1Η NaOH та 100мл ЕtOАс та шари були відділеними. Водний шар екстрагували ЕtOАс (2×60мл) знов та комбіновані органічні шари були висушеними MgSO4 та випареними. Залишок було очищено колонковою флеш-хроматографією, застосовуючи колонку на 40г ISCO™, елюючи сумішшю 5% МеОН/СН2СІ2, що містить 0,25% NH4OH. Фракції, що містять продукт, збирали та концентрували під зменшеним тиском, отримуючи заголовну сполуку 104мг, 37% виходу. Rf=0,50 (15% МеОН/СН2СІ2+0,2% NH4OH); РХ-МС m/z. Розраховано для С25 Н29 СІ N2 03, 440,9, виявлено 441,2 (М+1) ХІАТ; 100МГц 13С ЯМР (CDCI3) 1:1 суміш ротамерів, діагностичні піки, δ 175,4, 173.9, 159,5, 159,3, 134,2, 134,1, 131,4, 131,3, 122,0, 121,3, 121,0, 74,9, 72,6, 72,2, 56,3, 54,1, 53,9, 49,3, 48,7, 41,2, 41,0, 28,8, 28,5, 23,7, 23,6. Приклад 38 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3гідрокси-циклобутанкарбонової кислоти метил-(3метил-піридин-2-ілметил)-амід. До розчину сирого інтермедіату 17, 3-(3-хлор4-((піролідин-1-іл)метил)феніл)-3гідроксициклобутанкарбонової кислоти (~4,3мл, ~0,65ммоль) було додано метил-(3-метил-піридин2-ілметил)-амін (176мг, 1,29ммоль) та Т3Р (50% розчин у ЕtOАс, 0,62мл, 0,97ммоль). Утворену реакційну суміш перемішували при кімнатній температурі протягом 1 години та тоді були доданими 25мл 1Η NaOH та 100мл ЕtOАс та шари були відділеними. Водний шар екстрагували ЕtOАс (2×60мл) знов та комбіновані органічні шари були висушеними MgSO4 та випареними. Залишок було очищено колонковою флеш-хроматографією, застосовуючи колонку на 40г ISCO™, елюючи сумішшю 5% МеОН/СН2СІ2, що містить 0,25% NH4OH. Фракції, що містять продукт, збирали та концентрували під зменшеним тиском, отримуючи заголовну сполуку 127мг, 46% виходу). Rf=0,30 (15% МеОН/СН2СІ2+0,2% NH4OH); PX-MC m/z. Розраховано для С24 Н30 СІ N3 02, 427,9, виявлено 428,2 (М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) 2:1 суміш ротамерів, діагностичні піки, δ 4,72, 4,53 (s, 55 2Н), 3,72 & 3,70 (s, 2Н), 2,97, 2,93 (s, 3Н), 1,76-1,74 (m, 4H); 100МГц 13С ЯМР (CDCI3) 2:1 суміш ротамерів, діагностичні піки δ 177,6, 175,7, 154,7, 153,6, 146,8, 146,6, 126,5, 126,4, 122,8, 122,7, 73,4, 73,2, 56,7, 56,6, 54,3, 54,2, 51,1, 41,4, 40,9, 35,6, 35,4, 28,9, 28,7, 23,7, 23,6, 18,3, 18,2. Приклад 39 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти диметиламід. ТФОК (9,9мл, 128ммоль) було додано до розчину у ДХЕ (64мл) прикладу 19, 3-(3-флуор-4піролідин-1-ілметил-феніл)-3-гідроксициклобутанкарбонової кислоти диметиламіду (2,05г, 6,4ммоль) та суміш гріли до 75°С протягом 18 годин та концентрували для отримання трифлуорацетату інтермедіату 3-(3-флуор-4-піролідин1-ілметил-феніл)-циклобут-2-енкарбонової кислоти диметиламіду. Це було знов розчинено в абсолютному ЕtOН (64мл), було тоді додано каталізатор Уілкінсона (296мг) та цю суміш гідрогенували при 60°С, застосовуючи 45 фунт/кв.дюйм Н2. Через 1 годину 45хвил. реакції суміш було концентровано та залишок було знов розчинено у 1Η НСІ (50мл) та екстраговано двічі ЕtOАс (2×120мл). Водний шар було тоді підлужено 15% водн. NaOH (40мл) та екстраговано ЕtOАс (3×200мл). Комбіновані органічні фази були висушеними MgSO4 та концентрованими для отримання сирого матеріалу. Це було очищено флеш-хроматографією, застосовуючи колонку на 120г ISCO™ та суміш 4% МеОН/СН2СІ2 із 0,1% NH4OH. Фракції, що містять продукт, були комбінованими та концентрованими під зменшеним тиском, отримуючи заголовну сполуку (1,0г, 51% виходу). Rf=0,40 (10% МеОН/СН2СІ2+0,2% NH4OH); PX-MC m/z. Розраховано для С18 H25 F N2 О, 304,4, виявлено 305,4 (М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) δ 7,10 (t, J=7,8Гц, 1Н), 6,78 (dd, J=1,2, 6,6Гц, 1Н), 6,72 (dd, J=1,7, 11,2Гц, 1Н), 3,4 (s, 2H), 3,48-3,38 (m, 1Н), 3,13-3,04 (m, 1Н), 2,79 (s, 3Н), 2,70 (s, 3Н), 2,582,50 (m, 2H), 2,37-2,30 (m, 4H), 2,22-2,12 (m, 2H), 1,60-1,52 (m, 4H); 100МГц 13С ЯМР (CDCI3) δ 174,3, 161,2 (d, JC-F=245,7Гц), 147,0, 131,4, 123,4 (d, JCF=15,0Гц), 121,9, 113,0 (d, JC-F=22,5Гц), 54,0, 52,5, 36,7, 35,8, 35,5, 33,3, 31,6, 23,5. Приклад 40 [3-(3-Флуор-4-піролідин-1-ілметил-феніл)цикпобутил]-піролідин-1-іл-метанон. ТФОК (10,2мл, 133ммоль) було додано до розчину у ДХЕ (66мл) прикладу 8, N-{2-флуор-4-[1гідрокси-3-(піролідин-1ілкарбоніл)циклобутил]бензил}-піролідину, (2,3г, 6,7ммоль), та суміш гріли до 75°С протягом 18 годин та концентрували для отримання трифлуорацетату інтермедіату [3-(3-флуор-4-піролідин-1ілметил-феніл)-циклобут-2-еніл]-піролідин-1-ілметанон. Це було знов розчинено в абсолютному ЕtOН (67мл), було тоді додано каталізатор Уілкінсона (308мг) та суміш гідрогенували при 60°С, застосовуючи 45 фунт/кв.дюйм Н2. Через 1 годину 45хвил. реакції суміш було концентровано та залишок було знов розчинено у 1Η НСІ (50мл) та екстраговано двічі ЕtOАс (2×120мл). Водний шар було тоді підлужено 15% водн. NaOH (40мл) та екстраговано ЕtOАс (3×200мл). Комбіновані орга 88719 56 нічні фази були висушеними MgSO4 та концентрованими для отримання сирого матеріалу. Це було очищено флеш-хроматографією, застосовуючи колонку на 120г ISCO™ та 4% МеОН/СН2СІ2 із 0,1% NH4OH. Фракції, що містять продукт, були комбінованими та концентрованими під зменшеним тиском, отримуючи заголовну сполуку (1,1г, 50% виходу). Rf=0,40 (10% МеОН/СН2СІ2+0,2% NH4OH); РХ-МС m/z. Розраховано для С20 Н27 F N2 О, 330,4, виявлено 331,4 (М+1) ХІАТ; 400МГц 1 Н ЯМР (CDCI3) δ 7,30 (t, J=7,6Гц, 1Н), 6,97 (dd, J=1,3, 7,9Гц, 1Н), 6,91 (dd, J=1,3, 11,2Гц, 1Н), 3,66 (s, 2H), 3,73-3,63 (m, 1H), 3,50 (t, J=6,7Гц, 2Н), 3,31 (t, J=6,5Гц, 2Н), 3,22-3,14 (m, 1H), 2,77-2,69 (m, 2H), 2,58-2,51 (m, 4H), 2,38-2,28 (m, 2H), 1,97-1,81 (m, 4H), 1,80-1,74 (m, 4H); 100МГц 13С ЯМР (CDCI3) δ 173,4, 161,4 (d, JC-F=246,5Гц), 147,4, 131,6 (d, JCF=4,50Гц), 122,1, 113,2 (d, JC-F=22,6Гц), 112,5, 54,1, 52,7, 46,2, 46,1, 36,1, 34,6, 31,5, 26,3, 24,5, 23,6. Приклад 41 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти ізобутил-амід. ТФОК (14мл, 184ммоль) було додано до розчину у ДХЕ (80мл) прикладу 20, 3-(3-флуор-4піролідин-1-ілметил-феніл)-3-гідроксициклобутанкарбонової кислоти ізобутил-аміду (3,2г, 9,2ммоль) та суміш гріли до 75°С протягом 18 годин та концентрували для отримання трифлуорацетату інтермедіату 3-(3-Флуор-4-піролідин1-ілметил-феніл)-циклобут-2-енкарбонової кислоти ізобутил-амід. Це було знов розчинено в абсолютному EtOH (90мл), було тоді додано каталізатор Уілкінсона (424мг) та суміш гідрогенували при 60°С, застосовуючи 45 фунт/кв.дюйм Н2. Через 2 години реакції суміш було концентровано та залишок було знов розчинено у 1Η НСІ (60мл) та екстраговано двічі EtOAc (2×120мл). Водний шар було тоді підлужено 15% NaOH (40мл) та екстраговано ЕtOАс (3×250мл). Комбіновані органічні фази були висушеними MgSO4 та концентрованими для отримання сирого матеріалу. Це було очищено флеш-хроматографією, застосовуючи колонку на 120г ISCO™ та 4% та 8% МеОН/ СН2СІ2 із 0,1% NH4OH. Фракції, що містять продукт, були комбінованими та концентрованими під зменшеним тиском, отримуючи заголовну сполуку (885мг, 26% виходу). Rf=0,30 (10% МеОН/СН2СІ2+0,2% NH4OH); РХ-МС m/z. Розраховано для С20 Н29 F N2 О, 332,4, виявлено 333,5 (М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) δ 7,22 (t, J=7,9Гц, 1Н), 6,87 (dd, J=0,8, 8,7Гц, 1H), 6,82 (dd, J=1,2, 16,2Гц, 1H), 6,08 (m) 3,72-3,61 (m, 1H), 3,57 (s, 2H), 3,04 (t, J=6,3Гц, 2H), 3,02-2,82 (m, 1H), 2,65-2,56 (m, 2H), 2,50-2,43 (m, 4H), 2,32-2,22 (m, 2H), 1,78-1,66 (m, 5H), 0,86 (s, 3Н), 0,84 (s, 3Н); 100МГц 13С ЯМР (CDCI3) δ 175,5, 161,4 (d, JC-F=246,4Гц), 147,1, 131,5, 123,4 (d, JCF=14,3Гц), 122,1, 113,1 (d, JC-F=22,5Гц), 54,1, 52,7, 47,1, 36,6, 36,3, 32,3, 28,8, 23,6, 20,3. Приклад 42 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти етиламід. ТФОК (13мл, 169ммоль) було додано до розчину у ДХЕ (71мл) прикладу 12, 3-(3-Флуор-4піролідин-1-ілметил-феніл)-3-гідроксициклобутанкарбонової кислоти етиламіду (2,7г, 57 8,4ммоль) та суміш гріли до 75°С протягом 18 годин та концентрували для отримання трифлуорацетату інтермедіату 3-(3-Флуор-4-піролідин-1ілметил-феніл)-циклобут-2-енкарбонової кислоти етиламід. Це було знов розчинено в абсолютному ЕtOН (84мл). каталізатор Уілкінсона (390мг) було тоді додано та суміш гідрогенували при 60°С, застосовуючи 45 фунт/кв.дюйм Н2 Через 2 години реакції суміш було концентровано та залишок було знов розчинено у 1Η НСІ (60мл) та екстраговано двічі ЕtOАс (2×120мл). Водний шар було тоді підлужено 15% NaOH (40мл) та екстраговано ЕtOАс (3×250мл). Комбіновані органічні фази були висушеними MgSO4 та концентрованими для отримання сирого матеріалу. Це було очищено флеш-хроматографією, застосовуючи колонку на 120г ISCO™ та 4% та 8% МеОН/ СН2СІ2 із 0,1% NH4OH. Фракції, що містять продукт, були комбінованими та концентрованими під зменшеним тиском, отримуючи заголовну сполуку (1,0г, 39% виходу). Rf=0,30 (10% МеОН/СН2СІ2+0,2% NH4OH); РХ-МС m/z. Розраховано для С18 Н25 F N2 О, 304,4, виявлено 305,5 (М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) δ 7,13 (t, J=7,9Гц, 1Н), 6,79 (dd, J=1,2, 7,9Гц, 1Н), 6,82 (dd, J=11,2, 0,8Гц, 1Н), 6,68 (m, 1H), 3,64-3,53 (m, 1H), 3,48 (s, 2Н), 3,20-3,10 (m, 2Н), 2,94-2,84 (1Н), 2,58-2,50 (m, 2H), 2,44-2,32 (m, 4H), 2,22-2,12 (m, 2Н), 1,66-1,56 (m, 4H), 1,00 (t, J=24,5Гц, 3Н); 100МГц 13С ЯМР (CDCI3) δ 175,4, 161,2 (d, JC-F=246,5Гц), 147,1, 131,4, 123,3 (d, JCF=15,0Гц), 121,9, 113,0 (d, JC-F=21,8Гц), 54,0, 36,5, 36,1, 34,5, 34,2, 32,1, 23,6, 15,0. Приклад 43 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти етил-метил-амід. ТФОК (13,5мл, 175ммоль) було додано до розчину у ДХЕ (87мл) прикладу 14, 3-(3-Флуор-4піролідин-1-ілметил-феніл)-3-гідроксициклобутанкарбонової кислоти етил-метил-аміду (2,9г, 8,74ммоль) та суміш гріли до 75°С протягом 18 годин та концентрували для отримання трифлуорацетату інтермедіату 3-(3-Флуор-4-піролідин1-ілметил-феніл)-циклобут-2-енкарбонової кислоти етил-метил-аміду. Це було знов розчинено в абсолютному EtOH (87мл), було тоді додано каталізатор Уілкінсона (404мг) та суміш гідрогенували при 60°С, застосовуючи 45 фунт/кв.дюйм Н2. Через 2 години реакції суміш було концентровано та залишок було знов розчинено у 1Η НСІ (60мл) та екстраговано двічі ЕtOАс (2×120мл). Водний шар було тоді підлужено 15% NaOH (40мл) та екстраговано ЕtOАс (3×250мл). Комбіновані органічні фази були висушеними MgSO4 та концентрованими для отримання сирого матеріалу. Це було очищено флеш-хроматографією, застосовуючи колонку на 120г ISCO™ та 4% та 8% МеОН/ СН2СІ2 із 0,1% NH4OH. Фракції, що містять продукт, були комбінованими та концентрованими під зменшеним тиском, отримуючи заголовну сполуку (1,4г, 44% виходу). Rf=0,30 (10% МеОН/СН2СІ2+0,2% NH4OH); РХ-МС m/z. Розраховано для С19 Н27 F N2 О, 318,4, виявлено 319,5 (М+1) ХІАТ; 400МГц 1 Н ЯМР (CDCI3) δ 7,19 (t, J=7,9Гц, 1Н), 6,85 (dd, J=1,3, 7,9Гц, 1Н), 6,79 (dd, J=1,3, 11,2Гц, 1Н), 3,583,44 (m, 1H), 3,52 (s, 2H), 3,33 (q J=2,9Гц, 1H), 3,20 88719 58 3,07 (m, 2Н), 2,83 (s, 3Н), 2,76 (s, 3Н), 2,66-2,56 (m, 2H), 2,45-2,36 (m, 4Н), 2,28-2,18 (m, 2H), 1,68-1,58 (m, 4H), 1,02 (q, J=7,1Гц, 3Н); 100МГц 13С ЯМР (CDCI3) 1:1 суміш ротамерів, δ 174,2, 173,9, 161,2 (d, JC-F=246,5Гц), 147,1, 131,4, 123,3 (d, JCF=15,0Гц), 121,9, 113,1 (d, JC-F=21,8Гц), 54,0, 52,6, 43,9, 42,6, 36,0, 35,8, 34,1, 33,6, 33,0, 32,7, 31,8, 31,6, 23,6, 13,8, 12,4. Приклад 44 [3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутил]-піперидин-1-іл-метанон. Розчин прикладу 32, [3-(3-Хлор-4-піролідин-1ілметил-феніл)-3-гідрокси-циклобутил]-піперидин1-іл-метанону (106мг, 0,28ммоль) у дихлорметані (5мл) було охолоджено при -78°С та додано краплями охолоджений до -78°С розчин BAST (0,1мл, 0,31ммоль) у дихлорметані (5мл) під азотом. Через 1 годину перемішування при -78°С, реакційну суміш виливали у насичений водний NaHCO3 (15мл) та перемішували протягом 15 хвилин. Шари були відділеними та після ще двох екстракцій водної фази СН2СІ2 (2×20мл), комбіновані органічні екстракти були висушеними MgSO4 та концентрованими під зменшеним тиском для отримання залишкової оливи. Це було очищено колонковою флеш-хроматографією, застосовуючи колонку на 12г ISCO™ та 2% МеОН/СН2СІ2, отримуючи заголовну сполуку (28мг, 26% виходу) Rf=0,30 (5% МеОН/СН2СІ2); РХ-МС m/z. Розраховано для С21 Н28 СІ F N2 О, 378,9, виявлено 379,4, 359,4 (М+1) & (M+1-HF) ХІАТ; 400 МГц 1Н ЯМР (CDCI3) δ 7,507,46 (m, 1H), 7,40 (bs, 1H), 7,28 (dd, J=1,3, 7,9Гц, 1H), 3,74 (s, 2Н), 3,70-3,52 (m, 3Н), 3,38-3,32 (m, 2H), 2,96-2,80 (m, 2H), 2,78-2,66 (m, 2H), 2,64-2,54 (m, 4H), 1,84-1,74 (m, 4H), 1,68-1,60 (m, 2H), 1,581,50 (m,4H). Приклад 45 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти ізобутилметил-амід. Розчин прикладу 33, 3-(3-хлор-4-піролідин-1ілметил-феніл)-3-гідрокси-циклобутанкарбонової кислоти ізобутил-метил-амід (102мг, 0,27ммоль) у дихлорметані (5мл) було охолоджено при -78°С та додано краплями охолоджений до -78°С розчин BAST (0,06мл, 0,30ммоль) у дихлорметані (5мл) під азотом. Через 1 годину перемішування при 78°С, реакційну суміш виливали у насичений водний NaHCO3 (15мл) та перемішували протягом 15 хвилин. Шари були відділеними та після ще двох екстракцій водної фази СН2СІ2 (2×20мл), комбіновані органічні екстракти були висушеними MgSO4 та концентрованими під зменшеним тиском для отримання залишкової оливи. Це було очищено колонковою флеш-хроматографією, застосовуючи колонку на 12г ISCO™ та 2% МеОН/СН2СІ2, отримуючи заголовну сполуку (24мг, 23% виходу). Rf=0,35 (5% МеОН/СН2СІ2); РХ-МС m/z. Розраховано для С21 Н30 СІ F N2 О, 380,9, виявлено 381,4, 361,4 (М+1) & (M+1-HF) ХІАТ; 400МГц 1Н ЯМР (CDCI3) 1.1 суміш ротамерів, діагностичні піки, δ 3,74 (s, 2Н), 3,56-3,51 (m, 1Н), 3,21 (d, J=7,9Гц, 1Н), 3,07 (d, J=7,5Гц, 1Н), 2,62-2,54 (m, 4H), 2,00-1,88 (m, 1H), 1,85-1,75 (m, 4H); 100МГц 13 С ЯМР (CDCI3) 1:1 суміш ротамерів, δ 173,7, 59 173,4, 136,8, 134,0, 130,8, 125,8, 125,8, 123,3, 123,2, 57,2, 56,8, 55,5, 54,4, 35,6, 34,2, 31,0, 39,2, 27,6, 26,9, 23,8, 20,2, 20,1. Приклад 46 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти циклопропілметил-амід. Розчин прикладу 34 3-(3-Хлор-4-піролідин-1ілметил-феніл)-3-гідрокси-циклобутанкарбонової кислоти циклопропілметил-аміду (92мг, 0,25ммоль) у дихлорметані (5мл) було охолоджено при -78°С та додано краплями охолоджений до -78°С розчин BAST (0,05мл, 0,28ммоль) у дихлорметані (5мл) під азотом. Через 1 годину перемішування при -78°С, реакційну суміш виливали у насичений водний NaHCO3 (15мл) та перемішували протягом 15 хвилин. Шари були відділеними та після ще двох екстракцій водної фази СН2СІ2 (2×20мл), комбіновані органічні екстракти були висушеними MgSO4 та концентрованими під зменшеним тиском для отримання залишкової оливи. Це було очищено колонковою флешхроматографією, застосовуючи колонку на 12г ISCO™ та 2% МеОН/СН2СІ2, отримуючи заголовну сполуку (47мг, 51% виходу). Rf=0,35 (5% МеОН/СН2СІ2); РХ-МС m/z. Розраховано для С20 Н26 СІ F N2 О, 364,9, виявлено 365,4, 345,4 (М+1) & (M+1-HF) ХІАТ; 400МГц 1Н ЯМР (CDCI3) δ 7,48 (dd, J=1,2, 7,9Гц, 1Н), 7,43 (bs, 1H), 7,33 (dd, J=1,3, 7,9Гц, 1Н), 5,69 (bs, 1H), 3,73 (s, 2H), 3,32-3,22 (m, 1Н), 3,15-3,10 (2Н), 2,95-2,80 (m, 2H), 2,78-2,63 (m, 2H), 2,62-2,52 (m, 4H), 1,85-1,75 (m, 4Н), 1,00-0,88 (m, 1Н), 0,54-0,46 (m, 2Н), 0,22-0,15 (m, 2Н); 100МГц 13С ЯМР (CDCI3) 1:1 суміш ротамерів, δ 173,6, 142,0, 141,8, 134,0, 130,7, 125,8, 123,3, 56,9, 54,4, 44,8, 38,9, 38,6, 33,4, 23,8, 10,9, 3,6. Приклад 47 та Приклад 48 цис 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти метиламід та транс 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти метиламід. ТФОК (34,7мл, 450ммоль) було додано до розчину у ДХЕ (150мл) прикладу 18, 3-(3-флуор-4піролідин-1-ілметил-феніл)-3-гідроксициклобутанкарбонової кислоти метиламіду (10г, 31,4ммоль) та суміш гріли до 75°С протягом 18 годин та концентрували для отримання трифлуорацетату інтермедіату 3-(3-флуор-4-(піролідин-1іл)метил)феніл)-циклобут-2-енкарбонової кислоти метиламіду. Це було знов розчинено в абсолютному ЕtOН (79мл), було тоді додано каталізатор Уілкінсона (1000мг) та суміш гідрогенували при 60°С, застосовуючи 45 фунт/кв.дюйм Н2. Через 2 години реакції суміш було концентровано та залишок було знов розчинено у 1Η НСІ (100мл) та екстраговано двічі ЕtOАс (2×100мл). Водний шар було тоді підлужено 1Η NaOH (100мл) та екстраговано ЕtOАс (2×500мл). Комбіновані органічні фази були висушеними MgSO4 та концентрованими для отримання сирого матеріалу. Це було очищено флеш-хроматографією, застосовуючи колонку на 120г ISCO™ та 5%, 10% та 15% МеОН/СН2СІ2 із 0,25% NH4OH. Фракції, що містять продукт, були комбінованими та концентрованими під зменшеним тиском, отримуючи суміш цис та транс ізоме 88719 60 рів (4,8г, 74% виходу). Ізомери були відділеними препаративною хроматографією на колонці Chiralcel OD (10см×50см) при швидкості потоку 295мл/хвил, застосовуючи Гептан/EtOH (95/5) як елюент, отримуючи транс 3-(3-Флуор-4-піролідин1-ілметил-феніл)-циклобутанкарбонової кислоти метиламід (2,5г) та цис 3-(3-Флуор-4-піролідин-1ілметил-феніл)-циклобутанкарбонової кислоти метиламід (0,23г). Приклад 47 цис 3-(3-Флуор-4-піролідин-1-ілметил-феніл)циклобутанкарбонової кислоти метиламід: Rf=0,50 (25% МеОН/СН2СІ2+0,2% NH4OH); PX-MC m/z. Розраховано для С17 Н23 F N2 О, 290,4, виявлено 291,1 (М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) δ 7,19 (t, J=7,8Гц, 1Н), 6,89 (dd, J=1,3, 8,2Гц, 1Н), 6,83 (dd, J=1,3, 10,9Гц, 1Н), 3,54 (s, 2H), 3,30-3,19 (m, 1H), 2,94-2,84 (m, 1H), 2,68 (d, J=4,7Гц, 3Н), 2,48-2,36 (m, 6H), 2,34-2,24 (m, 2H), 1,72-1,64 (m, 4H); 100МГц 13С ЯМР (CDCI3) δ 175,1, 161,2 (d, JCF=245,5Гц), 146,4, 146,2, 131,4, 122,1 (d, JCF=15,0Гц), 113,4 (d, JC-F=22,8Гц), 54,0, 52,7, 35,7, 35,4, 32,9, 26,4, 23,5 Приклад 48 транс 3-(3-Флуор-4-піролідин-1-ілметилфеніл)-циклобутанкарбонової кислоти метиламід: Rf=0,50 (25% МеОН/СН2СІ2+0,2% NH4OH); PX-MC m/z. Розраховано для С17 Н23 F N2 О, 290,4, виявлено 291,1 (М+1) ХІАТ; 400МГц 1Н ЯМР (CDCI3) δ 7,16 (t, J=7,8Гц, 1Н), 6,85-6,74(m, 2H), 4,03 (bs, 1H), 3,62-3,50 (m, 1H), 3,55 (s, 2H), 3,25 (s, 3Н), 2,68-2,40 (m, 7H), 2,24-2,13 (m, 2H), 1,70-1,62 (m, 4H); 100МГц 13С ЯМР (CDCI3) δ 176,7, 161,2 (d, JCF=245,5Гц), 147,7, 147,6, 131,8, 122,1 (d, JCF=15,0Гц), 113,2 (d, JC-F=22,8Гц), 53,7, 52,3, 50,0, 35,6, 32,0, 26,4, 23,3. Приклад 49 3-(3-Хлор-4-піролідин-1-ілметил-феніл)-3флуор-циклобутанкарбонової кислоти метил(тетрагідро-піран-4-ілметил)-амід. Розчин прикладу 35, 3-(3-Хлор-4-піролідин-1ілметил-феніл)-3-гідрокси-циклобутанкарбонової кислоти метил-(тетрагідро-піран-4-ілметил)-аміду (70мг, 0,17ммоль) у дихлорметані (5мл) було охолоджено при -78°С та додано краплями охолоджений до -78°С розчин BAST (0,034мл, 0,18ммоль) у дихлорметані (5мл) під азотом. Через 1 годину перемішування при -78°С, реакційну суміш виливали у насичений водний NaHCO3 (15мл) та перемішували протягом 15 хвилин. Шари були відділеними та після ще двох екстракцій водної фази СН2СІ2 (2×20мл), комбіновані органічні екстракти були висушеними MgSO4 та концентрованими під зменшеним тиском для отримання залишкової оливи. Це було очищено колонковою флешхроматографією, застосовуючи колонку на 12г ISCO™ та 2% МеОН/СН2СІ2, отримуючи суміш цис/транс ізомерів заголовної сполуки (40мг, 57% виходу). Rf=0,30 (10% МеОН/СН2СІ2); PX-MC m/z. Розраховано для С23 Н32 СІ F N2 02, 422,9, виявлено 423,4 (М+1) & 403,4 (M+1-HF).
ДивитисяДодаткова інформація
Назва патенту англійськоюHistamine-3 receptor antagonists
Автори англійськоюWager Travis T., Chandrasekaran Ramalakshmi Yegna, Butler Todd William
Назва патенту російськоюАнтагонисты рецепторов гистамина-3
Автори російськоюВейджер Тревис Т., Чандрасекаран Рамалакшми Егна, Батлер Тодд Вилльям
МПК / Мітки
МПК: A61K 31/165, C07D 207/04, C07C 237/24
Мітки: рецепторів, гістаміну-3, антагоністи
Код посилання
<a href="https://ua.patents.su/38-88719-antagonisti-receptoriv-gistaminu-3.html" target="_blank" rel="follow" title="База патентів України">Антагоністи рецепторів гістаміну-3</a>
Попередній патент: Електродна система пристрою для електрогідравлічної дії на пласт
Наступний патент: Установка для відновлення та зміцнення масивних сталевих деталей циліндричної форми наплавленням шару металу
Випадковий патент: Картоновий піддон












