Полімерні кон’югати фрагментів інтерферону-b, еритропоетину та гормону росту
Формула / Реферат
1. Пептидополімерний кон'югат наступної формули:
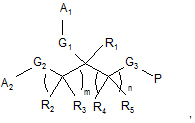
де
кожний з R1, R2, R3, R4 і R5 незалежно являє собою Н, С1-10алкіл, С2-10алкеніл, С2-10алкініл, арил, гетероарил, С3-8циклоалкіл або С3-8гетероциклоалкіл;
кожний з А1 і А2 незалежно являє собою полімерний фрагмент;
кожний з G1, G2 і G3 незалежно являє собою зв'язок або зв'язуючу функціональну групу;
Ρ вибирають з групи, що складається з фрагмента інтерферону-β, фрагмента еритропоетину і фрагмента гормону росту, при цьому атом азоту на N-кінці Ρ зв'язаний з G3;
m дорівнює 0 або цілому числу від 1 до 10; і
n дорівнює цілому числу від 1 до 10.
2. Кон'югат за п. 1, де Ρ являє собою фрагмент інтерферону-β.
3. Кон'югат за п. 2, де Ρ являє собою rINF-β Ser17.
4. Кон'югат за п. 2, де Ρ являє собою фрагмент модифікованого інтерферону-β, що містить 1-4 додаткових амінокислотних залишки на N-кінці.
5. Кон'югат за п. 1, де Ρ являє собою фрагмент еритропоетину.
6. Кон'югат за п. 1, де кожний з А1 і А2 являє собою фрагмент поліетиленгліколю з молекулярною масою 2-100 кД.
7. Кон'югат за п. 6, де кожний з А1 і А2 являє собою фрагмент поліетиленгліколю з молекулярною масою 10-30 кД.
8. Кон'югат за п. 7, де кожний з G1 і G2 являє собою

де О зв'язаний з А1 або А2, і атом N зв'язаний з атомом вуглецю; і G3 являє собою зв'язок.
9. Кон'югат за п. 8, де m дорівнює 4, n дорівнює 2, і кожний з R1, R2, R3, R4 і R5 являє собою Н.
10. Кон'югат за п. 9, де Ρ являє собою фрагмент інтерферону-β.
11. Кон'югат за п. 10, де Ρ являє собою rINF-b Ser17.
12. Кон'югат за п. 10, де Ρ являє собою фрагмент модифікованого інтерферону-β, що містить 1-4 додаткових амінокислотних залишки нa N-кінці.
13. Кон'югат за п. 9, де Ρ являє собою фрагмент еритропоетину.
14. Кон'югат за п. 9, де Ρ являє собою фрагмент гормону росту.
15. Кон'югат за п. 1, де Ρ являє собою фрагмент гормону росту.
16. Кон'югат за п. 1, який являє собою
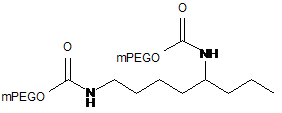 rINF-β Ser17,
rINF-β Ser17,
де mPEG являє собою фрагмент метоксиблокованого поліетиленгліколю з молекулярною масою 20 кД.
17. Кон'югат за п. 1, який являє собою
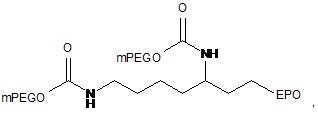
де mPEG являє собою фрагмент метоксиблокованого поліетиленгліколю з молекулярною масою 20 кД.
18. Кон'югат за п. 1, який являє собою
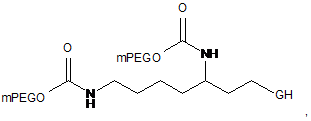
де mPEG являє собою фрагмент метоксиблокованого поліетиленгліколю з молекулярною масою 20 кД.
Текст
Реферат: Даний винахід стосується кон'югата полімерного фрагмента і фрагмента інтерферону, фрагмента еритропоетину або фрагмента гормону росту. UA 104146 C2 (12) UA 104146 C2 UA 104146 C2 5 10 15 20 25 30 35 40 45 Опис Перехресне посилання на споріднені заявки По даній заявці вимагається пріоритет на основі попередньої патентної заявки США № 61/085072, поданої 31 липня 2008 р., повний зміст якої включений в даний опис за допомогою посилання. Рівень техніки Прогрес в галузі клітинної біології і технології рекомбінантних білків привів до розробки білкових терапевтичних засобів. Проте, все ще існують значні ускладнення. Більшість білків чутливі до протеолітичного розкладання і внаслідок цього мають короткий час циркуляції в організмі. До інших недоліків належать низька розчинність у воді і індукція вироблення нейтралізуючих антитіл. Приєднання полімеру, наприклад поліетиленгліколю (PEG), до білка перешкоджає доступу протеолітичних ферментів до білкового кістяка, що приводить до підвищення стабільності білка. Крім того, це також може підвищувати розчинність у воді і зводити до мінімуму імуногенність. Існує потреба в ефективних способах приєднання полімеру до білків. Суть винаходу Один з аспектів даного винаходу стосується полімерополіпептидних кон’югатів формули I: Формула I де кожний з R1, R2, R3, R4 і R5 незалежно являє собою Н, C1-10алкіл, C2-10алкеніл, C2-10алкініл, арил, гетероарил, C3-8циклоалкіл або C3-8гетероциклоалкіл; кожний з A1 і A2 незалежно являє собою полімерний фрагмент (наприклад, поліалкіленоксидний фрагмент); кожний з G1, G2 і G3 незалежно являє собою зв'язок або зв'язуючу функціональну групу; Р являє собою фрагмент інтерферону-β (INF-β), фрагмент еритропоетину (EPO) або фрагмент гормону росту (GH); m дорівнює 0 або цілому числу від 1 до 10, і n дорівнює цілому числу від 1 до 10. У даних кон’югатах N-кінець фрагмента INF-β, фрагмента EPO або фрагмента GH зв'язаний з G3. З урахуванням наведеної вище формули, полімерополіпептидні кон’югати мають одну або декілька з наступних характерних особливостей: A1 і A2 являють собою поліалкіленоксидні фрагменти з молекулярною масою 2-100 кД (переважно, 10-30 кД, наприклад, 20 кД); кожний з G1 і G2 являє собою (де атом О зв'язаний з A1 або A2, і атом N зв'язаний з атомом вуглецю, як показано в формулі I; кожний з G1 і G2 являє собою сечовину, сульфонамід або амід (де атом N зв'язаний з атомом вуглецю, як показано в формулі I); m дорівнює 4; n дорівнює 2, і кожний з R1, R2, R3, R4 і R5 являє собою H. В деяких з цих кон’югатів Р являє собою фрагмент rINF-β Ser17 або модифікований фрагмент INF-β, що містить 1-4 додаткових амінокислотних залишки на N-кінці INF-β. Інший аспект даного винаходу стосується полімеропептидних кон’югатів формули II: Формула II де А являє собою полімерний фрагмент (наприклад, поліалкіленоксидний фрагмент); кожний з G1 і G2 незалежно являє собою зв'язок або зв'язуючу функціональну групу; L являє собою C2-10алкенілен або C2-10алкінілен, і Р являє собою фрагмент INF-β, фрагмент EPO або фрагмент GH. У даних кон’югатах N-кінець фрагмента INF-β, фрагмента EPO або фрагмента GH приєднаний до G2. З урахуванням формули II, полімеропептидні кон’югати мають одну або декілька з наступних характерних особливостей: A1 і A2 являють собою поліалкіленоксидні фрагменти з молекулярною масою 2-100 кД (переважно 10-30 кД, наприклад 20 кД); кожний з G1 і G2 являє собою зв'язок; C6 являє собою алкенілен, і кожний з R1, R2, R3, R4 і R5 являє собою Н. Інший аспект даного винаходу стосується полімеропептидних кон’югатів формули III: 1 UA 104146 C2 5 10 15 20 25 30 35 40 45 Формула III де кожний з R1, R2, R3 і R4 незалежно являє собою Н, C1-10алкіл, C2-10алкеніл, C2-10алкініл, арил, гетероарил, C3-8циклоалкіл або C3-8гетероциклоалкіл; n дорівнює цілому числу від 2 до 10; А являє собою полімерний фрагмент; G являє собою зв'язуючу функціональну групу, і Р являє собою пептидний фрагмент, при цьому атом азоту на N-кінці пептидного фрагмента зв'язаний з атомом вуглецю фрагмента у вказаній вище формулі. З урахуванням формули II, полімеропептидні кон’югати мають одну або декілька з наступних характерних особливостей: n дорівнює 1; А являє собою поліалкіленоксидний фрагмент з молекулярною масою 10-40 кД або 20-30 кД; G являє собою де атом О зв'язаний з А, і атом N зв'язаний з атомом вуглецю; і Р являє собою фрагмент INF, фрагмент EPO, фрагмент GH. Термін "C1-10алкіл", використовуваний в даному описі, означає прямий або розгалужений вуглеводневий одновалентний радикал, що містить від 1 до 10 атомів вуглецю. Приклади алкільних груп включають метил, етил, н-пропіл, ізопропіл, трет-бутил і н-пентил. Аналогічно, термін "C2-10алкеніл" означає прямий або розгалужений вуглеводневий одновалентний радикал, що містить від 2 до 10 атомів вуглецю і один або більше подвійних зв'язків. Термін "C2-10алкініл" означає прямий або розгалужений вуглеводневий одновалентний радикал, що містить від 2 до 10 атомів вуглецю і один або більше потрійних зв'язків. Термін "C2-10алкенілен" означає прямий або розгалужений вуглеводневий бівалентний радикал, що містить від 2 до 10 атомів вуглецю і один або більше подвійних зв'язків. Термін "C2-10алкінілен" означає прямий або розгалужений вуглеводневий бівалентний радикал, що містить від 2 до 10 атомів вуглецю і один або більше потрійних зв'язків. Термін "арил", використовуваний в даному описі, означає вуглеводневу кільцеву систему (моноциклічну або біциклічну) щонайменше з одним ароматичним кільцем. Приклади арильних фрагментів включають, але не обмежуються ними, феніл, нафтил і піреніл. Термін "гетероарил", використовуваний в даному описі, означає вуглеводневу кільцеву систему (моноциклічну або біциклічну) щонайменше з одним ароматичним кільцем, що містить щонайменше один гетероатом, такий як О, N або S, у вигляді частини кільцевої системи, при тому, що інші є атомами вуглецю. Приклади гетероарильних фрагментів включають, але не обмежуються ними, фурил, піроліл, тієніл, оксазоліл, імідазоліл, тіазоліл, піридиніл, піримідиніл, хіназолініл і індоліл. Термін "циклоалкіл", використовуваний в даному описі, означає частково або повністю насичену моноциклічну або біциклічну кільцеву систему, що має тільки атоми вуглецю в кільці. Приклади включають, але не обмежуються ними, циклопропаніл, циклопентаніл і циклогексаніл. Термін "гетероциклоалкіл", використовуваний в даному описі, означає частково або повністю насичену моноциклічну або біциклічну кільцеву систему, що має крім атомів вуглецю один або більше гетероатомів (наприклад, О, N або S) як атоми кільця. Приклади включають, але не обмежуються ними, піперидин, піперазин, морфолін, тіоморфолін і 1,4-оксазепан. Алкіл, алкеніл, алкініл, алкенілен, алкінілен, арил, гетероарил, циклоалкіл і гетероциклоалкіл, наведені в даному описі, включають як заміщені, так і незаміщені фрагменти. Приклади замісників включають C1-C10алкіл, C2-C10алкеніл, C2-C10алкініл, C3C8циклоалкіл, C5-C8циклоалкеніл, C1-C10алкокси, арил, арилокси, гетероарил, гетероарилокси, аміно, C1-C10алкіламіно, C1-C20діалкіламіно, ариламіно, діариламіно, гідроксіаміно, алкоксіаміно, C1-C10алкілсульфонамід, арилсульфонамід, гідроксил, галоген, тіо, C1-C10алкілтіо, арилтіо, ціано, нітро, ацил, ацилокси, карбоксил і складний ефір карбонових кислот. 2 UA 104146 C2 5 10 15 20 25 30 35 Термін "полімерний фрагмент" означає одновалентний радикал, похідний від лінійного, розгалуженого або зіркоподібного полімеру. Молекулярна маса полімерного фрагмента може становити 2-100 кД. Приклади полімерного фрагмента включають, але не обмежуються ними, поліетиленоксид, поліетиленгліколь, поліізопропіленоксид, полібутеніленоксид, поліетиленгліколь і їх співполімери. Інші полімери, такі як декстран, полівінілові спирти, поліакриламіди або полімери на основі вуглеводів, також можна використовувати, при умові, що вони не є антигенними, токсичними або такими, що викликають імунну відповідь. Термін "поліпептидний фрагмент" означає одновалентний радикал, похідний або від природного поліпептиду, або від модифікованого поліпептиду. Природним пептидом може бути INF-α2b, INF-β, GH, EPO і гранулоцитарний колонієстимулюючий фактор або антитіло. Модифікованим пептидом може бути, наприклад, пептид, що містить INF і 1-4 додаткових амінокислотних залишки на N-кінці INF-α2b. Прикладом такого модифікованого INF є , IFN, що представляє фрагмент INF-α2b, аміногрупа на N-кінці якого зв'язана з карбонільною групою. Термін "інтерферон-β" стосується сімейства високогомологічних білків, які інгібують вірусну реплікацію і клітинну проліферацію, а також модулюють імунну відповідь. Див. Derynck et al., (1980). Nature 285 (5766): 542-7; і Taniguchi et al., (1980). Gene 10(1): 11-5. Він включає як природні INF-β, так і їх функціональні еквіваленти, тобто поліпептиди, щонайменше на 80% (наприклад, 85%, 90%, 95% або 99%) ідентичні своєму аналогу дикого типу. Приклади INF-β включають активні інгредієнти комерційно доступних лікарських засобів, таких як авонекс, бетаферон і ребіф. Див., наприклад, Etemadifar M. et al., Acta Neurol. Scand., 2006, 113(5): 283-7. Нижче наведені амінокислотні послідовності прикладів білків INF-β людини, або у формі попередників, або в зрілій формі: (див. номер доступу GenBank: M28622, версія від 27 квітня 1993 р.; виділена курсивом частина стосується сигнальних пептидів) (див. номер доступу GenBank: CAA00839, версія від 3 грудня 1993 р.). У одному прикладі INF-β являє собою мутантну форму rINF-β Ser17 (рекомбінантний INF-β, де в положенні 17 знаходиться серин замість цистеїну природної зрілої послідовності INF-β). Амінокислотна послідовність даної мутантної форми наведена нижче: У іншому прикладі INF-β являє собою модифікований природний INF-β, де 1-4 додаткових амінокислотних залишки приєднані до N-кінця природного INF-β. EPO, продукований або в печінці, або в нирках, являє собою глікопротеїновий гормон, контролюючий еритропоез або виробництво червоних кров'яних клітин. Він включає як природний EPO, так і його функціональні еквіваленти. Див. патент США 5621080 і публікацію патентної заявки США 20050176627. Амінокислотні послідовності людського EPO (у формі попередника і в зрілій формі) наведені нижче: 3 UA 104146 C2 5 10 15 20 25 30 Білок EPO, використовуваний для створення кон’югата за даним винаходом, може являти собою білок EPO, або у формі попередника, або в зрілій формі, продукований організмами відповідних видів, наприклад, людський, мишачий, свинячий або великої рогатої худоби. У одному прикладі білок EPO має амінокислотну послідовність, щонайменше на 80% (наприклад, 85%, 90%, 95% або 99%) ідентичну одній з амінокислотних послідовностей, наведених вище. У іншому прикладі EPO являє собою модифікований природний EPO, де 1-4 додаткових амінокислотних залишки приєднані до N-кінця природного EPO. Термін "гормон росту" стосується природного людського гормону росту, або у формі попередника, або в зрілій формі, і його функціональних варіантів, тобто, які мають амінокислотну послідовність, щонайменше на 80% (наприклад, 85%, 90%, 95% або 99%) ідентичну природному людському гормону росту, і мають таку ж фізіологічну активність, що і людський гормон росту. У одному прикладі гормон росту являє собою модифікований природний гормон росту, де 1-4 додаткових амінокислотних залишки приєднані до N-кінця природного гормону росту. Амінокислотні послідовності природного людського гормону росту (у формі попередника і в зрілій формі) наведені нижче: "Процент ідентичності" двох амінокислотних послідовностей визначають, використовуючи алгоритм, описаний Karlin and Altschul в Proc. Natl. Acad. Sci. USA 87: 2264-68, 1990, модифікований згідно з Karlin and Altschul Proc. Natl. Acad. Sci. USA 90: 5873-77, 1993. Такий алгоритм включений в програми NBLAST і XBLAST (версія 2.0) Altschul et al. J. Mol. Biol. 215: 403-10, 1990. Пошуки білка програмою BLAST можна проводити за допомогою програми XBLAST, кількість балів=50, довжина "слова"=3, для одержання амінокислотних послідовностей, гомологічних білковим молекулам, використовуваним в даному винаході. Якщо між двома послідовностями існують гепи, можна використовувати програму Gapped BLAST, як описано у Altschul et al., в Nucleic Acids Res. 25(17): 3389-3402, 1997. При використанні програм BLAST і Gapped BLAST можна використовувати параметри за умовчанням відповідних програм (наприклад, XBLAST і NBLAST). Термін "зв'язуюча функціональна група" означає бівалентну функціональну групу, один кінець якої зв'язаний з полімерним фрагментом, а інший кінець зв'язаний з пептидним фрагментом. Приклади включають, але не обмежуються ними, -O-, -S-, складний ефір карбонової кислоти, карбоніл, карбонат, амід, карбамат, сечовину, сульфоніл, сульфініл, аміно, іміно, гідроксіаміно, фосфонатну або фосфатну групу. 4 UA 104146 C2 5 10 Пептидополімерні кон’югати, описані вище, можуть знаходитися у вільній формі або у формі солі, якщо це застосовно. Сіль, наприклад, може бути утворена між аніоном і позитивно зарядженою групою (наприклад, аміно) на пептидополімерному кон’югаті даного винаходу. Придатні аніони включають хлорид, бромід, йодид, сульфат, нітрат, фосфат, цитрат, метансульфонат, трифторацетат і ацетат. Крім того, сіль може бути утворена між катіоном і негативно зарядженою групою (наприклад, карбоксилатом) на поліпептидополімерному кон’югаті даного винаходу. Придатні катіони включають іон натрію, іон калію, іон магнію, іон кальцію і катіон амонію, такий як іон тетраметиламонію. Крім того, пептидополімерний кон’югат може мати один або декілька подвійних зв'язків або один або декілька асиметричних центрів. Такі кон’югати можуть існувати як рацемати, рацемічні суміші, одиночні енантіомери, окремі діастереомери, діастереомерні суміші, а також цис- або транс- або з Е- або Z-подвійним зв'язком ізомерні форми. Приклади полімеропептидних кон’югатів даного винаходу наведені нижче: 15 20 25 30 35 40 45 де mPEG являє собою метоксиблокований поліетиленгліколь з молекулярною масою 20 кД, і N-кінці rINF-β Ser17, EPO і GH приєднані до крайнього правого атома вуглецю, показаного на наведених вище структурах. Деякі білки мають терапевтичну корисність. Внаслідок цього, кон’югати даного винаходу, що містять пептидний фрагмент, можна використовувати для лікування захворювань. Наприклад, INF-β є імуномодулюючим лікарським засобом для лікування інфекції HCV або HBV. Див., наприклад, Journal of Vascular and Interventional Radiology 13 (2002): 191-196. Таким чином, в обсязі даного винаходу пропонується спосіб лікування інфекції, викликаної вірусом гепатиту С (HCV), або інфекції, викликаної вірусом гепатиту В (HBV), за допомогою INF-β-полімерного кон’югата, описаного вище. Як інший приклад, EPO є гормоном, продукованим нирками, для стимулювання утворення червоних кров'яних клітин в кістковому мозку. Він був використаний як імуномодулюючий лікарський засіб для лікування анемії, викликаної хронічним захворюванням нирок, повторної анемії після лікування СНІДу зидовудином і анемії, пов'язаної з раком. Нещодавні дослідження також показали, що EPO збільшує нейрогенез і грає важливу роль у відновленні після інсульту. Див., наприклад, Tsai P.T., Journal of Neuroscience, 2006, 26: 1269. Таким чином, ще один аспект даного винаходу стосується способу лікування анемії або посилення нейрогенезу за допомогою ЕРО-полімерного кон’югата, описаного вище. Також в обсязі даного винаходу пропонується композиція, що містить INF-β-полімерний кон’югат, описаний вище, для використання в лікуванні інфекції HCV або інфекції HBV, а також композиція, що містить ЕРО-полімерний кон’югат, описаний вище, для використання в лікуванні анемії або для посилення нейрогенезу, а також терапевтичне застосування і використання кон’югата для виробництва лікарського засобу для лікування інфекції HCV, інфекції HBV або анемії або для посилення нейрогенезу. Подробиці одного або більше варіантів здійснення винаходу викладені в наведеному нижче описі. Інші особливості, цілі і переваги винаходу будуть очевидні з опису і з формули винаходу. Докладний опис винаходу Пептидополімерні кон’югати за даним винаходом можна одержувати способами синтезу, добре відомими в галузі хімії. Наприклад, можна об'єднувати лінкерну молекулу, що має одну або більше активних функціональних груп, з двома молекулами полімеру, що мають функціональну групу, реагуючу з функціональними групами на лінкерній молекулі. Потім проводять взаємодію пептидної молекули, що містить функціональну групу, з функціональною 5 UA 104146 C2 5 10 15 20 групою на лінкерній молекулі, з одержанням пептидополімерного кон’югата даного винаходу. У даному описі наведені дві ілюстративні схеми синтезу. Наведена нижче схема 1 демонструє приклад одержання пептидополімерних кон’югатів формули I. Діамінну сполуку 1, що містить ацетальну групу, піддають взаємодії з Nгідроксисукцинімідилкарбонатом mPEG (тобто, сполукою 2) з утворенням дипегильованої сполуки 3, яку надалі перетворюють в альдегід 4. Проводять взаємодію одержаної альдегідної сполуки з пептидом H-P, що має вільну аміногрупу, шляхом відновного алкілування, з одержанням пептидополімерного кон’югата даного винаходу. Схема 1 Наведена нижче схема 2 демонструє приклад одержання пептидополімерних кон’югатів формули II. Хімічна сполука 6 містить полімерний фрагмент і альдегідну функціональну групу. Вона може бути піддана взаємодії з пептидом 7, що має вільну функціональну аміногрупу. Одержаний продукт 8 потім відновлюють, наприклад, гідруванням або за допомогою NaBH3CN, з одержанням пептидополімерного кон’югата 9. Схема 2 Наведена нижче схема 3 є прикладом одержання пептидополімерного кон’югата формули III. Сполуку 10, що містить ацетальну групу, яку можна одержати з β-амінокислоти, піддають взаємодії з N-гідроксисукцинімідилкарбонатом mPEG 2 з утворенням пегильованої сполуки 11, яку надалі перетворюють в альдегід 12. Проводять взаємодію одержаної альдегідної сполуки з пептидом H-P, що має вільну аміногрупу, шляхом відновного алкілування, з одержанням бажаної сполуки 13. Схема 3 6 UA 104146 C2 5 10 15 20 25 30 35 40 45 Проведення хімічних реакцій, описаних вище, включає використання розчинників, реагентів, каталізаторів, реактивів для створення захисних груп і зняття захисних груп, а також певних умов реакції. Вони можуть додатково включати стадії, або до, або після стадій, спеціально описаних в даному описі, необхідні для додавання або видалення відповідних захисних груп, щоб в кінцевому результаті здійснювати синтез пептидополімерного кон’югата. Крім того, різні стадії синтезу можна проводити в іншій послідовності або іншому порядку, щоб одержувати потрібні поліпептидополімерні кон’югати. Перетворення синтетичної хімії і методики роботи із захисними групами (створення і зняття захисту), корисні при синтезі відповідних пептидополімерних кон’югатів, відомі в даній галузі і включають, наприклад, такі, як описано в Larock R., Comprehensive Organic Transformations, VCH Publishers (1989); Greene T. W. and Wuts P.G.M., Protective Groups in Organic Synthesis, 2d. Ed., John Wiley and Sons (1991); Fieser L. and Fieser M., Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); і Paquette L., ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) і в їх подальших виданнях. Синтезований таким чином пептидополімерний кон’югат можна додатково очищати таким методом, як іонообмінна хроматографія, гельфільтраційна хроматографія, електрофорез, діаліз, ультрафільтрація або ультрацентрифугування. Пептидополімерний кон’югат даного винаходу може бути фармацевтично активний у формі кон’югата. Альтернативно, він може вивільняти фармацевтично активний пептид in vivo (наприклад, шляхом гідролізу) внаслідок ферментативного розщеплення зв'язку між пептидним фрагментом і полімерним фрагментом. Приклади ферментів, що беруть участь в розщепленні зв'язків in vivo, включають окиснювальні ферменти (наприклад, пероксидази, аміноксидази або дегідрогенази), відновні ферменти (наприклад, кеторедуктази) і гідролітичні ферменти (наприклад, протеази, естерази, сульфатази або фосфатази). Таким чином, один з аспектів даного винаходу стосується способу введення ефективної кількості одного або декількох з описаних вище пептидополімерних кон’югатів для лікування захворювання (наприклад, інфекції HCV або HBV, або анемії). Зокрема, захворювання можна лікувати шляхом введення суб'єкту одного або декількох пептидополімерних кон’югатів в ефективній кількості. Такий суб'єкт може бути визначений професіоналом в сфері охорони здоров'я на основі результатів будь-якого придатного методу діагностики. Використовуваний в даному описі термін "вплив" або "лікування" визначають як застосування або введення композиції, яка містить пептидополімерний кон’югат, суб'єкту (людині або тварині), що має захворювання, симптом захворювання, захворювання або розлад, що є вторинним відносно захворювання, або схильність до захворювання, з метою лікування, полегшення, зменшення, усунення або поліпшення стану захворювання, симптому захворювання, захворювання або розладу, що вторинним відносно захворювання, або схильності до захворювання. "Ефективна кількість" означає кількість пептидополімерного кон’югата, яка надає терапевтичний ефект на суб'єкта, що піддається лікуванню. Терапевтичний ефект може бути об'єктивним (тобто, вимірюваним за допомогою певних тестів або маркерів) або суб'єктивним (тобто, суб'єкт демонструє ознаки або відчуває ефект). У застосуванні на практиці способу за даним винаходом композицію, що містить один або декілька з вказаних вище кон’югатів, можна вводити парентерально, перорально, через ніс, ректально, місцево або трансбукально. Використовуваний в даному описі термін 7 UA 104146 C2 5 10 15 20 25 30 35 40 45 50 55 "парентерально" означає підшкірну, внутрішньошкірну, внутрішньовенну, внутрішньом'язову, внутрішньосуглобову, внутрішньоартеріальну, інтрасиновіальну, інтрастернальну, інтратекальну, внутрішньоосередкову, внутрішньоочеревинну, інтратрахеальну або внутрішньочерепну ін'єкцію, а також будь-який придатний інфузійний метод. Стерильна ін'єкційна композиція може являти собою розчин або суспензію в нетоксичному парентерально прийнятному розріджувачі або розчиннику, наприклад розчин в 1,3-бутандіолі. У числі прийнятних середовищ і розчинників, які можна використовувати, знаходяться маніт, вода, розчин Рінгера і ізотонічний розчин хлориду натрію. Крім того, як розчинник або суспендуюче середовище звичайно використовують нелеткі масла (наприклад, синтетичні моно- або дигліцериди). Жирні кислоти, такі як олеїнова кислота і її гліцеридні похідні, придатні для створення ін’єктованих препаратів, а також природні фармацевтично прийнятні олії, такі як оливкова олія або касторова олія, особливо в їх поліоксіетилованому варіанті. Такі масляні розчини або суспензії можуть також містити довголанцюжковий спиртовий розріджувач або диспергатор, або карбоксиметилцелюлозу, або аналогічні диспергуючі агенти. Для створення препарату можна також використовувати інші звичайно використовувані поверхнево-активні речовини, такі як твіни або спани, або інші аналогічні емульгатори або підсилювачі біодоступності, які звичайно використовують у виробництві фармацевтично прийнятних твердих, рідких або інших лікарських форм. Композиція для перорального введення може являти собою будь-яку прийнятну для перорального введення дозовану форму, включаючи капсули, таблетки, емульсії, а також водні суспензії, дисперсії і розчини. У випадку таблеток, звичайно використовувані носії включають лактозу і кукурудзяний крохмаль. Також звичайно додають лубриканти, такі як стеарат магнію. Для перорального введення в формі капсул, корисні розріджувачі включають лактозу і сухий кукурудзяний крохмаль. При пероральному введенні водних суспензій або емульсій активні інгредієнти можна суспендувати або розчиняти в масляній фазі в поєднанні з емульгаторами або суспендуючими агентами. При бажанні можна додавати певні підсолоджувачі, віддушки або барвники. Назальний аерозоль або інгаляційну композицію можна одержувати способами, добре відомими в галузі створення фармацевтичних препаратів. Наприклад, таку композицію можна одержувати у вигляді розчину в фізіологічному розчині, використовуючи бензиловий спирт або інші придатні консерванти, підсилювачі абсорбції для збільшення біодоступності, фторвуглеці і/або інших солюбілізуючі або диспергуючі агенти, відомі в даній галузі. Композицію, що містить одну або декілька з вказаних вище сполук, можна також вводити у формі супозиторіїв для ректального введення. З одним або декількома вказаними вище активними кон’югатами, як правило, використовують фармацевтично прийнятний носій. Носій в фармацевтичній композиції повинен бути "прийнятним" в тому значенні, що він повинен бути сумісним з активним інгредієнтом композиції (і переважно здатним стабілізувати активний інгредієнт) і не заподіювати шкоду суб'єкту, що піддається лікуванню. Один або більше солюбілізуючих агентів можна використовувати як фармацевтичні ексципієнти для доставки вказаної вище сполуки. Приклади інших носіїв включають колоїдний оксид кремнію, стеарат магнію, целюлозу, лаурилсульфат натрію і барвник D&С Yellow № 10. Наведені нижче приклади повинні розглядатися тільки як ілюстративні і ніяким чином не повинні обмежувати подальшу частину розкриття інформації. Вважається, що без додаткових подробиць фахівець в даній галузі може, виходячи з наведеного опису, в повній мірі використовувати даний винахід. Повний зміст всіх публікацій, цитованих в даному описі, включений в нього за допомогою посилань. Приклад 1: IFN-β-ди-PEG полімерний кон’югат Одержання ди-PEG альдегіду 20 кД PEGO(С=О)OSu одержували з 20 кД mPEGOH, придбаного у SunBio Inc. (CA, USA), способом, описаним в Bioconjugate Chem. 1993, 4, 568-569. Розчин 6-(1,3-діоксолан-2-іл)гексан-1,5-діаміну в дихлорметані (11,97 г розчину, що містить 9,03 мг діаміну, 47,8 мкмоль) додавали в колбу, що містить 20 кД PEGO(С=О)OSu (1,72 г, 86,0 мкмоль). Після повного розчинення PEGO(С=О)OSu додавали N, N-діізопропілетиламін (79 мкл, 478 мкмоль). Реакційну суміш перемішували при кімнатній температурі протягом 24 год., і 8 UA 104146 C2 5 10 15 20 25 30 35 40 45 50 55 потім по краплях додавали метил-трет-бутиловий ефір (200 мл) при перемішуванні. Осад, що утворився, збирали і сушили у вакуумі, з одержанням ди-PEG ацеталю (1,69 г, 98%) у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, d6-ДМСО) δ 7,16 (т, J=5,2 Гц, 1H), 7,06 (д, J=8,8 Гц, 1H), 4,76 (т, J=4,8 Гц, 1H), 4,10-3,95 (м, 4H), 1,80-1,65 (м, 1H), 1,65-1,50 (м, 1H), 1,48-1,10 (м, 6H). Ди-PEG ацеталь (4,0 г, 0,2 ммоль) суспендували в буфері pH 2,0 (лимонна кислота, 40 мл). Реакційну суміш перемішували при 35°С протягом 24 год. і потім екстрагували дихлорметаном (3×50 мл). Об'єднані органічні шари сушили над сульфатом магнію, концентрували і потім знов розчиняли в дихлорметані (20 мл). Розчин додавали по краплях до метил-трет-бутилового ефіру (400 мл) при перемішуванні. Осад, що утворився, збирали і сушили при зниженому тиску, з одержанням ди-PEG альдегіду (3,8 г, 95%) у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, d6-ДМСО) δ 9,60 (с, 1H), 7,24 (д, J=8,4 Гц, 1Н), 7,16 (т, J=5,2 Гц, 1Н), 4,103,95 (м, 4H), 3,95-3,80 (м, 1H), 3,00-2,85 (м, 2H), 2,58-2,36 (м, 2H), 1,46-1,15 (м, 6H). Альтернативно, ди-PEG альдегід одержували таким чином: Дві аміногрупи комерційно доступного гомолізину (Astatech Pharmaceutical Co., Ltd, China) захищали бензилоксикарбонілом. Гомолізин з N-захистом етерифікували і відновлювали з утворенням альдегідної сполуки. Потім альдегідну групу захищали за допомогою етиленгліколю. Бензилоксикарбонільну захисну групу потім видаляли гідруванням в присутності каталізатора паладію. Сполуку зі знятим N-захистом піддавали взаємодії з активованим mPEGOH (Sunbio Chemicals Co., Ltd., South Korea) в слабколужних умовах. Одержаний продукт перемішували в лимоннокислому буфері pH 2,0 (Sigma-Aldrich, Germany) при 25°С протягом 72 годин, для видалення альдегідної захисної групи. Одержували 109 г альдегіду ди-PEG полімеру (вихід: 95%). Чистота була більше 97,7% (за даними ВЕРХ) і більше 1 95% (за даними Н ЯМР аналізу). Одержання людського rhIFN-β Ser17 Фрагмент ДНК, що кодує людський IFN-β Ser17, клонували в експресійний вектор pET24a для створення експресійної плазміди rhIFN-β Ser17-pET24a. Одержану експресійну плазміду трансформували в Е. coli і позитивні трансформанти, тобто клони, що несуть експресійну плазміду, відбирали, культивували і одержані культури Е. coli зберігали при -80°С. 10 мкл вказаної вище збережуваної культури Е. coli інокулювали в 200 мл середовища для висівання, що складається з середовища Terrific Broth і гліцерину, приблизно на 15 годин при 37°С і 200 об./хв. 150 мл одержаної таким чином культури Е. coli переносили в 2,5 л культурального середовища, що містить глюкозу (10 г/л), MgSO4·7H2O (0,7 г/л), (NH4)2HPO4 (4 г/л), KH2PO4 (3 г/л), K2HPO4 (6 г/л), цитрат (1,7 г/л), дріжджовий екстракт (10 г/л), канаміцин (50 мг/мл), хлорамфенікол (50 мг/мл), піногасник і мікроелементи, включаючи FeSO4·7H2O (10 мг/л), ZnSO4·7H2O (2,25 мг/л), CuSO4 5H2O (1 мг/л), MnSO4 H2O (0,5 мг/л), H3BO3 (0,3 мг/л), CaCl2 2H2O (2 мг/л), (NH4)6Mo7O24 (0,1 мг/л), EDTA (0,84 мг/л) і Cl (50 мг/л), і культивували при 37°С. Коли значення OD600 культури Е. coli досягало 120-140, до культури додавали IPTG (1М) для індукції експресії rhIFN-β Ser17. Індуковану культуру інкубували при 37°С і 300 об./хв. протягом 3 годин. При необхідності в процесі інкубації до культури Е. coli додавали поживне середовище, що містить 800 г/л глюкози і 20 г/л MgSO4. Культуру E. coli, одержану, як описано вище, піддавали центрифугуванню для збирання клітин Е. coli. Клітини ресуспендували в буфері PBS (0,1 Na2HPO4, 0,15М NaCl) і руйнували в гомогенізаторі APV. Одержаний таким чином гомогенізований розчин центрифугували при 10000 об./хв., 4°С протягом 15 хв. Осади (включаючи тільця включення) збирали, ресуспендували в PBS і перемішували при кімнатній температурі протягом 20-30 хв. для утворення суспензії. NaOH (6Н) додавали до суспензії для доведення її pH до 12, щоб розчинилися білки, поміщені в тільця включення. Приблизно через 2 хвилини pH суспензії доводили до 7,5 за допомогою 6н HCl. Потім суспензію піддавали центрифугуванню і одержаний в результаті супернатант збирали, визначаючи в ньому концентрацію білка на спектрофотометрі. Супернатант змішували з буфером для рефолдингу (TEA, pH 8,3) і інкубували при кімнатній температурі без перемішування протягом 24-48 годин. Потім його концентрували і діалізували, використовуючи TFF-систему і касету PLCCC, що постачається Millipore, Inc. Одержаний розчин піддавали ультрафільтрації, діалізу і фракціонуванню на колонці з сефарозою SPFF. Одержані в результаті фракції A9 і A10, що містять рекомбінантний 9 UA 104146 C2 5 10 15 20 25 30 35 40 45 50 55 білок rhIFN-β Ser17, потім фракціонували на іншій колонці з сефарозою SPFF для збагачення рекомбінантним білком (у фракціях A8-A10). Фракції, що містять rhIFN-β Ser17, потім очищали гель-фільтрацією (Superdex 75 HR 10/300), з одержанням білка rhIFN-β Ser17 (1 мг/мл) з 7 чистотою більше 90%. Біологічна активність рекомбінантного білка становила >2×10 МЕ/мг білка. Одержання IFN-β-ди-PEG полімерного кон’югата 18,9 мг rhIFN-β Ser17 і 1,51 г ди-PEG альдегіду суспендували в 26 мл 0,1М натрійфосфатного буфера (рН 5,0). До одержаного розчину додавали 400 екв. NaCNBH3 (Acros Organics, Belgium). Реакційну суміш перемішували при кімнатній температурі протягом 16 годин і потім піддавали діалізу з 25 мМ тріс-HCl (рН 7,8). Неочищений продукт очищали на іонообмінній колонці, з одержанням 2 мг IFN-β-ди-PEG полімеру. Одержання людського IFN-β Трансформовані клітини E. coli BLR (DE3)-RIL, що несуть кодуючу послідовність IFN-β, функціонально зв'язану з промотором Е. coli, інокулювали в 250 мл середовища SYN (10 г/л добавки "select soytone", 5 г/л дріжджового екстракту, 10 г/л NaCl) з додаванням 50 мкл/мл канаміцину і 50 мкл/мл хлорамфеніколу. Потім клітини культивували при 37°С в інкубаторі з шейкером при 220 об./хв. протягом ночі (тобто 16 годин). 250 мл нічної культури, вказаної вище, інокулювали в 3,0 л мінімального середовища (10 г/л глюкози, 0,7 г/л MgSO4·7H2O, 4 г/л (NH4)2HPO4, 3 г/л KH2PO4, 6 г/л К2НРО4, 2 г/л цитрату, 10 г/л дріжджового екстракту і 2 г/л ізолейцину) з додаванням 10 г/л основної глюкози, 0,7 г/л поживного MgSO4, 30 мл поживних мікроелементів (10 г/л FeSO4·7H2O, 2,25 г/л ZnSO4·7H2O, 1 г/л CuSO4·5H2O, 0,5 г/л MnSO4·H2O, 0,3 г/л H3BO3, 2 г/л CaCl2·2H2O, 0,1 г/л (NH4)6Mo7O24, 0,84 г/л EDTA, 50 мл/л HCl), 25 мкл/мл канаміцину і 25 мкл/мл хлорамфеніколу і культивували в п’ятилітровому ферментері (Bioflo 3000; Brunswick Scientation Co., Edison NJ). У процесі ферментації pH середовища підтримували на рівні pH 7,1 автоматизованим додаванням 37% розчину NH4OH. Вміст розчиненого кисню (DO) підтримували на рівні 30%. Поживний розчин (800 г/л глюкози, 20 г/л MgSO4, 50 мкл/мл канаміцину і 50 мкл/мл хлорамфеніколу) додавали, використовуючи програмно керований насос, який був запрограмований на підживлення у випадку, коли рівень DO перевищує 40-60. Коли густина клітин (OD600) в ферментованій культурі досягала 180-200, 4 мл 1М ізопропіл-β-D-1-тіогалактопіранозиду (IPTG) додавали до ферментованої культури для індукції експресії IFN-β, спільно з 30 мл поживних мікроелементів і 25 г дріжджового екстракту. Клітини збирали центрифугуванням через 5 годин після індукції IPTG. Клітинні осади суспендували в буфері PBS (0,1М фосфат натрію, 0,15М хлорид натрію, рН 7,4) в приблизному співвідношенні 1:3 (г мокрої маси/мл), руйнували мікрофлюїдизатором і потім центрифугували при 10000 об./хв. протягом 20 хв. при 4°С. Осад, що містить тільця включення (IB), двічі промивали буфером PBS, центрифугували, як описано вище, і суспендували в 1 л розчину PBS (0,1М фосфат натрію, 0,15М хлорид натрію, рН 7,4, 3% zwittergent 3-14, 5 мМ ДТТ). Після перемішування протягом 30 хвилин pH суспензії доводили до 12 за допомогою 6,0М NaOH, перемішуючи для розчинення осаду. Потім pH суспензії доводили до 7,5 за допомогою 6н HCl. Після центрифугування при 10000 об./хв. протягом 20 хв. збирали супернатант, що містить розчинний IFN-β. Потім проводили рефолдинг розчинного IFN-β наступним чином. Вказаний вище супернатант розбавляли в 10 л свіжоприготованого буфера для рефолдингу (100 мМ тріс-HCl (рН 7,6), 0,5M L-аргінін, 2 мМ EDTA) з одержанням рефолдингової суміші. Суміш інкубували протягом 48 годин без перемішування. Після інкубації суміш, що містить наново згорнутий рекомбінантний IFN-β, діалізували проти 20 мМ тріс-буфера (з 100 мМ NaCl, 0,05% zwittergent 3-14, рН 7,0). Діалізовану суміш наносили на колонку з SP-сефарозою (GE Amersham Pharmacia), яку попередньо зрівноважували і промивали 20 мМ тріс-HCl буфером з 100 мМ NaCl (рН 7,0). IFN-β елюювали розчином, що містить 20 мМ тріс-HCl буфер (рН 7,0) і 200 мМ NaCl. Фракції, що містять IFN-β, збирали, основуючись на їх оптичній густині при 280 нм. IFN-β, що міститься в них, додатково очищали на колонці з гідрофобною взаємодією (GE healthcare, Butyl Sepharose Fast Flow), яку попередньо зрівноважували і промивали розчином, що містить 1,0М сульфат амонію, 20 мМ ацетат натрію і 0,05% zwittergent (рН 4,5). IFN-β елюювали розчином, що містить 0,5М сульфат амонію і 20 мМ ацетат натрію. Фракції, що містять білок, збирали, основуючись на їх оптичній густині при 280 нм. Одержані фракції об'єднували і концентрацію IFN-β визначали білковим аналізом BCA (BCA™ Protein assay, Pierce). Одержання кон’югата PEG-IFN-β 10 UA 104146 C2 5 10 15 20 25 30 35 40 45 50 55 До розчину ди-PEG альдегіду (296 мг, 7,4 мкмоль) у воді (1,46 мл) додавали 2M натрійфосфатний буфер (рН 4,0, 0,37 мл), zwittergent 3-14 (1,48 мл, 10% у воді) і IFN-β (14,8 мг в 3,7 мл буфера з рН 4,5, що містить 20 мМ ацетат натрію, 0,7% сульфат амонію і 0,05% детергент). Реакційну суміш перемішували при кімнатній температурі протягом 10 хвилин, потім додавали водний розчин ціаноборгідриду (400 мМ, 92,5 мкл, 37 мкмоль). Реакційну суміш перемішували в темряві протягом 40 годин і очищали хроматографією на SP-HP-сефарозі. Фракції, що містять бажаний кон’югат PEG-IFN-β, збирали, основуючись на їх часі утримання і оптичній густині при 280 нм. Концентрацію кон’югата визначали білковим аналізом BCA (BCA™ Protein assay, Pierce). Фармакокінетичні дослідження на щурах Проводили фармакокінетичне дослідження на щурячій моделі, щоб порівняти час напівжиття в сироватці IFN-β і PEG-IFN-β. Самцям щурів (250~350 г) вводили внутрішньовенно в дозі 600 мкг/кг маси IFN-β (n=3) і PEG-IFN-β (n=3). Кров (250 мкл) збирали від кожного щура перед введенням і через 0,1, 1, 2, 4, 6, 10, 24, 48, 72 і 96 годин після введення. З крові одержували зразки сироватки і кількості IFN-β, що містяться в зразках, аналізували імуноферментним аналізом (ELISA). Час напівжиття в сироватці IFN-β і PEG-IFN-β становив 2 години і 20 годин, відповідно, розрахований, виходячи з концентрації в сироватці в останніх трьох часових точках. Приклад 2: EPO-PEG полімерний кон’югат Одержання PEG-EPO До розчину ди-PEG альдегіду (267 мг, 6,1 мкмоль) у воді (2,67 мл) додавали 2M натрійфосфатний буфер (рН 4,0, 1 мл) і EPO (10 мг в 3,03 мл буфера, рН 7,3, що містить 20 мМ фосфат натрію і 150 мМ NaCl). Реакційну суміш перемішували при кімнатній температурі протягом 10 хвилин з подальшим додаванням водного розчину ціаноборгідриду натрію (400 мМ, 100 мкл, 40 мкмоль). Реакційну суміш перемішували в темряві протягом 17 годин і очищали на колонці з SP Toyopearl (Tosoh). Колонку зрівноважували 20 мМ натрійацетатним буфером, pH 4,5. Реакційну суміш розбавляли до концентрації 0,3-0,4 мг/мл і наносили на колонку з SP Toyopearl. Фракції, що містять бажаний кон’югат PEG-EPO, збирали, основуючись на їх часі утримання і оптичній густині при 280 нм. Концентрацію кон’югата визначали поглинанням в УФобласті при 280 нм. Фармакокінетичні дослідження на щурах Проводили фармакокінетичне дослідження на щурячій моделі, щоб порівняти час напівжиття в сироватці EPO і PEG-EPO. Самцям щурів (250~350 г) вводили внутрішньовенно EPO (n=5) і PEG-EPO (n=5) в дозі 25 мкг/кг маси. Кров (250 мкл) збирали від кожного щура перед введенням і через 0,088, 0,75, 1,5, 3, 6, 10, 24 і 48 годин після введення. При введенні щурам PEG-EPO зразки крові додатково збирали через 72 і 96 годин після введення. З крові одержували зразки сироватки і аналізували імуноферментним аналізом (ELISA) для визначення кількостей EPO, що містяться в них. Результати свідчать, що час напівжиття в сироватці EPO становив 9 годин, тоді як для PEG-EPO він значно збільшувався, тобто становив 38 годин. Одержання EPO-PEG полімерного кон’югата 0,2 мг EPO (Cashmere Scientific Company, Taiwan) і 4 мг ди-PEG альдегіду (20 екв.) суспендували в 0,1М фосфатному буфері (рН 5,0). До одержаного розчину додавали 400 екв. NaCNBH3. Реакційну суміш перемішували при кімнатній температурі протягом 16 годин. Дані ВЕРХ підтвердили утворення EPO-ди-PEG полімеру. Приклад 3: GH-PEG полімерний кон’югат Одержання Met-hGH Трансформовані клітини E. coli BLR (DE3)-RIL, здатні експресувати Met-hGH, культивували згідно з методом ферментації, описаним вище, для експресії Met-hGH. Клітини збирали центрифугуванням і клітинний осад суспендували в TE-буфері (50 мМ трісHCl, 1 мМ EDTA, рН 8,0) в приблизному співвідношенні 1:3 (г мокрої маси/мл). Після цього клітини руйнували мікрофлюїдизатором і потім центрифугували при 10000 об./хв. протягом 20 хв. Осад, що містить тільця включення (IB), двічі промивали буфером TED (50 мМ тріс-HCl, 1 мМ EDTA, 2% дезоксихолат, рН 8,0), центрифугували, як описано вище, суспендували в очищеній MilliQ воді і центрифугували при 20000 об./хв. протягом 15 хв. IB суспендували в 400 мл 50 мМ розчину TUD (50 мМ тріс-HCl, 4М сечовина, 2,5 мМ ДТТ, рН 10,0) і суспензію центрифугували при 20000 об./хв. протягом 20 хв.; супернатант збирали. Супернатант розводили в 2,0 л свіжоприготованого буфера для рефолдингу (50 мМ трісHCl, 0,5 мМ EDTA, 5% гліцерин, суміш 10 мМ GSH/1 мМ GSSG, рН 8,0). Одержану таким чином 11 UA 104146 C2 5 10 15 20 25 30 35 суміш інкубували протягом 36 годин без перемішування і потім діалізували проти 20 мМ трісбуфера (рН 7,0). Діалізовану суміш, що містить Met-hGH, наносили на колонку з Q-сефарозою (GE Amersham Pharmacia, Pittsburgh, PA), яку попередньо зрівноважували і промивали 20 мМ тріс-HCl буфером, рН 7,0. Met-hGH елюювали розчином, що містить 20 мМ тріс-HCl буфер, рН 7,0 і 100 мМ NaCl. Фракції, що містять Met-hGH, визначені по їх оптичній густині при 280 нм, збирали, об'єднували і наносили на колонку з гідрофобною взаємодією (GE Amersham Pharmacia, Pittsburgh, PA), попередньо зрівноважену і промиту 20 мМ натрійацетним буфером (рН 7,0) при швидкості потоку 5 мл/хв. Met-hGH елюювали розчином, що містить 20 мМ натрійацетний буфер і 150 мМ сульфат амонію. Фракцію, що містить Met-hGH, збирали і проводили білковий аналіз BCA (BCA™ Protein assay, Pierce) для визначення концентрації Met-hGH. Одержання кон’югата PEG-Met-hGH До розчину ди-PEG альдегіду (74 мг, 1,7 мкмоль) у воді (387 мкл) додавали 2M натрійфосфатний буфер (рН 4,0, 374 мкл) і людську GH (22,4 мг в 6,5 мл буфера, рН 4,5, що містить 20 мМ ацетат натрію і 150 мМ NaCl). Реакційну суміш перемішували при кімнатній температурі протягом 10 хвилин з подальшим додаванням водного розчину ціаноборгідриду натрію (400 мМ, 140 мкл, 56 мкмоль). Реакційну суміш перемішували в темряві протягом 17 годин і очищали хроматографією на SP-XL-сефарозі. Фракції, що містять бажаний полімеробілковий кон’югат, збирали, основуючись на їх часі утримання і оптичній густині при 280 нм. Концентрацію кон’югата визначали за допомогою набору для визначення білків методом Бредфорд (Pierce, Rockford, IL). Фармакокінетичні дослідження на щурах Проводили фармакокінетичне дослідження на щурячій моделі, щоб порівняти час напівжиття в сироватці Met-hGH і PEG-Met-hGH. Самцям щурів (250~350 г) вводили внутрішньовенно Met-hGH (n=5) або PEG-Met-hGH (n=5) в дозі 100 мкг/кг ваги. Зразки крові збирали у щурів, яким вводили Met-hGH, до введення і через 0,083, 1, 2, 4, 8, 12 і 24 години після введення; і у щурів, яким вводили PEG-Met-hGH, до введення і через 0,33, 1, 4, 8, 12, 24, 48, 72 і 96 годин після введення. З крові одержували зразки сироватки і аналізували імуноферментним аналізом (ELISA) для визначення концентрацій hGH. Час напівжиття MethGH і PEG-Met-hGH становив 3 години і 35 годин, відповідно. Інші варіанти здійснення Всі ознаки, розкриті в даному описі, можна об'єднувати в будь-якій комбінації. Кожну ознаку, розкриту в даному описі, можна замінювати іншою ознакою, що служить тій же еквівалентній або аналогічної меті. Таким чином, якщо прямо не вказане інше, кожна розкрита ознака є тільки прикладом конкретної групи еквівалентних або аналогічних ознак. Виходячи з наведеного вище опису, фахівець в даній галузі може легко встановити основні характеристики даного винаходу і, не відходячи від його суті і обсягу, зможе вносити різні зміни і модифікації в даний винахід, щоб адаптувати його до різних способів застосування і умов. Таким чином, інші варіанти здійснення також входять в обсяг прикладеної формули винаходу. 40 ФОРМУЛА ВИНАХОДУ 1. Пептидополімерний кон'югат наступної формули: A1 R1 G1 G2 A2 m R2 45 50 G3 R3 R4 n R5 P , де кожний з R1, R2, R3, R4 і R5 незалежно являє собою Н, С1-10алкіл, С2-10алкеніл, С2-10алкініл, арил, гетероарил, С3-8циклоалкіл або С3-8гетероциклоалкіл; кожний з А1 і А2 незалежно являє собою полімерний фрагмент; кожний з G1, G2 і G3 незалежно являє собою зв'язок або зв'язуючу функціональну групу; Ρ вибирають з групи, що складається з фрагмента інтерферону-β, фрагмента еритропоетину і фрагмента гормону росту, при цьому атом азоту на N-кінці Ρ зв'язаний з G3; m дорівнює 0 або цілому числу від 1 до 10; і n дорівнює цілому числу від 1 до 10. 12 UA 104146 C2 5 10 2. Кон'югат за п. 1, де Ρ являє собою фрагмент інтерферону-β. 3. Кон'югат за п. 2, де Ρ являє собою rINF-β Ser17. 4. Кон'югат за п. 2, де Ρ являє собою фрагмент модифікованого інтерферону-β, що містить 1-4 додаткових амінокислотних залишки на N-кінці. 5. Кон'югат за п. 1, де Ρ являє собою фрагмент еритропоетину. 6. Кон'югат за п. 1, де кожний з А1 і А2 являє собою фрагмент поліетиленгліколю з молекулярною масою 2-100 кД. 7. Кон'югат за п. 6, де кожний з А1 і А2 являє собою фрагмент поліетиленгліколю з молекулярною масою 10-30 кД. 8. Кон'югат за п. 7, де кожний з G1 і G2 являє собою O O 15 20 N H , де О зв'язаний з А1 або А2, і атом N зв'язаний з атомом вуглецю; і G3 являє собою зв'язок. 9. Кон'югат за п. 8, де m дорівнює 4, n дорівнює 2, і кожний з R 1, R2, R3, R4 і R5 являє собою Н. 10. Кон'югат за п. 9, де Ρ являє собою фрагмент інтерферону-β. 11. Кон'югат за п. 10, де Ρ являє собою rINF- Ser17. 12. Кон'югат за п. 10, де Ρ являє собою фрагмент модифікованого інтерферону-β, що містить 14 додаткових амінокислотних залишки нa N-кінці. 13. Кон'югат за п. 9, де Ρ являє собою фрагмент еритропоетину. 14. Кон'югат за п. 9, де Ρ являє собою фрагмент гормону росту. 15. Кон'югат за п. 1, де Ρ являє собою фрагмент гормону росту. 16. Кон'югат за п. 1, який являє собою O O N H mPEGO 25 NH mPEGO rINF-β Ser17, де mPEG являє собою фрагмент метоксиблокованого поліетиленгліколю з молекулярною масою 20 кД. 17. Кон'югат за п. 1, який являє собою O O NH mPEGO N H mPEGO EPO , де mPEG являє собою фрагмент метоксиблокованого поліетиленгліколю з молекулярною масою 20 кД. 18. Кон'югат за п. 1, який являє собою O O mPEGO 30 mPEGO N H NH GH , де mPEG являє собою фрагмент метоксиблокованого поліетиленгліколю з молекулярною масою 20 кД. 13 UA 104146 C2 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюPeptide-polymer conjugates
Автори російськоюLin, Ko-Chung
МПК / Мітки
МПК: A61K 38/19, A61K 47/48, A61K 38/21, A61K 38/27
Мітки: гормону, росту, інтерферону-b, полімерні, фрагментів, кон'югати, еритропоетину
Код посилання
<a href="https://ua.patents.su/16-104146-polimerni-konyugati-fragmentiv-interferonu-b-eritropoetinu-ta-gormonu-rostu.html" target="_blank" rel="follow" title="База патентів України">Полімерні кон’югати фрагментів інтерферону-b, еритропоетину та гормону росту</a>












