Заміщені похідні індазолу, фармацевтична композиція для інгібування фосфодіестерази типу iv або для інгібування утворення фактора пухлинного некрозу, проміжні сполуки
Формула / Реферат
1. Заміщені похідні індазолу формули І:
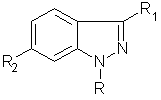 , І
, І
або їх фармацевтично прийнятні солі, де
R – С1-С6алкіл, (CH2)n-C3-C7циклоалкіл, де n = 0-2, С6-С10арил, де зазначені арильні угруповання зазначених R-груп, як варіант, заміщені 1-3 замісниками, незалежно вибраними з групи, яка складається з галогену, гідроксилу, С1-С5 алкілу, С2-С5алкенілу, С1-С5алкоксилу, трифлуорметилу, нітрогрупи, CO2R9, C(O)NR9R10, NR9R10 та SO2NR9R10;
R1 – С1-С4алкіл, як варіант, заміщений до трьох атомів флуору;
R2 є групою формули
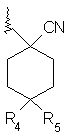 ;
;
R4 – H;
R5 – R9, OR9, CH2OR9, ціаногрупа, C(O)R9, CO2R9, C(O)NR9R10 або NR9R10,
або R4 і R5 разом утворюють =О;
кожне R9 і R10 є незалежно гідрогеном або С1-С4алкілом.
2. Сполука за п.1, де R – циклогексил, циклопентил, метиленциклопропіл, ізопропіл, феніл або 4-флуорфеніл.
3. Сполука за п. 2, де R1 – С1-С2алкіл.
4. Сполука за п.1, де R2 є групою формули
 .
.
5. Сполука за п.1, вибрана з групи, яку складають:
1-(1-циклопентил-3-етил-1Н-індазол-6-іл)-4-оксоциклогексанкарбонітрил;
метиловий естер транс-4-ціано-4-(1-циклопентил-3-етил-1Н-індазол-6-іл)циклогексанкарбонової кислоти;
метиловий естер цис-4-ціано-4-(1-циклопентил-3-етил-1Н-індазол-6-іл)циклогексанкарбонової кислоти;
1-(1-циклогексил-3-етил-1Н-індазол-6-іл)-4-оксоциклогексанкарбонітрил;
метиловий естер цис-4-ціано-4-(1-циклогексил-3-етил-1Н-індазол-6-іл)циклогексанкарбонової кислоти;
метиловий естер транс-4-ціано-4-(1-циклогексил-3-етил-1Н-індазол-6-іл)циклогексанкарбонової кислоти;
цис-4-ціано-4-(1-циклогексил-3-етил-1Н-індазол-6-іл)циклогексанкарбонова кислота;
транс-4-ціано-4-(1-циклогексил-3-етил-1Н-індазол-6-іл)циклогексанкарбонова кислота;
1-(циклогексил-3-етил-1Н-індазол-6-іл )цис-4-гідроксилметилциклогексанкарбонітрил;
амід цис-4-ціано-4-(1-циклогексил-3-етил)-1Н-індазол-6-іл)циклогексанкарбонової кислоти;
амід транс-4-ціано-4-(1-циклогексил-3-етил-1Н-індазол-6-іл)циклогексанкарбонової кислоти.
6. Сполука за п. 1 для виготовлення медикаменту для лікування захворювань, для яких інгібування фосфодіестерази (PDE) типу IV або інгібування утворення фактора пухлинного некрозу (TNF) у ссавця є релевантним.
7. Сполука за п.1 для виготовлення медикаменту для лікування астми, запалення суглобів, ревматоїдного артриту, подагричного артриту, ревматоїдного спондиліту, остеоартриту та інших артритних станів; сепсису, септичного шоку, ендотоксичного шоку, грамнегативного сепсису, токсичношокового синдрому, гострого респіраторного розладу, церебральної малярії, хронічного пульмонарного запалення, силікозу, пульмонарного саркоїдозу, хвороби резорбції кісток, реакцій відторгнення трансплантата та алотрансплантата, інфекційних лихоманки і міалгії (викликаних, наприклад, бактеріальною, вірусною або грибковою інфекцією), таких як грип, кахексія, викликана інфекцією або злоякісною пухлиною, кахексія, викликана СНІДом і пов'язаним з ним комплексом, утворення келоїдів, утворення рубцевої тканини, хвороби Крона, виразкового коліту, пірезу, множинного склерозу, diabetes mellitus типу 1, аутоімунного діабету, системного волчака, бронхіту, хронічного утруднення дихання, псоріазу, хвороби Беше, алергічного пурпурового нефриту, хронічного гломерулонефриту, запалення кишечнику, лейкемії, алергічного риніту або дерматиту.
8. Проміжні сполуки формули
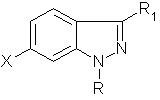 , ХХХХ
, ХХХХ
де R – С1-С6 алкіл, (СН2)n-Сз-С7 циклоалкіл, де n = 0-2, С6-С10 арил, де зазначені арильні угруповання зазначених R-груп, як варіант, заміщені 1-3 замісниками, незалежно вибраними з групи, яка складається з атома галогену, гідроксилу, С1-С5 алкілу, С2-С5 алкенілу, С1-С5 алкоксилу, трифлуорметилу, нітрогрупи, CO2R9, C(O)NR9R10, NR9R10 та SO2NR9R10;
R1 – C1-C4 алкіл;
кожне R9 та R10 незалежно є атомом гідрогену або C1-C4 алкілом;
X - бром, -С(О)О(С1-С6 алкіл), -СН2СN, карбоксил, -СН2ОН або -С(О)Н, за умови, що, коли R1 – метил, а X – Br, тоді R не є фенілом, заміщеним в параположенні NO2 або NH2, і фенілом, заміщеним OCH3 і COONa.
9. Сполука за п. 8, де R – циклогексил, циклопентил, метиленциклопропіл, ізопропіл, феніл або 4-флуорфеніл, або R1 – етил.
10. Сполука за п. 9, де Х – бром.
11. Проміжні сполуки формули
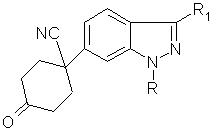 , ХІХ
, ХІХ
де R – С1-С6 алкіл, (СН2)n-С3-С7 циклоалкіл, де n = 0-2, С6-С10 арил, де зазначені арильні угруповання зазначених R-груп, як варіант, заміщені 1-3 замісниками, незалежно вибраними з групи, яка складається з галогену, гідроксилу, С1-С5 алкілу, С2-С5 алкенілу, С2-С5 алкоксилу, трифлуорметилу, нітрогрупи, CO2R9, C(O)NR9R10, NR9R10 та SO2NR9R10;
R1 – C1-C4 алкіл; і
кожне R9 та R10 незалежно є гідрогеном або C1-C4 алкілом;
12. Сполука за п.11, де R - циклогексил, циклопентил, метиленциклопропіл, ізопропіл, феніл або 4-флуорфеніл, R1 - етил.
13. Фармацевтична композиція, призначена для інгібування фосфодіестерази (PDE) типу IV або для інгібування утворення фактора пухлинного некрозу (TNF) у ссавця і містить терапевтично ефективну кількість сполуки за п. 1, і фармацевтично прийнятний носій.
14. Фармацевтична композиція, що призначена для запобігання або лікування астми, запалення суглобів, ревматоїдного артриту, подагричного артриту, ревматоїдного спондиліту, остеоартриту та інших артритних станів; сепсису, септичного шоку, ендотоксичного шоку, грамнегативного сепсису, токсичношокового синдрому, гострого респіраторного розладу, церебральної малярії, хронічного пульмонарного запалення, силікозу, пульмонарного саркоїдозу, хвороби резорбції кісток, реакцій відторгнення трансплантата та алотрансплантата, інфекційних лихоманки і міалгії (викликаних, наприклад, бактеріальною, вірусною або грибковою інфекцією), таких як грип, кахексія, викликана інфекцією або злоякісною пухлиною, кахексія, викликана СНІДом і пов'язаним з ним комплексом, утворення келоїдів, утворення рубцевої тканини, хвороби Крона, виразкового коліту, пірезу, множинного склерозу, diabetes mellitus типу 1, аутоімунного діабету, системного волчака, бронхіту, хронічного утруднення дихання, псоріазу, хвороби Беше, алергічного пурпурового нефриту, хронічного гломерулонефриту, запалення кишечнику, лейкемії, алергічного риніту або дерматиту у ссавців,
яка містить терапевтично ефективну кількість сполуки за п. 1 та фармацевтично
прийнятний носій.
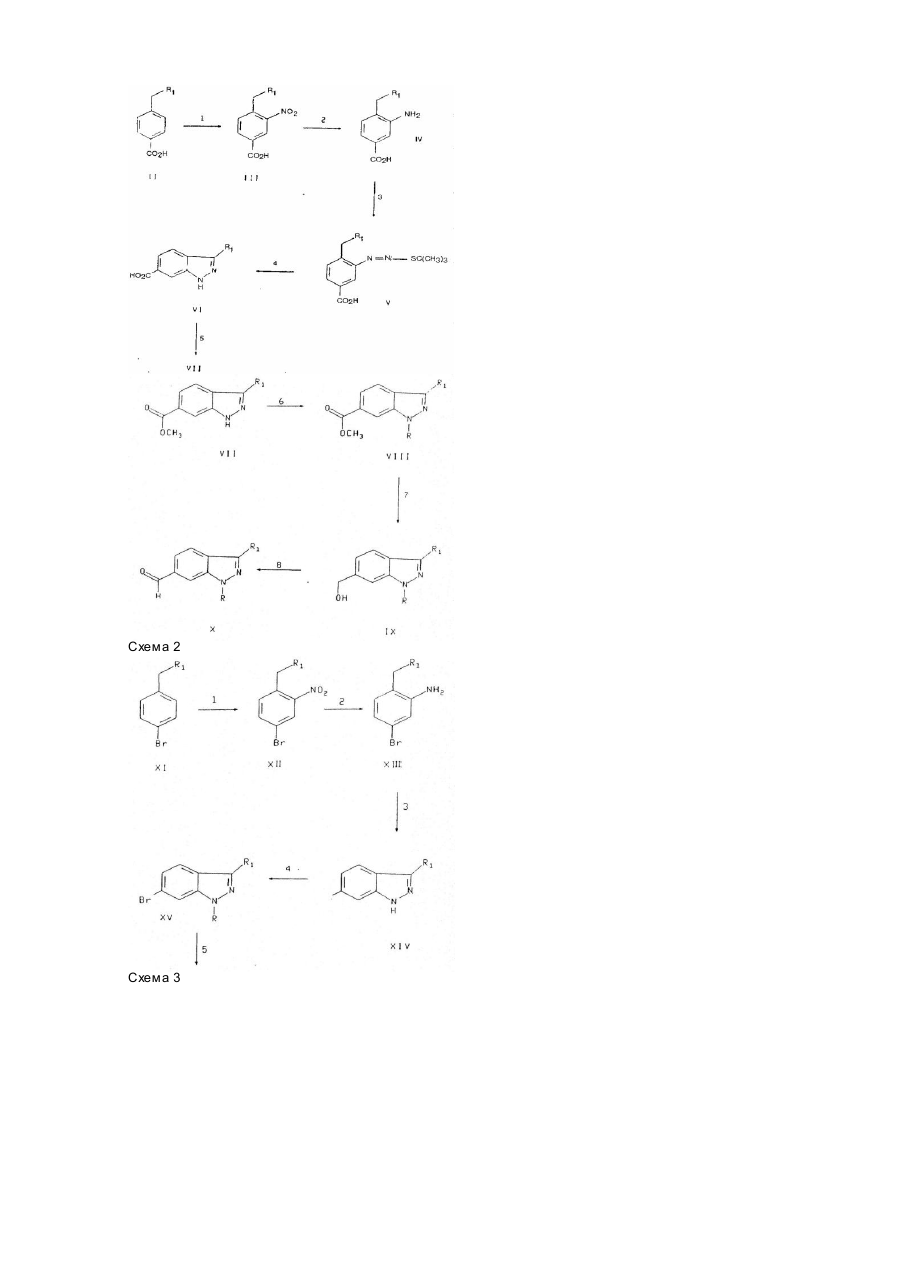
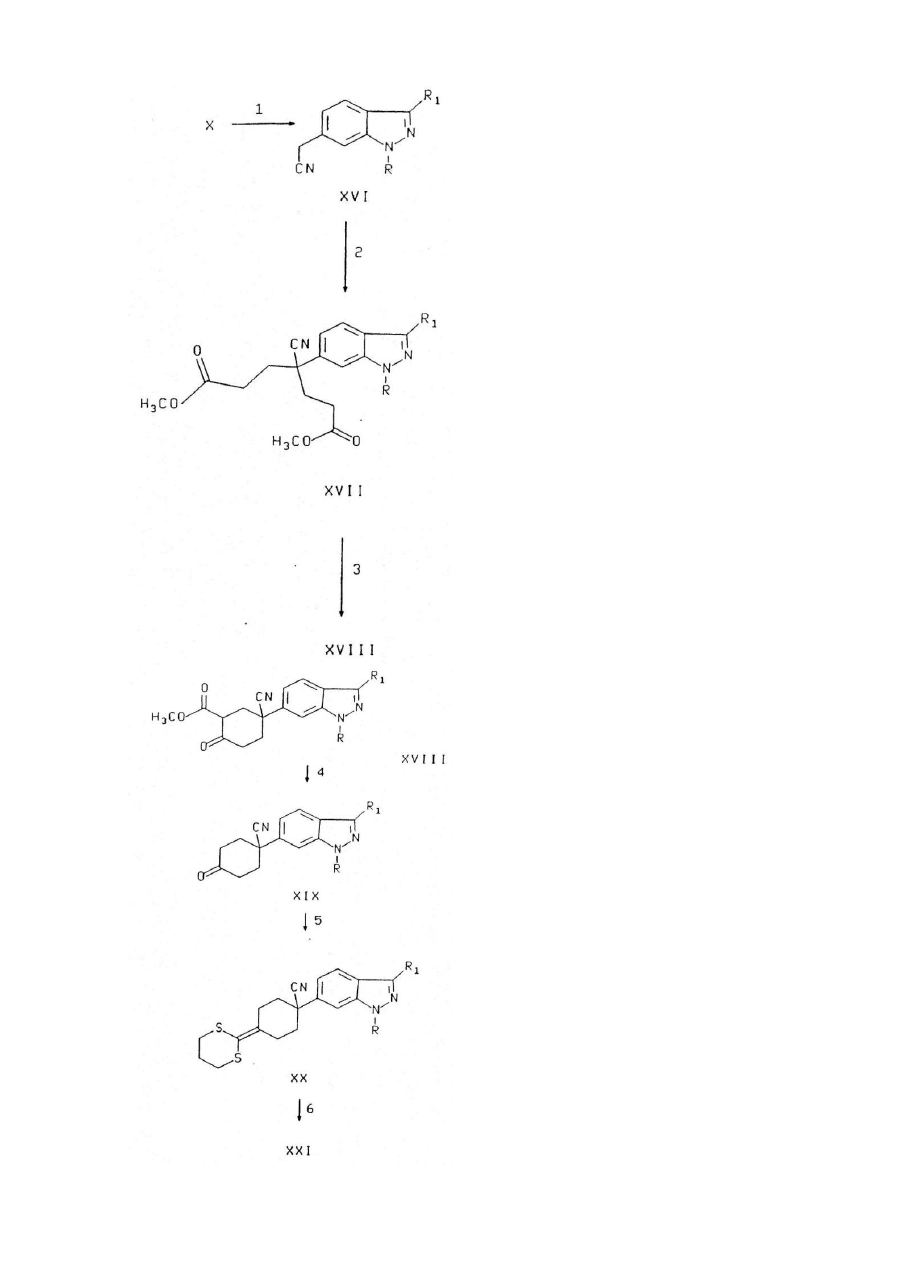
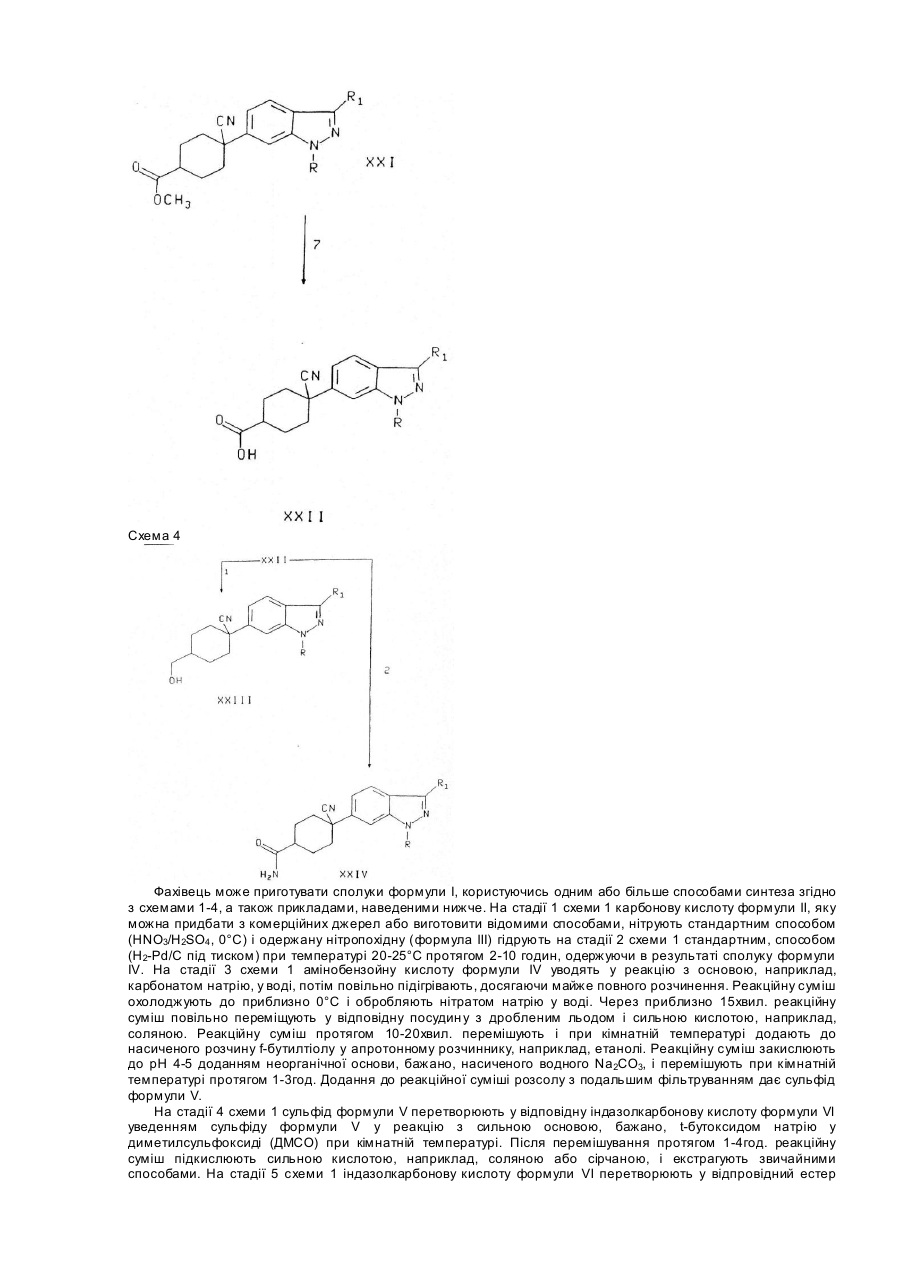
Текст
Винахід стосується ряду нових аналогів індазолу, що є активними інгібіторами фосфодіестерази (ФДЕ) типу IV і утворення фактора пухлинного некрозу (ФПН) і, як такі, корисні при лікуванні астми, артриту, бронхиту, хронічних захворювань дихальних шляхів, псоріазу, алергічного риніту, дерматиту та інших запалювальних захворювань, СНІДу, септичного шоку і інших захворювань, пов'язаних з утворенням ФПН. Винахід стосується також способу використання таких сполук при лікуванні перелічених захворювань у ссавців, особливо людини, і фармацевтичних композицій з такими сполуками. Після виявлення того, що циклічний аденозинфосфат (ЦАФ) є др угім внутрішньоклітинним переносником (E.W.Sutherland and T.W.Rall, Pharmacol. Rev., 12, 265, 1960), придушення ФДЕ стало об'єктом модуляції і, відповідно, терапевтичного втручання при багатьох хворобливих процесах. Пізніше були розпізнані окремі класи ФДЕ (J.A.Beavo et al., TiPS, 11, 150, 1990) і їх селективне придушення поліпшило ефективність медикаментозної терапії (C.D.Nicholson, M.S.Hahid, TiPS, 12, 19, 1991). Зокрема, було встановлено, що придушення ФДЕ типу IV може викликати придушення вивільнення посередника запалення (M.W. Verghese et al., J. Мої. Cell Cardiol., 12 (Suppl. II), S 61, 1989) і релаксацію гладких м'язів дихальних шляхі в (TJ.Torphy, "Directions for New Anti:Asthma Drugs", eds S.R.O'Donnell and C.G.A.Persson, 1988, 37 Birkhauser-Verlag). Таким чином, сполуки-інгібітори ФДЕ типу IV, малоактивні проти ФДЕ інших типів, придушують вивільнення посередників запалювання і викликають релаксацію гладких м'язів дихальних шляхів, не викликаючи серцевосудинних або тромбоцитарно-антиплазминних явищ. Було встановлено, що ФПН бере участь у бага тьох інфекційних та аутоімунних захворюваннях (W.Friers, FEBS Letters, 285, 199, 1991). Крім того, було показано, що ФПН є первинним посередником запалювальної реакції, яка супроводжує сепсис і септичний шок ( E.Spooner et al., Clinical Immunology and Irnmunopathology, 62, S11, 1992). Винахід стосується сполук формули І I і їх фармацевтично прийнятних солей, де R - водень, С1-С6алкіл, -(СН2)n(С3-С7циклоалкіл), де n=0...2, (С1-С6алкокси)С 1-С6алкіл, С2-С6алкеніл, (СН2)n(С3-С9гетероцикліл), де n=0...2, або -(Z')b(Z")c(C6-С10арил), де b та с незалежно можуть приймати значення 0 або 1, Z! - С1-С6алкілен або С2-С6алкенілен, a Z" - О, S, SO2 a6O NR 9 ; зазначені алкільні, алкенільні, алкоксіалкільні, гетероциклільні і арильні угруповання зазначених R-груп заміщені за вибором одним, двома або трьома замісниками, незалежно обраними з групи, що містить галоген, гідроксил, С1-С5алкіл, С2С5алкеніл, С1-С5алкоксил, С3-С6циклоалкоксил, трифторметил, нітрогрупу, CO2R9 , C(O)NR9R10 . NR9R10 та SO2NR9R10; R1 - водень, С1-С7алкіл, С2-С3алкеніл, феніл, С3-С7циклоалкіл або (С3-С7циклоалкіл)С 1-С2алкіл, де зазначені алкільна, алкенільна і фенільна групи R1 заміщено за вибором одним, двома або трьома замісниками, незалежно обраними з групи, що складається з метилу, етилу, трифторметилу і галогену. R2 обирають з групи, що складається з де штри хові лінії у формула х 1а, 1б репрезентують простий або подвійний зв'язок; m має значення від 0 до 4; R3 - Н, галоген, ціаногрупа, С1-С4алкіл, заміщений за вибором 1-3-ма галогеногрупами, CH2NHC(O)C(O)NH 2, циклопропіл, за вибором заміщений R11, R17, CH2OR 9, NR9R10 , CH2NR9R10, CO 2R9, C(O)NR9R10, C=CR11, C(Z)H або CH=CR11R11; R4 - H, C(Y)R14 , CO 2R14, C(Y)NR 17R14 , CN, C(NR17)NR17R14, C(NOR 9)R14, C(O)NR9NR9C(O)R9, C(O)NR9NR17R14, C(NOR 14)R9 , C(NR9)NR17R14, C(NR14)NR9R10 , C(NCN)NR17R14, C(NCN)S(C 1-C4)алкіл, CR9R10OR14б CR9R10SR14, CR9R10S(O) nR15 , де n=0...2, CR 9R10NR14R17, CR9R10NR17SO2R 15, CR9R10NR17C(Y)R14, CR9R10NR17CO2R15, CR9R10NR17C(Y)NR17R14, CR9R10NR17C(NCN)NR17R14, CR9R10NR17 G(CR9NO2)S(C1-С4)алкіл, CR9R10CO2R15 , CR9R10C(Y)NR17R14, CR9R10C(NR17)NR17R14, CR9R10CN, CR9R10C(NOR10)R14, CR9R10C(NOR14)R10 , СR9R10NR17С(NR17)S(С1-С4алкіл), CR9R10NR17C(NR17)NR17R14, CR9R10NR17C(O)C(O)NR17R14 , CR9R10NR17C(O)C(O)OR 14 , тетразоліл, тіазоліл, імідазоліл, імідазолідиніл, піразоліл, тіазолідиніл, оксазоліл, оксазолідиніл, тріазоліл, ізоксазоліл, оксадіазоліл, тіадіазоліл, CR9R10(тетразоліл), CR9R10(тіазоліл),CR9R10(імідазоліл), CR9R10(імідазолідиніл),CR9R10(піразоліл), CR9R10(тіазолідиніл), CR9R10(оксазоліл), CR9R10(оксазолідиніл), CR9R10(тріазоліл), CR9R10(ізоксазоліл), CR9R10(оксадіазоліл), CR9R10(тіадіазоліл), CR9R10(морфолініл), CR9R10(піперидиніл), CR9R10(піперазиніл) або CR9R10(піроліл), де зазначені гетероциклічні групи і угруповання для зазначених замісників R4 заміщено за вибором одним, двома або трьома замісниками R14; R5 – R9, OR9, CH2OR9, ціаногрупа, C(O)R9, CO2R9, C(O)NR9R10 або NR9R10 за умови, що R5 відсутня, коли штри хова лінія у формулі (Іа) позначає подвійний зв'язок; або R4, R5 разом утворюють =O або =R8; або R5 - водень, a R4 - OR14, SR14, S(O)nR15, де n=0...2, SO2NR17R14, NR17R14 , NR14C(O)R9 , NR17C(Y)R14, NR17C(O)OR 15, NR17C(Y)NR17R 14, NR17SO2NR17R 14, NR17C(NCN)NR17R14, NR17SO2R15, NR17C(CR9NO2)NR17R14, NR17C(NCN)S(C 1-C4алкіл), NR17C(CR9NO2)S(C1-C4алкіл), NR17C(NR17)NR17R14, NR17C(O)C(O)NR17R14 або NR17C(O)C(O)OR14 ; кожна R9 незалежно від інших є метилом або етилом, заміщеними за вибором 1-3-ма галогеногрупами; R7 - 0R14, SR14, SO2NR17R14, NR17R14, NR14C(O)R9, NR17C(Y)R 14 , NR17C(O)OR 15 , S(O)nR12, де n=0...2, OS(O)2R12, OR12,OC(O)NR 13R12, OC(O)R 13, OC(O) 2R13, O(CR 12R13) mOR12, де m=0...2, CR 9R10OR14, CR9R10NR17R14 , C(Y)R14, C(O) 2R14 , C(Y)NR17R14, CN, C(NR17)NR17R14, C(NOR 9)R14, C(O)NR9NR9C(O)R9, C(O)NR9NR17R14, C(NOR 14)R9, C(NR9)NR17R14 , C(NR14)NR9R10, C(NCN)NR17R14, С(NСN)S(С1-С4алкіл), тетразоліл, тіазоліл, імідазоліл, імідазолідиніл, піразоліл, тіазолідиніл, оксазоліл, оксазолідиніл, тріазоліл, ізоксазоліл, оксадіазоліл або тіадіазоліл, де зазначені гетероциклічні групи R7 заміщено за вибором 1-3-ма замісниками R14; R8 - =NR15, =NCR9R10(C2-C6алкеніл), =NOR14, =NOR 19, =NOCR9R10(C2-С6алкеніл), =NNR9R14, =NNR9R19, =NCN, =NNR9C(Y)NR9R14, =C(CN)2, =CR14CN, -CR14CO 2R9, =CR14C(O)NR9R14, =C(CN)NO2, =С(СN)СО2(С1С4алкіл), =С(СN)ОСО2(С1-С4алкіл)) =С(СN)(С1-С4алкіл), =C(CN)C(O)NR 9R14, 2-(1,3-дитіан), 2-(1,3-дитіолан), диметилтіокеталь, діетилтіокеталь, 2-(1,3-діоксалан), 2-(1,3-діоксан), 2-(1,3-оксатіолан), диметилкеталь або діетилкеталь. R9, R10 незалежно одна від одної є воднем або С 1-С4алкілом, заміщеним за вибором 1-3-ма атомами фтор у; кожна R11 незалежно від інших є фтором або R10, кожна R12 незалежно від інших являє собою С 1-С6алкіл, С2-С3алкеніл, С3-С7циклоалкіл, (С3С7циклоалкіл)С 1-С2алкіл, С6-С10арил або С 3-С9гетероцикліл, де зазначені групи R12 заміщено за вибором 1-3ма замісниками, незалежно один від одного обраними з групи, що складається з метилу, етилу, трифторметилу і галоген у; кожна R13 незалежно від інших є фтором або R12; кожна R14 незалежно від інших являє собою водень або R15, або, коли R14 і R17 є NR17R14 . то R14 і R17 разом з азотом можуть утворити 5-7-членне кільце, яке за бажанням може містити щонайменше один додатковий гетероатом, обраний з О, N і S; кожна R15 незалежно від інших являє собою С1-С6алкіл або -(CR9R10)nRi6, де n=0...2, a R16 і С1-С6алкіл заміщено за вибором 1-3-ма замісниками, які незалежно один від одного обирають з групи, яку складають галогеногрупа, нітрогрупа, ціаногрупа, NR10R17, C(O)R9, OR9 , CONR10R17 , OC(O)NR 10R17, NR17C(O)NR17R10, NR17C(O)R10, NR17C(O)O(C1-C4алкіл), C(NR17)NR17R10, C(NCN)NR17R10, C(NCN)S(C 1-С4алкіл), NR17C(NCN)S(C 1C4алкіл), NR17C(NCN)NR17R10, NR17SO 2(C1-C4алкіл), S(О)n(С1-С4алкіл), де n=0...2, NR 17C(O)C(O)NR17R10, NR17C(O)C(O)R17, тіазоліл, імідазоліл, оксазоліл, пірозоліл, тріазоліл, тетразоліл і С 1-С4алкіл, заміщені за вибором 1-3-ма атомами фтору; кожна R16 незалежно від інших являє собою С 3-С7циклоалкіл, піриділ, піриміділ, піразоліл, імідазоліл, тріазоліл, піроліл, піперазиніл, піперидиніл, морфолініл, фураніл, тіеніл, тіазоліл, хінолініл, нафтил або феніл; кожна R17 незалежно від інших являє собою OR9 або R10; R18 - Η, C(Y)R 14, CO 2R14 , C(Y)NR17R14 , CN, C(NR17)NR17Ri4, C(NOR 9)R14, C(O)NR9NR9C(O)R9, C(O)NR9NR17R14, C(NOR 14)R9, C(NR9)NR17R14 , C(NR14)NR9R10, C(NCN)NR17R14, С(NСN)S(С1-С4)алкіл, CR9R10OR14 , CR9R10SR14, CR9R10S(O)nR15. де n =0...2, CR 9R10NR14R17 , CR9R10NR17SO 2R15, CR9R10NR17C(Y)R14. CR9R10NR17CO2R15, CR9R10NR17C(Y)NR17R14, CR9R10NR17C(NCN)NR17R14, CR9R10NR17C(CR9NO2)S(C1-С4)алкіл, тетразоліл, тіазоліл, імідазоліл, імідазолідиніл, піразоліл, тіазолідиніл, оксазоліл, оксазолідиніл, тріазоліл, ізоксазоліл, оксадіазоліл, тіадіазоліл, де зазначені гетероциклічні групи заміщено за вибором одним, двома або трьома замісниками R14; R19 - -C(O)R14, -C(O)NR9R14, -S(O)2R15 або -S(O) 2NR9R14; кожна Υ незалежно від інших є =O або =S; Ζ - =O, =NR17, =NCN, =C(CN)2, =CR9CN, =CR9NO2, =CR9CO2, =CR9C(O)NR9R10, =С(СМ)СО 2(С1-С4алкіл) або =C(CN)C(O)NR 9R10. Винахід стосується також проміжних сполук, які можна використати для приготування сполук формули І, включаючи сполуки формули та де X - бром, -С(O)O(С1-С5алкіл), -CH2CN, карбоксил, -СН2ОН або -С(О)Н, a R, R1 ідентичні визначеним раніше для формули І. Термін "галоген" означає тут, якщо не зумовлено інше, фтор, хлор, бром або іод. Бажаними галогенами є фтор, хлор і бром. Термін "алкіл" включає, якщо не зумовлено інше, насичені моновалентні вуглеводневі радикали з лінійними або розгалуженими ланцюгами. Термін "алкоксил" включає, якщо не зумовлено інше, О-алкільні групи, де алкіл визначено вище. Термін "алкеніл" включає, якщо не зумовлено інше, ненасичені алкільні групи з одним або більше подвійними зв'язками, де алкіл визначено вище. Термін "циклоалкіл" включає, якщо не зумовлено інше, насичені моновалентні циклічні вуглеводневі радикали, включаючи циклобутил, циклопентил і циклогептил. Термін "арил" включає, якщо не зумовлено інше, органічні радикали, наприклад, феніл або нафтил, одержані з ароматичних вуглеводнів видаленням одного атома водню. Термін "гетероцикліл" включає, якщо не зумовлено інше, ароматичні і неароматичні гетероциклічні групи, які містять один або більше гетероатомів, кожний з яких обрано з О, S і N. Гетероциклічні групи включають системи, утворені кільцями, з'єднаними з бензольним кільцем, і кільцеві системи, заміщені оксогрупою. У заміснику R4 формули 1а С3-С9гетероциклічна група може бути приєднана до С 1-С6алкільної через атом азота або, бажано, вуглецю. Прикладом С 3гетероциклічної групи може бути тіазоліл, а прикладом С9гетероциклічної групи - хінолініл. Прикладами неароматичних гетероциклічних груп є піролідініл, піперидінол, морфолінол, тіоморфолінол і піперазиніл. Прикладами ароматичних гетероциклічних груп є піриділ, імідазоліл, піромідиніл, тріазоліл, піразоліл, піразиніл, тетразоліл, фурил, тіеніл, ізоксазоліл і тіазоліл. Зрозуміло, що коли гетероциклічні групи використовуються як замісники для сполуки формули І, маються на увазі також усі придатні ізомери таких гр уп. Наприклад, у заміснику R4 тіазоліл включає 2-, 4- або 6-тіазоліл; імідазоліл включає 2-, 4- або 5-імідазоліл; піразоліл включає 3-, 4- або 5-піразоліл; оксазоліл включає 2-, 4або 5-оксазоліл; ізоксазоліл включає 3-, 4- або 5-ізоксазоліл і т. д. Подібним чином у заміснику R16 піриділ включає 2-, 3- або, 4-піриділ. Бажані сполуки формули І включають ті, у яких R2 - гр упа формули (1а), де R3 і R5 є цис-групами: Інші бажані сполуки формули І включають ті, у яких R2 - група формули (1а), де штрихові лінії позначають простий зв'язок, a R3 і R4 є цис-гр упами. Інші бажані сполуки формули І включають ті, у яких R - циклогексил, циклопропіл, метиленциклопропіл, ізопропіл, феніл або 4-фторфеніл. Інші бажані сполуки формули І включають ті, у яких R1 – С1-С2алкіл, заміщений за вибором 1-3-ма атомами фтору і, більш бажано, ті, у яких R1 - етил. Інші бажані сполуки формули І включають ті, у яких R2 - група формули (1а), де штрихові лінії позначають простий зв'язок. Інші бажані сполуки формули І включають ті, у яких R2 - група формули (1а), де штрихові лінії позначають простий зв'язок, a R3 - ціаногрупа. Інші бажані сполуки формули І включають ті, у яких R2 - група формули (1а), де штрихові лінії позначають простий зв'язок, m=0, a R 5 - водень. Інші бажані сполуки формули І включають ті, у яких R2 - група формули (1а), де штрихові лінії позначають простий зв'язок, R4 - карбоксил, -СН2ОН або -CH 2C(O)NH2. Бажані сполуки формул X, XIV та XIX включають ті, у яких R1 - етил. Інші бажані сполуки формул X та XIX включають ті, у яких R - циклогексил, циклопропіл, метиленциклопропіл, ізопропіл, феніл або 4-фторфеніл. Особливо бажані сполуки включають: 1-(1-циклопентил-3-етил-1Н-індазол-6-іл)-4-оксоциклогексанкарбонітрил, Метиловий естер гранс-4-ціан-4-(1-циклопентил-3-етил-1Н-індазол-6-іл)-циклогексанкарбонової кислоти, Метиловий естер цис-4-ціан-4-(1-циклопентил-3-етил-1Н-індазол-6-іл)-циклогек-санкарбонової кислоти, 1-(1-циклогексил-3-етил-1Н-індазол-6-іл)-4-оксоциклогексанкарбонітрил, Метиловий естер цис-4-ціан-4-(1-циклогексил-3-етил-1Н-індазол-6-іл)-циклогек-санкарбонової кислоти, Метиловий естер гранс-4-ціан-4-(1-циклогексил-3-етил-1Н-індазол-6-іл)-циклогексанкарбонової кислоти, Цис-4-ціан-4-(1-циклогексил-3-етил-1Н-індазол-6-іл)-циклогексанкарбонова кислота, Гранс-4-ціан-4-(1 -циклогексил-3-етил-1Н-індазол-6-іл)-циклогексанкарбонова кислота, 1-(1-циклогексил-3-етил-1Н-індазол-6-іл )-цис-4-гідроксиметилциклогексанкарбо-нітрил, Амід цис-4-ціан-4-(1 -циклогексил-3-етил-1Н-індазол-6-іл )-циклогексанкарбонової кислоти, Амід гранс-4-ціан-4-(1-циклогексил-3-етил-1Н-індазол-6-іл)-циклогексанкарбонової кислоти, "Фармацевтично прийнятні солі", якщо не зумовлено інше, включають солі кислотних або основних груп, які можуть бути присутні у сполуках формули І. Такі солі включають, наприклад, натрійові, кальційові і калійові солі карбонокислотних гр уп і гідрохлоридні солі аміногруп. Іншими фармацевтично прийнятними солями аміногруп є гідробромід, сульфат, гідросульфат, фосфат, гідрофосфат, дигідрофосфат, ацетат, сукцинат, цитрат, тартрат, лактат, манделат, метансульфонат (мезилат) і р-толуолсульфонат (тозилат). Деякі сполуки формули І можуть мати асиметричні центри і тому існувати у різних енантіомерних формах. Винахід охоплює усі оптичні ізомери і стереоізомери сполук формули І, а також їх суміші. Стосовно формули І винахід охоплює використання рацемату, чистої енантомеричної форми, чистої діастереомеричної форми або їх суміші. Сполуки формули І можуть існувати як таутомери. Винахід включає також використання таких таутомерів і їх сумішей. Винахід, крім того, стосується фармацевтичної композиції, яка призначена для придушення ФДЕ типу IV або ФПН у ссавців і містить фармацевтично ефективну кількість сполук формули І або їх фармацевтично прийнятних солей з фармацевтично прийнятним носієм. Винахід також стосується способу придушення ФДЕ типу IV або ФПН уведенням пацієнту ефективної кількості сполуки формули І або її фармацевтично прийнятної солі. Винахід стосується, крім того, фармацевтичної композиції, призначеної для відвернення або лікування астми, запалення суглобів, ревматоїдного артриту, подагричного артриту, ревматоїдного спондиліту, остеоартриту та інши х артритних станів; сепсису, септичного шоку, ендотоксичного шоку, грам-негативного сепсису, токсичношокового синдрому, гострого респіраторного розладу, церебральної малярії, хронічного пульмонарного запалення, силікозу, пульмонарного саркоїдозу, хвороби резорбції кісток, реакцій відторгнення трансплантату та аллотрансплантату, інфекційних лихоманки і міалгії (викликаних, наприклад, бактеріальною, вірусною або грибковою інфекцією), таких, як грип, кахексію, викликану інфекцією або злоякісною пухлиною, кахексію, викликану СНІДом і пов'язаними з ним комплексами, утворення келоїдів, утворення рубцевої тканини, хвороби Крона, виразкового коліту, пірезу, множинного склерозу, diabetes mellitus типу 1, аутоімунного діабету, системної волчанки, бронхіту, хронічного утруднення дихання, псоріазу, хвороби Беше, алергічного пурпурового нефриту, хронічного гломерулонефриту, запалення кишечнику, лейкемії, алергічного риніту або дерматиту у ссавців, яка містить фармацевтично ефективну кількість сполуки формули І або її фармацевтично прийнятної солі з фармацевтично прийнятним носієм. Винахід стосується також способу відвернення або лікування перелічених хвороб і станів уведенням пацієнту фармацевтично ефективної кількості сполуки формули І або її фармацевтично прийнятної солі. Певні зміно- або ацетоподібні хімічні структури, що відповідають формулі І, можуть бути нестабільними. Такі структури можуть виникнути, коли два гетероатоми приєднуються 'до одного атома карбону. Наприклад, якщо R є С1-С2алкілом, заміщеним .гідроксилом, може статися, що гідроксил з'єднається з тим атомом вуглецю, який з'єднаний з атомом азоту, від якого простягається R. Зрозуміло, що винахід не стосується таких нестійких сполук. Далі наведено схеми 1-4 реакцій приготування сполук згідно з винаходом. Якщо не зумовлено інше, R та R1 відповідають визначеним вище. Схема 1 Схема 2 Схема 3 Схема 4 Фахівець може приготувати сполуки формули І, користуючись одним або більше способами синтеза згідно з схемами 1-4, а також прикладами, наведеними нижче. На стадії 1 схеми 1 карбонову кислоту формули II, яку можна придбати з комерційних джерел або виготовити відомими способами, нітрують стандартним способом (HNO3/H2SO4 , 0°С) і одержану нітропохідну (формула III) гідрують на стадії 2 схеми 1 стандартним, способом (H2-Pd/C під тиском) при температурі 20-25°С протягом 2-10 годин, одержуючи в результаті сполуку формули IV. На стадії 3 схеми 1 амінобензойну кислоту формули IV уводять у реакцію з основою, наприклад, карбонатом натрію, у воді, потім повільно підігрівають, досягаючи майже повного розчинення. Реакційну суміш охолоджують до приблизно 0°С і обробляють нітратом натрію у воді. Через приблизно 15хвил. реакційну суміш повільно переміщують у відповідну посудин у з дробленим льодом і сильною кислотою, наприклад, соляною. Реакційну суміш протягом 10-20хвил. перемішують і при кімнатній температурі додають до насиченого розчину f-бутилтіолу у апротонному розчиннику, наприклад, етанолі. Реакційну суміш закислюють до рН 4-5 доданням неорганічної основи, бажано, насиченого водного Nа2СО3, і перемішують при кімнатній температурі протягом 1-3год. Додання до реакційної суміші розсолу з подальшим фільтруванням дає сульфід формули V. На стадії 4 схеми 1 сульфід формули V перетворюють у відповідну індазолкарбонову кислоту формули VI уведенням сульфіду формули V у реакцію з сильною основою, бажано, t-бутоксидом натрію у диметилсульфоксиді (ДМСО) при кімнатній температурі. Після перемішування протягом 1-4год. реакційну суміш підкислюють сильною кислотою, наприклад, соляною або сірчаною, і екстрагують звичайними способами. На стадії 5 схеми 1 індазолкарбонову кислоту формули VI перетворюють у відпровідний естер формули VII звичайними способами, відомими фахівцям. На стадії 6 схеми 1 сполуку формули VIII одержують алкілуванням естеру формули VII звичайним способом (сильні основні алкілуючі агенти і, за бажанням, мідяний каталізатор, наприклад, СиВr2) у полярному апротонному розчиннику, наприклад, тетрагідрофурані (ТГФ), N-метилпіролідіноні або диметилформаміді (ДМФ) при температурі 25-200°С протягом приблизно 12год. На стадії 7 схеми 1 сполуку формули VIII перетворюють у відповідний спирт формули IX відомими способами відновлення естерів до спиртів. Відновлення бажано виконувати, використовуючи металогідридний відновник, наприклад, літійалюмогідрид у полярному апротонному розчиннику при температурі близько 0°С. На стадії 8 схеми 1 спирт формули IX окислюють до відповідного альдегіду формули X звичайними способами, відомими фахівцям, наприклад, використовуючи необхідну каталізуючу кількість перрутената тетрапропіламонію з надлишком N-метилморфолін-N^оксиду (J. Chem. Soc, Chem. Commun., 1625, 1987) у безводному розчиннику, бажано, метиленхлориді. Схема 2 відповідає іншому способу приготування альдегіду формули X. На стадії 1 схеми 2 сполуку формули IX нітрують стандартним способом (HNO3/H2SO4) і одержують сполуку формули XII. На стадії 2 схеми 2 нітропохідну формули XII відновлюють до відповідного аміну формули XIII звичайними способами, але бажано, використовуючи безводний хлорид олова у апротонному розчиннику, наприклад, етанолі. На стадії 3 схеми 2 амін формули XIII перетворюють у відповідний індазол формули XIV за допомогою відповідних діазонфторфоратів (A. Roe, Organic Reactions, vol.5, Wiley, New York, 1949, pp.198-226) з подальшим фазопереносним циклюванням (R.A.Bartsch and I.W.Yang, J.Het. Chem., 21, 1063, 1984). На стадії 4 схеми 2 стандартними способами (тобто сильна основа, полярний апротонний розчинник і алкілгалогенід) виконують алкілювання сполуки формули XIV і одержуть N-алкіловану сполуку формули XV. На стадії 5 схеми 2 сполуку формули XV піддають метал-галогеновому обміну, використовуючи алкілований літій, наприклад, nбутилований літій у полярному апротонному розчиннику, наприклад, ТГФ, при температурі від -50 до -100°С (бажано -78°С) з подальшим гашенням диметилформамідом при низькій температурі з подальшим підігріванням до кімнатної, і одержують альдегідну сполуку формули X. Схема 3 ілюструє приготування сполуки формули XXII, тобто сполуки формули І, у якій R2 - кільцева група формули (1а). На стадії 1 схеми альдегідну груп у формули X перетворюють у відповідну здатну до відщеплення групу, наприклад, галоген або мезилат, або іншу відому фа хівцям, після чого одержану сполуку уводять у реакцію з ціанатом натрію у полярному розчині, наприклад, ДМФ, і одержують сполуку формули XVI. На стадії 2 схеми 3 сполуку формули XVI уводять у реакцію з метилакрилатом (або відповідним похідним, що залежить від доданої групи R2) у основному середовищі у апротонному розчиннику, наприклад, етиленглікольдиметиловому естері, при високій температурі, бажано, під зворотним холодильником, одержуючи у результаті .сполуку формули XVII. На стадії 3 схеми 3 сполуку формули XVII перетворюють у сполуку формули XVIII за допомогою сильної основи, наприклад, гідриду натрію, і поляного апротонного розчинника, наприклад, ДМФ або ТГФ при підвищеній температурі, бажано, під зворотним холодильником. На стадії 4 схеми 3 сполуку формули XVIII декарбоксилують відомими способами, наприклад, хлоридом натрію у ДМСО при температурі приблизно 140°С, і одержують сполуку формули XIX. На стадії 5 схеми 3 з сполуки формули XIX реакцією з 2-літій-1,3-дитіаном одержують похідне - дитіан-2-ілідинциклогексанкарбонітрил формули XX. На стадії 6 схеми 3 сполуку формули XX перетворюють у відповідний естер формули XXI, використовуючи хлорид ртуті (II) і перхлоратну кислоту у полярному протонному розчиннику, наприклад, метанолі. На стадії 7 схеми 3 сполуку формули XXI гідролізом перетворюють у відповідну карбонову кислоту формули XXII, використовуючи стандартні способи, наприклад, водний гідроксид натрію у полярному розчині (див. T.Green and P.G.M.Wets, Protecting Groups in Organic Synthesis, 2-nd Edition, John Wiley and Sons, New York, 1991). Стадії синтезу схеми 3 схожі з методами синтезу відповідних катехінових сполук, описаних у міжнародних публікаціях WO 93/19751 та WO 93/17949. Інші сполуки формули І, де R2 обрано з груп (1а), (1б), (1в), (1г), можна одержати з однієї або більше проміжних сполук згідно з схемами І-III. Зокрема, для приготування різних сполук формули І можна використати альдегід формули X або кетонну сполуку формули XIX. Будь-яку групу R2 формул (1а), (1б), (1в), (1г) можна увести у одн у або більше проміжних сполук, згаданих вище, використовуючи способи синтезу, що використовуються для неіндазольних аналогів і описані у публікаціях WO 93/19748, WO 93/19749, WO 93/09751, WO 93/19720, WO 93/19750, WO 95/03794, WO 92/09623, WO 95/09624, WO 95/09627, WO 095/09836 і WO 95/09837. Наприклад, на стадії 1 схеми 4 карбонову кислоту формули XXII перетворюють у спирт формули XXIII відновленням різними гідридами металів у полярному розчині, як це описано у прикладі 9 (див. нижче), згідно з методами синтезу відповідних неіндазольних аналогів, описаних у WO 93/19747, WO 93/19749 та WO 95/09836. На стадії 2 схеми 4 карбонову кислоту формули XXII перетворюють у відповідний карбоксамід формули XXIV перетворенням спочатку у проміжний кислий хлорид звичайними способами синтезу, а потім уведенням кислого хлориду у реакцію з аміаком у апротонному розчиннику. Інші карбоксамідні аналоги формули XXIV можна приготувати, застосовуючи реакцію проміжного кислого хлорида з різними первинними або вторинними амідами згідно з відомими способами, описаними у згаданих ви ще п ублікаціях. Сполуки формули І можна також приготувати з проміжної сполуки формули XIX методами синтезу для відповідних неіндазольних аналогів, описаними у публікаціях, згаданих ви ще. Сполуки формули І, у яких R2 група формули (1а), a R3 або R4 є Н, можна одержати реакцією кетонної проміжної сполуки формули XIX з основою, наприклад, діізопропіламіном літію у полярному апротонному розчиннику, наприклад, ТГФ, з надлишковою кількістю N-фенілтрифторметилсульфонаміду, як це описано у WO 93/19749 для відповідних неіндазольних аналогів. Сполуки формули І, у яких R2 -гр упа формули (1а), R4 - водень, a R5 - -СО2СН3 або – СО2Н, можна одержати реакцією кетонної проміжної сполуки формули XIX з трифліковим ангідридом у присутності третичної амінової основи, і подальшою реакцією одержаного трифлату з (трифенілфосфін)паладієм і моноксидом вуглеця у присутності спирту або аміну, що дає сполуку з метиловим естером формули І, де R5 - -СО2СН3. Цю сполуку можна гідролізувати стандартним способом, наприклад, гідроксидом калію у водному метанол/тетрагідрофурані і одержати у результаті відповідну сполуку карбонової кислоти. Такі способи синтезу описано у WO 93/19749 для відповідних неіндазольних аналогів. Сполуки формули І можна також приготувати з проміжної сполуки формули XIX методами синтезу для відповідних неіндазольних аналогів, описаними у публікаціях, згаданих ви ще. Сполуки формули І, у яких R2 група формули (1а), R5 - водень, a R4 - гідроксил, можна одержати реакцією проміжної сполуки формули XIX з відповідним відновником, наприклад, боргідридом літію, діамілбораном, літійалюмотрис(1-бутоксидом) або боргідридом натрію у відповідному нереагуючому розчиннику, наприклад, 1,2-диметоксіетані, ТГФ або спирті. Сполуки формули І, у яких R2 - група формули (1а), R5 - водень, a R4 - -NH2, -NHCH3 або –N(СН3)2, можна одержати реакцією проміжної сполуки формули XIX з сіллю амонію, наприклад, форматом амонію, гідрохлоридом метиламіну або гідрохлоридом диметиламіну, у присутності ціанборгідриду натрію у відповідному розчиннику, наприклад, спирті. Сполуки формули І, у яких R2 - група формули (1а), R4 - амін, a R5 - водень, можна одержати реакцією відповідного спирту формули І (R4 - ОН, R5 - Η) з комплексом азадикарбоксилатного естеру у присутності іміду або фталіміду, і подальшою реакцією у спиртовому розчиннику, наприклад, етанолі. Сполуки формули І, у яких R2 - група формули (1а), R4 - SR14, a R5 - водень, можна одержати реакцією відповідної сполуки, у якій R4 - здатна до відщеплення група, наприклад, мезилат, тозилат, бром або хлор, з металевою сіллю меркаптану, наприклад, NaSR14 У відповідному апротонному розчиннику. Відповідні сполуки формули І, у яких R4 - -SH, можна приготувати реакцією відповідного спирту (R4=OH) з фосфіновим комплексом, наприклад, трифенілфосфіном, і азидкарбоксилатним естером у присутності тіолацетової кислоти з подальшим гідролізом одержаного тіолацетату. Сполуки цієї структури, у яких R4 - гідроксил, можуть бути взаємоперетворені за допомогою добре відомої процедури спиртової інверсії. Згадані вище сполуки формули І, у яких R2 - гр упа формули (1а), R5 - водень, a R4 - гідроксил, SH або -NH2, можна перетворити у інші сполуки формули І, використовуючи один або більше методів синтезу, описаних у WO 93/19751 та WO 93/19749 для відповідних неіндазольних аналогів. Сполуки формули І, у яких R2 - гр упа формули (1а), а штрихова лінія позначає подвійний зв'язок, можна одержати з проміжної сполуки формули XIX за допомогою одного або більше методів синтезу, описаних у WO 93/19720 для відповідних неіндазольних аналогів. Сполуки формули І, у яких R2 - група формули (1а), a R5 і R4 разом утворюють =0 або =R8 (група R8 відповідає визначеній раніше) можуть бути одержані з кетонної проміжної сполуки формули XIX за допомогою одного або більше методів синтезу, описаних у WO 93/19750 для відповідних неіндазольних аналогів. Сполуки формули І, у яких R2 - група формули (16) можна приготувати з однієї або більше проміжних сполук, згаданих вище, наприклад, броміндазольної проміжної сполуки формули XV, використовуючи один або більше методів синтезу, описаних у WO 95/09627, WO 95/09624, WO 95/09623, WO 95/09836, WO 95/03794 для відповідних неіндазольних аналогів. Сполуки формули І, у яких R2 - гр упа формули (1в) можна приготувати з проміжної сполуки, використовуючи один або більше методів синтезу, описаних у WO 95/09624 та WO 95/09837 для відповідних неіндазольних аналогів. Сполуки формули І, у яких R2 - гр упа формули (1г) можна приготувати з броміндазольної проміжної сполуки формули XV, використовуючи один або більше методів синтезу, описаних у WO 95/09627, WO 95/09623 та WO 95/09624 для відповідних неіндазольних аналогів. Фармацевтично прийнятні солі приєднання кислоти сполук згідно з винаходом включають (не обмежуючись), солі, утворені з НСІ, НВr, НNО3, H2SO4 , H3PO 4, CH3SO 3H, p-CH3C6H4SO3H, СН3СО2Н, глюконовою, винною, малеїновою і янтарною кислотами. Фармацевтично прийнятні катіонні солі сполук формули І, у яких, наприклад, R3 - CO3R9, a R9 - водень, включають (не обмежуючись), солі натрію, калію, кальцію, магнію, амонію, Ν,Ν'-дибензилетилендіамін, N-метилглюкамін (меглюмін), етаноламін, трометамін і діетаноламін. Профілактика або лікування запалювальних хвороб дорослої людини вагою 70кг у випадку орального уведення передбачають щоденні дози від 0,1 до 1000мг активної сполуки або її фармацевтично прийнятної солі з відповідним носієм. Типові одиничні дози для внутрішньовенного уведення складають від 0, 1 до 10мг. Для назального або інгаляційного уведення доза являє собою 0,1 - 1%-ий розчин. У практиці лікар визначає для пацієнта найбільш прийнятну дозу, беручи до уваги його вік, вагу і реакцію. Наведені дози відповідають середнім випадкам, і, зрозуміло, можуть траплятись індивідуальні випадки, коли дози мають бути збільшені або зменшені, що передбачено винаходом. Для придушення ФПН у людини можуть використовуватись різні способи уведення: орально, парентерально, локально і ректально (супозиторіями). Взагалі активну сполуку уводять орально або парентерально дозами приблизно від 0,1 до 25 мг/кг ваги тіла щоденно, бажано дозами приблизно від 0,3 до 5мг/кг. Можливі, однак, деякі варіювання доз залежно від стану пацієнта. У будь-якому разі належну дозу визначає особа, відповідальна за уведення. Для людини активні сполуки можуть уводитись окремо, але частіше її уводять у суміші з фармацевтичним розріджувачем або носієм залежно від способу уведення і згідно з прийнятою фармацевтичною практикою. Наприклад, вони можуть уводитись орально у вигляді таблеток з такими наповнювачами, як крохмаль або лактоза, або капсул окремо або у суміші з наповнювачами, або у вигляді еліксирів або суспензій, що містять забарвлювачі або модифікатори смаку. Вони можуть уводитись ін'єкціями парентерально, наприклад, внутрішньовенно, внутрішньом'язово або підшкірно. Для парентерального уведення активні сполуки краще використовува ти у вигляді стерильних водних розчинів, які можуть містити інші речовини, наприклад, солі або глюкозу у кількості, достатній для того, щоб розчин був ізотонічним. Крім того, для лікування запалювальних станів шкіри активні сполуки можна уводити локально у вигляді кремів, желе, паст і мазей згідно з фармацевтичною практикою. Активні сполуки можна уводити не тільки людині, але й іншим ссавцям. Дозування визначається видом тварини і хворобою, що підлягає лікуванню. їх можна уводити тваринам у вигляді капсул, болюсів, таблеток або рідкої композиції, а також ін'єкціями або імплантацією. Відповідні склади виготовляють звичайними способами згідно з прийнятою ветеринарною практикою. Активну сполуку можна також домішувати у корм для тварини, і для цього можна заздалегідь приготувати концентровану харчову добавку або суміш. Далі на прикладі ілюстровано здатність сполук формули І або їх фармацевтично прийнятних солей придушувати ФДЕ IV. 30-40г легеневої тканини людини було поміщено у 50мл трис/фенілметилсульфонілфторидного (ФМСФ) буфера з рН 7,4 і гомогенізовано за допомогою Tekmar Tissumizer® (Tekmar Co., 7143 Kemper Road, Cincinnati, Ohio 45249) при повній швидкості протягом 30с. Гомогенат центрифугували при 48000 x g протягом 7 хвил. при 4°С. Супернатант фільтрували двічі через фільтр 0,22мкм і увели у колонку Mono-Q FPLC (Pharmacia LKB Biotechnology, 800 Centennial Avenue, Piscataway, New Jersey 08854), заздалегідь збалансовану буфером трис/ФМСФ з рН 7,4. Розчин надходив у колонку з швидкістю 1мл/хвил., подальші промивання і елюювання здійснювались з швидкістю 2мл/хвил. Пробу елюювали, використовуючи у буфері трис/ФМСФ з рН 7,4 ступінчасто зростаючий градієнт NaCI. Було зібрано 8мл фракцій. Специфічну активність щодо ФДЕIV визначали гідролізом [3Н]циклічного аденазинмонофосфату (АМФ) і випробували здатність відомого інгібітора ФДЕIV (наприклад, роліпрама) придушувати цей гідроліз. Відповідні фракції було об'єднано, розріджено етиленгліколем (2мл етиленгліколя/5мл ензимного препарату), після чого перед використанням вони зберігались при температурі -20°С. Сполуки розчиняли у ДМСО з концентрацією 10мМ і розбавляли у пропорції 1:25 у воді (400мкМ сполуки, 4% ДМСО). Для досягнення потрібної концентрації було проведено кілька розбавлень. Кінцева концентрація ДМСО складала 1%. У кожну з двох скляних пробирок 12x75мм було додано у наведеній послідовності: і) 25мкл сполуки або ДМСО (конц. 1%) іі) 25мкл трис-буфера з рН 7,5 ііі) циклічний [3Н]АМФ (1мкМ) iv) 25мкл ензима ФДЕіу (для контрольної суміші ензим попередньо інкубували у киплячій воді протягом 5хвил.) Після струшування пробирки було поміщено у водн у ванну (37°С) на 20хвил., після чого реакцію зупиняли, перемістивши пробирки у киплячу воду на 4хвил. У льодяній ванні у кожну пробірку додали промиваючий буфер (0,5мл, 0,1Μ 4-(2-гідроксіетил)-1-піперазинетансульфонова кислота/0,1Μ пасі, рН 8,5. Вміст кожної з пробирок увели у колонки AFF-Gel 601 (Biorad Laboratories, P.O.Box 1229, 85A Markus Drive, Melvile, New York 11747) (гель з спорідненістю до боронату, об'єм шар у 1мл). Циклічний [3Н]АМФ був промитий 2x6мл промиваючого буфера, а [3Н]5'АМФ елюйoвано 4мл 0.25М оцтової кислоти. Після кругового перемішування 1мл елюата додали до 3мл сцинтиляційної рідини у відповідній судині, після чого були підраховані [3Н]. підрахунок (ттестов сполука) хх підрахунок (ччиста придушення (%) = підрахунок (кконтрольий) хх підрахунок (ччиста IC50 визначається як концентрація сполуки, яка придушує на 50% гідролізне перетворення [3Н]сАМР у [3Н]5'АМР. Здатність сполук формули І або їх фармацевтично прийнятних солей придушувати утворення ФПН і, таким чином, виявляти лікувальну ефективність, було показано на випробуваннях in vitro, описаних нижче. 100мл периферійної крові людини зібрали у етилендіамінтетраоцтову кислоту. Моноядерні клітини ізолювали за допомогою FICOLL/Hypaque і тричі промили неповним HBSS. Клітини були повторно суспендовані з кінцевою концентрацією 106клітин/мл у підігрітому RPMI (що містив 5% FCS). Клітини були інкубовані при 37°С у 5%-му діоксиді вуглеця і осаджені на пластинах протягом 2год., після чого залишки клітин були обережно змиті. Потім до клітин у 3-4 концентраціях було додано 10мл сполуки, що випробувалась, з подальшим інкубуванням протягом 1год. У відповідні чарунки було додано 10мкл лауринпиридінхлориду. Пластини були інкубовані протягом 18год. при 37°С. Після цього ФПН аналізували багатошаровим ELISA (R&D Quantikine Kit). IC50 визначалось для кожної сполуки лінійним регресивним аналізом. Винахід ілюструється подальшими прикладами, у яких ДМСО диметисульфоксид, ДМАП - 4диметиламінпіридін. Приклад 1 А. 3-нітро-4-пропілбензойна кислота 9,44г (57,5ммоль, 1,0еквів.) 4-пропілбензойної кислоти частково розчиняють у 50мл концентрованої H2SO4 і охолоджують у льодяній ванні. Протягом 1-2хвил. краплями додають розчин 4,7мл (74,7ммоль, 1,3еквів.) концентрованої Н2SО3 у 10мл-концентрованої H2SO4. Після 1-годинного перемішування при 0°С реакційну суміш вливають у 1-літровий хімічний стакан, наполовину заповнений льодом. Після 10-хвилинного перемішування білу тверду речовину, що утворилась, відфільтровують, промивають 1л води і висушують, одержуючи 12,01г (100%) бажаної речовини: темп, плавл. 106-109°С; ІЧ (КВr) 3200-3400, 2966, 2875, 2667, 2554, 1706, 1618, 1537, 1299, 921 см -1; 1Н ЯМР (300МГц, ДМСО-d6) δ 0,90(t, 3Н, J=7,4Гц), 1,59(m, 2H), 2,82(m, 2Н), 7,63(d,-1H, J=8,0Гц), 8,12(dd., 1H, J=1,7, 8,0Гц), 8,33(d, 1H, J=1,7Гц); 13С ЯМР (75,5 МГц, ДМСО-d6) δ 14,2, 23,7, 34,2, 125,4, 130,5, 132,9, 133,6, 141,4, 149,5, 165,9. Розрахункові дані для C10H11NO4 ·1/4H2O: С, 56,20; Η, 5,42; Ν, 6,55. Одержано: С, 56,12; Η, 5,31; Ν, 6,81. Б. 3-амін-4-пропілбензойна кислота Суміш 11,96г (57,2ммоль) 3-нітро-4-пропілбензойної кислоти і 1,5г 10%-го Pd/C 50%-ої вологості у 250мл СН3ОН поміщують у гідрогенізаційнии апарат Парра і при температурі струшують у Н 2 під тиском 25фунтів/кв. дюйм (172кПа). Через 1год. реакційну суміш фільтрують через броунмілерит, фільтрат концентрують і висушують, одержуючи 9,80г (96%) бажаної речовини у вигляді блідожовтої твердої речовини: темп, плавл. 139,5-142,5°С; IЧ (КВr) 3200-2400, 3369, 3298, 2969, 2874, 2588, 1690, 1426, 916, 864 см -1; 1Н ЯМР (300МГц, ДМСО-d6) δ 0,90(t, 3Н, J=7,2Гц), 1,52(m, 2Н), 2,42(171, 2Н), 5,08 (br s, 2H), 6,96(d, 1H, J=7,8Гц), 7,05(dd., 1H, J=1,7, 7,8Гц), 7,20(d, 1Н, J=1,7Гц); МС (СІ, NH3) м/з 180 (М+Н+, основа). Розрахункові дані для C10H13NO 2·1/3H2O: С, 64,85; Η, 7,89; Ν, 7,56. Одержано: С, 64,69; Η, 7,49; Ν, 7,86. В. 3-карбокси-6-пропілбензолдіазо-t-бутилсульфід Суміш 8,80г (49,1ммоль, 1еквів.) 3-амін-4-пропілбензойної кислоти і 2,34г (22,1ммоль, 0,45еквів.) карбоната натрію у 55мл води повільно підігрівають гарячим струмком до майже повного розчинення. Реакційну суміш охолоджують у льодяній ванні і краплями додають розчин 3,73г (54,0ммоль, 1,0еквів.) нітриту натрію у 27мл води. Через 15хвил. реакційну суміш переміщують у крапельну воронку і протягом 10хвил. переливають у хімічний стакан з 55г дробленого льоду і 10,6мл концентрованої НСІ. Після 10-хвилинного перемішування вміст стакану переносять у крапельну воронку і протягом 5хвил. додають до розчину 5,31мл (47,1ммоль, 0,96еквів.) f-бутилтіоля у 130мл етанолу, що має кімнатну температуру. Доданням насиченого водного Na2СО3 рН доводять до 4-5 і залишають реакційну суміш перемішуватись протягом 1год. при кімнатній температурі. Додають 200мл розсолу і фільтрують суміш. Тверду речовину промивають водою і висушують протягом доби, одержуючи 12,25г (89%) смердючого порошку коричнево-іржавого кольору, темп, плавл. 102°С; ІЧ (КВr) 3200-2400, 2962, 2872, 2550, 1678, 1484, 1298, 1171 см -1; 1Н ЯМР (300МГц, ДМСО-d 6) δ 0,84(t, 3Н, J=7,3Гц), 1,48(m, 2Н), 1,55 (s, 9Н), 2,42(m, 2H), 7,29(d, 1H, J=1,6Гц), 7,50(d, 1H, J=8,0Гц), 7,86(dd., 1H, J=1,7, 7,9Гц), 5,08 (br s, 2H); MC (термострумінь, NH4OAc) м/з 180 (M+H +, основа). Розрахункові дані для C14H20N2 O2S: С, 59,96; Н, 7,19; N, 9,99. Одержано: С, 59,71; Н, 7,32; N, 10,02. Г. 3-етил-1Н-індазол-6-карбонова кислота Розчин 12,0г (42,8ммоль, 1,0еквів.) 3-карбокси-6-пропілбензолдіазо-t-бутилсульфіду у 150мл ДМСО протягом 15хвил. краплями додають до розчину 44,6г (398ммоль, 9,3еквів.) f-бутоксида калію у 200мл ДМСО, що має кімнатну температур у. Після 2-годинного перемішування при кімнатній температурі реакційну суміш вливають у 1,5л 1N НСІ, перемішують протягом 5хвил. і екстрагують етилацетатом (2x350мл). Екстракти (обережно-сморід) змішують, промивають водою (2x250мл), висушують над MgSO4 , фільтрують, концентрують і висушують фільтрат, одержуючи світло-коричневу тверду речовину, яку розтирають з 1л Ет2О/гексану (1:3), висушують і одержують 7,8г (87%) світло-коричневого кристалічного порошку: темп, плавл. 248-251°С; ІЧ (КВr) 3301, 3300-2400, 2973, 2504, 1702, 1455, 1401, 1219 см"1; 1Н ЯМР (300МГц, ДMCO-d6) δ 1,31(t, 3Н, J=7,6Гц), 2,94(q, 2H, J=7,6Гц), 7,63(dd., 1H, J=1,1, 8,4Гц), 7,81 (d, 1H, J=8,4Гц); 8,06(d, 1H, J=1,1Гц), 12,95 (br s, 1H); MC (Cl, NH3) м/з 191 (M+H +, основа). Розрахункові дані для C10H10N2O 2: С, 63,14; Η, 5,30; Ν, 14,73. Одержано: С, 62,66; Η, 5,42; Ν, 14,80. Д. Метиловий естер 3-етил-1Н-індазол-6-карбонової кислоти 8,78г (45,8ммоль, 1,1еквів.) 1-(3-диметиламінпропіл)-3-етилкарбодіімідгідрохлориду однією порцією додають до розчину 7,92г (41,6ммоль, 1,0еквів.) 3-етил-1Н-індазол-6-карбонавої кислоти, 16,9мл (416ммоль, 10еквів.) метанолу і 5,59г (45,8ммоль, 1,1еквів,) ДМАП у 250мл СН 2СІ2. Після витримування протягом 18год. при кімнатній температурі реакційну суміш концентрують до 150мл, розбавляють 500мл етилацетату, промивають 1Ν НСІ (2х100мл), водою (1х100мл) і розсолом (1х100мл) і висушують над Na 2SО4. Фільтрування, концентрування фільтрату і сушіння дають 7,8г коричневої твердої речовини, яку очищують на силікагелевій колонці (з градієнтом від 30 до 50% етилацетату/гексан), одержуючи 6,41г (75%) світлокоричневої твердої речовини: темп, плавл. 107-108°С; ІЧ (КВr) 3100-2950, 1723, 1222 см-1; 1Н ЯМР (300МГц, CDCI3) δ 8,19(m, 1H), 7,7-7,8(m, 2H), 3,96(5, 3H), 3,05(q, 2Н, J=7,7Гц), 1,43(t, 3Н, J=7,7Гц); МС (СІ, NH3) м/з 205 (М+Н+, основа). Розрахункові дані для C11H12N2O 2: С, 64,70; Н, 5,92; N, 13,72. Одержано: С, 64,88; Н, 6,01; N, 13,96. Е. Метиловий естер 1-циклопентил-3-етил-1Н-індазол-6-карбонової кислоти 60%-ну дисперсію 1,17г (29,4ммоль, 1,05еквів.) гідриду натрію у маслі однією порцією додають до розчину (кімнатної температури) 5,7г (27,9ммоль, 1,0еквів.) метилового естеру 3-етил-1Н-індазол-6-карбонової кислоти у 125мл безводного ДМФ. Через 20хвил. краплями додають 3,89г (36,6ммоль, 1,3еквів.) циклопентилброміду і реакційну суміш залишають перемішуватись протягом доби при кімнатній температурі. Суміш вливають у 1л води і екстрагують етилацетатом (3x450мл). Органічні екстракти об'єднують, промивають водою (3x400мл) і розсолом (200мл) і висушують над Nа2SО4. Фільтрування, концентрування фільтрату і сушіння дають янтарне масло, яке очищують на силікагелевій колонці (10% етилацетату/гексан, дія ваги), одержуючи 5,48г (72%) чистого масла: 1Н ЯМР (300МГц, CDCI3) δ 8,16(d, 1H, J=1,0Гц), 7,7(m, 2H), 5,0(quintet, 1H, J=7,5Гц), 3,97(s, 3Н), 3,01(q, 2H, J=7,6Гц), 2,2(m, 4H), 2,0(m, 2H), 1,8(m, 2H), 1,39(t, 3Н, J=7,6Гц); Розрахункові дані Η ЯМР для C16H20N2 O2: 272,1526. Одержано: 272,15078. Є. (1-циклопентил-3-етил-1Н-індазол-6-іл)метанол 1,0М розчин 7мл (7,0ммоль, 1,0еквів.) літійалюмогідриду у ТГФ додають до розчину (з температурою 0°С) 1,02г (7,05ммоль, 1,0еквів.) метилового естеру 1-циклопентил-3-етил-1Н-індазол-6-карбонової кислоти у 125мл безводного ДМФ. Через 20хвил. обережно додають 1мл метанолу, реакційну суміш вливають у 500мл 5%-ої H2SO4 і екстрагують етилацетатом (3x50мл). Органічні екстракти об'єднують, промивають водою (4x40мл) і розсолом (40 мл) і висушують над Nа2SО4. Фільтр ування, концентрування фільтрату і сушіння дають 1,58г чистого масла, яке очищують на силікагелевій колонці, одержуючи 1,53г (89%) чистого масла: ІЧ (СНСІ3) 3606, 3411, 3009, 2972, 2875, 1621, 1490 см -1;1Н ЯМР (300МГц, CDCI3) δ 7,65(d, 1H, J=8,0Гц), 7,42(s, 1H), 7,06(dd, 1H, J=1,0, 8,2Гц), 4,92(quintet, 1H, J=7,7Гц), 4,84(s, 2H), 2,98(q, 2H, J=7,6Гц), 2,2(m, 4H), 2,0(m, 2H), 1,7(m, 3H), 1,38(t, 3H, J=7,6Гц); MC (термострумінь, NH4OAc) м/з 245 (M+H +, основа). Розрахункові дані Н ЯМР для C15Η 20Ν2O+Η: 245,1654. Одержано: 245,1675. Ж. 1-циклопентил-3-етил-1Н-індазол-6-карбальдегід 106мг (0,301ммоль, 0,05еквів.) перрутенату тетрапропіламонію (VII) додають до суспензії (що має кімнатну температуру) 1,47г (6,02ммоль, 1,0еквів) (1-циклопентил-3-етил-1Н-індазол-6-іл)метанолу, 1,06г (9,03ммоль, 1,5еквів.) Ν-етилморфолін-N-оксиду і 3,01г молекулярних сит (4А) у 12мл безводногоCH2CL2. Через 30хвил. реакційну суміш фільтрують через коротку силікагелеву колонку (елюент - CH2CL2). Фракції, що містять продукт, концентрують, залишок флеш-хроматографують на силікагелевій колонці (15% етилацетату/гексани) і одержують 924мг (63%) блідо-жовтої твердої речовини: темп, плавл. 41 °С; ІЧ (КВr) 3053, 2966, 2872, 2819, 1695 см -1; 1Н ЯМР (300МГц, CDCI3) δ 10,13(s, 1H), 7,93(d, 1H, J=0,9Гц); 7,77(d, 1H, J=8,4Гц), 7,60(dd., 1H, J=1,2, 8,4Гц), 5,00(quintet, 1H, J=7,5Гц), 3,01 (q, 2H, J=7,6Гц), 2,2(m, 4H), 2,0(m, 2H), 1,7(m, 2H), 1,39(t, 3H, J=7,6Гц); MC (СІ, NH3) м/з 243 (M+H +, основа). Розрахункові дані для C15H18N2O: С, 74,35; Η, 7,49; Ν, 11,56. Одержано: С, 74,17; Η, 7,58; Ν, 11,79. Приклад 2 Α. 4-бром-2-нітро-1-пропілбензол 125г (628ммоль, 1,0еквів.) 1-бром-4-пропілбензолу однією порцією додають до розчину (з температурою 10°С) 600мл концентрованої H2SO4 і 200мл води. При енергійному механічному перемішуванні протягом 30хвил. краплями додають суміш 43,2мл (691ммоль, 1,1еквів.) концентрованої ΗΝΟ3 (69-71%, 16М) у 150мл концентрованої H2SO4 і 50мл води, що має кімнатну температуру. Льодяну ванну залишають досягти кімнатної температури, і при цій температурі реакційну суміш перемішують протягом 68год., після чого вливають у 4літровий хімічний стакан, вільно наповнений дробленим льодом. Після одногодинного перемішування реакційну суміш переливають у ділильну воронку і екстрагують ізопропиловим ефіром (4х800мл). Органічні екстракти об'єднують, промивають водою (3х800мл) і розсолом (500мл) і висушують над Na2SО4. Фільтрування, концентрування фільтрату і висушування дають 150мл жовтої рідини, яку очищують силікагелевою хроматографією (2 колонки, 3кг силікагелю у кожній, 2% етилацетату/гексани) і одержують 63,9г (42%) жовтої рідини. Бажаним є менш полярний з двох регіоізомерів, одержаних з співвідношенням 1:1. Темп, кипіння 108°С, 2мм; ІЧ (СНСІ3) 3031, 2966, 2966, 2935, 2875, 1531, 1352 см -1; 1Н Я МР (300МГц, CDCI3) δ 8,01(d, 1H, J=2,1Гц), 7,62(dd., 1H, J=2,1, 8,3Гц), 7,23(d, 1H, J=8,3Гц), 2,81(m, 2H), 1,67(m, 2H), 0,98(t, 3H, J=7,4Гц); 13C ЯМР (75,5МГц, CDCI3) δ 13,94, 23,74, 34,43, 119,6, 127,4, 133,3, 135,7, 136,4, 149,8; мас-спектрометрична газова хроматографія (МСГХ) з іонізацією електронами (ЕІ) м/з 245/243 (М+.), 147 (основа); Розрахункові дані Η ЯМР для Ο 9Η10ΝΟ 2ΒR+Η: 243,9973. Одержано: 243,9954. Б. 5-бром-2-пропілфеніламін 121г (639ммоль, 3,0еквів.) безводного хлориду олова однією порцією додають до розчину (кімнатної температури) 51,9г (213ммоль, 1,0еквів.) 4-бром-2-нітро-1-пропілбензолу у 1200мл абсолютного етанолу і 12мл (6еквів.) води. Після 24-годинного витримування при кімнатній температурі більшу частин у етанолу видаляють у роторному випарювачі. Залишок вливають у 4-літровий хічний стакан, на три чверті заповнений дробленим льодом і водою. З перемішуванням порціями додають гранули NaOH до досягнення рН 10 і розчинення більшої частини гідроксиду олова. Суміш ділять на дві половини, і кожну з них екстрагують етилацетатом (2x750мл). Усі чотири етилацетатні екстракти об'єднують, промивають 1Ν NaOH (500мл), водою (500мл) і розсолом (500мл) і висушують над Nа2SО4. Фільтрування, концентрування фільтрату і висушування дають жовту рідину, яку очи щують на силікагелевій колонці (1,2кг силікагелю, етилацетату/гексани - 1:12) і одержують 41,83г (92%) жовтої рідини; ІЧ (СНСІ3) 3490, 3404, 3008, 2962, 2933, 2873, 1620, 1491 см -1; 1Н ЯМР (300МГц, CDCI3) δ 6,8-6,9(m, 3Н), 3,90(br s, 2Н), 2,42(m, 2Н), 1,62(m, 2Н), 0,99(t, 3Н, J=7,3Гц); МСГХ з ΕΙ м/з 215/213 (М+.), 186/184 (основа); Розрахункові дані для C9H12NBr: С, 50,49; Η, 5,65; Ν, 6,54. Одержано: С, 50,77; Η, 5,70; Ν, 6,50. В.6-бром-3-етил-1Н-індазол 49,22г (230ммоль, 1,0еквів.) 5-бром-2-пропілфеніламіну у трьохлітровій колбі охолоджують у льодяній ванні. Додають розчин (з температурою 0°С) 57,5мл (690ммоль, 3,0еквів.) концентрованої НСІ у 165мл води, і тверду речовину, що утворилась, перемелюють до утворення тонкої білої суспензії. Додають ще 100мл води, потім протягом 10хвил. краплями додають розчин 15,9г (230ммоль, 1,0еквів.) нітриту натрію у 75мл води. Видаляють льодяну ванну і залишають реакційну суміш перемішуватись на 30хвил., після чого фільтрують через агломеровану воронку, о холоджену до 0°С, фільтрат охолоджують у льодяній ванні і протягом 10хвил. при механічному перемішуванні краплями додають розчин/суспензію (що має температур у 0°С) 32,8г (313ммоль, 1,36еквів.) тетрафторборату амонію у 110мл води. Густу білу суспензію (тетрафторборат арилдіазонію), що утворилась, залишають перемішуватись протягом 1,5год. при 0°С. Суміш фільтрують, тверду речовину промивають 5%-им водним розчином NH4BF4 (200мл), охолодженим до 0°С, потім СН 3ОН, охолодженим до 0°С, і ЕТ2О (200мл). Висушування у вакуумі протягом 1год. при кімнатній температурі дає 54,47г (76%) солі діазонія у вигляді білої твердої речовини. 1500мл безетанольного хлороформу вливають у трьохлітровий хімічний стакан і додають 34,16г (348ммоль, 2,0еквів.) висушеного порошку ацетата натрію і 2,3г (8,7ммоль 0,05еквів.) 18-краун-6. Через 10хвил. однією порцією додають сіль діазонію і реакційну суміш залишають на 18 перемішуватись при кімнатній температурі у атмосфері азоту. С уміш фільтрують, тверду речовину двічі промивають СНСІ3, фільтрат концентрують і одержують 47г сирого продукту (коричневі кристали). Хроматографія на силікагелі (1,23кг силікагелю, 15, 20, 40% этилацетату/гексани) дає 21,6г (55% на другій стадії, 42% загального) світлокоричневих кристалів: темп. 33 плавл. 112-114°С; ІЧ (КВr) 3205, 3008, 2969, 2925, 1616, 1340, 1037 см-1; 1 Н ЯМР (300МГц, CDCI3) δ 9,86(br s, 1H), 7,61 (d, 1H, J=1,3Гц); 7,57(d, 1H, J=8,4Гц), 7,24(dd, 1H, J=1,5, 8,6Гц), 2,99(q, 2H, J=7,6Гц), 1,41(t, 3H, J=7,6Гц); MC (СІ, NH3) м/з 227/225 (M+H+, основа). Розрахункові дані для C9H9N2Br: С, 48,02; Η, 4,03; Ν, 12,45. Одержано: С, 48,08; Η, 3,87; Ν, 12,45. Г. 6-бром-1-циклопентил-3-етил-1Н-індазол 60%-ну диперсію 2,46г (61,4ммоль, 1,05еквів.) гідрида натрію у маслі порціями по 0,5г додають до розчину (що має температуру 10°С) 13,17г (58,5ммоль, 1,0еквів.) 6-бром-3-етил-1Н-індазолу у 500мл безводного формаміду. Суміш перемішують протягом 20хвил. при кімнатній температурі, потім краплями додають розчин 8,8мл (81,9ммоль, 1,4еквів.) циклопентилброміду у 10мл безводного ДМФ. Через 18год. реакційну суміш вливають у 2л води і екстрагують етилацетатом (2x1л). Органічні екстракти об'єднують, промивають водою (2x750мл) і розсолом (500мл) і висушують над Na2SO4. Фільтрування, концентрування фільтрату і висушування дають 20,7г сирого продукту, який очищують на силікагелевій колонці (1,1кг силікагелю, 3% етилацетату/гексани) і одержують 10,6г (62%) янтарної рідини: ІЧ (КВr) 2972, 2875, 1606, 1501, 1048 см -1; 1Н ЯМР (300МГц, CDCI3) δ 7,56(d, 1H, J=1,3Гц); 7,52(d, 1H, J=8,7Гц), 7,17(dd, 1H, J=1,5, 8,5Гц), 4,83(quintet, 1H, J=7,6Гц), 2,96(q, 2H, J=7,6Гц), 2,15(m, 4H), 2,0(m, 2H), 1,65(m, 2H), 1,36(t, 3Η, J=7,7Гц); МС (термострумінь, NH4ОАс) м/з 295/293 (М+Н+, основа). Розрахункові дані для C14H17N2Br: С, 57,35; Η, 5,84; Ν, 9,95. Одержано: С, 57,48; Η, 5,83; Ν, 9,90. Д. 1-циклопентил-3-етил-1Н-індазол-6-карбальдегід 11,6мл (28,4ммоль, 1,0еквів.) n-BuLi, 2,45Μ у гексанах додають до розчину (що має температуру -78°С) 8,32г (28,4ммоль, 1,0еквів.) 6-бром-1-циклопентил-3-етил-1Н-iндазолу у 200мл безводного ТГФ. Через 30хвил. при -78°С краплями додають 8,8мл (114ммоль, 4,0еквів.) ДМФ і реакційну суміш при цій температурі на 30хвил. залишають перемішуватись. Протягом 1год. реакційну суміш доводять до кімнатної температури і додають 125мл 1Ν НСІ. Після 10-хвилинного перемішування більшу частин у ТГФ видаляюють у роторному випарювачі. Залишок розбавляють водою (500мл) і екстрагують етилацетатом (2x250мл). Органічні екстракти об'єднують, промивають водою (100мл) і розсолом (100мл) і висушують над Nа2SО4. Фільтрування, концентрування фільтрату і висушування дають жовте масло, яке очищують на силікагелевій колонці (15% етилацетату/гексани, дія ваги) і одержують 4,7г (68%) жовтої кристалічної речовини: 1Н ЯМР (300МГц, CDCI3) див. приклад 8. Е. (1-циклопентил-3-етил-1Н-індазол-6-іл)-ацетонітрил 4,44мл (35,0мл, 1,5еквів.) триметилсилілхлориду краплями додають до суспензії (з кімнатною температурою) 5,65г (23,3ммоль, 1,0еквів.) 1-циклопентил-3-етил-1Н-індазол-6-карбальдегіду і 3,84г (44,3ммоль, 1,9еквів.) броміду літію у 115мл безводного ацетонітрилу. Через 15хвил. реакційну суміш охолоджують у льодяній ванні, краплями додають 6,84мл (38,7ммоль, 1,66еквів.) 1,1,3,3тетраметилдисолоксану і залишають на 2год. досягти кімнатної температури. Потім реакційну суміш протягом 6год. витримують під зворотним холодильником, охолоджують до кімнатної температури, розбавляють СН 2СІ2 (300мл) і фільтрують через Celite®. Фільтрат концентрують і висушують у вакуумі при кімнатній температурі, одержуючи 18,08г світлокоричневої маслянистої твердої речовини. Одержану речовину розчиняють у 200 мл безводного ДМФ, додають 259г (52,9ммоль, 2,27еквів.) ціаніду натрію, суміш перемішують при кімнатній температурі протягом 2год., потім вливають у 500мл води і екстрагують етилацетатом (3x200мл). Органічні екстракти об'єднують, промивають водою (3x200мл) і розсолом (200мл) і висушують над Na2SO4. Фільтрування, концентрування фільтрату і висушування дають коричневе масло, яке очищують на силікагелевій колонці (10, 20% етилацетату/гексани) і одержують 2,98г нечистого продукту і 2,05г ви хідного продукту. Одержаний вихідний продукт уводять у реакції, описані вище, використовуючи 50мл .1,1,3,3тетраметилдисилоксану, потім 50мл ДМФ і 940мг ціаніду натрію. Хроматографія на силікагелі дає 0,62г нечистого продукту, який об'єднують з попередніми 2,98г цього продукту, знову хроматографують (10% етилацетату/гексани) і одержують 3,27г (55%) жовтого масла: ІЧ (СНСІ3) 3062, 2972, 35 2874, 2255, 1623 см-1; 1 Н ЯМР (300МГц, CDCI3) δ 7,66(d, 1H, J=8, Гц); 7,39(s, 1H), 6,97(dd, 1H, J=1,1, 8,4Гц), 4,90(quintet, 1H, J=7,6Гц), 3,89(s, 2H), 2,98(q, 2H, J=7,6Гц), 2,2(m, 4Н), 2,0(m, 2Н), 1,7(m, 2Н), 1,37(t, 3Н, J=7,4Гц); МС (СІ, NH3) м/з 254 (М+Н+, основа). Розрахункові дані для C16H19N3: С, 75,86; Η, 7,56; Ν, 16,59. Одержано: С, 75,84; Η, 7,94; Ν, 16,60. Є. Диметиловий естер гептандіонової кислоти 530мкл (1,26ммоль, 0,1еквів.) 40%-го тритону В у метанолі додають до розчину (кімнатної температури) 3,19г (12,6ммоль, 1,0еквів.) (1-циклопентил-3-етил-1Н-індазол-6-іл)-ацетонітрилу у 100мл безводного ацетонітрилу. Реакційну суміш підігрівають під зворотним холодильником і краплями додають 11,3мл (126ммоль, 10,0еквів.) метилацетату. Через 15хвил. реакційну суміш охолоджують до кімнатної температури і концентрують у роторному випарювачі. Залишок розбавляють ефіром (300мл), промивають 1Ν НСІ (50мл) і розсолом (50мл) і висушують над Na2SO4. Фільтрування, концентрування фільтрату і висушування дають коричневе масло, яке очищують на силікагелевій колонці (20% етилацетату/гексани, флеш) і одержують 4,00г жовтого масла: ІЧ (СНСІ3) 3031, 2972, 2955, 2874, 2250, 1735 см -1; 1Н ЯМР (300МГц, CDCI3) δ 7,68(d, 1H, J=8,5Гц); 7,49(s, 1H), 6,97(d, 1H, J=8,4Гц), 4,93(quintet, 1H, J=7,6Гц), 3,58(s, 6H), 2,97(q, 2H, J=7,7Гц), 2,45(m, 6H), 2,2(m, 6H), 2,0(m, 2H), 1,8(m, 2H), 1,37(t, 3Н, J=7,4Гц); МС (СІ, NH3) м/з 426 (M+H +, основа). Розрахункові дані для C24H31N3O4 : С, 67,74; Н, 7,34; N, 9,88. Одержано: С, 67,76; Н, 7,40; N, 10,08. Ж. Метиловий естер (±)-5-ціан-5-(1-циклопентил-3-етил-1Н-індазол-6-іл)-2-оксоциклогексанкарбонової кислоти 60%-ну дисперсіію 924мг (23,1ммоль, 2,5еквів.) гідриду натрію у маслі однією порцією додають до розчину (кімнатної температури) 3,93г (9,24ммоль, 1,0еквів.) диметилового естеру 4-ціан-4-(1-циклопентил-3-етил-1Ніндазол-6-іл)-гептандіонової кислоти у 100мл безводного 1,2-диметоксіетану. Реакційну суміш підігрівають під зворотним холодильником протягом 1,5год. у атмосфері азоту і потім охолоджують до кімнатної температури. Через 18год. реакційну суміш гасять водою (50мл), вливають у 200мл етилацетату і промивають 1N НСІ (100мл). Водний шар екстрагують етилацетатом (50мл). Органічні екстракти об'єднують, промивають розсолом (50 мл) і висушують над МагБОф Фільтрування, концентрування фільтрату і висушування дають жовте масло, яке очищують на силікагелевій колонці (10% етилацетату/гексани) і одержують 2,78г (76%) білої аморфної твердої речовини: ІЧ (КВr) 2954, 2871, 2240, 1663, 1619 см -1; 1Н ЯМР (300МГц, CDCI3) δ 12,27(s, 1H), 7,70(d, 1H, J=8,5Гц); 7,57(s, 1H), 7,15(dd, 1H, J=1,6, 8,5Гц), 4,93(quintet, 1H, J=7,6Гц), 3,78(s, 3H), 3,05(m, 1H), 2,98(q, 2H, J=7,6Гц), 2,9(m, 1H), 2,75(m, 1H), 2,6(m, 1H), 2,35(m, 2H), 2,2(m, 4H), 2,0(m, 2H), 1,75(m, 2H), 1,38(t, 3H, J=7,6Гц); MC (СІ, NH3) м/з 394 (M+H +, основа). Розрахункові дані для C23H27N3O 3: С, 70,22; Н, 6,92; N, 10,68. Одержано: С, 70,07; Н, 7,01; N, 10,07. З. 1-(1-циклопентил-3-етил-1Н-індазол-6-іл)-4-оксоциклогексанкарбонітрил Суміш 2,72г (6,91ммоль, 1,0еквів.) метилового естеру (±)-5-ціан-5-(1-циклопентил-3-етил-1Н-індазол-6-іл)2-оксоциклогексанкарбонової кислоти і 2,58г (44,2ммоль, 6,4еквів.) хлориду натрію у 50мл диметилсульфоксиду і 4мл води підігрівають до 140°С у масляній ванні у атмосфері азоту. Через 3год. реакційну суміш охолоджують до кімнатної температури і залишають перемішуватись протягом 72год., після чого вливають у 250мл води і екстрагують етилацетатом (2х150мл). Органічні екстракти об'єднують, промиваюють водою (2х100мл) і розсолом (100мл) і висушують над Na 2SО4. Сирий продукт очищують на силікагелевій колонці (20% етилацетату/гексани) і одержують білу тверду кристалічну речовину: темп, плавл. 81-89°С; ІЧ (КВr) 2969, 2951, 2872, 2236, 1716 см -1; 1Н ЯМР (300МГц, CDCI3) δ 7,71(d, 1H, J=8,5Гц); 7,58(s, 1H), 7,16(dd, 1H, J=1,5, 8,5Гц), 4,93(quintet, 1H, J=7,6Гц), 3,0( m, 4H), 2,7(m, 4H), 2,45(m, 2H); MC (NH 4OAc) м/з 336 (M+H+, основа). Розрахункові дані для C21H25N3O: С, 75,20; Η, 7,51; Ν, 12,53. Одержано: С, 74,06; Η, 7,59; Ν, 12,41. Розрахункові дані Η ЯМР для C21H25N3O+Η: 336,20778. Одержано 336,2088. Приклад 3 А. 1-(1-циклопентил-3-етил-1Н-індазол-6-іл)-4-[1,31дитіан-2-ілідІнциклогексан-карбонітрил 3,94мл (9,84ммоль, 2,09еквів.) n-BuLi, 2,5М у гексанах краплями додають до розчину (температурою 0°С) 1,88мл (9,89ммоль, 2,1еквів.) 2-триметилсиліл-1,3-дитіану у 80мл безводного ТГФ. Після 25-хвилинного витримування при 0°С реакційну суміш охолоджують до -78°С і додають розчин 1,58г (4,71ммоль, 1,0еквів.) 1(1-циклопентил-3-етил-1Н-індазол-6-іл)-4-оксоциклогексанкарбонітрилу у 40мл безводного ТГФ. Після одногодинного витримування при -78°С реакційну суміш гасять доданням 50мл розсолу, підігрівають до кімнатної температури, розбавляють 100мл води, екстрагують СН 2СІ2 (100мл) і розсолом (50мл) і висушують над Na2SO4. Фільтрування, концентрування фільтрату і висушування дають прозоре масло, яке очищують на силікагелевій колонці (10% етилацетату/гексани) і одержують 1,51г (73%) білої аморфної твердої речовини: ІЧ (КВr) 2962, 2870, 2232, 1620, 1569, 1508, 1434, 1217 см -1; 1Н ЯМР (300МГц, CDCI3) δ 7,67(d, 1H, J=8,5Гц); 7,53(s, 1H), 7,15(dd, 1H, J=1,5, 8,6Гц), 4,92(quintet, 1H, J=7,6Гц), 3,36(m, 2H), 3,0(m, 6H), 2,42(m, 2H), 2,34(m, 2H), 2,2(m, 6H), 2,0(m, 4H), 1,8(m, 2H), 1,38(t, 3H, J=7,6Гц); MC (СІ, NH3) м/з 438 (M+H +, основа). Розрахункові дані для C25H31N3S2: С, 68,60; Н, 7,14; N, 9,60. Одержано: С, 68,26; Н, 7,29; N, 9,58. Б. Метиловий естер гранс-4-ціан-4-(1-циклопентил-3-етил-1Н-індазол-6-іл)-циклогексанкарбонової кислоти і цис-4-ціан-4-(1-циклопентил-3-етил-1Н-індазол-6-іл)-циклогексанкарбонової кислоти Суміш 1,45г (3,31ммоль, 1,0еквів) 1-(1-циклопентил-3-етил-1Н-індазол-6-іл)-4-[1,3]дитіан-2ілідинциклогексанкарбонітрилу, 3,59г (13,2ммоль, 4,0еквів.) хлориду ртуті (II) і 1,48мл (16,9ммоль, 5,1еквів.) 70%-ої перхлоратної кислоти і 60мл метанолу підігрівають під зворотним холодильником у атмосфері азоту. Через 2год. реакційну суміш о холоджують до кімнатної температури, розбавляють СН 2СІ2 (250мл) і фільтрують через Celite®. Фільтрат промивають насиченим розчином NаНСО3 у воді (100мл), 10%-им водним сульфітом натрію (75мл) і водою (100мл), після чого висушують над Na2SO4. Фільтрування, концентрування фільтрату і висушування дають прозоре масло, яке очищують на силікагелевій колонці (15% етилацетату/гексани) і одержують 340мг (27%) транс-ізомеру (менш полярного) білої твердої речовини. Дані для транс-ізомеру: темп, плавл. 79-82°С; ІЧ (КВr) 2973, 2949, 2890, 2871, 2235, 1721, 1618, 1484, 1453, 1217, 1170 см-1; 1Н ЯМР (300МГц, CDCI3) δ 7,67(d, 1H, J=8,4Гц); 7,52(s, 1Y), 7,14(dd, 1H, J=1,4, 8,5Гц), 4,93(quintet, 1H, J=7,6Гц), 3,74(s, 3Н), 2,97(q, 2H, J=7,6Гц), 2,85(m, 1H), 2,3(m, 2H), 2,2(m, 10Н), 2,0(m, 2H), 1,75(m, 2H), 1,37(t, 3Н, J=7,6Гц); MC (СІ, NH3) м/з 380 (M+H +, основа). Розрахункові дані для C23H29N3O2 : С, 72,79; Н, 7,70; N, 11,07. Одержано: С, 73,05; Н, 7,80; N, 11,03. Дані для цис-ізомеру: темп, плавл. 112-114°С; ІЧ (КВr) 3065, 2949, 2952, 2866, 2234, 1731, 1622, 1487, 1445, 1220, 1204 см -1; 1Н ЯМР (300МГц, CDCI3) δ 7,68(d, 1H, J=8,5Гц); 7,55(s, 1H), 7,14(dd, 1H, J=1,3, 8,4Гц), 4,93(quintet, 1H, J=7,6Гц), 3,73(s, 3Н), 2,97(q, 2H, J=7,6Гц), 2,42(m, 1H), 2,36(m, 1H), 1,9-2,3(m, 13H), 1,8(m, 2H), 1,37(t, 3Н, J=7,6Гц); MC (СІ, NH3) м/з 380 (M+H +, основа). Розрахункові дані для C23H29N3O2 : С, 72,79; Η, 7,70; Ν, 11,07. Одержано: С, 72,93; Η, 7,56; Ν, 10,92. Приклад 4 Гранс-4-ціан-4-(1-циклопентил-3-етил-1Н-індазол-6-іл)-циклогексанкарбонова кислота Суміш 337мг (0,888ммоль, 1,0еквів.) метилового естеру гранс-4-ціан-4-(1-циклопентил-3-етил-1Н-індазол6-іл)-циклогексанкарбонової кислоти у 10мл метанолу, 2мл ТГФ і 2,7мл (2,66ммоль, 3,0еквів.) 1Ν NaOH залишають переміщуватись при кімнатній температурі. Через 3год. реакційну суміш концентрують у роторному випарювачі, розбавляють 100мл води, закислюють до рН 1 і екстрагують етилацетатом (2x70мл). Органічні екстракти об'єднують, промивають водою (2x100мл) і розсолом (100мл) і висушують над Na 2SO4. Фільтрування, концентрування фільтрату і висушування дають білу тверду речовину, яку очищують на силікагелевій колонці (5% СН3ОН/СН2СІ2) і одержують 197мг (73%) білої аморфної твердої речовини: ІЧ (КВr) 3200-2500, 3060, 2963, 2871, 2245, 1729, 1702, 1621, 1453, 1219 см -1; 1Н ЯМР (300МГц, ДМСО-d6) δ 12,04(br s, 1H), 7,77(d, 1H, J=8,5Гц); 7,69(s, 1H), 7,20(dd, 1H, J=1,3, 8,5Гц), 5,17(quintet, 1H, J=7,6Гц), 2,90(q, 2H, J=7,6Гц), 2,75(m, 1H), 1,9-2,3(m, 16H), 1,7(m, 2H), 1,28(t, 3H, J=7,6Гц); МС (СІ, NH3) м/з 366 (M+H +, основа). Розрахункові дані для C22H27N3О2 : С, 72,29; Н, 7,45; N, 11,50. Одержано: С, 71,98; Н, 7,75; N,11,21. Приклад 5 Цис-4-ціан-4-(1-циклопентил-3-етил-1Н-індазол-6-іл )-циклогексанкарбонова кислота Суміш 831мг (2,19ммоль, 1,0еквів.) метилового естеру цис-4-ціан-4-(1-циклопентил-3-етил-1Н-індазол-6іл)-циклогексанкарбонової кислоти у 20мл метанолу, 4мл ТГФ і 6мл (6,57ммоль, 3,0еквів.) 1N NaOH залишають перемішуватись при кімнатній температурі. Через 1,5год. реакційну суміш концентрують у роторному випарювані, розбавляють 100мл води, закислюють до рН 1 і екстрагують етилацетатом (2х70мл). Органічні екстракти об'єднують, промивають водою (50мл) і розсолом (50мл) і висушують над Na2SO4. Фільтрування, концентрування фільтрату і висушування дають 0,8г білу тверду речовину, яку очи щують на силікагелевій колонці (5% СН3ОН/СН2СІ2) і одержують 730мг (91%) білої кристалічної твердої речовини. Рекристалізація з етил ацетату/гексанів дає 538мг білих кристалів: темп, плавл. 197-199°С; IR (КВr) 3200-2600, 3061, 2961, 2948, 2939, 2871, 2245, 1732, 1625, 1451, 1255, 1185, 1169 см-1; 1Н Я МР (300МГц, ДMCO-d6) δ 12,35(brs, 1Н), 7,77(d, 1Н, J=8,6Гц); 7,73(s, 1 Η), 7,27(dd, 1H, J=1,5, 8,5Гц), 5,13(quintet, 1H, J=7,5Гц), 2,90(q, 2H, J=7,6Гц), 2,42(m, 1H), 1,7-2,1(m, 14H), 1,29(t, 3Н, J=7,5Гц); МС (СІ, NH3) м/з 366 (М+Н+, основа). Розрахункові дані для C22H27N3O2 : С, 72,29; Н, 7,45; N. 11,50. Одержано: С, 72,01; Н, 7,60; N, 11,29. Приклад 6 А: 6-бром-1-циклогекс-2-еніл-3-етил-1Н-індазол 60%-ну дисперсію 2,12г (52,9ммоль, 1,05еквів.) гідриду натрію у маслі протягом 10хвил. чотирма порціями додають до розчину (кімнатної температури) 11,35г (50,4ммоль, 1,0еквів.) 6-брометил-1Н-індазолу у 300мл безводного ДМФ. Після 20-хвилинного перемішування краплями додають 9,0мл (70,6ммоль, 1,4еквів.) 3бромцикпогексану, реакційну суміш концентрують і висушують у вакуумі при кімнатній температурі, одержуючи 7,52г оранжево-жовтої твердої речовини. Цю речовину розчиняють у безводному ДМФ, додають 1,56 (31,8ммоль, 2,27еквів.) ціаніду натрію і перемішують при кімнатній температурі протягом 2,5год. Потім реакційну суміш вливають у 400мл води і екстрагують етилацетатом (3х200мл). Органічні екстракти об'єднують, промивають водою (3х150мл) і розсолом (150мл) і висушують над Na2SО4. Фільтрування, концентрування фільтрату і висушування дають жовте масло, яке очищують на силікагелевій колонці (5-10% етилацетату/гексани) і одержують 1,40г (38%) жовто-зеленого масла; МС (СІ, NH3) м/з 268 (М+Н+, основа). Розрахункові дані для C17H21N3: С, 76,38; Η, 7,92; Μ, 15,72. Одержано: С, 76,43; Η, 7,53; Ν, 15,39. Б. 6-бром-1 -циклогексил-3-етил-1Н-індазол Суміш 10,22г (33,5ммоль, 1,0еквів.) 6-бром-1-циклогекс-2-еніл-3-етил-1Н-індазолу і 1,5г 10%-го Pt/C у 1л циклогексану поміщують у гідрогенізаційний апарат Парра і при кімнатній температурі струшують у атмосфері N2 під тиском 2-5 фунтів/кв. дюйм (13,8-34,5кПа). Через 1год. реакційну суміш фільтрують через Celite®, фільтрат концентрують у роторному випарювачі і флеш-хроматографують (5% етилацетату/гексани), одержуючи 9,70г (94%) блідожовтого масла: МС (СІ, NH3) м/з 309/307 (М+Н+, основа). Розрахункові дані для C15H19N2Br: С, 58,64; Η, 6,23; Ν, 9,12. Одержано: С, 58,56; Η, 6,29; Ν, 8,77. В. 1-циклогексил-3-етил-1Н-індазол-6-карбальдегід Цю сполуку одержують згідно з прикладом 2.Ж, беручи як ви хідний матеріал 5,02г (16,3ммоль, 1,0еквів.) 6бром-1-циклогексил-3-етил-1Н-індазолу. Вихід - 3,65г (87%) блідо-жовтого масла: МС (СІ, ΝΗ3) м/з 257 (М+Н+, основа). Розрахункові дані для C16H20N2О: С, 74,97; Η, 7,87; Ν, 10,93. Одержано: С, 75,00; Η, 7,70; Ν, 10,74. Г. (1-циклогексил-3-етил-1Н-індазол-6-іл)-ацетонітрил 2,7мл (21,0ммоль, 1,5еквів.) триметилсилілхлориду краплями додають до суспензії (кімнатної температури) 3,58 (14,0ммоль, 1,0еквів.) 1-циклопентил-3-етил-1Н-індазол-6-карбальдепду і 2,31г (26,6ммоль, 1,9еквів.) броміду літію у 100мл безводного ацетонітрила. Через 15хвил. реакційну суміш о холоджують у льодяній ванні і краплями додають 1,1мл (23,2ммоль, 1,66еквів.) 1,1,3,3-тетраметилдисолоксану і залишають на ЗО хвил. досягти кімнатної температури. Потім реакційну суміш протягом 3 год. підігрівають під зворотним холодильником, охолоджують до кімнатної температури, розбавляють СН 2СІ2 (300мл) і фільтрують через Celite®. Фільтрат концентрують і висушують у вакуумі при кімнатній температурі, одержуючи 7,52г оранжевожовтої маслянистої твердої речовини. Цю речовину розчиняють у 100 г безводного ДМФ, додають 1,56 (31,8ммоль, 2,27еквів.) ціаніду натрію і перемішують при кімнатній температурі протягом 2,5год. Потім реакційну суміш вливають у 400мл води і екстрагують етилацетатом (3х200мл). Органічні екстракти об'єднують, промиваюють водою (3х150мл) і розсолом (150мл) і висушують над Na2SО4. Фільтрування, концентрування фільтрату і висушування дають жовте масло, яке очищують на силікагелевій колонці (5-10% етилацетату/гексани) і одержують 1,40г (38%) жовто-зеленого масла; МС (СІ, NH3) м/з 268 (М+Н+, основа). Розрахункові дані для С 17H21N3: С, 76,38; Η, 7,92; Ν, 15,72. Одержано: С, 76,43; Η, 7,53; Ν, 15,39. Д. Диметиловий естер 4-ціан-4-(1-циклогексил-3-етил-1Н-індазол-6-іл)-гептан-діонової кислоти Цю сполуку одержують згідно з прикладом 2.Є, беручи як вихідний матеріал 1,33г (4,98ммоль, 1,0еквів.) (1-циклопентил-3-етил-1Н-індазол-6-іл)-ацетонітрилу. Вихід - 1,38г (63%) жовтого масла; МС (СІ, ΝΗ3) м/з 440 (М+Н+, основа). Розрахункові дані для C25H33N3O 4: С, 68,32; Н, 7,57; Ν, 9,56. Одержано: С, 68,18; Н, 7,52; Ν, 9,28. Е. Метиловий естер 5-ціан-5-(1-циклогексил-3-етил-1Н-індазол-t-іл)-оксо-циклогексанкарбонової кислоти Цю сполуку одержують згідно з прикладом 2.Ж, беручи як вихідний матеріал 1,33г (3,03ммоль, 1,0еквів.) диметилового естеру 4-ціан-4-(1-циклопентил-3-етил-1Н-індазол-6-іл)-гептандіонової кислоти. Вихід - 983 мг (80%) жовтого масла; МС (СІ, NH3) м/з 408 (М+Н+, основа). Розрахункові дані для C24H29N3O3: С, 70,75; Н, 7,18; N, 10,31. Одержано: С, 70,75; Н, 7,33; N, 10,19. Є. 1 -(1 -циклогексил-З-етил-1 Н-індазол-6-іл )-4-оксоциклогексанкарбонітрил Цю сполуку одержують згідно з прикладом 2.3, беручи як вихідний матеріал 933 мг (2,29 ммоль, 1,0 еквів.) метилового естеру 5-ціан-5-(1-циклопентил-3-етил-1Н-індазол-t-іл)-оксоциклогексанкарбонової кислоти. Вихід - 588мг (74%) жовтої твердої аморфної речовини; МС (СІ, NН3) м/з 350 (М+Н+, основа). Розрахункові дані для C22H27N3 O: С, 75,62; Н, 7,79; N. 12,03. Одержано: С, 75,57; Н, 7,90; N. 12,15. Приклад 7 Метиловий естер цис-4-ціан-4-(1-циклогексил-3-етил-1Н-індазол-6-іл)-циклогексанкарбонової кислоти і метиловий естер гранс-4-ціан-4-(1-циклопентил-3-етил-1Н-індазол-6-іл)-циклогексанкарбонової кислоти Ці сполуки одержують згідно з прикладом 3.Б, беручи як вихідний матеріал 540мг (1,2ммоль, 1,0еквів.) 1(1-циклопентил-3-етил-1Н-індазол-6-іл)-4-[1,3]дитіан-2-ілідинциклогексанкарбонітрилу. Вихід - 117мг (25%) транс-ізомеру у вигляді білої маслянистої твердої речовини і 233мг (60%) цис-ізомеру у ви гляді білої кристалічної твердої речовини. Дані для транс-ізомеру: 1Н ЯМР (300МГц, СОСІ3) δ 7,68(d, 1H, J=8,4Гц); 7,50(d, 1H, J=0,8Гц), 7,13(dd, 1H, J=1,6, 8,5Гц), 4,34(m, 1H), 3,74(s, 3Н), 2,98(q, 2H, J=7,6Гц), 2,85(m, 1H), 2,35(m, 2H), 1,9-2,2(m, 12H), 1,8(m, 2H), 1,55(m, 2H), 1,37(t, 3Н, J=7,6Гц); МС (СІ, NH3) м/з 394 (M+H +, основа). Розрахункові дані для C24H31N3O 2: С, 73,25; Н, 7,95; N, 10,68. Одержано: С, 73,07; Н, 8,12; N, 10,89. Дані для цис-ізомеру: 1Н ЯМР (300МГц, CDCI3) δ 7,68(d, 1H, J=8,4Гц); 7,50(d, 1H, J=0,9Гц), 7,14(dd, 1H, J=1,6, 8,5Гц), 4,34(m, 1H), 3,74(s, 3Н), 2,98(q, 2H, J=7,6Гц), 2,43(m,1H), 1,9-2,2(m, 15H), 1,8(m, 2H), 1,5(m, 2H), 1,37(t, 3Н, J=7,6Гц); МС (СІ, NH3) м/з 394 (M+H+, основа). Розрахункові дані для C24H31N3O2: C, 73,25; H, 7,95; N, 10,68. Одержано: C, 73,17; H, 7,89; N, 10,43. Приклад 8 Цис-4-ціан-4-(1-циклогексил-3-етил-1Н-індазол-6-іл)-циклогексанкарбонова кислота Цю сполуку одержують згідно з прикладом 5, беручи як вихідний матеріал 201мг (0,511ммоль, 1,0еквів.) метилового естеру цис-4-ціан-4-(1-циклопентил-3-етил-1Н-індазол-6-іл)-циклогексанкарбонової кислоти. Одержують 178мг (92%) білої твердої кристалічної речовини, яку рекристалізують з етилацетат/гексанів і одержують 153мг білого кристалічного порошку; темп, плавлення 192-194°С. Розрахункові дані для C23H29N3 O2: С, 72,79; Н, 7,70; N, 11,07. Одержано: С, 72,25; Н, 7,99; N. 10,97. Приклад 9 1-(циклогексил-3-етил-1Н-індазол-6-іл)-цис-4-гідроксилметилциклогексанкарбо-нітрил До розчину продукта прикладу 8 (220мг, 0,58ммоль) у безводному тетрагідрофурані (5мл) при 0°С з перемішуванням краплями додають розчин борану у тетрагідрофурані (1М, 1,3мл, 1,3ммоль). Суміш при температурі 0°С перемішують протягом 1год. і потім гасять повільним доданням метанолу (1мл). Суміш вливають у воду (100мл) і екстрагують етилацетатом (2х100мл). Органічні екстракти об'єднують, промивають водою (20мл) і розсолом (20мл), висушують над суль фатом магнію і концентрують, одержуючи масло. Ідентичну процедуру було окремо здійснюють з використанням продукта прикладу 8 (100мг, 0,26ммоль) і борану у тетрагідрофурані (1М, 0,6мл, 0,58ммоль). Сирі продукти обох процедур об'єднують і хроматографують на силікагелі з елюентом метанол(2,5%)/метиленхлорид (по об'єму), одержуючи масло. Рекристалізація з етилацетату/гексанів дає 214мг (67%) білої твердої речовини з температурою плавлення 117-119°С. МС (м/з) 367 (М+1,20), 366 (М+, 100). Приклад 10 Амід цис-4-ціано-4-(1-циклогексил-3-етил-1Н-індазол-6-іл )циклогексанкарбонової кислоти Суміш продукта прикладу 8 (150мг, 0,4ммоль), тіонілхлориду (36мл, 0,49ммоль) і диметилформаміду (5мкл) у безводному метиленхлориді (3мл) витримують під зворотним холодильником протягом 4год. Суміш охолоджують до 0°С і бульбашками пропускають через неї безводний аміак з хлороформом (200 мл), після чого промивають водою (40мл), висушують над сульфатом магнію і концентрують, одержуючи тверду речовину. Рекристалізація з етилацетату/гексанів дає 125мг (63%) білої твердої речовини з температурою плавлення 180-182°С. МС (м/з) (М+1, 20), 379 (М+, 100). Приклад 11 Амід транс-4-ціан-4-(1-циклогексил-3-етил-1Н-індазол-6-іл)-циклогексанкарбонової кислоти Цю речовину одержують як у прикладі 4. Точка плавлення ізольованого продукта 140-143°С.
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted indazole derivatives, a pharmaceutical composition for the inhibition of phosphodiesterase type iv or the production of tumor necrosis factor, intermediate compounds
Назва патенту російськоюЗамещенные производные индазола, фармацевтическая композиция для ингибирования фосфодиэстеразы типа iv или для ингибирования образования фактора опухолевого некроза, промежуточные соединения
МПК / Мітки
МПК: C07D 231/56, C07D 409/08, A61P 35/02, A61P 15/00, A61P 37/06, A61P 3/00, A61P 31/12, A61P 11/00, A61P 33/02, A61K 31/416, A61K 31/415, A61P 29/00, A61P 13/02, A61P 11/08, A61P 43/00
Мітки: некрозу, типу, сполуки, заміщені, фармацевтична, композиція, фосфодіестерази, утворення, фактора, пухлинного, проміжні, інгібування, індазолу, похідні
Код посилання
<a href="https://ua.patents.su/16-65536-zamishheni-pokhidni-indazolu-farmacevtichna-kompoziciya-dlya-ingibuvannya-fosfodiesterazi-tipu-iv-abo-dlya-ingibuvannya-utvorennya-faktora-pukhlinnogo-nekrozu-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Заміщені похідні індазолу, фармацевтична композиція для інгібування фосфодіестерази типу iv або для інгібування утворення фактора пухлинного некрозу, проміжні сполуки</a>
Попередній патент: Похідні бензопірану та спосіб їх одержання
Наступний патент: Спосіб лікування симптоматичної вертеброгенної гіпертензії за марфинцями-лазориком
Випадковий патент: Пристрій для очищення та транспортування коренеплодів