Інгібітори протеасом
Формула / Реферат
1. Сполука формули (І)
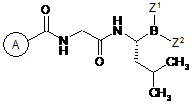 (І)
(І)
або її фармацевтично прийнятна сіль або бороновий ангідрид, де:
кожен з Z1 і Z2 незалежно являє собою гідрокси, алкокси, арилокси або аралкокси; або Z1 і Z2 разом утворюють фрагмент, що являє собою похідне комплексутворюючого агента на основі боронової кислоти; і
кільце А вибране з групи, що складається з:
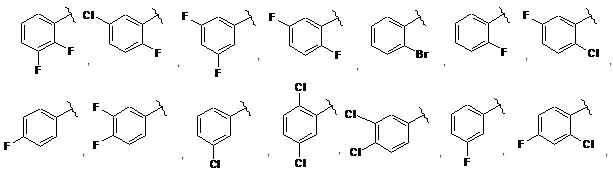
 і
і
2. Сполука за п. 1, де Z1 і Z2 кожний являє собою гідрокси.
3. Сполука за п. 1, де Z1 і Z2 разом утворюють фрагмент, який являє собою похідне комплексоутворюючого агента на основі боронової кислоти.
4. Сполука за п. 1, вибрана з групи, яка складається з:
[(1R)-1-({[(2,3-дифторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(5-хлор-2-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(3,5-дифторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2,5-дифторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2-бромбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2-хлор-5-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(4-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(3,4-дифторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(3-хлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2,5-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(3,4-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(3-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2-хлор-4-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2,3-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2-хлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2,4-дифторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(4-хлор-2-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(4-хлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2,4-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти і
[(1R)-1-({[(3,5-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
або її фармацевтично прийнятна сіль або бороновий ангідрид.
5. Сполука за п. 1, яка являє собою манітовий ефір боронової кислоти, вибраної з групи, що складається з:
[(1R)-1-({[(2,3-дифторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(5-хлор-2-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(3,5-дифторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2,5-дифторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2-бромбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2-хлор-5-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(4-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(3,4-дифторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(3-хлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2,5-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(3,4-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(3-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2-хлор-4-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2,3-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2-хлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2,4-дифторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(4-хлор-2-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(4-хлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти;
[(1R)-1-({[(2,4-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти і
[(1R)-1-({[(3,5-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронової кислоти.
6. Сполука за п. 1, де сполука являє собою [(1R)-1-({[(2,4-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронову кислоту; або її фармацевтично прийнятна сіль або бороновий ангідрид.
7. Сполука за п. 1, де сполука являє собою [(1R)-1-({[(2,3-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронову кислоту; або її фармацевтично прийнятна сіль або бороновий ангідрид.
8. Сполука за п. 1, де сполука являє собою [(1R)-1-({[(2,5-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронову кислоту; або її фармацевтично прийнятна сіль або бороновий ангідрид.
9. Сполука за п. 1, де сполука являє собою [(1R)-1-({[(4-хлор-2-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронову кислоту; або її фармацевтично прийнятна сіль або бороновий ангідрид.
10. Сполука за п. 1, де сполука являє собою [(1R)-1-({[(5-хлор-2-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронову кислоту; або її фармацевтично прийнятна сіль або бороновий ангідрид.
11. Сполука за п. 1, де Z1 і Z2 разом утворюють фрагмент, який являє собою похідне комплексоутворюючого агента на основі боронової кислоти; і кільце А являє собою
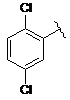 .
.
12. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-11 і фармацевтично прийнятний носій.
13. Спосіб лікування раку, який включає введення пацієнту, що потребує такого лікування, фармацевтичної композиції за п. 12.
14. Сполука за будь-яким з пп. 1-11 для застосування для лікування раку.
15. Застосування сполуки за будь-яким з пп. 1-11 для одержання лікарського засобу для лікування раку.
Текст
1. Сполука формули (І) Z1 O H N B N Z2 A H O CH3 F Cl F , F Cl F F F F , , F 1 F F F Cl (54) ІНГІБІТОРИ ПРОТЕАСОМ 3 97536 4 метилбутил]боронової кислоти; [(1R)-1-({[(2-хлор-4фторбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(2,3-дихлорбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти; [(1R)-1-({[(2-хлорбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(2,4-дифторбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти; [(1R)-1-({[(4-хлор-2фторбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(4-хлорбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(2,4-дихлорбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти і [(1R)-1-({[(3,5-дихлорбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти; або її фармацевтично прийнятна сіль або бороновий ангідрид. 5. Сполука за п. 1, яка являє собою манітовий ефір боронової кислоти, вибраної з групи, що складається з: [(1R)-1-({[(2,3-дифторбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти; [(1R)-1-({[(5-хлор-2фторбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(3,5-дифторбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти; [(1R)-1-({[(2,5-дифторбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти; [(1R)-1-({[(2-бромбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(2-фторбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(2-хлор-5фторбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(4-фторбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(3,4-дифторбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти; [(1R)-1-({[(3-хлорбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(2,5-дихлорбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти; [(1R)-1-({[(3,4-дихлорбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти; [(1R)-1-({[(3-фторбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(2-хлор-4фторбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(2,3-дихлорбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти; [(1R)-1-({[(2-хлорбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(2,4-дифторбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти; [(1R)-1-({[(4-хлор-2фторбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(4-хлорбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти; [(1R)-1-({[(2,4-дихлорбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти і [(1R)-1-({[(3,5-дихлорбензоїл)аміно]ацетил}аміно)3-метилбутил]боронової кислоти. 6. Сполука за п. 1, де сполука являє собою [(1R)-1({[(2,4-дихлорбензоїл)аміно]ацетил}аміно)-3метилбутил]боронову кислоту; або її фармацевтично прийнятна сіль або бороновий ангідрид. 7. Сполука за п. 1, де сполука являє собою [(1R)-1({[(2,3-дихлорбензоїл)аміно]ацетил}аміно)-3метилбутил]боронову кислоту; або її фармацевтично прийнятна сіль або бороновий ангідрид. 8. Сполука за п. 1, де сполука являє собою [(1R)-1({[(2,5-дихлорбензоїл)аміно]ацетил}аміно)-3метилбутил]боронову кислоту; або її фармацевтично прийнятна сіль або бороновий ангідрид. 9. Сполука за п. 1, де сполука являє собою [(1R)-1({[(4-хлор-2-фторбензоїл)аміно]ацетил}аміно)-3метилбутил]боронову кислоту; або її фармацевтично прийнятна сіль або бороновий ангідрид. 10. Сполука за п. 1, де сполука являє собою [(1R)1-({[(5-хлор-2-фторбензоїл)аміно]ацетил}аміно)-3метилбутил]боронову кислоту; або її фармацевтично прийнятна сіль або бороновий ангідрид. 1 2 11. Сполука за п. 1, де Z і Z разом утворюють фрагмент, який являє собою похідне комплексоутворюючого агента на основі боронової кислоти; і кільце А являє собою Cl Даний винахід стосується боронових кислот і боронових ефірів, що підходять для застосування як інгібітори протеасом. У даному винаході також запропоновані фармацевтичні композиції, що міс тять сполуки згідно із даним винаходом, і способи застосування зазначених композицій для лікування різних захворювань. Воронові кислоти і ефіри проявляють цілий . Cl . 12. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-11 і фармацевтично прийнятний носій. 13. Спосіб лікування раку, який включає введення пацієнту, що потребує такого лікування, фармацевтичної композиції за п. 12. 14. Сполука за будь-яким з пп. 1-11 для застосування для лікування раку. 15. Застосування сполуки за будь-яким з пп. 1-11 для одержання лікарського засобу для лікування раку. 5 ряд фармацевтично корисних видів біологічної активності. У патенті США 4499082 (1985), Шенві (Shenvi) із співавторами, показано, що пептидні боронові кислоти є інгібіторами деяких протеолітичних ферментів. Кеттнером (Kettner) і Шенві (Shenvi) у патентах США номер 5187157 (1993), 5242904 (1993) і 5250720 (1993) запропонований клас пептидних боронових кислот, які інгібують трипсин-подібні протеази. Кліманом (Kleeman) із співавторами в патенті США номер 5169841 (1992) запропоновані модифіковані за N-кінцем пептидні боронові кислоти, що інгібують дію реніну. Кіндером (Kinder) із співавторами в патенті США номер 5106948 (1992) зазначено, що деякі сполуки боронових кислот інгібують ріст ракових клітин. Баховчиним (Bachovchin) із співавторами в публікації міжнародної заявки WO 07/0005991 описані сполуки пептидних боронових кислот, що інгібують активуючий фібробласти білок. Боронові кислоти і ефіри є багатообіцяючими інгібіторами протеасоми, яка являє собою мультикаталітичну протеазу, що відповідає за більшу частину процесовнутріклітинного відновлення білків. Адамсом (Adams) із співавторами в патенті США номер 5780454 (1998) описані пептидні боронові ефіри і кислоти, що підходять для застосування як інгібітори протеасом. У цій роботі також описано застосування боронових ефірів і кислот для зменшення швидкості розпаду м'язових білків, зменшення активності NF-В у клітині, зменшення швидкості розпаду білка р53 у клітині, придушення розпаду циклінів у клітині, придушення росту ракових клітин та інгібування NF-В-залежної клітинної адгезії. Фуретом (Furet) із співавторами в публікації WO 02/096933, Четержи (Chatterjee) з співавторами в публікації WO 05/016859 і Бернадіні (Bernadini з співавторами в публікаціях WO 05/021558 й WO 06/08660 запропоновані додаткові боронові ефіри й кислоти, які, як повідомлялося, мають інгібіторну активність відносно щодо протеасом. У роботі Кішановера (Ciechanover), Cell, 79: 13-21 (1994), зазначено, що протеасома являє собою протеолітичний компонент убіквітинпротеасомного шляху, у якому білки з'єднуються з безліччю молекул убіквітину, що призводить до наступного розкладання зазначених білків. Кішановером також зазначено, що убіквітинпротеасомний шлях відіграє ключову роль у цілому ряду важливих фізіологічних процесів. У роботі Рівета (Rivett) з співавторами, Biochem. J. 291:1 (1993), зазначено, що протеасома проявляє трипсинову, хімотрипсинову й пептидилглютамілпептидазну активність. Каталітичне ядро протеасоми 26S складає протеасома 20S. МакКормаком (McCormack) із співавторами, Biochemistry 37:7792 (1998), описаний цілий ряд пептидних субстратів, включаючи Suc-Leu-Leu-Val-Tyr-AMC, ZLeu-Leu-Arg-AMC й Z-Leu-Leu-Glu-2NA, де Sue являє собою N-сукциніл, AMC являє собою 7аміно-4-метилкумарин, a 2NA являє собою 2нафтіламін, які розщеплюються протеасомою 20S. Інгібування протеасом являє собою важливу нову стратегію лікування раку. Кінгом (King) із співавторами, Science 274:1652-1659 (1996), пока 97536 6 зано, що убіквітин-протеасомний шлях відіграє важливу роль в регуляції клітинного циклу, рості новоутворень і метастазуванні. Авторами було показано, що ряд ключових регуляторних білків, включаючи цикліни й циклін-залежні кінази р21 й KSF1 p27 , безперервно розкладається в ході протікання клітинного циклу за убіквітин-протеасомним шляхом. Своєчасне розкладання цих білків потрібне для просування клітини за клітинним циклом та її мітотичного поділу. Крім того, убіквітин-протеасомний шлях необхідний для регуляції транскрипції. У роботі Паломбелі (Palombella) із співавторами, Cell, 78:773 (1994), показано, що активація транскрипційного фактора NF-В регулюється опосередкованим протеасомами розкладанням інгібіторного білка ІВ. У свою чергу, NF-В відіграє центральну роль в регуляції генів, що беруть участь в імунних і запальних реакціях. У роботі Ріда (Read) з співавторами, Immunity 2:493-506 (1995), показано, що убіквітин-протеасомний шлях необхідний для експресії молекул клітинної адгезії, таких як Еселектин, ICAM-I й VCAM-I. У роботі Цеттера (Zetter), Seminars in Cancer Biology 4:219-229 (1993), показано, що молекули клітинної адгезії беруть участь у метастазуванні пухлин і ангіогенезі in vivo, направляючи адгезію і екстравазацію пухлинних клітин у судинну систему та з неї до вилучених тканин усередині організму. Крім того, Бегом (Beg) і Балтімором (Baltimore), Science 274:782 (1996), показано, що NF-В являє собою протиапоптичний контролюючий фактор, й інгібування активації NF-KB робить клітини більше чутливими до впливу навколишнього середовища та дії цитотоксичних агентів. Інгібітор протеасом VELCADE® (бортезоміб; N-2-піразинкарбоніл-L-фенілаланін-Lлейцинборонова кислота) являє собою перший інгібітор протеасом, офіційно дозволений до застосування. У роботі Мітсіадез (Mitsiades) із співавторами, Current Drug Targets, 7:1341 (2006), наведений огляд клінічних досліджень, в результаті яких був одержаний дозвіл на застосування бортезомібу для лікування пацієнтів із множинною мієломою, які одержували щонайменше один відомий раніше лікарський препарат. Фішером (Fisher) із співавторами, J. Clin. Oncol, 30:4867, описане міжнародне багатоцентрове клінічне дослідження II фази, що підтверджує активність бортезомібу в пацієнтів з рецидивуючою або рефракторною лімфомою з клітин мантійної зони. У роботах Ішиї (Ishii) з співавторами, Anti-Cancer Agents in Medicinal Chemistry, 7:359 (2007), і Роккаро (Roccaro) з співавторами, Curr. Pharm. Biotech., 7:1341 (2006), обговорюється ряд молекулярних механізмів, які можуть вносити вклад у протипухлинну активність бортезомібу. Як видно з наведених вище джерел, протеасома являє собою важливу мішень для терапевтичного втручання. Отже, у даний час, як і раніше, існує необхідність у створенні нових та/або покращених інгібіторів протеасом. У даному винаході запропоновані сполуки, що є ефективними інгібіторами протеасоми. Зазначені сполуки підходять для придушення активності 7 97536 протеасом in vitro й in vivo та є особливо підходящими для лікування різних захворювань, пов'язаних із проліферацією клітин. Сполуки згідно із даним винаходом відповідають загальній формулі (І): 8 або являють собою фармацевтично прийнятну сіль або бороновий ангідрид сполуки зазначеної формули, де: 1 2 кожен з Z і Z незалежно являє собою гідрок1 2 си, алкокси, арилокси або аралкокси; або Z й Z разом утворюють фрагмент, що являє собою похідне комплексутворюючого агента на основі боронової кислоти; і кільце А вибране із групи, що складається з: 1 2 Сполуки боронових кислот формули (І), де кожен з Z і Z являє собою гідроксил, мають наступні хімічні назви: Таблиця 1 Інгібітори протеасом 1-1 1-2 1-3 1-4 1-5 1-6 1-7 1-8 1-9 1-10 1-11 1-12 1-13 1-14 1-15 1-16 1-17 1-18 1-19 1-20 1-21 Хімічна назва [(1R)-1-({[(2,3-дифторбензоіл)аміно]ацетил}аміно)-3-метилбутил]боронова кислота [1R)-1-({[(5-хлор-2-фторбензоїл)аміно]ацетил }аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(3,5-дифторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронова кислота [(1R)-1-({ [(2,5-дифторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(2-бромбензоїл)аміно] ацетил}аміно)-3-метилбутил] боронова кислота [(1R)-1-({[(2-фторбензоїл)аміно] ацетил}аміно)-3-метилбутил] боронова кислота [(1R)-1-({[(2-хлор-5-фторбензоїл)аміно] ацетил}аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(4-фторбензоїл)аміно] ацетил} аміно)-3-метилбутил] боронова кислота [(1R)-1-({[(3,4-дифторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(3-хлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(2,5-дйхлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(3,4-дихлорбензоїл)аміно]ацетил} аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(3-фторбензоїл)аміно] ацетил}аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(2-хлор-4-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(2,3-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(2-хлорбензоїл)аміно]ацетил} аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(2,4-дифторбензоїл)аміно] ацетил} аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(4-хлор-2-фторбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(4-хлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(2,4-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронова кислота [(1R)-1-({[(3,5-дихлорбензоїл)аміно]ацетил}аміно)-3-метилбутил]боронова кислота Термін "алкіл", застосовується окремо або як частина назви фрагмента більшого розміру, стосу ється прямого або розгалуженого ланцюга або циклічної аліфатичної групи, що містить від 1 до 12 9 атомів вуглецю. Термін "алкокси" стосується -Оалкільного радикала. Терміни "арил" і "ар-", застосовувані окремо або як частина назви фрагмента більшого розміру, наприклад, "аралкіл", "аралкокси" або "арилоксиалкіл", відносяться до ароматичних вуглеводнів від C6 до C14, що містять від одного до трьох кілець, кожне з яких можливо містить замісники. Переважно, арильна група являє собою арильну групу С610. Арильні групи включають, без обмеження, феніл, нафтил і антраценіл. "Аралкільна" або "арилалкільна" група включає арильну групу, ковалентно зв'язану з алкільною групою, кожна з яких незалежно може бути заміщеною. Переважно, аралкільна група являє собою С6-10 арил(С1-6)алкіл, С6-10 арил(С1-4)алкіл або С6-10 арил(С1-3)алкіл, включаючи, без обмеження, бензил, фенетил і нафтилметил. Термін "заміщений" у даному описі означає, що водневий радикал у зазначеному фрагменті заміщений на радикал конкретного замісника за умови, що в результаті зазначеного заміщення утворюється стабільна або хімічно можлива сполука. Необмежуючі приклади підходящих замісників включають С1-6 алкіл, С3-8 циклоалкіл, С1-6 алкіл(С3-8)циклоалкіл, С2-8 алкеніл, С2-8 алкініл, ціано, аміно, C1-6 алкіламіно, ді(С1-6)алкіламіно, бензиламіно, дибензиламіно, нітро, карбокси, карбо(С16)алкокси, трифторметил, галоген, С1-6 алкокси, С6арил, С6-10 арил(С1-6)алкіл, С6-10 арил(С110 6)алкоксил, гідрокси, С1-6 алкілтіо, С1-6 алкілсульфініл, С1-6 алкілсульфоніл, С6-10 арилтіо, С6-10 арилсульфініл, С6-10 арилсульфоніл, С6-10 арил, С1-6 алкіл(С6-10)арил і галоген(С6-10)арил. Вираз "один або більше замісників" у даному описі стосується кількості замісників, рівному від одного до максимально можливої кількості замісників, визначеної кількістю доступних положень, за якими може відбуватися зв'язування, за умови, що дотримуються зазначені вище умови стабільності й можливості утворення одержаної хімічної структури. Якщо не зазначене інше, можливо заміщена група може містити замісник у кожному положенні цієї групи, за яким може протікати заміщення, при цьому замісники можуть бути або однаковими, або різними. У даному описі термін "незалежно обраний" означає, що можна вибрати однакові або різні значення з безлічі випадків даної змінної у складі однієї сполуки. Термін "приблизно" у даному описі означає близько, в межах, орієнтовно або біля. Коли термін "приблизно" використовується разом із числовим діапазоном, використання зазначеного терміна призводить до зміни цього діапазону шляхом розширення верхніх і нижніх границь зазначеного числового діапазону. Як правило, термін "приблизно" у даному описі змінює числове значення в більшу або меншу сторону від зазначеного значення на величину похибки, що складає 10%. У даному описі термін "включає" означає "включає, але не обмежується". Якщо не зазначене інше, структури, наведені в даному описі, включають сполуки, які відрізняються лише присутністю одного або більше ізотопно збагачених атомів. Наприклад, сполуки, що відпо 97536 10 відають наведеній структурі за винятком того, що один з атомів водню заміщений на дейтерій або тритій або один з атомів вуглецю заміщений на 13 14 C- або С-збагачений вуглець, знаходяться у рамках даного винаходу. У даному описі термін "боронова кислота" стосується хімічної сполуки, що містить фрагмент B(OH)2. У деяких варіантах реалізації, боронові кислоти можуть утворювати олігомерні ангідриди шляхом дегідратації фрагмента боронової кислоти. Наприклад, Снайдером (Snyder) із співавторами, J. Am. Chem. Soc. 80:3611 (1958), описані олігомерні арилборонові кислоти. У даному описі термін "ангідрид боронової кислоти (бороновий ангідрид)" стосується хімічної сполуки, утвореної шляхом комбінування двох або більше молекул боронової кислоти з відщепленням однієї або більше молекул води. При змішуванні з водою ангідрид боронової кислоти гідратується з вивільненням вільної боронової кислоти. Відповідно до різних варіантів реалізації, ангідрид боронової кислоти може містити дві, три, чотири або більше одиниць боронової кислоти і може мати циклічну або лінійну конфігурацію. Необмежуючі приклади олігомерних боронових ангідридів пептидних боронових кислот згідно із даним винаходом наведені нижче: У формулах (1) і (2) змінна n являє собою ціле число від 0 до приблизно 10, переважно 0, 1, 2, 3 або 4. У деяких варіантах реалізації ангідрид боронової кислоти містить циклічний тример ("бороксин") формули (2), де n дорівнює 1. Змінна W має формулу (3): де кільце А приймає значення, зазначені вище для формули (І). У деяких варіантах реалізації щонайменше 80% боронової кислоти, що присутня в ангідриді боронової кислоти, існує у формі окремого олігомерного ангідриду. У деяких варіантах реалізації, щонайменше 85%, 90%, 95% або 99% боронової кислоти, що присутня в ангідриді боронової кислоти, існує у формі окремого олігомерного ангідриду. У деяких переважних варіантах реалізації ангідрид боронової кислоти складається або по суті складається з бороксину, що має формулу (3). Ангідрид боронової кислоти переважно можна одержати з відповідної боронової кислоти в умовах проведення дегідратації, включаючи, але не обмежуючись перерахованими, перекристаліза 11 цію, ліофілізацію, тепловий вплив та/або вплив осушувача. Необмежуючі приклади підходящих для перекристалізації розчинників включають етилацетат, дихлорметан, гексани, простий ефір, ацетонітрил, етанол та їхні суміші. 1 2 У деяких варіантах реалізації Z і Z разом утворюють фрагмент, що являє собою похідне комплексутворюючого агента на основі боронової кислоти. Для цілей даного винаходу термін "комплексутворюючий агент на основі боронової кислоти" стосується будь-якої сполуки, що містить щонайменше дві функціональні групи, кожна з яких може утворювати ковалентний зв'язок з бором. Необмежуючі приклади підходящих функціональних груп включають аміно та гідроксил. У деяких варіантах реалізації щонайменше одна із зазначених функціональних груп являє собою гідроксильну групу. Термін "фрагмент, що являє собою похідне комплексутворюючого агента на основі боронової кислоти" стосується фрагмента, утвореного шляхом видалення атомів водню із двох функціональних груп у складі комплексутворюючого агента на основі боронової кислоти. У даному описі терміни "боронатний ефір" і "бороновий ефір" використовуються взаємозамінюючи один одного й відносяться до хімічної спо1 2 луки, що містить фрагмент -B(Z )(Z ), де щонайме1 2 нше один з Z або Z являє собою алкокси, 1 2 аралкокси або арилокси; або Z і Z разом утворюють фрагмент, що являє собою похідне комплексутворюючого агента на основі боронової кислоти, який містить щонайменше одну гідроксильну групу. 1 2 У деяких варіантах реалізації, Z і Z разом утворюють фрагмент, який являє собою похідне сполуки, що містить щонайменше дві гідроксильні групи, розділені щонайменше двома проміжними атомами в ланцюзі або циклі, при цьому зазначений ланцюг або зазначене кільце містить атоми вуглецю і, можливо, гетероатом або гетероатоми, які можуть являти собою N, S або О, причому атом, приєднаний до бору, в кожному випадку являє собою атом кисню. У даному описі термін "сполука, яка містить щонайменше дві гідроксильні групи" стосується будь-якої сполуки, що містить дві або більше гідроксильні групи. Для цілей даного винаходу зазначені дві гідроксильні групи переважно розділені щонайменше двома проміжними атомами, переважно від приблизно 2 до приблизно 5 проміжними атомами, більш переважно 2 або 3 проміжними атомами. Для зручності, термін "дигідроксильна сполука" можна застосовувати щодо сполуки, яка містить щонайменше дві гідроксильні групи, як зазначено вище. Таким чином, у даному описі термін "дигідроксильна сполука" не повинен бути обмежений сполуками, що містять лише дві гідроксильні групи. Фрагмент, який являє собою похідне сполуки, що містить щонайменше дві гідроксильні групи, може бути приєднаний до бору через атоми кисню в складі кожної з двох зазначених гідроксильних груп. Переважно, атом бору, атоми кисню, приєднані до бору, і атоми, що з'єднують два атоми кисню, разом утворюють 5- або 6-членне кільце. 97536 12 Для цілей даного винаходу комплексутворюючий агент на основі боронової кислоти переважно є фармацевтично прийнятним, тобто підходящим для введення людям. У деяких переважних варіантах реалізації комплексутворюючий агент на основі боронової кислоти являє собою цукор. Термін "цукор" включає будь-який полігідроксильний вуглеводний фрагмент, включаючи моносахариди, дисахариди, полісахариди, цукрові спирти й аміноцукри. У деяких варіантах реалізації цукор являє собою моносахарид, дисахарид, цукровий спирт або аміноцукор. Необмежуючі приклади підходящих цукрів включають глюкозу, сахарозу, фруктозу, трегалозу, манніт, сорбіт, глюкозамін й Nметилглюкозамін. У деяких варіантах реалізації цукор являє собою манніт або сорбіт. Таким чином, у варіантах реалізації, згідно з якими цукор 1 2 являє собою манніт або сорбіт, Z і Z разом утворюють фрагмент формули С6Н12O6, де атоми кисню двох депротонованих гідроксильних груп утворюють ковалентні зв'язки із бором з утворенням боронатного ефіру. У деяких конкретних варіантах 1 2 реалізації, Z і Z разом утворюють фрагмент, що являє собою похідне D-манніту. У деяких варіантах реалізації сполуку формули (І) приготовано у виді ліофілізованого порошку, як описано Пламондоном (Plamondon) із співавторами в публікації заявки WO 02/059131, вміст якої повністю включений в даний опис за допомогою посилання. У деяких варіантах реалізації ліофілізований порошок також містить вільну дигідроксильну сполуку. Переважно, зазначена вільна дигідроксильна сполука і сполука формули (І) присутні в суміші в молярному співвідношенні, що знаходиться в діапазоні від приблизно 0.5:1 до приблизно 100:1, більш переважно від приблизно 5:1 до приблизно 100:1. У різних варіантах реалізації, у яких дигідроксильна сполука являє собою манніт, зазначений ліофілізований порошок містить вільний манніт і манніт-боронатний ефір у молярному співвідношенні, що знаходиться в діапазоні від приблизно 10:1 до приблизно 100:1, від приблизно 20:1 до приблизно 100:1 або від приблизно 40:1 до приблизно 100:1. У деяких варіантах реалізації ліофілізований порошок містить манніт й сполуку формули (І), і по суті не містить інших компонентів. Проте, зазначена композиція може додатково містити один або більше інших фармацевтично прийнятних допоміжних речовин, носіїв, розріджувачів, наповнювачів, солей, буферів, стабілізаторів, солюбілізаторів й інших речовин, добре відомих у даній галузі техніки. Одержання фармацевтично прийнятних композицій, що містять ці речовини, описано, наприклад, в Remington: The Science and Practice of Pharmacy, 20e вид., ред. A. Gennaro, Lippincott Williams & Wilkins, 2000, або в останньому виданні. Ліофілізований порошок, який містить сполуку формули (І), переважно одержували відповідно до методик, описаних Пламондоном (Plamondon) із співавторами в WO 02/059131. Таким чином, у деяких варіантах реалізації, спосіб одержання ліофілізованого порошку включає: (а) одержання водної суміші, що містить пептидну боронову кислоту й дигідроксильну сполуку; і (b) ліофілізування 13 97536 14 цієї суміші. Загальна методологія синтезу Сполуки формули (І) можна одержати за допомогою способів, відомих середньому фахівцеві в даній галузі техніки. Див., наприклад, Адамс (Adams) із співавторами, патент США номер 5780454; Пікерсджилл (Pickersgill) із співавторами, міжнародна публікація WO 2005/097809. Типовий спосіб синтезу представлений на Схемі 1 нижче. Схема 1: 1. умови протікання реакції з'єднання пептиду 2. видалення захисних груп умови протікання реакції з'єднання пептиду водн. HCl гексан Реакція з'єднання сполуки (і) із N-захищеним гліцином (іі) з наступним видаленням N-кінцевих захисних груп забезпечує одержання сполуки (ііі). Приклади підходящих захисних груп (PG) включають, необмежуючись, ацильні захисні групи, наприклад, форміл, ацетил (Ac), сукциніл (Suc) і метоксисукциніл; та уретанові захисні групи, наприклад, трет-бутоксикарбоніл (Вос), бензилоксикарбоніл (Cbz) і флуоренілметоксикарбоніл (Fmoc). Реакцію з'єднання пептиду можна здійснити шляхом попереднього перетворення фрагмента карбонової кислоти в складі сполуки (іі) в активований складний ефір, наприклад, O-(Nгідроксисукцинімідний) ефір з наступною обробкою сполукою (і). Як альтернатива, активований ефір можна одержати in situ шляхом приведення карбонової кислоти в контакт із агентом, що застосовується в реакції з'єднання пептиду. Приклади підходящих агентів, що застосовуються в реакції з'єднання пептиду, включають, необмежуючись, карбодиімідні агенти, наприклад, дициклогексилкарбодиімід (DCC) або 1-(3-диметиламінопропіл)3-етилкарбодиімід (EDC); фосфонієві агенти, наприклад, гексафторфосфат бензотриазол-1ілокситрис(диметиламіно)фосфонію (ВОР); і уронієві агенти, наприклад, тетрафторборат О-(1Нбензотриазол-1-іл)-N,N,N’,N’-тетраметилуронію (TBTU). Потім проводили реакцію з'єднання сполуки (ііі) із заміщеною бензойною кислотою (ArCO2H) з одержанням сполуки (iv). Умови проведення реакції з'єднання пептиду, описані вище для реакції з'єднання сполук (і) і (іі), також підходять для проведення реакції з'єднання сполуки (ііі) з ArCO2H. Видалення захисних груп із фрагмента боронової кислоти потім призводить до утворення сполуки (v). Етап видалення захисних груп переважно здійснюють шляхом переетерифікації у двофазній суміші, що містить бороновий ефір (iv), органічний акцептор боронової кислоти, нижчий алканол, С5-8 вуглеводневий розчинник та водну мінеральну кислоту. 15 1. умови проведення реакції з'єднання пептиду 2. видалення захисних груп умови проведення реакції з'єднання пептиду водн. HCl гексан Як альтернатива, черговість проведення реакцій з'єднання можна обернути, як показано на Схемі 2. Таким чином, О-захищений гліцин (vi) спочатку піддають з'єднанню із заміщеною бензойною кислотою (ArCO2H), а потім ефір гідролізують з одержанням сполуки (vii). Потім проводять реакцію з'єднання із сполукою (і) і видалення захисних груп з боронової кислоти, як описано вище для Схеми 1, з одержанням сполуки (v). Застосування, композиції та введення У даному винаході запропоновані сполуки, які являють собою ефективні інгібітори протеасоми. Зазначені сполуки можна досліджувати in vitro або in vivo з метою оцінки їх здатності інгібувати опосередковувані протеасомами гідроліз пептидів або розкладання білків. Таким чином, відповідно до іншого аспекту, у даному винаході запропонований спосіб інгібування одного або більше видів пептидазної активності протеасоми в клітині, що включає приведення клітини, у якій потрібне інгібування протеасом, у контакт із сполукою згідно із даним винаходом або фармацевтично прийнятною сіллю, бороновим ефіром або бороновим ангідридом зазначеної сполуки. У даному винаході також запропонований спосіб інгібування проліферації клітин, що включає приведення клітини, у якій потрібне забезпечення такого інгібування, у контакт із сполукою, запропонованою у даному винаході. Вираз "інгібування 97536 16 проліферації клітин" застосовується для того, щоб позначити здатність сполуки згідно із даним винаходом зменшувати кількість клітин або придушувати ріст контактуючих із зазначеною сполукою клітин у порівнянні із клітинами, що не контактують із зазначеним інгібітором. Оцінку проліферації клітин можна здійснити шляхом підрахунку кількості клітин із застосуванням пристрою для підрахунку клітин, або в ході дослідження виживаності клітин, наприклад, дослідження MTT або WST. У випадку, коли клітини перебувають у стадії безперервного росту (наприклад, у солідній пухлині або органі), таку оцінку проліферації клітин можна здійснити за допомогою вимірювання росту, наприклад, штангенциркулем, і порівняння масштабу росту контактуючих клітин з ростом неконтактуючих клітин. Переважно, ріст клітин, що контактують з інгібітором, уповільнюється на щонайменше приблизно 50% у порівнянні з ростом неконтактуючих клітин. У різних варіантах реалізації, проліферація контактуючих клітин придушувалася на щонайменше приблизно 75%, щонайменше приблизно 90% або щонайменше приблизно 95% у порівнянні з неконтактуючими клітинами. У деяких варіантах реалізації, вираз "придушення проліферації клітин" включає зменшення кількості контактуючих клітин у порівнянні з кількістю неконтактуючих клітин. Таким чином, інгібітор протеасом, що інгібує проліферацію контактуючих клітин, може індукувати уповільнення росту контактуючих клітин, зупинку росту, запрограмовану загибель клітин (тобто апоптоз), або некротичну загибель клітин. В іншому аспекті даного винаходу запропонована фармацевтична композиція, що містить сполуку формули (1) або фармацевтично прийнятну сіль або бороновий ангідрид зазначеної сполуки й фармацевтично прийнятний носій. 17 Якщо в даних композиціях застосовують фармацевтично прийнятну сіль сполуки згідно із даним винаходом, зазначену сіль переважно одержують з неорганічної або органічної кислоти або основи. Для огляду підходящих солей, див., наприклад, Berge et al, /. Pharm. Sci. 66:1-19 (1977) і Remington: The Science and Practice of Pharmacy, 20th Ed.ed. A. Gennaro, Lippincott Williams & Wilkins, 2000. Необмежуючі приклади підходящих солей приєднання кислоти включають наступні: ацетат, адипат, альгінат, аспартат, бензоат, бензосульфонат, бісульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропіонат, диглюконат, додецилсульфат, етансульфонат, фумарат, глюкогептаноат, гліцерофосфат, гемісульфат, гептаноат, гексаноат, гідрохлорид, гідробромід, гідройодид, 2-гідроксиетансульфонат, лактат, малеат, метансульфонат, 2-нафталінсульфонат, нікотинат, оксалат, памоат, пектинат, персульфат, 3фенілпропіонат, пікрат, півалат, пропіонат, сукцинат, тартрат, тіоціонат, тозилат й ундеканоат. Підходящі солі приєднання основи включають, необмежуючись, солі амонію, солі лужних металів, такі як солі літію, натрію й калію; солі лужноземельних металів, такі як солі кальцію й магнію; інші солі багатовалентних металів, такі як солі цинку; солі з органічними основами, такими як дициклогексиламін, N-метил-D-глюкамін, третбутиламін, етилендіамін, етаноламін і холін; і солі з амінокислотами, такими як аргінін, лізин тощо. У деяких варіантах реалізації фармацевтично прийнятна сіль являє собою сіль приєднання основи 1 до боронової кислоти формули (І), де кожен з Z і 2 Z являє собою гідроксил. Термін "фармацевтично прийнятний носій" у даному описі стосується матеріалу, який сумісний із суб'єктом-реципієнтом, переважно ссавцем, більш переважно людиною, і є підходящим для доставки активного агента до заданого місця, при цьому не обмежуючи активність зазначеного агента. Токсичність або небажані ефекти, при наявності як таких, пов'язані з носієм, переважно співрозмірні з прийнятним співвідношенням ризик/користь для передбачуваного застосування зазначеного активного агента. Терміни "носій", "ад'ювант" або "середовище" у даному описі використовуються взаємозамінюючи один одного, та включають всі й кожен з розчинників, розріджувачів та інших рідких носіїв, диспергуючих або суспендуючих засобів, поверхнево-активних речовин, модифікаторів рН, ізотонічних агентів, загусників або емульгаторів, консервантів, твердих зв'язуючих речовин, змащувальних речовин тощо, які підходять для конкретної бажаної дозованої форми. В Remington: The Science and Practice of Pharmacy, 20th Ed. ed. A. Gennaro, Iippincott Williams & Wilkins, 2000 описані різні носії, що застосовуються для приготування фармацевтично прийнятних композицій, і відомі методики їхнього одержання. За винятком випадків, коли яке-небудь традиційно застосовуване середовище-носій не сумісне із сполуками згідно із даним винаходом, наприклад, викликає яку-небудь небажану біологічну дію або іншим чином неспри 97536 18 ятливо взаємодіє з будь-яким іншим компонентом(ами) фармацевтично прийнятної композиції, застосування середовища-носія також знаходиться в рамках даного винаходу. Деякі приклади матеріалів, які можуть виступати як фармацевтично прийнятні носії, включають, але не обмежені перерахованими, іонообмінні речовини, окис алюмінію, стеарат алюмінію, лецитин, сироваткові білки, такі як людський сироватковий альбумін, буферні речовини, такі як фосфати, карбонати, гідроксид магнію й гідроксид алюмінію, гліцин, сорбінова кислота або сорбат калію, суміші неповних гліцеридів насичених рослинних жирних кислот, вода, апірогенна вода, солі або електроліти, такі як протамінсульфат, двозаміщений фосфат натрію, двозаміщений фосфат калію, хлорид натрію й солі цинку, колоїдний діоксид кремнію, трисилікат магнію, полівінілпіролідон, поліакрилати, воски, блоксополімери поліетилен-поліоксипропілен, ланолін, цукри, такі як лактоза, глюкоза, сахароза й манніт, крохмалі, такі як кукурудзяний крохмаль і картопляний крохмаль, целюлоза та її похідні, такі як натрійкарбоксиметилцелюлоза, етилцелюлоза й ацетат целюлози, порошкоподібний трагакант; солод, желатин, тальк, наповнювачі, такі як олія какао й воски для супозиторіїв, олії, такі як арахісова олія, бавовняна олія, сафлорова олія, кунжутна олія, маслинова олія, кукурудзяна олія й соєва олія, гліколі, такі як пропіленгліколь і поліетиленгліколь, ефіри, такі як етилолеат й етиллаурат, агар, альгінова кислота, ізотонічний сольовий розчин, розчин Рінгера, спирти, такі як етанол, ізопропіловий спирт, гексадециловий спирт і гліцерин, циклодекстрини, такі як гідроксипропіл-циклодекстрин і сульфобутиловий ефір циклодекстрину, змащувальні речовини, такі як лаурилсульфат натрію й стеарат магнію, нафтові вуглеводні, такі як мінеральна олія й петролатум. Барвники, вивільняючі агенти, глазуровочні агенти, підсолоджувачі, смакові добавки й ароматизатори, консерванти й антиоксиданти також можуть бути присутніми у композиції, на розсуд фахівця, відповідального за приготування композиції. Фармацевтичні композиції згідно із даним винаходом можна одержати за допомогою способів, добре відомих у даній галузі техніки, таких як, серед інших, традиційні процеси гранулювання, змішування, розчинення, інкапсулювання, ліофілізування або емульгування. Композиції можна одержати в різних формах, включаючи гранули, преципітати або тверді частинки, порошки, включаючи порошки, одержані за допомогою сублімації, сушіння в барабанній сушарці або сушіння розпиленням, аморфні порошки, таблетки, капсули, сироп, супозиторії, ін'єкції, емульсії, еліксири, суспензії або розчини. Відповідно до переважного варіанта реалізації, композиції згідно із даним винаходом приготовані для фармацевтичного введення ссавцеві, переважно людині. Такі фармацевтичні композиції згідно із даним винаходом можна вводити перорально, парентерально, шляхом інгаляційного розпилення, топічно, ректально, назально, буккально, вагінально або за допомогою імплантованої ємності. Термін "парентеральний" у даному описі вклю 19 чає методи підшкірної, внутрівенної, внутрім'язової, внутрісуглобної, внутрісиновіальної, внутрістернальної, інтратекальної, внутріпечіночної, усередину уражених тканин й інтракраніальної ін'єкції або інфузії. Переважно, композиції вводять перорально, внутрівенно або підшкірно. Композиції згідно із даним винаходом можуть бути розроблені таким чином, щоб зазначені композиції були швидкодіючими, являли собою композиції з швидким вивільненням або композиції пролонгованої дії. Крім того, сполуки можна вводити місцевими, а не системними засобами, як, наприклад, за допомогою введення (наприклад, шляхом ін'єкції) у місце локалізації пухлини. Рідкі дозовані форми для перорального введення включають, але не обмежені перерахованими, фармацевтично прийнятні емульсії, мікроемульсії, розчини, суспензії, сиропи й еліксири. Крім активних сполук, зазначені рідкі лікарські форми можуть містити інертні розріджувачі, широко використовувані в даній галузі техніки, такі як, наприклад, вода або інші розчинники, солюбілізуючі агенти й емульгатори, такі як етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, циклодекстрини, диметилформамід, олії (зокрема, бавовняна, арахісова, кукурудзяна, зародкова, оливкова, касторова й кунжутна олія), гліцерин, тетрагідрофурфуриловий спирт, поліетиленгліколі й ефіри сорбітану й жирних кислот, і суміші зазначених речовин. Крім інертних розріджувачів композиції для перорального прийому також можуть включати ад'юванти, такі як змочувальні агенти, емульгуючі й суспендуючі агенти, підсолоджувачі, смакові добавки й ароматизатори. Ін'єкуємі препарати, наприклад, стерильні ін'єкуємі водні або олійні суспензії, можуть бути приготовані за способами, відомими у даній галузі техніки, із застосуванням підходящих диспергуючих або змочувальних агентів і суспендуючих агентів. Стерильний ін'єкуємий препарат також може являти собою стерильний ін'єкуємий розчин, суспензію або емульсію в нетоксичному підходящому для парентерального введення розріджувачі або розчиннику, наприклад, розчин в 1,3бутандіолі. У число підходящих носіїв і розчинників, які можна застосовувати, входять вода, розчин Рінгера, носії й розчинники відповідно до Фармакопеї США та ізотонічний розчин хлориду натрію. Крім того, стерильні нелетучі олії зазвичай застосовують як розчинник або суспендуюче середовище. Для цієї мети можна застосовувати будь-яку несмачну нелетучу олію, включаючи синтетичні моно- або дигліцериди. Крім того, жирні кислоти, такі як олеїнова кислота, застосовують для одержання ін'єкуємих композицій. Ін'єкуємі композиції можна стерилізувати, наприклад, шляхом фільтрування через утримуючий бактерії фільтр або шляхом введення стерилізуючи агентів у виді стерильних твердих композицій, які можна розчинити або диспергувати у стерильній воді або іншому стерильному ін'єкуємому середовищі перед застосуванням. Композиції, приготовані для парентерального введення, можна вводити шляхом болюс 97536 20 ної ін'єкції або шляхом введення через певні інтервали часу, або шляхом безперервної інфузії. Тверді дозовані форми для перорального введення включають капсули, таблетки, пігулки, порошки й гранули. У таких твердих дозованих формах активна сполука змішана із щонайменше одною інертною фармацевтично прийнятною допоміжною речовиною або носієм, таким як цитрат натрію або дикальційфосфат, та/або а) наповнювачами або розріджувачами, такими як крохмалі, лактоза, сахароза, глюкоза, манніт і кремнієва кислота, b) зв'язувальними речовинами, такими як, наприклад, карбоксиметилцелюлоза, альгінати, желатин, полівінілпіролідинон, сахароза й камедь, с) зволожувачами, такими як гліцерин, d) дезинтегруючими агентами, такими як агар-агар, карбонат кальцію, картопляний або маніоковий крохмаль, альгінова кислота, деякі силікати й карбонат натрію, е) агентами, що уповільнюють розчинення, такими як парафін, f) підсилювачами абсорбції, такими як сполуки четвертинного амонію, г) змочувальними агентами, такими як, наприклад, цетиловий спирт і гліцеролмоностеарат, h) абсорбентами, такими як каолін і бентонітова глина, та і) змащувальними речовинами, такими як тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію, і сумішами зазначених речовин. У випадку капсул, таблеток і пігулок, дозована форма також може містити буферні речовини, такі як фосфати або карбонати. Тверді композиції аналогічного типу також можна застосовувати як наповнювачі в м'якій і твердій желатиновій капсулах, використовуючи такі допоміжні речовини, як лактоза або молочний цукор, а також високомолекулярні поліетиленгліколі тощо. Тверді дозовані форми у виді таблеток, драже, капсул, пігулок і гранул можна одержати з покриттями й оболонками, такими як ентеросолюбільні покриття й інші покриття, добре відомі в галузі фармацевтики. Такі дозовані форми можуть містити замутнювальні агенти й також можуть мати склад, що забезпечує вивільнення діючого інгредієнта(ів) винятково, або переважно, у певних відділах кишечнику, при цьому зазначене вивільнення може бути уповільненим. Приклади інкапсулюючих композицій, які можна застосовувати, включають полімерні речовини й воски. Тверді композиції аналогічного типу також можна застосовувати як наповнювачі в м'якій і твердій желатиновій капсулах, використовуючи такі допоміжні речовини, як лактоза або молочний цукор, а також високомолекулярні поліетиленгліколі тощо. Активні сполуки також можуть перебувати в мікроінкапсульованій формі разом з однією або більше допоміжними речовинами, як зазначалося вище. Тверді дозовані форми у виді таблеток, драже, капсул, пігулок і гранул можна одержати з покриттями й оболонками, такими як ентеросолюбільні покриття, покриття, що забезпечують контрольоване вивільнення, й інші покриття, добре відомі в галузі фармацевтики. У таких твердих дозованих формах активна сполука може перебувати в суміші із щонайменше одним інертним розріджувачем, таким як сахароза, лактоза або крохмаль. Такі дозовані форми також можуть містити, 21 як й у звичайній практиці, додаткові речовини, відмінні від інертних розріджувачів, наприклад, змащувальні речовини для таблетування й інші допоміжні засоби для таблетування, такі як стеарат магнію й мікрокристалічна целюлоза. У випадку капсул, таблеток і пігулок, дозовані форми також можуть включати буферні речовини. Такі дозовані форми можуть містити замутнювальні агенти й також можуть мати склад, що забезпечує вивільнення діючого інгредієнта(ів) винятково, або переважно, у певних відділах кишечнику, при цьому зазначене вивільнення може бути уповільненим. Приклади інкапсулюючих композицій, які можна застосовувати, включають полімерні речовини й воски. Дозовані форми для топічного або трансдермального введення сполуки згідно із даним винаходом включають мазі, пасти, креми, лосьйони, гелі, порошки, розчини, спреї, засоби для інгаляції або пластири. Активний компонент змішують у стерильних умовах з фармацевтично прийнятним носієм і будь-якими необхідними консервантами або буферами, застосування яких може вимагатися. Офтальмічні композиції, вушні краплі й краплі для очей також знаходяться у рамках даного винаходу. Додатково, даний винахід включає застосування трансдермальних пластирів, які мають додаткову перевагу у виді забезпечення контрольованої доставки сполуки в організм. Такі дозовані форми можна одержати шляхом розчинення або розподілу зазначеної сполуки в підходящому середовищі. Підсилювачі усмоктування також можна застосовувати для підвищення проникнення сполуки через шкіру. Швидкість можна контролювати або шляхом забезпечення контролюючої швидкість мембрани, або шляхом диспергування сполуки в полімерній матриці або гелі. У деяких варіантах реалізації сполуку формули (І) вводять внутрівенно. У таких варіантах реа1 2 лізації сполуку формули (І), де Z й Z разом утворюють фрагмент, що являє собою похідне комплексутворюючого агента на основі боронової кислоти, можна одержати у виді ліофілізованого порошку, як описано вище. Вологовміст ліофілізованого порошку переважно відновлюють шляхом додавання водного розчинника, що підходить для фармацевтичного введення. Приклади підходящих для відновлення вологовмісту розчинників включають, необмежуючись, воду, сольовий розчин і фосфатно-сольовий буферний розчин (ФБР). Переважно, вологовміст ліофілізованого порошку відновлюють нормальним (0.9%) фізіологічним розчином. Після відновлення вологовмісту встановлюється рівновага між боронатним ефіром і відповідною вільною бороновою кислотою. У деяких варіантах реалізації рівновага досягається швидко, наприклад, протягом 10-15 хвилин після додавання водного середовища. Відносні концентрації боронатного ефіру й боронової кислоти, що знаходяться в рівновазі, залежать від таких параметрів, як, наприклад, рН розчину, температура, природа комплексутворюючого агента на основі боронової кислоти й відношення вмісту комплексутворюючого агента на основі боронової кислоти до вмісту боронатного ефіру, що присутній в ліофілі 97536 22 зованому порошку. Фармацевтичні композиції згідно із даним винаходом переважно готують для введення пацієнтові, що має підвищений ризик розвитку або рецидиву опосередковуваного протеасомами розладу або страждаючим зазначеним розладом. Термін "пацієнт" у даному описі означає тварина, переважно ссавець, більш переважно людина. Переважними фармацевтичними композиціями згідно із даним винаходом є композиції, приготовані для перорального, внутрівенного або підшкірного введення. Проте, кожна із зазначених вище дозованих форм, що містить терапевтично ефективну кількість сполуки згідно із даним винаходом, може бути одержана за допомогою проведення звичайних експериментів й, отже, знаходиться в рамках даного винаходу. У деяких варіантах реалізації фармацевтична композиція згідно із даним винаходом може додатково містити інший терапевтичний агент. У деяких варіантах реалізації такий інший терапевтичний агент являє собою агент, що зазвичай вводять пацієнтам із захворюванням або патологічним станом, що піддають лікуванню. Під "терапевтично ефективною кількістю" мають на увазі кількість, достатню для того, щоб викликати помітне зниження активності протеасом або ваги опосередковуваного протеасомами розладу. Необхідна кількість інгібітору протеасом буде залежати від ефективності зазначеного інгібітору відносно даного типу клітин і періоду часу, необхідного для лікування розладу. Також є очевидним, що конкретне дозування й схема лікування для будь-якого конкретного пацієнта буде залежати від цілого ряду факторів, включаючи активність конкретної застосовуваної сполуки, вік, масу тіла, загальний стан здоров'я, стать і режим харчування пацієнта, тривалість введення, швидкість виведення, комбінації лікарських препаратів, думку лікаря й тяжкість конкретного захворювання, що піддається лікуванню. Кількість додаткового терапевтичного агента, присутнього у композиції згідно із даним винаходом, зазвичай не перевищує кількості, яку зазвичай вводять у композиції, що містить цей терапевтичний агент як єдиний активний агент. Переважно, кількість додаткового терапевтичного агента знаходиться в діапазоні від приблизно 50% до приблизно 100% від кількості, зазвичай присутньої в композиції, що містить цей агент як єдиний терапевтично активний агент. В іншому аспекті даного винаходу запропонований спосіб лікування пацієнта, що має підвищений ризик розвитку або рецидиву опосередковуваного протеасомами розладу або страждаючого від зазначеного розладу. У даному описі термін "опосередковуваний протеасомами розлад" включає будь-який розлад, захворювання або патологічний стан, що викликається або характеризується підвищеною експресією або активністю протеасом або, що потребує активності протеасом. Термін "опосередковуваний протеасомами розлад" також включає будь-який розлад, захворювання або патологічний стан, при якому інгібування активності протеасом забезпечує позитивний ефект. Наприклад, сполуки й фармацевтичні композиції згідно із даним винаходом підходять для лі 23 кування розладів, опосередковуваних білками (наКip WAF/CIP1 приклад, NFB, р27 , p21 , р53), які регулюються активністю протеасом. Такі розлади включають запальні розлади (наприклад, ревматоїдний артрит, запальне захворювання кишечнику, астму, хронічне обструктивне захворювання легень (COPD), остеоартрит, дерматоз (наприклад, атопічний дерматит, псоріаз)), судинні проліферативні розлади (наприклад, атеросклероз, рестеноз), офтальмологічні проліферативні розлади (наприклад, діабетичну ретинопатію), доброякісні проліферативні розлади (наприклад, гемангіому), аутоімунні захворювання (наприклад, множинний склероз, відторгнення тканин й органів), а також запалення, пов'язане з інфекцією (наприклад, імунні реакції), нейродегенеративні розлади (наприклад, хворобу Альцгеймера, хворобу Паркінсона, захворювання рухових нейронів, невропатичний біль, розлади, пов'язані із триплетними повторами, астроцитому й нейродегенерацію в результаті алкогольної хвороби печінки), ішемічне ушкодження (наприклад, інсульт), і кахексію (наприклад, прискорений розпад білка м'язів, що супроводжує різні фізіологічні й патологічні стани (наприклад, ушкодження нерва, голодування, лихоманку, ацидоз, ВІЛ-інфекцію, ракове захворювання й деякі ендокринопатії)). Сполуки й фармацевтичні композиції згідно із даним винаходом особливо підходять для лікування раку. У даному описі, термін "рак" стосується клітинного розладу, що характеризується неконтрольованою або розрегульованою проліферацією клітин, зниженим клітинним диференціюванням, патологічною здатністю проникати в навколишні тканини та/або здатністю викликати новий ріст в ектопічних ділянках. Термін "рак" включає, але не обмежений перерахованими, солідні пухлини й гемопоетичні пухлини. Термін "рак" також включає захворювання шкіри, тканин, органів, кості, хряща, крові й судин. Крім того, термін "рак" включає первинні й метастатичні ракові захворювання. Необмежуючі приклади солідних пухлин, які можна лікувати за допомогою запропонованих інгібіторів протеасом, включають рак підшлункової залози; рак сечового міхура; колоректальний рак; рак молочної залози, включаючи метастатичний рак молочної залози; рак передміхурової залози, включаючи андроген-залежний й андрогеннезалежний рак передміхурової залози; рак нирки, включаючи, наприклад, метастатичний світлоклітинний рак; гепатоцелюлярний рак; рак легень, включаючи, наприклад, недрібноклітинний рак легень (NSCLC), бронхіолоальвеолярну карциному (ВАС) і аденокарциному легень; рак яєчників, включаючи, наприклад, прогресуючий епітеліальний або первинний рак черева; рак шийки матки; рак ШКТ; рак стравоходу; рак голови й шиї, включаючи, наприклад, плоскоклітинну карциному голови й шиї; меланому; нейроендокринний рак, включаючи метастатичні нейроендокринні пухлини; пухлини мозку, включаючи, наприклад, гліому, анапластичну олігодендрогліому, мультиформну гліобластому в дорослих й анапластичну астроцитому в дорослих; рак кістки; і саркому м'яких тка 97536 24 нин. Необмежуючі приклади гематологічних злоякісних новоутворень, які можна лікувати за допомогою запропонованих інгібіторів протеасом, включають гостру мієлоїдну лейкемію (AML); хронічну мієлогенну лейкемію (CML), включаючи CML у фазі акселерації й CML у фазі бластів (CML-BP); гостру лімфобластну лейкемію (ALL); хронічну лімфоцитарну лейкемію (CLL); хворобу Ходжкіна (HD); неходжкінську лімфому (NHL), включаючи фолікулярну лімфому й лімфому із клітин мантійної зони; В-клітинну лімфому; Т-клітинну лімфому; множинну мієлому (MM); макроглобулінемію Вальденстрема; мієлодиспластичні синдроми (MDS), включаючи рефрактерну анемію (RA), рефрактерну анемію з кільцевими сидеробластами (RARS), (рефракторну анемію з підвищеним вмістом бластів (RAEB) та RAEB із трансформацією (RAEB-T); і мієлопроліферативні синдроми. У деяких варіантах реалізації сполуку або композицію згідно із даним винаходом застосовують для лікування пацієнта, що має підвищений ризик розвитку або рецидиву або страждаючого від ракового захворювання, обраного із групи, що складається із множинної мієломи й лімфоми з клітин мантійної зони. У деяких варіантах реалізації інгібітор протеасом згідно із даним винаходом вводять у поєднанні з іншим терапевтичним агентом. Інший терапевтичний агент також може інгібувати протеасоми або може діяти за іншим механізмом. У деяких варіантах реалізації зазначений інший терапевтичний агент являє собою агент, який зазвичай вводять пацієнтам з даним захворюванням або патологічним станом, що піддають лікуванню. Інгібітор протеасом згідно із даним винаходом можна вводити разом з іншим терапевтичним агентом у складі однієї дозованої форми або у виді окремої дозованої форми. При введенні у виді окремої дозованої форми зазначений інший терапевтичний агент можна вводити перед введенням, одночасно або після введення інгібітору протеасом згідно із даним винаходом. У деяких варіантах реалізації інгібітор протеасом формули (І) вводять у поєднанні з протираковим агентом. У даному описі термін "протираковий агент" стосується будь-якого агента, який вводять суб'єктові з раковим захворюванням для лікування зазначеного ракового захворювання. Необмежуючі приклади ушкоджуючих ДНК хіміотерапевтичних агентів включають інгібітори топоізомерази І (наприклад, іринотекан, топотекан, камптотецин та їх аналоги або метаболіти, і доксорубіцин); інгібітори топоізомерази II (наприклад, етопозид, теніпозид і даунорубіцин); алкілуючі агенти (наприклад, мелфалан, хлорамбуцил, бусульфан, тіотепа, іфосфамід, кармустин, ломустин, семустин, стрептозоцин, декарбазин, метотрексат, мітоміцин C і циклофосфамід); ДНКінтеркалятори (наприклад, цисплатин, оксаліплатин і карбоплатин); ДНК-інтеркалятори й джерела вільних радикалів, такі як блеоміцин; і міметики нуклеозидів (наприклад, 5-фторурацил, капецитабін, гемцитабін, флударабін, цитарабін, меркаптопурин, тіогуанін, пентостатин і гідроксисечовина). 25 97536 Хіміотерапевтичні агенти, які порушують реплікацію клітини, включають: паклітаксел, доцетаксел і родинні аналоги; вінкристин, вінбластин і родинні аналоги; талідомід, леналідомід і родинні аналоги (наприклад, СС-5013 й СС-4047); інгібітори протеїн-тирозинкіназ (наприклад, мезилат іматинібу й гефітиніб); інгібітори протеасом (наприклад, бортезоміб); інгібітори NF-B, включаючи інгібітори IB-кінази; антитіла, які зв'язуються з білками, надлишкова експресія яких має місце при ракових захворюваннях, і тим самим знижують реплікацію клітин (наприклад, трастузумаб, ритуксімаб, цетуксімаб і бевацизумаб); й інші інгібітори білків або ферментів, підвищена регуляція, надлишкова експресія або активація яких має місце при ракових захворюваннях, інгібування яких знижує реплікацію клітин. Для більш повного розуміння даного винаходу далі наведені наступні приклади одержання й проведення досліджень. Ці приклади ілюструють одержання або дослідження конкретних сполук і ні в якому разі не обмежують даний винахід. Приклади Скорочення Час [хв] 0,0 3,5 4,9 5,0 26 DCM - метиленхлорид DIEA - диізопропілетиламін EDCI - гідрохлорид N-(3-диметиламінопропіл)N’-етилкарбодиіміду EtOAc - етилацетат год. - години ВЕРХ - високоефективна рідинна хроматографія TBTU - тетрафторборат орто-бензотриазол-1іл-N,N,N',N'-тетраметилуронію HOBt - гідрат 1-гідроксибензтриазолу PX-MC - рідинна хроматографія - масспектрометрія хв. - хвилини tr - час утримання із спектрів діодної матриці Аналітичні методи PX-MC Спектри одержували на колонці Symmetry Cl8 - 3,5 мкм - 4,6 х 50 мм, використовуючи наступний градієнт: Розчинник А: 2% ізопропілового спирту, 98% води, 10 мМ NH4OAc Розчинник В: 75% ацетонітрилу, 25% метанолу, 10 мМ NH4OAc Витрата [мл/хв] 1,0 1,0 1,0 1,0 % розчинника В 5,0 100,0 100,0 5,0 Приклад 1: Синтез [(1R)-1-({[(2,3дифторбензоїл)аміно]ацетил}аміно)-3 метилбутил)боронової кислоти • 20 D-манніту (I-1) метанол D-манніт • 20 D-манніт Етап 1: метил[(2,3дифторбензоїл)аміно]ацетат До розчину 2,3-дифторбензойної кислоти (0,190 г, 1,2 ммоль) у тетрагідрофурані (5 мл) додавали гідрохлорид складного гліцинметилового ефіру (0,150 г, 1,2 ммоль), HOBt (0,162 г, 1,2 ммоль), DIEA (0,209 мл, 1,2 ммоль) і EDCI (0,252 г, 1,3 ммоль). Реакційну суміш залишали перемішуватися протягом ночі. Реакційну суміш гасили насиченим розчином бікарбонату натрію і розділяли продукт у DCM. Відділення органічного шару, а потім видалення розчинника дозволяло одержати метил[(2,3-дифторбензоїл)аміно]ацетат, який використовували на наступному етапі без очищення. Етап 2: [(2,3-дифторбензоїл)аміно] оцтова кислота До розчину метил[(2,3 27 97536 28 дифторбензоїл)аміно]ацетату (0,250 г, 1,1 ммоль) у метанолі (7 мл) додавали гідроксид літію (0,053 г, 2,2 ммоль) і воду (3 мл). Реакційну суміш залишали перемішуватися протягом ночі. Суміш розбавляли водою (20 мл) і підкислювали 1N HCl (5 мл). Продукт розділяли в DCM/метанолі (4:1). Органічний шар сушили над сульфатом натрію і розчинник видаляли з одержанням [(2,3дифторбензоїл)аміно]оцтової кислоти, яку використовували на наступному етапі без очищення. Етап 3: 2,3-дифтор-N-[2-({(1R)-3-метил-1[(3aR,4R,6R,7aS)-3a,5,5-триметилгексагідро-4,6метан-1,3,2-бензодіоксаборол-2-іл]бутил}аміно)-2оксоетилібензамід До розчину [(2,3-дифторбензоїл)аміно]оцтової кислоти (0,205 г, 0,95 ммоль) у диметилформаміді (10 мл) додавали TBTU (0,337 г, 1,0 ммоль) і (1R)3-метил-1-[(3аS,4S,6S,7аR)-3а,5,5триметилгексагідро-4,6-метан-1,3,2бензодіоксаборол-2-іл]бутан-1-амін у виді трифторацетатної солі (0,362 г, 0,95 ммоль). Суміш залишали охолоджуватися до 0°С і додавали по краплях DIEA (0,498 мл, 2,9 ммоль). Реакційну суміш залишали для нагрівання до кімнатної температури й перемішували протягом ночі. Реакцію гасили водою (100 мл) і продукт розділяли в DCM. Органічний шар сушили над сульфатом натрію й видаляли розчинник з одержанням 2,3-дифтop-N-[2({(1R)-3-мeтил-1-[(3aR,4R,6R,7aS)-3a,5,5триметилгексагідро-4,6-метан-1,3,2бензодіоксаборол-2-іл]бутил}аміно)-2оксоетил]бензаміду. Етап 4: [(1R)-1-({(2,3 дифторбензоїл)аміно)ацетил}аміно)-3-метилбутил] боронова кислота До розчину 2,3-дифтop-N-[2-({(1R)-3-мeтил-1[(3aR,4R,6R,7aS)-3a,5,5-триметилгексагідро-4,6метан-1,3,2-бензодіоксаборол-2-іл]бутил}аміно)-2оксоетил]бензаміду (0,536 г, 1,2 ммоль) у метанолі/1N HCl (1:1) (1,5 мл) додавали гептанол (1 мл) й ізобутилборат (0,207 г, 2,0 ммоль). Реакційну суміш залишали перемішуватися протягом ночі. Шар гептанолу відділяли і шар метанол/НСІ концентрували. Неочищений продукт очищали за допомогою ВЕРХ із зверненою фазою з одержанням [(1R)-1({(2,3-дифторбензоїл)аміно)ацетил}аміно)-3метилбутил]боронової кислоти. Етап 5: [(1R)-1-({(2,3дифторбензоїл)аміно)ацетил}аміно)-3метилбутил]боронова кислота • 20 D-манніт (I-1) До розчину [(1R)-1-({(2,3дифторбензоїл)аміно)ацетил}аміно)-3метилбутил]боронової кислоти (0,085 г, 0,26 ммоль) у трет-бутиловому спирті (2 мл) і воді (5 мл) додавали D-манніт (0,943 г, 5,2 ммоль). Розчин нагрівали й залишали перемішуватися до повного розчинення твердих речовин. Розчин потім заморожували й розчинник видаляли шляхом ліофілізації з одержанням [(1R)-1-({(2,3дифторбензоїл)аміно)ацетил}аміно)-3метилбутил]боронової кислоти • 20D-манніту (І-1) (0,98 г, 97 %). Приклад 2: Синтез [(1R)-1-({(2бромбензоїл)аміно)ацетил}аміно)-3метилбутил]боронової кислоти • 20 D-манніту (1-5) у діоксані метанол D-манніт • 20 D-манніт Етап 1: тpeт-бутил-[2-({(1R)-3-мeтил-1[3aS,4S,6S,7aR)-3a,5,5-триметилгексагідро-4,6метан-1,3,2-бензодіоксаборол-2-іл]бутил}аміно)-2оксоетил]карбамат До суміші (1R)-3-метил-1-[(3aS,4S,6S,7aR) 3a,5,5-триметилгексагідро-4,6-метан-1,3,2бензодіоксаборол-2-іл]бутан-1-аміну у виді трифторацетатної солі (4,9 г, 10,8 ммоль), N-•-(третбутоксикарбоніл)гліцину (1,98 г, 11,3 ммоль) і TBTU (3,81 г, 11,9 ммоль) в DCM (100 мл) додавали по краплях протягом 15 хв. розчин DIEA (5,64 мл, 32,4 ммоль) в DCM (25 мл). Реакційну суміш залишали перемішуватися протягом ночі і концентрували. Неочищений продукт очищали за допо 29 могою колонкової хроматографії з одержанням трет-бутил-[2-({(1R)-3-метил-1-[(3аS,4S,6S,7аR)3а,5,5-триметилгексагідро-4,6-метан-1,3,2бензодіоксаборол-2-іл]бутил}аміно)-2оксоетил]карбамату (2,5 г, 55 %). Етап 2: 2-аміно-N-[(1R)-3-метил-1[(3аS,4S,6S,7аR)-3а,5,5-триметилгексагідро-4,6метан-1,3,2-бензодіоксаборол-2-іл]бутил}ацетамід До розчину трет-бутил-[2-({(1R)-3-метил-1[(3аS,4S,6S,7аR)-3а,5,5-триметилгексагідро-4,6метан-1,3,2-бензодіоксаборол-2-іл]бутил}аміно)-2оксоетил]карбамату (2,5 г, 5,9 ммоль) в DCM (15 мл) додавали 4М HCl у діоксані (5,9 мл ). Реакційну суміш залишали перемішуватися протягом 2 год. і концентрували з одержанням 2-аміно-N-[(1R)-3метил-1-[(3aS,4S,6S,7aR)-3a,5,5триметилгексагідро-4,6-метан-1,3,2бензодіоксаборол-2-іл] бутил} ацетаміду, який використовували на наступному етапі без очищення. Етап 3: 2-бром-N-[2-({(1R)-3-метил-1[(3а8,4S,6S,7аR)-3а,5,5-триметилгексагідро-4,6метан-1,3,2-бензодіоксаборол-2-іл]бутил}аміно)-2оксоетил}бензамід До розчину 2-бромбензойної кислоти (0,124 г, 0,62 ммоль) в DCM (2,25 мл) додавали EDCI (0,119 г, 0,62 ммоль), HOBt (0,084 г, 0,62 ммоль), N-метилморфолін (0,185 мл, 1,68 ммоль) і 2-аміноN-[(1R)-3-метил-1-[(3aS,4S,6S,7aR)-3a,5,5триметилгексагідро-4,6-метан-1,3,2бензодіоксаборол-2-іл]бутил}ацетамід (0,2 г, 0,56 ммоль). Реакційну суміш залишали перемішуватися протягом 2 год. і концентрували. Осад розбавляли водою й екстрагували EtOAc. Органічні розчини з'єднували, промивали сольовим розчином, сушили над MgSO4, фільтрували й концентрували. Неочищений продукт очищали за допомогою колонкової хроматографії з одержанням 2-бром-N-[2I-1 I-2 I-3 I-4 I-5 I-6 I-7 I-8 I-9 I-10 I-11 I-12 I-13 I-14 I-15 I-16 I-17 I-18 I-19 I-20 I-21 97536 30 ({(1R)-3-метил-1-[(3aS,4S,6S,7aR)-3a,5,5триметилгексагідро-4,6-метан-1,3,2бензодіоксаборол-2-іл]бутил}аміно)-2оксоетил]бензаміду (0,22 г, 78 %). Етап 4: [(1R)-1-({(2бромбензоїл)аміно]ацетил}аміно)-3метилбутил]боронова кислота До розчину 2-бром-N-[2-({(1R)-3-метил-1[(3aS,4S,6S,7aR)-3a,5,5-триметилгексагідро-4,6метан-1,3,2-бензодіоксаборол-2-іл]бутил}аміно)-2оксоетил]бензаміду (0,220 г, 0,44 ммоль) у метанолі/гексані (1:1) (2,2 мл) додавали 1N HCl (1 мл, 1,0 ммоль) й ізобутилборат (0,078 г, 0,76 ммоль). Реакційну суміш залишали перемішуватися протягом ночі. Реакційну суміш концентрували й очищали за допомогою ВЕРХ зі зверненою фазою з одержанням [(1R)-1-({[(2бромбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти (0,119 г, 73 %). Етап 5: [(1R)-1-({(2бромбензоїл)аміно)ацетил}аміно)-3метилбутил]боронова кислота • 20 D-манніт (I-5) До розчину [(1R)-1-({[(2бромбензоїл)аміно]ацетил}аміно)-3метилбутил]боронової кислоти (0,103 г, 0,28 ммоль) у трет-бутиловому спирті (9 мл) і воді (15 мл) додавали D-манніт (1,01 г, 5,5 ммоль). Розчин нагрівали й залишали перемішуватися до повного розчинення твердих речовин. Розчин потім заморожували й розчинник видаляли шляхом ліофілізації з одержанням [(1R)-1-({(2бромбензоїл)аміно)ацетил}аміно)-3метилбутил]боронової кислоти • 20 D-манніта (I-5) (0,92 г, 84 %). Сполуки в наступній таблиці одержували з підходящих початкових матеріалів способом, аналогічним способу, наведеному в Прикладі 1 або 2: РХ-МС: EP - 327,3, tr = 3,36 хв. РХ-МС: EP - 343,2, tr = 3,62 хв. РХ-МС: EP - 327,3, tr = 3,49 хв. РХ-МС: EP - 327,2, tr = 327 хв. РХ-МС: EP- 369,2, tr = 3,30 хв. 1 Н ЯМР (300 МГц, d4-MeOD) : 7,62 (dd, 1Н), 7,28-7,50 (m, 3Н), 4,19 (s, 2Н), 2,70-2,78 (m, 1Н), 1,57-1,71 (m, 1Н), 1,26-1,40 (m, 2Н) і 0,89 (d, 6Н). РХ-МС: EP - 309,1, tr = 3,14 хв. РХ-МС: EP - 343,2, tr = 3,30 хв. РХ-МС: EP - 309,3, tr = 3,23 хв. РХ-МС: EP - 327,3, tr = 3,49 хв. РХ-МС: EP - 325,2, tr = 3,58 хв. РХ-МС: EP - 359,2, tr = 3,66 хв. 1 Н ЯМР (300 МГц, d4-MeOD) : 7,62 (s, 1H), 7,49 (d, 2Н), 4,23 (s, 2Н), 2,74-2,82 (m, 1H), 1,621,78 (m, 1H), 1,30-1,45 (m, 2Н) і 0,95 (d, 6Н). РХ-МС: EP - 359,2, tr = 3,95 хв. РХ-МС: EP - 309,2, tr = 3,34 хв. РХ-МС: EP - 343,2, tr = 3,44 хв. РХ-МС: EP - 359,2, tr = 3,26 хв. РХ-МС: EP - 325,2, tr = 3,20 хв. РХ-МС: EP - 327,3, tr = 3,39 хв. РХ-МС: EP - 343,2, tr = 3,58 хв. РХ-МС: EP - 325,1, tr = 3,51 хв. РХ-МС: EP - 359,2, tr = 3,54 хв. РХ-МС: EP - 359,2, tr = 3,99 хв. 31 97536 Приклад 2: Дослідження із застосуванням протеасоми 20S До 1 мкл досліджуваної сполуки, розчиненої в ДМСО, в 384-лунковому чорному мікротитраційному планшеті додавали 25 мкл використовуваного в даному дослідженні буфера при 37°С, що містить активатор РА28 людини (Boston Biochem, кінцева концентрація 12 нМ) з Ac-WLA-AMC (5селективний субстрат) (кінцева концентрація 15 мкМ), а потім додавали 25 мкл використовуваного в даному дослідженні буфера при 37°С, що містить 20S протеасоми людини (Boston Biochem, кінцева концентрація 0,25 нМ). Використовуваний у дослідженні буфер містив 20 мМ HEPES, 0,5 мМ EDTA й 0,01% BSA, рН 7,4. За ходом реакції стежили за допомогою планшет-рідера BMG Galaxy (37°C, збудження на 380 нм, випускання на 460 нм, посилення 20). Відсоток інгібування розраховували стосовно контрольних зразків з 0% інгібування (ДМСО) і 100% інгібування (10 мкм бортезоміб). У ході зазначеного дослідження всі сполуки з I1 по I-21 проявляли значення IC50, менші ніж 50 нМ. Приклад 3: Антипроліферативне дослідження HCT-116 (1000) або інші пухлинні клітини в 100 мкл підходящого культурального середовища (McCoy 5А для HCT-116, Invitrogen), доповненого 10% ембріональною бичачою сироваткою (Invitrogen), висівали в лунки 96-лункового планшета для вирощування культури й інкубували протягом ночі при 37°С. Тестуємі сполуки додавали в лунки, і планшети інкубували протягом 96 годин при 37°С. Реагент MTT або WST (10 мкл, Roche) додавали в кожну лунку й інкубували протягом 4 годин при 37°C, як описано у виробника. Для MTT метаболізований барвник солюбілізували протягом ночі відповідно до інструкції виробника (Roche). Оптичну щільність для кожної лунки зчитували при 595 нм (вихідний) і 690 нм (еталон) для MTT й 450 нм для WST, застосовуючи спектрофотометр (Molecular Devices). Для MTT значення оптичної щільності еталона віднімали від значень вихідної довжини хвилі. Відсоток інгібування розраховували, використовуючи значення, одержані для контрольного зразка із ДМСО, прийняті рівними 100%. Приклад 4: Модель пухлинної ефективності in vivo Свіжоодержані дисоційовані HCT-116 (2-5 х 6 10 ) або інші пухлинні клітини в 100 мкл середовища RPMI-1640 (Sigma-Aldrich) асептично ін'єкували в підшкірний простір у правій дорсальній стороні самок голих мишей CD-1 (вік 5-8 тижнів, Charles River), застосовуючи 1 мл голку розміром 26 3/8-ga (Becton Dickinson Ref#309625). Як альте 32 рнатива, деякі ксенотрансплантатні моделі потребують серійного пасирування пухлинних фрагментів. У цих випадках, невеликі фрагменти пухлинної 3 тканини (приблизно 1 мм ) імплантують підшкірно в праву дорсальну сторону анестезованих (3-5% суміш ізофлуран/кисень) мишей C.B-17/SCID (вік 5-8 тижнів, Charles River) через трокар розміром 13-ga (Popper & Sons 7927). Починаючи з 7 дня після інокуляції, пухлини вимірювали двічі на тиждень, використовуючи штангенциркуль. Об'єми пухлини розраховували, використовуючи стандар2 тні процедури (0,5 х (довжина х ширина )). Коли пухлини досягали об'єму, що дорівнює приблизно 3 200 мм , мишей розподіляли випадковим чином на групи лікування й починали давати лікарський препарат. Дозування й графіки визначали для кожного експерименту на основі більш ранніх результатів, одержаних з фармакокінетичних/фармакодинамічних досліджень і досліджень максимально переносимої дози. Контрольна група одержувала середовище без якого-небудь препарату. Зазвичай тестуєму сполуку (100-200 мкл) вводили внутрівенним (голка 27-ga), пероральним (голка для гаважа 20-ga) або підшкірним (голка 27ga) шляхами в різних дозах і за різними графіками. Розмір пухлини й вагу тіла вимірювали двічі на тиждень і дослідження завершували, коли контро3 льні пухлини досягали приблизно 2000 мм . Хоча даний винахід описаний вище із зазначенням деяких деталей, призначених забезпечити ясність і більш повне розуміння винаходу, наведені конкретні варіанти реалізації є ілюстративними й не обмежують даний винахід. Для фахівця в даній галузі техніки після ознайомлення з даним описом є очевидним, що можливі різні зміни за формою й вмістом також знаходяться у рамках даного винаходу, об'єм якого більшою мірою визначається прикладеною формулою винаходу, ніж конкретними варіантами реалізації. Патентна й наукова література, що згадується в даному описі, характеризує відомості, доступні фахівцям у даній галузі техніки. Якщо не зазначене інше, всі технічні й наукові терміни, які використовуються в даному описі, мають значення, які зазвичай передбачаються середнім фахівцем в галузі техніки, до якої відноситься даний винахід. Вміст патентів, заявок на патент і джерел, посилання на які наведені в даному описі, включені цим в даний опис за допомогою посилання тією самою мірою, якби для кожного з таких документів конкретно й окремо було зазначено, що даний документ включений за допомогою посилання. У випадку невідповідностей даний опис, включаючи визначення, буде визначальним. Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProteasome inhibitors
Автори англійськоюOlhava, Edward, J., Danca, Miheala
Назва патенту російськоюИнгибиторы протеасом
Автори російськоюОлхава Эдвард Дж., Данка Михаэла Д.
МПК / Мітки
МПК: A61K 38/05, A61P 29/00, C07F 5/02, C07K 5/06, A61P 35/00, A61K 31/69
Мітки: інгібітори, протеасом
Код посилання
<a href="https://ua.patents.su/16-97536-ingibitori-proteasom.html" target="_blank" rel="follow" title="База патентів України">Інгібітори протеасом</a>
Попередній патент: Лікарський протиепілептичний препарат леветирацетаму у формі таблеток, спосіб його виготовлення та кристалічний склад
Наступний патент: Спосіб переходу геологічного порушення зі зміненою структурою пласта
Випадковий патент: Спосіб експресного виявлення тіоціанату в рідких середовищах












