Спосіб лікування захворювань або порушень, спричинюваних індукованою транскрипційною активністю nf-kb
Формула / Реферат
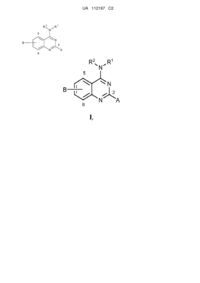
1. Спосіб лікування у ссавця захворювання або порушення, спричинюваного індукованою транскрипційною активністю NF-κΒ у клітинах ссавця, при цьому спосіб включає введення ссавцю сполуки, яка здійснює специфічне інгібування одного або декількох з CDK8 та CDK19, де сполука має структуру
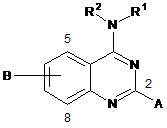 , (I)
, (I)
де
R1 являє собою аралкіл або арил, який може бути заміщеним або незаміщеним;
R2 вибрано з нижчого алкілу та водню;
А вибрано з водню або нижчого алкілу; та
В являє собою ціано.
2. Спосіб за п. 1, який відрізняється тим, що R1 являє собою аралкіл, причому арил являє собою нафтил.
3. Спосіб за п. 1 або п. 2, який відрізняється тим, що R1 являє собою аралкіл, який може бути незаміщеним, монозаміщеним або дизаміщеним одним або декількома з нижчого алкілу, О-нижчого алкілу, NO2, галогену, ацетамідо, диметиламідо та аміно.
4. Спосіб за п. 1, який відрізняється тим, що захворювання являє собою запальне захворювання.
5. Спосіб за п. 4, який відрізняється тим, що запальне захворювання вибране з групи, яка включає астму, запальне захворювання кишечнику та ревматоїдний артрит.
6. Спосіб за п. 4, який відрізняється тим, що запальне захворювання кишечнику являє собою хворобу Крона або неспецифічний виразковий коліт.
Текст
Реферат: Даний винахід забезпечує спосіб лікування у ссавця захворювання або порушення, спричинюваного індукованою транскрипційною активністю NF-kB у клітинах ссавця, при цьому спосіб включає введення ссавцю сполуки, яка здійснює специфічне інгібування одного або декількох з CDK8 та CDK19, де сполука має структуру UA 112197 C2 (12) UA 112197 C2 R 2 N R 1 5 N B 2 N 8 A . UA 112197 C2 5 10 15 20 25 30 35 40 45 50 55 60 Передумови винаходу Галузь винаходу Даний винахід стосується лікування захворювань або порушень, спричинюваних індукованою транскрипційною активністю NF-κВ. Рівень техніки Фактори транскрипції з родини ядерного фактора κВ (NF-κB), що включає димери білків родини NF-κB та Rel, залучено у декілька основних захворювань (Gupta et al., 2010; Marcu et al., 2010; Roman-Bias and Jimenez, 2008; O'Sullivan et al., 2007; Sethi et al, 2008; Melisi and Chiao, 2007). NF-κB активується різноманітними сигнальними молекулами, у тому числі цитокінами, такими як фактор некрозу пухлин-α (TNF-α) та інтерлейкін 1β (IL1β), хемокінами, бактеріальними та вірусними продуктами і вільними радикалами. Більшість індукторів активують NF-κB за допомогою канонічного сигнального шляху (фіг. 1), який включає фосфорилювання інгібіторних білків IκB, які зв'язуються з NF-κB, за допомогою кіназ IκB (IKK) з наступною протеасомною деградацією IκB. Димери NF-κB, інгібування яких за допомогою IκB більше не відбувається, надходять у ядро, де вони піддаються посттрансляційним модифікаціям та зв'язуються зі специфічними цис-діючими регуляторними послідовностями промоторів генів, що відповідають на NF-κB, у поєднанні з коактиваторними білками (головним чином з ацетилазами білків p300/CBP) та РНК-полімеразою II (Pol II) (Hayden and Ghosh, 2008; Roman-Bias and Jimenez, 2008). Певні сигнальні молекули активують NF-κB за допомогою альтернативних сигнальних шляхів, опосередкованих білками IKK або IκB, таких як неканонічний сигнальний шлях, що запускається лімфотоксином-α або RANKL (цитокіном, задіяним у резорбції кісток та дозріванні дендритних клітин) та регулює інший клас генів (Gupta et al., 2010; Hayden and Ghosh, 2008; Roman-Bias and Jimenez, 2008). NF-κB активує гени, задіяні в імунних запальних відповідях, гострофазових запальних відповідях, відповідях на оксидативний стрес, адгезії та диференціюванні клітин; активацію NFκB залучено в запальний артрит та інші ревматичні порушення (Roman-Bias and Jimenez, 2008; O'Sullivan et al., 2007). Конститутивна активація NF-κB також має місце під час багатьох форм раку та пов'язана з резистентністю пухлинних клітин до апоптозу та некрозу, підвищеною проліферацією, ангіогенезом та метастазуванням (Gupta et al, 2010; Melisi and Chiao, 2007; Shen and Tergaonkar, 2009; Richmond, 2002; Sethi et al, 2008). NF-κB стимулює експресію генів декількох вірусів людини, у тому числі ВІЛ (Tergaonkar, 2006). Звісно, NF-κB став головною мішенню для розробки лікарських засобів (Gupta et al, 2010). Було виявлено, що багато наявних лікарських засобів (у тому числі нестероїдні протизапальні лікарські засоби (NSAID) та глюкокортикоїди) інгібують NF-κB, і низку сполук розробляють як інгібітори NF-κB, хоча ще не було схвалено жодного лікарського засобу, конкретно спрямованого на NF-κB (Gupta et al, 2010; Tergaonkar, 2006; Sethi et al., 2008; Roman-Bias and Jimenez, 2008). Головні етапи сигнального шляху NF-κB, на які націлено наявні інгібітори (Gupta et al, 2010; Roman-Bias and Jimenez, 2008; Melisi and Chiao, 2007; Sethi et al., 2008), позначені зірочками на фіг. 1. Багато з цих інгібіторів націлюються на IKK, а інший головний клас блокує активність протеасом. Деякі інгібітори NF-κB націлюються на сигнальні молекули, що індукують NF-κB, у той час як інші блокують транслокацію NF-κB з цитоплазми у ядро, інгібують модифікації NF-κB або зв'язування з ДНК. Також розробляють інгібітори експресії генів NF-κB (такі як siRNA). Найспецифічніший до NF-κB клас наявних фармацевтичних інгібіторів націлюється на IKK. Проте, перший інгібітор IKK, що пройшов клінічні випробування стосовно лікування раку, CHS-828 (Hassan et al, 2006), продемонстрував високу токсичність та відсутність об'єктивних відповідей у фазі I (von Heideman et al, 2010). Інгібітор протеасом, бортезоміб, із сильною інгібіторною активністю стосовно NF-κB було схвалено для лікування множинної мієломи (Hideshima et al, 2009). Як і інші інгібітори протеасом, бортезоміб є цитотоксичним, а у клінічній практиці була продемонстрована значна токсичність, при цьому у 37-44 % пацієнтів спостерігалася індукована бортезомібом периферична нейропатія (Cavaletti and Jakubowiak, 2010). Інгібітори IKK та протеасом, які зміщують рівновагу між зв'язаним з IκB та вільним NF-κB, знижують як основну, так і індуковану активність NF-κB; такі інгібітори, таким чином, можуть перешкоджати здійсненню нормальних фізіологічних функцій NF-κB. На відміну від цього, інгібітор RANKL денозумаб, який впливає тільки на підмножину відповідей, опосередкованих NF-κB (Pageau, 2009), був схвалений для терапії остеопорозу та продемонстрував задовільний профіль безпеки (Hiligsmann and Reginster, 2010). Стрес-специфічний механізм активації NF-κB був виявлений у 1990-ті роки, але отримав порівняно невелику увагу. Цей механізм являє собою стимулювання транскрипційної активності NF-κB за допомогою p21 (CDKN1A) (Perkins et al., 1997; Poole et al, 2004), інгібітор клітинного циклу, індукований різними типами клітинного ушкодження та залучений у програму старіння 1 UA 112197 C2 5 10 15 20 25 30 35 40 45 50 55 60 (Abbas and Dutta, 2009). p21 зв'язується з різними циклін-залежними кіназами (CDK) з родини серин/треонінових кіназ, яка включає 21 представника в геномі людини, що діють у комплексі з регуляторними білками циклінами. Найвідоміші CDK (CDK1, 2, 4, 6) потрібні для переходів між різними фазами клітинного циклу, але багато інших функціонують як регулятори транскрипції або процесингу РНК (Malumbres et al, 2009). Зв'язування з p21 зазвичай інгібує активність CDK, але у випадку CDK4 p21 полегшує збирання комплексів циклін-CDK та може сприяти активності CDK4 in vivo (LaBaer et al., 1997). p21 стимулює активність NF-κB у аналізах за геномрепортером, але не підвищує рівні активного NF-κB у клітині (Perkins et al, 1997; Poole et al, 2004). Ефект p21 стосовно NF-κB опосередковано стимулюванням коактиваторних білків p300/CBP (Perkins et al., 1997; Snowden et al, 2000), і це стимулювання пов'язане не з інгібуванням фосфорилювання p300/CBP за допомогою CDK2, а з ефектом стосовно залежного від сумоїлювання домену транскрипційної репресії p300, CRD1 (Snowden et al., 2000; Gregory et al., 2002; Garcia-Wilson and Perkins, 2005). В дослідженнях одного з авторів даного винаходу було продемонстровано, що експресія p21 підвищує рівень транскрипції великої групи генів, багато з яких залучені у рак, хворобу Альцгеймера та атеросклероз; p21 також стимулював всі тестовані промотори різних вірусів (Chang et al, 2000; Chang et al, 2002; Poole et al, 2004). Індукцію 5 з 6 тестованих клітинних промоторів за допомогою p21 блокував суперрепресор розміром 1 т.п.о., а відповідь промотора на p21 припиняли шляхом мутації елемента NF-κB; індукцію транскрипції за допомогою p21 інгібував суліндак та деякі інші NSAID у концентраціях, що інгібують NF-κB (Poole et al., 2004). Отже, NF-κB являє собою ключовий медіатор індукції транскрипції за допомогою p21. Транскрипційну відповідь на p21 можуть імітувати інші білки CKI (p27 та p16), і, таким чином, її назвали сигнальним шляхом CKI. Функцією двох близькоспоріднених кіназ з родини CDK, CDK8 та CDK19, є регуляція транскрипції, а не перебігу клітинного циклу (Malumbres et al., 2009). (CDK19 також називали CDC2L6 та CDK11, але назву CDK11 частіше застосовують до двох інших білків). CDK8 та CDK19 (разом з цикліном C) являють собою альтернативні компоненти регуляторного модуля медіаторного комплексу, у якому регулятори транскрипції з'єднані з Pol II (Sato et al., 2004). Про CDK19, який заміняє CDK8 у відповідних медіаторних модулях та в деяких ситуаціях може мати ефект, відмінний від такого у CDK8, відомо небагато (Tsutsui et al., 2008). З іншого боку, CDK8 відомий як онкоген, ампліфікується у ~50 % випадків колоректального раку (Firestein and Hahn, 2009), і він залучений у сигнальні шляхи, задіяні у відповіді на стрес. Зокрема, CDK8 регулює активацію транскрипції та метаболізм Smad у сигнальних шляхах BMP та TGF-β (Alarcon et al, 2009) та діє як позитивний співрегулятор цільових генів p53, специфічний стосовно подразника (Donner et al, 2007). У дослідженнях з нокдауном та нокаутом CDK8 виявили, що CDK8 потрібен для раннього ембріонального розвитку, але не є необхідним для проліферації будь-яких тестованих типів клітин (Westerling et al., 2007). Підґрунтям для інгібування NF-κB в клінічних умовах є вимушеність. Проте, новий спосіб інгібування NF-κB, який був би спрямований головним чином на патологічні стани, такі як активація NF-κB під час запального артриту або раку, є терміново необхідним. Короткий опис винаходу Автори даного винаходу виявили сполуки (які мають назву сполук класу SNX2), які здійснюють селективне інгібування CDK8/19 та які не тільки інгібують індукцію транскрипційної активності NF-κB за допомогою p21, але також попереджають індукцію цієї активності за допомогою канонічного індуктора NF-κB TNF-α, який діє шляхом реалізації добре вивченого механізму, не пов'язаного з сигнальним шляхом CKI. Це виявлення вказує на те, що сполуки класу SNX2 та інгібітори CDK8/19 у цілому є корисними у лікуванні низки захворювань, у тому числі, без обмеження, запальних захворювань, які, як відомо, спричиняються NF-κB. Даний винахід забезпечує спосіб лікування у ссавця захворювання або порушення, спричинюваного індукованою транскрипційною активністю NF-κB у клітинах ссавця, при цьому спосіб включає введення ссавцю сполук, які здійснюють специфічне інгібування одного або декількох з CDK8 та CDK19. У деяких варіантах здійснення індукована транскрипційна активність NF-κB не індукується за допомогою сигнального шляху CKI. У деяких варіантах здійснення індукована транскрипційна активність NF-κB індукується за допомогою канонічного сигнального шляху. У деяких варіантах здійснення транскрипційна активність NF-κB була індукована за допомогою TNF-α. У деяких варіантах здійснення індукована транскрипційна активність NF-κB інгібується без інгібування основної транскрипційної активності NF-κB. У деяких варіантах здійснення захворювання являє собою запальне захворювання. У деяких варіантах здійснення запальне захворювання кишечника являє собою хворобу Крона або неспецифічний виразковий коліт. У деяких варіантах здійснення сполука має структуру, обрану з групи структур, показаних на фігурі 9. 2 UA 112197 C2 5 10 15 20 25 30 35 40 45 50 Короткий опис графічних матеріалів На фігурі 1 показано канонічний сигнальний шлях активації NF-κB. На фігурі 2 показано дозозалежне інгібування інгібітором CDK8/19 сенексином A IPTGіндукованої експресії GFP, контрольованої NF-κB-залежним промотором в клітинах HT1080 з p21, який індукується за допомогою IPTG, та структури інгібіторів CDK8/19 SNX2-1-53 (сенексин A) і SNX2-1-139. На фігурі 3 показано дозозалежний ефект інгібіторів CDK8/19 SNX2-1-53 (сенексин A) та SNX2-1-139 стосовно нормалізованої експресії GFP у необроблених та оброблених за допомогою TNF-α клітинах з геном-репортером, які походять від HT1080, у яких відбувається експресія GFP, контрольована NF-κB-залежним промотором. На фігурі 4 показано ефект сенексину A стосовно індукції NF-κB-регульованих генів за допомогою TNF-α у клітинах HEK293, вимірюваний за допомогою кількісної ПЛР зі зворотною транскрипцією (QPCR). На фігурі 5 показано індукцію NF-κB-регульованих генів за допомогою TNF-α у клітинах HCT116 дикого типу та p21 -/- (ліворуч) та ефекти сенексину A стосовно експресії цих генів у клітинах, оброблених за допомогою TNF-α. На фігурі 6 показано ефекти shRNA, що націлюються на CDK8 або CDK19, на рівні білків CDK8 та CDK19 у клітинах HEK293. На фігурі 7 показано, що сенексин A інгібує активацію NF-κB з мінімальними ефектами стосовно життєздатності клітин порівняно з інгібіторами NF-κB TPCK та MG115, що націлюються на протеасоми. На фігурі 8 показано, що сенексин A не блокує зв'язування ядерного білка NF-κB з ДНК, на відміну від інгібіторів NF-κB TPCK та MG115, що націлюються на протеасоми. На фігурі 9 показано низку сполук класу SNX2, застосовних у способах згідно з даним винаходом. Докладний опис переважних варіантів здійснення Автори даного винаходу виявили сполуки (які мають назву сполук класу SNX2), які здійснюють селективне інгібування CDK8/19 та які не тільки інгібують індукцію транскрипційної активності NF-κB за допомогою p21, але також попереджають індукцію цієї активності за допомогою канонічного індуктора NF-κB TNF-α, який діє шляхом реалізації добре вивченого механізму, не пов'язаного з сигнальним шляхом CKI. Це виявлення вказує на те, що сполуки класу SNX2 та інгібітори CDK8/19 у цілому є корисними у лікуванні низки захворювань, у тому числі, без обмеження, запальних захворювань, які, як відомо, спричиняються NF-κB. Даний винахід забезпечує спосіб лікування у ссавця захворювання або порушення, спричинюваного індукованою транскрипційною активністю NF-κB у клітинах ссавця, при цьому спосіб включає введення ссавцю сполуки, яка здійснює специфічне інгібування одного або декількох з CDK8 та CDK19. У деяких варіантах здійснення індукована транскрипційна активність NF-κB не індукується за допомогою сигнального шляху CKI. У деяких варіантах здійснення індукована транскрипційна активність NF-κB індукується за допомогою канонічного сигнального шляху, що у деяких варіантах здійснення може відбуватися за допомогою TNF-α або за допомогою інших канонічних індукторів. У деяких варіантах здійснення індукована транскрипційна активність NF-κB інгібується без інгібування основної транскрипційної активності NF-κB. У деяких варіантах здійснення захворювання являє собою запальне захворювання. У деяких варіантах здійснення запальне захворювання обране з групи, яка включає астму, запальне захворювання кишечника та ревматоїдний артрит. У деяких варіантах здійснення запальне захворювання кишечника являє собою хворобу Крона або неспецифічний виразковий коліт. У деяких варіантах здійснення сполука має структуру, обрану з групи структур, показаних на фігурі 9. У варіантах здійснення, де індукована транскрипційна активність NF-κB не індукується за допомогою сигнального шляху CKI, у тому числі у варіантах здійснення, де індукована транскрипційна активність NF-κB індукується за допомогою канонічного сигнального шляху, сполука може мати структуру 3 UA 112197 C2 5 10 15 20 25 30 35 40 45 50 де 1 R обрано з нижчого алкілу, аралкілу, арилу, гетероарилу, фенетилу та алкоксифенілу, будь-який з котрих може бути заміщеним або незаміщеним; 2 R обрано з нижчого алкілу та водню; A обрано з водню або нижчого алкілу; та В обрано з галогену, ціано, трифторметилу, NHAc, NO2 та O-нижчого алкілу. 1 У деяких варіантах здійснення R обрано з нижчого алкілу та аралкілу, які можуть бути 1 заміщеними або незаміщеними. У деяких варіантах здійснення R являє собою аралкіл, який може бути незаміщеним, або монозаміщеним, або дизаміщеним одним або декількома з нижчого алкілу, O-нижчого алкілу, NO2, галогену, ацетамідо та аміно. У деяких варіантах 1 здійснення R являє собою аралкіл, де арил являє собою нафтил. Варіанти здійснення, де транскрипційна активність NF-κB не індукується за допомогою сигнального шляху CKI, у тому числі варіанти здійснення, де індукована транскрипційна активність NF-κB індукується за допомогою канонічного сигнального шляху, включають способи лікування захворювання, спричинюваного індукованою транскрипційною активністю. Ці варіанти здійснення також включають способи інгібування індукованої транскрипційної активності NF-κB, але не основної активності NF-κB, у клітині ссавця. У деяких таких варіантах здійснення клітина ссавця перебуває в організмі ссавця. Вираз "захворювання або порушення" призначений означати медичний стан, асоційований з конкретними симптомами або ознаками. Вираз "спричинюваний індукованою транскрипційною активністю NF-κB у клітинах ссавця" означає, що щонайменше деякі симптоми або ознаки захворювання або порушення не будуть присутніми, якщо щонайменше деякі клітини ссавця не будуть характеризуватися індукованою транскрипційною активністю NF-κB. Вираз "індукована транскрипційна активність NF-κB" означає, що функція транскрипції, здійснювана NF-κB, здійснюється на рівні, вищому за рівень основної транскрипційної активності NF-κB. Вираз "основна транскрипційна активність NF-κB" означає рівень функції транскрипції, здійснюваної NF-κB в клітині за нормальних умов, тобто за відсутності захворювання або порушення. У деяких варіантах здійснення кількість активного NF-κB у ядрах клітин не є підвищеною, а підвищеним є лише тільки рівень активності NF-κB. Вираз "лікування" означає послаблення або усунення щонайменше деяких ознак або симптомів захворювання. Вираз "ссавець" включає людину. Вирази "вводити", "введення" тощо додатково обговорюються нижче. Вираз "сполука, яка здійснює специфічне інгібування одного або декількох з CDK8 та CDK19" означає малу молекулу, яка інгібує активність CDK8 та/або CDK19 більшою мірою, ніж вона інгібує активність одного або декількох CDK1, CDK2 та CDK6. У деяких варіантах здійснення сполуку згідно з даним винаходом вводять як фармацевтичний склад, який містить фізіологічно прийнятний носій. Вираз "фізіологічно прийнятний" зазвичай стосується матеріалу, який не чинить негативний вплив на ефективність сполуки і застосування якого є сумісним зі станом здоров'я ссавця. Вираз "носій" охоплює будьяке з наповнювача, розріджувача, заповнювача, солі, буфера, стабілізатора, солюбілізатора, олії, ліпідів, пухирців, що містять ліпіди, мікросфер, ліпосомних капсул або іншого матеріалу, добре відомого в даній галузі техніки стосовно застосування у фізіологічно прийнятних складах. Буде зрозуміло, що характеристики носія, наповнювача або розріджувача будуть залежати від шляху введення для конкретного застосування. Отримання фізіологічно прийнятних складів, які містять ці матеріали, описано, наприклад, у Remington's Pharmaceutical Sciences, 18th Edition, ed. A. Gennaro, Mack Publishing Co., Easton, Pa., 1990. Активну сполуку включають у фізіологічно прийнятний носій або розріджувач у кількості, достатній для доставки пацієнту профілактично або терапевтично ефективної кількості без спричинення небезпечних токсичних ефектів у пацієнта, якого лікують. Вираз "ефективна кількість" або "достатня кількість" зазвичай стосується кількості, достатній для чинення впливу на послаблення або усунення щонайменше одного симптому або ознаки захворювання або порушення. 4 UA 112197 C2 5 10 15 20 25 30 35 40 45 50 55 60 У способах згідно з даним винаходом введення сполуки згідно з даним винаходом можна здійснювати за допомогою будь-якого прийнятного шляху, у тому числі, без обмеження, парентерального, перорального, внутрішньопухлинного, під'язикового, трансдермального, місцевого, інтраназального шляхів, у формі аерозолю, за допомогою внутрішньоочного, інтратрахеального, інтраректального шляхів, крізь слизову оболонку, за допомогою вагінального шляху, за допомогою шкірного пластиру або у формі очних крапель або рідини для полоскання рота. Введення сполуки або фармацевтичного складу можна виконувати за допомогою відомих процедур у дозуваннях та протягом періодів часу, ефективних для послаблення симптомів або зниження рівнів сурогатних маркерів захворювання. Як описано у патентних публікаціях США 20080033000 та 20060154287 того ж заявника, автори даного винаходу провели високопродуктивний скринінг (HTS) стосовно інгібування сигнального шляху CKI із застосуванням диверсифікованих бібліотек, у яких містяться > 100000 малих молекул, подібних до лікарських засобів. У скринінговому аналізі застосовується лінія клітин на основі HT1080 людини з геном-репортером, у яких відбувається експресія p21, контрольована штучним промотором, який індукується ізопропіл-β-тіогалактозидом (IPTG), та яка містить промотор цитомегаловірусу (CMV), що відповідає на p21 та керує експресією GFP (Roninson and Chang, 2006). Серед невеликої кількості сполук, ідентифікованих за допомогою HTS, увагу було зосереджено на групі нецитотоксичних 4-амінохіназолінів, позначених як сполуки класу SNX2 (Chang et al., 2008). Хоча сполуки класу SNX2 інгібують індукцію транскрипції за допомогою p21 та інших CKI, вони не перешкоджають CKI-індукованій зупинці клітинного циклу (Chang et al, 2008). Після ідентифікації вихідних найкращих влучань (SNX2 та SNX14) (Chang et al, 2008) провели оптимізацію лідерних сполук класу SNX2 шляхом de novo синтезу та аналізу взаємозв'язку "структура-активність" (SAR), створивши нові структури з підвищенням дієвості до 30-разового у аналізі за геном-репортером на основі CMV (заявка на патент США US № 12956420). Також було визначено, що оптимізовані сполуки класу SNX2 здійснюють селективне націлювання на дві близькоспоріднені кінази з родини CDK, CDK8 та CDK19, функцією яких є регуляція транскрипції, а не перебігу клітинного циклу (Malumbres et al., 2009). У дослідженнях з нокдауном, опосередкованим shRNA, що проводилися авторами даного винаходу, було виявлено, що мішенню для сполук класу SNX2, яка визначає їх активність як інгібіторів сигнального шляху CKI у клітинах HT1080, є CDK8, але не CDK19 (заявка на патент США № 12956420). З урахуванням ролі NF-κB в індукції транскрипції за допомогою p21 (Poole et al, 2004) SNX2 тестували стосовно здатності зменшувати кількість активного NF-κB у ядрі у загальному аналізі різних відомих класів інгібіторів NF-κB. Як показано на фіг. 8 у патентній публікації США 20080033000, із застосуванням наборів хімічних речовин TransAM™ від ACTIVE MOTIF для аналізу факторів транскрипції NF-κB p65 та NF-κB p50 було виявлено, що SNX2 не мав ефекту стосовно кількості субодиниць NF-κB p50 або p65, які зв'язуються з консенсусною послідовністю NF-κB в ядерних екстрактах з клітин HT1080, необроблених або оброблених індуктором NF-κB TNF-α. Підстави припустити цю відсутність ефекту з'явилися тоді, коли було з'ясовано, що сполуки класу SNX2 не діють шляхом інгібування NF-κB. Як описано у прикладі 1 нижче, проте, тепер було виявлено, що ці сполуки не тільки інгібують індукцію транскрипційної активності NFκB за допомогою p21, але також попереджають індукцію цієї активності за допомогою канонічного індуктора NF-κB TNF-α, який діє шляхом реалізації добре вивченого механізму (фіг. 1), не пов'язаного з сигнальним шляхом CKI. Це виявлення вказує на те, що сполуки класу SNX2 та інгібітори CDK8/19 у цілому є корисними у лікуванні низки захворювань, у тому числі, без обмеження, запальних захворювань, які, як відомо, опосередковуються NF-κB. Як було показано раніше у патентній публікації США 20080033000, інгібітори сигнального шляху CKI класу SNX2 є корисними під час багатьох захворювань, асоційованих із сигнальним шляхом CKI, таких як рак, вірусні захворювання, хвороба Альцгеймера та атеросклероз. Очікували, що корисність інгібіторів сигнального шляху CKI від природи буде обмеженою відповідями, опосередкованими p21 або іншими білками CKI. У даному винаході продемонстровано, що сполуки класу SNX2 інгібують індукцію NF-κB за допомогою TNF-α, сигнальної молекули, яка активує NF-κB за допомогою канонічного сигнального шляху (фіг. 1), у який не залучено p21 або інші білки CKI. Це виявлення демонструє, що сполуки класу SNX2 мають бути застосовними у лікуванні будь-яких захворювань, у яких задіяна активація NF-κB, незалежно від задіяння білка CKI. Оскільки сполуки класу SNX2 є селективними інгібіторами CDK8/19, очікується, що будь-які інші інгібітори CDK8/19 будуть мати таку ж активність. Хоча відомі численні інгібітори NF-κB, сполуки класу SNX2, очевидно, мають унікальну комбінацію властивостей, про яку невідомо, чи мають її також будь-які інші інгібітори NF-κB, і яка слугує доброю ознакою стосовно корисності сполук класу SNX2 під час хронічних 5 UA 112197 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювань. Сполуки класу SNX2 не є цитотоксичними. Вони інгібують транскрипційну активність NF-κB, індуковану TNF-α або білком p21, який виробляється у відповідь на стрес, і вони не інгібують основну активність NF-κB, що дозволяє припустити, що ці сполуки можуть не мати токсичності, яка може виникати як результат інгібування NF-κB за нормальних умов. Крім того, сполуки класу SNX2 інгібують індукцію NF-κB за допомогою механізму, відмінного від використовуваного відомими інгібіторами, що визначається за нездатністю сполук класу SNX2 зменшувати основну або TNF-α-індуковану кількості активного NF-κB у ядрі. Ця відсутність активності є несумісною з інгібуванням тих етапів сигнального шляху NF-κB, на які зазвичай націлюються відомі інгібітори NF-κB (фіг. 1), але вона є сумісною з тими етапами, де, ймовірно, діють сполуки класу SNX2 з урахуванням природи їх селекції (проти ефекту p21) та їх молекулмішеней (CDK8/19). А саме, p21 стимулює ефект спільної активації р300/CBP стосовно NF-κB (Vazquez et al, 2005; Snowden et al., 2000; Gregory et al, 2002; Garcia-Wilson and Perkins, 2005), потенційний цільовий етап для сполук класу SNX2. На додаток, CDK8 та CDK19 задіяні у взаємодії Pol II з факторами транскрипції (Sato et al, 2004), що дозволяє припустити, що інгібування цієї взаємодії може опосередковувати ефект сполук класу SNX2 стосовно NF-κB (фіг. 1). Можна очікувати, що ефект стосовно р300/CBP або Pol II (ні на який з котрих не націлюються відомі інгібітори NF-κB) буде впливати на транскрипційну активність, але не на кількість активного NF-κB у ядрі, як спостерігається для сполук класу SNX2. Перелік відомих інгібіторів NF-κB включає політропні інгібітори CDK, флавопіридол та Rросковітин (Gupta et al, 2010). Проте, про ефекти цих сполук стосовно NF-κB повідомлялося, що вони пов'язані з інгібуванням IKK (Takada and Aggarwal, 2004; Dey et al, 2008), механізмом, несумісним з нездатністю сполук класу SNX2 блокувати підвищення вмісту активного NF-κB у ядрі (Chang et al., 2008). Політропні інгібітори CDK мають широкий спектр антипроліферативної активності та продемонстрували явно виражену токсичність у клінічних випробуваннях (DiazPadilla et al, 2009). На відміну від цього, сполуки класу SNX2 не мають антипроліферативної активності у їх активних концентраціях. Крім того, в умовах нокдауну або нокауту CDK8 не відбувалося інгібування росту клітин (Westerling et al., 2007), що дозволяло припустити, що роль CDK8 можна обмежити раннім ембріональним розвитком і що інгібітори CDK8 можуть бути безпечними у тривалому лікуванні за умов відсутності вагітності. Ці аспекти дозволяють припустити, що сполуки класу SNX2, перші селективні інгібітори CDK8/19, можуть бути безпечнішими під час довготермінового введення, ніж інші інгібітори CDK або інгібітори NF-κB, і, таким чином, можуть бути придатними для шляхів застосування у терапії хронічних захворювань, зокрема, запальних захворювань, у тому числі запального артриту. Наступні приклади призначені для додаткової ілюстрації даного винаходу, і їх не слід тлумачити як такі, що обмежують обсяг даного винаходу. Приклад 1 Сполуки класу SNX2 інгібують індукцію транскрипційної активності NF-κB Тестували ефекти сполук класу SNX2 стосовно транскрипційної активності NF-κB. Ці аналізи проводили з лінією клітин, що містять ген-репортер, які походять від клітин p21-9 HT1080, що мають p21, який індукується за допомогою IPTG (Chang et al, 1999), після трансдукції за допомогою лентивірусу Cignal Lenti з геном-репортером, що відповідає на NF-κB (SA Biosciences), у якому відбувається експресія GFP, контрольована NF-κB-залежним мінімальним промотором. Лінію клітин, що містять ген-репортер, згодом піддали селекції стосовно високого основного рівня NF-κB-залежної експресії GFP, який додатково підвищувався за допомогою TNF-α або безпосередньо після індукції p21 за допомогою IPTG. Сполуки класу SNX2 здійснювали суттєве інгібування індукції NF-κB-залежного промотора за допомогою p21, проілюстроване для SNX2-1-53 (також відомого як сенексин A) у експерименті з використанням проточної цитометрії на фіг. 2, де клітини не обробляли або обробляли за допомогою 50 мМ IPTG, що індукує p21, протягом 72 годин за відсутності або за присутності сенексину A в різних концентраціях. Здатність сполук класу SNX2 попереджати індукцію NF-κB-залежного промотора за допомогою p21 не була несподіваною, оскільки ці сполуки були ідентифіковані за своєю здатністю попереджати p21-опосередковану індукцію іншого промотора (CMV) (Chang et al., 2008), а стимулювання NF-κB за допомогою p21 вже було відомим. Проте, було виявлено, що сполуки класу SNX2 також інгібували індукцію NF-κB-залежного промотора за допомогою канонічного індуктора NF-κB TNF-α, як проілюстровано на фіг. 3 для двох сполук класу SNX2, SNX2-1-53 та SNX2-1-139 (структури цих сполук показано на фіг. 2). Таку ж лінію клітин на основі HT1080 з геном-репортером, що відповідає на NF-κB та кодує GFP, необроблених або оброблених за допомогою 10 нг/мл TNF-α протягом 18 годин за відсутності або за присутності сполук класу SNX2 в різних концентраціях, аналізували у флуорометричному аналізі в 96 6 UA 112197 C2 5 10 15 лункових планшетах, де експресію GFP нормалізували шляхом забарвлення ДНК за допомогою Hoechst 33342. Обидві сполуки класу SNX2 інгібували TNF-α-індуковану активність NF-κB, при цьому перехід інгібування у фазу плато досягався на рівні, що приблизно відповідає такому для необроблених клітин, але вони незначно інгібували основну активність NF-κB. Ефект сенексину A стосовно TNF-α-індукованої транскрипції також було продемонстровано 5 на клітинах нирки людини HEK293 (фіг. 4). Клітини висіяли у 6-лункові планшети при 6×10 клітин/лунка на середовище, яке містило 3 % сироватку, та культивували протягом ночі. Наступного дня клітини попередньо обробляли за допомогою 5 мкМ сенексину A або за допомогою контрольної інертної речовини DMSO протягом 1 години та обробляли за допомогою 10 нг/мл TNF-α або без нього протягом 30 хвилин. Клітини згодом піддавали лізису для очищення загальної РНК за допомогою набору RNeasy (Qiagen). Для QPCR-аналізу генів, що індукуються за допомогою NF-κB, кДНК отримували із застосуванням набору для синтезу першого ланцюга кДНК Maxima (Thermo Scientific/Fermentas, K1641), а експресію генів вимірювали за допомогою QPCR з ген-специфічними праймерами, з RPL13A як стандартом для нормалізації, застосовуючи мастер-мікс для qPCR Maxima SYBR Green/ROX (Thermo Scientific/Fermentas, K0223) та систему детекції ABI Prism 7900HT (Life technologies). Послідовності праймерів, застосовувані для QPCR, перелічені у таблиці I. Таблиця I Послідовності праймерів для QPCR Ген RPL13A IL8 CXCL1 IER3 CXCL2 CCL20 TNF EGR1 20 25 30 35 40 45 Смислова послідовність (SEQ ID NO) Антисмислова послідовність (SEQ ID NO) GGCCCAGCAGTACCTGTTTA (1) AGATGGCGGAGGTGCAG (2) AAATTTGGGGTGGAAAGGTT (3) TCCTGATTTCTGCAGCTCTGT (4) AACAGCCACCAGTGAGCTTC (5) GAAAGCTTGCCTCAATCCTG (6) ACACCCTCTTCAGCCATCAG (7) CGCAGGGTTCTCTACCCTC (8) GCTTCCTCCTTCCTTCTGGT (9) GGGCAGAAAGCTTGTCTCAA (10) CGTGTGAAGCCCACAATAAA (11) GTGCTGCTACTCCACCTCTG (12) TCAGCCTCTTCTCCTTCCTG (13) GCCAGAGGGCTGATTAGAGA (14) AGCCCTACGAGCACCTGAC (15) AAAGCGGCCAGTATAGGTGA (16) Усі тестовані гени індукували за допомогою TNF-α, але обробка за допомогою сенексину A істотно інгібувала таку індукцію (фіг. 4). Пересвідчувалися в ефекті інгібування CDK8/19 стосовно NF-κB-опосередкованої індукції транскрипції у клітинах колоректальної карциноми людини HCT116, де для визначення того, чи залежить цей ефект від p21, також застосовували доступність похідних p21 -/- цієї лінії клітин (Waldman et al., 1996). Клітини HCT116 дикого типу та p21 висіяли у 6-лункові планшети при 6 × 5 10 клітин/лунка на середовище з 10 % сироваткою та культивували протягом ночі. Наступного дня клітини попередньо обробляли за допомогою 5 мкМ сенексину A або за допомогою контрольної інертної речовини DMSO протягом 1 години та обробляли за допомогою 10 нг/мл TNF-α або без нього протягом 30 хвилин. Клітини згодом піддавали лізису для очищення РНК та QPCR-аналізу генів, що індукуються за допомогою NF-κB. На фіг. 5 (ліва панель) показано кратність індукції зазначених генів шляхом обробки за допомогою TNF-α за відсутності сенексину A. Усі гени індукували за допомогою TNF-α в обох лініях клітин, але через нокаут p21 кратність їх індукції була значно зниженою. На фіг. 5 (права панель) показано інгібіторні ефекти обробки за допомогою сенексину A стосовно TNF-α-індукованої експресії генів в обох лініях клітин. Примітно, що сенексин A інгібував TNF-α-індуковану експресію генів тією самою мірою у клітинах дикого типу та p21 -/-, що демонструє, що ефект інгібування CDK8/19 стосовно NF-κBопосередкованої індукції транскрипції не залежить від p21. Приклад 2 Як CDK8, так і CDK19 відіграють роль у активації NF-κB Щоб пересвідчитися у тому, що CDK8 та/або CDK19 опосередковують NF-κB-індуковану транскрипцію, застосовували shRNA, що націлюються на CDK8 та CDK19, для нокдауну експресії цих генів у клітинах HEK293. Клітини HEK293 піддавали трансдукції за допомогою лентивірусних векторів на основі pHLB, отриманих з лентивірусного вектора pLKO.l, та які мають маркер стійкості до бластицидину, та у яких відбувається експресія shRNA, спрямованих проти CDK8 (цільова послідовність CCTCTGGCATATAATCAAGTT (SEQ ID NO: 17)) або CDK19 (цільова послідовність GCTTGTAGAGAGATTGCACTT (SEQ ID NO: 18)). Після селекції клітин, інфікованих лентивірусом, стосовно стійкості до бластицидину нокдаун CDK8 та CDK19 було 7 UA 112197 C2 5 підтверджено на рівні білків за допомогою імуноблотингу, показаного на фіг. 6. Для імуноблотингу застосовували наступні первинні антитіла: антитіло кози до CDK8 (Santa Cruz, sc1521), антитіло кроля до CDK19 (Sigma, HPA007053). Для тестування ефектів нокдауну CDK8 та CDK19 стосовно індукції NF-κB-регульованих генів за допомогою TNF-α контрольні клітини (піддані трансдукції за допомогою pHLB) та клітини з нокдауном CDK8 або CDK19 висіяли у 65 лункові планшети при 6×10 клітин/лунка на середовище з 10 % сироваткою та культивували протягом ночі перед обробкою за допомогою 10 нг/мл TNF-α або без нього протягом 30 хвилин. Загальну РНК очищували, і експресію генів вимірювали за допомогою QPCR. Результати цього аналізу показано у таблиці II. 10 Таблиця II Кратність індукції зазначених генів за допомогою TNF-α pHLB shCDK8 shCDK19 15 20 25 30 35 40 45 50 CCL20 6,61 4,11 3,33 CXCL1 106,16 49,68 56,57 EGR1 2,29 1,54 1,17 IL8 6,50 4,47 3,90 TNF 8,67 8,96 4,32 Ці результати демонструють, що як CDK8, так і CDK19 є позитивними медіаторами індукції NF-κB-опосередкованої транскрипції, і, отже, сполуки, які інгібують як CDK8, так і CDK19 (такі як сполуки класу SNX2) є найпереважнішими для даного ефекту. Приклад 3 Інгібітор CDK8/19 інгібує NF-κB за допомогою механізму, відмінного від використовуваного іншими інгібіторами NF-κB Порівнювали сенексин A з двома відомими інгібіторами NF-κB, що націлюються на протеасоми, N-тозил-L-фенілаланінхлорметилкетоном (TPCK) (Ha et al, 2009) та MG115, стосовно їх цитотоксичності та їх ефекту стосовно транслокації активного NF-κB у ядро. В експерименті, показаному на фіг. 7, лінію клітин, які походять від HT1080, з геном-репортером, 5 що відповідає на NF-κB та кодує GFP, висіяли у чашки на 60 мм при 1,5×10 клітин на чашку та культивували протягом ночі перед обробкою різними інгібіторами NF-κB у концентраціях, зазначених на фіг. 7, протягом 3 годин з наступним стимулюванням за допомогою TNF-α (10 нг/мл) протягом 18 годин. Оброблені клітини трипсинізували, ресуспендували у PBS, змішували з 5 мкг/мл йодиду пропідію (PI) та аналізували із застосуванням проточного цитометра LSRII (BD Biosciences) стосовно флуоресценції GFP (ліва панель) та відсоткової долі мертвих (PIпозитивних) клітин (права панель). Усі з сенексину A, TPCK та MG115 інгібували TNF-αіндуковану NF-κB-залежну транскрипцію, але TPCK та MG115 суттєво збільшували частку мертвих клітин, тоді як сенексин A цього не робив. Показники активності зв'язування ядерних білків NF-κB з ДНК вимірювали за допомогою набору TransAM для аналізу факторів транскрипції з родини NF-κB на основі ELISA (Active Motif), дотримуючись протоколу виробника. Клітини HT1080 та HEK293 попередньо обробляли інгібіторами (5 мкМ сенексин A, 60 мкМ TPCK, 10 мкМ MG115) протягом 3 годин і згодом обробляли за допомогою 10 нг/мл TNF протягом 30 хвилин перед отриманням ядерного екстракту за допомогою набору для екстракції ядер (Active Motif). Ядерні екстракти аналізували при 5 мкг/лунка стосовно зв'язування p65 та при 2,5 мкг/лунка стосовно зв'язування p50 з ДНК. На фіг. 8 показано результати аналізів, проведених у двох повторностях. TPCK та MG115 суттєво зменшували кількість активних p65 та p50 у необроблених та оброблених за допомогою TNF-α клітинах в обох лініях клітин. На відміну від цього, результати для сенексину A було неможливо відрізнити від таких для контролю, що вказує на те, що інгібітор CDK8/19 не інгібує транслокацію NF-κB у ядро. Відповідно до цих отриманих даних раніше повідомлялося, що SNX2, сполука, споріднена з сенексином A, також не в змозі інгібувати рівні активного NF-κB у ядрі (Chang et al., 2008). Отже, інгібітори CDK8/19 інгібують NF-κB за допомогою нової комбінації властивостей: (i) вони інгібують TNF-α-індуковану, але не основну транскрипційну активність NF-κB, (ii) вони не є цитотоксичними та (iii) вони не інгібують транслокацію активного NF-κB у ядро. Цю унікальну комбінацію властивостей можна пояснити ймовірними механізмами дії інгібіторів CDK8/19 класу SNX2 (фіг. 1): CDK8/19 може діяти на коактиватори р300/СВР, які стимулюються за допомогою p21 (Vazquez et al, 2005; Snowden et al., 2000), або на взаємодію NF-κB з Pol II, яка регулюється медіаторними комплексами, що містять CDK8/19 (Sato et al., 2004). 8 UA 112197 C2 5 Літературні джерела, цитовані у даному документі, цим включено за допомогою посилання у всій своїй повноті. Будь-яку проблему невідповідності між ідеями будь-якого процитованого літературного джерела та ідеями даного опису слід розв'язувати на користь останніх. Фахівці в даній галузі визнають, що еквіваленти заявленого винаходу існують та охоплюються формулою винаходу. ФОРМУЛА ВИНАХОДУ 10 1. Спосіб лікування у ссавця захворювання або порушення, спричинюваного індукованою транскрипційною активністю NF-κΒ у клітинах ссавця, при цьому спосіб включає введення ссавцю сполуки, яка здійснює специфічне інгібування одного або декількох з CDK8 та CDK19, де сполука має структуру R 2 NR 1 5 N B 2 N A 8 15 20 25 , (I) де 1 R являє собою аралкіл або арил, який може бути заміщеним або незаміщеним; 2 R вибрано з нижчого алкілу та водню; А вибрано з водню або нижчого алкілу; та В являє собою ціано. 1 2. Спосіб за п. 1, який відрізняється тим, що R являє собою аралкіл, причому арил являє собою нафтил. 1 3. Спосіб за п. 1 або п. 2, який відрізняється тим, що R являє собою аралкіл, який може бути незаміщеним, монозаміщеним або дизаміщеним одним або декількома з нижчого алкілу, Онижчого алкілу, NO2, галогену, ацетамідо, диметиламідо та аміно. 4. Спосіб за п. 1, який відрізняється тим, що захворювання являє собою запальне захворювання. 5. Спосіб за п. 4, який відрізняється тим, що запальне захворювання вибране з групи, яка включає астму, запальне захворювання кишечнику та ревматоїдний артрит. 6. Спосіб за п. 4, який відрізняється тим, що запальне захворювання кишечнику являє собою хворобу Крона або неспецифічний виразковий коліт. 9 UA 112197 C2 10 UA 112197 C2 11 UA 112197 C2 12 UA 112197 C2 13 UA 112197 C2 14 UA 112197 C2 Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійськоюTreatment of disease or disorders caused by induced nfkb transcriptional activity
Автори англійськоюRoninson, Igor
Автори російськоюРонинсон Игор
МПК / Мітки
МПК: A61K 31/517, A61P 29/00
Мітки: спричинюваних, індукованою, захворювань, порушень, спосіб, активністю, nf-kb, транскрипційною, лікування
Код посилання
<a href="https://ua.patents.su/17-112197-sposib-likuvannya-zakhvoryuvan-abo-porushen-sprichinyuvanikh-indukovanoyu-transkripcijjnoyu-aktivnistyu-nf-kb.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування захворювань або порушень, спричинюваних індукованою транскрипційною активністю nf-kb</a>
Наступний патент: Спосіб отримання суспензійного рідинного комплексного добрива
Випадковий патент: Пристрій для візуалізації порожнистого органа