Похідні 4-бензиліденпіперидину
Номер патенту: 87862
Опубліковано: 25.08.2009
Автори: Колок Шандор, Фаркаш Шандор, Галгоци Корнель, Хорват Чілла, Борза Іштван, Шаги Каталін, Надь Йожеф, Дьєртьян Іштван
Формула / Реферат
1. Похідні 4-бензиліденпіперидину, що відповідають формулі (І)
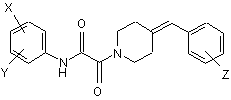 , (I)
, (I)
в якій значення
X і Y незалежно відповідають водню або атому галогену, гідрокси, ціано, нітро, аміно, С1-С4 алкіламіно, факультативно заміщеній атомом галогену або атомами галогену, ариламіно, факультативно заміщеній атомом галогену або атомами галогену, аралкіламіно, факультативно заміщеній атомом галогену або атомами галогену, С1-С4 алкілсульфонамідо, факультативно заміщеній атомом галогену або атомами галогену, С1-С4 алканоїламідо, факультативно заміщеній атомом галогену або атомами галогену, арилсульфонамідо, С1-С4 алкілсульфонілокси, карбоксильній, трифторметильній, трифторметокси, С1-С4 алкіл-SО2-NН-СН2-, NH2-(CH2)1-4 -SO2-NH-, NH2-(CH2)1-4-(CO)-NH-, сульфамоїльній [NH2-SO2-], формільній [-СНО], амінометильній [-CH2-NH2], гідроксиметильній, С1-С4 алкільній, С1-С4 алкоксиметильній, галогенметильній, тетразолільній групі, або С1-С4 алкокси, С1-С4 алкоксикарбонільній, C1-С6 алканоїлокси, фенільній або С1-С4 алкоксигрупам, факультативно заміщеним аміногрупою, або
сусідні X і Y групи разом з одним або більше ідентичними або відмінними додатковими гетероатомами і -СН= та/або -СН2-групами можуть сформувати факультативно заміщене 4-7-членне гомо- або гетероциклічне кільце, переважно морфолінове, пірольне, піролідинове, оксо- або тіоксопіролідинове, піразолове, піразолідинове, імідазольне, імідазолідинове, оксо- або тіоксоімідазольне або імідазолідинове, 1,4-оксазинове, оксазольне, оксазолідинове, оксо- або тіоксооксазолідинове, оксо- або тіоксотіазолідинове або 3-оксо-1,4-оксазинове кільце,
Z відповідає водню або атому галогену, нітро, аміно, С1-С4 алкільній, С1-С4 алкокси, ціано, трифторметильній, трифторметоксигрупі,
а також їхні оптичні ізомери, рацемічні сполуки та солі.
2. Сполука за п. 1, вибрана з групи похідних 4-бензиліденпіперидину:
2-(4-бензиліденпіперидин-1-іл)-2-оксо-N-(2-оксо-2,3-дигідробензооксазол-6-іл)-ацетамід,
2-(4-бензиліденпіперидин-1-іл)-2-оксо-N-(2-оксо-2,3-дигідробензотіазол-6-іл)-ацетамід,
2-[4-(4-хлорбензиліден)-піперидин-1-іл]-2-оксо-N-(2-оксо-2,3-дигідробензооксазол-6-іл)-ацетамід,
2-[4-(4-хлорбензиліден)-піперидин-1-іл]-2-оксо-N-(2-оксо-2,3-дигідробензоімідазол-5-іл)-ацетамід,
2-[4-(4-хлорбензиліден)-піперидин-1-іл]-2-оксо-N-(2-оксо-2,3-дигідробензотіазол-6-іл)-ацетамід,
2-[4-(4-метилбензиліден)-піперидин-1-іл]-2-оксо-N-(2-оксо-2,3-дигідробензоімідазол-5-іл)-ацетамід,
2-[4-(4-метилбензиліден)-піперидин-1-іл]-2-оксо-N-(2-оксо-2,3-дигідробензотіазол-6-іл)-ацетамід,
2-[4-(4-метилбензиліден)-піперидин-1-іл]-2-оксо-N-(2-оксо-2,3-дигідробензотіазол-6-іл)-ацетамід,
2-[4-(4-метоксибензиліден)-піперидин-1-іл]-2-оксо-N-(2-оксо-2,3-дигідробензоімідазол-5-іл)-ацетамід,
2-[4-(4-метоксибензиліден)-піперидин-1-іл]-2-оксо-N-(2-оксо-2,3-дигідробензотіазол-6-іл)-ацетамід,
N-(4-метансульфоніламінофеніл)-2-[4-(4-метоксибензиліден)-піперидин-1-іл]-2-оксоацетамід,
2-[4-(4-фторбензиліден)-піперидин-1-іл]-2-оксо-N-(2-оксо-2,3-дигідробензооксазол-6-іл)-ацетамід
та їх оптичні ізомери, рацемічні сполуки і солі.
3. Фармацевтична композиція, яка містить ефективну кількість похідної 4-бензиліденпіперидину, що відповідає формулі (І), в якій значення X, Y, Z визначені у п. 1, або її солі як активну речовину і допоміжні речовини, які широко застосовують у фармацевтичній практиці, такі як носії, формоутворювальні речовини, розчинники, стабілізатори, змочувальні або емульгувальні агенти, речовини, що впливають на рН та осмотичний тиск, духмяні або ароматизувальні речовини, а також добавки, що активують композицію, і добавки, що доставляють композицію.
4. Спосіб одержання похідних 4-бензиліденпіперидину, що відповідають формулі (І), в якій значення X, Y, Z визначені у п. 1, в якому здійснюють:
реакцію вторинного аміну, що відповідає формулі (II)
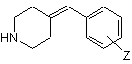 , (II)
, (II)
де Z має те саме значення, яке визначене у разі формули (І),
з етилоксалілхлоридом у відповідному придатному розчиннику у присутності основи,
омилення складноефірної сполуки, що відповідає формулі (III)
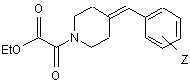 , (III)
, (III)
де Z має те саме значення, яке визначене у разі формули (І),
під дією лужного гідроокису та реакцію одержаної оксаламідної кислоти, що відповідає формулі (IV)
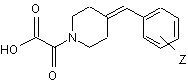 , (IV)
, (IV)
в якій Z має те саме значення, яке визначене у разі формули (І),
або її хімічно активної похідної з аніліном, що відповідає формулі (V)
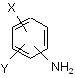 , (V)
, (V)
в якій значення X і Y відповідають тим значенням, які були визначені раніше у разі формули (І),
у дихлорметані,
з подальшою за необхідністю трансформацією одержаних похідних 4-бензиліденпіперидину, що відповідають формулі (І), в яких значення X, Y, Z відповідають тим значенням, які були визначені у п. 1, на інші сполуки, що відповідають формулі (І), шляхом введення нових замісних груп та/або модифікації або видалення груп, присутніх спочатку, та/або шляхом утворення солі, та/або виділення сполук, що відповідають формулі (І), зі складу солей із застосуванням відомих методів.
5. Спосіб за п. 4, в якому здійснюють реакцію активної похідної карбонової кислоти, що відповідає формулі (IV), в якій Z має те саме значення, яке визначене у п. 1, з аніліном, що відповідає формулі (V), в якій значення X і Y відповідають тим значенням, які були визначені у п. 1, у присутності основи.
6. Спосіб за п. 4, в якому здійснюють реакцію карбонової кислоти, що відповідає формулі (IV), в якій Z має те саме значення, яке визначене у п. 1, з аніліном, що відповідає формулі (V), в якій значення X і Y відповідають тим значенням, які були визначені у п. 1, у присутності триетиламіну і О-бензотриазол-1-іл-N,N,N’,N’-тетраметилуроніумгексафторфосфату (HBTU) в диметилформаміді.
7. Спосіб одержання фармацевтичної композиції, що має ефект NR2B селективного антагоніста рецептора NMDA, в якому здійснюють змішування похідних 4-бензиліденпіперидину, що відповідають формулі (І), в якій значення X, Y, Z визначені у п. 1, їхніх оптичних ізомерів, рацемічних сполук або їхніх фармацевтично прийнятних солей як активних речовин і допоміжних речовин, які широко застосовують у фармацевтичній практиці, таких як носії, формоутворювальні речовини, розчинники, стабілізатори, змочувальні або емульгувальні агенти, речовин, що впливають на рН і осмотичний тиск, духмяні або ароматизувальні речовини, а також добавки, що активують композицію, і добавки, що доставляють композицію.
8. Спосіб лікування та полегшення симптомів захворювань ссавців, у тому числі людини, таких як травматичні пошкодження мозку або спинного мозку, нервові пошкодження, пов’язані з вірусом імунодефіциту людини, бічний аміотрофічний склероз (хвороба Шарко), толерантність та/або залежність до лікування болів із застосуванням синтетичних наркотичних препаратів (опіоїдів), абстинентні синдроми з причини вживання, наприклад, алкоголю, синтетичних наркотичних препаратів (опіоїдів) або кокаїну, ішемічних розладів ЦНС, таких як, наприклад, хвороба Альцгеймера, хвороба Паркінсона, хвороба Хантингтона, болів і хронічних больових станів, таких як, наприклад, невропатичний біль, або біль, пов’язаний з раковим захворюванням, епілепсія, тривога, депресія, мігрень, психоз, мязові спазми, слабоумство різного походження, гіпоглікемія, дегенеративні розлади сітківки, глаукома, астма, дзвін у вухах, втрата слуху, викликана застосуванням аміноглікозидних антибіотиків, який відрізняється введенням ссавцям, що потребують лікування, ефективної кількості похідної 4-бензиліденпіперидину, що відповідає формулі (І), в якій значення X, Y, Z визначені у п. 1, її оптичних ізомерів, рацемічних сполук або її фармацевтично прийнятних солей як самих по собі, так і у комбінації з носіями, наповнювачами і тому подібним, які традиційно застосовують у фармацевтичній практиці.
9. Застосування похідної 4-бензиліденпіперидину, що відповідає формулі (І), в якій значення X, Y, Z визначені у п. 1, її оптичних ізомерів, рацемічних сполук або її фармацевтично прийнятних солей для виробництва фармацевтичних композицій, призначених для лікування та пом’якшення симптомів захворювань ссавців, у тому числі людини, таких як травматичні пошкодження мозку або спинного мозку, нервові пошкодження, пов’язані з вірусом імунодефіциту людини, бічний аміотрофічний склероз (хвороба Шарко), толерантність та/або залежність до лікування болів із застосуванням синтетичних наркотичних препаратів (опіоїдів), абстинентні синдроми з причини вживання, наприклад, алкоголю, синтетичних наркотичних препаратів (опіоїдів) або кокаїну, ішемічних розладів ЦНС, таких як, наприклад, хвороба Альцгеймера, хвороба Паркінсона, хвороба Хантингтона, болів і хронічних больових станів, таких як, наприклад, невропатичний біль, або біль, пов’язаний з раковим захворюванням, епілепсія, тривога, депресія, мігрень, психоз, м’язові спазми, слабоумство різного походження, гіпоглікемія, дегенеративні розлади сітківки, глаукома, астма, дзвін у вухах, втрата слуху, викликана застосуванням аміноглікозидних антибіотиків.
Текст
1. Похідні 4-бензиліденпіперидину, що відповідають формулі (І) X O C2 2 (19) 1 3 87862 2-[4-(4-метилбензиліден)-піперидин-1-іл]-2-оксо-N(2-оксо-2,3-дигідробензотіазол-6-іл)-ацетамід, 2-[4-(4-метоксибензиліден)-піперидин-1-іл]-2-оксоN-(2-оксо-2,3-дигідробензоімідазол-5-іл)-ацетамід, 2-[4-(4-метоксибензиліден)-піперидин-1-іл]-2-оксоN-(2-оксо-2,3-дигідробензотіазол-6-іл)-ацетамід, N-(4-метансульфоніламінофеніл)-2-[4-(4метоксибензиліден)-піперидин-1-іл]-2оксоацетамід, 2-[4-(4-фторбензиліден)-піперидин-1-іл]-2-оксо-N(2-оксо-2,3-дигідробензооксазол-6-іл)-ацетамід та їх оптичні ізомери, рацемічні сполуки і солі. 3. Фармацевтична композиція, яка містить ефективну кількість похідної 4-бензиліденпіперидину, що відповідає формулі (І), в якій значення X, Y, Z визначені у п. 1, або її солі як активну речовину і допоміжні речовини, які широко застосовують у фармацевтичній практиці, такі як носії, формоутворювальні речовини, розчинники, стабілізатори, змочувальні або емульгувальні агенти, речовини, що впливають на рН та осмотичний тиск, духмяні або ароматизувальні речовини, а також добавки, що активують композицію, і добавки, що доставляють композицію. 4. Спосіб одержання похідних 4бензиліденпіперидину, що відповідають формулі (І), в якій значення X, Y, Z визначені у п. 1, в якому здійснюють: реакцію вторинного аміну, що відповідає формулі (II) HN Z , (II) де Z має те саме значення, яке визначене у разі формули (І), з етилоксалілхлоридом у відповідному придатному розчиннику у присутності основи, омилення складноефірної сполуки, що відповідає формулі (III) O N EtO Z O , (III) де Z має те саме значення, яке визначене у разі формули (І), під дією лужного гідроокису та реакцію одержаної оксаламідної кислоти, що відповідає формулі (IV) O N HO Z O , (IV) в якій Z має те саме значення, яке визначене у разі формули (І), або її хімічно активної похідної з аніліном, що відповідає формулі (V) 4 X Y NH2 , (V) в якій значення X і Y відповідають тим значенням, які були визначені раніше у разі формули (І), у дихлорметані, з подальшою за необхідністю трансформацією одержаних похідних 4-бензиліденпіперидину, що відповідають формулі (І), в яких значення X, Y, Z відповідають тим значенням, які були визначені у п. 1, на інші сполуки, що відповідають формулі (І), шляхом введення нових замісних груп та/або модифікації або видалення груп, присутніх спочатку, та/або шляхом утворення солі, та/або виділення сполук, що відповідають формулі (І), зі складу солей із застосуванням відомих методів. 5. Спосіб за п. 4, в якому здійснюють реакцію активної похідної карбонової кислоти, що відповідає формулі (IV), в якій Z має те саме значення, яке визначене у п. 1, з аніліном, що відповідає формулі (V), в якій значення X і Y відповідають тим значенням, які були визначені у п. 1, у присутності основи. 6. Спосіб за п. 4, в якому здійснюють реакцію карбонової кислоти, що відповідає формулі (IV), в якій Z має те саме значення, яке визначене у п. 1, з аніліном, що відповідає формулі (V), в якій значення X і Y відповідають тим значенням, які були визначені у п. 1, у присутності триетиламіну і Обензотриазол-1-іл-N,N,N’,N’тетраметилуроніумгексафторфосфату (HBTU) в диметилформаміді. 7. Спосіб одержання фармацевтичної композиції, що має ефект NR2B селективного антагоніста рецептора NMDA, в якому здійснюють змішування похідних 4-бензиліденпіперидину, що відповідають формулі (І), в якій значення X, Y, Z визначені у п. 1, їхніх оптичних ізомерів, рацемічних сполук або їхніх фармацевтично прийнятних солей як активних речовин і допоміжних речовин, які широко застосовують у фармацевтичній практиці, таких як носії, формоутворювальні речовини, розчинники, стабілізатори, змочувальні або емульгувальні агенти, речовин, що впливають на рН і осмотичний тиск, духмяні або ароматизувальні речовини, а також добавки, що активують композицію, і добавки, що доставляють композицію. 8. Спосіб лікування та полегшення симптомів захворювань ссавців, у тому числі людини, таких як травматичні пошкодження мозку або спинного мозку, нервові пошкодження, пов’язані з вірусом імунодефіциту людини, бічний аміотрофічний склероз (хвороба Шарко), толерантність та/або залежність до лікування болів із застосуванням синтетичних наркотичних препаратів (опіоїдів), абстинентні синдроми з причини вживання, наприклад, алкоголю, синтетичних наркотичних препаратів (опіоїдів) або кокаїну, ішемічних розладів ЦНС, таких як, наприклад, хвороба Альцгеймера, хвороба Паркінсона, хвороба Хантингтона, болів і хронічних больових станів, таких як, наприклад, невропатичний біль, або біль, пов’язаний з раковим захворюван 5 87862 6 ням, епілепсія, тривога, депресія, мігрень, психоз, мязові спазми, слабоумство різного походження, гіпоглікемія, дегенеративні розлади сітківки, глаукома, астма, дзвін у вухах, втрата слуху, викликана застосуванням аміноглікозидних антибіотиків, який відрізняється введенням ссавцям, що потребують лікування, ефективної кількості похідної 4-бензиліденпіперидину, що відповідає формулі (І), в якій значення X, Y, Z визначені у п. 1, її оптичних ізомерів, рацемічних сполук або її фармацевтично прийнятних солей як самих по собі, так і у комбінації з носіями, наповнювачами і тому подібним, які традиційно застосовують у фармацевтичній практиці. 9. Застосування похідної 4-бензиліденпіперидину, що відповідає формулі (І), в якій значення X, Y, Z визначені у п. 1, її оптичних ізомерів, рацемічних сполук або її фармацевтично прийнятних солей для виробництва фармацевтичних композицій, призначених для лікування та пом’якшення симп томів захворювань ссавців, у тому числі людини, таких як травматичні пошкодження мозку або спинного мозку, нервові пошкодження, пов’язані з вірусом імунодефіциту людини, бічний аміотрофічний склероз (хвороба Шарко), толерантність та/або залежність до лікування болів із застосуванням синтетичних наркотичних препаратів (опіоїдів), абстинентні синдроми з причини вживання, наприклад, алкоголю, синтетичних наркотичних препаратів (опіоїдів) або кокаїну, ішемічних розладів ЦНС, таких як, наприклад, хвороба Альцгеймера, хвороба Паркінсона, хвороба Хантингтона, болів і хронічних больових станів, таких як, наприклад, невропатичний біль, або біль, пов’язаний з раковим захворюванням, епілепсія, тривога, депресія, мігрень, психоз, м’язові спазми, слабоумство різного походження, гіпоглікемія, дегенеративні розлади сітківки, глаукома, астма, дзвін у вухах, втрата слуху, викликана застосуванням аміноглікозидних антибіотиків. Цей винахід стосується нових похідних 4бензиліден-піперидину, що є NR2B селективними антагоністами рецептора NMDA з поліпшеним in vivo профілем або являють собою проміжні сполуки для виготовлення останніх. Рецептори N-метил-D-аспарганової кислоти (NMDA) являють собою катіонні канали, керовані лігандами, широко представлені у центральній нервовій системі. Рецептори NMDA залучені до росту, розвитку та адаптаційних змін нейронів. Надактивація рецепторів NMDA глутаміновою кислотою, їх природним лігандом, може призводити до кальцієвого перевантаження клітин. Це запускає каскад внутрішньоклітинних процесів, що змінюють функціонування клітин і, в кінцевому рахунку, можуть призвести до загибелі нейронів. Антагоністи рецепторів NMDA можуть бути використані для лікування безлічі розладів, що супроводжуються надлишковим вивільненням глутамінової кислоти, або надактивацією рецепторів NMDA з будь-якої іншої причини [Curr Opin Investig Drugs. 2003 4: 826-32]. Рецептори NMDA являють собою гетеромірні комплекси, що складаються з принаймні однієї субодиниці NR1 та однієї або більше з чотирьох субодиниць NR2 (NR2A - D). Як просторовий розподіл у центральній нервовій системі (ЦНС), так і фармакологічна чутливість рецепторів NMDA, що мають у своєму складі різні NR2 субодиниці, є різними. У зв'язку з цим, особливо цікавою є NR2B субодиниція внаслідок її обмеженого розподілу (найвищі щільності у передньому мозку та драглистій речовині спинного мозку) [Neuropharmacology, 38, 611-623 (1999)]. Сполуки, селективні для цього підтипу, е доступними, і їх ефективність була показана на тваринних моделях інсульту [Stroke, 28, 2244-2251 (1997)], травматичних пошкоджень мозку [Brain Res., 792, 291-298 (1998)], хвороби Паркінсона [Exp. Neurol., 163, 239-243 (2000)], невропатичного та запального болю [Neuropharmacology, 38, 611-623 (1999)]. Крім того, селективні антагоністи NR2B підтипу рецепторів NMDA можуть забезпечувати терапевтичну перевагу порівняно з неселективними антагоністами рецепторів NMDA. Неселективні антагоністи рецепторів NMDA, що діють за типом блокатора каналу, фенциклідин і кетамін, індукують психодислептичні ефекти, галюцинації, дисфорію, кататонію та амнезію у людини. Ці серйозні несприятливі ефекти ускладнюють їх клінічне використання як потенційно можливого препарату. Сполуки, що належать до цього класу, також обумовлюють аномальну поведінку у тварин, наприклад, збуджують рухову активність, індукують амнезію та погіршують координацію рухів. Серйозність (важкість) цих ефектів у тварин розглядають як предиктивну відносно серйозності клінічних побічних ефектів. Припускають, що NR2B підтип селективні антагоністи позбавлені більшої частини цих побічних ефектів. За підсумками експериментів із вивчення поведінки тварин повідомляли про те, що деякі NR2B селективні сполуки [Ro 63-1908 in J. Pharmacol. Exp. Ther., 302 (2002) 940-948 и Ro 25-6981 in Behav. Pharmacol., 14 (2003) 477-487] збільшують рухову активність, в той час як такий ефект не спостерігали у разі CP101,606, іншого NR2B селективного антагоніста, і Ro 256981 з іншої групи [Neuropharmacology, 38, 611-623 (1999)]. Відсутність ефекту стимулювання рухової активності у разі СР-101,606 аж до рівня 56 мг/кг підшкірно та 100 мг/кг внутрішньочеревинно була також підтверджена іншими даними [Soc.Neurosc.Abstr. 21, 439.9. 1995.]. Таким чином, згідно з нашими кращими даними, СР-101,606 є єдиним NR2B селективним антагоністом, який, згідно з однаковими повідомленнями, не має ефекту стимулювання рухової активності. Оскільки СР101,606 має невисоку ефективність при пероральному прийманні, і, згідно з опублікованими даними, був досліджений лише за допомогою внутрішньовенного способу введення людині, крім того, він має поліморф CYP2D6 опосередкований метабо 7 лізм [Drug Metabolism and Disposition 31: 76-87], зберігається велика потреба у нових NR2B антагоністах, що мають низьку важкість побічних ефектів (високий терапевтичний індекс), гарну ефективність у разі перорального прийняття (біодоступністю) і гарну здатність перспективного удосконалення у терапевтичних цілях, особливо з метою перорального застосування. Насичені аналоги сполук, що є предметом цього винаходу, описані у WO 2003010159 як NR2B підтип селективні антагоністи NMDA. Однак, інші структурно близькі аналоги похідних 4бензиліден-піперидину, що відповідають формулі (І), в літературі невідомі. Було виявлено, що нові похідні 4-бензиліденпіперидину, що відповідають формулі (І), які є предметом цього винаходу, являють собою функціонально активні антагоністи NMDA, селективні для рецепторів, що містять субодиницю NR2B. Автори також виявили, що бензиліден-піперидини мають анальгетичні властивості in vivo, подібні до тих, що їх мають їхні насичені бензил-піперидинові аналоги. Дивним є таке: в той час, як останні обумовлюють підвищення рухової активності на рівні, що відповідає або трохи перевищує їхню максимально ефективну анальгетичну дозу, сполуки, що є предметом цього винаходу, не мають ефекту підвищення рухової активності до рівня, що сягає 40-60-кратного перевищення їхньої анальгетичної дози. Ця властивість може забезпечити терапевтичну перевагу перед NR2B селективними антагоністами NMDA, що мають більш низький терапевтичний індекс. Докладний опис винаходу Таким чином, цей винахід стосується, у першу чергу, нових похідних 4-бензиліден-піперидину, що відповідають формулі (І) - в якій значення X і Y незалежно відповідають водню або атому галогену, гідрокси, ціано, нітро, аміно, С1-С4 алкіламіно, факультативно заміщеній атомом галогену або атомами галогену, ариламіно, факультативно заміщеній атомом галогену або атомами галогену, аралкіламіно, факультативно заміщеній атомом галогену або атомами галогену, С1-С4 алкілсульфонамідо, факультативно заміщеній атомом галогену або атомами галогену, С1-С4 алканоїламідо, факультативно заміщеній атомом галогену або атомами галогену, арилсульфонамідо, С1-С4 алкілсульфонілокси, карбоксильній, трифторметильній, трифторметокси, С1-С4 алкіл-SO2-NН-СН2-, NH2-(CH2)1-4-SO2-NH-, NH2-(CH2)1-4-(CO)-NH-, сульфамоїльній [NH2-SO2-], формільній [-СНО], амінометильній [-CH2-NH2], гідроксиметильній, С1-С4 алкільній, С1-С4 алкоксиметильній, галогенметильній, тетразолільній групі, або С1-С4алкокси, С1С4алкоксикарбонільній, С1-С6алканоїлокси, фенільній або С1-С4алкокси групам, факультативно заміщеним аміно групою, або сусідні X і Y групи разом з одним або більше ідентичним або відмін 87862 8 ним додатковим гетероатомом і -CH= та/або -CH2групами можуть сформувати факультативно заміщене 4-7 членне гомо- або гетероциклічне кільце, переважно морфолінове, пірольне, піролідинове, оксо- або тіоксо-піролідинове, піразолове, піразолідинове, імідазольне, імідазолідинове, оксо- або тіоксо-імідазольне або імідазолідинове, 1,4оксазинове, оксазольне, оксазолідинове, оксо- або тіоксо-оксазолідинове, оксоабо тіоксотіазолідинове або 3-оксо-1,4-оксазинове кільце, Z відповідає водню або атому галогену, нітро, аміно, C1-C4 алкільній, С1-С4алкокси, ціано, трифторметильній, трифторметокси групі, а також їх оптичних ізомерів, рацемічних сполук і солей. Крім того, об'єктами цього винаходу є фармацевтичні композиції, які мають у своєму складі як активні компоненти нові похідні 4-бензиліденпіперидину, що відповідають формулі (І), або їх оптичні ізомери, рацемічні сполуки, або їх солі. Наступними об'єктами цього винаходу є способи виробництва нових похідних 4-бензиліденпіперидину, що відповідають формулі (І), та фармацевтичного виготовлення медикаментів, що мають у своєму складі ці сполуки, рівно як і способи лікування із застосуванням цих сполук, що вміщує в себе введення препаратів в організм ссавця, у тому числі людини, що потребує лікування, ефективної кількості нових похідних бензиліденпіперидину, що відповідають формулі (І), які є об'єктом цього винаходу, як самих по собі, так і у складі медикаменту. Згідно з цим винаходом, сполуки - аміди карбонових кислот, що відповідають формулі (І), можуть бути приготовані викладеним далі способом. Для виробництва сполуки, що відповідає формулі (І), де X, Y і Z є такими, що визначені згідно з формулою (І), вторинний амін, що відповідає формулі (II), де Z має те саме значення, що визначене у разі формули (І), вступає у реакцію з етилоксалілхлоридом у відповідному підходящому розчиннику у присутності основи, одержана складно-ефірна сполука, що відповідає формулі (III), де Z має те саме значення, що визначене у разі формули (І), піддають омиленню під дією лужного гідроокису і одержана оксаламідна кислота, що відповідає формулі (IV), в якій Z має те саме значення, що визначене у разі формули (І), або її хімічно активна похідна, вступає у реакцію з аніліном, що відповідає формулі (V), 9 в якій значення X і Y відповідають тим самим значенням, що були визначені раніше у разі формули (І), після чого одержані похідні 4-бензиліденпіперидину, що відповідають формулі (І), в яких значення X, Y, Z відповідають тим значенням, що були визначені у разі формули (І), трансформуються у інші сполуки, що відповідають формулі (І), шляхом введення нових замісних груп, та/або модифікації, або видалення груп, присутніх спочатку, та/або шляхом утворення солі, та/або виділення сполуки зі складу солей, та/або розкладу одержаних рацемічних сполук із використанням оптично активних кислот або основ із застосуванням відомих методів. Реакція карбонової кислоти, що відповідає формулі (II), та аніліну, що відповідає формулі (V), тобто формування амідного зв'язку, здійснюють краще шляхом утворення активної похідної з карбонової кислоти, що відповідає формулі (II), яка і реагує з аніліном, що відповідає формулі (V), краще у присутності основи. Перетворення карбонової кислоти на хімічно активну похідну відбувається in situ у процесі формування амідного зв'язку в розчиннику (наприклад, диметилформаміді, ацетонітрилі, хлорованих вуглеводнях або вуглеводнях). Хімічно активні похідні можуть являти собою хлориди кислот (одержані, наприклад, з карбонової кислоти і тіонілхлориду), змішані ангідриди (одержані, наприклад, з карбонової кислоти та ізобутилхлороформату в присутності основи, такої як, наприклад, тріетиламін), хімічно активні складні ефіри (одержані, наприклад, з карбонової кислоти та гідроксибензтріазолу і дициклогексилкарбодііміду або Обензотріазол-1-іл-N,N,N’,N'тетраметилуроніумгексафторфосфату (HBTU) в присутності основи, такої як, наприклад, тріетиламін). Хімічно активні похідні утворюються у діапазоні температур від кімнатної температури до 0°С. Необхідний час реакції складає 6-20 годин. Реакційну суміш очищують із застосуванням колонкової хроматографії із використанням Kieselgel 60 (Merck) як адсорбенту та відповідного елюенту. Підходящі фракції концентрують з метою одержання чистого продукту. Якість і кількість продукту визначають із використанням методу високоефективної рідинної хроматографії, суміщеної з мас селекцією (HPLC-MS метод). Аніліни, що відповідають формулі (V), є як комерційно доступними, так і можуть бути синтезовані із застосуванням різних відомих методів. Способи синтезу деяких комерційно недоступних анілінів, що відповідають формулі (V), та карбонових кислот, що відповідають формулі (IV), описані у розділі Приклади. Як було сказано, нові похідні 4-бензиліденпіперидину, що відповідають формулі (І), які є об'єктом цього винаходу, являють собою високоефективні та високоселективні антагоністи рецепторів 87862 10 NMDA, і, більше того, більша частина сполук являє собою селективні антагоністи NR2B підтипу рецепторів NMDA. Для визначення ефективності сполук як NR2B селективних антагоністів NMDA, ми використовували культивовані нейрони кори головного мозку, що експресують переважно рецептори NMDA1 які містять субодиницю NR2B. Для підтвердження їхньої селективності використовували клітини НЕК-293, трансфековані комбінацією NR1/NR2A субодиниць. Для вимірювання анальгетичної ефективності in vivo та відповідальності за побічні ефекти сильних NR2B селективних антагоністів, автори використовували мишаче формалінове випробування і випробування на рухову активність, відповідно. Експериментальні протоколи Експресія рекомбінантних рецепторів NMDA Для підтвердження NR2B селективності сполук, що означає дослідження їхньої дії на NR2Aвмісні рецептори NMDA, автори випробували найсильніші з них на клітинних лініях, що стійко експресують рекомбінантні рецептори NMDA з композиціями NR1/NR2A субодиниць. кДНК людських NR1 і NR2A субодиниць, субклоновані на індуцибельні експресійні вектори ссавців, були інтродуковані у HEK 293 клітини, які не містять рецептори NMDA, із використанням катіонного опосередкованого ліпідами методу трансфекції [Biotechniques, 22, 982-987. (1997); Neurochemistry International, 43, 19-29. (2003)]. Стійкість до неоміцину і гігроміцину використовували для відбирання клонів, що містять обидва вектори, і, на основі клонів, були одержані моноклональні клітинні лінії, що забезпечують найбільшу відповідь на взаємодію з NMDA. Сполуки випробували на їхню інгібіторну активність відносно NMDA, викликану внутрішньоклітинним кальцієм, яка виражалась у збільшенні сигналу при флуоресцентних вимірюваннях вмісту кальцію. Дослідження проводили через 48-72 годин після додавання індукувального агента. Кетамін (500 мкМ) також був присутній у перебігу індукції з метою не допущення цитотоксичності. Визначення активності антагоніста NMDA in vitro шляхом вимірювання внутрішньоклітинної концентрації кальцію в культурі коркових клітин пацюка із використанням скандувального Флуориметра для читання планшетів Вимірювання внутрішньоклітинної концентрації кальцію були здійснені із використанням культур первинних клітин нової кори головного мозку, одержаних з 17 денних ембріонів пацюків Charles River (докладний опис одержання культури клітин кори головного мозку дивись у Johnson, М.І.; Bunge, R.P. (1992): Культури клітин первинних периферійних і центральних нейронів і нейроглії. В: Protocols for Neural Cell Culture, eds: Fedoroff, S.; Richardson A., The Humana Press Inc., 51-75.) Після виділення клітини були розсіяні на стандартні 96лункові мікропланшети, після чого культури інкубували в атмосфері 95% повітря, 5% CO2 при 37°С до проведення вимірювань концентрації кальцію. Культури клітин використовували для вимірювання внутрішньоклітинної концентрації кальцію через 3-7 днів in vitro. Вважають, що на цій стадії клітини in vitro експресують переважно NR2B 11 87862 BMJCHJ рецептори NMDA [Мої. Pharmacol. 45, 846853. (1994)]. Перед вимірюваннями у клітини вводили флуоресцентний Ca2+-чутливий барвник, Fluo-4/AM (2мкМ). Для зупинення введення барвника у клітини їх двічі промивали розчином, який використовували у перебігу вимірювань (140 мМ NaCI, 5 мМ КС1, 2 мМ CaCI2, 5 мМ HEPES, 5 мМ HEPES-Na, 20 мМ глюкози, 10 мкМ гліцину, рН=7,4). Після промивання до культур клітин додавали випробувані сполуки, розчинені у вказаному вище розчині (90 мкл/лунка). Вимірювання внутрішньоклітинної концентрації кальцію проводили із використанням сканувального флуориметра для читання планшетів: збільшення Fluo-4флуоресценції, що відповідало збільшенню внутрішньоклітинної концентрації кальцію, індукувалося шляхом введення 40 мкМ NMDA. Інгібіторну активність випробуваних сполук визначали шляхом вимірювання зниження росту концентрації кальцію у присутності різних концентрацій цих 12 сполук. Криві залежності доза - ефект і значення ІС50 визначали із застосуванням даних, одержаний принаймні у трьох незалежних експериментах. Інгібіторна активність сполуки в одній концентраційній точці виражалась як процент інгібування (ослаблення) відповіді NMDA. Як результати були одержані сигмоподібні криві концентрація - інгібування, після чого значення ІС50 визначали як концентрація сполуки, яка забезпечує інгібування, що дорівнює половині максимального інгібування, забезпеченого цією сполукою. В таблиці 1 наведені активності більшості ефективних сполук, що є об'єктом цього винаходу, як антагоністів NR2B, визначених у цьому експерименті. В таблиці 2 наведені результати для декількох відомих NR2B специфічних антагоністів і неспецифічного антагоніста рецептора NMDA МК801. Таблиця 1 Активність сполук як антагоністів NMDA, виміряна із застосуванням флуориметричного методу із використанням клітин кори головного мозку (NR2B активність) або із використанням трансформованих клітин НЕК293 (NR2A активність) Сполука згідно з Таблицею 5 3 5 6 7 10 11 12 13 14 15 16 17 20 22 23 25 26 27 30 32 33 35 40 41 42 1 Клітини кори головного мозку пацюка (NR2B) Наближене значення ІС50 ++ +++ ++ + ++ +++ +++ ++ ++ +++ ++ + ++ +++ ++ +++ ++ ++ ++ +++ ++ +++ +++ +++ + +++ +: IC50 між 500 і 1000 нМ ++: IC50 між 50 і 500 нМ +++: IC50 менше 50 нМ -: Не визначали Н.Е.: не ефективна, тобто інгібування менше 30% Клітини НЕК293 (NR2A) Інгібування у кількості 15 мкМ Н.Е. Н.Е. Н.Е. Н.Е. Н.Е. Н.Е. 13 87862 14 Таблиця 2 Активність сполук як антагоністів NMDA, виміряна із застосуванням флуориметричного методу із використанням клітин кори головного мозку (NR2B активність) або із використанням трансформованих клітин НЕК293 (NR2A активність) Клітини кори головного мозку пацюка Код відповідної сполуки СІ-1041 Со-101244 EMD 95885 СР-101,606 Ro 25.6981 Еритро-іфенпродил МК-801 IC50[HM] номер 6,6 23 35 41 159 483 37 4 3 1 3 4 5 3 Відповідні сполуки є такими: СІ-1041:6-{2-[4-(4-фторбензил)-піперидин-І-іл]етансульфініл}-3Н-бензооксазол-2-он Со-101244:1-[2-(4-гідроксифенокси)етил]-4гідрокси-4-(4-метилбензил)піперидин EMD 95885: 6-[3-(4-фторбензил)піперидин-Ііл]пропіоніл]-2,3-дигідро-бензоксазол-2-он СР-101,606: (18,23)-І-(4-гідроксифеніл)-2-(4гідрокси-4-фенілпіперидин-І-іл)-І-пропанол Ro 256981: R-(R*,S*)-1-(4-гiдpoкcифeнiл)-2мeтил-3-[4-(фeнiлмeтил)пiпepидин-l-iл]-І-пропанол. Іфенпродил: еритро-2-(4-бензилпіперидино)-1(4-гідроксифеніл)-1-пропанол МК-801: (+)-5-Метил10,11 -дигідро-5Н-дибензо[а,сІ]циклогептен-5,10імін Мишаче формалінове випробування для вимірювання in vivo ефективності Відомо, що ін'єкція розведеного формаліну у задню лапу пацюка або миші обумовлює появу та розвиток двофазної поведінки, пов'язаної з болем, інтенсивність якої вимірюють як час, витрачений на зализування/кусання пораненої лапи. Другу фазу, як правило, визначають як пов'язані з болем події, детектовані у 15-60 хвилинному інтервалі після ін'єкції формаліну, максимальну інтенсивність яких спостерігають у часовій точці близько ЗО хвилин. Відомо, що рецептори NMDA залучені до другої фази відповіді на ін'єкцію формаліну, і ця поведінкова відповідь є чутливою до блокування рецепторів NMDA [Dickenson, А. and Besson J.-M. (Editors): Chapter 1, pp. 6-7: Animal models of Analgesia; and Chapter 8, pp. 180-183: Mechanism of Central Hypersensitivity: Excitatory Amino Acid Mechanisms and Their Control - In Pharmacology of Pain. Springer-Verlag (Berlin) 1997.] Таким чином, автори використовували другу фазу формалінового випробування для визначення ефективності сполук in vivo. Вважають, що інгібування другої фази відповіді відображає анальгетичний ефект проти тривалого хімічно-індукованого болю [Hunker, S., et al.: Formalin Test in Mice, a Useful Technique for Evaluating Mild Analgesics, Journal of Neuroscience Methods, 14 (1985) 69-76.] Використовували самців мишей лінії NMRI (20 - 25 г). Тварини не одержували будь-якої твердої NR1-3/NR2A % інгібування у кількості 10 мкМ 21,0 -8,7 0,1 2,5 1,0 -2,7 ІС50=386 нМ номер 1 1 1 1 1 1 2 їжі впродовж приблизно 16 годин перед експериментом, але мали вільний доступ до 20% розчину глюкози. Далі тварини одержували 1 годинний період акліматизації (звикання) у скляному циліндрі (сс. 15 см у діаметрі), потім їх клали у такий самий циліндр з розташованим ззаду дзеркалом для полегшення спостереження. Випробувані сполуки суспендували у 5% tween-80 (10 мл на кг маси тіла) і вводили перорально шляхом годування за 15 хвилин до ін'єкції формаліну (20 мкл 1% формаліну у 0,9% розчині хлориду натрію у воді (фізіологічному розчині) вводили у вигляді підшкірної ін'єкції у дорзальну поверхню правої задньої лапи). Час, витрачений на зализування та кусання пораненої лапи, при проведенні вимірювань, складав від 20 до 25 хвилин після ін'єкції формаліну. Для визначення величини EDs0 різні дози (принаймні п'ять різних доз) випробуваних сполук давали групам по 5 мишей, і результати виражали як проценти зменшення часу, витраченого на зализування, порівняно з контрольною групою, якій давали лише розріджувач, за якою спостерігали у той самий день. Величини ED50 (тобто дози, що викликають зменшення на 50 %) рахували із застосуванням методу підбору сигмоїдальної кривої за Больцманом (Boltzman's sigmoidal curve fitting). Вимірювання мимовільної рухової активності у мишей В експериментах використовували самців мишей лінії NMRI, які важать 20-22 г. Мимовільну рухову активність вимірювали із використанням чотириканального контролера активності. Установка, яка складається з чотирьох акрилових клітин (43см х 43см х 32см), обладнана 2x16 парами фотоелементів вздовж усієї нижньої осі клітки. Додатковий набір фотоелементів (16 пар) клали вздовж двох протилежних боків клітки на висоті 10 см з метою фіксування відповіді у вигляді піднімання на задні лапи. Експериментальні групи складалися з 10 тварин. Через тридцять хвилин після перорального прийняття випробуваної сполуки або розчинника (tween-80) тварин клали індивідуально в одну з чотирьох кліток на одну годину. Горизонтальні та вертикальні пересування визначали як число переривань променя всередині 15 хвилинних інтер 15 87862 валів впродовж однієї години. Для кожної групи рахували середні ± стандартна помилка дані горизонтальної та вертикальної рухової активності, після чого були визначені відхилення від контрольної (що одержувала розчинник) групи, виражені у процентах. Вважали, що сполука викликає стимуляцію рухової активності, коли її ефект перевищує 50% збільшення кількості переривань променя. Відповідно, дози, визначені як такі, що не мають стимулюючого ефекту (LMAfree), викликали менше, ніж 50% збільшення. Таблиця 3 ілюструє результати, одержані для 16 деяких вибраних сполук, що є об'єктом цього винаходу (верхня таблиця), і для їхніх близьких бензил-піперидинових аналогів (нижня таблиця) у перебігу анальгетичного випробування і випробування на рухову активність. [А=2-(4бензилпіперидин-І-іл)-2-оксо-N-(2–оксо-2,3дигідро-бензоксазол-6-іл)-ацетамід і В = 2-[4-[4метилбензил)-піперидин-1-іл]-2-оксо-М-(2-оксо-2,3дигідро-1Н-індол-5-іл)-ацетамід]. Таким чином, пари 1 - А і 24 - В відрізняються лише наявністю подвійного зв'язку замість одинарного. Таблиця 3 Характеризування двох типів антагоністів NR2B у перебігу формалінового випробування і випробування на рухову активність (LMA test). Обчислення терапевтичних індексів (Tl) Формалін Сполука згідно з Таблицею 5 ED50 мг/кг 1 1,3 24 0,94 Формалин Відповідна речоED50 мг/кг вина А 0,85 В 0,48 Бензил іден-піперидини LMA Tl Доза мг/кг % збільшення 60 120 60 35* 69 13* Бензил-піперидини LMA LMAfree/EDso 46 >64 Tl Доза мг/кг % збільшення 1 3 3,75 7,5 34* 62 72 141 LMAfree/ED50 20* Відповідні сполуки LMA Доза мг/кг % збільшення 0,1 114 0,3 217 10 137 Tl LMAfree/ED50
ДивитисяДодаткова інформація
Назва патенту англійською4-benzylidene-piperidin derivatives
Автори англійськоюBorza Istvan, Horvath Csilla, Farkas Sandor, Gyertyan Istvan, Nagy Jozsef, Kolok Sandor, Galgoczy Kornel, Saghy Katalin
Назва патенту російськоюПроизводные 4-бензилиденпиперидина
Автори російськоюБорза Иштван, Хорват Чилла, Фаркаш Шандор, Дьертьян Иштван, Надь Йожеф, Колок Шандор, Галгоци Корнель, Шаги Каталин
МПК / Мітки
МПК: A61K 31/445, C07D 401/12, A61P 25/28, C07D 413/12, C07D 417/12
Мітки: 4-бензиліденпіперидину, похідні
Код посилання
<a href="https://ua.patents.su/17-87862-pokhidni-4-benzilidenpiperidinu.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-бензиліденпіперидину</a>
Попередній патент: Інгалятор для порошкоподібних, зокрема, медичних речовин
Наступний патент: Пристрій для гідроструминної обробки поверхонь
Випадковий патент: Апарат сушко для спицевого черезкісткового остеосинтезу












