Фармацевтична композиція контрольованого вивільнення, яка містить нітазоксанід
Формула / Реферат
1. Фармацевтична композиція у вигляді твердої пероральної дозованої форми, яка містить:
(a) першу частину, що містить першу кількість нітазоксаніду або його аналога в композиції контрольованого вивільнення; та
(b) другу частину, що містить другу кількість нітазоксаніду або його аналога в композиції негайного вивільнення,
причому відношення першої кількості нітазоксаніду або його аналога до другої кількості нітазоксаніду або його аналога становить від 2,5:1 до 4:1.
2. Композиція за п. 1, яка відрізняється тим, що тверда пероральна дозована форма являє собою таблетку.
3. Композиція за п. 2, яка відрізняється тим, що перша частина (а) утворює перший шар таблетки, а друга частина (b) утворює другий шар, осаджений зверху першого шару (а).
4. Композиція за п. 2, яка відрізняється тим, що перша частина (а) утворює перший шар таблетки; друга частина (b) утворює другий шар, осаджений зверху першого шару (а) для формування ядра таблетки, яке містить перший шар та другий шар; і (с) зовнішній покривний шар, осаджений зверху ядра таблетки.
5. Композиція за п. 1, яка відрізняється тим, що тверда пероральна дозована форма являє собою капсулу.
6. Композиція за п. 5, яка відрізняється тим, що перша частина (а) представлена у формі гранул контрольованого вивільнення, які містять першу кількість нітазоксаніду або його аналога, а друга частина (b) представлена у формі гранул негайного вивільнення, які містять другу кількість нітазоксаніду або його аналога.
7. Композиція за п. 1, яка відрізняється тим, що перша частина додатково містить один чи більше розріджувачів, дезінтегрантів, зв'язувальних агентів, суспендуючих агентів, агентів, що сприяють ковзанню, змащувачів, наповнювачів або додаткових ексципієнтів.
8. Композиція за п. 7, яка відрізняється тим, що перша частина додатково містить гідроксипропілцелюлозу та гідроксипропілметилцелюлозу як зв'язувальні агенти, дегідрат дикальціюфосфат як наповнювач, колоїдний безводний кремнезем як агент, що сприяє ковзанню та стеарат магнію як змащувач.
9. Композиція за п. 1, яка відрізняється тим, що друга частина додатково містить один або більше розріджувачів, дезінтегрантів, зв'язувальних агентів, суспендуючих агентів, агентів, що сприяють ковзанню, змащувачів, наповнювачів або додаткових ексципієнтів.
10. Композиція за п. 9, яка відрізняється тим, що друга частина додатково містить гідроксипропілцелюлозу та мікрокристалічну целюлозу як зв'язувальні агенти, кукурудзяний крохмаль як розріджувач, кроскармелозу натрію як дезінтегрант, колоїдний безводний кремнезем як агент, що сприяє ковзанню та стеарат магнію як змащувач.
11. Композиція за п. 1, яка відрізняється тим, що перша частина додатково містить полімер з низькою в'язкістю.
12. Композиція за п. 11, яка відрізняється тим, що полімер з низькою в'язкістю являє собою гідроксипропілметилцелюлозу з низькою в'язкістю.
13. Двошарова таблетка для перорального введення, де таблетка містить:
(a) перший шар, який містить приблизно 500 мг нітазоксаніду в композиції контрольованого вивільнення; та
(b) другий шар, який містить приблизно 175 мг нітазоксаніду в композиції негайного вивільнення, причому другий шар осаджений зверху і спресований з першим шаром для формування ядра таблетки; та
(c) зовнішній покривний шар, нанесений на ядро таблетки;
причому перший шар додатково містить гідроксипропілметилцелюлозу з низькою в'язкістю.
14. Спосіб лікування пацієнта, що страждає на гепатит С, в якому здійснюють введення пацієнту терапевтично ефективної кількості фармацевтичної композиції у вигляді твердої дозованої форми, де композиція містить:
(а) першу частину, що містить першу кількість нітазоксаніду або його аналога в композиції контрольованого вивільнення; та
(b) другу частину, що містить другу кількість нітазоксаніду або його аналога в композиції негайного вивільнення,
причому відношення першої кількості нітазоксаніду або його аналога до другої кількості нітазоксаніду або його аналога становить від 2,5:1 до 4:1.
15. Спосіб за п. 14, який відрізняється тим, що тверда дозована форма являє собою таблетку.
16. Спосіб за п. 15, який відрізняється тим, що перша частина (а) утворює перший шар таблетки, і друга частина (b) утворює другий шар, осаджений зверху першого шару (а).
17. Спосіб за п. 16, який відрізняється тим, що перший шар додатково містить один або більше розріджувачів, дезінтегрантів, зв'язувальних агентів, суспендуючих агентів, агентів, що сприяють ковзанню, змащувачів, наповнювачів або додаткових ексципієнтів.
18. Спосіб за п. 17, який відрізняється тим, що перший шар додатково містить гідроксипропілцелюлозу та гідроксипропілметилцелюлозу як зв'язувальні агенти, дегідрат дикальціюфосфат як наповнювач, колоїдний безводний кремнезем як агент, що сприяє ковзанню та стеарат магнію як змащувач.
19. Спосіб за п. 16, який відрізняється тим, що другий шар додатково містить один або більше розріджувачів, дезінтегрантів, зв'язувальних агентів, суспендуючих агентів, агентів, що сприяють ковзанню, змащувачів, наповнювачів або додаткових ексципієнтів.
20. Спосіб за п. 16, який відрізняється тим, що другий шар додатково містить гідроксипропілцелюлозу та мікрокристалічну целюлозу як зв'язувальні агенти, кукурудзяний крохмаль як розріджувач, кроскармелозу натрію як дезінтегрант, колоїдний безводний кремнезем як агент, що сприяє ковзанню та стеарат магнію як змащувач.
21. Спосіб за п. 16, який відрізняється тим, що перший шар додатково містить гідроксипропілметилцелюлозу з низькою в'язкістю.
22. Спосіб лікування пацієнта, що страждає на гепатит С, в якому здійснюють пероральне введення пацієнту терапевтично ефективної кількості двошарової таблетки, яка містить:
(а) перший шар, що містить приблизно 500 мг нітазоксаніду в композиції контрольованого вивільнення; та
(b) другий шар, що містить приблизно 175 мг нітазоксаніду в композиції негайного вивільнення, де другий шар осаджений зверху і спресований з першим шаром для формування ядра таблетки; та
(c) зовнішній покривний шар, нанесений на ядро таблетки;
причому перший шар додатково містить гідроксипропілметилцелюлозу з низькою в'язкістю.
23. Спосіб лікування пацієнта, що страждає на гепатит С, в якому здійснюють:
(і) попереднє лікування пацієнта шляхом введення пацієнту протягом деякого періоду часу першої композиції у вигляді твердої пероральної дозованої форми, яка містить нітазоксанід або його аналог як перший активний агент, причому перша композиція містить (а) першу частину, що містить першу кількість нітазоксаніду або його аналога в композиції контрольованого вивільнення, та (b) другу частину, що містить другу кількість нітазоксаніду або його аналога в композиції негайного вивільнення, причому відношення першої кількості нітазоксаніду або його аналога до другої кількості нітазоксаніду або його аналога становить від 2,5:1 до 4:1; та
(іі) після періоду часу, вказаного в (і), введення пацієнту другої композиції, що містить терапевтично ефективну кількість другого активного агента.
24. Спосіб за п. 23, який відрізняється тим, що другий активний агент являє собою інтерферон або поліетиленглікольну похідну інтерферону.
25. Спосіб за п. 23, який відрізняється тим, що друга композиція додатково містить третій активний агент, де третій активний агент містить один чи більше противірусних агентів.
26. Спосіб за п. 25, який відрізняється тим, що друга композиція додатково містить рибавірин як противірусний агент.
27. Спосіб зниження одного чи більше побічних ефектів, пов'язаних з лікуванням нітазоксанідом або тизоксанідом у пацієнта, в якому здійснюють введення пацієнту терапевтично ефективної кількості фармацевтичної композиції у вигляді твердої дозованої форми, причому композиція містить:
(а) першу частину, що містить першу кількість нітазоксаніду або його аналога в композиції контрольованого вивільнення; та
(b) другу частину, що містить другу кількість нітазоксаніду або його аналога в композиції негайного вивільнення,
причому відношення першої кількості нітазоксаніду або його аналога до другої кількості нітазоксаніду або його аналога становить від 2,5:1 до 4:1.
28. Спосіб за п. 27, який відрізняється тим, що тверда дозована форма являє собою двошарову таблетку, де:
перша частина (а) утворює перший шар, який містить приблизно 500 мг нітазоксаніду або його аналога в композиції контрольованого вивільнення, та додатково містить гідроксипропілметилцелюлозу з низькою в'язкістю;
друга частина (b) утворює другий шар, який містить приблизно 175 мг нітазоксаніду або його аналога в композиції негайного вивільнення, причому другий шар осаджений зверху та спресований з першим шаром для формування ядра таблетки; і
при цьому таблетка додатково містить зовнішній покривний шар (с), нанесений на ядро таблетки.
29. Фармацевтична композиція за п. 1, що має підвищену біодоступність нітазоксаніду або його аналога у пацієнта, порівняно з композицією негайного вивільнення нітазоксаніду або його аналога.
30. Фармацевтична композиція за п. 29, яка відрізняється тим, що тверда дозована форма являє собою двошарову таблетку, у якій:
перша частина (а) утворює перший шар, який містить приблизно 500 мг нітазоксаніду або його аналога в композиції контрольованого вивільнення, та додатково містить гідроксипропілметилцелюлозу з низькою в'язкістю;
друга частина (b) утворює другий шар, який містить приблизно 175 мг нітазоксаніду або його аналога в композиції негайного вивільнення, причому другий шар осаджений зверху та спресований з першим шаром для формування ядра таблетки; і
при цьому таблетка додатково містить зовнішній покривний шар (с), нанесений на ядро таблетки.
31. Фармацевтична композиція за п. 1, що має подовжену абсорбцію нітазоксаніду або його аналога у пацієнта, порівняно з композицією негайного вивільнення нітазоксаніду або його аналога.
32. Фармацевтична композиція за п. 31, яка відрізняється тим, що тверда дозована форма являє собою двошарову таблетку, у якій:
перша частина (а) утворює перший шар, який містить приблизно 500 мг нітазоксаніду або його аналога в композиції контрольованого вивільнення, та додатково містить гідроксипропілметилцелюлозу з низькою в'язкістю;
друга частина (b) утворює другий шар, який містить приблизно 175 мг нітазоксаніду або його аналога в композиції негайного вивільнення, причому другий шар осаджений зверху та спресований з першим шаром для формування ядра таблетки; і
при цьому таблетка додатково містить зовнішній покривний шар (с), нанесений на ядро таблетки.
33. Таблетка контрольованого вивільнення для перорального введення, де таблетка містить нітазоксанід або його аналог та полімер з низькою в'язкістю, причому полімер з низькою в'язкістю контролює вивільнення нітазоксаніду або його аналога.
34. Таблетка контрольованого вивільнення за п. 33, яка відрізняється тим, що полімер з низькою в'язкістю являє собою гідроксипропілметилцелюлозу з низькою в'язкістю.
Текст
Реферат: Запропоновані тверді дозовані композиції нітазоксаніду або аналогів нітазоксаніду, які включають частину контрольованого вивільнення та частину негайного вивільнення. Фармацевтична композиція зазвичай являє собою двошарову тверду оральну дозовану форму, яка включає (а) перший шар, який містить першу кількість нітазоксаніду або його аналога композиції контрольованого вивільнення; та (b) другий шар, який містить другу кількість нітазоксаніду або його аналога композиції негайного вивільнення. Також запропонований спосіб використання композицій у лікуванні гепатиту С. UA 107564 C2 (12) UA 107564 C2 UA 107564 C2 5 10 15 20 25 30 35 40 45 50 [0001] Дана заявка заявляє пріоритет тимчасової заявки U.S. № 61/202,285, поданої 13 лютого 2009 р. РІВЕНЬ ТЕХНІКИ [0002] Нітазоксанід - (2-(ацетолілокси)-N-(5-нітро-2-тіазоліл)бензамід) являє собою сполуку, яка має наступну формулу: [0003] Одержання та застосування цієї сполуки описані, наприклад, в патенті США № 3,950,351, виданого на ім'я Rossignol. [0004] Фармацевтичні композиції, які містять нітазоксанід та його метаболіт - тізаксанід спочатку розроблялись та поставлялись на ринок для лікування паразитарних інфекцій кишкового тракту. [0005] Після орального прийому нітазоксаніду або сумішей нітазоксаніду плюс тізоксанід у людей ці сполуки частково абсорбуються з кишкового тракту і нітазоксанід швидко гідролізується з утворенням тізоксаніду у плазмі. Тізоксанід є глюкуноро-кон'югованим і цей лікарський препарат виводиться з сечею та жовчю як тізоксанід або глюкуронід тізоксаніду. Період напіврозпаду тізоксаніду у плазмі становить лиши приблизно 1,5 години. [0006] Для лікування інфекцій кишкового тракту з успіхом використовувались фармацевтичні композиції, які містять нітазоксанід або суміші нітазоксаніду та тізоксаніду, зволожувальний агент і необов'язково похідне крохмалю. Для досягнення безпеки та ефективності було показано, що важливим є застосування активних інгредієнтів з розміром частинок у межах 5-200 мкм. Показано застосування фармацевтично прийнятної кислоти для покращення стабільності цих фармацевтичних композицій. Див., наприклад, патенти США № 5,387,598; 5,968,961; та 6,117,894, виданих на ім'я Rossignol. Показано, що композиції у формі таблеток та суспензій є однаково ефективними для лікування паразитарних інфекцій кишкового тракту незалежно від їх відносної біодоступності. [0007] Абсорбція нітазоксаніду та сумішей нітазоксанід-тізоксанід з кишкового тракту значно варіює в залежності від форми фармацевтичної композиції. Наприклад, було несподівано виявлено, що відносна біодоступність оральної суспензії становить лише 70 % від біодоступності таблетки. Системна біодоступність цих сполук не має першочергового значення, однак, через те, що ці сполуки широко застосовувались майже виключно для боротьби з паразитами, які знаходяться в просвіті кишкового тракту або слизовій оболонці кишкового тракту. [0008] Також показано, що нітазоксанід та тізоксанід є активними in vitro проти ДНК деяких вірусів in vitro (див., наприклад, патенти США №№ 5,578,621 та 5,886,013, видані на ім'я Rossignol). В останні роки несподівано було виявлено, що вони є активними до вірусу гепатиту С, (HCV) та РНК вірусу in vitro та в клінічних дослідженнях (посилання на заявку на видачу патенту США "Спосіб лікування вірусних гепатитів"). Механізм дії нітазоксаніду та тізоксаніду в інгібуванні реплікації вірусу невідомий але допускається, що він являє собою "клітинноопосередкований" механізм через широкий спектр його противірусної активності та нездатності викликати опір. [0009] Ранні клінічні дослідження нітазоксаніду та тізоксаніду в лікуванні хронічного гепатиту С проводили з використанням композиції у формі таблетки, розробленої для лікування паразитарних інфекцій кишкового тракту. Така таблетка містила 500 мг активного інгредієнту, (99 % нітазоксаніду/1 % тізоксаніду). У пацієнтів, хронічно інфікованих генотипом HCV 4, досягались швидкості тривалої вірусологічної відповіді (SVR) від 61 % до 80 %, коли таблетки вводились в режимі одна таблетка двічі на день протягом періоду від 4 до 12 тижнів, після чого застосовували той же режим прийому плюс стандартні дози пегінтерферону α-2a з або без рибавірину протягом 36 тижнів. На відміну, пацієнти, які одержували стандартну терапію пегінтерферону α-2a плюс рибавірин протягом 48 тижнів, показували лише 50 % швидкість SVR. [0010] Хоча ранні дослідження у пацієнтів з хронічним гепатитом C генотипу 4 показали покращену ефективність з використанням таблетки масою 500 мг, значне число пацієнті не були 1 UA 107564 C2 5 10 15 20 25 30 35 40 45 50 55 60 вилікувані. Вищі дози активного інгредієнту для покращення ефективності не можна було застосовувати тому, що попередні дослідження показали, що дози 1000 мг двічі на день були пов'язані зі значними побічними ефектами, які у першу чергу стосувались кишкового тракту (наприклад, черевний біль, діарея та нудота). Ці побічні ефекти знижують піддатливість пацієнта до режиму лікування та є зокрема непридатними для тривалого лікування пацієнтів з гепатитом С. [0011] Для лікування хронічної інфекції HCV тізоксанід треба доставляти в кров'яний потік та до інфікованих гепатоцитів. Ідеально, якби ліки вводили оральним шляхом не більше ніж двічі на день та без значних побічних ефектів для максимального дотримання пацієнтами режиму лікування. [0012] Абсорбція нітазоксаніду та тізоксаніду, яка змінюється в різних дозованих композиціях, дуже короткий період напіврозпаду в плазмі та побічні ефекти, пов'язані з високими дозами нітазоксаніду та тізоксаніду в шлунковому тракті є проблемами, які треба подолати для одержання нової оптимізованої дозованої композиції для лікування хронічного гепатиту С. Крім того, оскільки механізм дії нітазоксаніду проти HCV є невідомим, неможливо встановити чи будуть коливання пікових та мінімальних концентрацій у місці інфекції корисними чи згубними для покращення ефективності. [0013] Таким чином, є потреба у твердій дозованій композиції нітазоксаніду і/або тізоксаніду з покращеною ефективністю у лікуванні хронічного гепатиту С у порівнянні з таблетками, описаним у рівні техніки та без будь-якого збільшення побічних ефектів. ОПИС [0014] Описані композиції нітазоксаніду та аналогів нітазоксаніду з контрольованим вивільненням, а також спосіб застосування композицій у лікуванні гепатиту С. Зокрема, описані тверді дозовані композиції нітазоксаніду та аналогів нітазоксаніду, які включають частину контрольованого вивільнення та частину негайного вивільнення. [0015] Таким чином, в деяких аспектах пропонується фармацевтична композиція у вигляді твердої дозованої форми, де композиція включає: (a) першу частину, яка містить першу кількість нітазоксаніду або його аналога в композиції контрольованого вивільнення; та (b) другу частину, яка містить другу кількість нітазоксаніду або його аналога в композиціях негайного вивільнення. В деяких варіантах втілення композиція являє собою тверду оральну дозовану форму у формі таблетки, або у інших варіантах втілення - у формі капсули. [0016] В інших аспектах пропонується спосіб лікування пацієнта, який страждає від гепатиту С, де спосіб включає введення пацієнту терапевтично ефективної кількості фармацевтичної у вигляді твердої дозованої форми, де композиція включає: (a) першу частину, яка містить першу кількість нітазоксаніду або його аналога у композиції контрольованого вивільнення та (b) другу частину, яка містить другу частину нітазоксаніду або його аналога у композиції негайного вивільнення. [0017] В ще інших аспектах пропонується спосіб лікування пацієнта, який страждає від гепатиту С, де спосіб включає (i) попереднє лікування пацієнта шляхом введення пацієнту протягом періоду часу першої композиції у вигляді твердої оральної дозованої форми, яка містить нітазоксанід або його аналог як перший активний агент, де перша композиція включає: (a) першу частину, яка містить першу кількість нітазоксаніду або його аналога та (b) другу частину, яка містить другу кількість нітазоксаніду або аналога у композиції негайного вивільнення; та (ii) після періоду часу (i), введення пацієнту другої композиції, яка містить терапевтично ефективну кількість другого активного агента. [0018] В деяких аспектах пропонується спосіб зменшення одного чи більше побічних ефектів, пов'язаних з лікуванням за допомогою нітазоксаніду або тізоксаніду у пацієнта, де спосіб включає введення пацієнту терапевтично ефективної кількості фармацевтичної композиції у вигляді твердої дозованої форми, де композиція включає: (a) першу частину, яка містить першу кількість нітазоксаніду або його аналога та (b) другу частину, яка містить другу кількість нітазоксаніду або його аналога у композиції негайного вивільнення. [0019] В інших аспектах пропонується спосіб підвищення біодоступності нітазоксаніду або тізоксаніду у пацієнта, де спосіб включає введення пацієнту терапевтично ефективної кількості фармацевтичної композиції у вигляді твердої дозованої форми, де композиція включає: (a) першу частину, яка містить першу кількість нітазоксаніду або його аналога та (b) другу частину, яка містить другу кількість нітазоксаніду або його аналога у композиції негайного вивільнення. [0020] В інших аспектах пропонується спосіб подовження абсорбції нітазоксаніду або тізоксаніду у пацієнта, де спосіб включає введення пацієнту терапевтично ефективної кількості фармацевтичної композиції у вигляді твердої дозованої форми, де композиція включає: (a) першу частину, яка містить першу кількість нітазоксаніду або його аналога та (b) другу частину, 2 UA 107564 C2 5 10 15 20 25 30 35 40 45 50 55 60 яка містить другу кількість нітазоксаніду або його аналога у композиції негайного вивільнення. [0021] В ще інших аспектах пропонується таблетка контрольованого вивільнення для орального введення, де таблетка містить нітазоксанід або його аналог та полімер з низькою в'язкістю, де полімер з низькою в'язкістю контролює вивільнення нітазоксаніду або його аналога. ДОКЛАДНИЙ ОПИС [0022] Дані композиції являють собою композиції контрольованого вивільнення нітазоксаніду або його аналогів, зокрема тверді дозовані форми контрольованого вивільнення, які включають: (a) першу частину, яка містить першу кількість нітазоксаніду або його аналога в композиції контрольованого вивільнення та (b) другу частину, яка містить другу кількість нітазоксаніду або його аналога у композиції негайного вивільнення. Композиції зазвичай представлені у формі двошарової таблетки для орального введення. Композиції можна використовувати для ефективного лікування хронічного гепатиту С та забезпечення покращеної біодоступності та кращої абсорбції нітазоксаніду з меншими побічними ефектами, які звичайно спостерігаються в стандартних композиціях нітазоксаніду. [0023] Якщо не вказано інше, артикль "a" або "an" в тексті на англійській мові означає "один або більше". [0024] Як використано тут, термін "контрольоване вивільнення" стосується властивості фармацевтичної композиції, де абсорбція та біодоступність активного агента в композиції підтримуються таким чином, що терапевтично ефективні кількості активного агента є біодоступними протягом тривалого періоду часу. [0025] Як використано тут, термін "негайне вивільнення" стосується властивості фармацевтичної композиції, де активний агент в композиції роблять біодоступним без значної затримки. [0026] Як використано тут, термін "процес лікування" та "лікування" стосується зменшення серйозності і/або частоти симптомів, усунення симптомів, і/або їх причини, попередження появи симптомів і/або їх причини (наприклад, профілактичної терапії), покращення або усунення шкоди або зниження інтенсивності інфекції. [0027] Під термінами "ефективна кількість" або "терапевтична ефективна кількість" сполуки згідно з винаходом слід розуміти нетоксичну але достатню кількість сполуки згідно з винаходом для забезпечення бажаного ефекту. [0028] Під терміном "фармацевтично прийнятний" розуміється матеріал, який не є біологічно або іншим шляхом небажаним, тобто матеріал можна вводити у фармацевтичну композицію, яку вводять пацієнту, не викликаючи при цьому небажані біологічні ефекти або взаємодії у шкідливий спосіб з будь-яким з інших компонентів композиції, у якій він міститься. Коли термін "фармацевтично прийнятний" використовується по відношенню до фармацевтичного носія або ексципієнта, слід розуміти, що носій або екципієнт відповідає необхідним стандартам токсикології та виробничому тестуванню, або його включено в довідник "Inactive Ingredient Guide", підготовлений Управлінням по санітарному контролю за якістю харчових продуктів та медикаментів (США). [0029] Під "пацієнтом" розуміється будь-яка тварина для якої є бажаним лікування. Пацієнти можуть бути ссавцями і зазвичай, як використано тут, пацієнт являє собою людину. [0030] Дані тверді композиції можуть включати дві частини, кожна з яких містить певну кількість нітазоксаніду або аналога нітазоксаніду. Таким чином, у деяких варіантах втілення композиції включають першу частину, яка містить нітазоксанід або його аналог у композиції контрольованого вивільнення та другу частину, яка містить аналог нітазоксаніду у композиції негайного вивільнення. У деяких варіантах втілення тверда композиція представлена у формі таблетки, у якій частина негайного вивільнення розташована у формі шару, розміщеного на вершині частини контрольованого вивільнення та спресована для утворення таблетки. Тверда дозована форма також може бути у формі капсули, яка включає обидві гранули контрольованого вивільнення та гранули негайного вивільнення. [0031] Дані композиції містять нітазоксанід або його аналог як активний агент. Способи одержання нітазоксаніду відомі фахівцям у даній галузі. Див., наприклад, патент США № 3,950,351, виданий на ім'я Rossignol. Приклади аналогів нітазоксаніду та способи їх одержання описані в патентах США № 7,285,567 та 6,117,894 та опубліковані в заявках на видачу патентів США №№ 2007/0167504, 2007/0015803, 2008/0097106, 2008/0096941 та 2009/0036467. Кожен з цих патентів США та публікацій включені шляхом посилання на їх зміст. [0032] Як використано тут, термін "нітазоксанід" стосується обох нітазоксаніду (2(ацетолілокси)-N-(5-нітро-2-тіазоліл) бензаміду) та аналога нітазоксаніду, наприклад, однієї зі сполук, описаної в патенті США № 7,285,567 або US 2007/0167504. [0033] Нітазоксанід або будь-який з аналогів можна вводити у формі самої сполуки і/або, де 3 UA 107564 C2 5 10 15 20 25 30 35 40 45 50 55 60 прийнятно, у формі солі, поліморфу, естеру, аміду, проліків, похідного або тощо, за умови, що сіль, поліморф, естер, амід, проліки або похідне є прийнятними з точки зору фармакології. Такі солі, естери, аміди, проліки та їх інші похідні цих активних агентів можуть бути одержані за допомогою стандартних методик, які відомі фахівцям у галузі синтетичної органічної хімії і описані, наприклад, в J. March, Advanced Organic Chemistry: Reactions, Mechanisms and Structure, 4th Ed. (New York: Wiley-Interscience, 1992). Для будь-яких активних агентів на основі аналогів нітазоксаніду, які можуть існувати у енантіомерних формах, активні агенти можна вводити в дані композиції як у формі рацемату або у енантіомерно насиченій формі. [0034] Загальна кількість нітазоксаніду в даних композиціях зазвичай складає від приблизно 60 % до 75 % за вагою композиції. В тих варіантах втілення, де присутні частини контрольованого вивільнення та негайного вивільнення, кількість нітазоксаніду в частині контрольованого вивільнення зазвичай перевищує кількість в частині негайного вивільнення при співвідношенні кількості нітазоксаніду в частині контрольованого вивільнення до нітазоксаніду в частині негайного вивільнення, яке складає приблизно 2.5-4.0:1. Наприклад, у деяких варіантах втілення частина контрольованого вивільнення містить приблизно 500 мг нітазоксаніду, а частина негайного вивільнення містить приблизно 175 мг нітазоксаніду. В інших варіантах втілення частина контрольованого вивільнення містить приблизно 250 мг нітазоксаніду, а частина негайного вивільнення містить приблизно 87,5 мг нітазоксаніду. [0035] Композиції може включати один чи більше додаткових фармацевтично прийнятних добавок чи екципієнтів. У варіантах втілення з частинами контрольованого вивільнення та негайного вивільнення обидві частини контрольованого вивільнення та негайного вивільнення можуть містити один чи більше додаткових фармацевтично прийнятних добавок чи екципієнтів. Ці ексципієнти являють собою терапевтично інертні інгредієнти, які є добре відомими та використовуються в галузі. Як використано тут, термін "інертний інгредієнт" стосується тих фармацевтично інертних інгредієнтів, які є добре відомими в галузі фармацевтичної науки, які можуть використовуватись поодинці або в різних комбінаціях, і включають, наприклад, розріджувачі, дезінтегранти, зв'язувальні агенти, суспендуючі агенти, агенти, які сприяють ковзанню, змащувачі, наповнювачі, покривні агенти, агенти, які сприяють розчиненню, підсолоджувачі, барвники, ароматизатори та антиоксиданти. Див., наприклад, Remington: The Science and Practice of Pharmacy 1995, edited by E. W. Martin, Mack Publishing Company, 19th edition, Easton, Pa. [0036] Приклади розріджувачів або наповнювачів включають, але без обмеження, крохмаль, лактозу, ксиліт, сорбіт, кондитерський цукор, пресований цукор, декстрати, декстрин, декстрозу, фруктозу, лактілол, маніт, цукрозу, тальк, мікрокристалічну целюлозу, карбонат кальцію, двоосновний чи трьохосновний фосфат кальцію, дегідрат вторинного кислого фосфату кальцію, сульфат кальцію, тощо. [0037] Розріджувач(і) або наповнювач(і) зазвичай складають приблизно 10 % - 15 % за вагою частини контрольованого вивільнення або негайного вивільнення, або приблизно від 2 % до приблизно 15 % за масою всієї композиції. [0038] Приклади дезінтегрантів включають, але без обмеження, альгінову кислоту, метакрилову кислоту DVB, зшитий PVP, мікрокристалічну целюлозу, кроскармелозу натрію, кросповідон, полакрилін калію, крохмальгліколят натрію, крохмаль, включаючи кукурудзяний або маїсовий крохмаль, пептизований крохмаль і т.п. [0039] Деінтегрант(и) зазвичай складають приблизно 10 % - 15 % за масою частини контрольованого чи негайного вивільнення, або від приблизно 2 % до приблизно 15 % за масою всієї композиції. [0040] Приклади зв'язувальних агентів включають, але не обмежуючись цим, крохмалі, такі як картопляний крохмаль, пшеничний крохмаль, кукурудзяний крохмаль; мікрокристалічну целюлозу; целюлози, такі як цідроксипропілцелюлозу, гідроксиетилцелюлозу, гідроксиметилцелюлозу (HPMC), етилцелюлозу, натрійкарбоксиметилцелюлозу; натуральні камеді як гуміарабік, альгінова кислота, гуарова камедь; рідка глюкоза, декстрин, повідон, сироп, оксид поліетилену, полівінлпіролідон, полі-N-вініламід, поліетиленгліколь, желатин, поліпропіленгліколь, трагакант і т.п. [0041] Зв'язувальний(і) агент(и) зазвичай складають приблизно 2 % - 15 % за масою частини контрольованого чи негайного вивільнення, або від приблизно 0,2 % до приблизно 14 % за масою всієї композиції. [0042] Приклади речовин, що сприяють ковзанню включають, але не обмежуючись цим, діоксид кремнію, колоїдний безводний кремнезем, трисилікат магнію, трьохосновний фосфат кальцію, силікат кальцію, силікат магнію, колоїдний діоксид кремнію, порошкоподібна целюлозу, крохмаль, тальк і т.п. 4 UA 107564 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0043] Речовина(и), що сприяють ковзанню зазвичай складають приблизно 0,1 % - 0,5 % за масою частини контрольованого чи негайного вивільнення, або від приблизно 0,01 % до приблизно 0,3 % за масою приблизно всієї композиції. [0044] Приклади змащувачів включають, але не обмежуючись цим, стеарат магнію, стеарат алюмінію, стеарат кальцію, стеарат цинку, стеаринову кислоту, поліетиленгліколь, гліцерилбегенат, мінеральну олію, стеарилфумарат натрію, тальк, гідрогенізовану рослинну олію і т.п. [0045] Змащувач(і) зазвичай складають приблизно 0,5 % - 1,5 % за масою частини контрольованого чи негайного вивільнення, або від приблизно 0,2 % до приблизно 1,0 % за масою всієї композиції. [0046] У деяких варіантах втілення, наприклад, частина контрольованого вивільнення, частина негайного вивільнення, або обидві включають крохмаль як розріджувач, такий як кукурудзяний чи маїсовий крохмаль; кроскармелозу як дезінтегрант; гідроксипропілцелюлозу, мікрокристалічну целюлозу і/або гідроксипропілметилцелюлозу як зв'язувальний(і) агент(и); дегідрат вторинного кислого фосфату кальцію, як наповнювач; колоїдний безводний кремнезем як речовину, що сприяє ковзанню; та стеарат магнію як змащувач. [0047] Дані композиції контрольованого вивільнення також включають зв'язувальний агент, який є полімером з низькою в'язкістю. Приклади полімерів з низькою в'язкістю включають, але не обмежуючись цим, полімери з низькою в'язкістю на основі гідроксипропілметилцелюлози, такі як ті, що продаються компанією Dow Chemical під торговельною маркою "Methocel®” (наприклад, Methocel E50LV®, Methocel K100LV® та Methocel F50LV®) та, полімери з низькою в'язкістю на основі гідроксиетилцелюлози. Полімер з низькою в'язкістю контролюють вивільнення нітазоксаніду або його аналога у композиції. [0048] Полімер з низькою в'язкістю зазвичай присутній в кількості від приблизно 10 % до приблизно 20 %, або від приблизно 10 % до приблизно 15 %, або - краще приблизно 12 % за загальною масою всієї композиції, або у тих варіантах втілення, які мають частини контрольованого та негайного вивільнення, полімер з низькою в'язкістю в частині контрольованого вивільнення зазвичай присутній у кількості приблизно від 15 % до приблизно 20 %, краще - приблизно 18 % за масою частини контрольованого вивільнення. [0049] Дані композиції також можуть додатково включати покривний матеріал. Покривний матеріал зазвичай присутній як зовнішній шар на дозованій формі, який повністю покриває композицію. Наприклад, у деяких варіантах втілення дозована форма являє собою оральну таблетку, у якій частина контрольованого вивільнення утворює перший шар таблетки і частина негайного вивільнення утворює другий шар, осаджений на вершину першого шару для утворення ядра таблетки. У таких варіантах втілення, наприклад, покривний матеріал може перебувати у формі зовнішнього покривного шару, осадженого на вершину ядра таблетки. [0050] Покривний матеріал зазвичай присутній у кількості від приблизно 1 % до приблизно 5 % за масою композиції. [0051] Покривний матеріал може включати гідроксипропілметилцелюлозу і/або поліетиленгліколь і може включати один чи більше ексципієнтів, вибраних з групи, яка включає покривні агенти, агенти для надання непрозорості, агенти для маскування смаку, наповнювачі, полірувальні агенти, барвники, агенти проти злипання і т.п. Наприклад, покривний матеріал може містити діоксид титану як агент для надання непрозорості. Приклади плівкоутворюючих речовин та способи застосування таких покривних речовин добре відомі фахівцям у галузі. [0052] Наприклад, покривний матеріал, який використовують у даних композиціях, може являти собою OPADRY AMB 80W91416 або OPADRY FX 63F97546 як у прикладах, які наведені нижче. [0053] Способи приготування твердих фармацевтичних композицій добре відомі фахівцям у галузі фармацевтичних композицій і можуть бути застосовані для приготування даних композиції. Див., наприклад, Remington: The Science and Practice of Pharmacy (1995), edited by E. W. Martin, Mack Publishing Company, 19th edition, Easton, Pa. [0054] Дані композиції можуть бути ефективно застосовані для лікування хронічного гепатиту С та забезпечувати підвищену біодоступність та кращу абсорбцію нітазоксаніду з меншими побічними ефектами, які звичайно притаманні стандартним композиціям нітазоксаніду. [0055] Композиції можна вводити протягом будь-якого відрізку часу, придатного для ефективного лікування гепатиту С. Для композицій можна використовувати будь-яке придатне дозування та режим. Введення можна зазвичай проводити протягом періоду від приблизно 3 днів до приблизно 104 тижнів, але його можна проводити довше періоду 104 тижнів і навіть можна проводити без обмеження строку. Наприклад, лікування гепатиту С із застосуванням даних композицій зазвичай включає введення композицій протягом періоду 12, 24, або 48 5 UA 107564 C2 5 10 15 20 25 30 35 40 45 50 55 60 тижнів. Необхідний режим може призначити лікар. [0056] У дані фармацевтичні композиції та способи лікування може бути включений один чи більше додаткових активних агентів. Наприклад, у деяких варіантах втілення композиції можуть включати один чи більше терапевтичних агентів, які є корисні у лікування гепатиту С, такі як рибавірин та імуностимулюючі агенти, які включають, але не обмежуючись цим, інтерферони, такі як інтерферон α-2b, похідне інтерферону α-2b, таке як поліетиленгліколь-зв'язана форма інтерферону α-2b, інтерферон α-2a, інтерферон альфакон-1. [0057] Композиція та додатковий активний агент (наприклад, інтерферон) можна вводити одночасно або роздільно у той же час або у різних композиціях (включаючи різні композиції, які можуть різнитись дозованою формою, профілями вивільнення і т.п.). [0058] Наприклад, у деяких варіантах втілення пацієнт, який страждає від гепатиту С, спершу попередньо лікують однією з композицій нітазоксаніду, які тут описані. Тривалість попереднього лікування може становити між приблизно 3 днями та приблизно 6 місяцями, наприклад, між приблизно 1 тижнем та приблизно 12 тижнями, і як додатковий приклад - між приблизно 1 тижнем та приблизно 4 тижнями. Період попереднього лікування можна потім продовжити періодом лікування, де пацієнта після періоду попереднього лікування лікують одним інтерфероном або інтерфероном плюс нітазоксанід і, необов'язково, одним чи більше додатковими агентами, таким як противірусний агент, наприклад, рибавірин. Протягом періоду лікування може бути використаний будь-який з описаних тут інтерферонів. Тривалість періоду лікування може бути будь-якою, яка потрібна для одержання бажаної відповіді і зазвичай буде знаходитись в межах між приблизно 1 днем та приблизно 12 місяцями або довше. Наприклад, період лікування може включати тижневі ін'єкції інтерферону і може включати один тиждень лікування, 2-4 тижні лікування, 4-12 тижнів лікування або довше (6 місяців, 1 рік, 2 роки, або без строку). [0059] Слід розуміти, що опис а також Приклади, які наводяться далі, призначені лише для ілюстрації, а не обмеження обсягу винаходу. Інші аспекти, переваги та модифікації в межах обсягу винаходу будуть зрозумілі фахівцям у галузі, до якої відноситься винахід. ПРИКЛАДИ Приклад 1 Фактори, які впливають на біодоступність Нітазоксаніду [0060] Було проведено дослідження для з'ясування як кожен з нижчевказаних факторів впливає на біодоступність нітазоксаніду: (1) абсорбція тізоксаніду проти нітазоксаніду, (2) модифікація місця вивільнення в шлунково-кишковому тракті, (3) вплив різних полімерів та (4) вплив грануляції у спирті проти води. [0061] Для дослідження впливу з кожного з факторів шість різних композицій нітазоксаніду і/або тізоксаніду вводили орально з їжею чотирьом здоровим дорослим добровольцям чоловічої статі. Кожен з добровольців одержував кожну з шести композицій у шість різних періодів лікування, де кожен період лікування розділяли одним тижнем. Композиції вводили орально з їжею. Зразки крові відбирали в одинадцятьох часових точках: відразу після введення дози та на 1, 2, 3, 4, 5, 6, 7, 8, 10 і 12 години після введення дози. Вводили наступні композиції: (1) таблетку негайного вивільнення ("IR") нітазоксаніду/тізоксаніду, що містила 500 мг 99 % нітазоксаніду/1 % тізоксаніду як активний інгредієнт; (2) таблетку негайного вивільнення тізоксаніду, що містила 500 мг тізоксаніду як активний інгредієнт; (3) таблетку з ентеросолюбільною оболонкою IR нітазоксаніду/тізоксаніду, покриту ACRYL® EZE 70мг (10 % приросту маси); (4) таблетку нітазоксаніду/тізоксаніду, що містила 500 мг 99 % нітазоксаніду, 1 % тізокасаніду як активний інгредієнт, гранульований у спирті з гідроксипропілметилцеллюлозою (Metolose 90 SH) 100.000 SR як зв'язувальним агентом та дегідратом вторинного кислого фосфату кальцію як наповнювачем; (5)) таблетку нітазоксаніду/тізоксаніду, що містила 500 мг 99 % нітазоксаніду, 1 % тізокасаніду як активний інгредієнт, гранульований у воді з гідроксипропілметилцеллюлозою (Metolose 90 SH) 100.000 SR як зв'язувальним агентом та дегідратом вторинного кислого фосфату кальцію як наповнювачем; та (6) таблетку нітазоксаніду/тізоксаніду, що містила 450 мг 99 % нітазоксаніду, 1 % тізокасаніду як активний інгредієнт, гранульований у воді з гідроксипропілметилцеллюлозою (Methocel K100LV), 100 cP як зв'язувальним агентом та дегідратом вторинного кислого фосфату кальцію як наповнювачем (пацієнтам вводили дві таблетки). [0062] Параметри фармакокінетики сироватки (PK) розраховували із зразків крові, взятих у добровольців. Серединні значення для AUCt (мкг∙год./мл), Cmax (мкг/мл), Cmin (мкг/мл), та Tmax 6 UA 107564 C2 (год.) наводяться в Таблиці 1. Таблиця 1 Серединні значення фармакокінетичних параметрів для тізоксаніду після введення шести різних фармацевтичних композицій, які включали нітазоксанід і/або тізоксанід чотирьом здоровим дорослим добровольцям чоловічої статі Композиція 1 (1) Таблетка IR, 500 мг 2 (2) Тізоксанід, 500 мг (3) Таблетка IR з ентеросолюбільною покриттям, 3 500 мг (4) Полімер з високою в'язкістю (сухе гранулювання), 4 500 м (5) Полімер з високою в'язкістю 2 (вологе 5 гранулювання), 500 мг (6) Полімер з низькою в'язкістю (900 мг, 2 × 450 мг 6 таблетки) AUCt мкг*год./мл 38,07 9,12 Cmax мкг/мл 9,75 1,81 Cmin Мкг/мл 0,05 0,00 Tmax (год.) 3 4 26,97 6,50 0,00 8 2,88 0,72 0,00 7 6,14 1,49 0,00 8 34,77 7,03 0,21 7 1 Стандартна таблетка негайного вивільнення, яка містить приблизно 500 мг активного інгредієнта, який являє собою 99 % нітазоксаніду/1 % тізоксаніду. 2 Такий же склад, що в таблетці IR, за винятком, що активний інгредієнт являє собою 100 % тізоксанід. 3 ® Таблетка IR, покрита ACRYL-EZE 70mg (10 % приросту маси). 4 500 мг активного інгредієнта (99 % нітазоксаніду, 1 % тізоксаніду), гранульованого у спирті з гідроксипропілметилцелюлозою (HPMC), 100,000 сантипуаз ("cP") (Metolose 90 SH 100.000 SR) як зв'язувальним агентом та дегідратом вторинного кислого фосфату кальцію як наповнювачем. 5 500 мг активного інгредієнта (99 % нітазоксаніду, 1 % тізоксаніду), гранульованого у воді з HPMC, 100,000 cP (Metolose 90 SH 100.000 SR) як зв'язувальним агентом та дегідратом вторинного кислого фосфату кальцію як наповнювачем. 6 450 мг активного інгредієнта (99 % нітазоксаніду, 1 % тізоксаніду), гранульованого у воді з HPMC, 100 cP (Methocel K100LV). Цим пацієнтам вводили дві таблетки. 5 10 15 20 [0063] Несподівано виявлено, що біодоступність була значно нижче після орального введення тізоксаніду (Композиція 2) у порівнянні з нітазоксанідом (Композиція 1). [0064] Таблетка з ентеросолюбільним покриттям IR нітазоксаніду/тізоксаніду (Композиція 3) уповільнювала абсорбцію у двох пацієнтів, як засвідчено підвищенням T max від 3 до 8 годин, але вона також перешкоджала абсорбції з двох інших пацієнтів. [0065] Полімер з високою в'язкістю (HPMC 100,000 cP) у Композиції 4 та 5 суттєво перешкоджав абсорбції. [0066] Гранулювання у воді з використанням полімеру з високою в'язкістю (Композиція 5) поліпшило абсорбцію у порівнянні з гранулюванням у спирті (Композиція 4). [0067] Зниження в'язкості HPMC до 100 cP (Композиція 6) привело до суттєвого покращення абсорбції (AUCt), але абсорбція все ще була нижчою у порівнянні з абсорбцією таблетки IR. Крім того, навіть з уповільненою абсорбцією та використанням більшої дози 900 мг, тізоксанід швидко виводився з сироватки, таким чином, що концентрація тізоксаніду в сироватці через 12 годин після введення дози становила нижче 2 мкг/мл у всіх чотирьох пацієнтів (серединне значення 1,28 мкг/мл). Приклад 2 Композиція двошарової таблетки [0068] Двошарову таблетку, яка включала загалом 650 мг нітазоксаніду, виготовили за допомогою стандартної методики одержання композицій, як описано вище. Склад двошарової таблетки наведений в Таблиці 2. 7 UA 107564 C2 Таблиця 2 Таблетка контрольованого вивільнення, яка містить 675 мг нітазоксаніду ІНГРЕДІЄНТИ Одиниця складу (мг/таблетка) Функція Шар негайного вивільнення Нітазоксанід Неактивні речовини: 175 Активна речовина Кукурудзяний крохмаль 36 Розріджувач/дезінтегрант Гідроксипропілцелюлоза (Klucel EF) 5 Посилання на стандарти* Натрій кроскармелоза 7,5 Колоїдний безводний кремнезем (Aerosil 200) 1 Мікрокристалічна целюлоза 23 Стеарат магнію 2,5 Вода, очищена 50 Шар контрольованого вивільнення Нітазоксанід Неактивні речовини: Гідроксипропілцелюлоза (Klucel EF) Гідроксипропілметилцелюлоза (Methocel E50LV) Дегідрат вторинного кислого фосфату кальцію (Emcompress) Колоїдний безводний кремнезем (Aerosil 200) 500 2,5 135 102,5 Монографія Європ. Фармакоп. 0344 Зв'язувальний/суспендуючий Європ. Фармакоп. агент 0337 Європ. Фармакоп. Дезінтегрант 0985 Європ. Фармакоп. Агент, що сприяє ковзанню 0434 Європ. Фармакоп. Сухий зв'язувальний агент 0316 Європ. Фармакоп. Змащувач 0229 Європ. Фармакоп. Розчинник 0008 Активна речовина Монографія Зв'язувальний/суспендуючий агент Зв'язувальний/суспендуючий агент Європ. Фармакоп. 0337 Європ. Фармакоп. 0348 Наповнювач Європ. Фармакоп. 0116 Європ. Фармакоп. 0434 Європ. Фармакоп. 0229 Європ. Фармакоп. 0008 3 Агент, що сприяє ковзанню Стеарат магнію 7 Змащувач Вода, очищена 60 Розчинник 40 Покриття Власна монографія 5 Покриття Власна монографія 326 Розчинник Європ. Фармакоп.0008 Покривні матеріали OPADRY AMB 80W91416, GREEN (містить блакитний пігмент к. п. 63, полівініловий спирт, тальк, лецитини, ксантанову камедь, діоксид титану, жовтий пігмент к. п. 42) OPADRY FX 63F97546, Gloss (містить полівініловий спирт, тальк, поліетиленгліколь, перламутровий пігмент на основі слюди, полісорбат 80) Вода, очищена * Посилання відносяться до поточних видань. 8 UA 107564 C2 5 Приклад 3 Гуртове одержання двошарових таблеток [0069] Партія зі 100,000 двошарових таблеток нітазоксаніду (650 мг) з Прикладу 2 була одержана як показано в Таблиці 3. Таблиця 3 Одержання гуртового складу для таблеток контрольованого вивільнення, які містять 675 мг нітазоксаніду Одиниця складу Гуртовий склад (мг/таблетку) (100,000 таблеток) ІНГРЕДІЄНТИ Шар негайного вивільнення Нітазоксанід Неактивні речовини: Кукурудзяний крохмаль Гідроксипропілцелюлоза (Klucel EF) Натрій кроскармелоза Колоїдний безводний кремнезем (Aerosil 200) Мікрокристалічна целюлоза Стеарат магнію Вода, очищена Шар контрольованого вивільнення Нітазоксанід Неактивні речовини: Гідроксипропілцелюлоза (Klucel EF) Гідроксипропілметилцелюлоза (Methocel E50LV) Дегідрат вторинного кислого фосфату кальцію (Emcompress) Колоїдний безводний кремнезем (Aerosil 200) Стеарат магнію Вода, очищена Покривні матеріали: OPADRY AMB 80W91416, GREEN містить блакитний пігмент к. п. 63, полівініловий спирт, тальк, лецитини, ксантанову камедь, діоксид титану, жовтий пігмент к. п. 42 OPADRY FX 63F97546, Gloss (містить полівініловий спирт, тальк, поліетиленгліколь, перламутровий пігмент на основі слюди, полісорбат 80) Вода, очищена 10 15 20 175 17,5 кг 36 5 7,5 1 23 2,5 50 3,6 кг 0,5 кг 0,75 кг 0,1 кг 2,3 кг 0,25 кг 5 кг 500 50 кг 2,5 135 0,25 кг 13,5 кг 102,5 10,25 кг 3 7 60 0,3 кг 0,7 кг 6 кг 40 4 кг 5 0.5 кг 326 32,6 кг [0070] Таблетки були вироблені згідно з наступною виробничою протокольною схемою викладеною нижче. A. Обладнання Сито Frewitt Планетарний змішувач Collette Сушильна піч Таблетувальна машина - прес Manesty BB Пиловловлювач для таблеток Покривальний апарат - Accelacota [0071] Усе виробниче обладнання перед використанням чистять. B. Приготування грануляту негайного вивільнення (Гранулят A) 1. Зважені сировинні матеріали поміщають у герметичні пластикові пакети. 2. Справність машини перевіряють перед та після використання. 3. Якщо потрібно, нітазоксанід та кукурудзяний крохмаль просіюють крізь сито з отворами 1,25 мм використовуючи машину Frewitt. 4. Ці інгредієнти переносять в резервуар планетарного змішувача Collette і змішують протягом 15 хвилин на маленькій швидкості. 9 UA 107564 C2 5 10 15 20 25 30 35 40 45 50 55 60 5. Гідроксипропілцелюлозу (HPC) розчиняють у воді, і дають вистоятись протягом ночі. 6. Цей розчин HPC повільно додають з перемішуванням і вміст перемішують протягом 5-10 хвилин на маленькій швидкості. 7. Якщо потрібно, додатково додають воду. 8. Гранулят просіюють крізь сито з отворами 4 мм використовуючи машину Frewitt, поміщають на лотки та висушують при 50 °C протягом від 12 до 16 годин. 9. Лотки виймають з печі, зразки беруть для аналізу втрат при висушуванні. 10. Висушений гранулят повторно просіюють крізь сито з отворами 1,25 мм використовуючи машину Frewitt і переносять в барабан змішувача. 11. Аеросил, натрію кроскармелозу та мікрокристалічну целюлозу просіюють крізь сито з отворами 1,25 мм використовуючи машину Frewitt і додають до вищезазначеного та перемішують протягом 15 хвилин на маленькій швидкості. 12. Стеарат магнію просіюють крізь сито з отворами 1,25 мм використовуючи машину Frewitt і додають до вищезазначеного та перемішують протягом 4 хвилин на маленькій швидкості. C. Приготування грануляту контрольованого вивільнення (Гранулят B) 1. Зважені сировинні матеріали поміщають у герметичні пластикові пакети. 2. Справність машини перевіряють перед та після використання. 3. Нітазоксанід переносять в резервуар планетарного змішувача Collette. 4. Розчиняють HPC у воді, залишають to stand всю ніч. 5. Розчин HPC повільно додають з перемішуванням і вміст перемішують протягом 5-10 хвилин на маленькій швидкості. 6. Якщо потрібно, додатково додають воду. 7. Гранулят просіюють крізь сито з отворами 4 мм використовуючи машину Frewitt, поміщають на лотки та висушують при 50 °C протягом від 12 до 16 годин. 8. Лотки виймають з печі, зразки беруть для аналізу втрат при висушуванні. 9. Висушений гранулят повторно просіюють крізь сито з отворами 1,25 мм використовуючи машину Frewitt і переносять в барабан змішувача. 10. Гідроксипропілметилцелюлозу, дегідрат вторинного кислого фосфату кальцію та аеросил просіюють крізь сито з отворами 1,25 мм використовуючи машину Frewitt. 11. Ці інгредієнти додають до резервуару планетарного змішувача Collette і перемішують протягом 15 хвилин на маленькій швидкості. 12. Стеарат магнію просіюють крізь сито з отворами 1,25 мм використовуючи машину Frewitt і додають до вищезазначеного та перемішують протягом 4 хвилин на маленькій швидкості. D. Таблетування 1. Таблетування здійснюють використовуючи таблетувальний прес Manesty BB (19 мм видовжений двоопуклий пробійник). 2. Заповнення та попереднє пресування грануляту B: цільова вага = 750 мг друге заповнення гранулятом A: цільова вага = 250 мг та кінцеве пресування: цільова вага = 1000 мг [0072] Пресування коригують після наочної перевірки. 1. Таблетки очищають від пилу. 2. Таблетки беруть для контролю ваги, крихкості, кількісного аналізу, товщини та твердості. 3. Маса брутто та нетто одержаних таблеток документується. Якщо вона не в межах ± 5 % від ліміту, причини втрат мають бути задокументовані. E. Покриття 1. Перевіряють ідентичність і матеріалу, який використовують для виробництва, та чистоту виробничої лінії. 2. Таблетки доставляють до глазурувального апарату (Accelacota). 3. Готують покривну суспензію як визначено нижче: Очищену воду поміщають в придатну посудину. Розчиняють OPADRY AMB 80W91416, GREEN шляхом швидкого збовтування. Після всього OPADRY додають, продовжуючи збовтування в наступні 45 хвилин. 4. Покривну суспензію наливають в покривальний апарат (Accelacota). 5. Обережно перемішують в процесі розпилення покривної суспензію. 6. Повторюють крок 32-34 з OPADRY FX 63F97546, Gloss. 7. Потім, підтверджується збільшення ваги у 100 таблеток. Зростання має становити принаймні 35 мг/таблетку. 8. Відбір зразків та контроль ваги одиниці і подрібнення на складові частини. 9. Після підтвердження гарантії якості, таблетки поміщають в чисті посудини, вкриті двома поліетиленовими пакетами. 10 UA 107564 C2 5 10 15 20 Приклад 4 Тестування кінцевих двошарових таблеток [0073] Двошарова таблетка, яка містить 675 мг нітазоксаніду, описана в Прикладах 2 та 3 ("таблетка, яка містить 675 мг NTZ") була протестована в двох клінічних дослідженнях. 1. Дослідження RM06-1001 (Дослідження фармакокінетики та стерпності в здоров'ї добровольців з вживанням 675 мг таблеток контрольованого вивільнення). [0074] 12 здорових дорослих добровольців були випадково обрані у двічі сліпий спосіб для приймання однієї таблетки, яка містить 675 мг NTZ, та однієї таблетки плацебо двічі на день або двох таблеток, які містять 675 мг NTZ, двічі на день протягом 7 днів. Після 7-денного періоду промивання, кожного суб'єкта піддають 7 денному періоду лікування дозою, яку він не отримував протягом першого 7-денного періоду лікування. Зразки плазми збирали для аналізу NTZ метаболізмів, тізоксаніду (T) і тізоксанід глюкуроніду (TG), протягом 12 годин наступних за першою дозою в 1-й день, перед ранковою дозою на 5-й день 6-й день та протягом 24 годин наступних за ранковою дозою на 7-й день (остання доза). [0075] Наступна таблиця показує важливі фармакокінетичні параметри тізоксаніду, отримані після 7 днів прийому таблеток контрольованого вивільнення у порівняні з результатами отриманими при подібному дослідженні з використанням таблеток негайного вивільнення ("IR"), які містять 500 мг нітазоксаніду (Дослідження 198.637). Загальний вплив (AUC) та мінімальні концентрації плазми (Cmin) були значно вищі для таблетки контрольованого вивільнення ніж для таблетки IR, проте максимальні концентрації плазми були однакові. Таблиця 4 Співставлення важливих фармакокінетичних параметрів тізоксаніду з дослідження RM06-1001 до історичних даних з подібного дослідження таблеток негайного вивільнення, які містять 500 мг нітазоксаніду AUC(мкг.год./мл) Cmin (мкг/мл) Cmax (мкг/мл) 25 30 35 40 Таблетка CR 675 мг двічі на 1350 мг двічі на день (n=12) день (n=11) 78,3 221 1,26 5,39 11,9 29,8 Таблетка IR 500 мг двічі на 1000 мг двічі на день (n=6) день (n=5) 52,3 158 0,40 2,14 9,3 24,4 [0076] Величини представлені в Таблиці 4 є середніми арифметичними. Дані для таблетки CR були взяті з дослідження RM06-1001. Дані для таблетки IR було взято з дослідження 198.637. В обох дослідженнях, таблетки вживалися двічі на день з їжею протягом 7 днів здоровими дорослими добровольцями чоловічої статі. Фармакокінетичні параметри представлені на 7-й день в режимі введення двічі на день. [0077] Лише слабке стримування побічних ефектів було спостережено у Дослідженні RM061001, найбільш поширеними були хроматурія, втома, діарея, кон'юнктивне знебарвлення, черевний біль та нудота. Побічні ефекти, що траплялися з більшою частотою при лікуванні високою дозою, такі: діарея (8 [73 %] проти 4 [33 %] суб'єктів), нудота (7 [64 %] проти 3 [25 %] суб'єктів), черевний біль (6 [55 %] проти 2 [17 %] суб'єктів), та погіршення апетиту (4 [36 %] проти 1 [8 %] суб'єкта). Частота виявлення усіх інших побічних ефектів була подібна двом режимам лікування. Не було виявлено ніяких значних змін у клінічних лабораторних показниках, показниках життєво важливих функцій чи ECG параметрів. [0078] Історично, найбільш поширені побічні ефекти, пов'язані з оральним введенням нітазоксаніду відносяться до шлунково-кишкового тракту. Наступна таблиця відображає найбільш поширені шлунково-кишкові побічні ефекти, взяті з Дослідження RM06-1001 разом з даними, опублікованими в Дослідженні 198.637 використовуючи 500 мг таблетку негайного вивільнення (IR). Дані в Таблиці 5 свідчать, що таблетка контрольованого вивільнення більш стерпна ніж таблетка негайного вивільнення. 11 UA 107564 C2 Таблиця 5 Порівняння кількості пацієнтів, що скаржаться на найбільш поширені шлунково-кишкові побічні ефекти, з Фази I клінічних досліджень у здорових добровольців чоловічої статі: Дослідження RM06-1001 та 198.637 Черевний біль Діарея Метеоризм Нудота Всього Всього/n 3 Середній AEs 4 Припинення Плацебо Таблетка IR 1 BID (n=4) 1,25 % 2,50 % 2,50 % 0,0 % 5 1,25 0,0 % 0,0 % Таблетка CR 675 мг BID 2 (n=12) 2,17 % 4,33 % 0,0 % 3,25 % 9 0,75 0,0 % 0,0 % Таблетка IR 500 мг BID 1 (n=6) 3,50 % 4,67 % 1,17 % 0,0 % 8 1,25 0,0 % 0,0 % Таблетка CR 1350 мг BID 2 (n=11) 6,55 % 8,73 % 0,0 % 7,64 % 21 1,91 4,37 % 0,0 % Таблетка IR 1000 мг BID 1 (n=6) 6,100 % 5,83 % 4,67 % 4,67 % 21 3,5 3,50 % 1,17 % 1 З дослідження 198.637. З дослідження RM06-1001. 3 Усі інші побічні ефекти були слабкими. 4 Припинення зумовлене побічними ефектами. 2 5 10 15 20 25 [0079] Дані для таблетки CR брали з дослідження RM06-1001 (фінальний звіт по приготуванню). Дані для таблетки IR та таблеток плацебо були взяті з дослідження 198.637. В обох дослідженнях, таблетки вживалися двічі на день з їжею протягом 7 днів здоровими дорослими добровольцями чоловічої статі. Обидва дослідження проводилися в одному і тому ж клінічному центрі SGS Biopharma (CRO), і обидва дослідження були анонімними, тож ніхто з пацієнтів чи лікарів не знав до якої групи лікування він відносився. Дослідження таблетки IR було проведено в 1998 році, і дослідження таблетки CR було проведено в 2008 році. 2. Дослідження RM06-1002 (Вірусне кінетичне дослідження в пацієнтів з хронічним гепатитом C генотипу 4 використовуючи таблетки контрольованого вивільнення, які містять 675 мг нітазоксаніду). [0080] 40 інтерферон-нативних пацієнтів з хронічним гепатитом C генотипу 4 були випадково (2:2:1) обрані у двічі сліпий спосіб для отримання NTZ 675 мг двічі на день протягом 4 тижнів, після цього вводили NTZ 675 мг двічі на день +PegIFN+RBV протягом 48 тижнів, NTZ 1350 мг двічі на день протягом 4 тижнів, після цього вводили NTZ 1350 мг двічі на день +PegIFN+RBV протягом 48 тижнів, або плацебо двічі на день протягом 4 тижнів, після цього вводили ® плацебо+PegIFN+RBV протягом 48 тижнів. Доза PegIFN (пегінтерферон альфа-2a, Pegasys , ® Roche, Базель, Швейцарія) становила180 мкг/тиждень, і доза RBV (Viracure , October Pharma, Каїр, Єгипет) становила 1000 мг/день (вага
ДивитисяДодаткова інформація
Назва патенту англійськоюControlled release pharmaceutical formulations of nitazoxanide
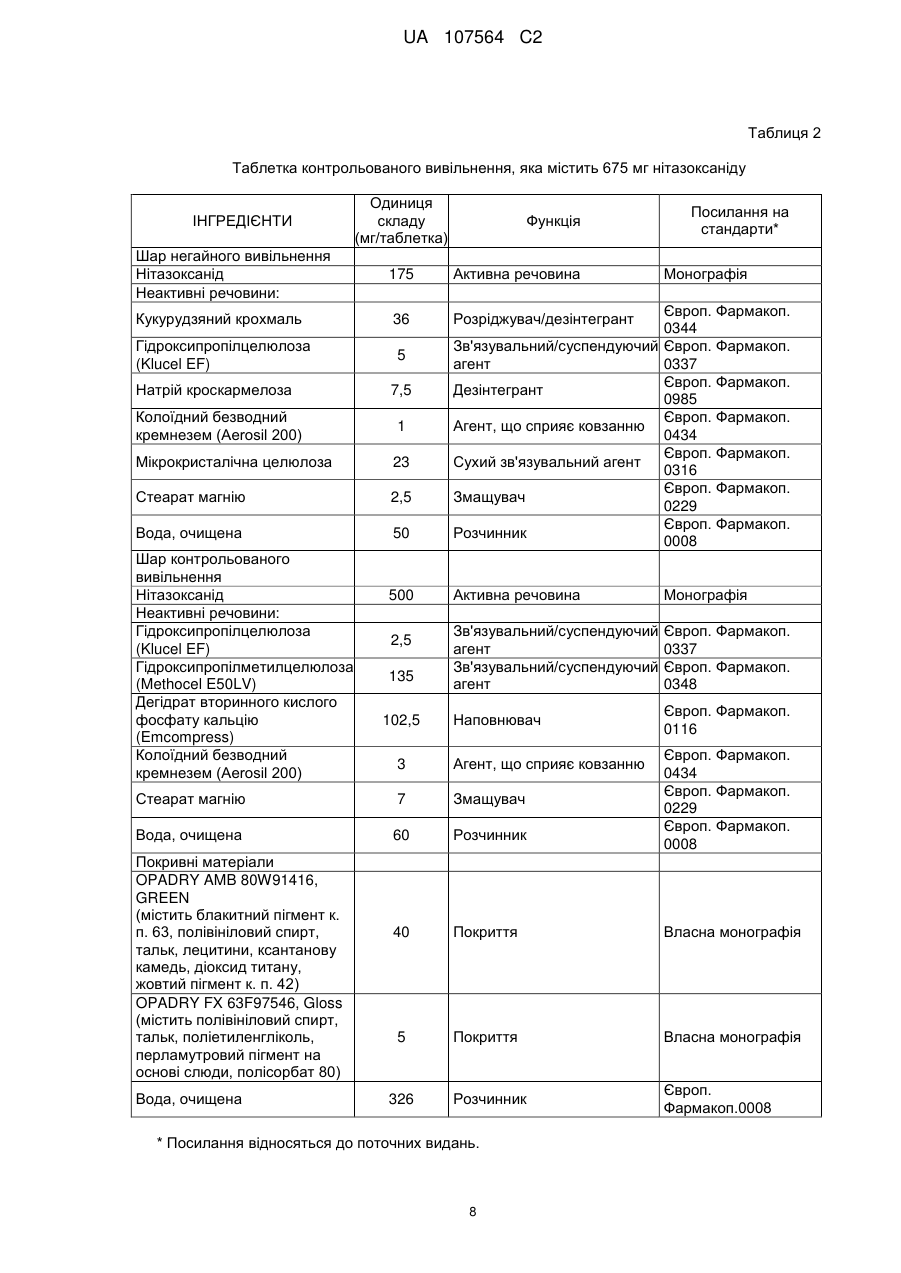
Автори російськоюRossignol, Jean-Francois, Ayers, Marc
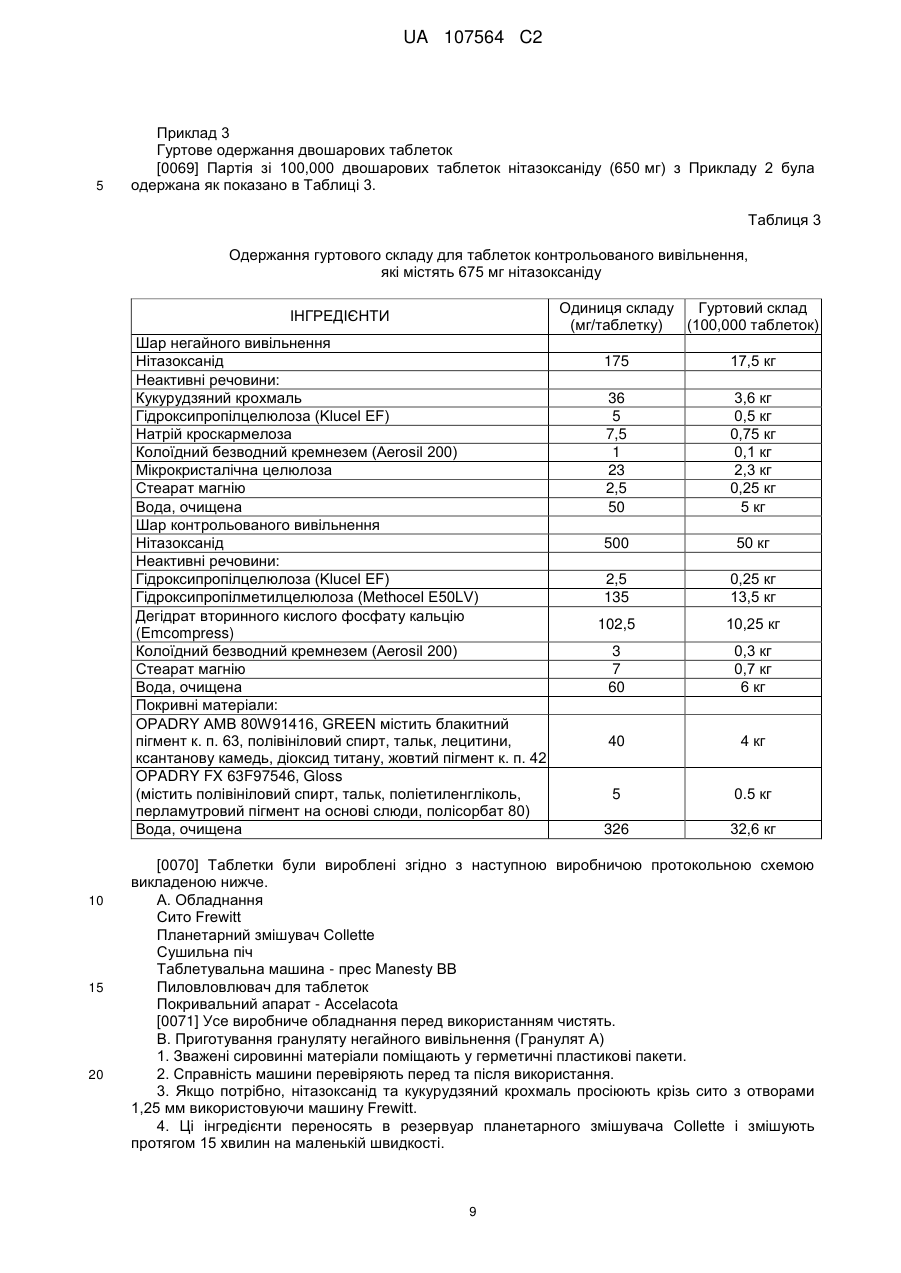
МПК / Мітки
МПК: A61K 31/495, A01N 43/60
Мітки: вивільнення, фармацевтична, композиція, яка, містить, нітазоксанід, контрольованого
Код посилання
<a href="https://ua.patents.su/18-107564-farmacevtichna-kompoziciya-kontrolovanogo-vivilnennya-yaka-mistit-nitazoksanid.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція контрольованого вивільнення, яка містить нітазоксанід</a>
Попередній патент: Фармацевтичний препарат для трансдермального застосування
Наступний патент: Титановий сляб для гарячого вальцювання, одержаний за допомогою електронно-променевої печі, спосіб його виготовлення та спосіб вальцювання титанового сляба
Випадковий патент: Спосіб переробки металовмісної сировини