Нестероїдні сполуки, корисні як модулятори глюкокортикоїдних рецепторів
Номер патенту: 92024
Опубліковано: 27.09.2010
Формула / Реферат
1. Сполука загальної формули І:
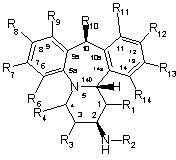 Формула І
Формула І
або її фармацевтично прийнятна сіль,
де групи R мають наступні значення:
R1 - -Н або -(1-4С)алкіл;
R2 - -C(O)R15 або -SO2R15;
R3 - -Н, -(1-4С)алкіл або -OR16;
R4 - -Н, -(1-4С)алкіл або -OR16;
R6 - -Н або -C(R16)NOR16;
R7 - -Н, -галоген, -ціано;
(1-6С)алкіл, -(2-6С)алкеніл або -(2-6С)алкініл, усі необов'язково заміщені замісником, вибраним з групи: аміно, -гідроксил або -галоген;
R8 - -Н, -ціано, -галоген, -нітро;
(1-6С)алкіл, -(2-6С)алкеніл, -(2-6С)алкініл або -О(1-6С)алкіл, усі необов'язково заміщені замісником, вибраним з групи: -аміно, -гідроксил або -галоген;
(гетеро)арил, необов'язково заміщений замісником, вибраним з групи: -ціано, -галоген, -(1-4С)алкіл, -(1-4С)алкоксил, -(1-4С)алкоксі(1-4С)алкіл або -(гетеро)арил;
C(R16)NOR16, -C(O)N(R17)2, -C(O)R18, -C(O)O-R19, NHC(O)R20 або -NHS(O)2R21;
R9 - -H, -галоген, -ціано або -(1-4С)алкіл, необов'язково заміщений галогеном;
R10 - -Н або -(1-4С)алкіл;
R11 - Н;
R12 - -Н, -ціано або -(1-4С)алкіл;
R13 - -Н, -(1-4С)алкіл, -галоген або -форміл;
R14 - -Н, -галоген, -ціано, -(1-4С)алкіл або -(гетеро)арил;
R15 - Н;
(1-6С)алкіл, -(2-6С)алкеніл, -(2-6С)алкініл, -О(2-6С)алкіл, -О(2-6С)алкеніл або -О(2-6С)алкініл, усі необов'язково заміщені одним або більше замісниками, вибраними з групи: -ОН, -галоген, -ціано або -(гетеро)арил;
(гетеро)арил, необов'язково заміщений замісником, вибраним з групи: -(1-4С)алкіл, -галоген або NH2;
NH2, -(ді)(1-4С)алкіламіно, -(1-4С)алкілтіо(1-4С)алкіл, -(1-4С)алкоксі(1-4С)алкіл або NR16OR16;
R16 - -Н, -(1-6С)алкіл, -(2-6С)алкеніл або -(2-6С)алкініл;
R17 - -H;
(1-6С)алкіл, необов'язково заміщений галогеном, -(1-4С)алкоксил або -(гетеро)арил, необов'язково заміщений замісником, вибраним з групи: галоген, -(1-4С)алкіл або -(1-4С)алкоксил;
(3-6С)циклоалкіл або -(гетеро)арил, необов'язково заміщений замісником, вибраним з групи: -галоген, -(1-4С)алкіл або -(1-4С)алкоксил;
R18 - -Н, NH2 або -(1-4С)алкіл, необов'язково заміщений замісником, вибраним з групи: -ОН, -галоген, -ціано або -S(1-4С)алкіл;
R19 - -Н або -(1-6С)алкіл, необов'язково заміщений замісником, вибраним з групи: -ОН або -галоген; а
R20 - Н;
(1-6С)алкіл або -(2-6С)алкеніл, обидва необов'язково заміщені замісником, вибраним з групи: -галоген, -О(1-6С)алкіл, -(гетеро)арил, необов'язково заміщений замісником, вибраним з групи: -(1-4С)алкіл або -галоген;
(3-6С)циклоалкіл, -(1-6С)алкоксил, -(1-6С)алкенілоксил; або
(гетеро)арил, необов'язково заміщений -(1-4С)алкілом; NH2, NН(1-6С)алкіл або -NН((гетеро)арил), а
R21 - -Н або -(1-6С)алкіл.
2. Сполука за п. 1, де R3, R6, R7, R9, R12, R13, R14 представляють -Н, a R4 та R16 - -Н або -(1-4С)алкіл.
3. Сполука за п. 1 чи 2, де R1 - -Н,
R8 - -Н, -ціано або -галоген;
(гетеро)арил, необов'язково заміщений -(1-4С)алкілом;
C(R16)NOR16, -C(O)N(R17)2, -C(O)R18 aбo -C(O)OR19;
R10 - -(1-4C)алкіл;
R15 - -(1-6С)алкіл, необов'язково заміщений одним або більше -галогеном або -(гетеро)арилом;
(гетеро)арил, необов'язково заміщений -(1-4C)алкілом або NH2, або
(ді)(1-4С)алкіламіно;
R17 - -(гетеро)арил, необов'язково заміщений -(1-4С)алкоксилом;
R18 - -(1-4C)алкіл, a
R19 - -(1-6C)алкіл.
4. Сполука, вибрана з групи:
peл-N-[(2R,10R,14bR)-8-бром-1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-2,2,2-трифлуорацетамід;
peл-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-2,2,2-трифлуорацетамід;
peл-2,2-дихлор-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14b-гексагідро-10-метилбензо[c,f]піридо[1,2-a]азепін-2-іл]ацетамід;
peл-2,2,2-тpифлyop-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил-1,2,3-тіадіазол-5-карбоксамід;
рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-2,2-дифлуорацетамід;
рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]метансульфонамід;
рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]етансульфонамід;
peл-N'-[(2R,10R,14bR)-8-цiaнo-1,2,3,4,10,14b-гeкcaгiдpo-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-N,N-диметиламіносульфамід;
рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-3,5-диметилізоксазол-4-карбоксамід;
peл-N-[(2R,10R,14bR)-8-ацетил-1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-2,2,2-трифлуорацетамід;
рел-N-[(2R,10R,14bR)-8-ацетил-1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2]-а]азепін-2-іл]-4-метил-1,2,3-тіадіазол-5-карбоксамід;
рел-2,2,2-трифлуор-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-8-[1-(гідроксііміно)етил]-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
рел-2,2,2-трифлуор-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
рел-2,2-дихлор-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
рел-2-хлор-2,2-дифлуор-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ізоксазол-5-карбоксамід;
рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-5-метилізоксазол-3-карбоксамід;
рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил-1,2,3-тіадіазол-5-карбоксамід;
peл-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-2-тіофенацетамід;
рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]метансульфонамід;
рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]етансульфонамід;
peл-N'-[(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-10-мeтил-8-(пipидин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-N,N-диметиламіносульфамід;
рел-2,2-дифлуор-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
peл-4-aмiнo-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-1,2,5-оксадіазол-3-карбоксамід;
peл-2,2,2-тpифлyop-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-2-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
peл-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-10-мeтил-8-(пipимiдин-2-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил-1,2,3-тіадіазол-5-карбоксамід;
peл-2,2,2-тpифлyop-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-10-мeтил-8-(піразин-2-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
метил peл-(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-10-мeтил-2-(2,2,2-трифлуорацетиламіно)дибензо[с,f]піридо[1,2-а]азепін-8-карбоксилат;
етил peл-(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-2-(2,2,2-трифлуорацетиламіно)дибензо[с,f]піридо[1,2-а]азепін-8-карбоксилат;
пропіл peл-(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-2-(2,2,2-трифлуорацетиламіно)дибензо[с,f]піридо[1,2-а]азепін-8-карбоксилат;
рел-(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-N-феніл-2-(2,2,2-трифлуорацетиламіно)дибензо[с,f]піридо[1,2-а]азепін-8-карбоксамід;
рел-(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-N-(піридин-4-іл)-2-(2,2,2-трифлуорацетиламіно)дибензо[с,f]піридо[1,2-а]азепін-8-карбоксамід;
рел-(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-N-(2-метоксипіримідин-5-іл)-10-метил-2-(2,2,2-трифлуорацетиламіно)дибензо[с,f]піридо[1,2-а]азепін-8-карбоксамід;
peл-(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-N-(2-метоксифеніл)-10-метил-2-(2,2,2-трифлуорацетиламіно)дибензо[с,f]піридо[1,2-а]азепін-8-карбоксамід;
рел-2,2,2-трифлуор-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(2-метилтетразол-5-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
рел-2-xлop2,2-дифлуор-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(2-метилтетразол-5-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
peл-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-10-мeтил-8-(2-мeтилтeтpaзoл-5-іл)дибензо[c,f]піридо[1,2-а]азепін-2-іл]-4-метил-1,2,3-тіадіазол-5-карбоксамід;
peл-2,2,2-тpифлyop-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
peл-2,2,2-тpифлyop-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-10-мeтил-8-(піридин-2-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил-1,2,3-тіадіазол-5-карбоксамід;
peл-2,2-xлop-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]метансульфонамід;
peл-2-xлop-2,2-дифлyop-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
peл-5-aмiнo-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-1,2,5-оксадіазол-4-карбоксамід;
рел-2,2,2-трифлуор-N-[(2R,4S,10R,14bR)-1,2,3,4,10,14b-гексагідро-4,10-диметилдибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-N'-метил-N'-метоксисечовина;
рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-2-гідроксіацетамід;
рел-(2R,10R,14bR)-2-[(N,N-диметиламінокарбоніл)аміно]-1,2,3,4,10,14b-гексагідро-10-метил-N-фенілдибензо[с,f]піридо[1,2-а]азепін-8-карбоксамід;
рел-2,2,2-трифлуор-N-[(2R,10R,14bR)-8-[4,5-дигідрооксазол-2-іл]-1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
рел-2,2,2-трифлуор-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил-8-нітродибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід;
рел-2,2,2-трифлуор-N-[(2R,10R,14bR)-8-форміл-1,2,3,4,10,14b-гексагідро-10-метилбензо[c,f]піридо[1,2-а]азепін-2-іл]ацетамід або
рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-8-[1-(гідроксііміно)етил]-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил-1,2,3-тіадіазол-5-карбоксамід.
5. Фармацевтична композиція, яка містить сполуку формули І за будь-яким з пп. 1-4 або її фармацевтично прийнятну сіль та один або більше фармацевтично прийнятних наповнювачів.
6. Сполука за будь-яким з пп. 1-4 для застосування у терапії.
7. Застосування сполуки формули І за будь-яким з пп. 1-4 або її фармацевтично прийнятної солі для виробництва медикаменту для ревматології, гематології, пульмонології, дерматології, гастроентерології, ендокринології, неврології або нефрології.
Текст
1. Сполука загальної формули І: 2 (19) 1 3 (гетеро)арил, необов'язково заміщений -(14С)алкілом; NH2, NН(1-6С)алкіл або NН((гетеро)арил), а R21 - -Н або -(1-6С)алкіл. 2. Сполука за п. 1, де R3, R6, R7, R9, R12, R13, R14 представляють -Н, a R4 та R16 - -Н або -(14С)алкіл. 3. Сполука за п. 1 чи 2, де R1 - -Н, R8 - -Н, -ціано або -галоген; (гетеро)арил, необов'язково заміщений -(14С)алкілом; C(R16)NOR16, -C(O)N(R17)2, -C(O)R18 aбo -C(O)OR19; R10 - -(1-4C)алкіл; R15 - -(1-6С)алкіл, необов'язково заміщений одним або більше -галогеном або -(гетеро)арилом; (гетеро)арил, необов'язково заміщений -(14C)алкілом або NH2, або (ді)(1-4С)алкіламіно; R17 - -(гетеро)арил, необов'язково заміщений -(14С)алкоксилом; R18 - -(1-4C)алкіл, a R19 - -(1-6C)алкіл. 4. Сполука, вибрана з групи: peл-N-[(2R,10R,14bR)-8-бром-1,2,3,4,10,14bгексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін2-іл]-2,2,2-трифлуорацетамід; peл-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14bгексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін2-іл]-2,2,2-трифлуорацетамід; peл-2,2-дихлор-N-[(2R,10R,14bR)-8-ціано1,2,3,4,10,14b-гексагідро-10метилбензо[c,f]піридо[1,2-a]азепін-2-іл]ацетамід; peл-2,2,2-тpифлyop-N-[(2R,10R,14bR)1,2,3,4,10,14b-гeкcaгiдpo-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід; рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14bгексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін2-іл]-4-метил-1,2,3-тіадіазол-5-карбоксамід; рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14bгексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін2-іл]-2,2-дифлуорацетамід; рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14bгексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін2-іл]метансульфонамід; рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14bгексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін2-іл]етансульфонамід; peл-N'-[(2R,10R,14bR)-8-цiaнo-1,2,3,4,10,14bгeкcaгiдpo-10-метилдибензо[с,f]піридо[1,2-а]азепін2-іл]-N,N-диметиламіносульфамід; рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14bгексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін2-іл]-3,5-диметилізоксазол-4-карбоксамід; peл-N-[(2R,10R,14bR)-8-ацетил-1,2,3,4,10,14bгексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін2-іл]-2,2,2-трифлуорацетамід; рел-N-[(2R,10R,14bR)-8-ацетил-1,2,3,4,10,14bгексагідро-10-метилдибензо[с,f]піридо[1,2]а]азепін-2-іл]-4-метил-1,2,3-тіадіазол-5карбоксамід; рел-2,2,2-трифлуор-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-8-[1-(гідроксііміно)етил]10-метилдибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід; 92024 4 рел-2,2,2-трифлуор-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід; рел-2,2-дихлор-N-[(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід; рел-2-хлор-2,2-дифлуор-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід; рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]ацетамід; рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]ізоксазол-5-карбоксамід; рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]-5-метилізоксазол-3-карбоксамід; рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]-4-метил-1,2,3-тіадіазол-5карбоксамід; peл-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]-2-тіофенацетамід; рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]метансульфонамід; рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]етансульфонамід; peл-N'-[(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-10мeтил-8-(пipидин-4-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]-N,N-диметиламіносульфамід; рел-2,2-дифлуор-N-[(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід; peл-4-aмiнo-N-[(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-1,2,5оксадіазол-3-карбоксамід; peл-2,2,2-тpифлyop-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-2іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід; peл-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-10мeтил-8-(пipимiдин-2-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]-4-метил-1,2,3-тіадіазол-5карбоксамід; peл-2,2,2-тpифлyop-N-[(2R,10R,14bR)1,2,3,4,10,14b-гeкcaгiдpo-10-мeтил-8-(піразин-2іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід; метил peл-(2R,10R,14bR)-1,2,3,4,10,14bгeкcaгiдpo-10-мeтил-2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксилат; етил peл-(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро10-метил-2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксилат; пропіл peл-(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксилат; рел-(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10метил-N-феніл-2-(2,2,2 5 92024 6 трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксамід; рел-(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10метил-N-(піридин-4-іл)-2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксамід; рел-(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-N-(2метоксипіримідин-5-іл)-10-метил-2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксамід; peл-(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-N-(2метоксифеніл)-10-метил-2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксамід; рел-2,2,2-трифлуор-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(2метилтетразол-5-іл)дибензо[с,f]піридо[1,2-а]азепін2-іл]ацетамід; рел-2-xлop2,2-дифлуор-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(2метилтетразол-5-іл)дибензо[с,f]піридо[1,2-а]азепін2-іл]ацетамід; peл-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-10мeтил-8-(2-мeтилтeтpaзoл-5іл)дибензо[c,f]піридо[1,2-а]азепін-2-іл]-4-метил1,2,3-тіадіазол-5-карбоксамід; peл-2,2,2-тpифлyop-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід; peл-2,2,2-тpифлyop-N-[(2R,10R,14bR)1,2,3,4,10,14b-гeкcaгiдpo-10-мeтил-8-(піридин-2іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід; рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10метил-8-(піримідин-4-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]-4-метил-1,2,3-тіадіазол-5карбоксамід; peл-2,2-xлop-N-[(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-8-(піримідин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід; рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10метил-8-(піримідин-4-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]метансульфонамід; peл-2-xлop-2,2-дифлyop-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід; peл-5-aмiнo-N-[(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-8-(піримідин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-1,2,5оксадіазол-4-карбоксамід; рел-2,2,2-трифлуор-N-[(2R,4S,10R,14bR)1,2,3,4,10,14b-гексагідро-4,10диметилдибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід; рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14bгексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін2-іл]-N'-метил-N'-метоксисечовина; рел-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14bгексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін2-іл]-2-гідроксіацетамід; рел-(2R,10R,14bR)-2-[(N,Nдиметиламінокарбоніл)аміно]-1,2,3,4,10,14bгексагідро-10-метил-N-фенілдибензо[с,f]піридо[1,2а]азепін-8-карбоксамід; рел-2,2,2-трифлуор-N-[(2R,10R,14bR)-8-[4,5дигідрооксазол-2-іл]-1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід; рел-2,2,2-трифлуор-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8нітродибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід; рел-2,2,2-трифлуор-N-[(2R,10R,14bR)-8-форміл1,2,3,4,10,14b-гексагідро-10метилбензо[c,f]піридо[1,2-а]азепін-2-іл]ацетамід або рел-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-8[1-(гідроксііміно)етил]-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил1,2,3-тіадіазол-5-карбоксамід. 5. Фармацевтична композиція, яка містить сполуку формули І за будь-яким з пп. 1-4 або її фармацевтично прийнятну сіль та один або більше фармацевтично прийнятних наповнювачів. 6. Сполука за будь-яким з пп. 1-4 для застосування у терапії. 7. Застосування сполуки формули І за будь-яким з пп. 1-4 або її фармацевтично прийнятної солі для виробництва медикаменту для ревматології, гематології, пульмонології, дерматології, гастроентерології, ендокринології, неврології або нефрології. Заявлений винахід стосується сполук, що модулюють глюкокортикоїдні рецептори, а також застосування цих сполук у терапії. Застосування сучасних стероїдних глюкокортикоїдів супроводжується метаболічними та іншими побічними ефектами (як-то, наприклад, діабет, гіпертензія, остеопороз, виснаження м'язів, та інші). Частина цих побічних ефектів, як вважають, є опосередкованими безпосередньою взаємодією зв'язаного з лігандом глюкокортикоїдного рецептору (GR) з чутливими до глюкокортикоїду елементами (GRE) на ДНК цільових генів та наступною індукцією експресії гена (J.D. Baxter, Advances у Internal Medicine 45; 317-349; 2000; Μ. Karin, Cell 93; 487-490; 1998). Ще одна частина цих побічних ефектів могла б бути обумовленою перехресною реактивністю із іншими стероїдними рецепторами типу рецептору мінералкортикоїду (MR) або прогестерону (PR). Нестероїдні глюкокортикоїди не мають молекулярної структурної подібності із стероїдами та тому можна було б також чекати відмінностей у фізико-хімічних властивостях, фармакокінетичних (РК) параметрах, тканинному розподілі (наприклад, стосовно центральної нервової системи відносно периферійної), та більш значно нестероїдні глюкокортикоїди можуть не показувати, чи показувати меншу перехресну реактивність стосовно інших стероїдних рецепторів або можуть не показувати, чи показувати менші метаболічні або інші побічні ефекти. Заявлений винахід стосується нестероїдних сполук, що модулюють активність глюкокортикоїдного рецептору. Більш конкретно, заявлений вина 7 хід стосується нестероїдних сполук з високою афінністю стосовно зв'язування GR, котрі показують антизапальні ефекти in vitro та in vivo. Згідно із заявленим винаходом запропоновано сполуки загальної формули І, або їх проліки, або їх фармацевтично прийнятні солі. Заявлений винахід стосується нестероїдних сполук, що модулюють активність глюкокортикоїдного рецептору. Більш конкретно, заявлений винахід стосується нестероїдних сполук з високою афінністю, котрі є агоністами, частковими агоністами або антагоністами глюкокортикоїдного рецептору. Згідно із заявленим винаходом запропоновано сполуки загальної формули І, або їх фармацевтично прийнятні солі. У цій формулі групи R мають нижченаведені значення: -FI, - -Н або -(1-4С)алкіл; -R2 - -C(O)R15 або -S(O)2R15; -R3 - -Η, -(1-4C) алкіл або -OR16; -R4 - -Η, -(1-4С)алкіл або -OR16; -R6 - -Η або -C(R16)NOR16; -R7 - -Η, -галоген, -ціано; -(1-6С) алкіл, -(2-6С)алкеніл або -(2-6С)алкініл, усі необов'язково заміщені вибраним з групи: аміно, -гідроксил або -галоген; -R8 - -Η, -ціано, -галоген, -нітро; -(1-6С)алкіл, -(2-6С)алкеніл, -(2-6С)алкініл або -О(1-6С)алкіл, усі необов'язково заміщені вибраним з групи: -аміно, -гідроксил або -галоген; -(гетеро)арил, необов'язково заміщений вибраним з групи: -ціано, -галоген, -(1-4С)алкіл, -(14С)алкоксил, -(1-4С)алкокси(1-4С)алкіл або (гетеро)арил; -C(R16)NOR16, -C(O)N(R17)2, -C(O)R18, C(O)OR19, NHC(O)R20 або NHS(O)2R21; -R9 - -H, -галоген, -ціано, або -(1-4С)алкіл, необов'язково заміщений галогеном; -R10 - -Η або -(1-4С)алкіл; -R11- -H; -R12 - -Η, -ціано або -(1-4С)алкіл; -R13 - -Η, -(1-4С)алкіл, -галоген або -форміл; -R14 - -Η, -галоген, -ціано, -(1-4С)алкіл або (гетеро)арил; -R15 - -H; -(1-6С)алкіл, -(2-6С)алкеніл, -(2-6С)алкініл, О(2-6С)алкіл, -О(2-6С)алкеніл або -О(2-6С)алкініл, усі необов'язково заміщені одним або більше з групи: -ОН, -галоген, -ціано або -(гетеро)арил; -(гетеро)арил, необов'язково заміщений вибраним з групи: -(1-4С)алкіл, -галоген або NH2; 92024 8 -NH2, -(ді)(1-4С)алкіламіно, -(1-4С)алкілтіо(14С)алкіл, -(1-4С)алкокси(1-4С)алкіл або NR16OR16; -R16 - -Η, -(1-6С)алкіл, -(2-6С)алкеніл або -(26С)алкініл; -R17 - -Η; -(1-6С)алкіл, необов'язково заміщений галогеном, -(1-4С)алкоксил або -(гетеро)арил, необов'язково заміщений вибраним з групи: галоген, -(14С)алкіл або -(1-4С)алкоксил; -(3-6С)циклоалкіл або -(гетеро)арил, необов'язково заміщений вибраним з групи: -галоген, -(14С)алкіл або -(1-4С)алкоксил; -R18 - -Η, ΝΗ2 або -(1-4С)алкіл, необов'язково заміщений вибраним з групи: -ОН, -галоген, -ціано або -S(1-4С)алкіл; -R19 - -Η або -(1-6С)алкіл, необов'язково заміщений вибраним з групи: -ОН або -галоген; а -R20 - Н; -(1-6С)алкіл або -(2-6С)алкеніл, обидва необов'язково заміщені вибраним з групи: -галоген, -О(16С)алкіл, -(гетеро)арил, необов'язково заміщений вибраним з групи: -(1-4С)алкіл або -галоген; -(3-6С)циклоалкіл, -(1-6С)алкоксил, -(16С)алкенілоксил; або -(гетеро)арил, необов'язково заміщений -(14С)алкілом); ΝΗ2, МН(1-6С)алкіл або І\ІН((гетеро)арил), а -R21 - -Η або -(1-6С)алкіл. Таким чином, зараз виявлено, що вищезазначений клас сполук формули І або їх фармацевтично прийнятні солі, мають модуляторну активність стосовно глюкокортикоїдних рецепторів. Термін -(1-6С)алкіл, як застосовуваний у визначенні заявленого винаходу, означає розгалужений або нерозгалужений алкіл, який має 1-6 атомів карбону, наприклад, метил, етил, пропіл, ізопропіл, бутил, втор-бутил та трет-бутил, пентил та гексил. Переважним є -(1-4С)алкіл. Термін -(1-4С)алкіл, як застосовуваний у визначенні заявленого винаходу, означає розгалужений або нерозгалужений алкіл, який має 1-4 атоми карбону, наприклад, метил, етил, пропіл, ізопропіл, бутил, втор-бутил та трет-бутил. Переважними є метил та етил. Найпереважнішим є метил. Термін -(3-6С)циклоалкіл означає циклічний алкіл, який має 3-6 атомів карбону. Термін галоген означає флуор, хлор, бром або йод. Термін -(2-6С)алкеніл означає розгалужений або нерозгалужений алкеніл, який має 2-6 атомів карбону, як-то етеніл, 2-бутеніл, пентеніл та гексеніл. Переважними є -(2-4С)алкеніл. Термін -(2-4С)алкеніл означає розгалужений або нерозгалужений алкеніл, який має 2-4 атоми карбону, як-то етеніл та 2-бутеніл. Термін -(2-6С)алкініл означає розгалужений або нерозгалужений алкініл, який має 2-6 атомів карбону, як-то етиніл, пропініл, бутил, пентиніл та гексиніл. Переважним є -(2-4С)алкініл. Термін -(2-4С)алкініл означає розгалужений або нерозгалужений алкініл, який має 2-4 атоми карбону, як-то етиніл та пропініл. Термін -О(1-6С)алкіл означає -(16С)алкілоксил, де -(1-6С)алкіл визначено вище. 9 Термін -О(2-6С)алкеніл означає -(26С)алкенілоксил, де -(2-6С)алкеніл визначено вище. Термін - О(2-6С)алкініл означає - (26С)алкінілоксил, де -(2-6С)алкініл визначено вище. Термін -(1-4С)алкілоксил означає алкілоксил, який має 1-4 атоми карбону, алкільну частину якого визначено вище. -(1-2С)Алкілоксили є переважними. Найпереважнішим є метоксил. Термін -(1-4С)алкокси(1-4С)алкіл означає -(14С)алкоксил, приєднаний до -(1-4С)алкілу, обидві групи визначено вище. Термін -(ді)(1-4С)алкіламіно означає аміногрупу з принаймні одним, необов'язково двома гідрогенами, заміщеними -(1-4С) алкілом, який визначено вище. Термін -S(1-4С)алкіл означає -(14С)алкілтіогрупу, -(1-4С)алкіл якої визначено вище. Термін NН(1-6С)алкіл означає -(16С)алкіламіногрупу, -(1-6С)алкіл якої визначено вище. Термін NН(гетеро)арил означає (гетеро)ариламіногрупу, -(гетеро)арил в якій визначено вище. Термін -(1-4С)алкілтіо(1-4С)алкіл означає -(14С)алкілтіогрупу, приєднану до -(1-4С)алкілу, обидва визначено вище. Термін арил означає 6-членну ароматичну кільцеву систему. Термін -(гетеро)арил означає 5 або 6-членну ароматичну кільцеву систему, що містить принаймні один гетероатом, вибраний з групи: Ν, Ο та S, як-то, але без обмеження, піридиніл, піримідиніл, піразиніл, тетразоліл, тіадіазоліл, ізоксазоліл, оксадіазоліл, дигідрооксазоліл або фураніл. Термін фармацевтично прийнятна сіль представляє солі, котрі у рамках медичних вимог придатні для застосування у контакті з тканинами людей τ нижчих тварин без надмірної токсичності, подразнення, алергічних реакцій тощо, та є відповідними прийнятному співвідношенні корисність/ризик. Фармацевтично прийнятні солі є добре відомими у рівні техніки. Вони можуть бути отриманими протягом кінцевого виділення та очистки сполук згідно із заявленим винаходом, або окремо реакцією вільної основної функціональної групи з придатною мінеральною кислотою, як-то хлоридна кислота, фосфатна кислота, або сульфатна кислота, або з органічною кислотою, як-то, наприклад, аскорбінова кислота, лимонна кислота, винна кислота, молочна кислота, малеїнова кислота, малонова кислота, фумарова кислота, гліколева кислота, бурштинова кислота, пропіонова кислота, оцтова кислота, метансульфонова кислота, тощо. Кислотна функціональна група може реагувати з органічною або мінеральною основою, типу натрій гідроксид, калій гідроксид або літій гідрид. Заявлений винахід тому стосується сполук формули X, яку визначено тут вище. Ще один аспект винаходу стосується сполук формули І, де -R3, -R6 -R7, -R9, -R12, -R13, -R14 представляють -Η, a -R4, та -R16 представляють -Н або -(1-4С)алкіл, а інші групи мають показані значення. 92024 10 Ще один аспект винаходу стосується сполук формули І, де -R1 - -H; -R8 - -Η, -ціано або -галоген; -(гетеро)арил, необов'язково заміщений -(14С)алкілом; -C(R16NOR16, -C(O)NCR17)2, -C(O)R18 aбo C(O)OR19; -R10 - -(1-4C)алкіл; -R15 - -(1-6С)алкіл, необов'язково заміщений одним або більше -галогеном або -(гетеро)арил; -(гетеро)арил, необов'язково заміщений -(16)алкілом або NH2, або -(ді)(1-4С)алкіламіно; -R17 - -(гетеро)арил, необов'язково заміщений (1-4С)алкоксилом; -R18 - -(1-4C)алкіл, a -R19 - -(1-6C)алкіл. Ще один аспект винаходу стосується сполук формули І, де -R8 - -ціано, -(гетеро)арил, необов'язково заміщений -(14С)алкілом; -CO(N)Ri7 -C(O)R18 або -C(O)OR19, Наступний аспект винаходу стосується сполук формули І, де -(гетеро)арил у -R8 є 6-членним гетероароматичним кільцем. Ще один аспект винаходу стосується сполук формули 1, де гетероароматичне кільце у (гетеро)арилі у -R8 містить 1 або більше атомів нітрогену. Ще один аспект винаходу стосується сполук формули І, де -R2 - -C(O)R15. Наступний аспект винаходу стосується сполук формули І, де -R15 є 5-членним (гетеро)арилом. Ще один аспект винаходу стосується сполук формули І, де -R15 є 5-членним (гетеро)арилом. Ще один аспект винаходу стосується сполук формули І, де -R15 є -(1-4С)алкілом, необов'язково заміщеним одним або більше галогеном. Заявлений винахід стосується також сполук формули І, які є високо специфічними стосовно глюкокортикоїдного рецептору. Специфічність можна визначити за допомогою тестування сполуки, як описано далі, на глюкокортикоїдному рецепторі з іншими відомими рецепторами, як-то рецептор прогестерону, рецептор андрогену, мінералкортикоїдний рецептор чи рецептор естрогену. Крім того заявлений винахід стосується усіх можливих комбінацій конкретних та переважних груп, описаних тут вище. Сполуки заявленого винаходу мають принаймні три хіральних атомів карбону та можуть тому бути отриманими як чисті енантіомери чи суміш енантіомерів, або як суміш діастереомерів. Способи отримання чистих енантіомерів відомі, наприклад, кристалізацією солей, які отримані з оптично активних кислот та рацемічної суміші, або хроматографією застосовуючи хіральні колонки. Для розділення діастереомерів можна застосовувати прямо- чи зворотнофазові колонки. Сполуки заявленого винаходу можна синтезувати послідовністю реакційних етапів, як показано на етапах А - І. 11 Етап А Обробка антрахінону (1) натрій азидом у концентрованій сульфатній кислоті дає потрібний 5Ндибензо[b,е]азепін-6,11-діон з кількісним виходом (схема 1). Етап В Сполуки загальної структури 2 можуть тоді бути метилованими з отриманням сполук загальної структури 3. Етап С Сполуки загальної структури 3 можуть тоді бути відновленими з отриманням сполук загальної структури 4. Вищезгадану реакцію звичайно проводять, застосовуючи літий алюмогідрид як реагент. Етап D Сполуки загальної структури 4 можуть тоді бути селективно окисненими з отриманням похідного морфантридину 5. Вищезгадану реакцію звичайно проводять при зовнішній температурі у присутності манган діоксиду. Етапи E.F 92024 12 Сполуки загальної структури 5 можуть тоді реагувати у режимі Дильса-Адлера з утворенням кільця D та дають тетрациклічні сполуки загальної структури 6. Ці сполуки можуть тоді бути відновленими на місці з отриманням тетрациклічних спиртів загальної структури 7, котрі отримують головним чином у транс-конфігурації. Першу вищезгадану реакцію звичайно проводять при зниженій температурі у присутності дієну Данішевського та ітербій трифлуорметансульфонату із застосуванням органічного розчиннику. Ці необроблені продукти тоді відновлюють при зовнішній температурі у присутності натрій борогідриду із застосуванням органічного розчиннику. Етап G Сполуки загальної структури 7 можуть тоді реагувати в умовах Міцунобу з отриманням азидної сполуки загальної структури 8. Вищезгадану реакцію звичайно проводять при зовнішній температурі у присутності трифенілфосфіну, діізопропілазодикарбоксилату та дифенілфосфорилазиду із застосуванням органічного розчиннику. Схема 1 13 Етап Η Сполуки загальної структури 8 можуть тоді бути відновленими з отриманням сполук з вільною аміногрупою загальної структури 9. Вищезгадану реакцію звичайно проводять при зовнішній температурі у присутності трифенілфосфіну та води із застосуванням органічного розчиннику. Етап І Ці продукти 9 тоді перетворюють у бажані аміди, карбамати та сечовини та сульфонаміди 10 загальними способами. Сполуки 7, 9 та 10 є ключовими проміжними сполуками в утворенні усіх інших сполук, розкритих тут. Ці сполуки, що вже є галогенованими або можуть бути галогенованими, тоді далі модифікують способами, описаними тут з отриманням бажаних сутностей із бажаною pen-(2R,10R,14bR)стереохімією. Сполуки згідно із заявленим винаходом мають принаймні три хіральні атоми карбону та можуть тому бути отриманими як чисті енантіомери, або як суміш енантіомерів, або як суміш діастереомерів. Способи отримання чистих енантіомерів є відомими у рівні техніки, наприклад, кристалізація солей, котрі отримують з оптично активних кислот та рацемічної суміш, ферментативним розділенням або хроматографією, застосовуючи хіральні колонки. Для відокремлення діастереомерів можуть бути застосовуваними прямо- чи зворотнофазові колонки. Виявлено, що еютомери мають (2S,10S,14bS)стереохімією. Сполуки згідно із заявленим винаходом модулюють активність глюкокортикоїдного рецептору. Сполуки таким чином можуть бути застосовуваними у лікуванні імунних та запальних хвороб. Зокрема сполуки можуть бути застосовуваними для лікування ревматичних хвороб як-то ревматоїдний артрит, юнацький артрит, та анкілозувальний спондиліт, шкірних хвороб, охоплюючи псоріаз та пемфігус, алергічних розладів, охоплюючи алергічний риніт, атопічний дерматит, та контактний дерматит, легеневих станів, охоплюючи астму та хронічну обструктивну хворобу легень, та інших імунних та запальних хвороб, охоплюючи хворобу Крона, виразковий коліт, системний червоний вовчак, автоімунний хронічний активний гепатит, остеоартрит, тендиніт, та бурсит. На додаток, сполуки можуть бути застосовуваними для попередження відторгнення органів після трансплантації органу. Більш конкретно сполуки можуть бути застосовуваними для лікування ревматоїдного артриту, псоріазу, астми та хронічної обструктивної хвороби легень, хвороби Крона або виразкового коліту та сполуки можуть бути застосовуваними для попередження відторгнення органів після трансплантації органу. Способи визначення зв'язування рецептору, а також in vitro та in vivo аналізи для визначення біологічної активності сполук є добре відомими у рівні техніки. Загалом, експресований рецептор обробляють тестованою сполукою та вимірюють 92024 14 зв'язування, стимуляцію або інгібування функціональної реакції. Для вимірювання зв'язування може бути застосовуваним виділений цитозоль, що містить експресований GR. Радіоактивно або флуоресцентно мічені сполуки можуть також бути застосовуваними. Як еталонна сполука можуть бути застосовуваними природний гормон або інші сполуки, що зв'язуються з рецептором. Як альтернативні можуть бути проведеними також аналізи конкурентного зв'язування. Ці аналізи зв'язування можуть бути розробленими самостійно або можуть бути закупленими як комерційні аналізи зв'язування (комплекти). Експериментальні способи визначення афінності зв'язування добре відомі у рівні техніки. Для вибору модуляторів GR, сполуки повинні зв'язуватися з рецептором із афінністю менше 105М. Більш переважно, афінність стосовно зв'язування менше 10-7Μ та найкраще, афінність стосовно зв'язування менше 10-8М. Для вимірювання функціональної реакції виділену ДНК, що кодує ген глюкокортикоїдного рецептору, переважно рецептору людини, експресують у придатних клітинах хазяїна, наприклад, у клітинах остеобластів людини U20S. Способи створення ліній клітин, які стабільно експресують рекомбінантний глюкокортикоїдний рецептор, добре відомі у рівні техніки (Sambrook et al, Molecular Cloning: Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, останнє видання). Експресії рецептору досягають експресією ДНК, що кодує бажаний білок. Способи сайт-спрямованого мутагенезу, лігування додаткових послідовностей, PCR та створення придатної системи експресії зараз добре відомі у рівні техніки. Порції або суцільна ДНК, що кодує бажаний білок, можуть бути створеними синтетично, застосовуючи стандартні твердо-фазні способи, переважно для уведення рестрикційних сайтів для полегшення лігування. Придатні контрольні елементи для транскрипції та трансляції уведеної кодувальної послідовності можуть бути запропонованими для ДНК-кодувальних послідовностей. Як добре відомо, зараз є системи експресії, котрі є сумісними з широкою різноманітністю хазяїв, охоплюючи прокаріотних хазяїв, як-то бактерії, та евкаріотних хазяїв, як-то дріжджі, клітини рослин, клітини комах, клітини ссавців, клітини птиць тощо. In vitro запалення може бути імітованим у лінії клітин людини, стабільно трансфектованих ДНК GR людини, що стимулюють до секретування цитокінів, хемокінів та інших запальних посередників. Антизапальні ефекти сполук можна вимірювати інгібуванням запальної реакції у цій лінії клітин. Тестуванням повних кривих доза - реакція, значення ЕК50 можуть бути розрахованими для сполук та еталонної сполуки типу преднізолону, значення ЕК50 можна було порівнювати зі значеннями ЕК50, отриманими для преднізолону у тому ж клітинному аналізі. Переважно сполуки мають значення ЕК50, що є у межах ЕК50, отриманих для преднізолону. Більш переважно, зна 15 чення ЕК50 є меншими, ніж ті, що отримані для преднізолону. Спеціаліст повинен усвідомлювати, що бажані значення ЕК50 є залежними від тестованих сполук. Наприклад, сполуку із ЕК50 менше, ніж 10-5М, загалом, вважають кандидатом для вибору ліків. Переважно це значення є нижчим, ніж 10-7М. Однак, сполука, котра має вищу ЕК50, але є селективною стосовно конкретного рецептору, може бути навіть кращим кандидатом. In vivo, антизапальний вплив сполук може бути тестованим у мишей, що є обробленими ліпополісахаридом (LPS). Сполуки можуть бути застосовуваними систематично під час обробки LPS або перед цим. Антизапальні ефекти можуть бути визначеними як інгібування індукованого LPS TNFα у сироватці мишей, або будь-якого іншого запального цитокіну або хемокіну (S.R. Hyde & R.E. McCallum, Infection and Immunity, 60; 976-982 (1992)). Потужність стосовно інгібування артриту може бути тестованою у мишачій моделі артриту, індукованій колагеном типу II (СІА) як здатність стосовно інгібування набрякання лап (D.E. Trentham et al. J Exp Med 146; 857-868 (1977)), або ще одна модель артриту. Винахід таким чином також стосується фармацевтичних композицій, які містять сполуку або сіль їх загальної формули І. Таким чином, сполуки формули І можуть бути застосовуваними у терапії. Придатними шляхами застосування для сполук формули І або їх фармацевтично прийнятних солей, також представлених тут як активний інгредієнт, є внутрішньом'язові ін'єкції, підшкірні ін'єкції, внутрішньовенні ін'єкції або інтраперитонеальні ін'єкції, пероральне та інтраназальне застосування. Переважно, сполуки можуть бути застосовуваними перорально. Точна доза та режим застосування активного інгредієнту, або його фармацевтичної композиції повинна неодмінно бути залежною від терапевтичного ефекту, якого треба досягти (наприклад, лікування астми, R.A, I.B.D) та може варіювати залежно від конкретної сполуки, шляху застосування, та віку та стану особини до якої є застосовуваним медикамент. Загалом, терапевтично ефективна добова доза є приблизно від 0,001мг до приблизно 15мг/кг маси тіла на добу сполуки згідно із заявленим винаходом; переважно, приблизно від 0,1мг до приблизно 10мг/кг маси тіла на добу; та найкраще, приблизно від 0,1мг/кг до приблизно 1,5мг/кг маси тіла на добу. Деякою мірою оптимізація звичайної дози може бути потрібною для визначення рівня та режиму оптимального дозування. Застосування сполук згідно із заявленим винаходом, у чистій формі або у прийнятній фармацевтичній композиції, можна здійснювати, застосовуючи будь-який зі звичайних режимів застосування фармацевтичних композицій. Таким чином, застосування може бути здійсненим, наприклад, перорально, букально (наприклад, сублінгвально), назально, парентерально, місцево, трансдермально, вагінально, або ректально, у формі твердого, напівтвердого, ліофілізованого порошку, або рідкої дозованої форми, як-то, наприклад, таблетки, супозиторії, пілюлі, м'які елас 92024 16 тичні та тверді желатинові капсули, порошки, розчини, суспензії, аерозолі, тощо, переважно в одиничних дозованих формах, придатних для простого застосування точних доз. Наступний аспект винаходу стосується застосування сполуки формули І або її фармацевтично прийнятної солі або сольвату для отримання медикаменту для імунотерапії. Приклади Нумерація у прикладах стосується схеми 1, де R1, R3, R4, R6-R9=Η, R10=Me, R11-R14=H, якщо не визначено інше. Суміш концентрованої сульфатної кислоти (25,2мл) та ДХМ (дихлорметан) (8,4мл) було охолоджено до 0°С, було додано антрахінон (1) (5г, 24ммоль), тоді було додано невеликими порціями протягом 1 години при 0-5°С натрій азид (1,84г, 28,3ммоль). Реакційну суміш перемішували протягом ночі при кімнатній температурі та тоді її було вилито у суміш лід-вода (300мл). Продукт було відфільтровано, промито водою до відсутності кислоти та висушено, отримуючи 5Ндибензо[b,е]азепін-6,11-діон (2) як білий твердий матеріал (5,3г, 100%). Дані: (m/z)=224 (М+Н)+. До суспензії 5Н-дибензо[b,е]азепін-6,11-діону (2) (50г, 0,22мол у толуолі (800мл) було додано метилмагній йодид (3Μ етері, 200мл, 0,6моль). Реакційну суміш гріли при кип'ятінні під зворотним холодильником протягом 6 годин, тоді її було вилито у водний амоній хлорид та це перемішували протягом 10 хвилин. Продукт було відфільтровано та висушено, отримуючи 11-гідрокси-11-метил5,11-дигідро-дибензо[b,е]азепін-6-он (3) як білий твердий матеріал (51,6г, 96%). Дані: (m/z)=240 (М+Н)+. 11-Гідрокси-11-метил-5,11-дигідродибензо[b,е]азепін-6-он (3) (51,6г 0,22моль) було додано до суспензії літій алюмогідриду (33г, 0,88моль) у діоксані (850мл). Реакційну суміш гріли до 105°С. Через 2,5 години при кип'ятінні під зворотним холодильником реакційну суміш було охолоджено, надлишок літій алюмогідрид було зруйновано водним натрій сульфатом (55мл), етилацетат (1,81) та натрій сульфат (440г) були доданими і реакційну суміш перемішували протягом 30 хвилин. Тверді продукти були відфільтрованими та фільтрат було концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі (Гептан:Етилацетат= 6:4), отримуючи 6,11-дигідро-11метил-5Н-дибензо[b,е]азепін (4) (28г, 61%). Дані: (m/z)=210 (М+Н)+. Розчин 6,11-дигідро-11-метил-5Ндибензо[b,е]азепіну (4) (8г, 38,3ммоль) в ацетоні (1500мл) було охолоджено до 0°С та було додано NBS (N-бромсукцинамід; 6,81г, 38,3ммоль). Реакційну суміш перемішували протягом 20 хвилин при 0°С, гасили додаванням водного розчину гідрокарбонату натрію (300мл) та її було концентровано під зниженим тиском. Продукт було екстраговано в етилацетат, котрий було промито розсолом, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі 17 (Гептан:Етилацетат= 8:2), отримуючи 2-бром-6,11дигідро-11-метил-5Н-дибензо[b,е]азепін (4, R8=Вr; 32г, 97%). Дані: (m/z)=288/290 (М+Н)+. До розчину 2-бром-6,11-дигідро-1,1-метил-5Ндибензо[b,е]азепіну (4, R8=Вr, 32г, 0,11моль) у ДХМ було додано МnО2 (манган оксид) (96,6г, 1,11моль) та реакційну суміш перемішували протягом ночі. Реакційну суміш було профільтровано через декаліт та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі (Гептан:Етилацетат= 8:2), отримуючи 2-бром-11метил-11Н-дибензо[b,е]азепін (5, R8=Вr; 29,4г, 92%). Дані: (m/z)=286/288 (М+Н)+. При перемішуванні до розчину 2-бром-1,1метил-11Н-дибензо[b,е]азепіну (5, R8=Вr; 666мг, 2,33ммоль) було додано ітербій (ІІІ)трифлат (146мг, 0,23ммоль). Після перемішування протягом 10 хвилин при кімнатній температурі було додано дієн Данішевського (0,89мл, 4,66ммоль). Реакційну суміш було витримано протягом ночі при кімнатній температурі. Реакційну суміш було погашено водним розчином гідрокарбонату натрію, екстраговано в етилацетат, промито розсолом, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі, отримуючи 8-бром-10,14b-дигідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2(1Н)-он (6, R8=Вr; 338мг, 41%). Дані: (m/z)=354/356 (М+Н)+. Суспензію 8-бром-10,14b-дигідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2(1Н)-ону (6, R8=Вr; 13,07г, 37ммоль) в етанолі (700мл) було охолоджено до 0°С та було додано натрій борогідрид (14г, 370ммоль). Реакційну суміш перемішували протягом ночі при кімнатній температурі. Реакційну суміш було охолоджено, надлишок натрій борогідриду було зруйновано ацетоном (300мл), це перемішували протягом 30 хвилин, та концентрували під зниженим тиском. Продукт було екстраговано етилацетатом та водним амоній хлоридом, промито розсолом, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі (Гептан:Етилацетат= 7:3), отримуючи рел-[(2R,10R,14bR)-8-бром1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2(1Н)-ол (7, R8=Вr; 7,8г, 60%). Дані: (m/z)=358/360 (М+Н)+. При перемішуванні розчин peл[(2R,10R,14bR)-8-бром-1,2,3,4,10,14b-гексагідро10-метил-дибензо[с,f]піридо[1,2-а]азепін-2(1Н)-олу (7, R8=Вr; 5,0г, 14ммоль) та трифенілфосфіну (4,76г, 18,1ммоль) у сухому ТГФ (150мл) було охолоджено до 0°С та було додано діізопропілазодикарбоксилат (3,60мл, 18,1ммоль). Дифенілфосфорилазид (3,90мл, 18,1ммоль) було додано, а тоді охолодження було видалено. Реакційну суміш було нагріто до зовнішньої температури та її перемішували протягом ночі. Реакційну суміш було концентровано під зниженим тиском та необроблений продукт було очищено колонковою хроматографією на силікагелі (Гептан:Етилацетат= 95:5) з отриманням peл-[(2R,10R,14bR)-2-азидо-8-бром1,2,3,4,10,14b-гексагідро-10-метил 92024 18 дибензо[с,f]піридо[1,2-а]азепіну (8, R8=Br; 4,7г, 89%). Дані: (m/z)=383/385 (М+Н)+. При перемішуванні до розчину peл[(2R,10R,14bR)-2-азидо-8-бром-1,2,3,4,10,14bгексагідро-10-метил-дибензо[с,f]піридо[1,2а]азепіну (8, R8=Br; 4,7г, 12,3ммоль) у ТГФ (150мл) та води (4,5мл) було додано трифенілфосфін (3,86г, 14,7ммоль). Реакційну суміш перемішували протягом ночі при 50°С, тоді її було концентровано під зниженим тиском з отриманням peл[(2R,10R,14bR)-8-бром-1,2,3,4,10,14b-гексагідро10-метил-дибензо[с,f]піридо[1,2-а]азепін-3-аміну (9, R8=Br). Дані: (m/z)=357/ 359 (М+Н)+. Приклад 1 peл-N-[(2R,10R,14bR)-8-бром1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-2,2,2трифлуорацетамід (10, R8=Br, R2=COCF3). Необроблений 9 (R8=Br) було перенесено у МеОН (150мл), триетиламін (3,4мл, 24,6ммоль) та етилтрифлуорацетат (7,33мл, 61,5ммоль) були доданими та реакційну суміш гріли до 50°С та витримували протягом 3 годин. Реакційну суміш було концентровано під зниженим тиском і очищено колонковою хроматографією на силікагелі (Гептан:Етилацетат= 8:2) з отриманням peл-N[(2R,10R,14bR)-8-бром-1,2,3,4,10,14b-гексагідро10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-2,2,2трифлуорацетаміду (10, R8=Br, R2=COCF3; 4,7г, 84%). Дані: (m/z) - 453/455 (М+Н)+. Приклад 2, peл-N-[(2R,10R,14bR)-8-ціано1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-2,2,2трифлуорацетамід (10, R8=CN, R2=COCF3). При перемішуванні розчин 10 (R8=Br, R2=COCF3; 800мг, 1,77ммоль) у NMP (Nметилпіролідон) (15мл) було дегазовано продуванням азоту протягом 0,5 годин. CuCN (395мг, 4,43ммоль) було додано та реакційну суміш перемішували протягом 7 годин при 200°С. Реакційну суміш було погашено 25% розчином амоній гідроксиду у воді та продукт було екстраговано в етилацетат. Органічні матеріали були промитими 25% розчином амоній гідроксиду у воді, розсолом, висушеними натрій сульфатом та концентрованими під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі (Гептан:Етилацетат= 8:2) до рел-N[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14b-гексагідро10-Метилдибензо[c,f]піридо[1,2-а]азепін-2-іл]-2,2,2трифлуорацетаміду (10, R8=CN, R2= COCF3; 630мг, 89%). Дані: (m/z)=400 (М+Н)+. Приклад 3, peл-2,2-диxлop-N-[(2R,10R,14bR)8-цiaнo-1,2,3,4,10,14b-гeкcaгiдpo-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід (10, R8=CN, R2= CO-CHCI2). При перемішуванні до розчину 10 (R8=CN; R2=COCF3; 78мг, 0,195ммоль) у EtOH (5мл) було додано 2Η розчин гідроксиду натрію у воді (1мл). Реакційну суміш перемішували при кімнатній температурі протягом 2 годин. Реакційну суміш було погашено водою та екстраговано етилацетатом. Органічні матеріали були промитими розсолом, висушеними натрій сульфатом та концентрованими під зниженим тиском з отриманням необробленого peл-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14b 19 гексагідро-10-метил-дибензо[с,f]піридо[1,2а]азепін-3-аміну (9, R8=CN; 60мг, 100%). При перемішуванні розчин 9 (R8=CN; 108мг, 0,356ммоль) та триетиламіну (52мл, 0,374ммоль) у ДХМ (4мл) було охолоджено до 0°С. Дихлорацетилхлорид (36мл, 0,374ммоль) було додано та реакційну суміш перемішували при кімнатній температурі протягом 2 годин. Реакційну суміш було погашено водним розчином гідрокарбонату натрію у воді та продукт було екстраговано у ДХМ. Органічні матеріали були висушеними та концентрованими під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі, а потім препаративною ВЕРХ. Сушка сублімацією з суміші ЕЮН/вода дала peл-2,2дихлор-N-[(2R,10R,14bR)-8-ціано-1,2,3,4,10,14bгексагідро-10-метил-дибензо[с,f]піридо[1,2а]азепін-2-іл]ацетамід (10, R8=CN, R2=COCHCI2; 64мг, 46%).Дані: (m/z)=415 (М+Н)+. Приклад 4, peл-2,2,2-тpифлyop-N[(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід (10: R2=CF3). Цю сполуку було отримано аналогічним чином, як описано у прикладі 1, з 5 з отриманням рел-2,2,2-трифлуор-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетаміду (10:R2=CF3). Дані: (m/z)=375 (М+Н)+. Приклад 5, peл-N-[(2R,10R,14bR)-8-ціано1,2,3,4,10,14b-гексагідро-10метилдібензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил1,2,3-тіадіазол-5-карбоксамід (10: R8=CN, R2=COC3H3N2S). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=CN) з отриманням peл-N-[(2R,10R,14bR)-8-ціано1,2,3,4,10,14b-гексагідро-10-метилдибензо [c,f]піридо[1,2-а]азепін-2-іл]-4-метил-1,2,3тіадіазол-5-карбоксаміду (10: R8=CN, R2=COC3H3N2S; 434мг, 61%). Дані: (m/z)=430 (М+Н)+. Приклад 6, рел-N-[2R,10R,14bR)-8-ціано1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-2,2дифлуорацетамід (10: R8=CN, R2=COCHF2). До розчину дифлуороцтової кислоти (8,5мкл, 0,135ммоль) у ДХМ (1мл), були доданими TBTU (O-(Бензотриазол-1-іл)-N,N,N',N'тетраметилуронійтетрафлуорборат) (51мг, 0,159ммоль) та DIPEA (Ν,Ν-Діізопропілетиламін) (26мкл, 0,149ммоль) та реакційну суміш перемішували при кімнатній температурі. Після 10 хвилин було додано розчин 9 (R8=CN; 25мг, 0,082ммоль) у ДХМ (1мл). Реакційну суміш перемішували протягом ночі при кімнатній температурі. Реакційну суміш було погашено насиченим водним розчином гідрокарбонату натрію у воді та екстраговано ДХМ. Органічний прошарок було висушено натрій сульфатом та органічні матеріали були концентрованими під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі з отриманням peл-N-[(2R,10R,14bR)-8ціано-1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-2,2 92024 20 дифлуорацетаміду (10: R8=CN, R2=COCHF2; 13мг, 34%). Дані: (m/z)=382 (М+Н)+. Приклад 7, peл-N-[(2R, 10R, 14bR)-8-ціано1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2іл]метансульфонамід (10: R8=CN, R2=SO2Me). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=CN) з отриманням 7, peл-N-[(2R,10R,14bR)-8-ціано1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2іл]метансульфонаміду (10: R8=CN, R2=SO2Me; 13мг, 34%). Дані: (m/z)=382 (М+Н)+. Приклад 8, peл-N-[(2R910R, 14bR)-8-ціано1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2іл]етансульфонамід (10: R8=CN, R2=SO2Et). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=CN) з отриманням peл-N-[(2R,10R,14bR)-8-ціано1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2іл]етансульфонаміду (10: R8=CN, R2=SO2Et; 12мг, ЗО%). Дані: (m/z)=396 (М+Н)+. Приклад 9, peл-N'-[(2R,10R,14bR)-8-ціано1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-N,Nдиметиламіносульфамід (10: R8=CN, R2=SO2N(CH3)2). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=CN) з отриманням peл-N'-[(2R,10R,14bR)-8-ціано1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-N,Nдиметиламіносульфаміду (10: R8=CN, R2= SO2N(CH3)2; 12мг, 29%). Дані: (m/z)=411 (М+Н)+. Приклад 10, peл-N-[(2R, 10R, 14bR)-8-ціано1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-3,5диметилізоксазол-4-карбоксамід(10: R8=CN, R2=COC5H6NO). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=CN) з отриманням peл-N-[(2R,10R,14bR)-8-ціано1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-3,5диметилізоксазол-4-карбоксаміду (10: R8=CN, R2= COC5H6NO; 15мг, 35%). Дані: (m/z)=427 (М+Н)+. Приклад 11, рел-N-[(2R,10R,14bR)-8-ацетил1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-2,2,2трифлуорацетамід (10: R8=СОСН3, R2=COCF3). При перемішуванні розчин 10 (R8=Br, R2=COCF3; 250мг, 0,55ммоль) у толуолі змішували з PdCI2 (PPh3)2 (8мг, 0,011ммоль) та 1етоксивінілтрибутилстанум (587мкл, 1,73ммоль). Реакційну суміш перемішували протягом ночі при кип'ятінні під зворотним холодильником. Розчин хлоридної кислоти у воді (2Н, 3мл) було додано та реакційну суміш перемішували протягом 10 хвилин при кімнатній температурі. Реакційну суміш було погашено насиченим водним розчином гідрокарбонату натрію у Н. 20 та продукт було екстраговано в етилацетат. Органічний прошарок було промито розсолом, висушено натрій сульфатом та 21 концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі з отриманням рел-N[(2R,10R,14bR)-8-aцeтил-1,2,3,4,10,14b-гeкcaгiдpo10-мeтилдибeнзo[c,f]пipидo[1,2-а]азепін-2-іл]-2,2,2трифлуорацетаміду (10: R8=СОСН3, R2=COCF3; 150мг, 65%). Дані: (m/z)=417(M+H)+. Приклад 12, peл-N-[(2R,10R,14bR)-8-aцeтил1,2,3,4,10,14b-гeкcaгiдpo-10-мeтилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил-1,2,3тіадіазол-5-карбоксамід (10: R8=СОСН3, R2=COC3H3N2S). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 10 (R8=СОСН3, R2=COCF3) з отриманням рел-N-[(2R,10R,14bR)-8ацетил-1,2,3,4,-10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил1,2,3-тіадіазол-5-карбоксаміду (10: R8=СОСН3, R2=COC3H3N2S; 27мг, 54%). Дані: (m/z)=447 (М+Н)+. Приклад 13, peл-2,2,2-тpифлyop-N[(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-8-[1(гідроксііміно)етил]-10-метилдибензо[с,f]піридо[1,2а]азепін-2-іл]ацетамід (10: R8=C(CH3)NOH, R2=COCF3). При перемішуванні розчин 10 (R8=СОСН3, R2=COCF3; 60мг, 0,14ммоль) у ЕtOН змішували з гідроксиламіном-НСІ (20мг, 0,28ммоль) та піридином (35мкл, 0,45ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 40 годин. Реакційну суміш було погашено водою та продукт було екстраговано в етилацетат. Органічні матеріали були промитими водою та розсолом, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі. Сушка сублімацією з суміші ацетонітрил/вода дала рел-2,2,2-трифлуор-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-8-[1-(гідроксііміно)етил]10-метилдибензо[с,f]піридо-[1,2-а]азепін-2іл]ацетамід (10: R8=C(CH3)NOH, R2=COCF3; 50мг, 80%). Дані: (m/z)=432 (М+Н)+. Приклад 14, рел-2,2,2-трифлуор-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід (10: R8=C5H4N, R2=COCF3). При перемішуванні до розчину 10 (R8=Br, R2=COCF3; 61мг, 0,148ммоль) у суміші діоксану (3мл) та води (0,5мл) було додано PdCI2 (PPh3)2 (6мг, 8,8 10-3ммоль), K3РО4·7Н2О (60мг, 0,178ммоль), AsPh3 (3мг, 0,010ммоль) та циклічний естер 2,2-диметил-пропандіолу з піридин-4бороновою кислотою (78мг, 0,408ммоль). Реакційну суміш перемішували протягом ночі при кип'ятінні під зворотним холодильником. Реакційну суміш було погашено насиченим водним розчином гідрокарбонату натрію у воді та продукт було екстраговано у ДХМ, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі, отримуючи рел-2,2,2-трифлуорN-[(2R,-10R,14bR)-1,2,3,4,10,14b-гексагідро-10метил-8-(піридин-4-іл)дибензо[с,f]піридо-[1,2а]азепін-2-іл]ацетамід (10: R8=C5H4N, R2=COCF3; 24мг, 36%). Дані: (m/z)=452 (М+Н)+. 92024 22 Приклад 15, рел-2,2-дихлор-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід (10: R8=C5H4N, R2=COCHCI2). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 10 (R8=C5H4N, R2=COCF3) з отриманням рел-2,2-дихлор-N[(2R,10R,14bR)-1,2,3,-4,10,14b-гексагідро-10метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]ацетаміду (10: R8=C5H4N, R2=СОСНСІ2; 18мг, 55%). Дані: (m/z)=467 (М+Н)+. Приклад 16, рел-2-хлор-2,2-дифлуор-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід (10: R8=C5H4N, R2=COCF2CI). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=C5H4N) з отриманням рел-2-хлор-2,2-дифлуор-N[(2R,10R,14bR)-1,2,3,4,-10,14b-гексагідро-10метил-8-(піридин-4-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]ацетаміду (10: R8=C5H4N, R2=COCF2CI; 20мг, 61%). Дані: (m/z)=468 (М+Н)+. Приклад 17, peл-N-[(2R,10R, 14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід (10: R8=C5H4N, R2=COCH3). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=C5H4N) з отриманням peл-N-[(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетаміду (10: R8=C5H4N, R2=COCH3; 7мг, 26%). Дані: (m/z) 398 (М+Н)+. Приклад 18, peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ізоксазол-5карбоксамід (10: R8=C5H4N, R2=COC3H2NO). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=C5H4N) з отриманням peл-N-[(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-a]азепін-2-іл]ізоксазол-5карбоксаміду (10: R8=C5H4N, R2=COC3H2NO; 19мг, 57%). Дані: (m/z)=451 (М+Н)+. Приклад 19, peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-5-метилізоксазол-3-карбоксамід (10: R8=C5H4N, R2=COC4H4NO). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=C5H4N) з отриманням peл-N-[(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-5-метилізоксазол-3-карбоксаміду (10: R8=C5H4N, R2=COC4H4NO; 22мг, 67%). Дані: (m/z)=465 (М+Н)+. Приклад 20, peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил1,2,3-тіадіазол-5-карбоксамід (10: R8=C5H4N, R2=COC3H3N2S). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=C5H4N) з отриманням peл-N-[(2R,10R,14bR)-1,2,3,4,10,14b 23 гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил1,2,3-тіадіазол-5-карбоксаміду (10: R8=C5H4N, R2=COC3H3N2S; 20мг, 59%). Дані: (m/z)=482(М+Н)+. Приклад 21, peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гeкcaгiдpo-10-мeтил-8-(пipидин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-2тіофенацетамід (10: R8=C5H4N, R2=COC5H5S). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=C5H4N) з отриманням рел-N-[(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-2тіофенацетаміду (10: R8=C5H4N, R2=COC5H5S) 21мг, 62%). Дані: (m/z)=480 (М+Н)+. Приклад 22, peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]метансульфонамід (10: R8=C5H4N 4-піридин, R2=SO2Me). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=C5H4N) з отриманням peл-N-[(2R,10R,14bR)-1,2,3,4,10,14bгeкcaгiдpo-10-мeтил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]метансульфонаміду (10: R8=C5H4N, R2=SO2Me; 19мг, 62%). Дані: (m/z)=434 (М+Н)+. Приклад 23, peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]етансульфонамід (10: R8=C5H4N, R2=SO2Et). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=C5H4N) з отриманням рел-N-[(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]етансульфонаміду (10: R8=С5H4N, R2=SO2Et; 10мг, 32%). Дані: (m/z)=448 (M+H)+. Приклад 24, peл-N'-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-N,Nдиметиламіносульфамід (10: R8=C5H4N, R2=SO2N(CH3)2). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 9 (R8=C5H4N) з отриманням peл-N'-[(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-N,Nдиметиламіносульфаміду (10: R8=C5H4N, R2=SO2N(CH3)2;14мг,42%).Дані: (m/z)=463 (М+Н)+. Приклад 25, peл-2,2-дифлyop-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(піридин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід (10: R8=C5H4N, R2=COCHF2). Цю сполуку було отримано аналогічним чином, як описано у прикладі 6, з 9 (R8=C5H4N) з отриманням рел-2,2-дифлуор-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетаміду (10: R8=C5H4N, R2=COCHF2; 15мг, 50%). Дані: (m/z)=434 (М+Н)+. Приклад 26, peл-4-аміно-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-1,2,5 92024 24 оксадіазол-3-карбоксамід (10: R8=C5H4N, R2=COC2H2N3O). Цю сполуку було отримано аналогічним чином, як описано у прикладі 6, з 9 (R8=C5H4N) з отриманням peл-4-аміно-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піридин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-1,2,5оксадіазол-3-карбоксаміду (10: R8=C5H4N, R2=COC2H2N3O; 23мг, 70%). Дані: (m/z)=467 (М+Н)+. Приклад 27, peл-2,2,2-тpифлyop-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(піримідин-2-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід (10: R8=C4H3N2, R2=COCF3). При перемішуванні до розчину 10 (R8=Br, R2=COCF3; 100мг, 0,22ммоль) у діоксані трибутилстанілпіримідин (98мг, 0,26ммоль), CsF (72мг, 0,473ммоль), Pd2(dba)3 (паладій дибензиліденацетон, 6мг, 6,6 (1моль) та P(tBu)3 (10% розчин у гексані, 26мкмоль) були доданими. Реакційну суміш перемішували протягом ночі при кип'ятінні під зворотним холодильником. Реакційну суміш було погашено водою та органічні матеріали були екстрагованими в етилацетат. Органічний прошарок було промито розсолом, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі, а потім препаративною ВЕРХ. Сушка сублімацією з суміші ацетонітрил/вода дала рел-2,2,2-трифлуор-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(піримідин-2-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід (10: R8=C4H3N2, R2=COCF3;31мг, 31%). Дані: (m/z)=453 (М+Н)+. Приклад 28, peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-2іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил1,2,3-тіадіазол-5-карбоксамід (10: R8=C4H3N2, R2=COC3H3N2S). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 10 (R8=C4H3N2, R2=COCF3) з отриманням peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-2іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил1,2,3-тіадіазол-5-карбоксаміду (10: R8=C4H3N2, R2=COC3H3N2S; 14мг, 47%). Дані: (m/z)=483 (М+Н)+. Приклад 29, рел-2,2,2-трифлуор-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(піразин-2-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід (10: R8=C4H3N2, R2=COCF3). Цю сполуку було отримано аналогічним чином, як описано у прикладі 27, з 10 (R8=Вr, R2=COCF3) з отриманням рел-2,2,2-трифлуор-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(піразин-2-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]ацетаміду (10: R8=C4H3N2, R2=COCF3; 24мг, 24%). Дані: (m/z)=453 (M+H)+. Приклад 30, метил peл-(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксилат (10: R8=СООСН3, R2=COCF3). До розчину 10 (R8=CN, R2=COCF3; 400мг, 1ммоль) у ЕtOН (20мл) було додано 6Η розчин 25 КОН у воді (8,5мл). Суміш гріли у мікрохвильовій шафі до 120°С (175Вт) протягом 3 годин. Реакційну суміш було нейтралізовано 2Η розчином хлоридної кислоти у воді. Реакційну суміш було концентровано під зниженим тиском та випарено разом з толуолом. Залишок було перенесено у МеОН (30мл) та були доданими триетиламін (277мкл, 2ммоль) та етилтрифлуорацетат (597мкл, 5ммоль). Реакційну суміш перемішували протягом ночі при 55°С та тоді її було концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі з отриманням (10: R8=СООН, R2=COCF3; 331мг, 79%). При перемішуванні до розчину 10 (R8=СООН, R2=COCF3; 30мг, 0,072ммоль) у метанолі (2мл) при 0°С було додано тіонілхлорид (300мкл, 3,46ммоль). Реакційну суміш перемішували протягом ночі при кімнатній температурі. Реакційну суміш було погашено насиченим водним розчином гідрокарбонату натрію у воді та продукт було екстраговано в етилацетат. Органічні матеріали були промитими розсолом, висушені натрій сульфатом та їх було концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі (Гептан:Етилацетат= 8:2). Сушка сублімацією з суміші ацетонітрил/вода дала метил peл-(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксилат (10: R8=COOCH3, R2=COCF3; 10,3мг, 33%). Дані: (m/z)=433 (М+Н)+. Приклад 31, етил peл-(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил 2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксилат (10: R8=СООСН2СН3, R2=COCF3). Цю сполуку було отримано аналогічним чином, як описано у прикладі 30, з 10 (R8=СООН, R2=COCF3) з отриманням етил peл-(2R,10R,14bR)1,2,3,4,10,14b-гeкcaгiдpo-10-метил-2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксилату (10: R8=СООСН2СН3, R2=COCF3; 18,9мг, 59%). Дані: (m/z)=447 (М+Н)+. Приклад 32, пропіл peл-(2R,10R,14bR)1,2,3,4,10,14b-гeкcaпдpo-10-мeтил 2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксилат (10: R8=СОО(СН2)2СН3, R2=COCF3). Цю сполуку було отримано аналогічним чином, як описано у прикладі 30, з 10 (R8=СООН, R2=COCF3) з отриманням пропіл рел(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил 2-(2,2,2-трифлуорацетиламіно)дибензо[с,f]піридо[1,2-а]азепін-8-карбоксилату (10: R8=СОО(СН2)2СН3, R2=COCF3; 10,3мг, 33%). Дані: (m/z)=461 (М+Н)+. Приклад 33, peл-(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-N-феніл-2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксамід (10: R8=CONH (C6H5), R2= COCF3). При перемішуванні до розчину 10 (R8=СООН, R2=COCF3; 40мг, 0,096ммоль) у диметилформаміді були доданими TBTU (46мг, 0,144ммоль) та 92024 26 DIPEA (84мкл, 0,48ммоль). Тоді було додано анілін (10мкл, 0,11ммоль) та реакційну суміш перемішували протягом 40 годин при кімнатній температурі. Реакційну суміш було погашено водою та органічні матеріали були екстраговані у ДХМ. Органічний прошарок було висушено на фільтрі та концентровано під зниженим тиском. Необроблений продукт було очищено препаративною ВЕРХ, це дало peл-(2R,10R,14bR)-1,2,3,4,10,14bгeкcaгiдpo-10-мeтил-N-феніл-2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксамід (10: R8=CONH (C6H5), R2=COCF3; 27,3мг, 58%). Дані: (m/z)=494 (М+Н)+. Приклад 34, рел-(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-10-метил-N-(піридин-4-іл)-2-(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксамід (10: R8=CONH (C5H4N), R2=COCF3). Цю сполуку було отримано аналогічним чином, як описано у прикладі 33, з 10 (R8=СООН, R2=COCF3) з отриманням peл-(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-N-(піридин-4іл)-2-(2,2,2-трифлуорацетиламіно)дибензо[с,f]піридо[1,2-а]азепін-8-карбоксаміду (10: R8=CONH(C5H4N), R2=COCF3; 17,5мг, 37%). Дані: (m/z)=495 (М+Н)+)=495 (М+Н)+. Приклад 35, peл-(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-N-(2-метоксипіримідин-5-іл)-10-метил-2(2,2,2трифлуорацетиламіно)дибензо[с,f]піридо[1,2а]азепін-8-карбоксамід (10: R8=CONH(C6H6NO), R2=COCF3). Цю сполуку було отримано аналогічним чином, як описано у прикладі 33, з 10 (R8=СООН, R2=COCF3) для peл-(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-N-(2-метоксипіримідин-5-іл)-10-метил-2(2,2,2-трифлуорацетиламіно)дибензо[с,f]піридо[1,2-а]азепін-8-карбоксаміду (10: R8=CONH(C6H6NO), R2=COCF3; 35,5мг, 71%). Дані: (m/z)=525 (M+H)+. Приклад 36, peл-(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-N-(2-метоксифеніл)-10-метил-2-(2,2,2трифлуорацетиламіно)-дибензо[с,f]піридо[1,2а]азепін-8-карбоксамід (10: R8=CONH(C7H7O), R2=COCF3). Цю сполуку було отримано аналогічним чином, як описано у прикладі 33, з 10 (R8=СООН, R2=COCF3) до peл-(2R,10R,14bR)-1,2,3,4,10,14bгексагідро-N-(2-метоксифеніл)-10-метил-2-(2,2,2трифлуорацетиламіно)-дибензо[с,f]-піридо[1,2а]азепін-8-карбоксаміду (10: R8=CONHC7H7O, R2=COCF3; 30,3мг,61%). Дані: (m/z)=524 (М+Н)+. Приклад 37, peл-2,2,2-тpифлyop-N[(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-10-метил8-(2-метилтетразол-5-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]ацетамід (10: R8=C2N4H3, R2=COCF3). До розчину 10 (R8=CN, R2=COCF3; 210мг, 0,53ммоль) у DME (3мл), триметилсилілазид (278мкл, 2,12ммоль) та дибутилстанумоксид (52мг, 0,21ммоль) були доданими. Суміш гріли у мікрохвильовій шафі до 160°С (300Вт) протягом 45 хвилин. Реакційну суміш було погашено 0,2Η розчином гідроксиду натрію та промито етилацетатом. Тоді основний водний прошарок було підкислено 2Η розчином хлоридної кислоти та екстраговано в 27 етилацетат. Органічний прошарок було промито водою та розсолом, висушено натрій сульфатом та концентровано під зниженим тиском з отриманням (10, R8=CN4H, R2=COCF3; 208мг, 89%). Дані: (m/z)=443 (М+Н)+. До розчину 10 (R8=CN4H, R2=COCF3; 200мг, 0,45ммоль) в ацетоні/ДМФ (1/1 20мл) натрій карбонат (72мг, 0,68ммоль) було додано, а потім Mel (280мкл, 4,5ммоль). Реакційну суміш перемішували протягом 3 годин при кімнатній температурі. Реакційну суміш було погашено 2Η розчином хлоридної кислоти та екстраговано в етилацетат. Органічний прошарок було промито водою та розсолом, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі (Гептан:Етилацетат= 6:4) з отриманням рел-2,2,2-трифлуор-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(2метилтетразол-5-іл)дибензо[с,f|піридо[1,2-а]азепін2-іл]ацетамід (10, R8=C2N4H3, R2=COCF3; 99мг 48%). Дані: (m/z)=457 (М+Н)+. Приклад 38, peл-2-xлop-2,2-дифлyop-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(2-метилтетразол-5-іл)дибензо[с,f]піридо[1,2а]азепін-2-іл]ацетамід (10: R8=C2N4H3, R2=COCCIF2). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 10 (R8=C2N4H3, R2=COCF3) з отриманням рел-2-хлор-2,2-дифлуорN-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10метил-8-(2-метилтетразол-5-іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетаміду (10: R8=C2N4H3, R2=COCCIF2; 24мг, 73%). Дані: (m/z)=473 (М+Н)+. Приклад 39, peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(2метилтетразол-5-іл)дибензо[с,f]піридо[1,2-а]азепін2-іл]-4-метил-1,2,3-тіадіазол-5-карбоксамід (10: R8=C2N4H3, R2=COC3H3N2S). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 10 (R8=C2N4H3, R2=COCF3) з отриманням peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(2метилтетразол-5-іл)дибензо[с,f]піридо[1,2-а]азепін2-іл]-4-метил-1,2,3-тіадіазол-5-карбоксаміду (10: R8=C2N4H3, R2=COC3H3N2S; 17мг, 50%). Дані: (m/z)=487 (М+Н)+. Приклад 40, рел-2,2,2-трифлуор-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(піримідин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід (10: R8=C4N2H3, R2=COCF3). Розчин 10 (R8=Br, R2=COCF3; 1,9г, 4,19ммоль), КОАс (1,23г, 12,6ммоль) та біспінаколятобор (1,17г, 4,61ммоль) у диметилформаміді (60мл) було дегазовано продуванням азоту протягом 15 хвилин. PdCI2(dppf)2 ([1,1'Біс(дифенілфосфіно)фероцен]дихлорпаладій(ІІ); 103мг, 0,13ммоль) було додано та реакційну суміш перемішували протягом ночі при 80°С. Реакційну суміш було погашено водою та продукт було екстраговано в етилацетат. Органічний прошарок було промито розсолом, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі (Гептан:Етилацетат= 85:15) з 92024 28 отриманням 10 (R8=C6H12BO2, R2=COCF3; 1,06г, 51%). Дані: (m/z)=501 (М+Н)+. При перемішуванні до розчину 10 (R8=C6H12BO2, R2=COCF3; 1,12г, 2,24ммоль) у суміші діоксану (42мл) та води (7мл) були доданими PdCI2(PPh3)2 (47мг, 0,067ммоль), Κ3ΡΟ4·7Η2Ο (910мг, 2,69ммоль), AsPh3 (47мг, 0,154ммоль) та 4,6-дихлорпіримідин (918мг, 6,16ммоль). Реакційну суміш перемішували протягом ночі при 100°С. Реакційну суміш було погашено насиченим водним розчином гідрокарбонату натрію у воді та продукт було екстраговано в етилацетат, промито розсолом, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі, отримуючи (10: R8=C4H2N2CI, R2=COCF3; 0,64г, 63%). Дані: (m/z)=487 (М+Н)+. При перемішуванні до розчину 10 (R8=C4H2N2CI, R2=COCF3; 614мг, 1,26ммоль) у ТГФ (50мл) та аміаку (22мл) було додано цинк (2,17г 33,2ммоль). Реакційну суміш перемішували протягом 5 годин при кип'ятінні під зворотним холодильником. Реакційну суміш було погашено насиченим водним розчином гідрокарбонату натрію у воді та профільтровано через декаліт. Продукт було екстраговано в етилацетат, промито розсолом, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі, отримуючи peл-2,2,2-тpифлyop-N[(2R,10R,14bR)-1,2,3,4,10,14b-гeкcaгiдpo-10-мeтил8-(піримідин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід (10: R8=C4H3N2, R2=COCF3; 485мг, 85%). Дані: (m/z)=453 (М+Н)+. Приклад 41, рел-2,2,2-трифлуор-N-[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(піридин-2-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід (10: R8=C5H4N, R2=COCF3). При перемішуванні до розчину 10 (R8=C6H12BO2, R2=COCF3; 50мг, 0,10ммоль) у суміші діоксану (3мл) та води (0,5мл) були доданими PdCI2 (PPh3)2 (6мг, 8,55мкмоль), Κ3ΡΟ4·7Η2Ο (40мг, 0,12ммоль), AsPh3 (6мг, 19,6мкмоль) та 2бромпіридин (26,3мкл, 0,28ммоль). Реакційну суміш перемішували протягом ночі при 100°С. Реакційну суміш було погашено водним розчином гідрокарбонату натрію у воді та продукт було екстраговано в етилацетат, промито розсолом, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено ко лонковою хроматографією на силікагелі а потім препаративною ВЕРХ з отриманням чистого peл-2,2,2-тpифлyop-N-[(2R,10R,14bR)1,2,3,4,10,14b-гeкcaгiдpo-10-метил-8-(піридин-2іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетаміду. (10: R8=C5H4N, R2=COCF3; 8мг, 18%). Дані: (m/z)=452(М+Н)+. Приклад 42, peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил1,2,3-тіадіазол-5-карбоксамід (10: R8=C4H3N2, R2=COC3H3N2S). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 10 (R8=C4H3N2, R2=COCF3) з отриманням peл-N-[(2R,10R,14bR) 29 1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-4-метил1,2,3-тіадіазол-5-карбоксаміду (10: R8=C4H3N2, R2=COC3H3N2S, 20мг, 62%). Дані (m/z)=483 (M+H)+. Приклад 43, рел-2,2-хлор-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід(10: R8=C4H3N2, R2=СОСНСІ2). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 10 (R8=C4H3N2, R2=COCF3) з отриманням peл-2,2-xлop-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(піримідин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]ацетаміду (10: R8=C4H3N2, R2=СОСНСІ2, 17мг, 53%). Дані (m/z)=468 (М+Н)+. Приклад 44, peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]метансульфонамід. (10: R8=C4H3N2, R2=COSO2CH3). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 10 (R8=C4H3N2, R2=COCF3) з отриманням peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]метансульфонаміду. (10: R8=C4H3N2, R2=COSO2CH3, 22мг, 72%). Дані (m/z)=435 (M+H)+. Приклад 45, peл-2-xлop-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід (10: R8=C4H3N2, R2=COCCIF2) Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 10 (R8=C4H3N2, R2=COCF3) з отриманням peл-2-хлор-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(піримідин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]ацетаміду (10: R8=C4H3N2, R2=COCF3, 23мг, 70%) Дані (m/z)=469 (М+Н)+. Приклад 46, peл-5-аміно-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4іл)дибензо[c,f]піридо[1,2-a]азепін-2-іл]1,2,5оксазол-4-карбоксамід (10: R8=C4H3N2, R2=COCH2N3O). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 10 (R8=C4H3N2, R2=COCF3) з отриманням рел-5-аміно-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(піримідин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]1,2,5-оксазол-4-карбоксаміду (10: R8=C4H3N2, R2=COCH2N3O, 22мг, 68%). Дані (m/z)=468 (М+Н)+. Приклад 47, рел-2,2,2-трифлуор-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-(піримідин-4-іл)дибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід (10: R2=COCF3, R4=CH3). При перемішуванні до розчину 9 (R4=CH3, 34мг, 0,12ммоль) (отримано аналогічним чином, як описано у прикладі 1) у метанолі (5мл) було додано триетиламін (81мкл, 0,58ммоль) та етилтрифлуорацетат (69мкл, 0,58ммоль) та реакційну суміш перемішували при 50°С та витримували протягом 5 годин. Реакційну суміш концентрували під зниженим тиском, тоді очищали колонковою хроматографією на силікагелі, отримуючи рел-2,2,2трифлуор-N-[(2R,10R,14bR)-1,2,3,4,10,14b 92024 30 гексагідро-10-метил-8-(піримідин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід (10: R2=COCF3, R4=CH3; 24мг, 53%). Дані: (m/z)=389 (М+Н)+. Приклад 44, peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-N'-метил-N'метоксисечовина (10: R8=CN, R2=CON(CH3)O(CH3)). При перемішуванні до розчину 9 (R8=CN; 75мг, 0,248ммоль) в етилацетаті (4мл) було додано каталітичну кількість активованого вугілля та трихлорметилхлорформіат (35мл, 0,298ммоль). Реакційну суміш гріли до кипіння під зворотним холодильником. Через 5 годин реакційну суміш було профільтровано через декаліт та концентровано під зниженим тиском, отримуючи 9 (R8=CN, R2=CNO). При перемішуванні до розчину ізоціанату 9 (R8=CN, R2=CNO) в етилацетаті (10мл) були доданими Et3N (173мл, 1,25ммоль) та Ν,Οдиметилгідроксиламін НСІ (121мг, 1,25ммоль) та реакційну суміш перемішували протягом ночі при 50°С. Тоді реакційну суміш було погашено насиченим водним розчином гідрокарбонату натрію у воді та продукт було екстраговано в етилацетат. Органічні матеріали були промитими водою, насиченим розчином NaCI у воді, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі, а потім препаративною ВЕРХ. Сушка сублімацією з ацетонітрилу/води дала peл-N-[(2R,10R,14bR)-1,2,3,4,10,14bгeкcaгiдpo-10-мeтил-8-(пipимiдин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-N'-метил-N'метоксисечовину (10, R8=CN, R2=CON(CH3)O(CH3); 30мг, 31%), Дані; (m/z)=391 (М+Н)+. Приклад 49, peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гексагідро-10-метил-8-(піримідин-4іл)дибензо[с,f]піридо[1,2-а]азепін-2-іл]-2гідроксіацетамід (10, R8=CN, R2=СОСН2ОН). При перемішуванні розчин 9 (R8=CN; 25мг, 0,0825ммоль) та триетиламіну (14мл, 0,099ммоль) у ДХМ (2мл) було охолоджено до 0°С. Ацетоксіацетилхлорид (11мл, 0,099ммоль) було додано та реакційну суміш перемішували при кімнатній температурі протягом 2 годин. Реакційну суміш було погашено насиченим водним розчином гідрокарбонату натрію у воді та продукт було екстраговано у ДХМ. Органічні матеріали були висушеними та концентрованими під зниженим тиском, необроблений продукт було очищено колонковою хроматографією на силікагелі, отримуючи 10 (R8=CN, R2=СОСН2ОС(О)СН3; 30мг, 90%). Дані; (m/z)=404 (М+Н)+. При перемішуванні до розчину 10 (R8=CN, R2=СОСН2ОС(О)СН3; 30мг, 0,075ммоль) у МеОН (3мл) було додано КОН (42мг, 0,75ммоль) у воді (1,5мл) та реакційну суміш перемішували при кімнатній температурі протягом 15 хвилин. Реакційну суміш було вилито у воду та продукт було екстраговано в етилацетат. Органічні матеріали були промитими водою та розсолом, висушені натрій сульфатом та концентрованими під зниженим тиском. Необроблений продукт було очищено колон 31 ковою хроматографією на силікагелі, а потім препаративною ВЕРХ. Сушка сублімацією з суміші ацетонітрил/вода дала рел-N-[(2R,10R,14bR)-8ціано-1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-2гідроксіацетамід (10, R8=CN, R2=СОСН2ОН; 7,5мг, 28%). Дані: (m/z)=362 (М+Н)+. Приклад 50, рел-(2R,10R,14bR)-2-[(N,Nдиметиламінокарбоніл)аміно]-1,2,3,4,10,14bгексагідро-10-метил-N-фенілдибензо[с,f]піридо[1,2а]азепін-8-карбоксамід (10: R8=CONH(C6H5), R2= CON(CH3)2). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 10 (R8=CONH(C6H5), R2=COCF3) з отриманням peл(2R,10R,14bR)-2-[(N,Nдиметиламінокарбоніл)аміно]-1,2,3,4,10,14bгексагідро-10-метил-N-фенілдибензо[с,f|піридо[1,2а]азепін-8-карбоксаміду (10: R8=CONH(C6H5), R2=CON(CH3)2; 7,4мг, 30%). Дані: (m/z)=469(M+H)+. Приклад 51, peл-2,2,2-тpифлyop-N[(2R,10R,14bR)-8-[4,5-диriдpooкcaзoл-2-iл]1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід (10: R8=C3H4NO, R2=COCF3). При перемішуванні до розчину 10 (R8=COOH, R2=COCF3; 200мг, 0,48ммоль) у ДХМ (4мл) та ДМФ (одна крапля), було додано оксалілхлорид (65мл, 0,72ммоль). Реакційну суміш перемішували протягом 1 годин при кімнатній температурі та тоді її було концентровано під зниженим тиском. Необроблений хлорангідрид кислоти було розчинено у ДХМ (1мл) та додано до розчину аміноетанолу (60мл, 0,96ммоль) та Et3N (130мл, 0,96ммоль) у ДХМ (3мл). Реакційну суміш перемішували протягом 1 годин при кімнатній температурі, тоді її було погашено насиченим водним розчином гідрокарбонату натрію у воді та продукт було екстраговано в етилацетат. Органічні матеріали були промитими насиченим розчином NaCI у воді, висушені натрій сульфатом та концентровані під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі, отримуючи (10: R8=C(O)NHCH2CH2OH, R2=COCF3; 152мг, 69%). При перемішуванні до розчину 10 (R8=CN, R2=СОСН2ОС(О)СН3; 30мг, 0,075ммоль) у МеОН (3мл) було додано КОН (42мг, 0,75ммоль) у воді (1,5мл) та реакційну суміш перемішували при кімнатній температурі протягом 15 хвилин. Реакційну суміш було вилито у воду та продукт було екстраговано в етилацетат. Органічні матеріали були промитими водою та розсолом, висушеними натрій сульфатом та концентрованими під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі, а потім препаративною ВЕРХ. Сушка сублімацією з суміші ацетонітрил/вода дала рел-N-[(2R,10R,14bR)-8ціано-1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-2гідроксіацетамід (10, R8=CN, R2=СОСН2ОН; 7,5мг, 28%). Дані: (m/z)=362 (М+Н)+. Приклад 50, рел-(2R,10R,14bR)-2-[(N,Nдиметиламінокарбоніл)аміно]-1,2,3,4,10,14b 92024 32 гексагідро-10-метил-N-фенілдибензо[с,f]піридо[1,2а]азепін-8-карбоксамід (10: R8=CONH(C6H5), R2=CON(CH3)2). Цю сполуку було отримано аналогічним чином, як описано у прикладі 3, з 10 (R8=CONH(C6H5), R2=COCF3) з отриманням peл(2R,10R,14bR)-2-[(N,Nдиметиламінокарбоніл)аміно]-1,2,3,4,10,14bгексагідро-10-метил-N-фенілдибензо[с,f]піридо[1,2а]азепін-8-карбоксаміду (10: R8=CONH(C6H5), R2=CON(CH3)2; 7,4мг, 30%). Дані: (m/z)=469(М+Н)+. Приклад 51, рел-2,2,2-трифлуор-N[(2R,10R,14bR)-8-[4,5-дигiдpooкcaзoл-2-iл]1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід (10: R8=C3H4NO, R2=COCF3). При перемішуванні до розчину 10 (R8=СООН, R2=COCF3; 200мг, 0,48ммоль) у ДХМ (4мл) та ДМФ (одна крапля) було додано оксалілхлорид (65мл, 0,72ммоль). Реакційну суміш перемішували протягом 1 годин при кімнатній температурі та тоді її було концентровано під зниженим тиском. Необроблений хлорангідрид кислоти було розчинено у ДХМ (1мл) та додано до розчину аміноетанолу (60мл, 0,96ммоль) та Et3N (130мл, 0,96ммоль) у ДХМ (3мл). Реакційну суміш перемішували протягом 1 годин при кімнатній температурі, тоді її було погашено насиченим водним розчином гідрокарбонату натрію у воді та продукт було екстраговано в етилацетат. Органічні матеріали були промитими насиченим розчином NaCI у воді, висушеними натрій сульфатом та концентрованими під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі, отримуючи (10: R8=C(O)NHCH2CH2OH, R2=COCF3; 152мг, 69%). При перемішуванні до розчину 10 (R8=C(O)NHCH2CH2OH, R2=COCF3; 150мг, 0,325ммоль) у ДХМ (5мл), було додано SOCI2 ( 90мл, 0,65ммоль). Реакційну суміш перемішували протягом ночі при кімнатній температурі. Реакційну суміш було погашено насиченим водним розчином гідрокарбонату натрію у воді та продукт було екстраговано у ДХМ. Органічні матеріали були промитими насиченим розчином NaCI у воді, висушеними натрій сульфатом та концентрованими під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі, отримуючи peл-2,2,2-тpифлyop-N[(2R,10R,14bR)-8-[4,5-дигiдpooкcaзoл-2-iл]1,2,3,4,10,14b-гексагідро-10метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід (10: R8=C3H4NO, R2=COCF3; 60мг, 42%). Дані: (m/z)=444 (М+Н)+. Приклад 52, рел-2,2,2-трифлуор-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-нітродибензо[с,f]піридо[1,2-а]азепін-2-іл]ацетамід (10: R8=NO3, R2=COCF3). Розчин 10 (8=Η, R2=COCF3; 76мг, 0,2ммоль) у ДХМ (1,5мл) було охолоджено до 0°С та було додано порціями димлячу нітратну кислоту (21мкл, 0,5ммоль). Лід/вода-баню було видалено та реакційна суміш стала червоною. Через 10 хвилин реакційну суміш було погашено водним розчином гід 33 рокарбонату натрію, екстраговано ДХМ, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі (Гептан:Етилацетат= 7:3) а потім препаративною ВЕРХ. Сушка сублімацією з суміші ацетонітрил/вода дала рел-2,2,2-трифлуор-N[(2R,10R,14bR)-1,2,3,4,10,14b-гексагідро-10-метил8-нітродибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід) (10, R8=NO2, R2=COCF3; 6мг, 7%. Дані: (m/z)=420 (М+Н)+. Приклад 53, рел-2,2,2-трифлуор-N[(2R,10R,14bR)-8-форміл-1,2,3,4,10,14b-гексагідро10-метилдибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід (10: R8=CHO, R2=COCF3). Оксалілхлорид (0,594мл, 6,8ммоль) було додано краплями при перемішуванні до розчину Ν,Νдиметилформаміду (3,5мл) при 0°С. Реакційну суміш перемішували протягом 25 хвилин при 0°С та утворився білий осад. Розчин 10 (R8=Η, R2=COCF3; 510мг, 1,36ммоль) у Ν,Νдиметилформаміді (2,5мл) було тоді додано до реакційної суміші та це гріли до 70°С. Через 1,5 години реакційну суміш було охолоджено, погашено водним розчином гідрокарбонату натрію та продукт було екстраговано в етилацетат, висушено натрій сульфатом та концентровано під зниженим тиском. Необроблений продукт було очищено колонковою хроматографією на силікагелі (Гептан:Етилацетат= 7:3) а потім препаративною ВЕРХ. Сушка сублімацією з суміші ацетонітрил/вода дала рел-2,2,2-трифлуор-N[(2R,10R,14bR)-8-форміл-1,2,3,4,10,14b-гексагідро10-метилдибензо[с,f]піридо[1,2-а]азепін-2іл]ацетамід (10, R8=СНО, R2=COCF3; 164мг, 30%). Дані: (m/z)=403(М+Н)+. Приклад 54, peл-N-[(2R,10R,14bR)1,2,3,4,10,14b-гeкcaгiдpo-8-[1-(гiдpoкciiмiнo)eтил]10-метилдибензо[с,f]піридо[1,2-а]азепін-2-іл]-4метил-1,2,3-тіадіазол-5-карбоксамід (10: R8=С (CH3)NOH, R2=COC3H3N2S). Цю сполуку було отримано аналогічним чином, як описано у прикладі 13, з 10 (R8=СОСН3, R2=COC3H3N2S) з отриманням peл-N[(2R,10R,14bR)-1,2,3,4,-10,14b-гексагідро-8-[1(гідроксііміно)етил]-10-метилдибензо[с,f]піридо[1,2а]азепін-2-іл]-4-метил-1,2,3-тіадіазол-5карбоксаміду (10: R8=C(CH3)NOH, R2=COC3H3N2S; 170мг, 49%). Дані: (m/z)=462 (M+H)+. Приклад 55, Активність стосовно зв'язування глюкокортикоїдного рецептору. Афінність сполук було тестовано, застосовуючи комплект для конкурентного аналізу глюкокортикоїдного рецептору (PanVera®). Компоненти комплекту були розмороженими від -80°С на льоді (Флуормон GS1, рекомбінантний глюкокортикоїдний рецептор людини (GR)) або при кімнатній температурі (буфер для GR-скринінгу, стабілізувальний пептид та DTT). 10мМ тест-сполуки були розведеними до 20мкМ, а тоді серійно розведеними до кінцевої концентрації у межах від 10мкМ до 0,1нМ, застосовуючи ВіоМек 2000 (BeckmanCoulter) у 384-лунковий планшет з чорними стінками (Matrix technologies). У нижченаведеному по 92024 34 рядку: флуормон GS1 (1нМ кінцева концентрація) додають в усі лунки за винятком контрольних лунок з буфером, GR (4нМ кінцева концентрація) додають до усіх лунок за винятком мінімуму та контрольних лунок з буфером, кортизол (10мкМ кінцева концентрація) додають тільки до контрольних лунок з флуормоном GS1, буфер додають в усі лунки до кінцевого об'єму 40мкл. Планшет покривають та інкубують при кімнатній температурі з перемішуванням протягом 90 хвилин. Зчитування робили, застосовуючи Analyst (LJL) у режимі зчитування флуоресценції поляризації. Співвідношення МіІІіР розраховують за числом імпульсів у секунду, отриманих у паралельному та перпендикулярному режимі. Процент впливу зв'язаного ліганду розраховують при кожній концентрації та створюють криві доза - реакція, що дозволяє розрахувати ЕК50. Це порівнюють з відомим стандартним (11β,17β)-11-(1,3-бензодіоксол-5-іл)-17гідрокси-17-(1-пропініл)естра-4,9-дієн-3-он (CAS Не. 189035-07-2), ЕК50=10-8М). Усі показані сполуки мають активності стосовно зв'язування менше 2 10-8М. Приклад 56, Функціональні реакції in vitro Для визначення здатності сполук інгібувати експресію запального гена in vitro, були оціненими реакції сполук у лінії клітин людини U2OS, що були стабільно трансфектованими рекомбінантною ДНК GR людини. Клітини U2OS були стимульованими TNFα та IFNγ, що призводить до секреції МСР-1 у супернатант. Секрецію МСР-1 визначають опосередковано застосуванням двох антилюдськихМСР-1 антитіл, одне є міченим флуоресцентним донором європієм, друге мічене флуоресцентним акцептором алофікоціаніном (АРС). Секрецію МСР-1 у супернатант визначають вимірюванням емісії при довжині хвилі АРС (665нм), коли європій збуджують при 340нм. Здатність сполук (преднізолону або сполуки формули І) стосовно інгібування експресії МСР-1 було визначено та значення ЕК50 були розрахованими. Усі показані сполуки були тестованими цим аналізом та показали потужні антизапальні властивості in vitro менше 2 10-3Μ. Приклад 57. Антизапальна активність in vivo. Потужність сполук стосовно інгібування запалення може бути визначеною у моделі, у котрій мишей обробляють ліпополісахаридом (LPS). Антизапальна дія може бути визначеною як інгібування індукованого ліпополісахаридом TNFα (S.R. Hyde & R.B. McCallum, Infectioin & Immumty, 60; 976-982 (1992)). Мишей обробляють інтраперитонеально 0,5мг/кг LPS. Сполуки формули І дозують системно пероральним застосуванням за 1 годину до індукції за допомогою LPS. Через півтори години після індукції LPS, сироватку збирають та мишей вбивають, Рівні TNFα у сироватці визначають, застосовуючи комерційно доступний комплект Elisa згідно з інструкціями виробника. Вибір (приклади 3, 5, 12, 16, 19, 20, 26, 38, 39, 42, 54) показаних сполук було тестовано у цій моделі. Усі тестовані сполуки показують антизапальну активність у моделі з ЕД50 менше 10мг/кг). Приклад 58, Антиартритна активність in vivo Здатність сполук інгібувати артрит може бути тестованою у моделі артриту, індукованого кола 35 92024 геном типу II, у мишей (D.E. Trentham et al J Exp Med 146- 857-868 (1977)). У цій моделі самців мишей Dba/1 імунізують та ревакцинують (через 3 тижні) колагеном. Артрит визначають як набрякання лап. Мишей, в яких розвився артрит, було перорально ліковано протягом 3 тижні преднізолоном або сполуками формули І (терапевтична модель). У моделі крім того розвиток артриту ви Комп’ютерна верстка Т. Чепелева 36 значають як набрякання лап 3 рази на тиждень. Через 3 тижні мишей вбивають. Потужність сполук стосовно інгібування артриту визначають як здатність стосовно інгібування набрякання лап. Вибір (приклади 5, 12, 19, 20, 39, 54) показаних сполук було тестовано у цій моделі. Усі тестовані сполуки показують анти артритну активність у моделі із ЕД50 менше 10мг/кг). Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNon-steroidal compounds useful as glucocorticoid receptor modulators
Автори англійськоюPlate Ralf, Jans Christiaan Gerardus Johannes Maria
Назва патенту російськоюНестероидные соединения, полезные в качестве модуляторов глюкокортикоидных рецепторов
Автори російськоюПлате Ральф, Янс Кристиан Герардус Йоганнес Мария
МПК / Мітки
МПК: C07D 471/04, A61P 29/00, A61P 5/44, A61K 31/55
Мітки: глюкокортикоїдних, корисні, рецепторів, сполуки, модулятори, нестероїдні
Код посилання
<a href="https://ua.patents.su/18-92024-nesterodni-spoluki-korisni-yak-modulyatori-glyukokortikodnikh-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Нестероїдні сполуки, корисні як модулятори глюкокортикоїдних рецепторів</a>
Попередній патент: Пиловловлювач
Наступний патент: Індольні сполуки
Випадковий патент: Спосіб вирощування культурних рослин












