Індольні сполуки
Номер патенту: 92025
Опубліковано: 27.09.2010
Автори: Доде П'єр, Бене Жан, Барт Мартін, Пупарден-Олів'є Олівія, Бубіа Бенаїсса, Лєжондр Крістіан
Формула / Реферат
1. Похідне індолу, яке відрізняється тим, що воно вибране із:
і) сполук формули
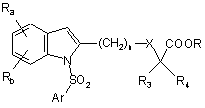 , (I)
, (I)
в якій:
Ra і Rb кожен незалежно означає атом водню, атом галогену, С1-С6алкільну групу, CF3, CN, CO-R2 або OR2, або фенільну групу, необов'язково заміщену С1-С4алкільною групою або групою CF3;
R2 означає С1-С4алкільну або CF3 групу, або фенільну групу, необов'язково заміщену С1-С4алкільною групою або групою CF3;
R3 і R4 кожен незалежно означає атом водню або С1-С4алкільну групу;
R означає атом водню або С1-С3алкільну групу;
n=1, 2 або 3;
X означає одинарний зв'язок, атом кисню або атом сірки; і
Аr означає ароматичне або гетероароматичне кільце, вибране з групи, яку складають феніл, нафтил, хінолініл, ізохінолініл, піридиніл, піразоліл, імідазоліл, ізоксазоліл, тіазоліл, бензімідазоліл, бензотіазоліл, 2,1,3-бензотіадіазоліл, 3,4-дигідро-1,4-бензоксазиніл, 5,6,7,8-тетрагідронафталініл, 1,2,3,4-тетрагідрохінолініл, 1,2,3,4-тетрагідроізохінолініл, 1,2,3,4-тетрагідро-2-оксохінолініл, 3,4-дигідро-2Н-бензопіраніл, індоліл, 2,3-дигідроіндоліл, бензофураніл, 2,3-дигідробензофураніл, 1,3-бензодіоксоліл, 1,4-бензодіоксаніл і бензоксазоліл, необов'язково заміщені одним чи кількома атомами або групами атомів, вибраних з атомів галогену і С1-С6алкільної групи, фенільної групи, CF3, CN, CO-R2, OR2, SR2, NH-COR2, морфолінілу, аміно і 4-морфоліносульфонілу; і
іі) їх фармацевтично прийнятних солей.
2. Сполука за п. 1, яка відрізняється тим, що принаймні один із замісників Ra і Rb не є атомом водню.
3. Сполука за п. 1 або 2, яка відрізняється тим, що Аr означає феніл або азотовмісну гетероароматичну групу.
4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що n дорівнює 1 або 2.
5. Сполука за будь-яким з пп. 1-4 для застосування як фармакологічно активної речовини.
6. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу, призначеного для лікування гіпертригліцеридемії, гіперліпідемії, гіперхолестеринемії, ожиріння і діабету.
7. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу, призначеного для лікування дисфункції ендотелію.
8. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу, призначеного для лікування серцево-судинного захворювання, запального захворювання і нейродегенеративного захворювання, такого як, зокрема, хвороба Альцгеймера або хвороба Паркінсона.
9. Фармацевтична композиція, яка відрізняється тим, що вона містить щонайменше одну сполуку за будь-яким з пп. 1-4 як активну речовину.
10. Спосіб одержання сполуки за п. 1, який відрізняється тим, що проводять
а) взаємодію, відповідно до реакції Соногашири, сполуки формули
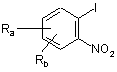 , (II)
, (II)
в якій:
Ra і Rb кожен незалежно є атомом водню, фтору, хлору або брому або С1-С6алкільною групою, CF3, CN, CO-R2 або OR2; і
R2 є С1-С4алкільною групою або групою CF3, або фенільною групою, необов'язково заміщеною С1-С4алкільною групою або групою CF3,
з похідним ацетилену формули
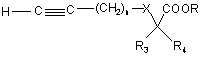 , (III)
, (III)
в якій:
n=1, 2 або 3;
R3 і R4 кожен незалежно є атомом водню або С1-С4алкільною групою;
R є С1-С3алкільною групою; і
X є одинарним зв'язком, атомом кисню або атомом сірки,
у присутності йодиду міді, каталізатора на основі паладію, наприклад тетракіс(трифенілфосфін)паладію, і органічної основи у розчиннику, наприклад диметилформаміді (ДМФ), при температурі між 0 і 60°С протягом 2-24 годин з одержанням сполуки формули
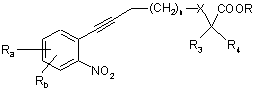 , (IV)
, (IV)
в якій:
Ra, Rb, n, X, R3, R4 і R є такими, як визначено для вихідних сполук;
б) відновлення нітрогрупи, яку несе наведена вище сполука формули IV, наприклад, шляхом взаємодії з хлоридом олова в присутності етанолу, у розчиннику при температурі, близькій до кімнатної температури, протягом 1-24 годин, з одержанням аніліну формули
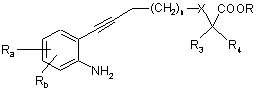 , (V)
, (V)
в якій:
Ra, Rb, n, X, R3, R4 і R є такими, як визначено для вихідних сполук;
в) взаємодію сполуки формули V з арилсульфонілхлоридом формули
Ar-SO2-Cl, (VI)
в якій:
Аr означає ароматичне або гетероароматичне кільце, вибране з групи, яку складають феніл, нафтил, хінолініл, ізохінолініл, піридиніл, піразоліл, імідазоліл, ізоксазоліл, тіазоліл, бензімідазоліл, бензотіазоліл, 2,1,3-бензотіадіазоліл, 3,4-дигідро-1,4-бензоксазиніл, 5,6,7,8-тетрагідронафталініл, 1,2,3,4-тетрагідрохінолініл, 1,2,3,4-тетрагідроізохінолініл, 1,2,3,4-тетрагідро-2-оксохінолініл, 3,4-дигідро-2Н-бензопіраніл, індоліл, 2,3-дигідроіндоліл, бензофураніл, 2,3-дигідробензофураніл, 1,3-бензодіоксоліл, 1,4-бензодіоксаніл і бензоксазоліл, необов'язково заміщені одним або кількома атомами або групами атомів, вибраних з атомів галогену і С1-С6алкілу, фенілу, CF3, CN, CO-R2, SR2, OR2, NH-COR2, морфолінілу, аміно і 4-морфоліносульфонілу,
у присутності піридину при кімнатній температурі протягом 10-120 хвилин з одержанням сполуки формули
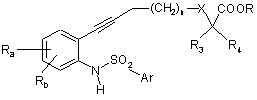 , (VII)
, (VII)
в якій:
Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначено для вихідних сполук;
г) циклізацію сполуки формули VII, наприклад, шляхом взаємодії з ацетатом міді (II) у розчиннику при температурі, близької до температури кипіння розчинника, протягом 4-24 годин з одержанням сполуки формули
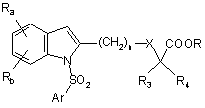 , (Ia)
, (Ia)
в якій:
Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначено для вихідних сполук; і
д) якщо необхідно, гідроліз естерної групи сполуки формули Іа, а потім обробку продукту кислотою з одержанням сполуки формули І у вигляді вільної кислоти:
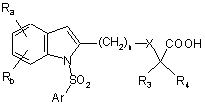 (Ib).
(Ib).
11. Спосіб одержання сполуки за п. 1, який відрізняється тим, що проводять
а) реакцію галогенування, переважно йодування, на аніліні формули
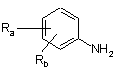 , (VIII)
, (VIII)
в якій:
Ra і Rb кожен незалежно означає атом водню, атом галогену або С1-С6алкільну групу, CF3, CN, CO-R2 aбo OR2; і
R2 означає С1-С4алкільну групу або CF3, або фенільну групу, необов'язково заміщену С1-С4алкільною групою або CF3,
за допомогою галогенувального агента, наприклад дихлорйодату бензилметиламонію, у розчиннику, такому як дихлорметан або метанол, при кімнатній температурі протягом 5-24 годин з одержанням сполуки формули
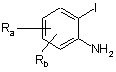 , (IX)
, (IX)
в якій:
Ra і Rb є такими, як визначено для вихідних сполук;
б) взаємодію сполуки формули IX з похідним ацетилену формули
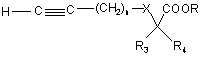 , (III)
, (III)
в якій:
n=1, 2 або 3;
R3 і R4 кожен незалежно означає атом водню або С1-С4алкільну групу;
R означає С1-С3алкільну групу; і
X означає одинарний зв'язок, атом кисню або атом сірки,
у присутності йодиду міді, каталізатора на основі паладію, наприклад тетракіс(трифенілфосфін)паладію, і органічної основи у розчиннику, наприклад диметилформаміді (ДМФ), при температурі між 0 і 60°С протягом 2-24 годин з одержанням сполуки формули
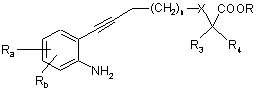 , (V)
, (V)
в якій:
Ra, Rb, n, X, R3, R4 і R є такими, як визначено для вихідних сполук;
в) циклізацію сполуки формули V, наприклад, шляхом взаємодії з ацетатом міді (II) у розчиннику при температурі, близькій до температури кипіння розчинника, протягом 4-24 годин з одержанням сполуки індолу формули
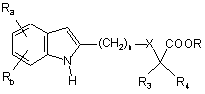 , (X)
, (X)
в якій:
Ra, Rb, n, X, R3, R4 і R є такими, як визначено для вихідних сполук;
г) взаємодію наведеної вище сполуки формули (X) з арилсульфонілхлоридом формули
Ar-SO2-Cl, (VI)
в якій:
Ar є ароматичним або гетероароматичним кільцем, вибраним з групи, яку складають феніл, нафтил, хінолініл, ізохінолініл, піридиніл, піразоліл, імідазоліл, ізоксазоліл, тіазоліл, бензімідазоліл, бензотіазоліл, 2,1,3-бензотіадіазоліл, 3,4-дигідро-1,4-бензоксазиніл, 5,6,7,8-тетрагідронафталініл, 1,2,3,4-тетрагідрохінолініл, 1,2,3,4-тетрагідроізохінолініл, 1,2,3,4-тетрагідро-2-оксохінолініл, 3,4-дигідро-2Н-бензопіраніл, індоліл, 2,3-дигідроіндоліл, бензофураніл, 2,3-дигідробензофураніл, 1,3-бензодіоксоліл, 1,4-бензодіоксаніл і бензоксазоліл, необов'язково заміщені одним чи кількома атомами або групами атомів, вибраних з атомів галогену і С1-С6алкілу, фенілу, CF3, CN, CO-R2, SR2, OR2, NH-COR2, морфолінілу, аміно і 4-морфоліносульфонілу,
у розчиннику при кімнатній температурі протягом 1-12 годин, зазвичай після активації сполук індолу формули (X) гідридом натрію, з одержанням сполуки формули (Іа):
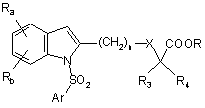 , (Ia)
, (Ia)
в якій:
Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначено для вихідних сполук; і
д) якщо необхідно, гідроліз естерної групи сполуки формули Іа, наприклад, шляхом взаємодії з неорганічною основою, такою як гідроксид натрію або гідроксид літію, після чого продукт обробляють кислотою з одержанням сполуки формули І у вигляді її вільної кислоти:
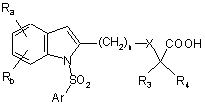 (Ib).
(Ib).
12. Спосіб одержання сполуки за п. 1, який відрізняється тим, що проводять
а) взаємодію сполуки формули IX:
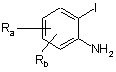 , (IX)
, (IX)
в якій:
Ra i Rb кожен незалежно означає атом водню, фтору, хлору чи брому або С1-С6алкільну групу, CF3, CN, CO-R2 або OR2; і
R2 є С1-С4алкільною групою або групою CF3, або фенільною групою, необов'язково заміщеною С1-С4алкільною групою або групою CF3,
з арилсульфонілхлоридом формули
Ar-SO2-Cl, (VI)
в якій:
Ar є ароматичним або гетероароматичним кільцем, вибраним з групи, яку складають феніл, нафтил, хінолініл, ізохінолініл, піридиніл, піразоліл, імідазоліл, ізоксазоліл, тіазоліл, бензімідазоліл, бензотіазоліл, 2,1,3-бензотіадіазоліл, 3,4-дигідро-1,4-бензоксазиніл, 5,6,7,8-тетрагідронафталініл, 1,2,3,4-тетрагідрохінолініл, 1,2,3,4-тетрагідроізохінолініл, 1,2,3,4-тетрагідро-2-оксохінолініл, 3,4-дигідро-2Н-бензопіраніл, індоліл, 2,3-дигідроіндоліл, бензофураніл, 2,3-дигідробензофураніл, 1,3-бензодіоксоліл, 1,4-бензодіоксаніл і бензоксазоліл, необов'язково заміщені одним чи кількома атомами або групами атомів, вибраними з атомів галогену і C1-C6алкілу, фенілу, CF3, CN, CO-R2, OR2, SR2, NH-COR2, морфолінілу, аміно і 4-морфоліносульфонілу,
у розчиннику при кімнатній температурі протягом 1-12 годин з одержанням сполуки формули
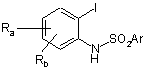 , (XI)
, (XI)
в якій:
Ra, Rb і Ar є такими, як визначено для вихідних сполук;
б) взаємодію сполуки формули XI з похідним ацетилену формули
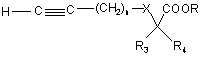 , (III)
, (III)
в якій:
n=1, 2 або 3;
R3 і R4 кожен незалежно означає атом водню або С1-С4алкільну групу;
R означає С1-С3алкільну групу; і
X означає одинарний зв'язок, атом кисню або атом сірки,
у присутності йодиду міді, каталізатора на основі паладію, наприклад тетракіс(трифенілфосфін)паладію, і органічної основи у розчиннику, наприклад диметилформаміді (ДМФ), при температурі між 0 і 60°С протягом 2-24 годин з одержанням сполуки формули
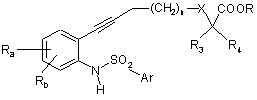 , (VII)
, (VII)
в якій:
Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначено для вихідних сполук;
в) циклізацію наведеної вище сполуки формули VII, наприклад, шляхом взаємодії з ацетатом міді (II) у розчиннику при температурі, близькій до температури кипіння розчинника, протягом 4-24 годин з одержанням сполуки індолу формули
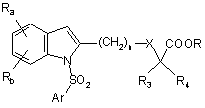 , (Ia)
, (Ia)
в якій:
Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначено для вихідних сполук; і
г) якщо необхідно, гідроліз естерної групи сполуки формули Іа, шляхом взаємодії з неорганічною основою, такою як гідроксид натрію чи гідроксид літію, після чого продукт обробляють кислотою з одержанням сполуки формули І у вигляді її вільної кислоти:
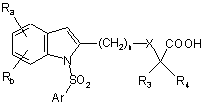 .
.
13. Спосіб за п. 12 одержання сполуки за п. 1, який відрізняється тим, що дві стадії (б) і (в) здійснюють в одній операції.
Текст
1. Похідне індолу, яке відрізняється тим, що воно вибране із: і) сполук формули Ra C2 2 (19) 1 3 92025 4 3. Сполука за п. 1 або 2, яка відрізняється тим, Ra, Rb, n, X, R3, R4 і R є такими, як визначено для що Аr означає феніл або азотовмісну гетероаровихідних сполук; матичну групу. б) відновлення нітрогрупи, яку несе наведена ви4. Сполука за будь-яким з пп. 1-3, яка відрізняще сполука формули IV, наприклад, шляхом взаєється тим, що n дорівнює 1 або 2. модії з хлоридом олова в присутності етанолу, у 5. Сполука за будь-яким з пп. 1-4 для застосуванрозчиннику при температурі, близькій до кімнатної ня як фармакологічно активної речовини. температури, протягом 1-24 годин, з одержанням 6. Застосування сполуки за будь-яким з пп. 1-4 для аніліну формули виготовлення лікарського засобу, призначеного (CH2)n X COOR для лікування гіпертригліцеридемії, гіперліпідемії, гіперхолестеринемії, ожиріння і діабету. R3 R4 7. Застосування сполуки за будь-яким з пп. 1-4 для Ra виготовлення лікарського засобу, призначеного NH2 для лікування дисфункції ендотелію. Rb , (V) 8. Застосування сполуки за будь-яким з пп. 1-4 для в якій: виготовлення лікарського засобу, призначеного Ra, Rb, n, X, R3, R4 і R є такими, як визначено для для лікування серцево-судинного захворювання, вихідних сполук; запального захворювання і нейродегенеративного в) взаємодію сполуки формули V з арилсульфонізахворювання, такого як, зокрема, хвороба Альцлхлоридом формули геймера або хвороба Паркінсона. Ar-SO2-Cl, (VI) 9. Фармацевтична композиція, яка відрізняється в якій: тим, що вона містить щонайменше одну сполуку за Аr означає ароматичне або гетероароматичне будь-яким з пп. 1-4 як активну речовину. кільце, вибране з групи, яку складають феніл, на10. Спосіб одержання сполуки за п. 1, який відрізфтил, хінолініл, ізохінолініл, піридиніл, піразоліл, няється тим, що проводять імідазоліл, ізоксазоліл, тіазоліл, бензімідазоліл, а) взаємодію, відповідно до реакції Соногашири, бензотіазоліл, 2,1,3-бензотіадіазоліл, 3,4-дигідросполуки формули 1,4-бензоксазиніл, 5,6,7,8-тетрагідронафталініл, I 1,2,3,4-тетрагідрохінолініл, 1,2,3,4Ra тетрагідроізохінолініл, 1,2,3,4-тетрагідро-2оксохінолініл, 3,4-дигідро-2Н-бензопіраніл, індоліл, NO2 Rb 2,3-дигідроіндоліл, бензофураніл, 2,3, (II) дигідробензофураніл, 1,3-бензодіоксоліл, 1,4в якій: бензодіоксаніл і бензоксазоліл, необов'язково заRa і Rb кожен незалежно є атомом водню, фтору, міщені одним або кількома атомами або групами хлору або брому або С1-С6алкільною групою, CF3, атомів, вибраних з атомів галогену і С1-С6алкілу, CN, CO-R2 або OR2; і фенілу, CF3, CN, CO-R2, SR2, OR2, NH-COR2, морR2 є С1-С4алкільною групою або групою CF3, або фолінілу, аміно і 4-морфоліносульфонілу, фенільною групою, необов'язково заміщеною С1у присутності піридину при кімнатній температурі С4алкільною групою або групою CF3, протягом 10-120 хвилин з одержанням сполуки з похідним ацетилену формули формули (CH2)n X COOR C C H (CH2)n X COOR R3 R4 , (III) в якій: n=1, 2 або 3; R3 і R4 кожен незалежно є атомом водню або С1С4алкільною групою; R є С1-С3алкільною групою; і X є одинарним зв'язком, атомом кисню або атомом сірки, у присутності йодиду міді, каталізатора на основі паладію, наприклад тетракіс(трифенілфосфін)паладію, і органічної основи у розчиннику, наприклад диметилформаміді (ДМФ), при температурі між 0 і 60°С протягом 2-24 годин з одержанням сполуки формули (CH2)n X COOR R3 Ra Rb в якій: Ra N Rb R3 SO2 H R4 Ar , (VII) в якій: Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначено для вихідних сполук; г) циклізацію сполуки формули VII, наприклад, шляхом взаємодії з ацетатом міді (II) у розчиннику при температурі, близької до температури кипіння розчинника, протягом 4-24 годин з одержанням сполуки формули Ra (CH2)n R4 X COOR N Rb NO2 , (IV) SO2 Ar в якій: R3 R4 , (Ia) 5 92025 6 Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначено (CH2)n X COOR для вихідних сполук; і д) якщо необхідно, гідроліз естерної групи сполуки R3 R4 формули Іа, а потім обробку продукту кислотою з Ra одержанням сполуки формули І у вигляді вільної NH2 кислоти: Rb , (V) Ra в якій: Ra, Rb, n, X, R3, R4 і R є такими, як визначено для (CH2)n X COOH вихідних сполук; N в) циклізацію сполуки формули V, наприклад, шляхом взаємодії з ацетатом міді (II) у розчиннику Rb SO2 R3 R4 при температурі, близькій до температури кипіння Ar розчинника, протягом 4-24 годин з одержанням (Ib). сполуки індолу формули 11. Спосіб одержання сполуки за п. 1, який відрізRa няється тим, що проводять а) реакцію галогенування, переважно йодування, на аніліні формули (CH2)n X COOR N Ra Rb H R3 R4 , (X) NH2 Rb в якій: , (VIII) Ra, Rb, n, X, R3, R4 і R є такими, як визначено для в якій: вихідних сполук; Ra і Rb кожен незалежно означає атом водню, атом г) взаємодію наведеної вище сполуки формули (X) галогену або С1-С6алкільну групу, CF3, CN, CO-R2 з арилсульфонілхлоридом формули aбo OR2; і Ar-SO2-Cl, (VI) R2 означає С1-С4алкільну групу або CF3, або фенів якій: льну групу, необов'язково заміщену С 1Ar є ароматичним або гетероароматичним кільС4алкільною групою або CF3, цем, вибраним з групи, яку складають феніл, нафза допомогою галогенувального агента, наприклад тил, хінолініл, ізохінолініл, піридиніл, піразоліл, дихлорйодату бензилметиламонію, у розчиннику, імідазоліл, ізоксазоліл, тіазоліл, бензімідазоліл, такому як дихлорметан або метанол, при кімнатній бензотіазоліл, 2,1,3-бензотіадіазоліл, 3,4-дигідротемпературі протягом 5-24 годин з одержанням 1,4-бензоксазиніл, 5,6,7,8-тетрагідронафталініл, сполуки формули 1,2,3,4-тетрагідрохінолініл, 1,2,3,4I тетрагідроізохінолініл, 1,2,3,4-тетрагідро-2оксохінолініл, 3,4-дигідро-2Н-бензопіраніл, індоліл, Ra 2,3-дигідроіндоліл, бензофураніл, 2,3NH2 дигідробензофураніл, 1,3-бензодіоксоліл, 1,4Rb , (IX) бензодіоксаніл і бензоксазоліл, необов'язково зав якій: міщені одним чи кількома атомами або групами Ra і Rb є такими, як визначено для вихідних сполук; атомів, вибраних з атомів галогену і С1-С6алкілу, б) взаємодію сполуки формули IX з похідним ацефенілу, CF3, CN, CO-R2, SR2, OR2, NH-COR2, мортилену формули фолінілу, аміно і 4-морфоліносульфонілу, (CH2)n X COOR у розчиннику при кімнатній температурі протягом C C H 1-12 годин, зазвичай після активації сполук індолу формули (X) гідридом натрію, з одержанням споR3 R4 луки формули (Іа): , (III) Ra в якій: n=1, 2 або 3; R3 і R4 кожен незалежно означає атом водню або (CH2)n X COOR С1-С4алкільну групу; N R означає С1-С3алкільну групу; і Rb X означає одинарний зв'язок, атом кисню або атом SO2 R3 R4 сірки, Ar , (Ia) у присутності йодиду міді, каталізатора на основі в якій: паладію, наприклад тетраRa, Rb, n, X, R3, R4, R і Ar є такими, як визначено кіс(трифенілфосфін)паладію, і органічної основи у для вихідних сполук; і розчиннику, наприклад диметилформаміді (ДМФ), д) якщо необхідно, гідроліз естерної групи сполуки при температурі між 0 і 60°С протягом 2-24 годин з формули Іа, наприклад, шляхом взаємодії з неородержанням сполуки формули ганічною основою, такою як гідроксид натрію або гідроксид літію, після чого продукт обробляють кислотою з одержанням сполуки формули І у вигляді її вільної кислоти: 7 92025 8 в якій: n=1, 2 або 3; R3 і R4 кожен незалежно означає атом водню або (CH2)n X COOH С1-С4алкільну групу; N R означає С1-С3алкільну групу; і X означає одинарний зв'язок, атом кисню або атом Rb SO2 R3 R4 сірки, Ar у присутності йодиду міді, каталізатора на основі (Ib). паладію, наприклад тетра12. Спосіб одержання сполуки за п. 1, який відрізкіс(трифенілфосфін)паладію, і органічної основи у няється тим, що проводять розчиннику, наприклад диметилформаміді (ДМФ), а) взаємодію сполуки формули IX: при температурі між 0 і 60°С протягом 2-24 годин з I одержанням сполуки формули Ra (CH2)n X COOR NH2 Rb , (IX) R3 R4 Ra в якій: SO2 Ra i Rb кожен незалежно означає атом водню, N Ar Rb фтору, хлору чи брому або С1-С6алкільну групу, H CF3, CN, CO-R2 або OR2; і , R2 є С1-С4алкільною групою або групою CF3, або (VII) фенільною групою, необов'язково заміщеною С1в якій: С4алкільною групою або групою CF3, Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначено з арилсульфонілхлоридом формули для вихідних сполук; Ar-SO2-Cl, (VI) в) циклізацію наведеної вище сполуки формули в якій: VII, наприклад, шляхом взаємодії з ацетатом міді Ar є ароматичним або гетероароматичним кіль(II) у розчиннику при температурі, близькій до темцем, вибраним з групи, яку складають феніл, нафператури кипіння розчинника, протягом 4-24 годин тил, хінолініл, ізохінолініл, піридиніл, піразоліл, з одержанням сполуки індолу формули імідазоліл, ізоксазоліл, тіазоліл, бензімідазоліл, Ra бензотіазоліл, 2,1,3-бензотіадіазоліл, 3,4-дигідро1,4-бензоксазиніл, 5,6,7,8-тетрагідронафталініл, (CH2)n X COOR 1,2,3,4-тетрагідрохінолініл, 1,2,3,4N тетрагідроізохінолініл, 1,2,3,4-тетрагідро-2оксохінолініл, 3,4-дигідро-2Н-бензопіраніл, індоліл, Rb SO2 R3 R4 2,3-дигідроіндоліл, бензофураніл, 2,3Ar дигідробензофураніл, 1,3-бензодіоксоліл, 1,4, (Ia) бензодіоксаніл і бензоксазоліл, необов'язково зав якій: міщені одним чи кількома атомами або групами Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначено атомів, вибраними з атомів галогену і C1-C6алкілу, для вихідних сполук; і фенілу, CF3, CN, CO-R2, OR2, SR2, NH-COR2, морг) якщо необхідно, гідроліз естерної групи сполуки фолінілу, аміно і 4-морфоліносульфонілу, формули Іа, шляхом взаємодії з неорганічною осу розчиннику при кімнатній температурі протягом новою, такою як гідроксид натрію чи гідроксид лі1-12 годин з одержанням сполуки формули тію, після чого продукт обробляють кислотою з одержанням сполуки формули І у вигляді її вільної I кислоти: Ra Ra SO2Ar N H Rb , (XI) (CH2)n X COOH в якій: N Ra, Rb і Ar є такими, як визначено для вихідних Rb SO R R сполук; Ra б) взаємодію сполуки формули XI з похідним ацетилену формули (CH2)n X COOR C C H R3 R4 2 3 4 Ar . 13. Спосіб за п. 12 одержання сполуки за п. 1, який відрізняється тим, що дві стадії (б) і (в) здійснюють в одній операції. , (III) Представлений винахід відноситься до нових індольних сполук, способу їх одержання і їх застосування в терапії для попередження чи лікування патологічних станів, в які залучені порушення функції ядерних рецепторів типу PPAR (рецепторів активаторів проліферації пероксисом). 9 92025 10 Попередній рівень техніки запропоновані сполуки індолу, що діють на рецепУ терапії відомо, що захворювання серцевотори PPAR. судинної системи представляють важливий факІнші джерела інформації включають документор ризику для здоров'я. Ці захворювання часто є ти WO 02/071827 і Bioorg. Med. Chem. Lett., 14 (11) наслідком високого рівня холестерину та/або тристор. 2759-2763 (06/2004), де описані похідні, що гліцеридів, і, отже, важливо підтримувати ці рівні модулюють рецептори RXR, та їх застосування в нижче значень, прийнятих у даний час професійтерапії для лікування патологічних станів, залученою медициною. них у метаболічний синдром. У випадку холестерину особливо необхідно Крім того, різні сполуки індолу описані в попеоцінювати кількості холестерину, зв'язаного з різредньому рівні техніки в інших публікаціях. Таким ними ліпопротеїнами, з метою адаптації терапій чином: таким чином, щоб усувати холестерин, зв'язаний із - у документах WO 00/46196 і WO 99/07678 роЛПНГ (ліпопротеїнами низької густини). Відомі зкрито сполуки, утворені від індол-2-карбонової сімейства сполук, що застосовуються для регулякислоти, у зв'язку з їх протизапальною активністю; ції цих параметрів, включають статини, які є інгібі- у документі WO98/41092 описані похідні інторами HMG СоА-редуктази і дають можливість по дол-2-карбоксаміду, що впливають на біль. суті лікувати надлишково високі рівні холестерину Короткий опис винаходу ЛПНГ, і сполуки сімейства фібратів, які діють за Даний винахід відноситься до нових сполук, похідних індолу, що є активаторами PPAR і вибрадопомогою активації ядерних рецепторів PPAR ні із (що активуються проліфератором пероксисом реі) сполук формули цепторів альфа) і дають можливість знизити рівні тригліцеридів і холестерину. Дослідження ядерних рецепторів PPAR привело до ідентифікації трьох підтипів, відомих як PPAR , PPAR і PPAR . Ці різні рецептори шляхом зв'язування зі специфічними фрагментами ДНК регулюють експресію генів-мішеней, що кодують білки, залучені в механізми регуляції метаболізму ліпідів. У такий спосіб: - PPAR експресуються по суті в печінці і зав якій: лучаються в катаболізм жирних кислот за допомоRa і Rb кожен незалежно означає атом водню, гою регуляції - і -окислення; атом галогену, С1-С6 алкільну групу, CF3, CN, CO- PPAR експресуються повсюдно, але, в осR2 або OR2, або фенільну групу, необов'язково новному, присутні в нирках, хребетних м'язах, сезаміщену С1-С4 алкільною групою або групою CF3; рці і кишечнику. R2 означає С1-С4 алкільну або CF3 групу, або Подібно іншим рецепторам типу PPAR, PPAR фенільну групу, необов'язково заміщену С1-С4 алутворюють гетеродимер з RXR (рецептором ретикільною групою або групою CF3; ноїду X), і потім стають здатними до зв'язування з R3 і R4 кожен незалежно означає атом водню певними елементами генів-мішеней ядра і регуляабо С1-С4 алкільну групу; ції факторів транскрипції. Серед різних досліR означає атом водню або С1-С3 алкільну груджень, присвячених даному ядерному рецептору, пу; продемонстровано, наприклад, що активація n=1, 2 або 3; PPAR дає можливість підвищити рівень холестеX означає одинарний зв'язок, атом кисню або рину ЛПВГ у мишей db/db (FEBS Letters (2000), атом сірки; і 473, 333-336) і інсулінозалежних макак-резусів з Ar означає ароматичне або гетероароматичне ожирінням, а також сприяє виділенню холестерину кільце, вибране з групи, яку складають феніл, начерез Аро А1 у людських клітинах ТНР-1 (Рrос. фтил, хінолініл, ізохінолініл, піридиніл, піразоліл, Nat. Ac. Sci. USA (2001), 98, 5306-5311). імідазоліл, ізоксазоліл, тіазоліл, бензімідазоліл, У результаті дослідження цих різних ядерних бензотіазоліл, 2,1,3-бензотіадіазоліл, 3,4-дигідрорецепторів виявилося, що сполуки, які здатні до 1,4-бензоксазиніл, 5,6,7,8-тетрагідронафталініл, активації або рецепторів PPAR , або рецепторів 1,2,3,4-тетрагідрохінолініл, 1,2,3,4PPAR , або обох цих рецепторів одночасно, мотетрагідроізохінолініл, 1,2,3,4-тетрагідро-2жуть мати вкрай сприятливий фармакологічний оксоххінолініл, 3,4-дигідро-2Н-бензопіраніл, індопрофіль для лікування патологічних станів, таких ліл, 2,3-дигідроіндоліл, бензофураніл, 2,3як гіперліпідемія, гіперхолестеринемія і різних задигідробензофураніл, 1,3-бензодіоксоліл, 1,4хворювань серцево-судинної системи, які є наслідбензодіоксаніл і бензоксазоліл, необов'язково заком метаболічного синдрому. міщені одним чи кількома атомами або групами Відомі документи попереднього рівня техніки, атомів, вибраних з атомів галогену і С1-С6 алкільв яких згадуються такі сполуки, включають, наприної групи, фенільної групи, CF3, CN, CO-R2, OR2, клад, документ WO 97/28149, в якому описані агоSR2, NH-COR2, морфолінілу, аміно і 4ністи рецепторів PPAR , документ WO 01/60807, в морфоліносульфонілу; і якому описані агоністи рецепторів PPAR , або іі) їх фармацевтично прийнятних солей. документи WO 05/009958 і WO 06/060535, в яких 11 92025 12 Кращими сполуками згідно з винаходом є споабо 1,1-диметилбутил, або циклічною групою залуки формули (І), наведеної вище, в якій виконано гальної формули Сn2n-1, такою як циклопропіл, одна або декілька з наведених нижче умов: циклобутил, циклопентил, циклогексил або цикло- щонайменше один з Ra і Rb є відмінним від пентилметил. Під галогеном розуміють атом фтоатома водню; ру, хлору, брому або йоду, де перевага надається -Ar являє собою феніл або азотмістку гетерофтору і хлору. ароматичну групу, вибрану з групи, яка включає Сполуки формули (І), в якій R означає атом хінолініл, ізохінолініл, піридиніл, піразоліл, імідаводню, є карбоновими кислотами, які можна викозоліл, ізоксазоліл, тіазоліл, бензімідазоліл, бензористовувати у формі вільних кислот або у формі тіазоліл, 2,1,3-бензотіадіазоліл, 1,2,3,4солей, де зазначені солі одержують шляхом об'єдтетрагідрохінолініл, 1,2,3,4-тетрагідроізохінолініл, нання кислоти з фармацевтично-прийнятною не1,2,3,4-тетрагідро-2-оксохінолініл, індоліл, 2,3токсичною неорганічною чи органічною основою. дигідроіндоліл і бензоксазоліл, необов'язково заПрикладами неорганічних основ, які можна викоміщені одним чи кількома атомами або групами ристовувати, є гідроксиди натрію, калію, магнію атомів, вибраних з атомів галогену і С1-С6 алкільабо кальцію. Прикладами органічних основ, які ної групи, CF3, CN, CO-R2, OR2, SR2, NH-COR2, можна використовувати, є аміни, аміноспирти, осморфолінілу, аміно і 4-морфоліносульфонілу; і новні амінокислоти, такі як лізин чи аргінін, або n дорівнює 1 або 2. сполуки, які несуть функціональну групу четверПерше конкретне сімейство сполук згідно з тинного амонію, наприклад, бетаїн або холін. винаходом складається із сполук формули (І), в Сполуки формули (І), в якій замісники R3 і R4 є якій X є атомом кисню, і їх фармацевтичнорізними, мають центр асиметрії. У випадку таких прийнятних солей. сполук винахід охоплює як рацемічні сполуки, так і Друге конкретне сімейство сполук згідно з викожний з оптичних ізомерів, розглянутий окремо. находом складається із сполук формули (І), в якій Переважними сполуками згідно з винаходом є X є одинарним зв'язком і щонайменше один з R3 і ті сполуки, в яких Ar є фенільною групою або азоR4 є С1-С4 алкільною групою, і їх фармацевтичнотмістким гетероциклом. Іншими переважними споприйнятних солей. луками є ті сполуки, в яких Ra є атомом галогену Третє конкретне сімейство сполук згідно з виабо трифторметильною групою, а також ті, в яких находом складається із сполук формули (І), в якій n дорівнює 1 або 2. X є одинарним зв'язком, a R3 і R4 є атомом водню, Сполуки згідно з винаходом можуть бути і їх фармацевтично-прийнятних солей. отримані першим способом, який включає Відповідно до другого аспекту винахід стосуа) використання реакції Соногашири (див., нається вищезгаданих сполук для їх застосування як приклад, Tet. Lett., 1975, 4467) для взаємодії спофармакологічно-активних речовин і до фармацевлуки формули тичних композицій, в яких вони присутні. Винахід додатково відноситься до застосування щонайменше одної сполуки формули (І) або однієї з її фармацевтично-прийнятних солей як активної речовини для виготовлення лікарського засобу, призначеного для застосування в терапії, зокрема, для боротьби з гіперхолестеринемією, гіперліпідемією, гіпертригліцеридемією, дисліпідев якій: мією, інсулінорезистентністю, діабетом або ожиRa і Rb кожен незалежно є атомом водню, рінням, а також із серцево-судинними захворюфтору, хлору або брому або С1-С6 алкільною груваннями, які є наслідком дисбалансу сироваткових пою, CF3, CN, CO-R2 або OR2; і ліпопротеїнів. Сполуки згідно з винаходом також R2 є С1-С4 алкільною групою або групою CF3, корисні як активні речовини лікарських засобів, або фенільною групою, необов'язково заміщеною призначених для попередження або лікування заС1-С4 алкільною групою або групою, хворювань, зумовлених дисфункцією ендотелія, с похідним ацетилену формули атеросклерозу, інфаркту міокарда, гіпертензії, проблем судин головного мозку, деяких запальних захворювань, наприклад, ревматоїдного артриту, і нейродегенеративних захворювань, таких як, зокрема, хвороба Альцгеймера або хвороба Паркінсона. Докладний опис винаходу в якій: У представленому описі під С1-Сn алкільною n=1, 2 або 3; групою (де n є цілим числом) розуміють нормальR3 і R4 кожен незалежно є атомом водню або ний, розгалужений або циклічний вуглеводневий С1-С4 алкільною групою; ланцюг, що містить від 1 до n атомів вуглецю. Як R є С1-С3 алкільною групою; і приклад, і без обмеження, С1-С6 алкільна група X є одинарним зв'язком, атомом кисню або може бути нормальною або розгалуженою групою атомом сірки, загальної формули Сn2n+1, такою як метил, етил, у присутності йодиду міді, каталізатора на оспропіл, бутил, пентил, гексил, 1-метилетил, 1нові паладію, наприклад, тетраметилпропіл, 2-метилпропіл, 1,1-диметилетил, 1кіс(трифенілфосфін)палладію, і органічної основи, метилбутил, 1,1-диметилпропіл, 1-метилпентил 13 92025 14 наприклад, триетиламіну, у розчиннику, наприклад, диметилформаміді (ДМФ), при температурі в якій: між 0 і 60°С, протягом 2-24 годин, з одержанням Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначесполуки формули но для вихідних сполук; г) циклізацію сполуки формули VII, наприклад, шляхом взаємодії з ацетатом міді (II) (див., наприклад, J. Org. Chem., 2004, 69 (4), 1126-1136) у розчиннику, такому як 1,2-дихлоретан, при температурі, близької до температури кипіння розчинника, протягом 4-24 годин з одержанням сполуки формули в якій: Ra, Rb, n, X, R3, R4 і R є такими, як визначено для вихідних сполук; б) відновлення нітрогрупи, яку несе наведена вище сполука формули IV, наприклад, шляхом взаємодії з хлоридом олова в присутності етанолу, у розчиннику, наприклад, в етилацетаті, при температурі, близькій до кімнатної температури, протягом 1-24 годин, з одержанням аніліну формули в якій: Ra, Rb, n, X, R3, R4 i R є такими, як визначено для вихідних сполук; в) взаємодію сполуки формули V з арилсульфонілхлоридом формули в якій: Ar означає ароматичне або гетероароматическое кільце, вибране з групи, яку складають феніл, нафтил, хінолініл, ізохінолініл, піридиніл, піразоліл, імідазоліл, ізоксазоліл, тіазоліл, бензімідазоліл, бензотіазоліл, 2,1,3-бензотіадіазоліл, 3,4-дигідро1,4-бензоксазиніл, 5,6,7,8-тетрагідронафталініл, 1,2,3,4-тетрагідрохінолініл, 1,2,3,4тетрагідроізохінолініл, 1,2,3,4-тетрагідро-2оксохінолініл, 3,4-дигідро-2Н-бензопіраніл, індоліл, 2,3-дигідроіндоліл, бензофураніл, 2,3дигідробензофураніл, 1,3-бензодіоксоліл, 1,4бензодіоксаніл і бензоксазоліл, необов'язково заміщені одним або кількома атомами або групами атомів, вибраних з атомів галогену і С1-С6 алкілу, фенілу, CF3, CN, CO-R2, SR2, OR2, NH-COR2, морфолінілу, аміно і 4-морфоліносульфонілу, у присутності піридину при кімнатній температурі протягом 10-120 хвилин з одержанням сполуки формули в якій: Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначено для вихідних сполук; і д) якщо необхідно, гідроліз естерної групи сполуки формули Іа, наприклад, шляхом взаємодії з неорганічною основою, такою як гідроксид натрію або гідроксид літію, з використанням методик, добре відомих фахівцям у даній області техніки, після чого продукт обробляють кислотою з одержанням сполуки формули І у формі її вільної кислоти: У першому варіанті способу одержання сполуки формули І можуть бути отримані шляхом послідовності реакцій, яка включає а) проведення реакції галогенування, переважно йодування, на аніліні формули в якій: Ra і Rb кожен незалежно означає атом водню, атом галогену або С1-С6 алкільну групу, CF3, CN, CO-R2 або OR2; і R2 означає С1-С4 алкільну групу або CF3, або фенільну групу, необов'язково заміщену С1-С4 алкільною групою або CF3, за допомогою галогенувального агента, наприклад, дихлорйодату бензилметиламонію, у розчиннику, такому як дихлорметан або метанол, при кімнатній температурі протягом 5-24 годин з одержанням сполуки формули 15 92025 16 1,2,3,4-тетрагідрохінолініл, 1,2,3,4тетрагідроізохінолініл, 1,2,3,4-тетрагідро-2оксохінолініл, 3,4-дигідро-2Н-бензопіраніл, індоліл, 2,3-дигідроіндоліл, бензофураніл, 2,3дигідробензофураніл, 1,3-бензодіоксоліл, 1,4бензодіоксаніл і бензоксазоліл, необов'язково заміщені одним чи кількома атомами або групами в якій: атомів, вибраних з атомів галогену і С1-С6 алкілу, Ra і Rb є такими, як визначено для вихідних фенілу, CF3, CN, CO-R2, SR2, OR2, NH-COR2, морсполук; фолінілу, аміно і 4-морфоліносульфонілу, б) взаємодію сполуки формули IX з похідним у розчиннику, наприклад, у диметилформаміді, ацетилену формули при кімнатній температурі протягом 1-12 годин, зазвичай після активації сполук індолу формули (X) гідридом натрію, з одержанням сполуки формули(Іа): в якій: n=1, 2 або 3; R3 і R4 кожен незалежно означає атом водню або С1-С4 алкільну групу; R означає С1-С3 алкільну групу; і X означає одинарний зв'язок, атом кисню або атом сірки, в умовах, аналогічних описаним для стадії (а) вищеописаного загального способу, з одержанням сполуки формули в якій: Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначено для вихідних сполук; і д) якщо необхідно, гідроліз естерної групи сполуки формули Іа, наприклад, шляхом взаємодії з неорганічною основою, такою як гідроксид натрію або гідроксид літію, з використанням методик, добре відомих фахівцям у даній галузі, після чого продукт обробляють кислотою з одержанням сполуки формули І у формі її вільної кислоти: в якій: Ra, Rb, n, X, R3, R4 і R є такими, як визначено для вихідних сполук; в) циклізацію наведеної вище сполуки формули V в умовах, аналогічних описаним для проведення стадії (г) вищеописаного загального способу, з одержанням сполуки індолу формули В другому варіанті способу одержання сполуки формули І можуть бути отримані шляхом серії реакцій, що включають а) взаємодію сполуки формули IX: в якій: Ra, Rb, n, X, R3, R4 i R є такими, як визначено для вихідних сполук; г) взаємодію наведеної вище сполуки формули (X) з арилсульфонілхлоридом формули в якій: Ar є ароматичним або гетероароматичним кільцем, вибраним з групи, яку складають феніл, нафтил, хінолініл, ізохінолініл, піридиніл, піразоліл, імідазоліл, ізоксазоліл, тіазоліл, бензімідазоліл, бензотіазоліл, 2,1,3-бензотіадіазоліл, 3,4-дигідро1,4-бензоксазиніл, 5,6,7,8-тетрагідронафталініл, в якій: Ra i Rb кожен незалежно означає атом водню, фтору, хлору чи брому або С1-С6 алкільну групу, CF3, CN, CO-R2 або OR2; і R2 є С1-С4 алкільною групою або групою CF3, або фенільною групою, необов'язково заміщеною С1-С4 алкільною групою або групою CF3, з арилсульфонілхлоридом формули 17 в якій: Ar є ароматичним або гетероароматичним кільцем, вибраним з групи, яку складають феніл, нафтил, хінолініл, ізохінолініл, піридиніл, піразоліл, імідазоліл, ізоксазоліл, тіазоліл, бензімідазоліл, бензотіазоліл, 2,1,3-бензотіадіазоліл, 3,4-дигідро1,4-бензоксазиніл, 5,6,7,8-тетрагідронафталініл, 1,2,3,4-тетрагідрохінолініл, 1,2,3,4тетрагідроізохінолініл, 1,2,3,4-тетрагідро-2оксохінолініл, 3,4-дигідро-2Н-бензопіраніл, індоліл, 2,3-дигідроіндоліл, бензофураніл, 2,3дигідробензофураніл, 1,3-бензодіоксоліл, 1,4бензодіоксаніл і бензоксазоліл, необов'язково заміщені одним чи кількома атомами або групами атомів, вибраних з атомів галогену і С1-С6 алкілу, фенілу, CF3, CN, CO-R2, OR2, SR2, NH-COR2, морфолінілу, аміно і 4-морфоліносульфонілу, у розчиннику, наприклад, у диметилформаміді, при кімнатній температурі протягом 1-12 годин з одержанням сполуки формули в якій: Ra, Rb і Ar є такими, як визначено для вихідних сполук; б) взаємодію сполуки формули XI з похідним ацетилену формули в якій: n=1, 2 або 3; R3 і R4 кожен незалежно означає атом водню або С1-С4 алкільну групу; R означає С1-С3 алкільну групу; і X означає одинарний зв'язок, атом кисню або атом сірки, в умовах, аналогічних описаним для стадії (а) вищеописаного загального способу, з одержанням сполуки формули в якій: Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначено для вихідних сполук; в) циклізацію наведеної вище сполуки формули VII в умовах, аналогічних описаним для проведення стадії (г) вищеописаного загального способу, з одержанням сполуки індолу формули 92025 18 в якій: Ra, Rb, n, X, R3, R4, R і Ar є такими, як визначено для вихідних сполук; і г) якщо необхідно, гідроліз естерної групи сполуки формули Іа, наприклад, шляхом взаємодії з неорганічною основою, такою як гідроксид натрію чи гідроксид літію, з використанням методик, добре відомих фахівцям у даній галузі, після чого продукт обробляють кислотою з одержанням сполуки формули І у формі її вільної кислоти: У даному останньому способі можливе проведення двох стадій (б) і (в) в одній операції. Сполуки формули І згідно з винаходом, в яких Ra (даний спосіб також застосовується до Rb) означає необов'язково заміщене фенільне кільце, можуть бути отримані з галогенованої сполуки формули в якій: Ra означає атом галогену, переважно атом брому, Rb означає атом водню, атом фтору чи хлору або С1-С6 алкільну групу, CF3, CN, CO-R2 або OR2; R2 означає С1-С4 алкільну групу або групу CF3, або фенільну групу, необов'язково заміщену С1-С4 алкільною групою або групою CF3; R3 і R4 кожен незалежно означає атом водню або С1-С4 алкільну групу; R означає С1-С3 алкільну групу; n=1, 2 чи 3; X означає одинарний зв'язок, атом кисню або атом сірки; і Ar є ароматичним або гетероароматичним кільцем, вибраним з групи, яку складають феніл, нафтил, хінолініл, ізохінолініл, піридиніл, піразоліл, імідазоліл, ізоксазоліл, тіазоліл, бензімідазоліл, бензотіазоліл, 2,1,3-бензотіадіазоліл, 3,4-дигідро1,4-бензоксазиніл, 5,6,7,8-тетрагідронафталініл, 1,2,3,4-тетрагідрохінолініл, 1,2,3,4тетрагідроізохінолініл, 1,2,3,4-тетрагідро-2 19 92025 20 оксохінолініл, 3,4-дигідро-2Н-бензопіраніл, індоліл, мілімоль. Температури плавлення вимірюють на 2,3-дигідроіндоліл, бензофураніл, 2,3установці Köfler, або з використанням апарата дигідробензофураніл, 1,3-бензодіоксоліл, 1,4Mettler, а спектральні значення ядерно-магнітного бензодіоксаніл і бензоксазоліл, необов'язково зарезонансу характеризуються хімічним зсувом, обміщені одним чи кількома атомами або групами численим відносно ТМС (тетраметилсилану), чисатомів, вибраних з атомів хлору і фтору і С1-С6 лом протонів, пов'язаних із сигналом, і формою алкілу, фенілу, CF3, CN, CO-R2, OR2, SR2, NHсигналу (с - для синглета, д - для дублета, дд - для COR2, морфолінілу, аміно і 4подвійного дублета, т - для триплету, к - для кварморфоліносульфонілу, тету, квінт. - для квінтету і м - для мультиплету). з фенілбороновою кислотою формули Робоча частота і використовуваний розчинник зазначені для кожної сполуки. Кімнатна температура складає 20°С±5°С. У деяких випадках структуру сполук підтверджували мас-спектроскопією (МС) з наступною рідинною хроматографією (РХ) (сполучення РХ/МС); вимірювання здійснювали на колонці Uptisphere HDO з фазою HDO (стовпчик: 50 x 2 в якій: мм x 3 мкм), швидкість протікання: 0,6 мл/хв (розRx означає атом водню або С1-С4 алкільну щеплення: 1/3), рухлива фаза: А=Н2О+0,5% ТФО групу або групу CF3, відповідно до реакції Сузуки (трифтороцтова кислота), В=ацетонитрил+0,5% (див., наприклад, Chem. Rev., 1995, 95, 2457) у ТФО (програмування градієнта: В=10-90% за 7 хв, присутності тетракіс(трифенілфосфін)палладію і потім плато при 90% протягом 2 хв, потім повероснови, наприклад, карбонату натрію, у розчиннинення до 10% за 1 хв і стабілізація при 10% протяку, наприклад, у суміші тетрагідрофурану, метаногом 3 хв); робоча температура: 45°С; УФ виявленлу і води, при температурі між 30°С і температуня: від 210 до 260 нм. Мас-спектр одержували за рою кипіння розчинника, протягом 5-24 годин з допомогою ESI+, розпилення: 3500 В, температура одержанням сполуки формули Id: блоку джерела: 130°С, десольватація: 230°С, газ десольватації: 600 л/год., газ дифузора: 100 л/год., напруга: 10 В/30 В/60 В. Результат виражали у масі (m/z) і часу утримування (Tr). Підготовчий приклад 1 Метиловий естер 5-(5-хлор-2-нітрофеніл)-4пентинової кислоти Змішують 35,5 г (125 мМ) 4-хлор-2-йод-1нітробензолу, 510 мл триетиламіну, 2,88 г (2,5 мМ) тетракіс(трифенілфосфін)паладію, 0,72 г йодиду міді і 50 мл диметилформаміду (ДМФ). Потім при кімнатній температурі, при перемішуванні додають 14 г (125 мМ) метилового естеру 4-пентинової кисв якій: лоти, і реакційну суміш перемішують протягом 24 R, Rb, Rx, X, R3, R4, n і Ar є такими, як визначегодин при кімнатній температурі. Додають 100 мл но для вихідних сполук. толуолу і розчинники видаляють при зниженому Сполуки згідно з винаходом у формі солей китиску. Залишок після випарювання переносять в слоти формули Іb з неорганічною чи органічною 150 мл етилацетату і 80 мл N соляної кислоти. основою можуть бути отримані загальноприйнятим Органічну фазу відокремлюють, промивають вошляхом, використовуючи способи, що добре відодою і потім сушать над сульфатом магнію і концемі фахівцям у даній галузі, наприклад, шляхом нтрують при зниженому тиску. Отримане масло змішування стехіометричних кількостей кислоти і коричневого кольору очищають хроматографією основи в розчиннику, наприклад, у воді або у водна силікагелі, використовуючи як елюент суміш но-спиртовій суміші, а потім ліофілізації отриманоциклогексан/етилацетат (9/1; об./об.), з одержанго розчину. ням 21,5 г очікуваного продукту у вигляді твердої На деяких із стадій вищеописаних реакцій перечовини жовтого кольору (вихід=65%). реважно можлива заміна традиційних методів наТ.пл.=75-78°С. грівання мікрохвильовим нагріванням з викорисПідготовчий приклад 2 танням реакторів, пристосованих до даного виду Метиловий естер 5-(2-аміно-5-хлорфеніл)-4реакції. В даному випадку фахівцеві в даній облапентинової кислоти сті техніки повинно бути зрозуміло, що час "нагріВносять в круглодонну колбу 90,6 г (400 мМ) вання" значно менше в порівнянні з часом, необхлориду олова, 70 мл етилацетату і 22 мл етанохідним для стандартного нагрівання. лу. Цю суміш перемішують протягом 15 хвилин Наведені нижче Приклади одержання сполук при кімнатній температурі і повільно додають розформули (І) забезпечують краще розуміння виначин 21,5 г (80 мМ) сполуки, отриманої згідно з Підходу. готовчим прикладом 1. Реакційну суміш переміУ даних прикладах, що не обмежують обсяг шують протягом 24 годин при кімнатній винаходу, терміном "Підготовчі приклади" познатемпературі і потім виливають в суміш 200 г льоду чають приклади, в яких описаний синтез проміжі 200 мл N розчину гідроксиду натрію. Отриману них сполук, а термін "Приклади" представляє присуміш екстрагують двічі з використанням 200 мл клади, в яких описаний синтез сполук формули (І) етилацетату; об'єднані органічні фази промивають згідно з винаходом. Серед скорочень "мМ" означає 21 92025 22 водою, сушать над сульфатом магнію і конценткімнатній температурі і потім частково концентрурують при зниженому тиску. Отримане масло ють при зниженому тиску. Потім розчин, що залиочищають хроматографією на силікагелі, викорисшився, фільтрують і ліофілізують з одержанням товуючи як елюент суміш циклогексан/етилацетат 115 мг очікуваної солі у вигляді тонкодисперсного (80/20; об./об.), з одержанням 9,1 г очікуваної спобілого порошку (вихід=95%). луки у вигляді твердої речовини оранжевого коТ.пл. 250°С. льору (вихід=30%). Підготовчий приклад 4 Т.пл.=67°С. 2-Йод-4-(трифторметил)анілін Підготовчий приклад 3 Готують розчин 5 г (31 мМ) 4Метиловий естер [5-хлор-2(трифторметил)аніліну в 90 мл метанолу і 30 мл (фенілсульфоніламіно)феніл]-4-пентинової кислодихлорметану і додають 3,56 г (35,6 мМ) карбонати ту кальцію. Потім додають частинами 14,9 г (42,7 Готують розчин 1,2 г (5 мМ) сполуки, отримамМ) дихлорйодиду триметилбензиламонію при ної згідно з Підготовчим прикладом 2, в 15 мл пікімнатній температурі, з перемішуванням. Реакридину і додають 0,77 мл (6 мМ) бензолсульфоніційне середовище перемішують протягом 24 годин лхлориду. Суміш перемішують протягом 1 години при кімнатній температурі і потім фільтрують для при кімнатній температурі і потім концентрують видалення мінеральних солей. Фільтрат концентпри зниженому тиску. Маслоподібний залишок рують при зниженому тиску і сирий продукт очиочищають хроматографією на силікагелі, викорисщають хроматографією на силікагелі, використотовуючи як елюент суміш циклогексан/етилацетат вуючи як елюент суміш циклогексан/етилацетат (8/2; об./об.), з одержанням 1,8 г очікуваної сполу(8/2; об./об.), з одержанням 6,65 г очікуваної споки у вигляді твердої речовини бежевого кольору луки у вигляді масла оранжвого кольору (ви(вихід=95%). хід=75%). 1 1 Н ЯМР (ДМСОd6, 300 МГц) : = 2,56 (с, 4Н), Н ЯМР (CDCI3, 300 МГц) : = 5,0 (с, 2Н), 6,82 3,65 (с, 3H), 7,28-7,36 (м, 3H), 7,54-7,72 (м, 5Н), (д, J=5,5 Гц, 1Н), 7,38 (дд, J=5,5 Гц, 1,3 Гц, 1Н), 9,69 (с, 1Н). 7,79 (д, J=1,3 Гц, 1Н). Приклад 1 Підготовчий приклад 5 Метиловий естер 5-хлор-1-(фенілсульфоніл)Метиловий естер 5-[2-аміно-51Н-індол-2-пропанової кислоти (трифторметил)феніл]-4-пентинової кислоти Готують розчин 300 мг (0,79 мМ) естеру, отриГотують розчин 1,5 г (5,23 мМ) сполуки, отриманого згідно з Підготовчим прикладом 3, в 35 мл маної згідно з Підготовчим прикладом 4, 0,644 г 1,2-дихлоретану, додають 15 мг (0,08 мМ) ацетату (5,75 мМ) метил 4-пентиноату і 90 мг (0,13 мМ) міді (II) і суміш кип'ятять протягом 24 годин, передихлорбіс(трифенілфосфін)паладію в 1 мл димемішуючи. Потім розчинник видаляють при знижетилформаміду і 2 мл діетиламіну і додають 50 мг ному тиску і залишкову в'язку тверду речовину (0,26 мМ) йодиду міді. Реакційну суміш опромінюочищають хроматографією на силікагелі, викорисють в мікрохвильовій печі при 120°С протягом 10 товуючи як елюент суміш толуол/етилацетат (9/1; хвилин. Потім розчинники видаляють при знижеоб./об.), з одержанням 230 мг сполуки, отриманої у ному тиску, і залишок після випарювання очищавигляді твердої речовини жовтого кольору (виють хроматографією на силікагелі, використовуюхід=77%). чи як елюент суміш циклогексан/етилацетат (8/2; Т.пл.=93-96°С. об./об.), з одержанням 1,16 г очікуваної сполуки у Приклад 2 вигляді масла оранжевого кольору (вихід=82%). 1 5-Хлор-1-(фенілсульфоніл)-1H-індол-2Н ЯМР (ДМСОd6, 300 МГц) : = 2,65-2,75 (м, пропанова кислота 4Н), 3,64 (с, 3H), 5,99 (с, 2Н), 6,78 (д, J=8,3 Гц, 1Н), 180 мг (0,46 мМ) Естеру, отриманого згідно з 7,31 (д, J=8,3 Гц, 1Н), 7,33 (с, 1Н). Прикладом 1, змішують з 16 мл ТГФ і 4 мл води, і Підготовчий приклад 6 додають 20 мг (0,48 мМ) гідроксиду літію Метиловий естер 5-(трифторметил)-1Н-індол(LiOH·1Н2О). Суміш перемішують протягом 3 годин 2-пропанової кислоти при кімнатній температурі і потім концентрують Готують розчин 1,16 г (4,28 мМ) естеру, отрипри зниженому тиску. Залишок після випарювання маного згідно з Підготовчим прикладом 5, в 5 мл переносять в 10 мл води і розчин підкислюють за 1,2-дихлоретану і додають 1,3 г (6,4 мМ) ацетату допомогою 1 N розчину соляної кислоти. Осад міді. Реакційну суміш опромінюють в мікрохвильобілого кольору екстрагують етилацетатом й оргавій печі при 150°С протягом 30 хвилин і потім охонічну фазу відокремлюють, сушать над сульфатом лоджують і фільтрують. Фільтрат концентрують магнію і концентрують при зниженому тиску з одепри зниженому тиску з одержанням 1 г очікуваної ржанням 160 мг очікуваного продукту у вигляді сполуки у вигляді твердої речовини коричневого твердої речовини жовтого кольору (вихід=93%). кольору (вихід=86%). Т.пл.=165-168°С. Т.пл.=106-108°С. Приклад 2а Приклад 3 Натрієва сіль 5-хлор-1-(фенілсульфоніл)-1НМетиловий естер 1-(фенілсульфоніл)-5індол-2-пропанової кислоти (трифторметил)-1H-індол-2-пропанової кислоти 114 мг (0,313 мМ) Кислоти, отриманої згідно з 0,18 г (4,6 мМ) Гідриду натрію (60% дисперсія Прикладом 2, змішують з 10 мл води і 0,313 мл N в маслі) додають при 0°С до розчину 1 г (3,69 мМ) розчину гідроксиду натрію. Додають при переміестеру, отриманого згідно з Підготовчим приклашуванні кілька крапель метанолу, отримуючи роздом 6. Цю суміш перемішують протягом 15 хвилин чин. Суміш перемішують протягом 15 хвилин при і додають 0,98 г (5,5 мМ) бензолсульфонілхлориду 23 92025 24 при 0°С. Суміш перемішують протягом 30 хвилин Готують розчин 0,5 г (1,18 мМ) естеру, отрипри кімнатній температурі і потім додають 100 мл маного згідно з Прикладом 5, і 0,68 г (0,59 мМ) 15% водного розчину хлориду амонію. Суміш екстетракіс(трифенілфосфін)паладію в 5 мл ТГФ і трагують 3 рази з використанням 50 мл дихлормедодають розчин 0,84 г (4,4 мМ) 4тану. Об'єднані органічні фази сушать над суль(трифторметил)фенілборної кислоти в 2,5 мл мефатом магнію і концентрують при зниженому танолу, після чого додають розчин 282 мг (2,6 мМ) тиску. Маслоподібний залишок очищають хромакарбонату натрію в 1 мл води. Потім суміш перетографією на силікагелі, використовуючи як елюмішують при температурі кипіння розчинника проент суміш циклогексан/етилацетат (8/2; об./об.), з тягом 24 годин. Після охолодження до кімнатної одержанням 0,95 г очікуваного продукту у вигляді температури суміш розбавляють 20 мл дихлормемасла, яке кристалізується в зірочки оранжевого тану і сушать над сульфатом магнію. Отриманий кольору (вихід=62%). розчин концентрують при зниженому тиску, і заТ.пл.=81-83°С. лишок після випарювання переносять в 50 мл етиПриклад 4 лового етеру. Отриманий розчин промивають 3 1-(Фенілсульфоніл)-5-(трифторметил)-1Hрази з використанням 15 мл 1 N розчину гідроксиіндол-2-пропанова кислота ду натрію і потім водою до нейтральної реакції Використовуючи методику, подібну до методипромивних вод, сушать над сульфатом магнію і ки Прикладу 2, та як вихідну сполуку - сполуку, концентрують при зниженому тиску. Маслоподіботриману згідно з Прикладом 3, очікуваний проний залишок очищають хроматографією на силікадукт отримують у вигляді твердої речовини бежегелі, використовуючи як елюент суміш циклогеквого кольору (вихід=85%). сан/етилацетат (85/15; об./об.), з одержанням 57 Т.пл.=170-172°С. мг очікуваної сполуки у вигляді масла бежевого Підготовчий приклад 7 кольору (вихід=10%). 1 Метиловий естер 5-(2-аміно-5-бромофеніл)-4Н ЯМР (ДМСОd6, 250 МГц) : = 2,84 (т, J=7,1 пентинової кислоти Гц, 2Н), 3,32 (д, J=7,2 Гц, 2Н), 3,62 (с, 3H), 6,68 (с, Використовуючи методику, подібну до методи1Н), 7,56-7,71 (м, 5Н), 7,78-7,91 (м, 6Н), 8,13 (д, ки Підготовчого прикладу 5, та як вихідну сполуку 1Н). 4-бром-2-йоданілін, очікувану сполуку отримують у Приклад 8 вигляді масла жовтого кольору (вихід=23%). 1-(Фенілсульфоніл)-5-[41 Н ЯМР (ДМСОd6, 250 МГц) : = 2,61-2,74 (м, (трифторметил)феніл]-1H-індол-2-пропанова кис4Н), 3,63 (с, 3H), 5,46 (с, 2Н), 6,63 (дд, J=8,3 Гц, 0,7 лота Гц, 1Н), 7,1-7,2 (м, 2Н). Використовуючи методику, подібну до методиПідготовчий приклад 8 ки Прикладу 2, та як вихідну сполуку - сполуку, Метиловий естер 5-бром-1Н-індол-2отриману згідно з Прикладом 7, очікуваний пропропанової кислоти дукт отримують у вигляді твердої речовини жовтоВикористовуючи методику, подібну до методиго кольору (вихід=76%). ки Підготовчого прикладу 6, та як вихідну сполуку Т.пл.=162°С. сполуку, отриману згідно з Підготовчим прикладом Підготовчий приклад 9 7, очікувану сполуку отримують у вигляді твердої Метиловий естер 5-(2-нітрофеніл)-4речовини коричневого кольору (вихід=98%). пентинової кислоти 1 Використовуючи методику, подібну до методиН ЯМР (ДМСОd6, 250 МГц) : = 2,75 (т, J=7,3 ки Підготовчого прикладу 1, та як вихідну сполуку Гц, 2H), 2,98 (т, J=7,2 Гц, 2Н), 3,60 (с, 3H), 6,14 (с, 1-йод-2-нітробензол, очікуваний продукт отриму1Н), 7,1 (дд, J=8,5 Гц, 1,9 Гц, 1Н), 7,2 (д, J=8,5 Гц, ють у вигляді твердої речовини жовтого кольору 1Н), 7,58 (д, J=1,9 Гц, 1Н), 11,1 (с, 1Н). (вихід=53%). Приклад 5 Т.пл.=44-46°С. Метиловий естер 5-бром-1-(фенілсульфоніл)Підготовчий приклад 10 1Н-індол-2-пропанової кислоти Метиловий естер 6-(5-хлор-2-нітрофеніл)-5Використовуючи методику, подібну до методигексинової кислоти ки Прикладу 3, та як вихідну сполуку - сполуку, Використовуючи методику, подібну до методиотриману згідно з Підготовчимприкладом 8, очікуки Підготовчого прикладу 1, та як вихідну сполуку вану сполуку отримують у вигляді твердої речовиметиловий естер 5-гексинової кислоти, очікуваний ни світло-коричневого кольору (вихід=25%). продукт отримують у вигляді масла коричневого Т.пл.=109-113°С. кольору (вихід=73%). Приклад 6 1 5-Бром-1-(фенілсульфоніл)-1H-індол-2Н ЯМР (ДМСОd6, 250 МГц) : = 1,81 (м, 2Н), пропанова кислота 2,54 (м, 4Н), 3,60 (с, 3H), 7,69 (дд, 1Н), 7,81 (д, 1Н), Використовуючи методику, подібну до методи8,09 (д, 1Н). ки Прикладу 2, та як вихідну сполуку - сполуку, Підготовчий приклад 11 отриману згідно з Прикладом 5, очікувану сполуку Метиловий естер 7-(5-хлор-2-нітрофеніл)-6отримують у вигляді твердої речовини бежевого гептинової кислоти кольору (вихід=81%). Використовуючи методику, подібну до методиТ.пл.=188-190°С. ки Підготовчого прикладу 1, та як вихідну сполуку Приклад 7 метиловий естер 6-гептинової кислоти, очікуваний Метиловий естер 1-(фенілсульфоніл)-5-[4продукт отримують у вигляді масла коричневого (трифторметил)феніл]-1H-індол-2-пропанової кискольору (вихід=98%). лоти 25 92025 26 Метиловий естер 5-[2-аміно-4Н ЯМР (ДМСОd6, 250 МГц) : = 1,34-1,73 (м, (трифторметил)феніл]-4-пентинової кислоти 4Н), 2,36 (т, 2Η), 2,53 (т, 2Η), 3,59 (с, 3H), 7,66 (дд, Використовуючи методику, подібну до методи1Н), 7,79 (д, 1Н), 8,09 (д, 1Н). ки Підготовчого прикладу 5, та як вихідну сполуку Підготовчий приклад 12 5-(трифторметил)-2-йодоанілін, очікуваний проМетиловий естер 5-(2-амінофеніл)-4дукт отримують у вигляді кристалів оранжевого пентинової кислоти кольору (вихід=71%). Використовуючи методику, подібну до методиТ.пл.=42°С. ки Підготовчого прикладу 2, та як вихідну сполуку Підготовчий приклад 19 сполуку, отриману згідно з Підготовчим прикладом Метиловий естер 5-(2-аміно-5-ацетилфеніл)-49, очікуваний продукт отримують у вигляді безбарпентинової кислоти вного масла (вихід=53%). 1 Використовуючи методику, подібну до методиН ЯМР (ДМСОd6, 250 МГц) : = 2,67 (м, 4Н), ки Підготовчого прикладу 5, та як вихідну сполуку 3,63 (с, 3H), 5,25 (с, 2Н), 6.46 (м, 1Н), 6,65 (дд, 1Н), 4-аміно-3-йодацетофенон, очікуваний продукт 7,02 (м, 2Н). отримують у вигляді твердої речовини жовтого Підготовчий приклад 13 кольору (вихід=39%). Метиловий естер 6-(2-аміно-5-хлорфеніл)-51 Н ЯМР (ДМСОd6, 300 МГц) : = 2,39 (с, 3H), гексинової кислоти 2,65-2,75 (м, 4Н), 3,64 (с, 3H), 6,15 (с, 2Н), 6,69 (д, Використовуючи методику, подібну до методи1Н), 7,64 (дд, 1Н), 7,69 (д, 1Н). ки Підготовчого прикладу 2, та як вихідну сполуку Підготовчий приклад 20 сполуку, отриману згідно з Підготовчим прикладом Метиловий естер 5-(2-аміно-4-хлор-510, очікуваний продукт отримують у вигляді тверфторфеніл)-4-пентинової кислоти дої речовини жовтого кольору (вихід=41%). 1 Використовуючи методику, подібну до методиН ЯМР (ДМСОd6, 250 МГц) : = 1,83 (м, 2Н), ки Підготовчого прикладу 5, та як вихідну сполуку 2,48 (м, 4Н), 3,59 (с, 3H), 5,40 (с, 2Н), 6,67 (д, 1Н), 5-хлор-4-фтор-2-йодоанілін, очікуваний продукт 7,03 (дд, 1Н), 7,08 (д, 1Н). отримують у вигляді кристалів коричневого кольоПідготовчий приклад 14 ру (вихід=81%). Метиловий естер 7-(2-аміно-5-хлорфеніл)-6Т.пл.=67-68°С. гептинової кислоти Підготовчий приклад 21 Використовуючи методику, подібну до методиМетиловий естер 5-(2-аміно-5-ціанофеніл)-4ки Підготовчого прикладу 2, та як вихідну сполуку пентинової кислоти сполуку, отриману згідно з Підготовчим прикладом Використовуючи методику, подібну до методи11, очікуваний продукт отримують у вигляді тверки Підготовчого прикладу 5, та як вихідну сполуку дої речовини жовтого кольору (вихід=68%). 4-аміно-3-йодобензонітрил, очікуваний продукт Т.пл.=66°С. отримують у вигляді безбарвного масла (виПідготовчий приклад 15 хід=52%). Метиловий естер 5-(2-аміно-5-фторфеніл)-41 Н ЯМР (ДМСОd6, 300 МГц) : = 2,65-2,75 (м, пентинової кислоти 4Н), 3,63 (с, 3H), 6,27 (с, 2Н), 6,73 (д, 1Н), 7,38 (дд, Використовуючи методику, подібну до методи1Н), 7,46 (д, 1 Гц, 1Н). ки Підготовчого прикладу 5, та як вихідну сполуку Підготовчий приклад 22 4-фтор-2-йодоанілін, очікуваний продукт отримуМетиловий естер 5-(2-аміно-5-бензоїлфеніл)ють у вигляді твердої речовини коричневого ко4-пентинової кислоти льору (вихід=45%). 1 Використовуючи методику, подібну до методиН ЯМР (ДМСОd6, 300 МГц) : = 2,6-2,75 (м, ки Підготовчого прикладу 5, та як вихідну сполуку 4Н), 3,63 (с, 3H), 5,16 (с, 2Н), 6,6-6,7 (м, 1Н), 6,84-аміно-3-йодобензофенон, очікуваний продукт 6,85 (м, 2Н). отримують у вигляді масла жовтого кольору (виПідготовчий приклад 16 хід=54%). Метиловий естер 5-(2-аміно-4,5-дихлорфеніл)1 Н ЯМР (ДМСОd6, 300 МГц) : = 2,63-2,73 (м, 4-пентинової кислоти 4Н), 3,62 (с, 3H), 6,28 (с, 2Н), 6,75 (д, 1Н), 7,47-7,61 Використовуючи методику, подібну до методи(м, 7Н). ки Підготовчого прикладу 5, та як вихідну сполуку Підготовчий приклад 23 4,5-дихлор-2-йодоанілін, очікуваний продукт отриМетиловий естер 5-(2-аміно-3,5-дихлорфеніл)мують у вигляді кристалів бежевого кольору (ви4-пентинової кислоти хід=87%). 1 Використовуючи методику, подібну до методиН ЯМР (ДМСОd6, 300 МГц) : = 2,65-2,75 (м, ки Підготовчого прикладу 5, та як вихідну сполуку 4Н), 3,63 (с, 3H), 5,70 (с, 2Н), 6,87 (с, 1Н), 7,24 (с, 2,4-дихлор-6-йоданілін, очікуваний продукт отри1Н). мують у вигляді масла темного кольору (виПідготовчий приклад 17 хід=87%). Метиловий естер 5-(2-аміно-5,6-дихлорфеніл)1 Н ЯМР (ДМСОd6, 300 МГц) : = 2,6-2,8 (м, 4Н), 4-пентинової кислоти 3,64 (с, 3H), 5,55 (с, 2Н), 7,13 (д, 1Н), 7,33 (д, 1Н). Використовуючи методику, подібну до методиПідготовчий приклад 24 ки Підготовчого прикладу 5, та як вихідну сполуку Метиловий естер 5-[23,4-дихлор-2-йодоанілін, очікуваний продукт отри[(фенілсульфоніл)аміно]феніл]-4-пентинової кисмують у вигляді безбарвного масла (вихід=49%). 1 лоти Н ЯМР (ДМСОd6, 300 МГц) : = 2,6-2,8 (м, 4Н), Використовуючи методику, подібну до методи3,63 (с, 3H), 5,74 (с, 2Н), 6,65 (д, 1Н), 7,20 (д, 1Н). ки Підготовчого прикладу 3, та як вихідну сполуку Підготовчий приклад 18 1 27 92025 28 сполуку, отриману згідно з Підготовчим прикладом Використовуючи методику, подібну до методи12, очікуваний продукт отримують у вигляді безбаки Підготовчого прикладу 3, та як вихідну сполуку рвного масла (вихід=82%). 4-метоксибензолсульфонілхлорид, очікуваний 1 продукт отримують у вигляді масла жовтого коН ЯМР (ДМСОd6, 300 МГц) : = 2,57 (с, 4Н), льору (вихід=84%). 3,65 (с, 3H), 7,13 (м, 1Н), 7,22-7,28 (м, 3H), 7,521 7,62 (м, 3H), 7,71 (дд, 2Н), 9.49 (с, 1Н). Н ЯМР (ДМСОd6, 300 МГц) : = 2,58 (с, 4Н), Підготовчий приклад 25 3,65 (с, 3H), 3,80 (с, 3H), 7,05 (м, 2Н), 7,29 (м, 2Н), Метиловий естер 5-[5-хлор-2-[[(47,36 (дд, 1Н), 7,63 (м, 2Н), 9,47 (с, 1Н). метилфеніл)сульфоніл]аміно]феніл]-4-пентинової Підготовчий приклад 31 кислоти Метиловий естер 5-[5-хлор-2-[[(4Використовуючи методику, подібну до методиацетилфеніл)сульфоніл]аміно]феніл]-4-пентинової ки Підготовчого прикладу 3, та як вихідну сполуку кислоти п-толуолсульфонілхлорид, очікуваний продукт Використовуючи методику, подібну до методиотримують у вигляді масла жовтого кольору (вики Підготовчого прикладу 3, та як вихідну сполуку хід=85%). 4-ацетилбензолсульфонілхлорид, очікуваний про1 дукт отримують у вигляді твердої речовини бежеН ЯМР (ДМСОd6, 250 МГц) : = 2,35 (с, 3H), вого кольору (вихід=59%). 2,56 (с, 4Н), 3,65 (с, 3H), 7,31 (м, 5Н), 7,59 (д, 2Н), Т.пл.=88°С. 9,57 (с, 1Н). Підготовчий приклад 32 Підготовчий приклад 26 Метиловий естер 5-[2-[([1,1-біфеніл]-4Метиловий естер 5-[5-хлор-2-[[(2,3ілсульфоніл)аміно]-5-хлорфеніл]-4-пентинової кидихлорфеніл)сульфоніл]аміно]феніл]-4-пентинової слоти кислоти Використовуючи методику, подібну до методиВикористовуючи методику, подібну до методики Підготовчого прикладу 3, та як вихідну сполуку ки Підготовчого прикладу 3, та як вихідну сполуку (1,1'-біфеніл)-4-ілсульфонілхлорид, очікуваний 2,3-дихлорбензолсульфонілхлорид, очікуваний продукт отримують у вигляді твердої речовини продукт отримують у вигляді твердої речовини бежевого кольору (вихід=81%). жовтого кольору (вихід=85%). Т.пл.=93°С. Т.пл.=64°С. Підготовчий приклад 33 Підготовчий приклад 27 Метиловий естер 5-[5-хлор-2-[[[2Метиловий естер 5-[5-хлор-2-[[(3(трифторметил)феніл]сульфоніл]аміно]феніл]-4метилфеніл)сульфоніл]аміно]феніл]-4-пентинової пентинової кислоти кислоти Використовуючи методику, подібну до методиВикористовуючи методику, подібну до методики Підготовчого прикладу 3 та як вихідну сполуку ки Підготовчого прикладу 3, та як вихідну сполуку 2-(трифторметил)бензолсульфонілхлорид, очікум-толуолсульфонілхлорид, очікуваний продукт ваний продукт отримують у вигляді масла оранжеотримують у вигляді твердої речовини бежевого вого кольору (вихід=73%). кольору (вихід=82%). 1 Т.пл.=69°С. Н ЯМР (ДМСОd6, 250 МГц) : = 2,56 (с, 4Н), Підготовчий приклад 28 3,63 (с, 3H), 1,21-1,42 (м, 3H), 7,83 (м, 2Н), 7,96 (м, Метиловий естер 5-[5-хлор-2-[[(2,42Н), 9,95 (с, 1Н). дихлорфеніл)сульфоніл]аміно]феніл]-4-пентинової Підготовчий приклад 34 кислоти Метиловий естер 5-[5-хлор-2-[[(3Використовуючи методику, подібну до методиметоксифеніл)сульфоніл]аміно]феніл]-4ки Підготовчого прикладу 3, та як вихідну сполуку пентинової кислоти 2,4-дихлорбензолсульфонілхлорид, очікуваний Використовуючи методику, подібну до методипродукт отримують у вигляді безбарвного масла ки Підготовчого прикладу 3, та як вихідну сполуку (вихід=96%). 3-метоксибензолсульфонілхлорид, очікуваний 1 продукт отримують у вигляді масла жовтого коН ЯМР (ДМСОd6, 300 МГц) : = 2,56 (с, 4Н), льору (вихід=86%). 3,64 (с, 3H), 7,27 (дд, J=8,4, 0,78 Гц, 1Н), 7,36 (м, 1 2Н), 7,58 (дд, 1Н), 7,84 (д, 1Н), 7,89 (с, 1Н), 10,06 Н ЯМР (ДМСОd6, 300 МГц) : = 2,56 (с, 4Н), (с, 1Н). 3,65 (с, 3H), 3,76 (с, 3H), 7,12-7,31 (м, 4Н), 7,37 (дд, Підготовчий приклад 29 1Н), 7,44 (м, 1Н), 7,69 (с, 1Н), 9,69 (с, 1Н). Метиловий естер 5-[5-хлор-2-[[[4Підготовчий приклад 35 (трифторметил)феніл]сульфоніл]аміно]феніл]-4Метиловий естер 5-[5-хлор-2-[[(2,5пентинової кислоти диметоксифеніл)сульфоніл]аміно]феніл]-4Використовуючи методику, подібну до методипентинової кислоти ки Підготовчого прикладу 3, та як вихідну сполуку Використовуючи методику, подібну до методи4-(трифторметил)бензолсульфонілхлорид, очікуки Підготовчого прикладу 3, та як вихідну сполуку ваний продукт отримують у вигляді твердої речо2,5-диметоксибензолсульфонілхлорид, очікуваний вини рожевого кольору (вихід=50%). продукт отримують у вигляді твердої речовини Т.пл.=80°С. жовтого кольору (вихід=92%). Підготовчий приклад 30 РХ/МС: m/z=438; Tr=5,97 хвил. Метиловий естер 5-[5-хлор-2-[[(4Підготовчий приклад 36 метоксифеніл)сульфоніл]аміно]феніл]-4Метиловий естер 5-[5-хлор-2-[[[4-(1,1пентинової кислоти диметилетил)феніл]сульфоніл]аміно]феніл]-4пентинової кислоти 29 92025 30 Використовуючи методику, подібну до методиПідготовчий приклад 43 ки Підготовчого прикладу 3, та як вихідну сполуку Метиловий естер 5-[5-хлор-2-[[(44-трет-бутилбензолсульфонілхлорид, очікуваний хлорфеніл)сульфоніл]аміно]феніл]-4-пентинової продукт отримують у вигляді безбарвного масла кислоти (вихід=88%). Використовуючи методику, подібну до методиРХ/МС: m/z=434; Tr=6,89 хвил. ки Підготовчого прикладу 3, та як вихідну сполуку Підготовчий приклад 37 4-хлорбензолсульфонілхлорид, очікуваний проМетиловий естер 5-[5-хлор-2-[[(4дукт отримують у вигляді масла оранжевого коетилфеніл)сульфоніл]аміно]феніл]-4-пентинової льору (вихід=56%). кислоти РХ/МС: m/z=412; Tr=6,27 хвил. Використовуючи методику, подібну до методиПідготовчий приклад 44 ки Підготовчого прикладу 3, та як вихідну сполуку Метиловий естер 5-[5-хлор-2-[[(44-етилбензолсульфонілхлорид, очікуваний профторфеніл)сульфоніл]аміно]феніл]-4-пентинової дукт отримують у вигляді масла жовтого кольору кислоти (вихід=37%). Використовуючи методику, подібну до методиРХ/МС: m/z=406; Tr=6,40 хвил. ки Підготовчого прикладу 3, та як вихідну сполуку Підготовчий приклад 38 4-фторбензолсульфонілхлорид, очікуваний проМетиловий естер 5-[5-хлор-2-[[[4-(1дукт отримують у вигляді масла оранжевого кометилетил)феніл]сульфоніл]аміно]феніл]-4льору (вихід=28%). пентинової кислоти РХ/МС: m/z=396; Tr=5,99 хвил. Використовуючи методику, подібну до методиПідготовчий приклад 45 ки Підготовчого прикладу 3, та як вихідну сполуку Метиловий естер 5-[5-хлор-2-[[(4-хлор-34-ізопропілбензолсульфонілхлорид, очікуваний метилфеніл)сульфоніл]аміно]феніл]-4-пентинової продукт отримують у вигляді масла оранжевого кислоти кольору (вихід=92%). Використовуючи методику, подібну до методиPX/MC: m/z=420; Tr=6,95 хвил. ки Підготовчого прикладу 3, та як вихідну сполуку Підготовчий приклад 39 4-хлор-3-метилбензолсульфонілхлорид, очікуваМетиловий естер 5-[5-хлор-2-[[(4ний продукт отримують у вигляді масла жовтого пропілфеніл)сульфоніл]аміно]феніл]-4-пентинової кольору (вихід=59%). кислоти РХ/МС: m/z=426; Tr=6,80 хвил. Використовуючи методику, подібну до методиПідготовчий приклад 46 ки Підготовчого прикладу 3, та як вихідну сполуку Метиловий естер 5-[5-хлор-2-[[[34-пропілбензолсульфонілхлорид, очікуваний про(трифторметил)феніл]сульфоніл]аміно]феніл]-4дукт отримують у вигляді масла оранжевого копентинової кислоти льору (вихід=22%). Використовуючи методику, подібну до методиPX/MC: m/z=420; Tr=6,92 хвил. ки Підготовчого прикладу 3, та як вихідну сполуку Підготовчий приклад 40 3-(трифторметил)бензолсульфонілхлорид, очікуМетиловий естер 5-[5-хлор-2-[[(4ваний продукт отримують у вигляді масла оранжепентилфеніл)сульфоніл]аміно]феніл]-4-пентинової вого кольору (вихід=50%). кислоти РХ/МС: m/z=446; Tr=6,58 хвил. Використовуючи методику, подібну до методиПідготовчий приклад 47 ки Підготовчого прикладу 3, та як вихідну сполуку Метиловий естер 5-[2-[[[44-пентилбензолсульфонілхлорид, очікуваний про(ацетиламіно)феніл]сульфоніл]аміно]-5дукт отримують у вигляді масла оранжевого кохлорфеніл]-4-пентинової кислоти льору (вихід=88%). Використовуючи методику, подібну до методиPX/MC: m/z=448; Tr=7,61 хвил. ки Підготовчого прикладу 3, та як вихідну сполуку Підготовчий приклад 41 4-(ацетиламіно)бензолсульфонілхлорид, очікуваМетиловий естер 5-[5-хлор-2-[[(3,5ний продукт отримують у вигляді твердої речовини диметилфеніл)сульфоніл]аміно]феніл]-4оранжевого кольору (вихід=74%). пентинової кислоти РХ/МС: m/z=435; Tr=5,15 хвил. Використовуючи методику, подібну до методиПідготовчий приклад 48 ки Підготовчого прикладу 3, та як вихідну сполуку Метиловий естер 5-[5-хлор-2-[[(43,5-диметилбензолсульфонілхлорид, очікуваний ціанофеніл)сульфоніл]аміно]феніл]-4-пентинової продукт отримують у вигляді масла оранжевого кислоти кольору (вихід=92%). Використовуючи методику, подібну до методиPX/MC: m/z=406; Tr=6,70 хвил. ки Підготовчого прикладу 3, та як вихідну сполуку Підготовчий приклад 42 4-ціанобензолсульфонілхлорид, очікуваний проМетиловий естер 5-[5-хлор-2-[[(2,4,6дукт отримують у вигляді твердої речовини жовтотриметилфеніл)сульфоніл]аміно]феніл]-4го кольору (вихід=87%). пентинової кислоти РХ/МС: m/z=403; Tr=5,71 хвил. Використовуючи методику, подібну до методиПідготовчий приклад 49 ки Підготовчого прикладу 3, та як вихідну сполуку Метиловий естер 5-[5-хлор-2-[[(42,4,6-триметилбензолсульфонілхлорид, очікувафеноксифеніл)сульфоніл]аміно]феніл]-4ний продукт отримують у вигляді масла оранжевопентинової кислоти го кольору (вихід=23%). Використовуючи методику, подібну до методиPX/MC: m/z=420; Tr=6,66 хвил. ки Підготовчого прикладу 3, та як вихідну сполуку 31 92025 32 4-феноксибензолсульфонілхлорид, очікуваний Метиловий естер 6-[5-хлор-2продукт отримують у вигляді твердої речовини [(фенілсульфоніламіно)феніл]-5-гексинової кисложовтого кольору (вихід=71%). ти РХ/МС: m/z=470; Tr=6,67 хвил. Використовуючи методику, подібну до методиПідготовчий приклад 50 ки Підготовчого прикладу 3, та як вихідну сполуку Метиловий естер 5-[5-хлор-2-[(1сполуку, отриману згідно з Підготовчим прикладом нафталенілсульфоніл)аміно]феніл]-4-пентинової 13, очікуваний продукт отримують у вигляді тверкислоти дої речовини оранжевого кольору (вихід=66%). Використовуючи методику, подібну до методиТ.пл.=90°С. ки Підготовчого прикладу 3, та як вихідну сполуку Підготовчий приклад 56 1-нафталінсульфонілхлорид, очікуваний продукт Метиловий естер 6-[5-хлор-2-[[(2,3отримують у вигляді масла коричневого кольору дихлорфеніл)сульфоніл]аміно]феніл]-5-гексинової (вихід=89%). кислоти 1 Використовуючи методику, подібну до методиН ЯМР (ДМСОd6, 300 МГц) : = 2,15 (т, 2Н), ки Підготовчого прикладу 55, та як вихідну сполуку 2,44 (т, 2Н), 3,63 (с, 3H), 7,18 (с, 1Н), 7,34 (с, 2Н), - 2,3-дихлорбензолсульфонілхлорид, очікуваний 7,62 (м, 3H), 8,01 (дд, 1Н), 8,04 (д, 1Н), 8,22 (д, 1Н), продукт отримують у вигляді масла жовтого ко8,72 (д, 1Н), 10,01 (с, 1Н). льору (вихід=87%). Підготовчий приклад 51 1 Метиловий естер 5-[5-хлор-2-[(2Н ЯМР (ДМСОd6, 250 МГц) : = 1,72 (м, 2Н), нафталенілсульфоніл)аміно]феніл]-4-пентинової 2,35 (т, 2Η), 2,43 (т, 2Η), 3,60 (с, 3H), 7,25-7,36 (м, кислоти 2Н), 7,39 (с, 1Н), 7,48 (т, 1Н), 7,79 (д, 1Н), 7,90 (д, Використовуючи методику, подібну до методи1Н), 10,28 (с, 1Н). ки Підготовчого прикладу 3, та як вихідну сполуку Підготовчий приклад 57 2-нафталінсульфонілхлорид, очікуваний продукт Метиловий естер 6-[5-хлор-2-[[(4отримують у вигляді безбарвного масла (виметоксифеніл)сульфоніл]аміно]феніл]-5-гексинової хід=22%). кислоти РХ/МС: m/z=428; Tr=6,63 хвил. Використовуючи методику, подібну до методиПідготовчий приклад 52 ки Підготовчого прикладу 55, та як вихідну сполуку Метиловий естер 5-[5-хлор-2-[[(4-метил-1- 4-метоксибензолсульфонілхлорид, очікуваний нафталеніл)сульфоніл]аміно]феніл]-4-пентинової продукт отримують у вигляді масла жовтого кокислоти льору (вихід=43%). 1 Використовуючи методику, подібну до методиН ЯМР (ДМСОd6, 250 МГц) : = 1,73 (м, 2Н), ки Підготовчого прикладу 3, та як вихідну сполуку 2,35-2,48 (м, 4Н), 3,62 (с, 3H), 3,81 (с, 3H), 7,04 (д, 4-метил-1-нафталінсульфонілхлорид, очікуваний 2Н), 7,25-7,35 (м, 3H), 7,60 (д, 2Н), 9,57 (с, 1Н). продукт отримують у вигляді масла жовтого коПідготовчий приклад 58 льору (вихід=77%). Метиловий естер 6-[5-хлор-2-[(81 Н ЯМР (ДМСОd6, 250 МГц) : = 2,24 (т, 2Η), хінолінілсульфоніл)аміно]феніл]-5-гексинової кис2,37 (т, 2Η), 2,70 (с, 3H), 3,64 (с, 3H), 7,25 (с, 1Н), лоти 7,33 (с, 2Н), 7,45 (дд, 1Н), 7,68 (м, 2Н), 7,93 (д, 1Н), Використовуючи методику, подібну до методи8,15 (м, 1Н), 8,75 (м, 1Н), 9,91 (с, 1Н). ки Підготовчого прикладу 55, та як вихідну сполуку Підготовчий приклад 53 - 8-хінолінсульфонілхлорид, очікуваний продукт Метиловий естер 5-[2-[[[5-(ацетиламіно)-1отримують у вигляді порошку білого кольору (винафталеніл]сульфоніл]аміно]-5-хлорфеніл]-4хід=48%). 1 пентинової кислоти Н ЯМР (ДМСОd6, 300 МГц) : = 1,77 (м, 2Н), Використовуючи методику, подібну до методи2,44 (м, 4Н), 3,61 (с, 3H), 7,29 (с, 2Н), 7,43 (д, 1Н), ки Підготовчого прикладу 3, та як вихідну сполуку 7,75 (м, 2Н), 8,32 (д, 1Н), 8,39 (д, 1Н), 8,55 (д, 1Н), 5-(ацетиламіно)-1-нафталінсульфонілхлорид, очі9,01 (с, 1Н), 9,08 (д, 1Н). куваний продукт отримують у вигляді безбарвного Підготовчий приклад 59 масла (вихід=94%). Метиловий естер 6-[5-хлор-2-[[[4-(11 Н ЯМР (ДМСОd6, 300 МГц) : = 2,18 (с, 3H), метилетил)феніл]сульфоніл]аміно]феніл]-52,23 (т, 2Η), 2,41 (т, 2Η), 3,62 (с, 3H), 7,18 (с, 1Н), гексинової кислоти 7,32 (с, 2Н), 7,62 (м, 2Н), 7,76 (д, 1Н), 8,04 (дд, 1Н), Використовуючи методику, подібну до методи8,35 (д, 1Н), 8,58 (д, 1Н), 10,03 (с, 1Н). ки Підготовчого прикладу 55, та як вихідну сполуку Підготовчий приклад 54 - 4-ізопропілбензолсульфонілхлорид, очікуваний Метиловий естер 5-[5-хлор-2-[(8продукт отримують у вигляді масла оранжевого хінолінілсульфоніл)аміно]феніл]-4-пентинової кискольору (вихід=86%). 1 лоти Н ЯМР (ДМСОd6, 300 МГц) : = 1,20 (д, 6Н), Використовуючи методику, подібну до методи1,71 (м, 2Н), 2,34 (т, 2Н), 2,41 (т, 2Н), 2,73 (м, 1Н), ки Підготовчого прикладу 3, та як вихідну сполуку 3,61 (с, 3H), 7,26-7,62 (м, 5Н), 9,71 (с, 1Н). 8-хінолінсульфонілхлорид, очікуваний продукт Підготовчий приклад 60 отримують у вигляді масла жовтого кольору (виМетиловий естер 6-[5-хлор-2-[(2хід=76%). нафталенілсульфоніл)аміно]феніл]-5-гексинової РХ/МС: m/z=429; Tr=5,96 хвил. кислоти Підготовчий приклад 55 Використовуючи методику, подібну до методики Підготовчого прикладу 55, та як вихідну сполуку - 2-нафталінсульфонілхлорид, очікуваний продукт 33 92025 34 отримують у вигляді масла жовтого кольору (виТ.пл.=142°С. хід=69%). Підготовчий приклад 67 1 Метиловий естер 4,5-дихлор-1Н-індол-2Н ЯМР (ДМСОd6, 300 МГц) : = 1,59 (м, 2Н), пропанової кислоти 2,20 (т, J=7,1 Гц, 2Н), 2,32 (т, J=7,4 Гц, 2Н), 3,61 (с, Використовуючи методику, подібну до методи3H), 7,08-7,34 (м, 3H), 7,63-7,74 (м, 3H), 7,99-8,33 ки Підготовчого прикладу 6, та як вихідну сполуку (м, 3H), 9,91 (с, 1Н). сполуку, отриману згідно з Підготовчим прикладом Підготовчий приклад 61 17, очікуваний продукт отримують у вигляді тверМетиловий естер 6-[5-хлор-2-[[(3,5дої речовини коричневого кольору (вихід=90%). диметилфеніл)сульфоніл]аміно]феніл]-51 гексинової кислоти Н ЯМР (ДМСОd6, 300 МГц) : = 2,78 (т, 2Н), Використовуючи методику, подібну до методи3,01 (т, 2Н), 3,61 (с, 3H), 6,24 (с, 1Н), 7,17 (д, 1Н), ки Підготовчого прикладу 55, та як вихідну сполуку 7,29 (д, 1Н) 11,49 (с, 1Н). - 3,5-диметилбензолсульфонілхлорид, очікуваний Підготовчий приклад 68 продукт отримують у вигляді порошку білого коМетиловий естер 6-(трифторметил)-1Н-індолльору (вихід=71%). 2-пропанової кислоти Т.пл.=92-94°С. Використовуючи методику, подібну до методиПідготовчий приклад 62 ки Підготовчого прикладу 6, та як вихідну сполуку Метиловий естер 6-[5-хлор-2-[[(3сполуку, отриману згідно з Підготовчим прикладом метоксифеніл)сульфоніл]аміно]феніл]-5-гексинової 18, очікуваний продукт отримують у вигляді тверкислоти дої речовини бежевого кольору (вихід=91%). Використовуючи методику, подібну до методиТ.пл.=108-110°С. ки Підготовчого прикладу 55, та як вихідну сполуку Підготовчий приклад 69 - 3-метоксибензолсульфонілхлорид, очікуваний Метиловий естер 5-ацетил-1Н-індол-2продукт отримують у вигляді порошку жовтого копропанової кислоти льору (вихід=82%). Використовуючи методику, подібну до методиТ.пл.=71-76°С. ки Підготовчого прикладу 6, та як вихідну сполуку Підготовчий приклад 63 сполуку, отриману згідно з Підготовчим прикладом Метиловий естер 6-[5-хлор-2-[[(2,519, очікуваний продукт отримують у вигляді твердиметоксифеніл)сульфоніл]аміно]феніл]-5дої речовини бежевого кольору (вихід=91%). 1 гексинової кислоти Н ЯМР (ДМСОd6, 250 МГц) : = 2,57 (с, 3H), Використовуючи методику, подібну до методи2,77 (т, 2Η), 3,01 (т, 2Η), 3,61 (с, 3H), 6,32 (с, 1Н), ки Підготовчого прикладу 55, та як вихідну сполуку 7,34 (д, 1Н), 7,66 (дд, 1Н), 8,15 (д, 1Н), 11,33 (с, - 2,5-диметоксибензолсульфонілхлорид, очікува1Н). ний продукт отримують у вигляді порошку білого Підготовчий приклад 70 кольору (вихід=80%). Метиловий естер 6-хлор-5-фтор-1Н-індол-2Т.пл.=115-117°С. пропанової кислоти Підготовчий приклад 64 Використовуючи методику, подібну до методиМетиловий естер 6-[5-хлор-2-[(1ки Підготовчого прикладу 6, та як вихідну сполуку нафталенілсульфоніл )аміно]феніл]-5-гексинової сполуку, отриману згідно з Підготовчим прикладом кислоти 20, очікуваний продукт отримують у вигляді тверВикористовуючи методику, подібну до методидої речовини сірого кольору (вихід=92%). ки Підготовчого прикладу 55, та як вихідну сполуку Т.пл.=138-139°С. - 1-нафталінсульфонілхлорид, очікуваний продукт Підготовчий приклад 71 отримують у вигляді порошку жовтого кольору Метиловий естер 5,7-дихлор-1Н-індол-2(вихід=81%). пропанової кислоти Т.пл. = 93-95°С. Використовуючи методику, подібну до методиПідготовчий приклад 65 ки Підготовчого прикладу 6, та як вихідну сполуку Метиловий естер 5-фтор-1Н-індол-2сполуку, отриману згідно з Підготовчим прикладом пропанової кислоти 23, очікуваний продукт отримують у вигляді тверВикористовуючи методику, подібну до методидої речовини коричневого кольору (вихід=30%). 1 ки Підготовчого прикладу 6, та як вихідну сполуку Н ЯМР (ДМСОd6, 250 МГц) : = 2,77 (т, 2Н), сполуку, отриману згідно з Підготовчим прикладом 3,02 (т, 2Н), 3,61 (с, 3H), 6,26 (с, 1Н), 7,15 (д, 1Н), 15, очікуваний продукт отримують у вигляді твер7,47 (д, 1Н), 11,47 (с, 1Н). дої речовини бежевого кольору (вихід=71%). Підготовчий приклад 72 1 Н ЯМР (ДМСОd6, 300 МГц) : = 2,75 (т, 2Н), Метиловий естер 5-ціано-1Н-індол-22,98 (т, 2Н), 3,61 (с, 3H), 6,14 (дд, 1Н), 6,82 (ддд, пропанової кислоти 1Н), 7,15 (дд, 1Н), 7,25 (дд, 4,68 Гц, 1Н), 11,02 (с, Використовуючи методику, подібну до методи1Н). ки Підготовчого прикладу 6, та як вихідну сполуку Підготовчий приклад 66 сполуку, отриману згідно з Підготовчим прикладом Метиловий естер 5,6-дихлор-1H-індол-221, очікуваний продукт отримують у вигляді тверпропанової кислоти дої речовини бежевого кольору (вихід=72%). 1 Використовуючи методику, подібну до методиН ЯМР (ДМСОd6, 250 МГц) : = 2,77 (т, 2Н), ки Підготовчого прикладу 6, та як вихідну сполуку 3,02 (т, 2Н), 3,60 (с, 3H), 6,33 (с, 1Н), 7,35 (дд, 1Н), сполуку, отриману згідно з Підготовчим прикладом 7,35 (дд, 1,6 Гц, 1Н), 7,4 (д, 1Н), 7,93 (д, 1Н), 11,56 16, очікуваний продукт отримують у вигляді твер(с, 1Н). дої речовини коричневого кольору (вихід=100%). Підготовчий приклад 73 35 92025 36 Метиловий естер 5-бензоїл-1Н-індол-2дукт отримують у вигляді масла жовтого кольору пропанової кислоти (вихід=63%). 1 Використовуючи методику, подібну до методиН ЯМР (ДМСОd6, 300 МГц) : = 1,56-1,66 (м, ки Підготовчого прикладу 6, та як вихідну сполуку 2Н), 2,23 (т, 2Η), 2,35 (т, 2Η), 3,60 (с, 3H), 7,27-7,39 сполуку, отриману згідно з Підготовчим прикладом (м, 3H), 7,79 (д, 1Н), 8,21 (д, 1Н), 8,60 (с, 1Н), 9,61 22, очікуваний продукт отримують у вигляді твер(с, 1Н), 9,97 (с, 1Н). дої речовини коричневого кольору (вихід=44%). Підготовчий приклад 79 1 Н ЯМР (ДМСОd6, 250 МГц) : = 2,77 (т, 2Н), Метиловий естер 6-[5-хлор-2-[[[6-(43,02 (т, 2Н), 3,61 (с, 3H), 6,33 (с, 1Н), 7,42 (д, 1Н), морфолініл)-3-піридиніл]сульфоніл]аміно]-феніл]7,45-7,75 (м, 7Н), 7,86 (д, 1Н), 11,42 (с, 1Н). 5-гексинової кислоти Підготовчий приклад 74 Використовуючи методику, подібну до методиМетиловий естер 7-[5-хлор-2ки Підготовчого прикладу 55, та як вихідну сполуку [(фенілсульфоніл)аміно]феніл]-6-гептинової кис- 6-(4-морфолініл)-3-піридинсульфонілхлорид, очілоти куваний продукт отримують у вигляді масла жовВикористовуючи методику, подібну до методитого кольору (вихід=66%). 1 ки Підготовчого прикладу 3, та як вихідну сполуку Н ЯМР (ДМСОd6, 300 МГц) : = 1,69-1,79 (м, сполуку, отриману згідно з Підготовчим прикладом 2Н), 2,36-2,51 (м, 4Н), 3,55-3,58 (м, 4Н), 3,60 (с, 14, очікуваний продукт отримують у вигляді безба3H), 3,64-3,68 (м, 4Н), 6,87 (д, 1Н), 7,29-7,39 (м, рвного масла (вихід=54%). 3H), 7,64 (дд, 1Н), 8,30 (д, 1Н), 9,58 (с, 1H). 1 Н ЯМР (ДМСОd6, 250 МГц) : = 1,55 (м, 4Н), Підготовчий приклад 80 2,33 (м, 4Н), 3,60 (с, 3H), 7,22 (м, 3H), 7,61 (м, 5Н), Метиловий естер 6-[5-хлор-2-[[(3,5-диметил-49,75 (с, 1Н). ізоксазоліл)сульфоніл]аміно]феніл]-5-гексинової Підготовчий приклад 75 кислоти Метиловий естер 6-[5-хлор-2-[[(3,4-дигідро-4Використовуючи методику, подібну до методиметил-2Н-1,4-бензоксазин-7ки Підготовчого прикладу 55, та як вихідну сполуку іл)сульфоніл]аміно]феніл]-5-гексинової кислоти - 3,5-диметил-4-ізоксазолсульфонілхлорид, очікуВикористовуючи методику, подібну до методиваний продукт отримують у вигляді порошку жовки Підготовчого прикладу 55, та як вихідну сполуку того кольору (вихід=62%). 3,4-дигідро-4-метил-2Н-1,4-бензоксазин-7Т.пл.=107-109°С. сульфонілхлорид, очікуваний продукт отримують у Підготовчий приклад 81 вигляді порошку білого кольору (вихід=88%). Метиловий естер 6-[5-хлор-2-[[(1,3,5Т.пл.=131-133°С. триметил-1Н-піразол-4-іл)сульфоніл]аміно]-феніл]Підготовчий приклад 76 5-гексинової кислоти Метиловий естер 6-[5-хлор-2-[[[1,2,3,4Використовуючи методику, подібну до методитетрагідро-2-(трифторацетил)-7-ізохінолініл]ки Підготовчого прикладу 55, та як вихідну сполуку сульфоніл]аміно]феніл]-5-гексинової кислоти 1,3,5-триметил-1Н-піразол-4-сульфонілхлорид, Використовуючи методику, подібну до методиочікуваний продукт отримують у вигляді масла ки Підготовчого прикладу 55, та як вихідну сполуку жовтого кольору (вихід=86%). 1 1,2,3,4-тетрагідро-2-(трифторацетил)-7Н ЯМР (ДМСОd6, 250 МГц) : = 1,73-1,81 (м, ізохінолінсульфонілхлорид, очікуваний продукт 2Н), 2,05 (с, 3H), 2,15 (с, 3H), 2,36 (д, 2Н), 2,42 (д, отримують у вигляді масла жовтого кольору (ви2Н), 3,61 (с, 3H), 3,62 (с, 3H), 7,31-7,41 (м, 3H), 9,38 хід=89%). (с, 1Н). 1 Н ЯМР (ДМСОd6, 300 МГц) : = 1,70-1,75 (м, Підготовчий приклад 82 2Н), 2,35-2,45 (м, 4Н), 3,0 (т, 2Η), 3,85 (т, 2Η), 4,80 Метиловий естер 6-[5-хлор-2-[[(1-метил-1Н(с, 2Н), 7,30-7,35 (м, 4Н), 7,60 (дд, 1Н), 7,65 (д, 1Н), імідазол-4-іл)сульфоніл]аміно]феніл]-5-гексинової 9,80 (с, 1Н). кислоти Підготовчий приклад 77 Використовуючи методику, подібну до методиМетиловий естер 6-[5-хлор-2-[[(2,3-дигідро-1,4ки Підготовчого прикладу 55, та як вихідну сполуку бензодіоксин-6-іл)сульфоніл]аміно]-феніл]-5- 1-метил-1Н-імідазол-4-сульфонілхлорид, очікугексинової кислоти ваний продукт отримують у вигляді порошку жовВикористовуючи методику, подібну до методитого кольору (вихід=89%). ки Підготовчого прикладу 55, та як вихідну сполуку Т.пл.=76-79°С. - 2,3-дигідро-1,4-бензодіоксин-6-сульфонілхлорид, Підготовчий приклад 83 очікуваний продукт отримують у вигляді масла Метиловий естер 6-[2-[[(2,1,3-бензотіадіазол-4жовтого кольору (вихід=95%). іл)сульфоніл]аміно]-5-хлорфеніл]-5-гексинової ки1 слоти Н ЯМР (ДМСОd6, 250 МГц) : = 1,70-1,81 (м, Використовуючи методику, подібну до методи2Н), 2,37-2,51 (м, 4Н), 3,61 (с, 3H), 4,25-4,32 (м, ки Підготовчого прикладу 55, та як вихідну сполуку 4Н), 6,59-7,37 (м, 6Н), 9,63 (с, 1Н). - 2,1,3-бензотіадіазол-4-сульфонілхлорид, очікуваПідготовчий приклад 78 ний продукт отримують у вигляді масла жовтого Метиловий естер 6-[5-хлор-2-[[(6кольору (вихід=87%). бензотіазоліл)сульфоніл]аміно]феніл]-5-гексинової 1 кислоти Н ЯМР (ДМСОd6, 300 МГц) : = 1,49-1,59 (м, Використовуючи методику, подібну до методи2Н), 2,03 (т, 2Η), 2,32 (т, 2Η), 3,60 (с, 3H), 7,25-7,38 ки Підготовчого прикладу 55, та як вихідну сполуку (м, 3H), 7,82 (дд, 1Н), 8,13 (дд, 1Н), 8,37 (дд, 1Н), - 6-бензотіазолсульфонілхлорид, очікуваний про9,83 (с, 1Н). Підготовчий приклад 84 37 92025 38 Метиловий естер 6-[2-[[(2,1,3-бензотіадіазол-5Використовуючи методику, подібну до методиіл)сульфоніл]аміно]-5-хлорфеніл]-5-гексинової кики Підготовчого прикладу 55, та як вихідну сполуку слоти - 2-(ацетиламіно)-6-бензотіазолсульфонілхлорид, Використовуючи методику, подібну до методиочікуваний продукт отримують у вигляді порошку ки Підготовчого прикладу 55, та як вихідну сполуку білого кольору (вихід=80%). - 2,1,3-бензотіадіазол-5-сульфонілхлорид, очікуваТ.пл.=138-140°С. ний продукт отримують у вигляді масла жовтого Підготовчий приклад 90 кольору (вихід=22%). Метиловий естер 6-[2-[[(2-аміно-61 бензотіазоліл)сульфоніл]аміно]-5-хлорфеніл]-5Н ЯМР (ДМСОd6, 300 МГц) : = 1,52-1,62 (м, гексинової кислоти 2Н), 2,20 (т, 2Н), 2,33 (т, 2Н), 3,59 (с, 3H), 7,31-7,40 Використовуючи методику, подібну до методи(м, 3H), 7,95 (дд, 1Н), 8,31 (дд, 1Н), 8,36 (дд, 1Н), ки Підготовчого прикладу 55, та як вихідну сполуку 10,3 (с, 1Н). - 2-аміно-6-бензотіазолсульфонілхлорид, очікуваПідготовчий приклад 85 ний продукт отримують у вигляді твердої речовини Метиловий естер 6-[5-хлор-2-[[(3,4-дигідро-2,2оранжевого кольору (вихід=96%). диметил-2Н-1-бензопіран-6Т.пл.=61-65°С. іл)сульфоніл]аміно]феніл]-5-гексинової кислоти Підготовчий приклад 91 Використовуючи методику, подібну до методиМетиловий естер 6-[5-хлор-2-[[(2-метил-6ки Підготовчого прикладу 55, та як вихідну сполуку бензоксазоліл)сульфоніл]аміно]феніл]-53,4-дигідро-2,2-диметил-2Н-1-бензопіран-6гексинової кислоти сульфонілхлорид, очікуваний продукт отримують у Використовуючи методику, подібну до методивигляді масла жовтого кольору (вихід=88%). 1 ки Підготовчого прикладу 55, та як вихідну сполуку Н ЯМР (ДМСОd6, 300 МГц) : = 1,28 (с, 6Н), - 2-метил-6-бензоксазолсульфонілхлорид, очіку1,70-1,79 (м, 4Н), 2,35-2,51 (м, 4Н), 2,72 (т, 2Н), ваний продукт отримують у вигляді масла оранже3,60 (с, 3H), 6,80 (д, 1Н), 7,25-7,65 (м, 5Н), 9.48 (с, вого кольору (вихід=93%). 1Н). 1 Н ЯМР (ДМСОd6, 250 МГц) : = 1,65 (м, 2Н), Підготовчий приклад 86 2,15 (т, 2Η), 2,39 (т, 2Η), 2,65 (с, 3H), 3,61 (с, 3H), Метиловий естер 6-[5-хлор-2-[[(5,6,7,87,26-7,39 (м, 3H), 7,65 (дд, 1Н), 7,81 (д, 1Н), 7,95 (с, тетрагідро-5,5,8,8-тетраметил-2-нафталеніл)1Н), 9,93 (с, 1Н). сульфоніл]аміно]феніл]-5-гексинової кислоти Підготовчий приклад 92 Використовуючи методику, подібну до методиМетиловий естер 6-[5-хлор-2-[[(2,3-дигідро-5ки Підготовчого прикладу 55, та як вихідну сполуку бензофураніл)сульфоніл]аміно]феніл]-5-гексинової 5,6,7,8-тетрагідро-5,5,8,8-тетраметил-2кислоти нафталінсульфонілхлорид, очікуваний продукт Використовуючи методику, подібну до методиотримують у вигляді порошку жовтого кольору ки Підготовчого прикладу 55, та як вихідну сполуку (вихід=65%). - 2,3-дигідро-5-бензофурансульфонілхлорид, очіТ.пл.=113-115°С. куваний продукт отримують у вигляді масла оранПідготовчий приклад 87 жевого кольору (вихід=99%). Метиловий естер 6-[2-[[(1-ацетил-2,3-дигідро1 1Н-індол-5-іл)сульфоніл]аміно]-5-хлорфеніл]-5Н ЯМР (ДМСОd6, 300 МГц) : = 1,76 (м, 2Н), гексинової кислоти 2,40-2,49 (м, 4Н), 3,23 (т, 2Η), 3,85 (с, 3H), 4,62 (т, Використовуючи методику, подібну до методи2Н), 6,85 (д, 1Н), 7,25-7,45 (м, 4Н), 7,77 (с, 1Н), ки Підготовчого прикладу 55, та як вихідну сполуку 9,51 (с, 1Н). 1-ацетил-2,3-дигідро-1Н-індол-5Підготовчий приклад 93 сульфонілхлорид, очікуваний продукт отримують у Метиловий естер 6-[5-хлор-2-[[(2-метил-5вигляді пастоподібної твердої речовини (вибензотіазоліл)сульфоніл]аміно]феніл]-5-гексинової хід=88%). кислоти 1 Використовуючи методику, подібну до методиН ЯМР (ДМСОd6, 250 МГц) : = 1,68-1,80 (м, ки Підготовчого прикладу 55, та як вихідну сполуку 2Н), 2,17 (с, 3H), 2,39 (т, 2Η), 2,43 (т, 2Η), 3,14 (т, - 2-метил-5-бензотіазолсульфонілхлорид, очікува2Н), 3,61 (с, 3H), 4,14 (т, 2Н), 7,25 (дд, 1Н), 7,32ний продукт отримують у вигляді твердої речовини 7,37 (м, 2Н), 7,48 (д, 1Н), 7,52 (д, 1Н), 8,07 (д, 1Н), жовтого кольору (вихід=42%). 9,59 (с, 1Н). Т.пл.=68-72°С. Підготовчий приклад 88 Підготовчий приклад 94 Метиловий естер 6-[5-хлор-2-[[(2-метил-6Метиловий естер 6-[2-[[(2-аміно-6бензотіазоліл)сульфоніл]аміно]феніл]-5-гексинової бензоксазоліл)сульфоніл]аміно]-5-хлорфеніл]-5кислоти гексинової кислоти Використовуючи методику, подібну до методиВикористовуючи методику, подібну до методики Підготовчого прикладу 55, та як вихідну сполуку ки Підготовчого прикладу 55, та як вихідну сполуку - 2-метил-6-бензотіазолсульфонілхлорид, очікува- 2-аміно-6-бензоксазолсульфонілхлорид, очікуваний продукт отримують у вигляді твердої речовини ний продукт отримують у вигляді твердої речовини жовтого кольору (вихід=68%). білого кольору (вихід=9%). Т.пл.=103-106°С. Т.пл.=135°С. Підготовчий приклад 89 Підготовчий приклад 95 Метиловий естер 6-[2-[[[2-(ацетиламіно)-6Метиловий естер 6-[2-[[[2-(ацетиламіно)-4бензотіазоліл]сульфоніл]аміно]-5-хлорфеніл]-5метил-5-тіазоліл]сульфоніл]аміно]-5-хлорфеніл]-5гексинової кислоти гексинової кислоти 39 92025 40 Використовуючи методику, подібну до методиМетиловий естер 6-[2-[[(1,3-бензодіоксол-5ки Підготовчого прикладу 55, та як вихідну сполуку іл)сульфоніл]аміно]-5-хлорфеніл]-5-гексинової ки2-(ацетиламіно)-4-метил-5слоти тіазолсульфонілхлорид, очікуваний продукт отриВикористовуючи методику, подібну до методимують у вигляді порошку білого кольору (вики Підготовчого прикладу 55, та як вихідну сполуку хід=62%). - 1,3-бензодіоксол-5-сульфонілхлорид, очікуваний Т.пл.=147-149°С. продукт отримують у вигляді масла коричневого Підготовчий приклад 96 кольору (вихід=89%). 1 Метиловий естер 6-[5-хлор-2-[[(1,2,3,4Н ЯМР (ДМСОd6, 300 МГц) : = 1,76 (м, 2Н), тетрагідро-2-оксо-6-хінолініл)сульфоніл]2,37-2,45 (м, 4Н), 3,61 (с, 3H), 6,14 (с, 2Н), 7,0 (д, аміно]феніл]-5-гексинової кислоти 1Н), 7,38-7,71 (м, 5Н), 9,68 (с, 1Н). Використовуючи методику, подібну до методиПідготовчий приклад 102 ки Підготовчого прикладу 55, та як вихідну сполуку Метиловий естер 6-[5-Хлор-2-[[[4-(41,2,3,4-тетрагідро-2-оксо-6морфолінілсульфоніл)феніл]сульфоніл]аміно]хінолінсульфонілхлорид, очікуваний продукт отрифеніл]-5-гексинової кислоти мують у вигляді порошку жовтого кольору (виВикористовуючи методику, подібну до методихід=27%). ки Підготовчого прикладу 55, та як вихідну сполуку Т.пл.=53-57°С. 4-(4Підготовчий приклад 97 морфолінілсульфоніл)бензолсульфонілхлорид, Метиловий естер 5-[2-[[(6очікуваний продукт отримують у вигляді твердої бензотіазоліл)сульфоніл]аміно]-5-хлорфеніл]-4речовини білого кольору (вихід=66%). пентинової кислоти Т.пл.=135-139°С. Використовуючи методику, подібну до методиПідготовчий приклад 103 ки Підготовчого прикладу 3, та як вихідну сполуку Метиловий естер 6-[2-аміно-56-бензотіазолсульфонілхлорид, очікуваний про(трифторметил)феніл]-5-гексинової кислоти дукт отримують у вигляді масла жовтого кольору Використовуючи методику, подібну до методи(вихід=92%). ки Підготовчого прикладу 5, та як вихідну сполуку 1 Н ЯМР (ДМСОd6, 300 МГц) : = 2,44 (с, 4Н), метиловий естер 5-гексинової кислоти, очікуваний 3,63 (с, 3H), 7,26-7,39 (м, 3H), 7,25-7,65 (м, 5Н), продукт отримують у вигляді масла коричневого 7,80 (дд, 1Н), 8,21 (дд, 1Н), 8,62 (д, 1Н), 9,62 (с, кольору (вихід=84%). 1 1Н), 9,88 (с, 1Н). Н ЯМР (ДМСОd6, 250 МГц) : = 1,86 (к, 2Н), Підготовчий приклад 98 2,45-2,54 (м, 4Н), 3,6 (с, 3H), 5,96 (с, ΝΗ2), 6,78 (д, Метиловий естер 5-[2-[[[2-(ацетиламіно)-61Н), 7,30 (дд, 1Н), 7,36 (д, 1Н). бензотіазоліл]сульфоніл]аміно]-5-хлорфеніл]-4Підготовчий приклад 104 пентинової кислоти Метиловий естер 5-[2-[[(6Використовуючи методику, подібну до методибензотіазоліл)сульфоніл]аміно]-5ки Підготовчого прикладу 3, та як вихідну сполуку (трифторметил)феніл]-4-пентинової кислоти 2-(ацетиламіно)-6-бензотіазолсульфонілхлорид, Використовуючи методику, подібну до методиочікуваний продукт отримують у вигляді твердої ки Підготовчого прикладу 97, та як вихідну сполуку речовини бежевого кольору (вихід=99%). метиловий естер 5-[2-аміно-5Т.пл.=85°С. (трифторметил)феніл]-4-пентинової кислоти (ПідПідготовчий приклад 99 готовчий приклад 5), очікуваний продукт отримуМетиловий естер 5-[2-[[(1-ацетил-2,3-дигідроють у вигляді масла оранжевого кольору (ви1H-індол-5-іл)сульфоніл]аміно]-5-хлорфеніл]-4хід=83%). 1 пентинової кислоти Н ЯМР (ДМСОd6, 500 МГц) : = 2,53 (д, 2Н), Використовуючи методику, подібну до методи2,55 (д, 2Н), 3,65 (с, 3H), 6,80 (д, 1Н), 7,54-7,66 (м, ки Підготовчого прикладу 3, та як вихідну сполуку 3H), 7,90 (дд, 1Н), 8,22 (д, 1Н), 8,73 (д, 1Н), 9,63 (с, 1-ацетил-2,3-дигідро-1H-індол-5-сульфонілхлорид, 1Н), 10,13 (с, 1Н). очікуваний продукт отримують у вигляді твердої Підготовчий приклад 105 речовини бежевого кольору (вихід=84%). Метиловий естер 6-[2-[[(2-метил-6Т.пл.=154°С. бензоксазоліл)сульфоніл]аміно]-5Підготовчий приклад 100 (трифторметил)феніл]-5-гексинової кислоти Метиловий естер 5-[2-[[(1,3-бензодіоксол-5Використовуючи методику, подібну до методиіл)сульфоніл]аміно]-5-хлорфеніл]-4-пентинової ки Підготовчого прикладу 91, та як вихідні сполуки кислоти метиловий естер 6-[2-аміно-5Використовуючи методику, подібну до методи(трифторметил)феніл]-5-гексинової кислоти (Підки Підготовчого прикладу 3, та як вихідну сполуку готовчий приклад 103) і 2-метил-61,3-бензодіоксол-5-сульфонілхлорид, очікуваний бензоксазолсульфонілхлорид, очікуваний продукт продукт отримують у вигляді масла коричневого отримують у вигляді масла оранжевого кольору кольору (вихід=98%). (вихід=54%). 1 1 Н ЯМР (ДМСОd6, 300 МГц) : = 2,60 (с, 4Н), Н ЯМР (ДМСОd6, 300 МГц) : = 1,65-1,75 (м, 3,65 (с, 3H), 6,15 (с, 2Н), 7,01 (д, J=8,73 Гц, 1Н), 2Н), 2,33-2,43 (м, 4Н), 2,65 (с, 3H), 3,60 (с, 3H), 7,49 7,20 (дд, 2Н), 7,27 (с, Н), 7,30-7,38 (м, 2Н). (д, 1Н), 7,62 (с, 1Н), 7,63 (д, 1Н), 7,74 (дд, 1Н), 7,82 Підготовчий приклад 101 (д, 1Н), 8,07 (с, 1Н), 10,16 (с, 1Н). Підготовчий приклад 106 41 92025 42 Метиловий естер 6-[2-[[(1-ацетил-2,3-дигідроМетиловий естер 5-[2-[[(2-метил-51H-індол-5-іл)сульфоніл]аміно]-5бензотіазоліл)сульфоніл]аміно]-5(трифторметил)феніл]-5-гексинової кислоти (трифторметил)феніл]-4-пентинової кислоти Використовуючи методику, подібну до методиВикористовуючи методику, подібну до методики Підготовчого прикладу 105, та як вихідну сполуки Підготовчого прикладу 104, та як вихідну сполуку 1-ацетил-2,3-дигідро-1H-індол-5ку - 2-метил-5-бензотіазолсульфонілхлорид, очікусульфонілхлорид, очікуваний продукт отримують у ваний продукт отримують у вигляді масла жовтого вигляді пастоподібної твердої речовини (викольору (вихід=46%). 1 хід=56%). Н ЯМР (ДМСОd6, 250 МГц) : = 2,55 (м, 4Н), 1 Н ЯМР (ДМСОd6, 300 МГц) : = 1,74-1,83 (м, 2,83 (с, 3H), 3,65 (с, 3H), 7,55 (м, 2Н), 7,66 (дд, 1Н), 2Н), 2,16 (с, 3H), 2,43-2,48 (м, 4Н), 3,15 (т, 2Н), 3,61 7,72 (дд, 1Н), 8,24 (д, 1Н), 8,30 (д, 1Н), 10,09 (с, (с, 3H), 4,13 (т, 2Н), 7,44-7,47 (м, 1Н), 7,58-7,61 (м, 1Н). 4Н), 8,07-8,10 (м, 1Н), 9,86 (с, 1Н). Підготовчий приклад 112 Підготовчий приклад 107 Метиловий естер 5-[2-[[(2-метил-6Метиловий естер 6-[2-[[(2,3-дигідро-5бензоксазоліл)сульфоніл]аміно]-5бензофураніл)сульфоніл]аміно]-5(трифторметил)феніл]-4-пентинової кислоти (трифторметил)феніл]-5-гексинової кислоти Використовуючи методику, подібну до методиВикористовуючи методику, подібну до методики Підготовчого прикладу 104, та як вихідну сполуки Підготовчого прикладу 105, та як вихідну сполуку - 2-метил-6-бензоксазолсульфонілхлорид, очіку - 2,3-дигідро-5-бензофурансульфонілхлорид, куваний продукт отримують у вигляді порошку очікуваний продукт отримують у вигляді пасти жобілого кольору (вихід=41%). 1 втого кольору (вихід=19%). Н ЯМР (ДМСОd6, 250 МГц) : = 2,56 (м, 4Н), 1 Н ЯМР (ДМСОd6, 250 МГц) : = 1,80 (т, 2Н), 2,66 (с, 3H), 3,65 (с, 3H), 7,55 (м, 2Н), 7,62 (д, 1Н), 2,43-2,51 (м, 4Н), 3,21 (т, 2Η), 3,61 (с, 3H), 4,62 (т, 7,75 (дд, 1Н), 7,83 (дд, 1Н), 8,12 (дд, 1Н), 10,04 (с, 2Н), 6,87 (д, 1Н), 7,48 (д, 1Н), 7,55 (дд, 1Н), 7,601Н). 7,67 (м, 3H), 9,77 (с, 1Н). Підготовчий приклад 113 Підготовчий приклад 108 Метиловий естер 5-[2-[[(2-метил-7Метиловий естер 6-[2-[[(2-метил-5бензотіазоліл)сульфоніл]аміно]-5бензотіазоліл)сульфоніл]аміно]-5(трифторметил)феніл]-4-пентинової кислоти (трифторметил)феніл]-5-гексинової кислоти Використовуючи методику, подібну до методиВикористовуючи методику, подібну до методики Підготовчого прикладу 104, та як вихідну сполуки Підготовчого прикладу 105, та як вихідну сполуку - 2-метил-7-бензотіазолсульфонілхлорид, очікуку - 2-метил-5-бензотіазолсульфонілхлорид, очікуваний продукт отримують у вигляді масла ваний продукт отримують у вигляді пасти жовтого оранжевого кольору (вихід=32%). 1 кольору (вихід=17%). Н ЯМР (ДМСОd6, 250 МГц) : = 2,40 (м, 4Н), 1 Н ЯМР (ДМСОd6, 250 МГц) : = 1,61-1,73 (м, 2,78 (с, 3H), 3,64 (с, 3H), 7,68 (м, 3H), 8,17 (дд, 1Н), 2Н), 2,32 (т, 2Η), 2,38 (т, 2Η), 2,83 (с, 3H), 3,60 (с, 10,40 (с, 1Н). 3H), 7,52 (д, 1Н), 7,60-7,66 (м, 3H), 7,72 (дд, 1Н), Підготовчий приклад 114 8,23 (д, 1Н), 8,25 (с, 1Н), 10,19 (с, 1Н). Метиловий естер 5-[2-[[(1-ацетил-2,3-дигідроПідготовчий приклад 109 1H-індол-5-іл)сульфоніл]аміно]-5Метиловий естер 5-[2-[[(2-аміно-6(трифторметил)феніл]-4-пентинової кислоти бензотіазоліл)сульфоніл]аміно]-5Використовуючи методику, подібну до методи(трифторметил)феніл]-4-пентинової кислоти ки Підготовчого прикладу 104, та як вихідну сполуВикористовуючи методику, подібну до методику 1-ацетил-2,3-дигідро-1H-індол-5ки Підготовчого прикладу 104, та як вихідну сполусульфонілхлорид, очікуваний продукт отримують у ку - 2-аміно-6-бензотіазолсульфонілхлорид, очікувигляді твердої речовини жовтого кольору (виваний продукт отримують у вигляді масла жовтого хід=32%). 1 кольору (вихід=69%). Н ЯМР (ДМСОd6, 300 МГц) : = 2,63 (м, 4Н), 1 Н ЯМР (ДМСОd6, 250 МГц) : = 2,65 (м, 4Н), 3,16 (т, 2Η), 3,66 (с, 3H), 4,13 (т, 2Η), 7,50 (д, 1Н), 3,68 (с, 3H), 7,40 (д, 1Н), 7,54-7,66 (м, 4Н), 7,99 (с, 7,62 (м, 4Н), 8,10 (д, 1Н), 9,74 (с, 1Н). 2Н), 8,19 (д, 1Н), 9,71 (с, 1Н). Підготовчий приклад 115 Підготовчий приклад 110 Метиловий естер 5-[2-[[(2,3-дигідро-5Метиловий естер 5-[2-[[(2-метил-6бензофураніл)сульфоніл]аміно]-5бензотіазоліл)сульфоніл]аміно]-5(трифторметил)феніл]-4-пентинової кислоти (трифторметил)феніл]-4-пентинової кислоти Використовуючи методику, подібну до методиВикористовуючи методику, подібну до методики Підготовчого прикладу 104, та як вихідну сполуки Підготовчого прикладу 104, та як вихідну сполуку - 2,3-дигідро-5-бензофурансульфонілхлорид, ку - 2-метил-6-бензотіазолсульфонілхлорид, очікуочікуваний продукт отримують у вигляді масла ваний продукт отримують у вигляді масла жовтого жовтого кольору (вихід=53%). 1 кольору (вихід=24%). Н ЯМР (ДМСОd6, 250 МГц) : = 2,66 (м, 4Н), 1 Н ЯМР (ДМСОd6, 300 МГц) : = 2,54 (м, 4Н), 3,20 (т, 2Н), 3,66 (с, 3H), 4,63 (т, 2Н), 6,88 (д, 1Н), 2,84 (с, 3H), 3,65 (с, 3H), 7,53 (м, 2Н), 7,56 (м, 1Н), 7,59 (м,5Н), 9,65 (с, 1Н). 7,65 (дд, 1Н), 7,83 (дд, 1Н), 8,05 (дд, 1Н), 8,57 (д, Підготовчий приклад 116 1Н), 10,05 (с, 1Н). Метиловий естер 5-[2-[[[4-(4Підготовчий приклад 111 морфолінілсульфоніл)феніл]сульфоніл]аміно]-5(трифторметил)феніл]-4-пентинової кислоти 43 92025 44 Використовуючи методику, подібну до методипри зниженому тиску і залишок обробляють водою ки Підготовчого прикладу 104, та як вихідну сполуі підкислюють до рН 2 розбавленим розчином соку 4-(4ляної кислоти. Утворений осад відфільтровують, морфолінілсульфоніл)бензолсульфонілхлорид, промивають водою на фільтрі і сушать з одержаночікуваний продукт отримують у вигляді масла ням 2,79 г очікуваного продукту у вигляді твердої жовтого кольору (вихід=56%). речовини білого кольору (вихід=90%). 1 Т.пл.=126-128°С. Н ЯМР (ДМСОd6, 250 МГц) : = 2,60 (с, 4Н), Підготовчий приклад 121 2,88 (т, 4Η), 3,60 (т, 4Η), 3,65 (с, 3H), 7,53 (с, 1Н), N-[2-йод-47,58 (д, 1Н), 7,92 (дд, 1Н), 7,99 (дд, 2Н), 10,37 (с, (трифторметил)феніл]бензолсульфонамід 1Н). Використовуючи методику, подібну до методиПідготовчий приклад 117 ки Підготовчого прикладу 120, та як вихідну сполуN-(4-хлор-2-йодофеніл)-2-піридинсульфонамід ку - 2-йод-4-(трифторметил)анілін, очікуваний проГотують розчин 1 г (3,95 мМ) 4-хлор-2дукт отримують у вигляді твердої речовини білого йодоаніліну і 0,65 мл піридину в 10 мл дихлормекольору (вихід=74%). тану і додають 1,68 г (9,5 мМ) 2Т.пл.=84-86°С. піридинсульфонілхлориду при 0°С, при перемішуПідготовчий приклад 122 ванні. Потім реакційну суміш перемішують при Метиловий естер 2-[[3-(2-аміно-5-хлорфеніл)кімнатній температурі протягом 16 годин, після 2-пропініл]окси]-2-метилпропанової кислоти чого концентрують при зниженому тиску. МаслоОдержують суміш 2 г (7,89 мМ) 4-хлор-2подібний залишок очищають хроматографією на йодоаніліну, 75 мг (0,395 мМ) йодиду міді, 277 мг силікагелі, використовуючи як елюент суміш цик(0,39 мМ) біс(трифенілфосфін)дихлорпаладію, 221 логексан/етилацетат (8/2; об./об.), з одержанням мг (0,79 мМ) триі(циклогексил)фосфіну, 3,08 г (19,7 0,74 г очікуваного продукту у вигляді твердої речомМ) метилового естеру 2-метил-2-(2вини білого кольору (вихід=48%). пропінілокси)пропанової кислоти і 15 мл третТ.пл.=112-124°С. бутиламіну. Реакційну суміш кип'ятять із зворотПідготовчий приклад 118 ним холодильником при слабкому кипінні протягом Метиловий естер 6-[2-[[(616 годин і потім охолоджують, гідролізують в 60 мл бензотіазоліл)сульфоніл]аміно]-5води і екстрагують 3x40 мл дихлорметану. Об'єд(трифторметил)феніл]-5-гексинової кислоти нані органічні фази промивають водою і потім суВикористовуючи методику, подібну до методишать над сульфатом магнію та концентрують при ки Підготовчого прикладу 105, та як вихідну сполузниженому тиску. Маслоподібний залишок очищаку - 6-бензотіазолсульфонілхлорид, очікуваний ють хроматографією на силікагелі, використовуюпродукт отримують у вигляді пасти оранжевого чи суміш дихлорметан/етилацетат (98/2; об./об.), з кольору (вихід=59%). 1 одержанням 1,84 г очікуваного продукту у вигляді Н ЯМР (ДМСОd6, 250 МГц) : = 1,62-1,73 (м, масла оранжевого кольору (вихід=83%). 2Н), 2,32 (т, 2Η), 2,39 (т, 2Η), 3,60 (с, 3H), 7,51 (д, 1 Н ЯМР (ДМСОd6, 250 МГц) : = 1,41 (с, 6Н), 1Н), 7,61-7,65 (м, 2Н), 7,89 (дд, 1Н), 8,23 (д, 1Н), 3,66 (с, 3H), 4,40 (с, 2Н), 5,22 (ш с, 2Н), 6,69 (д, 8,69 (с, 1Н), 9,62 (с, 1Н), 10,22 (с, 1Н). 1Н), 7,07 (дд, 1Н), 7,13 (д, 1Н). Підготовчий приклад 119 Підготовчий приклад 123 Метиловий естер 5-(трифторметил)-1H-індолМетиловий естер 2-[[3-[2-[[(62-бутанової кислоти бензотіазоліл)сульфоніл]аміно]-5-хлорфеніл]-2Використовуючи методику, подібну до методипропініл]окси]-2-метилпропанової кислоти ки Підготовчого прикладу 6, та як вихідну сполуку Використовуючи методику, подібну до методиестер, отриманий згідно з Підготовчим прикладом ки Підготовчого прикладу 117, та як вихідні сполу103, очікуваний продукт отримують у вигляді тверки - сполуку, отриману згідно з Підготовчим прикдої речовини бежевого кольору (вихід=36%). ладом 122, і 6-бензотіазолсульфонілхлорид, Т.пл.=115°С. очікуваний продукт отримують у вигляді масла Підготовчий приклад 120 жовтого кольору (вихід=53%). N-(4-хлор-2-йодофеніл)бензолсульфонамід 1 Готують розчин 2 г (7,89 мМ) 4-хлор-2Н ЯМР (ДМСОd6, 300 МГц) : = 1,63 (с, 6Н), йоданіліну в 30 мл піридину і при перемішуванні 3,67 (с, 3H), 4,14 (с, 2Н), 7,30 (д, 1Н), 7,38 (д, 1Н), додають 1,21 мл (9,5 мМ) бензолсульфонілхлори7,41 (дд, 1Н), 7,85 (дд, 1Н), 8,23 (д, 1Н), 8,62 (д, ду при 0°С. Потім реакційну суміш перемішують 1Н), 9,61 (с, 1Н), 10,05 (с, 1Н). при кімнатній температурі протягом 16 годин, після Підготовчий приклад 124 чого концентрують при зниженому тиску. МаслоМетиловий естер 2-[[3-[2-аміно-5подібний залишок переносять в 50 мл етилацета(трифторметил)феніл]-2-пропініл]окси]-2-метилту, і отриманий розчин промивають водою і потім пропанової кислоти сушать над сульфатом магнію та концентрують Використовуючи методику, подібну до методипри зниженому тиску. Аналіз сирого продукту поки Підготовчого прикладу 122, та як вихідну сполуказує наявність близько 12% N-(4-хлор-2ку - 2-йод-5-(трифторметил)анілін, очікуваний пройодофеніл)-Nдукт отримують у вигляді масла оранжевого (фенілсульфоніл)бензолсульфонаміду. Сирий кольору (вихід=80%). 1 продукт потому переносять в розчин в 60 мл діокН ЯМР (ДМСОd6, 300 МГц) : = 1,42 (с, 6Н), сану і обробляють 19 мл розчину 3 Μ гідроксиду 3,65 (с, 3H), 4,41 (с, 2Н), 6.08 (с, 2Н), 6,79 (д, 1Н), калію при слабкому кипінні із зворотним холоди7,34 (д, 1Н), 7,39 (с, 1Н). льником протягом 8 годин. Розчинник виділяють Підготовчий приклад 125 45 92025 46 Метиловий естер 2-[[3-[2-[[(6Т.пл.=166-168°С. бензотіазоліл)сульфоніл]аміно]-5Підготовчий приклад 130 (трифторметил)феніл]-2-пропініл]окси]-2Метиловий естер 6-[2-[[(1,3-бензодіоксол-5метилпропанової кислоти іл)сульфоніл]аміно]-5-(трифторметил)-феніл]-5Використовуючи методику, подібну до методигексинової кислоти ки Підготовчого прикладу 123, та як вихідні сполуВикористовуючи методику, подібну до методики - сполуку, отриману згідно з Підготовчим прикки Підготовчого прикладу 118, та як вихідну сполуладом 124, і 6-бензотіазолсульфонілхлорид, ку - 1,3-бензодіоксол-5-сульфонілхлорид, очікуваочікуваний продукт отримують у вигляді пасти жоний продукт отримують у вигляді масла втого кольору (вихід=23%). коричневого кольору, яке використовують на на1 ступній стадії без подальшого очищення (виН ЯМР (ДМСОd6, 300 МГц) : = 1,38 (с, 6Н), хід=73%). 3,67 (с, 3H), 4,25 (с, 2Н), 7,52 (д, 1Н), 7,66 (д, 2Н), Підготовчий приклад 131 7,94 (дд, 1Н), 8,24 (дд, 1Н), 8,72 (д, 1Н), 9,63 (с, Метиловий естер 5-[2-[[[2-(ацетиламіно)-61Н), 10,33 (с, 1Н). бензотіазоліл]сульфоніл]аміно]-5Підготовчий приклад 126 (трифторметил)феніл]-4-пентинової кислоти Метиловий естер 2-[[3-[2-[[(2-метил-6Використовуючи методику, подібну до методибензотіазоліл)сульфоніл]аміно]-5-хлорфеніл]-2ки Підготовчого прикладу 104, та як вихідну сполупропініл]окси]-2-метилпропанової кислоти ку 2-(ацетиламіно)-6Використовуючи методику, подібну до методибензотіазолсульфонілхлорид, очікуваний продукт ки Підготовчого прикладу 117, та як вихідні сполуотримують у вигляді масла коричневого кольору, ки - сполуку, отриману згідно з Підготовчим прикякий використовують на наступній стадії без подаладом 122, і 2-метил-6льшого очищення (вихід=66%). бензотіазолсульфонілхлорид, очікуваний продукт Підготовчий приклад 132 отримують у вигляді пасти жовтого кольору (виМетиловий естер 2-[[3-[2-[[(2-метил-5хід=58%). 1 бензотіазоліл)сульфоніл]аміно]-5Н ЯМР (ДМСОd6, 250 МГц) : = 1,36 (с, 6Н), (трифторметил)феніл]-2-пропініл]окси]-22,84 (с, 3H), 3,68 (с, 3H), 4,14 (с, 2Н), 7,28 (д, 1Н), метилпропанової кислоти 7,36 (д, 1Н), 7,40 (дд, 1Н), 7,78 (дд, 1Н), 8,03 (д, Використовуючи методику, подібну до методи1Н), 8,46 (д, 1Н), 9,96 (с, 1Н). ки Прикладу 3, та як вихідні сполуки - сполуку, Підготовчий приклад 127 отриману згідно з Підготовчим прикладом 124, та Метиловий естер 2-[[3-[2-[[(2-метил-52-метил-5-бензотіазолсульфонілхлорид, очікувабензотіазоліл)сульфоніл]аміно]-5-хлорфеніл]-2ний продукт отримують у вигляді масла оранжевопропініл]окси]-2-метилпропанової кислоти го кольору (вихід=16%). Використовуючи методику, подібну до методи1 Н ЯМР (ДМСОd6, 300 МГц) : = 10,30 (с, 1Н), ки Підготовчого прикладу 117, та як вихідні сполу8,27 (м, 2Н), 7,76 (дд, 1Н), 7,69 (м, 2Н), 7,53 (д, ки - сполуку, отриману згідно з Підготовчим прик1Н), 4,22 (с, 2Н), 3,67 (с, 3H), 2,83 (с, 3H), 1,39 (с, ладом 122, і 2-метил-56Н). бензотіазолсульфонілхлорид, очікуваний продукт Підготовчий приклад 133 отримують у вигляді масла жовтого кольору (виМетиловий естер 2-[[3-[2-[(1,3-бензодіоксол-5хід=45%). 1 ілсульфоніл)аміно]-5-(трифторметил)феніл]-2Н ЯМР (ДМСОd6, 300 МГц) : = 1,36 (с, 6Н), пропініл]окси]-2-метилпропанової кислоти 2,83 (с, 3H), 3,67 (с, 3H), 4,11 (с, 2Н), 7,30 (д, 1Н), Використовуючи методику, подібну до методи7,36 (д, 1Н), 7,41 (дд, 1Н), 7,66 (дд, 1Н), 8,18 (д, ки Прикладу 3, та як вихідні сполуки - сполуку, 1Н), 8,21 (д, 1Н), 10,01 (с, 1Н). отриману згідно з Підготовчим прикладом 124, і Підготовчий приклад 128 1,3-бензодіоксол-5-сульфонілхлорид, очікуваний Етиловий естер 2-[[3-(2-аміно-5-хлорфеніл)-2продукт отримують у вигляді масла жовтого копропініл]окси]пропанової кислоти льору (вихід=21%). Використовуючи методику, подібну до методи1 Н ЯМР (ДМСОd6, 250 МГц) : = 9,99 (с, 1Н), ки Підготовчого прикладу 122, та як вихідну сполу7,69 (м, 2Н), 7,47 (д, 1Н), 7,34 (м, 2Н), 7,04 (д, 1Н), ку - етиловий естер 2-(2-пропінілокси)пропанової 6,15 (с, 2Н), 4,37 (с, 2Н), 3,68 (с, 3H), 1,43 (с, 6Н). кислоти, очікуваний продукт отримують у вигляді Підготовчий приклад 134 масла оранжевого кольору (вихід=69%). 1 Метиловий естер 2-[[3-[2-[[[2-(ацетиламіно)-6Н ЯМР (ДМСОd6, 300 МГц) : = 1,19 (т, 3H), бензотіазоліл]сульфоніл]аміно]-51,31 (д, 3H), 4,13 (к, 2Н), 4,25 (к, 1Н), 4,42 (д, 1Н), (трифторметил)феніл]-2-пропініл]окси]-24,53 (д, 1Н), 5,56 (с, 2Н), 6,69 (д, 1Н), 7,08 (дд, 1Н), метилпропанової кислоти 7,14 (д, 1Н). Використовуючи методику, подібну до методиПідготовчий приклад 129 ки Прикладу 3, та як вихідні сполуки - сполуку, Етиловий естер 2-[[3-[2-[[(6отриману згідно з Підготовчим прикладом 124, та бензотіазоліл)сульфоніл]аміно]-5-хлорфеніл]-22-(ацетиламіно)-6-бензотіазолсульфонілхлорид, пропініл]окси]пропанової кислоти очікуваний продукт отримують у вигляді твердої Використовуючи методику, подібну до методиречовини білого кольору (вихід=63%). ки Підготовчого прикладу 123, та як вихідні сполуТ.пл.=104-106°С. ки - сполуку, отриману згідно з Підготовчим прикПідготовчий приклад 135 ладом 128, і 6-бензотіазолсульфонілхлорид, Метиловий естер 2-[[3-[2-[(2,3очікуваний продукт отримують у вигляді твердої дигідробензофуран-5-ілсульфоніл)аміно]-5речовини білого кольору (вихід=82%). 47 92025 48 (трифторметил)феніл]-2-пропініл]окси]-2Метиловий естер 2-[[3-[2-[[(3,5метилпропанової кислоти диметилфеніл)сульфоніл]аміно]-5Використовуючи методику, подібну до методи(трифторметил)феніл]-2-пропініл]окси]-2ки Прикладу 3, та як вихідні сполуки - сполуку, метилпропанової кислоти отриману згідно з Підготовчим прикладом 124, та Використовуючи методику, подібну до методи2,3-дигідро-5-бензофурансульфонілхлорид, очікуки Прикладу 3, та як вихідні сполуки - сполуку, ваний продукт отримують у вигляді масла жовтого отриману згідно з Підготовчим прикладом 124, та кольору (вихід=87%). 3,5-диметилбензолсульфонілхлорид, очікуваний 1 продукт отримують у вигляді твердої речовини Н ЯМР (ДМСОd6, 250 МГц) : = 9,88 (с, 1Н), бежевого кольору (вихід=70%). 7,68 (м, 3H), 7,61 (м, 1Н), 7,49 (дд, 1Н), 6,88 (д, Т.пл.=128-130°С. 1Н), 4,63 (т, 2Η), 4,38 (с, 2Н), 3,68 (с, 3H), 3,22 (т, Підготовчий приклад 141 2Η), 1,43 (с, 6Н). Метиловий естер 2-[[3-[2-[[(2,5Підготовчий приклад 136 диметоксифеніл)сульфоніл]аміно]-5Метиловий естер 2-[[3-[2-[[(2-метил-7(трифторметил)феніл]-2-пропініл]окси]-2бензотіазоліл)сульфоніл]аміно]-5метилпропанової кислоти (трифторметил)феніл]-2-пропініл]окси]-2Використовуючи методику, подібну до методиметилпропанової кислоти ки Прикладу 3, та як вихідні сполуки - сполуку, Використовуючи методику, подібну до методиотриману згідно з Підготовчим прикладом 124, та ки Прикладу 3, та як вихідні сполуки - сполуку, 2,5-диметоксибензолсульфонілхлорид, очікуваний отриману згідно з Підготовчим прикладом 124, та продукт отримують у вигляді масла жовтого ко2-метил-7-бензотіазолсульфонілхлорид, очікувальору (вихід=76%). ний продукт отримують у вигляді масла жовтого 1 кольору (вихід=44%). Н ЯМР (ДМСОd6, 300 МГц) : = 9,13 (с, 1Н), 1 7,13 (с, 1H), 7,66 (д, 1Η), 7,56 (д, 1Н), 7,32 (д, 1Н), Н ЯМР (ДМСОd6, 250 МГц) : = 10,57 (с, 1Н), 7,20 (дд, 1Н), 7,15 (д, 1Н), 4,42 (с, 2Н), 3,76 (с, 3H), 8,15 (д, 1Н), 7,75 (м, 1Н), 7,64 (м, 3H), 7,46 (д, 1Н), 3,74 (с, 3H), 3,68 (с, 3H), 1,42 (с, 6Н). 4,06 (с, 2Н), 3,68 (с, 3H), 2,79 (с, 3H), 1,37 (с, 6Н). Підготовчий приклад 142 Підготовчий приклад 137 Метиловий естер 2-[[3-[2-[[[4-(1Метиловий естер 2-[[3-[2-[[(2,3-дигідро-1,4метилетил)феніл]сульфоніл]аміно]-5бензодіоксин-6-іл)сульфоніл]аміно]-5(трифторметил)феніл]-2-пропініл]окси]-2(трифторметил)феніл]-2-пропініл]окси]-2метилпропанової кислоти метилпропанової кислоти Використовуючи методику, подібну до методиВикористовуючи методику, подібну до методики Прикладу 3, та як вихідні сполуки - сполуку, ки Прикладу 3, та як вихідні сполуки - сполуку, отриману згідно з Підготовчим прикладом 124, та отриману згідно з Підготовчим прикладом 124, і 4-(1-метилетил)бензолсульфонілхлорид, очікува2,3-дигідро-1,4-бензодіоксин-6-сульфонілхлорид, ний продукт отримують у вигляді масла жовтого очікуваний продукт отримують у вигляді пасти бекольору (вихід=77%). жевого кольору (вихід=79%). 1 1 Н ЯМР (ДМСОd6, 250 МГц) : = 10,08 (с, 1Н), Н ЯМР (ДМСОd6, 250 МГц) : = 9,98 (с, 1Н), 8,23 (д, 1Н), 8,03 (с, 1Н), 7,92 (дд, 1Н), 7,76 (д, 2Н), 7,68 (м, 2Н), 7,48 (д, 1Н), 7,31 (м, 2Н), 7,02 (д, 1Н), 7,67 (м, 2Н), 7,46 (м, 4Н), 4,33 (с, 2Н), 3,67 (с, 3H), 4,37 (с, 2Н), 4,29 (м, 4Н), 3,68 (с, 3H), 1,43 (с, 6Н). 2,96 (геп., 1Н), 1,42 (с, 6Н), 1,19 (д, 6Н). Підготовчий приклад 138 Підготовчий приклад 143 Метиловий естер 2-[[3-[2-[[(3,4-дигідро-4Метиловий естер 2-[[3-[2-[(1,3-бензодіоксол-5метил-2Н-1,4-бензоксазин-7-іл)сульфоніл]аміно]-5ілсульфоніл)аміно]-5-хлорфеніл]-2-пропініл]окси](трифторметил)феніл]-2-пропініл]окси]-22-метилпропанової кислоти метилпропанової кислоти Використовуючи методику, подібну до методиВикористовуючи методику, подібну до методики Прикладу 3, та як вихідні сполуки - сполуку, ки Прикладу 3, та як вихідні сполуки - сполуку, отриману згідно з Підготовчим прикладом 122, та отриману згідно з Підготовчим прикладом 124, і 1,3-бензодіоксол-5-сульфонілхлорид, очікуваний 3,4-дигідро-4-метил-2Н-1,4-бензоксазин-7продукт отримують у вигляді масла жовтого косульфонілхлорид, очікуваний продукт отримують у льору (вихід=55%). вигляді твердої речовини бежевого кольору (ви1 хід=69%). Н ЯМР (ДМСОd6, 250 МГц) : = 9,71 (с, 1Н), Т.пл.=98-100°С. 7,39 (м, 2Н), 7,23 (м, 3H), 7,02 (д, 1Н), 6,15 (с, 2Н), Підготовчий приклад 139 4,30 (с, 2Н), 3,67 (с, 3H), 1,42 (с, 6Н). Метиловий естер 2-[[3-[2-[[(1-ацетил-2,3Підготовчий приклад 144 дигідро-1H-індол-5-іл)сульфоніл]аміно]-5Метиловий естер 2-[[3-[2-[[[2-(ацетиламіно)-6(трифторметил)феніл]-2-пропініл]окси]-2бензотіазоліл]сульфоніл]аміно]-5-хлорфеніл]-2метилпропанової кислоти пропініл]окси]-2-метилпропанової кислоти Використовуючи методику, подібну до методиВикористовуючи методику, подібну до методики Прикладу 3, та як вихідні сполуки - сполуку, ки Прикладу 3, та як вихідні сполуки - сполуку, отриману згідно з Підготовчим прикладом 124, і 1отриману згідно з Підготовчим прикладом 122, і 2ацетил-2,3-дигідро-1H-індол-5-сульфонілхлорид, (ацетиламіно)-6-бензотіазолсульфонілхлорид, очікуваний продукт отримують у вигляді твердої очікуваний продукт отримують у вигляді твердої речовини бежевого кольору (вихід=44%). речовини жовтого кольору (вихід=50%). Т.пл.=134-136°С. Т.пл.=80°С. Підготовчий приклад 140 Підготовчий приклад 145 49 92025 50 Метиловий естер 2-[[3-[2-[[(1-ацетил-2,3вигляді твердої речовини бежевого кольору (видигідро-1H-індол-5-іл)сульфоніл]аміно]-5хід=69%). хлорфеніл]-2-пропініл]окси]-2-метилпропанової Т.пл.=98-100°С. кислоти Підготовчий приклад 150 Використовуючи методику, подібну до методиМетиловий естер 2-[[3-[5-хлор-2-[[[4-(1ки Прикладу 3, та як вихідні сполуки - сполуку, метилетил)феніл]сульфоніл]аміно]феніл]-2отриману згідно з Підготовчим прикладом 122, і 1пропініл]окси]-2-метилпропанової кислоти ацетил-2,3-дигідро-1H-індол-5-сульфонілхлорид, Використовуючи методику, подібну до методиочікуваний продукт отримують у вигляді пасти жоки Прикладу 3, та як вихідні сполуки - сполуку, втого кольору (вихід=44%). отриману згідно з Підготовчим прикладом 122, та 1 4-(1-метилетил)бензолсульфонілхлорид, очікуваН ЯМР (ДМСОd6, 300 МГц) : = 9,68 (с, 1Н), ний продукт отримують у вигляді твердої речовини 8,08 (д, 1Н), 7,54 (м, 2Н), 7,38 (м, 2Н), 7,27 (дд, бежевого кольору (вихід=86%). 1Н), 4,30 (с, 2Н), 4,13 (т, 2Η), 3,67 (с, 3H), 2,17 (с, Т.пл.=65-67°С. 3H), 1,41 (с, 6Н). Підготовчий приклад 151 Підготовчий приклад 146 Метиловий естер 2-[[3-[5-хлор-2-[[(3,5Метиловий естер 2-[[3-[5-хлор-2-[(2,3диметилфеніл)сульфоніл]аміно]феніл]-2дигідробензофуран-5-ілсульфоніл)аміно]феніл]-2пропініл]окси]-2-метилпропанової кислоти пропініл]окси]-2-метилпропанової кислоти Використовуючи методику, подібну до методиВикористовуючи методику, подібну до методики Прикладу 3, та як вихідні сполуки - сполуку, ки Прикладу 3, та як вихідні сполуки - сполуку, отриману згідно з Підготовчим прикладом 122, та отриману згідно з Підготовчим прикладом 122, і 3,5-диметилбензолсульфонілхлорид, очікуваний 2,3-дигідро-5-бензофурансульфонілхлорид, очікупродукт отримують у вигляді твердої речовини ваний продукт отримують у вигляді масла жовтого білого кольору (вихід=62%). кольору (вихід=49%). 1 Т.пл.=78-80°С. Н ЯМР (ДМСОd6, 300 МГц) : = 9,59 (с, 1Н), Підготовчий приклад 152 7,61 (д, 1Н), 7,48 (дд, 1Н), 7,39 (м, 2Н), 7,27 (д, 1Н), Метиловий естер 2-[[3-[5-хлор-2-[[(2,56,85 (д, 1Н), 4,62 (т, 2Η), 4,28 (с, 2Н), 3,64 (с, 3H), диметоксифеніл)сульфоніл]аміно]феніл]-23,21 (т, 2Η), 1,42 (с, 6Н). пропініл]окси]-2-метилпропанової кислоти Підготовчий приклад 147 Використовуючи методику, подібну до методиМетиловий естер 2-[[3-[5-хлор-2-[[(2-метил-7ки Прикладу 3, та як вихідні сполуки - сполуку, бензотіазоліл)сульфоніл]аміно]феніл]-2отриману згідно з Підготовчим прикладом 122, та пропініл]окси]-2-метилпропанової кислоти 2,5-диметоксибензолсульфонілхлорид, очікуваний Використовуючи методику, подібну до методипродукт отримують у вигляді масла жовтого коки Прикладу 3, та як вихідні сполуки - сполуку, льору (вихід=90%). отриману згідно з Підготовчим прикладом 122, і 21 Н ЯМР (ДМСОd6, 250 МГц) : = 8,93 (с, 1Н), метил-7-бензотіазолсульфонілхлорид, очікуваний 7,43 (д, 1Н), 7,35 (м, 2Н), 7,25 (д, 1Н), 7,17 (м, 2Н), продукт отримують у вигляді масла жовтого ко4,36 (с, 2Н), 3,77 (с, 3H), 3,73 (с, 3H), 3,68 (с, 3H), льору (вихід=33%). 1 1,41 (с, 6Н). Н ЯМР (ДМСОd6, 300 МГц) : = 10,30 (с, 1Н), Підготовчий приклад 153 8,14 (дд, 1Н), 7,64 (м, 2Н), 7,41 (дд, 1Н), 7,32 (д, Метиловий естер 2-[[3-[5-хлор-2-[[(41Н), 7,26 (д, 1Н), 3,91 (с, 2Н), 3,67 (с, 3H), 2,79 (с, метоксифеніл)сульфоніл]аміно]феніл]-23H), 1,34 (с, 6Н). пропініл]окси]-2-метилпропанової кислоти Підготовчий приклад 148 Використовуючи методику, подібну до методиМетиловий естер 2-[[3-[5-хлор-2-[[(2,3-дигідроки Прикладу 3, та як вихідні сполуки - сполуку, 1,4-бензодіоксин-6-іл)сульфоніл]аміно]феніл]-2отриману згідно з Підготовчим прикладом 122, та пропініл]окси]-2-метилпропанової кислоти 4-метоксибензолсульфонілхлорид, очікуваний Використовуючи методику, подібну до методипродукт отримують у вигляді твердої речовини ки Прикладу 3, та як вихідні сполуки - сполуку, бежевого кольору (вихід=83%). отриману згідно з Підготовчим прикладом 122, і Т.пл.=98-100°С. 2,3-дигідро-1,4-бензодіоксин-6-сульфонілхлорид, Підготовчий приклад 154 очікуваний продукт отримують у вигляді масла Етиловий естер 2-[[3-[5-хлор-2-[[(2-метил-6жовтого кольору (вихід=94%). 1 бензотіазоліл)сульфоніл]аміно]феніл]-2Н ЯМР (ДМСОd6, 250 МГц) : = 9,70 (с, 1Н), пропініл]окси]пропанової кислоти 7,40 (м, 2Н), 7,24 (м, 3H), 6,97 (д, 1Н), 4,28 (м, 6Н), Використовуючи методику, подібну до методи3,67 (с, 3H), 1,41 (с, 6Н). ки Прикладу 3, та як вихідні сполуки - сполуку, Підготовчий приклад 149 отриману згідно з Підготовчим прикладом 128, та Метиловий естер 2-[[3-[5-хлор-2-[[(3,4-дигідро2-метил-6-бензотіазолсульфонілхлорид, очікува4-метил-2H-1,4-бензоксазин-7ний продукт отримують у вигляді пасти жовтого іл)сульфоніл]аміно]феніл]-2-пропініл]окси]-2кольору (вихід=49%). метилпропанової кислоти 1 Н ЯМР (ДМСОd6, 300 МГц) : = 10,04 (с, 1Н), Використовуючи методику, подібну до методи8,45 (д, 1Н), 8,03 (д, 1Н), 7,78 (дд, 1Н), 7,41 (м, 2Н), ки Прикладу 3, та як вихідні сполуки - сполуку, 7,27 (дд, 1Н), 4,34 (д, 1Н), 4,16 (м, 4Н), 2,83 (с, 3H), отриману згідно з Підготовчим прикладом 122, і 1,29 (д, 3H), 1,19 (т, 3H). 3,4-дигідро-4-метил-2Н-1,4-бензоксазин-7Підготовчий приклад 155 сульфонілхлорид, очікуваний продукт отримують у 51 92025 52 Етиловий естер 2-[[3-[5-хлор-2-[[(2,3-дигідродукт отримують у вигляді масла оранжевого ко1,4-бензодіоксин-6-іл)сульфоніл]аміно]феніл]-2льору (вихід=82%). 1 пропініл]окси]пропанової кислоти Н ЯМР (ДМСОd6, 300 МГц) : = 7,42 (д, 1Н), Використовуючи методику, подібну до методи7,35 (дд, 1Н), 6,80 (д, 1Н), 6,11 (с, 2Н), 4,54 (д, 1Н), ки Прикладу 3, та як вихідні сполуки - сполуку, 4,43 (д, 1Н), 4,27 (к, 1Н), 4,11 (м, 2Н), 1,32 (д, 3H), отриману згідно з Підготовчим прикладом 128, і 1,20 (т, 3H). 2,3-дигідро-1,4-бензодіоксин-6-сульфонілхлорид, Підготовчий приклад 160 очікуваний продукт отримують у вигляді масла Етиловий естер 2-[[3-[2-[[(2-метил-6жовтого кольору (вихід=65%). бензотіазоліл)сульфоніл]аміно]-51 Н ЯМР (ДМСОd6, 300 МГц) : = 9,78 (с, 1Н), (трифторметил)феніл]-2-пропініл]окси]пропанової 7,43 (дд, 2Н), 7,25 (д, 1Н), 7,19 (м, 2Н), 6,97 (д, 1Н), кислоти 4,45 (д, 1Н), 4,29 (м, 6Н), 4,14 (м, 2Н), 1,33 (д, 3H), Використовуючи методику, подібну до методи1,21 (т, 3H). ки Прикладу 3, та як вихідні сполуки - сполуку, Підготовчий приклад 156 отриману згідно з Підготовчим прикладом 159, та Етиловий естер 2-[[3-[5-хлор-2-[[(3,4-дигідро-42-метил-6-бензотіазолсульфонілхлорид, очікуваметил-2Н-1,4-бензоксазин-7ний продукт отримують у вигляді масла жовтого іл)сульфоніл]аміно]феніл]-2кольору (вихід=44%). 1 пропініл]окси]пропанової кислоти Н ЯМР (ДМСОd6, 300 МГц) : = 10,33 (с, 1Н), Використовуючи методику, подібну до методи8,55 (д, 1Н), 8,06 (д, 1Н), 7,87 (дд, 1Н), 6,68 (м, 2Н), ки Прикладу 3, та як вихідні сполуки - сполуку, 7,50 (д, 1Н), 4,43 (д, 1Н), 4,26 (м, 2Н), 4,15 (м, 2Н), отриману згідно з Підготовчим прикладом 128, та 2,84 (с, 3H), 1,31 (д, 3H), 1,20 (т, 3H). 3,4-дигідро-4-метил-2Н-1,4-бензоксазин-7Підготовчий приклад 161 сульфонілхлорид, очікуваний продукт отримують у Етиловий естер 2-[[3-[2-[[(6вигляді масла жовтого кольору (вихід=63%). бензотіазоліл)сульфоніл]аміно]-51 Н ЯМР (ДМСОd6, 300 МГц) : = 9,57 (с, 1Н), (трифторметил)феніл]-2-пропініл]окси]пропанової 7,41 (м, 2Н), 7,26 (д, 1Н), 6,93 (м, 2Н), 6,74 (д, 1Н), кислоти 4,45 (д, 1Н), 4,26 (м, 4Н), 4,15 (м, 2Н), 3,26 (м, 2Н), Використовуючи методику, подібну до методи2,79 (с, 3H), 1,32 (д, 3H), 1,21 (т, 3H). ки Прикладу 3, та як вихідні сполуки - сполуку, Підготовчий приклад 157 отриману згідно з Підготовчим прикладом 159, і 6Етиловий естер 2-[[3-[5-хлор-2-[[(3,5-диметилбензотіазолсульфонілхлорид, очікуваний продукт 4-ізоксазоліл)сульфоніл]аміно]феніл]-2отримують у вигляді твердої речовини блідопропініл]окси]пропанової кислоти жовтого кольору (вихід=28%). Використовуючи методику, подібну до методиТ.пл.=112-114°С. ки Прикладу 3, та як вихідні сполуки - сполуку, Підготовчий приклад 162 отриману згідно з Підготовчим прикладом 128, і Етиловий естер 2-[[3-[2-[[(2,3-дигідро-1,43,5-диметил-4-ізоксазолсульфонілхлорид, очікувабензодіоксин-6-іл)сульфоніл]аміно]-5ний продукт отримують у вигляді масла жовтого (трифторметил)феніл]-2-пропініл]окси]пропанової кольору (вихід=30%). кислоти 1 Використовуючи методику, подібну до методиН ЯМР (ДМСОd6, 300 МГц) : = 10,29 (с, 1Н), ки Прикладу 3, та як вихідні сполуки - сполуку, 7,52 (м, 2Н), 7,37 (д, 1Н), 4,43 (д, 1Н), 4,26 (м, 2Н), отриману згідно з Підготовчим прикладом 159, і 4,15 (м, 2Н), 2,27 (с, 3H), 2,16 (с, 3H), 1,32 (д, 3H), 2,3-дигідро-1,4-бензодіоксин-6-сульфонілхлорид, 1,22 (т, 3H). очікуваний продукт отримують у вигляді масла Підготовчий приклад 158 жовтого кольору (вихід=68%). Етиловий естер 2-[[3-[5-хлор-2-[[(2,51 Н ЯМР (ДМСОd6, 300 МГц) : = 10,07 (с, 1Н), диметоксифеніл)сульфоніл]аміно]феніл]-2пропініл]окси]пропанової кислоти 7,70 (м, 2Н), 7,48 (д, 1Н), 7,29 (м, 2Н), 7,00 (д, 1Н), Використовуючи методику, подібну до методи4,51 (д, 1Н), 4,38 (д, 1Н), 4,31 (м, 5Н), 4,16 (м, 2Н), ки Прикладу 3, та як вихідні сполуки - сполуку, 1,34 (д, 3H), 1,20 (т, 3H). отриману згідно з Підготовчим прикладом 128, та Підготовчий приклад 163 2,5-диметоксибензолсульфонілхлорид, очікуваний Етиловий естер 2-[[3-[2-[[(3,4-дигідро-4-метилпродукт отримують у вигляді масла жовтого ко2Н-1,4-бензоксазин-7-іл)сульфоніл]аміно]-5льору (вихід=62%). (трифторметил)феніл]-2-пропініл]окси]пропанової 1 кислоти Н ЯМР (ДМСОd6, 300 МГц) : = 9,11 (с, 1Н), Використовуючи методику, подібну до методи7,46 (д, 1Н), 7,37 (д, 1Н), 7,29 (м, 1Н), 7,24 (м, 1Н), ки Прикладу 3, та як вихідні сполуки - сполуку, 7,16 (м, 2Н), 4,49 (д, 1Н), 4,36 (д, 1Н), 4,24 (к, 1Н), отриману згідно з Підготовчим прикладом 159, і 4,16 (м, 2Н), 3,75 (с, 3H), 3,72 (с, 3H), 1,31 (д, 3H), 3,4-дигідро-4-метил-2H-1,4-бензоксазин-71,21 (т, 3H). сульфонілхлорид, очікуваний продукт отримують у Підготовчий приклад 159 вигляді масла жовтого кольору (вихід=57%). Етиловий естер 2-[[3-[2-аміно-51 (трифторметил)феніл]-2-пропініл]окси]пропанової Н ЯМР (ДМСОd6, 300 МГц) : = 9,88 (с, 1Н), кислоти 7,69 (м, 2Н), 7,49 (д, 1Н), 7,02 (м, 2Н), 7,78 (д, 1Н), Використовуючи методику, подібну до методи4,51 (д, 1Н), 4,37 (д, 1Н), 4,28 (м, 3H), 4,15 (м, 2Н), ки Підготовчого прикладу 122, та як вихідні сполу3,27 (м, 2Н), 2,80 (с, 3H), 1,33 (д, 3H), 1,20 (т, 3H). ки - сполуку, отриману згідно з Підготовчим прикПідготовчий приклад 164 ладом 4, та етиловий естер 2-(2Етиловий естер 2-[[3-[2-[[(2,5пропінілокси)пропанової кислоти, очікуваний продиметоксифеніл)сульфоніл]аміно]-5 53 92025 54 (трифторметил)феніл]-2-пропініл]окси]пропанової Мети;ловий естер (2R)-2-[[3-[5-хлор-2-[[(6кислоти бензотіазоліл)сульфоніл]аміно]феніл]-2Використовуючи методику, подібну до методипропініл]окси]пропанової кислоти ки Прикладу 3, та як вихідні сполуки - сполуку, Використовуючи методику, подібну до методиотриману згідно з Підготовчим прикладом 159, та ки Прикладу 3, та як вихідні сполуки - сполуку, 2,5-диметоксибензолсульфонілхлорид, очікуваний отриману згідно з Підготовчим прикладом 167, і 6продукт отримують у вигляді масла жовтого кобензотіазолсульфонілхлорид, очікуваний продукт льору (вихід=65%). отримують у вигляді твердої речовини білого ко1 льору (вихід=65%). Н ЯМР (ДМСОd6, 250 МГц) : = 9,29 (с, 1Н), Т.пл.=136°С. 7,74 (с, 1Н), 7,67 (д, 1Н), 7,56 (д, 1Н), 7,31 (д, 1Н), Підготовчий приклад 169 7,18 (м, 2Н), 4,55 (д, 1Н), 4,41 (д, 1Н), 4,25 (к, 1Н), Метиловий естер 6-[5-хлор-2-[[(2-метил-74,13 (м, 2Н), 3,74 (с, 6Н), 1,32 (д, 3H), 1,20 (т, 3H). бензотіазоліл)сульфоніл]аміно]феніл]-5-гексинової Підготовчий приклад 165 кислоти Етиловий естер (28)-2-[[3-[2-аміно-5Використовуючи методику, подібну до методихлорфеніл]-2-пропініл]окси]пропанової кислоти ки Підготовчого прикладу 55, та як вихідну сполуку а)Етиловий естер (2S)-2-(2- 2-метил-7-бензотіазолсульфонілхлорид, очікувапропінілокси)пропанової кислоти: Цю сполуку ний продукт отримують у вигляді масла коричнеотримують з виходом 24% взаємодією пропаргілбвого кольору (вихід=97%). роміду з етиловим естером (S)-(-)-молочної кисло1 ти, який заздалегідь обробляють гідридом натрію в Н ЯМР (ДМСОd6, 300 МГц) : = 10,21 (с, 1H), тетрагідрофурані (т.кип.=70-73°С при тиску 13 8,13 (м, 1Η), 7,60 (м, 2Н), 7,38 (дд, 1Н), 7,28 (м, гПа). 2Н), 3,61 (с, 3H), 2,78 (с, 3H), 2,33 (т, 2Η), 2,04 (т, b)- Використовуючи методику, подібну до ме2Η), 1,55 (квін., 2Н). тодики Підготовчого прикладу 122, та як вихідну Підготовчий приклад 170 сполуку етиловий естер (2S)-2-(2Метиловий естер 6-[2-[[(1-ацетил-1H-індол-5-іл пропінілокси)пропанової кислоти, очікуваний про)сульфоніл]аміно]-5-хлорфеніл]-5-гексинової кисдукт отримують у вигляді масла жовтого кольору лоти (вихід=99%). Використовуючи методику, подібну до методи1 ки Підготовчого прикладу 55, та як вихідну сполуку Н ЯМР (ДМСОd6, 300 МГц) : = 7,14 (д, 1H). - 1-ацетил-1H-індол-5-сульфонілхлорид, очікува7,08 (дд, 1Н), 6,69 (д, 1Н), 5,56 (с, 2Н), 4,53 (д, 1Н), ний продукт отримують у вигляді масла коричне4,42 (д, 1Н), 4,25 (к, 1Н), 4,13 (м, 2Н), 1,30 (д, 3H), вого кольору (вихід=79%). 1,21 (т, 3H). 1 Н ЯМР (ДМСОd6, 300 МГц) : = 9,72 (с, 1Н), Підготовчий приклад 166 Етиловий естер (25)-2-[[3-[5-хлор-2-[[(68,42 (д, 1Н), 8,00 (д, 1Н), 7,99 (д, 1Н), 7,62 (дд, 1Н), бензотіазоліл)сульфоніл]аміно]феніл]-27,33 (м, 3H), 6,87 (д, 1Н), 3,59 (с, 3H), 2,67 (с, 3H), пропініл]окси]пропанової кислоти 2,35 (т, 2Η), 2,27 (т, 2Η), 1,64 (квін., 2Н). Використовуючи методику, подібну до методиПідготовчий приклад 171 ки Прикладу 3, та як вихідні сполуки - сполуку, Метиловий естер 5-[5-хлор-2-[[(2-метил-7отриману згідно з Підготовчим прикладом 165, і 6бензотіазоліл)сульфоніл]аміно]феніл]-4бензотіазолсульфонілхлорид, очікуваний продукт пентинової кислоти отримують у вигляді твердої речовини білого коВикористовуючи методику, подібну до методильору (вихід=43%). ки Прикладу 3, та як вихідні сполуки - сполуку, 1 отриману згідно з Підготовчим прикладом 2, та 2Н ЯМР (ДМСОd6, 300 МГц) : = 10,11 (с, 1Н), метил-7-бензотіазолсульфонілхлорид, очікуваний 9,61 (с, 1Н), 8,60 (д, 1Н), 8,22 (д, 1Н), 7,84 (дд, 1Н), продукт отримують у вигляді аморфної твердої 7,40 (м, 2Н), 7,30 (д, 1Н), 4,32 (д, 1Н), 4,15 (м, 4Н), речовини (вихід=45%). 1,28 (д, 3H), 1,21 (т, 3H). 1 Н ЯМР (ДМСОd6, 300 МГц) : = 10,15 (с, 1Н), Підготовчий приклад 167 Метиловий естер (2R)-2-[[3-[2-аміно-58,15 (м, 1Н), 7,60 (м, 2Н), 7,40 (дд, 1Н), 7,31 (д, хлорфеніл]-2-пропініл]окси]пропанової кислоти 1Н), 7,23 (д, 1Н), 3,63 (с, 3H), 2,79 (с, 3H), 2,37 (м, а)Метиловий естер (2R)-2-(22Н), 2,25 (м, 2Н). пропінілокси)пропанової кислоти: Цю сполуку Підготовчий приклад 172 отримують з виходом 9,5% взаємодією пропаргілМетиловий естер 5-[2-[[(2-аміно-6броміду з метиловим естером (R)-(+)-молочної бензоксазоліл)сульфоніл]аміно]-5-хлорфеніл]-4кислоти, який заздалегідь обробляють гідридом пентинової кислоти натрію в тетрагідрофурані (т.кип.=81-88°С при атВикористовуючи методику, подібну до методимосферному тиску). ки Прикладу 3, та як вихідні сполуки - сполуку, b)- Використовуючи методику, подібну до меотриману згідно з Підготовчим прикладом 2 і 2тодики Підготовчого прикладу 122, та як вихідну аміно-6-бензоксазолсульфонілхлорид, очікуваний сполуку метиловий естер (2R)-2-(2продукт отримують у вигляді твердої речовини пропінілокси)пропанової кислоти, очікуваний пробілого кольору (вихід=9%). дукт отримують у вигляді масла жовтого кольору Т.пл.=170-171°С. (вихід=89%). Підготовчий приклад 173 1 Метиловий естер 5-[5-хлор-2-[[(2,3-дигідро-5Н ЯМР (ДМСОd6, 300 МГц) : = 7,14 (д, 1Н), бензофураніл)сульфоніл]аміно]феніл]-47,08 (дд, 1Н), 6,69 (д, 1Н), 5,57 (с, 2Н), 4,53 (д, 1Н), пентинової кислоти 4,41 (д, 1Н), 4,25 (к, 1Н), 3,66 (с, 3H), 1,31 (д, 3H). Підготовчий приклад 168 55 92025 56 Використовуючи методику, подібну до методиМетиловий естер 1-(фенілсульфоніл)-1Нки Прикладу 3 та як вихідні сполуки - сполуку, індол-2-пропанової кислоти отриману згідно з Підготовчим прикладом 2, та Використовуючи методику, подібну до методи2,3-дигідро-5-бензофурансульфонілхлорид, очікуки Прикладу 1, та як вихідну сполуку - сполуку, ваний продукт отримують у вигляді аморфної твеотриману згідно з Підготовчим прикладом 24, очірдої речовини (вихід=98%). куваний продукт отримують у вигляді твердої ре1 човини білого кольору (вихід=75%). Н ЯМР (ДМСОd6, 300 МГц) : = 9.39 (с, 1Н), Т.пл.=95-99°С. 7,60 (д, 1Н), 7,44 (дд, 1Н), 7,31 (м, 3H), 6,85 (д, 1Н), Приклад 10 4,62 (т, 2Н), 3,65 (с, 3H), 3,21 (т, 2Н), 2,60 (м, 4Н). 1-(Фенілсульфоніл)-1H-індол-2-пропанова кисПідготовчий приклад 174 лота Метиловий естер 5-[2-[[(2-аміно-6Використовуючи методику, подібну до методибензотіазоліл)сульфоніл]аміно]-5-хлорфеніл]-4ки Прикладу 2, та як вихідну сполуку - сполуку, пентинової кислоти отриману згідно з Прикладом 9, очікуваний проВикористовуючи методику, подібну до методидукт отримують у вигляді твердої речовини білого ки Прикладу 3, та як вихідні сполуки - сполуку, кольору (вихід=99%). отриману згідно з Підготовчим прикладом 2, та 2Т.пл.=180-185°С. аміно-6-бензотіазолсульфонілхлорид, очікуваний Приклад 11 продукт отримують у вигляді твердої речовини Метиловий естер 5-хлор-1-[(4білого кольору (вихід=93%). метилфеніл)сульфоніл]-1H-індол-2-пропанової Т.пл.=175°С. кислоти Підготовчий приклад 175 Використовуючи методику, подібну до методиN-(2-Бром-4-метилфеніл)-6ки Прикладу 1, та як вихідну сполуку - сполуку, бензотіазолсульфонамід отриману згідно з Підготовчим прикладом 25, очіВикористовуючи методику, подібну до методикуваний продукт отримують у вигляді твердої реки Прикладу 3, та як вихідні сполуки - 2-бром-4човини бежевого кольору (вихід=89%). метиланілін і 6-бензотіазолсульфонілхлорид, очіТ.пл.=100-103°С. куваний продукт отримують у вигляді твердої реПриклад 12 човини оранжевого кольору (вихід=76%). 5-Хлор-1-[(4-метилфеніл)сульфоніл]-1H-індолТ.пл.=171-174°С. 2-пропанова кислота Підготовчий приклад 176 Використовуючи методику, подібну до методиN-(2-Бром-4-метилфеніл)бензолсульфонамід ки Прикладу 2, та як вихідну сполуку - сполуку, Використовуючи методику, подібну до методиотриману згідно з Прикладом 11, очікуваний проки Підготовчого прикладу 120, та як вихідну сполудукт отримують у вигляді твердої речовини бежеку - 2-бром-4-метиланілін, очікуваний продукт вого кольору (вихід=93%). отримують у вигляді твердої речовини бежевого Т.пл.=165-168°С. кольору (вихід=95%). 1 Приклад 13 Н ЯМР (ДМСОd6, 250 МГц) : = 9,75 (с, 1Н), Метиловий естер 5-хлор-1-[(2,37,69 (м, 3H), 7,63 (м, 2Н), 7,40 (с, 1Н), 7,09 (д, 1Н), дихлорфеніл)сульфоніл]-1Н-індол-2-пропанової 7,02 (д, 1Н), 2,23 (с, 3H). кислоти Підготовчий приклад 177 Використовуючи методику, подібну до методиN-(4-Хлор-2-йодофеніл)-6ки Прикладу 1, та як вихідну сполуку - сполуку, бензотіазолсульфонамід отриману згідно з Підготовчим прикладом 26, очіВикористовуючи методику, подібну до методикуваний продукт отримують у вигляді масла жовки Підготовчого прикладу 120, та як вихідну сполутого кольору (вихід=96%). ку - 6-бензотіазолсульфонілхлорид, та використо1 Н ЯМР (ДМСОd6, 300 МГц) : = 2,77 (т, 2Н), вуючи в реакції фторид тетрабутиламонію в ТГФ 3,15 (т, 2Н), 3,59 (с, 3H), 6,65 (с, 1Н), 7,26 (дд, 1Н), для видалення диконденсованої сполуки, очікува7,67 (м, 3H), 7,84 (дд, 1Н), 8,04 (дд, 1Н). ний продукт отримують у вигляді твердої речовини Приклад 14 жовтого кольору (вихід=91%). 5-Хлор-1-[(2,3-дихлорфеніл)сульфоніл]-1HТ.пл.=162°С. індол-2-пропанова кислота Підготовчий приклад 178 Використовуючи методику, подібну до методиМетиловий естер 6-[5-хлор-2-[[(4-фтор-3ки Прикладу 2, та як вихідну сполуку - сполуку, нітрофеніл)сульфоніл]аміно]феніл]-5-гексинової отриману згідно з Прикладом 13, очікуваний прокислоти дукт отримують у вигляді твердої речовини білого Використовуючи методику, подібну до методикольору (вихід=76%). ки Підготовчого прикладу 55, та як вихідну сполуку Т.пл.=163-166°С. - 4-фтор-3-нітробензолсульфонілхлорид, та викоПриклад 15 ристовуючи триетиламін як основний агент, очікуМетиловий естер 5-хлор-1-[(3ваний продукт отримують у вигляді масла оранжеметилфеніл)сульфоніл]-1H-індол-2-пропанової вого кольору (вихід=98%). 1 кислоти Н ЯМР (ДМСОd6, 300 МГц) : = 10,31 (с, 1Н), Використовуючи методику, подібну до методи8,38 (дд, 1Н), 8,00 (м, 1Н), 7,81 (дд, 1Н), 7,41 (с, ки Прикладу 1, та як вихідну сполуку - сполуку, 1Н), 7,38 (м, 1Н), 7,23 (м, 1Н), 3,60 (с, 3H), 2,41 (т, отриману згідно з Підготовчим прикладом 27, очі2Н), 2,34 (т, 2Н), 1,68 (квін., 2Н). куваний продукт отримують у вигляді твердої реПриклад 9 човини бежевого кольору (вихід=68%). 57 92025 58 Т.пл.=105-108°С. дукт отримують у вигляді твердої речовини білого Приклад 16 кольору (вихід=86%). 5-Хлор-1-[(3-метилфеніл)сульфоніл]-1H-індолТ.пл.=95-98°С. 2-пропанова кислота Приклад 23 Використовуючи методику, подібну до методиМетиловий естер 1-[(4ки Прикладу 2, та як вихідну сполуку - сполуку, ацетилфеніл)сульфоніл]-5-хлор-1H-індол-2отриману згідно з Прикладом 15, очікуваний пропропанової кислоти дукт отримують у вигляді твердої речовини білого Використовуючи методику, подібну до методикольору (вихід=92%). ки Прикладу 1, та як вихідну сполуку - сполуку, Т.пл.=161-165°С. отриману згідно з Підготовчим прикладом 31, очіПриклад 17 куваний продукт отримують у вигляді твердої реМетиловий естер 5-хлор-1-[(2,4човини жовтого кольору (вихід=93%). дихлорфеніл)сульфоніл]-1H-індол-2-пропанової Т.пл.=83-87°С. кислоти Приклад 24 Використовуючи методику, подібну до методи1-[(4-Ацетилфеніл)сульфоніл]-5-хлор-1Hки Прикладу 1, та як вихідну сполуку - сполуку, індол-2-пропанова кислота отриману згідно з Підготовчим прикладом 28, очіВикористовуючи методику, подібну до методикуваний продукт отримують у вигляді масла жовки Прикладу 2, та як вихідну сполуку - сполуку, того кольору (вихід=83%). отриману згідно з Прикладом 23, очікуваний про1 дукт отримують у вигляді твердої речовини жовтоН ЯМР (ДМСОd6, 300 МГц) : = 2,76 (т, 2Н), го кольору (вихід=70%). 3,15 (т, 2Н), 3,59 (с, 3H), 6,63 (с, 1Н), 7,26 (дд, 1H), Т.пл.=159-161°С. 7,71 (м, 3H), 7,94 (м, 2Н). Приклад 25 Приклад 18 Метиловий естер 5-хлор-1-[(45-Хлор-1-[(2,4-дихлорфеніл)сульфоніл]-1Hфенілфеніл)сульфоніл]-1H-індол-2-пропанової індол-2-пропанова кислота кислоти Використовуючи методику, подібну до методиВикористовуючи методику, подібну до методики Прикладу 2, та як вихідну сполуку - сполуку, ки Прикладу 1, та як вихідну сполуку - сполуку, отриману згідно з Прикладом 17, очікуваний проотриману згідно з Підготовчим прикладом 32, очідукт отримують у вигляді твердої речовини білого куваний продукт отримують у вигляді масла жовкольору (вихід=76%). того кольору (вихід=58%). Т.пл.=179-181°С. 1 Приклад 19 Н ЯМР (ДМСОd6, 250 МГц) : = 2,84 (т, 2Н), Метиловий естер 5-хлор-1-[[43,37 (т, 2Н), 3,62 (с, 3H), 6,62 (с, 1Н), 7,34 (дд, 1Н), (трифторметил)феніл]сульфоніл]-1H-індол-27,47 (м, 3H), 7,61 (с, 1Н), 7,68 (дд, 2Н), 7,88 (д, 4Н), пропанової кислоти 8,07 (д, 1Н). Використовуючи методику, подібну до методиПриклад 26 ки Прикладу 1, та як вихідну сполуку - сполуку, 5-Хлор-1-[(4-фенілфеніл)сульфоніл]-1H-індолотриману згідно з Підготовчим прикладом 29, очі2-пропанова кислота куваний продукт отримують у вигляді твердої реВикористовуючи методику, подібну до методичовини жовтого кольору (вихід=97%). ки Прикладу 2, та як вихідну сполуку - сполуку, Т.пл.=82-86°С. отриману згідно з Прикладом 25, очікуваний проПриклад 20 дукт отримують у вигляді твердої речовини білого 5-Хлор-1-[[4-(трифторметил)феніл]сульфоніл]кольору (вихід=78%). 1H-індол-2-пропанова кислота Т.пл.=160-162°С. Використовуючи методику, подібну до методиПриклад 27 ки Прикладу 2, та як вихідну сполуку - сполуку, Метиловий естер 5-хлор-1-[(3отриману згідно з Прикладом 19, очікуваний прометоксифеніл)сульфоніл]-1H-індол-2-пропанової дукт отримують у вигляді твердої речовини бежекислоти вого кольору (вихід=78%). Використовуючи методику, подібну до методиТ.пл.=179-182°С. ки Прикладу 1, та як вихідну сполуку - сполуку, Приклад 21 отриману згідно з Підготовчим прикладом 34, очіМетиловий естер 5-хлор-1-[(4куваний продукт отримують у вигляді твердої реметоксифеніл)сульфоніл]-1H-індол-2-пропанової човини жовтого кольору (вихід=63%). кислоти Т.пл.=106-109°С. Використовуючи методику, подібну до методиПриклад28 ки Прикладу 1, та як вихідну сполуку - сполуку, 5-Хлор-1-[(3-метоксифеніл)сульфоніл]-1Hотриману згідно з Підготовчим прикладом 30, очііндол-2-пропанова кислота куваний продукт отримують у вигляді твердої реВикористовуючи методику, подібну до методичовини жовтого кольору (вихід=68%). ки Прикладу 2, та як вихідну сполуку - сполуку, Т.пл.=98-99°С. отриману згідно з Прикладом 27, очікуваний проПриклад 22 дукт отримують у вигляді твердої речовини білого 5-Хлор-1-[(4-метоксифеніл)сульфоніл]-1Hкольору (вихід=62%). індол-2-пропанова кислота Т.пл.=182-184°С. Використовуючи методику, подібну до методиПриклад 29 ки Прикладу 2, та як вихідну сполуку - сполуку, отриману згідно з Прикладом 21, очікуваний про 59 92025 60 Метиловий естер 5-хлор-1-[(2,5Використовуючи методику, подібну до методидиметоксифеніл)сульфоніл]-1H-індол-2ки Прикладу 1, та як вихідну сполуку - сполуку, пропанової кислоти отриману згідно з Підготовчим прикладом 38, очіВикористовуючи методику, подібну до методикуваний продукт отримують у вигляді твердої реки Прикладу 1, та як вихідну сполуку - сполуку, човини білого кольору (вихід=58%). отриману згідно з Підготовчим прикладом 35, очіТ.пл.=90-94°С. куваний продукт отримують у вигляді твердої реПриклад 36 човини жовтого кольору (вихід=85%). 5-Хлор-1-[[4-(1-метилетил)феніл]сульфоніл]Т.пл.=120-124°С. 1H-iндол-2-пропанова кислота Приклад 30 Використовуючи методику, подібну до методи5-Хлор-1-[(2,5-диметоксифеніл)сульфоніл]-1Hки Прикладу 2, та як вихідну сполуку - сполуку, індол-2-пропанова кислота отриману згідно з Прикладом 35, очікуваний проВикористовуючи методику, подібну до методидукт отримують у вигляді твердої речовини білого ки Прикладу 2, та як вихідну сполуку - сполуку, кольору (вихід=70%). отриману згідно з Прикладом 29, очікуваний проТ.пл.=150-154°С. дукт отримують у вигляді твердої речовини білого Приклад 37 кольору (вихід=88%). Метиловий естер 5-хлор-1-[(4Т.пл.=185-189°С. пропілфеніл)сульфоніл]-1H-індол-2-пропанової Приклад 31 кислоти Метиловий естер 5-хлор-1-[[4-(1,1Використовуючи методику, подібну до методидиметилетил)феніл]сульфоніл]-1Н-індол-2ки Прикладу 1, та як вихідну сполуку - сполуку, пропанової кислоти отриману згідно з Підготовчим прикладом 39, очіВикористовуючи методику, подібну до методикуваний продукт отримують у вигляді твердої реки Прикладу 1, та як вихідну сполуку - сполуку, човини білого кольору (вихід=87%). отриману згідно з Підготовчим прикладом 36, очіТ.пл.=85-88°С. куваний продукт отримують у вигляді твердої реПриклад 38 човини бежевого кольору (вихід=87%). 5-Хлор-1-[(4-пропілфеніл)сульфоніл]-1H-індолТ.пл.=130-133°С. 2-пропанова кислота Приклад 32 Використовуючи методику, подібну до методи5-Хлор-1-[[4-(1,1ки Прикладу 2, та як вихідну сполуку - сполуку, диметилетил)феніл]сульфоніл]-1Н-індол-2отриману згідно з Прикладом 37, очікуваний пропропанова кислота дукт отримують у вигляді твердої речовини жовтоВикористовуючи методику, подібну до методиго кольору (вихід=92%). ки Прикладу 2, та як вихідну сполуку - сполуку, Т.пл.=144-148°С. отриману згідно з Прикладом 31, очікуваний проПриклад 39 дукт отримують у вигляді твердої речовини білого Метиловий естер 5-хлор-1-[(4кольору (вихід=98%). пентилфеніл)сульфоніл]-1H-індол-2-пропанової Т.пл.=169-171°С. кислоти Приклад 33 Використовуючи методику, подібну до методиМетиловий естер 5-хлор-1-[(4ки Прикладу 1, та як вихідну сполуку - сполуку, етилфеніл)сульфоніл]-1Н-індол-2-пропанової кисотриману згідно з Підготовчим прикладом 40, очілоти куваний продукт отримують у вигляді масла жовВикористовуючи методику, подібну до методитого кольору (вихід=76%). 1 ки Прикладу 1, та як вихідну сполуку - сполуку, Н ЯМР (ДМСОd6, 300 МГц) : = 0,81 (т, 3H), отриману згідно з Підготовчим прикладом 37, очі1,22 (м, 4Н), 1,50 (м, 2Н), 2,58 (т, 2Н), 2,81 (т, 2Н), куваний продукт отримують у вигляді масла жов3,28 (т, 2Н), 3,61 (с, 3H), 6,58 (с, 1Н), 7,31 (дд, 1Н), того кольору (вихід=86%). 7,39 (д, 2Н), 7,59 (д, 1Н), 7,72 (д, 2Н), 8,02 (д, 1Н). 1 Н ЯМР (ДМСОd6, 300 МГц) : = 1,12 (т, J=7,56 Приклад 40 Гц, 3H), 2,63 (к, 2Н), 2,81 (т, J=7,62 Гц, 2Н), 3,28 (т, 5-Хлор-1-[(4-пентилфеніл)сульфоніл]-1HJ=4,08 Гц, 2Н), 3,61 (с, 3H), 6,57 (с, 1Н), 7,31 (дд, індол-2-пропанова кислота J=8,9 Гц, 2,22 Гц, 1Н), 7,45 (д, J=12,8 Гц, 2Н), 7,59 Використовуючи методику, подібну до методи(с, 1Н), 7,74 (д, J=12,78 Гц, 2Н), 8,02 (д, J=8,91, ки Прикладу 2, та як вихідну сполуку - сполуку, 1H). отриману згідно з Прикладом 39, очікуваний проПриклад 34 дукт отримують у вигляді твердої речовини білого 5-Хлор-1-[(4-етилфеніл)сульфоніл]-1H-індол-2кольору (вихід=79%). пропанова кислота Т.пл.=131-134°С. Використовуючи методику, подібну до методиПриклад 41 ки Прикладу 2, та як вихідну сполуку - сполуку, Метиловий естер 5-хлор-1-[(3,5отриману згідно з Прикладом 33, очікуваний продиметилфеніл)сульфоніл]-1H-індол-2-пропанової дукт отримують у вигляді твердої речовини білого кислоти кольору (вихід=70%). Використовуючи методику, подібну до методиТ.пл.=130-133°С. ки Прикладу 1, та як вихідну сполуку - сполуку, Приклад 35 отриману згідно з Підготовчим прикладом 41, очіМетиловий естер 5-хлор-1-[[4-(1куваний продукт отримують у вигляді твердої реметилетил)феніл]сульфоніл]-1H-індол-2човини білого кольору (вихід=90%). пропанової кислоти Т.пл.=146-150°С.
ДивитисяДодаткова інформація
Назва патенту англійськоюIndole compounds
Автори англійськоюBinet Jean, Boubia, Benaissa, Dodey Pierre, Legendre Christiane, Barth Martine, Poupardin-Olivier, Olivia
Назва патенту російськоюИндольные соединения
Автори російськоюБен Жан, Доде Пьер, Лежондр Кристиан, Барт Мартин, Пупарден-Оливье Оливия
МПК / Мітки
МПК: A61K 31/427, A61K 31/405, A61K 31/4178, A61P 3/00, C07D 209/18, C07D 413/14, C07D 401/12, C07D 403/12, A61K 31/433, C07D 413/12, A61P 25/00, A61K 31/4155, A61K 31/422, C07D 417/12, C07D 405/12
Код посилання
<a href="https://ua.patents.su/83-92025-indolni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Індольні сполуки</a>












