Складні ефіри нуклеозиду та його похідні, фармацевтична композиція на їх основі
Номер патенту: 41296
Опубліковано: 17.09.2001
Автори: ДАЛЕН Аре, Берретсен Бернт, СТУККЕ Кьєлль Тургейр, МЮХРЕН Фінн
Формула / Реферат
1. Сложные эфиры нуклеозида и его производные общей формулы (I)
Nu-О-Fa, (I)
в которой О представляет собой кислород,
Nu представляет собой нуклеозид или его аналог и
Fa представляет собой ацильную группу мононенасыщенной С18 или C20 жирной кислоты, причем жирная кислота этерифицирована гидроксильной группой, находящейся в 5-положении сахарного фрагмента нуклеозида или его аналога, или гидроксильной группой, находящейся в 4-положении нециклической цепи нуклеозидного аналога, при условии, что исключаются следующие соединения:
5'-О-олеил-Аrа-цитидин;
5'-О-олеил-5-фторуредин;
5'-О-злаидоил-N6,N6-диметиладенозин;
5'-О-олеоил-N6,N6-диметиладенозин;
5'-фтор-2'-деокси-5'-О-олеил--уридин-3-(2-бромэтил)фосфат; и
5'-фтор-2' -деокси-5'-О-олеил--уридин-3'-(2-диметиламиноэтил)фосфат.
2. Соединение по п. 1, отличающееся тем, что Nu представлен формулой (II)
S-B, (II)
где S является моносахаридным производным, выбранным из 1--D-арабинофуранозы или 2,3-дидеокси-3-азидо-1--D-рибофуранозы, или выбран из 2-оксиэтоксиметила, 4-окси-3-(оксиметил)бутила, 2-окси-1-(оксиметил)этоксиметила или 2,3-диоксипропокси; и
В является азотным основанием, выбранным среди аденина, гуанина, цитозина, урацила, тимина или производного тимина следующей формулы:
где Х является дейтерием или фтором.
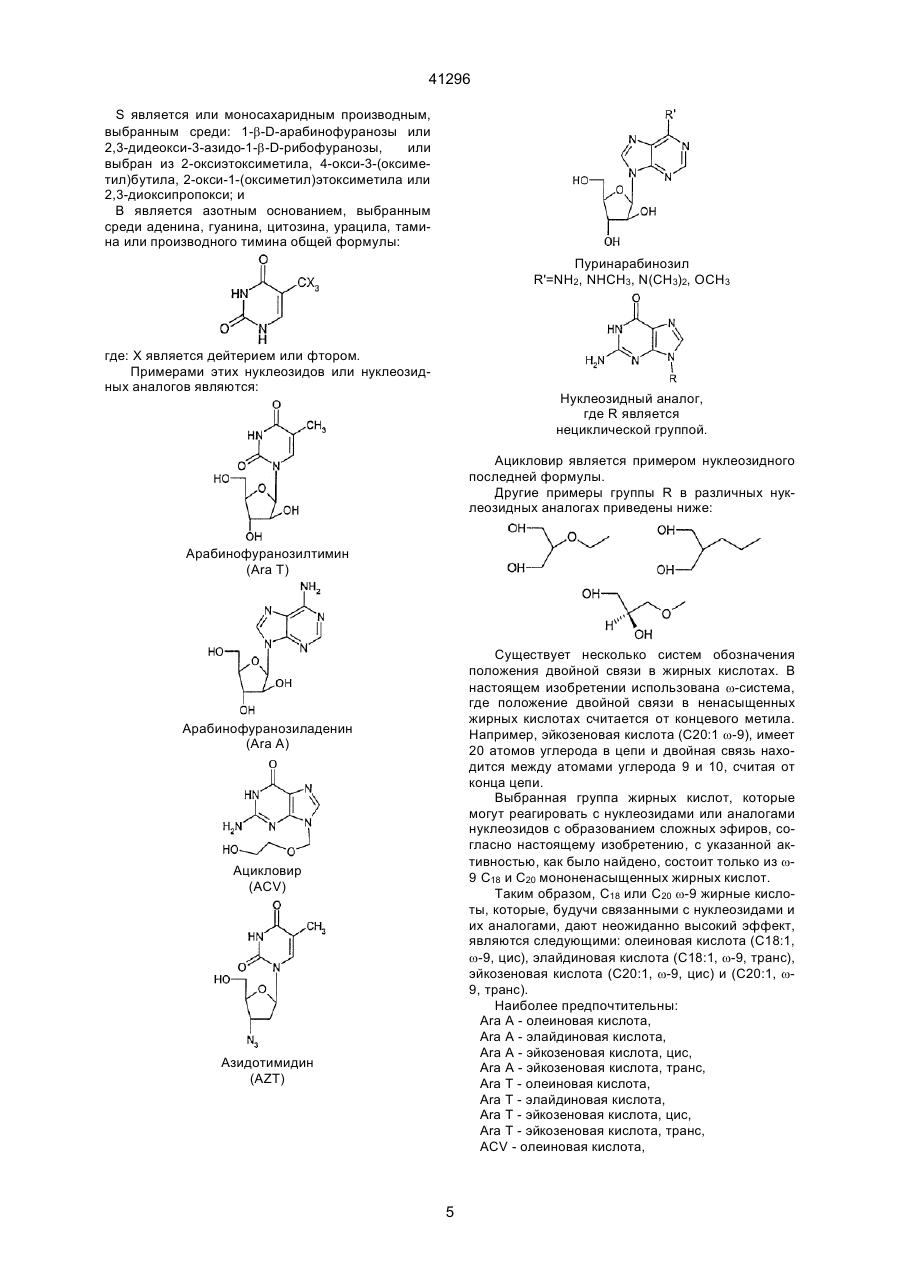
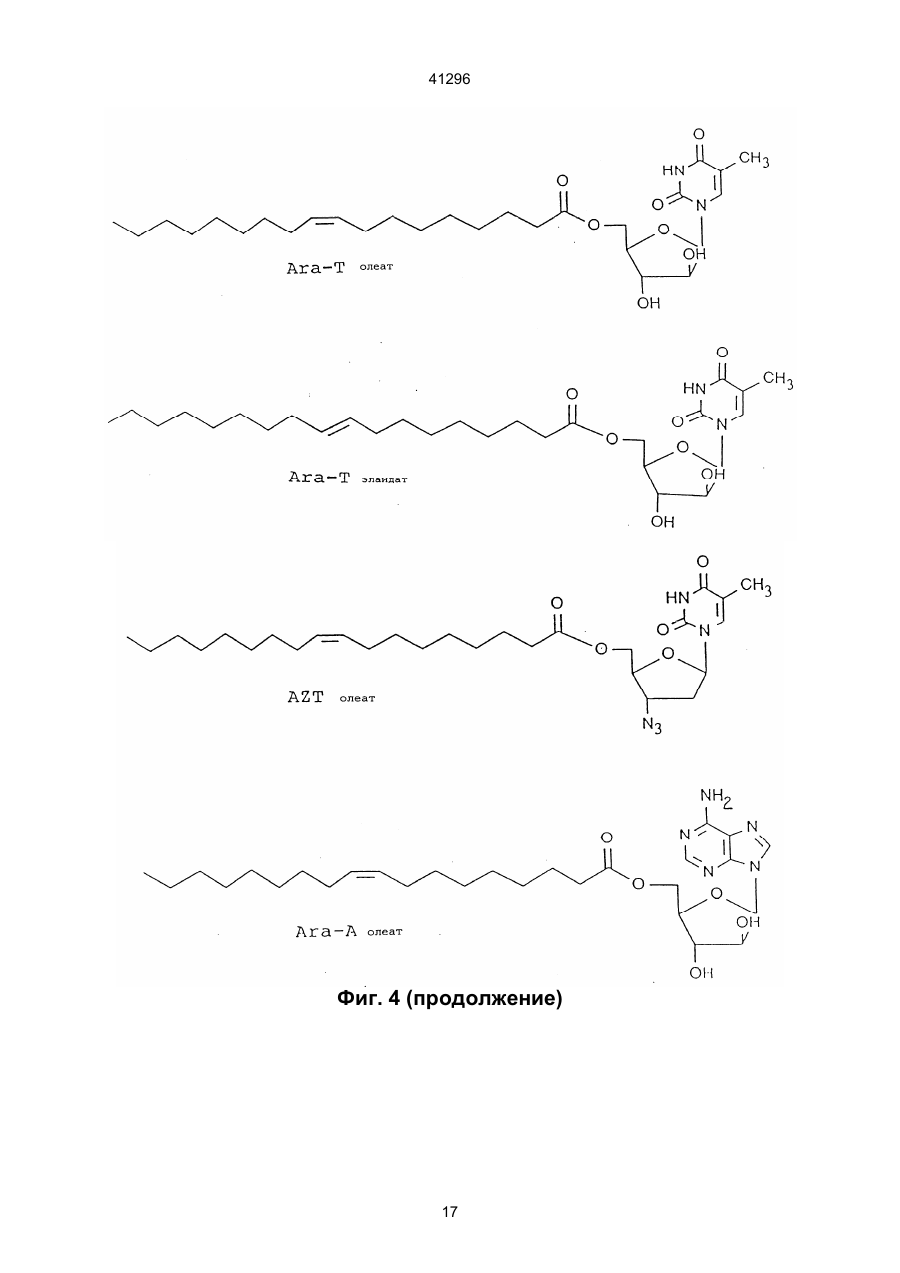
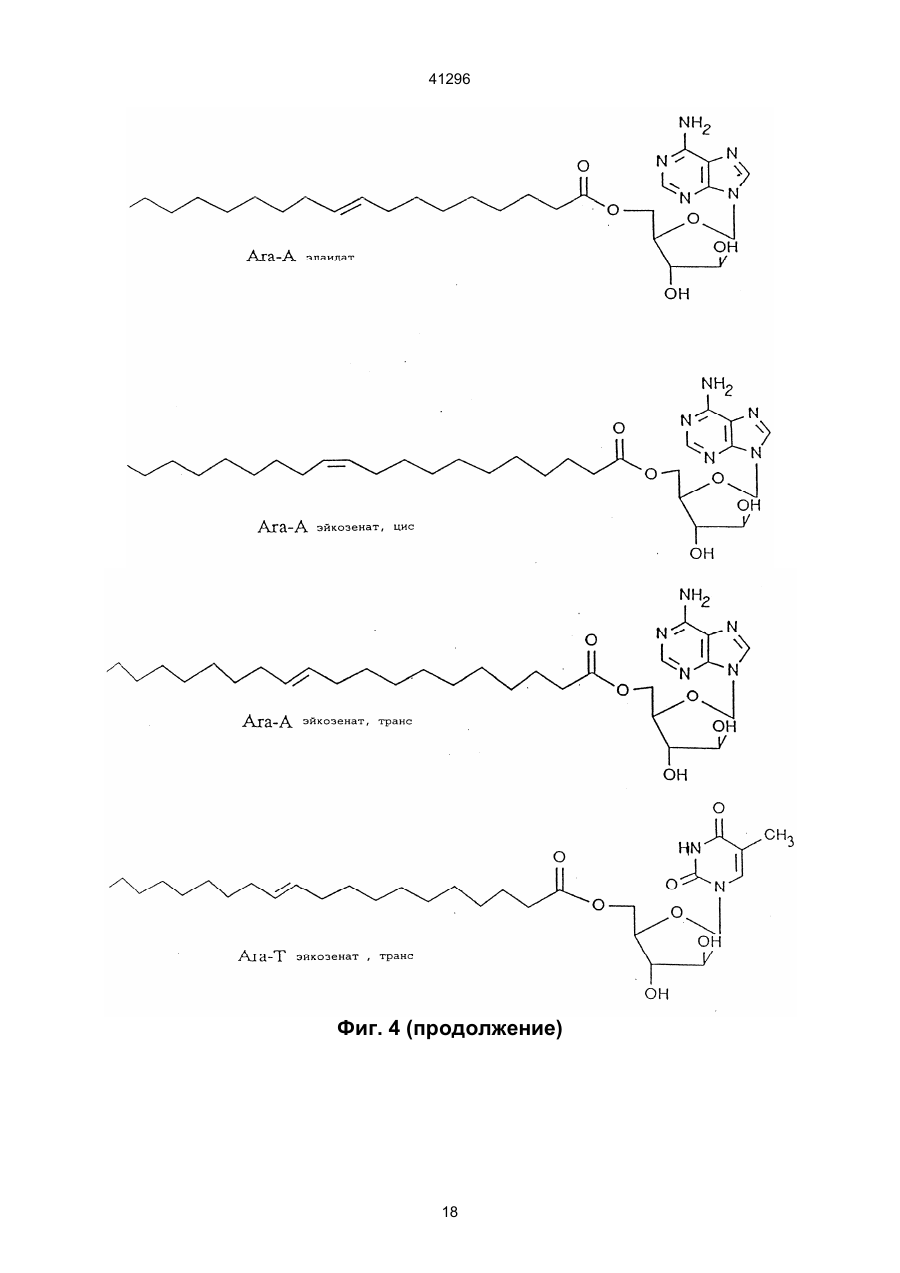
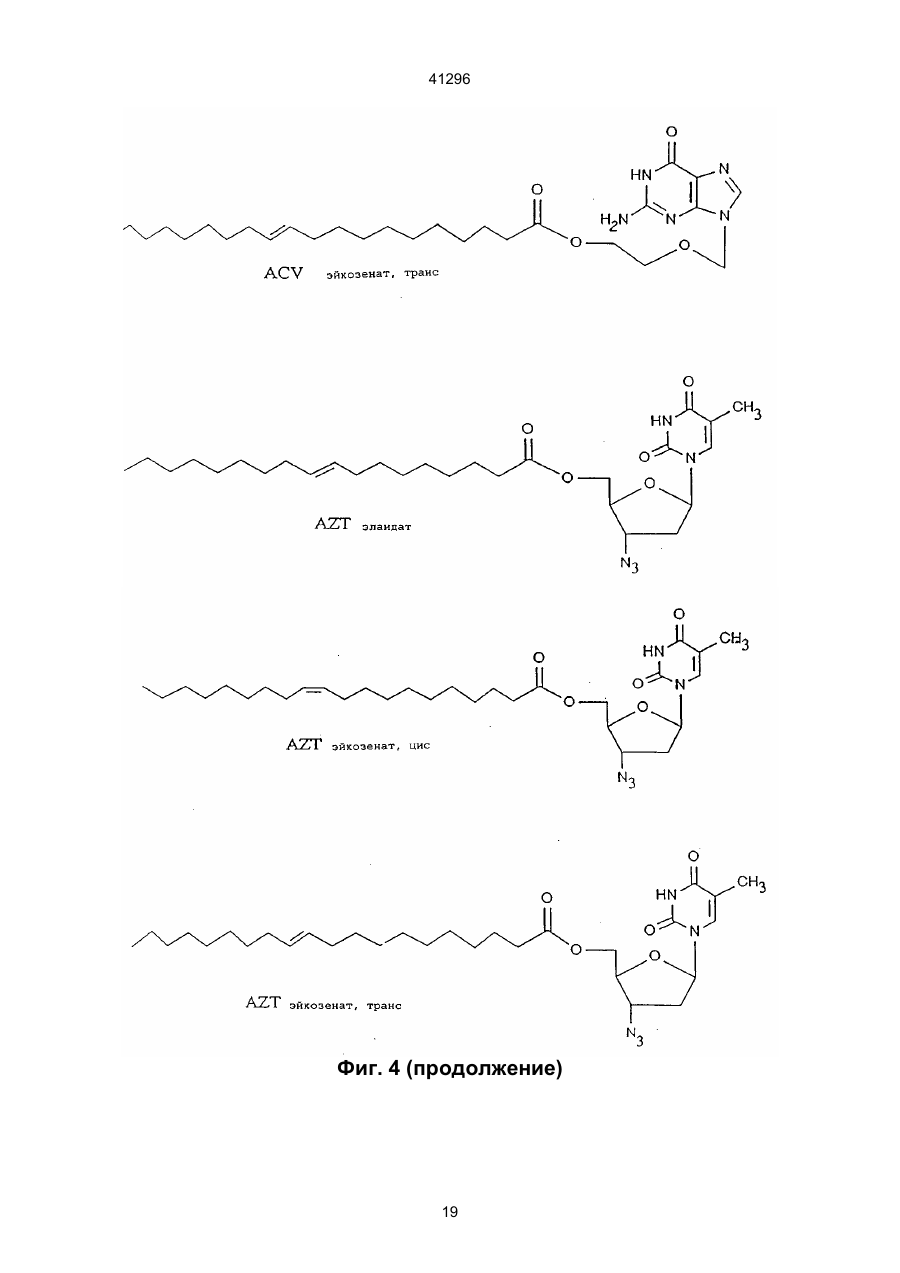
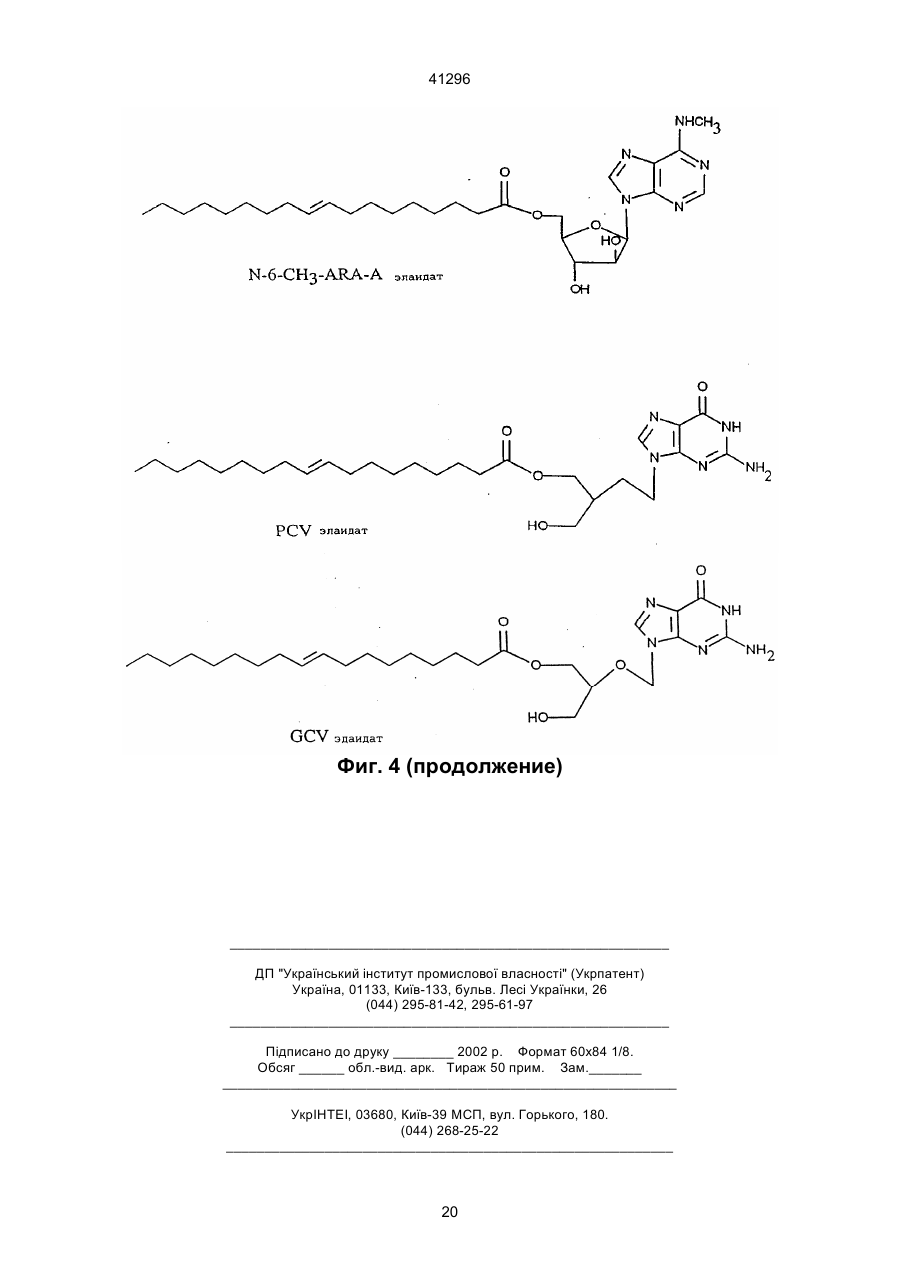
3. Соединение по п.2, отличающееся тем, что Nu является арабинофуранозилтимином (Аrа T), арабинофуранозиладенином (АRа А), ацикловиром (ACV), азидотимидином (AZT), пуринарабинозидом общей формулы:
где R' является NH2, NНСН3, N(СН3)2 или ОСН3, или аналогом нуклеозида общей формулы:
где R является нециклической группой.
4. Соединение по п. 3, отличающееся тем, что R является 2-окси-1-(оксиметил)этоксиметилом.
5. Соединение по любому из пп. 1-4, отличающееся тем, что Fa является олеиновой кислотой, элайдиновой кислотой или эйкозеновой кислотой, цис или транс.
6. Соединение по п.1, отличающееся тем, что Nu является ацикловиром и Fa является олеиновой кислотой.
7. Соединения по п.1, отличающееся тем, что Nu является ацикловиром и Fa является элайдиновой кислотой.
8. Соединение по п.1, отличающееся тем, что Nu является ацикловиром и Fa является эйкозеновой кислотой, цис или транс.
9. Соединение по п.1, отличающееся тем, что Nu является Ага Т и Fa является элайдиновой кислотой.
10. Соединение по п.1, отличающееся тем, что Nu является Ага Т и Fa является олеиновой кислотой.
11. Соединение по п.1, отличающееся тем, что Nu является Ага Т и Fa является эйкозеновой кислотой, цис и транс.
12. Соединение по п.1, отличающееся тем, что Nu является Ага А и Fa является эйкозеновой кислотой, цис и транс.
13. Соединение по п.1, отличающееся тем, что Nu является Ага А и Fa является олеиновой кислотой.
14. Соединение по п.1, отличающееся тем, что Nu является Ага А и Fa является элаидиновой кислотой.
15. Соединение по п.1, отличающееся тем, что Nu является ганцикловиром и Fa является элаидиновой кислотой.
16. Соединение по п.1, отличающееся тем, что Nu является AZT и Fa является элаидиновой кислотой.
17. Соединение по п.1, отличающееся тем, что Nu является AZT и Fa является олеиновой кислотой.
18. Соединение по п.1, отличающееся тем, что Nu является AZT и Fa является эйкозеновой кислотой, цис или транс.
19. Антивирусная фармацевтическая композиция, включающая активный ингредиент и фармацевтически приемлемый носитель или эксципиент, отличающийся тем, что в качестве активного ингредиента она содержит эффективное количество сложного эфира нуклеозида формулы (I):
Nu-O-Fa, (I)
в которой О представляет собой кислород,
Nu представляет собой нуклеозид или его аналог, и
Fa представляет собой ацильную группу мононенасыщенной С18 или C20 жирной кислоты, причем жирная кислота этерифицирована гидроксильной группой, находящейся в 5-положении сахарного фрагмента нуклеозида или его аналога или гидроксильной группой, находящейся в 4-положении нециклической цепи нуклеозидного аналога, кроме 5'-O-олеил-Аrа-цитидина и 2,2'-ангидро-5'-O-олеил-Аrа-цитидина.
20. Антивирусная фармацевтическая композиция по п. 19, обладающая антивирусным действием в отношении ВИЧ, отличающийся тем, что в качестве сложного эфира нуклеозида она содержит нуклеозид по одному из пп. 16-18.
21. Антивирусная фармацевтическая композиция по п. 19, обладающая антивирусным действием в отношении HSV 1 или 2, отличающийся тем, что в качестве сложного эфира нуклеозида она содержит нуклеозид по одному из пп. 6-8.
Текст
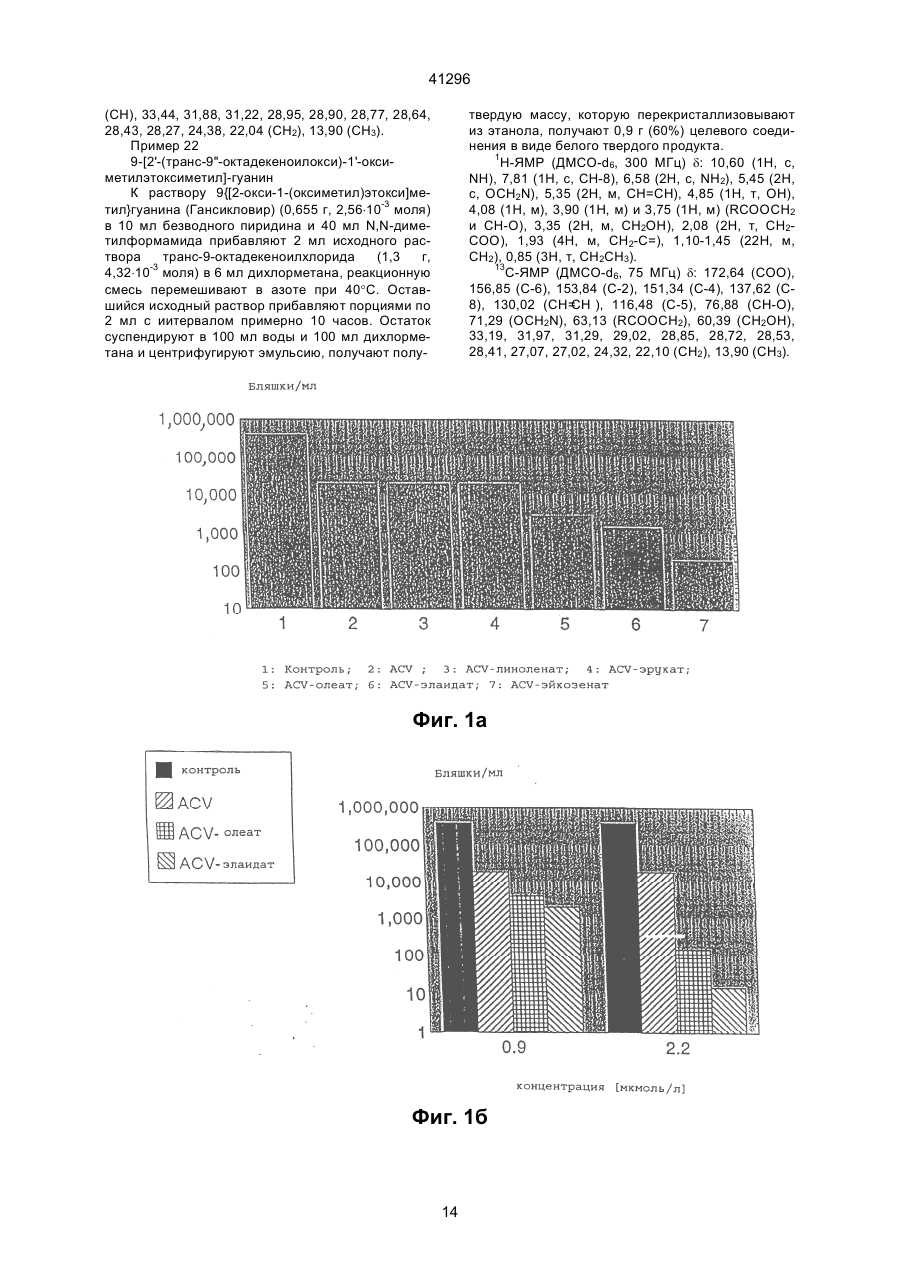
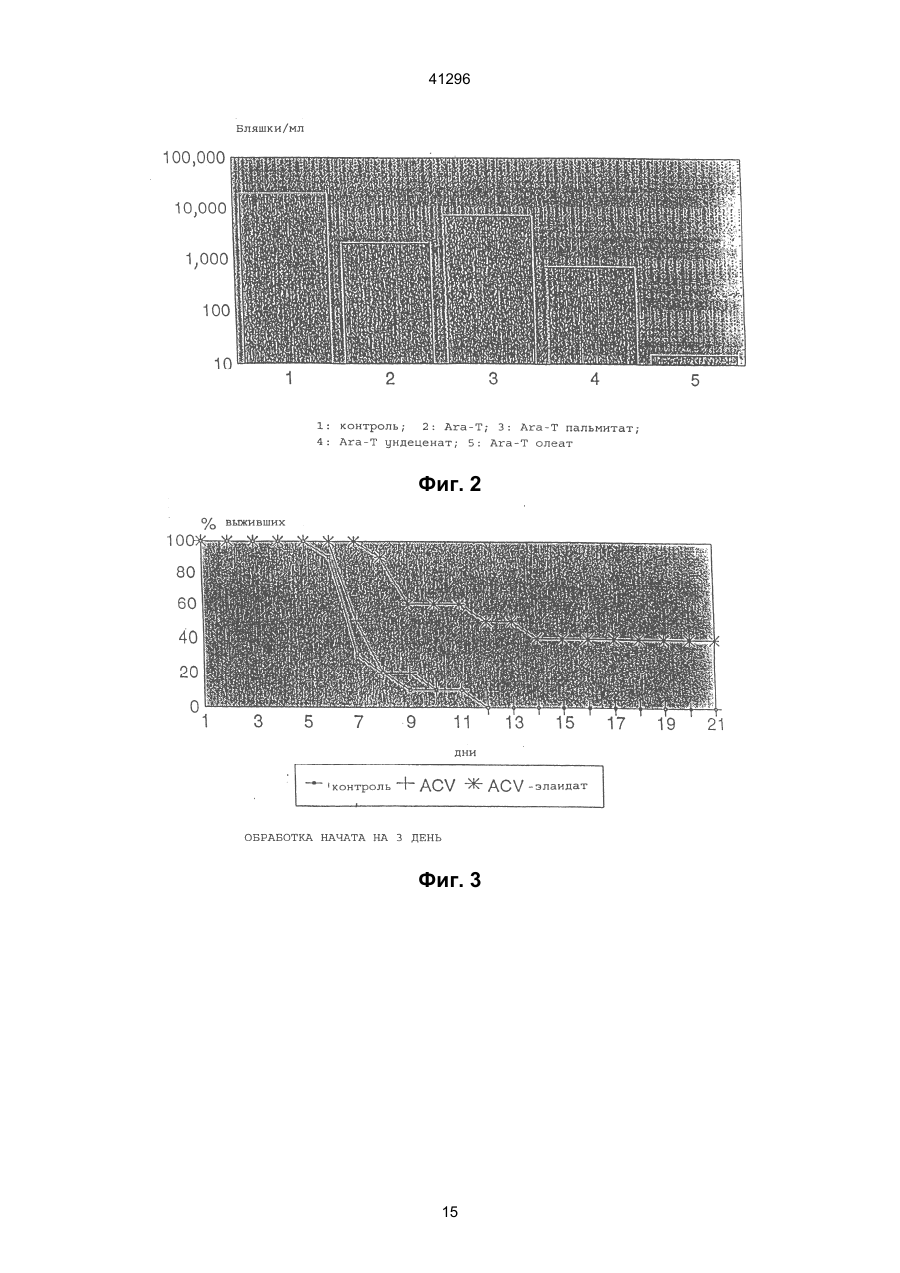
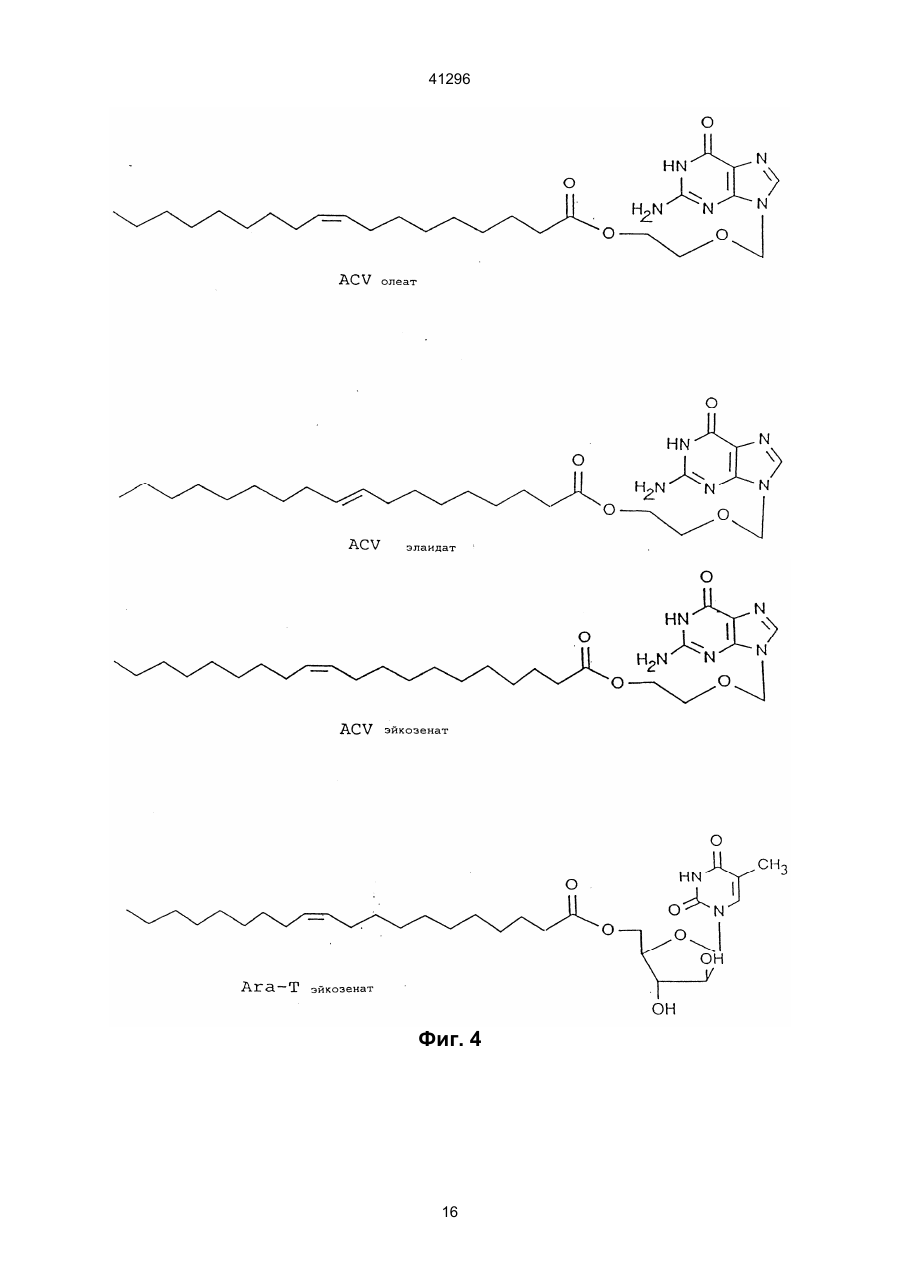
1. Сложные эфиры нуклеозида и его производные общей формулы (I): Nu-О-Fa (I) в которой О представляет собой кислород, Nu представляет собой нуклеозид или его аналог и Fa представляет собой ацильную группу мононенасыщенной С18 или C20 w-9 жирной кислоты, причем жирная кислота этерифицирована гидроксильной группой, находящейся в 5-положении сахарного фрагмента нуклеозида или его аналога, или гидроксильной группой, находящейся в 4положении нециклической цепи нуклеозидного аналога, при условии, что исключаются следующие соединения: 5'-О-олеил-Аrа-цитидин; 5'-О-олеил-5-фторуредин; 5'-О-элаидоил-N6,N6-диметиладенозин; 5'-О-олеоил-N6,N6-диметиладенозин; 5'-фтор-2'-деокси-5'-О-олеил-b-уридин-3-(2бромэтил)фосфат; и 5'-фтор-2'-деокси-5'-О-олеил-b-уридин-3'-(2диметиламиноэтил)фосфат. 2. Соединение по п. 1, отличающееся тем, что Nu представлен формулой (II): S-B (II) где S является моносахаридным производным, выбранным из 1-b-D-арабинофуранозы или 2,3-дидеокси-3-азидо-1-b-D-рибофуранозы, или выбран из 2-оксиэтоксиметила, 4-окси-3-(оксиметил)бутила, 41296 7. Соединение по п. 1, отличающееся тем, что Nu является ацикловиром и Fa является элаидиновой кислотой. 8. Соединение по п. 1, отличающееся тем, что Nu является ацикловиром и Fa является эйкозеновой кислотой, цис или транс. 9. Соединение по п. 1, отличающееся тем, что Nu является Аrа Т и Fa является элаидиновой кислотой. 10. Соединение по п. 1, отличающееся тем, что Nu является Аrа Т и Fa является олеиновой кислотой. 11. Соединение по п. 1, отличающееся тем, что Nu является Аrа Т и Fa является эйкозеновой кислотой, цис и транс. 12. Соединение по п. 1, отличающееся тем, что Nu является Аrа А и Fa является эйкозеновой кислотой, цис и транс. 13. Соединение по п. 1, отличающееся тем, что Nu является Аrа А и Fa является олеиновой кислотой. 14. Соединение по п. 1, отличающееся тем, что Nu является Аrа А и Fa является элаидиновой кислотой. 15. Соединение по п. 1, отличающееся тем, что Nu является ганцикловиром и Fa является элаидиновой кислотой. 16. Соединение по п. 1, отличающееся тем, что Nu является AZT и Fa является элаидиновой кислотой. 17. Соединение по п. 1, отличающееся тем, что Nu является AZT и Fa является олеиновой кислотой. 18. Соединение по п. 1, отличающееся тем, что Nu является AZT и Fa является эйкозеновой кислотой, цис или транс. 19. Антивирусная фармацевтическая композиция, включающая активный ингредиент и фармацевтически приемлемый носитель или эксципиент, отличающаяся тем, что в качестве активного ингредиента она содержит эффективное количество сложного эфира нуклеозида формулы (I): Nu-O-Fa (I) в которой О представляет собой кислород, Nu представляет собой нуклеозид или его аналог, и Fa представляет собой ацильную группу мононенасыщенной С18 или C20 w-9 жирной кислоты, причем, жирная кислота этерифицирована гидро-ксильной группой, находящейся в 5-положении сахарного фрагмента нуклеозида или его аналога или гидроксильной группой, находящейся в 4положении нециклической цепи нуклеозидного аналога, кроме 5'-O-олеил-Аrа-цитидина и 2,2'ангидро-5'-O-олеил-Аrа-цитидина. 20. Антивирусная фармацевтическая композиция по п. 19, обладающая антивирусным действием в отношении ВИЧ, отличающаяся тем, что в качестве сложного эфира нуклеозида она содержит нуклеозид по одному из пп. 16-18. 21. Антивирусная фармацевтическая композиция по п. 19, обладающая антивирусным действием в отношении HSV 1 или 2, отличающаяся тем, что в качестве сложного эфира нуклеозида она содержит нуклеозид по одному из пп. 6-8. Настоящее изобретение относится к группе новых соединений общей формулы I: Nu-O-Fa где: О означает кислород, Nu является нуклеозидом или аналогом нуклеозида, Fa является ацильной группой мононенасыщенной C18 или С20 жирной кислоты. Изобретение также относится к антивирусным фармацевтическим или ветеринарным композициям, содержащим соединение общей формулы I, одно или в сочетании с фармацевтически приемлемым носителем. Настоящее изобретение также относится к способу лечения людей или животных, страдающих от вирусной инфекции, и снижения инфекционной нагрузки при введении соединения формулы I. Известно, что большое количество серьезных заболеваний, таких как СПИД, гепатит В, герпес и гинекологический рак, а также по последним данным, папилломные бородавки, вызываются вирусными инфекциями. Вирусы являются маленькими инфекционными агентами, которые неспособны к независимой репликации и, следовательно, зависят для репликации от клетки хозяина. Генетическим материалом вируса является или РНК или ДНК. При заражении организма вирус атакует специфическую клетку хозяина. После присоедине ния вирус проникает через цитоплазматическую мембрану и вирусный геном выделяется из вирусной частицы. Вирусный геном обычно транспортируется в ядро клетки, где реплицируются новые вирусные геномы. Новый вирусный белок синтезируется в цитоплазме и новые частицы формируются или вблизи к цитоплазматической или ядерной мембране. Некоторые вирусы имеют геномный материал, который непосредственно (ДНК вируса) или не непосредственно (обратная транскрипция РНК, ретровирус) включен в геномы клетки хозяина. Внеклеточные вирусы нейтрализуются циркулирующими антителами и клеточный иммунный аппарат может атаковать и удалять зараженные клетки. Вирусы внутри зараженных клеток ускользают от иммунной защиты, если вирусные антигены не экспонированы на поверхности клеток. Иммунная атака на зараженные органы способствует заболеванию по механизму, обычно называемому вызванной вирусом иммунопатологией. Механизмы, лежащие в основе некоторых из более важных вирусных заболеваний, различаются. При заболевании ВИЧ-инфекцией Т-хелперные клетки пациентов являются пораженными и разрушенными. Это приводит к состоянию иммунодефицита, что делает пациента очень чувствительным к инфекциям, которые обычно подавля 2 41296 ются иммунной системой без каких-либо опасных последствий для пациента. Вирус гепатита В поражает клетки печени и пациент может оказаться очень больным, когда иммунная система старается избавить организм от этих зараженных клеток. Если инфекция не подавляется иммунной системой на ранних стадиях, результатом будет хронический гепатит. Следовательно, пациент будет инфицирован на всю жизнь. У ряда пациентов хронический гепатит будет развиваться в цирроз или рак печени. При инфекциях простым герпесом вирус первоначально проникает в эпидермальные клетки. Вирус простого герпеса (HSV) доходит до нервного центра, где он находится в спокойном состоянии до вспышки через определенный интервал времени. Хотя в большинстве случаев герпесная инфекция не угрожает жизни, она является болезненной и пациент будет заражаться каждый раз, когда происходит вспышка. У вируса папилломы, особенно в мочеполовых путях женщин, вирусный геном локализован в ядрах эпителиальных клеток, но не интегрирован в хромосомы клеток. Это является устойчивым состоянием и у некоторых штаммов, промотирующих опухоли, интеграция наконец происходит, приводя к развитию болезни. В этом случае вирусный геном оказывает решающее инициирующее действие на процесс, приводящий к раку. Если иммунная система справляется с освобождением организма от вируса на ранней стадии, это приводит к длительному иммунитету. С другой стороны, если вирус является слишком агрессивным и подавляет иммунный аппарат, не достигается иммунитетом и результатом является состояние постоянной инфекции. Из-за различных механизмов стратегия лечения должна различаться для этих состояний. Конечной целью при лечении ВИЧ/СПИДа является освобождение пациента от инфекционного вируса. Это кажется мало вероятным в настоящее время. Однако многое может быть достигнуто путем улучшения общего состояния пациента. Снижение вирусной нагрузки будет увеличивать длительность безсимптомного периода и уменьшать инфекционность, которая является крайне важной в отношении эпидемиологической ситуации. Все используемые в настоящее время противовирусные агенты обладают токсическими побочными эффектами, которые делают невозможным достаточно интенсивное лечение. Считается, что имеется от 250 до 300 миллионов носителей гепатита В во всем мире. Известно, что у многих из них развивается гепатома или печеночная недостаточность из-за инфекции. Обнадеживающие результаты при лечении носителя такого состояния были получены в последние годы при индукции иммунного ответа интерфероном. Терапия, снижающая вирусную нагрузку, является важной при таком, режиме, так как эффективное лечение острого гепатита В снизит количество находящихся в состоянии носителя. Недавно идентифицированный вирус гепатита С вызывает очень большое число случаев гепатита, из которых большое количество становятся носителями. Предварительные исследования указывают, что состояние носителя может быть прерва но терапевтическими режимами, подобными режимам для гепатита В. Вирусы простого герпеса 1 и 2 (HSV1 и HSV2) часто заражают людей, вызывая состояние носителя с возвратами локальной инфекции. Распространенные инфекции, включая энцефалит, являются редкими, но катастрофичными для пациента. Имеются большие индивидуальные отклонения в частоте локальных инфекций. Для тех пациентов, которые подверглись воздействию половым путем или через лицо, это составляет серьезную проблему для здоровья физически, умственно и социально. Ни один из разработанных до настоящего времени терапевтических режимов не лечит латентные инфекции клеток центральной нервной системы. Таким образом, терапевтическая задача заключается в сведении к минимуму клинических проявлений возвратов как по симптомам, так и по длительности. Преобладание вирусных инфекций генитальной папилломы резко возросло в 1980-е годы. Теперь установлено, что некоторые генотипы являются онкогенными, т.е. они инициируют изменения в клетке, которые после латентного периода превращаются в рак. Вирус папилломы половых путей дает длительные устойчивые инфекции. Факторы, вызывающие злокачественное превращение повреждений, полностью не известны, но полагают, что важную роль играет иммунная система. Считается, что повреждения органа, прогрессирующие в течение месяцев и лет, являются такими, которые переходят в рак. Генитальные папилломы, называемые кондиломами, в настоящее время лечат физическими средствами, такими как хирургическое удаление, некротирующие средства, жидкий азот и т.п. Генитальные бородавки вначале становятся опухолями с измененным ферментным набором, воздействующим наряду с другими моментами и на метаболизм нуклеозидных аналогов. Нуклеозидные продукты воздействуют на эписомальную пролиферацию вируса папилломы, вызывая в результате регрессию бородавок. Профилактическая вакцинация была очень успешной при острых инфекциях, таких как полиомиелит, корь, эпидемический паратит и т.п., но вакцинация была не эффективной для многих других серьезных вирусных инфекций. Даже хотя в последние десятилетия были приложены значительные усилия для получения эффективных противовирусных лекарств, в настоящее время не может быть предложено удовлетворительного медицинского лечения для большинства вирусных заболеваний. Усилия были особенно значительны из-за появления ВИЧ и родственных вирусных инфекций, которые распространяются в мире с пугающей скоростью, кроме того, эффекты, полученные с такими агентами, как азидотимидин (AZT) и ацикловир (ACV) при СПИДе и герпесе могут быть охарактеризованы только как частично успешные. Эти наиболее обещающие противовирусные агенты, следовательно, являются производными нуклеозидов природного происхождения, которые были модифицированы или в основании или в сахарном фрагменте. Однако у них не имеется желаемого терапевтического потенциала, поскольку они вызывают серьез 3 41296 ные побочные эффекты у некоторых пациентов или оказывают слабое или не оказывают никакого действия на других. Кроме того, лечение этими агентами является очень дорогостоящим. По этим причинам только пациенты, страдающие очень серьезными вирусными инфекциями, такими как СПИД, получают такое лечение. Пациенты, страдающие от менее серьезных, но также очень мучительных вирусных инфекций, часто остаются без какого-либо лечения, предоставляя инфекции развиваться своим путем. Пациент без лечения переносит очень высокую инфекционную нагрузку и представляет опасность для жизни окружающих его людей. Если он получает противовирусный агент, целью является снижение инфекционной нагрузки, чтобы заставить иммунную систему организма подавить инфекцию. Другой целью является снижение заразности и, следовательно, количества новых пациентов и носителей. Таким образом, потребность в соединениях, обладающих лучшим терапевтическим показателем, является очевидной. Потребность особенно велика для хронических или возвратных вирусных инфекций с опасной острой фазой или когда длительный срок болезни влияет на здоровье или самочувствие, таких как СПИД, гепатит В и С, инфекции группы герпеса и папилломные вирусные инфекции. Подобным образом также имеется потребность в противовирусных агентах, полезных для лечения животных, страдающих от вирусных заболеваний. Для улучшения воздействия уже были разработаны производные нуклеозидов, которые модифицированы или в основании или в сахарном фрагменте. В частности, были разработаны сложные эфиры жирных кислот нуклеозидов или аналогов нуклеозидов, чтобы улучшить липофильность и достигнуть лучшего прохода через мембраны. Известны сложные эфиры арабино-фуранозил-тимина (Аrа Т) с насыщенными кислотами, имеющими 1-17 атомов углерода (ЕР № 56265). Также известны липидные производные, соединенные, особенно через фосфатную группу, с 5'-положением пентозной группы нуклеозида (РСТ № 90/00555). Цель этой модификации заключается в получении более липофильных нуклеозидов, чтобы они могли быть включены в липосомы, которые предпочтительно проникают в макрофаги и моноциты, клетки которых, как было обнаружено, содержат вирус ВИЧ. Установлено, что в результате достигается эффект мишени. Из ЕР 393920 известны ненасыщенные, предпочтительно полиненасыщенные С16 и выше жирнокислотные эфиры или амиды нуклеозидов или аналогов нуклеозидов. Установлено, что жирнокислотная часть этих молекул предпочтительно представлена полиненасыщенными жирными кислотами, такими как g-линоленовая или линолевая кислоты. В патенте США № 3920630 указано, что 2,2'ангидроарацитидин и его 5'-O-ацильные производные имеют одинаковую основную биологическую и терапевтическую активность в качестве антивирусных агентов самих арацитидинов. Соединение 2,2'-ангидро-5'-O-олеиларацитидин особо упомя нуто. Соединение 5-O-олеил-Аrа С (известный также как 5'-O-олеил-ара-цитидин) описано в Int. J. Cancer, 37, 149-154, 1986, но не указано, что оно обладает антивирусными свойствами. С целью улучшения эффекта предложены сложные эфиры жирных кислот противовирусных нуклеозидов или аналогов нуклеозидов, согласно изобретению, где жирная кислота является мононенасыщенной C18 или С20 кислотой. Соединения, согласно настоящему изобретению, являются относительно нетоксичными, что подтверждено экспериментами по росту молодых мышей, и также имеют низкую цитотоксичность в соответствии с наблюдениями, сделанными в экспериментах на культуре ткани. Известно, что как нуклеозиды, так и аналоги нуклеозидов сами по себе, а также некоторые ненасыщенные жирные кислоты сами по себе проявляют противовирусные эффекты, величина эффектов, достигаемых с соединениями настоящего изобретения, указывает, что они являются не добавками, а скорее синергетиками. Механизм этих эффектов в настоящее время не известен, но они имеют порядок величины лучше, чем ближайшие родственные соединения, известные на данном уровне техники. Возможно, они возникают только благодаря мембранному эффекту или эффекту мишени. Эффекты достигаются с соединениями согласно изобретению в системах, где никакие эффекты не могут быть достигнуты с материнским нуклеозидным соединением. Новые моноэфирные соединения настоящего изобретения описываются общей формулой (I): Nu-O-Fa где: О является кислородом, Nu является нуклеозидом или аналогом нуклеозида и Fa представляет собой ацильную группу мононенасыщенной C18 или С20 w-9 жирной кислоты, причем жирная кислота этерифицирована гидроксильной группой, находящейся в 5-положении сахарного фрагмента нуклеозида или его аналога или гидроксильной группой, находящейся в 4положении нециклической цепи нуклеозидного аналога, кроме 5'-O-олеил-Аrа-цитидина и 2,2'ангидро-5'-O-олеил-Аrа-цитидина. Нуклеозиды являются молекулами, содержащими гетероциклическое основание, такое как цитозин, урацил, аденин или гуанин, соединенное с рибосомной единицей. В аналогах нуклеозидов или основание или рибосомная единица модифицированы. Например, рибосомная единица может быть заменена другим сахарным фрагментом или нециклической цепью. Жирной кислотой этерифицирована гидроксильная группа в 5-положении сахарного фрагмента нуклеозида или гидроксильная группа нециклической группы нуклеозидного аналога. Нуклеозиды или аналоги нуклеозидов, которые могут быть выбраны как Nu в соединениях формулы I, предпочтительно могут быть представлены формулой (II): S-B где: 4 41296 S является или моносахаридным производным, выбранным среди: 1-b-D-арабинофуранозы или 2,3-дидеокси-3-азидо-1-b-D-рибофуранозы, или выбран из 2-оксиэтоксиметила, 4-окси-3-(оксиметил)бутила, 2-окси-1-(оксиметил)этоксиметила или 2,3-диоксипропокси; и В является азотным основанием, выбранным среди аденина, гуанина, цитозина, урацила, тамина или производного тимина общей формулы: Пуринарабинозил R'=NH2, NHCH3, N(CH3)2, OCH3 где: X является дейтерием или фтором. Примерами этих нуклеозидов или нуклеозидных аналогов являются: Нуклеозидный аналог, где R является нециклической группой. Ацикловир является примером нуклеозидного последней формулы. Другие примеры группы R в различных нуклеозидных аналогах приведены ниже: Арабинофуранозилтимин (Аrа Т) Существует несколько систем обозначения положения двойной связи в жирных кислотах. В настоящем изобретении использована w-система, где положение двойной связи в ненасыщенных жирных кислотах считается от концевого метила. Например, эйкозеновая кислота (С20:1 w-9), имеет 20 атомов углерода в цепи и двойная связь находится между атомами углерода 9 и 10, считая от конца цепи. Выбранная группа жирных кислот, которые могут реагировать с нуклеозидами или аналогами нуклеозидов с образованием сложных эфиров, согласно настоящему изобретению, с указанной активностью, как было найдено, состоит только из w9 C18 и С20 мононенасыщенных жирных кислот. Таким образом, С18 или С20 w-9 жирные кислоты, которые, будучи связанными с нуклеозидами и их аналогами, дают неожиданно высокий эффект, являются следующими: олеиновая кислота (С18:1, w-9, цис), элайдиновая кислота (С18:1, w-9, транс), эйкозеновая кислота (С20:1, w-9, цис) и (С20:1, w9, транс). Наиболее предпочтительны: Аrа А - олеиновая кислота, Аrа А - элайдиновая кислота, Аrа А - эйкозеновая кислота, цис, Аrа А - эйкозеновая кислота, транс, Аrа Т - олеиновая кислота, Аrа Т - элайдиновая кислота, Аrа Т - эйкозеновая кислота, цис, Аrа Т - эйкозеновая кислота, транс, ACV - олеиновая кислота, Арабинофуранозиладенин (Ara A) Ацикловир (ACV) Азидотимидин (AZT) 5 41296 ACV - элайдиновая кислота, ACV - эйкозеновая кислота, цис, ACV - эйкозеновая кислота, транс, AZT - олеиновая кислота, AZT - элайдиновая кислота, AZT - эйкозеновая кислота, цис, AZT - эйкозеновая кислота, транс. Их формулы приведены на фиг. 4. Соединения, согласно настоящему изобретению, обладают противовирусным действием, и, следовательно, настоящее изобретение включает фармацевтические или ветеринарные композиции, содержащие, по крайней мере, одно соединение формулы I, одно или в сочетании с фармацевтически приемлемыми носителем или экcципиентом. Кроме того, некоторые нуклеозиды или аналоги нуклеозидов с мононенасыщенными жирными кислотами будут особенно пригодны для лечения определенных вирусных инфекций. Так, очевидно, что производные AZT жирных кислот являются особенно полезными для лечения СПИДа. Жирнокислотные производные Аrа Т и Аrа А особенно пригодны для лечения гепатита В. Сложные эфиры Аrа Т должны быть эффективными агентами для лечения папилломных вирусных инфекций. Получение необходимого иммунного ответа для подавления вирусной инфекции, такой как гепатит, в некоторых случаях может быть вызвано совместным введением интерферона. В зависимости, от того, какая вирусная инфекция подвергается лечению и на какой стадии находится инфекция, или от того, является ли пациент человеком или животным, может быть использовано как системное, так и местное введение. Для местного введения соединения могут быть сформулированы, как известно на данном уровне техники, для нанесения на кожу или слизистую в любой подходящей форме. При местном введении, соединения формулы I могут быть сформулированы в виде мази, крема, геля, тинктуры, аэрозоля, лосьона и т.п., содержащих соединения формулы I в смеси с инертным, твердым или жидким носителем, который является обычным в препаратах для местного нанесения. Особенно пригодно использование рецептуры, которая защищает активный ингредиент окисления или разложения. Фармацевтические рецептуры, содержащие соединения формулы I, также могут быть введены системно, или эетерально, или парентерально. При энтеральном введении соединения формулы I могут быть сформулированы, например, в мягких или твердых желатиновых капсулах, в виде таблеток, гранул, зерен или порошков, драже, сиропов, суспензий или растворов. При парентеральном введении пригодными являются рецептуры соединений формулы І в виде растворов для инъекций или инфузий, суспензий или эмульсий. Препараты могут содержать инертные или фармакодинамически активные добавки. Таблетки или грануляты, например, могут содержать серию связующих агентов, наполнители, субстанцию носителя или разбавители. Липкие рецептуры могут быть, например, в форме стерильного раствора. Капсулы могут содержать наполнитель или загуститель в дополнение к активному ингредиенту. Кроме того, также могут присутствовать улучшающие вкус добавки, а также вещества, обычно используемые в качестве консервантов, стабилизаторов, удерживающих влагу и эмульгирующих агентов, соли для изменения осмотического давления, буферы и другие добавки. Дозы, в которых вводят препараты согласно настоящему изобретению, могут меняться в соответствии со способом введения и путем использования, а также от требований пациента. Обычно дневная доза для системной терапии для взрослого среднего пациента будет составлять примерно 0,1-100 мг/кг массы тела/день, предпочтительно 120 мг/кг/день. Для местного нанесения подходящая мазь может содержать 0,1-10% масс. фармацевтической рецептуры, особенно 0,5-5% масс. При желании, фармацевтический препарат соединения формулы I может содержать антиоксидант, например, токоферол, N-метил-токоферамин, бутилированный оксианизол, аскорбиновую кислоту или бутилированный окситолуол. Далее изобретение относится также к использованию соединения формулы I, как определено выше, для получения фармацевтической композиции для лечения вирусной инфекции. Кроме того, изобретение также включает фармацевтическую композицию, которая включает соединение формулы І в сочетании с интерфероном. Примеры приготовления фармацевтических композиций Пример А Мягкие желатиновые капсулы для наполнения жидкостью К смеси 5-95% (мас./мас.) масла (кукурузное масло, арахисовое масло, Capmul МСМ, Labrasol, Captex 355 или подобные), 0-50% олеиновой кислоты, 0-50% этилового спирта и 0-50% полисорбата 80 добавляют 5-10% активного ингредиента. Затем смесь гомогенизируют и инкапсулируют. Пример Б Технология приготовления лекарственного средства в виде 5% крема Фаза А 5% (мас./мас.) aктивного ингредиента диспергируют в смесь, состоящую из 5-10% цетостеарилового спирта, 1-2% лаурилсульфата натрия, 510% белого мягкого парафина, 5-10% минерального масла, 1-5% полоксамера 407 и 0,1-1% пропилпарабена. Фаза Б Пропиленгликоль 30-50% Метилпарабен 0,1-1% Вода до 100% Фазу А эмульгируют в фазу Б при 30-50°С. Пример В Капсулы для наполнения сухим веществом (таблетки) Aктивный ингредиент 50% (мас./мас.) смешивают с 0-10% Avicel PH 102, 10-15% кукурузным крахмалом, 0-1% коллоидальным кремнием, 0-1% стеаратом магния, 0-1% додецилсульфатом натрия. Смесь пропускают через 500 мкм сито, перемешивают, просеивают второй раз. Смесью наполняют капсулы или смесь прессуют в таблетки. 6 41296 Пример Г Препарат в виде крема для местного применения, содержащий в качестве активного ингредиента элаидат ACV, получают в следующей композиции: Компонент АСV элаидат (активный ингредиент) Эмульгирующий воск Белый мягкий парафин Минеральное масло Жидкий силикон 200 Полисорбат 60 Пропилпарабен Глицерол Метилпарабен Вода После выстаивания (в течение 5 дней при 5°С) суспензия остается стабильной. Наблюдается некоторое расслаивание, не осаждение (твердое вещество) эмульсии. Пример Е В этом примере готовят капсулы, наполненные сухой смесью, содержащей элаидат GCV в качестве активного ингредиента. Препарат для наполнения капсулы следующий: % маc. 5,00 10,00 5,00 15,00 1,00 1,00 0,20 4,00 0,20 58,60 Компонент GCV элаидат Лактоза Кукурузный крахмал Коллоидальный кремнезем Стеарат магния вес (г) 6,600 4,950 1,518 0,066 0,066 Каждый из вышеуказанных ингредиентов аккуратно взвешивают и затем переносят в полипропиленовый сосуд и смешивают вместе. Полученную смесь затем пропускают через 500 мкм сито. Смесь со сборных противней затем смешивают и пропускают через то же сито второй раз. Смесь после второго просеивания возвращают в полипропиленовый сосуд и смешивают в барабане приблизительно со скоростью 60 об./мин. в течение 1 час. Полученным препаратом затем заполняют вручную твердо-желатиновые капсулы, имеющие размер 1, таким образом, чтобы каждая капсула содержала около 200 мг препарата. Изобретение иллюстрируется биологическими экспериментами и примерами получения, а также фигурами, в которых: На фиг. 1а представлено ингибирующее действие сложных эфиров жирной кислоты и ACV; соединения согласно настоящему изобретению сравнивают с известным соединением (ACV линолеат, см. ЕР-А-393920, и С22 мононенасыщенным (w-9) сложным эфиром (ACV эрукат). На фиг. 1б представлено сравнение двух соединений, согласно настоящему изобретению, с материнским нуклеозидом в двух различных концентрациях. На фиг. 2 показан ингибирующий эффект, достигнутый со сложными эфирами Аrа; соединение согласно настоящему изобретению сравнивают с известным соединением - насыщенным сложным эфиром Аrа Т (Аrа Т пальмитат, см. ЕР56265), двумя материнскими нуклеозидами и мононенасыщенным С11 сложным эфиром Аrа Т (Аrа Т ундеценат). На фиг. 3 представлено сравнение дозы выживания для молодых мышей, зараженных HSV2, после введения ACV и ACV элайдата. На фиг. 4 показана полная структура наиболее предпочтительных соединений согласно настоящему изобретению. Биологическое действие. А. Эксперименты in vitro Метод бляшек: Культура ткани вируса Вирусный препарат HSV2 (3-й пассаж клинического изолята) разбавляют до 3х103 pfu/ячейку и после этого инокулируют в клетки и инкубируют 1 час в культуре ткани верно-клеток. За это время вирус включается в клетки. Крем готовят как две отдельные фазы, А и Б, которые затем смешивают вместе для получения однородного гомогенного крема. Фаза А включает эмульгирующий воск, белый мягкий парафин, минеральное масло, жидкий силикон 200 (увеличивает чувствительность кожи и способность распространяться на коже), полисорбат 60 (улучшает физическую стабильность), пропилпарабен и ACV элаидат. Вторая фаза, фаза Б, включает глицерол (сорастворитель для улучшения смягчения), метилпарабен и воду. Две фазы независимо друг от друга смешивают при 70°С до тех пор, пока все ингредиенты не будут смешены вместе. Затем фазу Б добавляют к фазе А при 70°С и смешивание продолжают в течение 5 мин. Полученную смесь затем снимают с источника нагревания и, энергично перемешивая, объединяют до тех пор, пока не получится однородный крем при снижении температуры до 30-35°С. Пример Д Этот пример иллюстрирует приготовление липосомного препарата, содержащего элаидат ddC для орального введения. Получают исходный раствор лецитина (100 мг), растворенный в смеси хлороформ/метанол (1:1 об./об., 2 мл), и фосфатидил-глицерол (10 мг), растворенный в той же самой смеси растворителей (1,0 мл). В 25 мл колбе с круглым дном смешивают 0,2 мл раствора лецитина и 0,1 мл раствора фосфатидилглицерола. Активный ингредиент, элаидат ddC (5 мг), растворенный в смеси хлороформ/метанол (1:1 об./об., 5 мл), добавляют к смеси, получая прозрачный раствор (необходимо легкое нагревание). Растворитель удаляют, используя роторный выпарной аппарат, оставляя тонкую "стекловидную" пленку. Ее сушат в высоком вакууме в течение 1 час. В колбу добавляют фосфатный буфер (1,5 мл) и энергично встряхивают. Получают суспензию молочного цвета, которая стабильна к диализу против фосфатного буфера. Частицы суспензии имеют размер в интервале 4-15 мкМ (среднее 10 мкМ), измерено над ситом Малвена. 7 41296 Затем эти клетки культивируют в течение 24 часов с противовирусным агентом. Затем их замораживают, что приводит к разрыву клеток и появлению свободного вируса в последующем процессе плавления. Готовят разбавления 1/100 или 1/10000 и прибавляют к свежим культурам ткани. Инкубирование в течение 1 часа приводит к включению вируса в клетки. Добавляют карбоксиметилцеллюлозу (КМЦ), чтобы предотвратить миграцию вируса между клетками через среду. Распространение вируса при контакте с клетками является еще эффективным, вызывая образование бляшек. Одна бляшка будет представлять один инфекционный вирус. Следовательно, подсчет бляшек дает уточненное количество числа инфекционных вирусов. 1.1. Ацикловирные сложные эфиры Различные противовирусные агенты, согласно настоящему изобретению, и известные (ЕР № 393920), а также сравниваемый сложный эфир мононенасыщенной жирной кислоты с более длинной цепью прибавляют к культуре ткани, растворенными в диметилсульфокииде (ДМСО) в концентрации 0,94 мкмоль/д. Эта концентрация ниже эффективной ингибирующей концентрации ацикловира в использованном штамме простого Герпесса 2. Результаты показаны на фиг. 1а. Как можно видеть из фиг. 1а, нуклеозидные сложные эфиры жирных кислот, согласно изобретению, даже при этой концентрации оказывают ингибирущее действие на вирус с величинами лучшими, чем материнское соединение ацикловир. Кроме того, фиг. 1а показывает повышенный ингибирующий эффект при сравнении с соединениями в соответствии с известным уровнем техники, представленными ACV g-линолеатом (С18:3 w-3) и также при сравнении с нуклеозидным сложным эфиром жирной мононенасыщенной кислоты с более длинной цепью, ACV эрукатом (С22:1 w-9), имеющим ненасыщенность в таком же положении цепи. Ингибирующий эффект, достигаемый с тремя соединениями настоящего изобретения, близок к 100%. Эффект увеличивающихся концентраций показан на фиг. 1в. В данном тесте со штаммом HSV 2, относительно устойчивом к ACV, испытуемые соединения: ACV, ACV-олеат и ACV-элайдат, добавляют при 0,9 мкмоль/л или 2,2 мкмоль/л. Как можно видеть, ингибирующее действие соединений, согласно настоящему изобретению, сильно возрастает при более высокой концентрации, тогда как действие материнского нуклеозида ACV, остается на том же уровне. 1.2. Аrа Т сложные эфиры Проводят соответствующие эксперименты с Аrа Т, Аrа Т-олеатом, одним сложным эфиром насыщенной жирной кислоты, представляющим уровень техники, Аrа Т-пальмитатом (С16:0), и Аrа Тундеценатом (С11:11, w-1), сложным эфиром мононенасыщенной жирной кислоты с более короткой цепью. Противовирусные агенты прибавляют в концентрации 3,9 мкмоль/л. Результаты представлены на фиг. 2. Как отмечалось ранее, для ACV-сложных эфиров, Аrа Т сложный эфир согласно изобретению, Аrа Т олеат, обладает значительно лучшей ингибирующей активностью. В этом тесте ингибирование достигает 100%. Б. Достигнутые результаты in vitro - снижение смертности. Вирус простой Герпес 2 Эксперименты in vitro проводят с использованием самок мышей 3-4 недельного возраста NMR1. Этот штамм является чувствительным к вирусу человеческого герпеса в возрасте примерно до 6 недель, после этого они становятся относительно устойчивыми. Используют мышей ниже этого критического возраста, имеющиx массу 13-17 г. Вирус герпеса 2 является третьим пассажем изолята и его инокулируют в левую долю уха по стандартизованной процедуре. Через 3 дня устанавливают наличие местной инфекции. В этих условиях HSV2 является высоко нейротрофическим и у 95% животных развивается фатальный энцефалит, обычно через 7-9 дней. Следовательно, HSV 2 является особенно пригодным в качестве системы оценки терапевтической эффективности путем подсчета количества случаев энцефалита. Введение испытуемых соединений проводят при очень низкой концентрации, чтобы лучше наблюдать разницу в действии. Животные получают приблизительно 12 мг/кг массы тела/день тестируемого соединения с питьевой водой. Соединения добавляют к питьевой воде в виде мицелл с деоксихолатом. Конечная концентрация составляет 0,22 ммоль/л. Как контрольная группа, так и группы, получавшие испытуемые соединения, состоят из 10 животных в каждой группе. Испытуемыми соединениями были ACV-элайдат и ACV в сравнении с контролем. Лечение начинали на день 3 после инокуляции. За это время инфекция хорошо обосновалась в центральной нервной системе. Смертность животных наносят на график и результаты приведены на фиг. 3. Эта тест-система представляет собой очень жесткие условия. Как видно из фиг. 3, все животные контрольной группы умерли от инфекции. Материнский нуклеозид ацикловир не оказывает терапевтического действия при этой концентрации, когда обработку начинают после хорошо развившейся инфекции на 3 день после заражения. Как можно видеть, количество выживших повышается от 0 до 40% у животных, получавших ACV-элайдат. Через 21 день животных этой группы осматривали взъерошиванием, у них не было признаков энцефалита. Соединения общей формулы I в общем могут быть получены в соответствии со следующим уравнением реакции: основание Nu - OH + FaX ¾¾ ¾ ¾ ® Nu - O - Fa ¾ - HX где: Nu, О и Fa имеют указанные ранее значения, а X может быть Cl, Br, О-CO-R', где R' является Fa, CH3, СН2СН3 или CF3. Таким образом, реакция протекает путем ацилирования нуклеозида или его аналога. Ее проводят при использовании подходящих реактивных производных жирных кислот, предпочтительно галоидангидридов и ангидридов кислот. Когда используют галоидангидрид, такой как хлорангидрид 8 41296 зола прибавляют 1,5 мл (17,72×10-3 моля) оксалилхлорида и перемешивают смесь в азоте при 35°С в течение 3 часов. Удаляют растворитель и избыток реагента в высоком вакууме, а остаток разбавляют 10 мл дихлорметана, чтобы получить исходный раствор цис-9-гексадекеноилхлорида. К раствору 1,0 г (3,87×10-3 моля) АRА-Т в 20 мл безводного пиридина и 10 мл N,N-диметилформамида прибавляют 2 мл исходного раствора и реакционную смесь перемешивают в азоте при комнатной температуре. Прибавляют дополнительно 4 мл исходного раствора порциями по 1 мл с интервалом примерно 8 часов. После суммарного времени реакции 60 часов удаляют растворители в высоком вакууме и разбавляют остаток 50 мл воды и 50 мл хлороформа. Центрифугирование полученной эмульсии дает полутвердую массу, которую перекристаллизовывают из этанола/гептана 1:1, получают 1,15 г (60%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 11,25 (1Н, с, NH), 7,32 (1Н, с, Н-6), 6,05 (1Н, д, Н-1'), 5,65 (1Н, д, ОН-2'), 5,55 (1H, д, ОН-3'), 5,3 (2H, м, -СН=СН ), 4,45 (1Н, м, H-5'1), 4,15 (1Н, м, Н-5'2), 3,98 (1Н, м, Н-2'), 3,95 (1Н, м, Н-3'), 3,90 (1Н, м, Н-4'), 2,35 (2Н, т, СН2-СОО), 1,98 (4Н, м, =СН-СН2-), 1,75 (3Н, т, СН3-5), 1,52 (2Н, м, СН2-С-СОО), 1,20 (16Н, м, СН2), 0,85 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d": 172,31 (СОО), 163,31 (СО-4), 149,90 (СО-2), 137,89 (С-6), 129,13 и 129,03 (-СНОСН-), 106,74 (С-5), 84,83 (С-1'), 81,26 (C-4'), 75,59 (С-3'), 74,16 (С-2'), 62,76 (С-5'), 32,98, 30,62, 28,57, 28,50, 28,02, 27,91, 27,84, 27,76, 26,07, 26,03, 23,95, 21,56 (СН2), 13,39 (СН3СН2-), 11,68 (СН3-5). Пример 3 5'-О-(цис-6''-Октадекеноил)-1-b-D-арабинофуранозил-тимин К раствору 1,0 г (3,87×10-3 моля) АRА-Т в 20 мл безводного пиридина и 10 мл N,N-диметилформамида прибавляют 2 мл исходного раствора 2,1 г (6,98×10-3 моля) октадекеноилхлорида в 6 мл дихлорметана и перемешивают реакционную смесь в азоте при комнатной температуре. Оставшийся исходный раствор прибавляют порциями по 2 мл с интервалами приблизительно 12 часов. После суммарного времени реакции 60 часов выпаривают растворители в высоком вакууме и остаток разбавляют 65 мл хлороформа и 65 мл воды. Полученную эмульсию центрифугируют и органическую фазу обрабатывают рассолом, концентрируют и остаток перекристаллизовывают, получают 1,1 г (55%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 11,28 (1Н, с, NН), 7,35 (1Н, с, Н-6), 6,05 (1Н, д, Н-1'), 5,65 (1Н, д, ОН-2'), 5,55 (1H, д, ОН-3'), 5,28 (2H, м, СН=С H), 4,45 (1Н, м, H-5'1), 4,15 (1Н, м, Н-5'2), 3,98 (1Н, м, Н-2'), 3,95 (1Н, м, Н-3'), 3,90-(1Н, м, Н-4'), 2,35 (2Н, т, СН2-СОО), 1,97 (4H, м, СН2-СН-), 1,75 (3Н, с, CH3-5), 1,52 (2Н, м, СН2-С-СОО), 1,25 (20H, м, СН2), 0,85 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМCO-d6, 75 МГц) d: 172,73 (COO), 163,81 (CO-4), 150,40 (CO-2, 137,88 (C-6), 129,88 и 129,10 (СН=СН ), 107,24 (C-5), 85,34 (С-1'), 81,76 (C-4'), 76,10 (C-3'), 74,66 (C-2'), 63,28 (C-5'), 33,29, кислоты, добавляют третичный аминный катализатор, такой как триэтиламин, N,N-диметиланилин, пиридин или N,N-диметиламинопиридин, в реакционную смесь для связывания высвобождающейся галоидводородной кислоты. Реакцию предпочтительно проводят в инертном растворителе, таком как N,N-диметилформамид или галоидированный углеводород, такой как дихлорметан. При желании любой из вышеупомянутых третичных аминных катализаторов может быть использован в качестве растворителя, при этом внимательно следят, чтобы имелся подходящий избыток. Температура реакции варьируется между 0°С и 40°С, предпочтительно, 5°-25°С. Реакция практически завершается за 24-60 часов. За ходом реакции следят, используя тонкослойную хроматографию (ТСХ) и подходящую систему растворителей. По окончании реакции по данным ТСХ продукт экстрагируют органическим растворителем и очищают хроматографией и/или перекристаллизацией из подходящей системы растворителей. Если в нуклеозиде или его аналоге имеется более одной гидроксильной или аминогруппы, может быть получена смесь соединений. Индивидуальные моно- или поли- ацилированные соединения могут быть разделены с помощью мгновенной хроматографии. Способ проиллюстрирован следующими примерами. Пример 1 5'-0-Гексадекеноил-1-b-D-арабинофуранозилтимин К раствору 0,5 г (1,94×10-3 моля) 1-b-Dарабинофуранозил-тимина (ARA-T) в 20 мл безводного пиридина прибавляют 3 мл исходного раствора 0,58 г (2,13×10-3 моля) пальмитоилхлорида в 5,5 мл дихлоргметана. Реакционную смесь перемешивают в азоте при комнатной температуре 12 часов, когда тонкослойная хроматография показывает частичную конверсию. Прибавляют остальной раствор пальмитоилхлорида и полученную смесь перемешивают 24 часа. Реакционную смесь выпаривают досуха и остаток распределяют между 50 мл хлороформа и 50 мл воды. Центрифугирование полученной эмульсии дает полутвердый продукт, который перекристаллизовывают из этанола/гептана 1:1, получают 0,7 г (72%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 11,25 (1Н, с, NH), 7,32 (1Н, с, Н-6), 6,05 (1H, д, H-1'), 5,65 (1H, д, ОН-2'), 5,58 (1Н, д, ОН-3'), 4,50 (1H, м, Н-5'1), 4,15 (1Н, м, Н-5'2), 4,02 (1Н, м, Н-2'), 3,92 (1Н, м, Н-3'), 3,88 (1Н, м, Н-4'), 2,31 (2Н, т, СН2-СОО), 1,75 (3Н, с, СН3-5), 1,55 (2Н, м, СН2-С-СОО), 1,20 (24Н, м, СН2), 0,85 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,81 (СОО), 163,78 (СО-4), 150,37 (СО-2), 137,88 (С-6), 107,21 (С-5), 85-29 (С-1'), 81,74 (С-4'), 76,06 (С-3'), 74,65 (С-2'), 63,23 (С-5'), 33,41, 31,26, 28,97, 28,82, 28,66, 28,33, 24,44, 22,05 (СН2), 13,89 (CH3-CH2), 12,15 (CH3-5). Пример 2 5'-О-(цис-9''-Гексадекеноил)-1-b-D-арабинофуранозил-темин К раствору 4,0 г (15,72×10-3 моля) цис-9гексадекеновой кислоты в 40 мл безводного бен 9 41296 28,56, 28,44, 28,40, 24,50 и 22,15 (CH2), 13,90 (СН3СН2), 12,20 (СН3-5). Пример 6 5'-О-(цис-11''-Октадекеноил)-1-b-D-арабинофуранозил-тимин К раствору 1,0 г (3,87×10-3 моля) АRА-Т в 20 мл безводного пиридина и 10 мл N,N-диметилформамида прибавляют 2 мл исходного раствора цис11-октадекеноилхлорида (2,1 г, 6,93×10-3 моля) в 6 мл дихлорметана и реакционную смесь перемешивают в азоте при комнатном температуре. Реакцию завершают обычным образом и сырой продукт очищают хроматографией на силикагеле, используя в качестве элюента 5% метанола в хлороформе. Гомогенные фракции выпаривают, получают 1,2 г (55%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 11,25 (1H, с, NН), 7,35 (1H, с, Н-6), 6,05 (1Н, д, Н-1'), 5,65 (1Н, д, ОН-2'), 5,55 (1Н, д, ОН-3'), 5,32 (2Н, м, СН=СН ), 4,45 (1Н, м, Н-5'1), 4,15 (1Н, м, Н-5'2), 3,98 (1H, м, Н=2'), 3,90 (1H, м, Н-3'), 3,88 (1Н, м, Н-4'), 2,33 (2Н, т, СН2-СОО), 1,95 (4Н, м, СН2-СН=), 1,75 (3Н, с, СН3-5), 1,52 (2Н, м, СН2-С-СОО), 1,25 (20Н, м, СН2), 0,95 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,78 (СОО), 163,78 (СО-4), 150,38 (СО-2), 137,87 (С-6), 129,56 (СН-СН), 107,21 (С-5), 85,31 (С-1'), 81,73 (С-4'), 76,07 (С-3'), 74,65 (С-2'), 63,24 (С-5'), 33,41, 31,10, 29,05, 28,81, 28,74, 28,64, 28,50, 28,34, 28,24, 26,56, 26,52, 24,43, 22,04 (СН2), 13,85 (СН3-СН2), 12,15 (СН3-5). Пример 7 5'-О-(транс-11''-Октадекеноил)-1-b-D-арабинофуранозил-тимин К раствору 1,0 г (3,87×10-3 моля) АRА-Т в 20 мл безводного пиридина и 10 мл N,N-диметилформамида прибавляют 2 мл исходного раствора 2,1 г (6,98×10-3 моля) транс-11-октадекеноилхлорида в 6 мл дихлорметана и перемешивают реакционную смесь в азоте при комнатной температуре. Реакцию завершают обычным образом и сырой продукт перекристаллизовывают, получают 1,3 г (65%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 11,25 (1Н, с, NН), 7,35 (1Н, с, Н-6), 6,05 (1Н, д, Н-1'), 5,65 (1Н, д, ОН-2'), 5,55 (1H, д, ОН-3'), 5,35 (2Н, м, НС=СН ), 4,45 (1H, м, H-5'1), 4,15 (1H, м, Н-5'2), 4,05 (1H, м, Н-2'), 3,95-3,90 (2Н, м, Н-3' и Н-4'), 2,35 (2Н, т, СН2СОО), 1,95 (4Н, м, СН2-СН=), 1,75 (3Н, с, СН3-5), 1,52 (2Н, м, СН2-С-СОО), 1,25 (20Н, м, СН2), 0,85 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,75 (COO), 163,79 (CO-4), 150,38 (CO-2), 137,90 (C-6), 129,98 (СН=СН ), 107,19 (C-5), 85,34 (C-1'), 81,77 (C-4'), 76,11 (C-3'), 74,65 (C-2'), 63,26 (C-5'), 33,42, 31,91, 31,10, 28,95, 28,83, 28,76, 28,65, 28,40, 28,37, 28,12, 24,44 и 22,04 (CH2), 13,83 (CH3-CН2), 12,13 (CH3-5). Пример 8 5'-О-(цис-11''-Эйкозеноил)-1-b-D-арабинофуранозил-тимин К раствору 1,0 г (3,87×10-3 моля) АRА-Т в 20 мл безводного пиридина и 10 мл N,N-диметилформамида прибавляют 2 мл исходного раствора 2,1 г 31,28, 28,99, 28,84, 28,69, 28,57, 28,43, 26,54, 26,29, 24,07, 22,07 (CH2), 13,89 (СН3-СН2), 12,16 (СН3-5). Пример 4 5'-О-(цис-9''-октадекеноил)-1-b-D-арабинофуранозил-тимин К раствору 1,0 г (3,87×10-3 моля) АRА-Т в 20 мл безводного пиридина и 10 мл N,N-диметилформамида прибавляют 2 мл исходного раствора 2,1 г (6,98×10-3 моля) цис-9-октадекеноилхлорида в 6 мл дихлорметана и перемешивают в азоте при комнатной температуре. Оставшийся исходный раствор прибавляют порциями по 2 мл с интервалами пимерно 12 часов. После суммарного времени реакции 60 часов растворители выпаривают в высоком вакууме и остаток разбавляют 65 мл хлороформа и 65 мл воды. Полученную эмульсию центрифугируют и органическую фазу обрабатывают рассолом, концентрируют и перекристаллизовывают остаток, получают 1,2 г (60%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6) d: 11,28 (1Н, с, N-H), 7,35 (1H,с, Н-6), 6,05 (1Н, д, Н-1'), 5,65 (1H, д, ОН-2'), 5,55 (1Н, д, ОН-3'), 5,28 (2Н, м, СH=СH), 4,45 (1Н, м, Н-5'1), 4,15 (1Н, м, Н-5'2), 3,98 (1Н, м, Н-2'), 3,95 (1Н, м, Н-3'), 3,95 (1Н, м, Н-3'), 3,90 (1Н, м, Н-4'), 2,35 (2Н, т, СН2-СОО), 1,97 (4Н, м, СН2-СН=), 1,75 (3Н, с, СН3-5), 1,52 (2Н, м, СН2-С-СОО), 1,25 (20Н, м, СН2), 0,35 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6 75 МГц) d: 172,75 (СОО), 163,80 (СО-4), 150,39 (СО-2), 137,88 (С-6), 129,58 и 129,49 (СН=СН), 107,21 (С-5), 85,36 (С-1'), 81,79 (С-4'), 76,11 (С-3'), 74,67 (C-2'), 63,26 (C-5'), 33,42, 31,27, 29,08, 29,02, 28,84, 28,68, 28,55, 26,43, 28,37, 26,54, 24,44, 22,07 (CH2), 13,86 (CH3-CH2), 12,15 (CH3-5). Пример 5 5'-О-(транс-9"-Октадекеноил)-1-b-D-арабинофуранозил-тимин К раствору 1,0 г (3,87×10-3 моля) АRА-Т в 20 мл безводного пиридина и 10 мл N,N-диметилформамида прибавляют 2 мл исходного раствора 2,1 г (6,98×10-3 моля) транс-9-октадекеноилхлорида в 6 мл дихлорметана и перемешивают реакционную смесь в азоте при комнатной температуре. Оставшийся исходный раствор прибавляют порциями по 2 мл с интервалами примерно 12 часов. После суммарного времени реакции 60 часов выпаривают растворители в высоком вакууме и остаток разбавляют 65 мл хлороформа и 65 мл воды. Обычная обработка и перекристаллизация дают 1,30 г (65%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 11,35 (1Н, с, NН), 7,35 (1H, с, H-6), 6,05 (1H, д, H-1'), 5,65 (1H, д, ОН-2'), 5,55 (1Н, д, ОН-3'), 5,35 (2Н, м, СН=СН ), 4,45 (1Н, м, Н-5'), 4,15 (1Н, м, Н-5'2), 4,0 (1H, м, Н2'), 3,95 (1Н, м, Н-3'), 3,90 (1H, м, Н-4'), 2,35 (2Н, т, СH2-COO), 1,93 (4Н, м, СН2-СН=), 1,75 (3Н, с, СН35), 1,51 (2Н, м, СН2-С-СОО), 1,25 (20Н, м, СН2), 0,85 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,77 (СОО), 163,88 (СО-4), 150,45 (СО-2), 137,98 (С-6), 130,03 и 129,97 (CН=CH), 107,24 (С-5), 85,44 (С-1'), 81,89 (С-4'), 76,17 (С-3'), 74,69 (С-2'), 63,34 (С-5'), 33,48, 31,99, 31,35, 29,06, 29,00, 28,91, 28,78, 28,61, 10 41296 (6,38×10-3 моля) цис-11-эйкозеноилхлорида в 6 мл дихлорметана и перемешивают смесь в азоте при комнатной температуре. Реакцию завершают обычным образом и сырой продукт очищают на колонке с силикагелем, используя 10% метанол в хлороформе в качестве элюента. Гомогенные фракции выпаривают, получают 1,25 г (58%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 11,25 (1Н, с, NН), 7,35 (1Н, с, Н-6), 6,05 (1Н, д, Н-1'), 5,65 (1Н, д, ОН-2'), 5,55 (1Н, д, ОН-3'), 5,32 (2Н, м, CН=CH), 4,45 (1Н, м, H-5'1), 4,15 (1Н, м, Н-5'2), 3,98 (1Н, м, Н-2'), 3,90 (1Н, м, Н-3'), 3,88 (1Н, м, Н-4'), 2,33 (2Н, т, CH2COO), 1,95 (4Н, м, CH2-CН=), 1,75 (3Н, с, СН3-5), 1,52Т (2Н, м, СН2-С-СОО), 1,25 (24Н, м, СН2), 0,95 (3Н, т, CН3-CН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,25 (СОО), 163,30 (СО-4), 149,89 (СО-2), 137,38 (С-6), 129,05 (СН=СН ), 106,71 (С-5), 84,85 (С-1'), 81,28 (С-4'), 75,60 (С-3'), 74,16 (С-2'), 62,76 (С-5'), 32,92, 30,78, 28,58, 28,34, 28,19, 28,08, 27,88, 26,04, 23,95, 21,58 (СН2), 13,36 (СН3-СН2), 11,65 (СН3-5). Пример 9 5'-О-(цис-13''-Докозеноил)-1-b-D-арабинофуранозил-тимин К раствору 1,0 г (3,87×10-3 моля) АRА-Т в 10 мл безводного пиридина и 10 мл N,N-диметилформамида прибавляют 2 мл исходного раствора 2,15 г (6,02×10-3 моля) цис-13-докозеноилхлорида в 6 мл дихлорметана и реакционную смесь перемешивают в азоте при комнатной температуре. Реакцию завершают и очищают продукт на колонке с силикагелем (10% МеОН/СНСl3), получают 1,15 г (51%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 11,25 (1H, с, NН), 7,35 (1H, с, Н-6), 6,05 (1Н, д, H-1'), 5,65 (1H, д, ОН-2'), 5,55 (1H, д, OН-3'), 5,32 (2Н, м, CН=CH), 4,45 (1H, м, H-5'1), 4,15 (1H, м, Н-5'2), 3,98 (1H, м, Н-2'), 3,90 (1H, м, Н-3'), 3,88 (1H, м, Н-4'), 2,33 (2Н, т, СН2-СОО), 1,95 (4Н, м, СН2-СН=), 1,75 (3Н, с, СН3-5), 1,52 (2Н, м, СН2-С-СОО), 1,25 (28Н, м, СН2), 0,95 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,63 (СОО), 163,48 (СО-4), 150,43 (СО-2), 137,88 (С-6), 129,44 (СН=СН ), 107,21 (С-5), 85,51 (C-1'), 81,92 (С-4'), 76,20 (С-3'), 74,69 (С-2'), 63,36 (С-5'), 33,47, 31,40, 29,20, 29,15, 29,03, 28,83, 28,73, 28,55, 26,63, 24,50, 22,16 (СН2), 13,79 (СН3-СН2), 12,14 (Cн3-5). Пример 10 9-(2'-)цис-9''-Гексадекеноилокси(этоксиметил)гуанин К раствору 1,0 г (4,43×10-3 моля) 9-(2-оксиэтоксиметил) гуанина (Ацикловир, АСV) в 20 мл безводного пиридина и 10 мл N,N-диметилформамида прибавляют 2 мл исходного раствора 4,29 г (15,72×10-3 моля) цис-9-гексадекеноилхлорида в 10 мл дихлорметана и реакционную смесь перемешивают в азоте при комнатной температуре. Прибавляют дополнительно 4 мл исходного раствора порциями по 2 мл с интервалом примерно 10 часов. После 60 часов суммарного времени реакции растворители удаляют в высоком вакууме и остаток разбавляют 65 мл хлороформа и 65 мл воды. Центрифугирование и перекристаллизация (этанол) полученной полутвердой массы дают 1,35 г (66%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 10,65 (1Н, с, NН), 7,82 (1Н, с, СН-8), 6,50 (2Н, с, СН2), 5,35 (2Н, с, СН2-1'), 5,2-5,4 (2Н, м, СН=СН), 4,07 (2Н, т, СН24'), 3,65 (2Н, т, СН2-3'), 2,21 (2Н, т, СН2-СОО), 1,98 (4Н, м, СН2-СН=), 1,48 (2Н, м, СН2-С-СОО), 1,25 (16H, м, СН2), 0,85 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,72 (COO), 156,79 (CO-6), 153,91 (C-2), 151,41 (C-4), 137,62 (CH-8), 129,56 (CH=CH), 116,43 (C-5), 71,81 (CH21'), 66,55 (CH2-3'), 62,53 (CH2-4'), 33,28, 31,14, 29,08, 28,54, 28,47, 28,40, 28,29, 26,59, 24,35, 22,07 (CH2), 13,86 (CH3-CH2). Пример 11 9-(2'-)цис-6''-Октадекеноилокси(этоксиметил)гуанин К раствору 1,0 г (4,43×10-3 моля) АСV в 20 мл безводного пиридина и 10 мл N,N-диметилформамида прибавляют 2 мл исходного раствора 2,1 г (6,98×10-3 моля) цис-6-октадекеноилхлорида в 6 мл дихлорметана и перемешивают реакционную смесь в азоте при комнатной температуре. Реакцию завершают обычным путем и перекристаллизовывают продукт, получают 1,6 г (80%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 10,65 (1Н, с, NН), 7,82 (1H, с, СН-8), 6,52 (2Н, с, NH2), 5,25-5,4 (4Н, м, СН2-1' и СН=СН ), 4,07 (2Н, т, СН2-4'), 3,65 (2Н, т, СН2-3'), 2,25 (2Н, т, СН2-СОО), 1,95 (4Н, м, CH2-CН=), 1,48 (2Н, м, CH2-C-COO), 1,20 (20Н, м, СН2), 0,85 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,66 (СОО), 156,72 (СО-6), 153,87 (С-2), 151,37 (С-4), 137,58 (СН-8), 129,85 и 129,17 (СН=СН ), 116,42 (С-5), 71,81 (СН2-1'), 66,52 (СН3-3'), 62,52 (СН2-4'), 33,14, 31,25, 29,06, 28,97, 28,85, 28,66, 28,57, 28,43, 26,56, 26,26, 23,96, 22,05 (СН2), 13,88 (СН3-СН2). Пример 12 9-(2'-)цис-9"-Октадекеноилокси(этоксиметил)гуанин К раствору 2,0 г (8,89×10-3 моля) АСV в 40 мл безводного пиридина и 20 мл N,N-диметилформамида прибавляют 4 мл исходного раствора 4,25 г (14,12×10-3 моля) цис-9-октадекеноилхлорида в 8 мл дихлорметана и перемешивают реакционную смесь в азоте при комнатной температуре. Оставшийся раствор хлорангидрида кислоты прибавляют порциями по 4 мл каждые 8 часов. После суммарного времени реакции 40 часов удаляют растворители в высоком вакууме. Остаток суспендируют в 50 мл воды и 100 мл хлороформа. Центрифугирование эмульсии дает полутвердую массу, которую перекристаллизовывают из этанола, получают 3,7 г (85%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 10,65 (1Н, c, NН), 7,82 (1Н, с, СН-8), 6,52 (2Н, с, NН2), 5,25-5,4 (4Н, м, СН2-1' и СН=СН ), 4,07 (2Н, т, CH2-4'), 3,65 (2Н, т, СН2-3'), 2,25 (2Н, т, СН2-СОО), 1,98 (4Н, м, СН2-СН=), 1,48 (2Н, м, СН2-С-СОО), 1,20 (20Н, м, СН2), 0,85 (3Н, т, CH3-CH2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,72 (COO), 156,70 (CO-6), 153,85 (С-2), 151,37 (С-4), 137,58 (СН-8), 129,58 (СН=СН ), 116,46 (С-5), 71,76 (СН2 11 41296 Реакцию завершают обычным путем и сырой продукт перекристаллизовывают и получают 1,7 г (78%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 10,60 (1Н, с, NН), 7,81 (1Н, с, СН-8), 6,60 (2Н, с, NН2), 5,25-5,4 (4Н, м, СН2-1' и СН=СН ), 4,05 (2Н, т, СН2-4'), 3,65 (2Н, т, СН2-3'), 2,22 (2Н, т, СН2-СОО), 1,95 (4Н, м, СН2-СН=), 1,45 (2Н, м, СН2-С-СОО), 1,20 (20Н, м, СН2), 0,85 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,75 (СОО), 156,76 (СО-6), 153,78 (С-2), 151,41 (С-4), 137,63 (СН-8), 130,03 (СН=СН ), 116,48 (С-5), 71,79 (СН21'), 66,54 (CH2-3'), 62,52 (CH2-4'), 33,28, 31,92, 31,09, 28,95, 28,79, 28,63, 28,38, 28,12, 24,35 и 22,05 (СН2), 13,86 (СН3-СН2). Пример 16 9-(2'-)цис-11''-Эйкозеноилокси(этоксиметил)гуанин К растрору 1,0 г (4,43×10-3 моля) АСV в 20 мл безводного пиридина и 10 мл N,N-диметилформамида прибавляют 2 мл исходного раствора 1,59 г (4,83×10-3 моля) циc-11-эйкозеноилхлорида в 4 мл дихлорметана и перемешивают реакционную смесь в азоте при комнатной температуре. Оставшийся раствор хлорангидрат кислоты прибавляют порциями по 1 мл каждые 8 часов. После суммарного времени реакции 60 часов удаляют растворители в высоком вакууме. Остаток обрабатывают хлороформом и водой и окончательно очищают на колонке с силикагелем (10% MeОН) (CHCI3), получают 0,92 г (40%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 10,65 (1Н, с, NH), 7,81 (1Н, с, СН-8) 6,50 (2Н, с, NН2), 5,25-5,4 (4Н, м, СН2-1' и СН=СН ), 4,08 (2Н, т, СН2-4'), 3,65 (2Н, т, СН2-3'), 2,21 (2Н, т, СН2-СОО), 2,0 (4Н, м, СН2-СН=), 1,45 (2Н, м, СН2-С-СОО), 1,25 (24Н, м, СН2), 0,85 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,73 (COO), 156,70 (CO-6), 153,90 (C-2), 151,37 (С-4), 137,59 (СН-8), 129,58 (СН=СН ), 116,35 (С-5), 71,81 (CН21'), 66,54 (СН2-3'), 62,52 (СН2-4'), 33,28, 31,26, 29,09, 28,82, 28,67, 28,58, 28,40, 26,56, 24,35 и 22,07 (СН2), 13,88 (СН3СН2). Пример 17 9-(2'-цис-13''-Докозеноилокси(этоксиметил)гуанин К раствору 1 г (4,43×10-3 моля) АСV в 20 мл безводного пиридина и 10 мг N,N-диметилформамида прибавляют 2 мл исходного раствора цис13-докозеноилхлорида (2,10 г, 5,88×10-3 моля) в 6 мл дихлорметана и перемешивают реакционную смесь в азоте при комнатной температуре. Реакцию завершают и продукт перекристаллизовывают (этанол), получают 1,24 г (52%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 10,65 (1Н, с, NН), 7,80 (1H, с, СН-8), 6,50 (2Н, с, NН2), 5,2-5,4 (4Н, м, СН2-1' и СН=СН ), 4,10 (2Н, т, СН2-4'), 3,65 (2Н, т, СН2-3'), 2,22 (2Н, т, СН2-СОО), 2,05 (4Н, м, СН2-С=), 1,45 (2Н, м, СН2-С-СОО), 1,25 (28Н, м, СН2), 0,85 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,74 (COO); 156,70 (CO-6), 153,87 (C-2), 151,38 (C-4), 33,28, 1'), 66,51 (СН2-3'), 62,50 (СН2-4'), 33,25, 31,23, 29,03, 28,78, 28,63, 28,54, 28,48, 28,42, 28,35, 26,54, 24,32, 22,03 (СН2), 13,87 (CH3-CH2). Пример 13 9-(2'-)транс-9''-Октадекеноилокси(этоксиметил)-гуанин К раствору 2,0 г (8,89×10-3 моля) АСV в 40 мл безводного пиридина и 20 мл N,N-диметилформамида прибавляют 4 мл исходного раствора 4,25 г (14,12×10-3 моля) транс-9-октадекеноилхлорида в 8 мл дихлорметана и реакционную смесь перемешивают при комнатной температуре в азоте. Оставшийся раствор хлорангидрида кислоты прибавляют порциями по 4 мл каждые 8 часов. После суммарного времени реакции 50 часов отгоняют растворители в высоком вакууме. Остаток суспендируют в 50 мл воды и 100 мл хлороформа и центрифугируют эмульсию, получают полутвердую массу, которую перекристаллизовывают из этанола, получают 3,75 г (86%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 10,65 (1Н, с, NН), 7,82 (1Н, с, СН-8), 6,75 (2Н, с, NH2), 5,25-5,4 (4Н, м, CH2-1' и СН=СН ), 4,07 (2Н, т, CН-4'), 3,65 (2Н, т, СН2-3'), 2,21 (2Н, т, СН2-СОО), 1,98 (4Н, м, СН2-СН=), 1,45 (2Н, м, СН2-С-СОО), 1,25 (20Н, м, СН2), 0,85 (3Н, т, СН3-СП2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,77 (COO), 156,72 (CO-6), 154,17 (C-2), 151,36 (C-4), 137,52 (CH-8), 130,03 (CH=CH), 116,44 (C-5), 71,77 (CH21'), 66,54 (CH2-3'), 62,55 (CH2-4'), 33,28, 31,93, 31,26, 28,98, 28,95, 28,82, 28,69, 28,49, 28,38, 28,33, 24,35 и 22,08 (CH2), 13,91 (CH3-CH2). Пример 14 9-(2'-)цис-11''-Октадекеноилокси(этоксиметил)гуанин К раствору 1,0 г (4,43×10-3 моля) АСV 20 мл безводного пиридина и 10 мл N,N-диметилформамида прибавляют 2 мл исходного раствора 2,1 г (6,98×10-3 моля) цис-11-октадекеноилхлорида в 6 мл дихлорметана и перемешивают реакционную смесь в азоте при комнатной температуре. Реакцию завершают обычным путем и продукт перекристиллизовывают, получают 1,8 г (90%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 10,65 (1H, с, NН), 7,82 (1H, с, СН-8), 6,52 (2Н, с, NН2), 5,25-5,4 (4Н, м, СН2-1' и СН=СН ), 4,07 (2Н, т, СН2-4'), 3,65 (2Н, т, СН2-3'), 2,25 (2Н, т, СН2-СОО), 1,95 (4Н, м, СН2-СН=), 1,48 (2Н, м, СН2-С-СОО), 1,20 (20Н, м, СН2), 0,85 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,74 (COO), 156,62 (CO-6), 153,91 (С-2), 151,34 (С-4), 137,58 (СН-8), 129,58 (СН=СН ), 116,22 (С-5), 71,82 (СН21'), 66,55 (СН2-3'), 62,50 (CH2-4'), 33,26, 31,09, 29,06, 28,81, 28,79, 28,62, 28,54, 28,36, 28,23, 26,55, 24,33, 22,04 (СН2), 13,87 (СН3-СН2). Пример 15 9-(2'-)транс-11''-Октадекеноилокси(этоксиметил)-гуанин К раствору 1,0 г (4,43×10-3 моля) АСV в 20 мл безводного пиридина и 10 мл N,N-диметилформамида прибавляют 2 мл исходного раствора транс-11-октадекеноилхлорида (2,1 г, 6,98×10-3 моля) в 6 мл дихлорметана и реакционную смесь перемешивают в азоте при комнатном температуре. 12 41296 (C-1'), 81,23 (C-4'), 75,88 (C-2'), 75,11 (C-3'), 63,88 (C-5'), 33,37, 31,29, 29,09, 29,05, 28,85, 28,70, 28,59, 28,48, 28,42, 26,56, 24,41, 22,08 (CH2), 13,87 (СН3-CH2). Пример 20 5'-О-(транс-9"-Октадекеноил)-1-b-D-арабинофуранозил-(N-6-метил)-аданин К раствору 1,0 г (3,55×10-3 моля) 9-b-Dарабинофуразоил-N-6-метил-аденина в 10 мл безводного пиридина и 15 мл N,N-диметилформамида прибавляют 2 мл исходного раствора транс-9-октадекеноилхлорида (2,0 г, 6,64×10-3 моля) в 6 мл дихлорметана и перемешивают реакционную смесь в азоте при комнатной температуре. Оставшийся исходный раствор прибавляют порциями по 20 мл с интервалами примерно 8 часов. После суммарного времени реакции 60 часов растворители отгоняют в высоком вакууме и остаток растворяют в 5% метанола и хлороформе и повторно хроматографируют на колонке с силикагелем, получают 0,7 г (36%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 8,25 (1H, с, АrH), 8,10 (1H, с, ArH) 7,75 (1H, с, NН), 6,29 (1H, д, Н-1'), 5,78 (1H, д, OН-2'), 5,70 (1H, д, ОН-3'), 5,255,35 (2Н, м, СН=СН) 4,40 (1H, м, Н-5'1), 4,27 (1Н, м, Н-5'2), 4,15 (2Н, м, H-2', Н-3'), 3,95 (1Н, м, Н-4'), 2,95 (3Н, шир., с, Н-СН3), 2,30 (2H, т, СН2-СОО), 1,90 (4Н, м, СН2-С=), 1,50 (2Н, н, CH2-C-COO), 1,25 (20Н, м, СН2), 0,85 (3H, т, CH3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,75 (COO), 154,89 (С-6), 152,43 (С-2), 149,33 (С-4), 140,02 (С8), 129,99 (СН=СН ), 118,20 (С-5), 83,61 (С-1'), 81,06 (С-4'), 75,77 (С-2'), 75,06 (С-3'), 63,76 (С-5'), 33,36, 31,90, 31,25, 28,97, 28,90, 28,81, 28,68, 28,47, 28,36, 28,30 (СН2), 27,20 (Н-СН3), 24,41, 22,07 (СН2), 13,89 (СН3-СН2). Пример 21 9-(4'-)транс-9''-Октадекеноилокси(-3'-оксиметилбутил)-гуанин К раствору 1,0 г (3,98×10-3 моля) 9-(4-окси-3оксиметилбутил)гуанина (пенсикловир) в 10 мл безводного пиридина и 40 мл N,N-диметилформамида прибавляют 2 мл исходного раствора транс-9-октадекеноилхлорида (2,1 г, 6,98×10-3 моля) в 6 мл дихлорметана и реакционную смесь перемешивают в азоте при комнатной температуре. Оставшийся исходный раствор прибавляют порциями по 2 мл с интервалами примерно 8 часов. После суммарного времени реакции 65 часов отгоняют растворители в высоком вакууме и остаток растворяют в 15% метанола в хлороформе и элюируют через колонку с силикагелем. Гомогенные фракции перекристаллизовывают из этанола, получают 0,45 г (22%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 10,50 (1Н, с, NH), 7,65 (1Н, с, СН-8), 6,43 (2H, с, NН2), 5,33 (2Н, м, CH=CH), 4,62 (1H, т, ОН), 4,00 (4Н, м, СН2-Н и RСООСН2), 3,38 (2Н, м, СН2-ОН), 2,25 (2Н, т, СН2СОО), 1,90 (4Н, м, СН2-С=), 1,60-1,80 (СН и СН2СН2N), 1,45 (2Н, м, СН2-С-СОО), 1,20 (20Н, м, СН2), 0,85 (3Н, т, СН3). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,90 (СОО), 156,75 (С-6), 153,40 (С-2), 151,07 (С-4), 137,22 (С8), 130,02 (CH=CH), 116,57 (С-5), 63,80 (RСООСН2), 60,50 (CH2OH), 40,67 (СН2N), 37,54 31,25, 29,06, 28,98, 28,85, 28,66, 28,56, 28,39, 26,53, 24,35, 22,06 (СН2), 13,89 (CH3-CH2). Пример 18 5'-О-о(цис-9"-Октадекеноил)-3'-деокси-3'азидотимидин К раствору 1,0 г 3'-деокси-3'-азидотимидина (АZТ) (3,75×10-3 моля) в 20 мл безводного пиридина прибавляют 2 мл исходного раствора цис-9октадекеноилхлорида (70%, 1,7 г, 3,9×10-3 моля) в 6 мл дихлорметана и перемешивают реакционную смесь в азоте при комнатной температуре. Оставшийся исходный раствор прибавляют порциями по 2 мл с интервалами примерно 8 часов. После суммарного времени реакции 60 часов растворители отгоняют в высоком вакууме и остаток разбавляют 100 мл хлороформа и 50 мл воды. Органическую фазу обрабатывают рассолом, сушат над сульфатом магния и концентрируют, получают вязкое масло. Продукт очищают хроматографией на колонке, элюируя 3% метанола в хлороформе. Гомогенные фракции выпаривают, получают 1,65 г (82%) целевого соединения в виде бесцветного вязкого масла. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 11,25 (1Н, с, NН), 7,45 (1Н, с, Н-6), 6,12 (1Н, т, Н-1'), 5,25-5,4 (2Н, м, СН=СН), 4,45 (1Н, м, Н-3'), 3,95 (1Н, м, Н4'), 2,25-2,45 (2Н, м, СН2-2'), 2,35 (2Н, т, СН2-СОО), 1,97 (4Н, м, СН2-СН=), 1,77 (3Н, с, СН3-5), 1,53 (2Н, м, СН2-С-СОО), 1,25 (20Н, м, СН2), 0,85 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,51 (СОО), 163,58 (СО-4), 150,32 (СО-2), 135,91 (CH-6), 129,55 и 129,49 (СН=СН ), 109,81 (С-5), 83,61 (СН-1'), 80,61 (СН-3'), 63,11 (СН2-5'), 60,17 (СН-4'), 35,67 (СН2-2'), 33,30, 31,29, 29,10, 29,06, 28,85, 28,70, 28,61, 28,54, 28,43, 26,56, 24,30, 22,09 (СН2), 13,85 (СН3-СН2), 12,04 (СН3-5). Пример 19 5'-О-(цис-9''-Октадекеноил)-9-b-D-арабинофуранозил-аденин К раствору 1,0 г (3,74×10-3 моля) 9-b-Dарабинофуранозил-аденина (АRА-А) в 10 мл безводного пиридина и 20 мл N,N-диметилформамида прибавляют 2 мл исходного раствора 2,1 (6,98×10-3 моля) цис-9-октадекеноилхлорида в 6 мл дихлорметана и реакционную смесь перемешивают в азоте при комнатной температуре. Оставшийся исходный раствор прибавляют порциями по 2 мл с интервалом примерно 8 часов. После суммарного времени реакции 50 часов растворители отгоняют в высоком вакууме и растворяют остаток в 10% метанола в хлороформе и фильтруют через колонку с силикагелем. Фракции концентрированного продукта очищают на колонке с силикагелем, получают 0,6 г (30%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 8,18 (1Н, с, ArH), 8,12 (1Н, с, АrН), 7,25 (2Н, с, NН2), 6,30 (1Н, д, H-1'), 5,78 (1H, д, ОН-2'), 5,68 (1H, д, ОН-3'), 5,25,4 (2H, м, СН=СН), 4,38 (1Н, м, H-5'1), 4,25 (1Н, м, H-5'2), 4,15 (2Н, м, Н-2', Н-3'), 3,95 (1Н, м, Н-4'), 2,30 (2H, т, CH2-COO), 1,95 (4H, м, CH2-C=), 1,50 (2H, м, CH2-C-COO), 1,25 (20Н, м, CH2), 0,85 (3Н, т, СН3-СН2). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,73 (COO), 155,43 (C-6), 151,85 (C-2), 149,28 (C-4), 140,60 (C8), 129,66 и 129,54 (СН=СН ), 118,22 (C-5), 83,82 13 41296 (СН), 33,44, 31,88, 31,22, 28,95, 28,90, 28,77, 28,64, 28,43, 28,27, 24,38, 22,04 (СН2), 13,90 (CH3). Пример 22 9-[2'-(транс-9"-октадекеноилокси)-1'-оксиметилэтоксиметил]-гуанин К раствору 9{[2-окси-1-(оксиметил)этокси]метил}гуанина (Гансикловир) (0,655 г, 2,56×10-3 моля) в 10 мл безводного пиридина и 40 мл N,N-диметилформамида прибавляют 2 мл исходного раствора транс-9-октадекеноилхлорида (1,3 г, 4,32×10-3 моля) в 6 мл дихлорметана, реакционную смесь перемешивают в азоте при 40°С. Оставшийся исходный раствор прибавляют порциями по 2 мл с иитервалом примерно 10 часов. Остаток суспендируют в 100 мл воды и 100 мл дихлорметана и центрифугируют эмульсию, получают полу твердую массу, которую перекристаллизовывают из этанола, получают 0,9 г (60%) целевого соединения в виде белого твердого продукта. 1 Н-ЯМР (ДМСО-d6, 300 МГц) d: 10,60 (1H, с, NH), 7,81 (1H, с, СН-8), 6,58 (2Н, с, NH2), 5,45 (2Н, с, ОСH2N), 5,35 (2Н, м, CH=СН), 4,85 (1H, т, ОН), 4,08 (1H, м), 3,90 (1Н, м) и 3,75 (1H, м) (RСООСН2 и СН-O), 3,35 (2Н, м, CH2OH), 2,08 (2Н, т, СН2СОО), 1,93 (4Н, м, СН2-С=), 1,10-1,45 (22Н, м, СН2), 0,85 (3Н, т, CH2CН3). 13 С-ЯМР (ДМСО-d6, 75 МГц) d: 172,64 (СОО), 156,85 (С-6), 153,84 (С-2), 151,34 (С-4), 137,62 (С8), 130,02 (СН=СН ), 116,48 (С-5), 76,88 (СН-О), 71,29 (OCH2N), 63,13 (RСООСН2), 60,39 (СН2ОН), 33,19, 31,97, 31,29, 29,02, 28,85, 28,72, 28,53, 28,41, 27,07, 27,02, 24,32, 22,10 (СН2), 13,90 (CH3). Фиг. 1а Фиг. 1б 14 41296 Фиг. 2 Фиг. 3 15 41296 Фиг. 4 16 41296 Фиг. 4 (продолжение) 17 41296 Фиг. 4 (продолжение) 18 41296 Фиг. 4 (продолжение) 19 41296 Фиг. 4 (продолжение) __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 20
ДивитисяДодаткова інформація
Назва патенту англійськоюNucleoside esters and derivatives thereof, a pharmaceutical composition based thereon
Автори англійськоюDalen Are, MYHREN FINN, BOERRETZEN BERNT, STOKKE KJELL TORGEIR
Назва патенту російськоюСложные эфиры нуклеозида и его производные, фармацевтическая композиция на их основе
Автори російськоюДален Аре, Мюхрен Финн, БЕРРЕТСЕН Бернт, СТУККЕ Кьелль Тургейр
МПК / Мітки
МПК: A61K 31/52, C07D 473/18, C07D 473/00, A61K 31/7042, C07H 19/02, C07H 19/16, A61K 31/7064, A61K 31/70, C07H 19/09, A61K 31/505, A61K 31/522, C07H 19/06, C07D 473/34, A61K 31/708, C07D 239/54, A61K 31/7052, C07H 19/19, A61K 31/7072, A61P 31/12, A61K 31/7076, A61K 31/7068
Мітки: складні, фармацевтична, основі, нуклеозиду, похідні, композиція, ефіри
Код посилання
<a href="https://ua.patents.su/20-41296-skladni-efiri-nukleozidu-ta-jjogo-pokhidni-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Складні ефіри нуклеозиду та його похідні, фармацевтична композиція на їх основі</a>
Попередній патент: Триазолілзаміщені третинні амінні сполуки або їх солі як інгібітор ароматази та фармацевтична композиція на їх основі
Наступний патент: Похідні індолу, фармацевтична композиція і спосіб лікування
Випадковий патент: Ємнісний негасенсор мостового типу