Циклопентаноіндоли, композиція, що їх містить, і способи лікування простагландинопосередкованих захворювань
Номер патенту: 73787
Опубліковано: 15.09.2005
Автори: Лябелль Марк, Бертелетт Карл, Шайгетц Джон, Стуріно Клаудіо, Ляшанс Ніколя, Рой Бруно, Бойд Майкл
Формула / Реферат
1. Сполука формули І:
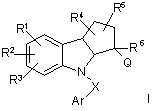
та її фармацевтично прийнятні солі, гідрати і складні ефіри, де:
R1, R2 і R3, кожний незалежно, вибирають з групи, що складається з:
(1) водню, і
(2) Rс,
R4 і R5, кожний незалежно, вибирають з групи, що складається з:
(1) Н,
(2) F,
(3) CN,
(4) С1-6алкілу,
(5) ORа, і
(6) S(O)nС1-6алкілу,
де кожна з вказаних алкільних груп необов'язково заміщена галогеном, або
R4 і R5 біля одного і того ж атома вуглецю можуть являти собою оксо, або
R4 і R5 біля одного і того ж атома вуглецю або біля суміжних атомів вуглецю, взяті разом, утворюють 3- або 4-членне кільце, що містить 0-1 гетероатом, вибраний з N, S або О, необов'язково заміщене однією або двома групами, вибраними з F, СF3 і СН3;
R6 вибирають з групи, що складається з:
(1) Н,
(2) С1-6алкілу, необов'язково заміщеного однією-шістьма групами, вибраними незалежно з ORа і галогену, і
(3) гетероциклілу, необов'язково заміщеного одним-чотирма галогенами; або R5 і R6, приєднані до суміжних атомів вуглецю, разом утворюють 3-4-членне кільце, що містить 0-1 гетероатом, вибраний з N, S або О, необов'язково заміщений однією-двома групами, вибраними з F, СF3 і СН3;
Х вибирають з групи, що складається з: С=O, SO2 і С1-4алкілу, де вказаний алкіл необов'язково заміщений одним-шістьма галогенами;
Ar являє собою арил або гетероарил, кожний з яких необов'язково є заміщеним однією-чотирма групами, незалежно вибраними з Rc;
Q являє собою С1-6алкіл, необов'язково заміщений однією-шістьма групами, незалежно вибраними з:
(1) галогену,
(2) арилу,
(3) гетероарилу,
(4) ОН,
(5) ОС1-6алкілу,
(6) СООН,
(7) CONRaRb,
(8) C(O)NSO2R7,
(9) тетразолілу,
де кожний з арилу, гетероарилу і алкілу необов'язково є заміщеним однією-шістьма групами, незалежно вибраними з галогену, СF3 і СООН; або
Q і R6 разом утворюють 3-4-членне кільце, що необов'язково містить гетероатом, вибраний з N, S і О, і необов'язково заміщене однією-двома групами, незалежно вибраними з:
(1) галогену,
(2) оксо,
(3) ORa,
(4) СООН,
(5) C(O)NHSO2R7, і
(6) тетразолілу,
R7 вибирають з групи, що складається з:
(1) С1-6алкілу, необов'язково заміщеного одним-шістьма галогенами,
(2) арилу, і
(3) гетероарилу,
де вказані арил і гетероарил необов'язково є заміщеними галогеном, ОС1-5алкілом, С1-5алкілом, і де вказаний алкіл необов'язково є заміщеним одним-шістьма галогенами;
Ra і Rb незалежно вибирають з водню і С1-6алкілу, необов'язково заміщеного одним-шістьма галогенами;
Rc являє собою:
(1) галоген,
(2) CN,
(3) С1-6алкіл, необов'язково заміщений однією-шістьма групами, незалежно вибраними з галогену, NRaRb, C(O)Ra, C(ORa)RaRb і ORa,
(4) С2-6алкеніл, необов'язково заміщений однією-шістьма групами, незалежно вибраними з галогену і ORa,
(5) гетероцикліл,
(6) арил,
(7) гетероарил,
(8) С(O)Ra,
(9) C(ORa)RaRb,
(10) C(O)ORa,
(11) CONRaRb,
(12) OCONRaRb,
(13) S(O)nR7,
(14) NRaC(O)OC1-6алкіл, де алкіл необов'язково заміщений одним-шістьма галогенами, і
(15) S(O)nNRaRb,
де гетероцикліл, арил, гетероарил необов'язково є заміщеними однією-чотирма групами, незалежно вибраними з галогену;
n дорівнює 0, 1 або 2.
2. Сполука за п. 1, де Х являє собою СН2.
3. Сполука за п. 1, де Q являє собою С1-3алкіл, заміщений СООН.
4. Сполука за п. 1, де Q і R6 разом утворюють 3-4-членне кільце, що містить 0-1 гетероатом, вибраний з N, S і О, і необов'язково заміщене однією-двома групами, вибраними з галогену, ОН, СООН, оксо, тетразолілу, C(O)NSO2R7, ОС1-6алкілу, де вказана алкільна група необов'язково заміщена одним-шістьма галогенами.
5. Сполука за п. 1, де R3 являє собою Н, R1 і R2 вибирають з групи, що складається з водню, галогену, С1-3алкілу (необов'язково заміщеного однією-шістьма групами, незалежно вибраними з галогену, C(O)Ra і C(ORa)RaRb, арилу, гетероарилу, гетероциклілу, С(O)ОС1-3алкілу, S(O)nС1-3алкілу, S(O)nNRaRb, C(O)Ra, C(OH)RaRb і C(OC1-3aлкiл)RaRb, де кожний арил, гетероарил, гетероцикліл і алкіл необов'язково є заміщеним одним-шістьма атомами галогену; n = 0, 1 або 2; Ra і Rb незалежно вибирають з водню і С1-6алкілу, необов'язково заміщеного галогеном.
6. Сполука за п. 1, де кожний з R4 і R5 незалежно вибирають з групи, що складається з Н, С1-4алкілу, необов'язково заміщеного одним-шістьма атомами галогену, і ORa, де Ra є таким, як визначено у п. 1; або R4 і R5, приєднані до одного і того ж атома вуглецю, являють собою оксо.
7. Сполука за п. 1, де Ar являє собою арил або гетероарил, кожний з яких необов'язково заміщений однією-чотирма групами, незалежно вибраними з галогену, CN, С1-4алкілу, необов'язково заміщеного одним-шістьма атомами галогену, C(O)Ra і C(OH)RaRb, де Ra і Rb незалежно вибирають з водню і С1-6алкілу, необов'язково заміщеного галогеном.
8. Сполука за п. 1, що має формулу Іа:
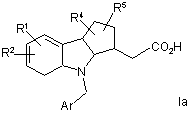 ,
,
де Ar і R1-R4 є такими, як визначено у п. 1.
9. Сполука за п. 8, де кожний з R4 і R5 являє собою водень, і R1 не є воднем у 7-положенні.
10. Фармацевтична композиція, що містить сполуку формули І за будь-яким з пп. 1-9 або її фармацевтично прийнятну сіль, гідрат або складний ефір і фармацевтично прийнятний носій.
11. Спосіб лікування простагландинопосередкованих захворювань, при якому вводять пацієнту, який потребує такого лікування, терапевтично ефективну кількість сполуки за п. 1.
12. Сполука формули І за будь-яким з пп. 1-9 або її фармацевтично прийнятна сіль, гідрат або складний ефір для застосування у лікувальній терапії.
13. Сполука формули І за будь-яким з пп. 1-9 або її фармацевтично прийнятна сіль, гідрат або складний ефір для застосування при лікуванні простагландинопосередкованих захворювань.
14. Сполука формули І за будь-яким з пп. 1-9 або її фармацевтично прийнятна сіль, гідрат або складний ефір для застосування при лікуванні закупорення носового каналу, алергічної астми або алергічного риніту.
15. Фармацевтична композиція за п. 10, що має антагоністичну активність відносно закупорювальної дії носових каналів і легень під дією простагландинів D-типу, що містить прийнятну антагоністичну кількість сполуки формули І за будь-яким з пп. 1-9 або її фармацевтично прийнятну сіль, гідрат або складний ефір у поєднанні з фармацевтично прийнятним носієм.
Текст
Даний винахід відноситься до сполук і способів лікування простагландин-опосередкованих захворювань та їх деяких фармацевтичних композицій. Більш конкретно, сполуки за винаходом структурно відрізняються від стероїдів, антигістамінів або адренергічних агоністів і є антагоністами дії простагландинів D-типу, що закупорює носові канали та легені. У двох оглядових статтях описані характеристики і терапевтична значимість простаноїдних рецепторів, а також більшості селективних агоністів і антагоністів, що звичайно використовуються: Eicosanoids: From Biotechnology to Therapeutic Applications (Ейкозаноїди: від біотехнології до терапевтичних застосувань), ред. Folco, Samuelsson, Maclouf and Velo, Plenum Press, New York, 1996, частина 14, 13ΤΙ 54, і Journal of Lipid Mediators and Cell Signalling, 1996, 14, 83-87. У статті T.Tsuri et al., опублікованій в 1997 p. в Journal of Medicinal Chemistry, vol.40, pp.3504-3507, вказано, що «PGD2 розглядається як важливий медіатор при різних алергічних захворюваннях, таких як алергічний риніт, неінфекційно-алергічна (атонічна) бронхіальна астма, алергічний кон'юнктивіт і атопічний дерматит». Зовсім нещодавно, у статті Matsuoka et al., в Science (2000), 287:2013-7, PGD2 описаний як ключовий медіатор при алергічній астмі. Крім того, у патентах, таких як патент США 4808608, згадується, що антагоністи простагландину можуть використовуватися при лікуванні алергічних захворювань і, детально, при лікуванні алергічної астми. Антагоністи PGD2 описані, наприклад, у заявці на Європейський патент 837052 і заявці РСТ WO98/25919, а також WO99/62555. У патенті США 4808608 описані похідні тетрагідрокарбазол-1-алканової кислоти як антагоністи простагландину. У заявці на Європейський патент 468785 описана сполука 4-[(4-хлорфеніл)метил]-1,2,3,4-тетрагідро-7(2-(хінолінілметокси)циклопент[Ь]індол-3-оцтова кислота, яка є різновидом роду, що вважається інгібіторами біосинтезу лейкотрієну. У патенті США 3535326 описані сполуки, що володіють протизапальною дією, формули: Даний винахід відноситься до нових сполук, які являють собою антагоністи простагландинових рецепторів; більш конкретно, вони є антагоністами простагландин D2 рецептора (DP рецептор). Сполуки даного винаходу корисні для лікування різних простагландин-опосередкованих захворювань і хворобливих станів; відповідно, даний винахід відноситься до способу лікування простагландин-опосередкованих захворювань з використанням описаних у ньому нових сполук, а також фармацевтичних композицій, що їх містять. Даний винахід відноситься до сполук формули І: та їх фармацевтично прийнятних солей, гідратів і складних ефірів, де: R1, R2 і R3 , кожний незалежно, вибирають з групи, що складається з: (1) водню і (2) Rc, R4 і R5, кожний незалежно, вибирають з групи, що складається з: (1) Н, (2) F, (3) CN, (4) С1-6алкілу, (5) OR a, і (6) S(О)nС1-6алкілу, де кожна з вказаних алкільних груп необов'язково заміщена галогеном, або R4 і R5 біля одного і того ж атома вуглецю можуть являти собою оксо, або R4 і R5 біля одного і того ж атома вуглецю або біля суміжних атомів вуглецю, взяті разом, утворюють 3або 4-членне кільце, що містить 0-1 гетероатом, вибраний з N, S або О, необов'язково заміщене однією або двома групами, вибраними з F, CF3 і СН3; R6 вибирають з групи, що складається з: (1) Н, (2) С1-6алкілу, необов'язково заміщеного однією-шістьма групами, вибраними незалежно з ORa і галогену, і (3) гетероциклілу, необов'язково заміщеного одним-чотирма галогенами; або R5 і R6, приєднані до суміжних атомів вуглецю, разом утворюють 3-4-членне кільце, що містить 0-1 гетероатом, вибраний з N, S або О, необов'язково заміщений однією-двома групами, вибраними з F, CF3 і СН3; X вибирають з групи, що складається з: С=О , SO2 і С1- 4алкілу, де вказаний алкіл необов'язково заміщений одним-шістьма галогенами; Аr являє собою арил або гетероарил, кожний з яких необов'язково є заміщеним однією-чотирма групами, незалежно вибраними з Rc; Q являє собою С 1-6алкіл, необов'язково заміщений однією-шістьма групами, незалежно вибраними з: (1) галогену, (2) арилу, (3) гетероарилу, (4) ОН, (5) ОСі_6алкілу, (6) СООН, (7) CONRaRb, (8) C(O)NSO2R7, (9) тетразолілу, де кожний з арилу, гетероарилу і алкілу необов'язково є заміщеним однією-шістьма групами, незалежно вибраними з галогену, CF3 і СООН; або Q і R6 разом утворюють 3-4-членне кільце, яке необов'язково містить гетероатом, вибраний з N, S і О, і необов'язково заміщене однією-двома групами, незалежно вибраними з: (1) галогену, (2) оксо, (3) OR a, (4) СООН, (5) C(O)NHSO2R7, і (6) тетразолілу, R7 вибирають з групи, що складається з: (1) С1-6алкілу, необов'язково заміщеного одним-шістьма галогенами, (2) арилу і (3) гетероарилу, де вказані арил і гетероарил необов'язково є заміщеними галогеном, ОС1-5алкілом, С1-5алкілом, і де вказаний алкіл необов'язково є заміщеним одним-шістьма галогенами; Ra і Rb незалежно вибирають з водню і С1-6алкілу, необов'язково заміщеного одним-шістьма галогенами; Rc являє собою: (1) галоген, (2) CN, (3) С1-6алкіл, необов'язково заміщений однією-шістьма групами, незалежно вибраними з галогену, NRaRb, C(O)R a, C(OR a)RaRb і OR a, (4) С2-6алкеніл, необов'язково заміщений однією-шістьма групами, незалежно вибраними з галогену і ORa, (5) гетероцикліл, (6) арил, (7) гетероарил, (8) C(O)Ra, (9) C(ORa)RaRb, (10) C(O)OR a, (11)CONRaRb, (12) OCONR aRb, (13) S(O)nR7, (14) NR aC(O)OС1-6алкіл, де алкіл необов'язково заміщений одним-шістьма галогенами, і (15) S(O)nNRaRb, де гетероцикліл, арил, гетероарил необов'язково є заміщеними однією-чотирма групами, незалежно вибраними з галогену; n дорівнює 0, 1 або 2. В об'єм винаходу також включені фармацевтичні композиції, що містять сполуку формули І і способи лікування або профілактики простагландин-опосередкованих захворювань з використанням сполук формули І. Нумерація ядра трициклічної кільцевої системи показана нижче: Винахід описаний з використанням наступних визначень, якщо не вказано іншого. Термін «галоген» або «гало» включає F, СІ, Вr та І. Термін «алкіл» відноситься до лінійних, розгалужених та циклічних і біциклічних стр уктур та їх комбінацій, що містять вказане число атомів. Необмежуючі приклади алкільних груп включають метил, етил, пропіл, ізопропіл, бутил, втор- і трет-бутил, пентил, гексил, гептил, октил, ноніл, ундецил, додецил, тридецил, тетрадецил, пентадецил, ейкозил, 3,7-діетил-2,2-диметил-4-пропілноніл, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклопропілметил, циклопентилетил, метилзаміщений циклопропіл, етилзаміщений циклобутил, адамантил, циклододецилметил, 2-етил-1-біцикло[4.4.0]децил і тому подібні. Термін «С1-6алкіл» охоплює ациклічні алкільні групи, що мають вказане число атомів вуглецю, а також -Схалкіл-С zциклоалкіл, де x дорівнює від 0 до 3, і z дорівнює від 3 до 6, за умови, що х+z=від 3 до 6. «Галогеналкіл» означає алкільну групу, як описано вище, де один або декілька атомів водню були замінені на атоми галогену аж до повного заміщення всіх атомів водню групами галогену. С1-6галогеналкіл, наприклад, включає -CF3, -CF2CF 3 і тому подібне. «Алкокси» означає алкоксильні групи лінійної, розгалуженої або циклічної конфігурації, що мають вказане число атомів вуглецю. С1-6алкокси, наприклад, включає метокси, етокси, пропокси, ізопропокси і тому подібні. «Галогеналкокси» означає алкоксильну групу, як описано вище, де один або декілька атомів водню були замінені на атоми галогену аж до повного заміщення всіх атомів водню гр упами галогену. С16галогеналкокси, наприклад, включає -OCF3, -OCF2CF 3 і тому подібне. «Алкеніл» означає лінійні або розгалужені структури та їх комбінації з вказаного числа атомів вуглецю, що мають, принаймні, один вуглець-вуглецевий подвійний зв'язок, де атоми водню можуть бути замінені додатковим вуглець-вуглецевим подвійним зв'язком. С1-6алкеніл, наприклад, включає етеніл, пропеніл, 1метил-етеніл, бутеніл і тому подібні. «Гетероцикліл» відноситься до неароматичного кільця, що містить від 1 до 4 гетероатомів, вказане кільце є окремим або сконденсованим з другим кільцем, вибраним з 3-7-членного аліциклічного кільця, що містить від 0 до 4 гетероатомів, арилу і гетероарилу, де вказані гетероатоми незалежно вибирають з О, N і S. Необмежуючі приклади гетероциклілу включають оксетаніл, 1,3-дитіацикло-пентан, дигідробензофуран і тому подібні. «Арил» означає 6-14-членну карбоциклічну ароматичну кільцеву систему, що включає 1-3 бензольних кільця. Якщо є присутніми два або більше ароматичних кільця, то кільця конденсовані спільно, таким чином, що суміжні кільця беруть участь у спільному зв'язку. Приклади включають феніл і нафтил. Термін «гетероарил» (Het), як він використаний у даному описі, являє собою 5-10-членну ароматичну кільцеву систему, що містить одне кільце або два конденсованих кільця, 1-4 гетероатоми, вибрані з О, S і N. Het включає, але не обмежується ними, фураніл, діазиніл, імідазоліл, ізоксазоліл, ізотіазоліл, оксадіазоліл, оксазоліл, піразоліл, піридил, піроліл, тетразиніл, тіазоліл, тієніл, триазиніл, триазоліл, 1Н-пірол-2,5-діоніл, 2-пірон, 4-пірон, пірол опіридин, фуропіридин і тієнопіридин. Для даного опису наступні скорочення мають вказані значення: ВОС=трет-бутилоксикарбоніл CBZ=карбобензокси DCC=1,3-дициклогексилкарбодіімід DIBAL=діізобутилалюмінійгідрид DIEA=Ν,Ν-діізопропілетиламін DMAP=4-(диметиламіно)піридин ДМФ=диметилформамід EDCI=гідрохлорид 1-(3-диметиламінопропіл)-3-етилкарбодііміду EDTA=тетранатрієва сіль етилендіамінтетраоцтової кислоти, гідрат FAB=бомбардування швидкими атомами FMOC=9-флуоренілметоксикарбоніл ГМФА=гексаметилфосфорамід HATU=гексафторфосфат О-(7-азабензотриазол-1-іл)N,N,N',N'-тетраметилуронію HOBt=1-гідроксибензотриазол HRMS=мас-спектрометрія високого розрізнення ICBF=ізобутилхлор форміат KHMDS=гексаметилдисилазан калію LDA=діізопропіламід літію МСРВА=метахлорпербензойна кислота Ms=метансульфоніл=мезил MsO=метансульфонат=мезилат NBS=N-бромсукцинімід NMM=4-метилморфолін РСС=хлорхромат піридинію PDC=дихромат піридинію Ph=феніл pPTS п-толуолсульфонат піридинію pTSA п-толуолсульфонова кислота КТ кімнатна температура рац. рацемічний ТfO трифторметансульфонат=трифлат ТШХ тонкошарова хроматографія Скорочення алкільних гр уп Ме=метил Et=етил n-Рr=нормальний пропіл і-Рі=ізопропіл с-Рr=циклопропіл n-Bu=нормальний бутил і-Вu=ізобутил с-Вu=циклобутил s-Bu=вторинний бутил t-Bu=третинний бутил Одним варіантом сполук формули І є сполуки, де X являє собою С1-4алкіл; більш конкретно, де X являє собою СН 2. Іншим варіантом сполук формули І є сполуки, де Q являє собою С1-6алкіл, заміщений СООН або тетразолілом. Іншим варіантом сполук формули І є сполуки, де Q являє собою С1-3алкіл, необов'язково заміщений однією-шістьма групами, вибраними з групи, що складається з галогену, СООН, тетразолілу і CONRaRb, де Ra і Rb незалежно вибирають з водню і С1-6алкілу, необов'язково заміщеного одним-шістьма галогенами (переважно фтором). Більш конкретно, Q являє собою С1-3алкіл, заміщений СООН. Іншим варіантом сполук формули І є сполуки, де Q і R6 разом утворюють 3-4-членне кільце, що містить 0-1 гетероатом, вибраний з N, S і О, і необов'язково заміщене однією-двома групами, вибраними з галогену, ОН, СООН, оксо, тетразолілу, C(O)NSO2R7, ОС1-6алкілу, де вказана алкільна група необов'язково заміщена одним-шістьма галогенами. Більш конкретно, Q і R6 разом утворюють 3-4-членне кільце, що містить 0-1 гетероатом, вибраний з N, S і О, і необов'язково заміщене СООН або тетразолілом. Іншим варіантом сполук формули І є сполуки, де R3 являє собою Н, R1 і R2 вибирають з групи, що складається з водню, галогену, С1-3алкілу (необов'язково заміщеного однією-шістьма групами, незалежно вибраними з галогену, C(O)Ra і C(ORa)RaRb), арилу, гетероарилу, гетероциклілу, С(О)ОС1-3алкілу, S(О)nС1a b a a b a b 3алкілу, S(O)nNR R , C(O)R , C(OH)R R і C(OC 1-3алкіл)R R , де кожний арил, гетероарил, гетероцикліл і алкіл необов'язково є заміщеними одним-шістьма атомами галогену; n=0, 1 або 2; Ra і Rb незалежно вибирають з водню і С1-6алкілу, необов'язково заміщеного галогеном. Галоген, при використанні у даному варіанті втілення, переважно являє собою фтор. Іншим варіантом сполук формули І є сполуки, де кожний з R4 і R5 незалежно вибирають з групи, що складається з Н, С1-4алкілу, необов'язково заміщеного одним-шістьма атомами галогену, переважно фтору, і ORa, де Ra є таким, як визначено для цього значення у формулі І, переважно воднем; або R4 і R5, приєднані до одного і того ж атому вуглецю, являють собою оксо. Іншим варіантом сполук формули І є сполуки, де Аг являє собою арил або гетероарил, кожний з яких необов'язково заміщений однією-чотирма групами, незалежно вибраними з галогену, CN, С1-4алкілу, необов'язково заміщеного одним-шістьма атомами галогену, переважно фтору, C(O)Ra і C(OH)RaRb, де Ra і Rb незалежно вибирають з водню і С 1-6алкілу, необов'язково заміщеного галогеном (переважно фтором). Переважними сполуками формули І є сполуки формули Іа: де Аr і R1-R4 є такими, як визначено для формули І. У більш переважному варіанті втілення кожний з R 4 і R5 являє собою водень, і R1 не є воднем у 7-положенні. Оптичні ізомери - Діастереомери - Геометричні ізомери -Таутомери Сполуки формули І містять один або декілька асиметричних центрів і отже можуть існувати у вигляді рацематів і рацемічних сумішей, окремих енантіомерів, діастереомерних сумішей та окремих діастереомерів. Мається на увазі, що даний винахід включає в себе всі такі ізомерні форми сполук формули І. Деякі з описаних тут сполук містять олефінові подвійні зв'язки, і мається на увазі, що, якщо не вказано іншого, включають обидва геометричних ізомери Ε і Ζ. Деякі з описаних тут сполук, в яких водень може бути приєднаний у різних місцях, згадуються як таутомери. Таким прикладом може бути кетон і його енольна форма, відомі як кето-енольні таутомери. Сполуки формули І охоплюють індивідуальні таутомери, а також їх суміші. Сполуки формули І можуть бути розділені на діастереоізомерні пари енантіомерів, наприклад, дробною кристалізацією з відповідного розчинника, наприклад, метанолу або етилацетату або з їх суміші. Одержана таким чином пара енантіомерів може бути розділена на індивідуальні стереоізомери звичайними методами, наприклад, при використанні як агента, що розділяє, оптично активної кислоти. Альтернативно, будь-який енантіомер сполуки загальної формули І або Іа може бути одержаний стереоспецифічним синтезом з використанням оптично чистих вихідних речовин або реагентів відомої конфігурації. Солі Термін «фармацевтично прийнятні солі» відноситься до солей, одержаних з фармацевтично прийнятних нетоксичних основ, включаючи неорганічні основи і органічні основи. Солі, одержані з неорганічних основ, включають солі алюмінію, амонію, кальцію, міді, заліза (II), заліза(III), літію, магнію, марганцю(III), марганцю (II), калію, натрію, цинку і тому подібні. Особливо переважними є солі амонію, кальцію, магнію, калію і натрію. Солі, одержані з фармацевтично прийнятних органічних нетоксичних основ, включають солі первинних, вторинних і третинних амінів, заміщених амінів, включаючи природні заміщені аміни, циклічних амінів і основних іонообмінних смол, таких як аргінін, бетаїн, кафеїн, холін, Ν,Ν'дибензилетилендіамін, діетиламін, 2-діетиламіноетанол, 2-диметиламіноетанол, етаноламін, етилендіамін, N-етилморфолін, N-етилпіперидин, глюкамін, глюкозамін, гістидин, гідрабамін, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, поліамінові смоли, прокаїн, пурини, теобромін, триетиламін, триметиламін, трипропіламін, трометамін і тому подібні. Коли сполука даного винаходу є основною, солі можуть бути одержані з фармацевтично прийнятних нетоксичних кислот, включаючи неорганічні та органічні кислоти. Такі кислоти включають оцтову, бензолсульфонову, бензойну, камфорсульфонову, лимонну, етансульфонову, фумарову, глюконову, глутамінову, бромистоводневу, хлористоводневу, ізетіонову, молочну, малеїнову, яблучну, мигдалеву, метансульфонову, слизову, азотну, памову, пантотенову, фосфорну, янтарну, сірчану, винну, птолуолсульфонову кислоту і тому подібні. Особливо переважними є лимонна, бромистоводнева, хлористоводнева, малеїнова, фосфорна, сірчана і винна кислоти. Потрібно розуміти, що якщо не вказано іншого, мається на увазі, що посилання на сполуки формули І також включають фармацевтично прийнятні солі. Застосування Здатність сполук формули І взаємодіяти з простагландиновими рецепторами робить їх корисними для профілактики або зникнення небажаних симптомів, викликаних простагландинами у ссавців, особливо у людини. Така імітація або антагонізм дії простагландинів вказують на те, що сполуки та їх фармацевтичні композиції корисні для лікування, профілактики або поліпшення самопочуття у ссавців і особливо у людей захворювань дихальних шля хів, алергічних станів, болю, запальних захворювань, порушень виділень слизової, кісткових захворювань, порушень сну, порушень здібності до відтворення потомства, порушень зсілості крові, проблем зору, а також імунних і автоімунних захворювань. Крім того, така сполука може інгібувати клітинні трансформації, що відносяться до новоутворень, та ріст метастазів пухлин і, отже, може використовува тися при лікуванні раку. Сполуки формули І також можуть використовува тися для лікування і/або профілактики простагландин-опосередкованих порушень проліферації, таких, які можуть існувати при діабетичній ретинопатії та ангіогенезі пухлин. Сполуки формули І також можуть інгібувати простаноїдіндуковане скорочення гладкої мускулатури за рахунок антагонізування простаноїдів, що скорочуються, або імітації простаноїдів, що розслаблюють, і внаслідок цього можуть використовуватися при лікуванні дисменореї (розлади менструального циклу), передчасних родів і захворювань, що відносяться до еозинофілів. Більш конкретно, сполуки формули І являють собою антагоністи простагландину D2. Відповідно, інший аспект винаходу відноситься до способу лікування або профілактики простагландинопосередкованого захворювання, що включає введення пацієнту-ссавцеві, який потребує такого лікування, сполуки формули І у кількості, що є ефективною для лікування або профілактики вказаного простагландинопосередкованого захворювання. Простагландин-опосередковані захворювання включають, але не обмежуються ними, алергічний риніт, закупорку носового каналу, ринорею, тривалий риніт, запалення носового каналу, астму, включаючи алергічну астму, хронічні обструктивні захворювання легень та інші форми запалення легень; порушення сну і порушення циклу засинання-прокидання; простаноїд-індуковане скорочення гладкої мускулатури, пов'язане з дисменореєю (розладом менструального циклу) і передчасними родами; захворювання, пов'язані з еозинофілами; тромбоз; глаукому і порушення зору; захворювання закупорки судин; застійну серцеву недостатність; захворювання або хворобливі стани, що вимагають антикоагулюючого лікування, такі як посттравматичне або постхірургічне лікування; запалення; гангрену; хворобу Рейнауда (Raynaud); порушення секреції слизової, включаючи цитозахист; біль і мігрень; захворювання, що вимагають боротьби з утворенням і розсмоктуванням кісткової тканини, такі, наприклад, як остеопороз; шок; терморегуляцію, включаючи високу температуру; та імунні порушення або хворобливі стани, при яких бажане імунорегулювання. Більш конкретно, захворювання, призначене для лікування, є захворюванням, опосередкованим простагландином D2, таким як закупорка носового каналу, закупорка легень і астма, включаючи алергічну астму. Одним варіантом втілення винаходу є спосіб лікування або профілактики простагландинопосередкованого захворювання, що включає введення пацієнту-ссавцеві, який потребує такого лікування, сполуки формули І у кількості, яка є ефективною для лікування або профілактики простагландинопосередкованого захворювання, де простагландин-опосередковане захворювання являє собою закупорку носового каналу, риніт, включаючи алергічний і тривалий риніт, та астму, включаючи алергічну астм у. Іншим варіантом втілення даного винаходу є спосіб лікування або профілактики простагландин D2опосередкованого захворювання, що включає введення пацієнту-ссавцеві, який потребує такого лікування, сполуки формули І у кількості, яка є ефективною для лікування або профілактики простагландин D2опосередкованого захворювання, де вказане простагландин D2-опосередковане захворювання являє собою закупорку носового каналу або астму. Іншим варіантом втілення даного винаходу є спосіб лікування закупорки носового каналу у пацієнта, який потребує такого лікування, що включає введення вказаному пацієнту терапевтично ефективної кількості сполуки формули І. Ще одним варіантом втілення даного винаходу є спосіб лікування астми, зокрема алергічної астми, у пацієнта, який потребує такого лікування, що включає введення вказаному пацієнту терапевтично ефективної кількості сполуки формули І. Діапазон дозування Величина профілактичної або терапевтичної дози сполуки формули І, звичайно, буде змінюватися в залежності від природи і серйозності хворобливого стану, що піддається лікуванню, конкретної сполуки формули І і шляху введення. Вона також буде змінюватися відповідно до великої кількості факторів, включаючи вік, вагу, загальний стан здоров'я, стать, режим харчування, час введення, швидкість виділення, комбінацію лікарських засобів і реакцію у відповідь індивідуального пацієнта. Звичайно, денна доза складає приблизно від 0,001мг до приблизно 100мг накг ваги тіла ссавця, переважно від 0,01мг до приблизно 10мг накг. З іншого боку, у деяких випадках може виявитися необхідним використовувати дозування, що знаходяться за даними межами. Кількість активного інгредієнта, яку можна об'єднувати з речовинами носія для одержання окремої препаративної лікарської форми, буде змінюватися в залежності від організму-хазяїна, що піддається лікуванню, і конкретного способу введення. Наприклад, склад, що призначається для перорального введення людям, може містити від 0,05мг до 5г активного агента, компаундованого з відповідною і придатною кількістю матеріалу носія, яка буде змінюватися приблизно від 5 до 99,95 процента від загальної композиції. Одиничні препаративні лікарські форми звичайно будуть містити приблизно від 0,1мг до приблизно 0,4г активного інгредієнта, звичайно 0,5мг, 1мг, 2мг, 5мг, 10мг, 25мг, 50мг, 100мг, 200мг або 400мг. Фармацевтичні композиції Інший аспект даного винаходу відноситься до фармацевтичних композицій, що включають сполуку формули І з фармацевтично прийнятним носієм. Термін «композиція», як він вжитий для фармацевтичної композиції, призначений для охоплення продукту, що включає активний інгредієнт(и) та інертний інгредієнт(и) (фармацевтично прийнятні ексципієнти), який складає носій, а також будь-якого продукту, який виникає, безпосередньо або опосередковано, при комбінації, комплексоутворенні або агрегації будь-яких двох або більше інгредієнтів, або при дисоціації одного або декількох інгредієнтів, або внаслідок інших типів реакцій або взаємодій одного або декількох інгредієнтів. Відповідно, фармацевтичні композиції даного винаходу о хоплюють будь-яку композицію, одержану змішуванням сполуки формули І, додаткового активного інгредієнта(ів) та фармацевтично прийнятних ексципієнтів. Для лікування будь-якого з простаноїд-опосередкованих захворювань сполуки формули І можна вводити орально, шляхом інгаляційного розпилення, місцево, парентерально або ректально у вигляді одиничних препаративних лікарських складів, що містять звичайні нетоксичні фармацевтично прийнятні носії, ад'юванти і наповнювачі. Термін «парентеральний», як він використаний у даному описі, включає підшкірні ін'єкції, внутрішньовенні, внутрішньом'язові, інтрастенальні ін'єкції або методики вливання. На додаток до лікування теплокровних тварин, таких як миші, щурі, коні, велика рогата худоба, вівці, собаки, коти і т.д., сполука за винаходом ефективна для лікування людей. Фармацевтичні композиції, що містять активний інгредієнт, можуть знаходитися у формі, відповідній для перорального застосування, наприклад, у вигляді таблеток, пілюль, пастилок для розсмоктування, водних або масляних суспензій, порошків або гранул, що диспергуються, емульсій, твердих або м'яких желатинових капсул або сиропів або еліксирів. Композиції, призначені для перорального застосування, можуть бути одержані відповідно до будь-якого способу, відомого у даній області для виробництва фармацевтичних композицій, і такі композиції можуть містити один або декілька агентів, вибраних з групи, що складається з підсолоджувачів, смакових агентів, барвників і консервантів для одержання фармацевтично придатних і приємних препаратів. Таблетки містять активний інгредієнт у суміші з нетоксичними фармацевтично прийнятними ексципієнтами, які є придатними для виробництва таблеток. Такі ексципієнти можуть являти собою, наприклад, інертні розріджувачі, такі як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; агенти, що гранулюють і дезінтегрують, наприклад, кукурудзяний крохмаль або альгінову кислоту; агенти, що зв'язують, наприклад, крохмаль, желатин або гуміарабік, і мастильні агенти, наприклад, стеарат магнію, стеаринову кислоту або тальк. Таблетки можуть бути не покриті оболонкою, або вони можуть бути покриті оболонкою відомими способами для сповільнення розкладання і поглинання у шлунково-кишковому тракті і забезпечення таким чином тривалої дії протягом тривалого періоду часу. Наприклад, можна використовувати речовину для відстрочки часу, таку як гліцерилмоностеарат або гліцерилдистеарат. Вони також можуть бути покриті оболонкою способом, описаним у патентах США 4256108; 4166452 і 4265874, для утворення осмотичних лікувальних таблеток для вивільнення, що контролюється. Склади для перорального застосування також можуть бути представлені у вигляді твердих желатинових капсул, в яких активний інгредієнт змішаний з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або у вигляді м'яких желатинових капсул, де активні інгредієнти змішують з розчинниками, що змішуються з водою, такими як пропіленгліколь, PEG (поліетиленгліколі) і етанол, або масляним середовищем, наприклад, арахісовою олією, рідким парафіном або оливковою олією. Водні суспензії містять активний інгредієнт у суміші з ексципієнтами, придатними для одержання водних суспензій. Такі ексципієнти являють собою агенти, що суспендують, наприклад, карбоксиметилцелюлозу натрію, метилцелюлозу, гідроксипропілметилцелюлозу, альгінат натрію, полівінілпіролідон, трагакантову камедь і гуміарабік; диспергатори або змочувальні агенти можуть являти собою природний фосфатид, наприклад, лецитин, або продукти конденсації алкіленоксиду з жирними кислотами, наприклад, поліоксіетиленстеарат, або продукти конденсації етиленоксиду з довголанцюговими аліфатичними спиртами, наприклад, гептадекаетиленоксицетанол, або продукти конденсації етиленоксиду з частковими складними ефірами, одержаними з жирних кислот і гекситолу, такі як моноолеат поліоксіетиленсорбіту, або продукти конденсації етиленоксиду з частковими складними ефірами, одержаними з жирних кислот і ангідридів гекситолу, наприклад, поліетиленсорбітан моноолеат. Водні суспензії також можуть містити один або декілька консервантів, наприклад, етил- або н-пропіл, п-гідроксибензоат, один або декілька барвників, один або декілька ароматизаторів, один або декілька підсолоджувачів, таких як сахароза, сахарин або аспартам. Масляні суспензії можуть бути одержані суспендуванням активного інгредієнта у рослинній олії, наприклад, арахісовій олії, оливковій олії, кунжутній олії або кокосовій олії або у мінеральному маслі, такому як рідкий парафін. Масляні суспензії можуть містити загусник, наприклад, бджолиний віск, твердий парафін або цетиловий спирт. Для поліпшення смаку перорального препарату можна додавати підсолоджувані, такі як вказані вище, і смакові агенти. Дані композиції можна зберігати при додаванні антиоксиданту, такого як аскорбінова кислота. Порошки і гранули, що диспергуються, придатні для одержання водної суспензії при додаванні води, забезпечують активний інгредієнт у суміші з агентом, що диспергує, або змочувальним агентом, агентом, що суспендує, і одним або декількома консервантами. Відповідні агенти, що диспергують, або змочувальні агенти і агенти, що суспендують, які можуть бути використані, згадувалися вище. Також можуть бути присутніми додаткові ексципієнти, наприклад, підсолоджувачі, смакові агенти і барвники. Фармацевтичні композиції за винаходом також можуть бути у формі емульсії олія-у-воді. Масляна фаза може являти собою рослинну олію, наприклад, оливкову олію або арахісову олію, або мінеральне масло, наприклад, рідкий парафін, або їх суміші. Відповідні агенти, що емульгують, можуть являти собою природні фосфа тиди, наприклад, соєву олія, лецитин і складні ефіри або часткові складні ефіри, одержані з жирних кислот і ангідридів гекситолу, наприклад, сорбітанмоноолеат, і продукти конденсації вказаних часткових складних ефірів з етиленоксидом, наприклад, поліоксіетиленсорбітанмоноолеат. Емульсії також можуть містити підсолоджуачі та смакові агенти. Сиропи та еліксири можуть бути одержані з використанням підсолоджувачів, наприклад, гліцерину, пропіленгліколю, сорбіту або сахарози. Такі склади також можуть містити засіб, що зменшує подразнення, консервант і смакові агенти або агенти, що забарвлюють. Фармацевтичні композиції можуть бути у формі стерильної водної або масляної суспензії, що ін'єкують. Така суспензія може бути одержана відповідно до відомого рівня техніки з використанням таких придатних агентів, що диспергують, або змочувальних агентів і агентів, що суспендують, які були відмічені вище. Стерильні препарати, що ін'єкують, також можуть являти собою стерильний розчин, що ін'єкують, або суспензію у нетоксичному парентерально прийнятному розріджувачі або розчиннику, наприклад, у вигляді розчину в 1,3-бутандіолі. Прийнятними носіями і розчинниками, які можна використовувати, є вода, розчин Рінгера та ізотонічний розчин хлориду натрію. Також можна використовувати співрозчинники, такі як етанол, пропіленгліколь або поліетиленгліколі. Крім того, як розчинник або середовище, що суспендує, звичайно використовують стерильні жирні (нелеткі) олії. Для даної мети можна використовувати будь-яку м'яку жирну (нелетку) олію, включаючи синтетичні моноабо дигліцериди. Крім того, при одержанні препаратів для ін'єкцій знаходять застосування жирні кислоти. Сполуки формули І також можна вводити у формі супозиторіїв для ректального введення лікарського засобу. Такі композиції можуть бути одержані змішуванням лікарського засобу з відповідним ексципієнтом, що не подразнює, який є твердим при температурах навколишнього середовища, але рідким при ректальній температурі, і отже, буде розплавлятися у прямій кишці, вивільняючи лікарський засіб. Такими речовинами є кокосова олія та поліетиленгліколі. Для місцевого застосування використовують креми, мазі, гелі, розчини або суспензії і т.д., що містять сполуку формули І. (Для такого застосування місцеве застосування буде включати рідини для полоскання рота і полоскання для горла). Місцеві склади звичайно можуть включати фармацевтичний носій, співрозчинник, емульгатор, підсилювач проникності, систему консервантів і пом'якшувальний засіб. Комбінації з іншими лікарськими засобами. Для лікування і профілактики простагландин-опосередкованих захворювань сполуку формули І можна вводити разом з іншими терапевтичними агентами. Таким чином, в іншому аспекті даний винахід відноситься до фармацевтичних композицій для лікування простагландин-опосередкованих захворювань, що включають терапевтично ефективну кількість сполуки формули І і один або декілька інших терапевтичних агентів. Відповідні терапевтичні агенти для комбінаційної терапії зі сполукою формули І включають: (1) антагоніст простагландину D2, такий як S-5751; (2) кортикостероїд, такий як триамцинолон ацетонід; (3) β-агоніст, такий як салметерол, форметерол, тербуталін, метапротеренол, албутерол і тому подібні; (4) лейкотрієновий модифікатор, включаючи антагоніст лейкотрієну або інгібітор ліпооксигенази, такий як монтелукаст, зафірлукаст, пранлукаст або цилейтон; (5) антигістамін, такий як бромфенірамін, хлорфенірамін, дексхлорфенірамін, трипролідин, клемастин, дифенгідрамін, дифенілпіралін, трипеленамін, гідроксизин, метдилазин, прометазин, тримепразин, азатадин, ципрогептадин, антазолін, фенірамін, піриламін, астемізол, норастемізол, терфенадин, лоратадин, цетиризин, левоцетиризин, фексофенадин, дезкарбоетоксилоратадин і тому подібні; (6) протинабряковий лікарський засіб, включаючи фенілеприн, фенілпропаноламін, псевдофедрин, оксиметазолін, ефінеприн, нафазолін, ксилометазолін, пропілгекседрин або леводезоксіефедрин; (7) наркотичні анальгетики, включаючи кодеїн, гідрокодон, караміфен, карбетапентан або декстраметорфан; (8) інші простагландинові ліганди, включаючи агоніст простагландину F, такий як латанопрост; мізопростол, енпростил, ріопростил, орнопростол або розапростол; (9) діуретик; (10) нестероїдні протизапальні засоби (НСПЗЗ), такі як похідні пропіонової кислоти (амінопрофен, беноксапрофен, буклоксанова кислота, карпрофен, фенбуфен, фенпрофен, флупрофен, флурбіпрофен, ібупрофен, індопрофен, кетопрофен, міропрофен, напроксен, оксапрозин, пірпрофен, пранопрофен, супрофен, тіапрофенова кислота і тіоксапрофен), похідні оцтової кислоти (індометацин, ацеметацин, альклофенак, кліданак, диклофенак, фенклофенак, фенклозинова кислота, фентіазак, фурофенак, ібуфенак, ізоксепак, окспінак, суліндак, тіопінак, толметин, зидометацин і зомепірак), похідні фенамінової кислоти (флуфенамінова кислота, меклофенамінова кислота, мефенамінова кислота, ніфлумінова кислота і толфенамінова кислота), похідні біфенілкарбонової кислоти (дифлузиналь і флуфенізаль), оксиками (ізоксикам, піроксикам, судоксикам і теноксикам), саліцилати (ацетилсаліцилова кислота, сульфазалазин) і піразолони (апазон, безпіперилон, фепразон, мофебутазон, оксифенбутазон, фенілбутазон); (11) інгібітори циклооксигенази-2 (СОХ-2), такі як целекоксиб і рофекоксиб, еторикоксиб і валдекоксиб; (12) інгібітори фосфодіестерази типу IV (PDE-IV), наприклад, Аріфло, рофлуміласт; (13) антагоністи хемокінових рецепторів, особливо CCR-1, CCR-2 і CCR-3; (14) агенти, що знижують рівень холестерину, такі як інгібітори HMG-CoA редуктази (ловастатин, симвастатин і правастатин, флувастатин, аторвастатин та інші статини), секвестранти (холестирамін і колестипол), нікотинова кислота, похідні фенофібринової кислоти (гемфіброзил, клофібрат, фенофібрат і бензафібрат) і пробукол; (15) антидіабетичні агенти, такі як інсулін, сульфонілсечовини, бігуанідини (метформін), інгібітори а-глюкозидази (акарбоза) і глітазони (троглітазон, піоглітазон, енглітазон, розиглітазон і тому подібні); (16) препарати бетаінтерферону (інтерферон бета-la, інтерферон бета-1b); (17) антихолінергічні агенти, такі як мускаринові антагоністи (іпратропійбромід і тіотропійбромід), а також селективні мускаринові МЗ антагоністи, (18) стероїди, такі як беклометазон, метилпреднізолон, бетаметазон, преднізон, дексаметазон і гідрокортізон; (19) триптани, що звичайно використовуються для лікування мігрені, такі як сумітриптан і ризатриптан; (20) алендронат та інші лікарські засоби для остеопорозу; (21) інші сполуки, такі як 5-аміносаліцилова кислота та її проліки, антиметаболіти, такі як азатіоприн і 6-меркаптопурин, цитотоксичні протиракові хіміотерапевтичні агенти, антагоністи брадикініну (ВК2), антагоністи ТР рецептора, такі як сератродаст, антагоністи нейрокініну (NK1/NK2), VLA-4антагоністи, такі як описані у патенті США 5510332, WO97/03094, WO97/02289, WO96/40781, WO96/22966, WO96/20216, WO96/01644, WO96/06108, WO95/15973 і WO96/31206. Крім того, винахід охоплює спосіб лікування простагландин D2 опосередкованих захворювань, що включає введення пацієнту, який потребує такого лікування, нетоксично!" терапевтично ефективної кількості сполуки формули І, необов'язково разом з одним або декількома такими інгредієнтами, які щойно були перераховані вище. Кількості активних інгредієнтів можуть являти собою кількості, що звичайно використовуються для кожного з активних інгредієнтів, при їх введенні окремо, або у деяких випадках комбінація активних інгредієнтів може приводити до більш низьких доз одного або декількох активних інгредієнтів. СПОСОБИ СИНТЕЗУ Сполуки формули І за даним винаходом можуть бути одержані синтетичними шляхами, стисло охарактеризованими на схемах 1-6 і відповідно до описаних тут методів. Проміжні сполуки формули IV можуть бути одержані способом, представленим на схемі 1, з відповідним чином заміщеного фенілгідразину (II). Взаємодія II з відповідним циклопентаноном III вумовах утворення індолу за Фішером або в аналогічних умовах приводить до IV: Альтернативно сполуки формули IV можуть бути одержані способом, представленим на схемі 2, з відповідним чином заміщеного аніліну (V). Взаємодія V з йодом дає VI. Конденсація з відповідним циклопентаноном III з подальшою циклізацією в умовах за Хеком або аналогічних умовах каталізу металами приводить до індолу IV. Сполуки формули III можуть бути одержані способом, представленим на схемі З, з відповідним чином заміщеного силілового ефіру енолу (VII) або відповідним чином заміщеного енаміну (VIII). Приєднання відповідного електрофілу, такого як QY (де Υ являє собою галоген або групу, яка відходить), у присутності основи, такої як алкіллітій, або кислоти Льюіса, такої як трифторацетат срібла з силіловим ефіром енолу VII дає циклопентанон III. Сполука формули III альтернативно може бути одержана приєднанням QY до відповідним чином заміщеного енаміну VIII в умовах перетворення енаміну за Сторком або аналогічних умовах. Проміжні сполуки формули X можуть бути одержані способом, представленим на схемі 4, з відповідним чином заміщеного індолу (IX). Бромування IX може бути здійснене бромом у полярному і основному розчиннику, такому як піридин, з подальшим моно-відновленням проміжної дибромвмісної сполуки під дією кислоти і в умовах відновлення металом для утворення індолу X. Сполуки формули І можуть бути одержані способом, представленим на схемі 5, з відповідним чином заміщеного індолу (IV). Алкілування IV відповідним електрофілом, таким як ArXY (де Υ являє собою галоген або групу, яка відходить) у присутності основи і у відповідному розчиннику, такому як ДМФ, дає І. Альтернативно, сполуки формули І можуть бути одержані способом, представленим на схемі 6, з відповідним чином заміщеного броміндолу (XI) зі сполуки формули X після реакції зв'язування, описаної на схемі 5. Зв'язування у присутності паладію або аналогічні реакції броміндолу XI з відповідною металоорганічною сполукою R3M (де Μ являє собою метал, такий як В, Mg, Zn або Sn) приводять до сполуки І. Той же самий броміндол XI альтернативно спочатку може взаємодіяти з відповідним агентом, що металує, таким як n-BuLi, з подальшим захопленням електрофілом, таким як R 3Y, даючи сполуку І. ІЛЮСТРАТИВНІ СПОЛУКИ Ілюстративні сполуки формули І представлені у наступних таблицях; замісники є такими, як вказано, і Η призначений для випадків, де немає значення конкретної змінної. Мається на увазі, що кожна сполука включає рацемічну або діастереомерну суміш, та індивідуальні енантіомери і/або діастереомери. Способи розділення енантіомерів і розділення діастереомерів добре відомі фахівцям у даній області; вибрані ілюстрації таких методів також описані далі у прикладах. ТЕСТИ ДЛЯ ВИЗНАЧЕННЯ БІОЛОГІЧНОЇ АКТИВНОСТІ Сполуки формули І можуть бути протестовані з використанням наступних аналізів для визначення їх простаноїд-антагоністичної або агоністичної активності in vitro та in vivo і їх селективності. Активність простагландинових рецепторів демонстрували для DP, ЕР1 ЕР 2, ЕР 3, ЕР4, FP, IP і ТР. Стабільна експресія простаноїдних рецепторів у клітинній лінії ембріональної нирки (НЕK) 293 (ebna) людини Простаноїдні рецептори кДНК, відповідні повній довжині послідовностей, що кодують, субклонували у відповідні сайти векторів експресії ссавців і трансфектували у клітини НЕК 293 (ebna). Клітини НЕК 293 (ebna), що експресують індивідуальні кДНК, вирощували з відбором і виділяли через 2-3 тижні росту індивідуальні колонії з використанням кільцевого способу, що клонує, і потім поширювали на клональні клітинні лінії. Аналізи зв'язування простаноїдного рецептора Для використання в аналізах зв'язування рецептора клітини НЕК 293 (ebna) підтримували у культурі, харвестували (збирали) і мембрани одержували диференційним центрифугуванням з подальшим лізисом клітин у присутності інгібіторів протеази. Аналіз зв'язування простаноїдного рецептора проводили у 10мМ MES/KOH (рН 6,0) (EPs, FP і ТР) або 10мМ HEPES/KOH (рН 7,4) (DP і IP), що містять 1мМ EDTA, 10мМ двовалентного катіона та відповідний радіоізотопний ліганд. Реакцію ініціювали додаванням мембранного білка. Ліганди додавали у диметилсульфоксиді, який підтримували постійно на рівні 1% (об./об.) у всіх інкубаціях. Неспецифічне зв'язування визначали у присутності 1мкМ відповідного нерадіоактивного простаноїду. Інкубації проводили протягом 60 хвилин при кімнатній температурі або при 30°С і завершували швидким фільтруванням. Специфічне зв'язування розраховували шляхом віднімання неспецифічного зв'язування з загального зв'язування. Розраховували залишкове специфічне зв'язування при кожній концентрації ліганду і виражали як функцію концентрації ліганду для створення сигмоїдальних кривих концентрація-відповідь для визначення афінності ліганду. Аналізи агоніста і антагоніста простаноїдного рецептора Для визначення того, є рецепторні ліганди агоністами або антагоністами, проводили аналізи вимірювальної стимуляції (ЕР2, ЕР4, DP і IP у НЕК 293 (ebna) клітинах) або інгібування (ЕР3 у клітинах еритролейкемії людини (HEL)) міжклітинної цАМФ акумуляції або мобілізації внутрішньоклітинного кальцію (ЕРЬ FP і ТР у НЕК 293 (ebna) клітинах, стабільно трасфектованих апоаекворином) для повторних месенджерів цілої клітини. Для цАМФ аналізів клітини харвестували і повторно суспендували у HBSS, що містить 25мМ HEPES, рН 7,4. Інкубати містять 100мкМ RO-20174 (інгібітор фосфодіестерази типу IV, доступний від Biomol) і, тільки у випадку аналізу ЕР3 інгібування, 15мкМ форсколіну для стимуляції продукування цАМФ. Зразки інкубували при 37°С протягом 10 хвилин, реакцію завершували і потім вимірювали рівні цАМФ. Для аналізів мобілізації кальцію клітини заряджали кофакторами, що знижують глютатіон і коелентеразин, збирали і повторно суспендували у Ham F12 середовищі. Мобілізацію кальцію вимірювали шляхом контролю люмінесценції, що викликається зв'язуванням кальцію з внутрішньоклітинним фотобілком аекворином. Ліганди додавали у диметилсульфоксиді, рівень якого підтримували постійним 1% (об./об.) у всіх інкубаціях. Для агоністів, реакції у відповідь вторинних месенджерів виражали як функцію концентрації ліганду і розраховували як значення ЕС5о, так і максимальну реакцію у відповідь у порівнянні з простаноїдним стандартом. Для антагоністів здатність ліганду інгібувати реакцію у відповідь агоніста визначали аналізом Шилда (Schild) і розраховували як Кв, так і значення нахилу. Запобігання PGD2- або алерген-індукованій закупорці носового каналу у вівці, схильної до алергії Підготовка тварини: Використовували здорових дорослих овець (18-50кг). Даних тваринних відбирали на основі природної позитивної реакції шкури на підшкірне введення екстракту Ascaris suum. Вимірювання закупорки носового каналу: Експеримент проводили на тваринах, що знаходяться у свідомості. їх рухову активність обмежували у візку у лежачому положенні з фіксованою у нерухомому стані головою. Стійкість носових дихальних шляхів (NAR) вимірювали з використанням модифікованої техніки ринометричної маски. Для введення носо-трахейної трубки проводили місцеву анестезію (2% лідокаїн) носоглотки. Максимальний кінець трубки зв'язують з пневмотахографом і реєструють сигнал струму і тиску на осцилографі, зв'язаному з комп'ютером для розрахунку N AR в оперативному режимі. Викликають подразнення носа (назальної області) шляхом введення аерозольного розчину (10 випусків/ніздря). Зміни закупорки NAR реєструють до і через 60-120 хвилин після введення в організм речовини, що провокує виділення антитіл. Запобігання PGD2- або алерген-індукованій закупорці носового каналу у мавпи cynomolgus Підготовка тварини: Використовували здорових дорослих мавп cynomolgus (4-10кг). Даних тваринних відбирали на основі природної позитивної реакції шкури на підшкірне введення екстракту Ascaris suum. Перед кожним експериментом мавпу, відібрану для дослідження, не годували протягом ночі, забезпечуючи водою за бажанням. На наступний ранок тварину заспокоювали кетаміном (10-15мг/кг, внутрішньом'язово) перед видаленням її зі своєї клітки. її поміщали на підігрітий стіл (36°С) та ін'єкували болюсною дозою (512мг/кг внутрішньовенно) пропофолу. Тварині робили інтубацію за допомогою ендотрахеальної трубки з манжетами (внутрішній діаметр 4-6мМ) і підтримували анестезію шляхом постійного внутрішньовенного вливання пропофолу (25-30мг/кг/год). Під час експерименту контролювали ознаки життя (скорочення серця, тиск крові, частоту ди хання, температуру тіла). Вимірювання закупорки носового каналу: Стійкість дихальних шляхів тварини вимірювали з використанням пневмотахографу, зв'язаного з ендотрахеальною трубкою для того, щоб гарантувати, що вимірювання є нормальними. Для оцінки закупорки носового каналу використовували акустичний ринометр Ecovision. Такий метод дає неінвазивну 2D ехограму всередині носа. Об'єм носа і мінімальну поперечнорозсічену ділянку вздовж довжини носової порожнини обчислювали протягом 10 секунд з використанням невеликого портативного комп'ютера, обладнаного звичайним програмним забезпеченням (Hood Laboratories, Mass, США). Речовину для носового каналу, яка провокує виділення антитіл, вводили безпосередньо у носову порожнину тварини (об'єм 50мкл). Реєстрували зміни закупорки носового каналу до і через 60-120 хвилин після введення в організм речовини, яка провокує виділення антитіл. Якщо відбувається закупорка носового каналу, її переводять у зниження об'єму носового каналу. Легенева механіка у дресированих білячих мавп (саймирі), що знаходяться у свідомості Процедура дослідження включає поміщення дресированих білячих мавп у крісла у камери аерозольної дії. З метою контролю вимірювання легеневої механіки параметрів дихання реєстрували протягом приблизно 30 хвилин для встановлення нормальних контрольних значень для кожної мавпи у цей день. Для перорального введення сполуки розчиняли або суспендували в 1%-ному розчині метоцелю (метилцелюлоза, 65HG, 400 сантипуаз) і давали в об'ємі 1мг/кг ваги тіла. Для аерозольного введення сполук використовували ультразвуковий розпилювач De Vilbiss. Періоди перед обробкою змінювалися від 5 хвилин до 4 годин перед тим як мавпам вводили аерозольні дози або PGD2, або антигену Ascaris suum. Після введення кожну хвилину дані розраховували за допомогою комп'ютера як процент зміни від контрольних значень для кожного параметра дихання, включаючи стійкість дихальних шляхів (RL) і динамічну відповідність (Cdyn). Результати для кожної сполуки, що тестується, згодом одержували для мінімального періоду у 60 хвилин після введення речовини, які потім порівнювали з заздалегідь одержаними історичними контрольними значеннями базисної лінії для даної мавпи. Крім того, загальні значення протягом 60 хвилин після введення речовини для кожної мавпи (значення історичної базисної лінії та значення у випробуванні) усереднювали окремо і використовували для розрахунку сумарного процента інгібування сполукою, що тестується, реакції у відповідь медіатора або Ascaris антигену. Для статистичного аналізу використовували спарений t-тест. [Посилання: McFarlane C.S. et al., Prostaglandins, 28, 173-182 (1984) і McFarlane C.S. et al., Agents Actions, 22, 63-68 (1987)]. Запобігання індукованому бронхостенозу у овець, схильних до алергії Підготовка тварини: Використовували дорослу вівцю з середньою вагою 35кг (діапазон 18-50кг). Всі тварини, що тестуються, відповідали двом критеріям: а) вони мали природну шкірну реакцію до 1:1000 або 1:10000 розведення екстракту Ascaris suum (Greer Diagnostics, Lenois, NC); і b) вони раніше давали реакцію у відповідь на введення інгаляцією Ascaris suum у вигляді гострого бронхостенозу і пізнього бронхіального утруднення дихання (W.M.Abraham et al., Am.Rev.Resp.Dis., 128, 839-44 (1983)). Вимірювання механіки дихальних шляхів: Рухову активність вівці без введення заспокійливого засобу обмежували у візку у лежачому положенні з фіксованою у нерухомому стані головою. Після місцевої анестезії носоглотки 2% розчином лідокаїну балонний катетер вводили у нижній езофагус через одну ніздрю. Тварин потім інтубували за допомогою ендотрахеальної трубки з манжетами через іншу ніздрю, використовуючи гнучкий оптиковолоконний бронхоскоп як направляюче. Плевральний тиск оцінювали за допомогою балонного катетера для стравоходу (наповненого одниммл повітря), який встановлювали таким чином, що вдихання давало негативне відхилення тиску з чітко помітними кардіогенними коливаннями. Латеральний тиск у трахеї вимірювали з використанням бічного стовбура катетера (внутрішній розмір 2,5мм) просунутого вперед і розташованого на периферії до вершини носотрахеальної трубки. Транслегеневий тиск, різницю між трахеальним тиском і плевральним тиском вимірювали з диференціальним датчиком тиску (DP45, Validyne Corp., Northridge, CA). Для вимірювання легеневої стійкості (RL) максимальний кінець носотрахеальної трубки зв'язували з пневмотахографом (Fleisch, Dyna Sciences, Blue Bell, PA). Сигнали руху і транслегеневий тиск реєстрували на осцилоскопі (модель DR-12; Electronics for Medicine, White Plains, NY), який зв'язаний з PDP-11 Digital комп'ютером (Digital Equipment Corp., Ma ynard, MA) для розрахунку в оперативному режимі RL від транслегеневого тиску, ди хального об'єму, одержаного інтегруванням, і руху. Для визначення R L використовували аналіз 10-15 дихань. Вимірювали грудний об'єм газу (Vtg ) у плетизмографі для тіла для одержання специфічної легеневої стійкості (SRL=RL*Vtg). Далі винахід буде проілюстрований наступними необмежуючими прикладами в яких, якщо не вказано іншого: 1. Всі кінцеві продукти формули І були проаналізовані ЯМР, ТШХ і елементним аналізом або масспектрометрією. 2. Проміжні сполуки аналізували з використанням ЯМР і ТШХ. 3. Більшість сполук очищали флеш-хроматографією на силікагелі, перекристалізацією і/або енергійним розтиранням (суспензія у розчиннику з подальшим фільтруваннямтвердої речовини). 4. Хід реакцій контролювали за допомогою тонкошарової хроматографії (ТШХ) і час реакцій приведений тільки для ілюстрації. 5. Енантіомерний надлишок вимірювали ВЕРХ з нормальною фазою з використанням хіральної колонки: ChiralPak AD; 250x4,6мм. Наступні проміжні сполуки одержували відповідно до літературних методик, або вони були закуплені від наступного постачальника: 1. Етил 2-(2-оксоциклопентил)ацетат: Acros/Fisher Scientific. 2. 4-фтор-2-йоданілін: Beugelmans, R.; Chbani, M. Bull. Soc. Chim. Fr. 1995, 132,306-313. 3. Етил 2-(1-метил-2-оксоциклопентил)ацетат: Hudlicky, Т.; Short, R. P.; Revol, J.-M.; Ranu, В. С J. Org. Chem. 1983, 48, 4453-4461. 4. Гідрохлорид 4-метилсульфоніланіліну: Acros/Fisher Scientific. ПРИКЛАД 1 (+/-)-2-{5-АЦЕТИЛ-4-[(4-ХЛОРФЕНІЛ)МЕТИЛ]-7-(МЕТИЛСУЛЬФОНІЛ)-1,2,3ТРИПДРОЦИКЛОПЕНТА[2,3-В]ІНДОЛ-3-ІЛ}ОЦТОВА КИСЛОТА Стадія 1: 2-йод-4-(метилсульфоніл)феніламін До розчину, що інтенсивно перемішується, 100г 4-(метилсульфоніл)-феніламіну, розчиненого у 5,5л EtOH при 50°С додавали суміш 49,3г йоду і 110г сульфату срібла віл EtOH. Дану процедуру повторювали після перемішування протягом 1 години. Ще через годину додавали суміш 49,3г йоду і 43,8г сульфату срібла віл EtOH і суміш перемішували протягом ночі. Гарячий розчин потім фільтрували через целіт і розчинник видаляли. Залишок розтирали з 1л EtOH при 50°С протягом 45хв. і охолоджували до 0°С. Продукт відфільтровували і збирали, одержуючи 140г вказаної у заголовку сполуки у вигляді коричневої твердої речовини. 1 Н ЯМР (ацетон-(d6) d 7,95 (1Н, д), 7,54 (1Н, дд), 6,79 (1Н, д), 6,19 (2Н, ушир, с), 3,08 (3Н, с). MS (+АРСІ) m/z 298,2 (М+Н)+. Стадія 2: (+/-)-етил2-[7-(метилсульфоніл)-1,2,3-тригідроциклопента[2,3-b]індол-3-іл]-ацетат До розчину 150г 2-йод-4-(метилсульфоніл)феніламіну і 4,8г PTSA у 30мл дегазованого ДМФ, що зберігається в N2-атмосфері, додавали послідовно 135г тетраетоксисилану і 129г етил 2-(2оксоциклопентил)ацетату. Одержану суміш нагрівали до 130-140°С і перемішували протягом 6 годин. Потім додавали 30мл ДМФ і розчин дегазували перед подальшим послідовним додаванням 270мл основи Ханіга (Hunig) і 3,4г Pd(OAc)2. Розчин нагрівали при 120°С протягом 2 годин, потім охолоджували до кімнатної температури. Для гасіння реакції додавали 300мл 1н НСl і 200мл ізопропілацетату і суміш фільтрували через целіт. Фази розділяли і кислу фазу екстрагували двічі 200мл ізопропілацетату. Органічні шари об'єднували, промивали насиченим розчином солі, сушили над безводним Na2SO4, фільтрували через целіт і концентрували. Неочищену речовину додатково очищали фле ш-хроматографією, елююючи 50% EtOAc у гексанах, одержуючи 63г вказаної у заголовку сполуки у вигляді жовтої твердої речовини. 1 Н ЯМР (ацетон-d6) d 10,23 (1Н, ушир, с), 7,98 (1Н, с), 7,58 (2Н, м), 4,14 (2Н, кв), 3,63 (1Н, с), 3,04 (3Н, с), 2,90-2,65 (5Н, м), 2,19 (1Н, м), 1,22 (3Н, т). MS (+АРСІ) m/z 322,2 (М+Н)+. Стадія 3: (+/-)-2-[7-(метилсульфоніл)-1,2,3-тригідроциклопента[2,3-b]індол-3-іл]оцтова кислота До розчину 10,4г складного ефіру з стадії 2 у 80мл ТГФ при кімнатній температурі додавали 40мл МеОН, після чого 40мл 2н NaOH. Через 1,5 години реакційну суміш виливали у ділильну лійку, що містить ЕtOАс/1н НСl, фази розділяли і кислу фазу екстрагували двічі ЕtOАс. Органічні шари об'єднували, промивали насиченим розчином солі, сушили над безводним Na2SO4 і упарювали досуха. Неочищену тверду речовину енергійно розтирали у суміші EtOАс/гексани, одержуючи 9,1г вказаної у заголовку кислоти у вигляді тьмяно-коричневої твердої речовини. 1 Н ЯМР (ацетон-d6) d 10,86 (1Н, ушир, с), 10,25 (1Н, ушир, с), 7,98 (1Н, с), 7,58 (2Н, м), 3,62 (1Н, м), 3,04 (3Н, с), 2,89-2,68 (5Н, м), 2,21 (1Н, м). MS (+APCI) m/z 294,0 (М+Н)+. Стадія 4: (+/-)-2-[5-бром-7-(метилсульфоніл)-1,2,3-тригідроциклопента[2,3-b]індол-3-іл]оцтова кислота Трибромід піридинію (154г) додавали до розчину 2-[7-(метилсульфоніл)-1,2,3-тригідроциклопента[2,3b]індол-3-іл]оцтової кислоти (50,8г) у піридині при -25 - -30°С. Розчин нагрівали до 0°С протягом 15 хвилин і потім до кімнатної температури протягом 30 хвилин. Додавали 1250мл суміші 1:1 ТГФ/простий ефір і 2500мл суміші 1:1 насичений розчин солі/бн НСl, фази відділяли, водний шар промивали сумішшю 1:1 ТГФ/простий ефір і об'єднані органічні шари сушили Na 2SO4. Органічну фазу о холоджували до 10°С, додавали оцтову кислоту (50,5мл) з подальшим повільним додаванням цинку (70,2г) (підтримуючи температуру нижче 15°С). Реакційну суміш перемішували протягом 1 години при кімнатній температурі. Додавали 3000мл 1н НСl і 1250мл ЕtOАс, фази відділяли і водний шар промивали 2000мл ЕtOАс. Об'єднані органічні шари сушили Na2SO 4 і розчинник видаляли. Одержаний коричнюватий порошок енергійно розтирали з 1000мл суміші 20% EtOАс/гексани. Виділяли 52г (81%) вказаної у заголовку сполуки. 1 Н ЯМР (ацетон-d6) d 10,38 (1Н, ушир, с), 8,00 (1Н, д), 7,76 (1Н, д), 3,66 (1Н, м), 3,13 (3Н, с), 3,00-2,75 (4Н, м), 2,62 (1Н, дд), 2,26 (1Н, м). MS (-APCI) m/z 372,2, 370,2 (М-Н)Стадія 5: (+/-)-метил 2-[5-бром-7-(метилсульфоніл)-1,2,3-тригідроцикло-пента[2,3-b]індол-3-іл]ацетат Кислоту, одержану на стадії 4, етерифікували у ТГФ з використанням ефірного розчину CH2N2. Після видалення розчинників, вказаний у заголовку складний ефір одержували з кількісним виходом у вигляді блідо-коричневої твердої речовини. 1 Н ЯМР (ацетон-d6) d 10,41 (1Н, ушир, с), 8,00 (1Н, д), 7,76 (1Н, д), 3,68 (4Н, м), 3,13 (3Н, с), 3,00-2,75 (4Н, м), 2,62 (1Н, дд), 2,23 (1Н, м). Стадія 6: (+/-)-метил 2-{5-бром-4-[(4-хлорфеніл)метил]-7-(метилсульфоніл)-1,2,3тригідроциклопента[2,3-b]індол-3-іл}ацетат До розчину 3,70г індолу зі стадії 5 у 30мл ДМФ при -78°С додавали 790мг суспензії NaH (60% в олії). Одержану суспензію перемішували протягом 10хв. при 0°С, знову охолоджували до -78°С і обробляли 2,36г 4-хлорбензилброміду. Через 5хв. температуру підвищували до 0°С і перемішували 20хв. У цей момент реакційну суміш гасили додаванням 1мл АсОН і дану суміш виливали у ділильну лійку, що містить 1н НСІ/ЕtOАс. Шари розділяли і органічний шар промивали насиченим розчином солі, сушили над безводним Na2SO4 і концентрували. Неочищену речовину додатково очищали флеш-хроматографією, елююючи 10%ним EtOAc у толуолі та енергійно розтирали у суміші EtOAc/гексани, одержуючи 4,33г вказаної у заголовку сполуки у вигляді білої твердої речовини. 1 Н ЯМР (ацетон-d6) d 8,03 (1Н, д), 7,74 (1Н, д), 7,34 (2Н, д), 6,95 (2Н, д), 5,97 (1Н, д), 5,86 (1Н, д), 3,66 (1Н, м), 3,57 (3Н, с), 3,14 (3Н, с), 2,99 (1Н, м), 2,95-2,75 (2Н, м), 2,67 (1Н, дд), 2,45 (1Н, дд), 2,28 (1Н, м). Стадія 7: (+/-)-метил 2-{5-ацетил-4-[(4-хлорфеніл)метил]-7-(метилсульфоніл)-1,2,3тригідроциклопента[2,3-b]індол-3-іл}ацетат До розчину 3,0г броміндолу зі стадії 6 у 15мл ДМФ додавали 3,97мл 1-етоксивінілтрибутилолова. Одержану суміш дегаз ували, барботуючи через розчин Ν 2 протягом декількох хвилин. В окрему колбу вміщували 538мг Pd2(dba)3, 720мг Ph3As разом з 9,0мл ДМФ і дану суміш піддавали дії ультразвуку протягом 1 хвилини. Потім у реакційну колбу вводили каталітичну суміш і нагрівали при 90°С протягом 30 хвилин, дозволяючи реакційній суміші охолонути до кімнатної температури, у реакційну колбу додавали 4мл 1н розчину НСl і залишали перемішуватися доти, доки ТШХ аналіз не показував витрачання аддукту вінілового простого ефіру. Реакційну суміш розбавляли водою, екстрагували ізопропілацетатом, сушили над безводним Na2SO4 і концентрували. Одержану речовину додатково очищали флеш-хроматографією, елююючи 20%-ним ацетоном у толуолі, одержуючи 2,7г вказаного у заголовку кетону у вигляді білої твердої речовини. 1 Н ЯМР (CDCl3) d 8,19 (1Н, с), 7,74 (1Н, с), 7,16 (2Н, д), 6,55 (2Н, д), 5,35 (1Н, д), 5,29 (1Н, д), 3,71 (1Н, м), 3,65 (3Н, с), 3,06 (3Н, с), 3,05-2,80 (3Н, м), 2,66 (1Н, дд), 2,50 (1Н, дд), 2,32 (1Н, м), 2,12 (3Н, с). Стадія 8: (+/-)-2-{5-ацетил-4-[(4-хлорфеніл)метил]-7-(метилсульфоніл)-1,2,3-тригідроциклопента[2,3b]індол-3-іл}оцтова кислота Вказану у заголовку сполуку одержували з 2,08г складного ефіру зі стадії 7 відповідно до методики стадії 3, одержуючи 1,99г коричневої твердої речовини. 1 Н ЯМР (ацетон-d6) d 10,76 (1Н, ушир, с), 8,19 (1Н, д), 7,87 (1Н, д), 7,27 (2Н, д), 6,73 (2Н, д), 5,48 (2Н, с), 3,79 (1Н, м), 3,12 (3Н, с), 3,05 (1Н, м), 3,00-2,70 (3Н, м), 2,55 (1Н, дд), 2,38 (1Н, м), 2,19 (3Н, с). 13 С ЯМР (ацетон-d6) d 204,4, 177,3, 158,0, 142,5, 141,3, 137,5, 136,6, 133,6, 133,3, 132,3, 131,6, 126,6, 125,5, 124,5, 54,8, 48,9, 43,2, 40,5, 40,3, 33,1, 27,5. MS (+АРСІ) m/z 460,5, 458,3 (М+Н)+. ПРИКЛАД 2 (+)-2-{5-АЦЕТИЛ-4-[(4-ХЛОРФЕНІЛ)МЕТИЛ]-7-(МЕТИЛСУЛЬФОНІЛ)-1,2,3-ТРИПДРОЦИКЛОПЕНТА[2,3В]IHДОЛ-3-ІЛ}ОЦТОВА КИСЛОТА [(+)-ізомер сполуки Прикладу 1] 150-200мг (+/-)-2-{5-ацетил-4-[(4-хлорфеніл)метил]-7-(метилсульфоніл)-1,2,3-тригідроциклопента[2,3b]індол-3-іл}оцтової кислоти (приклад 1, стадія 8), розчиненої у 10мл гарячого EtOH, розділяли препаративною хіральною ВЕРХ з нормальною фазою [ChiralPak AD колонка: 50x5см, 20мкм; рухома фаза: гексан/2-пропанол/оцтова кислота (70:30:0,4); потік: 70-75мл/хв.; тиск: 280-300фт/кв.дюйм; УФ: 265нм]. Час утримування двох енантіомерів складав 38хв. і 58хв. Вказану у заголовку сполуку одержували як менш полярний енантіомер з 98% ее. ее=98%; Час утримування=12,1хв. [ChiralPak AD колонка: 250x4,6мМ, гексан/2-пропанол/оцтова кислота (75:25:0,1)]. Елементний аналіз. Обчислено для C23H22CINO5S: С, 60,06; Н, 4,82; N, 3,05; S, 6,97. Знайдено: С, 60,24; Η, 4,55; Ν, 3,03; S, 7,20. ПРИКЛАД 3 (-)-2-{5-АЦЕТИЛ-4-[(4-ХЛОРФЕНІЛ)МЕТИЛ]-7-(МЕТИЛСУЛЬФОНІЛ)-1,2,3-ТРИПДРОЦИКЛОПЕНТА[2,3В]IHДОЛ-3-ІЛ}ОЦТОВА КИСЛОТА [(-)-ізомер сполуки Прикладу 1] 150-200мг (+/-)-2-{5-ацетил-4-[(4-хлорфеніл)метил]-7-(метилсульфоніл)-1,2,3-тригідроциклопента[2,3b]індол-3-іл}оцтової кислоти (приклад 1, стадія 8), розчиненої у 10мл гарячого ЕtOН, розділяли препаративною хіральною ВЕРХ з нормальною фазою [ChiralPak AD колонка: 50x5см, 20мкм; рухома фаза: гексан/2-пропанол/оцтова кислота (70:30:0,4); потік: 70-75мл/хв.; тиск: 280-300фт/кв.дюйм (20,63621,093кгс/см 2; УФ:265м). Час утримування двох енантіомерів складав 38хв. і 58хв. Вказану у заголовку сполуку одержували як більш полярний енантіомер з 96,7% ее. Даний енантіомер перекристалізовували з суміші 80% 2-пропанол/гексани, для збільшення ее. ее=96,7%; Час утримування^ 5,3хв. [ChiralPak AD колонка: 250x4,6мМ, гексан/2-пропанол/оцтова кислота (75:25:0,1)]; [a]D21=-10,9° (с 0,45, МеОН). Елементний аналіз. Обчислено для C23H22ClNO5S: С, 60,06; Η, 4,82; Ν, 3,05; S, 6,97. Знайдено: С, 59,96; Η, 4,81; Ν, 3,01; S, 7,22. Т.пл. 219,5°С. ПРИКЛАД 3А Альтернативний спосіб одержання сполуки прикладу 3. А. Розділення (+)-2-[5-бром-7-(метилсульфоніл)-1,2,3-тригідроцикло-пента[2,3-b]індол-3-іл]оцтової кислоти Суспензію 300мг (+/-)-2-[5-бром-7-(метилсульфоніл)-1,2,3-тригідроцикло-пента[2,3-b]індол-3-іл]оцтової кислоти (приклад 1, стадія 4) і 138мг (R)-(+)-1-(нафтил)етиламіну у 15мл 2-пропанолу і 5мл ацетону розчиняли шляхом нагрівання при кипінні зі зворотним холодильником. Розчинники потім видаляли при зниженому тиску і залишок перекристалізовували з суміші 1:1 2-пропанол/ацетон (7мл). Після фільтрування одержану білу тверду сіль суспендували у 5мл метанолу і обробляли 3н НСl до рН 1. Осад відфільтровували і сушили на повітрі, одержуючи 78мг вказаного у заголовку енантіомера. Час утримування двох енантіомерів складав 6,5хв. і 8,2хв. [ChiralPak AD колонка, гексан/2-пропанол/оцтова кислота (75:25:0,2)]. Вказану у заголовку сполуку одержували як більш полярний енантіомер з 90% ее. Дану процедуру повторювали для одержання зазначеної вище сполуки з 99% ее. ее=99%; Час утримування =8,2хв. [ChiralPak AD колонка: 250x4,6мМ, гексан/2-пропанол/оцтова кислота (75:25:0,2)]; [a]D21=+11,0° (с 0,5, МеОН). В. Для одержання сполуки прикладу 3 слідували методиці, описаній у прикладі 1, стадії 5-8, використовуючи зазначений вище (+)енантіомер замість рацемату. ПРИКЛАД 4 (+)-2-{4-[(4-ХЛОРФЕНІЛ)МЕТИЛ]-5-(ГІДРОКСІЕТИЛ)-7-(МЕТИЛ-СУЛЬФОНІЛ)-1,2,3ТРИГІДРОЦИКЛОПЕНТА[2,3-В]ІНДОЛ-3-ІЛ)ОЦТОВА КИСЛОТА (ДІАСТЕРЕОМЕР А) Стадія 1. Відновлення кетону У суху колбу вміщували 350мг (-)-2-{5-ацетил-4-[(4-хлорфеніл)метил]-7-(метилсульфоніл)-1,2,3 тригідроциклопента[2,3-b]індол-3-іл}оцтової кислоти (приклад 3; ее=99%) разом з 30мл МеОН. До даного розчину, що перемішується, порціями додавали NaBPLj (приблизно 50мг/порція) з 10-15-хвилинними інтервалами доти, доки витрачання кетону не відмічалося за ТШХ аналізом. У даний момент реакційну суміш виливали у ділильну лійку, що містить 100мл насиченого водного розчину NH4Cl/10мл 1н розчину НСl і 100мл ЕtOАс. Шари розділяли і водний шар екстрагували EtOAc, об'єднані органічні шари сушили над безводним Na2SO4 і концентрували. Одержану речовину очи щали хіральною ВЕРХ наступним чином: Стадія 2. Хіральне очищення 150-200мг попередньої суміші спиртів, розчиненої у 10мл гарячого EtOH розділяли на препаративній хіральній ВЕРХ з нормальною фазою [ChiralPak AD колонка: 50x5см, 20мкм; рухома фаза: гексан/2пропанол/оцтова кислота (80:20:0,4); потік: 70-75мл/хв.; тиск: 280-300фт/кв.дюйм, УФ: 245нм]. Час утримування двох діастереоізомерів складав 33хв. і 51хв. Вказану у заголовку сполуку одержували як менш полярний діастереоізомер з de>99%. ее=99%; de>99%; Час утримування=6,0хв. [ChiralPak AD колонка: 250x4,6мМ, гексан/2-пропанол/оцтова кислота (75:25:0,2)]; [a]D21=+7,6° (с 1,0, МеОН). 1 Н ЯМР (ацетон-d6) d 7,95 (1Н, д), 7,83 (1Н, д), 7,32 (2Н, д), 6,90 (2Н, д), 5,92 (1Н, д), 5,65 (1Н, д), 5,19 (1Н, кв), 3,60 (1Н, м), 3,07 (3Н, с), 2,99 (1Н, м), 2,83 (2Н, м), 2,65 (1Н, дд), 2,39 (1Н, м), 2,31 (1Н, м), 1,45 (3Н, д). 13 С ЯМР (ацетон-d6) d 173,3, 152,0, 141,1, 139,4, 133,3, 133,2, 132,6, 129,7, 127,8, 126,4, 121,7, 118,8, 117,3,64,6,50,3,45,0,39,1,36,5,36,2,24,6,23,5. MS (-APCI) m/z 462,8, 460,5 (М-Н)-. Елементний аналіз. Обчислено для C23H24CINO5S: С, 59,80; Н, 5,24; N, 3,03; S, 6,94. Знайдено: С, 59,47; Н, 5,22; N, 2,96; S, 7,14. Тлш. 212,4°С. ПРИКЛАД 5 2-{4-[(4-ХЛОРФЕНІЛ)МЕТИЛ]-5-(ГІДРОКСІЕТИЛ)-7-(МЕТИЛСУЛЬФОНІЛ)-1,2,3ТРИПДРОЦИКЛОПЕНТА[2,3-В]ІНДОЛ-3-ІЛ}ОЦТОВА КИСЛОТА (ДІАСТЕРЕОМЕР В) Речовину прикладу 4, стадія 1 (150-200мг, ее=99%), розчинену у 10мл гарячого EtOH, розділяли за допомогою препаративної хіральної ВЕРХ з нормальною фазою [ChiralPak AD колонка: 50x5см, 20мкм; рухома фаза: гексан/2-пропанол/оцтова кислота (80:20:0,4); потік: 70-75мл/хв.; тиск: 280-300фт/кв.дюйм; УФ: 245 нм]. Час утримування двох діастереоізомерів складав 33хв. і 51хв. Вказану у заголовку сполуку одержували у вигляді більш полярного діастереоізомера с>95% de. ее=99%; de>95%; Час утримування=7,9хв. [ChiralPak AD колонка: 250x4,6мМ, гексан/2-пропанол/оцтова кислота (75:25:0,2)]. 1 Н ЯМР (ацетон-d6) d 7,95 (1Н, д), 7,83 (1Н, д), 7,32 (2Н, д), 6,90 (2Н, д), 6,00 (1Н, д), 5,57 (1Н, д), 5,20 (1Н, кв), 3,59 (1Н, м), 3,07 (3Н, с), 3,01 (1Н, м), 2,82 (2Н, м), 2,65 (1Н, д), 2,45-2,25 (2Н, м), 1,45 (3Н, д). MS (АРСІ) m/z 462,6, 460,5 (М-Н)ПРИКЛАД 6 (+/-)2-{4-[(2,4-ДИХЛОРФЕНІЛ)МЕТИЛ]-5-БРОМ-7-(МЕТИЛСУЛЬФОНІЛ)-1,2,3ТРИГІДРОЦИКЛОПЕНТА[2,3-В]ІНДОЛ-3-ІЛ}ОЦТОВА КИСЛОТА Слідуючи методиці конденсації, описаній у прикладі 1, стадія 6, використовуючи 104мг метил 2-[5-бром7-(метилсульфоніл)-1,2,3-тригідро-циклопента[2,3-Ь]-індол-3-іл]ацетату (приклад 1, стадія 5) і 50мкл 2,4дихлорбензилхлориду одержували 50мг метилового складного ефіру вказаної у заголовку сполуки у вигляді білої твердої речовини (чистота >95%). 1 Н ЯМР (ацетон-d6) d 8,05 (1Н, д), 7,73 (1Н, д), 7,58 (1Н, д), 7,24 (1Н, дд), 6,28 (1Н, д), 5, 91 (1Н, д), 5,85 (1Н, д), 3,73 (1Н, м), 3,55 (3Н, с), 3,15 (3Н, с), 3,01 (1Н, м), 2,95-2,75 (2Н, м), 2,68 (1Н, дд), 2,49 (1Н, дд), 2,30 (1Н, м). Вказану у заголовку сполуку одержували з 50мг зазначеного вище метилового складного ефіру відповідно до методики, описаної у прикладі 1, стадія 3, одержуючи 34мг білої твердої речовини (чистота >95%). 1 Н ЯМР (ацетон-d6) d 10,73 (1Н, ушир, с), 8,05 (1Н, д), 7,73 (1Н, д), 7,57 (1Н, д), 7,23 (1Н, дд), 6,28 (1Н, д), 5,91 (2Н, с), 3,71 (1Н, м), 3,15 (3Н, с), 3,02 (1Н, м), 2,95-2,75 (2Н, м), 2,68 (1Н, дд), 2,47 (1Н, дд), 2,34 (1Н, м). MS (-APCI) m/z 532,3, 530,1, 527,9 (М-Н)ПРИКЛАД 7 (+/-)-2-{4-[(4-ХЛОРФЕНІЛ)МЕТИЛ]-7-(МЕТИЛСУЛЬФОНІЛ)-5-ВІНІЛ-1,2,3-ТРИГІДРОЦИКЛОПЕНТА[2,3В]ІНДОЛ-3-ІЛ}ОЦТОВА КИСЛОТА З використанням способу, описаного у прикладі 1, стадія 7, з 112мг метил 2-{5-бром-4-[(4хлорфеніл)метил]-7-(метилсульфоніл)-1,2,3-тригідроциклопента-[2,3-b]індол-3-іл}ацетату (приклад 1, стадія 6) і 128мкл вінілтрибутилолова одержували 94мг метилового складного ефіру вказаної у заголовку сполуки у вигляді жовтої твердої речовини. Дану речовину використовували без додаткового очищення на наступній стадії. Вказану у заголовку сполуку одержували з 17мг зазначеного вище метилового складного ефіру відповідно до методики, описаної у прикладі 1, стадія 3, одержуючи 16,5мг безбарвної олії (чистота >95%). 1 Н ЯМР (ацетон-d6) d 10,68 (1Н, ушир, с), 7,98 (1Н, с), 7,55 (1Н, С), 7,35 (2Н, д), 7,12 (1Н, дд), 6,99 (2Н, д), 5,74 (1Н, д), 5,63 (1Н, д), 5,66 (1Н, д), 5,31 (1Н, д), 3,64 (1Н, м), 3,12 (3Н, с), 3,10-2,75 (3Н, м), 2,65 (1Н, м), 2,50-2,25 (2Н, м). MS (+АРСІ) m/z 463,0, 461,0 (M+NH 4)+. ПРИКЛАД 8 (+/-)2-{4-[(4-ХЛОРФЕНІЛ)МЕТИЛ]-5-ЦИКЛОПРОПІЛ-7-(МЕТИЛ-СУЛЬФОНІЛ)-1,2,3ТРИГІДРОЦИКЛОПЕНТА[2,3-В]IHДОЛ-3-ІЛ)ОЦТОВА КИСЛОТА У круглодонну колбу, що містить 27,6мг метил 2-{4-[(4-хлорфеніл)метил]-7-(метилсульфоніл)-5-вініл1,2,3-тригідроциклопента[2,3-b]-індол-3-іл}ацетату (одержаного у прикладі 7) і 2мл ТГФ, охолоджених до 0°С, додавали декількамг Pd(OAc)2 і 4мл ефірного розчину CH2N2 і залишали перемішуватися при даній температурі. До реакційної суміші додавали додаткові порції Pd(OAc)2 і CH2N2 доти, доки 1Н ЯМР аналіз аліквоти реакційної суміші не виявляв відсутність вінільних протонів. Реакційну суміш фільтрували через шар силікагелю і концентрували для одержання метилового складного ефіру вказаної у заголовку сполуки. 1 Н ЯМР (ацетон-d6) d 8 ,00 (1Н, с), 7,34 (3Н, м), 6,92 (2Н, д), 6,04 (1Н, д), 5,93 (1Н, д), 3,54 (4Н, м), 3,05 (3Н, с), 2,96 (1Н, м), 2,81 (2Н, м), 2,65 (1Н, дд), 2,43 (1Н, дд), 2,25 (1Н, м), 2,06 (1Н, м), 0,95-0,70 (4Н, м). MS (+APCI) m/z 495,8, 493,8 (M+Na)+. Вказану у заголовку сполуку одержували з 42мг зазначеного вище метилового складного ефіру відповідно до методики, описаної у прикладі 1, стадія З, одержуючи 34мг безбарвної олії. 1 Н ЯМР (ацетон-d6) d 10,67 (1Н, ушир, с), 7,91 (1Н, с), 7,33 (3Н, м), 6,92 (2Н, д), 6,06 (1Н, Д), 5,94 (1Н, д), 3,58 (4Н, м), 3,05 (3Н, с), 2,99 (1Н, м), 2,83 (2Н, м), 2,64 (1Н, дд), 2,50-2,25 (2Н, м), 2,09 (1Н, м), 1,00-0,70 (4Н, м). MS (+APCI) m/z 477,2, 474,9 (M+NH 4)+. ПРИКЛАД 9 (+/-)-2-{4-[(4-ХЛОРФЕНІЛ)МЕТИЛ]-7-(МЕТИЛСУЛЬФОНІЛ)-5-(2-ТІЄНІЛ)-1,2,3ТРИГІДРОЦИКЛОПЕНТА[2,3-В]IHДОЛ-3-ІЛ}ОЦТОВА КИСЛОТА З використанням способу, описаного у прикладі 1, стадія 7, з 500мг метил 2-{5-бром-4-[(4хлорфеніл)метил]-7-(метилсульфоніл)-1,2,3-тригідроциклопента-[2,3-b]індол-3-іл}ацетату (приклад 1, стадія 6) і 600мкл 2-тіофенілтрибутилолова одержували 480мг метилового складного ефіру вказаної у заголовку сполуки у вигляді тьмяно-жовтої олії. Дану речовину використовували без додаткового очищення на наступній стадії. 1 Н ЯМР (CDCl3) d 8,09 (1Н, с), 7,52 (1Н, с), 7,28 (1Н, д), 7,07 (2Н, д), 6,91 (1Н, м), 6,71 (1Н, м), 6,35 (2Н, д), 5,03 (1Н, д), 4,96 (1Н, д), 3,61 (3Н, с), 3,49 (1Н, м), 3,07 (3Н, с), 3,05-2,70 (3Н, м), 2,51 (1Н, дд), 2,39 (1Н, дд), 2,25 (1Н, м). Вказану у заголовку сполук у одержували з 480мг зазначеного вище метилового складного ефіру відповідно до методики, описаної у прикладі 1, стадія З, одержуючи 450мг білої спіненої речовини. 1 Н ЯМР натрієвої солі (ДМСО-d6) d 8,00 (1Н, д), 7,59 (1Н, дд), 7,31 (1Н, д), 7,18 (2Н, д), 7,04 (1Н, дд), 6,94 (1Н, м), 6,37 (2Н, д), 5,26 (1Н, д), 5,04 (1Н, д), 3,42 (1Н, м), 3,20 (3Н, с), 2,88 (1Н, м), 2,78 (1Н, м), 2,62 (1Н, м), 2,25-2,05 (2Н, м), 1,92 (1Н, дд). MS (-АРСІ) m/z 500,3,498,2 (М-Н)-· ПРИКЛАД 10 (+/-)-2-{7-[(ДИМЕТИЛАМIHО)СУЛЬФОНІЛ]-4-[(4-ХЛОРФЕНІЛ)МЕТИЛ]-1,2,3ТРИГІДРОЦИКЛОПЕНТА[2,3-В]ІНДОЛ-3-ІЛ}ОЦТОВА КИСЛОТА Стадія 1: [(4-амінофеніл)сульфоніл]диметиламін До розчину 40,2г сульфаніламіду у 1,5л МеОН, охолодженому до 0°С, додавали одночасно протягом 3 годин за допомогою двох насосів зі шприцами 220мл диметилсульфату і 464мл 5н NaOH. Після витрачання вихідної речовини органічний розчинник видаляли у вакуумі, додавали водний NH 4Cl і продукт екстрагували EtOAc. Органічний шар промивали водою, насиченим розчином солі і сушили над безводним Na2SO4. Органічну фазу концентрували досуха і неочищену тверду речовину перекристалізовували з 90% EtOAc у гексанах, одержуючи 26,2г вказаної у заголовку сполуки у вигляді білої твердої речовини. 1 Н ЯМР (CDCl3) d 7,53 (2Н, д), 6,69 (2Н, д), 4,12 (2Н, ушир, с), 2,64 (6Н, с). Стадія 2: [(4-аміно-3-йодфеніл)сульфоніл]диметиламін З використанням способу, описаного у прикладі 1, стадія 1, виходячи з 6,1г [(4амінофеніл)сульфоніл]диметиламіну, одержували 4,2г вказаної у заголовку сполуки у вигляді коричневої твердої речовини. 1 Н ЯМР (CDCl3) d 8,01 (1Н, д), 7,51 (1Н, дд), 6,75 (1Н, д), 4,58 (2Н, ушир, с), 2,66 (6Н,с). Стадія 3: (+/-)-етил 2-{7-[(диметиламіно)сульфоніл]-1,2,3-тригідроцикло-пента[2,3-b]індол-3-іл} ацетат Вказану у заголовку сполуку одержували з 3,46г [(4-аміно-3-йод-феніл)сульфоніл] диметиламіну і 1,91г етил 2-(2-оксоциклопентил)ацетату відповідно до методики, описаної у прикладі 1, стадія 2, одержуючи 1,11г білої твердої речовини. 1 Н ЯМР (ацетон-d6) d 10,23 (1Н, ушир, с), 7,84 (1Н, д), 7,58 (1Н, д), 7,44 (1Н, дд), 4,15 (2Н, кв), 3,63 (1Н, м), 2,95-2,65 (5Н, м), 2,61 (6Н, с), 2,21 (1Н, м), 1,22 (3Н, т). MS (-АРСІ) m/z 349,2 (М-Н)-. Стадія 4: (+/-)-2-{7-[(диметиламіно)сульфоніл]-4-[(4-хлорфеніл)метил]-1,2,3-тригідроциклопента[2,3b]індол-3-іл}оцтова кислота З використанням способу, описаного у прикладі 1, стадія 6, з 497мг складного ефіру стадії 3 і 354мг 4хлорбензилброміду одержували етиловий складний ефір вказаної у заголовку сполуки, який гідролізували відповідно до прикладу 1, стадія З, одержуючи 500мг вказаної у заголовку сполуки у вигляді білої твердої речовини. 1 Н ЯМР (ацетон-d6) d 10,78 (1Н, ушир, с), 7,90 (1Н, с), 7,46 (2Н, м), 7,33 (2Н, д), 7,12 (2Н, д), 5,59 (1Н, д), 5,49 (1Н, д), 3,64 (1Н, м), 2,97 (1Н, м), 2,90-2,70 (3Н, м), 2,61 (6Н, с), 2,45 (1Н, дд), 2,30 (1Н, м). MS (-АРСІ) m/z 445,4 (М-Н)ПРИКЛАД 11 (+/-)-2-{5-БРОМ-4-[(4-ХЛОРФЕНІЛ)МЕТИЛ]-7-ФТОР-1,2,3-ТРИГІДРО-ЦИКЛОПЕНТА[2,3-В]ІНДОЛ-3ІЛ}ОЦТОВА КИСЛОТА Стадія 1: (+/-)2-(7-фтор-1,2,3-тригідроциклопента[2,3-b]індол-3-іл)оцтова кислота Етиловий складний ефір вказаної у заголовку сполуки одержували з 10,00г 4-фтор-2-йодфеніламіну і 6,57г етил 2-(2-оксоциклопентил)ацетату відповідно до прикладу 1, стадія 2, одержуючи 5,36г жовтої твердої речовини. 1 Н ЯМР (ацетон-d6) d 9,76 (1Н, ушир, с), 7,34 (1Н, дд), 7,03 (1Н, д), 6,78 (1Н, тд), 4,14 (2Н, кв), 3,57 (1Н, м), 2,85-2,55 (5Н, м), 2,15 (1Н, м), 1,22 (3Н, т). Вказану у заголовку сполуку одержували з 1,24г зазначеного вище етилового складного ефіру відповідно до прикладу 1, стадія 3, одержуючи 1,08г неочищеної і нестабільної воскоподібної коричневої олії, яку використовували як таку на наступній стадії (чистота >90%). 1 Н ЯМР (ацетон-d6) d 10,90 (1Н, ушир, с), 9,77 (1Н, ушир, с), 7,34 (1Н, дд), 7,04 (1Н, дд), 6,79 (1Н, тд), 3,56 (1Н, м), 2,90-2,50 (5Н, м), 2,16 (1Н, м). MS (-APCI) m/z 232,2 (М-Н)\ Стадія 3: (+/-)-2-(5-бром-7-фтор-1,2,3-тригідроциклопента[2,3-b]індол-3-іл)оцтова кислота З використанням способу, описаного у прикладі 1, стадія 4, виходячи з 2,2г кислоти зі стадії 2 (чистота >90%), одержували 2,13г вказаної у заголовку сполуки у вигляді неочищеної і нестабільної коричневої твердої речовини. Дану речовину використовували без додаткового очищення на наступній стадії. 1 Н ЯМР (ацетон-d6) d 10,77 (1Н, ушир, с), 9,84 (1Н, ушир, с), 7,09 (2Н, м), 3,60 (1Н, м), 2,95-2,65 (4Н, м), 2,56 (1Н, дд), 2,19 (1Н, м). Стадія 4: (+/-)-2-{5-бром-4-[(4-хлорфеніл)метил]-7-фтор-1,2,3-тригідро-циклопента[2,3-b]індол-3іл}оцтова кислота Етерифікація 2,13г попередньої кислоти діазометаном з подальшим алкілуванням 1,7г 4хлорбензилброміду відповідно до способів, описаних у прикладі 1, стадії 5 і 6, давали метиловий складний ефір вказаної у заголовку сполуки, яку гідролізували з використанням методики прикладу 1, стадія 3. Одержували 2,35г вказаної у заголовку сполуки у вигляді коричневої твердої речовини. 1 Н ЯМР (ацетон-d6) d 10,70 (1Н, ушир, с), 7,31 (2Н, д), 7,18 (1Н, д), 7,06 (1Н, д), 6,92 (2Н, д), 5,90 (1Н, д), 5,74 (1Н, д), 3,61 (1Н, м), 3,00-2,70 (ЗН, м), 2,65 (1Н, дд), 2,39 (1Н, дд), 2,26 (1Н, м). MS (-АРСІ) m/z 436,3, 434,5 (М-Н)ПРИКЛАД 12 (+)-2-{5-БРОМ-4-[(4-ХЛОРФЕНІЛ)МЕТИЛ]-7-ФТОР-1,2,3-ТРИГІДРО-ЦИКЛОПЕНТА[2,3-В]ІНДОЛ-3ІЛ}ОЦТОВА КИСЛОТА [(+)-ізомер сполуки Прикладу 11] До розчину 2,35г (+/-)-2-{5-бром-4-[(4-хлорфеніл)метил]-7-фтор-1,2,3-тригідроциклопента[2,3-Ь]індол-3іл}оцтової кислоти (приклад 11, стадія 4) у 130мл ЕtOН при 80°С додавали 780мкл (8)-(-)-1(нафтил)етиламіну. Розчин охолоджували до кімнатної температури і перемішували протягом ночі. 1,7г виділеної солі повторно перекристалізовували з 200мл ЕtOН. Після фільтрування одержану білу тверду речовину нейтралізували 1н НСl і продукт екстрагували ЕtOАс. Органічний шар промивали насиченим розчином солі, сушили над безводним Na2SO4 і концентрували. Речовину фільтрували через шар SiO2, елююючи ЕtOАс, одержуючи 500мг вказаного у заголовку енантіомера у вигляді білої твердої речовини. Час утримування обох енантіомерів складав, відповідно, 7,5хв. і 9,4 хв. [ChiralPak AD колонка, гексан/2пропанол/оцтова кислота (95:5:0,1)]. Більш полярний енантіомер мав 98% ее. ее=98%; Час утримування=9,4хв. [ChiralPak AD колонка: 250x4,6мМ, гексан/2-пропанол/оцтова кислота (75:25:0,1)]; [a]D21=+39,2° (с 1,0, МеОН). ПРИКЛАД 13 (-)-2-{5-БРОМ-4-[(4-ХЛОРФЕНІЛ)МЕТИЛ]-7-ФТОР-1,2,3-ТРИГІДРО-ЦИКЛОПЕНТА[2,3-В]ІНДОЛ-3ІЛ}ОЦТОВА КИСЛОТА [(-)-ізомер сполуки Прикладу 11] До розчину 1,58г (+/-)-2-{5-бром-4-[(4-хлорфеніл)-метил]-7-фтор-1,2,3-тригідроциклопента[2,3-Ь]індол-3іл}оцтової кислоти (виділеної з надосадових рідин, одержаних при розділенні у прикладі 12) у 180мл ЕtOН при 80°С додавали 530мл (ІІ)-(+)-1-(нафтил)етиламіну. Розчин охолоджували до кімнатної температури і перемішували протягом ночі. 1,07г виділеної солі знову перекристалізовували з 120мл ЕtOН. Після фільтрування, одержану білу тверду сіль нейтралізували 1н НСl і продукт екстрагували ЕtOАс. Органічний шар промивали насиченим розчином солі, сушили над безводним Na 2SO4 і концентрували. Речовину фільтрували через шар SiO2 , елююючи ЕtOАс, одержуючи 640мг вказаного у заголовку енантіомера у вигляді білої твердої речовини. Час утримування двох енантіомерів складав 7,5хв. і 9,4 хв. [ChiralPak AD колонка, гексан/2-пропанол/оцтова кислота (95:5:0,1)]. Менш полярний енантіомер одержували с>99% ее. ее>99%; Час утримування=7,4хв. [ChiralPak AD колонка: 250x4,6мМ, гексан/2-пропанол/оцтова кислота (75:25:0,1)]. ПРИКЛАД 14 (+/-)-2-{5-БРОМ-4-[(4-ХЛОРФЕНІЛ)МЕТИЛ]-3-МЕТИЛ-1,2,3-ТРИГІДРО-ЦИКЛОПЕНТА[2,3-В]ІНДОЛ-3ІЛ}ОЦТОВАКИСЛОТА Стадія 1: (+/-)-етил 2-(5-бром-3-метил-1,2,3-тригідроциклопента[2,3-b]індол-3-іл)ацетат Суспензію 3,52г 2-бромфенілгідразину і 2,90г етил 2-(1-метил-2-оксоциклопентил)ацетату у 40мл АсОН нагрівали при 100°С протягом 1 години. Потім після даного часу додавали 20мл толуолу і розчинники видаляли при зниженому тиску. Неочищену речовину очищали флеш-хроматографією, одержуючи 1,40г вказаної у заголовку сполуки у вигляді жовтої олії. 1 Н ЯМР (ацетон-d6) d 9,85 (1Н, ушир, с), 7,38 (1Н, д), 7,23 (1Н, д), 6,93 (1H, т), 4,05 (2H, м), 2,80-2,60 (5Н, м), 2,36 (1Н, м), 1,40 (3Н, с), 1,11 (3Н, т). MS (-APCI) m/z 336,3 (М-Н)Стадія 2: (+/-)2-{5-бром-4-[(4-хлорфеніл)метил]-3-метил-1,2,3-тригідро-циклопента[2,3-Ь]індол-3іл}оцтова кислота З використанням способу, описаного у прикладі 1, стадія 6, 390мг попереднього складного ефіру зі стадії 1 і 222мг 4-хлорбензилхлориду давали 120мг етилового складного ефіру вказаної у заголовку сполуки у вигляді не зовсім білої твердої речовини. 1 Н ЯМР (ацетон-d6) d 7,44 (1Н, д), 7,30 (2Н, д), 7,22 (1Н, д), 6,92 (1Н, т), 6,90 (2Н, д), 6,05 (1Н, д), 5,85 (1Н, д), 3,90 (2Н, кв), 2,80 (3Н, м), 2,65 (2Н, д), 2,36 (1Н, м), 1,35 (3Н, с), 1,00 (3Н, т). MS (-АРСІ) m/z 458,3 (М-Н)Вказану у заголовку сполуку одержували з 105мг зазначеного вище етилового складного ефіру вказаної у заголовку сполуки відповідно до прикладу 1, стадія 3, одержуючи 90мг білої твердої речовини. 1 Н ЯМР (ацетон-d6) d 10,50 (1Н, ушир, с), 7,43 (1Н, д), 7,30 (2Н, д), 7,22 (1Н, д), 6,94 (1Н, т), 6,90 (2Н, д), 6,05 (1Н, д), 5,80 (1Н, д), 2,80 (3Н, м), 2,65 (2Н, д), 2,36 (1Н, м), 1,35 (3Н, с). MS (-АРСІ) m/z 432,2 (М-Н)-.
ДивитисяДодаткова інформація
Назва патенту англійськоюCyclopentanoindoles, composition containing them and methods for the treatment of prostaglandin mediated diseases
Назва патенту російськоюЦиклопентаноиндолы, композиция, которая их содержит, и способы лечения простагландинопосредствованных заболеваний
Автори російськоюLachance, Nicolas
МПК / Мітки
МПК: C07D 409/04, A61K 31/403, C07D 209/94, A61P 27/16, A61P 11/06
Мітки: лікування, містить, способи, циклопентаноіндоли, простагландинопосередкованих, захворювань, композиція
Код посилання
<a href="https://ua.patents.su/20-73787-ciklopentanoindoli-kompoziciya-shho-kh-mistit-i-sposobi-likuvannya-prostaglandinoposeredkovanikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Циклопентаноіндоли, композиція, що їх містить, і способи лікування простагландинопосередкованих захворювань</a>
Попередній патент: Спосіб реабілітації хворих, які перенесли мозковий інсульт
Наступний патент: Перетворювач енергії хвиль
Випадковий патент: Мастика












