1-феніл-2-піридинілалкіл-спиртові похідні як інгібітори фосфодіестерази
Номер патенту: 102574
Опубліковано: 25.07.2013
Автори: Дельканале Мауріціо, Амарі Ґабріель, Армані Елізабетта
Формула / Реферат
1. Сполука загальної формули (І), яка є (-) енантіомером
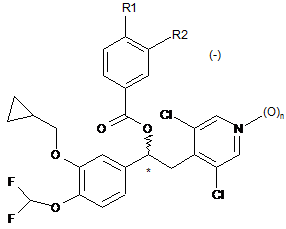 , (І)
, (І)
де:
n=0 або 1;
R1 та R2 можуть бути однаковими або різними, та є вибраними з групи:
лінійний або розгалужений С1-С6алкіл, необов'язково заміщений одним або більше атомами галогену;
OR3, де R3 - лінійний або розгалужений С1-С6алкіл, необов'язково заміщений одним або більше атомами галогену, або С3-С7циклоалкіли; та
HNSO2R4, де R4 - лінійний або розгалужений С1-С4 алкіл, необов'язково заміщений одним або більше атомами галогену,
де принаймні один з R1 та R2 - HNSO2R4,
його фармацевтично прийнятні неорганічні або органічні солі, гідрати та сольвати.
2. Сполука за п. 1, де R1 - HNSO2R4, де R4 - метил, R2 - OR3, де R3 - циклопропілметил, а n=0.
3. Сполука за п. 1, де R1 - HNSO2R4, де R4 - метил, R2 - OR3, де R3 - циклопропілметил, а n=1.
4. Сполука за п. 1, де R1 - OR3, R2 - HNSO2R4, де R4 - метил, а n=1.
5. Сполука за п. 1, де R1 - метил, R2 - HNSO2R4, де R4 - метил, а n=1.
6. Сполука за п. 1, де R1 та R2 - HNSO2R4, де R4 - метил, а n=0.
7. Сполука за п. 1, де R1 та R2 - HNSO2R4, де R4 - метил, а n=1.
8. Спосіб отримання сполуки за будь-яким з пп. 1-7, що має етап реакції альдегіду (1)
 (1)
(1)
з метилдихлоропіридином (2)
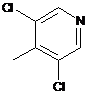 (2)
(2)
для отримання рацемічного спирту (3), який необов'язково окислюють до відповідного N-оксидного похідного (4)
 (3)
(3)
конденсування (3) або (4) з хіральною кислотою, як-то (S)-напроксен або (S)-ацетилмигдальна кислота, отримуючи, відповідно, діастереомерну суміш (10)
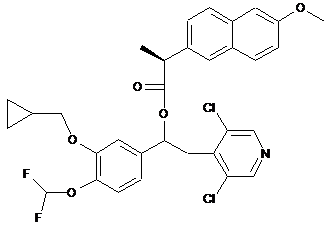 (10)
(10)
або (5),
 , (5)
, (5)
розділення діастереоізомерної суміші (10) або (5) на два одиничні діастереоізомери відповідно (11)
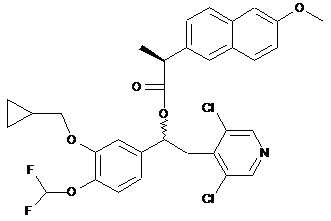 (11)
(11)
та (13)
 (13)
(13)
або (6)
 (6)
(6)
та (8)
 (8)
(8)
хроматографією або кристалізацією, отримуючи після розщеплення спирт (+) (14)
 (14)
(14)
або (+) (7)
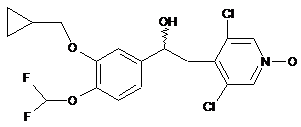 (7)
(7)
та (-) (9)
 , (9)
, (9)
а тоді реакції сполуки (+) (14) або (+) (7) із придатною бензойною кислотою(15)
 (15),
(15),
отримуючи сполуки загальної формули (І), де R1 та R2 визначено у п. 1.
9. Сполука загальної формули (II)
 , (II)
, (II)
де n визначено у п. 1, а атом карбону із зірочкою нижче виявляє (S) конфігурацію.
10. Комбінація сполуки формули (І) за будь-яким з пп. 1-7 з другим фармацевтичним активним компонентом, вибраним з класів b2 агоністів, М3 антагоністів та кортикостероїдів.
11. Комбінація за п. 10, де другим активним компонентом є формотерол або кармотерол.
12. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким з пп. 1-7 або комбінацію за п. 10 або 11, та один або більше фармацевтично прийнятних носіїв та/або наповнювачів.
13. Сполука формули (І) за будь-яким з пп. 1-7, яка відрізняється тим, що є медикаментом.
14. Сполука формули (І) за будь-яким з пп. 1-7, яка відрізняється тим, що є призначеною для попередження та/або лікування хвороб респіраторного тракту, що характеризуються обструкцією дихальних шляхів, як-то астма та COPD.
15. Пристрій, що містить фармацевтичну композицію за п. 12.
16. Комплект, що містить фармацевтичну композицію за п. 12 та пристрій, який може бути одинично- або багатодозовим інгалятором сухого порошку, інгалятором з вимірюваною дозою або розпилювачем дрібного аерозолю.
17. Сполука формули (І) за будь-яким з пп. 1-7, яка відрізняється тим, що є призначеною для застосування у попередженні та/або лікуванні алергічного риніту.
18. Сполука формули (І) за будь-яким з пп. 1-7, яка відрізняється тим, що є призначеною для застосування у попередженні та/або лікуванні атопічного дерматиту.
Текст
Реферат: Цей винахід стосується інгібіторів ферменту фосфодіестераза 4 (PDE4). Більш конкретно, цей винахід стосується 1-феніл-2-піридинілалкілоспиртових похідних загальної формули І, їх способів виготовлення, композицій, що їх містять, їх комбінацій та терапевтичного застосування. UA 102574 C2 (12) UA 102574 C2 R1 R2 (-) O O (O)n Cl N O * F F Cl O (І) R1 R2 (-) O O Cl N O * F F O Cl (O) n UA 102574 C2 5 10 15 20 25 30 35 40 45 50 Цей винахід стосується інгібіторів ферменту фосфодіестераза 4 (РDЕ4). Більш особливо, цей винахід стосується 1-феніл-2-піридиніл алкіл-спиртових похідних, способів їх виготовлення, композицій, що їх містять, комбінацій та їх терапевтичного застосування. Обструкція дихальних шляхів характеризує ряд суворих респіраторних хвороб, у тому числі астму та хронічну обструктивну хворобу легень (СОРD). Випадки, що призводять до обструкції дихальних шляхів, охоплюють набряк стінок дихальних шляхів, збільшене продукування слизу та запалення. Ліки для лікування респіраторних хвороб, як-то астма та СОРD, зараз застосовують інгаляцією. Одною з переваг інгаляції над системною є можливість доставляння ліків безпосередньо на ділянку дії, запобігаючи будь-якій системній побічній дії, забезпечуючи тим більш швидку клінічну реакцію та вище терапевтичне співвідношення. Інгаляційні кортикостероїди є сучасними ліками для астми та разом із 2-агоністами бронходилататор для полегшення гострих симптомів, вони утворюють основу сучасної терапії хвороби. Сучасне лікування СОРD є дуже симптоматичним за допомогою бронхорозширювальної терапії інгаляційними антихолінергічними агентами та інгаляційними агоністами 2-адреноміметику. Однак, кортикостероїди не зменшують запальної реакції у СОРD, як вони діють при астмі. Ще один клас терапевтичних агентів, що досліджують стосовно їх анти-запальної дії для лікування запальних респіраторних хвороб, як-то астма та СОРD, представлено інгібіторами фосфодіестеразних ферментів (РDЕ), зокрема фосфодіестерази типу 4 (далі позначено як РDЕ4). Різні сполуки, що діють як інгібітори РDЕ4 розкриті. Однак, корисність кількох інгібіторів РDЕ4 першого покоління, як-то роліпрам та пікламіласт обмежена внаслідок їх небажаної побічної дії, як-то нудота, секретування шлункової кислоти та блювота внаслідок їх дії на РDЕ4 у центральній нервовій системі та внаслідок дії на РDЕ4 у пристінних клітинах у кишечнику. Причину вказаної побічної дії широко досліджено. Виявлено, що РDЕ4 існує у двох відмінних формах з різними конформаціями, що були позначеними як ділянка зв'язування роліпраму з високою афінністю або НРDЕ4, особливо у центральній нервовій системі та у пристінних клітинах, та ділянка зв'язування роліпраму з низькою афінністю або LРDЕ4 (Jасоbіtz, S еt аl Моl. Рhаrmасоl, 1996, 50, 891-899), що виявлено в імунних та запальних клітинах. Тоді як обидві форми виявляють каталітичну активність, вони відрізняються відносно їх чутливості до інгібіторів. Зокрема, сполуки з вищою афінністю стосовно LРDЕ4 виявляють меншу схильність до індукування побічної дії, як-то нудота, блювота та збільшене шлункове секретування. Зусилля пошуку LРDЕ4 мають результатом слабке поліпшення селективності для інгібіторів РDЕ4 другого покоління, як-то циломіласт та рофлуміласт. Однак, навіть ці сполуки не забезпечують гарну селективність стосовно LРDЕ4. Сполуки із активністю селективного інгібування LРDЕ4 є розкритими у WО2009/018909. 1-феніл-2-піридиніл-алкілен-спирти та їх застосування як інгібіторів РDЕ4 описано також у WО 2008/006509. Цей винахід стосується потужних нових інгібіторів РDЕ4, що мають чудову LРDЕ4селективність. Несподівано виявлено, що присутність сульфонамідо замісників на бензоатному залишку помітно поліпшує потужність. Більш того, несподівано виявлено, що сульфоніламідо похідні винаходу, що є (-) енантіомерами (дивись атом карбону із зірочкою нижче), є більш потужними, ніж відповідні (+) енантіомери та рацемати. Виявлено, що неочікувано благотворну терапевтичну дію, особливо синергічну дію, отримують у лікуванні запальних або обструктивних хвороб респіраторного тракту, коли сполуки винаходу застосовують у комбінації з довгодіючим 2-агоністом. Винахід стосується сполук загальної формули (І) як (-) енантіомерів, що діють як інгібітори ферменту фосфодіестераза 4 (РDЕ4), способів їх виготовлення, композиції, що їх містять та їх терапевтичного застосування 1 UA 102574 C2 R1 R2 (-) O O Cl N (O) n O * F F 5 10 15 20 25 30 Cl O (І) де: n – 0 або 1; R1 та R2 можуть бути однаковими або різними, та є вибраними з групи: - лінійний або розгалужений С1-С6 алкіл, необов'язково заміщений одним або більше атомами галогену; - ОR3, де R3 – лінійний або розгалужений С1-С6 алкіл, необов'язково заміщений одним або більше атомами галогену, або С3-С7 циклоалкіли; та - НNSО2R4, де R4 – лінійний або розгалужений С1-С4 алкіл, необов'язково заміщений одним або більше атомами галогену, де принаймні один з R1 та R2 – НNSО2R4. Винахід також стосується їх фармацевтично прийнятних гідратів, сольватів, комплексів додавання, неорганічних або органічних солей, наприклад, натрію, калію та лізину. Цей винахід також стосується способу виготовлення сполук формули (І), як показано у схемі 1, що полягає у реакції альдегіду (1) із метилдихлоропіридином (2) для отримання рацемічного спирту (3). Останній тоді конденсують з хіральною кислотою, як-то (S)-напроксен або (S)ацетилмигдальна кислота для отримання діастереомерної суміші (10) або (5), відповідно, як шляхами 1 або 2 схеми 1. Відокремлення на одиничні діастереоізомери відповідно (11) та (13) або (6) та (8) проводять хроматографією, кристалізацією або іншими добре відомими способами, отримуючи після розщеплення, відповідно енантіомерних спиртів (-) (12) та (+) (14) або (+) (7) та (-) (9). Зрештою, реакцією з придатною бензойною кислотою(15), енантіомери (+) (14) або (+) (7) дають сполуки загальної формули (І). Цей винахід також стосується способу виготовлення сполук формули (І), де n=0, як показано у схемі 1, що полягає у реакції будь-якого енантіомерного спирту, наприклад, (+) (14), з бензойною кислотою (15). Цей винахід також стосується способу виготовлення сполук формули (І), де n=1, як показано у схемі 1, що полягає в окисненні енантіомерного спирту (+) (14) за допомогою окиснику, як-то 3хлоропербензойна кислота, пероцтова кислота або гідроген пероксид для отримання енантіомеру (+)спирту (7), що реакцією з бензойною кислотою формули (15) дає сполуки формули (І), де n=1. Цей винахід також стосується способу виготовлення сполук формули (І), де n=1, як показано у схемі 1, що полягає в окисненні естерів формули (І), де n=0 за допомогою окиснику, як-то 3хлоропербензойна кислота, пероцтова кислота або гідроген пероксид. Цей винахід також стосується інтермедіату загальної формули (ІІ) Cl OH N (O) n O * F F 35 40 O Cl III) ( де n визначено вище, а атом карбону із зірочкою нижче показує (S) конфігурацію. Цей винахід також стосується фармацевтичних композицій, що містять сполуку формули (І) та один або більше фармацевтично прийнятних носіїв та/або наповнювачів. Цей винахід також стосується фармацевтичних препаратів, придатних для застосування інгаляцією. Цей винахід також стосується комбінацій сполуки формули (І) з другим компонентом, вибраним з групи: класи довгодіючих 2 агоністів, М3 антагоністів та кортикостероїдів. 2 UA 102574 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід також стосується комбінацій сполуки формули (І) з довгодіючим 2 агоністом, вибраним з групи: кармотерол, GSК-642444, індакатерол, мілветерол, арформотерол, формотерол, салбутамол, формотерол, левалбутерол, тербуталін, АZD-3199, ВІ-1744-СL, LАS100977, бамбутерол, ізопротеренол, прокатерол, кленбутерол, репротерол, фенотерол та АSF1020. Цей винахід також стосується комбінацій сполуки формули (І) з М3 антагоністом, вибраним з групи: аклідініум, тіотропіум, іпратропіум та окситропіум. Цей винахід також стосується комбінацій сполуки формули (І) із кортикостероїдом, вибраним з групи: дексаметазон, флутиказон, флутиказон фуроат, преднізолон, бетаметазон, будезонід, мометазон, мометазон фуроат, триамцинолон ацетонід, циклезонід, ТРІ-1020, беклометазон, беклометазон дипропіонат, преднізон, дефлазакорт, гідрокортізон, QАЕ-397 та флунізолід. У кращому втіленні цей винахід стосується комбінацій сполуки формули (І) із формотеролом або кармотеролом. Цей винахід також стосується сполуки формули (І) для застосування як медикаменту. Також запропоновано застосування сполуки формули (І) при виготовленні медикаменту для попередження або лікування будь-якої хвороби, де задіяно активність рецепторів РDЕ4 та інгібування активності рецептору РDЕ4 є бажаним. Цей винахід також стосується способу попередження або лікування будь-якої хвороб, де задіяно активність рецепторів РDЕ4 та інгібування активності рецептору РDЕ4 є бажаним, спосіб полягає у застосуванні до пацієнта при потребі цього терапевтично ефективної кількості сполуки формули (І). Вищенаведені застосування або способи використовують сполуку формули (І) поодинці або комбінованою з іншими активними інгредієнтами. Вищенаведені хвороби, де активність рецепторів РDЕ4 та інгібування рецепторів РDЕ4 задіяно, охоплюють хвороби респіраторного тракту, охарактеризовані обструкцією дихальних шляхів, як-то астма та СОРD. Більш того, винахід також стосується застосування сполуки формули (І) для іn vіtrо інгібування РDЕ4. Винахід також стосується пристрою, який може бути одинично- або багатодозовим інгалятором сухого порошку, інгалятором з вимірюваною дозою або розпилювачем дрібного аерозолю, що містять сполуку формули (І). Винахід також стосується комплекту, що містить фармацевтичні композиції сполук формули (І), поодинці або у комбінації з додатковим фармацевтичним інгредієнтом, у суміші із один або більше фармацевтично прийнятних носіїв та/або наповнювачів, та пристрій, який може бути одинично- або багатодозовим інгалятором сухого порошку, інгалятором з вимірюваною дозою або розпилювачем дрібного аерозолю. Визначення Термін "атоми галогену" як застосовувано тут, охоплює флуор, хлор, бром та йод. Як застосовувано тут, вираз "лінійний або розгалужений С 1-Сх алкіл", де х – ціле число більше, ніж 1, як-то С1-С6 або С1-С4 алкіл, стосується алкілів з лінійним або розгалуженим ланцюгом, де число атомів карбону є у межах 1 – х (наприклад, 1-6 або 1-4). Приклади алкілів можуть охоплювати метил, етил, н-пропіл, ізопропіл, т-бутил, пентил, гексил тощо. Необов'язково у вказаних групах один або більше атомів гідрогену можна заміщувати атомами галогену, як-то переважно хлор або флуор. Як застосовувано тут, вираз "С3-С7 циклоалкіл" стосується циклічної неароматичної вуглеводневої групи з вмістом 3-7 кільцевих атомів карбону. Приклади можуть охоплювати циклопропіл, циклобутил, циклопентил, циклогексил та циклогептил. Якщо це не визначено інше, стосовно хіральних сполук, ступінь чистоти "по суті чистий" означає принаймні більше, ніж приблизно 97 % хірально чистий, переважно більше, ніж 99 % та найбільш переважно більше, ніж 99,9 %. Фіг. Фіг. показує існування синергічної дії для кращого втілення цього винаходу. ОА=овоальбумін С1=3-Циклопропілметокси-4-метансульфоніламіно-бензойної кислоти 1-(3циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин-4-іл)-етил-естер КАРМ=кармотерол Винахід стосується сполук, що діють як інгібітори ферменту фосфодіестераза 4 (РDЕ4). Вказані сполуки інгібують перетворення циклічних нуклеотидів, зокрема циклічний аденозин монофосфат (цАМФ), в їх неактивні 5’-мононуклеотидні форми. У дихальних шляхах фізіологічні реакції на підвищені внутришньоклітинні рівні циклічних 3 UA 102574 C2 5 10 15 20 нуклеотидів, зокрема цАМФ, призводять до пригнічення активності імунних та про-запальних клітини, як-то мастоцити, макрофаги, Т лімфоцити, еозинофіли та нейтрофіли, що дає зменшення вивільнення запальних медіаторів, що охоплюють цитокіни, як-то ІL-1, ІL-3 та фактор некрозу пухлин-альфа(ТNF-α). Це також призводить до релаксації гладеньких м'язів дихальних шляхів та зменшення набряку. Каталітичну ділянку РDЕ4 попередньо ідентифіковано: вона головним чином містить гідрофобний регіон, де двома субпорожнинами є, наприклад, Sо та S1, та гідрофільний регіон з 2+ 2+ вмістом метал-іонів Zn та Мg , що у свою чергу містить субпорожнину S2, що простягається о навкруги метал-іонів, та субпорожнину S3, що відгалужується приблизно на 90 від середини гідрофобної порожнини. Більшість відомих сполук з групою, здатною взаємодіяти з субпорожнинами S 0 та S1 гідрофобного регіону, як-то заміщена катехольна група, та з ще одною групою, здатною опосередковано взаємодіяти із метал-іонами S2 субпорожнини, наприклад гетероцикл, як-то піридин або піролідон. Цей винахід стосується сполук, що можуть підтримувати взаємодії із субпорожнинами S о та S1 за допомогою заміщеної катехольної групи та взаємодії з регіоном метал-іонів за допомогою піридинового кільця типу інших відомих інгібіторів РDЕ4, але відрізняються від них присутністю групи сульфоніламіно-бензойної кислоти, що робить можливою їх додаткову взаємодію з субпорожниною S3. Зокрема цей винахід стосується сполуки загальної формули (І), яку визначено раніше, у тому числі її фармацевтично прийнятних неорганічних та органічних солей, гідратів, сольватів або комплексів додавання. R1 R2 (-) O O Cl N (O) n O * F F 25 30 35 40 45 O Cl (І) Кращі групи сполук формули (І) є тими де: - R1 – НNSО2R4, R2 – ОR3 та n=0; - R1 – НNSО2R4, R2 – ОR3 та n=1; - R1 – НNSО2R4, де R4 – метил, R2 – ОR3, де R3 – циклопропілметил та n=0; - R1 – НNSО2R4, де R4 – метил, R2 – ОR3, де R3 – циклопропілметил та n=1; - R1 – лінійний або розгалужений С1-С6 алкіл, R2 – НNSО2R4 та n=0; - R1 – метил, R2 – НNSО2R4, де R4 – метил та n=0; - R1 – лінійний або розгалужений С1-С6 алкіл, R2 – НNSО2R4 та n=1; - R1 – метил, R2 – НNSО2R4, де R4 – метил та n=1; - R2 – лінійний або розгалужений С1-С6 алкіл, R1 – НNSО2R4 та n=0; - R2 – метил, R1 – НNSО2R4, де R4 – метил та n=0; - R2 – лінійний або розгалужений С1-С6 алкіл, R1 – НNSО2R4 та n=1; - R2 – метил, R1 – НNSО2R4, де R4 – метил та n=1; - R1 – ОR3, R2 – НNSО2R4 та n=0; - R1 – ОR3, R2 – НNSО2R4 та n=1; - R1 – ОR3, де R3 – циклопропілметил, R2 – НNSО2R4 та R4 – метил та n=1; - R1 – ОR3, R2 – НNSО2R4 та n=1; - R1 та R2 – НNSО2R4 та n=0; - R1 та R2 – НNSО2R4, де R4 – метил та n=0; - R1 та R2 – НNSО2R4 та n=1; - R1 та R2 – НNSО2R4, де R4 – метил та n=1. Спеціалістам зрозуміло, що сполуки загальної формули (І) містять принаймні один асиметричний центр, представлений атомом карбону із зірочкою нижче, та тому існують як оптичні стереоізомери. Цей винахід стосується сполуки формули (І), що є (-) енантіомером із конфігурацією (S) при атомі карбону із зірочкою нижче. 4 UA 102574 C2 5 Цей винахід також стосується інтермедіату сполуки формули (ІІ), де атом карбону із зірочкою нижче показує (S) конфігурацію. Сполуки формули (І) показують іn vіtrо інгібіторну активність щодо ферменту РDЕ4 у межах нМ та вони наділяють чудовою активністю у легенях при інтратрахеальному застосуванні у тваринній моделі СОРD. Вони можуть також виявляти тривалі легень рівні у легенях, будучи невиявними у плазмі, що є індексом короткої системної дії. Згідно з кращими втіленнями, цей винахід стосується сполук формули (І) вказаних нижче: Сполука С1 С2 С3 С4 С5 С6 Хімічна назва (-)-3-Циклопропілметокси-4-метансульфоніламіно-бензойної кислоти 1-(3циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин-4-іл)етил-естер (-)-3-Циклопропілметокси-4-метансульфоніламіно-бензойної кислоти 1-(3циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-оксипіридин-4-іл)-етил-естер (-)-4-Циклопропілметокси-3-метансульфоніламіно-бензойної кислоти 1-(3циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-оксипіридин-4-іл)-етил-естер (-)-3,4-Біс-метансульфоніламіно-бензойної кислоти 1-(3-циклопропіл-метокси4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-окси-піридин-4-іл)-етил-естер (-)-3-Метансульфоніламіно-4-метил-бензойної кислоти 1-(3-циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-окси-піридин-4-іл)-етилестер (-)-4-Метансульфоніламіно-3-метил-бензойної кислоти 1-(3циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-оксипіридин-4-іл)-етил-естер 10 Вищенаведені сполуки зручно ідентифіковані як (-) енантіомери, що, однак, мають (S) конфігурацію при атомі карбону з зірочкою. Як такі, ці сполуки можуть бути також ідентифікованими як у нижченаведеній таблиці: Сполука С1 С2 С3 С4 С5 С6 Хімічна назва 3-Циклопропілметокси-4-метансульфоніламіно-бензойної кислоти 1-(S)-(3циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин-4-іл)етил-естер 3-Циклопропілметокси-4-метансульфоніламіно-бензойної кислоти 1-(S)-(3циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-оксипіридин-4-іл)-етил-естер 4-Циклопропілметокси-3-метансульфоніламіно-бензойної кислоти 1-(S)-(3циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-оксипіридин-4-іл)-етил-естер 3,4-Біс-метансульфоніламіно-бензойної кислоти 1-(S)-(3-циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-окси-піридин-4-іл)-етилестер 3-Метансульфоніламіно-4-метил-бензойної кислоти 1-(S)-(3-циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-окси-піридин-4-іл)-етилестер 4-Метансульфоніламіно-3-метил-бензойної кислоти 1-(S)-(3циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-оксипіридин-4-іл)-етил-естер 15 20 Переважно, сполуки винаходу характеризуються селективністю щодо LРDЕ4 вище, ніж щодо НРDЕ4, як отримано визначенням їх ІК50. У випадку LРDЕ4, ІК50 є молярною концентрацією тест-сполуки, що дає 50 % інгібування зникнення цАМФ, оціненого як описано у Соrtіjо J еt аl Вr J Рhаrmасоl 1993, 108: 562-568. У випадку НРDЕ4, ІК50 є молярною концентрацією тест-сполуки, що дає 50 % інгібування 3 зв'язування [Н ] роліпраму, оціненого як описано у Duрlаntіеr АJ еt аl J Меd Сhеm 1996; 39: 120125. Переважно, співвідношення НРDЕ4/LРDЕ4 ІК50 для сполук винаходу є вище, ніж 5, більш 5 UA 102574 C2 переважно вище, ніж 10, навіть більш переважно вище, ніж 20 та найбільш переважно вище, ніж 100. Сполуки формули (І) можна виготовляти відомими способами. Деякі зі способів, що можна застосовувати, є описаними нижче у схемі 1. 5 Схема 1 R1 R1 R2 R2 Cl Cl O O F F H F (1) O O Cl O (2) Cl F THF mCPBA, DCM Cl N OH F Cl O (S)-acetyl mandelic acid O F O (15) (15) O N O O Cl F (14): (+)single enantiomer O O Cl O O Cl (6): single diastereoisomer F N O Cl Cl (7): (+)single enantiomer N O O chromatographic separation O Cl O (5): mixture of 2 diastereoisomers O O Cl O F F NaHCO3 ss, MeOH OH O O Cl F (9): (-)single enantiomer Cl (8) F O F N Cl EDC, HOBT, F DMAP CH2Cl2 (10): mixture of 2 diastereoisomers N O F OH N O (S)-Naproxen O Cl O F Cl O N O route 1 O O F O Cl O Cl F (13): single diastereoisomer Cl OH NO O N F NaHCO3 ss, MeOH O Cl O F F COOH R1 O F O R2 EDC, HOBT, DMAP CH2Cl2 OH Cl O O O (I) wherein n is 0 F EDC, HOBT, DMAP CH2Cl2 O (-)single enantiomer route B COOH R1 Cl O F DCM R2 EDC, HOBT, DMAP CH2Cl2 route 2 (4): racemate (-) single enantiomer route A O F mCPBA, (I) wherein n is 1 O F Cl O (O)n O route B F O F N O O (O)n N O O (3): racemate tBuOK Cl Cl N OH N + O Cl (3): racemate O O (8): single diastereoisomer O Cl O N F OH O F F N F O O Cl Cl (11): single diastereoisomer Cl (12): (-)single enantiomer 10 15 20 25 30 35 Спосіб виготовлення сполук формули (І) Згідно з певним втіленням цього винаходу, сполуки формули (І) можна виготовляти, наприклад, шляхами синтезу у схемі 1. Рацемічний спирт (3) можна виготовляти реакцією альдегіду (1) із метилдихлоропіридином (2). Шлях 1 - Рацемічний спирт (3) можна розділяти на (-) (12) та (+) (14) енантіомери відомими способами, як-то реакцією рацемічної суміші з придатним хіральним допоміжником, отримуючи суміш діастереоізомерів. Такі діастереоізомери можна розділяти кристалізацією або хроматографією або за допомогою ферментів відомими способами. Далі, хіральний допоміжник можна видаляти від діастереоізомерів, отримуючи бажаний хіральний спирт як одиничний енантіомер. Альтернативно, рацемічну суміш спирту можна розділяти за допомогою хроматографії з хіральною стаціонарною фазою, відомими способами (Rеf: "Еnаntіоmеr Sераrаtіоn: Fundаmеntаls аnd Рrасtісаl Меthоds" F. Тоdа, Sрrіngеr-Vеrlаg 2004; "Drug Stеrеосhеmіstrу: Аnаlуtісаl Меthоds аnd Рhаrmасоlоgу", Іrvіng W. Wаіnеr, СRС Рrеss, 1993). Зокрема, рацемічний спирт (3) можна конденсувати з хіральною кислотою, як-то (S)напроксен та отриману діастереомерну суміш (10) можна розділяти на два одиничні діастереоізомери (11) та (13) хроматографією. Після розщеплення одиничних діастереомерних естерів гідролізом у водному розчиннику або алкоголізом у спиртовому розчиннику, застосовуючи кислотні або основні умови, можна отримувати енантіомерно чисті спиртові інтермедіати (-) (12) та (+) (14). Шлях 2 - Рацемат (4), отриманий окисненням рацемату (3), проведеним звичайними способами, може реагувати з хіральною кислотою, як-то (S)-ацетилмигдальна кислота, отримуючи суміш двох діастереоізомерів (5). Розтиранням у порошок з діетил-етером та кристалізацією у розчиннику, як-то ізопропанол, етанол або метанол, або хроматографічним відокремленням, можна отримувати одиничні діастереомерні естери (6) та (8). Після розщеплення одиничних діастереомерних естерів гідролізом у водному розчиннику 6 UA 102574 C2 5 10 15 20 25 30 35 40 45 50 55 60 або алкоголізом у спиртовому розчиннику, застосовуючи кислотні або основні умови, можна отримувати енантіомерно чисті спиртові інтермедіати (+) (7) та (-) (9) Сполуки загальної формули (І), де n=0, можна виготовляти реакцією належного енантіомерного спирту (+)(14) з бензойною кислотою (15) у присутності придатної сильної основи, як-то літію діізопропіламід (LDА), NаН або диметиламінопіридин (DМАР) та у присутності конденсувального агенту, як-то 1-Етил-3-[3-диметиламінопропіл]карбодіімід гідрохлорид (ЕDС) або N-гідроксибензотриазол (НОВТ) у розчиннику, як-то дихлорометан. Інші розчинники можна застосовувати, як-то диметилформамід (ДМФ), тетрагідрофуран (ТГФ), хлороформ, діоксан або будь-який інший апротонний розчинник, відомий спеціалістам. У певному втіленні реакцію можна також проводити без розчинників. Сполуки формули (І), де n=1 можна виготовляти окисненням відповідної сполуки формули (І), де n=0 за допомогою окиснику, як-то 3-хлоропербензойна кислота, пероцтова кислота або гідроген пероксид у розчинниках, як-то хлороформ, дихлорометан або оцтова кислота (шлях В). Альтернативно, сполуки формули (І), де n=1 можна також виготовляти спершу окисненням спиртових енантіомерів (+) (14), у вищезгаданих умовах, отримуючи спиртові енантіомери (+) (7). Наступна реакція може дати спиртовий енантіомер з бензойною кислотою формули (15), отже стосується вищенаведеної сполуки формули (І), де n=0 (шлях А). Відокремлення (+) (7) та (-) (9) енантіомерів з рацемічного спирту (4), отриманого окисненням рацемічного спирту (3), можна проводити відомими способами, як описано вище для відокремлення енантіомерів рацемічного спирту (3). Спеціалісту ясно, що можна застосовувати необов'язкові варіації етапів синтезу у схемі 1 для виготовлення сполук винаходу. Ми говоримо, зокрема, про порядок реакцій, що можна проводити для отримання бажаних сполук або їх інтермедіатів, а також для вибору умов, у тому числі розчинників, необов'язкових окисників, конденсувальних агентів, тощо. Як приклад, у випадку хімічно реактивних замісників, що є у будь-якому з вихідних матеріалів або їх інтермедіатів, що можуть давати небажані побічні реакції, придатний захист тих замісників можна проводити перед реакцією. За аналогією, наступне зняття захисту можна тоді проводити, як для отримання вищенаведеного хімічно реактивного заміснику або групи у вільній формі. Захист та зняття захисту з функціональних групописано у "Рrоtесtіvе Grоuрs іn Оrgаnіс Сhеmіstrу"3rd еdіtіоn, Т.W. Grееnе та Р.G.М. Wuts, Wіlеу-Іntеrsсіеnсе (1999) та "Рrоtесtіng Grоuрs", Р.J. Косіеnskі, Gеоrg Тhіеmе Vеrlаg (1994). Згідно із заявленим способом для виготовлення сполук винаходу, та їх варіантів, вихідні матеріали формули (1) та (2), а також будь-які додаткові реагенти [(наприклад, формули (15)],, розчинник або агент, є відомими або можуть бути легко виготовленими відомими способами. Цей винахід також стосується фармацевтичних композицій сполук формули (І) у суміші із одним або більше фармацевтично прийнятними носіями, наприклад, описаними у Rеmіngtоn's Рhаrmасеutісаl Sсіеnсеs Наndbооk, ХVІІ Еd., Масk Рub., N.Y., U.S.А. Приклади охоплюють розріджувачі (як-то сахароза, манітол, лактоза, крохмалі) та відомі наповнювачі, у тому числі суспендувальні агенти, солюбілізатори, буфери, зв'язуючі, дезинтегратори, консерванти, барвники, ароматизатори, лубриканти тощо. Час вивільнення з капсул, таблеток та гелів є також переважним у застосуванні сполуки цього винаходу. Застосування сполук цього винаходу можна проводити згідно з потребами пацієнта, наприклад, перорально, назально, парентерально, наприклад, підшкірно, внутрішньовенно, внутрішньом'язово, інтрастернально та вливанням, інгаляцією, ректально, вагінально, місцево, локально, трансдермально, та до очей. Різні тверді пероральні форми дозування можна застосовувати для сполук винаходу, у тому числі такі тверді форми, як таблетки, капсули, гранули, пастилки та порошки. Різні рідкі пероральні форми дозування можна також застосовувати для сполук винаходу, у тому числі водні та неводні розчини, емульсії, суспензії, сиропи, та еліксири. Такі форми дозування можуть також містити відомі придатні інертні розріджувачі, як-то вода та відомі придатні наповнювачі, як-то консерванти, змочувальні агенти, підсолоджувачі, ароматизатори, а також агенти для емульгування та/або суспендування сполук винаходу. Сполуки винаходу можна уводити, наприклад, внутрішньовенно, у формі ізотонічного стерильного розчину. Інші відомі препарати є також можливими. Супозиторії для ректального застосування вказаних сполук винаходу можна виготовляти змішуванням сполук з придатним наповнювачем, як-то масло какао, саліцилати та поліетиленгліколі. Композиції для вагінального застосування можуть бути у формі крему, гелю, пасти, пінки або 7 UA 102574 C2 5 10 15 20 25 30 35 40 45 50 55 60 спрею з вмістом, на додаток до активного інгредієнту, звичайного носія. Для місцевого застосування, фармацевтичні композиції можуть бути у формі кремів, мазей, лосьйонів, емульсій, суспензій, гелів, розчинів, паст, порошків, спреїв, та крапель, придатних для застосування до шкіри, очей, ушей або носа. Місцеве застосування може також охоплювати трансдермальне застосування, наприклад, за допомогою трансдермальних пластирів. Для лікування хвороб респіраторного тракту, сполуки винаходу переважно застосовують інгаляцією. Придатні для інгаляції препарати охоплюють придатні для інгаляції порошки, аерозолі з вмістом пропеленту або придатні для інгаляції композиції без пропеленту. Для застосування як сухого порошку, можна застосовувати відомі одинично- або багатодозові інгалятори., у цьому випадку порошок може бути у желатинових, пластичних або інших капсулах, картриджах або у балонах. Розріджувач або носій, загалом хімічно інертні до сполуки винаходу, як-то лактоза або будьяка інша добавка, придатна для поліпшення вдихуваної фракції, можна додавати до порошкоподібної сполуки винаходу. Інгаляційні аерозолі з вмістом пропеленту, як-то гідрофлуороалканів, можуть містити сполуки винаходу у розчині або у диспергованій формі. Пропелентні композиції можуть також містити інші інгредієнти, як-то співрозчинники, стабілізатори та необов'язково інші наповнювачі. Придатні для інгаляції композиції без пропеленту, що містять сполуки винаходу, можуть бути у формі розчинів або суспензій у водному, спиртовому або водноспиртовому середовищі та їх можна доставляти розпилювачами, як-то Rеsріmаt. Сполуки винаходу можна застосовувати як єдиний активний агент або у комбінації із одним або більше іншими фармацевтичними активними інгредієнтами, у тому числі зараз застосовуваними у лікуванні респіраторних розлади, наприклад, 2-агоністи, кортикостероїди та М3 антагоністи. Дози сполук винаходу можуть залежати від різних факторів, у тому числі хвороби, що лікують, суворості симптомів, шляху застосування, частоти дозування, застосовуваної сполуки, ефективності, профілю токсичності, та фармакокінетичного профілю сполуки. Переважно, сполукиформули (І) можна застосовувати наприклад, при дозуванні між 0,001 та 1000 мг/добу, переважно між 0,1 та 500 мг/добу. При їх застосуванні інгаляцією, дозування сполук формули (І) є переважно між 0,01 та 20 мг/добу, переважно між 0,1 та 10 мг/добу. Переважно, сполуки формули (І) поодинці або комбіновані з іншими активними інгредієнтами можна застосовувати для попередження та/або лікування будь-якої обструктивної респіраторної хвороби, як-то астма, хронічний бронхіт та хронічна обструктивна хвороба легень (СОРD). Однак сполуки формули (І) можна застосовувати для попередження та/або лікування будьякої хвороби, де задіяно активність рецепторів РDЕ4 та інгібування активності рецептору РDЕ4 є бажаним, або хвороби, що є опосередкованою активністю РDЕ4 (наприклад, хвороби, де РDЕ4 є надекспресованим або надактивним). Приклади таких хвороб охоплюють: алергічні хвороби, як-то атопічний дерматит, кропивниця, алергічний риніт, алергічний кон'юнктивіт, весняний кон'юнктивіт, еозинофільна гранулома, псоріаз, запальний артрит, ревматоїдний артрит, септичний шок, виразковий коліт, хвороба Крона, реперфузійне пошкодження міокарду та мозку, хронічний гломерулонефрит, ендотоксичний шок, кистозний фіброз, артеріальний рестеноз, атеросклероз, кератоз, ревматоїдний спондиліт, остеоартрит, пірез, цукровий діабет, пневмоконіоз, токсична та алергічна контактна екзема, атопічна екзема, себорейна екзема, лихеноїдний свербіжний дерматит, сонячний опік, свербіж в аногенітальній зоні, осередкова плішивість, гіпертрофічні рубці, дискоїдний червоний вовчак, системний червоний вовчак, фолікулярні та поширені піодермії, ендогенні та екзогенні вугри, рожеві вугри, хвороба Бекхета, анафілактоїдний пурпурний нефрит, запальна хвороба кишечнику, лейкемія, розсіяний склероз, шлунково-кишкові хвороби, автоімунні хвороби тощо. Вони також охоплюють неврологічні та психіатричні розлади, як-то хвороба Альцгеймера, розсіяний склероз, амілолатеросклероз (АLS), системи розсіяної атрофії (МSА), шизофренія, хвороба Паркінсона, хвороба Хантингтона, хвороба Піка, депресія, інсульт, та пошкодження спинного хребта. Цей винахід далі описано у нижченаведених прикладах. Приклад 1 Виготовлення 1-(3-Циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин4-іл)-етанолу (3) Розчин 3-циклопропілметокси-4-дифлуорометокси-бензальдегіду (5,00 г) та 3,5-дихлоро-4 8 UA 102574 C2 5 10 15 20 25 30 35 40 45 50 55 60 метилпіридину (2,57 г) у 50 мл сухий ТГФ охолоджували до -30 °C. Твердий калію т-бутоксид (tВuОК, 1,96 г) додавали частинами, підтримуючи температуру між -30 °C та -20 °C, отримуючи темно-червоний розчин. Після додавання, суміш перемішували при -30 °C протягом 1 години. Насичений водний розчин NН 4Сl (50 мл) тоді додавали до реакційної суміші, підтримуючи температуру між -5 °C та -10 °C. Колір реакційної суміші став жовтим. Суміш тоді екстрагували ЕtОАс. Органічний шар сушили безводним натрію сульфатом та розчинник випарювали. Залишок обробляли 30 мл суміші петролейного етеру/ ЕtОАс =8/2; осад фільтрували та сушили, отримуючи 4,83 г названої сполуки, що застосовували у наступному етапі без очистки. + + МС/ЕSІ 404-406 [МН] . Приклад 2 Виготовлення 1-(3-Циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-оксипіридин-4-іл)-етанолу (4) Сполуку (3) (13,0 г) розчиняли у СН2Сl2 (250 мл) і додавали м-хлоропербензойну кислоту(16,5 г) та утворений розчин перемішували при кімнатній температурі протягом 2 годин. Nа2S2О3 (25,4 г) додавали та суміш енергійно перемішували при кімнатній температурі протягом 1 години. Твердий залишок відфільтровували, розчин промивали 1N NаОН (3 × 100 мл) і органічну фазу сушили безводним натрію сульфатом та розчинник випарювали, отримуючи10,3 г бажаного продукту (4), як білий твердий матеріал, що застосовували у наступному етапі без очистки. + + МС/ЕSІ 420-422 [МН] Приклад 3 Виготовлення ацетокси-феніл-оцтової кислоти 1-(3-циклопропілметокси-4дифлуорометокси-феніл)-2-(3,5-дихлоро-1-окси-піридин-4-іл)-етил-естеру (5, суміш діастереоізомерів) Сполуку (4) (19,95 г), (S)-ацетилмигдальну кислоту (9,22 г), 1-етил-3-[3диметиламінопропіл]карбодіімід гідрохлорид (18 г) та 4-диметиламінопіридин (2,89 г) розчиняли, в атмосфері азоту, у сухому СН2Сl2 (300 мл). Реакційну суміш перемішували при кімнатній температурі протягом ночі. 5 % водний розчин NаНСО3 (200 мл) додавали та водну фазу екстрагували СН2Сl2 (3 × 100 мл). Комбіновані органічні фази сушили безводним натрію сульфатом та розчинник випарювали під зменшеним тиском, отримуючи названу сполуку (5), як суміш двох діастереоізомерів (32 г); відокремлення двох діастереоізомерів описано у прикладах 4 та 6. Приклад 4 Виготовлення (+)-Ацетокси-феніл-оцтової кислоти 1-(3-циклопропілметокси-4дифлуорометокси-феніл)-2-(3,5-дихлоро-1-окси-піридин-4-іл)-етил-естеру (6) Сиру діастереомерну суміш (5) (32 г) розтирали у порошок з Еt 2О (100 мл), обробляли ультразвуком та фільтрували. Це повторювали чотири рази для отримання твердої суміші, збагаченої діастереоізомером (6). Цей твердий матеріал кристалізували з іРrОН (80 мл) та фільтрували, отримуючи 9,65 г сполуки (6) з діастереомерною чистотою >95 %. Діастереомерну чистоту визначали за допомогою ВЕРХ та аналітичною хіральною ВЕРХ на колонці Сhіrасеl ОD (ізократичне елювання гексан:ізопропанол 40:60, потік 0,45 мл/хвил, час утримання = 27,2 хвил). + + МС/ЕSІ 596, 598 [МН] –1 '1Н ЯМР (300 МГц, ДМСО-d6) млн 8,57 (s, 2 Н), 7,27-7,44 (m, 5 Н), 6,91-7,18 (m, 1 Н), 7,03 (t, 1 Н), 6,71-6,79 (m, 2 Н), 5,95 (dd, 1 Н), 5,85 (s, 1 Н), 3,72 (dd, 1 Н), 3,60 (dd, 1 Н), 3,41 (dd, 1 Н), 3,23 (dd, 1 Н), 2,13 (s, 3 Н), 1,07-1,31 (m, 1 Н), 0,48-0,72 (m, 2 Н), 0,21-0,44 (m, 2 Н) [α]D= +14° (с=0,54, МеОН) Приклад 5 Виготовлення (+)-1-(3-Циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1окси-піридин-4-іл)-етанолу (7) Сполуку (6) (6,42 г) суспендували у метанолі (350 мл) ї додавали насичений розчин NаНСО 3 (175 мл). Білу суспензію енергійно перемішували при кімнатній температурі протягом ночі. Реакційну суміш розбавляли СН2Сl2 (700 мл) та промивали 5 % водним розчином NаНСО3 (300 мл); водну фазу екстрагували СН2Сl2 (2 × 300 мл), комбіновані органічні шари сушили безводним натрію сульфатом та розчинник випарювали під вакуумом. Отриманий сирий білий твердий матеріал розтирали у порошок з Еt 2О (2 × 100 мл) та фільтрували, отримуючи 3,88 г сполуки (7) з енантіомерною чистотою >99 %. Енантіомерну чистоту визначали аналітичною хіральною ВЕРХ на колонці Сhіrасеl ОD (ізократичне елювання гексан:ізопропанол 30:70, потік 0,35 мл/хвил, час утримання = 22,3 хвил). 9 UA 102574 C2 + 5 10 15 20 25 30 35 40 45 50 55 60 + МС/ІЕР 420-422 [МН] –1 '1Н ЯМР (300 МГц, ДМСО-d6) млн 8,51 (s, 2 Н), 7,11 (d, 1 Н), 7,05 (d, 1 Н), 6,88 (dd, 1 Н), 7,01 (t, 1 Н), 5,59 (d, 1 Н), 4,84 (dd, 1 Н), 3,89 (dd, 1 Н), 3,84 (dd, 1 Н), 3,18 (dd, 1 Н), 3,02 (dd, 1 Н), 1,03-1,35 (m, 1 Н), 0,46-0,67 (m, 2 Н), 0,24-0,46 (m, 2 Н) [α]D = +68° (с=0,5, МеОН) Приклад 6 Виготовлення (+)-Ацетокси-феніл-оцтової кислоти 1-(3-циклопропілметокси-4дифлуорометокси-феніл)-2-(3,5-дихлоро-1-окси-піридин-4-іл)-етил-естеру (8) Сиру діастереомерну суміш (5) розтирали у порошок з Еt 2О (100 мл), обробляли ультразвуком та фільтрували. Це повторювали чотири рази, та фільтрати збирали та випарювали під зменшеним тиском, отримуючи тверду суміш, збагачену діастереоізомером (8), що кристалізували з іРrОН (100 мл), отримуючи 6,4 г сполуки (8), як білий твердий матеріал з діастереомерною чистотою >99 %. Діастереомерну чистоту визначали за допомогою ВЕРХ та аналітичною хіральною ВЕРХ на колонці Сhіrасеl ОD (ізократичне елювання гексан:ізопропанол 40:60, потік 0,45 мл/хвил, час утримання = 21,6 хвил). + + МС/ІЕР 596, 598 [МН] 1 –1 Н ЯМР (300 МГц, ДМСО-d6) млн 8,27 (s, 2 Н), 7,27-7,45 (m, 5 Н), 7,20 (d, 1 Н), 7,08 (d, 1 Н), 7,00 (dd, 1 Н), 7,08 (t, 1 Н), 5,97 (dd, 1 Н), 5,85 (s, 1 Н), 3,93 (dd, 1 Н), 3,89 (dd, 1 Н), 3,33 (dd, 1 Н), 3,17 (dd, 1 Н), 2,07 (s, 3 Н), 1,14-1,38 (m, 1 Н), 0,50-0,71 (m, 2 Н), 0,21-0,47 (m, 2 Н) [α]D = +26° (с=0,55, МеОН) Приклад 7 Виготовлення (-)-1-(3-Циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1окси-піридин-4-іл)-етанолу (9) Сполуку (8) (1,18 г) суспендували у метанолі (50 мл) і додавали насичений розчин NаНСО 3 (25 мл). Білу суспензію енергійно перемішували при кімнатній температурі протягом 24 годин. Реакційну суміш розбавляли СН2Сl2 (700 мл) ї додавали 5 % водний розчин NаНСО3 (300 мл) та фази відокремлювали. Водну фазу екстрагували СН2Сl2 (2 × 100 мл), комбіновані органічні шари сушили безводним натрію сульфатом та розчинник випарювали під вакуумом. Отриманий сирий білий твердий матеріал розтирали у порошок двічі з Еt 2О (50 мл) та раз СН2Сl2 (20 мл), тоді фільтрували, отримуючи 0,74 г сполуки (7) з енантіомерною чистотою >99 %. Енантіомерну чистоту визначали аналітичною хіральною ВЕРХ на колонці Сhіrасеl ОD (ізократичне елювання гексан:ізопропанол 30:70, потік 0,35 мл/хвил, час утримання = 24,0 хвил). + + МС/ІЕР 420-422 [МН] –1 '1Н ЯМР (300 МГц, ДМСО-d6) млн 8,51 (s, 2 Н), 7,11 (d, 1 Н), 7,05 (d, 1 Н), 6,88 (dd, 1 Н), 7,01 (t, 1 Н), 5,59 (d, 1 Н), 4,84 (dt, 1 Н), 3,89 (dd, 1 Н), 3,84 (dd, 1 Н), 3,18 (dd, 1 Н), 3,02 (dd, 1 Н), 1,08-1,32 (m, 1 Н), 0,47-0,66 (m, 2 Н), 0,26-0,45 (m, 2 Н) [α]D = -61° (с=0,5, МеОН) Приклад 8 2-(6-Метокси-нафтален-2-іл)-пропіонової кислоти 1-(3-циклопропілметокси-4дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин-4-іл)-етил-естер (10, суміш діастереоізомерів 11 та 13) Сполуку (3) (12,0 г) розчиняли у ДМФ (100 мл) і додавали (S)-2-(6-метокси-нафтален-2-іл)пропіонову кислоту (7,5 г), 4-диметиламінопіридин (3,6 г) та 1-етил-3-[3диметиламінопропіл]карбодіімід гідрохлорид (5,7 г). Після перемішування при кімнатній температурі протягом 4 годин, додавали воду (1000 мл). Суміш екстрагували ЕtОАс (500 мл х 2), комбіновані органічні шари сушили безводним натрій сульфатом та розчинник випарювали під зменшеним тиском, отримуючи 17,0 г оливи, що кристалізували з ЕtОН, отримуючи 11,5 г названої сполуки як суміш діастереомерів (11) та (13). 1 –1 Н ЯМР (200 МГц, СDСl3) млн 8,43 та 8,60 (2s, 1Н кожний, 2Н), 7,51-7,68 (m, 3Н), 7,10-7,23 (m, 3Н), 6,85-6,97 (m, 2Н), 6,51-6,68 (m, 1Н), 6,22-6,97 (t, 1Н, СНF2), 6,00-6,13 (m, 1Н), 3,93-3,95 (s, 3Н, ОСН3), 3,72-3,84 (m, 2Н), 3,07-3,57 (m, 3Н), 1,42-1,45 (d, 3Н, СН3), 0,94-1,25 (m, 1Н), 0,510,67 (m, 2Н), 0,12-0,36 (m, 2Н). + + МС/ІЕР 616, 618 [МН] Приклад 9 (+)-2-(6-Метокси-нафтален-2-іл)-пропіонової кислоти 1-(3-циклопропіл метокси-4дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин-4-іл)-етил-естер (ельований другим діастереоізомер) (13) Сполуку виділяли з діастереомерної суміші прикладу 8 ВЕРХ-відокремленням, застосовуючи колонку Dаіsоgеl 10 мкм, 50 × 300 мм; елюент: н-гексан/метил-трет-бутилетер/ізопропіловий спирт: 90/9,9/0,1; потік: 80 мл/хвил.; завантаження: 300 мг на уведення; час 10 UA 102574 C2 5 10 15 20 25 30 35 40 45 50 55 60 елювання: 11-20 хвил. Зібрані фракції випарювали та залишок кристалізували з суміші нгексан/ізопропіловий спирт. 1 –1 Н ЯМР (200 МГц, СDСl3) млн 8,60 (s, 2Н), 7,68-7,75 (m, 2Н), 7,58-7,59 (m, 1Н), 7,27-7,29 (d, 1Н), 7,12-7,24 (m, 2Н), 6,98-7,04 (m, 1Н), 6,73-6,78 (dd, 1Н), 6,67-6,68 (d, 1Н), 6,60-7,35 (t, 1Н, СНF2), 5,99-6,06 (m, 1Н), 3,84-3,87 (m, 4Н), 3,47-3,55 (m, 2Н), 3,32-3,41 (dd, 1Н), 3,22-3,29 (m, 1Н), 1,33-1,37 (d, 3Н, СН3), 0,96-1,03 (m, 1Н), 0,43-0,52 (m, 2Н), 0,13-0,21 (m, 2Н). + + МС/ІЕР 616, 618 [МН] [α]D = +52,8° (с=0,5, МеОН) ПРИКЛАД 10 (+)-2-(6-Метокси-нафтален-2-іл)-пропіонової кислоти 1-(3-циклопропілметокси-4дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин-4-іл)-етил-естер (ельований першим діастереоізомер) (11) Сполуку виділяли з діастереомерної суміші прикладу 8 ВЕРХ-відокремленням, застосовуючи колонку Dаіsоgеl 10 мкм, 50 × 300 мм; елюент: н-гексан/метил-трет-бутилетер/ізопропіловий спирт: 90/9,9/0,1; потік: 80 мл/хвил.; завантаження: 300 мг на уведення; елювання час: від 7 до 10 хвил. Зібрані фракції випарювали та залишок кристалізували з суміші н-гексан/ізопропіловий спирт. 1 –1 Н ЯМР (200 МГц, СDСl3) млн 8,27 (s, 2Н), 7,64-7,80 (m, 2Н), 7,56-7,57 (m, 1Н), 7,28-7,29 (d, 1Н), 7,14-7,20 (m, 3Н), 6,68-7,42 (t, 1Н, СНF2), 6,93-6,98 (m, 2Н), 6,00-6,07 (m, 1Н), 3,88-3,92 (m, 4Н), 3,71-3,84 (m, 2Н), 3,39-3,51 (dd, 1Н), 3,16-3,25 (dd, 1Н), 1,33-1,37 (d, 3Н, СН3), 1,08-1,23 (m, 1Н), 0,50-0,59 (m, 2Н), 0,34-0,26 (m, 2Н). + + МС/ІЕР 616, 618 [МН] [α]D = +45° (с=0,5, МеОН) Приклад 11 (+)-1-(3-Циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин-4-іл)-етанол (14) До суспензії (+)-2-(6-метокси-нафтален-2-іл)-пропіонової кислоти 1-(3-циклопропілметокси-4дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин-4-іл)-етил-естеру (13) (14,0 г) у метанолі (110 мл), додавали калію трет-бутоксид (5,1 г). Утворену суміш перемішували при кімнатній температурі протягом 2 годин, отримуючи прозорий розчин. Воду повільно додавали при перемішуванні для осадження. Після перемішування ще 60 хвил. осаджений твердий матеріал фільтрували, промивали водою та розчиняли у хлороформі (100 мл). Розчин сушили безводним натрію сульфатом та розчинник видаляли під вакуумом. Залишок кристалізували у хлороформі/ гексані=1/2,5, отримуючи 8,1 г білого твердого матеріалу. 1 –1 Н ЯМР (200 МГц, СDСl3) млн δ 8,45 (s, 2Н), 7,19-7,08 (d, 1Н), 7,06-7,00 (d, 1Н), 6,95-6,85 (dd, 1Н), 6,99-6,24 (t, 1Н, СНF2), 5,18-5,00 (m, 1Н), 3,98-3,78 (m, 2Н), 3,54-3,35 (m, 1Н), 3,31-3,15 (m, 1Н), 2,04-1,94 (d, 1Н, ОН), 1,40-1,14 (m, 1Н), 0,75-0,53 (m, 2Н), 0,50-0,29 (m, 2Н). + + МС/ІЕР 404, 406 [МН] . [α]D = +9,35° (с=1, СНСl3). Приклад 12 (-)-1-(3-Циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин-4-іл)-етанол (12) Починаючи з діастереоізомеру (11), способом прикладу 10, отримували спирт (12). + + МС/ІЕР 404, 406 [МН] . [α]D = - 9,15° (с=1, СНСl3). Приклад 13 Виготовлення спирту (7) окисненням спирту (14) Сполуку (14) (3,0 г) розчиняли у СН2Сl2 (100 мл). 70 % м-Хлоропербензойну кислоту(5,4 г) додавали та утворений розчин перемішували при кімнатній температурі протягом 18 годин. Твердий Nа2S2О3 (5 г) тоді додавали та суміш енергійно перемішували при кімнатній температурі протягом 30 хвил. Твердий залишок відфільтровували; органічний розчин розбавляли ще 100 мл СН2Сl2 та промивали водним насиченим розчином NаНСО3 (3 × 100 мл). Органічну фазу сушили безводним натрію сульфатом та розчинник випарювали. Залишок розтирали у порошок у ЕtОАс (20 мл), отримуючи 1,9 г бажаного продукту 7 як білий твердий матеріал, що застосовували у наступному етапі без очистки. 1 –1 Н ЯМР (200 МГц, СDСl3) млн 8,14 (s, 2Н), 7,18-7,09 (d, 1Н), 7,07-7,02 (d, 1Н), 6,92-6,83 (dd, 1Н), 7,01-6,22 (t, 1Н, СНF2), 5,10-4,96 (m, 1Н), 3,96-3,84 (d, 2Н), 3,45-3,29 (m, 1Н), 3,23-3,07 (m, 1Н), 3,24-3,17 (d, 1Н, ОН), 1,41-1,67 (m, 1Н), 0,75-0,53 (m, 2Н), 0,50-0,29 (m, 2Н). + + МС/ІЕР 420, 422 [МН] 11 UA 102574 C2 5 10 15 20 25 30 [α]D = + 65,0° (с=0,5, МеОН) Приклад 14 Виготовлення спирту (9) окисненням спирту (12) Спирт (9) можна отримувати способом, описаним у прикладі 13, застосовуючи спирт (12) замість спирту (14), як матеріал. + + МС/ІЕР 420, 422 [МН] [α]D =-60,6° (с=0,5, МеОН) Приклад 15 Виготовлення (-)-3-Циклопропілметокси-4-метансульфоніламіно-бензойної кислоти 1-(3циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-піридин-4-іл)-етил-естеру (С1) Етап 1: 3-Циклопропілметокси-4-(N-трет-бутоксикарбоніл-N-метансульфоніл)амінобензойної кислоти 1-(3-циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоропіридин-4-іл)-етил-естер 1-Етил-3-[3-диметиламінопропіл]карбодіімід гідрохлорид (2,85 г) додавали до розчину спирту (14) (2,0 г), 4-диметиламінопіридин (0,3 г), 3-циклопропілметокси-4-(N-третбутоксикарбоніл-N-метансульфоніл)-аміно-бензойної кислоти (2,0 г) у сухому СН2Сl2 (180 мл) при кімнатній температурі в атмосфері азоту. Після перемішування при кімнатній температурі протягом ночі, суміш промивали 5 % водною НСl (2 × 100 мл); органічну фазу відокремлювали та промивали насиченим водним розчином NаНСО3 (2 × 100 мл), сушили безводним натрію сульфатом та випарювали до сухого стану. Сирий матеріал очищали флеш-хроматографією на силікагелі з градієнтом елювання (гексан/ЕtОАс 10/1-6/4), отримуючи 1,4 г названої сполуки. Етап 2: Виготовлення С1 3-Циклопропілметокси-4-(N-трет-бутоксикарбоніл-N-метансульфоніл)-аміно-бензойної кислоти 1-(3-циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин-4-іл)-етилестер (1,4 г) розчиняли у СН2Сl2 (140 мл). 4М розчин НСl у діоксані (40 мл) додавали та утворену суміш перемішували при кімнатній температурі протягом 24 годин. Реакційну суміш тоді випарювали до сухого стану та залишок розтирали у порошок у іРrОН (50 мл) та далі у ЕtОН (50 мл), а потім Еt2О (70 мл), отримуючи 0,880 г сполуки (С1). Аналітичні характеристики С1 є у таблиці 1. Таблиця 1 (-) A O O Cl N O * F O Cl F Сполука А H N С1 35 40 * O SO2 Me Аналітичні дані + + МС/ІЕР 671, 673 [МН] ; 1 –1 Н ЯМР (300 МГц, ДМСО-d6) млн 9,13 (br. s., 1 Н) 8,60 (s, 2 Н) 7,55 (dd, 1 Н) 7,44-7,49 (m, 1 Н) 7,39 (d, 1 Н) 7,06 (t, 1 Н) 6,78-7,33 (m, 3 Н) 6,20-6,30 (m, 1 Н) 3,87-3,98 (m, 4 Н) 3,63-3,78 (m, 1 Н) 3,38-3,50 (m, 1 Н) 3,10 (s, 3 Н) 1,09-1,40 (m, 2 Н) 0,48-0,67 (m, 4 Н) 0,280,44 (m, 4 Н) [α]D = -22° (с=0,4, МеОН) Аналогічно, можна виготовляти нижченаведені сполуки: (-)-4-Циклопропілметокси-3-метансульфоніламіно-бензойної кислоти 1-(3циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин-4-іл)-етил-естер, (-)-3,4-Біс-метансульфоніламіно-бензойної кислоти 1-(3-циклопропілметокси-4дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин-4-іл)-етил-естер, (-)-3-Метансульфоніламіно-4-метил-бензойної кислоти 1-(3-циклопропілметокси-4дифлуорометокси-феніл)-2-(3,5-дихлоро-піридин-4-іл)-етил-естер та (-)-4-Метансульфоніламіно-3-метил-бензойної кислоти 1-(3-циклопропілметокси-4дифлуорометокси-феніл)-2-(3,5-дихлоро-1-окси-піридин-4-іл)-етил-естер. Приклад 16 Виготовлення (-)-3-Циклопропілметокси-4-метансульфоніламіно-бензойної кислоти 1-(3 12 UA 102574 C2 5 10 15 циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-окси-піридин-4-іл)-етилестеру (С2) Сполуку (С2) виготовляли способом синтезу прикладу 15,, починаючи від спиртового інтермедіату (7). Альтернативно, сполуку (С2) можна виготовляти, починаючи від сполуки (С1), як описано у нижченаведеному Прикладі 17. Приклад 17 Виготовлення (-)-3-Циклопропілметокси-4-метансульфоніламіно-бензойної кислоти 1-(3циклопропілметокси-4-дифлуорометокси-феніл)-2-(3,5-дихлоро-1-окси-піридин-4-іл)-етил-естер (С2), починаючи від сполуки (С1) Сполуку (С1) (0,69 г) розчиняли у СН2Сl2 (20 мл). 70 % м-Хлоропербензойну кислоту(0,355 г) додавали та утворений розчин перемішували при кімнатній температурі протягом 18 годин. Твердий Nа2S2О3 (0,244 г) тоді додавали та суміш енергійно перемішували при кімнатній температурі протягом 30 хвил. Твердий залишок відфільтровували; органічний розчин розбавляли ще 20 мл СН2Сl2 та промивали водним насиченим розчином NаНСО3 (3 × 20 мл). Органічну фазу сушили безводним натрію сульфатом та розчинник випарювали. Залишок розтирали у порошок у ЕtОН (20 мл), отримуючи 0,710 г бажаної сполуки (С2), як білий твердий матеріал. Нижченаведені сполуки виготовляли тим же шляхом, застосовуючи придатні реагенти: Таблиця 2 (-) A O O Cl N O O * F O Cl F Сполука А H N С2 * SO2 Me O O С3 * С4 * N SO2Me H N SO2Me H N SO2Me H Аналітичні дані + + МС/ІЕР 687, 689 [МН] ; 1 –1 Н ЯМР (300 МГц, ДМСО-d6) млн 9,14 (br. s., 1 Н), 8,56 (s, 2 Н), 7,59 (dd, 1 Н), 7,49 (d, 1 Н), 7,41 (d, 1 Н), 7,14-7,27 (m, 2 Н), 7,07 (dd, 1 Н), 7,06 (t, 1 Н), 6,18 (dd, 1 Н), 3,84-4,04 (m, 4 Н), 3,61 (dd, 1 Н), 3,34 (dd, 1 Н), 3,11 (s, 3 Н), 1,25-1,43 (m, 1 Н), 1,13-1,26 (m, 1 Н), 0,49-0,67 (m, 4 Н), 0,27-0,47 (m, 4 Н) [α]D = -47° (с=0,4, МеОН) 1 Н ЯМР (200 МГц, СD3ОD-d4 калібровано при 3,31 –1 –1 млн ) δ млн 8,42 (s, 2 Н), 8,13 (d, J=2,44 Гц, 1 Н), 7,85 (dd, J=8,79, 2,44 Гц, 1 Н), 7,12-6,37 (t, 1Н, СНF2), 7,00-7,24 (m, 4 Н), 6,26-6,40 (m, 1 Н), 3,97 (dd, J=14,89, 7,08 Гц, 4 Н), 3,75 (dd, J=13,92, 9,52 Гц, 1 Н), 3,45 (dd, J=14,16, 4,39 Гц, 1 Н), 2,98 (s, 3 Н), 1,17-1,45 (m, 2 Н), 0,54-0,75 (m, 4 Н), 0,29-0,47 (m, 4 Н) [α]D = -36 (с=0,1, СНСl3) 1 –1 Н ЯМР (200 МГц, СDСl3 калібровано при 7,26 млн ) –1 δ млн 8,23 (s, 2 Н), 7,85-8,01 (m, 2 Н), 7,69 (d, J=8,30 Гц, 1 Н), 7,20 (m, 1 Н), 7,00-6,25 (t, 1Н, СНF2), 6,977,11 (m, 2 Н), 6,21-6,32 (m, 1 Н), 3,91 (d, J=6,84 Гц, 2 Н), 3,72 (dd, J=13,67, 10,74 Гц, 1 Н), 3,32 (dd, J=13,92, 3,66 Гц, 1 Н), 3,04 (d, J=17,58 Гц, 6 Н), 1,16-1,35 (m, 1 Н), 0,55-0,74 (m, 2 Н), 0,30-0,45 (m, 2 Н) [α]D = -27 (с=0,1, СНСl3) 20 13 UA 102574 C2 Продовження таблиці 2 Сполука А Аналітичні дані Н ЯМР (200 МГц, ДМСО-d6 калібровано при 2,50 –1 –1 млн ) δ млн 9,25 (s, 1 Н), 8,53 (s, 2 Н), 7,91 (m, 1 Н), 7,76 (d, J=8,30 Гц, 1 Н), 7,43-6,69 (t, 1Н, СНF2), 7,40 (d, J=8,30 Гц, 1 Н), 7,19 (d, J=4,39 Гц, 2 Н), 7,00-7,12 (m, 1 Н), 6,21 (dd, J=9,52, 4,15 Гц, 1 Н), 3,92 (d, J=6,84 Гц, 2 Н), 3,63-3,55 (m, 1 Н), 3,37 (d, J=4,39 Гц, 1 Н), 2,99 (s, 3 Н), 2,37 (s, 3 Н), 1,11-1,28 (m, 1 Н), 0,48-0,65 (m, 2 Н), 0,26-0,41 (m, 2 Н) [α]D = - 38,67° 1 Н ЯМР (200 МГц, ДМСО-d6 калібровано при 2,50 –1 –1 млн ) δ млн 8,55 (s, 2 Н), 7,93-7,83 (m, 2 Н), 7,49 (d, J=8,30 Гц, 1 Н), 7,43-6,69 (t, 1Н, СНF2), 7,03-7,27 (m, 3 Н), 6,11-6,24 (m, 1 Н), 3,93 (d, J=6,84 Гц, 2 Н), 3,60 (s, 3 Н), 2,28 (s, 3 Н), 1,11-1,29 (m, 1 Н), 0,57 (m, 2 Н), 0,34 (m, 2 Н) [α]D = - 58,0° 1 С5 * N SO2Me H H N С6 SO2 Me * 5 Карбоновокислотні інтермедіати, застосовувані у синтезі описаних кінцевих сполук є у продажу або є вже відомими або їх синтезують відомими способами. Пиклад 18 Синтез 3-Циклопропілметокси-4-(N-трет-бутоксикарбоніл-N-метан-сульфоніл)-амінобензойної кислоти Схема 2 10 NO2 OH H SO 2 4 COOH O O O S N O O MeOH NO2 COOMe NaOH NO2 OH Br K2CO3 DMF 15 20 25 H2, Pd/C NH2 O MeOH COOMe O O O S N O O Boc2O DMAP DCM MeOH COOH O COOMe COOMe O O S NH O MeSO2Cl Et3N pyridine COOMe Етап 1: 3-Гідрокси-4-нітро-бензойної кислоти метил-естер 3-Гідрокси-4-нітро-бензойну кислоту(10 г) розчиняли у МеОН (500 мл). 96 % Н2SО4 (2 мл) додавали та суміш гріли до 60 °C протягом 18 годин. Реакційну суміш концентрували до приблизно 200 мл, розбавляли ЕtОАс (200 мл) та промивали водним насиченим розчином NаНСО3 (2 × 20 мл). Органічний шар сушили безводним натрію сульфатом та розчинник випарювали, отримуючи 10,5 г бажаного інтермедіату. Етап 2: 3-Циклопропілметокси-4-нітро-бензойної кислоти метил-естер 3-Гідрокси-4-нітро-бензойної кислоти метил-естер (10,5 г) розчиняли у сухому ДМФ (150 мл) в атмосфері азоту. К2СО3 (24,3 г), КІ (2,6 г) та циклопропілметилбромід (10,3 мл) додавали та суміш перемішували при 50 °C протягом 6 годин. Реакційну суміш розбавляли водою (300 мл) та екстрагували Еt2О (2 × 200 мл); комбіновані органічні шари сушили безводним натрію сульфатом та розчинник випарювали, отримуючи 12,7 г бажаного інтермедіату. Етап 3: 4-Аміно-3-циклопропілметокси-бензойної кислоти метил-естер 3-Циклопропілметокси-4-нітро-бензойної кислоти метил-естер (12,7 г) розчиняли у МеОН (100 мл) та ЕtОАс (100 мл); додавали 10 % Рd/С (1,0 г, суспендований у 20 мл води) та суміш гідрували в апараті Парра (Н2: 20 фунт/кв.дюйм) протягом 5 годин. 37 %НСl додавали (10 мл) та 14 UA 102574 C2 5 10 15 20 25 30 35 40 гідрування продовжували ще 2 години для повного перетворення. Каталізатор фільтрували через шар броунмілериту, суміш розбавляли ЕtОАс (200 мл) та промивали водним насиченим розчином NаНСО3 (2 × 100 мл). Органічний шар сушили безводним натрію сульфатом та розчинник випарювали, отримуючи 10,7 г бажаного інтермедіату. Етап 4: 3-Циклопропілметокси-4-метансульфоніламіно-бензойної кислоти метил-естер Метил 3-(циклопропілметокси)-4-амінобензоат (8,86 г) розчиняли у піридині (80 мл) при кімнатній температурі в атмосфері азоту. Метансульфонілхлорид (4,04 мл) додавали та суміш перемішували при кімнатній температурі протягом 18 годин. Реакційну суміш випарювали до сухого стану, сирий матеріал обробляли 1N НСl (500 мл) та екстрагували СН 2Сl2 (3 × 200 мл). Органічний шар сушили безводним натрію сульфатом та розчинник випарювали, отримуючи 11,7 г бажаного інтермедіату. + + МС/ІЕР 300 [МН] Етап 5: 3-Циклопропілметокси-4-(N-трет-бутоксикарбоніл-N-метансульфоніл)-амінобензойної кислоти метил-естер 3-Циклопропілметокси-4-метансульфоніламіно-бензойної кислоти метил-естер (3,0g) розчиняли у СН2Сl2 (150 мл). Диметиламінопіридин (DМАР, 1,22 г) та Вос 2О (2,18 г) додавали та суміш перемішували при кімнатній температурі протягом 1 години. Реакційну суміш промивали 5 % водною НСl (2 × 50 мл), органічний шар сушили безводним натрію сульфатом та розчинник випарювали. Залишок розтирали у порошок у Еt2О та фільтрували, отримуючи 4,0 г бажаного інтермедіату, що застосовували у наступному етапі без очистки. Етап 6: 3-Циклопропілметокси-4-(N-трет-бутоксикарбоніл-N-метансульфоніл)-амінобензойна кислота Циклопропілметокси-4-(N-трет-бутоксикарбоніл-N-метансульфоніл)-аміно-бензойної кислоти метил-естер (4,0 г) розчиняли у МеОН (100 мл). 1N NаОН (15 мл) додавали та утворену суміш перемішували при кімнатній температурі протягом 1 години, тоді гріли до 50 °C протягом 2 годин. Реакційну суміш тоді розбавляли ЕtОАс (250 мл) та промивали 1N НСl (2 × 100 мл). Органічний шар сушили безводним натрію сульфатом та розчинник випарювали, отримуючи 3,5 г бажаного кислотного похідного. + + МС/ІЕР 386 [МН] . * ЯМР s = синглет d = дублет t = триплет q = квартет dd = дублет дублетів m = мультиплет br = широкий ІЕР = електророзпилення Фармацевтична активність сполук винаходу Приклад 19 Іn vіtrо визначення інгібіторної активності РDЕ4 в аналізі моноядерних клітин периферійної крові (РВМС) Аналіз, що є на основі відомої інгібіторної активності, виявленої інгібіторами РDЕ4 на індукований ліпополісахаридами (LРS) фактор некрозу пухлин-альфа (вивільнення ТNF- у . 45 50 55 моноядерних клітинах периферійної крові (РВМС), проведено попередньо описаним способом (Наtzеlmаnn А еt аl J. Рhаrmасоl. Ехр. Тhеr. 2001; 297:267-279; Drаhеіm R еt аl J. Рhаrmасоl. Ехр. Тhеr. 2004; 308:555-563. 5 Кріозбережені РВМС людини, (100 мкл/лунку) інкубують у 96-лункових планшетах (10 клітини/лунку), протягом 30 хвил, у присутності або відсутності (50 мкл) тест-сполук, у межах -12 -6 концентрацій від 10 М до 10 М. Далі, додають LРS (3 нг/мл). Після 18 годин інкубування при 37С у зволоженому інкубаторі в атмосфері 95 % повітря та 5 % СО2, середовище збирають та ТNF-α вимірюють за допомогою ЕLІSА. Результати для сполук С1 – С6, виражені як середнє ± 95 % довірчий інтервал молярної концентрації тест-сполуки, що дає 50 % інгібування індукованого LРS вивільнення ТNF-а (ІК50), є між 0,06 та 4,4 нМ. Дію тест-сполуки розраховують як процент інгібування вивільнення ТNF- , . приймаючи індуковане LРS продукування ТNF-α без інгібітору як 100 % та базальне продукування ТNF- РВМС без LРS як 0 %. Приклад 20 . 15 UA 102574 C2 5 10 15 20 25 30 Оцінка здатності інгібувати LРDЕ4 низької афінності проти здатності відносно НРDЕ4 високої афінності Афінність щодо LРDЕ4 та НРDЕ4 оцінюють, як попередньо описано Соrtіjо J еt аl Вr J Рhаrmасоl 1993, 108: 562-568 та Duрlаntіеr АJ еt аl J Меd Сhеm 1996; 39: 120-125. 12 5 Концентрації тест-сполук є між 10- М та 10- М. Значення афінності щодо тестованих на сполуках С1 – С6 LРDЕ4 та НРDЕ4 є між 82 та 477. У випадку LРDЕ4, ІК50 є молярною концентрацією тест-сполуки, що дає 50 % інгібування зникнення цАМФ, тоді як у випадку НРDЕ4, ІК50 є молярною концентрацією тест-сполуки, що дає 3 50 % інгібування зв'язування [Н ] роліпраму. Результати показують, що сполуки винаходу інгібують LРDЕ4 із субнаномолярною афінністю та є значно більш селективними щодо LРDЕ4 проти НРDЕ4. Приклад 21 Синергічна активність комбінації фіксованих доз кармотеролу/С1 на індуковане карбахолом скорочення у трахеях морських свинок. Zіg-zаg-трахеальні сегменти отримують від сенсибілізованих овоальбуміном (ОА) самців морських свинок та два препарати отримують від трахей. Кожний препарат розміщають у 20-мл бані для органів з оксигенованим (О2 95 % та СО2 5 %) нормальним розчином КребсаХенселейта та тримають при 37ºС. Трахеальні препарати сполучають з ізометричними датчиками сили при навантаженні покою 1 г. Після періоду урівноваження 60 хвил, трахеальні -7 препарати попередньо обробляють протягом 30 хвил С1 (10 М), кармотеролом (3*10 М), асоціацією С1 та кармотеролу або носієм, відповідно, а потім бікумулятивним застосуванням -10 -5 -5 ОА (10 -10 г/мл). У кінці застосування ОА максимальну концентрацію карбахолу (10 М) додають для отримання максимального скорочення кожного препарату. Дію виражено як процент індукованої карбахолом максимальної реакції (100 %). -7 30-хвил попереднього обробки С1 (10 М) спричинювало інгібування індукованого ОА -10 скорочення 23 %. Аналогічно інгібування кармотеролом (3*10 М) дало 18 %. -7 -10 Комбінація С1 (10 М) та кармотеролу (3*10 М) спричинювала зменшення індукованого ОА скорочення 93 %. Це дослідження показує, що кармотерол та С1 є потужними в антагонізації індукованого карбахолом скорочення у дихальних шляхах морських свинок. Більш того, відповідно їх доповняльному молекулярному механізму дії у рамках функціонального агонізму-антагонізму, комбінація виявляє синергічну дію у контролі холінергічного скорочення у трахеях морських свинок. ФОРМУЛА ВИНАХОДУ 35 1. Сполука загальної формули (І), яка є (-) енантіомером R1 R2 (-) O O (O)n Cl N O * F F 40 45 O Cl , (І) де: n=0 або 1; R1 та R2 можуть бути однаковими або різними, та є вибраними з групи: лінійний або розгалужений С1-С6алкіл, необов'язково заміщений одним або більше атомами галогену; OR3, де R3 - лінійний або розгалужений С1-С6алкіл, необов'язково заміщений одним або більше атомами галогену, або С3-С7циклоалкіли; та 16 UA 102574 C2 5 10 HNSO2R4, де R4 - лінійний або розгалужений С1-С4 алкіл, необов'язково заміщений одним або більше атомами галогену, де принаймні один з R1 та R2 - HNSO2R4, його фармацевтично прийнятні неорганічні або органічні солі, гідрати та сольвати. 2. Сполука за п. 1, де R1 - HNSO2R4, де R4 - метил, R2 - OR3, де R3 - циклопропілметил, а n=0. 3. Сполука за п. 1, де R1 - HNSO2R4, де R4 - метил, R2 - OR3, де R3 - циклопропілметил, а n=1. 4. Сполука за п. 1, де R1 - OR3, R2 - HNSO2R4, де R4 - метил, а n=1. 5. Сполука за п. 1, де R1 - метил, R2 - HNSO2R4, де R4 - метил, а n=1. 6. Сполука за п. 1, де R1 та R2 - HNSO2R4, де R4 - метил, а n=0. 7. Сполука за п. 1, де R1 та R2 - HNSO2R4, де R4 - метил, а n=1. 8. Спосіб отримання сполуки за будь-яким з пп. 1-7, що має етап реакції альдегіду (1) O O H F O F (1) з метилдихлоропіридином (2) Cl N Cl 15 (2) для отримання рацемічного спирту (3), який необов'язково окислюють до відповідного Nоксидного похідного (4) Cl OH N O F Cl O F (3) конденсування (3) або (4) з хіральною кислотою, як-то (S)-напроксен або (S)-ацетилмигдальна кислота, отримуючи, відповідно, діастереомерну суміш (10) O O Cl O O N F O Cl F 20 (10) або (5), O O O O Cl O N O F O F Cl , (5) 17 UA 102574 C2 розділення діастереоізомерної суміші (10) або (5) на два одиничні діастереоізомери відповідно (11) O O Cl O O N F O Cl F (11) та (13) O O Cl O O N F O 5 Cl F (13) або (6) O O O Cl O O N O F O Cl F (6) та (8) O O O Cl O O N O F O Cl F 10 (8) хроматографією або кристалізацією, отримуючи після розщеплення спирт (+) (14) Cl OH O N F O Cl F (14) або (+) (7) Cl OH O N O F O F Cl (7) та (-) (9) 18 UA 102574 C2 Cl OH O N O F O Cl F , (9) а тоді реакції сполуки (+) (14) або (+) (7) із придатною бензойною кислотою(15) 5 (15), отримуючи сполуки загальної формули (І), де R1 та R2 визначено у п. 1. 9. Сполука загальної формули (II) (O)n Cl OH N O * F F 10 15 20 25 O Cl , (II) де n визначено у п. 1, а атом карбону із зірочкою нижче виявляє (S) конфігурацію. 10. Комбінація сполуки формули (І) за будь-яким з пп. 1-7 з другим фармацевтичним активним компонентом, вибраним з класів 2 агоністів, М3 антагоністів та кортикостероїдів. 11. Комбінація за п. 10, де другим активним компонентом є формотерол або кармотерол. 12. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким з пп. 1-7 або комбінацію за п. 10 або 11, та один або більше фармацевтично прийнятних носіїв та/або наповнювачів. 13. Сполука формули (І) за будь-яким з пп. 1-7, яка відрізняється тим, що є медикаментом. 14. Сполука формули (І) за будь-яким з пп. 1-7, яка відрізняється тим, що є призначеною для попередження та/або лікування хвороб респіраторного тракту, що характеризуються обструкцією дихальних шляхів, як-то астма та COPD. 15. Пристрій, що містить фармацевтичну композицію за п. 12. 16. Комплект, що містить фармацевтичну композицію за п. 12 та пристрій, який може бути одинично- або багатодозовим інгалятором сухого порошку, інгалятором з вимірюваною дозою або розпилювачем дрібного аерозолю. 17. Сполука формули (І) за будь-яким з пп. 1-7, яка відрізняється тим, що є призначеною для застосування у попередженні та/або лікуванні алергічного риніту. 18. Сполука формули (І) за будь-яким з пп. 1-7, яка відрізняється тим, що є призначеною для застосування у попередженні та/або лікуванні атопічного дерматиту. 19 UA 102574 C2 Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 20
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzoic acid (1-phenyl-2-pyridin-4-yl) ethyl esters as phosphodiesterase inhibitors
Автори англійськоюAmari, Gabriele, Armani, Elisabetta, Delcanale, Maurizio
Назва патенту російською1-фенил-2-пиридинилалкил-спиртовые производные как ингибиторы фосфодиэстеразы
Автори російськоюАмари Габриель, Армани Элизабетта, Дельканале Маурицио
МПК / Мітки
МПК: C07D 213/89, A61K 31/44, A61P 11/00, C07D 213/61
Мітки: похідні, фосфодіестерази, інгібітори, 1-феніл-2-піридинілалкіл-спиртові
Код посилання
<a href="https://ua.patents.su/22-102574-1-fenil-2-piridinilalkil-spirtovi-pokhidni-yak-ingibitori-fosfodiesterazi.html" target="_blank" rel="follow" title="База патентів України">1-феніл-2-піридинілалкіл-спиртові похідні як інгібітори фосфодіестерази</a>
Попередній патент: Зносостійкий композиційний матеріал
Наступний патент: Спосіб одержання сечовини, установка для її одержання та спосіб модернізації установки для синтезу сечовини
Випадковий патент: Спосіб моделювання внутрішньоутробної дії антигенів