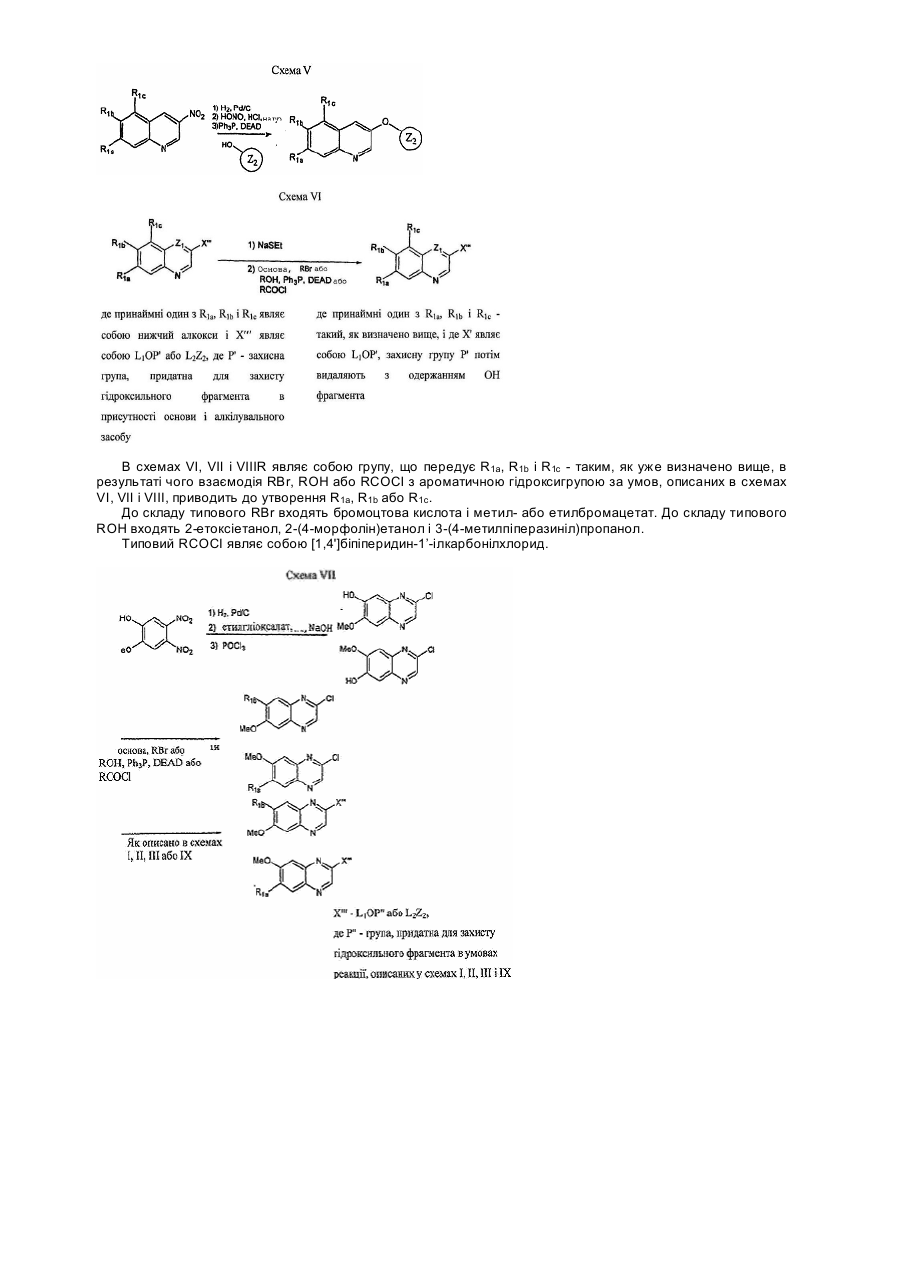
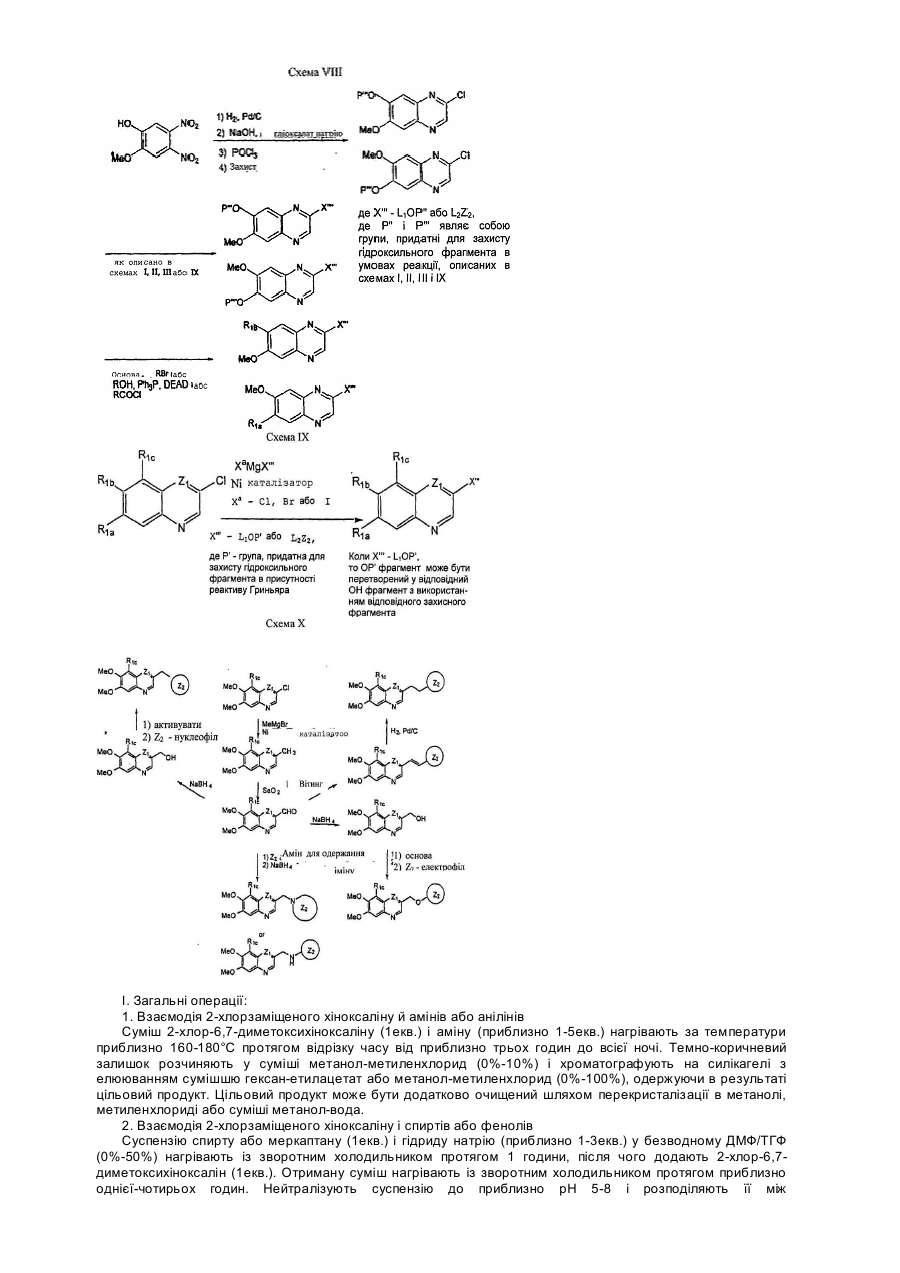
Хінолінові і хіноксалінові сполуки, що інгібують активність тирозинкінази, фармацевтична композиція на їх основі, спосіб інгібування (варіанти) та спосіб лікування (варіанти)
Формула / Реферат
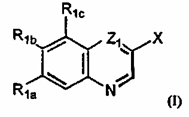
1. Хінолінові або хіноксалінові сполуки формули I:
 ,
,
де
X являє собою L1OH або L2Z2;
L1 являє собою (CR3aR3b)r або (СR3аR3b)m-Z3-(CR3’аR3’b)n;
L2 являє собою (CR3aR3b)р-Z4-(СR3’aR3’b)q або етеніл;
Z1 являє собою СН або N;
Z2 являє собою гідрокси(С3-С10)циклоалкіл, необов'язково заміщений 1-3 замісниками, вибраними з групи, що включає С1-С10алкіл, гідрокси, ацилокси, С1-С10алкокси, галоген, R5R6N, ацилR5N, карбокси і R5R6NCO; гідрокси(С3-C10)циклоалкеніл, необов'язково заміщений 1-3 замісниками, вибраними з групи, що включає С1-С10алкіл, гідрокси, ацилокси, С1-С10алкокси, галоген, R5R6N, aцилR5N, карбокси і R5R6NCO; гідроксигетероцикліл, де гетероцикліл являє собою 4-10-членну, моноциклічну або поліциклічну систему, в якій один або більше атомів кільця є відмінними від вуглецю і вибрані з азоту, кисню або сірки, необов'язково заміщений 1-3 замісниками, вибраними з групи, що включає С1-С10алкіл, гідрокси, ацилокси, С1-С10алкокси, галоген, R5R6N, ацилR5N, карбокси і R5R6NCO; або гідроксигетероцикленіл, де гетероцикленіл являє собою гетероцикліл, визначений вище, що містить, щонайменше, один подвійний зв'язок вуглець-вуглець або вуглець-азот, необов'язково заміщений 1-3 замісниками, вибраними з групи, що включає C1-С10алкіл, гідрокси, ацилокси, C1-С10алкокси, галоген, R5R6N, ацилR5N, карбокси і R5R6NCO;
причому коли циклоалкіл заміщений принаймні двома гідроксизамісниками, то принаймні два гідроксизамісники, можуть бути кеталізовані або ацеталізовані альдегідом або кетоном з 1-6 атомами вуглецю з утворенням відповідного кеталю або ацеталю;
Z3 являє собою О, NR4, S, SO або SО2;
Z4 являє собою О, NR4, S, SO, SО2 або зв'язок;
m дорівнює 0 або 1;
n дорівнює 2 або 3, і n + m = 2 або 3;
р і q дорівнюють, незалежно, 0, 1, 2, 3 або 4, і р + q = 0, 1, 2, 3 або 4, коли Z4 є зв'язком, і р + q = 0, 1, 2 або 3, коли Z4 являє собою інше, ніж зв'язок;
r дорівнює 2, 3 або 4;
R1a і R1b являють собою, незалежно, C1-С10алкіл з прямим або розгалуженим ланцюгом, необов'язково заміщений C1-С10алкоксигрупою, галогеном, карбокси, гідрокси або R5R6N-групою; С6-С10арил, необов'язково заміщений одним або більше замісниками, вибраними з групи, що включає водень, гідрокси, галоген, C1-С10алкіл, C1-С10алкокси, карбокси, C1-С10алкоксикарбоніл і Y1Y2NCO, де Y1 і Y2, незалежно, являють собою водень або C1-С10алкіл; гетероарил, що являє собою 5-10-членну ароматичну моноциклічну або поліциклічну вуглеводневу систему кілець, в якій один або більше атомів кільця є відмінними від вуглецю і вибрані з азоту, кисню або сірки, необов'язково заміщену одним або більше замісниками, вибраними з групи, що включає водень, гідрокси, галоген, C1-С10алкіл, C1-С10алкокси, карбокси, C1-С10алкоксикарбоніл і Y1Y2NCO, де Y1 і Y2, незалежно, являють собою водень або C1-С10алкіл; гідрокси; ацилокси; С1-С10алкокси, необов'язково заміщений одним або більше замісниками, вибраними з групи, що включає аміно, С1-С10алкокси, карбокси, C1-С10алкоксикарбоніл, карбоксі(С6-С10)арил, карбамоїл або гетероцикліл, де гетероцикліл має вищезгадане значення; циклоалкіл-О-, де циклоалкіл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу; гетероцикліл-О-, де гетероцикліл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу; гетероцикліл-С(О)О-, де гетероцикліл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу; С6-С10арилокси, необов'язково заміщений групами, як вказано вище для арилу; гетероарил-О-, де гетероарил має вищезгадані значення, необов'язково заміщений групами, як вказано вище для арилу; ціано; R5R6N або ацил-R5N, або один з R1a і R1b являє собою водень або галоген, а інший являє собою C1-С10алкіл, необов'язково заміщений, як вказано для нього вище; С6-С10арил, необов'язково заміщений, як вказано для нього вище; гетероарил, як він визначений вище, необов'язково заміщений як вказано вище для арилу; гідрокси; ацилокси; С1-С10алкокси, необов'язково заміщений, як вказано для нього вище; циклоалкіл-О-, де циклоалкіл має вищезгадані значення, необов'язково заміщений як вказано для нього вище; гетероцикліл-О-, де гетероцикліл визначений вище, необов'язково заміщений, як вказано вище для циклоалкілу; гетероцикліл-С(О)О-, де гетероцикліл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу; С6-С10арилокси, необов'язково заміщений групами, як вказано вище для арилу; гетероарил-О-, де гетероарил має вищезгадані значення, необов'язково заміщений групами, як вказано вище для арилу; ціано, R5R6N або ацил-R5N;
R1c являє собою водень, C1-С10алкіл з прямим або розгалуженим ланцюгом, необов'язково заміщений як вказано для нього вище; С6-С10арил, необов'язково заміщений одним або більше замісниками, вибраними з групи, що включає водень, гідрокси, галоген, C1-С10алкіл, C1-С10алкокси, карбокси, C1-С10алкоксикарбоніл і Y1Y2NСО, де Y1 і Y2, незалежно, являють собою водень або C1-С10алкіл; гетероарил, що являє собою 5-10-членну ароматичну моноциклічну або поліциклічну вуглеводневу систему кілець, в якій один або більше атомів кільця є відмінними від вуглецю і вибрані з азоту, кисню або сірки, необов'язково заміщену одним або більше замісниками, вибраними з групи, що включає водень, гідрокси, галоген, C1-С10алкіл, C1-С10алкокси, карбокси, С1-С10алкоксикарбоніл і Y1Y2NCO, де Y1 і Y2, незалежно, являють собою водень або C1-С10алкіл; гідрокси; ацилокси; С1-С10алкокси, необов'язково заміщений одним або більше замісниками, вибраними з групи, що включає аміно, C1-С10алкокси, карбокси, C1-С10алкоксикарбоніл, карбоксі(С6-С10)арил, карбамоїл або гетероцикліл, де гетероцикліл має вищезгадане значення; циклоалкіл-О-, де циклоалкіл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу; гетероцикліл-О-, де гетероцикліл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу; гетероцикліл-С(О)О-, де гетероцикліл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу; С6-С10арилокси, необов'язково заміщений групами, як вказано вище для арилу; гетероарил-О-, де гетероарил має вищезгадані значення, необов'язково заміщений групами, як вказано вище для арилу; галоген; ціано; R5R6N або ацил-R5N;
R3a, R3b, R3’a і R3’b, незалежно, являють собою водень або C1-С10алкіл з прямим або розгалуженим ланцюгом;
R4 являє собою водень, C1-С10алкіл з прямим або розгалуженим ланцюгом, Н-СО- або C1-С10алкіл-СО-; і
R5 і R6, незалежно, являють собою водень або C1-С10алкіл з прямим або розгалуженим ланцюгом, або R5 і R6, взяті разом з атомом азоту, з яким пов'язані R5 і R6, утворюють азагетероцикліл, де гетероцикліл визначений вище,
або їх N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль.
2. Сполука формули 1 за п.1, в якій:
L1 являє собою (CR3aR3b)m-Z3-(CR3’aR3’b)n;
L2 являє собою (CR3aR3b)p-Z4-(CR3’aR3’b)q;
Z2 являє собою гідрокси(С3-C10)циклоалкіл, необов'язково заміщений 1-3 замісниками, вибраними з групи, що включає C1-С10алкіл, гідрокси, ацилокси, C1-С10алкокси, галоген, R5R6N, aцилR5N, карбокси і R5R6NCO, або гідроксигетероцикліл, де гетероцикліл являє собою 4-10-членну, моноциклічну або поліциклічну систему, в якій один або більше атомів кільця є відмінними від вуглецю і вибрані з азоту, кисню або сірки, необов'язково заміщений 1-3 замісниками, вибраними з групи, що включає C1-С10алкіл, гідрокси, ацилокси, C1-С10алкокси, галоген, R5R6N, ацилR5N, карбокси і R5R6NCO;
Z4 являє собою О і NR4;
m дорівнює 0;
n дорівнює 2 або 3;
р + q = 0 або 1;
R1a і R1b, незалежно, являють собою C1-С10алкіл з прямим або розгалуженим ланцюгом, необов'язково заміщений C1-С10алкоксигрупою, галогеном, карбокси, гідрокси або R5R6N-групою; C1-С10алкокси, необов'язково заміщений одним або більше замісниками, вибраними з групи, що включає аміно, C1-С10алкокси, карбокси, C1-С10алкоксикарбоніл, карбоксі(С6-С10)арил, карбамоїл і гетероцикліл, де гетероцикліл має вищезгадане значення; циклоалкіл-О-, де циклоалкіл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу; гетероцикліл-О-, де гетероцикліл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу; або R5R6N; або один з R1a і R1b являє собою водень або галоген, а інший з R1a і R1b являє собою C1-С10алкіл з прямим або розгалуженим ланцюгом, необов'язково заміщений C1-С10алкоксигрупою, галогеном, карбокси, гідрокси або R5R6N-групою; C1-С10алкокси, необов'язково заміщений одним або більше замісниками, вибраними з групи, що включає аміно, C1-С10алкокси, карбокси, C1-С10алкоксикарбоніл, карбоксі(С6-С10)арил, карбамоїл і гетероцикліл, де гетероцикліл має вищезгадане значення; циклоалкіл-О-, де циклоалкіл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу; гетероцикліл-О-, де гетероцикліл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу, або R5R6N;
R1c являє собою водень, C1-С10алкіл з прямим або розгалуженим ланцюгом, необов'язково заміщений С1-С10алкоксигрупою, галогеном, карбокси, гідрокси або R5R6N-групою; або C1-С10алкокси, необов'язково заміщений одним або більше замісниками, вибраними з групи, що включає аміно, C1-С10алкокси, карбокси, C1-С10алкоксикарбоніл, карбоксі(С6-С10)арил, карбамоїл або гетероцикліл, де гетероцикліл має вищезгадане значення;
R3а, R3b, R3’a і R3’b, незалежно, являють собою водень або C1-С6алкіл;
R4 являє собою водень; і
R5 і R6, взяті разом з атомом азоту, з яким пов'язані R5 і R6, утворюють азагетероцикліл, або
її N-оксид, її гідрат, її сольват, її проліки або її фармацевтично прийнятна сіль.
3. Сполука формули 1 за п.1, в якій:
X являє собою L2Z2;
L2 являє собою (CR3aR3b)p-Z4-(CR3’aR3’b)q;
Z2 являє собою гідрокси(С3-C10)циклоалкіл, необов'язково заміщений 1-3 замісниками, вибраними з групи, що включає C1-С10алкіл, гідрокси, ацилокси, C1-С10алкокси, галоген, R5R6N, aцилR5N, карбокси і R5R6NCO;
Z4 являє собою O і NR4;
р дорівнює 0;
q дорівнює 0 або 1;
R1a і R1b, незалежно, являють собою C1-С10алкіл з прямим або розгалуженим ланцюгом, необов'язково заміщений С1-С10алкоксигрупою, галогеном, карбокси, гідрокси або R5R6N-групою; C1-С10алкокси, необов'язково заміщений одним або більше замісниками, вибраними з групи, що включає аміно, C1-С10алкокси, карбокси, C1-С10алкоксикарбоніл, карбоксі(С6-С10)арил, карбамоїл або гетероцикліл, де гетероцикліл має вищезгадане значення; циклоалкіл-О-, де циклоалкіл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу, або гетероцикліл-О-, де гетероцикліл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу; або один з R1a і R1b являє собою водень або галоген, а інший з R1a і R1b являє собою C1-С10алкіл з прямим або розгалуженим ланцюгом, необов'язково заміщений C1-С10алкоксигрупою, галогеном, карбокси, гідрокси або R5R6N-групою; C1-С10алкокси, необов'язково заміщений одним або більше замісниками, вибраними з групи, що включає аміно, C1-С10алкокси, карбокси, C1-С10алкоксикарбоніл, карбоксі(С6-С10)арил, карбамоїл або гетероцикліл, де гетероцикліл має вищезгадане значення, або циклоалкіл-О-, де циклоалкіл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу; гетероцикліл-О-, де гетероцикліл має вищезгадані значення, необов'язково заміщений групами, як вказано вище для циклоалкілу;
R1c являє собою водень;
R3’a і R3’b, незалежно, являють собою водень; і
R4 являє собою водень, або
її N-оксид, її гідрат, її сольват, її проліки або її фармацевтично прийнятна сіль.
4. Сполука за п. 1, в якій Z1 являє собою СН.
5. Сполука за п. 1, в якій Z1 являє собою N.
6. Сполука за п. 1, в якій Z2 являє собою гідрокси(С3-С10)циклоалкіл, необов'язково заміщений 1-3 замісниками, вибраними з групи, що включає C1-С10алкіл, гідрокси, ацилокси, C1-С10алкокси, галоген, R5R6N, ацилR5N, карбокси і R5R6NCO.
7. Сполука за п. 1, в якій р і q являють собою 0.
8. Сполука за п. 1, в якій р + q = 1.
9. Сполука за п. 1, в якій Z4 являє собою О.
10. Сполука за п. 1, в якій Z4 являє собою О, і р і q являють собою 0.
11. Сполука за п. 1, в якій Z4 являє собою О, і р + q = 1.
12. Сполука за п. 1, в якій Z4 являє собою NR4.
13. Сполука за п. 1, в якій Z4 являє собою NR4, і р і q являють собою 0.
14. Сполука за п. 1, в якій Z4 являє собою NR4, і р + q = 1.
15. Сполука за п. 1, в якій Z4 являє собою S.
16. Сполука за п. 1, в якій Z4 являє собою S, і р і q являють собою 0.
17. Сполука за п. 1, в якій Z4 являє собою S, і р + q = 1.
18. Сполука за п. 1, в якій R1a і R1b, незалежно, являють собою необов'язково заміщений гідроксигрупою С1-С6алкіл, гідрокси, C1-С6алкокси, циклоалкіл-О-, де циклоалкіл має вказані в п.1 значення, необов'язково заміщені групами, як вказано в п.1 для циклоалкілу, гетероцикліл-О-, де гетероцикліл має вказані в п. 1 значення, необов'язково заміщений групами, як вказано в п. 1 для циклоалкілу; або один з R1a і R1b являє собою водень або галоген, а інший з R1a і R1b являє собою необов'язково заміщений гідроксигрупою C1-С6алкіл, гідрокси, C1-С6алкокси, циклоалкіл-О-, де циклоалкіл має вказані в п.1 значення, необов'язково заміщені групами, як вказано в п.1 для циклоалкілу, гетероцикліл-О-, де гетероцикліл має вказані в п. 1 значення, необов'язково заміщений групами, як вказано в п. 1 для циклоалкілу.
19. Сполука за п. 1, в якій R1a і R1b, незалежно, являють собою гетероцикліл-С(О)О-, де гетероцикліл має вказані в п. 1 значення, необов'язково заміщений групами, як вказано в п.1 для циклоалкілу, або C1-С6алкокси, необов'язково заміщений групами, як вказано для нього в п.1.
20. Сполука за п. 19, в якій C1-С6алкокси являє собою метокси або етокси.
21. Сполука за п. 1, в якій R1a і R1b, незалежно, являють собою C1-С6алкіл.
22. Сполука за п. 21, в якій C1-С6алкілом є метил або етил.
23. Сполука за п. 1, в якій один з R1a і R1b являє собою C1-С6алкокси, а інший з R1a і R1b є галогеном.
24. Сполука за п. 23, в якій C1-С6алкокси є метокси або етокси, а галогеном - хлор або бром.
25. Сполука за п. 1, в якій один з R1a і R1b являє собою C1-С6алкіл, а інший з R1a і R1b є С1-С6алкокси.
26. Сполука за п. 25, в якій C1-С6алкокси являє собою метокси або етокси, а C1-С6алкіл є метилом або етилом.
27. Сполука за п. 1, в якій один з R1a і R1b являє собою C1-С6алкокси, а інший з R1a і R1b являє собою циклоалкіл-О-, де циклоалкіл має значення, вказані в п. 1.
28. Сполука за п. 27, в якій C1-С6алкокси являє собою метокси або етокси, і циклоалкіл-О- є циклопентилокси або циклогексилокси.
29. Сполука за п. 1, в якій один з R1a і R1b являє собою водень, а інший з R1a і R1b являє собою C1-С6алкокси, циклоалкіл-О- або гетероцикліл-О-, де вказані радикали мають вказані в п.1 значення.
30. Сполука за п. 29, в якій С1-С6алкокси являє собою метокси або етокси, і циклоалкіл-О- є циклопентилокси або циклогексилокси, а гетероцикліл-О- є фуранілокси.
31. Сполука за п. 1, в якій R1c являє собою водень, C1-С6алкіл або C1-С6алкокси.
32. Сполука за п. 31, в якій C1-С6алкілом є метил або етил, а C1-С6алкокси є метокси або етокси.
33. Сполука за п. 1, в якій Z2 являє собою гідрокси(С3-С10)циклоалкіл, необов'язково заміщений гідрокси або C1-С10алкілом.
34. Сполука за п. 33, в якій Z2 являє собою гідрокси(С3-С10)циклоалкіл, необов'язково заміщений С1-С6алкілом.
35. Сполука за п. 19, в якій C1-С6алкокси необов'язково заміщений C1-С10алкоксигрупою, гетероциклілом, де гетероцикліл має значення, вказані в п.1, карбоксигрупою, C1-С10алкоксикарбонілом або карбамоїлом.
36. Сполука за п. 35, в якій один з R1a і R1b являє собою незаміщений C1-С6алкокси, а інший з R1a і R1b являє собою гетероцикліл-С(О)О-, де гетероцикліл має вказані в п.1 значення, необов'язково заміщені групами, як вказано в п. 1 для циклоалкілу, або C1-С6алкокси, заміщений C1-С10алкоксигрупою, гетероциклілом, де гетероцикліл має значення, вказані в п.1, карбоксигрупою, C1-С10алкоксикарбонілом або карбамоїлом.
37. Сполука за п. 36, в якій один з R1a і R1b являє собою метокси, а інший з R1a і R1b являє собою [1,4']біпіперадин-1'-ілкарбонілокси, 2-(етоксі)етокси, 2-(4-морфолініл)етокси, 2-(4-метилпіперазин-1-іл)етокси, карбоксиметокси, метоксикарбонілметокси, амінокарбонілметокси, N-метиламінокарбонілметокси або N,N-диметиламінокарбонілметокси.
38. Сполука за п. 1, яка являє собою:
транс-4-(7-хлор-6-метоксихіноксалін-2-іламіно)циклогексанол;
транс-4-(6-хлор-7-метоксихіноксалін-2-іламіно)циклогексанол;
транс-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанол;
цис-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанол;
(2ендо,5екзо)-5-(6,7-диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2-ол;
(2екзо,5екзо)-5-(6,7-диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2-ол;
(2ендо,3екзо,5екзо)-5-(6,7-диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2,3-діол;
цис-2-(6-метоксихіноксалін-2-іламіно)циклопентанол;
транс-2-(6-метоксихіноксалін-2-іламіно)циклопентанол;
транс-4-(6-метоксихіноксалін-2-іламіно)циклогексанол;
[3aR,4S,6R,6aS]-6-(6,7-диметоксихіноксалін-2-іламіно)-2,2-диметилтетрагідроциклопента[1.3]діоксол-4-карбонової кислоти етиламід;
2-(1,4-діоксаспіро[4.5]дец-8-ілокси)-6,7-диметоксихіноксалін;
4-(6,7-диметоксихіноксалін-2-ілоксиметил)циклогексанол;
3-(6,7-диметоксихіноксалін-2-ілокси)циклогексанол;
4-(6,7-диметоксихіноксалін-2-ілокси)циклогексанол;
5-(6,7-диметоксихіноксалін-2-ілокси)біцикло[2.2.1]гептан-2,3-діол;
(2екзо,3екзо,5екзо)-5-(6,7-диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2,3-діол;
цис-4-(6,7-диметоксихіноксалін-2-ілокси)циклогексиловий ефір оцтової кислоти;
цис-4-(6,7-диметоксихіноксалін-2-ілокси)циклогексанол;
4-(6,7-диметоксихіноксалін-2-ілокси)циклогексиловий ефір диметилкарбамінової кислоти;
транс-4-(6,7-диметокси-4-оксихіноксалін-2-іламіно)циклогексанол;
транс-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексиловий ефір оцтової кислоти;
(2екзо,5екзо)-5-(6,7-диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2-ол;
(2ендо,5екзо)-5-(6,7-диметоксихінолін-2-іламіно)біцикло[2.2.1]гептан-2-ол;
(2екзо,6екзо)-6-(6,7-диметоксихінолін-2-іламіно)біцикло-[2.2.1]гептан-2-ол;
4-(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанол;
(2транс,4транс)-4-(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанол;
(+)-(2транс,4транс)-4-(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанол;
(-)-(2транс,4транс)-4-(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанол;
(2транс,4транс)-4-(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанол;
(2цис,4цис)-4-(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанол;
(2цис,4транс)-4-(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанол, і
4-(6,7-диметилхіноксалін-2-іламіно)циклогексанол,
або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль.
39. Сполука за п. 1, яка являє собою транс-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанол, або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль.
40. Сполука за п. 1, яка являє собою цис-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанол, або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль.
41. Сполука за п. 1, яка являє собою 4-(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанол, або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль.
42. Сполука за п. 1, яка являє собою (2екзо,5екзо)-5-(6,7-диметоксихіноксалін-2-іламіно)біцикло-[2.2.1]гептан-2-ол, або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль.
43. Сполука за п. 1, яка являє собою транс-4-(7-хлор-6-метоксихіноксалін-2-іламіно)циклогексанол, або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль.
44. Сполука за п. 1, яка являє собою 4-(6,7-диметоксихінолін-2-іламіно)циклогексанол, або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль.
45. Сполука за п. 1, яка являє собою (-)-(2транс,4транс)-4-(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанол, або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль.
46. Сполука за п. 1, яка являє собою (1S, 2R, 4S, 5R)-5-(6,7-диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2-ол, або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль.
47. Сполука за п. 1, яка являє собою сульфат транс-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанолу.
48. Фармацевтична композиція, що містить сполуку за п. 1 і фармацевтично прийнятний носій.
49. Спосіб інгібування активності тирозинкінази фактора росту PDGF, який відрізняється тим, що сполуку за п. 1 піддають контактуванню з композицією, що містить тирозинкіназу PDGF.
50. Спосіб інгібування активності тирозинкінази Lck, який відрізняється тим, що сполуку за п. 1 піддають контактуванню з композицією, що містить тирозинкіназу Lck.
51. Спосіб інгібування проліферації клітин, диференціювання або вивільнення посередника у пацієнта, який страждає від порушення, що характеризується такими проліферацією і/або диференціюванням, і/або вивільненням посередника, який відрізняється тим, що вказаному пацієнту вводять фармацевтично ефективну кількість сполуки за п. 1.
52. Спосіб за п. 51, в якому порушенням є лейкоз, рак, гліобластома, псоріаз, запальні захворювання, захворювання кістки, фіброзні захворювання, артрит, фіброз легені, фіброз нирки, фіброз печінки, атеросклероз або рестеноз після ангіопластики вінцевої артерії, стегнової артерії або артерії нирки.
53. Спосіб лікування патології, пов'язаної з гіперпроліферативним порушенням, який відрізняється тим, що пацієнту вводять фармацевтично ефективну кількість сполуки за п. 1.
54. Спосіб за п. 53, в якому вказаною патологією є рестеноз.
55. Спосіб за п. 53, в якому патологією, пов'язаною з гіперпроліферативним порушенням, є рак, сприйнятливий до лікування шляхом інгібування тирозинкінази фактора росту PDGF.
56. Спосіб за п. 55, в якому рак являє собою рак головного мозку, рак яєчника, рак товстої кишки, рак передміхурової залози, рак легенів, саркому Капоши або злоякісну меланому.
57. Спосіб лікування рестенозу, який відрізняється тим, що пацієнту, потребуючому такого лікування, вводять фармацевтично ефективну кількість сполуки за п. 1, здатну інгібувати проліферацію клітин гладких м'язів кровоносних судин і міграцію в заданому місці.
58. Спосіб за п. 57, в якому вказане місце є місцем механічного пошкодження артеріальної стінки, одержане внаслідок лікування атеросклеротичного ураження шляхом ангіопластики.
59. Спосіб за п. 57, в якому сполуку за п. 1 вводять за допомогою балона для ангіопластики, покритого гідрофільною плівкою, просоченою сполукою за п. 1.
60. Спосіб за п. 57, в якому сполуку за п. 1 вводять за допомогою катетера, забезпеченого інфузійною камерою, що містить сполуку за п. 1.
61. Спосіб за п. 57, в якому сполуку за п. 1 вводять за допомогою покриття на розширювальному пристрої (стенті), що містить сполуку за п. 1.
62. Спосіб лікування запалення у пацієнта, який страждає від такого порушення, який відрізняється тим, що вказаному пацієнту вводять фармацевтично ефективну кількість сполуки за п. 1.
63. Спосіб лікування ревматоїдного артриту, розсіяного склерозу, системного червоного вовчака, хвороби "трансплантат проти хазяїна", астми, запальної хвороби кишечнику або панкреатиту, який відрізняється тим, що пацієнту, потребуючому такого лікування, вводять інгібуючу тирозинкіназу Lck кількість сполуки за п. 1.
Текст
Цей винахід відноситься до інгібування проліферації клітин і/або продукції клітинного матриксу, і/або пересування клітин (хематоксису), і/або активації і проліферації Т-клітин шляхом використання хінолінових і хіноксалінових сполук, що є корисними інгібіторами білкової тирозинкінази (TKIs). Клітинна передача сигналів відбувається за посередництвом системи взаємодій, до якої входить контакт клітини з клітиною, клітини з матриксом або позаклітинного рецептора з субстратом. Позаклітинний сигнал часто передається до інших частин клітини через опосередковане тирозинкіназою фосфорилування, що впливає на білки субстрату за клітинною мембраною, зв'язаною з комплексом, що передає сигнал. Прикладом ферментів тирозинкіназ, втягнутих у клітинну передачу сигналів, є конкретний ряд рецепторівферментів таких, як інсуліновий рецептор, рецептор епідермального фактора росту (EGF-R) або рецептор тромбоцитарного фактора росту (PDGF-R). Для ефективного ферментативного фосфорилування субстратних білків, що містять тирозинові залишки, потрібне автофосфорилування ферменту. Відомо, що ці субстрати відповідальні за різноманітні клітинні акти, серед яких - клітинна проліферація, продукція клітинного матриксу, клітинна міграція, апоптоз тощо. Зрозуміло, що некероване розмноження клітин, надвиробництво матриксу або погано регульована запрограмована загибель клітин (апоптоз) викликають багато хворобливих станів. Ці хворобливі стани уражають найрізноманітніші типи клітин і до них відносять такі захворювання, як лейкоз, рак, гліобластома, псоріаз, запальні хвороби, фібрози, атеросклероз і рестеноз, що виникає після ангіопластики коронарних, стегнових або ниркових артерій, або фібропроліферативне захворювання таке, як артрит, фіброз легенів, нирок і печінки. Крім того, після коронарного шунтування створюються умови клітинної проліферації з порушеною регуляцією. Здається, що інгібування активності тирозинкінази було б корисним в регуляції некерованого розмноження клітин, надвиробництва матриксу або погано регульованої запрограмованої загибелі клітин (апоптозу). Відомо також, що деякі інгібітори тирозинкіназ можуть взаємодіяти з більш ніж одним типом ферменту тирозинкінази. Деякі тирозинкінази дуже важливі для нормального функціонування організму. Наприклад, було б бажаним інгібувати дію інсуліну в більшості звичайних випадків. Таким чином, сполуки, що інгібують активність тирозинкінази рецептора PDGF-R при концентраціях, нижчих концентрацій, ефективних в інгібуванні кінази інсулінового рецептора, могли б давати цінні засоби для вибіркового лікування захворювань, що характеризуються проліферацією клітин і/або продукцією клітинного матриксу, і/або пересуванням клітин (хемотаксисом) таких, як рестеноз. Цей винахід стосується модулювання і/або інгібування передачі сигналів в клітинах, проліферації клітин, продукції позаклітинного матриксу, хемотаксису, регуляції анормального росту клітин і запальної реакції клітин. Конкретніше цей винахід стосується застосування заміщених хіноксалінів, що мають здатність вибірково інгібувати диференціювання, проліферацію або вивільнення посередника шляхом ефективного інгібування активності тирозинкінази рецептора тромбоцитарного фактора росту (PDGF-R) і/або активності Lck тирозинкінази. У ряді повідомлень в літературних джерелах описані інгібітори тирозинкіназ, що вибірково діють на ферменти тирозинкіназних рецепторів таких, як EGF-R або PDGF-R, або нерецепторні цитозольні тирозинкінази такі, як v-abl, p56Іck або c-src. В недавніх оглядах, зроблених Spada and Myers (Ехр. Opin. Ther. Patents 1995, 5(8), 805) і Bridges (Exp. Opin. Ther. Patents 1995, 5(12), 1245) наведено короткий опис літератури стосовно інгібіторів тирозинкіназ і інгібіторів, вибіркових щодо EGF-R відповідно. Крім того, Law and Lydon дали коротке повідомлення про протипухлинну здатність інгібіторів тирозинкіназ (Emerging Drugs: The Prospect For Improved Medicines 1996, 241-260). До відомих інгібіторів активності тирозинкінази рецептора PDGF-R відносять інгібітори на основі хіноліну, описані Maguire et al. (J. Med. Chem. 1994, 37, 2129) і Dolle et al. (J. Med. Chem. 1994, 37, 2627). Клас інгібіторів на основі феніламінопіримідину був недавно описаний Traxler et al. в ЕР 564409 і Zimmerman, J.; and Traxler, P. et al. (Вiorg. & Med. Chem. Lett. 1996, 6(11), 1221-1226) і Buchdunger, E. et al. (Proc. Nat. Acad. Sci. 1995,92,2558). Незважаючи на прогрес в даній області, в цих класах сполук ще немає засобів, які були б схвалені для застосування на людях для лікування проліферативних захворювань. Взаємозв'язок між багатофакторним захворюванням рестенозом і PDGF і PDGF-R достатньо описаний в науковій літературі. Однак недавні просування в розумінні фіброзів легенів (Antoniades, H.N. et al. J. Clin. Invest. 1990, 86, 1055), нирок і печінки (Peterson, T.C. Hepatology, 1993, 17, 486) показали, що важливу роль у цих захворюваннях також відіграють PDGF і PDGF-R. Наприклад, гломерулонефрит є основною причиною ниркової недостатності, і, як показано Shultz et al. (Am. J. PhysioІ. 1988, 255, F674) і Floege et al. (Clin. Exp. Immun. 1991, 86, 334), PDGF був ідентифікований як потужний мітоген для мезангіальних клітин in vitro. Як було повідомлено Thornton, B.C.; et al. (Clin. Exp. Immun. 1991, 86, 79), TNF-альфа і PDGF (отримані від людей, хворих ревматоїдним артритом) є основними цитокінами, втягнутими в процес проліферації синовіальних клітин. Крім того, вже ідентифіковані конкретні типи пухлинних клітин (див. Silver, B.J., BioFactors. 1992, 3, 217) такі, як гліобластома і саркома Капоши, що здійснюють переекспресію білка PDGF або рецептора, що веде до некерованого росту пухлинних клітин через аутокринний або паракринний механізм. Таким чином, очікується, що інгібітор PDGF тирозинкінази буде корисним в лікуванні різноманітних, мабуть, неспоріднених хворобливих станів, які можна характеризувати залученням в їх етіологію PDGF і/або PDGF-R. Роль різних нерецепторних тирозинкіназ таких, як р56Іск (далі "Lck"), у пов'язаних із запаленням станах, до яких віднесено активацію і проліферацію Т-клітин, уже була описана Hanke, et al. (Inflamm. Res. 1995, 44, 357) і Bolen and Brugge (Ann. Rev. Immunol., 1997, 15, 371). До цих запальних станів відносяться алергія, аутоімунна хвороба, ревматоїдний артрит і відторгнення трансплантату. В іншому недавньому огляді коротко описані різні класи інгібіторів тирозинкіназ, включно сполуки, що мають інгібуючу активність стосовно Lck (Groundwater, et al. Progress in Medicinal Chemistry. 1996, 33, 233). До інгібіторів активності Lck тирозинкіназ віднесено деякі природні продукти, що звичайно є невибірковими інгібіторами тирозинкіназ такі, як ставроспорин, геністеїн, деякі флавони і ербстатин. Недавно було повідомлення про дамнакантол як низько-нМ-ний інгібітор Lck (Faltynek, et al. Biochemistry, 1995, 34, 12404). Приклади синтетичних інгібіторів Lck включають: ряд дигідроксіізохінолінових інгібіторів, що, як повідомлено (Burke, et al., J. Med. Chem. 1993, 36, 425), мають активність при низькій концентрації в межах від мікромолярної до субмікромолярної; і похідне хіноліну, яке, як виявлено, є набагато менш активним стосовно Lck (ІС50=610мкМ). Дослідниками було також відкрито низку 4-заміщених хіназолінів, що інгібують Lck при низькій концентрації в межах від мікромолярної до субмікромолярної (Myers et al., W095/15758 і Myers et al., Bioorg. Med. Chem. Lett. 1997, 7, 417). Дослідники з Pfizer (Hanke et al., J. Biol. Chem. 1996, 271, 695) розкрили два специфічних піразолопіримідинових інгібітори, відомих як РР1 і РР2, що мають низьконаномолярну активність стосовно Lck і Fyn. (інша кіназа сімейства Src). Немає ніякого повідомлення про інгібітори Lck, що відносяться до сполук на основі хіноліну або хіноксаліну. Тому очікується, що хіноліновий або хіноксаліновий інгібітор активності тирозинкінази Lck може бути корисним при лікуванні різноманітних неспоріднених хворобливих станів людини, які можна характеризувати залученням у їх етіологію передачі сигналів через тирозинкінази Lck. Цей винахід стосується сполуки за формулою І: де X являє собою L1OH aбo L2Z2; L1 являє собою (CR3aR3b)r або (CR3aR3b)m-Z3-(CR3'aR3'b)n; L2 являє собою (CR3aR3b)p-Z4-(CR3’aR3'b)q або етеніл; Z1 являє собою CH aбo N; Z2 являє собою необов'язково заміщений гідроксициклоалкіл, необов'язково заміщений гідроксициклоалкеніл, необов'язково заміщений гідроксигетероцикліл або необов'язково заміщений гідроксигетероцикленіл; Z3 являє собою О, NR4, S, SO або SO2; Z4 являє собою О, NR4, S, SO, SO2 або зв'язок; m являє собою 0 або 1; n являє собою 2 або 3, причому n+m=2 або 3; р або q незалежно являють собою 0, 1, 2, 3 або 4, причому р+q=0, 1, 2, 3 або 4, коли Z4 являє собою зв'язок, і р+q=0, 1, 2 або 3, коли Z4 не є зв'язком; r являє собою 2, 3 або 4; R1a і R1b незалежно являють собою необов'язково заміщений алкіл, необов'язково заміщений арил, необов'язково заміщений гетероарил, гідрокси, ацилокси, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений гетероциклілокси, необов'язково заміщений гетероциклілкарбонілокси, необов'язково заміщений арилокси, необов'язково заміщений гетероарилокси, ціано, R5R6N- або ацилR5N- або один із R1a і R1b являє собою водень або галоген, а інший - необов'язково заміщений алкіл, необов'язково заміщений арил, необов'язково заміщений гетероарил, гідрокси, ацилокси, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений гетероциклілокси, необов'язково заміщений гетероциклілкарбонілокси, необов'язково заміщений арилокси, необов'язково заміщений гетероарилокси, ціано, R5R6N- або aцилR5N-; R1c являє собою водень, необов'язково заміщений алкіл, необов'язково заміщений арил, необов'язково заміщений гетероарил, гідрокси, ацилокси, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений гетероциклілокси, необов'язково заміщений гетероциклілкарбонілокси, необов'язково заміщений арилокси, необов'язково заміщений гетероарилокси, галоген, ціано, R5R6N- або ацил R5N-; R3a, R3b R3'a і R3'b являють собою незалежно водень або алкіл; R4 являє собою водень, алкіл або ацил; і R5 і R6 незалежно являють собою водень або алкіл або R5 і R6 узяті разом з атомом азоту, до якого R5 і R6 приєднані, утворюють азагетероцикпіл, або її N-оксиду, гідрату, сольвату, пролікарського засобу або фармацевтично прийнятної солі. Цей винахід стосується також фармацевтичної композиції, що містить фармацевтично ефективну кількість сполуки формули І і фармацевтично прийнятний носій. І ще цей винахід стосується проміжних сполук, придатних для одержання сполук формули І, способів одержання проміжних сполук і сполук формули І і застосування сполуки формули І для лікування пацієнта, що страждає від (або схильний до них) порушень або станів, серед яких - клітинне диференціювання, проліферація, продукція позаклітинного матриксу або вивільнення посередника. Слід розуміти, що використані вище і у всьому описі винаходу наступні терміни мають, якщо не вказано інше, такі значення. Визначення "Пацієнт" являє собою як людину, так і інших ссавців. "Ефективна кількість" являє собою кількість сполуки за цим винаходом, що є ефективною в інгібуванні активності тирозинкінази PDGF-R та активності Lck тирозинкінази і тому такою, що забезпечує потрібний терапевтичний ефект. "Алкіл" являє собою аліфатичну вуглеводневу групу, яка може бути групою з розгалуженим або нерозгалуженим ланцюгом, що має від приблизно 1 до приблизно 10 вуглецевих атомів. Переважним алкілом є "нижчий алкіл", що має від приблизно 1 до приблизно 6 вуглецевих атомів. Розгалужений ланцюг являє собою, що до лінійного алкільного ланцюга приєднані одна або кілька нижчих алкільних груп таких, як метил, етил або пропіл. Алкільна група є також необов'язково заміщеною алкокси, галогеном, карбокси, гідрокси або R5R6N-. Прикладами алкілу можуть бути метил, фторметил, дифторметил, трифторметил, етил, н-пропіл, ізопропіл, бутил, втор-бутил, трет-бутил, аміл і гексил. "Алкеніл" являє собою аліфатичну вуглеводневу групу, що містить подвійний вуглець-вуглецевий зв'язок, який може бути нерозгалуженою або розгалуженою групою, що має від приблизно 2 до приблизно 10 вуглецевих атомів в ланцюзі. Переважні алкенільні групи, що мають приблизно 2-6 вуглецевих атомів, а більш переважно приблизно 2-4 вуглецевих атомів в ланцюзі. Розгалужений ланцюг являє собою, що до лінійного алкільного ланцюга приєднані одна або кілька нижчих алкільних груп таких, як метил, етил або пропіл. "Нижчий алкеніл" являє собою групу, що має приблизно 2-4 вуглецевих атоми в ланцюзі, що може бути нерозгалуженим або розгалуженим. Алкенільна група може бути заміщена за допомогою карбалкокси. Прикладами алкенільних груп можуть бути етеніл, пропеніл, н-бутеніл, ізобутеніл, 3-метилбут-2-еніл, нпентеніл, гептеніл, октеніл, циклогексилбутеніл і деценіл. "Етиленіл" являє собою групу -СН=СН-. "Циклоалкіл" являє собою неароматичну моно- або поліциклічну кільцеву систему, що має від приблизно 3 до приблизно 10 вуглецевих атомів. Циклоалкільна група може бути заміщеною одним або кількома, переважно одним-трьома, більш переважно одним-двома, наступними "замісниками циклоалкілу": алкіл, гідрокси, ацилокси, алкокси, галоген, R5R6N-, ацилR5N-, карбокси або R5R6NCO-, причому більш переважними замісниками є алкіл, гідрокси, ацилокси, алкокси і R5R6NCO-. Крім того, якщо циклоалкільна група заміщена принаймні двома гідроксизамісниками, то принаймні два гідроксизамісники можуть бути кеталізовані або ацеталізовані альдегідом або кетоном з одним-шістьма вуглецевими атомами з утворенням відповідного кеталю або ацеталю. "Гідроксициклоалкіл" являє собою НО-циклоакліл, де циклоалкіл може бути заміщений так, як вказано вище. Якщо гідроксіалкільна група вибрана з циклоалкільної групи, яка теж заміщена гідрокси, то вказані два гідроксизамісники можуть бути кеталізовані або ацеталізовані альдегідом або кетоном з одним-шістьма вуглецевими атомами з утворенням відповідного кеталю або ацеталю. Кеталізація гемдіолу приводить до утворення спіроконденсованої кільцевої системи. Переважним спіроциклоалкільним кільцем є 1,4діоксаспіро[4,5]дец-8-ил. Переважні незаміщені або заміщені моноциклічні циклоалкільні кільця включають циклопентил, гідроксициклопеентил, фторциклопентил, циклогексил, гідроксициклогексил, гідроксиметилциклогексил і циклогептил; більш переважно гідроксициклогексил і гідроксициклопентил. Прикладами поліциклічних циклоалкільних кілець можуть бути 1-декалін, адамант-(1 або 2-)ил, [2.2.1]біциклогептаніл (норборніл), гідрокси[2.2.1]біциклогептаніл (гідроксинорборніл), [2.2.2]біциклооктаніл і гідрокси[2.2.2]біциклооктаніл; більш переважно гідрокси[2.2.1]біциклогептаніл (гідроксинорборніл) і гідрокси[2.2.2]біциклооктаніл. "Циклоалкеніл" являє собою неароматичну моноциклічну або поліциклічну кільцеву систему, що має подвійний вуглець-вуглецевий зв'язок і має від приблизно 3 до приблизно 10 вуглецевих атомів. Циклоалкенільна група може бути заміщена одним або кількома, переважно одним-трьома, а ще більш переважно одним-двома замісниками циклоалкілу, описаними вище. "Гідроксициклоалкеніл" являє собою НО-циклоалкеніл, в якому циклоалкіл може бути, як вказано, заміщеним. Переважні незаміщені або заміщені моноциклічні циклоалкенільні кільця мають у своєму складі циклопентеніл, циклогексеніл, гідроксициклопентеніл, гідроксициклогексеніл і циклогептеніл; більш переважно гідроксициклопентеніл і гідроксициклогексеніл. Переважні поліциклічні циклоалкенільні кільця мають у своєму складі [2.2.1]біциклогептеніл (норборненіл) і [2.2.2]біциклооктеніл. "Арил" являє собою ароматичний карбоциклічний радикал, що містить від приблизно 6 до приблизно 10 вуглецевих атомів. Прикладом арилу є феніл або нафтил, або феніл чи нафтил, заміщений одним або кількома замісниками арильної групи, що можуть бути однаковими або різними, причому "замісник арильної групи" має у своєму складі водень, гідрокси, галоген, алкіл, алкокси, карбокси, алкоксикарбоніл або Y1Y2CO, де Y1 і Y2 незалежно являють собою водень або алкіл. Переважні замісники арильної групи, до складу яких входять водень, галоген і алкокси. "Гетероарил" являє собою приблизно 5-10-членну ароматичну моноциклічну або поліциклічну вуглеводневу кільцеву систему, у якій один або кілька вуглецевих атомів в кільцевій системі є елементом(ами), відмінним(и) від вуглецю, наприклад, азотом, киснем або сіркою. "Гетероарил" може бути також заміщений одним або декількома вищевказаними "замісниками арильної групи". Прикладами гетероарильних груп можуть бути заміщений піразиніл, фураніл, тієніл, піридил, піримідиніл, ізоксазоліл, ізотіазоліл, оксазоліл, тіазоліл, піразоліл, фуразаніл, піроліл, імідазо[2,1-b]тіазоліл, бензофуразаніл, індоліл, азаіндоліл, бензімідазоліл, бензотієніл, хінолініл, імідазоліл і ізохінолініл. "Гетероцикліл" являє собою 4-10-членну моноциклічну кільцеву систему, в якій один або кілька атомів в кільцевій системі є елементом(ами), відмінним(и) від вуглецю й вибраним(и) з азоту, кисню або сірки. Гетероциклільна група може бути заміщеною одним або декількома, переважно одним-трьома, більш переважно одним-двома замісниками циклоалкілу, описаними вище. "Гідроксигероцикліл" являє собою НОгетероцикліл, в якому гетероцикліл може бути заміщений так, як вказано вище. "Азагетероцикліл" являє собою вказаний вище гетероцикліл, в якому принаймні один з кільцевих атомів є азотом. До складу прикладів гетероциклільних фрагментів входять хінуклідил, пентаметиленсульфід, тетрагідропіраніл, тетрагідротіофеніл, піролідиніл, тетрагідрофураніл або 7-оксабіцикло[2.2.1]гептаніл. "Гетероциклілкарбонілокси" являє собою гетероциклільну групу таку, як описана вище, яка приєднана до родоначального молекулярного фрагмента через карбонілоксигрупу (-С(О)О-). Гетероциклільний фрагмент є необов'язково заміщеним одним або кількома, переважно одним-трьома, більш переважно одном замісником циклоалкілу, таким, як описано вище. Типовою гетероциклілкарбонілоксигрупою є [ 1,4']біперидин-1'-ілкарбонілокси. "Гетероцикленіл" являє собою визначену вище гетероциклільну кільцеву систему, яка містить принаймні один вуглець-вуглецевий або вуглець-азотний подвійний зв'язок. Гетероцикленільна група може бути заміщеною одним або декількома, переважно одним-трьома, більш переважно одним-двома замісниками циклоалкілу, описаними вище. "Гідроксигетероцикленіл" являє собою НО-гетероцикленіл, в якому гетероцикленіл може бути заміщений так, як зазначено вище. "Азагетероцикленіл" являє собою вказаний вище гетероцикленіл, в якому принаймні один з кільцевих атомів є азотом. До складу типових моноциклічних гетероцикленільних груп входять 1,2,3,4-тетрагідрогідропіридин, 1,2-дигідропіридил, 1,4дигідропіридил, 1,2,3,6-тетрагідропіридин, 1,4,5,6-тетрагідропіримідин, 3,4-дигідро-2Н-піран, 2-піролініл, 3піролініл, 2-імідазолініл, 2-піразолініл, тетрагідротіофеніл і тетрагідротіопіраніл тощо. "Ацил" являє собою Н-СО- або алкіл-СО-групу, в якій алкільна група така, як описано вище. Перевагу слід надавати ацилам, які містять нижчий алкіл. Приклади ацильних груп включають форміл, ацетил, пропаноїл, 2-метилпропаноїл, бутаноїл і пальмітоїл. "Ароїл" являє собою арил-СО-групу, в якій алкільна група така, як описано вище. Прикладами груп можуть бути бензоїл і 1- і 2-нафтоїл. "Алкокси" являє собою алкіл-О-групу, в якій алкільна група така, як описано вище. Перевагу слід надавати алкокси, яким є "нижчий алкокси", що має від приблизно 1 до приблизно 6 вуглецевих атомів. Алкокси може бути необов'язково заміщеним однією або декількома групами такими, як аміно, алкокси, карбокси, алкоксикарбоніл, карбоксіарил, карбамоїл або гетероцикліл. Прикладами алкоксигруп можуть бути метокси, етокси, н-пропокси, ізопропокси, н-бутокси, гептокси, 2-(морфолін-4-іл)етокси, 2(етокси)етокси, 2-(4-метилпіперазин-1-іл)етокси, карбамоїл, N-метилкарбамоїл, N,N-диметилкарбамоїл, карбоксиметокси і метоксикарбонілметокси. "Циклоалкілокси" являє собою циклоалкіл-О-групу, в якій циклоалкільна група така, як описано вище. Прикладами циклоалкілоксигрупи можуть бути циклопентилокси, циклогексилокси, гідроксициклопентилокси і гідроксициклогексилокси. "Гетероциклілокси" являє собою гетероцикліл-О-групу, в якій гетероциклільна група така, як описано вище. До прикладів гетероциклілоксигруп входять хінуклідилокси, пентаметиленсульфідокси, тетрагідропіранілокси, тетрагідротіофенілокси, піролідинілокси, тетрагідрофуранілокси або 7-оксабіцикло[2.2.1]гептанілокси, гідрокситетрагідропиранілокси і гідрокси-7-оксабіцикло-[2.2.1]гептанілокси. "Арилокси" являє собою арил-О-групу, в якій арильна група така, як описано вище. "Гетероарилокси" являє собою гетероарил-О-групу, в якій гетероарильна група така, як описано вище. "Ацилокси" являє собою ацил-О-групу, в якій ацильна група така, як описано вище. "Карбокси" являє собою НО(О)С-(карбонова кислота)групу. "R5R6-N-" являє собою заміщену або незаміщену аміногрупу, в якій R5 і R6 - такі, як визначено вище. Прикладами груп можуть бути аміно (H2 N-), метиламіно, етилметиламіно, диметиламіно і діетиламіно. "R5R6NCO-" являє собою заміщену або незаміщену карбамоїльну групу, в якій R5 і R6 - такі, як визначено вище. Прикладами груп є карбамоїл (H2NCO-), N-мeтилкapбaмoїл-(MeNHCO-) і N,Nдиметиламінокарбамоїл (Me2NCO-). "АцилR5N-" являє собою ациламіногрупу, в якій R5 і ацил -такі, як визначено вище. "Галоген" являє собою фтор, хлор, бром або йод. Переважними є фтор, хлор або бром, а більш переважно - фтор або хлор. "Пролікарський засіб" являє собою форму сполуки формули І, придатну для введення пацієнту без надмірних токсичності, подразнень, алергічної реакції і тому подібного, та ефективну в її призначенні; до таких форм відносять кетальну, складноефірну і цвітеріонну форми. Пролікарський засіб трансформується in vivo у родоначальну сполуку вказаної вище формули, наприклад, шляхом гідролізу в крові. Повний опис наведено Т. Higuchi і V. Stella в Pro-drugs as Novel Delivery Svstems, Vol. 14 of the A.C.S. Symposium Series, і Edward B. Roche, ed., в Bioreversible Carriers in Drug Design, American Pharmaceutical Association and. Pergamon Press, 1987; обидва матеріали включені в даний опис шляхом посилання. "Сольват" являє собою фізичну асоціацію сполуки за цим винаходом з однією або кількома молекулами розчинника. Ця фізична асоціація охоплює змінні ступені утворення іонного і ковалентного зв'язків, включно утворення водневого зв'язку. У деяких випадках сольват може виділятись, наприклад, коли одна або декілька молекул розчинника впроваджені в кристалічну решітку кристалічної твердої речовини. "Сольват" являє собою як сольвати у фазі розчину, так і сольвати, що виділяються. Типові сольвати включають етанолати, метанолати тощо. "Гідрат" являє собою сольват, у якому молекула(и) розчинника - це Н2О. Переважні варіанти Переважною сполукою за цим винаходом є сполука формули І, в якій: L1 являє собою (CR3aR3b)m-Z3-(CR3'aR3'b)n; L2 являє собою (CR3aR3b)p-Z4-(CR3’aR3’b)q; Z2 являє собою необов'язково заміщений гідроксициклоалкіл або необов'язково заміщений гідроксигетероцикліл; Z4 являє собою О і NR4; m являє собою 0; n являє собою 2 або 3; p+q=0 aбo 1; R1a i R1b незалежно являють собою необов'язково заміщений алкіл, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений гетероциклілокси або R5R6N- або один із R1a, і R1b являє собою водень або галоген; R1c являє собою водень, необов'язково заміщений алкіл або необов'язково заміщений алкокси; R3a, R3b, R3'а і R3'b являють собою незалежно водень або нижчий алкіл; R4 являє собою водень; і R5 і R6 узяті разом з атомом азоту, до якого R5 і R6 приєднані, утворюють азагетероцикліл, або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятну сіль. Іншою переважною сполукою за цим винаходом є сполука формули І, в якій: X являє собою L2Z2; L2 являє собою (CR3aR3b)p-Z4-(CR3'aR3'b)q; Z2 являє собою необов'язково заміщений гідроксициклоалкіл; Z4 являє собою C I NR4; р являє собою 0; q являє собою 0 або 1; R1a і R1b незалежно - необов'язково заміщений алкіл, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси або необов'язково заміщений гетероциклілокси, або один із R1a, і R1b являє собою водень або галоген, а інший із R1a і R1b - необов'язково заміщений алкіл, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси або необов'язково заміщений гетероциклілокси; R1c являє собою водень; R3'a і R3'b незалежно являють собою водень; і R4 являє собою водень; або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятну сіль. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій R1a і R1b незалежно являють собою необов'язково гідроксизаміщений нижчий алкіл, гідрокси, нижчий алкокси, циклоалкілокси, гетероциклілокси або один із R1a, і R2b являє собою водень або галоген, а інший із R1a, і R1b - необов'язково заміщений нижчий алкіл, гідрокси, нижчий алкокси, циклоалкілокси, гетероциклілокси. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій R1a і R1b незалежно являють собою гетероциклілкарбонілокси або необов'язково заміщений нижчий алкокси, причому більш переважно нижчим алкокси є метокси або етокси. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій R1a і R1b незалежно являють собою нижчий алкіл, причому більш переважно нижчий алкіл, який є метилом або етилом. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій один із R1a і R1b являє собою нижчий алкокси, а інший з R1a і R1b являє собою галоген, причому більш переважно нижчим алкокси є метокси або етокси, а галогеном - хлор або бром. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій один із R1a і R1b являє собою нижчий алкіл, а інший з R1a і R1b являє собою нижчий алкокси, причому більш переважно нижчим алкокси є метокси або етокси, а нижчим алкілом - метил або етил. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій один із R1a і R1b являє собою нижчий алкокси, а інший з R1a і R1b являє собою циклоалкілокси, причому більш переважно нижчим алкокси є метокси або етокси, а циклоалкілокси - циклопентилокси або циклогексилокси. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій один із R1a і R1b являє собою водень, а інший з R1a і R1b являє собою нижчий алкокси, циклоалкілокси або гетероциклілокси, причому більш переважно нижчим алкокси є метокси або етокси, циклоалкілокси - циклопентилокси або циклогексилокси і гетероциклілокси - фуранілокси. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій R1a і R1b являють собою нижчий алкокси, необов'язково заміщений алкокси, гетероциклілом, карбокси, алкоксикарбонілом або карбамоїлом. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій один з R1a і R1b являє собою незаміщений нижчий алкокси, а інший з R1a і R1b являють собою необов'язково заміщений гетероциклілкарбонілокси або нижчий алкокси, заміщений алкокси, гетероциклілом, карбокси, алкоксикарбонілом або карбамоїлом. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій один із R1a і R1b являє собою метокси, а інший з R1a і R1b являє собою [1,4’]біпіперидин-1’-ілкарбонілокси, 2-(етокси)етокси, 2-(4морфолініл)етокси, 2-(4-метилпіперазин-1-іл)етокси, карбоксиметокси, метоксикарбонілметокси, амінокарбонілметокси, N-метиламінокарбонілметокси або N,N-диметиламінокарбонілметокси. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій R1c являє собою водень, нижчий алкіл або нижчий алкокси, причому більш переважно нижчим алкокси є метокси або етокси. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій Z1 являє собою СН. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій Z1 являє собою N. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій Z2 являє собою необов'язково заміщений гідроксициклоалкіл. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій р і q являють собою 0. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій р+q=1. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій Z4 являє собою 0. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій Z4 являє собою 0, і р і q являють собою 0. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій Z4 являє собою 0, і p+q=1. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій Z4 являє собою NR4. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій Z4 являє собою NR4, і р і q являють собою 0. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій Z4 являє собою NR4, і р+q=1. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій Z4 являє собою S. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій Z4 являє собою S, і р і q являють собою 0. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій Z4 являє собою S, і p+q=1. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій Z2 являє собою гідрокси- або алкілзаміщений гідроксициклоалкіл, більш переважно (нижчий алкіл) гідроксициклоалкіл. Наступною переважною сполукою за цим винаходом є сполука формули І, в якій R1a і R1b являє собою нижчий алкокси. необов'язково заміщений на алкокси, гетероцикліл, карбокси. алкоксикарбоніл або карбамоїл. Переважні сполуки за цим винаходом вибирають з таких: транс-4-(7-Хлор-6-метоксихіноксалін-2-іламіно)циклогексанол; транс-4-(6-Хлор-7-метоксихіноксалін-2-іламіно)циклогексанол; транс-4-(6,7-Диметоксихіноксалін-2-іламіно)циклогексанол; цис-4-(6,7-Диметоксихіноксалін-2-іламіно)циклогексанол; (2ендо,5екзо)-5-(6,7-Диметоксихіноксалін-2-іламіно)біцикло-[2.2.1]гептан-2-ол; (2екзо,5екзо)-5-(6,7-Диметоксихіноксалін-2-іламіно)біцикло-[2.2.1]гептан-2-ол; (2ендо,3екзо,5екзо)-5-(6,7-Диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2,3-діол; цис-2-(6-Метоксихіноксалін-2-іламіно)циклопентанол; транс-2-(6-Метоксихіноксалін-2-іламіно)циклопентанол; транс-4-(6-Метоксихіноксалін-2-іламіно)циклогексанол; [3аR,4S,6R,6аS]-6-(6,7-Диметоксихіноксалін-2-іламіно)-2,2-диметилтетрагідроциклопента[1.3]діоксол-4карбонової кислоти етиламід; 2-(1,4-Діокса-спіро[4.5]дец-8-ілокси)-6,7-Диметоксихіноксалін; 4-(6,7-Диметоксихіноксалін-2-ілоксиметил)циклогексанол; 3-(6,7-Диметоксихіноксалін-2-ілокси)циклогексанол; 4-(6,7-Диметоксихіноксалін-2-ілокси)циклогексанол; 5-(6,7-Диметоксихіноксалін-2-ілокси)біцикло[2.2.1]гептан-2,3-діол; (2екзо,3екзо,5екзо)-5-(6,7-Диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2,3-діол; цис-4-(6,7-Диметоксихіноксалін-2-ілокси)циклогексиловий складний ефір оцтової кислоти; цис-(6,7-Диметоксихіноксалін-2-ілокси)циклогексанол; 4-(6,7-Диметоксихіноксалін-2-ілокси)циклогексиловий складний ефір диметилкарбамінової кислоти; транс-4-(6,7-Диметокси-4-оксихіноксалін-2-іламіно)циклогексанол; транс-4-(6,7-Диметоксихіноксалін-2-іламіно)циклогексиловий складний ефір оцтової кислоти; (2екзо,5екзо)-5-(6,7-Диметоксихіноксалін-2-іламіно)біцикло [2.2.1]гептан-2-ол; (2ендо,5екзо)-5-(6,7-Диметоксихінолін-2-іламіно)біцикло[2.2.1]гептан-2-ол; (2екзо,6ендо)-6-(6,7-Диметоксихінолін-2-іламіно)біцикло[2.2.1] переважною гептан-2-ол; 4-(6,7-Диметоксихіноксалін-2-іламіно)-2-метилциклогексанол; (2транс,4транс)-4-(6,7-Диметоксихіноксалін-2-іламіно)-2-метилциклогексанол; (+)-(2транс,4транс)-4-(6,7-Диметоксихіноксалін-2-іламіно)-2-метилциклогексанол; (-)-{2транс,4транс)-4-(6,7-Диметоксихіноксалін-2-іламіно)-2-метилциклогексанол; (2транс,4транс)-4-(6,7-Диметоксихіноксалін-2-іламіно)-2-метилциклогексанол; (2цис,4цис)-4-(6,7-Диметоксихіноксалін-2-іламіно)-2-метилциклогексанол; (2цис,4транс)-4-(6,7-Диметоксихіноксалін-2-іламіно)-2-метилциклогексанол; 4-(6,7-Диметоксихіноксалін-2-іламіно)циклогексанол і (1S,2R,4S,5R)-5-(6,7-Диметоксихіноксалін-2-іламіно)біцикло-[2.2Л]гептан-2-ол. Більш переважними є наступні сполуки: транс-4-(6,7-Диметоксихіноксалін-2-іламіно)циклогексанол; цис-4-(6,7-Диметоксихіноксалін-2-іламіно)циклогексанол; 4-(6,7-Диметоксихіноксалін-2-іламіно)-2-метилциклогексанол; (-)-{2транс,4транс)-4-(6,7-Диметоксихіноксалін-2-іламіно)-2-метилциклогексанол; (2екзо,5екзо)-5-(6,7-Диметоксихінолін-2-іламіно)біцикло[2.2.1]-гептан-2-ол; транс-4-(7-Хлор-6-метоксихіноксалін-2-іламіно)циклогексанол; 4-(6,7-Диметоксихіноксалін-2-іламіно)циклогексанол і (1S,2R,4S,5R)-5-(6,7-Диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2-ол. Потрібно розуміти, що цей винахід охоплює усі відповідні комбінації особливих груп і переважних груп, згаданих в цьому описі. Сполуки за цим винаходом можуть бути отримані з використанням методик, відомих з літератури, з відомих сполук або з легко одержуваних проміжних сполук. Приклади загальних методів наведено нижче. Крім того, сполуки формули І одержують за наступними схемами І-Х, де змінні є такими, як описано вище, за винятком тих змінних, які фахівець у даній області хімії оцінив би як несумісні з описаним методом. В схемах VI, VII і VIIIR являє собою групу, що передує R1a, R1b і R1c - таким, як уже визначено вище, в результаті чого взаємодія RBr, ROH або RCOCІ з ароматичною гідроксигрупою за умов, описаних в схемах VI, VII і VIII, приводить до утворення R1a, R1b або R1c. До складу типового RBr входять бромоцтова кислота і метил- або етилбромацетат. До складу типового ROH входять 2-етоксіетанол, 2-(4-морфолін)етанол і 3-(4-метилпіперазиніл)пропанол. Типовий RCOCІ являє собою [1,4']біпіперидин-1’-ілкарбонілхлорид. І. Загальні операції: 1. Взаємодія 2-хлорзаміщеного хіноксаліну й амінів або анілінів Суміш 2-хлор-6,7-диметоксихіноксаліну (1екв.) і аміну (приблизно 1-5екв.) нагрівають за температури приблизно 160-180°С протягом відрізку часу від приблизно трьох годин до всієї ночі. Темно-коричневий залишок розчиняють у суміші метанол-метиленхлорид (0%-10%) і хроматографують на силікагелі з елююванням сумішшю гексан-етилацетат або метанол-метиленхлорид (0%-100%), одержуючи в результаті цільовий продукт. Цільовий продукт може бути додатково очищений шляхом перекристалізації в метанолі, метиленхлориді або суміші метанол-вода. 2. Взаємодія 2-хлорзаміщеного хіноксаліну і спиртів або фенолів Суспензію спирту або меркаптану (1екв.) і гідриду натрію (приблизно 1-3екв.) у безводному ДМФ/ТГФ (0%-50%) нагрівають із зворотним холодильником протягом 1 години, після чого додають 2-хлор-6,7диметоксихіноксалін (1екв.). Отриману суміш нагрівають із зворотним холодильником протягом приблизно однієї-чотирьох годин. Нейтралізують суспензію до приблизно рН 5-8 і розподіляють її між метиленхлоридом і розсолом. Залишок після концентрування метиленхлориду хроматографують на силікагелі, елюючи сумішшю гексан-етилацетат або метанол-метиленхлорид (0%-100%), з одержанням цільового продукту. 3. Реакція відновлювального амінування з амінохінолінами і альдегідами або кетонами Відповідним чином заміщений 3-амінохінолін (1екв.) перемішують з 1екв. відповідного альдегіду або кетону в метанолі (або іншої відповідної суміші розчинників) доти, поки ТШХ не покаже завершення утворення іміну. Додають надлишковий NaCNBH4 або NaBH4 або інший відповідний відновник і суміш перемішують, поки ТШХ не покаже витрату проміжного іміну. Суміш концентрують і залишок хроматографують на силікагелі сумішшю гексан-етилацетат (0-100%) або хлороформ-метанол (0-20%), з одержанням цільового продукту. 4. Взаємодія 3-амінозаміщених хінолінів і бромфенільних сполук Відповідним способом заміщений 3-амінохінолін (1екв.) перемішують із приблизно 1,4екв. сильної основи такої, як трет-бутоксид натрію, 1екв. відповідної бромфенільної сполуки і каталітичними кількостями 2,2'-біс(дифенілфосфіно)-1,1’-бінафтилу (S-BINAP) і біс(дибензиліденацетон)паладію (Pd(dba)2) в інертному органічному розчиннику такому, як толуол, в інертному середовищі такому, як аргон, і нагрівають до приблизно 80°С протягом ночі. Суміш охолоджують, розводять розчинником таким, як ефір, фільтрують, концентрують і хроматографують сумішшю 50% EtOAc-гексан з одержанням цільового продукту. 5. Утворення простого ефіру з 3-гідроксизаміщених хінолінів шляхом забезпечення умов реакції Міцунобу (Mitsunobu) Розчин відповідним чином заміщеного гідроксихіноксаліну (при приблизно 0-25°С) в ТГФ обробляють 1екв. кожного з потрібного спирту, трифенілфосфіну і в кінці - діетилазодикарбоксилату (DEAD) або відповідного еквівалента. Хід реакції контролюють шляхом ТШХ і після закінчення реакції (від приблизно 1 до приблизно 24 годин) суміш концентрують, а залишок хроматографують на силікагелі з одержанням цільового продукту. 6. Деалкілування нижчим алкокси заміщеного хіноліну або хіноксаліну з наступним алкілуванням Відповідний нижчим алкокси заміщений хінолін або хіноксалін (1екв.) в ДМФ обробляють надлишковим етантіолатом натрію (звичайно приблизно 2 або більше екв.), і реакційну суміш перемішують при нагріванні протягом приблизно 1-24 годин. Суміш розподіляють між водою і етилацетатом. Екстрактивна обробка з наступною хроматографією, якщо необхідно, дає відповідний цільовий продукт: гідроксизаміщений хінолін або хіноксалін. Гідроксизаміщений хіноліновий або хіноксаліновий продукт може бути алкілований з використанням умов реакції Міцунобу, докладно описаних вище. У відповідності до іншого варіанту цільовий алкілований продукт дає просте алкілування методами, добре відомими в даній області хімії, реакційноздатним алкілабо бензилгалогенідом з використанням NaH або іншої відповідної основи у відповідному розчиннику. 7. Окислення азоту в хіноліні або хіноксаліні до відповідного N-оксиду Іміновий (=N-) фрагмент у хіноліновій або хіноксаліновій сполуці формули (І) може бути перетворений у відповідну сполуку, в якій іміновий фрагмент окислюють до N-оксиду переважно шляхом здійснення взаємодії з перкислотою, наприклад пероцтовою кислотою в оцтовій або м-хлорпероксибензойній кислоті в інертному розчиннику такому, як дихлорметан, за температури в межах від приблизно кімнатної температури до температури кипіння зі зворотним холодильником, переважно при підвищеній температурі. Сполуки згідно з цим винаходом корисні у формі вільної основи або вільної кислоти, або у формі їх фармацевтично прийнятної солі. Усі форми знаходяться в межах обсягу цього винаходу. У випадку сполуки за цим винаходом, заміщеної основним фрагментом, утворюють кислотно-адитивні солі, що є зручнішою формою для застосування; практично застосування сполуки у формі солі, власне кажучи, є рівнозначним застосуванню сполуки у формі вільної основи. Серед кислот, що можуть бути використані для одержання кислотно-адитивних солей, є такі, які при сполученні з вільною основою створюють фармацевтично прийнятні солі, тобто солі, аніони яких не токсичні для пацієнта в фармацевтичних дозах солей, завдяки чому корисні інгібуючі ефекти на PDGF, властиві вільній основі, не супроводжуються шкідливими побічними ефектами, що приписуються аніонам. Хоча фармацевтично прийнятні солі вказаних основних сполук є кращими, але всі кислотно-адитивні солі корисні як джерела форми у вигляді вільної основи, навіть якщо конкретна сіль як така потрібна лише як проміжний продукт, як, наприклад, у випадку, коли сіль утворюють лише для цілей очищення й ідентифікації, або коли її використовують як проміжний продукт при одержанні фармацевтично прийнятної солі іонообмінними методами. Фармацевтично прийнятними солями в обсязі цього винаходу є солі, одержані від таких кислот: мінеральні кислоти такі, як хлористоводнева кислота, сірчана кислота, фосфорна кислота і сульфамінова кислота, і органічні кислоти такі, як оцтова кислота, лимонна кислота, молочна кислота, винна кислота, малонова кислота, метансульфонова кислота, етансульфонова кислота, бензолсульфонова кислота, птолуолсульфонова кислота, циклогексилсульфамінова кислота, хінна кислота тощо. До відповідних кислотно-адитивних солей відносять такі: гідрогалогеніди, наприклад гідрохлорид і гідробромід, сульфат, фосфат, нітрат, сульфамат, ацетат, цитрат, лактат, тартрат, малонат, оксалат, саліцилат, пропіонат, сукцинат, фумарат, малеат, метилен-біс-b-гідроксинафтоати, гентизати, мезилати, ізотіонати і ди-птолуоїлтартратесметансульфонат, етансульфонат, бензолсульфонат, п-толуолсульфонат, циклогексилсульфамат і хінат відповідно. Відповідно до іншої ознаки цього винаходу кислотно-адитивні солі сполук за цим винаходом одержують шляхом здійснення взаємодії вільної основи з відповідною кислотою із застосуванням або пристосовуванням відомих методів. Наприклад, кислотно-адитивні солі сполук за цим винаходом одержують або шляхом розчинення вільної основи у водному або водно-спиртовому розчині або інших відповідних розчинниках, що містять відповідну кислоту, і виділення солі шляхом випарювання розчину, або шляхом здійснення взаємодії вільної основи і кислоти в органічному розчиннику, причому в цьому випадку сіль виділяється безпосередньо або вона може бути отримана шляхом концентрування розчину. Сполуки за цим винаходом можуть бути регенеровані з кислотно-адитивних солей шляхом застосування або пристосовування відомих методів. Наприклад, вихідні (родоначальні) сполуки за цим винаходом можуть бути регенеровані з їх кислотно-адитивних солей шляхом обробки лугом, наприклад водним розчином бікарбонату натрію або водним розчином аміаку. У випадку сполуки за цим винаходом, заміщеної кислотним фрагментом, можуть бути утворені основноадитивні солі, що є зручнішою формою для застосування; практично застосування сполуки у формі солі по суті є рівнозначним застосуванню сполуки у формі вільної кислоти. До основ, що можуть бути використані для одержання основно-адитивних солей, відносять переважно ті, які при сполученні з вільною кислотою утворюють фармацевтично прийнятні солі, тобто солі, катіони яких не токсичні для організму тварини в фармацевтичних дозах солей, завдяки чому корисні інгібуючі ефекти на PDGF, властиві вільній кислоті, не супроводжуються шкідливими побічними ефектами, що приписуються катіонам. Фармацевтично прийнятними солями, до яких віднесено, наприклад солі лужних і лужноземельних металів, в обсязі цього винаходу є солі, одержані з таких основ: гідрид натрію, гідроксид натрію, гідроксид калію, гідроксид кальцію, гідроксид алюмінію, гідроксид літію, гідроксид магнію, гідроксид цинку, аміак, триметиламіак, триетиламіак, етилен-діамін, н-метилглюкамін, лізин, аргінін, орнитін, холін, N,N'-дибензилетилендіамін, хлорпрокаїн, діетаноламін, прокаїн, н-бензилфенетиламін, діетиламін, піперазин, тріс(гідроксиметил)амінометан, гідроксид тетраметиламонію тощо. Металеві солі сполук за цим винаходом можуть бути отримані шляхом контактування гідриду, гідроксиду, карбонату або подібної реакційноздатної сполуки обраного металу у водному або органічному розчиннику з сполукою у формі вільної кислоти. Використовуваним водним розчинником може бути вода або суміш води з органічним розчинником, переважно спиртом таким, як метанол або етанол, кетоном таким, як ацетон, аліфатичним простим ефіром таким, як тетрагідрофуран, або складним ефіром таким, як етилацетат. Такі реакції звичайно проводять при температурі навколишнього середовища, але за необхідності їх можна проводити з нагріванням. Амінові солі сполук за цим винаходом можуть бути отримані шляхом контактування аміну у водному або органічному розчиннику зі сполукою у формі вільної кислоти. До відповідних водних розчинників відносять воду і суміші води зі спиртами такими як метанол або етанол, простими ефірами такими, як тетрагідрофуран, нітрилами такими, як ацетонітрил, або кетонами такими, як ацетон. Аналогічним способом можуть бути отримані амінокислотні солі. Сполуки за цим винаходом можуть бути регенеровані з основно-адитивних солей шляхом застосування або пристосовування відомих методів. Наприклад, вихідні (родоначальні) сполуки за цим винаходом можуть бути регенеровані з їх основно-адитивних солей шляхом обробки кислотою, наприклад хлористоводневою кислотою. Крім користі як таких як активних сполук, солі сполук за цим винаходом корисні також для цілей очищення сполук, наприклад із використанням відмінностей в розчинності між солями і родоначальними сполуками, побічними продуктами і/або вихідними матеріалами методами, добре відомими фахівцям у даній області хімії. Сполуки за цим винаходом можуть містити асиметричні центри. Ці асиметричні центри можуть незалежно мати R або S конфігурацію. Для фахівців у даній області хімії очевидно також, що деякі сполуки формули І можуть виявляти геометричну ізомерію. До геометричних ізомерів відносяться цис- і трансформи сполук за цим винаходом, тобто сполуки, що мають алкенільні фрагменти або замісники в кільцевих системах. Крім того, до біциклічних кільцевих систем віднесено ендо- і екзоізомери. Цей винахід охоплює окремі геометричні ізомери, стереоізомери, енантіомери і їх суміші. Такі ізомери можуть бути виділені з їх сумішей шляхом застосування або пристосовування відомих методів, наприклад, методів хроматографії і методів перекристалізації, або можуть бути отримані окремо з відповідних ізомерів їх проміжних сполук, наприклад, шляхом застосування або пристосовування методів, наведених у даному описі. Вихідні матеріали і проміжні сполуки одержують шляхом застосування або пристосовування відомих методів, наприклад таких, як описані в прикладах, на які посилаються, або їх очевидних хімічних еквівалентів, або методами, описаними у відповідності до винаходу в даному описі. Цей винахід додатково проілюстровано прикладами, але він не обмежується наведеними нижче ілюстративними прикладами, в яких описано одержання сполук за цим винаходом. Крім того, наведені далі приклади є способами, що використовуються для синтезу сполук за цим винаходом. ПРИКЛАД 1 3-циклогексилокси-6,7-диметоксихінолін До ТГФ розчину (30мл) при 0°С додають 3-гідрокси-6,7-диметоксихінолін (0,237г, 1,15ммоль), циклогексанол (0,347г, 3,46ммоль), Ph3P (0,908г, 3,46ммоль). Порціями додають діетилазодикарбоксилат, поки розчин не набуде темно-червоного кольору (0,663г, 3,81ммоль). Через 4 години розчин концентрують і залишок хроматографують (50% EtOAc в гексанах). Продукт перекристалізовують із суміші пропанол/гексани з одержанням хлористоводневої солі у вигляді білої твердої речовини (т. пл. 229-232°С, розкладання). ПРИКЛАД 2 2-аніліно-6-ізопропоксихіноксалінгідрохлорид До NaH (0,033г, 0,84ммоль) в аргоні додають 1мл ДМФ. Додають порціями 2-аніліно-6-хіноксалінол (0,1г, 0,42ммоль) у 1,5мл ДМФ. Через 30 хвилин додають краплями 2-бромпропан і розчин нагрівають до 50°С протягом 1,5 годин. Охолоджену реакційну суміш гасять водою і розподіляють між EtOAc і Н2О, промивають Н2О (3рази) розсолом, сушать (MgSO4) і концентрують. Отриманий залишок хроматографують (30% EtOAc/гексани), з одержанням 0,05г діалкілованого продукту і 0,1г вказаної в заголовку сполуки. Аналітичний зразок хлористоводневої солі одержують шляхом додавання ІРА (ізопропанол)/НСІ до Et2O/IPA розчину вільної основи з одержанням хлористоводневої солі (т. пл. 205-210°С, розкладання). Анал. обчислено для C17H17 N3O·HCІ: С, 64,65; Н, 5,74; N, 13,31. Знайдено: С, 64,51; Н, 5,90; N, 13,09. ПРИКЛАД 3 2-Аніліно-6-метоксихіноксалінгідрохлорид До 2-хлор-6-метоксихіноксаліну (0,93г, 4,8ммоль) в аргоні додають анілін (1,3мл, 14,3ммоль). Реакційну суміш нагрівають при 120°С протягом 2 годин і потім при 150°С протягом 1,5 години. Суміш охолоджують і додають до неї СН2СІ 2. Отриману суспензію перемішують і жовтогарячу тверду речовину відфільтровують, промивають СН2СІ 2/Et2O і потім інтенсивно перемішують в Н2О протягом 40 хвилин, фільтрують і промивають Et2O з одержанням світло-жовтої твердої речовини. ПРИКЛАД 4 2-аніліно-6-хіноксалінол Методом Feutrill, G.I.: Mirrington, R.N. Tet. Lett. 1970, 1327, перетворюють арилметиловий ефір у похідну фенолу. До 2-аніліно-6-метоксихіноксаліну (0,27г, 1,07ммоль) в аргоні в ДМФ додають натрієву сіль етантіолу (0,19г, 2ммоль). Реакційну суміш нагрівають до 110°С протягом ночі. Суміш концентрують і розподіляють між EtOAc і сумішшю Н2О/5% винна кислота, так що рН водного шару дорівнюватиме приблизно 4. Органічний шар промивають водою (4 рази) і потім 2,5% NaOH (4 рази). Основні шари об'єднують, промивають EtOAc (2 рази), знову підкислюють 5%-ною винною кислотою і багаторазово промивають порціями EtOAc. Органічні шари об'єднують, промивають розсолом, сушать (Na2SO4) і концентрують. Отриману тверду речовину хроматографують (50% EtOAc/гексани). Шляхом розтирання продукту з Et2O одержують зразок для аналізу у вигляді жовтого порошку (т. пл. 211-213°С). Анал. обчислено для С14H11N3O: С, 70,88; Н, 4,67; N, 17,71. Знайдено: С, 70,64; Н, 4,85; N,17,58. ПРИКЛАД 5 Феніл-[6-(тетрагідрофуран-3-(R)-ілокси)хіноксалін-2-іл]амін До ТГФ розчину при 0°С в аргоні додають 2-аніліно-6-хіноксалінол (0,23г, 0,97ммоль). Додають порціями (S)-(+)-3-гідрокситетрагідрофуран (0,086мл, 1,3ммоль) і трифенілфосфін (0,31г, 1,2ммоль). Додають порціями DEAD (0,18мл, 1,2ммоль). Реакційній суміші дають нагрітися до кімнатної температури і перемішують 1,5 години. Суміш концентрують і розподіляють між EtOAc і Н2О. Органічний шар промивають водою, розсолом, сушать (MgSO4) і концентрують. Отримане жовте масло хроматографують (50% EtOAc/гексани) і розчиняють в Et2O/IPA. Додають краплями розчин HCl/Et2O і отриманий червонооранжевий порошок висушують у вакуумі. Порошок роблять вільноосновним шляхом перемішування в МеОН з промитою (3хН2О, 5хМеОН) основною іонообмінною смолою. Суміш перемішують 30 хвилин, фільтрують, концентрують і перекристалізовують із суміші EtOАс/гексани з одержанням (у двох збираннях) продукту (т. пл. 173-175°С). Анал. обчислено для C18H17N3O2: С, 70,35; Н, 5,57; N, 13,67. Знайдено: С, 70,19; Н, 5,60; N, 13,66. ПРИКЛАД 6 2,7-біциклогексилокси-6-метоксихіноксалін До розчину NaH (0,32г, 8ммоль) в ДМФ (5мл) в аргоні додають краплями циклогексанол (0,7мл, 6,7ммоль). Суміш перемішують при кімнатній температурі протягом 25 хвилин, після чого додають порціями 2-хлор-6,7-диметоксихіноксалін. Реакційну суміш перемішують 15 хвилин при кімнатній температурі, 2 години при 90°С і 1 годину при 110°С. Суміш охолоджують, гасять за допомогою Н2О і розподіляють між EtOAc і Н2О. Органічний шар промивають водою і розсолом, сушать (MgSO4) і хроматографують (10% EtOAc/гексани) з одержанням воскоподібної білої твердої речовини (т. пл. 75-78°С). Анал. обчислено для C21H28N2O3: С, 70,76; Н, 7,92; N, 7,86. Знайдено: С, 70,81; Н, 7,79; N, 7,70. ПРИКЛАД 7 циклогексил-(6,7-диметоксихіноксалін-2-ілметил)-амін До 0,067М розчину 6,7-диметокси-2-хіноксалінкарбоксальдегіду в суміші (2:1) МеОН-1,2-дихлоретан (7,5мл, 0,5ммоль) додають циклогексиламін (0,11мл, 0,9ммоль). Реакційну суміш залишають перемішуватися при кімнатній температурі протягом ночі, після чого додають NaBH4 (0,038г, 1ммоль) і перемішують реакційну суміш протягом ночі. Потім суміш концентрують і хроматографують (50% EtOAc/гексан - приблизно 5% МеОН у 50% EtOАс/гексани). Масло розчиняють в EtOAc/гексанах й обробляють НСІ в EtOН. Отриманий розчин концентрують і тверді частки розтирають з ізопропанолом з одержанням білої твердої речовини після висушування у вакуумі при 60°С (т. пл. 185-190°С, розкладання). Анал. обчислено для C17H23 N3O2·HCІ: С, 60,44; Н, 7,16; N, 12,44. Знайдено: С, 60,48; Н, 6,88; N, 12,07. ПРИКЛАД 8 (6,7-диметоксихінолін-3-іл)-транс-(3-(R)-метил-циклогексил)амін і (6,7-диметоксихінолін-3іл)-цис-(3-(R)-метилциклогексил)амін Реакцію здійснюють аналогічно описаному вище одержанню з використанням вільної основи 3-аміно6,7-диметоксихіноліну (0,32г, 1,6ммоль) і (R)-(+)-3-метилциклогексанону (0,23мл, 1,9ммоль). Отриману суміш продуктів хроматографують (70% EtOAc/гексани) і перекристалізовують із суміші EtOAc/гексани з одержанням білої твердої речовини (суміш цис- і трансізомерів, 1:1) (т. пл. 153-160°С). Анал. обчислено для C18H24N2O2: С, 71,97; Н, 8,05; N, 9,33. Знайдено: С, 72,12; Н, 7,85; N, 9,29. ПРИКЛАД 9 3-(6,7-диметоксихінолін-3-іламіно)-2,2-диметилпропан-1-ол Реакцію проводять аналогічно одержанню в прикладі 7. До розчину порошкоподібних (4А) молекулярних сит (0,35г) в МеОН під аргоном додають 3-аміно-6,7-диметоксихінолін (0,32г, 1,6ммоль) і 2,2диметил-3-гідроксипропіональдегід (0,19г, 1,9ммоль). Суміш продуктів хроматографують (3% МеОН/СНСІ 3) з одержанням 0,10г матеріалу, який розподіляють між СН2СІ 2 і 10% NaOH. Органічний шар промивають 10% NaOH, H2O і розсолом, після чого сушать (MgSO4) і перекристалізовують з суміші EtOAc/гексани з одержанням світло-жовтої твердої речовини (т. пл. 170-173, 5°С). Анал. обчислено для C16H22N2O3: С, 66,18; Н, 7,64; N, 9,65. Знайдено: С, 66,11; Н, 7,49; N, 9,33. ПРИКЛАД 10 Циклогексил-(6-метокси-7-морфолін-4-іл-хіноксалін-2-іл)амін Це одержання грунтується на адаптації методу, описаного Buchwald, et al., J. Am. Chem. Soc, 1996, 118, 7215. До толуолового розчину 2-циклогексиламіно-6-метокси-7-бромхіноксаліну (0,1г, 0,3ммоль) в аргоні додають морфолін (0,1г, 0,3ммоль), трет-бутоксид натрію (0,04г, 0,42ммоль), S-(-)-BINAP (кат., 0,001г) і біс(дибензиліденацетон)паладій (кат., 0,001г). Реакційну суміш нагрівають до 80°С протягом ночі. Суміш охолоджують, розводять Et2O, фільтрують, концентрують і хроматографують (50% EtOAc/гексани). Продукт перекристалізовують з суміші EtOAc/гексани з одержанням (у двох збираннях) жовтої твердої речовини (т. пл. 194-196°С). Анал. обчислено для C19H26N4O2: С, 66,64; Н, 7,65; N, 16,36. Знайдено: С, 66,60; Н, 7,60; N, 16,51. ПРИКЛАД 11 транс-4-(7-хлор-6-метоксихіноксалін-2-аміно)-циклогексанол і транс-4-(6-хлор-7метоксихіноксалін-2-іл-аміно)циклогексаном В реакційну колбу, оснащену пасткою Діна-Старка і зворотним холодильником, в аргоні вводять суміш (6:1, 0,30г, 1,3ммоль) 2,7-дихлор-6-метоксихіноксаліну і 2,6-дихлор-7-метоксихіноксаліну і транс-4аміноциклогексанол (0,35г, 3ммоль). Реакційну суміш нагрівають до 170°С протягом приблизно 10 годин, після чого концентрують і двічі хроматографують (7% МеОН/СНСІ 3 і потім 5% МеОН/СНСІ 3). Продукт перекристалізовують з суміші EtOAc/гексани з одержанням світло-жовтої твердої речовини (т. пл. 144147°С). Анал. обчислено для C19H26N4O2·0,4H2O: С, 57,20; Н, 6,02; N, 13,34. Знайдено: С, 57,21; Н, 5,97; N, 13,08. 1Н ЯМР-аналіз показує, що продукт є сумішшю (2:1) транс-4-(7-хлор-6-метоксихіноксалін-2 аміно)циклогексанолу і транс-4-(6-хлор-7-метокси-хіноксалін-2-іламіно)циклогексанолу. ПРИКЛАД 12 транс-4-(6,7-диметоксихіноксалін-2-іламіно)-циклогексанол транс-4-аміноциклогексанол (0,11 г, 2 екв.) і 2-хлор-6,7-диметоксихіноксалін (0,1г, 1екв.) об'єднують і нагрівають до 160-180°С протягом 4-8 годин. Темно-коричневу суспензію фільтрують і концентрують. Залишок очищають на флеш-колонці, елююючи сумішшю 3% метанол/метиленхлорид з одержанням продукту у вигляді жовтого порошку з т. пл. 119-123°С. Анал. обчислено для C16H21N3O3: C, 62,33; Н, 7,05; N, 13,63. Знайдено: С, 62,35; Н, 7,09; N, 13,18. Сполуку можна перекристалізувати у такий спосіб. З 0,2г жовтого порошку в суміші 2,5мл води і 1,25мл метанолу одержують при нагріванні зі зворотним холодильником прозорий розчин жовтогарячого кольору. Гарячий розчин залишають стояти і поступово охолоджуватися. Жовтогарячі голчасті кристали збирають шляхом фільтрування і висушують у високому вакуумі з одержанням жовтої твердої речовини (т. пл. 119120°С). Відповідно до іншого варіанта одержують НСІ сіль вказаної в заголовку сполуки в такий спосіб. До розчину транс-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанолу в ізопропанолі додають розчин НСІ при 0°С. Суміш перемішують 15 хвилин, після чого фільтрують. Зібрану тверду речовину висушують у високому вакуумі з одержанням хлористоводневої солі транс-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанолу. Анал. обчислено для С16Н22СІN3О3·1,2Н2О: С, 53,19; Н, 6,80; N, 11,63; СІ, 9,81. Знайдено: С, 55,14; Н, 6,85; N, 11,24; СІ, 10,28. Згідно з ще одним варіантом одержують сульфат (сіль) вказаної в заголовку сполуки в такий спосіб. Звичайним методом розчиняють транс-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанол в ацетоні або іншому відповідному органічному розчиннику з підігріванням до 45°С, якщо це необхідно. До отриманого розчину обережно додають водний розчин H2SO4 (1екв., 1М розчин) при швидкому перемішуванні. Утворену при цьому сіль збирають і висушують з одержанням сульфату при виході >80%. Аналогічним чином із відповідного вихідного матеріалу одержують такі сполуки: 3-(6,7-диметоксихіноксалін-2-іламіно)пропан-1-ол (т. пл. 154,5-156°С). Анал. обчислено для С 13Н17N3О3: С, 59,30; Н, 6,51; N, 15,96. Знайдено: С, 59,30; Н, 6,46; N, 15,87. 3-(6,7-диметоксихіноксалін-2-іламіно)-2,2-диметилпропан-1-ол (т.пл. 174-176,5°С). Анал. обчислено для С15Н21 N3О3: С, 61,84; Н, 7,27; N, 14,42. Знайдено: С, 61,67; Н, 7,22; N,14,22. 4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанол (т. пл. 168-171°С). Анал. обчислено для C16H21N3O3: С, 70,82; Н, 7,80; N, 15,48. Знайдено: С, 70,76; Н, 7,90; N, 15,20. ПРИКЛАД 13 цис-4-(6,7-Диметоксихіноксалін-2-аміно)циклогексанол Суміш циc-4-аміноциклогексанолу (400мг, 3,48ммоль) і 2-хлор-6,7-диметоксихіноксаліну (450мг, 2ммоль) у 5мл етанолу поміщають в закупорену пробірку і потім нагрівають при 180°С протягом 3 годин. Темно-коричневу суміш хроматографують на силікагелі і элююють етилацетатом з одержанням цільового продукту (т. пл. 65-67°С). Анал. обчислено для C16H21ClN3O3·0,6Н2О: С, 61,17; Н, 7,12; N, 13,37. Знайдено: С, 61,22; Н, 7,19; N, 12,19. ПРИКЛАД 14 (±)-біцикло[2.2.1]гепт-2-ил-(6,7-диметоксихіноксалін-2-іл)амін Спосіб А: Суміш 2-хлор-6,7-диметоксихіноксаліну (5г, 22,3ммоль) і (±)-екзо-норборніл-2-аміну (10г, 90ммоль) нагрівають при 160-180°С протягом ночі. Темно-коричневий залишок розчиняють у 200мл метиленхлориду і промивають 1н. NaOH (50мл). Органічний шар сушать над сульфатом магнію і потім фільтрують. Залишок після концентрування хроматографують на силікагелі, елююючи сумішшю гексан/етилацетат (80%) з одержанням цільового продукту у вигляді жовтої твердої речовини, яку можна перекристалізовувати з метанолу. Спосіб В: Суміш 2-хлор-6,7-диметоксихіноксаліну (9г, 40,1ммоль) і (±)-екзо-норборніл-2-аміну (5,77г, 52ммоль), трет-бутоксиду натрію (4,22г, 44ммоль), 2,2’-біс(дифенілфосфіно)-1,1’-бінафтилу (BINAP, 120мг) і біс(дибензиліденацетон)-паладію Pd(dba)2, (20мг) і суміш нагрівають при 100°С протягом ночі. Додають іншу порцію BINAP (60мг) і Pd(dba)2 (20мг) і суміш нагрівають при 100°С протягом ночі. Після розведення 200-ми мл метиленхлориду реакційну суміш промивають 1н. NaOH (100мл). Органічний шар сушать над сульфатом магнію і фільтрують. Залишок після концентрування хроматографують на силікагелі, елююючи сумішшю гексан/етилацетат (80%), з одержанням цільового продукту у вигляді світло-жовтої твердої речовини (т. пл. 188-189°С). Анал. обчислено для C17H21N3O3: С, 68,20; Н, 7,07; N, 14,04. Знайдено: С, 68,18; Н, 7,03; N, 14,03. Аналогічним чином одержують з відповідних вихідних матеріалів наступні сполуки (спосіб А): екзо-біцикло[2.2.1]гепт-5-eн-2-іл-(6,7- диметоксихіноксалін-2-іл)aмін (т. пл. 175-177°С). Анал. обчислено для C17H19 N3O2·0,4Н2О: С, 60,94; Н, 6,56; N, 13,78. Знайдено: С, 66,98; Н, 6,62; N, 12,73; (2ендо,5екзо)-5-(6,7-диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2-ол (т. пл. 90-93°С); (2екзо,5екзо)-5-(6,7-диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2-ол (т. пл. 97-100°С); (2ендо,3екзо,5екзо)-5-(6,7-диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2,3-діол (т. пл. 220222°С). Анал. обчислено для C17H21N3O4·0,2Н2О: С, 60,96; Н, 6,44; N, 12,54. Знайдено: С, 60,93; Н, 6,06; N, 11,60; циклогексил-(6,8-диметилхіноксалін-2-іл)амін [МС m/z: 255 (М+)]. Анал. обчислено для C16H21N3: С, 75,26; Н, 8,29; N, 16,46. Знайдено: С, 75,08; Н, 8,28; N, 15,86; цис/транс-2-(6-метоксихіноксалін-2-іламіно)циклопентанол (т. пл. 137-139°С). Анал. обчислено для C14H17N3O2: С, 64,85; Н, 6,61; N, 16,20. Знайдено: С, 64,87; Н, 6,45; N, 16,22; транс-4-(6-метоксихіноксалін-2-іламіно)циклогексанол (т. пл. 70-75°С). Анал. обчислено для C15H19N3O2·0,3Н2О: С, 64,64; Н, 7,09; N, 15,08. Знайдено: С, 64,68; Н, 7,06; N, 14,77; [3аR,4S,6R,6аS]-6-(6,7-диметоксихіноксалін-2-іламіно)-2,2-диметилтетрагідроцикло-пента[1.3]діоксол-4карбонової кислоти етиламід (т. пл. 94-97°С). Анал. обчислено для С21Н28N4О5·0,3Н2О: С, 59,79; Н, 6,83; N, 13,28. Знайдено: С, 59,80; Н, 6,89; N,12,03; (6,7-диметоксихіноксалін-2-іл)-(4-метоксициклогексил)амін, (т. пл. 58-68°С). Анал. обчислено для C17H23N3O3·0,5Н2О: С, 62,56; Н, 7,41; N, 12,87. Знайдено: С, 62,53; Н, 7,22; N, 12,22. ПРИКЛАД 15 екзо-2-(біцикло[2.2.1]гепт-2-ілокси)-6,7-диметоксихіноксалін Суміш екзо-2-норборнеолу (223мг, 2ммоль) і NaH (60%, 100мг, 2,5ммоль) у 10мл безводного ТГФ нагрівають із зворотним холодильником протягом 0,5 години, після чого додають 2-хлор-6,7диметоксихіноксалін (336мг, 1,5ммоль). Отриману суміш продовжують нагрівати зі зворотним холодильником ще дві години. Залишок після фільтрування і концентрування хроматографують на силікагелі (50% ефір/гексан) з одержанням цільового продукту у вигляді білої твердої речовини (т. пл. 135137°С). Анал. обчислено для C17H20 N2О3: С, 67,98; Н, 6,71; N, 9,33. Знайдено: С, 67,96; Н, 6,762; N,9,19. Аналогічно одержують із відповідного вихідного матеріалу такі сполуки: екзо-2-(біцикло[2.2.1]гепт-5-ен-2-ілокси)-6,7-диметоксихіноксалін (т. пл. 108-110°С). Анал. обчислено для C17H18 N2O3: С, 68,44; Н, 6,08; N, 9,39. Знайдено: С, 68,54; Н, 6,23; N, 9,27; 2-(біцикло[2.2.1]гепт-5-ен-2-ілокси)-6,7-диметоксихіноксалін (т. пл. 93-95°С). Анал. обчислено для C17H18N2O3: С, 68,44; Н, 6,08; N, 9,39. Знайдено: С, 68,32; Н, 5,98; N, 9,25; 2-(1,4-діоксаспіро[4.5]дец-8-ілокси)-6,7-диметоксихіноксалін (т. пл. 124-125°С). Анал. обчислено для C18H22N2O5: С, 62,42; Н, 6,40; N, 8,09. Знайдено: С, 62,63; Н, 6,46; N, 7,79. ПРИКЛАД 16 цис/транс-4-(6,7-диметоксихіноксалін-2-ілокси)-циклогексанкарбонова кислота Суміш цис/транс-4-гідроксициклогексанкарбонової кислоти (144мг, 1ммоль) і NaH (60%, 160мг, 4ммоль) в суміші безводний ТГФ/ДМФ (10мл/2мл) нагрівають із зворотним холодильником протягом години, після чого додають 2-хлор-6,7-диметоксихіноксалін (225мг, 1ммоль). Отриману суміш продовжують нагрівати зі зворотним холодильником ще чотири години. Реакційну суміш нейтралізують до рН 5 і екстрагують етилацетатом (2х50мл). Об'єднані органічні розчини сушать над безводним сульфатом магнію і фільтрують. Залишок після концентрування хроматографують на силікагелі (етилацетат і потім метанол) з одержанням цільового продукту у вигляді білої твердої речовини (т. пл. 90-93°С). Анал. обчислено для C17H20N2O5·0,5Н2О: С, 59,89; Н, 6,19; N, 8,22. Знайдено: С, 59,91; Н, 6,62; N, 7,90. Аналогічно одержують із відповідного вихідного матеріалу такі сполуки: 4-(6,7-диметоксихіноксалін-2ілоксиметил)циклогексанол (т. пл. 118-121 °С). Анал. обчислено для C17H22N2O4·0,3Н2О: С, 63,15; Н, 7,03; N, 8,66. Знайдено: С, 63,13; Н, 6,65; N, 9,01; 3-(6,7-диметоксихіноксалін-2-ілокси)циклогексанол (т. пл. 151-153°С). Анал. обчислено для С16H20N2O4: С, 63,14; Н, 6,62; N, 9,20. Знайдено: С, 62,56; Н, 6,58; N, 8,67; 4-(6,7-диметоксихіноксалін-2-ілокси)циклогексанол (т. пл. 162-164°С). Анал. обчислено для C16H20N2O4: С, 63,14; Н, 6,62; N, 9,20. Знайдено: С, 63,52; Н, 6,80; N, 8,88; ПРИКЛАД 17 5-(6,7-Диметоксихіноксалін-2-ілокси)біцикло[2.2.1]гептан-2,3-діол До розчину 2-(біцикло[2.2.1]гепт-5-ен-2-ілокси)-6,7-диметоксихіноксаліну (149мг, 0,5ммоль) і 4метилморфолін N-оксиду (234мг, 2ммоль) при кімнатній температурі в 5мл ТГФ додають розчин OsO4 в трет-бутанолі (2,5%мас, 0,2мл). Коричневий розчин інтенсивно перемішують дві години, після чого гасять насиченим NaHS2O3 (2мл). Розчин екстрагують ефіром (3x100мл) і сушать над сульфатом магнію. Залишок фільтрують і концентрують, після чого хроматографують на силікагелі (50% етилацетат/гексан) з одержанням цільового продукту (т. пл. 85-88°С). Анал. обчислено для C17H20N2О5·0,9Н2О: С, 58,73; Н, 6,29; N, 8,06. Знайдено: С, 58,74; Н, 5,91; N, 7,53. Аналогічним способом одержують (2екзо,3екзо,5екзо)-5-(6,7-диметоксихіноксалін-2іламіно)біцикло[2.2.1]гептан-2,3-діол (т. пл. 150-153°С). ПРИКЛАД 18 цис-4-(6,7-Диметоксихіноксалін-2-ілокси)циклогексиловий складний ефір оцтової кислоти і цис-4-(6,7-диметоксихіноксалін-2-ілокси)циклогексанол. Суміш циc-4-ацетоксициклогексанолу (632мг, 4ммоль) і NaH (60%, 220мг, 5,5ммоль) в 15мл безводного ТГФ нагрівають із зворотним холодильником протягом 0,5 години, після чого додають 2-хлор-6,7диметоксихіноксалін (674мг, 3ммоль). Отриману суміш продовжують нагрівати зі зворотним холодильником ще дві години. Залишок після фільтрування і концентрування хроматографують на силікагелі (ефір) з одержанням цис-4-(6,7-диметоксихіноксалін-2-ілокси)циклогексилового складного ефіру оцтової кислоти (т. пл. 150-152°С). Анал. обчислено для С16Н20N2O4: С, 62,42; Н, 6,40; N, 8,09. Знайдено: С, 62,39; Н, 6,55; N, 7,82 і цис-4-(6,7-диметоксихіноксалін-2-ілокси)циклогексанолу (т. пл. 148-150°С). Анал. обчислено для C16H20N2О4: С, 63,14; Н, 6,62; N, 9,20. Знайдено: С, 62,80; Н, 6,76; N, 8,67. Аналогічним чином одержують цис-4-(6,7-диметоксихіноксалін-2-ілокси)циклогексанол [МС m/z: (М+)]. ПРИКЛАД 19 4-(6,7-Диметоксихіноксалін-2-ілокси)циклогексиловий складний ефір диметилкарбамінової кислоти Суміш 4-(6,7-диметоксихіноксалін-2-ілокси)циклогексанолу (100мг, 0,33ммоль), диметилкарбамілхлориду (90мкл, 1,2ммоль) NaH (60%, 19,6мг, 0,49ммоль) в 5мл ТГФ перемішують при кімнатній температурі три дні з одержанням білої твердої речовини (т. пл. 152-155°С), виділеної шляхом хроматографії (50% етилацетат/гексан). Анал. обчислено для C19H25 N3O5: С, 60,79; Н, 6,71; N, 11,19. Знайдено: С, 60,38; Н, 6,54; N, 10,43. ПРИКЛАД 20 3-Циклогексилокси-6,7-диметоксихіноксаліну 1-оксид Суміш 2-циклогексилокси-6,7-диметоксихіноксаліну (110мг, 0,38ммоль) і метахлорбензойної перкислоти (70%, 113мг, 0,46ммоль) в 10мл метиленхлориду перемішують при кімнатній температурі протягом дня. Після фільтрування розчин концентрують і залишок хроматографують на силікагелі (20% етилацетат/гексан) з одержанням цільового продукту (т. пл. 167-169°С). Аналогічним способом одержують транс-4-(6,7-диметокси-4-оксихіноксалін-2-іламіно)циклогексанол (т. пл. 220-222°С). Анал. обчислено для С16Н21N3О4·0,2Н2О: С, 59,42; Н, 6,69; N, 12,99. Знайдено: С, 59,43; Н, 6,64; N, 12,95. ПРИКЛАД 21 транс-4-(6,7-Диметоксихіноксалін-2-іламіно)циклогексиловий складний ефір оцтової кислоти Суміш транс-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанолу (303мг, 1ммоль), оцтового ангідриду (2мл) і піридину (2мл) в 10мл дихлорметану перемішують при кімнатній температурі протягом ночі. Суміш гасять водою (5мл) і екстрагують дихлорметаном (2x30мл). Після сушіння над сульфатом магнію і фільтрування розчин концентрують на роторному випарнику. Залишок хроматографують на силікагелі (етилацетат) з одержанням цільового ацетату у вигляді світло-жовтої твердої речовини (т. пл. 176-177°С). Анал. обчислено для C18H23 N3O4: С, 62,59; Н, 6,71; N, 12,17. Знайдено: С, 62,89; Н, 6,67; N, 11,95. ПРИКЛАД 22 (2екзо, 5екзо)-5-(6,7-Диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2-ол Суміш (2екззо,5екзо)-5-амінобіцикло[2.2.1]гептан-2-ацетату (127мг, 0,75ммоль) і 2-хлор-6,7диметоксихіноксаліну (224мг, 1ммоль) нагрівають до 180°С протягом 6 годин. Потім суміш охолоджують до кімнатної температури, розчиняють у метиленхлориді й очищають на флеш-колонці. Добутий продукт (20мг, вихід 7,5%) розчиняють в метанолі (2мл) і додають свіжий розчин 1н. метоксиду натрію (0,063мл, 0,063ммоль). Реакційну суміш нагрівають із зворотним холодильником протягом 90 хвилин. Неочищену суміш очищають шляхом препаративної тонкошарової хроматографії з одержанням продукту у вигляді жовтої твердої речовини з т. пл. 97-100°С. C17H21N3O3 (m/z): 315. Аналогічним способом одержують із відповідного вихідного матеріалу такі сполуки: (2ендо,5екзо)-5-(6,7-диметоксихіноксалін-2-іламіно)біцикло[2.2.1]гептан-2-ол у вигляді жовтої твердої речовини, C17H21N3O3 m/z: 315. (2eкзo,6екзо)-5-(6,7- диметоксихіноксалін-2-іліміно)біцикло[2.2.1]гепьан-2-ол у вигляді жовтої твердої речовини (30мг, усього 21%), C17H21N3O3 m/z: 315. Анал. обчислено для C17H21N3O3: С, 64,74; Н, 6,71; N, 13,32. Знайдено: С, 58,42; Н, 6,26; N, 11,56. ПРИКЛАД 23 (2транс, 4цис)-4-(6,7-Диметоксихіноксалін-2-іламіно)-2-метилциклогексанол і (2транс,4транс)-4-(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанол Суміш 2-хлор-6,7-диметоксихіноксаліну (1,08г, 4,81ммоль) і (2транс)-4-аміно-2-метилциклогексанолу (620мг, 4,81ммоль) нагрівають до 180°С протягом 6 годин. Реакція дає два діастереомери. Основний ізомер виділяють у вигляді жовтої твердої речовини, визначеної як (2транс,4транс)-4-(6,7диметоксихіноксалін-2-іламіно)-2-метилциклогексанол (240мг, 0,76ммоль), C17H23N3O3 (m/z): 317. Анал. обчислено для С17Н23N3О3·2Н2О: С, 58,00; Н, 7,69; N, 11,94. Знайдено: С, 58,00; Н, 6,58; N, 11,24. Другорядний ізомер також являє собою жовту тверду речовину, визначену як (2транс,4цис)-4-(6,7диметоксихіноксалін-2-іламіно)-2-метилциклогексанол C17H23N3O3 (m/z): 317. Анал. обчислено для C17H23N3O3·Н2О С, 60,08; Н, 6,94; N, 12,53. Знайдено: С, 61,21; Н, 6,94; N, 11,56. (2транс,4транс)-4-(6,7-Диметоксихіноксалін-2-іламіно)-2-метилциклогексанол додатково розділяють шляхом хіральної ВЕРХ на окремі його енантіомери. Перший енантіомер має (+)-обертання (порядок елюювання за Chiracel OJ). Другий енантіомер має (-)-обертання (порядок елюювання за Chiracel OJ). В умовах аналізу з використанням колонки Chiracel OD (+)-енантіомер елююється другим, (-)-енантіомер виявляє крашу активність при аналізі PDGF-R методом ELISA. ПРИКЛАД 24 (2цис,4цис)-4-(6,7-Диметоксихіноксалін-2-іламіно)-2-метилциклогексанол і (2цис,4транс)-4(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанол До розчину суміші (2:1) (2трянс,4транс)-4-(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанолу і (2транс,4цис)-4-(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанолу (120мг, 0,38ммоль) в ТГФ (7мл) додають трифеніл фосфін (110мг, 0,42ммоль), діетилазодікарбоксилат (0,066мл, 0,42ммоль) і бензойну кислоту (46,4мг, 0,38ммоль). Суміш перемішують при кімнатній температурі протягом ночі і залишок після обробки розділяють на силікагелі (30% етилацетат/гексан) з одержанням суміші бензоатів. До розчину основного бензоату (50мг, 0,12ммоль) в метанолі (2мл) додають 1н. гідроксид натрію (0,12мл, 0,12ммоль). Чистий продукт (13мг, вихід 32%) виділяють шляхом препаративної тонкошарової хроматографії у вигляді жовтої твердої речовини (т. пл. 85-88°С), визначеної як (2цис,4цис)-4-(6,7диметоксихіноксалін-2-іламіно)-2-метилциклогексанол, C17H23N3O3 (m/z): 317. Аналогічним способом, другорядний бензоат (4,4мг) гідролізують і цільовий продукт також виділяють шляхом препаративної тонкошарової хроматографії у вигляді жовтої твердої речовини, визначеної як (2цис,4транс)-4-(6,7-диметоксихіноксалін-2-іламіно)-2-метилциклогексанол, С17Н23N3O3 (m/z): 317. ПРИКЛАД 25 (1R,2R,4S)-(+)-Біцикло[2.2.1]гепт-2-іл-(6,7-диметоксихіноксалін-2-іл)амін (+)-Біцикло[2.2.1]гепт-2-іл-(6,7-диметоксихіноксалін-2-іл)амін з прикладу 14 елююють на колонці для хіральної ВЕРХ (Chiralpac AD, 25x2см, 60% гептан/40% етанол з 10мМ (18)-(+)-камфорсульфонової кислоти, 12мл/хвилину) і одержують вказаний в заголовку продукт у вигляді першого елюату. Зібрані фракції об'єднують і промивають 50мл 1н. NaOH, після чого сушать (MgSO4). Розчин після фільтрування концентрують на роторному випарнику і потім висушують під високим вакуумом. Одержують жовту тверду речовину: [a]d20+19,5° (с=0,20, СН2СІ 2), т. пл. 184-186°С. Анал. обчислено для C17H21N3O2·0,3Н2О: С, 66,90; Н, 7,15; N, 13,77. Знайдено: С, 66,86; Н, 7,01; N, 13,86. ПРИКЛАД 26 Біотрансформативне одержання (1S,2R,4S,5R)-5-(6,7-диметоксихіноксалін-2іламіно)біцикло[2.2.1 ]гептан-2-олу Грибки лінії F 2052 (Mortierella isabellina) купують у Northern Utilization Research and Development Division (NRRL). Грибки зберігають при -25°С. В конічні колби ємністю 250мл, кожна з яких містить 50мл живильного середовища для посіву (середовище 216), засівають 2мл грибкової суспензії і інкубують її на роторному струшувачі (200об/хв) при 23°С протягом 3 днів. В конічні колби ємністю 250мл, кожна з яких містить 50мл такого ж самого середовища, засівають 2мл посівної культури і інкубують її на роторному струшувачі (200об/хв) при 23°С. Через 24 години (1R,2R,4S)-(+)-біцикло[2.2.1]гепт-2-іл-(6,7-диметоксихіноксалін-2іл)амін з прикладу 25 розчиняють в МеОН і додають в колби до кінцевої концентрації 30мг/л. Після 24 годин інкубації культури збирають. (Середовище 216: глюкоза 0,4%, дріжджовий екстракт 0,05%, соєве борошно 0,05%, NaCl 0,05%, КН2РО4 0,05.). Здійснюють екстракцію, використовуючи 2 об'єми ацетонітрилу, 1 об'єм трет-бутилметилового ефіру і 1 об'єм н-гептану, що додаються до 1 об'єму бульйону. Після перемішування магнітним розмішувачем при 22°С екстракт розділяють на 3 шари. Проміжний шар збирають і випарюють досуха і знову розчиняють в етилацетаті. Етилацетатний екстракт розділяють на силікагелі (0,04-0,063мм), використовуючи етилацетат як елюент. Фракції, що містять продукт біотрансформації, розділяють на діоксиді кремнію С18, використовуючи як елюент градієнт Н2О/МеОН. Ця хроматографія дає чисту вказану в заголовку сполуку у вигляді аморфного жовтого порошку, т. пл. 190-192°С. ПРИКЛАД 27 транс-4-[7-Метокси-6-(2-морфолін-4-ілетокси)хіноксалін-2-іламіно]циклогексанол і транс-4[6-метокси-6-(2-морфолін-4-ілетокси)хіноксалін-2-іламіно]циклогексанол Вказану в заголовку сполуку одержують шляхом здійснення реакції Міцунобу (Mitsunobu) між 6-гідрокси7-метокси-2-хлорхіноксаліном:7-(2-морфолін-4-ілетокси)-6-метокси-2-хлорхіноксаліном і 2-(морфолін-4іл)етанолом з використанням методики прикладу 1 і реакції між отриманим 6-(2-морфолін-4-ілетокси)-7 метокси-2-хлорхіноксаліном:7-(2-морфолін-4-іл-етокси)-6-метокси-2-хлорхіноксаліном і транс-4аміноциклогексанолом з використанням методики прикладу 11. ПРИКЛАД 28 2-[2-(транс-4-Гідроксициклогексиламіно)-7-метоксихіноксалін-6-ілоксил]-1-оцтова кислота і 2-[2-(транс-4-гідроксициклогексиламіно)-6-метоксихіноксалін-7-ілоксил]-1-оцтова кислота Вказану в заголовку сполуку одержують шляхом деалкілування 4-(6,7-диметоксихіноксалін-2іламіно)циклогексанолу з використанням натрієвої солі енантіолу в ДМФ так, як описано в прикладі 4, з наступним алкілуванням бромоцтовою кислотою в присутності основи, як описано в загальній операції 6. ПРИКЛАД 29 2-[2-транс-4-Гідроксициклогексиламіно)-7-метоксихіноксалін-6-ілоксил]-N,Nдиметилацетамід і 2-[2-(транс-4-гідроксициклогексиламіно)-6-метоксихіноксалін-6-ілоксил]-N,Nдиметилацетамід Вказану в заголовку сполуку одержують шляхом амінолізу сполуки прикладу 28 із використанням диметиламіну. ПРИКЛАД 1 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ 4-бром-5-метоксибензол-1,2-діаміндигідрохлорид До розчину ЕtOАс (50мл) і 5-бром-4-метокси-2-нітрофеніламіну (2,5г, 10ммоль) в аргоні додають 5% Pd/C (0,5г). Реакційну суміш гідрують при 50 фунтах на квадратний дюйм (3,5кг/см2) протягом 1 години. Суміш фільтрують через целіт у розчин HCl/EtOAc, і подушку целіту промивають додатковим EtOAc. Отриманий осад відфільтровують з одержанням білої твердої речовини. ПРИКЛАД 2 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ 7-бром-6-метоксихіноксалін-2-ол і 6-бром-7-метоксихіноксалін-2-ол До розчину МеОН (15мл) в аргоні додають подрібнені в порошок таблетки NaOH (0,86г, 21ммоль) і 4бром-5-метоксибензол-1,2-діаміндигідрохлорид (2,7г, 9,3ммоль). Суміш перемішують 10 хвилин, після чого додають порціями розчин 45% етиленгліоксалату в толуолі (2,7г, 12ммоль). Реакційну суміш нагрівають із зворотним холодильником протягом 1 години, після чого охолоджують. Додають воду і потім суспензію фільтрують. Отриману тверду речовину промивають послідовно Н2О, МеОН, ІРА і Et2O з одержанням жовтого порошку. ПРИКЛАД 3 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ 7-бром-2-хлор-6-метоксихіноксалін і 6-бром-2-хлор-7-метоксихіноксалін До суміші 7-бром-6-метоксихіноксалін-2-олу і 6-бром-7-метоксихіноксалін-2-олу (1г, 3,9ммоль) додають РОСІ 3 (5мл). Реакційну суміш нагрівають із зворотним холодильником протягом 1 години, вливають в крижану воду, фільтрують і потім промивають водою з одержанням світло-рудувато-коричневої твердої речовини. Відношення 7-бром-2-хлор-6-метоксихіноксалін:6-бром-2-хлор-7-метоксихіноксалін дорівнює приблизно 7:1 згідно з результатами аналізу методом 1Н ЯМР. ПРИКЛАД 4 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ 5-хлор-4-метокси-2-нітроанілін До розчину N-(5-хлор-4-метокси-2-нітрофеніл)ацетаміду (2г, 8,2ммоль) в 5н. НСI (20мл) додають 1,4діоксан (10мл) і суміш перемішують при 60°С протягом 1,5 години. Реакційну суміш концентрують і розподіляють між EtOAc і 2н. NaOH. Водні шари промивають EtOAc (3 рази), розсолом, сушать (MgSO4), адсорбують на силікагель і хроматографують (70% EtOAc/гексан) з одержанням жовтогарячого порошку. ПРИКЛАД 5 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ 4-хлор-5-метоксибензол-1,2-діаміндигідрохлорид До розчину EtOAc (25мл) і 5-хлор-4-метокси-2-нітрофеніламіну (1,6г, 7,9ммоль) в аргоні додають 5% Pd/C (0,5г). Реакційну суміш гідрують при 50 фунтах на квадратний дюйм (3,5кг/см2) протягом 1 години. Суміш фільтрують в азоті через целіт у розчин 1н. HCl/Et2O в EtOAc, і шар целіту промивають додатковим EtOAc. Отриманий осад відфільтровують з одержанням білої твердої речовини. ПРИКЛАД 6 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ 7-хлор-6-метоксихіноксалін-2-ол і 6-хлор-7-метоксихіноксалін-2-ол До розчину 4-хлор-5-метоксибензол-1,2-діаміндигідрохлориду (1,8г, 7,2ммоль) в ЕtOН (15мл) в аргоні додають TEA (триетаноламін) (2,5мл, 18ммоль) при 0°С. Суміш перемішують 20 хвилин, після чого додають порціями розчин 45% етиленгліоксалату в толуолі (2,1г, 9,3ммоль). Реакційну суміш підігрівають до кімнатної температури, нагрівають із зворотним холодильником протягом 1,5 години, після чого охолоджують. Додають воду і потім суспензію фільтрують і промивають послідовно Н2О, ІРА і Et2O з одержанням світло-жовтого порошку. Продукт кілька разів піддають азеотропній перегонці з толуолом і висушують у вакуумі перед застосуванням. ПРИКЛАД 7 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ 2,7-дихлор-6-метоксихіноксалін і 2,6-дихлор-7-метоксихіноксалін До суміші 7-хлор-6-метоксихіноксалін-2-олу і 6-хлор-7-метоксихіноксалін-2-олу (1г, 4,7ммоль), використовуючи сушильну трубку з хлоридом кальцію (СаСI 2), додають РОСІ 3 (5мл). Реакційну суміш нагрівають із зворотним холодильником протягом 30 хвилин, вливають у холодний насичений розчин NаНСО3, фільтрують і потім промивають водою з отриманням твердої речовини. Відношення 2,7-дихлор-6метоксихіноксалін:2,6-дихлор-7-метоксихіноксалін дорівнює приблизно 6:1 у відповідності до аналізу методом 1Н ЯМР. ПРИКЛАД 8 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ цис-Аміноциклогексанол цис-4-Аміноциклогексанол одержують описаним в літературі методом з незначними змінами [J. Med. Chem. 18(6), 634, 1975]. ПРИКЛАД 9 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ екзо-біцикло[2.2.1]гепт-5-ен-2-амін екз0-біцикло[2.2.1]гепт-5-ен-2-амін одержують так само, як в прикладі 15 одержання проміжної сполуки з 5-норборнен-2-олу через нестійку проміжну сполуку екзо-2-біцикло[2.2.1]гепт-5-ен-2-ілізоіндол-1,3-діон. ПРИКЛАД 10 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ (2екзо,6екзо)-2-(6-Гідроксибіцикло[2.2.1]гепт-2-ілізоіндол-1,3-діон і (2екзо,5екзо)-2-(5гідроксибіцикло[2.2.1 ]гепт-2-ілізоіндол-1,3-діон До суміші екзо-2-біцикло[2.2.1]гепт-5-ен-2-ілізоіндол-1,3-діону (320мг, 1,34ммоль) в 5мл ТГФ при 0°С додають розчин (1М, 2мл, 2ммоль) ВН3 в ТГФ. Суміш перемішують при кімнатній температурі протягом 2 годин і потім додають воду (2мл) і NaBO3·4H2O (900мг). Отриману суспензію перемішують протягом ночі. Потім її екстрагують ефіром (3x50мл) і сушать над сульфатом магнію. Залишок після фільтрування і концентрування хроматографують на силікагелі (ефір) з одержанням цільових продуктів, які можна потім розділити. ПРИКЛАД 11 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ (2екзо,5ендо)-2-(5-Гідроксибіцикло[2.2.1]гепт-2-іл-ізоіндол-1,3-діон (a) Суміш (2екзо,6екзо)-2-(6-Гідроксибіцикло[2.2,1]гепт-2-ілізоіндол-1,3-діону і (2екзо,5екзо)-2-(5гідроксибіцикло-[2.2.1]гепт-2-ілізоіндол-1,3-діону (800мг, 3,3ммоль) і піридинійхлорхромату (2г) в 10мл метиленхлориду перемішують при кімнатній температурі протягом 2 днів. Після розведення ефіром суспензію фільтрують і розчин концентрують. Залишок хроматографують на силікагелі (ефір) з одержанням 750мг (95%) відповідних кетонів. Кетони потім розділяють шляхом обернено-фазової ВЕРХ (CH3CN/H2O, 10-70%) з одержанням екзо-2-(5-оксибіцикло[2.2.1]гепт-2-ілізоіндол-1,3-діону. (b) До розчину екзо-2-(5-оксибіцикло[2.2.1]гепт-2-ілізоіндол-1,3-діону (250мг, 0,98ммоль) в 10мл метанолу при 0°С додають NaBH4 (38мг, 1ммоль). Суміш перемішують ще півгодини і гасять 1н. НСІ (1мл). Після концентрування залишок екстрагують метиленхлоридом (2x50мл). Випарювання метиленхлориду дає цільовий продукт, використовуваний безпосередньо без додаткового очищення. ПРИКЛАД 12 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ (2ендо,5екзо)-5-Амінобіцикло[2.2.1]гептан-2-ол, (2екзо,5екзо)-5-Амінобіцикло[2.2.1]гептан-2-ол, (2ендо,6екзо)-6-Амінобіцикло[2.2.1]гептан-2-ол, (2екзо,6екзо)-6-Амінобіцикло[2.2.1]-2-ол Вказані в заголовку сполуки одержують з відповідного вихідного матеріалу шляхом застосування описаної вище методики прикладу 11 одержання проміжної сполуки. ПРИКЛАД 13 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ 2-метил-6,7-диметоксихіноксалін Вказану в заголовку сполуку одержують, адаптувавши опублікований метод Tamao, et al., Tetrahedron, 1982, 38, 3347-3354. До ТГФ розчину в аргоні додають 2-хлор-6,7-диметоксихіноксалін (5г, 26ммоль) і NiCl2 (dppp) (0,14г, 0,26ммоль). Реакційну суміш охолоджують до 0°С і додають до неї порціями 3М розчин MeMgBr в Et2O (13мл, 39ммоль). Дають реакційній суміші прогрітися до кімнатної температури, перемішують протягом години і потім нагрівають із зворотним холодильником протягом 1,5 години. Суміш охолоджують, гасять 10% НСІ, перемішують 10 хвилин і потім підлуговують за допомогою 5% NaOH. Додають СН2СІ 2 і Н2О й отриману суміш перемішують протягом ночі. Потім ще додають СН2СІ 2, Н2О і НСІ і суміш фільтрують. Отриманий розчин виливають у ділильну лійку і водні шари промивають 3 рази СН2СІ 2. Органічні шари об'єднують, промивають розсолом, сушать (MgSO4), концентрують на силікагель і хроматографують (50%-80% EtOAc/гексани) з одержанням оранжевої твердої речовини (вихід 49%). ПРИКЛАД 14 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ 6,7-диметокси-2-хіноксалінкарбоксальдегід В реакційну колбу в аргоні вводять 1,4-діоксан (20мл), 2-метил-6,7-диметоксихіноксалін (1,09г, 5,3ммоль) і SeO2 (1,8г, 16ммоль). Суміш нагрівають до 100°С протягом 2 годин 45 хвилин, охолоджують і фільтрують через целіт. Подушку целіту промивають порціями EtOAc і СН2СІ 2. Отриманий розчин концентрують, розчиняють в суміші МеОН/СН2СІ 2, завантажують на колонку із силікагелем і хроматографують (30% ЕtOАс/СН2СІ 2) з одержанням не зовсім білої твердої речовини (вихід 73%). ПРИКЛАД 15 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ (2екзо,5екзо)-5-амінобщикло[2.2.1]гептан-2-ацетат З біцикло[2.2.1]гептан-2,5-дієну одержують екзо-5-ацетоксибіцикло[2.2.1]-гептан-2-он і екзо-6ацетоксибіцикло[2.2.1]гептан-2-он у відповідності до методики R. Gagnon (J. Chem. Soc. Perkin trans. 1, 1505 1995), з незначними змінами. До розчину екзо-5-ацетоксибіцикло[2.2.1]гептан-2-ону (350мг, 2,08ммоль) в 10мл ТГФ при кімнатній температурі додають 1М розчин (1,2мл, 1,2ммоль) борану в ТГФ. Суміш перемішують 0,5 години, після чого гасять при 0°С метанолом (3мл) і 1н НСІ (1,5мл). Суміш екстрагують етилацетатом (3х30мл) і сушать над сульфатом магнію. Потім суміш фільтрують і концентрують і залишок хроматографують на силікагелі з одержанням (2ендо,5екзо)-5-ацетоксибіцикло-[2.2.1]гептан-2-олу. До розчину (2ендо,5екзо)-5-ацетоксибіцикло[2.2.1]гептан-2-олу (350мг, 2,06ммоль) в ТГФ (10мл) додають фталімід (454мг, 3,09ммоль), трифенілфосфін (810мг, 3,09ммоль) і діетилазодикарбоксилат (0,49мл, 3,09ммоль) при 0°С. Реакційну суміш залишають на ніч перемішуватися і потім конденсують на роторному випарнику і залишок очищають шляхом колонкової хроматографії (20% етилацетат/гексан) з одержанням цільового продукту у вигляді жовтої твердої речовини. Суміш вказаної вище твердої речовини (300мг, 1ммоль) і гідразину (0,126мл, 2,2ммоль) в 5мл метанолу нагрівають із зворотним холодильником протягом 6 годин. Після видалення метанолу залишок екстрагують дихлорметаном (3х30мл). Концентрування розчинника дає (екзо,екзо)-5-амінобіцикло[2.2.1]-гептан-2-ацетат (127мг, 75%), що використовують у реакції сполучення без додаткового очищення. Аналогічним способом одержують (2ендо,5екзо)-5-амінобіцикло[2.2.1]гептан-ацетат, (2ендо,6екзо)-6амінобіцикло-[2.2.1]-гептан-2-ацетат і (2екзо,6екзо)-6-амінобіцикло[2.2.1]гептан-2-ацетат із відповідного вихідного матеріалу. ПРИКЛАД 16 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ (2транс)-4-Аміно-2-метилциклогексанол Суміш 3-метил-2-циклогексенону (4г, 36,36ммоль), толуолсульфонової кислоти (100мг) і етиленгліколю (7мл) в 100мл толуолу нагрівають зі зворотним холодильником протягом ночі, причому воду, що утворилася, видаляють за допомогою пастки Діна-Старка. Залишок після концентрування хроматографують на силікагелі (10% етилацетат/гексан) з одержанням 3,36г (62%) 7-метил-1,4-діоксаспіро[4.5]дец-7-ену. До перемішуваного 7-метил-1,4-діоксаспіро[4.5]дец-7-ену (3,36г, 22,47ммоль) у тетрагідрофурані (ТГФ) (125мл) додають 1М розчин борану в ТГФ (22,47мл, 22,47ммоль) при кімнатній температурі. Суміш перемішують протягом години і реакцію гасять додаванням Н2О (10мл) при 0°С, після чого додають тетрагідрат перборату натрію (10,0г, 66ммоль). Суміш залишають перемішуватися всю ніч. Два шари розділяють і водний шар промивають декілька разів етилацетатом (4x150мл). Після колонкової флешхроматографії одержують цільовий спирт у вигляді прозорої рідини. Вищезгаданий спирт (1,8г, 10,5ммоль) розчиняють в метанолі (50мл) і 1н. НСІ (16мл). Реакційну суміш залишають на ніч для перемішування. Кислий розчин нейтралізують 1н. гідроксидом натрію (18мл) з наступною звичайною водною обробкою. Неочищену суміш очищають на флеш-колонці (50% етилацетат) з одержанням транс-4-гідрокси-3-метилциклогексанону. До розчину транс-4-гідрокси-3-метилциклогексанону (730мг, 6,1ммоль) у воді (3мл) додають гідроксиламінгідрохлорид (550мг, 7,92ммоль) з наступним повільним додаванням насиченого розчину карбонату натрію (326мг, 3,8ммоль) у воді (1,02мл). Після перемішування протягом 30 хвилин, до реакційної суміші додають ефір і розділяють два шари. Органічний шар конденсують і розчиняють в етанолі (10мл). До киплячого етанолового розчину додають натрій (1,8г, 78,3ммоль) протягом години й отриману суміш нагрівають ще 2,5 години. Після видалення етанолу додають н-пропанол (10мл), ефір (25мл) і воду (3мл). Органічний розчин сушать над сульфатом магнію і фільтрують. Концентрування розчинника дає суміш (2транс)-4-аміно-2-метилциклогексанолу у вигляді білої твердої речовини. ПРИКЛАД 17 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ 2-метокси-4,5-діамінофенолдигідрохлорид Вказану в заголовку сполуку одержують шляхом гідрування 2-метокси-4,5-динітрофенолу у відповідності до методу Enrlich et al., J. Org. Chem., 1947, 12, 522. ПРИКЛАД 18 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ 7-гідрокси-6-метоксихіноксалін-2-ол і 6-гідрокси-7-метоксихіноксалін-2-ол Вказані в заголовку сполуки одержують з 4-метокси-5-гідроксибензол-1,2-діаміндигідрохлориду шляхом взаємодії з NaOH і етилгліоксалатом за методикою прикладу 2 одержання проміжної сполуки. ПРИКЛАД 19 ОДЕРЖАННЯ ПРОМІЖНОЇ СПОЛУКИ 7-гідрокси-6-метокси-2-хлорхіноксалін і 6-гідрокси-7-метокси-2-хлорхіноксалін Вказані в заголовку сполуки одержують з 7-гідрокси-6-метоксихіноксалін-2-олу і 6-гідрокси-7метоксихіноксалін-2-олу шляхом взаємодії з РОСІ 3 за методикою прикладу 3 одержання проміжної сполуки. Сполуки формули І, як описано вище, інгібують проліферацію клітин і/або продукцію клітинного матриксу, і/або пересування клітин (хемотаксис) через інгібування активності тирозинкінази PDGF-R. Некероване розмноження клітин, надвиробництво матриксу або погано регульована запрограмована загибель клітин (апоптоз) викликають багато хворобливих станів. Ці хворобливі стани уражають найрізноманітніші типи клітин і до них відносять такі захворювання, як лейкоз, рак, гліобластома, псоріаз, запальні хвороби, фібрози, атеросклероз і рестеноз, що трапляється після ангіопластики коронарних, стегнових або ниркових артерій, або фібропроліферативне захворювання таке, як артрит, фіброз легенів, нирок і печінки. Зокрема, як було повідомлено, PDGF і PDGF-R беруть участь у виникненні деяких типів раків і пухлин таких, як рак головного мозку, рак яєчників, рак товстої кишки, рак передміхурової залози, рак легенів, саркома Капоши і злоякісна меланома. Крім того, після коронарного шунтування створюються умови клітинної проліферації з порушеною регуляцією. Здається, що інгібування активності тирозинкінази було б корисним у регуляції некерованого розмноження клітин, надвиробництва матриксу або погано регульованої запрограмованої загибелі клітин (апоптозу). Цей винахід стосується модулювання і/або інгібування передачі сигналів у клітинах, проліферації клітин, продукції клітинного матриксу, пересування клітин (хемотаксису), регуляції анормального росту клітин і запальної реакції клітин. Конкретніше, цей винахід стосується застосування заміщених хінолінів і хіноксалінів, що мають здатність вибірково інгібувати диференціювання, проліферацію, продукцію матриксу, хемотаксис або вивільнення посередника шляхом ефективного інгібування активності тирозинкінази рецептора тромбоцитарного фактора росту (PDGF-R). Ініціювання аутофосфорилування, тобто фосфорилування самого рецептора фактора росту, і ініціювання фосфорилувания хазяїна внутрішньоклітинних субстратів є деякими з біологічних подій, що втягуються в передачу сигналів у клітинах, проліферацію клітин, продукцію матриксу, хемотаксис і вивільнення посередника. Завдяки ефективному інгібуванню активності тирозинкінази Lck сполуки за цим винаходом також корисні при лікуванні опору трансплантації й аутоімунних захворювань таких, як ревматоїдний артрит, розсіяний склероз і системний червоний вовчак, при відторгненні трансплантату, при хворобі "трансплантат проти хазяїна", при гіперпроліферативних порушеннях таких, як пухлини і псоріаз, і при захворюваннях, в яких клітини приймають сигнали про необхідність запалення таких, як астма, запальна хвороба кишечнику і панкреатит. Для лікування опору трансплантації сполуки за цим винаходом можуть бути використані або профілактично, або у відповідь на несприятливу реакцію людини на пересаджений орган або пересаджену тканину. При профілактичному застосуванні сполуку за цим винаходом вводять пацієнту або в тканину, що пересаджується, або в орган, що пересаджується, у ході операції трансплантації. Профілактичне лікування може також використовувати введення лікарського засобу після операції трансплантації, але до виявлення будь-яких ознак несприятливої реакції на трансплантацію. При введенні у відповідь на несприятливу реакцію сполуку за цим винаходом вводять безпосередньо пацієнту, щоб протистояти опору трансплантації після виявлення зовнішніх ознак опору. Відповідно до іншої ознаки цього винаходу пропонується спосіб лікування пацієнта, який має (або схильний до них) стани, що можуть бути ослаблені або відвернені шляхом введення інгібітора активності тирозинкінази рецептора PDGF-R і/або активності тирозинкінази Lck (наприклад, такі стани, як описані вище), що передбачає введення пацієнту ефективної кількості сполуки формули І або композиції, що містить сполуку формули І, або його фармацевтично прийнятної солі. Лікування, що згадується в даному описі, слід розуміти як таке, що охоплює як профілактичну терапію, так і лікування станів, що розвинулися. Цей винахід охоплює фармацевтичні композиції, що містять фармацевтично прийнятну кількість, принаймні, однієї із сполук формули І разом із фармацевтично прийнятним носієм, наприклад, допоміжною речовиною, розріджувачем, покривною речовиною і наповнювачем. На практиці сполуки або композиції для лікування у відповідності до цього винаходу можуть бути введені будь-яким із багатьох відповідних способів, наприклад, шляхом інгаляції, місцево, парентерально, ректально або перорально; більш переважним є пероральний спосіб введення. До конкретніших способів введення слід віднести внутрішньовенний, внутрішньом'язовий, підшкірний, внутрішньоочний, внутрішньосуглобовий, в товсту кишку, перитонеальний, трансепітеліальний, включно черезшкірний, офтальмічний, під'язичний, трансбукальний, інгаляційний у ніс шляхом інсуфляції й аерозольний. Сполуки формули І можуть бути подані у формах, що дозволяють введення найвідповіднішим способом, і винахід стосується також фармацевтичних композицій, що містять, принаймні, одну сполуку за цим винаходом, які придатні для застосування як лікарські засоби для пацієнта. Ці композиції можуть бути виготовлені звичайними методами з використанням однієї або кількох фармацевтично прийнятних допоміжних речовин або наповнювачів. До допоміжних речовин відносять, крім всього іншого, розріджувачі, стерильні водні середовища і різні нетоксичні органічні розчинники. Композиції можуть бути у формі таблеток, пігулок, гранул, порошків, водних розчинів або суспензій, розчинів для ін'єкції, елексирів або сиропів, і можуть містити одну або кілька речовин, вибраних з групи, що містить підсолоджувачі такі, як сахароза, лактоза, фруктоза, сахарин або Нутрасвіт (NutrasweetÒ), коригенти такі, як м'ятна олія, вінтергренова олія або вишневі чи апельсинові коригенти, барвники та стабілізатори такі, як метил- або пропілпарабен, для одержання фармацевтично прийнятних препаратів. Вибір носія й вміст активної речовини в носієві звичайно визначають у відповідності до розчинності і хімічних властивостей продукту, конкретним способом введення і заходами безпеки, прийнятими у фармацевтичній практиці. Наприклад, для виготовлення таблеток, пастилок, пігулок, капсул і тому подібного можуть бути використані наповнювачі, такі, як лактоза, цитрат натрію, карбонат кальцію, фосфат дикальцію, і речовини-розпушувачі такі, як крохмаль, альгінові кислоти і деякі комплексні силікагелі, поєднані зі змащувальними речовинами такими, як стеарат магнію, лаурилсульфат натрію і тальк. Для виготовлення капсул вигідно використовувати лактозу і рідкий носій такий, як високомолекулярні поліетиленгліколі. Різні інші матеріали можуть бути присутніми як покриття або для будь-якої зміни фізичної форми дозованої лікарської форми. Наприклад, таблетки, пілюлі або капсули можуть бути покриті шелаком, цукром або тим і іншим. При використанні водних суспензій вони можуть містити емульгуючі речовини або речовини, що сприяють утворенню суспензії. Можуть бути також використані розріджувачі такі, як сахароза, етанол, поліоли такі, як поліетиленгліколь, пропіленгліколь і гліцерин, і хлороформ або їх суміші. Крім того, активна сполука може входити в склад препаратів і лікарських засобів продовженої дії. При пероральному введенні активна сполука може бути введена, наприклад, з інертним розріджувачем або з засвоюваним їстівним носієм, може бути вміщена в тверді або м'які желатинові капсули, може бути спресована в таблетки або може бути введена безпосередньо з їжею або об'єднана з наповнювачем і використана у формі проковтуваних таблеток, таблеток для повільного розчинення в щічній кишені, пастилок, капсул, еліксирів, суспензій, сиропів, облаток і тому подібного. Для парентерального введення використовують емульсії, суспензії або розчини сполук за цим винаходом в рослинній олії, наприклад сезамовій, арахісовій або маслиновій олії, або водно-органічні розчини такі, як вода і пропіленгліколь, органічні складні ефіри, що вводяться шляхом ін'єкцій такі, як етил олеат, а також стерильні водні розчини фармацевтично прийнятних солей. Ін'єкційні форми повинні бути настільки рідкими, щоб їх можна було легко вводити за допомогою шприца, причому належна плинність може бути забезпечена, наприклад, шляхом застосування оболонки такої, як лецитин, шляхом забезпечення необхідного розміру часток у випадку дисперсії і шляхом застосування поверхнево-активних речовин. Пролонговане всмоктування ін'єкційних композицій може бути забезпечене шляхом застосування засобів, що затримують всмоктування, наприклад моностеарату алюмінію і желатину. Розчини солей продуктів за цим винаходом особливо підходять для введення шляхом внутрішньом'язової або підшкірної ін'єкції. Розчини активної сполуки у вигляді вільної основи або фармакологічно прийнятної солі можуть бути приготовлені у воді, відповідним способом змішаній з поверхнево-активною речовиною такою, як гідроксипропілцелюлоза. Може бути також приготовлена дисперсія в гліцерині, рідких поліетиленгліколях і їх сумішах та в оліях. Водні розчини, що містять також розчини солей в чистій дистильованій воді, можуть бути використані для внутрішньовенного введення за умови, що їх рН належним способом відрегульований, що їм надано належних буферних властивостей і вони зроблені ізотонічними за допомогою достатньої кількості глюкози або хлориду натрію, і що вони стерилізовані шляхом нагрівання, опромінення, мікрофільтрування і/або за допомогою різних антибактеріальних і протигрибкових засобів, наприклад парабенів, хлор-бутанолу, фенолу, сорбінової кислоти, тимеросалу і тому подібного. Стерильні ін'єкційні розчини готують шляхом введення активної сполуки в необхідній кількості у відповідний розчинник з різними іншими компонентами, наведеними вище, якщо вони вимагаються, з наступною стерилізацією фільтруванням. Звичайно дисперсії готують шляхом введення різних стерилізованих активних компонентів в стерильний носій, що містить основне середовище дисперсії й інші необхідні компоненти з тих, що вказані вище. У випадку стерильних порошків для виготовлення стерильних ін'єкційних розчинів кращими методами виготовлення є вакуумне сушіння і ліофільне сушіння, що дають порошок активного компонента плюс будь-який інший необхідний компонент із попередньо профільтрованого для стерилізації розчину. Для місцевого введення можуть бути використані гелі (на основі води або спирту), креми або мазі, що містять сполуки за цим винаходом. Сполуки за цим винаходом можуть бути також введені в гелеву або матричну основу для нанесення на пластир, що могло б забезпечити можливість регульованого вивільнення сполуки через черезшкірний бар'єр. Для введення шляхом інгаляції сполуки за цим винаходом можуть бути розчинені або суспендовані у відповідному носієві для застосування в розпилювачеві або для суспензій чи розчинів в аерозольній формі, або можуть бути абсорбовані або адсорбовані на відповідному твердому носієві для застосування в інгаляторі сухого порошку. Для твердих композицій для ректального введення передбачаються супозиторії, виготовлені у відповідності до відомих методів і такі, що містять принаймні одну сполуку формули І. Композиції за цим винаходом можуть бути також складені з забезпеченням опору швидкому видаленню зі стінки судини (артерії або вени) шляхом конвекції і/або дифузії, завдяки чому збільшується тривалість перебування вірусних часток у необхідному місці дії. Для продовженого вивільнення може бути використане периадвентиціальне депо, що містить сполуку за цим винаходом. Одним таким депо, придатним для введення сполуки за цим винаходом, може бути співполімерна матриця така, як етиленвінілацетат, або гель полівінілового спирту, в оболонці з Силастику (Silastic). У відповідності до іншого варіанту сполука за цим винаходом може бути доставлена локально з силіконового полімеру, імплантованого в адвентиціальну оболонку. Альтернативний спосіб мінімізації вимивання сполуки за цим винаходом під час черезшкірної трансваскулярної доставки передбачає застосування недифундованих мікрочастинок з вимиванням лікарського засобу. Частки можуть складатись з найрізноманітніших синтетичних полімерів таких, як, наприклад, полілактид, або природних речовин, до складу яких входять білки і полісахариди. Такі мікрочастинки забезпечують можливість оперативного маніпулювання змінними, серед яких - сумарна доза лікарського засобу і кінетика її вивільнення. Мікрочастинки можна ефективно вводити в артеріальну або венозну стінку через пористий балонний катетер або балон на стенті (розширювачі) і утримувати в стінці судини і періадвентиціальній тканині протягом принаймні приблизно двох тижнів. Склад і методики локальної доставки лікарських засобів в конкретне місце всередині судини описані у Reissen et al. (J. Am. Coil. Cardlol. 1994; 23; 1234-1244); зміст цього матеріалу цілком вміщено в даний опис шляхом посилання. Композиція за цим винаходом може також містити гідрогель, приготовлений з будь-якого біосумісного або нецитотоксичного (гомо або гетеро) полімеру такого, як гідрофільний полімер поліакрилової кислоти, який може діяти як губка, що всмоктує лікарський засіб. Такі полімери вже описані, наприклад, в заявці W093/08845, весь зміст якої міститься в даному описі шляхом посилання. Деякі з них, такі, зокрема, як ті, що одержані з етилену і/або пропіленоксиду, комерційно доступні. При застосуванні сполук за цим винаходом для лікування патологій, пов'язаних з гіперпроліферативними порушеннями, ці сполуки можуть бути введені різними шляхами. Для лікування рестенозу сполуки за цим винаходом вводять безпосередньо в стінку кровоносної судини за допомогою балона для ангіопластики, покритого гідрофільною плівкою (наприклад, гідрогелем), яку насичують сполукою, або за допомогою будь-якого іншого катетера, що містить інфузійну камеру для сполуки, яка, таким чином, може бути точно доведена до місця, що підлягає лікуванню, і дає можливість ефективно вивільнити сполуку саме в тому місці клітин, де необхідно лікування. Цей спосіб введення забезпечує можливість швидкого введення сполуки в контакт із клітинами, що потребують лікування. Спосіб лікування за цим винаходом переважно полягає у введенні сполуки за цим винаходом в місці, що підлягає лікуванню. Наприклад, композиція, що містить гідрогель, може бути накладена безпосередньо на поверхню тканини, що підлягає лікуванню, наприклад, при хірургічному втручанні. Зручно вводити гідрогель в потрібне місце всередині судини шляхом покриття ним катетера, наприклад, балонного катетера, і доставки до стінки судини, переважно під час ангіопластики. Є особливо доцільним вводити насичений гідрогель у місці, що підлягає лікуванню, за допомогою балонного катетера. При просуванні катетера в напрямку до наміченої судини балон може бути оснащений захисною оболонкою для мінімізації змивання лікарського засобу після введення катетера в потік крові. Інший варіант здійснення цього винаходу дає сполуку для введення за допомогою перфузійних балонів. Ці перфузійні балони, що забезпечують можливість підтримувати кровотік і тим самим зменшувати небезпеку ішемії міокарда при роздуванні балона, забезпечують також можливість доставки сполуки в потрібне місце при нормальному тиску протягом відносного тривалого часу (більше двадцяти хвилин), що може бути необхідним для його оптимальної дії. Альтернативно можна використовувати каналізований балонний катетер ("каналізований балонний катетер для ангіопластики", Mansfield Medical, Boston Scientific Corp., Watertown, MA). Останній складається з традиційного балона, вкритого шаром з 24 перфорованих каналів, що заливаються, завдяки незалежному просвіту, через додатковий інфузійний отвір. Різні типи балонних катетерів такі, як здвоєний балон, пористий балон, мікропористий балон, балон з каналами, балон на стенті і гідрогелевий катетер, які усі можуть бути використані для практичної реалізації винаходу, описані у Reissen et al. (1994); весь зміст цього матеріалу внесено в даний опис шляхом посилання. Особливо вигідним є застосування перфузійного балонного катетера, оскільки він забезпечує можливість тримати балон роздутим протягом тривалого періоду часу зі збереженням властивостей полегшеного ковзання і конкретної локалізації гідрогелю одночасно. Інший аспект цього винаходу стосується фармацевтичної композиції, що містить сполуку за цим винаходом і полоксамер, такий, як Полоксамер (Poloxamer) 407 - нетоксичний біосумісний поліол, комерційно доступний (BASF, Parsippany, NJ). Полоксамер, просякнутий сполукою за цим винаходом, може бути накладений безпосередньо на поверхню тканини, що підлягає лікуванню, наприклад, під час хірургічного втручання. Полоксамер дає, власне кажучи, такі ж переваги, як гідрогель, хоча має нижчу в'язкість. Застосування оснащеного каналами балонного катетера з полоксамером, просякнутим сполукою за цим винаходом, є особливо вигідним. У цьому випадку одночасно забезпечуються можливість тримати балон роздутим протягом тривалого періоду часу зі збереженням властивостей полегшеного ковзання і конкретної локалізації полоксамеру. Відсотковий вміст активного компонента в композиціях можна змінювати, причому необхідно, щоб він складав частку, що забезпечує потрібне дозування. Очевидно, що можна вводити кілька лікарських форм приблизно в той самий час. Використовувана доза може бути визначена лікарем або кваліфікованим медичним персоналом і залежить від необхідного терапевтичного ефекту, способу введення, тривалості лікування і стану пацієнта. Для дорослих дози становлять звичайно від приблизно 0,001 до приблизно 50, переважно від приблизно 0,001 до приблизно 5, мг/кг маси тіла на добу при інгаляції, від приблизно 0,01 до приблизно 100, переважно 0,1-70, більш переважно 0,5-10, мг/кг маси тіла на добу при пероральному введенні і від приблизно 0,001 до 10, переважно 0,01-10, мг/кг маси тіла на добу при внутрішньовенному введенні. У кожному конкретному випадку дози визначають у відповідності до характерних особливостей пацієнта, що підлягає лікуванню таких, як вік, маса, загальний стан здоров'я й інші характеристики, що можуть впливати на ефективність сполуки за цим винаходом. Сполуки і композиції за цим винаходом можна вводити настільки часто, наскільки потрібно для досягнення необхідного терапевтичного ефекту. Деякі пацієнти можуть реагувати на вищу або нижчу дозу, причому для них можуть виявитись достатніми набагато слабші підтримуючі дози. Для інших пацієнтів може виявитись необхідним тривале лікування при нормі 1-4 дози на добу, у відповідності до фізіологічних потреб кожного конкретного пацієнта. Як правило, активний продукт можна вводити перорально 1-4 рази на добу. Але, звичайно, для інших пацієнтів може бути необхідним призначати не більше однієї або двох доз на добу. Сполуки за цим винаходом можуть бути також використані в поєднанні з іншими терапевтичними засобами або в поєднанні з застосуванням терапевтичних методів до адресних фармакологічних станів, що можуть бути полегшені шляхом застосування сполук формули І такими, як наступні. Сполуки за цим винаходом можуть бути використані для лікування рестенозу після ангіопластики з використанням будь-якого пристрою такого, як балон, вирізання або лазерних процедур. Сполуки за цим винаходом можуть бути використані для лікування рестенозу після установлення стешу в кровоносній системі або 1) для первинного лікування закупорення судин, або 2) у випадку, коли ангіопластика з використанням будь-якого пристосування не здатна дати прохідну артерію. Сполуки за цим винаходом можуть бути використані перорально, парентерально, шляхом місцевого застосування при введенні спеціального пристосування або у вигляді належним чином складеного покриття на розширювачі (стенті). Сполуки за цим винаходом можуть бути використані для лікування рестенозу в поєднанні з будь-яким протизгортальним, антитромбоцитарним, антитромботичним або профібринолітичним засобом. Часто пацієнтів лікують до, під час і після хірургічного втручання засобами вказаних класів, щоб безпечно виконати хірургічну операцію або запобігти несприятливим ефектам тромбоутворення. У склад деяких прикладів класів засобів, відомих як протизгортальні, антитромбоцитарні, антитромботичні або профібринолітичні засобів, входять будь-які склади гепарину, низькомолекулярні гепарини, пентасахариди, антагоністи фібриногенових рецепторів, інгібітори тромбіну, інгібітори фактора Ха або інгібітори фактора VIla. Сполуки за цим винаходом можуть бути використані в поєднанні з будь-яким гіпотензивним засобом або засобом регулювання холестерину або ліпідів при лікуванні рестенозу або атеросклерозу паралельно з лікуванням високого кров'яного тиску або атеросклерозу. До складу деяких прикладів засобів, придатних для лікування високого кров'яного тиску, входять сполуки таких класів: бета-блокатори, інгібітори АСЕ (ангіотензин-перетворюючого фермента, АПФ), антагоністи кальцієвих каналів і антагоністи альфарецепторів. До складу деяких прикладів засобів, придатних для лікування підвищених рівнів холестерину або розрегульованих рівнів ліпідів, входять сполуки, відомі як інгібітори редуктази HMGCoA, сполуки класу фібратів. Сполуки за цим винаходом можуть бути використані для лікування різних форм раку окремо або в поєднанні з відомими сполуками для лікування раку. Зрозуміло, що цей винахід охоплює комбінації сполук за цим винаходом з одним або кількома зі згаданих вище лікарських засобів. Сполуки в об'ємі цього винаходу виявляють помітні фармакологічні активності при описаних у літературі випробуваннях, результати яких, можна вважати, приведені у відповідність до фармакологічної активності людей і інших ссавців. Наступні результати фармакологічних випробувань in vitro і in vivo є типовими для характеризації сполук за цим винаходом. Розділ одержання фармацевтичних композицій і фармакологічних випробувань Сполуки за цим винаходом виявляють значну активність як інгібітори білкових тирозинкіназ і мають терапевтичну цінність як клітинні антипроліферативні засоби для лікування деяких станів, до яких віднесено псоріаз, атеросклероз і рестеноз. Сполуки за цим винаходом забезпечують модулювання і/або інгібування передачі сигналів у клітинах, проліферації клітин, продукції матриксу, хемотаксису і/або запальної реакції клітин і можуть бути використані для запобігання або затримки прояву або повторного прояву таких станів або ж лікування стану. Для визначення ефективності сполук за цим винаходом використовують описані нижче фармакологічні випробування, що прийняті в даній області медицини і, як відомо, відповідають фармакологічній активності у ссавців. Сполуки за цим винаходом були піддані різним цим випробуванням і, здається, відповідають корисній активності посередника диференціювання клітин. Результати цих випробувань, треба вважати, дають достатню інформацію фахівцям в області фармакології і медичної хімії, щоб визначити параметри застосування досліджуваних сполук в одному або кількох терапевтичних заходах, наведених в даному описі. 1. Аналіз аутофосфорилування тирзинкінази PDGF-R методом ELISA Вказаний у заголовку аналіз виконують так, як описано у Dolle et al. (J. Med. Chem. 1994, 37, 2627) (матеріал внесено в даний опис шляхом посилання), за винятком використання клітинного лізату, отриманого з клітин аортальних гладких м'язів людини (HAMSC), як описано нижче. 2. Загальна процедура аналізу мітагенезу а. Культура клітин Клітини аортальних гладких м'язів людини (пасаж 4-9) вміщують на 96-ти ямкові планшети в живильне середовище по 6000 клітин на ямку і дозволяють їм зростати 2-3 дні. При приблизно 80%-ому злитті ріст клітин зупиняють безсироватковим живильним середовищем (SFM). b. Аналіз мітогенезу Через 24 години сироваткової недостатності середовище видаляють і замінюють сполукою, що випробовується, і носієм в SFM (200мкл на ямку). Сполуки розчиняють у клітинній культурі DMSO (ДМСО) при концентрації 10мМ і роблять додаткові разведения в SFM. Через 30 хвилин попередньої інкубації з сполукою клітини стимулюють за допомогою PDGP при 10нг/мл. Визначення здійснюють дубльовано зі стимульованими і нестимульованими ямками при кожній концентрації сполуки. Через чотири години додають 1мкКі 3Н тимідин/ямку. Культивування закінчують через 24 години після додавання фактора росту. Клітини піднімають трипсином і збирають на фільтрувальну плівку (мат), користуючись автоматизованим збирачем клітин (Wallac MachII96). Фільтрувальну плівку обраховували в сцинтиляційному лічильнику (Wallac Betaplate) для визначення мітки, введеної в ДНК. 3. Аналіз хемотаксису З АТСС одержують клітини аортальних гладких м'язів людини (HASMC) при ранніх пасажах. Клітини культивують в Clonetics SmGM 2 SingleQuots (використовують середовище і клітини при пасажах 4-10). При 80%-ному злитті клітин у середовище додають флуоресцентний зонд, кальцеїн AM (5мМ, Molecular Probe), і клітини інкубують 30 хвилин. Після промивання сольовим розчином з буфером HEPES клітини піднімають трипсином і нейтралізують буфером MCDB 131 (Gibco) з 0,1% BSA (бичачий сироватковий альбумін), 10мМ глутаміном і 10% сироваткою плідного теляти. Після центрифугування клітини промивають ще раз і ресуспендують у тому ж самому буфері без сироватки плідного теляти при 30000 клітин на 50мл. Клітини інкубують при різних концентраціях сполуки формули І (кінцева концентрація в ДМСО = 1%) протягом 30 хвилин при 37°С. Для дослідження хемотаксису використовують модифіковані камери Бойдена з 96 комірками (Neuroprobe, Inc.) і полікарбонату мембрану з розміром пор 8мм (Poretics, CA). Мембрану покривають колагеном (Sigma C3657, 0,1мг/мл). У нижню камеру вміщують PDGF-bb (3нг/мл) в буфері зі сполукою формули І і без неї. В верхню камеру вміщують клітини (30000) з інгібітором і без нього. Клітини інкубують 4 години. Фільтрувальну мембрану знімають і видаляють клітини, що знаходяться на верхньому боці мембрани. Після висушування визначають флуоресценцію на мембрані, використовуючи Cytofluor II (Millipore) при довжині хвилі збудження й емісії 485 і 530нм. У кожному експерименті середню міграцію клітин одержують за шістьма повтореннями. Відсоток інгібування визначають за контрольними значеннями з обробкою ДМСО. На підставі п'яти оцінок обчислюють залежне від концентрації інгібування, значення ІС50. Результати подають як середнє значення ±SEM (середня квадратична похибка вимірювання) від п'яти таких експериментів. 4. Очищення EGF-рецептора Очищення EGF-рецептора грунтується на процедурі Ярдена і Шлессінгера (Yarden and Schlessinger). Клітини А431 культивують в склянках площею 80см2 до злиття (2х107 клітин на склянку). Клітини промивають два рази PBS (фосфатно-сольовим буферним розчином) і збирають за допомогою PBS, що містить 11,0ммоль EDTA (1 година при 37°С), і центрифугують при 600g протягом 10 хвилин. Клітини солюбілізують в 1мл на 2х107 клітин холодного солюбілізаційного буфера (50ммоль буфера Hepes, рН 7,6, 1% Triton Х-100, 150ммоль NaCI, 5ммоль EGTA, 1ммоль PMSF, 50мг/мл апротиніну, 25ммоль бензамідину, 5мг/мл інгібітора лейпепсину і 10мг/мл інгібітора соєвого трипсину) протягом 20 хвилин при 4°С. Після центрифугування при 100000g протягом 30 хвилин супернатант завантажують на WGA-агарозну колонку (100мл упакованої смоли на 2х107 клітин) і струшують протягом 2 годин при 4°С. Неабсорбований матеріал видаляють і смолу промивають два рази HTN буфером (50ммоль буфера Hepes, pH 7,6, 0,1% Triton X-100, 150ммоль NaCI), два рази HTN буфером, що містить 1М NaCI, і два рази HTNG буфером (50ммоль буфера Hepes, pH 7,6, 0,1% Triton X-100, 150ммоль NaCI і 10% гліцерин). EGF-рецептор елюють періодично HTNG буфером, що містить 0,5М N-ацетил-D-глюкозамін (200мл на 2х107 клітин). Елюйований матеріал зберігають аліквотами при -70°С і перед застосуванням розводять TMTNG буфером (50ммоль Tris-Mes буфера, рН 7,6,0,1% Triton X-100, 150ммоль NaCI і 10% гліцерин). 5. Інгібування аутофосфорилування EGF-R Клітини А431 культивують до злиття на тарілках з культурою людської тканини, покритою фібронектином. Після дворазового промивання охолодженим льодом розчином PBS клітини лізують шляхом додавання 500мл/тарілку лізисного буфера (50ммоль Hepes, pH 7,5, 150ммоль NaCI, 1,5ммоль MgCI 2, 1ммоль EGTA, 10% гліцерин, 1% Тритон Х-100, 1ммоль PMSF, 1мг/мл апротиніну, 1мг/мл лейпептину) і інкубують 5 хвилин при 4°С. Після стимуляції EGF (500мг/мл, 10 хвилин при 37°С) виконують імунопреципітацію за допомогою анти-EGF-R (Аb 108) і здійснюють реакцію аутофосфорилування зразка (50мл аліквоти, 3мКі [g-32P]ATФ) в присутності 2 або 10мМ сполуки за цим винаходом протягом 2 хвилин при 4°С. Реакцію зупиняють шляхом додавання гарячого електрофорезного буфера для зразка. Здійснюють SDA-PAGE аналіз (7,5%ел.) з наступною ауторадіографією і визначають кількісні результати реакції шляхом денситометричного сканування рентгенівських плівок. а. Культура клітин Клітини під назвою HER 14 і К721А одержують шляхом трансфекції клітин NIH3T3 (клон 2.2) (з С. Fryling, NCI, NIH), що відчувають нестачу ендогенних EGF-рецепторів, конструкціями кДНК з дикого типу EGF-рецептора або мутантного EGF-рецептора, що потребує тирозинкіназної активності (у них Ліз 721 в місці зв'язування з АТФ замінений залишком Ala відповідно). Усі клітини культивують в DMEM з 10% сироваткою теляти (Hyclone, Logan, Utah). 6. Вибірковість в залежності від РКА і РКС визначають з використанням комерційних комплектів приладів: a. Колориметричний комплект Pierce для аналізу РКА, формат Spinzyme Короткий протокол: пробірка 1U ферментом РКА (бичаче серце) пептидний (мічений барвником) субстрат Кемптид 45 хвилин при 30°С Спектральна поглинальна здатність при 570нм b. Колориметричний комплект Pierce для аналізу РКС, формат Spinzyme Короткий протокол: пробірка 0,025U з ферментом РКС (головний мозок пацюка) пептидний (мічений барвником) субстрат Нейрогранін 30 хвилин при 30°С Спектральна поглинальна здатність при 570нм 7. Вимірювання активності інгібування тирозинкінази р56lck Активність інгібування тирозинкінази р56lck визначають у відповідності до методики, розкритої в патенті США №5714493, наведеному в даному описі шляхом посилання. У відповідності до іншого варіанту активність інгібування тирзинкінази визначають таким методом. Субстрат (субстрат, що містить тирозин, Biot-(bА1а)3-Lys-Val-Glu-Lys-Ile-Gly-Glu-Gly-Thr-Tyr-Glu-Val-Val-TyrLys-(NH2), розпізнаний за допомогою р56lck, 1мкМ) спочатку фосфорилують в присутності або за відсутності заданої концентрації випробовуваної сполуки заданою кількістю ферменту (фермент роблять шляхом експресії гена р56lck в дріжджовій конструкції), очищеного від клонованих дріжджів (очищення ферменту здійснюють такими класичними методами), у присутності АТФ (10мкМ), MgCl2 (2,5мМ), МnСl2 (2,5мМ), NaCl (25мМ), DTT (0,4мМ) в Hepes 50мМ, рН 7,5, протягом 10 хвилин при температурі навколишнього середовища. Загальний об'єм реакційної суміші складає 50мкл, і реакції виконують в чорному 96-ти ямковому флуропланшеті. Реакцію зупиняють шляхом додавання 150мкл зупиняючого буфера (100мМ Hepes, pH 7,5, KF 400мМ, EDTA 133мМ, BSA 1г/л), що містить антитіло до тирозину, мічене криптатом європію (PY20-K), при 0,8мкг/мл, і мічений алофікоціаніном стрептавідин (XL665) при 4мкг/мл. Мічення Стрептавідину і антитіл до тирозину було здійснено Cis-Bio International (Франція). Суміш обраховували за допомогою лічильника Packard Discovery, здатного вимірювати перенесення однорідної флуоресценції з часовим розділенням (збудження при 337нм, зчитування при 620нм і 665нм). Відношення сигналу 665нм до сигналу 620нм є мірою концентрації фосфорильованого тирозину. Сліпий дослід одержують шляхом заміни ферменту буфером. Характерний сигнал є різницею між відношенням, отриманим без інгібітора, і відношенням при сліпому досліді. Обчислюють характерний сигнал у відсотках. Обчислюють ІС 50 з 10 концентраціями інгібітору дубльовано, користуючись програмним забезпеченням Xlfit. Еталонною сполукою є ставроспорин (Sigma), що показує ІС50=30±6нМ (n=20). Результати, отримані описаними вище експериментальними методами, доводять, що сполуки за цим винаходом мають корисну здатність інгібувати білкову тирозинкіназу рецептора PDGF і здатність інгібувати тирозинкіназу р56lck, і тому мають терапевтичну цінність. Результати описаних вище фармакологічних випробувань можуть бути використані для визначення дози і способу введення для задуманого конкретного терапевтичного заходу. Цей винахід може бути здійсненим в інших конкретних видах в межах його суті або істотних ознак.
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinoline and quinoxaline compounds which inhibit platelet-derived growth factor and/ or p56
Автори англійськоюHe Wei
Назва патенту російськоюХинолиновые и хиноксалиновые соединения, ингибирующие тирозинкиназы тромбоцитарного фактора роста и/или p56
Автори російськоюХе Вей
МПК / Мітки
МПК: C07D 405/10, C07D 241/52, A61P 9/10, A61K 31/498, C07D 453/00, A61P 19/08, C07D 241/44, C07D 215/20, C07D 403/04, A61P 35/02, A61P 9/00, C07D 215/38, A61P 43/00, A61P 17/06, A61P 35/00, A61K 31/5377, C07D 241/54, C07D 405/12, C07D 241/42, A61K 31/47, A61P 29/00
Мітки: тирозинкінази, основі, інгібують, активність, інгібування, спосіб, сполуки, лікування, хіноксалінові, композиція, фармацевтична, варіанти, хінолінові
Код посилання
<a href="https://ua.patents.su/22-66362-khinolinovi-i-khinoksalinovi-spoluki-shho-ingibuyut-aktivnist-tirozinkinazi-farmacevtichna-kompoziciya-na-kh-osnovi-sposib-ingibuvannya-varianti-ta-sposib-likuvannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Хінолінові і хіноксалінові сполуки, що інгібують активність тирозинкінази, фармацевтична композиція на їх основі, спосіб інгібування (варіанти) та спосіб лікування (варіанти)</a>
Попередній патент: Хінолінові і хіноксалінові сполуки, фармацевтична композиція, спосіб інгібування (варіанти) та спосіб лікування (варіанти)
Наступний патент: Спосіб записування поточного часу на носії інформації (варіанти), носій інформації (варіанти) та пристрої для записування та читання
Випадковий патент: Алмазна бурова коронка для бурового снаряду зі зйомним керноприймачем