Застосування анти-нвр антитіла ссавця для приготування лікарського засобу для профілактики або лікування захворювання, яке виникає в результаті вивільнення брадикініну у ссавця, спосіб визначення моноклональног
Номер патенту: 77385
Опубліковано: 15.12.2006
Автори: Флодгор Ганс Якоб, Бйорн Сьорен, Ліндбом Леннарт
Формула / Реферат
1. Застосування анти-НВР антитіла ссавця для приготування лікарського засобу для профілактики або лікування захворювання, яке виникає в результаті вивільнення брадикініну у ссавця, причому зазначений ссавець виробляє НВР, який зв'язується з анти-НВР антитілом ссавця, де захворювання вибране з групи, яка включає синдром системної запальної реакції, ішемічну реперфузію, анафілаксію та відторгнення алотрансплантата.
2. Застосування за п. 1, у якому кількість анти-НВР антитіла, яку вводять ссавцеві, становить 0,1-100 мг/кг маси тіла.
3. Застосування за п. 1, у якому кількість анти-НВР антитіла, яку вводять ссавцеві, становить 0,5-50 мг/кг маси тіла.
4. Застосування за п. 1, у якому кількість анти-НВР антитіла, яку вводять ссавцеві, становить 1-25 мг/кг маси тіла.
5. Застосування за п. 1, у якому антитіло являє собою моноклональне антитіло, переважно моноклональне антитіло людини.
6. Застосування за п. 5, у якому ссавець являє собою людину і НВР являє собою НВР людини.
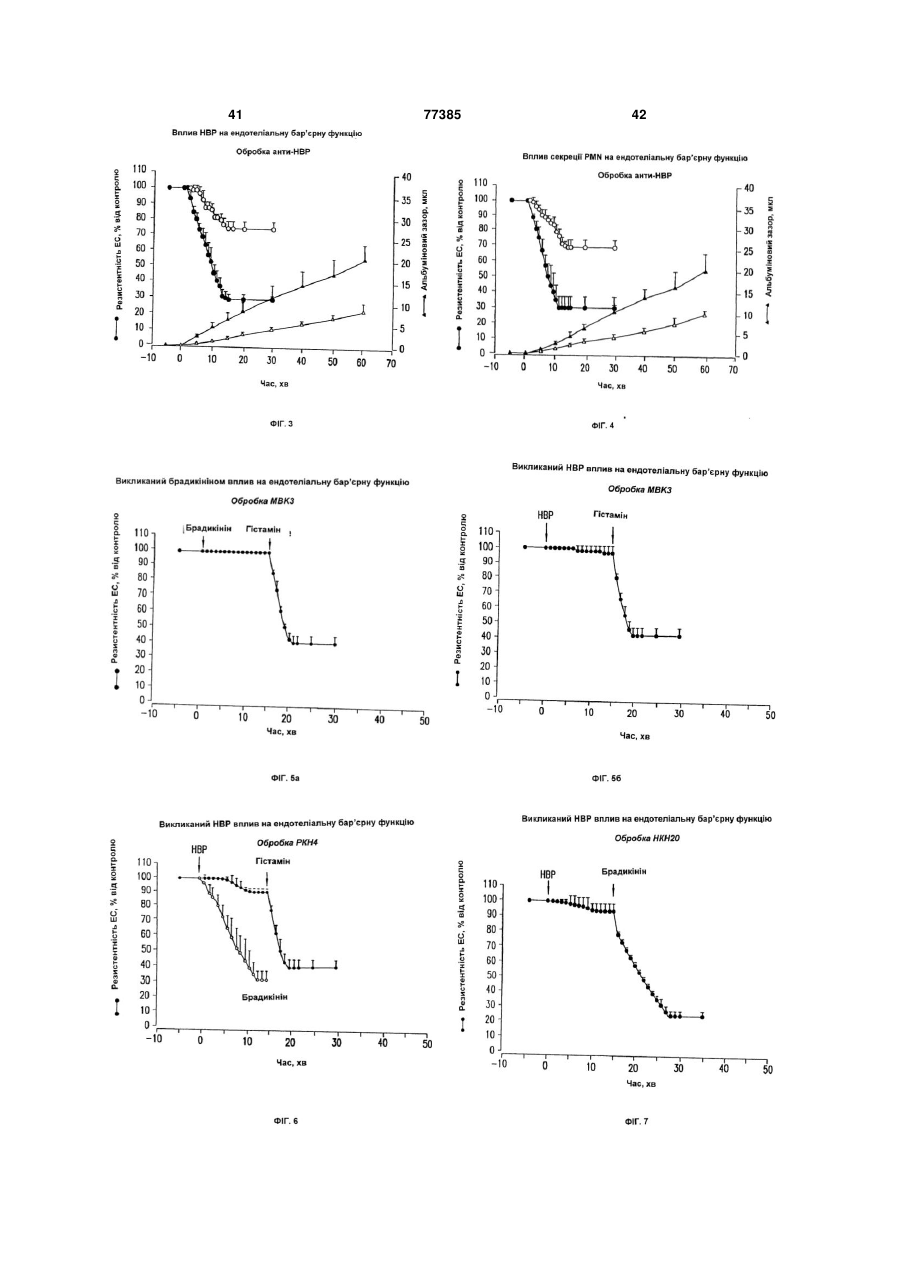
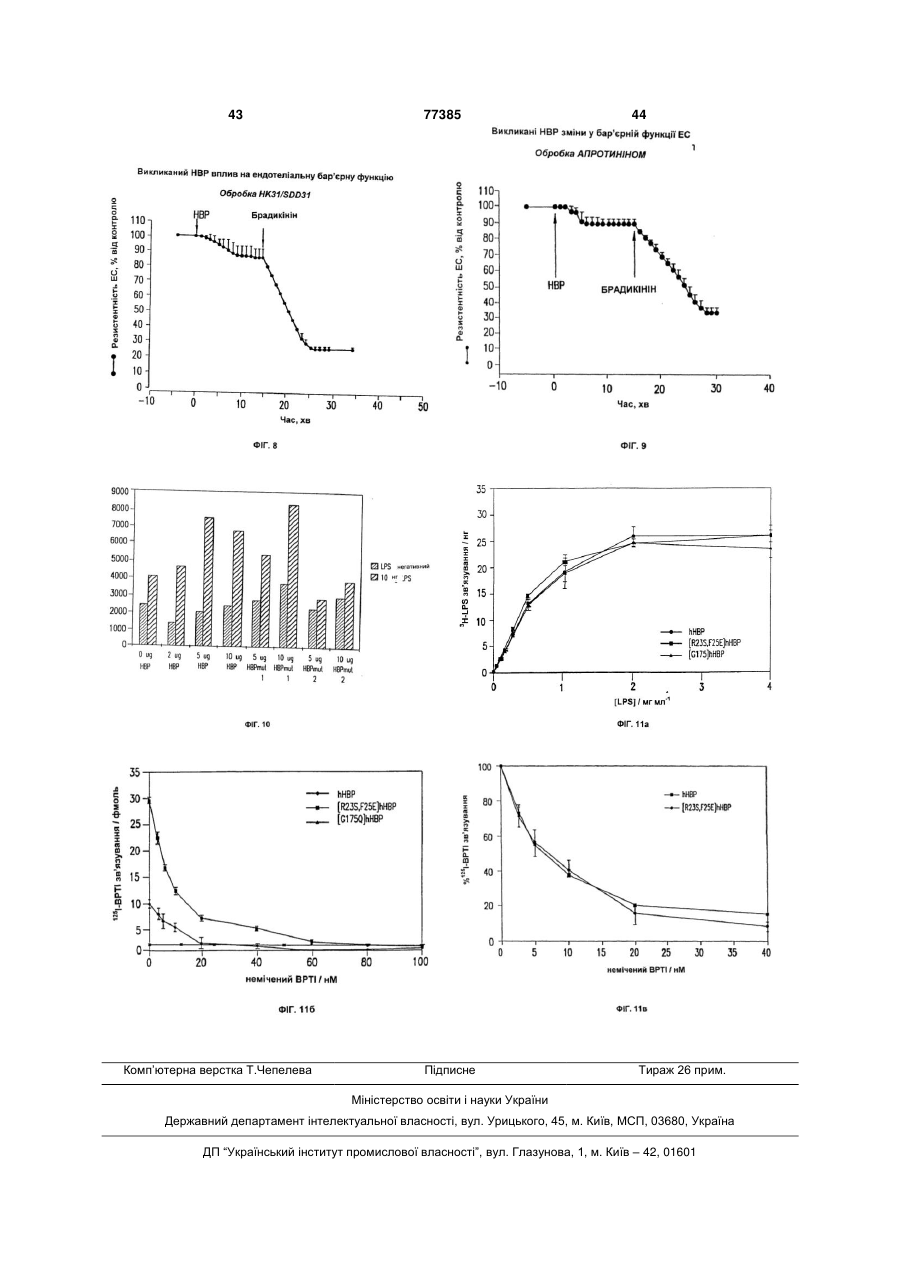
7. Спосіб визначення моноклонального антитіла, яке зв'язується з принаймні одним епітопом на природному НВР, у якому (а) культивують ендотеліальні клітини у присутності НВР та у присутності і за відсутності моноклонального антитіла, яке, як вважають, зв'язується з принаймні одним епітопом на НВР, та (b) виявляють будь-який вплив речовини на проникність ендотеліальних клітин, причому зниження проникності ендотеліальних клітин, порівняно з проникністю клітин при інкубації у присутності НВР без речовини, вказує на те, що моноклональне антитіло зв'язується з принаймні одним епітопом на НВР.
8. Спосіб за п. 7, у якому природний НВР являє собою НВР людини.
9. Спосіб за п. 7, у якому вивільнення брадикініну визначають шляхом імунологічного аналізу.
10. Випробувальний комплект, який включає (а) НВР антитіло, (b) HBP або клітину, яка продукує НВР, та (с) речовину, тканину, клітини або компонент, що взаємодіє з НВР.
11. Випробувальний комплект за п. 10, у якому НВР є міченим.
12. Випробувальний комплект за п. 10, де випробувальний комплект включає речовину, яка взаємодіє з НВР.
13. Випробувальний комплект за п. 12, у якому вказана речовина являє собою Н-кініноген.
14. Випробувальний комплект за п. 12, у якому вказана речовина є міченою.
15. Випробувальний комплект за п. 12, який додатково включає гранули.
16. Спосіб визначення продукування клітиною або тканиною ссавця НВР, що зв'язується з моноклональним антитілом, яке зв'язується з принаймні одним епітопом на природному НВР, у якому (а) культивують клітину або тканину з ендотеліальними клітинами у присутності або за відсутності антитіла, та (b) виявляють будь-який вплив антитіла на проникність ендотеліальних клітин, причому зниження проникності вказує, що НВР зв'язується з антитілом.
17. Спосіб за п. 16, у якому ссавець являє собою людину.
18. Спосіб за п. 16, у якому природний НВР являє собою НВР людини.
Текст
1. Застосування анти-НВР антитіла ссавця для приготування лікарського засобу для профілактики або лікування захворювання, яке виникає в результаті вивільнення брадикініну у ссавця, причому зазначений ссавець виробляє НВР, який зв'язується з анти-НВР антитілом ссавця, де захворювання вибране з групи, яка включає синдром системної запальної реакції, ішемічну реперфузію, анафілаксію та відторгнення алотрансплантата. 2. Застосування за п. 1, у якому кількість анти-НВР антитіла, яку вводять ссавцеві, становить 0,1100 мг/кг маси тіла. 3. Застосування за п. 1, у якому кількість анти-НВР антитіла, яку вводять ссавцеві, становить 0,550 мг/кг маси тіла. 4. Застосування за п. 1, у якому кількість анти-НВР антитіла, яку вводять ссавцеві, становить 125 мг/кг маси тіла. UA (21) 2001107327 (22) 28.04.2000 (24) 15.12.2006 (86) PCT/DK00/00213, 28.04.2000 (31) 60/132,748 (32) 29.04.1999 (33) US (31) PA 1999 00613 (32) 06.05.1999 (33) DK (31) PA 1999 01402 (32) 01.10.1999 (33) DK (31) 60/157,384 (32) 01.10.1999 (33) US (46) 15.12.2006, Бюл. № 12, 2006 р. (72) Флодгор Ганс Якоб, DK, Ліндбром Леннарт , DK, Бйорн Сьорен , DK (73) НОВО НОРДІСК А/С, DK (56) US 5786328 A, 28.07.1998. US 5780265 A, 14.07.1998. WO 9305396 A1, 18.03.1993. Walter A. PATTON II et al. "Identification of a heparinbinding protein using monoclonal antibodies that 2 (19) 1 C2 (54) ЗАСТОСУВАННЯ АНТИ-НВР АНТИТІЛА ССАВЦЯ ДЛЯ ПРИГОТУВАННЯ ЛІКАРСЬКОГО ЗАСОБУ ДЛЯ ПРОФІЛАКТИКИ АБО ЛІКУВАННЯ ЗАХВОРЮВАННЯ, ЯКЕ ВИНИКАЄ В РЕЗУЛЬТАТІ ВИВІЛЬНЕННЯ БРАДИКІНІНУ У ССАВЦЯ, СПОСІБ ВИЗНАЧЕННЯ МОНОКЛОНАЛЬНОГО АНТИТІЛА, ВИПРОБУВАЛЬНИЙ КОМПЛЕКТ, СПОСІБ ВИЗНАЧЕННЯ ПРОДУКУВАННЯ КЛІТИНОЮ АБО ТКАНИНОЮ ССАВЦЯ НВР 3 77385 4 5. Застосування за п. 1, у якому антитіло являє 11. Випробувальний комплект за п. 10, у якому собою моноклональне антитіло, переважно моноНВР є міченим. клональне антитіло людини. 12. Випробувальний комплект за п. 10, де випро6. Застосування за п. 5, у якому ссавець являє бувальний комплект включає речовину, яка взаєсобою людину і НВР являє собою НВР людини. модіє з НВР. 7. Спосіб визначення моноклонального антитіла, 13. Випробувальний комплект за п. 12, у якому яке зв'язується з принаймні одним епітопом на вказана речовина являє собою Н-кініноген. природному НВР, у якому (а) культивують ендоте14. Випробувальний комплект за п. 12, у якому ліальні клітини у присутності НВР та у присутності і вказана речовина є міченою. за відсутності моноклонального антитіла, яке, як 15. Випробувальний комплект за п. 12, який додатвважають, зв'язується з принаймні одним епітопом ково включає гранули. на НВР, та (b) виявляють будь-який вплив речови16. Спосіб визначення продукування клітиною або ни на проникність ендотеліальних клітин, причому тканиною ссавця НВР, що зв'язується з моноклозниження проникності ендотеліальних клітин, порінальним антитілом, яке зв'язується з принаймні вняно з проникністю клітин при інкубації у присутодним епітопом на природному НВР, у якому (а) ності НВР без речовини, вказує на те, що моноккультивують клітину або тканину з ендотеліальнилональне антитіло зв'язується з принаймні одним ми клітинами у присутності або за відсутності анепітопом на НВР. титіла, та (b) виявляють будь-який вплив антитіла 8. Спосіб за п. 7, у якому природний НВР являє на проникність ендотеліальних клітин, причому собою НВР людини. зниження проникності вказує, що НВР зв'язується 9. Спосіб за п. 7, у якому вивільнення брадикініну з антитілом. визначають шляхом імунологічного аналізу. 17. Спосіб за п. 16, у якому ссавець являє собою 10. Випробувальний комплект, який включає (а) людину. НВР антитіло, (b) HBP або клітину, яка продукує 18. Спосіб за п. 16, у якому природний НВР являє НВР, та (с) речовину, тканину, клітини або компособою НВР людини. нент, що взаємодіє з НВР. Винахід стосується способу лікування або профілактики захворювань, які спричинені вивільненням брадикініну у ссавців, зокрема ссавців, які виробляють гепарин-зв'язаний білок, причому цей білок зв'язується з антагоністом гепаринзв'язаного білка, даний спосіб полягає у введенні вищезгаданому ссавцю відповідної дози антагоніста гепарин-зв'язаного білка з метою зниження вивільнення брадикініну у ссавців. Крім того, винахід стосується способів та комплектів для визначення здатності ссавця виробляти гепарин-зв'язаний білок, який зв'язується з антагоністом гепаринзв'язаного білка, та способу виявлення антагоніста гепарин-зв'язаного білка. Запалення Гостра запальна реакція має певні особливості, що включають в себе зміни діаметра та тонусу судин, а саме порушення функції проникності судин, яке в результаті призводить до утворення багатого на білок ексудату [Lewis, Mediators of Inflammation, Wright, Bristol, U.K., 1986]. Отже, щойно нейтрофіли (PMN) приймають хемотаксичні сигнали, вони облямовуються й прилипають до судинних ендотеліальних клітин через специфічні адгезивні молекули, які синтезуються як на ендотеліальній поверхні, так і на поверхні нейтрофілів. Після прикріплення нейтрофілів до ендотеліальних клітин відбувається відкривання ендотеліальних зазорів, які спричинюють порушення функції проникності судин і допускають міграцію нейтрофілів у міжвузля інтерстицію. Система контактної фази охоплює три ферментні фактори, фактор XI (F XI), фактор XII (F XII) та прокалікреїн плазми (прекалікреїн) (РК) і неферментний кофактор, Нкініноген (НК), який утворює еквімолярні комплекси з F XI та РК відповідно. Наявність контактної фази спостерігається у моноцитах, фібробластах та нейтрофілах. Сайти специфічного зв'язування залишаються відкритими з боку ендотеліальних клітин та неклітинних негативно заряджених поверхонь, таких як каолін, що мають загальну назву "контактна фаза" і дозволяють локалізацію збору головних компонентів. Перетворення зимогену, F XII, на активний фермент, F ХІІа, активує саму систему контактної фази [Colman et al., 1986, Grit. Rev. Oncol. Hematol. 5: 57-85]. Внаслідок взаємної активації поверхнево зв'язаного F XII та РK, закріпленого на поверхні через НК утворюється F ХІІа та Рkа, таким чином посилюючи початковий сигнал. Після цього фактор ХІІа може активувати Фактор XI, і отже, започатковується природний шлях коагуляції. Відомо що РК також гідролізує НK для утворення ефективного нонапептиду, брадикініну [Kaplan and Silverberg, 1987, Blood 70:1-15]. Кініни вважають основними посередниками запального процесу, які спричинюють біль, призводять до розширення та порушення функції проникності судин внаслідок їх прямої дії на ендотеліальні клітини, змушуючи їх стягуватися й допускати як міграцію нейтрофілів, так і транссудацію компонентів плазми [Oyvin et al., 1970, Experentia 26:843-844]. Можливе також місцеве вироблення простагландин та оксиду азоту, NO [Hall, 1992, Pharmacol. Ther. 56:131-190]. Отже, активація системи контактної фази може призводити до побічної дії, наприклад, запалення, септичного шоку, синдрому розладу дихання у дорослих, дисемінованої внутрішньосудинної коагуляції, післяопераційної кровотечі при серцево-судинних операціях. Зокрема, система контактної фази може бути 5 77385 6 активована, в період коли нейтрофіли зв'язуються припущеннями, сайт зв'язування ліпіду A/LPS приз ендотеліальними клітинами за умови наявності родного НВР розміщується як незаряджена вставендотоксинів та шляхом бактеріальної інфекції ка між основною та кислотною вставками на НВР і [див. Colman et al., 1997, Blood 90:3819-3843]. Навключає в себе залишки 20-26 та 41-43. У сайті приклад, було виявлено що під час сепсису актизв'язування ліпіду A/LPS Phe25, Cys26, Cys42 та вація фактора XII та прекалікреїну призводить до Phe43 утворюють гідрофобну нішу, здатну до зв'ярозщеплень, які активують їх до ферментів, що зування жирнокислотних ланцюгів або глікозамінішвидко реагують з інгібітором С1 для утворення льного цукрового кільця ліпіду А. За цією нішею комплексів інгібітор фактора ХІІа-С1 та інгібітор розміщується іонна та гідрофільна ніша (Asn20, калікреїну-С1. Значне посилення в утворенні комGln21 та Arg23), яка має високу здатність до зв'яплексу інгібітор калікреїну-С1 спостерігають при зування глікозамініл-з'єднаної фосфатної групи змодельованому серцево-легеневому шунтуванні. ліпіду A [Iversen et al., 1997, Nature Struct. Biology Було виявлено що апротинін, інгібітор плазмі4:265-268]. ну та калікреїну плазми, знижує втрату крові після Крім того, результати лікування калового пеоперацій на серці й скорочує тривалість сильної ритоніту з застосуванням НВР у тварин показали, післяопераційної кровотечі. Зокрема, було виявщо наприклад миші з допомогою цього лікування лено що апротинін знижує комплекси інгібітор каліможуть уникнути смертельного пошкодження креїну-С1 та інгібітор С1-С1 в обвідній моделі шту[Mercer-Jones et al., 1996, In Surgical Forum, cc.105чного кровообігу [Wachtfogel et al., 1993, J. Thorac. 108 та Wickel et al., 1997, In 4th International Cardiovasc Surg. 106:1]. У разі додавання апротиCongress on the Immune Consequences of Trauma, ніну до систем для серцево-легеневого шунтуванShock and Sepsis, Munich, Germany, cc.413-416]. ня, які використовують із суцільною кров'ю, обробБуло запропоновано, щоб гепарин-зв'язаний білок леною проти коагуляції гепарином, апротинін або його LPS-зв'язані частини застосовувалися фактично доповнює дію гепарину [Bannan et al., для лікування септичного шоку [WO95/28949, па1998, Brit. J. Haem. 101:455-461]. Отже, апротинін тенти США №№5,458,874, 5,607,916 та 5,650,392]. має ще одну дію, крім тієї, яку було виявлено у Спершу проводилися дослідження антибіотичгепарин-зв'язаних системах, - кровоспинну дію. них та LPS-зв'язувальних властивостей HBP Апротинін також збільшує життєздатність ен[Gabayetal., 1989, Proc. Natl. Acad. Sci. U.S.A. дотеліальних клітин за гіпоксичних умов зберіган86:5610-5614 та Pereira et al., 1993, Proc. Natl. ня у холодильній камері, коли такі клітини містятьAcad. Sci. USA 90: 4733-7]. Однак зібрані останнім ся у розчинах для збереження органів, і поліпшує часом дані підтверджують концепцію, згідно з якою зберігання легенів та міокарда у моделях цілих НВР, крім бактерицидної дії, спричинює прогресуорганів [Sunamori et al., 1991, Ann. Thor. Surg. вання запалень внаслідок його властивості впли52:971-978 та Roberts et al., 1998, Ann. Thorac. вати на залучення та активацію моноцитів [Pereira Surg. 66:225-230]. Крім того, якщо брадикінін сприet al., 1990, J. Clin. Invest. 85:1468-1476 та чинював більшу проникність судин, то апротинін Rasmussen et al., 1996, FEBS Lett. 390:109-112], знижував цю проникність судин та кількість нейтзалучення Т-клітин [Chertov et al., 1996, J. Biol. рофілів [O'Brien et al., 1997, Can. J. Physiol. Chem. 271: 2935-2940]. Pharmacol. 75:741-749 та Dwengeretal., 1995, Eur. Було виявлено що НВР викликає скорочення в J. Clin. Chem. Clin. Biochem. 34:207-214]. ендотеліальних клітинах та фібробластах Гепарин-зв'язаний білок [Ostergaard and Flodgaard, 1992, J. Leuk. Biol. Нещодавно було визначено ковалентну струк51:316-323]. У зв'язку з цим [у WO 93/05396] опитуру двох споріднених білків, виділених із лейкосано спосіб відбору інгібіторів НВР шляхом інкубацитів периферичних нейтрофілів людини та свині ції НВР або клітин, які виробляють НВР, з речови[пор. Η. Flodgaard et al., 1991, Eur. J. Biochem. ною, яку вважають інгібітором НВР, та з тканиною 197:535-547; J. Pohl et al., 1990, FEBS Lett. 272: або клітинами, здатними взаємодіяти з НВР; зни200ff.]. Обидва білки виявляють високу споріднежена взаємодія (наприклад, скорочення ендотеліність з еластазою нейтрофілів, але через селектиальних клітин) свідчить про те, що речовина є інгівну мутацію активного серину 195 та гістидину 57 бітором НВР. (нумерація хімотрипсину [В. S. Hartley, "Homologies [У заявці WO99/26647] описано застосування in Serine Proteinases", Phil. Trans. Roy. Soc. Series гепарин-зв'язаного білка для модуляції або профі257,1970, с.77ff.] білки не мають активності протелактики апоптозу клітин ссавців. У заявці також ази. Білки відповідно назвали гепарин-зв'язаним описано, що НВР звільняє клітини інсуломи щура білком людини (hHBP) та гепарин-зв'язаним білвід спричиненого IL-1 апоптозу. ком свині (рНВР) внаслідок їх високої спорідненосБуло також виявлено що тільки гепаринті з гепарином. зв'язаний білок людини, а не гепарин-зв'язаний Schafer et al. [Schafer et al., 1984, Infect. Immun. білок свині, зв'язується з апротиніном (ВРТІ) 53:651] назвали білок катіонним антимікробним [Petersen et al., Eur. J. Biochem. 214:271-279]. Зокбілком (САР37) внаслідок його антимікробної актирема, ВРТІ все ж здатен зв'язуватися з НВР з -6 вності. НВР міцно зв'язується з компонентом ліпіду Kd=0,1 10 Μ [Petersen et al., 1993, Eur. J. Biochem. 9 -1 A/LPS та ендотоксином (Kass=0,8 10 Μ ). ВказуваB214:271-279]. Було визначено що Р1 специфічлося на те що бактерицидна дія НВР зумовлена ність НВР є насамперед Lys або Leu [Kiczak et al., зв'язуванням ліпіду A [Petersen et al., 1993, Eur. J. 1999, Biol. Chem. 380:101-105]. Було зазначено що Biochem. B214: 271-279., Flodgaard et al., 1994, J. найпомітнішими залишками в НВР, які впливають Cell. Biochem. Suppl. 78AAbstr. E505; Pereira et al., на зв'язування ВРТІ, є Gly169, Gly175, Ser192 та 1993, Proc. Natl. Acad. Sci. USA 90:4733-4737]. За Asp201, які відповідають Asp 189, Ser195, Gly216 7 77385 8 та Asp226 у трипсині [Petersen et al., 1993, Eur. J. ніну у вищезгаданого ссавця. Biochem. B214: 271-279. Kiczak et al., 1999, Biol. В іншому конкретному втіленні винахід стосуChem. 380:101-106] зібрали бібліотеку мутантів у ється способу лікування або профілактики захвобоковому ланцюгу Р1 апротиніну, застосовуючи рювань, які виникають в результаті вивільнення способи показу фагів. Вони виявили що у НВР брадикініну у ссавців, зокрема людини, особливо високий ступінь спорідненість із Р1 Lys, а також із ссавців, які виробляють НВР, який зв'язується з незарядженими Ρ1-амінокислотами, Leu, Thr, моноклональним антитілом, яке зв'язується з приMet, Gin. наймні одним епітопом на НВР, причому вищезгаБуло виявлено новий факт, що гепаринданий епітоп зв'язується з комплексом прекалікрезв'язаний білок (НВР) служить сигнальною ланкою їну-Н-кініногену й активує вивільнення брадикініну, у спричиненому нейтрофілами порушенні функції і цей спосіб передбачає введення вищезгаданому проникності судин та активації системи контактної ссавцю, який цього потребує, моноклонального фази з паралельним утворенням брадикініну, і що антитіла, яке зв'язується з принаймні одним епітовін відіграє роль в опосередкованому РК розщеппом на НВР, причому вищезгаданий епітоп зв'язуленні НК для одержання послідовності брадикініється з комплексом прекалікреїну-Н-кініногену й ну. До того ж було виявлено, що антагоністи НВР активує вивільнення відповідної кількості брадикізнижують проникність ендотеліальних клітин. Як ніну длямодуляції або зниження вивільнення брабуло вже визначено, "антагоніст НВР" є речовидикініну у вищезгаданого ссавця. ною, яка взаємодіє з гепарин-зв'язаним білком і Винахід також стосується способів виявлення інгібує дію гепарин-зв'язаного білка. антагоніста НВР. В одному з втілень винаходу Винахід стосується способу лікування або вищезгаданий спосіб включає в себе: (а) культипрофілактики захворювань, які виникають в ревування ендотеліальних клітин за наявності НВР і зультаті вивільнення брадикініну у ссавців, зокреза наявності та відсутності речовини, яку вважама людини, особливо, ссавців, які виробляють ють вищезгаданим антагоністом, та (б) виявлення НВР, що зв'язується з антагоністом НВР, який пебудь-якого впливу вищезгаданої речовини на фунредбачає введення вищезгаданому ссавцю, який кцію проникності ендотеліальних клітин, причому цього потребує, відповідної дози антагоніста гепазнижена функція проникності вищезгаданих ендорин-зв'язаного білка людини для модуляції або теліальних клітин, порівняно з функцією проникнозниження вивільнення брадикініну у вищезгаданості вищезгаданих клітин при інкубації за наявності го ссавця. До таких захворювань, крім інших, наНВР без вищезгаданої речовини вказує на те, що лежать синдром системної запальної реакції, ішевищезгадана речовина є антагоністом. В іншому мічна реперфузія, анафілаксія та відторгнення втіленні винаходу вищезгаданим способом передалотрансплантата. До цих захворювань також мобачено (а) інкубацію НВР з першою речовиною) жуть належати синдром розладу дихання у доросяка взаємодіє з НВР, та другою речовиною, яку лих - побічна дія синдрому системної запальної вважають антагоністом НВР, та (б) виявлення реакції. Анафілаксія може виникнути внаслідок будь-якого впливу вищезгаданої другої речовини, невідповідної активації PMN під час серцевояку вважають антагоністом, на взаємодію НВР з легеневого шунтування, операції на легенях, травищезгаданою першою речовиною. вми голови та широкої травми всього тіла. МодуУ конкретному втіленні винахід стосується ляції або зниження у вивільненні брадикініну досяспособів розпізнавання моноклонального антитіла, гають шляхом запобігання контакту НВР з яке зв'язується з принаймні одним епітопом НВР, ендотеліальними клітинами та/або з системою зокрема НВР людини, у яких вищезгаданий епітоп контактної фази. У конкретному втіленні винаходу зв'язується з комплексом прекалікреїну-Нантагоніст НВР модулює або зменшує опосередкініногену й активує вивільнення брадикініну. В коване калікреїном розщеплення Н-кініногену для одному з втілень винаходу спосіб включає в себе: одержання послідовності брадикініну. Винахід та(а) культивування ендотеліальних клітин за наявкож стосується застосування антагоніста НВР з ності НВР і за наявності та відсутності моноклонаметою одержання медикаменту для лікування сильного антитіла, яке вважають таким, що зв'язундрому системної запальної реакції, ішемічної реється з принаймні одним епітопом НВР, зокрема перфузії, анафілаксії та відторгнення алотрансНВР людини, причому вищезгаданий епітоп зв'яплантата у пацієнта, що має НВР, який зв'язується зується з комплексом прекалікреїну-Н-кініногену й з антагоністом НВР. Антагоністи НВР також моактивує вивільнення брадикініну, і (б) виявлення жуть використовуватися у лікування або в одербудь-якого впливу вищезгаданої речовини на фунжанні медикаменту для лікування ускладнення кцію проникності ендотеліальних клітин, причому синдрому системної запальної реакції - синдрому знижена функція проникності вищезгаданих ендорозладу дихання у дорослих. теліальних клітин, порівняно з функцією проникноУ конкретному втіленні винахід стосується сті вищезгаданих клітин при інкубації за наявності способу профілактики захворювань, які виникають НВР без вищезгаданого антитіла вказує на те, що в результаті вивільнення брадикініну у ссавців, вищезгадане антитіло є моноклональним антитізокрема людини, особливо ссавців, які вироблялом, яке зв'язується з принаймні одним епітопом ють НВР, що зв'язується з антагоністом НВР, який на НВР, причому вищезгаданий епітоп зв'язується передбачає введення вищезгаданому ссавцю, з комплексом прекалікреїну-Н-кініногену й активує який цього потребує, домену або аналога інгібітовивільнення брадикініну. В іншому втіленні винару серинової протеази Kunitz-типу, або його похідходу способом передбачено (а) інкубацію компленої, що зв'язується з НВР, у кількості, ефективній ксу прекалікреїну-Н-кініногену за наявності НВР і для модуляції або зниження вивільнення брадикіза наявності та відсутності моноклонального анти 9 77385 10 тіла, яке вважають таким, що зв'язується з придини та (в) комплекс прекалікреїну-Н-кініногену, наймні одним епітопом на НВР, зокрема НВР люприєднаний до твердої основи. дини, причому вищезгаданий епітоп зв'язується з На Фіг.1 показано вплив зшивання CD18 з втокомплексом прекалікреїну-Н-кініногену й активує ринним антитілом кози анти-миші F(ab)2. вивільнення брадикініну, і (б) виявлення будьНа Фіг.2 показано вплив НВР, що залежить від якого впливу вищезгаданого антитіла на вивільдози (25-75мг/мл), на функцію проникності мононення брадикініну, зниження вивільнення брадикішару ендотеліальних клітин. ніну, що свідчить про те, що вищезгадане антитіло На Фіг.3 показано інгібування викликаного НВР зв'язується з вищезгаданим епітопом на НВР. збільшення проникності ЕС поліклональною антиВинахід також стосується способів та комплексироваткою до НВР. тів для визначення, чи виробляє ссавець НВР, На Фіг.4 показано вплив антитіл анти-НВР на який зв'язується з антагоністом НВР. Цим спосодію секреції PMN на ендотеліальну бар'єрну функбом передбачено такі етапи: (а) відокремлення цію. НВР або клітин, або тканини, що виробляють НВР, На Фіг.5 показано інгібування викликаного від організму ссавця, зокрема людини; (б) інкубабрадикініном та НВР збільшення проникності ЕС цію вищезгаданого НВР або клітин, або тканини, моноклональним антитілом МВКЗ до брадикініну. що виробляють НВР, з речовиною, тканиною, кліБрадикінін (100нМ; Фігура 5а) або НВР (75мкг/мл; тинами або їх компонентом, що взаємодіє з НВР Фіг.56) вводять на початку відліку часу з ламінальта вищезгаданим антагоністом НВР і (в) виявлення ного боку моношарів ЕС, попередньо інкубованих впливу вищезгаданого гепарин-зв'язаного антагоmAb МВКЗ (40мкг/мл). ніста на взаємодію НВР з вищезгаданою речовиНа Фіг.6 показано інгібування викликаного НВР ною, тканиною, клітинами або їх компонентами, збільшення проникності EC моноклональним антизниження взаємодії вказує на те, що вищезгаданий тілом РКН4 до калікреїну плазми. НВР (75мкг/мл; НВР зв'язується з вищезгаданим антагоністом заштриховані символи) або брадикінін (100нМ; НВР. Випробувальний комплект включає в себе (а) незаштриховані символи). антагоніст НВР; (б) природний НВР та (в) речовиНа Фіг.7 показано інгібування викликаного НВР ну, тканину, клітини або їх компонент, що взаємозбільшення проникності EC внаслідок пептидної діють з НВР. обробки НКН20. У конкретному втіленні винахід також стосуНа Фіг.8 показано інгібування викликаного НВР ється способів та комплектів для визначення, чи збільшення проникності EC внаслідок пептидної виробляє ссавець, зокрема людина, НВР, який обробки SDD31. зв'язується з моноклональним антитілом, що зв'яНа Фіг.9 показано інгібування викликаного НВР зується з принаймні одним епітопом на природнозбільшення проникності EC внаслідок обробки му НВР, зокрема НВР людини, причому вищезгаапротиніном. даний епітоп зв'язується з комплексом Фіг.10: вилучення ІІ-6 з моноцитів людини. Мопрекалікреїну-Н-кініногену й активує вивільнення ноцити культивують в 1мл середовища без сиробрадикініну, а також передбачає (а) відокремлення ватки протягом 24 годин разом з LPS та/або приНВР або клітин, або тканини, що виробляють НВР, родним НВР/[R23S,F25E]HBP/[G175QJHBP у від організму вищезгаданого ссавця; (б) культивукількостях, вказаних на Фіг. вання вищезгаданого НВР або клітин, або тканини, Фіг.11: насичення природного НВР, що виробляють НВР, з ендотеліальними клітинами [R23S,F25E]HBP та [G175Q]HBP-(А) 3Н-LPS і (Б) за наявності або відсутності вищезгаданого антиконкуренція за 125І-ВРТІ-зв'язування з постійними, тіла та (в) виявлення будь-якого впливу вищезгазростаючими концентраціями неміченого ВРТІ. (В) даного антитіла на функцію проникності ендотеліКонцентрацію 125І-ВРТІ показано у % 0нМ немічеальних клітин, знижена функція проникності вказує ного ВРТІ. Очевидна різниця у зв'язуванні між НВР на те, що вищезгаданий НВР зв'язується з вищета [R23SfF25E]HBP обговорюється у розділі "Резгаданим антитілом. В іншому втіленні способом зультати". Стовпчики означають стандартне відпередбачено (а) відокремлення НВР або клітин, хилення. або тканини, що виробляють НВР, від організму Гепарин-зв'язаний білок вищезгаданого ссавця; (б) інкубацію вищезгаданоУданому контексті термін "гепарин-зв'язаний го HBP або клітин, або тканини, що виробляють білок" ("НВР") означає білок, який (і) є протеолітиНВР, з комплексом прекалікреїну-Н-кініногену за чно неактивним; (іі) зберігається в азурофільних наявності та відсутності вищезгаданого антитіла та гранулах поліморфно-ядерних лейкоцитів; і (ііі) є (в) виявлення будь-якого впливу вищезгаданого хемоатрактантом для моноцитів і/або активує моНВР на вивільнення брадикініну з комплексу преноцити. НВР може бути ссавця, зокрема людини. калікреїну-Н-кініногену, зниження вивільнення Зокрема, НВР може бути розвинутий НВР людини, брадикініну вказує на те, що вищезгаданий НВР що принаймні має приблизно 80% ідентичність з зв'язується з вищезгаданим антитілом. Комплект амінокислотною послідовністю, представленою в згідно з даним винаходом включає в себе (а) моSEQ ID NО:1, краще - принаймні приблизно 90%, ноклональне антитіло, яке зв'язується з принаймні ще краще - принаймні приблизно 95%, найкраще одним епітопом на природному НВР, зокрема НВР принаймні приблизно 97% (далі - "гомологічні полюдини, причому вищезгаданий епітоп зв'язується ліпептиди"), які якісно зберігають активність вищез комплексом прекалікреїну-Н-кініногену й активує згаданого НВР. вивільнення брадикініну, (б) природний НВР лю 11 77385 12 станням гепарин-сефарози. Такий хроматографічний спосіб, який включає в себе градієнтне елюювання з NaCI від 0,5Μ до 3Μ колонки, через яку спочатку пропускали екстракт кров'яних пластинок, в результаті призводить до елюювання двох піків. Перший пік - приблизно 1,2Μ NaCI - може бути виміряний на рівні 280нМ як великий білковий пік, який і є фактором росту тромбоцитів (PF4) та відомий у галузі. Кількість білка приблизно 1,8Μ NaCI є меншою за межу виявлення у застосовуваній системі, але фракції в цій ділянці мають ангіогенну активність. Активні фракції додатково очищують Амінокислотні послідовності гомологічних пошляхом мікроколонкової протифазної HPLC на ліпептидів відрізняються від амінокислотної посліколонці С4, при 214нМ можна виявити повністю довності, представленої в SEQ ID NO: 1, вставкою очищений білок, цей білок ідентично представлеабо делецією одного або кількох амінокислотних ний в НВР як свинячого, так і людського типу, зазалишків та/або заміщенням одного або кількох лежно від типу застосованих пластинок. амінокислотних залишків іншими амінокислотними Якщо НВР має бути застосований для виявзалишками. Переважно амінокислотні зміни є нелення антагоністів НВР, його в оптимальному вазначними, тобто консервативними амінокислотниріанті одержують через представлені нижче споми заміщеннями, які не мають значного впливу на соби рекомбінантних ДНК. Нуклеїновокислотна склад та/або активність білка; невеликі делеції, як послідовність, що кодує НВР, може бути одержана правило, від однієї до приблизно 30 амінокислот; синтетично загальноприйнятими стандартними невеликі подовження на аміно- або карбоксильноспособами, наприклад, фосфоамідитним спосому кінці, такі як аміно-кінцевий метіоніновий залибом, [описаним S.L. Beaucage and Μ.Η. Caruthers, шок; невеликий лінкерний пептид з приблизно 201981, Tetrahedron Letters 22:1859-1869, або спосо25 залишків; або невелике подовження, яке сприяє бом, описаним Matthes et al., 1984, EMBO Journal очищенню шляхом зміни результуючого заряду 3:801-805]. Згідно з фосфоамідитним способом, або іншої функції, таке як полігістидиновий тракт, олігонуклеотиди синтезують, наприклад, в автомаантигенний епітоп або домен зв'язування. тичному синтезаторі ДНК, очищують, відпалюють, Приклади консервативних заміщень належать зшивають і клонують у відповідні вектори. до групи основних амінокислот (таких як аргінін, Технології виділення або клонування нуклеїлізин та гістидин), кислотних амінокислот (таких як новокислотної послідовності, що кодує гепаринглутамінова кислота та аспарагінова кислота), позв'язаний білок, застосовані у способі згідно з далярних амінокислот (таких як глутамін та аспараним винаходом, спеціалістам відомі і включають в гін), гідрофобних амінокислот (таких як лейцин, себе виділення з геномної ДНК, одержання з кДНК ізолейцин та валін), ароматичних амінокислот (таабо комбінацію цих способів. Клонування нуклеїких як фенілаланін, триптофан та тирозин) та мановокислотних послідовностей із геномної ДНК лих амінокислот (таких як гліцин, аланін, серин, згідно з даним винаходом здійснюють, наприклад, треонін та метіонін). Амінокислотні заміщення, які шляхом застосування загальновідомої полімеразв цілому не змінюють специфічну активність, спеноланцюгової реакції (PCR) або відбору за допоціалістам відомі і описані, [наприклад, у роботах Н. могою антитіл експресійних бібліотек для виявNeurath and R.L. Hill, 1979, The Proteins, Academic лення клонованих фрагментів ДНК зі спільними Press, New York]. Найпоширенішими змінами є: структурними фрагментами. Дивись, [наприклад, Ala/Ser, Val/lle, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Innis et al., 1990, A Guide to Methods and Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Application, Academic Press, New York]. ЗастосовуAsp/Asn, Leu/lle, Leu/Val, Ala/Glu, Asp/Gly, а також ють й інші процедури нуклеїновокислотної ампліці зміни у зворотному напрямку. фікації, такі як лігазноланцюгова реакція (LCR), Цей термін, зокрема охоплює пептидні фрагзшита активована транскрипція (LAT) та ампліфіменти НВР, і особливо фрагменти з хемотаксичкація на основі нуклеїновокислотної послідовності ним впливом, подібним до природного НВР. Крім (NASBA). того, НВР, які застосовують у способах згідно з Нуклеїновокислотну послідовність після цього даним винаходом, зв'язуються з антагоністами вставляють у рекомбінантний експресійний вектор, НВР, такими як апротинін та/або моноклональне який може бути будь-яким вектором, який можна антитіло, яке виробляється проти природного НВР піддати процедурі рекомбінантної ДНК. Вибір веклюдини. Природний НВР людини у його розвинутій тора часто залежить від клітини-хазяїна, в яку його формі має амінокислотну послідовність, показану вводять. Таким чином, вектор може бути автономв SEQ ID NO:1 і, крім того, (і) є протеолітично неаним вектором реплікації, тобто вектором, що існує ктивним; (іі) зберігається в азурофільних гранулах як позахромосомне утворення, реплікація якого є поліморфно-ядерних лейкоцитів; і (ііі) є хемоатракнезалежною від хромосомної реплікації, напритантом для моноцитів і/або активує моноцити. клад плазміда. В альтернативному втіленні вектор НВР виділяють із кров'яних пластинок, одерможе бути таким, який при введенні у клітинужаних із крові людини з застосуванням процедур, хазяїн інтегрується в геном клітини-хазяїна й репописаних [у патенті США № 5,814,602]. Точніше, лікується разом із хромосомою(ами), у яку (які) білок виробляється шляхом фракціонування екстйого було інтегровано. ракту кров'яних пластинок. З цією метою доцільно Нуклеїновокислотна послідовність, яка кодує застосовувати колонкову хроматографію з викори 13 77385 14 SEQ ID NOS: 1, SEQ ID NO:2, може бути функціоНВР, також може бути функціонально зв'язана з нально зв'язана з нуклеїновою кислотою, яка копридатним термінатором, таким як термінатор дує гетерологічну pro- та/або сигнальну послідовгормону росту людини (Palmiter et al., op. cit.) Векність. В альтернативному втіленні нуклеїнова тор також може містити інші елементи. До них накислота, яка кодує SEQ ID NOS:4 (сигнальна послежать сигнали поліаденілування (наприклад, з SV лідовність + розвинутий НВР) та 6 (сигнальна пос40 або ділянки аденовірусу 5 ЕІb), послідовності лідовність + рrо-послідовність + розвинутий HBP), транскрипційних енхансерів (наприклад, енхансер SEQ ID NOS:3 та 5 відповідно, можуть бути введеSV 40) та послідовності трансляційних енхансерів ні у рекомбінантний вектор. (наприклад, ті, що кодують аденовірус VA RNAs). Рекомбінантний експресійний вектор також може містити ДНК послідовність, яка дозволяє вектору повторюватися в даній клітині-хазяїні. Цей вектор також може включати в себе селектований маркер, наприклад, ген, продукт якого доповнює нестачу в клітині-хазяїні, такий як ген, що кодує дигідрофолат-редуктазу (DHFR), або такий, що надає резистентності до медикаменту, наприклад, неоміцин, генетицин, ампіцилін або гігроміцин. У конкретному втіленні НВР можна виробляти шляхом культивування клітин-хазяїнів, що містять послідовність ДНК, яка кодує розвинутий НВР, розташований після N-кінцевого подовження, у відповідному культуральному середовищі в умовах, які дозволяють експресію НВР, і вилучення одержаного в результаті НВР з культурального середовища як подовженого на N-кінці НВР. N-кінцеве подовження може бути послідовністю, яка містить у собі приблизно від 5 до 25 амінокислотних залишків, зокрема від приблизно 8 до приблизно 15 амінокислотних залишків. Походження амінокислотних залишків в N-кінцевій послідовності вважають несуттєвим. Для підвищення вироблення розвинутого НВР, як правило, обирають послідовність ДНК, що кодує подовжений на N-кінці НВР, яка містить послідовність ДНК, що кодує сайт розщеплення протеази, розміщений між послідовністю ДНК, що кодує Nкінцеве подовження, та послідовністю ДНК, що кодує розвинутий НВР. Прикладами підходящого сайта розщеплення протеази є сайт розщеплення ентерокінази з амінокислотною послідовністю, сайт розщеплення фактора Ха з амінокислотною послідовністю. В альтернативному втіленні клітини-хазяїни, які містять ДНК, що кодує розвинутий НВР, якому передує сигнальна послідовність, культивують у відповідному культуральному середовищі в умовах, які дозволяють експресію НВР, і одержаний в результаті НВР вилучають із культурального середовища як розвинутий НВР. Процедури, зшивання нуклеїновокислотних послідовностей, які кодують НВР або подовжений на N-кінці НВР, рrо-НВР (сигнал + розвинутий НВР), промотор та термінатор відповідно, і введення їх у відповідні вектори, що містять інформацію, необхідну для реплікації, є добре відомими спеціалістам [пор., наприклад, Sambrook et al., op. dt]. Клітина-хазяїн (клітини-хазяїни), у яку(і) вводять вектор експресії, може бути будь-якою(ими) клітиною(ами), здатною(ими) виробляти НВР, і в оптимальному втіленні є еукаріотною(ими) клітиною(ами), наприклад, клітиною(ами) безхребетних (комах) або клітиною(ами) хребетних, наприклад, клітиною(ами) ссавців, зокрема клітиною(ами) Нуклеїновокислотна послідовність, яка кодує хребетних та ссавців. В оптимальному втіленні, 15 77385 16 клітина ссавця є клітиною, яка може бути культиодержання поліклональних антитіл анти-НВР завована в анаеробних умовах після трансфекції стосовують таку процедуру. Для вироблення антинуклеїновою кислотою, що кодує НВР ссавця. тіла шляхом ін'єкції НВР, в оптимальному втіленні Особлива перевага надається втіленню, де кліти- НВР людини, імунізують різних тварин-хазяїнів, у на ссавця є трансформованою(ими) аденовірусом тому числі, крім інших, кролів, мишей, щурів, кіз та клітиною(ами) або походить від ембріональної(их) ін. В одному з втілень НВР можуть бути кон'юговаклітини(клітин). Як було визначено авторами, кліні з імуногенним носієм, наприклад, альбуміном тина, яка походить від ембріональної клітини, є сироватки великої рогатої худоби (BSA) або гемоклітиною, одержаною від первинної культури ембціаніном молюсків виду Acmaea (KLH). Для посиріональних клітин, або клітина(и) з лінії клітин, яка лення імунологічної реакції, застосовують різні первісно походить від первинної культури ембріоімуностимулятори, залежно від виду хазяїнів, а нальних клітин. Прикладом такої трансформованої саме, крім інших, ад'ювант Фрейнда (повний і неаденовірусом клітини або похідної від ембріона повний), мінеральні гелі, такі як гідроксид алюміклітини є клітина(и) нирки ембріона людини (НЕК), нію, поверхнево-активні речовини, такі як лізолезокрема клітини НЕК 293. Клітина комахи може цитин, поверхнево-активні поліоли/поліаніони, бути, наприклад, клітиною лускокрилих або дропептиди, олійні емульсії, гемоціаніни молюсків зофіли. виду Астаеа, динітрофенол та потенційно корисні Способи трансфікування клітин ссавців та ексімуностимулятори людини, такі як BCG (бацила пресування послідовностей ДНК, введених в кліCalmette-Guerin) та Corynebacterium parvum. тини, описано, [наприклад, у роботах Kaufman and Для одержання моноклонального антитіла, яке Sharp, 1982, J. Моl. Biol. 159:601-621; Southern and зв'язується з принаймні одним епітопом НВР, зокBerg, 1982, J. Мо]. Appl. Genet. 1:327-341; Loyter et рема НВР людини, застосовують різні процедури, al., 1982, Proc. Natl, Acad. Sci. USA 79:422-426; причому вищезгаданий епітоп зв'язується з комWigler et al., 1978, Cell 14:725; Corsaro and плексом прекалікреїну-Н-кініногену й активує вивіPearson, 1981, Somatic Cell Genetics 7:603, Graham льнення брадикініну. В оптимальному втіленні and van der Eb, 1973, Virology 52:456; Fraley et al., моноклональне антитіло є моноклональним анти1980, JBC 225:10431; Capecchi, 1980, Cell 22:479; тілом людини. Може бути застосована будь-яка Wiberg et al., 1983, NAR 11:7287; і Neumann et al., технологія, яка забезпечує вироблення молекул 1982, EMBO J. 1:841-845]. Клітини комах трансфіантитіла безперервною лінією клітин у культурі. До кують вектором бакуловірусу, як описано [в патенті них, крім інших, належать гібридомний спосіб, США №4,745,051]. вперше розроблений [Kohler and Milstein (1975, Середовище для культивування клітин може Nature 256:495-497)], а також триомний спосіб, бути будь-яким традиційним середовищем, придагібридомний спосіб В-клітин людини [Kozboret al., тним для вирощування клітин ссавців, таким як 1983, Immunology Today 4:72], та EBV- гібридомсередовище, що містить або не містить сироватку і ний спосіб для утворення моноклонального антимістить відповідні додатки, або середовищем, тіла людини [Cole et al., 1985, Monoclonal придатним для вирощування клітин ссавців. Усі Antibodies and Cancer Therapy, Alan R. Liss, Inc., середовища, які можна придбати через торгову cc.77-96]. У додатковому втіленні винаходу монокмережу або одержати згідно з опублікованими лональні антитіла можуть вироблятися у трансрецептами (наприклад, у каталогах Американськогенних тваринах із застосуванням сучасних техного зібрання типових культур), є придатними. Клітилогій [PCT/US90/02545; Green, 1999, J. Immunol. ни відбираються на стійкість до антибіотиків. Після Methods 231:11-23 та пат. США №№5,625,126 та цього вибрані клони перевіряють на активність 5,633,425]. Згідно з винаходом, антитіла людини НВР, застосовуючи такі відомі спеціалістам спосоможуть бути використані та одержані шляхом заби, як хемотаксичний аналіз та аналіз вивільнення стосування гібридом людини [Cote et al. 1983, цитокінів з моноцитів [див., наприклад, Rasmussen Proc. Natl. Acad. Sci. U.S.A. 80:2026-2030] або пеet al., 1996, FEBS Lett. 390:109-112]. ретворенням В-клітин людини вірусом EBV in vitro HBP, що виробляється клітинами, потім вилу[Cole et al., 1985, Monoclonal Antibodies and Cancer чають із культурального середовища традиційниTherapy, Alan R Liss, cc.77-96]. ми способами, у тому числі відокремленням кліЗгідно з винаходом, описані технології виробтин-хазяїнів від середовища шляхом лення одноланцюгових антитіл [пат. США центрифугування або фільтрування, осадженням №4,946,778] можуть бути адаптовані для утворенбілкових компонентів спливаючого шару або фільня НВР-специфічних одноланцюгових антитіл. У трату за допомогою солі, наприклад, сульфату додатковому втіленні винаходу застосовують техамонію, очищенням з застосуванням різних хроманології, описані для конструювання Fab експресійтографічних процедур, наприклад, іонообмінної них бібліотек [Huse et al., 1989, Science 246:1275хроматографії, афінної хроматографії тощо. 1281], що дозволяють швидко й легко розпізнавати Якщо НВР є подовженим на N-кінці НВР, після моноклональні Fab фрагменти зі специфічністю до вилучення з культурального середовища подовНВР. жений на N-кінці НВР краще розщепити відповідФрагменти антитіл, які містять ідіотип молекуною протеазою для утворення розвинутого (і актили антитіла, можуть бути отримані відомими сповного) НВР. Прикладами відповідних ферментів є, собами. Наприклад, до таких фрагментів, крім інкрім інших, ентерокіназа та фактор Ха. ших, належать: фрагмент F(ab').sub.2, який можна Антагоністи HBP отримати шляхом розщеплення молекули антитіла Антагоністом HBP можуть бути як анти-НВР пепсином; фрагменти Fab', які можна одержати поліклональні, так і моноклональні антитіла. Для шляхом відновлення дисульфідних містків фраг 17 77385 18 мента F(ab').sub.2 та фрагментів Fab, які можна В альтернативному втіленні певні петлі моодержати шляхом обробки молекули антитіла пажуть бути піддані мутагенезу шляхом застосуванпаїном та відновлювальним агентом. ня дегенерованих олігонуклеотидів [Schier et al., При одержанні антитіл відбір потрібних антитіл 1996, Gene 169:147-153]. Синтетичні випадкові здійснюють відомими спеціалістам способами, олігонуклеотиди вводять у Kunitz-типу домен під наприклад, способом радіоімунного аналізу, ELISA час PCR, що комплектує бібліотеку з варіантами в (твердофазного імуносорбентного аналізу), багапевній петлі. тошарового імунологічного аналізу, імунорадіомеЗгідно з іншим підходом, бібліотеки можуть бутричних аналізів, гель-дифузійних реакцій преципіти укомплектовані через перетасовування ДНК тації, імунодифузійних аналізів, імунологічних [Stemmer et al., 1994, Nature 370:389-391]. Цей аналізів in situ (з застосуванням, наприклад, колоїспосіб застосовують для рекомбінації між гомолодного золота, ферментних або радіоізотопних мігічними Kunitz-типу доменами. Тобто, ДНК, що ток), вестерн-блотингу, реакцій осадження, аглюкодує кожен з варіантів, змішують і фрагментують тинаційних аналізів (наприклад, гельна дрібні частини. Ці частини потім повторно збиаглютинаційних аналізів, гемаглютинаційних анарають шляхом звичайної PCR реакції. Під час цієї лізів), аналізів фіксації комплементу, імунофлуореакції дрібні частини з'єднуються між собою, оскіресцентних аналізів, протеїн А-аналізів, імуноелельки вони комплементарні, що спричинює рекомктрофорезних аналізів тощо. В одному з втілень бінацію відповідних генів. зв'язування антитіла виявляють шляхом виявленСпособи виявлення ня мітки на первинному антитілі. В іншому втіленні Для виявлення антагоністів гепарин-зв'язаного первинне антитіло виявляють шляхом виявлення білка (НВР) потрібно визначити, чи зв'язується зв'язування вторинного антитіла або реагенту з речовина, яку вважають антагоністом НВР, з НВР, первинним антитілом. В іншому втіленні мітять з цією метою проводять (а) інкубацію НВР з первторинне антитіло. Спеціалістам відомо багато шою речовиною, що взаємодіє з НВР, та другою способів виявлення зв'язування в імунологічному речовиною, яку вважають антагоністом НВР, і (б) аналізі, і які охоплюються обсягом даного вивиявлення будь-якого впливу вищезгаданої другої находу. речовини, яку вважають антагоністом, на взаємоВ альтернативному втіленні бібліотеку антитіл дію HBP з вищезгаданою першою речовиною, анти-НВР комплектують способом вияву фагів причому зниження взаємодії НВР з першою речо[див., наприклад, Koscielska et al., 1998, Acta виною вказує на те, що друга речовина є антагоніBiochimica Polinica 45:705-720]. З бібліотеки відбистом НВР. рають найсильніші зв'язувальні компоненти, які НВР або перша речовина можуть бути мічевикористовують як антагоністи НВР. ними. Мітку переважно вибирають із групи забарвАнтагоніст НВР також може бути поліпептилених ферментів або флуоресцентних речовин, дом, який містить Kunitz-типу домен інгібітору серадіоактивних ізотопів та агентів, що утворюють ринової протеази, який зв'язується з НВР. Пептикомплекси. ди, які містять Kunitz-типу домени інгібітору Прикладами ферментів, які застосовують як серинової протеази, як правило, мають приблизно мічені речовини, є пероксидази (наприклад, перок60 залишків та шість розташованих на певній відссидаза хрону), фосфатази (наприклад, кисла або тані цистеїнів, присутніх у дисульфідних зв'язках. У лужна фосфатаза), В-галактозидаза, уреаза, глюконкретному втіленні, якщо НВР є НВР людини, то козооксидаза, карбоангідраза, ацетилхолінестераKunitz-типу інгібітор може бути апротиніном, який за, глюкоамілаза, лізозим, малатдегідрогеназа, також відомий як ВРТІ або його аналог, що зв'язуглюкоза-6-фосфатдегідрогеназа, b-глюкозидаза, ється з НВР. В оптимальному втіленні аналог аппротеази, піруватдекарбоксилаза, естерази, люротиніну має мутації у позиціях 12-19 та 34-39, цифераза тощо. перевага надається, якщо мутації у позиціях 15-19. Ферменти самі не можуть бути виявлені, вони Інші аналоги, які можуть бути застосовані, описано повинні бути у комбінації з субстратом для каталі[у патентах США №№5,162,498, 5,316,923, зації реакції, кінцевий продукт якої може бути ви5,395,922, 5,514,585, 5,510,249, 5,591,603, явлений. Прикладами субстратів, які застосовують 5,618,915, 5,621,074, 5,673,090, 5,618,696 та згідно зі способом за даним винаходом, є перекис 5,576,294]. У найхарактернішому втіленні мутаціяводню/тетраметилбензидин або хлорнафтол або ми є А16Н, K15А, І18М, I19S, R17T. о-фенілендіамін або 3-(р-гідроксифеніл) пропіоноВеликі бібліотеки (107-109) поліпептидів, які ва кислота або люмінол, індоксил фосфат, рвключають в себе Kunitz-типу домени, комплектунітрофенілфосфат, нітофеніл галактоза, 4-метил ють, застосовуючи різні підходи. Наприклад, підумбеліферил-D-галактопіранозид або люциферин. дана похибкам PCR [Saiki et al., 1988, Science В альтернативному втіленні мічена речовина 293:487-491] може бути застосована до кожного може містити забарвлені або флуоресцентні речоокремого Kunitz-типу домену. Ця процедура певини, у тому числі частинки золота, забарвлені або редбачає випадкове включення неправильного флуоресцентні латексні частинки, частинки барвнуклеотиду до гена кожного відповідного Kunitzника, флуоресцеїн, фікоеритрин або фікоціанін. типу домену шляхом здійснення PCR-реакції в Радіоактивні ізотопи, які застосовують з цією умовах, коли Taq-полімераза включає в себе неметою, вибирають з 125І, 131І,111Іn, 3Н, 32Р, 14С та 35 правильні нуклеотиди на етапі ампліфікації. БібліS. Радіоактивність, що випромінюється цими отеку можна виявити на фагових частинках для ізотопами, вимірюють гамма-лічильником або сцивідбору найкращого зв'язувального компонента нтиляційним лічильником відомим спеціалістам для НВР. способом. 19 77385 20 Агенти, що утворюють комплекси, які застосовідомими спеціалістам процедурами, наприклад, вують з цією метою, вибирають з біотину (який імунологічним аналізом. утворює комплекс з авідином або стрептавідином), В одному з втілень вкриваючий буфер містить авідину (який утворює комплекс з біотином), про0,05% Tween, 15,9мМ динатрійкарбонату, 35мМ теїну А (який утворює комплекс з імуноглобулінагідрокарбонату натрію, рН9,6. Додають Н-кініноген ми) та лектинів (які утворюють комплекс з вуглеі інкубують при 4°С протягом ночі. Вкриваючий водими рецепторами). Оскільки комплекс не може буфер видаляють і планшет промивають Tris бубути прямо виявлений, необхідно позначити речофером, рН7,4, що містить приблизно 50Μ цинку. вину, з якою цей агент утворює комплекс. Мічення Після цього додають прекалікреїн і суміш інкубує успішним з будь-якою з вищезгаданих мічених ють протягом 1год. при кімнатній температурі. Пісречовин для мічення ферменту. ля цього додають НВР у Tris буфері і зразки видаУ конкретному втіленні зв'язування антагоніста ляють з приблизно 10-хвилинними інтервалами НВР з НВР виявляють шляхом застосування, напротягом приблизно 1 години, починаючи приблиприклад, технології SPA від Amersham Pharmacia зно через 5 хвилин після додавання НВР і піддаBiotech. Тобто, біотиніловані плазматичні мембрають аналізу на вивільнення брадикініну. В одному ни з ендотеліальних клітин пупкової вени (HUVEC) з втілень вивільнення брадикініну аналізують з зв'язуються з кон'югованими стрептавідином PVT допомогою комплекту для ELISA-аналізу серійного SPA гранулами. Ці гранули одержують від виробництва (MARKIT-M Bradykin, Dainippon Amersham Pharmacia Biotech. До мембран додаPharmaceutical Co., Ltd.). У цьому аналізі здійснюють мічений кініноген людини (наприклад, 3Н, 125І), ють конкурентну реакцію брадикініну у зразку та доки сайти зв'язування з кініногеном не насичуміченого пероксидазою брадикініну з антитіла проються. НВР додають зі збільшенням концентрації ти ВК (кроля), захопленого антитілом IgG антидля витіснення міченого кініногену й вимірюють кроля (кози), що вкриває мікросмужкову лунку. зниження включення мітки. Будують стандартну Концентрацію брадикініну визначають за ферменкриву витіснення. Антагоніст НВР випробують на тною активністю міченого пероксидазою брадикініздатність інгібувати опосередковане НВР витісну, зв'язаного з антитілом анти- брадикініну. нення радіоактивного кініногену для плазматичних В альтернативному втіленні прекалікреїн та Нмембран. Зокрема, НВР інкубують з різними конкініноген додають в еквімолярній кількості до моцентраціями, до молярного надлишку антагоністів ношару ендотеліальних клітин і інкубують протяНВР, і визначають їх здатність інгібувати опосерегом 1год. при 37°С. Після цього додають НВР і дковане НВР витіснення міченого кініногену з зразки видаляють з приблизно 10-хвилинними мембран. інтервалами протягом приблизно 1 години, почиВ альтернативному втіленні антагоністи НВР наючи приблизно через 5 хвилин після додавання виявляють шляхом культивування ендотеліальних НВР, і проводять аналіз на вивільнення брадикініклітин за наявності НВР і за наявності та відсутнону, застосовуючи процедури, описані вище. сті речовини, яку вважають антагоністом. У конкУ іншому втіленні прекалікреїн та Н-кініноген ретному втіленні антагоністом є моноклональне додають в еквімолярній кількості до розчину плазантитіло, яке зв'язується з принаймні одним епітоми, що містить інгібітор АСЕ (ангіотензинпом НВР, в оптимальному варіанті - HBP людини, конвертуючого ферменту) і інкубують протягом причому вищезгаданий епітоп зв'язується з ком1год. при 37°С. Після цього додають НВР і зразки плексом прекалікреїну-Н-кініногену й активує вивівидаляють з приблизно 10-хвилинними інтервальнення брадикініну. В оптимальному втіленні лами протягом приблизно 1 години, починаючи моноклональне антитіло є моноклональним антиприблизно через 5 хвилин після додавання НВР, і тілом людини. В одному з втілень антитіло та НВР проводять аналіз на вивільнення брадикініну, заразом піддаються попередній інкубації перед інкустосовуючи процедури, описані вище. бацією з ендотеліальними клітинами протягом Способи лікування приблизно 10 хвилин при 37°С. Вплив речовини на Композиція згідно з даним винаходом містить функцію проникності ендотеліальних клітин визначастину водного розчину. Розчин в оптимальному чають шляхом вимірювання трансендотеліального варіанті має бути фізіологічно прийнятним, щоб електричного опору або визначення альбумінового після введення в організм пацієнта потрібної посзазору, як описано нижче у Прикладах. Знижена лідовності, розчин не призводив до побічної дії на функція проникності має свідчити, що речовина не електролітичний та об'ємний баланс пацієнта. Водіє як антагоніст НВР. дне середовище для композиції, таким чином, моУ конкретному втіленні зв'язування монокложе містити в собі, наприклад, нормальний фізіолонального антитіла з принаймні одним епітопом гічний розчин (0,9% NaCI, 0,15М), рН7-7,4 або інші НВР, коли вищезгаданий епітоп зв'язується з комйого фармацевтично прийнятні солі. Розчини для плексом прекалікреїну-Н-кініногену й активує вивізастосування готують будь-яким способом, добре льнення брадикініну, визначають шляхом інкубації відомих серед фармацевтів, описаних, [наприклад, антитіла з НВР та комплексом прекалікреїну-Ну роботі "Remington's Pharmaceutical Sciences", кініногену. Як більш детально описано у Прикла(Gennaro, Α., ed.), Mack Pub., 1990]. дах, НВР зв'язується з комплексом прекалікреїнуКонцентрація антагоніста HBP може бути різН-кініногену, таким чином, стимулюючи вивільненною, а саме приблизно від менше ніж 0,5%, наприня брадикініну. Моноклональне антитіло, яке зв'яклад, від 1% до 15-20% за масою. Одинична доза зується з принаймні одним епітопом НВР, має композиції, як правило, містить приблизно від 10мг знижувати вивільнення брадикініну або запобігати до 1г антагоніста НВР. Терапевтично ефективні йому. Аналіз вивільнення брадикініну здійснюють дози визначаються in vitro або in vivo. 21 77385 22 Антагоніст НВР вводять місцево, підшкірно креїну-Н-кініногену й активує вивільнення брадикіабо шляхом внутрішньовенної ін'єкції. Дозування ніну; (б) природний НВР людини та (в) комплекс призначається лікарем згідно з конкретним станом прекалікреїну-Н-кініногену, приєднаний до твердої конкретного пацієнта. Дозування та частоту ввеоснови. дення ретельно підбирають і врегульовують відПриклади повідно до параметрів, визначених лікарем. ОптиПриклад 1: Активовані нейтрофіли ініціюють мальним шляхом введення може бути, наприклад, зміни в ендотеліальній бар'єрній функції сигналівнутрішньочеревинна ін'єкція. Внутрішньовенні зуванням через β2 інтегрини внутрішньочеревинні ін'єкції антагоніста НВР здійМатеріали та способи снюють на 24-годинній основі доза відповідно стаРеагенти новить 0,1-100мг, краще - 0,5-50мг, ще краще - 1Середовище-199, RPMI-1640 (яке містить L25мг на 1кг маси тіла. Дозу вводять 1-4 рази на 24 глутамін), сироватку ембріона великої рогатої хугодини або вводять безперервно через катетер. В доби (FBS), трипсин-EDTA, фосфатну буферну сіл альтернативному втіленні лікування здійснюють (PBS) та збалансований соляний розчин Хенкса шляхом безперервного внутрішньовенного вли(HBSS) отримують від Life Technologies вання під час хірургічної операції з наступним піс(Gaithersburg, MD, USA). Желатин, колагеназу, ляопераційним лікуванням протягом 1-4 днів. пеніцилін, стрептоміцин, каталазу, альбуміном Антагоніст НВР вводять лише пацієнтам, які сироватки великої рогатої худоби (BSA), Nвиробляють НВР, який зв'язується з антагоністом форміл-метіоніл-лейцил-фенілаланін (fMLP), блаНВР. Для визначення, чи виробляє пацієнт такий китний барвник Еванса, гексадецилтриметиламоНВР, НВР виділяють із кров'яних пластинок пацієнійбромід та тетраметилбензидин отримують від нта, застосовуючи процедури, описані вище. Зв'яSigma Chemical Co. (St. Louis, MO, USA). H2O2 зування НВР з антагоністом НВР (наприклад, моотримують від Е. Merck (Darmstadt, Germany). ноклональним антитілом) або вплив НВР на Biomatrix І отримують від Biomedical Technologies функцію проникності ендотеліальних клітин виявInc. (Stoughton, MA, USA) і Dextran 70 (Macrodex) ляють з допомогою процедур, описаних вище, і та Ficoll-Paque отримують від Pharmacia Biotech порівнюють із впливом природного НВР. В альтеAB (Uppsala, Sweden). Основне культуральне сернативному втіленні вплив НВР на скорочення редовище містить 1:1 суміш С-199 та RPMI-1640 з ендотеліальних клітин або фібробластів чи агредодаванням 20% інактивованого нагріванням FBS, гацію моноцитів за наявності або відсутності антапеніциліну (100Од/мл) та стрептоміцину гоніста НВР також може бути визначений із засто(100мкг/мл). Моноклональне антитіло ІВ4 проти суванням процедур, [описаних у WO93/05396]. звичайного β-ланцюга (CD18) β2-інтегринів надано Знижена здатність до скорочення або агрегації Dr. Claes Lundberg, Pharmacia & Upjohn (Uppsala, клітин вказує на наявність взаємодії між НВР та Sweden) з люб'язного дозволу Dr. Samuel D. антагоністом НВР. Випробувальний комплект, який Wright, Rockefeller University, mAb 60,1, що розпізастосовують для визначення, чи виробляє пацізнає m-ланцюг інтегрину (CD11b) надано Dr. єнт такий НВР, включає в себе (а) антагоніст НВР; Manuel Patarroyo, Karolinska Institute, mAb DREG (б) НВР або клітину, що виробляє НВР, і (в) речо200 (анти-L-селектин) надано Dr. Eugene Butcher, вину, тканину, клітини або компонент, що взаємоStanford University, mAb SK11 (анти-L-селектин) діють із НВР. отримано від Becton Dickinson, (San Jose, CA) і У конкретному втіленні НВР чи клітини або mAb G44-26 (анти-CD44) отримано від PharMтканину, які виробляють НВР, виділяють з організingen (San Diego, CA). F(ab')2 фрагмент антитіла му пацієнта. НВР чи клітини або тканину, що вирокози анти-миші IgG надано Jackson бляють вищезгаданий НВР, інкубують з ендотеліImmunoResearch Laboratories, Inc. (West Grove, альними клітинами й визначають вплив на PA), FITC-кон'югований F(ab')2 фрагмент антитіла функцію проникності за наявності та відсутності кроля анти-миші IgG отримано від Dako A/S моноклонального антитіла, яке зв'язується з при(Glostrup, Denmark). наймні одним епітопом НВР, причому вищезгадаЕндотеліальні клітини ний епітоп зв'язується з комплексом прекалікреїнуЕндотеліальні клітини пупкової вени людини Н-кініногену й активує вивільнення брадикініну. (HUVEC) та ендотеліальні клітини аорти великої Цей вплив порівнюють із впливом природного НВР рогатої худоби (ВАЕС) виділяють і культивують, як людини. У конкретному втіленні природний НВР описано вище [Gautam et al., 1998, Brit. J. Pharm. людини може бути рекомбінантним НВР, який зв'я125:1109-1114]. HUVEC або ВАЕС першого-п'ятого зується з таким самим моноклональним антитілом. пропущення відокремлюють шляхом короткої В альтернативному втіленні НВР або клітини, або (2хв.) обробки трипсином-EDTA (0,25% трипсину / тканину, які виробляють НВР, інкубують за наяв0,01% EDTA) і наносять або на неорганічну мемності комплексу прекалікреїну-Н-кініногену та за брану Аnороrе з розміром пор 0,2мкм, або на полінаявності моноклонального антитіла. Визначають карбонатні фільтри з розміром пор 3,0мкм (вклювплив моноклонального антитіла на вивільнення чення тканинної культури, 10мм; NUNC, Roskilde, брадикініну. Зниження вивільнення брадикініну за Denmark). Для сприяння диференціації клітин та наявності антитіла вказує на те, що пацієнт виробпосилення з'єднання ендотеліальних клітин (EC) ляє НВР, який зв'язується з антитілом. За цих фільтри попередньо обробляють 50мА Biomatrix І умов випробувальний комплект має включати в (167Мг/мл) і висушують на повітрі. EC висівають з себе (а) моноклональне антитіло, яке зв'язується з густиною 2 105 клітин на фільтр і інкубують у кульпринаймні одним епітопом на НВР, причому вищетуральному середовищі при 37°С у зволоженій згаданий епітоп зв'язується з комплексом прекаліатмосфері 5% СО2 в повітрі. EC вирощують до 23 77385 24 конфлюентних моношарів, які можна виявити потім повертають у 4°С ще на 10хв., після чого шляхом щоденних спостережень під мікроскопом двічі промивають. PMN, які не піддають обробці та вимірювання електричного опору поперек моантитілом, одержують згідно з тим самим протоконошару [Gautam et al., 1998, Brit. J. Pharm, лом, застосовуючи носій замість антитіла. 125:1109-1114]. Зчеплення PMN з ЕС та трансендотеліальну Вимірювання бар'єрної функції EC міграцію кількісно визначають шляхом аналізу Для визначення спричинених стимуляцією PMN-специфічного ферменту мієлопероксидази змін у функції проникності EC застосовують два (МРО). Тобто, PMN розчиняють у 0,5% гексадецирізні підходи. Для вимірювання трансендотеліальлтриматиламонійброміді й центрифугують, ферного електричного опору (TEER) фільтрові вставки ментну активність у спливаючому шарі визначають з EC переносять до камери вимірювання опору спектрофотометрично за зміною оптичної густини [докладно див. у роботі Gautam et al., 1998, Brit. J. при 650нМ, яка відбувається в окисно-відновній Pharm. 125:1109-1114]. Камеру (нижнє/люмінальне реакції Н2О2-тетраметилбензидину, каталізованій відділення) з фільтровими вставками (верхМРО [Suzuki et al., 1983, Anal. Biochem. 132:345нє/люмінальне відділення), заповнену 2мл та 352]. МРО активність зчеплених і перенесених 400мкл культурального середовища відповідно PMN, відповідно, співвідносять із показником загапоміщують в інкубатор клітинних культур. Електльної кількості PMN, доданих до моношару ЕС. ричний опір поперек моношару ЕС вимірюють при Експериментальні процедури 37°С за допомогою електродів у кожному віддіПеред перенесенням фільтрових включень до ленні, розташованих у точній позиції відносно один камери вимірювання опору (яку тримають при до одного та до моношару. Результати електрич37°С) середовище у включенні та у камері заміного опору окремого моношару ЕС одержують нюють на свіже культуральне середовище (37°С) з шляхом віднімання опору відповідного фільтра, додаванням 10мМ Hepes. У деяких експериментах вкритого Biomatrix, виміряного перед висіванням моношар EC інкубують перед стимуляцією ендотеліальних клітин. 10мкг/мл Herbimycin А протягом 15хв. при 37°С і В окремих експериментах кон'югований з бладвічі промивають. PMN (2 106) з моноклональними китним барвником Еванса альбумін (ЕВА) застоантитілами, зв'язаними з молекулами поверхні совують як маркер макромолекулярної проникності клітин, або без них, додають у верхнє відділення моношарів EC. Перед стимуляцією ЕС культура(співвідношення РМІМ:ЕС=10:1) і залишають для льне середовище у верхньому відділенні замінюосадження на 10хв. на моношарі EC. Активацію ють середовищем, яке містить ЕВА (культуральне PMN спричинюють або fMLP (10-7Μ), який додають середовище, яке містить 4% BSA, змішаного з у нижнє відділення, або перехресною компоновблакитним барвником Еванса в остаточній конценкою молекул поверхні клітин вторинними фрагметрації 0,67мг/мл). Концентрацію ЕВА у зразках нтами IgG F(ab')2 кози-анти-миші. Тансендотеліарідини верхнього та нижнього відділення визначальний електричний опір вимірюють до і щохвилини ють спектрофотометрично шляхом вимірювання після початку стимуляції, доки не досягають фази оптичної густини при 620нМ (Titertek Multiskan плато у зміні опору, а потім з 5-хвилинними інтерMCC; Flow Laboratories, Solna, Sweden). Альбумівалами. В експериментах з дослідженням проникновий зазор розраховують за співвідношенням: ності альбуміну та міграції PMN крізь моношар EC V1=А2 V2 1/Α1, де V1 є об'ємом зазору (тобто, середовище у включенні було наявно ЕВА. Після теоретичним об'ємом люмінального середовища, перевірки імунності фільтрові вставки переносять очищеного від альбуміну шляхом дифузії з аблюз 5-10-хвилинними інтервалами до нових лунок, мінальним відділенням), V2 є аблюмінальним що містять свіже середовище. Інкубацію в усіх об'ємом, і А1 та А2 є оптичною густиною люмінавипадках здійснюють при 37°С. Наприкінці експельного та аблюмінального середовища відповідно. рименту нижні лунки центрифугують при 425г і 4°С Базовий зазор за відсутності будь-якого стимулу, в протягом 20хв. і надосадову рідину аналізують на середньому 0,08±0,03мкл/хв., віднімають від об'євміст ЕВА. Кількість PMN, що мігрувала крізь мому зазору, отриманого у відповідь на відповідний ношар, визначають шляхом аналізу МРОспецифічний подразник. активності гранул, що залишилися в лунці. Із сеОдержання й визначення кількості PMN редовища у фільтровому включенні відсмоктують PMN людини виділяють із багатої на лейкоцирідину для визначення кількості незчепленого ти плазми, як [описано в роботі Gautam et al., PMN і фільтрувальну, мембрану з ЕС видаляють із 1998, Brit. J. Pharm. 125:1109-1114], і ресуспендувставки для визначення кількості зчепленої фракють у культуральному середовищі при концентрації PMN. В окремих експериментах очищені PMN, попеції 2-5 107клітин/мл. Чистота ΡΜΝ становить редньо оброблені анти-CD 18 mAb ІВ4 (6мкг на >98%, і їх життєздатність при витісненні трипанового синього становить >95%. Перед додаванням 2 106 клітин) протягом 30хв., інкубують у культудо моношарів EC PMN інкубують протягом 30хв. з ральному середовищі з F(ab)2 кози-анти-миші або моноклональними антитілами проти молекул побез нього протягом 10хв. при 37°С. PMN осаджуверхні клітин для наступного зшивання з вторинють шляхом центрифугування при 300 г протягом ним mAb (див. експериментальні процедури). 15хв. при кімнатній температурі і вільний від клітин У деяких експериментах експресію клітинної спливаючий шар, що містить продукти секреції поверхні CD1 1b/CD 18 регулюють у підвищенням ΡΜΝ, декантують для використання в експериментемператури PMN перед застосуванням. PMN за ті in vivo (див. нижче) або з ЕС-моношарами. В наявності анти-CD 18 mAb IB4 інкубують при 4°С останніх умовах середовище у включенні протягом 10хв., переносять до 37°С на 10хв., а фільтр/ЕС замінюють на середовище, що містить 25 77385 26 секрецію PMN, і дані щодо впливу на TEER та невеликому збільшенні у флуоресцентному світлі проникність альбуміну записують, як описано виза допомогою мікроскопа Leitz Orthoplan і записуще. У деяких випадках середовище, що містить ють на відео. Після контрольних записів суперфусекрецію PMN, перед застосуванням інкубують за зію зупиняють і 1мл середовища, яке містить підвищеної температури (80°С протягом 15хв.). спричинену зшиванням CD18m секрецію PMN, при Визначення утворення внутрішньоклітинного 37°С місцево наносять на защічний мішок. У пара[Са2+]ЕС та f-актину лельних експериментах застосовують оброблене Чутливий до Са2+ флуоресцентний зонд fluoанти-GD18 середовище PMN, не піддане зши3/AM (Molecular Probes Europe BV, Leiden, The ванню. Netherlands) застосовують для визначення змін у Результати вільному внутрішньоклітинному Са2+ EC. КонфлюPMN (2 106), попередньо оброблені антиентні ВАЕС моношари на фільтрах інкубують проGD18 mAb (IB4), додають до EC/фільтрових вклютягом 30хв. при 37°С з fluo-3/AM (3мкМ у HBSS, що чень (люмінальний бік EC/верхнього відділення містить 2% FCS та 10мМ HEPES), який додають як камери опору) і дають відстоятися протягом 10хв. до апікальної, так і до базолатеральної поверхні. Зшивання CD18 з вторинним антитілом кози антиМоношари тричі промивають і інкубують зі свіжим миші F(ab)2 виявляло помітне зниження TEER, яке HBSS у темноті протягом 20хв. при кімнатній темвиявляється протягом 1хв., досягає свого максипературі для повного гідролізу естеру-барвника. муму (36±13 контролю) через 15хв. і залишається До EC додають оброблені анти-GDI 8 або анти-Lна своєму рівні протягом усього періоду спостереселектиновим mAb PMN і рецепторне зшивання ження (Фіг.1). Ні обробка PMN тільки одним ІВ4, ні стимулюють вторинним mAb, як описано вище. В обробка вторинним mАb без ІВ4 не викликали жоокремих експериментах застосовують секрецію дних змін у TEER. PMN, що містить середовище (див. вище) для Ефективність зшивання CD18 для збільшення стимуляції EC за відсутності PMN. Зміни в [Ca2+]i макромолекулярного потоку та міграції PMN крізь EC у відповідь на ці стимули вимірюють через моношар EC досліджують у додаткових експерибезперервну реєстрацію інтенсивності флуоресментах. PMN, попередньо оброблені насичувальценції за допомогою системи конфокальної візуаною концентрацією ІВ4, додають до лізації з лазерним скануванням (Insight Plus; EC/фільтрових включень і дають відстоятися проMeridian Instruments Inc., Okemon, Michigan). тягом 10хв. у середовищі, що містить ЕВА. ЗшиДля аналізу утворення f-актину в EC у відповання CD18 так само виникає внаслідок дії антитівідь на активацію PMN конфлюентні моношари ла кози анти-миші F(ab)2, і PMN/EBA, що містить EC, які вирощували на вкритому Biomatrix склі, фільтрові вставки, які переносять з однаковими інкубують протягом 15хв. при 37°С або з PMN, інтервалами до нових лунок зі свіжим середовипідданих зшиванню з антитілом CD18, або з секщем. За відсутності вторинного антитіла, існує рецією PMN, що містить середовище, ідентичне незначний незмінний зазор альбуміну, застосовуваному для вищеописаних процедур. 0,08±0,03мклхв-1 (сер.±SD, n=13), що не змінювавІнкубація EC з обробленими ІВ4 PMN служить як ся з часом і точно відповідав спонтанному діапаконтроль. Моношари фіксують у 3,7% формальдезону, який виявляли у фільтрових вставках, що гіді в PBS протягом 10хв. при кімнатній температумістять необроблені ΡΜΝ. І навпаки, активація рі, двічі промивають і пермеабілізують 0,2% Triton ΡΜΝ шляхом зшивання CD18 призводила до збіX-100 у PBS (1хв. при 4°С). Клітини двічі промивальшення альбумінового зазору, яке дедалі зростають і забарвлюють на виявлення акти нових елело з часом (Фіг.1). Чисте збільшення альбуміновоментарних волокон FITC-кон'югованим фалоїдиго зазору зростало з 0,5±0,1мкл під час першого 5ном протягом 20хв. при 37°С. Після трьох хвилинного періоду до загального показника додаткових промивань ендотеліальні клітини спо20,0±4,5мкл (сер.±SD, n=10) за 60хв. На відміну від стерігають у системі конфокальної візуалізації з збільшення альбумінового зазору, зшивання CD18 лазерним скануванням (Insight Plus; Meridian не призвело до помітного зчеплення ΡΜΝ з EC або Instruments Inc., Okemon, Michigan). трансендотеліальної міграції (Фіг.1). З допомогою In vivo експерименти аналізу активності МРО у різних відділеннях через Для дослідження впливу продуктів секреції 60хв. після зшивання CD18 було виявлено, що PMN на мікросудинну проникність in vivo застосо91±6% (сер.±SD, n=9) доданих PMN відновлюютьвують інтравітальну мікроскопію мікроциркуляції ся у середовищі, зібраному з верхнього відділензащічного мішка хом'яка. Як описано детально ня, тоді як у EC/фільтрі або у середовищі нижнього вище [Raud & Lindbom, 1994, Immunology of the відділення значної активності МРО не було виявMicrocirculation, Academic Press, 1994, розд. 7], лено. Дані безпосереднього мікроскопічного сполівий защічний мішок сирійських золотих хом'яків стереження прозорих фільтрів, які промивають під анестезії вивертають готують до мікроскопічнаприкінці експерименту, підтверджували відсутних спостережень в умовах безперервної суперність PMN, зчеплених з моношаром ЕС. фузії бікарбонатного буфера з підтриманням фізіМоношари ендотеліальних клітин мітять чут2+ ологічного рівня температури, рН та газової ливим до Са флуорофором fluo-3, і зміни, спринапруги. FITC-кон'югований декстран (Мол. маса: чинені стимулом в EC [Ca+]i, спостерігали шляхом 150,000), введений шляхом внутрішньовенної ін'єконфокальної мікроскопічної візуалізації з лазеркції (250мг/кг маси тіла) застосовують як плазмоним скануванням. Додавання оброблених антивий трасер, що забезпечує візуалізацію змін у проСD18 PMN до моношару ЕС не викликало ніяких никності судин для макромолекул. Мікросудини у змін у [Са2+] ЕС. Однак зшивання CD18 з вторинвідкритому защічному мішку спостерігають при ним mAb виявляло швидке збільшення цитозольно 27 77385 28 вільного [Са2+] EC, яке досягало піку через прибведе до проступания плазми та утворення набрялизно 100с, а потім повільно знижувалося. Зшику. Результати вищеописаних експериментів свідвання антитіла L-селектину рівноцінним способом чать про причинний зв'язок між трансмембранним не викликало ніяких змін [Са2+] EC, тоді як реакція (ззовні всередину) сигналом з боку β2 інтегринів в Са2+, подібна до тієї, що викликається зшиванням активованих ΡΜΝ та здатністю цих клітин викликаCD18, спостерігається після стимуляції необробти бар'єрну дисфункцію ЕС. Було виявлено, що лених PMN fMLP [пор. Gautam et al., 1998, Brit. J. викликане антитілом зшивання та утворення груп Pharmacol. 125:1109-1114]. Про причинний зв'язок β2 інтегринів призводить до збільшення проникноміж змінами внутрішньоклітинної активності Са2+ сті ЕС на зразок того, що спостерігається після та функціональною реакцією ЕС на активацію стимуляції ΡΜΝ хемоатрактантом. Це клітинне PMN свідчать експерименти, в яких ендотеліальні перехрещування відбувається за відсутності фізиклітини попередньо обробляють кальцієвим комчного зв'язування ΡΜΝ з ЕС, що свідчить про те, плексоном ВАРТА AM. Ця обробка повністю інгібущо саме зчеплення ΡΜΝ та сам структурний зв'явала як збільшення вільного внутрішньоклітинного зок прямо не передають сигнали на ЕС, якими Са2+ ЕС, так і зміни у TEER у відповідь на зшиванопосередковується проникність. Скоріше, лігандне ня CD18. зв'язування β2 інтегрину спричинює внутрішньокВ інших експериментах моношари EC інкубулітинними сигнальними каскадами ΡΜΝ секреторні ють з PMN, а потім забарвлюють на виявлення події та вивільнення хімічного посередника, який актинових елементарних волокон FITCадаптує залежні від ΡΜΝ зміни у проникності ЕС. кон'югованим фалоїдином. Конфокальна мікроскоКрім того, було продемонстровано, що зміна у пічна візуалізація з лазерним скануванням виявпроникності судин, викликана таким чином, є насляла, що ендотеліальні клітини, інкубовані з обролідком активної залежної від тирозинкінази реакції бленим ІВ4 PMN за відсутності вторинного ЕС, включаючи цитоскелетну реорганізацію та антитіла виявляли кілька напружених волокон та оборотне утворення міжклітинного розриву, що тонку смугу актину уздовж країв клітин у прямому свідчить про нелітичну функцію в цьому відношенконтакті з сусідньою клітиною. З другого боку, енні похідного(их) від ΡΜΝ фактора(ів). дотеліальні клітини, інкубовані PMN та зшиті Для більш детального дослідження механізCD18, виявляли помітне збільшення вмісту fмів, завдяки яким активовані ΡΜΝ можуть передаактину, а також кількості та густини напружених вати сигнали на ЕС, у цьому процесі моделюють волокон. взаємодію PMN/EC та залежну від зчеплення Щоб дослідити, чи регулює(ють) фактор(и), які участь β2 інтегринів через зшивання антитіла виділяються PMN, реакцію, яка зрештою веде до CD11/CD18. Можливість зшивання антитіл β2 інте6 гринів з шунтуванням викликаної хемоатрактантом збільшення проникності EC, PMN (2 10 ), попереклітинної активації демонструє, що залучення та дньо оброблені анти-СD18 mAb IB4 і промиті для утворення груп рецепторів β2 інтегрину як таке видалення незв'язаного антитіла, інкубують з анчерез внутрішньоклітинні сигнали призводять до титілом кози анти-миші F(ab')2 протягом 30хв., а збільшення проникності ЕС. Оскільки ця реакція потім піддають легкому центрифугуванню. Додавідбувалася незалежно від зчеплення ΡΜΝ з ЕС, вання вільного від клітин спливаючого шару до передача сигналів між ΡΜΝ та ЕС не може поясмоношару ЕС виявляло зниження TEER та збільнюватися взаємодією CD11/CD18 з контррецептошення альбумінового зазору на ту саму величину з рами на поверхні ЕС, а скоріше має відбуватися тим самим часовим інтервалом, що й після зшичерез вивільнення похідної від PMN молекуливання CD8 у PMN, доданих до ЕС. Спливаючий посередника. Такий механізм також підтверджушар також викликав зміни в ЕС[Са2+], та вмісті і ється здатністю до викликання гіперпроникності розподілі f-актину. Крім того, місцеве нанесення EC вільного від клітин спливаючого шару, якої доспливаючого шару з вмістом секреції PMN на засягають після зшивання CD18 у суспензії PMN. щічний мішок хом'яка in vivo виявляло негайне Приклад 2: Розпізнання похідного від нейтровитікання плазми з посткапілярних та малих венул. філів HBP (HBP) як сигнальної ланки у викликаноМісця витікання проявляються уже через 1,5хв. му нейтрофілами витіканні плазми судин після нанесення, а максимальна реакція виявляУ Прикладі 1 зчеплення PMN через β2 інтегрин лася приблизно через 5 хв. Після промивання ткає попередньою умовою для спричиненого ΡΜΝ нин буфером протікання повільно зменшувалося. впливу на проникність ендотеліальних клітин та Цей вплив на функцію проникності мікросудин знитого, що залежний від Са2+ трансмембранний сигкав після термічної обробки похідної від PMN секнал через зчеплення активованого β2 інтегрину реції, що свідчить про те, що збільшення прониквикликає секрецію розчинного(их) фактора(ів), які ності пояснюється термочутливим(и) прямо безпосередньо діють на зміни у бар'єрній фактором(ами). Нанесення на защічний мішок функції EC. спливаючого шару оброблених ІВ4 PMN, не піддаЯк описано нами у Прикладі 2, розчинний факних зшиванню, не призводило до помітного витітор визначають як НВР людини. Приклад 2 також кання плазми. характеризує взаємодію НВР з системою контактОбговорення ної фази. Зчеплення поліморфно-клітинних лейкоцитів з Матеріали та способи ендотеліальним шаром та залучення до позасуРеагенти динної тканини при гострому запаленні значною Середовище-199, RPMI-1640 (що містить Lмірою залежить від функції β-2 інтегринів. Збільглутамін), сироватку ембріона великої рогатої хушення проникності судин для макромолекул стидоби (FBS), трипсин-EDTA, фосфатну буферну мулюють у зв'язку з цією клітинною реакцією, що 29 77385 30 сіль (PBS) та збалансований соляний розчин Хенконфлюентності (3-5 днів). В експериментах закса (HBSS) отримують від Life Technologies стосовують HUVEC або ВАЕС першого-п'ятого (Gaithersburg, MD, США). Желатин, колагеназу, пропущення. Розпізнання та визначення чистоти пеніцилін, стрептоміцин, альбумін сироватки велиЕС основані на морфології булижника та характекої рогатої худоби (BSA), блакитний барвник Еванристики за фактором VIII /vWf-антигеном [Booyse са та FITC-кон'югований фалоїдин отримано від et al., 1975, Thromb. Diath. Haemmorrh. 24:825-839]. Sigma Chemical Co. (St. Louis, MO, USA). Fluo-3/AM Забарвлення на фактор VIII/vWf-фактор у клітинах отримано від Molecular Probes (Eugene, OR, USA). є гомогенним. Biomatrix I отримано від Biomedical Technologies Висівання на проникні мембрани Inc. (Stoughton, MA, USA). Dextran 70 (Macrodex) та Культивовані EC відокремлюють шляхом коFicoll-Paque отримано від Pharmacia Biotech AB роткої (2хв.) обробки трипсином-EDTA (0,25% три(Uppsala, Sweden). Основне культуральне середопсину/0,01% EDTA) і наносять або на неорганічну вище містить в собі 1:1 суміш С-199 та RPMI-1640 мембрану Аnороrе з розміром пор 0,2мкм, або на з додаванням 20% інактивованого нагріванням полікарбонатні фільтри з розміром пор 3,0мкм FBS, пеніциліну (100Од/мл) та стрептоміцину (включення тканинної культури, 10мм; NUNC, (100мкг/мл). Моноклональне антитіло ІВ4 проти Roskilde, Denmark). Для сприяння диференціації звичайного β-ланцюга (CD18) β2-інтегринів надано клітин та посиленню приєднання EC фільтри обDr. Claes Lundberg, Pharmacia & Upjohn (Uppsala, робляють 50мкл Biomatrix I (167мкг/мл) і залишаSweden) з люб'язного дозволу Dr. Samuel D. ють для просушування на повітрі. EC висівають з Wright, Rockefeller University. F(ab')2 фрагмент кози густиною 2 105 клітин на фільтр і інкубують у кульанти-миші IgG одержано від Jackson туральному середовищі при 37°С у зволоженій ImmunoResearch Laboratories, Inc. (West Grove, атмосфері 5% СО2 у повітрі. EC вирощують до PA). конфлюентних моношарів, які можна виявити Поліклональні антитіла до HBP одержують згішляхом щоденних спостережень під мікроскопом дно з такою процедурою. Новозеландським білим та вимірювань електричного опору поперек мокролям роблять підшкірні ін'єкції 50мкг гепаринношару. зв'язаного білка людини (НВР), емульгованого у Вимірювання трансендотеліального електричповному імуностимуляторі Фрейнда (FCA), після ного опору (TEER) чого здійснюють три посилені ін'єкції 50мкг НВР Для вимірювання електричного опору поперек людини, емульгованого в неповному ад'юванті моношару ЕС фільтрові вставки переносять до Фрейнда (FIA), кожні два тижні. Через десять днів камери вимірювання опору (ENDOHM-12; World після останньої ін'єкції у тварин беруть кров і відоPrecision Instruments, Sarasota, FL, USA), видозмікремлюють сироватку. неної з метою забезпечення точного розташуванМоноклональні антитіла до НВР одержують ня електродів відносно один до одного та фільтзгідно з такою процедурою. RBF мишей імунізують рових включень під час багаторазових шляхом підшкірної ін'єкції 20мкг очищеного НВР вимірювань. Камеру (нижнє відділення) та фільтлюдини у FCA, після чого здійснюють дві ін'єкції рові вставки (верхнє відділення) заповнюють 2мл 20мкг НВР людини у FIA. Мишам з високим ступета 400мкл культурального середовища відповідно. нем реакції роблять посилену внутрішньовенну Усі вимірювання здійснюють при 37°С за допомоін'єкцію 20мкг НВР і через три дні видаляють селегою обладнання, розташованого в інкубаторі клізінку. Клітини селезінки зливають із лінією клітин тинних культур. Безпосередні показники електричмієломи Fox. Спливаючі шари відбирають на виного опору отримують від омметра (EVOM; World роблення антитіла проти НВР шляхом НВРPrecision Instruments, Sarasota, FL, USA), сполучеспецифічного аналізу ELISA. Позитивні лінії відбиного з електродами камери опору. Електричний рають для зв'язування з внутрішньоклітинною часопір окремих моношарів EC отримують шляхом тиною лінії макрофагів за допомогою стандартних віднімання опору відповідного фільтра, вкритого способів FACS. Позитивні лінії клонують і піддають Biomatrix, виміряного перед висіванням ендотеліаповторному випробуванню в обох аналізах. Монольних клітин. клональні антитіла очищують шляхом протеїн ΑВизначення альбумінового зазору афінної хроматографії. Кон'югований з блакитним барвником Еванса Ендотеліальні клітини альбумін (ЕВА) застосовують як маркер макромоЕндотеліальні клітини пупкової вени людини лекулярної проникності моношарів EC. Барвник в (HUVEC) виділяють із свіжих пуповин, як описано остаточній концентрації 0,67мг/мл змішують із ку[у роботі Jaffe et al., 1973, J. Clin. Invest. 52:2745льтуральним середовищем, яке містить 4% BSA. В 2756], а ендотеліальні клітини аорти великої рогаекспериментах, у яких аналізують проникність для тої худоби (ВАЕС) виділяють згідно зі способом, альбуміну, культуральне середовище у верхньому описаним [у роботі Booyse et al., 1975, Thromb. відділенні змінюють на середовище, яке містить Diath. Haemmorrh. 24:825-839], з деякими змінами. ЕВА. Концентрацію ЕВА у рідких зразках верхньоТобто, люмен пупкової вени або аорти великої го та нижнього відділення визначають спектрофорогатої худоби інкубують з 0,25% розчином колатометрично вимірюванням оптичної густини при генази протягом 10хв. і відокремлені ендотеліальні 620нМ (Titertek Multiskan MCC; Flow Laboratories, клітини вимивають із PBS. Зібрані клітини грануSolna, Sweden). Альбуміновий зазор розраховують люють і ресуспендують у культуральному середоза співвідношенням: V1=А2 V2 1/Α1, де V1 є вищі, висівають у колби з культурою тканин і інкуоб'ємом зазору (тобто, теоретичним об'ємом апібують за стандартних умов. Середовище кального середовища, очищеного від альбуміну змінюють кожні 48год., доки культури не досягають шляхом дифузії з базолатеральним відділенням), 31 77385 32 V2 є базолатеральним об'ємом, і А1 та А2 є оптитих Biomatrix І фільтрах, інкубують з розчином чною густиною апікального та базолатерального Fluo-3/AM (3мкм у HBSS, що містить 2% FCS та середовища відповідно. Базовий зазор за відсут10мМ HEPES), який додають до апікальної та баності будь-якого стимулу, в середньому золатеральної поверхні, протягом 30хв. при 37°С. 0,08±0,01мкл/хв., віднімають від об'єму зазору, Моношари перед застосуванням тричі промивають отриманого у відповідь на відповідний специфічі інкубують зі свіжим HBSS у темному місці протяний подразник. гом 20хв. при кімнатній температурі для повного Виділення та активація PMN гідролізу естеру-барвника до його чутливої до каБагату на лейкоцити плазму, видобуту з сульцію вільнокислотної форми. EC стимулюють цільної крові людини шляхом осадження декстраНВР, який додають до апікальної поверхні. Зміни ном, обережно вкладають шарами на Ficoll-Paque і [Са2+]i ЕС у відповідь на стимуляцію НВР вимірюцентрифугують при 400г протягом 30хв. Гранули, ють безперервною реєстрацією інтенсивності що містять PMN ресуспендують і двічі промивають флуоресценції за допомогою системи конфокаль(400г 7хв.) у льодяному PBS. PMN ресуспендують ної візуалізації з лазерним скануванням (Insight у культуральному середовищі в остаточній концеPlus; Meridian Instruments Inc., Okemon, Michigan). Для аналізу розподілу F-актину в EC у відпонтрації 2-5 106 клітин/мл. Чистота ΡΜΝ становить відь на стимуляцію НВР конфлюентні моношари >98%, а життєздатність за витісненням трипановоEC, які вирощували на вкритому Biomatrix склі, го синього становить >95%, інкубують з НВР або самим носієм при 37°С протяЗшивання антитіла молекул CD18 на поверхні гом 15хв. Моношари двічі промивають у культуранейтрофілів стимулюють, як описано вище. Тобто, льному середовищі й фіксують у 3,7% формальдеочищені ΡΜΝ (5 106/мл) інкубують з анти-СО18 гіді у PBS протягом 10хв. при кімнатній mAb IB4, 10мкг/мл у HBSS протягом 30хв. Під час температурі. EC пермеабілізують 0,2% Triton Хінкубаційного періоду клітини піддають різкій зміні 100 у PBS (1хв. при 4°С), двічі промивають і забатемператури з 4° до 37° С для збільшення поверхрвлюють на виявлення актинових елементарних невої експресії CD11/CD18. Клітини двічі промиволокон FITC-кон'югованим фалоїдином протягом вають і здійснюють зшивання CD18 шляхом дода20хв. при 37°С. Ендотеліальні клітини знову тричі вання фрагментів F(ab')2 кози анти-миші IgG промивають у PBS і візуалізують за допомогою (розведення 1:20). PMN осаджують шляхом конфокального мікроскопа з лазерним скануцентрифугування при 300г протягом 15хв. при кімванням. натній температурі і вільний від клітин спливаючий Вестерн-блотинг шар збирають. В окремих експериментах зшиванЗразок очищеного НВР або секреції PMN доня антитіла CD18 стимулюють після додавання до дають до SDS буфера для зразка і варять протямоношарів EC PMN попередньо інкубованих з mAb гом 5хв. Електрофорез здійснюють, наносячи зраIB4 (див. нижче). зки на SDS поліакриламідні градієнтні гелі (3-10%). Експериментальні процедури Білки шляхом електрофорезу переносять на нітПеред перенесенням фільтрових вставок до роцелюлозну мембрану (Bio-Rad Laboratories, камери вимірювання опору (яку тримають при Richmond, CA) для імуноблот-аналізу. Додаткові 37°С) середовище у вставці та у камері замінюють сайти зв'язування блокують шляхом інкубації нітсвіжим культуральним середовищем (37°С) з дороцелюлозної мембрани протягом 2год. у молоці. даванням 10мМ Hepes. HBP (25-100мкг/мл) або НВР виявляють, застосовуючи вестерн-блотинг. продукт секреції PMN додають або у верхнє, або у Результати нижнє відділення і зміни трансендотеліального Активовані PMN вивільнюють НВР електричного опору вимірюють щохвилини, доки PMN у суспензії активуються через зшивання не буде досягнуто фази плато, а після цього - з 5антитіл CD18. PMN центрифугують, спливаючий хвилинними інтервалами. В окремих експерименшар збирають і подають на SDS-PAGE. Вестернтах PMN (2 106) попередньо інкубовані з mAb IB4 блотинг із застосуванням антитіл, спрямованих (10мкг/мл), додають у верхнє відділення (співвідпроти НВР, дозволяє розпізнати помітну смугу ношення PMN:EC=10:1) і залишають для оса27kD у секреції PMN. Особливих смуг у контрольдження на 10хв. Активацію PMN стимулюють ченому IgG кроля виявлено не було. рез зшивання антитіла лейкоцитарного CD18 НВР збільшує проникність моношарів EC шляхом додавання кози анти-миші IgG F(ab')2, роДодавання НВР (75мкг/мл) у верхнє відділення зведеного у співвідношенні 1:20. В експериментах, викликало помітне зниження трансендотельальноу яких досліджують проникність для альбуміну го опору, що виявляє себе протягом однієї хвилипоперек моношару ЕС, середовище у вставці місни, досягає свого максимуму (30%±3% від контротило ЕВА. Під час експерименту фільтрові вставки лю) через 15хв. і залишається незмінним протягом переміщують з 5-10-хвилинними інтервалами до усього періоду спостереження (Фігура 2). Перевірнових лунок, що містять свіже середовище. Інкука імунності НВР також викликала збільшення мабацію в усіх випадках здійснюють при 37°С. Після кромолекулярної проникності EC, що відображаексперименту середовище у нижніх лунках відсмоється у поступовому збільшенні альбумінового ктували й піддавали аналізу на вміст ЕВА. зазору, яке дає чистий об'єм зазору 20,4±3,4мкл за Визначення внутрішньоклітинне Са2+ ЕС та період 60хв. (Фіг.2). Реакція ЕС на стимуляцію розподілу F-актину НВР явно залежить від дози, що підтверджується Для визначення змін у внутрішньоклітинному не так чітко виявленим зменшенням TEER у стійвільному Са2+ ЕС застосовують чутливий до Са2+ кому стані з НВР 25 та 50мкг/мл (Фіг.2). Однак флуоресцентний зонд fluo-3/AM. Конфлюентні мошвидкість змін, при яких відбувається реакція, є ношари HUVEC або ВАЕС, культивовані на вкри 33 77385 34 однаковою для всіх доз НВР. щину та розрив периферичних смуг, свідчить про Стимуляція EC НВР з базолатерального боку реорганізацію цитоскелета EC як наслідок стимумоношару (НВР додавали у нижнє відділення) ляції НВР. викликала такі самі зміни у проникності ЕС, що й НВР збільшує проникність судин in vivo апікальна стимуляція, однак при дещо вищих конМісцеве нанесення НВР (75мкг/мл) на мікроцентраціях. судини защічного мішка хом'яка за 2хв. призводить Нейтралізація НВР послаблює викликане до утворення видимих місць витікання флуоресPMN4 збільшення проникності ЕС центної мітки і з посткапілярних, і з великих венул. Очищений IgG антисироватки кроля проти Максимальне витікання спостерігають через 7НВР застосовують для нейтралізації активності 10хв. після перевірки імунності. Після цього витібілка. Додавання антитіл НВР (50мкг/мл) до мокання повільно знижується й повністю зникає за ношару ЕС перед стимуляцією НВР (75мкг/мл) 30хв. помітно послаблювало викликані зміни у TEER та Інгібування викликаного брадикініном та НВР макромолекулярній проникності. Зміни у TEER збільшення проникності EC моноклональним антивідбувалися з певною затримкою й досягали тілом МВKЗ до брадикініну 75%±5% від контролю (Фіг.3), що свідчило про Брадикінін (100нМ; Фіг.5а) або НВР (75мкг/мл; інгібування викликаної НВР реакції приблизно на Фіг.5б) вводять на початку відліку часу з люміна65%. Подібним чином, витікання альбуміну інгібульного боку моношарів EC, попередньо інкубовається приблизно на 60% до чистого об'єму зазору них з моноклональним антитілом до брадикініну, 8,64±1,74мкл за 60хв. (Фіг.3). Обробка неспецифіМВKЗ (40мкг/мл) [Haasemann et al., 1991, J. чним IgG кроля (50мкг/мл) не має впливу на виImmunol. 147:3882-3892]. МВKЗ повністю запобігає кликане НВР зниження TEER, що досягає 31%±5% збільшенню проникності EC, викликаному брадиківід контролю за 15хв. ніном або НВР. Специфічність впливу mAb підтвеРобиться визначення, чи можуть антитіла прорджується відсутністю інгібування викликаних гісти НВР мати інгібіторну дію також на зміни у бар'єтаміном змін у проникності (гістамін вводили через рній функції EC, викликаній активованими PMN. 15хв. після стимуляції брадикініном або HBP), N=6. PMN у суспензії активують через зшивання антитіл Інгібування викликаного НВР збільшення проCD18 лейкоцитів і центрифугують. Спливаючий никності ЕС моноклональним антитілом РKН4 до шар, який містить продукти секреції PMN (див. калікреїну плазми Матеріали та способи) переносять до моношару НВР (75мкг/мл; заштриховані символи) або ЕС. За наявності антитіл проти НВР зниження у брадикінін (100нМ; незаштриховані символи) ввоTEER та збільшення у макромолекулярній проникдять на початку відліку часу з люмінального боку ності помітно стримувалися порівняно з реакцією моношарів ЕС, попередньо інкубованих mAb PKH4 на стимуляцію секрецією PMN за відсутності анти(40мкг/мл). Результати показано на Фіг.6. РКН4 тіла проти НВР (Фіг.4). Майже ідентичний ефект запобігали збільшенню проникності EC, викликаспостерігають, коли зшивання антитіла CD18 стиному НВР, але не викликаному брадикініном. Обмулюють після додавання PMN до моношару ЕС, робка РКН4 не впливала на зміну проникності, а отже, досягнення продукту секреції PMN моновикликану гістаміном (гістамін вводять через 15хв. шару ЕС. після стимуляції НВР), N=6. Стимуляція НВР збільшує внутрішньоклітинІнгібування викликаного НВР збільшення проний вільний Са2+ ЕС никності EC шляхом обробки НКН20-пептидом Для визначення, чи реагує ЕС на стимуляцію Моношари EC інкубують з НКН20 (3мкг/мл) НВР збільшенням цитозольного Са2+, застосовупротягом 30хв., видаляючи таким чином поверхють конфокальну мікроскопічну візуалізацію з ланево зв'язаний Н-кініноген. Після промивання на зерним скануванням. Додавання НВР (75мкг/мл) початку відліку часу з люмінального боку EC вводо конфлюентних моношарів HUVEC або ВАЕС, дять НВР (75мкг/мл), після чого через 15хв. ввозаряджених чутливим до Са2+ флуорофорним fluoдять брадикінін (100нМ). НК закріплюється на по3/AM, викликало швидке збільшення інтенсивності верхні EC через домен 5 та 6, причому домен 5 є флуоресценції, яка досягав піку протягом 1хв., а найважливішим. Мінімальну амінокислотну посліпотім поступово знижувалася до базового рівня. довність, яка необхідна для зв'язування НК людиЦя мобілізація внутрішньоклітинного Са2+ чітко ни у домені 5 з EC, представлено пептидом з 20 вказує на активну реакцію ЕС на стимуляцію НВР. амінокислот (НКН 20) з такою послідовністю: Стимуляція НВР викликає реорганізацію мікHKHGHGHHKKNKGKKNGKH (SEQ ID NO:7) (Нрофіламентів EC кініноген 479-498 людини). Цей пептид інгібує приКонфлюентні моношари EC, інкубовані з НВР єднання НК до EC [Hasan et al., 1995, J. Biol. (75мкг/мл) або лише культуральним середовищем Chem. 270:19256-19261 та Herwald et al., 1996, J. протягом 15хв., забарвлюють на виявлення актиBiol. Chem. 271:13040-13047]. Результати показано нових елементарних волокон FITC-кон'югованим на Фіг.7. Обробка НКН20 EC дозволяла запобігти фалоїдином і візуалізують за допомогою конфокавикликаному НВР збільшенню проникності EC, але льної мікроскопії з лазерним скануванням. Порівне зміні проникності, викликаній наступним ввеняно з необробленим EC, що виявляє F-актинові денням брадикініну, N=6. напружені волокна низької густини та чіткі компакІнгібування викликаного НВР збільшення протні периферичні смуги уздовж країв клітини, існуникності EC шляхом обробки SDD31-пептидом ють суттєві зміни у вмісті F-актину та розподілі у Моношари EC інкубують з SDD31 (3мкг/мл) стимульованих HBP EC. Збільшення густини Fпротягом 30хв. SDD31, який також називають актинових напружених волокон, які стягують тріНK31, є пептидом, що походить від домену 6 Н 35 77385 36 кініногену людини НК, який блокує зв'язування НК чи технологію PCR з перекриттям [Ho, S. Ν., Hunt, з калікреїном плазми та фактором XII [Tait et al., Η. D., Horton, R. Μ., Pullen, J. K., and Pease, L R. 1986, J. Biol. Chem. 261:15396-15401 та Vogel et (1989) Gene (Amst.)77: 51-59]. Шляхом PCR отриal., 1990, J. Biol. Chem. 265:12494-12502]. Він має мують два мутовані фрагменти з частковим перекпослідовність риттям, застосовуючи олігонуклеотиди 1+2 та 3+6, SDDDWIPDIQTDPNGLSFNPISDFPDTTSPK і одержані в результаті фрагменти з'єднують, за(SEQ ID NO:8) (Н-кініноген 565-595 людини). Після стосовуючи олігонуклеотид 1+6 (Таблиця 1). кДНК промивання на початку відліку часу з люмінальноприродного НВР людини застосовують як шаблон го боку EC вводять НВР (75мкг/мл), після чого чедля PCR-реакції. Одержаний в результаті кДНК рез 15хв. вводять брадикінін (100нМ). Результати кодує 19 амінокислотних пропептидів, 222 амінопоказано на Фіг.8. SDD31-обробка EC дозволяла кислотні розвинуті частини та три амінокислотні Сзначною мірою запобігти викликаному НВР збількінцеві подовження. Сайти ВаmН1 включено з кошенню проникності EC. Реакція ЕС на пряму стижного боку мутованої кДНК для клонування. Мутомуляцію брадикініном зберігалася після SDD31ваний фрагмент вставляють у pVL1393 трансферобробки, N=6. ну плазміду (Invitrogen). ДНК для трансфекції Інгібування викликаного НВР збільшення проодержують, застосовуючи комплекти Qiagen никності EC шляхом обробки апротиніном midiprep. Після очищення вставку секвенують. НВР (75мкг/мл) вводять на початку відліку часу з люмінального боку моношарів EC, попередньо інкубованих з апротиніном (100мкг/мл; 30хв.). Результати показано на Фіг.9. Обробка апротиніном дозволяла значною мірою запобігти викликаному НВР збільшенню проникності EC, але не зміні проникності, викликаній наступним введенням брадикініну (100нМ), N=6. Мутант НВР (G 175N) не здатен зв'язуватися з апротиніном через мутацію, але тривимірна структура та поверхневий розподіл заряду залишаються незмінними. При випробуванні у моделі витікання цей мутант викликає вивільнення брадикініну та збільшення проникності EC. Однак додавання апротиніну не має інгібіторного впливу. Подібний результат отримують і з НВР свині, який є дуже гомологічним з НВР людини, але не може зв'язуватися з апротиніном через присутність R внизу дегенерованої каталітичної тріщини. Приклад 3: Два мутанти гепарин-зв'язаного біЦей мутант в цілому будують так, як описано лка вище. Два мутовані фрагменти з частковим перекДва мутанти НВР людини, [R23S,F25E]HBP та риттям одержують шляхом PCR, застосовуючи [G175Q]HBP, було вироблено для дослідження олігонуклеотиди 1+4 та 5+6 і одержані в результаті взаємозв'язку структура-функція залишків у можфрагменти з'єднують, застосовуючи олігонуклеоливому сайті зв'язування ліпіду A/LPS та сайті тиди 1+6 (Таблиця 1). зв'язування ВРТІ (інгібітор трипсину підшлункової Експресія та очищення залози великої рогатої худоби). Мутація G175Q не s/9-клітини комах тримають у середовищі ТС змінює структуру білка, але зникає здатність до 100, підтримуваному 10% FCS. Перед інфікуванзв'язування з ВРТІ, і мутант опосередковує лише ням середовище змінюють на вільне від сироватки дуже обмежену стимуляцію викликаного ліпополіSF900-II. Експресію обох мутантів у середовищі сахаридом (LPS) вивільнення цитокінів з моноцибез сироватки та очищення мутантів від спливаютів людини. Властивість зв'язування ліпіду A/LPS чого шару культури здійснюють, як описано вище можна порівняти з такою властивістю природного для природного НВР людини [Rasmussen, Р.В., НВР. Мутація R23S,F25E не впливає на зв'язуванBjorn, S., Kastrup, S., Nielsen, P. F., Norris, K., Thim, ня ліпіду A/LPS та ВРТІ або вивільнення ліпополіL, Wiberg, F. С, та Flodgaard, H. (1996) FEBS Lett. сахаридом (LPS) вивільнення цитокінів з моноци390:109-112]. тів людини. Аналіз викликаного LPS вивільнення IL-6 з моМатеріали та способи ноцитів Побудова мутантного білка Моноцити людини виділяють і обробляють, як Pwo ДНК полімерази отримано від Boehringer описано [Rasmussen, P.В., Bjørn, S., Kastrup, S., Mannheim, SamH1, Т4 ДНК лігазу отримано від Nielsen, P. F., Norris, K., Thim, L, Wiberg, F. С, та New England Biolabs, клітини spodoptera frugiperda Flodgaard, H. (1996) FEBS Lett. 390:109-112], за (sf9), і pVL1393 трансферплазміду отримано від винятком того, що з середовища виключали 1% Invitrogen, TC100, a SF900-II вироблено на Novo неесенціальних амінокислот. Nordisk A/S, сироватку ембріона великої рогатої Аналіз зв'язування 3H-LPS з НВР худоби (FCS) отримано від GibcoBRL Всі інші хіміСпорідненість за ліпополісахаридом (3H-LPS) кати мають найвищий сорт. вимірюють шляхом сцинтиляційного аналізу бли[R23S,F25E]HBP мутант зькості (SPA), як описано [Linde, V., Bjorn, S., [R23S,F25E]HBP мутант будують, застосовуюKastrup, S. та Flodgaard, Η., 2000, Biotechniques 37 77385 38 28:218-222]. Усі зразки представлено у трьох приможуть охоплюватися обсягом даного винаходу. мірниках. Отже, для спеціалістів на основі вищенаведеного Аналіз зв'язування 125І-ВРТІ з НВР опису стають очевидними різні видозміни винахоСпорідненість за ВРТІ визначають, застосовуду, тобто додаткові до показаних і описаних автоючи аналіз SPA, практично як описано для аналізу рами. Такі видозміни також охоплюються обсягом LPS [Linde, V., Bjorn, S., Kastrup, S. та Flodgaard, формули винаходу, що додається. Η., 2000, Biotechniques 28:218-222] з деякими зміНаведені нами посилання включено як посинами. 3H-LPS замінюють на 125І-ВРТІ (одержаний лання в їх повному обсязі. Novo Nordisk A/S), а буфер замінюють на PBS (20мМ фосфат, рН7,4 і 150мМ NaCI), включаючи 0,05% BSA та 0,05% Triton X-100. Відносну спорідненість НВР та мутантів визначають шляхом здійснення досліджень конкуренції з фіксованими, зростаючими концентраціями неміченого ВРТІ. Результати Біологічна характеристика Біологічну активність двох мутантів порівнюють із природним НВР стосовно їх здатності підвищувати, залежно від дози, викликане LPS вивільнення ІІ-6 з моноцитів людини in vitro. LPSспорідненість двох мутантів та НВР вимірюють шляхом сцинтиляційного аналізу близькості (SPA) [Linde, V., Bjørn, S., Kastrup, S. та Flodgaard, H., 2000, Biotechniques 28:218-222]. Обидва мутанти зв'язуються з 3H-LPS з можливістю насичення з подібним видимим Kd (приблизно 0,7г/мл), як можна спостерігати для природного НВР (Фіг.11 а). Крім того, у подібному сцинтиляційному аналізі близькості вимірюють спорідненість щодо ВРТІ для обох мутантів і для природного НВР, причому 125 І-ВРТІ застосовують як ліганд для НВР. [R23S,F25E]HBP мутант, а також природний НВР зв'язуються з ВРТІ, у той час, як для [G175Q]HBP мутанта зв'язування не спостерігають (Фіг.11б). Досліди конкуренції, проведені шляхом додавання фіксованих, зростаючих концентрацій неміченого ВРТІ, показали, що 125І-ВРТІ зв'язується з НВР та [R23S,F25E]HBP з подібними видимими значеннями ІС50 приблизно 7 нМ. Як можна спостерігати на Фіг.11в, [R23S,F25E]HBP візуально має більшу здатність до зв'язування порівняно з НВР. Ця різниця, можливо, зумовлюється здатністю [R23S,F25E]HBP до зв'язування з різними формами застосованого йодованого ВРТІ. Однак більша здатність до зв'язування не впливає на спорідненість 125І-ВРТІ. Крім того, здатність 3H-LPS до витіснення 125І-ВРТІ, зв'язаного з природним НВР і vice versa, досліджували шляхом експериментів з конкуренцією: конкуренцією за зв'язування з 125І-ВРТІ шляхом додавання до 5мкг/мл неміченого LPS та конкуренцією за 3Н-LРS-зв'язування шляхом додавання до 50мМ неміченого ВРТІ. У жодній із ситуацій не спостерігали ніякого інгібіторного впливу, це свідчить про те, що сайти зв'язування LPS та ВРТІ розташовані у різних частинах молекули НВР. Дані аналізу біологічної активності in vitro показують, що [G175Q]HBP, на відміну від [R23S,F25E]HBP та природного НВР, опосередковує лише дуже обмежену стимуляцію викликаного ліпополісахаридом (LPS) вивільнення цитокінів з моноцитів людини (Фіг.10). Обсяг описаного й сформульованого авторами винаходу не обмежується конкретними описаними втіленнями, оскільки ці втілення ілюструють кілька аспектів винаходу. Будь-які рівноцінні втілення 39 77385 40 41 77385 42 43 Комп’ютерна верстка Т.Чепелева 77385 Підписне 44 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of anti-hbp monoclonal antibody for therapeutic agent intended for treating or preventing disorders resulting from release of bradykinin in mammals, method for assaying monoclonal antibody, assay kit, method for assaying hbp production in mammalian cells and tissues
Автори англійськоюFLODGAARD, Hans, Jakob, LINDBOM, Lennart, Bjoern Soeren
Назва патенту російськоюПрименение антител против нвр млекопитающих для получения лекарственного средства, предназначенного для лечения или профилактики заболеваний, развивающихся в результате высвобождения брадикинина, способ определения моноклональных антител, набор для определения, способ определения продукции нвр в клетках и тканях млекопитающих
Автори російськоюБйорн Сьёрен
МПК / Мітки
МПК: A61K 38/00, G01N 33/15, G01N 33/68, A61K 38/55, G01N 33/566, G01N 33/50, A61K 39/395, G01N 33/53, A61P 29/00, C07K 14/47, A61K 45/00, A61P 11/00, A61P 37/08, A61P 9/10, C07K 16/28
Мітки: виникає, брадикініну, визначення, засобу, захворювання, вивільнення, спосіб, яке, профілактики, ссавця, застосування, моноклональног, лікування, результаті, анти-нвр, лікарського, антитіла, приготування
Код посилання
<a href="https://ua.patents.su/22-77385-zastosuvannya-anti-nvr-antitila-ssavcya-dlya-prigotuvannya-likarskogo-zasobu-dlya-profilaktiki-abo-likuvannya-zakhvoryuvannya-yake-vinikaeh-v-rezultati-vivilnennya-bradikininu-u-ss.html" target="_blank" rel="follow" title="База патентів України">Застосування анти-нвр антитіла ссавця для приготування лікарського засобу для профілактики або лікування захворювання, яке виникає в результаті вивільнення брадикініну у ссавця, спосіб визначення моноклональног</a>
Попередній патент: Каталізатор і спосіб одержання вінілацетату
Випадковий патент: Спосіб скринінгу лікарських препаратів