Спосіб отримання похідних (3-оксо-2,3-дигідро-1н-ізоіндол-1-іл)ацетилгуанідину
Номер патенту: 83883
Опубліковано: 26.08.2008
Автори: Кайль Йоханнес, Хуан Бао-Го, Клеєманн Хайнц-Вернер, Шуберт Герріт, Ханна Реда, У Сяо-Дун, Гуро Ів, Ріке-Цапп Йорг
Формула / Реферат
1. Спосіб отримання сполук формули І
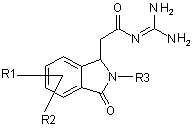 I,
I,
причому
R1 і R2 незалежно один від одного означають водень, F, Сl, трифторметокси, 2,2,2-трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами;
R3 означає Alk-R4 або трифторметил;
Alk означає алкіл з 1, 2, 3 або 4 С-атомами;
R4 означає водень, трифтормeтил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами;
а також їх солей, який відрізняється тим, що
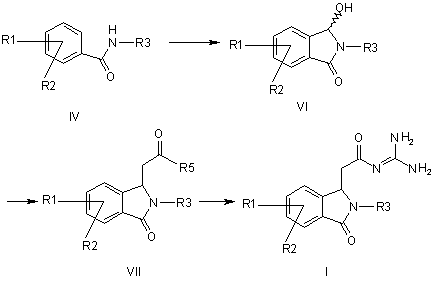
a) формілують амід формули IV і потім циклізують його з отриманням сполуки формули VI,
b) сполуку формули VI піддають перетворенню з алкоксикарбонілметилентрифенілфосфораном, з 1-алкокси-1-триметилсилоксіетиленом або з триалкілфосфоноацетатом з отриманням сполуки формули VII, і
с) сполуку формули VII піддають перетворенню з гуанідином з отриманням сполуки формули І,
причому в сполуках формул IV, VI і VII
R1-R3 мають значення, як у формулі І, і
R5 означає алкокси з 1, 2, 3 або 4 С-атомами,
а також її солей.
2. Спосіб отримання сполук формули І за п. 1,
причому
R1 і R2 незалежно один від одного означають водень, F, Сl, трифторметокси, 2,2,2-трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами;
R3 означає Alk-R4 або трифторметил;
Alk означає алкіл з 1, 2, 3 або 4 С-атомами;
R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами,
а також їх солей,
який відрізняється тим, що
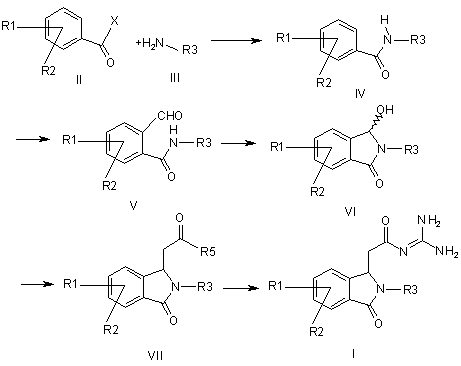
a) сполуку формули II піддають перетворенню з аміном формули III з отриманням аміду формули IV,
b) амід формули IV формілують в орто-положення до амідної функції з отриманням форміламіду формули V,
c) форміламід формули V циклізують з отриманням сполуки формули VI,
d) сполуку формули VI піддають перетворенню з алкоксикарбонілметилентрифенілфосфораном, з 1-алкокси-1-триметилсилоксіетиленом або з триалкілфосфоноацетатом з отриманням сполуки формули VII, і
е) сполуку формули VII піддають перетворенню з гуанідином з отриманням сполуки формули І,
причому в сполуках формул II, III, IV, V, VI і VII
R1-R3 мають значення, як в формулі І,
R5 означає алкокси з 1, 2, 3 або 4 С-атомами, і
X означає Сl, Вr, ОН або алкокси з 1, 2, 3 або 4 С-атомами,
а також її солей.
3. Спосіб за п. 1 або 2, при якому стадії способу незалежно одна від одної проводять безперервно або періодично.
4. Спосіб за одним або декількома пп. 1, 2 або 3, причому сполука формули І являє собою N-{2-[3-оксо-2-(2,2,2-трифторетил)-6-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил)гуанідин, а також його фармацевтично сумісні солі.
5. Спосіб отримання сполук формули І
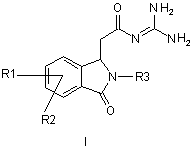 ,
,
причому
R1 і R2 незалежно один від одного означають водень, F, Сl, трифторметокси, 2,2,2-трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами;
R3 означає Alk-R4 або трифторметил;
Alk означає алкіл з 1, 2, 3 або 4 С-атомами;
R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами,
а також їх солей,
який відрізняється тим, що
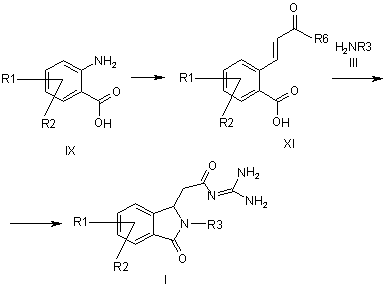
a) амін формули IX піддають перетворенню через сіль діазонію з алкіловим ефіром акрилової кислоти з отриманням похідного коричної кислоти формули XI,
b) сполуку формули XI піддають перетворенню з аміном формули III і гуанідином з отриманням ацилгуанідину формули І,
причому в сполуках формул III, IX і XI
R1-R3 мають значення як в формулі І, і
R6 означає алкокси з 1, 2, 3 або 4 С-атомами,
а також його солей.
6. Спосіб отримання сполук формули І за п. 5,
причому
R1 і R2 незалежно один від одного означають водень, F, Сl, трифторметокси, 2,2,2-трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами;
R3 означає Alk-R4 або трифторметил;
Аlk означає алкіл з 1, 2, 3 або 4 С-атомами;
R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами,
а також їх солей,
який відрізняється тим, що
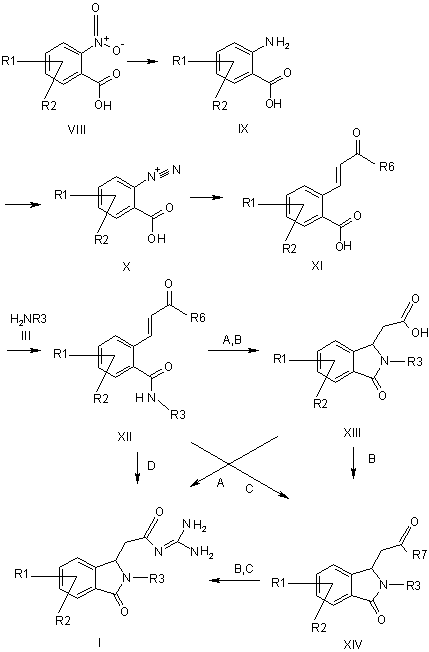
a) нітросполуку формули VIII піддають перетворенню з отриманням аміну формули IX,
b) амін формули IX піддають перетворенню з отриманням солі діазонію формули X,
c) сіль діазонію формули X піддають перетворенню з алкіловим ефіром акрилової кислоти з отриманням похідного коричної кислоти формули XI,
d) сполуку формули XI піддають перетворенню з отриманням аміду формули ХІІ і
e) сполуку формули XII піддають перетворенню з отриманням ацилгуанідину формули І, або шляхом перетворення сполуки формули XII в присутності основи з отриманням похідного ізоіндолону формули XIII і потім шляхом перетворення з гуанідином при активуванні з отриманням ацилгуанідину формули І (варіант А), або
після утворення похідного ізоіндолону формули XIII в присутності основи із сполуки формули XII шляхом перетворення сполуки формули XIII в складний ефір формули XIV і потім шляхом перетворення з гуанідином з отриманням ацилгуанідину формули І (варіант В), або
шляхом перетворення сполуки формули XII в присутності сильної основи з отриманням складного ефіру формули XIV і потім шляхом перетворення з гуанідином з отриманням ацилгуанідину формули І (варіант С), або
шляхом прямого перетворення сполуки формули XII з гуанідином в присутності основи при гуанілуванні, що слідує одночасно, і циклізації з отриманням ізоіндолону формули І (варіант D),
причому в сполуках формул VIII, IX, X, XI, XII, XIII і XIV
R1-R3 мають значення, як в формулі І, і
R6 і R7 незалежно один від одного означають алкокси з 1, 2, 3 або 4 С-атомами,
а також його солей.
7. Спосіб за п. 6, причому на стадії способу e) використовують варіант D.
8. Спосіб за п. 6 або 7, при якому стадії способу d) і e) проводять за способом "в одній посудині".
9. Спосіб за п. 5 або 6, при якому стадії способу незалежно одна від одної проводять безперервно або періодично.
10. Спосіб за одним або декількома пп. 5-9, причому сполука формули І являє собою N-{2-[3-оксо-2-(2,2,2-трифторeтил)-6-трифтормeтил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, а також його фармацевтично сумісні солі.
11. Сполуки формули XII
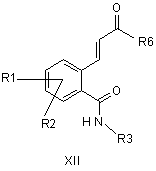 ,
,
причому R1 і R2 незалежно один від одного означають водень, F, Сl, трифторметокси, 2,2,2-трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами;
R3 означає Alk-R4 або трифторметил;
Alk означає алкіл з 1, 2, 3 або 4 С-атомами;
R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами,
R6 означає алкокси з 1, 2, 3 або 4 С-атомами,
а також їх солі.
12. Сполуки формули XII за п. 11 для застосування як проміжних продуктів синтезу.
13. Спосіб виділення сполук формули Іа і Іb
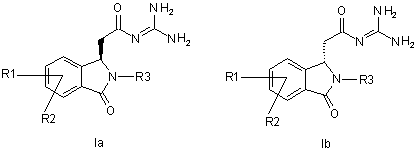 ,
,
причому
R1 і R2 незалежно один від одного означають водень, F, Сl, трифторметокси, 2,2,2-трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами;
R3 означає Alk-R4 або трифторметил;
Alk означає алкіл з 1, 2, 3 або 4 С-атомами;
R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами,
а також їх солей,
який відрізняється тим, що
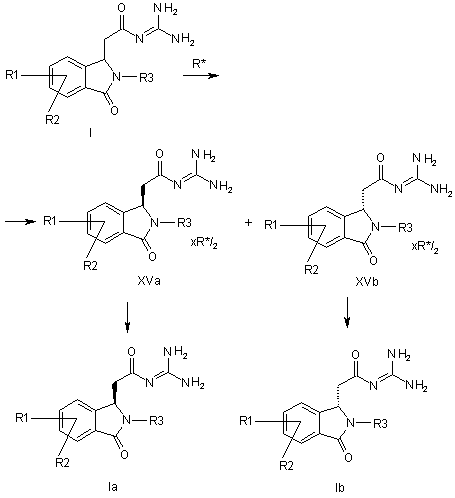
a) сполуку формули І піддають перетворенню з отриманням солей 2,3-O-ацильованої D- або L-винної кислоти, і за допомогою кристалізації обидві солі формул XVa і XVb отримують роздільно, і
b) вільні основи формул Iа або Іb вивільняють з обох солей формул XVa або XVb,
причому в сполуках формул І, XVa і XVb
R1-R3 мають значення, як в формулах Іа і Іb, і
R* означає
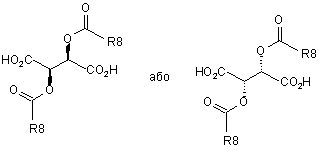 ,
,
R8 означає алкіл з 1, 2, 3, 4, 5 або 6 С-атомами або феніл, незаміщений або заміщений 1, 2 або 3 замісниками з групи F, Сl, Вr, І, алкіл з 1, 2, 3 або 4 С-атомами або алкокси з 1, 2, 3 або 4 С-атомами.
14. Спосіб за п. 13, причому небажаний енантіомер формул Іа або Іb знову рацемують.
15. Спосіб за п. 13 або 14, причому сполуки формул Іа і Іb являють собою (R)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил)гуанідин і (S)-N-(2-[3-оксо-2-(2,2,2-трифторетил)-6-трифтормeтил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин.
16. Сполуки формул XVa і/або XVb
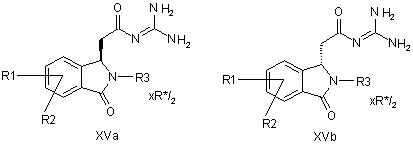 ,
,
причому
R1 і R2 незалежно один від одного означають водень, F, Сl, трифторметокси, 2,2,2-трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами;
R3 означає Alk-R4 або трифторметил;
Alk означає алкіл з 1, 2, 3 або 4 С-атомами;
R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами,
R* означає
 ,
,
R8 означає алкіл з 1, 2, 3, 4, 5 або 6 С-атомами або феніл, незаміщений або заміщений 1, 2 або 3 замісниками з групи F, Сl, Вr, І, алкіл з 1, 2, 3 або 4 С-атомами або алкокси з 1, 2, 3 або 4 С-атомами.
17. (S)-N-{2-[3-oкco-2-(2,2,2-тpифтopeтил)-6-тpифтopмeтил-2,3-дигiдpo-1H-ізоіндол-1-іл]ацетил}гуанідин гідрофумарат гідрат формули XVI
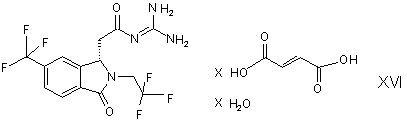 .
.
18. Сполука формул XVa або XVb за п. 16 або формули XVI за п. 17 для застосування як лікарського засобу.
19. Застосування сполуки формул XVa або XVb, вказаної в п. 16, або формули XVI, вказаної в п. 17, окремо або в комбінації з іншими лікарськими засобами або біологічно активними речовинами при отриманні лікарського засобу для лікування або профілактики гострих або хронічних порушень, захворювань або опосередкованих наслідків захворювань органів і тканин, викликаних ішемією або реперфузією, для лікування або профілактики аритмій, загрозливого для життя мерехтіння шлуночків серця, інфаркту міокарда, стенокардії, для лікування або профілактики ішемічних станів серця, ішемічних станів периферійної і центральної нервової системи або апоплексичного удару, або ішемічних станів периферичних органів і тканин, для лікування або профілактики шокових станів, захворювань, первинною або вторинною причиною яких є проліферація клітин, онкологічних захворювань, метастазування, гіпертрофії або гіперплазії простати, атеросклерозу або порушень жирового обміну, підвищеного кров'яного тиску, есенціальної гіпертонії, захворювань центральної нервової системи, захворювань, що є результатом збудливості ЦНС, епілепсії або судом, викликаних центральною нервовою системою, захворювань центральної нервової системи, особливо стану страху, депресій або психозів, для лікування або профілактики не інсулінозалежного цукрового діабету (NIDDM) або пізніх діабетичних пошкоджень, тромбозів, захворювань внаслідок ендотеліальної дисфункції, переміжної кульгавості, для лікування або профілактики фіброзних захворювань внутрішніх органів, фіброзних захворювань печінки, фіброзних захворювань нирок, фіброзних захворювань судин і фіброзних захворювань серця, для лікування або профілактики серцевої недостатності або застійної серцевої недостатності, гострих або хронічних запальних захворювань, захворювань, викликаних найпростішими, малярії і курячого кокцидіозу, і для використання при хірургічних операціях і трансплантації органів, для консервації і зберігання трансплантатів, для хірургічних заходів, для використання при шунтуванні, для використання при реанімації після зупинки серця, для запобігання віковим змінам тканин, для отримання лікарського засобу, направленого проти старіння або для продовження життя, для лікування і зниження кардіотоксичної дії в тиреотоксикозі або для отримання діагностичного засобу.
20. Лікарський засіб для застосування в медицині людини і/або ветеринарії, що містить ефективну кількість сполуки формул XVa або XVb, вказаної в п. 16, або сполуки формули XVI, вказаної в п. 17, разом з фармацевтично прийнятними носіями і добавками.
Текст
1. Спосіб отримання сполук формули І C2 2 (19) 1 3 83883 b) амід формули IV формілують в орто-положення до амідної функції з отриманням форміламіду формули V, c) форміламід формули V циклізують з отриманням сполуки формули VI, d) сполуку формули VI піддають перетворенню з алкоксикарбонілметилентрифенілфосфораном, з 1-алкокси-1-триметилсилоксіетиленом або з триалкілфосфоноацетатом з отриманням сполуки формули VII, і е) сполуку формули VII піддають перетворенню з гуанідином з отриманням сполуки формули І, причому в сполуках формул II, III, IV, V, VI і VII R1-R3 мають значення, як в формулі І, R5 означає алкокси з 1, 2, 3 або 4 С-атомами, і X означає Сl, Вr, ОН або алкокси з 1, 2, 3 або 4 Сатомами, а також її солей. 3. Спосіб за п. 1 або 2, при якому стадії способу незалежно одна від одної проводять безперервно або періодично. 4. Спосіб за одним або декількома пп. 1, 2 або 3, причому сполука формули І являє собою N-{2-[3оксо-2-(2,2,2-трифторетил)-6-трифторметил-2,3дигідро-1Н-ізоіндол-1-іл]ацетил)гуанідин, а також його фармацевтично сумісні солі. 5. Спосіб отримання сполук формули І O ти з отриманням похідного коричної кислоти формули XI, b) сполуку формули XI піддають перетворенню з аміном формули III і гуанідином з отриманням ацилгуанідину формули І, причому в сполуках формул III, IX і XI R1-R3 мають значення як в формулі І, і R6 означає алкокси з 1, 2, 3 або 4 С-атомами, а також його солей. 6. Спосіб отримання сполук формули І за п. 5, причому R1 і R2 незалежно один від одного означають водень, F, Сl, трифторметокси, 2,2,2-трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами; R3 означає Alk-R4 або трифторметил; Аlk означає алкіл з 1, 2, 3 або 4 С-атомами; R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами, а також їх солей, який відрізняється тим, що O N+ O R1 N N H2 R1 O O OH R2 OH R2 IX V III N H2 O R6 + N N N H2 N R1 4 R1 R3 R1 O O OH R2 R2 X O O I , причому R1 і R2 незалежно один від одного означають водень, F, Сl, трифторметокси, 2,2,2-трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами; R3 означає Alk-R4 або трифторметил; Alk означає алкіл з 1, 2, 3 або 4 С-атомами; R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами, а також їх солей, який відрізняється тим, що R6 H 2NR3 III R6 NH2 R1 O O OH R2 OH R2 XI IX O N R1 N R2 N H2 N H2 R3 O I a) амін формули IX піддають перетворенню через сіль діазонію з алкіловим ефіром акрилової кисло R1 O HN R2 N XIII X II B D A O N R1 N R3 C O NH2 N H2 R7 B,C R1 N O R3 O R2 I R3 O R2 R3 R2 H2NR3 III OH A ,B R1 O R1 XI O R2 OH XIV a) нітросполуку формули VIII піддають перетворенню з отриманням аміну формули IX, b) амін формули IX піддають перетворенню з отриманням солі діазонію формули X, c) сіль діазонію формули X піддають перетворенню з алкіловим ефіром акрилової кислоти з отриманням похідного коричної кислоти формули XI, d) сполуку формули XI піддають перетворенню з отриманням аміду формули ХІІ і e) сполуку формули XII піддають перетворенню з отриманням ацилгуанідину формули І, або шляхом перетворення сполуки формули XII в присутності основи з отриманням похідного ізоіндолону формули XIII і потім шляхом перетворення з гуаніди 5 83883 ном при активуванні з отриманням ацилгуанідину формули І (варіант А), або після утворення похідного ізоіндолону формули XIII в присутності основи із сполуки формули XII шляхом перетворення сполуки формули XIII в складний ефір формули XIV і потім шляхом перетворення з гуанідином з отриманням ацилгуанідину формули І (варіант В), або шляхом перетворення сполуки формули XII в присутності сильної основи з отриманням складного ефіру формули XIV і потім шляхом перетворення з гуанідином з отриманням ацилгуанідину формули І (варіант С), або шляхом прямого перетворення сполуки формули XII з гуанідином в присутності основи при гуанілуванні, що слідує одночасно, і циклізації з отриманням ізоіндолону формули І (варіант D), причому в сполуках формул VIII, IX, X, XI, XII, XIII і XIV R1-R3 мають значення, як в формулі І, і R6 і R7 незалежно один від одного означають алкокси з 1, 2, 3 або 4 С-атомами, а також його солей. 7. Спосіб за п. 6, причому на стадії способу e) використовують варіант D. 8. Спосіб за п. 6 або 7, при якому стадії способу d) і e) проводять за способом "в одній посудині". 9. Спосіб за п. 5 або 6, при якому стадії способу незалежно одна від одної проводять безперервно або періодично. 10. Спосіб за одним або декількома пп. 5-9, причому сполука формули І являє собою N-{2-[3-оксо2-(2,2,2-трифторeтил)-6-трифтормeтил-2,3дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, а також його фармацевтично сумісні солі. 11. Сполуки формули XII 6 O N H2 N R3 R1 N Ia Ib , причому R1 і R2 незалежно один від одного означають водень, F, Сl, трифторметокси, 2,2,2-трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами; R3 означає Alk-R4 або трифторметил; Alk означає алкіл з 1, 2, 3 або 4 С-атомами; R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами, а також їх солей, який відрізняється тим, що NH2 O N R1 N NH2 R* R3 O R2 I O N H2 N R1 N O N + R1 R3 N O R2 O N O NH2 R3 , причому R1 і R2 незалежно один від одного означають водень, F, Сl, трифторметокси, 2,2,2трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами; R3 означає Alk-R4 або трифторметил; Alk означає алкіл з 1, 2, 3 або 4 С-атомами; R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами, R6 означає алкокси з 1, 2, 3 або 4 С-атомами, а також їх солі. 12. Сполуки формули XII за п. 11 для застосування як проміжних продуктів синтезу. 13. Спосіб виділення сполук формули Іа і Іb xR*/2 N H2 N H2 N R3 R1 O N R2 Ia XII R3 XVb N H2 N R2 HN N H2 O R2 XVa R1 R2 N H2 NH2 xR*/2 R6 O R3 O R2 O R1 NH2 N O R2 N H2 N H2 N R1 O R3 O Ib a) сполуку формули І піддають перетворенню з отриманням солей 2,3-O-ацильованої D- або Lвинної кислоти, і за допомогою кристалізації обидві солі формул XVa і XVb отримують роздільно, і b) вільні основи формул Iа або Іb вивільняють з обох солей формул XVa або XVb, причому в сполуках формул І, XVa і XVb R1-R3 мають значення, як в формулах Іа і Іb, і R* означає O O HO 2C CO2H O O R8 O R8 O або HO2C O R8 CO2H O R8 , R8 означає алкіл з 1, 2, 3, 4, 5 або 6 С-атомами або феніл, незаміщений або заміщений 1, 2 або 3 замісниками з групи F, Сl, Вr, І, алкіл з 1, 2, 3 або 4 С-атомами або алкокси з 1, 2, 3 або 4 С-атомами. 7 83883 14. Спосіб за п. 13, причому небажаний енантіомер формул Іа або Іb знову рацемують. 15. Спосіб за п. 13 або 14, причому сполуки формул Іа і Іb являють собою (R)-N-{2-[3-оксо-2-(2,2,2трифторетил)-6-трифторметил-2,3-дигідро-1Нізоіндол-1-іл]ацетил)гуанідин і (S)-N-(2-[3-оксо-2(2,2,2-трифторетил)-6-трифтормeтил-2,3-дигідро1Н-ізоіндол-1-іл]ацетил}гуанідин. 16. Сполуки формул XVa і/або XVb O N H2 N R1 N R3 N H2 N R1 N XVa xR*/2 O R2 NH2 R3 xR*/2 O R2 O NH2 XVb , причому R1 і R2 незалежно один від одного означають водень, F, Сl, трифторметокси, 2,2,2-трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами; R3 означає Alk-R4 або трифторметил; Alk означає алкіл з 1, 2, 3 або 4 С-атомами; R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами, R* означає O O O HO 2C R8 O CO 2 H O або O R8 HO 2 C O R8 CO 2H O R8 , R8 означає алкіл з 1, 2, 3, 4, 5 або 6 С-атомами або феніл, незаміщений або заміщений 1, 2 або 3 замісниками з групи F, Сl, Вr, І, алкіл з 1, 2, 3 або 4 С-атомами або алкокси з 1, 2, 3 або 4 С-атомами. 17. (S)-N-{2-[3-oкco-2-(2,2,2-тpифтopeтил)-6тpифтopмeтил-2,3-дигiдpo-1H-ізоіндол-1іл]ацетил}гуанідин гідрофумарат гідрат формули XVI O F F N H2 N O OH X HO F F F O NH2 N F O XVI X H2 O . 18. Сполука формул XVa або XVb за п. 16 або формули XVI за п. 17 для застосування як лікарського засобу. Даний винахід стосується способу отримання похідних (3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетилгуанідину через похідні 3-гідрокси-2,3дигідро-1Н-ізоіндол-1-ону або похідні складного ефіру 3-(2-карбамоїл-феніл)-акрилової кислоти як проміжні сполуки, способу розділення рацемату, а 8 19. Застосування сполуки формул XVa або XVb, вказаної в п. 16, або формули XVI, вказаної в п. 17, окремо або в комбінації з іншими лікарськими засобами або біологічно активними речовинами при отриманні лікарського засобу для лікування або профілактики гострих або хронічних порушень, захворювань або опосередкованих наслідків захворювань органів і тканин, викликаних ішемією або реперфузією, для лікування або профілактики аритмій, загрозливого для життя мерехтіння шлуночків серця, інфаркту міокарда, стенокардії, для лікування або профілактики ішемічних станів серця, ішемічних станів периферійної і центральної нервової системи або апоплексичного удару, або ішемічних станів периферичних органів і тканин, для лікування або профілактики шокових станів, захворювань, первинною або вторинною причиною яких є проліферація клітин, онкологічних захворювань, метастазування, гіпертрофії або гіперплазії простати, атеросклерозу або порушень жирового обміну, підвищеного кров'яного тиску, есенціальної гіпертонії, захворювань центральної нервової системи, захворювань, що є результатом збудливості ЦНС, епілепсії або судом, викликаних центральною нервовою системою, захворювань центральної нервової системи, особливо стану страху, депресій або психозів, для лікування або профілактики не інсулінозалежного цукрового діабету (NIDDM) або пізніх діабетичних пошкоджень, тромбозів, захворювань внаслідок ендотеліальної дисфункції, переміжної кульгавості, для лікування або профілактики фіброзних захворювань внутрішніх органів, фіброзних захворювань печінки, фіброзних захворювань нирок, фіброзних захворювань судин і фіброзних захворювань серця, для лікування або профілактики серцевої недостатності або застійної серцевої недостатності, гострих або хронічних запальних захворювань, захворювань, викликаних найпростішими, малярії і курячого кокцидіозу, і для використання при хірургічних операціях і трансплантації органів, для консервації і зберігання трансплантатів, для хір ургічних за ходів, для використання при шунтуванні, для використання при реанімації після зупинки серця, для запобігання віковим змінам тканин, для отримання лікарського засобу, направленого проти старіння або для продовження життя, для лікування і зниження кардіотоксичної дії в тиреотоксикозі або для отримання діагностичного засобу. 20. Лікарський засіб для застосування в медицині людини і/або ветеринарії, що містить ефективну кількість сполуки формул XVa або XVb, вказаної в п. 16, або сполуки формули XVI, вказаної в п. 17, разом з фармацевтично прийнятними носіями і добавками. також проміжних продуктів способу згідно з винаходом. Похідні (3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетилгуанідину формули І 9 83883 є інгібіторами NHE1 і описані в [РСТ/ЕР03/05279]. Однак описані там синтези приводять до рацемічних сумішей регіоізомсрів, що вимагає способів розділення, що дорого коштують, і зменшує ви хід бажаних сполук. Досі доступ до енантіомерів був можливий тільки через хроматографічне розділення на хіральних носіях, що дорого коштує. Однак пропускна спроможність речовин при хроматографічному розділенні обмежена. Тому представляло великий інтерес розробити регіоселективний спосіб отримання похідних (3оксо-2,3-дигідро-1Н-ізоіндол-1-іл)-ацетилгуанідину, а також спосіб отримання енантіомерів. Поліпшене, регіоселективне отримання рацемічних похідних (3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетилгуанідину досягається двома незалежними шляхами, представленими на схемі 1 і схемі 3. Розділення рацематів досягається шляхом кристалізації у вигляді солей 2,3-О-ацильованих D- або L-винних кислот, як представлено на схемі 5. Шляхом ощадної каталізованої основою рацемізації небажаних в цьому випадку енаптіомерів можливо значне перетворення рацемату в бажаний енантіомер. Названі способи роблять можливими просте отримання енантіомерно збагачених або енантіомерно чистих похідних (3-оксо-2,3-дигідро-1Нізоіндол-1-іл)-ацетилгуанідину. За допомогою нових способів в цей час можливе просте отримання великих кількостей сполук формули І в промисловому масштабі. Таким чином, дана сполука стосується способу отримання сполук формули І, Причому R1 і R2 незалежно один від одного означають водень, F, СІ, трифторметокси, 2,2,2трифторетокси, трифторметил, 2,2,2-трифтор етил або алкіл з 1, 2, 3 або 4 С-атомами; R3 означає Alk-R4 або трифторметил; Alk означає алкіл з 1, 2, 3 або 4 С-атомами; R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами, а також їх солей, який відрізняється тим, що, як представлено на схемі 1 10 a) формілують амід формули IV і потім циклізують його з отриманням сполуки формули VI, b) сполуку формули VI піддають перетворенню з алкоксикарбонілметилентрифенілфосфораном, з 1-алкокси-1-триметилсилоксіетиленом або з триалкілфосфоноацетатом з отриманням сполуки формули VII, і с) сполуку формули VII піддають перетворенню з гуанідином з отриманням сполуки формули І, причому в сполуках формул IV, VI і VII R1-R3 мають значення як в формулі І і R5 означає алкокси з 1, 2, 3 або 4 С-атомами; а також її солей. Об'єктом винаходу є також спосіб отримання сполук формули І, причому R1 i R2 незалежно один від одного означають водень, F, СІ, трифторметокси, 2,2,2трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами; R3 означає AlR-R4 або трифторметил; Alk означає алкіл з 1, 2, 3 або 4 С-атомами; R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами; а також їх солей, який відрізняється тим, що, як представлено на схемі 2 a) сполуку формули II піддають перетворенню з аміном формули III з отриманням аміду формули IV, b) амід формули IV формілують в ортоположення до амідної функції з отриманням форміламіду формули V, c) форміламід формули V циклізують з отриманням сполуки формули VI, 11 83883 d) сполуку формули VI піддають перетворенню з алкоксикарбонілметилентрифенілфосфораном, з 1-алкокси-1-триметилсилоксіетиленом або з триалкілфосфоноацетатом з отриманням сполуки формули VII і e) сполуку формули VII піддають перетворенню з гуанідином з отриманням сполуки формули І, причому в сполуках формул II, III, IV, V, VI і VII R1-R3 мають значення як в формулі І, R5 означас алкокси з 1, 2, 3 або 4 С-атомами і X означає СІ, Вr, ОН або алкокси з 1, 2, 3 або 4 С-атомами; а також її солей. Сполуку формули II звичайним чином піддають перетворенню в інертному розчиннику, наприклад, простому ефірі, вуглеводні або галогенованому вуглеводні, наприклад, дихлорметані, при температурі між -30°С і температурою кипіння розчинника, переважно при кімнатній температурі (КТ), з аміном формули НІ, у разі необхідності в присутності активатора, з отриманням аміду формули IV. Орто-формілування можна провести, наприклад, тим, що використовують сполуку алкілметалу, наприклад, сполуку алкіллітію, переважно третBuLi, з комплексними лігандами, переважно TMED A, в інертному розчиннику як простий ефір або вугле водень, наприклад, ТГФ, при температурі між -100°С і 0°С, переважно між -80°С і -50°С. Потім додають амід формули IV і депротонують протягом інтервалу часу між 10 хвилинами і 10 годинами, переважно між 10 хвилинами і 60 хвилинами, при температурі між -100°С і 0°С, переважно між -80°С і -50°С. Потім додають формілуючий реагент, переважно ДМФ, і при температурі між -100°С і 40°С, переважно між -80°С і кімнатною температурою, здійснюють реакцію з аніоном. Переважно розчин після додавання ДМФ залишають при КТ протягом періоду від 10 хвилин до 3 годин, наприклад, протягом 30 хвилин. При цьому утворюваний проміжний амід формули V в цілому циклізується безпосередньо з отриманням ізоіндолону формули VI. Ізоіндолон формули VI піддають перетворенню з (С1-С4)-алкоксикарбонілметилентрифенілфосфораном в інертному розчиннику, такому як простий ефір, вуглеводень або галогенований вуглеводень, наприклад, толуол, при температурі між 0°С і температурою кипіння розчинника, переважно між 20°С і температурою кипіння розчинника, або з три-(С1-С4)алкілфосфонацетатом в присутності основи, наприклад, гідриду натрію, в інертному розчиннику, як простий ефір, вуглеводень або галогенований вуглеводень, наприклад, 1,2-диметоксіетан, при температурі між 0°С і температурою кипіння розчинника, переважно між 20°С і температурою кипіння розчинника. Альтернативно ізоіндолон формули VI піддають перетворенню з 1-(С1-С4)алкокси-1-триметилсилоксіетиленом в присутності кислоти Льюїса, наприклад, хлориду титану(IV) або триметилсилілтрифлату, в інертному розчиннику, як простий ефір, вуглеводень або галогенований вуглеводень, наприклад, дихлорметан, при температурі між -80°С і температурою кипіння роз 12 чинника, переважно при температурі між -80°С і 20°С [Synth. Commun. 1987. 17, 1]. Складний ефір формули VII загалом відомими способами може бути перетворений з допомогою гуанідину до ацилгуанідину формули І. Перетворення здійснюють переважно відомими фахівцям способами в протонному або апротонному, полярному, але інертному органічному розчиннику. При цьому при перетворенні, наприклад, складного метилового ефіру (формула VII; R5=ОСН3) з гуанідином придатні розчинники, як метанол, ізопропанол або ТГФ при температурі від 20°С аж до температури кипіння цього розчинника. При більшості перетворень сполук формули VII з безсольовим гуанідином використовують, наприклад, апротонні інертні розчинники, наприклад, простий ефір, як ТГФ, диметоксіетан або діоксан. Але також при необхідності основи, наприклад, NaOH, як розчинник при перетворенні сполук формули VII з гуанідином може бути використана вода. При перетворенні сполук формули VII з солями гуанідину, як, наприклад, гідрохлоридом гуанідину, звичайно здійснюють перетворення в присутності основи, наприклад, калій-трет-бутоксиду, метилату натрію або етилату натрію в інертному розчиннику, як диметилформамід, ΗΜΠ (ΝΜΡ), 2-пропанол при температурі між 20°С і температурою кипіння розчинника. Крім ефіру карбонових кислот формули VII для перетворення з гуанідином можуть використовуватися також інші активовані похідні кислот, наприклад хлорангідриди, тіоефіри або ангідриди карбонових кислот. Активування карбонових кислот можна здійснювати також, наприклад, з допомогою ДЦГКДІ (DCC). Активовані похідні кислот можуть виходити відомим фахівцеві способом безпосередньо з карбонових кислот формули VII, що лежать в основі складних ефірів, або з відповідних карбонових кислот, які можуть бути отримані з складного ефіру за допомогою типових методів гідролізу. Ряд придатних способів отримання активованих похідних карбонових кислот є у відомостях з літературних джерел: [J. March, Advanced Organic Chemistry, Third Edition (John Wiley & Sons, 1985, S. 350]. Стадії способу, наведені на схемах 1 і 2, незалежно один від одного можуть здійснюватися безперервно або періодично. Оновлення реакційної суміші може відбуватися після кожної стадії способу. Оновлення і, при бажанні, очищення продукту відбувається загальноприйнятими способами, такими як екстракція, рН-розділення, хроматографія або кристалізація і звичайне сушіння. Вихідні сполуки формул II і III є комерційно доступними або можуть бути отримані відомими фахівцеві способами, описаними в літературі або аналогічними до них. Об'єктом винаходу також є спосіб отримання сполук формули І 13 83883 14 причому R1 i R2 незалежно один від одного означають водень, F, СІ, трифторметокси, 2,2,2трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами; R3 означає Alk-R4 або трифторметил; Alk означає алкіл з 1, 2, 3 або 4 С-атомами; R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами, а також їх солей, який відрізняється тим, що, як представлено на схемі 3 a) амін формули IX піддають перетворенню через сіль діазонію з алкіловим ефіром акрилової кислоти з отриманням похідного коричної кислоти формули XI, b) сполуку формули XI піддають перетворенню з аміном формули III і гуанідином з отриманням ацилгуанідину формули І, причому в сполуках формул III, IX і XI R1-R3 мають значення як в формулі І, і R6 означає алкокси з 1, 2, 3 або 4 С-атомами; а також її солей. Дана сполука стосується також способу отримання сполук формули І, причому R1 і R2 незалежно один від одного означають водень, F, СІ, трифторметокси, 2,2,2трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами; R3 означає Alk-R4 або трифторметил; Alk означає алкіл з 1, 2, 3 або 4 С-атомами; R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами, а також їх солей, який відрізняється тим, що, як представлено на схемі 4 a) нітросполуку формули VIII піддають перетворенню з отриманням аміну формули IX, b) амін формули IX піддають перетворенню з отриманням солі діазонію формули X, c) сіль діазонію формули X піддають перетворенню з алкіловим ефіром акрилової кислоти з отриманням похідного коричної кислоти формули XI, d) сполуку формули XI піддають перетворенню з отриманням аміду формули ХІІ і e) сполуку формули XII піддають перетворенню з отриманням ацилгуанідину формули І, або за допомогою перетворення сполуки формули XII в присутності основи з отриманням похідного ізоіндолону формули XIII і потім за допомогою перетворення з гуанідином при активуванні з отриманням ацилгуанідину формули І (варіант А), або після утворення похідного ізоіндолону формули XIII в присутності основи із сполуки формули XII за допомогою перетворення сполуки формули XIII в складний ефір формули XIV і потім за допомогою перетворення з гуанідином з отриманням ацилгуанідину формули І (варіант В), або за допомогою перетворення сполуки формули XII в присутності сильної основи з отриманням складного ефіру формули XIV і потім за допомогою перетворення з гуанідином з отриманням ацилгуанідину формули І (варіант С), або за допомогою прямого перетворення сполуки формули XII з гуанідином в присутності основи при гуанілуванні і циклізації, що йдуть одночасно, з отриманням ізоіндолону формули І (варіант D), причому в сполуках формул VIII, IX, X, XI, XII, XIII і XIV R1-R3 мають значення як в формулі І і R6 і R7 незалежно один від одного означають алкокси з 1, 2, 3 або 4 С-атомами, а також стосується їх солей. Нітросполука формули VIII відомими способами (як, наприклад, описано в [публікації „HoubenWeyl, Methoden der organischen Chemie", Band 15 83883 XI/1, Stickstoffverbindungen II, Georg Thieme Verlag Stuttgart, 1957, S. 360ff)] може бути відновлена до аніліну формули IX. Переважним є каталітичне гідрування, наприклад з Pd/C, наприклад, з 5% Pd/C або 10% Pd/C, в розчиннику, як, наприклад, спирт, переважно етанол, в атмосфері водню при тиску від 1бар до 200бар, переважно при тиску 1бар-10бар. Подальше діазотування аніліну формули IX відбувається в інертному розчиннику, переважно етанолі, в присутності кислоти, аніон якої не сам заміняє іон діазонію, як, наприклад, HBF4 або HPF6, переважно HBF4, або, наприклад, H2SO4 і в присутності нітриту, переважно NaNO2, при температурі між -30°С і температурою кипіння розчинника, переважно між 0°С до 30°С. Сіль діазонію формули X переважно безпосередньо піддають перетворенню з (С1-С4)алкіловим ефіром акрилової кислоти, переважно етиловим ефіром акрилової кислоти, в присутності паладієвого каталізатора, переважно Pd(OAc)2, при температурі між 0°С і температурою кипіння розчинника, переважно між 45°С до 55°С, до похідного коричної кислоти формули XI. Залишок бензойної кислоти сполуки формули XI відомими фахівцеві способами може бути переведений в амід формули XII, переважно через хлорангідрид або з допомогою ДЦГКДІ (DCC). Ця реакція також може бути проведена таким чином, що амід формули XII в реакційній суміші безпосередньо циклізують до складного ефіру формули XIV, так що реакцію від сполуки формули XI до складного ефіру формули XIV проводять в одну стадію. Це може відбуватися або при основних умовах реакції амідоутворення, або циклізації може сприяти додавання основи, наприклад, триетиламіну, основи Хюніга (Hunig-Base) або третбутилат калію. Інша альтернатива полягає в тому, що сполука формули XI безпосередньо перетворюється в сполуку формули І, тим, що послідовно один за одним проводять амідоутворення, циклізацію і гуанідування в тій же реакційній посудині, причому реакція може здійснюватися без виділення проміжних сполук. Для наступного перетворення сполуку формули XII до ацилгуанідину формули І є 4 варіанти: Варіант А: Перетворення аміду формули XII відбувається переважно з водним розчином лугу, переважно водним розчином NaOH, в розчиннику як спирт, переважно метанол або етанол, при температурі між -30°С і температурою кипіння розчинника, переважно при КТ. Має місце як омилення складноефірної групи, так і циклізація з утворенням похідного ізоіндолону формули XIII. Сполуку формули XIII активують загальновідомим способом (і як зображено на схемі 1) до ацилювання, наприклад через хлорангідрид або з допомогою ДЦГКДІ (DCC), і отримують ацилгуанідин формули І. Варіант В: Синтез карбонової кислоти формули XIII відбувається як в альтернативному варіанті А. Потім стандартним способом для отримання складного ефіру, переважно з SOCl2 в спирті, такому як метанол або етанол, отримують, наприклад, складний метиловий або етиловий ефір фо 16 рмули XIV. Подальше перетворення складного ефіру формули XIV відбувається як показано на схемі 1 з утворенням ацилгуанідину формули І. Варіант С: Перетворення аміду формули XII відбувається в розчині сильної основи, переважно метилату або трет-бутилату в спирті, такому як метанол або етанол, і отримують складний метиловий або етиловий ефір формули XIV. Перетворення складного ефіру формули XIV до ацилгуанідину формули І відбувається як показано на схемі 1. Варіант D: Амід формули XII піддають перетворенню при звичайних умовах до ацилювання гуанідину. Як розчинник використовують інертний розчинник, такий як простий ефір, вугле водень або галогенований вуглеводень, переважно ДМФ. Звичайно спочатку піддають перетворенню сіль гуанідинію з сильною основою, переважно KOtBu, причому вивільняється вільний гуанідин. Суміш додають до розчину сполуки формули XII в розчиннику, такому як спирт, простий ефір, вуглеводень або галогенований вуглеводень, наприклад, ДМФ, Η ΜΠ (ΝΜΡ) або 2-пропанол. При цьому відбувається одночасно гуанілювання і циклізація до ізоіндолону формули І. Варіант полягає в тому, що послідовно один за одним з каталітичною кількістю сильної основи, наприклад, трет-бутилату калію або метилату нагрію, або етилату натрію в розчиннику, наприклад, ДМФ, ΗΜΠ (ΝΜΡ) або 2пропанолі, сполуку формули XI циклізують до сполуки формули XIV і потім in situ піддають перетворенню до сполуки формули І. Переважним є варіант D, при якому проводять перетворення похідного бензойної кислоти формули XI темплатним способом (декілька стадій в одній посудині) аж до ацилгуанідину формули І. Стадії способу, наведені на схемі 2, можуть здійснюватися безперервно або періодично. Оновлення реакційної суміші може відбуватися після кожної стадії способу. Оновлення і, при бажанні, очищення продукту відбувається загальноприйнятими способами, такими як екстракція, pHрозділення, хроматографія або кристалізація і звичайне сушіння. Початкові сполуки формул III і VIII є комерційно доступними або можуть бути отримані відомими фахівцеві способами, описаними в літературі або аналогічних ним. Об'єктом винаходу також є сполуки формули XII причому R1 i R2 незалежно один від одного означають водень, F, СІ, трифторметокси, 2,2,2трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами; R3 означає Alk-R4 або трифторметил; 17 83883 Alk означає алкіл з 1, 2, 3 або 4 С-атомами; R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами, R6 означає алкокси з 1, 2, 3 або 4 С-атомами, а також їх солі. Заявлене також застосування сполук формули XII як проміжних продуктів синтезу. Сполуки формули І в енантіомерно збагаченій або енантіомерно чистій формі переважно можуть бути о тримані новим способом розділення рацемату, який також є об'єктом даного винаходу. Для цього рацемати сполук формули І у вигляді солей 2,3-О-ацильованої D- або L-винної кислоти використовують для кристалізації, причому енантіомери збагачуються в кристалізаті або в маточнику. Потім знову вивільняють вільні основи з солей. Таким чином, даний винахід стосується способу виділення сполук формули Іa і Ib причому R1 i R2 незалежно один від одного означають водень, F, СІ, трифторметокси, 2,2,2рифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами; R3 означає Alk-R4 або трифторметил; Alk означає алкіл з 1, 2, 3 або 4 С-атомами; R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами, а також їх солей, який відрізняється тим, що, як представлено на схемі 5 a) сполуку формули І піддають перетворенню з отриманням солей 2,3-О-ацильованої D- або Lвинної кислоти і за допомогою кристалізації обидві солі формул XVa і XVb отримують роздільно, і b) вільні основи формул Іа або ІЬ вивільняють з обох солей формул XVa або XVb, причому в сполуках формул І, XVa і XVb R1-R3 мають значення як в формулах Іа і Іb і R* означає 18 R8 означає алкіл з 1, 2, 3, 4, 5 або 6 Сатомами або феніл, незаміщений або заміщений 1, 2 або 3 замісниками з групи F, СІ, Вr, І, алкіл з 1, 2, 3 або 4 С-атомами або алкокси з 1, 2, 3 або 4 Сатомами. Винахід також розповсюджується на вище описаний спосіб, при якому небажані енантіомери формули Іа або Іb знову рацемізують. Рацемат сполуки формули І з похідним винної кислоти R*, наприклад, як О,О'-дибензоїл-О-винна кислота, О,О'-дибензоїл-L-винна кислота, О,О'ди(4-метилбензоїл)-L-винна кислота, О,О'-ди(4метилбензоїл)-D-винна кислота, O,O'-ди(4метоксибензоїл)-L-винна кислота або О,О'-ди(4метоксибензоїл)-D-винна кислота, переважно з О,О'-дибензоїл-L-винною кислотою або О,О'дибензоїл-D-винною кислотою, піддають кристалізації в придатному розчиннику, наприклад, в простому ефірі, наприклад, діетиловому ефірі, діізопропіловому ефірі, диметоксіетані, тетрагідрофурані або діоксані, в галогенованому вуглеводні, наприклад, дихлорметані, трихлорметані, тетрахлорметані, 1,2-дихлоретані або трихлоретилені, в спирті, наприклад, метанолі, етанолі, н-пропанолі, 2-пропанолі, бутанолі, в складному ефірі, наприклад, етилацетаті або бутилацетаті, у воді, або в суміші розчинників, переважно в 2пропанолі, диметоксіетані або етилацетаті, при температурі між -10°С і температурою кипіння розчинника, переважно при 0°С до 40°С. Варіант способу полягає в тому, що суміші з дво х або декількох 2,3-O-ацильованих D- або L-винних кислот цих конфігурацій, що мають різні ацильні групи, можуть використовуватися для розділення. Утворення солей із сполук формули І і похідного винної кислоти R* може відбуватися при використанні еквівалентних кількостей, тобто можуть бути використані 0,5моль похідного винної кислоти R*, що має дві карбоксильні групи, на моль сполуки формули І. Сполука формули І також може зазнавати кристалізації з менш ніж 0,5 мольних еквівалентів 2,3-О-ацильованої D- або L-винної кислоти, наприклад, з 0,25моль до 0,5моль похідного винної кислоти R* на моль сполуки формули І, особливо з 0,25моль до 0,3моль похідного винної кислоти R* на моль сполуки формули І. Бажаний енантіомер потім викристалізовується в формі солі формули XVa або XVb, а небажаний енантіомер знаходиться в маточнику переважно в формі енантіомеру формули Іb або Іа і не міститься в формі солі формул XVa або XVb. Чистота енантіомерів солей формул XVa і XVb може бути збільшена за допомогою повторної кристалізації або шляхом перемішування первинних кристалів зі свіжим розчинником при підвищеній температурі і подальшому охолоджуванні. Після розділення обох солей формул XVa і XVb або відділення солі формули XVa або XVb від небажаних енантіомерів Іb або Іа, енантіомерно збагачені сполуки формул Іа і Іb потім звичайно вивільняють з солей шляхом додавання допоміжної основи, наприклад, аміну, як, наприклад, триетиламін, неорганічної основи, як NaHCO3, Na2CO3 або їх водних розчинів. При цьому звичайно використовують придатний розчинник, як, наприклад, 19 83883 простий ефір, наприклад, діетиловий ефір, діізопропіловий ефір, диметоксіетан, тетрагідрофуран або діоксан, галогенований вуглеводень, наприклад, дихлорметан, трихлорметан, тетрахлорметан, 1,2-дихлоретан або трихлоретилеп, спирт, наприклад, метанол, етанол, н-пропанол, 2пропанол або бутанол, складний ефір, наприклад, етилацетат або бутилацетат, або вода, або суміш розчинників, переважно етилацетат, 2-пропанол, дихлорметан або вода або їх суміші, причому реакційна суміш може мати одну або декілька фаз, при температурі між -10°С і температурою кипіння розчинника, переважно при 10°С до 40°С. Це може відбуватися, наприклад, таким чином, що сіль розчиняють у водному розчині NaHCO3 і потім з органічним розчинником, наприклад етилацетатом, екстрагують енантіомер формули Іа або Ib. У кожному випадку, небажаний енаптіомер Іа або Іb знову може бути переведений в рацемат формули І за допомогою способу рацемізації, і таким чином використаний для нової стадії розділення рацемату. При цьому небажані енантіомери переважно в розчиннику як спирт, наприклад, 2пропанол, при температурі між -10°С і температурою кипіння розчинника, переважно при 0°С до 40°С, обробляють малою кількістю основи, наприклад, КОН, нейтралізують реакційну суміш, і після водно-екстракційної обробки відділяють рацемат. Цей спосіб, шляхом відповідного вибору кількості основи і температури реакції, може бути проведений так, що практично відбувається виключно утворення рацемату, і не спостерігається ніяких хімічних змін речовини. Об'єктом даного винаходу далі є сполуки формул XVa і XVb причому R1 і R2 незалежно один від одного означають водень, F, СІ, трифторметокси, 2,2,2трифторетокси, трифторметил, 2,2,2-трифторетил або алкіл з 1, 2, 3 або 4 С-атомами; R3 означає Alk-R4 або трифторметил; Alk означає алкіл з 1, 2, 3 або 4 С-атомами; R4 означає водень, трифторметил або циклоалкіл з 3, 4, 5, 6 або 7 С-атомами, R* означає R8 означає алкіл з 1, 2, 3, 4, 5 або 6 Сатомами або феніл, незаміщений або заміщений 1, 2 або 3 замісниками з групи F, СІ, Вr, І, алкіл з 1, 2, 3 або 4 С-атомами або алкокси з 1, 2, 3 або 4 Сатомами. 20 Якщо вищеописані сполуки, наприклад, сполуки формул І, la, Ib, VII, XIII, XIV, XVa або XVb, містять один або декілька центрів асиметрії, то незалежно один від одного вони можуть мати як S- так і R-конфігурацію, якщо не обумовлено інакше. Сполуки можуть існувати у вигляді оптичних ізомерів, у вигляді діастереомерів, у вигляді рацемату або у вигляді суміші таких, якщо це точно не позначене. У сполук з подвійним зв'язком може бути як Е- так і Z-конфігурація, якщо не обумовлено інакше. Даний винахід включає таутомерні форми вищеописаних сполук, наприклад, сполук формул І, la, Ib, XVa і XVb. Алкільні залишки можуть бути нерозгалуженими або розгалуженими. Це також має місце, якщо вони мають замісники або виступають як замісники інших залишків, наприклад, у фторалкільних залишках або алкоксильних залишках. Прикладами алкільних залишків є метил, етил, н-пропіл, ізопропіл (= 1-метилетил), н-бутил, ізобутил (= 2метилпропіл), втор-бутил (= 1-метилпропіл), третбутил (= 1,1-диметилетил), н-пентил, ізопентил, трет-пентил, неопентил і гексил. Переважними алкільними залишками є метил, етил, н-пропіл і ізопропіл, особливо переважні метил або етил. В алкільних залишках один або декілька, наприклад, 1, 2, 3, 4 або 5 атомів водню можуть бути заміщені атомами фтору. Прикладами таких фторалкільних залишків є трифторметил, 2,2,2-трифторетил і пентафторетил, переважно трифторметил або 2,2,2-трифторетил. Заміщені алкільні залишки можуть бути заміщені в будь-яких положеннях. Прикладами циклоалкільних залишків є циклопропіл, циклобутил, пиклопентил, циклогексил або циклогептил. Фенільні залишки можуть бути незаміщеними або однократно або багато разів, наприклад, однократно, двократно або трикратно, заміщеними однаковими або різними залишками. Якщо фенільний залишок заміщений, переважно він має один або два однакових або різних замісники. У монозаміщених фенільних залишках замісник може знаходитися в 2-положенні, 3-положенні або 4положенні. Двократно заміщений феніл може бути заміщений в 2,3-положенні, 2,4-положенні, 2,5положенні, 2,6-положенні, 3,4-положенні або 3,5положенні. У трикратно заміщених фенільних залишках замісники можуть знаходитися в 2,3,4положенні, 2,3,5-положенні, 2,4,5-положенні, 2,4,6положенні, 2,3,6-положенні або 3,4,5-положенні. Вищеописані сполуки, наприклад, сполуки формул І, Іа і Іb, можуть використовуватися в способі згідно з винаходом в формі їх солей і/або в формі солей виділятися. Солі можуть бути отримані звичайними методами, наприклад, шляхом перетворення з кислотами або основами в розчиннику, або за допомогою аніонного або катіонного обміну з інших солей. Як солі кислотного приєднання, наприклад, сполук формул І, Іа і Іb при цьому мають на увазі, наприклад, галогеніди, особливо гідрохлориди, гідроброміди, лактати, сульфати, цитрати, тартрати, ацетати, фосфати, метилсульфонати, бензолсульфонати, птолуолсульфонати, адипінати, фумарати, глюконати, глутамати, гліцеринфосфати, малеїнати, 21 83883 бензоати, оксалати і памоати, а також трифторацетати. У випадку отримання біологічно активних речовин переважні фізіологічно і фармацевтично сумісні солі. Як приклад можна було б назвати солі сполук формул І, Іа і Іb з фумаровою кислотою, особливо солі, що містять один моль фумарової кислоти на моль сполуки формули І, Іа або Іb, які, таким чином, є гідрогенфумаратами або напівфумаратами. Завдяки корисним властивостям, таким як кристалічність, стабільність, особливо мала гігроскопічність, мала схильність до рацемізації і хороша розчинність, особливо відрізняється, наприклад, (S)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин гідрогенфумарат гідрат формули XVI, який також у всіх своїх таутомерних формах є об'єктом даного винаходу. Якщо сполуки містять кислотну груп у, вони можуть утворювати солі з основами, наприклад, солі лужних металів, переважно натрієві або калієві солі або солі амонію, наприклад, солі з аміаком або органічними амінами або амінокислотами. Сполуки, що містять основну групу і кислотну групу, також можуть існувати у вигляді амфотерного іона. Одна форма виконання даного винаходу стосується сполук, в яких R1 і R2 обидва не є воднем, особливо сполук, в яких R1 означає водень і R2 означає фтор, хлор або трифторметил, особливо трифторметил. У сполуках, в яких R1 означає водень, замісник R2 переважно знаходиться в параположенні бензольного кільця відносно С=О-групи в системі ізоіндолону. Група Alk переважно означає алкіл з 1, 2 або 3 С-атомами, особливо з 1 або 2 С-атомами, особливо з 1 С-атомом. R4 переважно означає трифторметил або циклоалкіл з 3, 5 або 6 С-атомами, особливо 3 С-атомами, особливо переважно трифторметил. Одна форма виконання даного винаходу стосується сполук, в яких R3 означає трифторметил або 2,2.2-трифторетил, особливо 2,2,2-трифторетил. Спеціальна форма виконання даного винаходу стосується отримання N-{2-[3-оксо-2-(2,2,2трифторетил)-6-трифторметил-2,3-дигідро-1Нізоіндол-1 -іл]-ацетил}гуанідину і його енантіомерних форм і їх солей. X переважно означає хлор або метокси, особливо хлор. R5 переважно означає метокси або етокси, особливо етокси. R6 переважно означає метокси або етокси, особливо етокси. R7 переважно означає метокси або етокси, особливо етокси. В одній формі виконання даного винаходу R8 означає феніл, незаміщений або заміщений 1, 2 або 3 замісниками з групи F, СІ, алкіл з 1, 2, 3 або 4 С-атомами або алкокси з 1, 2, 3 або 4 Сатомами, особливо незаміщений феніл. Сполуки формул І, la, Ib, XVa і XVb і їх фармацевтично сумісні солі є заміщеними ацилгуаніди 22 нами і інгібують клітинний натрій/протонний обмін (Na+/H+-обмінник, NHE), особливо підтип NHE-1. На основі властивостей інгібування NHE сполуки формул І, la, Ib, XVa, XVb і XVI і/або їх фармацевтично сумісні солі придатні для профілактики і лікування захворювань, що викликаються активацією NHE або активованим NHE, а також вторинних захворювань, що викликаються пошкодженнями, зумовленими NHE. Сполуки формул І, la, Ib, XVa і XVb також можуть використовуватися для лікування і профілактики захворювань, причому NHE інгібується лише частково, наприклад, шляхом використання зниженого дозування. Оскільки інгібітори NHE переважним чином впливають за допомогою клітинної регуляції pH, вони сприятливим чином можуть комбінуватися з іншими сполуками, що також регулюють внутрішньоклітинне значення pH, причому маються на увазі інгібітори ферментних гр уп карбоангідраз, інгібітори систем, що транспортують бікарбонатні іони, такі як інгібітори натрій-бікарбонатного котранспортера (NBC) або залежного від натрію хлоридбікарбонатного обміну (NCBE), а також з інгібіторами NHE з інгібуючою дією на інші підтипи NHE, як компоненти для комбінації, оскільки з їх допомогою можуть бути посилені або модульовані істотні фармакологічні ефекти, що регулюють pH, описаних тут інгібіторів NHE. Застосування сполук формул І, la, Ib, XVa, XVb або XVI стосується профілактики і лікування гострих і хронічних захворювань у ветеринарній медицині і медицині людини. Таким чином, інгібітори NHE згідно з винаходом придатні для лікування захворювань, викликаних ішемією і реперфузією. Описані тут сполуки внаслідок своїх фармакологічних властивостей придатні як антиаритмічні лікарські засоби. Завдяки своїм кардіозахисним компонентам інгібітори NHE виключно придатні для профілактики інфаркту і лікування інфаркту, а також для лікування стенокардії, причому вони також превентивно інгібують або сильно скорочують патофізіологічні процеси при виникненні викликаних ішемією порушень, особливо при виникненні викликаних ішемією серцевих аритмій. Завдяки їх захисній дії проти патологічних гіпоксичних і ішемічних ситуацій, сполуки формул І, la, Ib, XVa, XVb і XVI і/або їх фармацевтично сумісні солі, що використовуються згідно з винаходом, внаслідок інгібування клітинного механізму Na+/H+-обміну можуть бути використані як лікарські засоби для лікування всіх гострих або хронічних порушень, викликаних ішемією, або первинних або вторинних індукованих нею захворювань. Це стосується також їх застосування як лікарських засобів при хірургічних втр учаннях. Так, сполуки можуть бути використані при трансплантації органів, причому сполуки можуть бути використані як для захисту органів донора перед і під час вилучення, для захисту вилучених органів, наприклад, при лікуванні або їх зберіганні в фізіологічному розчині, так і при введенні в організм реципієнта. Сполуки згідно з винаходом також є цінними лікарськими засобами із захисною дією при прове 23 83883 денні ангіопластичних операцій, наприклад, на серці, а також на периферичних органах і судинах. Далі, сполуки згідно з винаходом можуть бути використані при операціях шунтування, наприклад, при шунтуванні коронарних судин і при коронарному артеріальному шунтуванні (Coronary Artery Bypass Graft) (CABG). У відповідності зі своєю дією відносно викликаних ішемією порушень сполуки згідно з винаходом формули І також можуть бути використані для реанімації після зупинки серця. Сполуки згідно з винаходом представляють інтерес для лікарських засобів проти загрозливих життю аритмій. Вони зупиняють мерехтіння шлуночків і відновлюють фізіологічний синусоїдальний ритм серця. Оскільки інгібітори NHE-1 не тільки ефективно захищають тканини і органи людини, особливо серце, від пошкоджень, що викликаються ішемією і реперфузією, але і від цитотоксичної дії лікарських засобів, особливо що використовуються при лікуванні раку і аутоімунних захворювань, можливе комбіноване застосування з інгібіторами NHE, які можуть інгібувати цитотоксичну, особливо кардіотоксичну побічну дію названих сполук. Шляхом зменшення цитотоксичного ефекту, особливо кардіотоксичності, внаслідок додаткового призначення ліків з інгібіторами NHE-1, крім того, доза цитотоксичного терапевтичного засобу може бути збільшена і/або призначення лікаря з такими ліками продовжено. Терапевтична користь такої цитотоксичної терапії може бути істотно збільшена за допомогою комбінації з інгібіторами NHE. Крім того, інгібітори NHE1 можуть бути використані при перевиробництві гормонів щитовидної залози, що ушкоджує серце, тиреотоксикозі, або при зовнішньому введенні гормонів щитовидної залози. Тому сполуки формул І, Іа, Іb, XVa, XVb і XVI і/або їх фармацевтично сумісні солі придатні для поліпшення лікування кардіотоксичними лікарськими засобами. У відповідності зі своєю захисною дією проти викликаних ішемією пошкоджень сполуки згідно з винаходом також придатні як лікарські засоби для лікування ішемії нервової системи, особливо центральної нервової системи, причому вони, наприклад, придатні для лікування апоплексичного удару або набряку головного мозку. Інгібітори NHE придатні також для лікування і профілактики захворювань і порушень, викликаних підвищеною збудливістю центральної нервової системи, особливо для лікування епілептичних захворювань, клонічних і тонічних спазмів, викликаних центральною нервовою системою, психічних депресивних станів, станів страху і психозів. При цьому описані інгібітори NHE можуть бути використані окремо або в комбінації з іншими речовинами, що діють антиепілептно, або антипсихотичними біологічно активними речовинами, або інгібіторами карбоангідраз, наприклад, з ацетазоламідом, а також з іншими інгібіторами NHE або натрієво-залежними хлорид-бікарбонатними іонообмінниками (NCBE). В доповнення до цього інгібітори NHE також придатні для лікування форм шоку таких, як, на 24 приклад, алергічний, кардіогенний, гіповолемічний і бактерійний шок. Сполуки формул І, la, Ib, XVa, XVb і XVI і/або їх фармацевтично сумісні солі також можуть використовуватися для профілактики і лікування тромбозних захворювань, оскільки вони як інгібітори NHE самі можуть інгібувати агрегацію тромбоцитів. Крім цього, вони можуть інгібувати або запобігати вивільненню медіаторів запалення і коагуляції, в надлишку присутніх після ішемії і реперфузії, особливо фактор Віллебранда і тромбогенні селективні протеїни. Тим самим може бути зменшена або виключена патогенна дія істотних тромбогенних факторів. Тому інгібітори NHE згідно з даним винаходом можна комбінувати з іншими антикоагуляційними і/або тромболітичними біологічно активними речовинами, як, наприклад, плазміногенні активатори рекомбінантних або природних тканин, стрептокінази, урокінази, ацетилсаліцилова кислота, антагоністи тромбіну, антагоністи фактора Ха, лікарські засоби, що діють фібринолітично, антагоністи рецептора тромбоксану, інгібітори фосфодіестерази, антагоністи фактора-VIIa, клопідогрел (Clopidogrel), тиколопідин і т.д. Комбіноване використання даних інгібіторів NHE з інгібіторами NCBE і/або з інгібіторами карбоангідрази, наприклад, з ацетазоламідом, особливо переважне. Крім цього, інгібітори NHE характеризуються сильною інгібіторною дією на проліферацію клітин, наприклад, клітинну проліферацію фібробластів і проліферацію клітин гладеньких м'язів судин. Тому мова йде про сполуки формул І, la, Ib, XVa, XVb і XVI і/або їх фармацевтично сумісні солі як цінні терапевтичні засоби для захворювань, у випадку яких проліферація є первинною або вторинною причиною, і тому вони можуть використовуватися як засоби проти атеросклерозу, засоби проти хронічної ниркової недостатності, онкологічних захворювань. Було показано, що з допомогою інгібіторів NHE інгібується міграція клітин. Тому мова йде про сполуки формул І, la, Ib, XVa, XVb і XVI і/або їх фармацевтично сумісні солі як цінні терапевтичні засоби для захворювань, у яких міграція клітин є первинною або вторинною причиною, як, наприклад, онкологічні захворювання з явно вираженою схильністю до метастазуванню. Інгібітори NHE далі характеризуються сповільненням або запобіганням фіброзних захворювань. Таким чином, вони придатні як відмінні засоби для лікування фіброзів серця, а також фіброзу легень, фіброзу печінки, фіброзу нирок і інших фіброзних захворювань. Таким чином, вони можуть використовуватися для лікування гіпертрофії і гіперплазії органів, наприклад, серця і простати. Тому вони придатні для профілактики і лікування серцевої недостатності (конгестивна серцева недостатність, = CHF), а також для лікування і профілактики гіперплазії простати або гіпертрофії простати. Оскільки NHE у есенціальних гіпертоників є значно підвищеним, сполуки формул І, la, Ib, XVa, XVb і XVI і/або їх фармацевтично сумісні солі придатні для профілактики і лікування підвищеного кров'яного тиску і лікування серцево-судинних захворювань. При цьому вони можуть використову 25 83883 ватися окремо або спільно з придатними компонентами для комбінацій і препаративних готових форм для лікування підвищеного кров'яного тиску і серцево-судинних захворювань. Так, наприклад, один або декілька засобів, що діють як тіазидоподібні сечогінні, петлеві діуретики, антагоністи альдостерону і псевдоальдостерону, такі як гідрохлоротіазид, індапамід, політіазид, фуросемід, піретанід, торасемід, буметанід, амілорид, триамтерен, спіронолактон або еплерон, можуть бути скомбіновані із сполуками згідно з винаходом. Далі, інгібітори NHE даного винаходу можуть використовуватися в комбінації з антагоністами кальцію, такими як верапаміл, дилтіазем, амлодипін або ніфедипін, а також з інгібіторами АСЕ, як, наприклад, раміприл, еналаприл, лісиноприл, фосиноприл або каптоприл. Іншими сприятливими компонентами для комбінацій також є b-блокатори, такі як метопролол, албутерол і т.д., антагоністи рецептора ангіотензину і субтипів його рецепторів, такі як лосартан, ірбесартан, валсартан, омапатрилат, гемопатрилат, антагоністи ендотеліну, інгібітори реніну, агоністи рецепторів аденозину, інгібітори і активатори калієвих каналів, такі як глібенкламід, глімепірид, діазоксид, кромакалим, міноксидил і їх похідні, активатори мітохондріального чутливого до АТР (АТФ) калієвого каналу, інгібітори Kv1.5 і т.д. Було показано, що інгібітори NHE-1 характеризуються істотною протизапальною дією, і тому можуть бути використані як протизапальні засоби. При цьому звертає на себе увагу інгібування вивільнення медіаторів запалення. Таким чином, сполуки можуть використовуватися окремо або в комбінації з протизапальним засобом для профілактики або лікування хронічних і гострих запальних захворювань. Як компоненти для комбінацій переважно використовують стероїдні і нестероїдні протизапальні засоби. Далі сполуки згідно з винаходом можуть використовуватися для профілактики або лікування захворювань, викликаних найпростішими, як малярія і курячий кокцидіоз. Крім того, було виявлено, що інгібітори NHE впливають сприятливим чином на сироваткові ліпопротеїни. Загальновизнано, що для виникнення атеросклеротичних змін судин, особливо коронарних серцевих захворювань, високе значення жирів в крові, так звана гіперліпідемія, представляє істотний фактор ризику. Тому для профілактики і регресії атеросклеротичних змін зниження підвищеного вмісту сироваткових ліпопротеїнів має надзвичайне значення. Крім скорочення загального сироваткового холестерину особливе значення має зниження частки специфічної атерогенної ліпідної фракції цього загального холестерину, особливо ліпопротеїнів низької щільності (low density Lipoprotein) (LDL) і ліпопротеїнів дуже низької щільності (very low density Lipoprotein) (VLDL), оскільки ці фракції ліпідів представляють атерогенний фактор ризику. Навпаки, ліпопротеїнам високої щільності приписують захисну функцію проти коронарних захворювань серця. Відповідно цьому гіполіпідемічні засоби повинні бути спроможні знижувати не тільки загальний холестерин, але 26 і особливо VLDL і LDL-фракції сироваткового холестерину. Тепер було знайдено, що інгібітори NHE-1 характеризуються цінними властивостями, що терапевтично використовуються відносно впливу на рівень сироваткових ліпідів. Так, вони істотно знижують підвищені концентрації LDL і VLDL в сироватці до рівня, який може спостерігатися, наприклад, при посиленому дієтичному прийомі їжі, що не містить холестерину і жиру, або при патологічних змінах обміну речовин, наприклад, генетично зумовленій гіперліпідемії. Тому вони можуть використовуватися для профілактики і регресії атеросклеротичних змін, в яких вони виключають причинний фактор ризику. Сюди ж відносять не тільки первинні гіперліпідемії, але і відомі вторинні гіперліпідемії, які мають місце, наприклад, при діабеті. Крім того, інгібітори NHE приводять до явного скорочення інфарктів, викликаних аномаліями обміну речовин, і особливо до істотного зменшення величини індукованого інфаркту і його ступеня тяжкості. Тому сполуки формул I, la, Ib, XVa, XVb і XVI згідно з винаходом переважно знаходять застосування для отримання медикаменту для лікування гіперхолестеринемії; для отримання медикаменту для попередження атерогенезу; для отримання медикаменту для профілактики і лікування атеросклерозу, для отримання медикаменту для профілактики і лікування захворювань, викликаних підвищеним рівнем холестерину, для отримання медикаменту для профілактики і лікування захворювань, викликаних ендотеліальною дисфункцією; для отримання медикаменту для профілактики і лікування гіпертонії, індукованої атеросклерозом, для отримання медикаменту для профілактики і лікування тромбозів, індукованих атеросклерозом, для отримання медикаменту для профілактики і лікування ішемічних порушень і постішемічних реперфузійних порушень, індукованих гіперхолестеринемією і ендотеліальною дисфункцією, для отримання медикаменту для профілактики і лікування серцевої гіпертрофії і кардіоміопатії і застійної серцевої недостатності (CHF), індукованих гіперхолестеринемією і ендотеліальною дисфункцією, для отримання медикаменту для профілактики і лікування коронарних спазмів судин і міокардіального інфаркту, індукованих гіперхолестеринемією і ендотеліальною дисфункцією, для отримання медикаменту для лікування названих хвороб в комбінації з речовинами, що знижують кров'яний тиск, переважно з інгібіторами ангіотензинперетворювального ферменту (АСЕ) і антагоністів рецепторів ангіотензину. Комбінація інгібітору NHE з біологічно активними речовинами, що знижують рівень жиру в крові, переважно з інгібітором HMG-CoA-редуктази (наприклад, ловастатином або правастатином), причому останній приводить до гіполіпідемічної дії і внаслідок цього підвищує гіполіпідемічні властивості інгібітору NHE, являє собою сприятливу комбінацію з посиленою дією і скороченим використанням біологічно активних речовин. Таким чином, інгібітори NHE ведуть до ефективного захисту проти пошкоджень ендотелію різного генезу. З цим захистом судин проти синдрому 27 83883 ендотеліальної дисфункції сполуки формул І, la, Ib, XVa, XVb і XVI і/або їх фармацевтично сумісні солі є цінними лікарськими засобами для профілактики і лікування спазмів коронарних судин, захворювань периферичних судин, особливо інтермітуючої кульгавості, атерогенезу і атеросклерозу, лівошлуночкової гіпертрофії і дилятаційної кардіоміопатії, і захворювань на основі тромбозу. Крім того, було показано, що інгібітори NHE придатні для лікування неінсулінозалежного діабету (NIDDM), причому резистентність до інсуліну пригнічується. При цьому посиленню антидіабетичного ефекту і якості дії сполук згідно з винаходом може сприяти їх комбінування з бігуанідом як метформін, з антидіабетичною сульфонілсечовиною, як глібурид, глімепірид, толбутамід, і т.д., інгібітором глюкозидази, агоністом PPAR, як росиглітазон, піоглітазон і т.д., з інсуліновими препаратами різних форм застосування, з інгібітором DB4, з сенсибілізатором інсуліну або з меглітинідом. Крім гострих антидіабетичних ефектів, інгібітори NHE протидіють виникненню пізніх діабетичних ускладнень і тому можуть використовуватися як лікарські засоби для профілактики і лікування пізніх діабетичних порушень, таких як діабетична нефропатія, діабетична невропатія, діабетична ретинопатія, діабетична кардіоміопатія і інші захворювання, що виникають як наслідок діабету. При цьому вони можуть переважно комбінуватися з антидіабетичними лікарськими засобами, описаними вище при лікуванні NIDDM. Комбінація з сприятливими формами прийому інсуліну при цьому може мати особливе значення. Інгібітори NHE, крім захисної дії проти гострих ішемічних ситуацій і подальших також гостро обтяжених реперфузійних ситуацій, виявляють також пряму терапевтично придатну для використання дію проти захворювань і порушень всього організму ссавців, які тісно пов'язані з симптомами процесу старіння, що протікає хронічно, і які також є незалежними від гострих станів недостатнього кровопостачання і також можуть зустрічатися при нормальних, неішемічних умовах. Для цих патологічних вікових проявів, що виникають після тривалого старіння, таких як нездужання, кволість і смерть, які останнім часом лікують з допомогою інгібіторів NHE, мова йде про захворювання і порушення, значною мірою зумовлені віковими змінами життєво необхідних органів і їх функцій, які набувають організмі, що старіє, зростаюче значення. До захворювань, пов'язаних з функціональними віковими порушеннями, із зумовленими віком симптомами зносу органів, відносяться, наприклад, недостатня чутли вість і здатність кровоносних судин до реакції по відношенню до реакцій контракції і релаксації. Це вікове ослаблення здатності до реакції судин на стискаюче і релаксуюче збудження, яке є істотним процесом серцевосудинної системи і тим самим життя і здоров'я, може бути значною мірою ліквідоване або скорочене з допомогою інгібіторів NHE. Важливою функцією і засобом для підтримання здатності судин до реакції є блокада або ретардація вікової прогресуючої ендотеліальної дисфункції, яка може 28 бути значно скорочена за допомогою інгібіторів NHE. Таким чином, інгібітори NHE виключно придатні для лікування і профілактики вікової прогресуючої ендотеліальної дисфункції, особливо переміжної кульгавості. Прикладом показника, що характеризує наступний процес старіння, є ослаблення скоротливості серця і ослаблення адаптації серця до необхідної потужності серця, що нагнітається. Ця знижена серцева діяльність як наслідок процесу старіння в більшості випадків пов'язана з дисфункцією серця, викликаною, крім іншого, відкладенням сполучної тканини в тканині серця. Це відкладення сполучної тканини характеризується збільшенням ваги серця, збільшенням серця і обмеженою серцевою функцією. Несподівано було виявлено, що подібне старіння органу серця могло бути інгібоване майже повністю. Тим самим інгібітори NHE виключно придатні для лікування і профілактики серцевої недостатності, застійної серцевої недостатності (CHF). Шляхом пригнічення проліферації можуть виліковуватися не тільки онкологічні захворювання, що вже настали, але і з допомогою інгібіторів NHE скорочуватися або сильно сповільнюватися множинні вікові форми виникнення раку. Особливо гідний уваги висновок про те, що скорочуються або сильно сповільнюються виникаючі вікові захворювання всіх органів, а не тільки паралізуються певні форми раку. Таким чином, інгібітори NHE придатні для лікування і, особливо, для профілактики зумовлених віком форм раку. З допомогою інгібіторів NHE констатують істотне запізнення настання вікових захворювань всіх досліджених органів, включаючи серце, судини, печінку і т.д., а також значне запізнення старечого раку. Більш того, це також може несподівано приводити до продовження життя в тій мірі, яка досі не могла бути досягнута ніякими іншими групами медикаментів або будь-якими природними матеріалами. Ця єдина в своєму роді дія інгібіторів NHE також дає можливість, крім виняткового використання біологічно активних речовин для людини і тварин, комбінувати ці інгібітори NHE з іншими геронтологічно застосовними принципами дії, заходами, речовинами і природними матеріалами, в основі яких лежить інший механізм дії. Такого роду класами біологічно активних речовин, що використовуються в геронтологічній терапії, є, особливо, вітаміни і речовини з антиокислювальною дією. Оскільки існує кореляція між енергетичним (калорійним) навантаженням або їжею і процесом старіння, може існувати комбінація дієтичних заходів, наприклад, з регулюванням апетиту. Таким же чином може бути згадана комбінація з медикаментами, що знижують кров'яний тиск, як, наприклад, інгібітори АСЕ, антагоністи рецепторів ангіотензину, сечогінні засоби, антагоністи Са+2 і т.д., або з медикаментами, що нормалізують обмін речовин, як речовини, що знижують холестерин. Таким чином, інгібітори NHE виключно придатні для профілактики вікових змін тканин і для продовження життя при збереженні високої якості життя. 29 83883 Сполуки згідно з винаходом є ефективними інгібіторами клітинного антипорту натрій/протон (Na/H-іонообмінник), який при численних захворюваннях (есенціальна гіпертонія, атеросклероз, діабет і т.д.) також в таких клітинах є підвищеним, вимірювання є легко доступними, як, наприклад, в еритроцитах, тромбоцитах або лейкоцитах. Тому сполуки, що використовуються згідно з винаходом, придатні як виняткові і прості наукові інструменти, наприклад при їх застосуванні як діагностикумів для визначення і розпізнавання певних форм гіпертонії, а також атеросклерозу, діабету і пізніх діабетичних ускладнень, проліферативних захворювань і т.д. Далі, в медицині людини, ветеринарії або для захисту рослин використовують лікарські засоби, що містять разом з фармацевтично прийнятними носіями і добавками ефективну кількість однієї або декількох сполук формул XVa, XVb і XVI і/або їх фармацевтично сумісних солей окремо або в комбінації з іншими фармакологічними біологічно активними речовинами або лікарськими засобами. Лікарські засоби, що містять сполуки формул І, la, Ib, XVa, XVb і XVI і/або їх фармацевтично сумісні солі, можна приймати, наприклад, орально, парентерально, внутрішньовенно, ректально, черезшкірно або шляхом інгаляції, причому переважне застосування залежить від відповідної форми прояву хвороби. При цьому сполуки формул І, la, Ib, XVa, XVb і XVI можуть використовуватися окремо або разом з галеновими допоміжними речовинами, як у ветеринарній медицині, так і в медицині людини. Лікарські засоби містять біологічно активні речовини формул І, la, Ib, XVa, XVb і XVI і/або їх фармацевтично сумісні солі, загалом, в кількості від 0,01мг до 1г на разову дозу. Які допоміжні речовини придатні для бажаних лікарських готови х форм, відомо фахівцеві завдяки його спеціальним знанням. Крім розчинників, гелеутворювачів, основ супозиторіїв, допоміжних речовин для таблеток і інших носіїв біологічно активних речовин, можуть бути використані, наприклад, антиоксиданти, диспергатори, емульгатори, антивспінювачі, речовини, що поліпшують смак, консервувальні засоби, агенти розчинення або барвники. Для оральної форми введення активні сполуки змішують з придатними для цього добавками, такими як носії, стабілізатори або інертні розріджувачі, і за допомогою загальноприйнятих методів доводять до придатних форм застосування, таких як таблетки, драже, рознімні капсули, водні, спиртові або масляні розчини. Як інертні носії можуть бути використані, наприклад, гуміарабік, магнезія, карбонат магнію, фосфат калію, молочний цукор, глюкоза або крохмаль, особливо кукурудзяний крохмаль. При цьому композиція може існувати у вигляді як сухого, так і вологого грануляту. Як масляні носії або як розчинники використовують, наприклад, рослинні або тваринні масла, наприклад, соняшникова олія або риб'ячий жир. Для підшкірного, внутрішньом'язового або внутрішньовенного введення застосовують активні сполуки, за бажанням із загальноприйнятими для цього речовинами як агенти розчинення, емульга 30 тори або інші допоміжні речовини в розчині, суспензії або емульсіях. Як розчинники мають на увазі, наприклад, воду, фізіологічний розчин кухонної солі або спирти, наприклад, етанол, пропанол, гліцерин, нарівні з цим також розчини цукру, такого як розчини глюкози або маніту, або також суміш з різних названих розчинників. Як фармацевтичні препаративні готові форми для прийому в формі аерозолів або спреїв придатні, наприклад, розчини, суспензії або емульсії біологічно активних речовин формул І, la, Ib, XVa, XVb і XVI і/або їх фармацевтично сумісних солей в фармацевтично нешкідливих розчинниках, особливо етанолі або воді, або суміші таких розчинників. Препаративна готова форма може при необхідності містити і інші фармацевтичні допоміжні речовини, такі як тензиди, емульгатори і стабілізатори, а також пропелент. Одна така готова форма звичайно містить біологічно активну речовину в концентрації приблизно від 0,1 до 10, особливо приблизно від 0,3 до 3ваг.-%. Дозування біологічно активної речовини, що приймається, формул І, la, Ib, XVa, XVb і XVI і частота прийому залежать від ефективності і часу впливу сполук, що використовуються; крім того, також впливають вид і інтенсивність хвороби, що піддається лікуванню, а також стать, вік, вага і індивідуальна схильність ссавця, що піддається лікуванню. У середньому денна доза сполуки формул І, la, Ib, XVa, XVb і XVI і/або її фармацевтично сумісних солей при вазі пацієнта близько 75кг становить, щонайменше, 0,001мг/кг, наприклад, 0,01мг/кг, аж до максимально 10мг/кг, наприклад, 1мг/кг ваги тіла. У гострих си туаціях хвороби, наприклад, безпосередньо після перенесення інфаркту міокарда, можуть бути необхідні ще більш високі і, передусім, більш часте дозування, наприклад, аж до 4 разових доз на день. Особливо при внутрішньовенному введенні, наприклад, у пацієнтів з інфарктом у відділенні інтенсивної терапії, може бути необхідна доза аж до 700мг на день, і сполуки згідно з винаходом можуть вводитися шляхом ін'єкцій. Лист скорочень: ДЦГКДІ (DCC) дициклогексил-карбодіімід ДІП (DIP) діізопропіловий ефір ТШХ (DC) тонкошарова хроматографія ДМФ (DMF) Ν,Ν-диметилформамід ЕА (ЕЕ) етилацетат ек. (eq.) еквівалент TEA (Et3N) триетиламін ДЕЕ (Et2 O) діетиловий ефір EC (EtOH) етанол год.(h) години HEP н-гептан HOAc оцтова кислота KOtBu калій-2-метил-пропан-2-олят MC (MeOH) метанол хв. хвилини Т.пл. температура плавлення простий трет-бутил-метиловий ТБМЕ (MTB) ефір ΗΜΠ (ΝΜΡ) 1 -метилпіролідин-2-он Pd(OAc)2 ацетат паладію(ІІ) 31 83883 КТ кімнатна температура rt час утримування tBu трет-бутил ТГФ (THF) тетрагідрофуран ТМЕДА (TME- Ν,Ν,Ν',Ν'-тетраметил-етан-1,2DA) діамін Часи утримування (rt), наведені далі, відносяться до результатів ВЕРХ з наступними параметрами: Метод А: Стаціонарна фаза: Waters Symmetry С8 (5мк) 3,9´150мм Рухома фаза: ізократний CH3CN/0,1% водна CF3CO2H 35:65; λ=220нм; 1мл/хв. Метод В: Стаціонарна фаза: Waters Symmetry С8 (5мк) 3,9´150мм Рухома фаза: ізократний CH3CN/0,1% водна CF3CO2H 40:60; λ=230нм; 1мл/хв. Метод С: Стаціонарна фаза: Waters Symmetry С8 (5мк) 3,9´150мм Рухома фаза: ізократний CH3CN/0,1% водна CF3CO2H 50:50; λ=220нм; 1мл/хв. Приклад 1 а) N-(2,2,2-трифтор-етил)-4-трифторметилбензамід 5,0г (24ммоль) 4-трифторметилбензоїлхлориду і 5,0мл (36ммоль) триетиламіну розчиняють в 50мл СН 2Сl2 і при КТ повільно прикрапують 2,4г (24ммоль) 2,2,2-трифтор-етиламіну. 4 години перемішують при КТ, потім летючі компоненти відганяють під вакуумом. У залишок додають 100мл ТБМЕ (MTB) і промивають спочатку 30мл насиченого водного розчину Na2СОз, а потім 30мл насиченого водного розчину NaHSO4. Сушать над MgSO4 і отримують 6,1г (94%) безбарвної смоли, яка кристалізується при витримуванні; т. пл: 117°С. Rf (DIP)=0,50 MS (EI): 271 (M+1)+ b) (RS)-3-гідрокси-2-(2,2,2-трифтор-етил)-5трифторметил-2,3-дигідроізоінлол-1-он 0,37мл (2,4ммоль) TMED A і 1,4мл (2,3ммоль) 1,5Μ розчину t-BuLi в н-пентані розчиняють при 75°С в 2мл ТГФ (безводного) і при -75°С прикрапують розчин 0,30г (1,1ммоль) N-(2,2,2-трифторетил)-4-трифторметил-бензаміду в 2мл ТГФ. 3 години перемішують при -75°С, потім прикрапують 0,43мл (5,5ммоль) ДМФ і протягом 30 хвилин нагрівають до КТ. Реакційну суміш виливають в 100мл насиченого водного розчину NaHCO3 і 3 рази екстрагують з ЕА (по 30мл). Сушать над 32 MgSO4 , і розчинник відганяють під вакуумом. Хроматографія на кизельгелі з ДІП (DIP) дає 80мг (R,S)-3-гідрокси-2-(2,2,2-трифтор-етил)-5трифторметил-2,3-дигідро-ізоіндол-1-ону, крім 110мг суміші з початковим продуктом. Цю суміш знову розділяють з допомогою ВЕРХ із зворотною фазою (умови дивись нижче) і далі отримують 40мг (R,S)-3-гідрокси-2-(2,2.2-трифтор-етил)-5трифторметил-2,3-дигідро-ізоіндол-1-ону; Загальний вихід продукту 30%. ВЕРХ: Градієнт, час пробігу 20хв. Розчинник: 0,1% водна CF3CO2H, ацетонітрил (Chromasolv); Потік: 30мл/хв. Колонка: Waters Xterra™ MS C185мкМ, 30´100мм Градієнт: 0-2,5хв. 10% ацетонітрил 3,0хв. 25% ацетонітрил 14,0хв. 75% ацетонітрил 15,0хв. 95% ацетонітрил 17,5хв. 10% ацетонітрил Rf (DIP)=0,50 MS(EI): 299(M+1)+ c) етиловий ефір (RS)-[3-оксо-2-(2,2,2трифтор-етил)-6-трифторметил-2,3-дигідро-1Нізоіндол-1-іл]-оцтової кислоти У струмі аргону етиловий ефір (діетоксифосфорил)-оцтової кислоти (135мг, 0,6ммоль) розчиняють в безводному диметоксіетані (10мл). До цього розчину при КТ додають 17,6мг NaH (60%-ий в маслі) і перемішують 10хв. при КТ. Після цього додають розчин (RS)-3-гідрокси-2-(2,2,2трифторетил)-5-трифторметил-2,3-дигідроізоіндол-1-ону 120мг (0,04ммоль) в безводному диметоксіетані (5мл) і потім 2 години перемішують із зворотним потоком. Реакційний розчин охолоджують, потім його виливають в 50мл 5%-ного розчину гідрокарбонату натрію, 2 рази екстрагують етилацетатом (по 20мл), органічну фазу сушать над MgSO4, випарюють під вакуумом і залишок очищають за допомогою хроматографії на кизельгелі з ДІП (DIP) як елюентом. Отримують 90мг (61%) етиловий ефір (RS)-[3-оксо-2-(2,2,2трифтор-етил)-6-трифторметил-2,3-дигідро-1Нізоіндол-1-іл]-оцтової кислоти у вигляді безбарвного масла, яке кристалізується з гептану у вигляді бежевої твердої речовини. Rf(DIP)=0,31 ЯМР-спектр ідентичний продукту, отриманому в прикладі 4. d) (RS)-N-{2-[3-оксо-2-(2,2,2-трифтор-етил)-6трифторметил-2,3-дигідро-Н-ізоіндол-1-іл]ацетил}гуанідин 33 83883 Етиловий ефір (RS)-[3-оксо-2-(2,2,2-трифторетил)-6-трифторметил-2,3-дигідро-1Н-ізоіндол-1іл]-оцтової кислоти може бути підданий перетворенню з гуанідином як описано в прикладі 2g. Приклад 2 а) 2-нітро-4-трифторметил-бензойна кислота 11,97г 4-трифторметил-бензойної кислоти (63ммоль) повільно порціями додають до 48мл HNO3 (100%) при КТ. Потім суміш протягом 1 години нагрівають із зворотним потоком, потім охолоджують до КТ і виливають на 600г льоду. 1 годину суміш перемішують, потім осад відфільтровують і промивають 1л води. Фільтрат 300мл СН2СІ2 екстрагують, органічну фазу об'єднують з осадом і сушать над Na2SO4. Розчинник відганяють під вакуумом і осад перекристалізовують тим, що розчиняють в 1л ДІП (DIP) при 68°С, додають 2л н-гептану при цій температурі і на закінчення повільно охолоджують розчин до КТ. Закристалізований продукт промивають 1л гептану, сушать під вакуумом і отримують 7,1г (48%), т.пл. 136°С-138°С. b) 2-аміно-4-трифторметил-бензойна кислота 250г 2-нітро-4-трифторметил-бензойної кислоти (1,06моль) розчиняють в 1л ЕtOН і додають 7,5г Pd/C (5%). Суміш гідрують при тиску водню 12,5бар. Під час прийому водню температура підвищується в інтервалі від 10°С до 104°С. Через 2 години прийом водню закінчується. Потім каталізатор відфільтровують, розчинник відганяють під вакуумом і отримують 215г (99%) блідо-жовтої твердої речовини, т.пл. 174-176°С. с) 2-((Е)-2-етоксикарбоніл-вініл)-4трифторметил-бензойна кислота 520мг NaNO2 (7,6ммоль) розчиняють в 2мл води і прикрапують до розчину 1,3г 2-аміно-4трифторметил-бензойної кислоти (6,5ммоль) в 34 2,6мл 48% водного розчину HBF4 і 30мл етанолу при 0°С. 10 хвилин перемішують при 0°С, потім нагрівають до КТ. Далі додають 0,3мл 48% водного розчину HBF4, потім 30мл етанолу, 0,9г етилового ефіру акрилової кислоти (9,0ммоль) і 26,9мг Pd(OAc)2 (0,12ммоль). Потім суміш перемішують 1 годину при 50-60°С. Потім розчинник відганяють під вакуумом, залишок змішують з 25мл ЕА і промивають спочатку 25мл 1N водного розчину HCI, потім 25мл насиченого водного розчину NaCl. Органічну фазу сушать над Na2SO4, і розчинник відганяють під вакуумом. Залишок суспендують в 25мл гептану і відфільтровують продукт, що випав. Вихід 1,3г (69%) ясно-коричнюватої твердої речовини. Аналітичну пробу очищають кристалізацією з гептану/етилацетату. ЯМР-спектр ідентичний продукту, отриманому в прикладі 3а. d) етиловий ефір (Е)-3-[2-(2,2,2-трифторетилкарбамоїл)-5-трифторметил-феніл]-акрилової кислоти 1,3г 2-(2-етоксикарбоніл-вініл)-4трифторметил бензойної кислоти (4,5ммоль) і 453мг 2,2,2-трифтор-етиламін (4,5ммоль) розчиняють в 5мл ДМФ і додають 0,93г ДЦГКДІ (DCC). Суміш перемішують протягом 4год. при КТ. Побічний продукт сечовину відділяють фільтрацією, і потім розчинник відганяють під вакуумом. Осад перекристалізовують з DIP і отримують 1,6г (96%) білих кристалів. ЯМР-спектр ідентичний продукту, отриманому в прикладі 3b. e) (RS)-[3-оксо-2-(2,2,2-трифтор-етил)-6трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл]-оцтова кислота 2,2г етилового ефіру (Е)-3-[2-(2,2,2-трифторетилкарбамоїл)-5-трифторметил-феніл]-акрилової кислоти (5,9ммоль) розчиняють в 10мл метанолу і 1,5мл 5Μ водного розчину NaOH (7,5ммоль). Суміш 18год. перемішують при КТ і потім встановлюють рН=7 водним розчином НСI. Розчинники відганяють під вакуумом, і залишок суспендують в 10мл води. У цій суспензії встановлюють рН=2 за допомогою 2N водного розчину НСI, і 3 рази екстрагують ЕА (по 10мл). Сушать над Na2SO4, і розчинник відганяють під вакуумом. Залишок піддають кристалізації з системою діетиловий ефір/ДІП(ОІР), т.пл.: 202-204°С. Вихід 1,8г (89%). 35 83883 36 1 H-ЯМР (400МГц, CDCI3): d=3,07 (дд, J1=17Гц, J2=6Гц, 1 Η), 3,23 (дд, J1=17Гц, J2=5Гц, 1 Η), 4,27 (м, 1 Η), 4,58 (м, 1 Η), 5,08 (τ, J=5Гц, 1 Η), 7,91 (д, J=8Гц, 1 Η), 7,96 (д, J=8Гц, 1 Η), 8,12 (с, 1 Η), 12,50 (ш.с, 1 Η) ч/млн. Елементарний аналіз спалюванням: C13H9F6NO 3 (341,2): розр. С 45,76, Η 2,66, N4,10; отрим. С 45,71, Η 2,43, Ν 4,11. f) етиловий ефір (RS)-[3-оксо-2-(2,2,2-трифторетил)-6-трифторметил-2,3-дигідро-1Н-ізоіндол-1іл]-оцтової кислоти (м, 1 Η), 4,64 (м, 1 Η), 5,18 (м, 1 Η), 6,65 (ш.с, 2 Η), 7,75 (ш.с, 2 Η), 7,88 (д, J=8Гц, 1 Η), 7,95 (д, J=8Гц, 1 Η), 8,02 (с, 1 Η) ч/млн. C14H12F 6N4O 2´C 4H8O2 (426,33): розр. С 45,08, Η 3,78, Ν 13,14; знайд. С 45,07, Η 3,79, Ν 13,01. Приклад 3 а) 2-((Е)-2-етоксикарбоніл-вініл)-4трифторметил-бензойна кислота (Варіант прикладу 2с) 2,6мл SOCl2 (35ммоль) розчиняють в 20мл етанолу і додають 3,4г (R,S)-[3-оксо-2-(2,2,2трифтор-етил)-6-трифторметил-2,3-дигідро-1Нізоіндол-1-іл]-оцтової кислоти (10ммоль) при 10°С. 18год. перемішують при КТ і потім летючі компоненти відганяють під вакуумом. Залишок піддають хроматографії на кизельгелі з системою елюентів НЕР/ЕЕ 3:1. Вихід 3,0г (81%) безбарвного масла, яке кристалізується з гептану у вигляді бежевої твердої речовини. ЯМР-спектр ідентичний продукту, отриманому в прикладі 4. g)(RS)-N-{2-[3-оксо-2-(2,2,2-трифтор-етал)-6трифторметил-2,3-дигідро-Н-ізоіндол-1-іл]ацетил}гуанідин До 339г 2-аміно-4-трифторметил-бензойної кислоти (1,65моль) в 6,8л ЕtOН (безводного) додають при КТ 658мл 48-50% водного розчину HBF4. При цьому температура підвищується від 21°С до 26°С. Потім суміш охолоджують до 0°С, і прикрапують розчин 125г NaNO2 в 500мл води протягом 17 хвилин між 0°С і 5°С. При цьому з спочатку блідо-жовтого розчин спочатку перетворювався в оранжево-червону суспензію, а потім в ясно-жовту суспензію. Хід реакції відстежують з допомогою ВЕРХ (метод В; час утримання 2аміно-4-трифторметил-бензойної кислоти =6,4хв.; побічного продукту солі 2-карбокси-5трифторметил-бензолдіазонію =1,1хв.). Протягом 30 хвилин закінчують перетворення солі 2карбокси-5-трифторметил-бензолдіазонію до >99%. Потім до суміші додають 231г етилового ефіру акрилової кислоти (2,31моль), 11,1г Pd(OAc)2 (49ммоль) і 6,8л етанолу (безводного), і реакційну суміш нагрівають до 49-51°С. При цьому спостерігають рівномірне виділення азоту, що збільшується з підвищенням температури. Перетворення відбувається з допомогою ВЕРХ (метод В; час утримування 2-((Е)-2~етоксикарбоніл-вініл)-4трифторметил-бензойної кислоти =16,4хв.). Через 45хв. ступінь перетворення складає більше 99%. Потім суміш охолоджують до КТ, і розчинник відганяють під вакуумом. Залишок змішують з 3л ЕА і відфільтровують. Потім фільтрат промивають спочатку 3 рази водним розчином НСl (по 2,1л), потім 1л насиченого водного розчину NaCl. Сушать над Na2SO4, розчинник відганяють під вакуумом і отримують 449г ясно-коричневої твердої речовини. При включенні домішки (4-трифторметилбензойна кислота; 6,3%) і залишків розчинника (ЕА; 4%) ви хід становить 83%. Аналітичну пробу очищають за допомогою кристалізації з суміші гептан/етилацетат. Т.пл.: 132-133°С. 1 H-ЯМР (400МГц, CDCl3): d=1,36 (τ, J=7Гц, 3 Η), 4,31 (кв, J=7Гц, 2 Η), 6,41 (д, J=16Гц, 1 Η), 7,72 (д, J=8Гц, 1 Η), 7,86 (с, 1 Η), 8,21 (д, J=8Гц, 1 Η), 8,51 (д, J=16Гц, 1 Η), 8,5-9,5 (ш.с, 1 Η) ч/млн. Елементарний аналіз спалюванням: C13H11F 3O 4 (288,23): розр. С 54,17, Η 3,85; знайд. С 54,24, Η 3,74. Гуанідин-гідрохлорид (11,5г, 120ммоль) розчиняють в НМП (NMP) (45мл) і додають KOtBu (11,2г, 100ммоль) при перемішуванні, 1,5 години перемішують при КТ і суміш фільтрують. Фільтрат прикрапують до розчину етилового ефір у (RS)-[3-оксо2-(2,2,2-трифтор-етил)-6-трифторметил-2,3дигідро-1Н-ізоіндол-1-іл]-оцтової кислоти (7,38г, 20ммоль) в НМП (NMP) (12мл) при перемішуванні при КТ і залишають перемішуватися протягом 60хв. при КТ. Потім додають крижану воду (270мл), встановлюють pH 7 з допомогою 2N НСl, додають етилацетат (60мл) і потім шляхом додавання розчину NaHCO3 встановлюють значення pH на рівні 8-8,5. Суміш сильно перемішують протягом 1 години при КТ, відсмоктують осад, що утворюється, і промивають водою. Отримують 7,06г (83%) (R,S)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6-трифторметил-2,3-дигідро-Н-ізоіндол-1-іл]ацетил}гуанідину, сполуку включення з 0,5 еквівалентами етилацетату, у вигляді ясно-жовтих кристалів, т.пл. 160-161 °С при повільному нагріванні, виділення етилацетату близько 90°С. Rf (етилацетат/метанол)=0,45 1 H-ЯМР (400МГц, CDCl3): d=2,54 (дд, J1=8Гц, J2=16Гц, 1 Η), 3,09 (дд, J1=4Гц, J2=16Гц, 1 Η), 4,25 37 83883 38 b) етиловий ефір (Е)-3-[2-(2,2,2трифторетилкарбамоїл)-5-трифторметил-феніліакрилової кислоти 315г оксалілхлориду (2,48моль) при температурі між 15 і 18°С протягом 24хв. додають до суміші з 650г 2-((Е)-2-етоксикарбоніл-вініл)-4трифторметил-бензойної кислоти (2,25моль), 33мл ДМФ і 7,8л СН2Сl2. Під час додавання спостерігають газовиділення. 1 годину перемішують при КТ, потім охолоджують до 5°С і додають 285г Et3N (2,81моль) при температурі між 5°С і 10°С протягом 27хв. Перемішують 10хв. при 5°С, потім додають 279г 2,2,2-трифтор-етиламін (2,81моль) при температурі між 9°С і 20°С протягом 27хв. 10хв. перемішують при КТ, при цьому випадає тонкий осад, і для поліпшення перемішуваності суміші додатково додають 1л СН2Сl2. Реакцію відстежують з допомогою ВЕРХ (метод С; час утримування: 2-((Е)-)(2-етоксикарбоніл-вініл)-4трифторметил-бензойна кислота =5,9хв.; час утримування: етиловий ефір (Е)-3-[2-(2,2,2трифторетилкарбамоїл)-5-трифторметил-феніл]акрилової кислоти =13,2хв.). Після подальших 50хв. перемішування при КТ перетворення закінчене. Потім летючі компоненти відганяють під вакуумом, залишок змішують з 12л ЕА і промивають 3 рази водою (по 2,5л), потім 2 рази насиченим водним розчином NaHCO3 (по 2,5л) і, нарешті, 1,5л насиченого водного розчину NaCl. Сушать над MgSO4 , розчинник відганяють під вакуумом і отримують 802г етилового ефіру (Е)-3-[2-(2,2,2трифторетилкарбамоїл)-5-трифторметил-феніл]акрилової кислоти у вигляді коричневої твердої речовини. Цей необроблений продукт об'єднують з сировиною з іншого осаду (177г) і розчиняють в 3л ЕА при 60-70°С, і при цій температурі змішують з 14л HEP порціями по 1л. Потім суміш нагрівають до 80°С і 1,5 години перемішують при цій температурі. Потім цю суміш додають до 5,6л нагрітого до 70°С ПЕР, і потім суміш при перемішуванні протягом 5год. охолоджують до КТ. Потім продукт відфільтровують, промивають 3л HEP, сушать на повітрі і отримують 689г етилового ефіру (Е)-3-[2(2,2,2-трифторетилкарбамоїл)-5-трифторметилфеніл]-акрилової кислоти (67%) у вигляді яснокоричневої твердої речовини. Т.пл.: 161,5-162°С. 1 H-ЯМР (400МГц, CDCl3): d=1,33 (τ, J=7Гц, 3 Η), 4,05 (м, 2 Η), 4,26 (кв, J=7Гц, 2 Η), 6,19 (ш.с, 1 Η), 6,46 (д, J=16Гц, 1 Η), 7,63 (д, J=8Гц, 1 Η), 7,68 (д, J=8Гц, 1 Η), 7,87 (с, 1 Η), 7,90 (д, J=16Гц, 1 Η) ч/млн. Елементарний аналіз спалюванням: C15H13F 6NO3 (369,27): розр. С 48,79, Η 3,55, Ν 3,79; знайд. С 48,93, Η 3,51, Ν 3,92. с) (RS)-N-{2-[3-оксо-2-(2,2,2-трифтор-етил)-6трифторметил-2,3-дигідро-Н-ізоіндол-1-іл]ацетил}гуанідин 386г етилового ефіру (Е)-3-[2-(2,2,2трифторетилкарбамоїл)-5-трифторметил-феніл]акрилової кислоти (1,05моль) суспендують в 600мл ДМФ і при температурі між 5°С і 15°С порційно повільно додають 4,7г KOtBu (42ммоль). Циклізацію з утворенням ізоіндолону відстежують з допомогою ТШХ (HEP/ЕЕ=2:1; етиловий ефір акрилової кислоти: Rf = 0,32; ізоіндолон: Rf=0,41). Через годину перетворення закінчене. В проміжку часу 587г KOtBu суспендують в 2,2л ДМФ і додають 600г гуанідиній-хлориду при температурі між 20°С і 25°С. Суміш перемішують 1 годину при 25°С і потім відфільтровують КСl. Фільтрат з вивільненим гуанідином потім додають до реакційної суміші, що містить ізоіндолон, і 2 години перемішують при КТ. Перетворення з утворенням ацилгуанідину відстежують з допомогою ВЕРХ (метод В; довжина хвилі 230нм і 254нм; ізоіндолон: час утримування =15,1хв.; ацилгуанідин: час утримування =2,9хв.). Потім реакційну суміш виливають в 14л крижаної води, за допомогою водного розчину НСl встановлюють pH=8,5-9,0 і 4 рази екстрагують ЕА (по 3л). Потім промивають 3 рази по 3л насиченим водним розчином NaCl, сушать над Na2SO4 і розчинник відганяють під вакуумом. Отримують 329г (82%) коричневої твердої речовини. Продукт об'єднують з 3 іншими осадами з таких же способів отримання; загальна кількість 842г. Ці 842г (2,2моль) настоюють в 2л ЕА і 5л Et2 O 2 години при 30°С. Потім відфільтровують тверду речовину, промивають 2 рази по 2л Еt2О і сушать під вакуумом. Отримують 693г (82% регенерації) майже білої твердої речовини. Сполука викристалізовується з 2пропанолу як сполука включення з 0,5 еквівалентами 2-пропанолу. ЯМР-спектр ідентичний S-енантіомеру, отриманому в прикладі 5b. Приклад 4 Етиловий ефір (RS)-(2-(2,2,2-трифторетил)-3оксо-6-трифторметил-2,3-дигідро-1Н-ізоіндол-1іл)-оцтової кислоти за допомогою реакції в одній посудині, виходячи з 2-((Е)-2-етоксикарбоніл-вініл)4-трифторметил-бензойної кислоти До суспензії 2-((Е)-2-етоксикарбоніл-вініл)-4трифторметил-бензойної кислоти (2,9г, 10,1ммоль) в толуолі (30мл) додають при кімнатній температурі SOCl2 (1,98г, 27,2ммоль). Перемішують 5хв. при кімнатній температурі і потім нагрівають протягом 30хв. до 105°С (температура бані). Приблизно при 70°С починається газовиділення. Перемішують 3 години при 105°С, потім охоло 39 83883 джують до кімнатної температури і відсмоктують через шар кизельгура (2,5´0,5см), промивають толуолом і фільтрат випаровують під вакуумом. Отримують хлорангідрид в формі червонокоричневого масла (3,34г). 2,2,2-трифторетиламін (1,2г, 12,1ммоль) і триетиламін (2,58г, 25,3ммоль) розчиняють в дихлорметані (15мл) при 5°С і при охолоджуванні льодом прикрапують хлорангідрид, розчинений в дихлорметані (20мл), з такою швидкістю, що температура зберігається між 5°С і 10°С. Потім баню з льодом видаляють, і надлишок трифторетиламіну і частину дихлорметану відганяють під легким вакуумом. Потім суміш 10год. нагрівають до кипіння із зворотним холодильником. Після охолоджування суміш розбавляють дихлорметаном (50мл) і двічі струшують з водним розчином 2Ν НСl (по 50мл), об'єднані органічні фази промивають водою (100мл), суша ть над Na2SO4 і випарюють під вакуумом. Отримують етиловий ефір (RS)-(2-(2,2,2-трифторетил)-3-оксо-6трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл)оцтової кислоти (3,51г, 94%) у вигляді темнокоричневого масла, яке очищають кристалізацією з н-гептану. Т.пл.: 54,5-55,5°С. 1 H-ЯМР (400МГц, CDCl3): d=1,15 (τ, J=7Гц, 3 Η), 2,85 (дд, J1=6Гц, J2=16Гц, 1 Η), 3,01 (дд, J1=5Гц, J2=16Гц, 1 Η), 3,83 (м, 1 Η), 4,12 (кв, J=7Гц, 2 Η), 4,73 (м, 1 Η), 5,17 (τ, J=6Гц, 1 Η), 7,80 (м, 2 Η), 8,01 (д, J=8Гц, 1 Η) ч/млн. Елементарний аналіз спалюванням: C15H13F 6NO3 (369,27): розр. С 48,79, Η 3,55, Ν 3,79; знайд. С 48,54, Η 3,49, Ν 3,79. Приклад 5 а) (S)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, сіль О,О'-дибензоїл-L-винної кислоти (RS)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин (сполука включення з етилацетатом, вміст 87,06% у відповідності з ЯМР, 44г, 100ммоль) і О,О'-дибензоїл-L-винну кислоту (11,2г, 31ммоль) використовують у вигляді твердих речовин і при перемішуванні прикрапують 2-пропанол (500мл). При цьому тверді речовини розчиняються спочатку повністю, потім випадас білий осад. Через 30хв. суміш нагріваьоть до 70°С. При цьому знову виникає майже прозорий розчин. Його протягом 4год. охолоджують до кімнатної температури і потім при цій температурі перемішують протягом ночі. Після цього перемішують ще 4 години при 10°С і потім відсмоктують. Осад двічі промивають 2-пропанолом (по 100мл) і сушать на повіт 40 рі. Отримують 28,05г (S)-N-{2-[3-оксо-2-(2,2,2трифторетил)-6-трифторметил-2,3-дигідро-1Нізоіндол-1-іл]-ацетил}гуанідин, сіль Ο,Ο'-дибензоїлL-винної кислоти (74% вихід в розрахунку на (S)енантіомер), чистота енантіомеру 82% у відповідності з ВЕРХ (Chiracel OD/21, 250´4,6мм, нгептан/етанол/метанол 50:5:2, 1мл/хв., 30°С) у вигляді безбарвних кристалів. Беруть 20г (14,6ммоль) цих кристалів і прикрапують 2пропанол (400мл). Суміш при перемішуванні нагрівають до 80°С і потім залишають повільно охолоджуватися до кімнатної температури. Ще 2 години перемішують при цій температурі і потім відсмоктують, осад двічі промивають 2-пропанолом (по 50мл) і сушать на повітрі. Отримують 16,3г (100% вихід в розрахунку на (S)-енантіомер) (S)-N-{2-[3okco-2-(2,2,2-трифторетил)-6-трифторметил-2,3дигідро-1Н-ізоіндол-1-іл]-ацетил}гуанідин, сіль О,О'-дибензоїл-L-винної кислоти у вигляді безбарвних кристалів, т.пл.: 192-193°С, чистота енантіомеру >97% у відповідності з ВЕРХ (умови див. вище). Елементарний аналіз спалюванням: C14H12F 6N4O 2´1/2 С18Н14O 8 (561,43): розр. С 49,21, Η 3,41, Ν 9,98; знайд. С 49,17, Η 3,30, Ν 9,97. b) (S)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6трифторметил-2,3-дигідро-1Н-ізоіндол-1-іліацетил}гуанідин (S)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, сіль О,О'-дибензоїл-L-винної кислоти (113мг, 0,20ммоль) розчиняють в суміші з води (1мл) і етилацетату (5мл) і додають розчин NaHCO3 (50мг) у воді (7,5мл). Суміш перемішують 16год. при кімнатній температурі і потім тричі екстрагують етилацетатом (по 5мл). Об'єднані органічні фази один раз струшують з розчином NaHCO3 (50мг) у воді (20мл) і потім з чистою водою (20мл), сушать Na2SO4 і випарюють у вакуумі. Отримують 75мг (97%) (S)-N-{2-[3-оксо-2-(2,2,2-трифторетил)6-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідину. Продукт кристалізується з 2пропанолу у вигляді сполуки включення з 0,5 еквівалентами 2-пропанолу, т.пл.: 80-82°С. Речовина також може бути перекристалізована з етилацетату і кристалізована з 0,5 еквівалентами етилацетату, т.пл.: 121,5-122°С. Чистота енантіомеру >97% у відповідності з ВЕРХ (Chiracel OD/21, 250´4,6мм, н-гептан/2пропанол 4:1, 1мл/хв., 30°С). 1 H-ЯМР (400МГц, CDCl3): d=2,54 (дд, J1=8Гц, J2=16Гц, 1 Η), 3,09 (дд, J1=4Гц, J2=16Гц, 1 Η), 4,25 (м, 1 Η), 4,64 (м, 1 Η), 5,18 (м, 1 Η), 6,65 (ш.с., 2 Η), 7,75 (ш.с., 2 Η), 7,88 (д, J=8Гц, 1 Η), 7,95 (д, J=8Гц, 1 Η), 8,02 (с, 1 Η) ч/млн. Елементарний аналіз спалюванням (Сполука включення з 0,5 еквівалентами 2-пропанолу): 41 83883 C14H12F 6N4O 2´ 1 C3H8O (412,32): розр. С 45,15, Η 2 3,91, Ν 13,59; знайд. С 45,23, Η 4,27, Ν 13,10. Приклад 6 (RS)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин за допомогою рацемування (R)-N{2-[3-okco-2-(2,2,2-трифторетил)-6-трифторметил2,3-дигідро-1Н-ізоіндол-1-іл]-ацетил}гуанідину (R)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин (сполука включення з 0,5 еквівалентами 2-пропанолу (М=412,3), 43г, 104ммоль, отриманий шляхом концентрування маточного розчину, який утворюється при осадженні (S)-N-{2[3-okco-2-(2,2,2-трифторетил)-6-трифторметил2,3-дигідро-1Н-ізоіндол-1-іл]-ацетил}гуанідин, солі О,О'-дибензоїл-L-винної кислоти в прикладі 5а), і обробки з NaHCO3 як описано в прикладі 5b) розчиняють в 2-проианолі (1,8л) і при кімнатній температурі при перемішуванні додають розчин КОН (85%.. 660мг, 10ммоль) в 2-пропанолі (400мл). Суміш перемішують 24 години при кімнатній температурі і потім підкисляють крижаною оцтовою кислотою (720мг, 1,5мл), випарюють під вакуумом при макс. температурі в бані 40°С, і залишок розподіляють між водою (500мл) і етилацетатом (400мл). Водну фазу двічі стр ушують з етилацетатом (по 300мл). Об'єднані органічні фази струшують з розчином NaHCO3 (10г) у воді (500мл) і потім ще раз з чистою водою. Органічну фазу сушать з Na2SO4 і випарюють під вакуумом при макс. температурі бані 40°С. Отримують 39,8г (RS)-N-{2-[3okco-2-(2,2,2-трифторетил)-6-трифторметил-2,3дигідро-1Н-ізоіндол-1-іл]-ацетил}гуанідину, вміст 87% у відповідності з ЯМР, сполуку включення з 0,5 еквівалентами етилацетату, у вигляді ясножовтих кристалів, вихід 87%. Т.пл.: 164-166°С при повільному нагріванні, видалення етилацетату ок. 100°С. Співвідношення енантіомерів 49:51 у відповідності з ВЕРХ (Chiracel OD/21, 250´4,6мм, нгептан/2-пропанол 4:1, 1мл/хв., 30°С). Приклад 7 (S)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6трифторметил-2.3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин гідрофумарат гідрат (S)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6трифторметил-2,3-Дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин (сполука включення з 0,5 еквівалентами 2-пропанолу, (М=412,3), 110г, 266ммоль) 42 розчиняють в диметоксіетані (2л) і змішують з розчином фумарової кислоти (0,5Μ в суміші диметоксіетан/вода 9:1, 512мл) і утворений прозорий розчин випарюють під вакуумом. Залишок змішують з дихлорметаном (2л), і суміш знову випарюють під вакуумом. Залишок суспендують у воді (1,5л), відсмоктують при кімнатній температурі і протягом ночі сушать на повітрі при кімнатній температурі. Отримують 125,9г (95%) (S)-N-{2-[3-оксо-2-(2,2,2трифторетил)-6-трифторметил-2,3-дигідро-1Нізоіндол-1-іл]-ацетил}гуанідин гідрогенфумарат гідрату у вигляді безбарвних кристалів. Т.пл. 210´С. Визначення інгібування NHE Концентрацію інгібування ІС 50 Для пригнічення NHE-1 визначали таким чином: ІС50 для пригнічення NHE-1 визначали аналізом FLIPR за допомогою вимірювання зростання pHі, в трансфікованих лініях клітин, які експресують NHE-1 людини. Аналіз проводили в приладі FLIPR (флуометричний планшетний рідер) з 96-ямковим мікротитраційним планшетом (з чорними стінками) з прозорим дном. Трансфіковані лінії клітин, які експресують різні підтипи NHE (батьківська лінія LAP-1 як результат мутагенезу і подальшої селекції не характеризується ніякою ендогенною ΝHΕ активністю), висівали в попередній день з густиною ~25000 клітин/ на ямку. Поживне середовище трансфікованих клітин (Iscove +10% зародкової телячої сироватки) додатково містить G418 як селекційний антибіотик, щоб забезпечувати присутність трансфікованих послідовностей. Безпосередній аналіз починають з видалення поживного середовища і додавання 100мкл/на ямку навантажуваного буфера (5мкМ BCECF-AM [2',7'-біс-(карбоксіетил)][-5-(і-6)][карбоксифлуоресцеїн, складний ацетоксиметиловий ефір] в 20мМ NH4Cl, 115мМ холінхлориду, 1мМ MgCl2, 1мМ СаСl2, 5мМ КСl, 20мМ HEPES, 5мМ глюкози; pH 7,4 [встановлений КОН]). Потім клітини протягом 20 хвилин інкубують при 37°С. Ця інкубація приводить до навантаження клітин флуоресцуючим барвником, інтенсивність флуоресценції якого залежить від рНі, і NH4Cl, що приводить до слабкої лужності клітин. Барвник, що не флуоресціює, попередньої стадії BCECF-AM у вигляді складного ефіру є мембранопроникним. Внутрішньоклітинно з допомогою естерази вивільняється безпосередній барвник BCECF, який є не мембранопроникним. Після 20-хвилинної інкубації видаляють навантажувальний буфер, що містить NH4Cl і вільний BCECF-AM, шляхом трикратного промивання в промивальнику клітин (Tecan Columbus), кожен раз використовуючи по 400мкл промивального буфера (133,8мМ холінхлориду, 4,7мМ КСl, 1,25мМ MgCl2, 1,25мМ СаСl2, 0,97мМ К2НРО 4, 0,23мМ KH2PO4, 5мМ HEPES, 5мМ Glucose; pH 7,4 [встановлений КОН]). Залишковий об'єм, що залишається в ямці, становить 90мкл (можливо 50-125мкл). Ця стадія промивання видаляє вільний BCECF-AM і як наслідок веде до видалення зовнішніх іонів NH 4+ до внутрішньоклітинного підкислення (~рНі 6,3-6,4). 43 83883 Оскільки рівновага внутрішньоклітинних іонів NH4+ з NH3 і Н+ порушується внаслідок видалення позаклітинних іонів NH4+ і за допомогою подальших переходів NH3 через клітинну мембрану, що протікають вмить, процес промивання веде до того, що вн утрішньоклітинні Н+ залишаються, що є причиною внутрішньоклітинного підкислення. У кінцевому результаті це може привести до смерті клітин, якщо вони утримуються досить довго. У цьому положенні було важливо, що промивальний буфер не містив натрію (
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for producing (3-oxo-2,3-dihydro-1h-isoindol-1-yl) acetylguanidine derivatives
Автори англійськоюSchubert Gerrit, Keil Johannes, Kleemann Heinz-Werner, Hanna Reda, Huang Bao-Guo, Wu Xiao-Dong, Gouraud Yves
Назва патенту російськоюСпособ получения производных (3-оксо-2,3-дигидро-1н-изоиндол-1-ил)ацетилгуанидина
Автори російськоюШуберт Геррит, Кайль Йоханнес, Клееманн Хайнц-Вернер, Ханна Реда, Хуан Бао-Го, У Сяо-Дун, Гуро Ив
МПК / Мітки
МПК: C07D 209/46, C07C 233/66
Мітки: отримання, 3-оксо-2,3-дигідро-1н-ізоіндол-1-іл)ацетилгуанідину, похідних, спосіб
Код посилання
<a href="https://ua.patents.su/22-83883-sposib-otrimannya-pokhidnikh-3-okso-23-digidro-1n-izoindol-1-ilacetilguanidinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання похідних (3-оксо-2,3-дигідро-1н-ізоіндол-1-іл)ацетилгуанідину</a>
Попередній патент: Нероз`ємна заморожена модель
Наступний патент: Спосіб формування електронного потоку в приладах з холодним вторинно-емісійним катодом та неоднорідним магнітним полем
Випадковий патент: Похідна бензилпіперазину, її застосування при лікуванні різних розладів та фармацевтична композиція, що її містить












