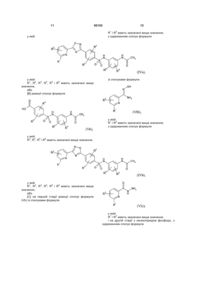
Заміщені арилсульфонаміди як противірусні засоби
Номер патенту: 95103
Опубліковано: 11.07.2011
Автори: Свенструп Нільс, Хеннінгер Керстін, Шое-Лооп Рудольф, Шумахер Йоахім, Хаймбах Дірк, Картхаус Дагмар, Ланг Дітер, Паульсен Даніела, Гьоллер Андреас, Ціммерманн Хольгер, Рідл Бернд, Вунберг Тобіас
Формула / Реферат
1. Сполука формули
 , (I)
, (I)
у якій
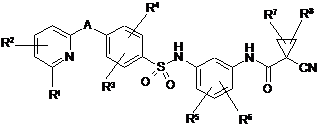
А означає групу формули
![]() ,
, ![]() ,
,
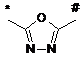 або
або ![]() ,
,
у якій
* вказує місце зв'язування з атомом вуглецю піридинільного кільця,
та
# вказує місце зв'язування з атомом вуглецю фенільного кільця,
R1 означає водень, аміногрупу або метилкарбоніламіногрупу,
R2 означає водень або галоген,
R3 означає водень, галоген або ціаногрупу,
R4 означає водень, галоген або ціаногрупу,
R5 означає водень або галоген,
R6 означає водень або галоген,
R7 означає водень, галоген або С1-С3-алкіл,
R8 означає водень, галоген або С1-С3-алкіл,
або одна з її солей, її сольватів або сольватів її солей.
2. Сполука за п. 1, яка відрізняється тим, що
А означає групу формули
![]() або
або ![]() ,
,
у якій
* вказує місце зв'язування з атомом вуглецю піридинільного кільця, та
# вказує місце зв'язування з атомом вуглецю фенільного кільця,
R1 означає водень, аміногрупу або метилкарбоніламіногрупу,
R2, R3 і R4 означають водень,
R5 означає водень або галоген,
R6 означає водень або галоген,
R7 і R8 означають водень,
або одна з її солей, її сольватів або сольватів її солей.
3. Сполука за п. 1 або 2, яка відрізняється тим, що
А означає групу формули
![]() ,
,
у якій
* вказує місце зв'язування з атомом вуглецю піридинільного кільця, та
# вказує місце зв'язування з атомом вуглецю фенільного кільця,
R1 означає аміногрупу або метилкарбоніламіногрупу,
R2, R3 і R4 означають водень,
R5 означає водень,
R6 означає водень або галоген,
R7 і R8 означають водень,
або одна з її солей, її сольватів або сольватів її солей.
4. Спосіб одержання сполуки формули (І) за п. 1, який відрізняється тим, що сполуку формули
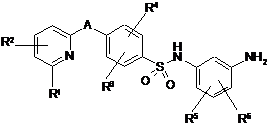 , (II)
, (II)
у якій
A, R1, R2, R3, R4, R5 і R6 мають значення за п. 1,
вводять у реакцію зі сполукою формули
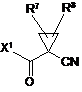 , (ІІІ)
, (ІІІ)
у якій
R7 і R8 мають значення за п. 1, і
X1 означає галоген, краще хлор або бром, або гідроксигрупу.
5. Сполука за будь-яким з пп. 1-3, призначена для лікування і/або профілактики захворювань.
6. Лікарський засіб, який містить сполуку за будь-яким з пп. 1-3 у комбінації з інертним, нетоксичним, фармацевтично прийнятним інертним наповнювачем.
7. Лікарський засіб за п. 6, призначений для лікування і/або профілактики вірусних інфекцій.
8. Застосування сполуки за будь-яким з пп. 1-3 для приготування лікарського засобу, призначеного для лікування і/або профілактики вірусних інфекцій.
9. Застосування за п. 8, яке відрізняється тим, що вірусна інфекція являє собою інфекцію цитомегаловірус людини (ЦМВЛ) або інший представник групи herpes viridae (віруси герпесу).
10. Спосіб боротьби з вірусними інфекціями у людей і тварин шляхом введення противірусно ефективної кількості принаймні однієї сполуки за будь-яким з пп. 1-3.
11. Спосіб боротьби з вірусними інфекціями у людей і тварин шляхом введення противірусно ефективної кількості лікарського засобу за п. 6.
Текст
1. Сполука формули R7 R2 N R1 S R3 O H N H N O N N , * # , у якій * вказує місце зв'язування з атомом вуглецю піридинільного кільця, та # вказує місце зв'язування з атомом вуглецю фенільного кільця, 1 R означає водень, аміногрупу або метилкарбоніламіногрупу, 2 R означає водень або галоген, 3 R означає водень, галоген або ціаногрупу, 4 R означає водень, галоген або ціаногрупу, 5 R означає водень або галоген, у якій * вказує місце зв'язування з атомом вуглецю піридинільного кільця, та # вказує місце зв'язування з атомом вуглецю фенільного кільця, 1 R означає водень, аміногрупу або метилкарбоніламіногрупу, 2 3 4 R , R і R означають водень, 5 R означає водень або галоген, 6 R означає водень або галоген, 7 8 R і R означають водень, (11) # R означає водень або галоген, 7 R означає водень, галоген або С1-С3-алкіл, 8 R означає водень, галоген або С1-С3-алкіл, або одна з її солей, її сольватів або сольватів її солей. 2. Сполука за п. 1, яка відрізняється тим, що А означає групу формули N O O N * # * # N N або , 95103 6 # або , UA O R6 (19) * CN (I) O R5 у якій А означає групу формули O N N O # * * N N , R8 C2 R4 A (13) (21) a200811582 (22) 26.02.2007 (24) 11.07.2011 (86) PCT/EP2007/001620, 26.02.2007 (31) 10 2006 009 928.1 (32) 03.03.2006 (33) DE (46) 11.07.2011, Бюл.№ 13, 2011 р. (72) СВЕНСТРУП НІЛЬС, DK/DE, ЦІММЕРМАНН ХОЛЬГЕР, DE, КАРТХАУС ДАГМАР, DE, ГЬОЛЛЕР 3 95103 або одна з її солей, її сольватів або сольватів її солей. 3. Сполука за п. 1 або 2, яка відрізняється тим, що А означає групу формули O N * # N , 4 # вказує місце зв'язування з атомом вуглецю фенільного кільця, 1 R означає аміногрупу або метилкарбоніламіногрупу, 2 3 4 R , R і R означають водень, 5 R означає водень, 6 R означає водень або галоген, 7 8 R і R означають водень, або одна з її солей, її сольватів або сольватів її солей. 4. Спосіб одержання сполуки формули (І) за п. 1, який відрізняється тим, що сполуку формули у якій * вказує місце зв'язування з атомом вуглецю піридинільного кільця, та R4 A R2 N S R3 R1 O H N NH2 O R5 у якій 1 2 3 4 5 6 A, R , R , R , R , R і R мають значення за п. 1, вводять у реакцію зі сполукою формули R8 R7 (ІІІ) X1 CN O , у якій 7 8 R і R мають значення за п. 1, і 1 X означає галоген, краще хлор або бром, або гідроксигрупу. 5. Сполука за будь-яким з пп. 1-3, призначена для лікування і/або профілактики захворювань. 6. Лікарський засіб, який містить сполуку за будьяким з пп. 1-3 у комбінації з інертним, нетоксич Даний винахід стосується заміщених арилсульфонамідів і способів їх одержання, а також їх застосування для приготування лікарських засобів, призначених для лікування і/або профілактики захворювань, особливо застосування як противірусних засобів, переважно - для боротьби з цитомегаловірусами. В WO 02/085869 описані заміщені арилсульфонаміди як противірусні засоби, особливо для боротьби із цитомегаловірусами. Одним об'єктом даного винаходу є нові сполуки, які мають таку ж або більшу противірусну активність, поліпшену фармакокінетику, зокрема, більший період напіввиведення і/або поліпшену (II) R6 , ним, фармацевтично прийнятним інертним наповнювачем. 7. Лікарський засіб за п. 6, призначений для лікування і/або профілактики вірусних інфекцій. 8. Застосування сполуки за будь-яким з пп. 1-3 для приготування лікарського засобу, призначеного для лікування і/або профілактики вірусних інфекцій. 9. Застосування за п. 8, яке відрізняється тим, що вірусна інфекція являє собою інфекцію цитомегаловірус людини (ЦМВЛ) або інший представник групи herpes viridae (віруси герпесу). 10. Спосіб боротьби з вірусними інфекціями у людей і тварин шляхом введення противірусно ефективної кількості принаймні однієї сполуки за будьяким з пп. 1-3. 11. Спосіб боротьби з вірусними інфекціями у людей і тварин шляхом введення противірусно ефективної кількості лікарського засобу за п. 6. доступність при пероральному введенні, шляхи метаболічного розкладання яких для людей і звичайних піддослідних тварин, таких як щури та собаки, значно не розрізняються, призначені для лікування вірусних інфекційних захворювань у людей та тварин. Відповідно до винаходу несподівано було встановлено, що заміщені арилсульфонаміди, описані в даному винаході, мають противірусну активність, мають поліпшені фармакокінетичні характеристики і що шляхи їх метаболічного розкладання в людей, щурів і собак значно не розрізняються. Даний винахід стосується сполук формули 5 у якій А означає групу формули у якій * вказує місце зв'язування з атомом вуглецю піридинільного кільця, та # вказує місце зв'язування з атомом вуглецю фенільного кільця, 1 R означає водень, аміногрупу або метилкарбоніламіногрупу, 2 R означає водень або галоген, 3 R означає водень, галоген або ціаногрупу, 4 R означає водень, галоген або ціаногрупу, 5 R означає водень або галоген, 6 R означає водень або галоген, 7 R означає водень, галоген або С1-С3-алкіл, 8 R означає водень, галоген або С1-С3-алкіл, і їх солей, їх сольватів і сольватів їх солей. Сполуки, пропоновані в даному винаході, являють собою сполуки формули (І) і їх солі, сольвати та сольвати солей; а також сполуки, зазначені нижче, як типовий варіант (варіанти) здійснення та описуються формулою (І) і (Іа), та їх солі сольвати та сольвати солей, якщо тільки сполуки, зазначені нижче та описані формулою (І), уже не є солями, сольватами та сольватами солей. Сполуки, пропоновані в даному винаході, залежно від структури можуть існувати в стереоізомерних формах (енантіомери, діастереоізомери). Відповідно до цього даний винахід стосується енантіомерів або діастереоізомерів і відповідних їх сумішей. З таких сумішей енантіомерів і/або діастереоізомерів за відомими методиками можна виділити стереоізомерно чисті компоненти. Якщо сполуки, пропоновані в даному винаході, можуть існувати в таутомерних формах, то даний винахід включає всі такі таутомерні форми. Солями, кращими для задач даного винаходу, є фізіологічно прийнятні солі сполук, пропонованих у даному винаході. Однак в обсяг даного винаходу включені й солі, які самі непридатні для застосування у фармацевтиці, але які все-таки можна використовувати, наприклад, для виділення або 95103 6 очищення сполук, пропонованих у даному винаході. Фізіологічно прийнятні солі сполук, пропонованих у даному винаході, включають солі приєднання неорганічних кислот, карбонових кислот і сульфонових кислот, наприклад, солі хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, метансульфонової кислоти, етансульфонової кислоти, толуолсульфонової кислоти, бензолсульфонової кислоти, нафталіндисульфонової кислоти, оцтової кислоти, трифтороцтової кислоти, пропіонової кислоти, молочної кислоти, винної кислоти, яблучної кислоти, лимонної кислоти, фумарової кислоти, малеїнової кислоти та бензойної кислоти. Фізіологічно прийнятні солі сполук, пропонованих у даному винаході, також включають солі звичайних основ, таких як, наприклад і переважно солі лужних металів (наприклад, солі натрію та калію), солі лужноземельних металів (наприклад, солі кальцію та магнію) і солі амонію, одержані з аміаку або органічних амінів, які містять від 1 до 16 атомів вуглецю, таких як, наприклад і переважно етиламін, діетиламін, триетиламін, етилдіізопропіламін, моноетаноламін, діетаноламін, триетаноламін, дихлоргексиламін, диметиламіноетанол, прокаїн, дибензиламін, N-метилморфолін, аргінін, лізин, етилендіамін і N-метилпіперидин. Сольвати, для задач даного винаходу, означають такі форми сполук, пропонованих у даному винаході, які у твердому або рідкому стані утворюють комплекс шляхом координації з молекулами розчинника. Гідрати є особливою формою сольватів, у яких координація відбувається з водою. Крім того, даний винахід також стосується проліків сполук, пропонованих у даному винаході. Термін "проліки" включає сполуки, які самі можуть бути біологічно активними або неактивними, але під час присутності в організмі перетворюються в сполуки, пропоновані в даному винаході (наприклад, внаслідок метаболізму або гідролізу). Для задач даного винаходу, якщо не зазначено інше, замісники мають наступні значення. Алкіл означає лінійний або розгалужений алкільний радикал, який звичайно містить від 1 до 3, особливо краще - від 1 до 2, атомів вуглецю, наприклад і переважно - метил, етил, н-пропіл і ізопропіл. Галоген означає фтор, хлор, бром або йод, краще - фтор або хлор. У формулі групи, яка може являти собою А, кінцеві точки сусідніх відрізків, поруч із якими знаходяться значки * або #, означають не атом вуглецю 7 й не групу СН2, а ділянки зв'язків з атомами, до яких приєднані А. Перевагу надають сполукам формули (І), у якій А означає групу формули у якій * вказує місце зв'язування з атомом вуглецю піридинільного кільця, та # вказує місце зв'язування з атомом вуглецю фенільного кільця, 1 R означає водень, аміногрупу або метилкарбоніламіногрупу, 2 3 4 R , R і R означають водень, 5 R означає водень або галоген, 6 R означає водень або галоген, 7 8 R і R означають водень, і їх солям, їх сольватам і сольватам їх солей. Перевагу також надають сполукам формули (І), у якій А означає групу формули у якій * вказує місце зв'язування з атомом вуглецю піридинільного кільця, та # вказує місце зв'язування з атомом вуглецю фенільного кільця, 1 R означає аміногрупу або метилкарбоніламіногрупу, 2 3 4 R , R і R означають водень, 5 R означає водень, 6 R означає водень або галоген, 7 8 R і R означають водень, і їх солям, їх сольватам і сольватам їх солей. Перевагу також надають сполукам формули (І), у якій А означає групу формули у якій * вказує місце зв'язування з атомом вуглецю піридинільного кільця, та # вказує місце зв'язування з атомом вуглецю фенільного кільця. Перевагу також надають сполукам формули 1 (І), у якій R означає аміногрупу. Перевагу також надають сполукам формули 2 (І), у якій R означає водень. Перевагу також надають сполукам формули 3 (І), у якій R означає водень. 95103 8 Перевагу також надають сполукам формули 4 (І), у якій R означає водень. Перевагу також надають сполукам формули 5 (І), у якій R означає водень. Перевагу також надають сполукам формули 6 (І), у якій R означає фтор. Перевагу також надають сполукам формули 5 6 (І), у якій R означає водень і R означає фтор. Перевагу також надають сполукам формули 7 (І), у якій R означає водень. Перевагу також надають сполукам формули 8 (І), у якій R означає водень. Визначення радикалів, зазначені для відповідних комбінацій і кращих комбінацій радикалів, при необхідності замінюються на визначення радикалів іншої комбінації, незалежно конкретної комбінації радикалів, яка зазначена. Особливу перевагу також надають комбінаціям двох або більшої кількості зазначених вище кращих діапазонів. Даний винахід також стосується способу одержання сполук формули (І), у якій сполуки формули у якій 1 2 3 4 5 6 A, R , R , R , R , R і R мають зазначені вище значення, вводять у реакцію зі сполуками формули у якій 7 8 R і R мають зазначені вище значення та 1 X означає галоген, переважно - хлор або бром, або гідроксигрупу. 1 У випадку, якщо X означає галоген, реакцію звичайно проводять в інертних розчинниках, у присутності основи, переважно - у температурному діапазоні від 0 до 40°С при атмосферному тиску. Приклади інертних розчинників включають галогеновані вуглеводні, такі як метиленхлорид, трихлорметан або 1,2-дихлоретан, прості ефіри, такі як діоксан, тетрагідрофуран або 1,2диметоксіетан, або інші розчинники, такі як ацетон, диметилформамід, диметилацетамід, 2-бутанон або ацетонітрил, кращими є тетрагідрофуран або метиленхлорид. Приклади основ включають карбонати лужних металів, такі як карбонат цезію, карбонат натрію 9 або калію, або органічні основи, такі як триалкіламіни, наприклад, триетиламін або діізопропілетиламін або N-метилморфолін, N-метилпіперидин, 4диметиламінопіридин або піридин, кращим є діізопропілетиламін. 1 У випадку, якщо X означає гідроксигрупу, реакцію звичайно проводять в інертних розчинниках, у присутності дегідратуючого реагенту, якщо це доцільно, то в присутності основи, переважно - у температурному діапазоні від 0°С до кімнатної температури при атмосферному тиску. Приклади придатних для даного винаходу дегідратуючих реагентів включають карбодііміди (КДІ), такі як N,N'-діетил-, N,N'-дипропіл-, Ν,Ν'діізопропіл-, N,N'-дициклогексилкарбодіімід, N-(3диметиламіноізопропіл)-N'етилкарбодіімідгідрохлорид (ЕДХ) (якщо це доцільно, то в присутності пентафторфенолу (ПФФ)), N-циклогексилкарбодіімід-N'пропілоксиметилполістирол (ПС-карбодіімід) або карбонільні сполуки, такі як карбонілдіімідазол, або 1,2-оксазолієві сполуки, такі як 2-етил-5-феніл1,2-оксазолій-3-сульфат або 2-трет-бутил-5-метилізоксазолійперхлорат, або ациламінові сполуки, такі як 2-етоксі-1-етоксикарбоніл-1,2дигідрохінолін, або ангідрид пропанфосфінової кислоти, або ізобутилхлорформіат, або біс(2-оксо3-оксазолідиніл)фосфорилхлорид, або бензотриазолілокситри(диметиламіно)фосфонійгексафторфосфат, або O-(бензотриазол-1-іл)-Ν,Ν,Ν',Ν у якій 1 2 3 4 5 6 A, R , R , R , R , R і R мають зазначені вище значення, з кислотою. Реакцію звичайно проводять у полярних розчинниках, переважно - у температурному діапазоні від кімнатної температури до температури кипіння розчинника при атмосферному тиску. Приклади кислот включають хлористоводневу кислоту, бромистоводневу кислоту, сірчану кислоту, фосфорну кислоту, метансульфонову кислоту, етансульфонову кислоту, толуолсульфонову кислоту, бензолсульфонову кислоту, нафталінсульфонову кислоту та трифтороцтову кислоту особливо кращою є хлористоводнева кислота. Приклади полярних розчинників включають спирти, такі як метанол, етанол, н-пропанол, ізопропанол, н-бутанол або трет-бутанол, або тетрагідрофуран, діоксан і оцтову кислоту, або суміші розчинників або розчинника з водою, особливо кращим є етанол. Сполуки формули (IV) є відомими або їх можна одержати за методикою [А] реакції сполук формули 95103 10 тетраметилуронійгексафторфосфат (HBTU), 2-(2оксо-1-(2Н)-піридил)-1,1,3,3тетраметилуронійтетрафторборат (TPTU) або О(7-азабензотриазол-1-іл)-N,N,N',N'тетраметилуронійгексафторфосфат (HATU), або 1-гідроксибензотриазол (HOBt) або бензотриазол1-ілокситрис(диметиламіно)фосфонійгексафторфосфат (ВОР), або їх суміші з основами. Конденсацію переважно проводити з використанням HATU. Приклади основ включають карбонати лужних металів, такі як, наприклад, карбонати або гідрокарбонати натрію або калію, і органічні основи, такі як триалкіламіни, наприклад, триетиламін або діізопропілетиламін, або N-метилморфолін, Nметилпіперидин або 4-диметиламінопіридин, кращим є діізопропілетиламін. Приклади інертних розчинників включають галогеновані вуглеводні, такі як дихлорметан або трихлорметан, вуглеводні, такі як, наприклад, бензол, або нітрометан, діоксан, диметилсульфоксид, диметилформамід, ацетонітрил, тетрагідрофуран, або триамід гексаметилфосфорної кислоти, або суміші розчинників, особливо кращими є дихлорметан, тетрагідрофуран або диметилформамід. Сполуки формули (III) є відомими або їх можна синтезувати за відомими методиками з відповідних вихідних речовин. Сполуки формули (II) є відомими або їх можна одержати за реакцією сполук формули у якій 3 4 5 6 R , R , R і R мають зазначені вище значення, зі сполуками формули 11 95103 12 1 у якій у якій 1 2 3 4 5 6 R , R , R , R , R і R мають зазначені вище значення, або [B] реакції сполук формули 2 R і R мають зазначені вище значення, з одержанням сполук формули зі сполуками формули у якій 1 2 R і R мають зазначені вище значення, з одержанням сполук формули у якій 3 4 5 6 R , R , R і R мають зазначені вище значення, у якій 1 2 3 4 5 6 R , R , R , R , R і R мають зазначені вище значення, або [C] на першій стадії реакції сполук формули (Vb) зі сполуками формули у якій 1 2 R і R мають зазначені вище значення, і на другій стадії з оксихлоридом фосфору, з одержанням сполук формули 13 у якій 1 2 3 4 5 6 R , R , R , R , R і R мають зазначені вище значення, або [D] реакції сполук формули у якій у якій 1 2 3 4 5 6 R , R , R , R , R і R мають зазначені вище значення. 1 Під час синтезу аміногрупу групи R , якщо це доцільно, захищають аміногрупою, яка відома спеціалісту в даній галузі техніки, такою як, наприклад, ацильна, яку після синтезу видаляють при умовах, відомих спеціалісту в даній галузі техніки. Сполуки формул (IVa), (IVb), (IVc) і (IVd) спільно утворюють сполуки формули (IV). Реакцію в способі [А], [В] і на першій стадії способу [С] звичайно проводять в інертних розчинниках, у присутності дегідратуючого реагенту, переважно - у температурному діапазоні від кімнатної температури до 100°С при атмосферному тиску. Приклади інертних розчинників включають вуглеводні, такі як бензол або толуол, або інші розчинники, такі як діоксан, диметилформамід, диметилсульфоксид або ацетонітрил, або суміші розчинників, особливо кращим є диметилформамід. 95103 14 3 4 5 6 R , R , R і R мають зазначені вище значення, та 2 X означає галоген, переважно - йод або бром, зі сполуками формули у якій 1 2 R і R мають зазначені вище значення, з одержанням сполук формули Приклади дегідратуючих реагентів включають карбодііміди, такі як Ν,Ν'-діетил-, N,N'-дипропіл-, N,N'-діізопропіл-, N,N'-дициклогексилкарбодіімід, Ν-(3-диметиламіноізопропіл)-N'етилкарбодіімідгідрохлорид (ЕДХ) (якщо це доцільно, то в присутності пентафторфенолу (ПФФ)), N-циклогексилкарбодіімід-N'пропілоксиметилполістирол (ПС-карбодіімід) або карбонільні сполуки, такі як карбонілдіімідазол, або 1,2-оксазолієві сполуки, такі як 2-етил-5-феніл1,2-оксазолій-3-сульфат або 2-трет-бутил-5-метилізоксазолійперхлорат, або ациламінові сполуки, такі як 2-етоксі-1-етоксикарбоніл-1,2дигідрохінолін, або ангідрид пропанфосфінової кислоти, або ізобутилхлорформіат, або біс(2-оксо3-оксазолідиніл)фосфорилхлорид, або бензотриазолілокситри(диметиламіно)фосфонійгексафторфосфат, або О-(бензотриазол-1-іл)-N,N,N'N'тетраметилуронійгексафторфосфат (HBTU), 2-(2оксо-1-(2Н)-піридил)-1,1,3,3тетраметилуронійтетрафторборат (TPTU) або O 15 (7-азабензотриазол-1-іл)-N,N,N'N'тетраметилуронійгексафторфосфат (HATU), або 1-гідроксибензотриазол (HOBt) або бензотриазол1-ілокситрис(диметиламіно)фосфонійгексафторфосфат (ВОР), або їх суміші з основами. Особливо кращим є карбонілдіімідазол. Реакцію на другій стадії способу [С] звичайно проводять в інертних розчинниках, переважно - у температурному діапазоні від 50 до 100°С при атмосферному тиску. Також можна використовувати суміші розчинників, суміш розчинника з РОСI3 або чистий РОСI3. Приклади інертних розчинників включають вуглеводні, такі як бензол або толуол, або інші розчинники, такі як діоксан, диметилсульфоксид, диметилформамід або ацетонітрил, або суміші розчинників, особливо кращими є діоксан і/або диметилформамід. Реакцію в способі [D] звичайно проводять при умовах реакції Соногашіра в атмосфері аргону в інертних і дегазованих розчинниках, у присутності каталізатора, якщо це доцільно, то в присутності додаткового реагенту, у присутності основи та, якщо це доцільно, трифенілфосфіну, переважно у температурному діапазоні від кімнатної температури до температури кипіння розчинника при атмосферному тиску (R. R. Tykwinski, Angew. Chem. Int. Ed. 2003, 42, 1566-1568, K. Sonogashira in Handbook of organopalladium chemistry for organic synthesis (Ed. E.-I. Negishi), 1133-1178 WileyInterscience, New York (2002)). Приклади каталізаторів включають паладієві каталізатори, звичайні для реакції Соногашіра, кращими є такі каталізатори, як, наприклад, три(дибензиліденацетон)дипаладій, дихлорбіс(трифенілфосфін)паладій, тетракістрифенілфосфінпаладій(О), ацетат паладію(ІІ), комплекс 1,1'біс[(біфенілфосфіно)фероцен]паладій-II-хлориду з дихлорметаном складу (1:1). Приклади додаткових реагентів включають йодид міді(І) і трифенілфосфін. Приклади основ включають амінові основи, такі як триетиламін. Приклади інертних розчинників включають прості ефіри, такі як діоксан, тетрагідрофуран або 1,2-диметоксіетан, вуглеводні, такі як бензол, ксилол або толуол, або інші розчинники, такі як нітробензол, диметилформамід, диметилацетамід, диметилсульфоксид або N-метилпіролідон, кращими є такі розчинники, як, наприклад, диметилформамід, диметилацетамід, диметилсульфоксид або 1,2-диметоксіетан. 95103 16 Сполуки формул (VIa), (VIb), (VIc) і (VId) є відомими або їх можна синтезувати за відомими методиками з відповідних вихідних речовин. Сполуки формул (Va), (Vb) і (Vc) є відомими або їх можна одержати за реакцією сполук формули у якій 3 4 R і R мають зазначені вище значення, та 3 X означає галоген, переважно - йод або бром, гідроксикарбоніл або ціаногрупу, зі сполуками формули у якій 5 6 R і R мають зазначені вище значення. Реакції звичайно проводять в інертних розчинниках у присутності основи, переважно - у температурному діапазоні від 0 до 40°С при атмосферному тиску. Приклади інертних розчинників включають спирти, такі як метанол, етанол, н-пропанол, ізопропанол, н-бутанол або трет-бутанол, або тетрагідрофуран, ацетон, діоксан або піридин, або суміші розчинників або суміші розчинника з водою, особливо кращими є тетрагідрофуран або ізопропанол з невеликою кількістю води. Приклади основ включають ацетат натрію, ацетат калію, карбонат натрію, карбонат калію або амінні основи, такі як триетиламін або діізопропілетиламін, особливо кращим є ацетат натрію. Сполуки формул (VII) і (VIII) є відомими або їх можна синтезувати за відомими методиками з відповідних вихідних речовин. В альтернативному способі сполуки формули (IV) можна одержати з використанням іншого порядку реакцій синтезу. Одержання сполук, пропонованих у даному винаході, можна проілюструвати за допомогою наведених нижче схем синтезу. 17 95103 18 19 Сполуки, пропоновані в даному винаході, характеризуються неочікуваним діапазоном ефектів, які не можна було передбачити. Вони мають противірусну активність відносно представників групи herpes viridae (віруси герпесу), зокрема, відносно цитомегаловірусів (ЦМВ) і особливо відносно цитомегаловірусу людини (ЦМВЛ). Областями показань, які можна відзначити як приклад, є: 1) Лікування та профілактика інфікування за допомогою ЦМВЛ у пацієнтів зі СНІД (синдром набутого імунодефіциту) (ретиніту, пневмоніт, шлунково-кишкових інфекційних захворювань). 2) Лікування та профілактика інфікування цитомегаловірусом пацієнтів, яким трансплантований кістковий мозок або орган і в яких розвивається часто небезпечний для життя викликаний ЦМВЛ пневмоніт або енцефаліт, або шлунковокишкові та системні викликані ЦМВЛ інфекційні захворювання. 3) Лікування та профілактика викликаних ЦМВЛ інфекційних захворювань у немовлят і дітей. 4) Лікування гострого інфікування за допомогою ЦМВЛ у вагітних жінок. 5) Лікування інфікування за допомогою ЦМВЛ пацієнтів з послабленим імунітетом, викликаним раком і протираковою терапією. 6) Лікування інфікованих за допомогою ЦМВЛ страждаючих раком пацієнтів з метою послаблення опосередковуваного ЦМВЛ прогресування пухлини (див. J. Cinatl, et al., FEMC Microbiology Reviews 2004, 28, 59-77). Даний винахід також стосується застосування сполук, пропонованих у даному винаході, для лікування і/або профілактики захворювань, зокрема інфікування вірусами, переважно - зазначеними вище вірусами, і викликаних ними інфекційних захворювань. Інфікування вірусами нижче в даному винаході означає й інфікування вірусами, і захворювання, викликане інфікуванням вірусом. Даний винахід також стосується застосування сполук, пропонованих у даному винаході, для лікування і/або профілактики захворювань, переважно - зазначених вище захворювань. Даний винахід також стосується застосування сполук, пропонованих у даному винаході, для приготування лікарського засобу, призначеного 95103 20 для лікування і/або профілактики захворювань, переважно - зазначених вище захворювань. Сполуки, пропоновані в даному винаході, переважно використовують для приготування лікарських засобів, які є придатними для профілактики і/або лікування інфікування представниками групи herpes viridae (віруси герпесу), переважно цитомегаловірусом, переважно - цитомегаловірусом людини. Даний винахід також стосується способу лікування і/або профілактики захворювань, переважно - зазначених вище захворювань, із застосуванням противовірусно ефективної кількості сполук, пропонованих у даному винаході. Даний винахід також стосується лікарських засобів, які включають принаймні одну сполуку, пропоновану в даному винаході, і принаймні одну або більшу кількість додаткових активних інгредієнтів, зокрема, призначених для лікування і/або профілактики зазначених вище захворювань. Активними інгредієнтами, придатними для комбінації, які наприклад і переважно можна відзначити, є: противовірусно активні інгредієнти, такі як вальганцикловір, ганцикловір або ацикловір. Сполуки, пропоновані в даному винаході, можуть впливати системно і/або місцево. Для цього їх можна вводити придатним шляхом, таким як, наприклад, пероральний, парентеральний, пульмональний, назальний, сублінгвальний, лінгвальний, трансбукальний, ректальний, шкірний, черезшкірний, кон'юнктивальний, вушний або місцевий, або у вигляді імплантату або стенту. При цих шляхах введення сполуки, пропоновані в даному винаході, можна вводити в придатних препаративних формах. Для перорального введення придатними є препаративні форми, які впливають відповідно до попереднього рівня техніки й виділяють сполуки, пропоновані в даному винаході, швидко і/або модифікованим чином і які включають сполуки, пропоновані в даному винаході, у кристалічній і/або аморфізованій і/або розчиненій формі, такі як, наприклад, таблетки (таблетки без покриття або з покриттям, наприклад, які містять покриття, які стійкі до впливу шлункового соку або розчиняються з затримкою або нерозчинні та регулюють вивільнення сполуки, пропонованої в даному ви 21 95103 наході), таблетки або плівки/облатки, які швидко розпадаються в порожнині рота, плівки/ліофілізати, капсули (наприклад, капсули з м'якого або твердого желатину), таблетки, покриття цукром, гранули, пелети, порошки, емульсії, суспензії, аерозолі або розчини. Парентеральне введення можна проводити без стадії всмоктування (наприклад, внутрішньовенно, внутрішньоартеріально, внутрішньокардіально, внутрішньоспінально або внутрішньолюмбально) або із включенням стадії всмоктування (наприклад, внутрішньом'язово, підшкірно, внутрішньошкірно, черезшкірно або внутрішньобрюшинно). Препаративними формами, придатними для парентерального введення, є, зокрема, препарати для ін'єкції та вливання у вигляді розчинів, суспензій, емульсій, ліофілізатів або стерильних порошків. Прикладами форм, придатних для інших шляхів введення, є препаративні форми для інгаляції (зокрема, призначені для порошкових інгаляторів і розпилювальних пристроїв), краплі, розчини, спреї для носа; таблетки, плівки/облатки або капсули, які вводять лінгвально, сублінгвально або трансбуккально, супозиторії, препарати для очей та вух, вагінальні капсули, водні суспезії (лосьйони, мікстури, які необхідно збовтувати), ліпофільні суспензії, мазі, креми, черезшкірні терапевтичні системи, молочко, пасти, пінки, розпилювальні порошки, імплантати або стенти. Сполуки, пропоновані в даному винаході, можна приготувати у вигляді стандартних препаративних форм. Це виконують за відомими технологіями, включаючи змішування з інертними, нетоксичними, фармацевтично прийнятними інертними наповнювачами. Ці інертні наповнювачі, зокрема, включають носії (наприклад, мікрокристалічна целюлоза, лактоза, маніт), розчинники (наприклад, рідкі поліетиленгліколі), емульгатори та диспергуючі агенти або змочувальні агенти (наприклад, додецилсульфат натрію, поліоксісо 22 рбітанолеат), сполучні (наприклад, полівінілпіролідон), синтетичні та натуральні полімери (наприклад, альбумін), стабілізатори (наприклад, антиоксиданти, такі як аскорбінова кислота), барвники (наприклад, неорганічні пігменти, такі як оксидизаліза) або агенти, що змінюють смак і/або запах. Даний винахід також стосується лікарських засобів, які включають принаймні одну сполуку, пропоновану в даному винаході, звичайно разом з одним або більшою кількістю інертних, нетоксичних, фармацевтично прийнятних інертних наповнювачів, і їх застосування для зазначених вище цілей. Для забезпечення ефективних результатів при внутрішньовенному введенні звичайно переважно вводити кількості, які складають приблизно від 0,001 до 10 мг/кг, краще - приблизно 0,01 до 5 мг/(кг маси тіла), і при пероральному введенні доза становить приблизно від 0,01 до 25 мг/кг, краще - від 0,1 до 10 мг/(кг маси тіла). Проте у відповідних випадках може виявитися доцільним відхилення від зазначених кількостей, особливо залежно від маси тіла, шляху введення, індивідуальної реакції на активний інгредієнт, типу препарату та часу введення або інтервалів між введеннями. Так, у деяких випадках може виявитися достатнім введення кількості, меншої, ніж зазначена мінімальна, а в інших випадках буде необхідно перевищити зазначену верхню граничну кількість. У випадку введення великих кількостей може виявитися доцільним їх розділення на декілька окремих доз, які вводяться протягом доби. Якщо не зазначено інше, то виражені у відсотках вмісти в описах досліджень і прикладах є масовими; виражені в частинах вмісти також є масовими. Відношення кількостей розчинників, співвідношення при розведенні та значення концентрацій розчинів рідин у рідинах у всіх випадках є об'ємними. А. Приклади Абревіатури Вос CDCl3 ПХІ ДХМ ДІРЕА ДМСО ДМФ ЕДХ ЕА ЕУ ІЕР Fmoc год ВЕРХ ВВ РХ-МС ДАЛ хв МС МТБЕ трет-бутоксикарбоніл дейтерохлороформ пряма хімічна іонізація (у МС) дихлорметан N,N-діізопропілетиламін диметилсульфоксид Ν,Ν-диметилформамід N-(3-диметиламіноізопропіл)-N'-етилкарбодіімідгідрохлорид етилацетат (етиловий ефір оцтової кислоти) іонізація електронним ударом (у МС) іонізація електророзпиленням (у МС) 9-флуоренілметоксикарбоніл години високоефективна рідинна хроматографія високий вакуум об'єднана рідинна хроматографія - мас-спектроскопія діізопропіламід літію хвилини мас-спектроскопія метил-трет-бутиловий ефір 23 ЯМР Pd-C РуВОР ОФ-ВЕРХ Rt ТГФ 95103 24 спектроскопія ядерного магнітного резонансу паладій на вугіллі 1-бензотриазолілокситрипіролідино-фосфонійгексафторфосфат ВЕРХ з оберненою фазою час утримання (у ВЕРХ) тетрагідрофуран Загальні методики РХ-МС і ВЕРХ: Методика 1 (РХ-МС): Тип приладу для МС: Micromass ZQ, Тип приладу для ВЕРХ: HP 1100 series; УФ DAD; колонка: Phenomenex Synergi 2 Hydro-ΟΦ Mercury 204 мм; елюент А: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент В: 1 л ацетонітрилу + 0,5 мл 50% мурашиної кислоти; градієнтний режим: 0,0 хв 90%А 2,5 хв 30%А 3,0 хв 5%А 4,5 хв 5%А; швидкість потоку: 0,0 хв 1 мл/хв, 2,5 хв/3,0 хв/4,5 хв 2 мл/хв; піч: 50°С; УФ-детектування: 210 нм. Методика 2 (РХ-МС): Прилад: Micromass Quattro LCZ з ВЕРХ Agilent series 1100; колонка: Phenomenex Synergi 2 Hydro-ΟΦ Mercury 204 мм; елюент А: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент В: 1 л ацетонітрилу + 0,5 мл 50% мурашиної кислоти; градієнтний режим: 0,0 хв 90%А 2,5 хв 30%А 3,0 хв 5%А 4,5 хв 5%А; швидкість потоку: 0,0 хв 1 мл/хв, 2,5 хв/3,0 хв/4,5 хв 2 мл/хв; піч: 50°С; УФ-детектування: 208-400 нм. Методика 3 (РХ-МС): Тип приладу для МС: Micromass ZQ; Тип приладу для ВЕРХ: Waters Alliance 2795; колонка: Phenomenex Synergi 2 Hydro-ΟΦ Mercury 204 мм; елюент А: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент В: 1 л ацетонітрилу + 0,5 мл 50% мурашиної кислоти; градієнтний режим: 0,0 хв 90%А 2,5 хв 30%А 3,0 хв 5%А 4,5 хв 5%А; швидкість потоку: 0,0 хв 1 мл/хв, 2,5 хв/3,0 хв/4,5 хв 2 мл/хв; піч: 50°С; УФ-детектування: 210 нм. Методика 4 (РХ-МС): Прилад: Micromass Platform LCZ з ВЕРХ Agilent series 1100; колонка: Thermo Hypersil GOLD 3 204 мм; елюент А: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент В: 1 л ацетонітрилу + 0,5 мл 50% мурашиної кислоти; градієнтний режим: 0,0 хв 100%А 0,2 хв 100%А 2,9 хв 30%А 3,1 хв 10%А 5,5 хв 10%А; піч: 50°С; швидкість потоку: 0,8 мл/хв; УФдетектування: 210 нм. Методика 5 (ВЕРХ): Прилад: HP 1100 з детектуванням DAD; колонка: Kromasil ОФ-18, 602 мм, 3,5 мкм; елюент А: 5 мл хлорної кислоти/л води, елюент В: ацетонітрил; градієнтний режим: 0 хв 2%В, 0,5 хв 2%В, 4,5 хв 90%В, 9 хв 90%В, 9,2 хв 2%В, 10 хв 2%В; швидкість потоку: 0,75 мл/хв; піч 30°С; УФ-детектування: 210 нм. Методика 6 (ВЕРХ): Прилад: HP 1100 з детектуванням DAD; колонка: Kromasil ОФ-18, 602 мм, 3,5 мкм; елюент А: 5 мл хлорної кислоти/л води, елюент В: ацетонітрил; градієнтний режим: 0 хв 2%В, 0,5 хв 2%В, 4,5 хв 90%В, 6,5 хв 90%В, 6,7 хв 2%В, 7,5 хв 2%В; швидкість потоку: 0,75 мл/хв; піч 30°С; УФ-детектування: 210 нм. Методика 7 (ЖХ/МС): Тип приладу для МС: Micromass ZQ; Тип приладу для ВЕРХ: HP 1100 series; УФ DAD; колонка: Phenomenex Gemini 3 303,00 мм; елюент А: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент В: 1 л ацетонітрилу + 0,5 мл 50% мурашиної кислоти; градієнтний режим: 0,0 хв 90%А 2,5 хв 30%А 3,0 хв 5%А 4,5 хв 5%А; швидкість потоку: 0,0 хв 1 мл/хв, 2,5 хв/3,0 хв/4,5 хв 2 мл/хв; піч: 50°С; УФдетектування: 210 нм. Вихідні сполуки Приклад 1А 4-(Бензилтіо)бензонітрил Гідрид натрію (5 г 60% дисперсії в маслі) промивають гексаном і сушать у вакуумі. Залишок диспергують у сухому ДМФ (100 мл) при 0°С і протягом 30 хв по краплях додають бензилмеркаптан (14,82 г). Потім реакційну суміш перемішують протягом 30 хв при кімнатній температурі. Обережно додають 4-фторбензонітрил (14,45 г) і реакційну суміш перемішують до введення в реакцію всієї вихідної речовини (монітроринг за допомогою ВЕРХ, приблизно 3 год). Реакційну суміш виливають у воду з льодом (400 мл) і перемішують протягом 5 хв. Продукт збирають фільтруванням, промивають водою (три рази) і сушать на фільтрі. Неочищений продукт перекристалізовують із циклогексану, збирають фільтруванням і промивають петролейним ефіром і сушать. Одержують 23,04 г (86% від теоретичного виходу) продукту. РХ-МС (методика 1): Rt = 2,85 хв + МС (ІЕР): m/z = 226 [М+Н] Приклад 2А 4-(Бензилтіо)-N'гідроксибензокарбоксимідамід 4-(Бензилтіо)бензонітрил (23,00 г) і гідроксиламінгідрохлорид (10,66 г) приготовляють у сухому етанолі (10 мл) і додають триетиламін (17 мл). Реакційну суміш спочатку перемішують протягом 30 хв при 50°С і потім кип'ятять зі зворотним хо 25 лодильником протягом 2 год. Потім, додають воду, поки розчин не стане мутним. Реакційну суміш охолоджують до кімнатної температури й одержану тверду речовину збирають фільтруванням. Тверду речовину промивають водою й потім сушать при 85°С у сушильній шафі. Неочищений продукт перекристалізовують з нбутанолу, кристалічний продукт збирають фільтруванням, промивають діетиловим ефіром і сушать при 65°С у сушильній шафі. Одержують 23,40 г (88% від теоретичного виходу) продукту у вигляді твердої речовини. РХ-МС (методика 1): Rt = 1,79 хв + МС (ІЕР): m/z = 229 [М+Н] Приклад 3А N-(6-{3-[4-(Бензилтіо)феніл]-1,2,4-оксадіазол5-іл}піридин-2-іл)ацетамід 1,1-Карбонілдіімідазол (15,16 г) невеликими порціями повільно додають до 6ацетамінопіридин-2-карбонової кислоти (16,84 г) у сухому ДМФ (75 мл) (виділення газу). Одержаний розчин перемішують при кімнатній температурі протягом 1,5 год. Потім додають 4(бензилтіо)-N'-гідроксибензокарбоксимідамід (23,00 г) і реакційну суміш перемішують при кімнатній температурі до вступання в реакцію всієї вихідної речовини (приблизно 3 год). Реакційну суміш нагрівають до 100°С і перемішують протягом 2 год. Потім додають воду, поки розчин не стане трохи мутним, і реакційну суміш охолоджують до кімнатної температури. Неочищений продукт збирають фільтруванням, три рази промивають водою й сушать у сушильній шафі при 65°С. Одержують 24,42 г (67% від теоретичного виходу) продукту у вигляді твердої речовини. РХ-МС (методика 1): Rt = 2,98 хв + МС (ІЕР): m/z = 403 [М+Н] 1 H-ЯМР (400 МГц, ДМСО-d6): = 10,96 (s, 1Н), 8,38 (d, 1Н), 8,08 (t, 1H), 8,02-7,95 (m, 3H), 7,53 (d, 2H), 7,43 (d, 2H), 7,35-7,21 (m, 3H), 4,36 (s, 2H), 2,15 (s, 3H). Приклад 4А 6-{3-[4-(Бензилтіо)феніл]-1,2,4-оксадіазол-5іл}піридин-2-амінгідрохлорид 95103 26 Воду (50 мл) і концентровану хлористоводневу кислоту (50 мл) додають до N-(6-{3-[4(бензилтіо)феніл]-1,2,4-оксадіазол-5-іл}піридин-2іл)ацетаміду (40,55 г) в етанолі (150 мл). Реакційну суміш кип'ятять зі зворотним холодильником до вступання в реакцію всієї вихідної речовини (приблизно 3 год) і потім охолоджують до кімнатної температури. Тверду речовину збирають фільтруванням, три рази промивають етанолом і сушать у вакуумній сушильній шафі при 80°С. Одержують 36,60 г (92% від теоретичного виходу) продукту у вигляді твердої речовини. РХ-МС (методика 2): Rt = 2,76 хв + МС (ІЕР): m/z = 361 [М+Н] 1 H-ЯМР (400 МГц, ДМСО-d6): = 7,95 (d, 2Н), 7,73 (t, 1Н), 7,53 (d, 2H), 7,51 (m, 1H), 7,42 (d, 2H), 7,30 (t, 2H), 7,25 (m, 1H), 6,85 (d, 1H), 4,38 (s, 2H). Приклад 5А 4-[5-(6-Амінопіридин-2-іл)-1,2,4-оксадіазол-3іл]бензосульфонілхлорид 6-{3-[4-(Бензилтіо)феніл]-1,2,4-оксадіазол-5іл}піридин-2-амін (35,95 г) охолоджують до 5°С у суміші оцтової кислоти (200 мл) і води (100 мл) у бані з льодом. Хлор поступово додають до вступання в реакцію всієї вихідної речовини (монітроринг за допомогою ВЕРХ) і при цьому температура не повинна перевищувати 10°С. Реакційну суміш перемішують при 5°С протягом 15 хв і потім розбавляють водою з льодом (200 мл). Неочищений продукт збирають фільтруванням, промивають водою з льодом (три рази) і діетиловим ефіром (три рази) і потім сушать у вакуумі. Одержують 26,00 г (85% від теоретичного виходу) продукту у вигляді твердої речовини. РХ-МС (методика 3): Rt = 2,22 хв + МС (ІЕР): m/z = 337 [М+Н] Приклад 6А 2-Хлор-5-фтор-1,3-динітробензол ДМФ (10 мл) і тіонілхлорид (14 мл) послідовно додають до 4-фтор-2,6-динітрофенолу (26,00 г) у бензолі (50 мл). Одержаний розчин перемішують при кімнатній температурі протягом 5 хв (осаджується проміжний продукт) і потім кип'ятять зі зворотним холодильником протягом 1,5 год (або до вступання в реакцію всієї вихідної речовини). Реакційну суміш охолоджують до кім 27 натної температури, концентрують і залишок виливають у воду з льодом. Осад збирають фільтруванням, три рази промивають водою й сушать. Після перекристалізації з етанолу одержують 23,50 г (83% від теоретичного виходу) продукту в кристалічному вигляді. 1 Н-ЯМР (400 МГц, ДМСО-d6): = 8,56 (d, 2H). Приклад 7 А 5-Фтор-1,3-амінобензол Триетиламін (12,6 мл) і паладій (10% на вугіллі) (6,0 г) додають до 2-хлор-5-фтор-1,3динітробензолу (10,00 г) у метанолі (450 мл). Реакційну суміш гідрують при кімнатній температурі при тиску водню, що дорівнює 3 бар, до вступання в реакцію всієї вихідної речовини (2 год). Реакційну суміш фільтрують через целіт і концентрують. Залишок розчиняють у ДХМ (150 мл) і обробляють 10% розчином лимонної кислоти. Потім водну фазу підлуговують 2 н. розчином гідроксиду натрію й екстрагують за допомогою ДХМ (три рази по 100 мл). Органічну фазу сушать над сульфатом натрію й концентрують. Одержують 5,0 г (88% від теоретичного виходу) продукту у вигляді масла. РХ-МС (методика 4): Rt = 0,58 хв + МС (IEP): m/z = 127 [М+Н] Приклад 8А N-(3-Аміно-5-фторфеніл)-1ціаноциклопропанкарбоксамід 1,1-Карбонілдіімідазол (3,29 г) додають до 1ціаноциклопропанкарбонової кислоти (2,05 г) у ТГФ і одержаний розчин перемішують при кімнатній температурі протягом 45 хв. Додають 5фтор-1,3-амінобензол (3,00 г) і суміш перемішують протягом ще 2,5 год. Потім розчин концентрують, залишок розчиняють у ДХМ (150 мл) і промивають водою. Водну фазу двічі екстрагують за допомогою ДХМ. Органічні екстракти поєднують, сушать над сульфатом натрію й концентрують. Залишок хроматографують на силікагелі (елюент: від ДХМ до ДХМ-метанол 50:1). Після концентрування відповідної фракції виділяють 2,35 г (58% від теоретичного виходу) продукту. РХ-МС (методика 1): Rt = 1,31 хв + МС (IEP): m/z = 220 [М+Н] 95103 28 Приклад 9А N-(3-{[(4Ціанофеніл)сульфоніл]аміно}феніл)ацетамід 3'-Аміноацетанілід (13,54 г) розчиняють в 2пропанолі (200 мл) і при кімнатній температурі додають розчин ацетату натрію (8,51 г) у воді (100 мл). Додають 4-ціанобензосульфонілхлорид (20,0 г), реакційну суміш нагрівають до 30°С і перемішують при кімнатній температурі протягом 3 год. Реакційну суміш виливають на лід (250 мл), одержану тверду речовину збирають фільтруванням, промивають водою (три рази) і потім сушать у сушильній шафі. Одержують 27,8 г (98% від теоретичного виходу) продукту у вигляді твердої речовини. РХ-МС (методика 1): Rt = 1,79 хв + МС (IEP): m/z = 316 [М+Н] 1 H-ЯМР (400 МГц, ДМСО-d6): = 10,52 (s, 1Н), 9,94 (s, 1H), 8,05 (d, 2H), 7,90 (d, 2H), 7,46 (s, 1H), 7,27 (d, 1H), 7,13 (t, 1H), 6,72 (d, 1H), 2,00 (s, 3H). Приклад 10А N-{3-[({4-[(Z)Аміно(гідроксіміно)метил]феніл}сульфоніл)аміно]фе ніл}ацетамід N-(3-{[(4Ціанофеніл)сульфоніл]аміно}феніл)ацетамід (27,00 г) приготовляють в етанолі (190 мл) і послідовно додають гідроксиламінгідрохлорид (7,14 г) і триетиламін (14,0 мл). Реакційну суміш перемішують при 50°С протягом 2 год і потім виливають на лід, речовину збирають фільтруванням і сушать у вакуумній камері. Одержують 25,78 г (86% від теоретичного виходу) продукту у вигляді твердої речовини. РХ-МС (методика 1): Rt= 1,14 хв + МС (IEP): m/z = 349 [М+Н] Приклад 11А N-(6-{3-[4-({[3(Ацетиламіно)феніл]аміно}сульфоніл)феніл]1,2,4-оксадіазол-5-іл}піридин-2-іл)ацетамід 29 95103 30 1,1-Карбонілдіімідазол (9,78 г), розчинений у діоксані (100 мл), по краплях додають до 6ацетиламінопіридин-2-карбонової кислоти (10,86 г) у суміші діоксану (100 мл) і ДМФ (60 мл) і суміш перемішують при кімнатній температурі протягом 3 год. Потім додають N-{3-[({4-[(Z)аміно(гідроксіміно)метил]феніл}сульфоніл)аміно]фе ніл}ацетамід у вигляді твердої речовини й реакційну суміш перемішують при кімнатній температурі протягом 16 год. Потім реакційну суміш перемішують при 100°С протягом 4 год і потім ви виливають у воду з льодом. Продукт витримують протягом 10 хв, збирають фільтруванням, промивають водою (три рази) і сушать у вакуумній сушильній шафі. Одержують 25,55 г (90% від теоретичного виходу) продукту у вигляді твердої речовини. ВЕРХ (методика 5): Rt = 4,03 хв + МС (ІЕР): m/z = 493 [М+Н] Приклад 12А N-(3-Амінофеніл)-4-[5-(6-амінопіридин-2-іл)1,2,4-оксадіазол-3-іл]бензосульфамід 15% Хлористоводневу кислоту (150 мл) додають до N-(6-{3-[4-({[3(ацетиламіно)феніл]аміно}сульфоніл)феніл]1,2,4-оксадіазол-5-іл}піридин-2-іл)ацетаміду (20,00 г) в етанолі (200 мл). Реакційну суміш перемішують при кип'ятінні зі зворотним холодильником протягом 6 год і потім при нагріванні значення рН доводять до 4 за допомогою 10% розчину гідроксиду натрію. Реакційну суміш охолоджують до 5°С і перемішують протягом 16 год. Неочищений продукт збирають фільтруванням з відсмоктуванням, промивають водою (двічі) і потім сушать. Одержують 12,73 г (77% від теоретичного виходу) продукту у вигляді твердої речовини. ВЕРХ (методика 5): Rt = 3,53 хв + МС (ІЕР): m/z = 409 [М+Н] 1 H-ЯМР (300 МГц, ДМСО-d6): = 10,16 (br s, 1H), 8,23 (d, 2H), 7,97 (d, 2H), 7,63 (t, 1H), 7,45 (d, 1H), 6,85 (t, 1H), 6,74 (d, 1H), 6,58 (br s, 2H), 6,42 (s, 1H), 6,28 (t, 1H), 5,44 (br s, 2H). Приклад 13А N-(6-Бромпіридин-2-іл)ацетамід грівають до кімнатної температури при перемішуванні. До реакційної суміші додають 10% розчин гідрокарбонату натрію й реакційну суміш екстрагують метиленхлоридом. Органічну фазу промивають водою й насиченим водним розчином хлориду натрію, сушать над сульфатом натрію й концентрують. Після флеш-хроматографії (елюент: метиленхлорид/метанол 1:0, 500:1) одержують 5,84 г (86% від теоретичного виходу) продукту. ВЕРХ (методика 6): Rt = 3,66 хв + МС (M+NH4+NН3): m/z = 215 і 217 [М+Н] , 232 + + і 234 [M+NH4] , 249 і 251 [M+NH4+NH3] 1 H-ЯМР (400 МГц, ДМСО-d6): = 10,79 (s, 1H, NH), 8,08 (d, 1H), 7,71 (t, 1H), 7,31 (d, 1Н), 2,09 (s, 3H). Приклад 14А N-[6-(3-Гідрокси-3-метилбут-1-ин-1іл)піридин-2-іл]ацетамід 2-Аміно-6-бромпіридин (5,40 г) і ацетилхлорид (2,66 мл) приготовляють у метиленхлориді (80 мл) і охолоджують до 0°С. Потім по краплях додають триетиламін (6,53 мл) і суміш потім на N-(6-Бромпіридин-2-іл)ацетамід (5,84 г) приготовляють у діетиламіні (50 мл). Після додавання 2-метил-3-бутин-2-олу (2,51 г), біс(трифенілфосфін)паладій(II)хлориду (381 мг) і йодиду міді(І) (52 мг) суміш перемішують при кімнатній температурі протягом 2 год. Потім реак 31 ційну суміш концентрують і очищають за допомогою флеш-хроматографії (елюент: метиленхлорид/метанол 200:1, 100:1, 50:1). Одержують 5,20 г (88% від теоретичного виходу) продукту. ВЕРХ (методика 6): Rt = 3,30 хв МС (методика М-40, ΠΧΙ/ΝΗ3): m/z = 219 + [М+Н] 1 H-ЯМР (400 МГц, ДМСО-d6): = 10,68 (s, 1Н, NH), 8,05 (d, 1H), 7,75 (t, 1H), 7,14 (d, 1H), 5,55 (s, 1H, OH), 2,07 (s, 3H), 1,46 (s, 6H). Приклад 15А N-(6-Етинілпіридин-2-іл)ацетамід N-[6-(3-Гідрокси-3-метилбут-1-ин-1іл)піридин-2-іл]ацетамід (5,20 г) приготовляють у толуолі (50 мл), додають гідрид натрію (95 мг) і суміш перемішують при 120°С протягом 1,5 год. Реакційну суміш концентрують, залишок розбавляють водою та екстрагують етилацетатом. Органічну фазу сушать над сульфатом натрію, концентрують і очищають за допомогою флешхроматографії (елюент: метиленхлорид/метанол 1:0, 500:1, 200:1, 100:1). Одержують 1,75 г (43% від теоретичного виходу) продукту. ВЕРХ (методика 6): Rt = 3,18 хв МС (методика М-40, ΠΧΙ/ΝΗ3): m/z = 161 + + [М+Н] , 178 [M+NH4] , 1 Н-ЯМР (400 МГц, ДМСО-d6): = 10,68 (s, 1Н, NH), 8,10 (d, 1H), 7,78 (t, 1H), 7,26 (d, 1H), 4,31 (s, 1H), 2,08 (s, 3H). Приклад 16А N-(3-{[(4Йодфеніл)сульфоніл]аміно}феніл)ацетамід (4,60 г), тетракіс(трифенілфосфін)паладій(0) (1,28 г) і йодид міді(І) (421 мг) приготовляють у ДМФ в атмосфері аргону, додають N-(6-етинілпіридин-2іл)ацетамід (2,66 г) і триетиламін (15,4 мл) і суміш перемішують при кімнатній температурі протягом 2 год. Суміш потім розбавляють водою, екстрагують метиленхлоридом і органічну фазу сушать і очищають за допомогою флеш-хроматографії (елюент: метиленхлорид/метанол 1:0, 200:1, 95103 32 N-(3-{[(4Йодфеніл)сульфоніл]аміно}феніл)ацетамід 4-Йодбензилсульфоніл хлорид (10,0 г) приготовляють в ізопропанолі (100 мл), додають ацетат натрію (3,12 г), який розчинений у невеликій кількості води, і суміш перемішують при кімнатній температурі протягом 30 хв. Потім додають N-(3амінофеніл)ацетамід (4,96 г) і суміш додатково перемішують протягом ночі. Реакційну суміш розбавляють водою й насиченим водним розчином хлориду натрію й екстрагують етилацетатом. Органічну фазу сушать над сульфатом натрію, концентрують і очищають за допомогою флешхроматографії (елюент: метиленхлорид/метанол 1:0, 100:1, 80:1). Одержують 9,62 г (70% від теоретичного виходу) продукту. ВЕРХ (методика 6): Rt = 4,14 хв + + МС (ІЕР , ΙΕΡ): m/z = 417 [М+Н] , 415 [М-Н]", 1 H-ЯМР (400 МГц, ДМСО-d6): = 10,31 (s, 1Н, NH), 9,91 (s, 1H, NH), 7,93 (d, 2H), 7,51 (d, 2H), 7,45 (s, 1H), 7,26 (d, 1H), 7,12 (t, 1H), 6,73 (d, 1H), 2,00 (s, 3H). Приклад 17А N-(6-{[4-({[3(Ацетиламіно)феніл]аміно}сульфоніл)феніл]етиніл}піридин2-іл)ацетамід 100:1, 50:1, 30:1). Одержують 3,56 г (48% від теоретичного виходу) продукту. ВЕРХ (методика 6): Rt = 3,86 хв + + МС (ІЕР , ІЕР): m/z = 449 [М+Н] , 447 [М-Н], 1 H-ЯМР (400 МГц, ДМСО-d6): = 10,76 (s, 1Н, NH), 10,38 (s, 1H, NH), 9,93 (s, 1H, NH), 8,13 (d, 1H), 7,88-7,78 (m, 3H), 7,73 (d, 2H), 7,48 (s, 1H), 7,37 (d, 1H), 7,26 (d, 1H), 7,12 (t, 1H), 6,76 (d, 1H), 2,09 (s, 3H), 2,00 (s, 3H). Приклад 18А N-(3-Амінофеніл)-4-[(6-амінопіридин-2іл)етиніл]бензосульфаміддигідрохлорид 33 N-(6-{[4-({[3(Ацетиламіно)феніл]аміно}сульфоніл)феніл]етиніл}піридин2-іл)ацетамід (3,12 г) приготовляють в етанолі (45 мл), додають 20% хлористоводневу кислоту (45 мл) і суміш перемішують при 60°С протягом 3 год. Реакційну суміш концентрують і залишок перемішують із ацетонітрилом. Після збирання речовини фільтруванням з відсмоктуванням, додаткового промивання ацетонітрилом і сушіння у високому вакуумі одержують 3,45 г (кількісний вихід) продукту. ВЕРХ (методика 6): Rt = 3,65 хв + + МС (ІЕР , ІЕР·): m/z = 365 [М+Н] , 363 [М-H], 1 H-ЯМР (400 МГц, ДМСО-d6): = 10,70 (s, 1Н, NH), 7,91-7,78 (m, 5Н), 7,24 (t, 1Н), 7,09 (d, 1H), 7,02 (s, 1H), 6,96-6,83 (m, 3H). Приклад 19А 4-[5-(6-Ацетиламінопіридин-2-іл)-1,2,4оксадіазол-3-іл]бензосульфонілхлорид N-(3-Аміно-5-фторфеніл)-1ціаноциклопропанкарбоксамід (2,46 г) додають до 4-[5-(6-амінопіридин-2-іл)-1,2,4-оксадіазол-3іл]бензосульфонілхлориду (3,78 г) у сухому піридині (120 мл). Одержаний розчин перемішують при кімнатній температурі протягом 18 год і потім виливають у воду з льодом. Неочищений продукт збирають фільтруванням, промивають водою й сушать. Після хроматографії на силікагелі (від метиленхлориду до метиленхлорид/метанол 50:1) і концентрування відповідних фракцій виді 95103 34 N-(6-{3-[4-(Бензилтіо)феніл]-1,2,4-оксадіазол5-іл}піридин-2-іл)ацетамід (11,55 г) перемішують у суміші оцтової кислоти (80 мл) і води (50 мл) у бані з льодом і охолоджують до 5°С. Хлор поступово додають до вступання в реакцію всієї вихідної речовини (моніторинг за допомогою ВЕРХ) і при цьому температура не повинна перевищувати 10°С. Реакційну суміш перемішують при 5°С протягом 15 хв і потім розбавляють водою з льодом (100 мл). Неочищений продукт збирають фільтруванням, промивають водою з льодом (три рази) і діетиловим ефіром (три рази) і потім сушать у вакуумі. Одержують 9,60 г (88% від теоретичного виходу) продукту у вигляді твердої речовини. РХ-МС (методика 3): Rt = 2,31 хв + МС (ІЕР): m/z = 379 [М+Н] Типові варіанти здійснення Приклад 1 N-{3-[({4-[5-(6-Амінопіридин-2-іл)-1,2,4оксадіазол-3-іл]феніл}сульфоніл)аміно]-5фторфеніл}-1-ціаноциклопропанкарбоксамід ляють 2,28 г (40% від теоретичного виходу) продукту. РХ-МС (методика 3): Rt = 2,07 хв + МС (ІЕР): m/z = 520 [М+Н] 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,37 (d, 2H), 8,01 (d, 2H), 7,64 (t, 1H), 7,45 (d, 1H), 7,35 (s, 1H), 7,21 (br d, 1H), 6,73 (d, 1H), 6,68 (br d, 1H), 6,56 (br s, 2H), 1,65 (s, 4H). Приклад 2 Ν-{3-[({4-[5-(6-Амінопіридин-2-іл)-1,2,4оксадіазол-3-іл]феніл}сульфоніл)аміно]феніл}-1ціаноциклопропанкарбоксамід 35 95103 36 N-(3-амінофеніл)-4-[5-(6-амінопіридин-2-іл)1,2,4-оксадіазол-3-іл]бензосульфамід (4,50 г) приготовляють у сухому ДМФ (110 мл), додають HATU (6,28 г), 1-ціаноциклопропанкарбонову кислоту (2,45 г) і Ν,Ν-діізопропілетиламін (2,90 мл) і реакційну суміш перемішують в атмосфері аргону при кімнатній температурі протягом 1 год і потім концентрують. Залишок хроматографують на силікагелі (елюент: метиленхлорид/метанол від 100:1 до 20:1). Після концентрування відповідних фракцій можна виділити 4,99 г (90% від теоретичного виходу) продукту. РХ-МС (методика 2): Rt = 2,13 хв + МС (ІЕР): m/z = 502 [М+Н] 1 H-ЯМР (400 МГц, ДМСО-d6): = 10,47 (s, 1Н), 10,06 (s, 1Н), 8,23 (d, 2H), 7,97 (d, 2H), 7,64 (t, 1H), 7,53 (s, 1H), 7,45 (d, 1H), 7,28 (d, 1H), 7,17 (t, 1H), 6,84 (d, 1Н), 6,73 (d, 1H), 1,65 (s, 4H). Приклад 3 Ν-{3-[({4-[5-(6-Амінопіридин-2-іл)-1,2,4оксадіазол-З-іл]феніл}сульфоніл)аміно]-2метилфеніл}-1-ціаноциклопропанкарбоксамід Одержують за аналогією із прикладом 2 з використанням 3'-аміно-2'-метилфенілацетаміду як вихідна речовина. РХ-МС (методика 3): Rt = 1,91 хв + МС (ІЕР): m/z = 516 [М+Н] 1 H-ЯМР (400 МГц, ДМСО-d6): = 9,91 (s, 1Н), 9,67 (s, 1H), 8,26 (d, 2H), 7,87 (d, 2H), 7,65 (t, 1H), 7,47 (d, 1H), 7,10 (m, 2H), 6,84 (dd, 1H), 6,76 (d, 1H), 1,91 (s, 3H), 1,63 (m, 4H). Приклад 4 Ν-{3-[({4-[(6-Амінопіридин-2іл)етиніл]феніл}сульфоніл)аміно]феніл}-1ціаноциклопропанкарбоксамідгідрохлорид N-(3-Амінофеніл)-4-[(6-амінопіридин-2іл)етиніл]бензосульфамід дигідрохлорид (750 мг), 1-ціаноциклопропіонову кислоту (229 мг), HATU (783 мг) і Ν,Ν-діізопропілетиламін (1,04 мл) перемішують протягом ночі при кімнатній температурі в сухому ДМФ (7 мл). Реакційну суміш очищають за допомогою препаративної ВЕРХ (елюент: вода (з додаванням суміші 1% хлористоводнева кислота)/ацетонітрил, швидкість потоку 50 мл/хв) і одержують 400 мг (47% від теоретичного виходу) продукту. ВЕРХ (методика 6): Rt = 3,87 хв МС (ΙΕΡ , ΙΕΡ): m/z = 458 [М-НСl+Н] , 456 [МНСl-Н], 1 Н-ЯМР (400 МГц, ДМСО-d6): = 10,45 (s, 1Η, NH), 10,07 (s, 1H, NH), 7,83 (d, 2H), 7,79-7,66 (m, 3H), 7,51 (s, 1H), 7,27 (d, 1H), 7,17 (t, 1H), 7,01 (d, 1H), 6,82 (d, 2H), 1,65 (s,4H). Приклад 5 N-{3-[({4-[5-(6-Ацетиламінопіридин-2-іл)-1,2,4оксадіазол-3-іл]феніл}сульфоніл)аміно]-5фторфеніл}-1-ціаноциклопропанкарбоксамід + + 37 N-(3-Аміно-5-фторфеніл)-1ціаноциклопропанкарбоксамід (100 мг) додають до 4-[5-(6-ацетиламінопіридин-2-іл)-1,2,4оксадіазол-3-іл]бензосульфонілхлориду (148 мг) у сухому піридині (2 мл). Одержаний розчин перемішують при кімнатній температурі протягом 18 год і потім виливають у воду з льодом. Неочищений продукт збирають фільтруванням, промивають водою й сушать. Після очищення за допомогою препаративної ОФ-ВЕРХ (елюент ацетонітрил:вода, градієнтний режим) і концентрування відповідних фракцій виділяють 53 мг (24% від теоретичного виходу) продукту. РХ-МС (методика 7): Rt = 2,46 хв + МС (ІЕР): m/z = 562 [М+Н] 1 H-ЯМР (400 МГц, ДМСО-d6): = 10,99 (s, 1Н), 10,78 (s, 1Н), 10,26 (s, 1Н), 8,40 (d, 1H), 8,17 (d, 2H), 8,06 (m, 4H), 7,37 (s, 1H), 7,21 (d, 1H), 6,68 (d, 1H), 2,15 (s, 3H), 1,66 (s, 4H). В. Дослідження фізіологічної активності Активність in vitro сполук, пропонованих у даному винаході, можна продемонструвати за допомогою описаних нижче досліджень: Дослідження анти-ЦМВЛ (проти цитомегаловірусу людини) цитопатогенності Досліджувані сполуки використовують у вигляді 50 мМ розчинів у диметилсульфоксиді (ДМСО). Як сполуку для порівняння використовують ганцикловір. Після додавання 2 мкл вихідних розчинів у ДМСО концентрації 50, 5, 0,5 і 0,05 мМ відповідно в порції по 98 мкл культурального середовища для клітин, поміщеного в рядки 2 А-Н 96-лункового планшета для проведення дворазових досліджень, у рядках до 11 планшета проводять розведення 1:2 порціями середовища по 50 мкл. Лунки в рядках 1 і 12 містять по 50 мкл середовища. Потім в усі лунки (рядок 1 = контрольні клітини) піпеткою поміща4 ють по 150 мкл суспензії 110 клітин (фібробласти ембріонів препуціума людини [NHDF]) і в рядки 2-12 поміщають суміш інфікованих за допомогою ЦМВЛ і неінфікованих клітин NHDF (МНЗ (множинність зараження) = 0,001-0,003), тобто по 1-3 інфіковані клітини на 1000 неінфікованих клітин. Рядок 12 (без додавання речовини) виконує функції вірусного контролю. Кінцеві концентрації при дослідженні становлять 250-0,0005 мкМ. Планшети інкубують при 37°С/5% СО2 протягом 6 днів, поки всі клітини у вірусних контролях не будуть інфіковані (100% цитопатогенний ефект [ЦПЕ]). Потім клітини фіксують і забарвлюють шляхом додавання суміші формаліну з барвником Гімза (30 хв), промивають бідистильованою водою й сушать у сушильній шафі при 50°С. Потім проводять візуальне вивчення план 95103 38 шетів за допомогою розташованого зверху мікроскопу (пристрій для вивчення розмноження колоній, який випускається фірмою Technomara). За допомогою дослідницьких планшетів можна одержати наступні дані: СС50 (NHDF) = концентрація речовини в мкМ, при якій не виявляється видимих цитостатичних впливів на клітини в порівнянні з неінфікованими контрольними клітинами; ЕС50 (ЦМВЛ) = концентрація речовини в мкМ, що приводить до пригнічення ЦПЕ (цитопатогенний ефект) на 50% у порівнянні з вірусним контролем, який не піддавали впливу; SI (коефіцієнт селективності) = СС50 (NHDF)/EC50 (ЦМВЛ). Одержані in vitro типові значення активності сполук, пропонованих у даному винаході, наведені в таблиці А: Таблиця А Приклад № 1 2 3 4 5 NHDF СС50 [мкМ] 71 141 102 47 71 ЦМВЛ ЕС50 [мкМ] 0,011 0,007 0,002 0,021 0,026 SI ЦМВЛ 6450 20140 51000 2240 2730 Застосовність сполук, пропонованих у даному винаході, для боротьби з інфекцією ЦМВЛ можна продемонструвати за допомогою описаної нижче моделі на тварин: Модель ЦМВЛ ксенотрансплантату Gelfoam Тварини: Використовують імунодефіцитних мишей Fox Chase SCID.NOD або NOD.CB17-Prkdc/J у віці 5-6 тижнів (16-20 г), придбаних у фірми з розведенням тварин Taconic M&B, Denmark; Jackson, USA. Тварин тримають у стерильних умовах (включаючи підстилку та корм) в ізоляторах. Вирощування вірусу: Цитомегаловірус людини (ЦМВЛ), штам Davis або AD169, вирощують in vitro на фібробластах ембріонів препуціума людини (клітини NHDF). Після інфікування клітин NHDF при множинності зараження (МНЗ), що дорівнює 0,01-0,03, інфіковані вірусом клітини збирають через 5-10 днів і зберігають у присутності мінімального підтримуючого середовища (МПС), 20% фетальної телячої сироватки (ФТС) (об./об.), 1% глутаміну (об./об.), 1% суміші пеніцилін/стрептоміцин (об./об.) з додаванням 10% ДМСО при -80°С. Після 10-кратного серійного розведення інфікованих вірусом клітин, визначають титр в 24лункових планшетах, які містять клітини NHDF, що зливаються, після фіксування та забарвлення розчином барвника Гімза у формальдегіді. Приготування губок, трансплантація, лікування та дослідження: Губки з колагену розміром 111 cм (Gelfoam; Peasel & Lorey, order no. 407534; K.T. th Chong et al., Abstracts of 39 Interscience Conference on Antimicrobial Agents and 39 Chemotherapy, 1999, p. 439) спочатку змочують забуференим фосфатом фізіологічним розчином (ЗФФ), бульбашки повітря, які містяться, видаляють шляхом дегазації й потім їх зберігають у МПС, 10% ФТС (об./об.), 1% глутаміну (об./об.), 6 1% суміші пеніцилін/стрептоміцин (об./об.). 110 Інфікованих вірусом клітин NHDF (інфікування за допомогою ЦМВЛ Davis або ЦМВЛ AD169 МНЗ = 0,03) відбирають через 3 год після інфікування й в 20 мкл МПС, 10% ФТС (об./об.), 1% глутамін (об./об.), 1% суміші пеніцилін/стрептоміцин (об./об.) по краплях наносять на вологу губку. Губки інкубують протягом 3-4 год для забезпечення адгезії клітин. Потім, після додавання середовища (МПС, 10% ФТС) (об./об.), 1% глутаміну (об./об.), 1% суміші пеніцилін/стрептоміцин (об./об.)), губки інкубують протягом ночі. Для проведення трансплантації імунодефіцитних мишей анестезують авертином або сумішшю кетамін/ксилазин/азепромазин, вовну зі спини видаляють бритвою, розкривають 1-2 епідерміси, знімають напруження й вологі губки трансплантують під шкіру спини. Рану закривають за допомогою клею для тканин або затисків. Через 4-6 год після трансплантації мишей можна в перший раз лікувати (одну дозу вводять у день операції). У наступні дні проводять пероральне лікування три рази на добу (в 7,00 і 14,00 і 19,00 год), два рази на добу (в 8 і 18 год) або один раз на добу (в 9 год) протягом 8 днів. Добова доза становить, наприклад, 1 або 3 або 10 або 30 або 100 мг/(кг маси тіла), об'єм, що вводиться, становить 10 мл/(кг маси тіла). Сполуки приготовляють у вигляді суспензії 0,5% тілози/ЗФФ із 2% ДМСО або у вигляді іншої придатної суміші, яка сприяє розчиненню сполук, наприклад, 2% етанолу, 2,5% Solutol, 95,5% ЗФФ. Через 10 днів після трансплантації й приблизно через 16 год після останнього введення сполуки тварин безболісно умертвляють і вилучають губки. Інфіковані вірусом клітини виділяють із губок шляхом розщеплення колагеназою (330 Од/1,5 мл) і зберігають у присутності МПС, 10% ФТС (об./об.), 1% глутаміну (об./об.), 1% суміші пеніцилін/стрептоміцин (об./об.), 10% ДМСО при -140°С. Дослідження проводять після 10-кратного серійного розведення інфікованих вірусом клітин шляхом визначення титру в 24лункових планшетах, які містять клітини NHDF, що зливаються, після фіксування та забарвлення розчином барвника Гімза у формальдегіді. Кількість інфікованих клітин або інфікованих вірусом частинок (дослідження інфекційного центу) після введення сполуки зіставляють із кількістю, одержаною для контрольної групи, яку лікували за допомогою плацебо. Статистичну обробку проводять за допомогою відповідних комп'ютерних програм, таких як GraphPad Prism. Фармакокінетичні дослідження Фармакокінетику активних речовин досліджують після внутрішньовенного або перорального введення доз у діапазоні від 1 мг/кг внутрішньовенно та 3 мг/кг перорально трьом самцям щурів лінії Wistar у циклі лікування. Для періодичного відбирання проб крові за день до проведення експерименту в яремну вену тварин імпланту 95103 40 ють катетер. Речовини вводять внутрішньовенно й перорально у вигляді розчину. При цьому в більшості випадків композицію плазми (плазма щурів з додаванням 1-2% етанолу або ДМСО, 2 мл/кг) використовують для внутрішньовенного введення й композицію на основі ПЕГ (поліетиленгліколь (10% етанолу, 40% ПЕГ 400, 50% води, 5 мл/кг) використовують для перорального введення. Після введення активної речовини проби крові відбирають через катетер протягом 24 год в пробірки для проб, які містять гепарини. Після відбирання проб крові проби центрифугують і надосадові рідини (плазму) піпеткою переносять у пробірки Еппендорфа. До проведення аналізу зразки плазми зберігають при температурі не вище -15°С. Для обробки зразки відтаюють. Потім білки плазми осаджують шляхом додавання ацетонітрилу, який є внутрішнім стандартом. Як внутрішній стандарт вибирають речовину такого ж структурного класу, яка структурно як можна більш подібна з активною сполукою. Для приготування каліброваних зразків активну речовину в різних концентраціях додають до аліквотів чистої плазми і їх обробляють разом із пробами невідомого складу. Крім того, приготовляють додаткові проби для контролю якості трьох різних концентрацій, які використовують для перевірки методики аналізу. Визначення концентрацій активної речовини в пробах проводять за допомогою високоефективної рідинної хроматографії з масспектрометричним детектуванням (РХ/МС-МС). Концентрації активної речовини в пробах невідомого складу визначають за відносними висотами або площами піків при зіставленні з каліброваним графіком з використанням програми Concalc для Windows (CCW, Integrierte Labordatensysteme, версія 2,5 або більш пізня, Bayer AG). Потім для кожної тварини за змінами концентрації в плазмі з часом фармакокінетичні параметри розраховують із використанням неблокового аналізу з використанням програми KINCALC, версія 2,50,02 (Bayer AG, 2001). Потім для сполук, у яких виявляються поліпшені фармакокінетичні параметри для щурів, проводять фармакокінетичні дослідження після введення мишам і собакам. На основі цих даних проводять першу оцінку фармакокінетичних параметрів для людини за допомогою міжвидового перенесення фармакокінетичних даних за методикою Boxenbaum. За допомогою цих досліджень можна одержати наступні дані: Vss = об'єм розподілення; CL = швидкість виведення; t1/2 = період напіввиведення; AUC = повна площа під кривою залежності лікарський засіб - концентрація від часу; Сmах = максимальна концентрація; F = біологічна доступність; Фармакокінетичні дані для сполуки прикладу 1 після однократного внутрішньовенного та перорального введення самцям щурів лінії Wistar (n=3 41 95103 для шкірного дослідження або n=3 відповідно) наведені в таблиці В. Сполуки, пропоновані в даному винаході, проявляють поліпшені фармакокінетичні характеристики. Таблиця В Щури лінії Wistar 1,3 мг/кг внутрішВнутрішньовенна доза 1 ньовенно Vss [л/кг] 0,321 СLпдазма [л/(год·кг)] 0,064 СLкров [л/(год·кг)] 0,128 t½ [год] 4,26 2 Пероральна доза 3 мг/кг р.о., AUCнормальна, перорально [кг·год/л] 8,58 Сmax, нормальна, перорально [кг/л] 1,08 F [%] 55,3 1 : розчин у плазмі щурів з додаванням 1% ДМСО, 2 мл/кг 2 : розчин в 10% етанолі, 40% ПЕГ 400, 50% води, 5 мл/кг Ідентифікація метаболітів Міжвидові розходження метаболізму активної сполуки можуть дуже вплинути на його розробку. Задачею є знаходження речовин, шляхи метаболічного розкладання яких у людей і піддослідних тварин, таких як, наприклад, щури та собаки, не сильно відрізняються. Для цього нові активні речовини спочатку інкубують in vitro з мікросомами печінки щурів, собак і людини для зіставлення фази І метаболізму. Потім сполуки, які являють інтерес, додатково інкубують з гепатоцитами щурів і людину для вивчення повної фази І і фази II метаболізму в печінці і для їх зіставлення. Всі нові активні сполуки інкубують при концентрації, що дорівнює 20 мкМ. Для цього приготовляють вихідні розчини концентрації 2 мМ в ацетонітрилі й потім їх піпеткою вводять в інкубовану порцію при розведенні 1:100, так щоб у порції містилося не більше 1% ацетонітрилу. Мікросоми печінки інкубують при 37°С в 50 мМ калійфосфатному буфері з рН 7,4 з додаванням і без додавання системи, що виробляє NADPH, яка містить + 1 мМ NADP , 10 мМ глюкози-6-фосфату та 1 Од глюкоза-6-фосфатдегідрогенази. Первинні гепатоцити також інкубують при 37°С у суспензії середовища Вільямса Е. Після інкубації протягом 04 год реакції в інкубованих порціях зупиняють ацетонітрилом (кінцева концентрація дорівнює приблизно 30%) і білок відокремлюють центрифугуванням приблизно при 15000g. Зразки, у яких у такий спосіб зупинені реакції, аналізують відразу або до проведення аналізу зберігають при -20°С. Аналізи проводять за допомогою високоефективної рідинної хроматографії з ультрафіолетовим мас-спектрометричним детектуванням 42 (ВЕРХ-УФ-МС). Для цього надосадові рідини їх інкубованих проб хроматографують на придатній колонці з оберненою фазою С18 з використанням різних сумішей ацетонітрилу та 10 мм форміату амонію. Для ідентифікації метаболітів використовують УФ-хроматограми разом з масспектрометричними даними. Характеристики метаболітів, які утворилися у відповідних досліджених видів зіставляють і використовують для виявлення розходжень між видами. С. Типові варіанти здійснення фармацевтичних композицій Сполуки, пропоновані в даному винаході, у такий спосіб можна включити у фармацевтичні препарати: Таблетка: Склад: 100 мг Сполуки прикладу 1, 50 мг лактози (моногідрату), 50 мг кукурудзяного крохмалю (натурального), 10 мг полівінілпіролідону (ПВП 25) (BASF, Ludwigshafen, Germany) і 2 мг стеарату магнію. Маса таблетки 212 мг. Діаметр 8 мм, радіус кривизни 12 мм. Приготування: Суміш активного інгредієнта, лактози та крохмалю гранулюють із 5% (мас/мас.) водним розчином ПВП. Потім гранули сушать і перемішують зі стеаратом магнію протягом 5 хв. Цю суміш пресують за допомогою звичайного таблетувального пресу (геометричні параметри таблетки див. вище). Відповідно до рекомендацій пресування проводять із зусиллям, що дорівнює 15 кН. Суспензія, яку можна вводити перорально: Склад: 1000 мг Сполуки прикладу 1, 1000 мг етанолу (96%), 400 мг Rhodigel (ксантанова камедь, FMC, Pennsylvania, USA) і 99 г води. 10 мл Суспензії для перорального введення еквівалентні разовій дозі сполуки, що дорівнює 100 мг, пропонованої в даному винаході. Приготування: Rhodigel суспендують в етанолі й до суспензії додають активний інгредієнт. При перемішуванні додають воду. Суміш перемішують протягом приблизно 6 год до завершення набухання Rhodigel. Розчин, який можна вводити внутрішньовенно: Склад: 10-500 мг Сполуки прикладу 1,15 г поліетиленгліколю 400 і 250 г води для ін'єкцій. Приготування: Сполуку прикладу 1 при перемішуванні разом з поліетиленгліколем 400 розчиняють у воді. Розчин стерилізують фільтруванням (діаметр пор 0,22 мкм) і в асептичних умовах розфасовують у термічно стерилізовані флакони для вливання. Останні закривають пробками для вливання й завальцьованими ковпачками. 43 Комп’ютерна верстка О. Гапоненко 95103 Підписне 44 Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted arylsulfonamides as antiviral agents
Автори англійськоюSvenstrup Niels, Zimmermann Holger, Karthaus, Dagmar, Goller, Andreas, Heimbach, Dirk, Henninger Kerstin, Lang Dieter, Paulsen Daniela, Riedl Bernd, Schohe-Loop Rudolf, Schuhmacher Joachim, Wunberg Tobias, Wunberg, Tobias
Назва патенту російськоюЗамещенные арилсульфонамиды в качестве противовирусных средств
Автори російськоюСвенструп Нильс, Циммерманн Хольгер, Картхаус Дагмар, Гьоллер Андреас, Хаймбах Дирк, Хеннингер Керстин, Ланг Дитер, Паульсен Даниэла, Ридль Бернд, Шоэ-Лооп Рудольф, Шумахер Йоахим, Вунберг Тобиас
МПК / Мітки
МПК: C07D 413/04, A61P 31/00, A61K 31/4439, A61K 31/44, C07D 213/73
Мітки: арилсульфонаміди, заміщені, засоби, противірусні
Код посилання
<a href="https://ua.patents.su/22-95103-zamishheni-arilsulfonamidi-yak-protivirusni-zasobi.html" target="_blank" rel="follow" title="База патентів України">Заміщені арилсульфонаміди як противірусні засоби</a>
Попередній патент: Шестикутна система доріг і управління її трафіком
Наступний патент: Система, спосіб і пристрій для платежів віртуальною готівкою для комерції з використанням засобів мобільного зв’язку
Випадковий патент: Спосіб лікування злоякісних пухлин