Фармацевтична композиція, що містить комбінацію hgh і rhigf-1, і процес її приготування (варіанти)
Номер патенту: 108994
Опубліковано: 10.07.2015
Автори: Гопінат Енона, Аракава Тсутому, Рішар Жоель, Парк Сьюзен, Фаіс Фабіо
Формула / Реферат
1. Фармацевтична композиція, яка містить IGF-1 і GH, а також
агент, який перешкоджає агрегації;
буфер;
сурфактант;
консервант і,
необов'язково, модифікатор тонічності,
де агентом, який перешкоджає агрегації, є аргінін в концентрації щонайменше від приблизно 80 мМ до приблизно 200 мМ, і
де модифікатором тонічності є натрію хлорид в концентрації від 1 мМ до 50 мМ.
2. Фармацевтична композиція за пунктом 1, в якій агентом, який перешкоджає агрегації, є аргінін в концентрації в межах від приблизно 100 мМ до приблизно 150 мМ.
3. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій буфер вибирається з гістидину, сукцинату або цитрату в концентрації в межах від приблизно 1 мМ до 50 мМ, переважно від приблизно 10 мМ до 20 мМ.
4. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій сурфактантом є неіонний сурфактант.
5. Фармацевтична композиція за пунктом 4, в якій неіонним сурфактантом є полісорбат 20 в концентрації в межах від приблизно 0,1 до 0,3 мас. %, переважно приблизно 0,2 мас. %.
6. Фармацевтична композиція за пунктом 4, в якій неіонним сурфактантом є полоксамер 188 в концентрації в межах від приблизно 0,1 до 0,5 мас. %, переважно приблизно 0,3 мас. %.
7. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій модифікатором тонічності є натрію хлорид.
8. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій наповнювачем є манітол та/або сахароза.
9. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій консервантом є бензиловий спирт або фенол.
10. Фармацевтична композиція за пунктом 1, в якій консервантом є бензиловий спирт в концентрації в межах від приблизно 0,2 до приблизно 2 мас. %, переважно приблизно 1 мас. %.
11. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій масове співвідношення IGF-1;GH (м/м) коливається в межах від приблизно 1:1 до 1:9 (м/м).
12. Фармацевтична композиція за будь-яким з пунктів 1-10, в якій масове співвідношення IGF-1:GH (м/м) коливається в межах від приблизно 1:1 до 7:1 (м/м), і переважно становить 1,1:1 (м/м), 2,2:1 (м/м), 3,3:1 (м/м) або 6,6:1 (м/м).
13. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій рН фармацевтичної композиції коливається в межах від приблизно 5,0 до приблизно 6,5, краще від приблизно 5,4 до приблизно 6,2, а ще краще від приблизно 5,8 до приблизно 6,2.
14. Фармацевтична композиція за будь-яким з пунктів 1-12, яка являє собою готовий до використання препарат в попередньо наповненому шприці або в картриджі пристрою для ін'єкцій.
15. Процес приготування фармацевтичної композиції за пунктом 1, який включає:
а) приготування розчину hGH в буфері при рН між 5 і 6,5, що містить агент, який перешкоджає агрегації, і модифікатор тонічності або наповнювач;
б) приготування розчину IGF-1 шляхом діалізу препарату IGF-1 в буфері, що використовувався на етапі (а), який містить вказаний агент, що перешкоджає агрегації, і вказаний модифікатор тонічності;
в) додавання сурфактанту і необов'язково консерванту до обох основних розчинів; і
г) змішування разом розчинів hGH і IGF-1.
16. Процес за пунктом 15, в якому агентом, що перешкоджає агрегації, є аргінін.
17. Процес приготування фармацевтичної композиції за пунктом 1, який включає:
а) приготування розчину І змішуванням буфера, переважно гістидинового буфера, агента, що перешкоджає агрегації, переважно аргініну, сурфактанту, переважно полісорбату 20, необов'язково консерванту, переважно бензилового спирту, і необов'язково регулювання об'єму водою, при цьому розчин І має рН приблизно 5,8 або регулюється до рН приблизно 5,8;
б) приготування розчину IGF-1 в буфері і агенті, що перешкоджає агрегації, які використовувались на етапі (а), з одержанням розчину II;
в) додавання розчину II до розчину І з одержанням розчину ІІІ;
г) приготування розчину IV змішуванням буфера, переважно гістидину, агента, що перешкоджає агрегації, переважно аргініну, сурфактанту, переважно полісорбату 20, необов'язково консерванту, переважно бензилового спирту, і необов'язково регулювання об'єму водою, при цьому розчин IV має рН приблизно 5,8 або регулюється до рН приблизно 5,8;
д) приготування розчину GH в буфері і агенті, що перешкоджає агрегації, які використовувались на етапі (г), при цьому GH необов'язково може містити натрій-бікарбонатний буфер, з одержанням розчину V;
є) додавання розчину V до розчину IV з одержанням розчину VI;
е) необов'язково, незалежне фільтрування розчинів III і VI;
ж) змішування профільтрованих розчинів ІІI і VI при співвідношенні IGF-1:GH (м/м) в межах від приблизно 1:1 до 7:1 (м/м), переважно 1,1:1 (м/м), 3,3:1 (м/м) або 6,6:1 (м/м), з одержанням розчину VII; і
з) необов'язково, фільтрування розчину VII.
18. Процес за пунктом 17, в якому рідка лікарська речовина GH безпосередньо змішується з розчином IV без виконання етапу (д).
19. Процес за пунктом 17, в якому лікарська речовина GH містить натрій-бікарбонатний буфер.
20. Процес за пунктом 17, в якому етапи фільтрування здійснюються на фільтрах PVDF (полівінілідену фторид).
21. Процес за пунктом 16, в якому агентом, який перешкоджає агрегації, є аргінін в концентрації в межах від приблизно 80 мМ до приблизно 200 мМ, переважно в межах від приблизно 100 мМ до приблизно 150 мМ.
22. Процес за пунктом 17, в якому агентом, який перешкоджає агрегації, є аргінін в концентрації в межах від приблизно 80 мМ до приблизно 200 мМ, переважно в межах від приблизно 100 мМ до приблизно 150 мМ.
Текст
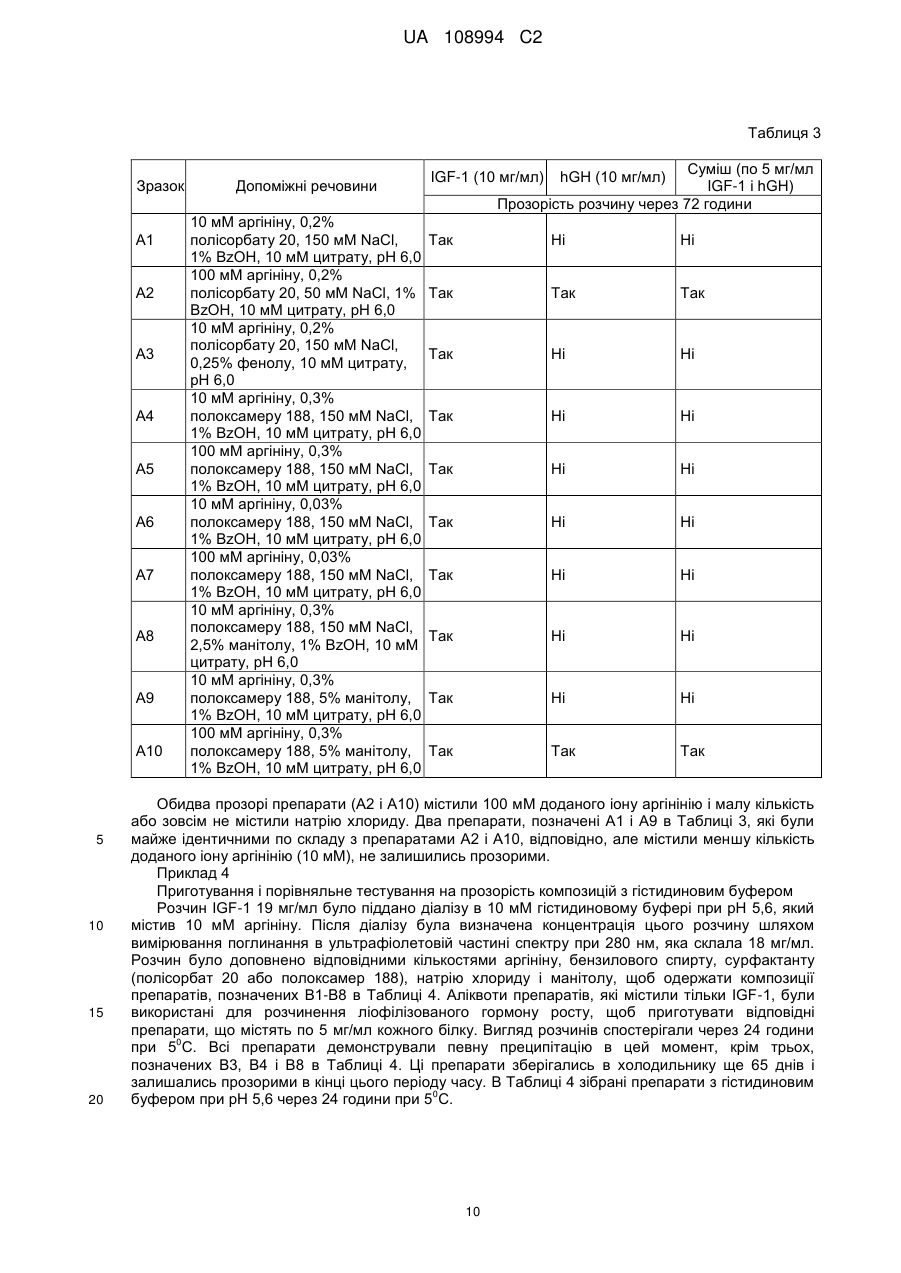
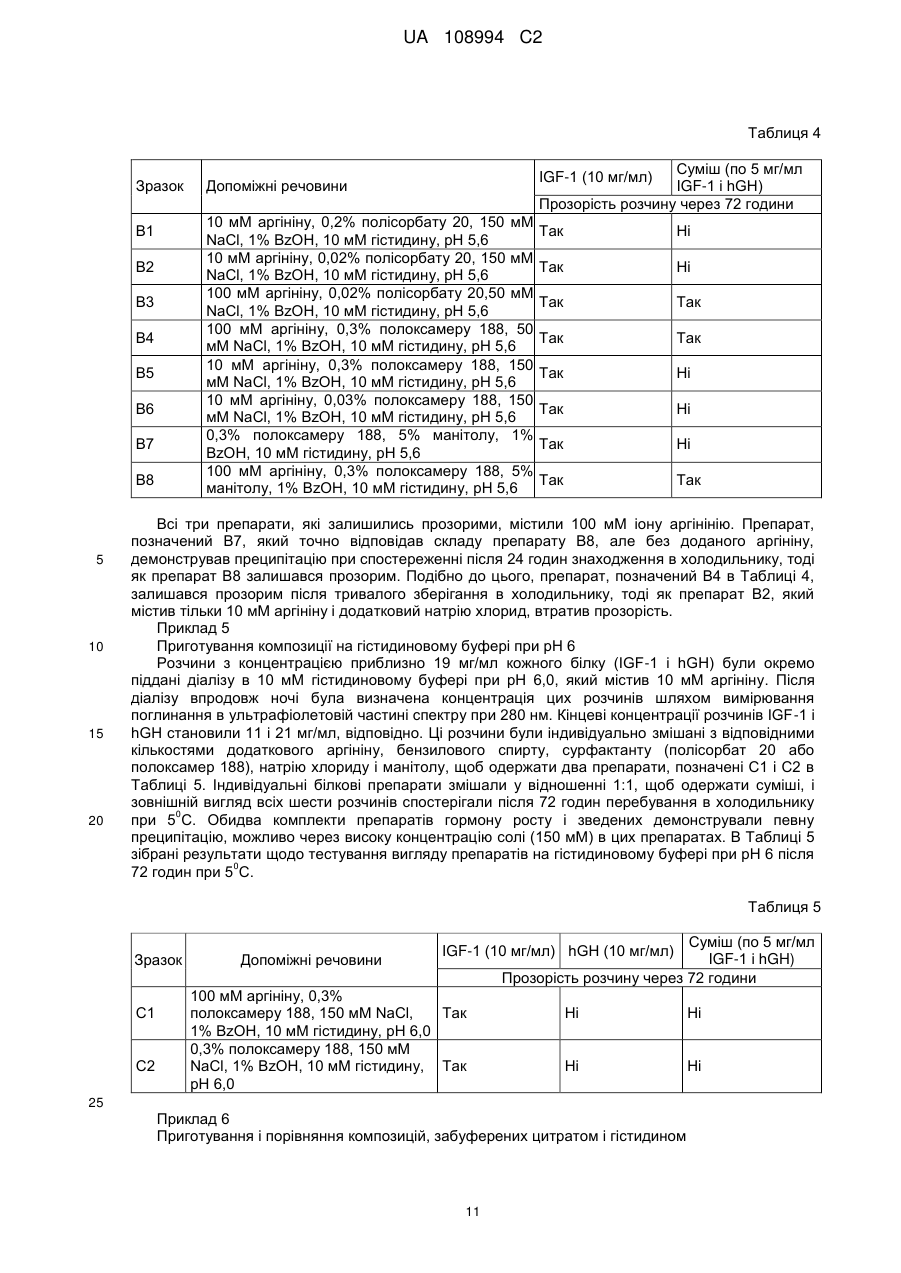
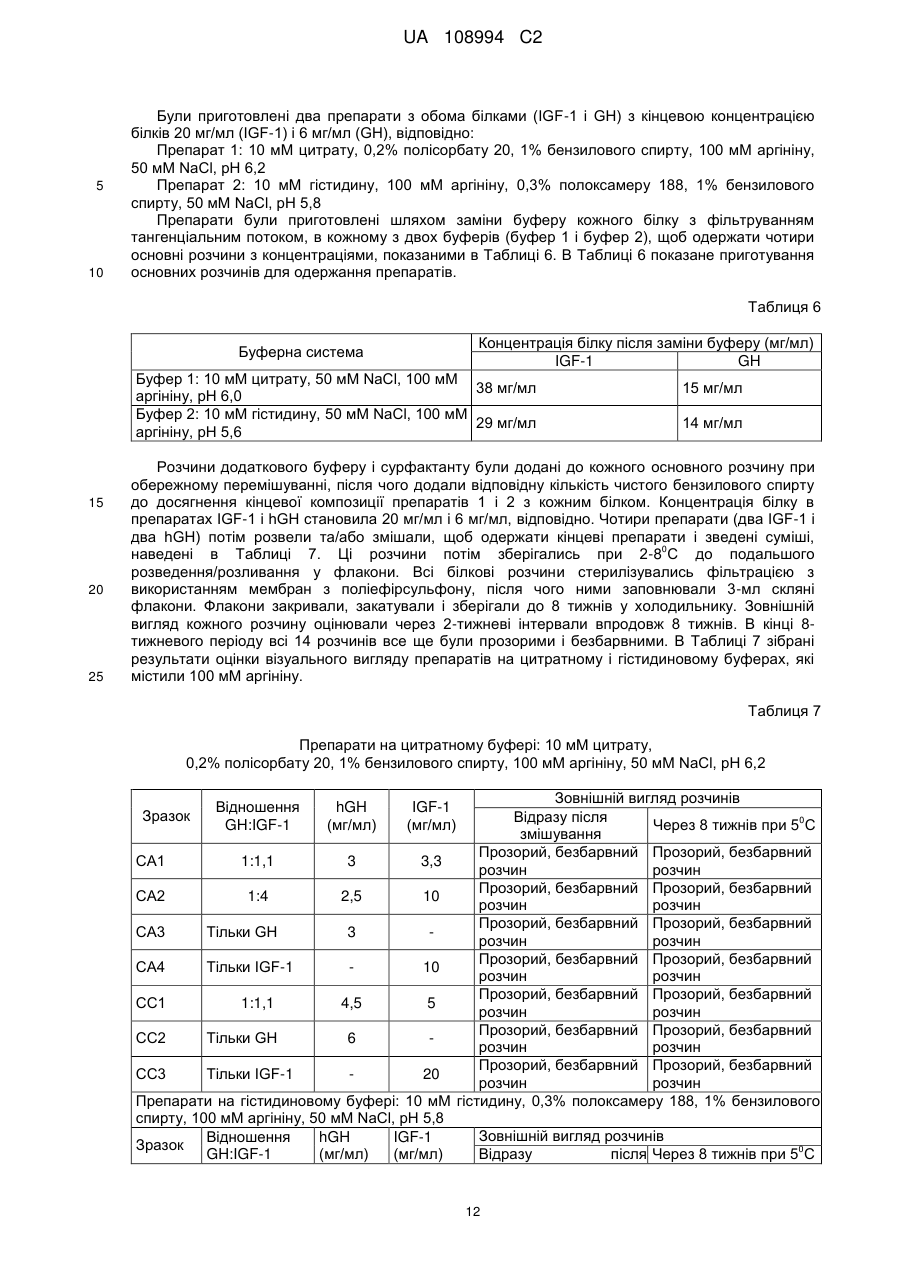
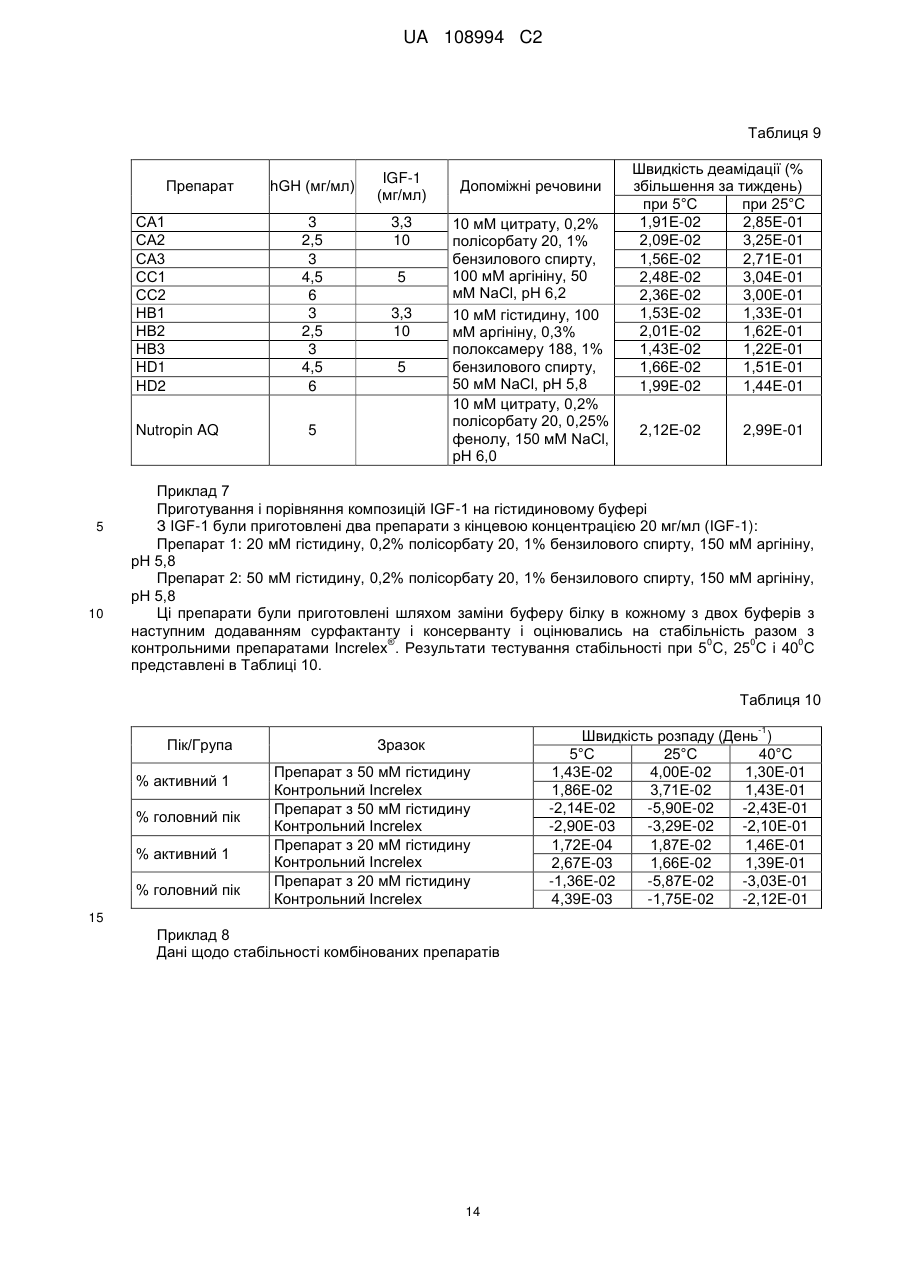
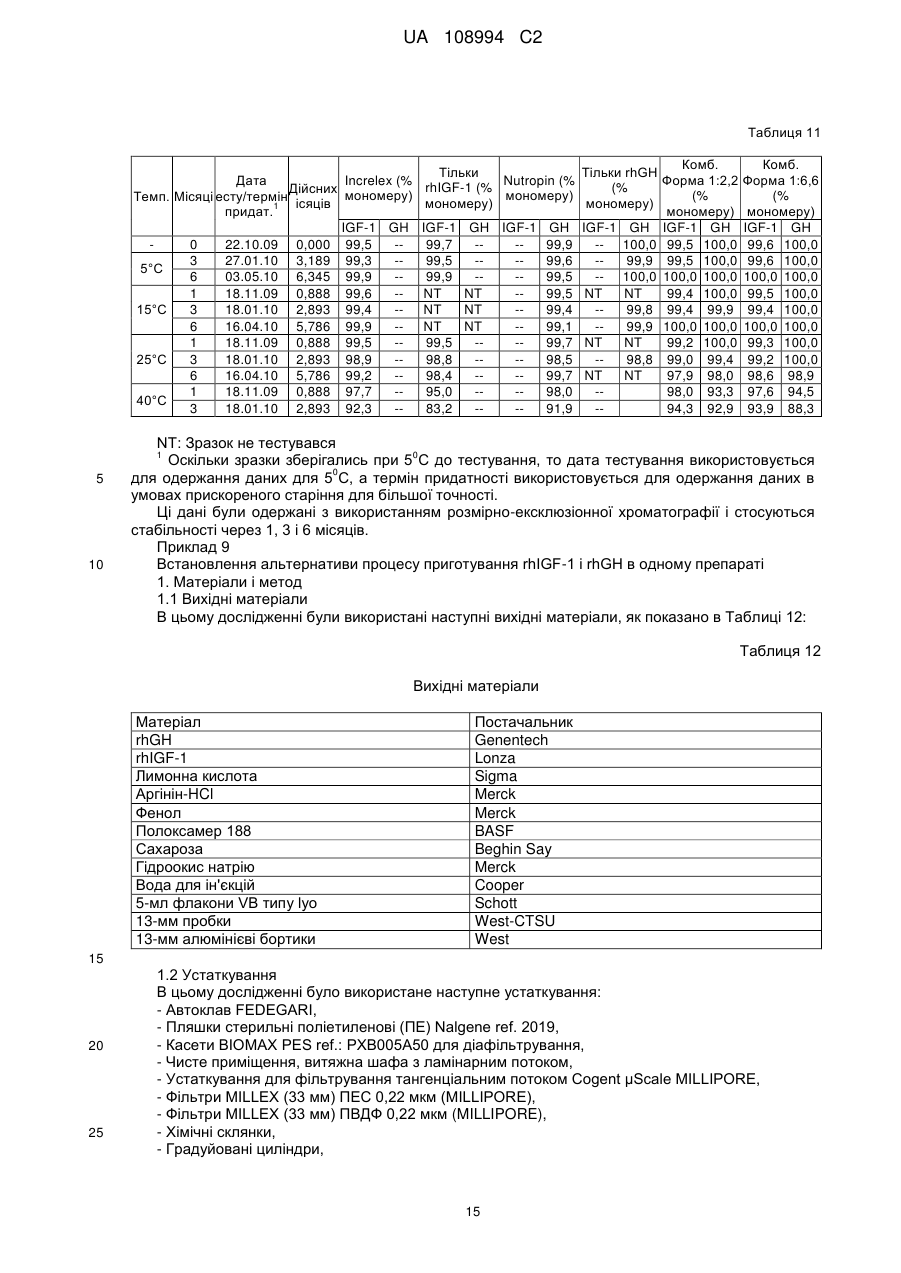
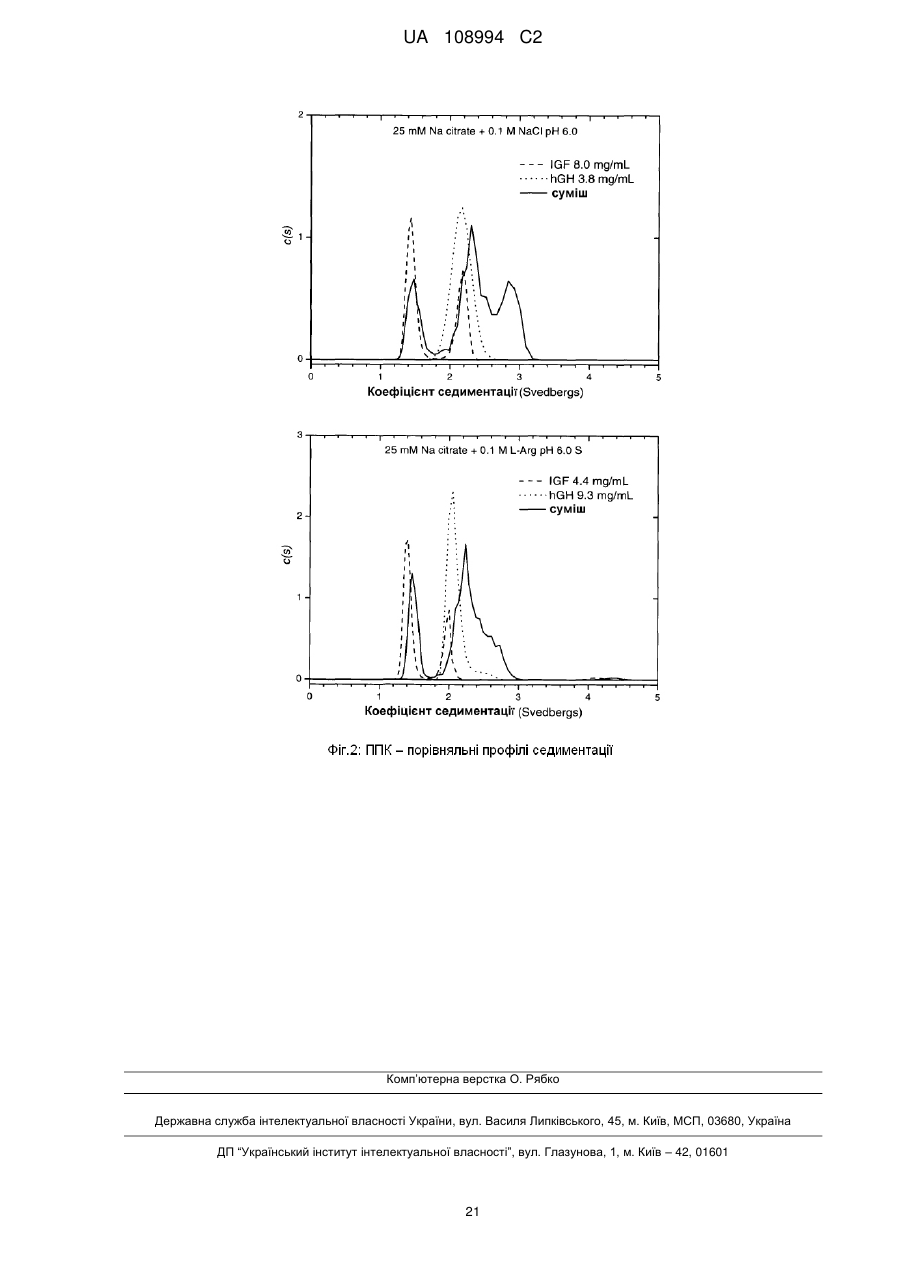
Реферат: Даний винахід стосується фармацевтичних композицій, що містять комбінацію гормону росту (GH) і інсуліноподібного фактора росту (IGF-1), що являють собою стабільні рідкі фармацевтичні композиції без утворення видимих нерозчинних агрегатів при бажаному рН, а також процесів їх приготування, UA 108994 C2 (12) UA 108994 C2 UA 108994 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується фармацевтичних композицій. Більш конкретно, цей винахід стосується препаратів комбінаційних композицій гормону росту (GH) і інсулін-подібного фактору росту (IGF-1). Такі комбінаційні композиції дають стабільні рідкі фармацевтичні композиції без утворення видимих нерозчинних агрегатів при бажаному рН. Даний винахід пропонує також лікарську форму для інсулін-подібного фактору росту 1 (IGF1) і гормону росту (GH), в якій білки можуть вводитись разом в ін’єкційну форму або виготовляються окремо і змішуються в дозованій ін’єкційній лікарській формі перед введенням. Інсулін-подібний гормон росту належить до родини поліпептидів, відомих як соматомедини, і являє собою поліпептид, що природно трапляється в рідинах організму людини. Більшість тканин і особливо печінка продукують IGF-1 разом зі специфічними білками, що зв’язують IGF. IGF-1 стимулює ріст і поділ широкого кола типів клітин, зокрема під час розвитку, так що рівень IGF-1 впливає на такі процеси, як скелетний ріст і реплікація клітин. Ці молекули знаходяться під контролем гормону росту (GH). IGF-1 є головним білковим гормоном, який опосередковує стимулюючі ріст кістки ефекти GH. IGF-1 виробляється у відповідь на GH, а потім індукує наступні клітинні реакції, включаючи клітинні реакції в кістці. IGF-1 складається з 70 амінокислот в одинарному ланцюгу з трьома внутрішньомолекулярними дисульфідними містками. IGF-1 має молекулярну масу 7649 дальтонів і продукується головним чином печінкою як ендокринний гормон, а також в тканинахмішенях у паракрин/автокриновий спосіб. У великих масштабах IGF-1 вироблявся рекомбінантно (rhIGF-1) з використанням дріжджів і E. coli. Гормон росту або гормон росту людини (hGH) є поліпептидом у вигляді одинарного ланцюга, який складається зі 191 амінокислоти. Дисульфідні зв’язки з’єднують позиції 53 і 165, а також 182 і 189. GH людини є сильним анаболічним агентом. Серед його найбільш разючих ефектів у гіпопітуїтарних (з дефіцитом GH) суб’єктів є прискорений лінійний ріст ростової пластинки росту, результатом чого є висока статура. Корисний і синергічний ефект комбінації обох білків є описаним у міжнародній патентній заявці WO9118621. Одночасне введення IGF-1 і GH ссавцю приводить до посиленого росту у порівнянні з тим ростом, який досягається при використанні IGF-1 або GH окремо. Це посилення росту дорівнює сумі росту, який спостерігається при введенні IGF-1, і росту, який спостерігається при введенні GH. Способи і композиції для збільшення швидкості росту є описаними також у міжнародній патентній заявці WO 2006/130769. Це дослідження стосувалось головним чином способу лікування, а результати фокусувались на реакції пацієнтів. Описуються також фармацевтичні композиції і, зокрема, суміш IGF-1 і GH з доданими до рецептури манітолом, гліцином та/або фосфатом при рН 7,4. Коли така суміш має зберігатись, до рецептури вводиться буфер, такий як цитрат, при рН біля 6 з сурфактантом, який підвищує розчинність GH при такому рН, таким як полісорбат 20 або полоксамер 188. В цій заявці також описується можливість додавання неорганічної солі і стабілізатору. В препаратах, описаних в заявці WO 2006/130769, використовується агент, який перешкоджає агрегації. Проблемою, що часто трапляється при комбінуванні в одному розчині двох білків, є утворення комплексів при взаємодіях білок-білок. На таке утворення комплексів впливають, зокрема, зміна концентрації, температура, рН і буфер, який використовується в розчинах, що містять білок. Потім білкові комплекси можуть утворювати нерозчинні агрегати, що призводить до втрати потенціалу і активності білків. Більше того, в фармацевтичних препаратах доза терапевтичного білку є важливою і її потрібно тримати в контрольованих межах впродовж значного періоду часу. Застосування солюбілізуючих агентів часто є необхідним для досягнення і підтримання потрібної концентрації білку в розчині і, зокрема, для солюбілізації великих кількостей білків. В патенті США № 6,767,892 описуються фармацевтичні композиції IGF-1 і його аналогів, що містять солюбілізуючі сполуки, такі як аргінін, N-ацетил аргінін або гуанідину гідрохлорид IGF-1. Такі композиції були піддані тестуванню, і представлені порівняльні дані показують підвищену розчинність IGF-1 при рН понад 5,0 і при температурах холодильного зберігання. Однак в цьому документі не описуються композиції, які містять IGF-1 в комбінації з додатковими терапевтичними білками. Метою даного винаходу є одержання рідких препаратів, що містять одночасно IGF-1 і 0 гормон росту (GH), які є стабільними при 4 С впродовж щонайменше 30 днів без скільки-небудь значної агрегації, як засвідчуватиме візуальна прозорість розчину. Процес приготування рідкого препарату, який містить IGF-1 і GH, є додатковою метою цього винаходу. Опис малюнків: Фіг. 1: показує накладені один на одного профілі швидкості седиментації, одержані при аналітичному ультрацентрифугуванні розчину IGF-1, розчинів GH і суміші 1:1 цих двох розчинів. 1 UA 108994 C2 5 10 15 20 25 30 35 40 45 50 55 Перший комплект профілів (Фіг. 1) було одержано з білками, приготовленими в 25 мМ цитратному буфері при рН 6; він демонструє ознаки суттєвої асоціації між цими білками. Фіг. 2: показує профілі седиментації розчинів, які включають 100 мМ іону аргінінію (аргініну). Ці профілі показують, що присутність аргініну викликає зміни, що засвідчують зменшену кількість в цих розчинах агрегатів з високою молекулярною масою. Наступні дефініції наведені для того, щоб проілюструвати і визначити значення і об’єм різних термінів, використаних тут при описанні винаходу. Згідно з даним винаходом, термін «агент, який перешкоджає агрегації» стосується сполук, які попереджають або зменшують утворення нерозчинних білкових агрегатів, коли білки знаходяться в розчині. Термін «IGF-1» стосується інсулін подібного фактору росту 1 від будь-якого виду, включаючи, але не обмежуючись ними, бичачих, овечих, свинячих і птичих і, переважно, людину, в нативній послідовності або у формі варіанту і з будь-якого джерела – природного, синтетичного або рекомбінантного. Переважно, IGF-1 одержується рекомбінантно, як, наприклад, описано в патенті США № 6,331,414. Краще, коли IGF-1 є активним фармацевтичним інгредієнтом в продукті під торговою TM маркою INCRELEX . Термін «rhIGF-1» стосується рекомбінантного людського IGF-1. Термін «GH» стосується гормону росту від будь-якого виду, включаючи, але не обмежуючись ними, бичачих, овечих, свинячих і птичих і, переважно, людину, в нативній послідовності або у формі варіанту і з будь-якого джерела – природного, синтетичного або рекомбінантного. Терміни «гормон росту людини» і «hGH» стосуються гормону росту людини, одержаного методами, які включають екстракцію і очистку з природних джерел, і з використанням систем рекомбінантних клітинних культур, наприклад як описано в науковій публікації “Direct expression in Escherichia coli of a DNA sequence coding for human growth hormone” Goeddel & al, Nature Vol. 281, October 1979. Послідовність hGH наведена, наприклад, в Hormone Drugs, Gueriguian et al., USP convention, Rockville, MD (1982). Ці терміни охоплюють також біологічно активні еквіваленти гормону людини, наприклад такі, які включають одну або більше інших амінокислот в загальній послідовності. Більше того, ці терміни, як вони використовуються в цій заявці, охоплюють варіанти hGH із заміщенням, делецією або вставкою амінокислот, тобто аналоги та/або гомологи hGH або hGHs з пост-трансляційними модифікаціями. Часто використовуються два види: нативний вид з 191 амінокислоти (Соматропін) і N-термінальний метіоніновий зі 192 амінокислот, причому обидва звичайно одержуються рекомбінантно. Краще використовувати метіоніловий гормон росту людини (met-hGH), який виробляють у E. ® coli і який продається під торговою маркою PROTROPIN фірмою Genentech, Inc. Він є ідентичним природному поліпептиду, за виключенням наявності N-термінального метіонінового залишку. Серед кращих також рекомбінантний hGH тієї ж фірми Genentech, Inc., який ® продається під торговою маркою NUTROPIN . Перевагу ж віддають рекомбінантній rhGH рідині ® для ін’єкцій від фірми Genentech, Inc., який продається під торговою маркою NUTROPIN AQ . Термін «буфер», як він тут використовується, означає фармацевтично прийнятний буфер, який переважно дає рН 5-6,5. Придатні буфери включають, не обмежуючись ними, ацетатні буфери, цитратні буфери, фосфатні буфери, сукцинатні буфери і амінокислотні буфери, такі як гістидинові буфери, та всі їх солі. Термін «консервант», як він тут використовується, означає фармацевтично прийнятну речовину, яка попереджає розпад через ріст мікробів або небажані хімічні зміни. Термін «сурфактант», як він тут використовується, означає фармацевтично прийнятну речовину, яка забезпечує диспергування або суспендування, зменшуючи поверхневий натяг розчинника (такого як вода) або натяг міжфазової поверхні між двома рідинами, що не змішуються. Придатними сурфактантами є, наприклад, неіонні сурфактанти, такі як полісорбати або полоксамери. Термін «наповнювач», як він тут використовується, означає фармацевтично прийнятну речовину, яка використовується для збільшення кількості твердих речовин і є, наприклад, сахарозою, трегалозою і манітолом, не обмежуючись ними. Термін «модифікатор тонічності» стосується ізотонічного модифікатору або осмотичного регулятору або осмоліту, які забезпечують буферному розчину осмолярність. Осмолярність означає загальну осмотичну активність, яку іони і неіонізовані молекули вносять в розчин, який включає неорганічні солі, такі як натрію хлорид і калію хлорид, поліетилен гліколі (PEGs), поліпропілен, гліколь, гліцин, гліцерин. 2 UA 108994 C2 5 10 15 20 25 30 35 40 45 50 55 Термін «ліофілізований», як він тут використовується, стосується препарату, який було піддано процесу, відомому в цій галузі як сушка виморожуванням, яка передбачає заморожування препарату і наступне видалення льоду з замороженого вмісту. Термін «амінокислота», як він тут використовується, означає амінокислоту (вільну амінокислоту, а не амінокислоту в пептидній або білковій послідовності). Амінокислота, як тут використовується, включає, не обмежуючись ними, аргінін, гліцин, лізин, гістидин, глютамінова кислота, аспарагінова кислота, ізолейцин, лейцин, аланін, фенілаланін, триптофан, серин, метіонін і пролін, наприклад. Термін «IRF» або «препарат з негайним вивільненням» стосується лікарської композиції або суміші лікарських композицій, переважно в рідкій формі, в якій немає носія, що регулює біодоступність активної речовини препарату для тканин у місці введення препарату в організм пацієнта. Термін «агент, який перешкоджає агрегації», як він тут використовується, стосується продукту, який перешкоджає взаємодії білків з утворенням комплексів та/або агрегатів, коли вони змішуються разом в розчині. Згідно даного винаходу, фармацевтична композиція включає rhIGF-1 і rhGH, а також - агент, який перешкоджає агрегації; - буфер; - сурфактант; - необов’язково, консервант; і - необов’язково, модифікатор тонічності або наповнювач, де агент, який перешкоджає агрегації, є присутнім в композиції в концентрації щонайменше 80 мМ. Характерною особливістю фармацевтичної композиції за даним винаходом є те, що в одному препараті є присутніми два активні інгредієнти – IGF-1 і GH. «Єдиний препарат», як він тут використовується, називають також «зведеним препаратом» або «зведеною сумішшю». Терміни «зведений препарат» і «зведена суміш» використовуються тут взаємозамінно. Переважно, цими двома активними інгредієнтами є IGF-1 і GH людини, які тут називаються також rhIGF-1 і rhGH. Також краще, щоб обидва активні інгредієнти були одержані рекомбінантними засобами. В кращому варіанті здійснення фармацевтичною композицією за цим винаходом є рідка композиція. Також краще, щоб це була багатодозова композиція. У випадку реалізації винаходу як багатодозової композиції в ній переважно є присутнім консервант. В подальшому аспекті даний винахід стосується процесів приготування фармацевтичної композиції, що містить IGF-1 і GH. Згідно з цим винаходом, один процес приготування фармацевтичної композиції може здійснюватись наступним чином: a) Приготування розчину hGH у буфері при рН між 5 і 6,5, що містить агент, який перешкоджає агрегації, модифікатор тонічності або наповнювач; b) Приготування розчину IGF-1 шляхом діалізу препарату IGF-1 у буфері, який використовувався на етапі (а) і містив агент, який перешкоджає агрегації, модифікатор тонічності або наповнювач; с) Додавання сурфактанту і, необов’язково, консерванту до обох основних розчинів; і d) Змішування разом розчинів hGH і IGF-1. У варіантах здійснення цього процесу на етапі (а) ліофілізований hGH розчиняють в буфері або рідкий hGH (наприклад, розчин біля 20 мг/мл в бікарбонатному буфері) переводять в інший буфер, переважно цитратний, сукцинатний або гістидиновий буфер, при звичайному рН, переважно між приблизно 5 і 6,5, який містить агент, який перешкоджає агрегації, в діапазоні концентрацій від 80 до 200 мМ, переважно в діапазоні від приблизно 100 мМ до приблизно 150 мМ. Необов’язково, щонайменше один розчин, приготовлений на будь-якому з етапів (a), (b), (c) або (d), містить консервант, переважно фенол або бензиловий спирт. Термін «приблизно» в контексті кількості інгредієнтів, представлених тут, означає, що ця кількість може коливатись в межах, менших ніж ±20%, або менших ніж ±15%, або менших ніж ±10%, або менших ніж ±5%. На етапі (b) ліофілізований IGF-1 розчиняють у буфері або рідкий IGF-1 (наприклад, розчин біля 20-35 мг/мл в цитратному буфері) переводять в інший буфер, переважно цитратний, сукцинатний або гістидиновий буфер, при звичайному рН, переважно між приблизно 5 і 6,5, який містить агент, який перешкоджає агрегації, в діапазоні концентрацій від приблизно 80 мМ до приблизно 200 мМ Після цього два незалежно приготовлені розчини змішують разом. 3 UA 108994 C2 5 10 15 20 25 30 35 40 45 50 55 60 Альтернативний процес приготування фармацевтичної композиції також охоплюється цим винаходом. Згідно з даним винаходом, альтернативний процес приготування фармацевтичної композиції за даним винаходом включає: а) Приготування розчину І змішуванням буферу, переважно гістидинового буферу, агента, що перешкоджає агрегації, переважно аргініну, сурфактанту, переважно полісорбату 20, необов’язково консерванту, переважно бензилового спирту, і необов’язково регулювання об’єму водою, при цьому розчин І має або регулюється до рН біля 5,8; b) Приготування розчину IGF-1 в буфері і агенті, що перешкоджає агрегації, які використовувались на етапі (а), з одержанням розчину ІІ; с) Додавання розчину ІІ до розчину І з одержанням розчину ІІІ; d) Приготування розчину IV змішуванням буферу, переважно гістидинового, агента, що перешкоджає агрегації, переважно аргініну, сурфактанту, переважно полісорбату 20, необов’язково консерванту, переважно бензилового спирту, і необов’язково регулювання об’єму водою, при цьому розчин IV має або регулюється до рН біля 5,8; е) Приготування розчину GH у буфері і агенті, що перешкоджає агрегації, які використовувались на етапі (d), цей GH необов’язково може містити буфер з натрію бікарбонатом, щоб одержати розчин V; f) Додавання розчину V до розчину ІV з одержанням розчину VІ; g) Необов’язково, незалежне фільтрування розчинів ІІІ і ІV; h) Змішування профільтрованих розчинів ІІІ і ІV при співвідношенні IGF-1:GH (м/м) між приблизно 1:1 і 7:1 (м/м), переважно 1,1:1 (м/м), 3,3:1 (м/м) і 6,6:1 (м/м), з одержанням розчину VІІ; і і) Необов’язково, фільтрування розчину VІІ. Етапи (b) і (e) можуть здійснюватись, наприклад, шляхом діафільтрування розчину, що містить IGF-1 або GH, у відповідний буфер і агент, що перешкоджає агрегації, або в будь-який інший придатний розчин для одержання розчинів ІІ і ІV. В одному варіанті здійснення розчини І і ІV є ідентичними. В цьому варіанті здійснення етап (d) є зайвим, тобто розчин ІV не готується і розчин V просто змішується з розчином І, щоб одержати розчин VІ. В одному варіанті здійснення розчини ІІ і ІV можуть містити наповнювач, такий як, наприклад, сахароза або манітол. В одному варіанті здійснення рідка лікарська речовина GH (тобто розчин, що містить GH, краще hGH, а ще краще rhGH) змішується безпосередньо з розчином ІV без будь-якого попереднього обміну буферу або діафільтрування у буфер і агент, що перешкоджає агрегації, у відповідності до етапу (е), тобто без виконання етапу (е), як описано вище. Відповідно, в цьому варіанті здійснення процес включає наступні етапи: а) Приготування розчину І змішуванням буферу, переважно гістидинового буферу, агента, що перешкоджає агрегації, переважно аргініну, сурфактанту, переважно полісорбату 20, необов’язково консерванту, переважно бензилового спирту, і необов’язково регулювання об’єму водою, при цьому розчин І має або регулюється до рН біля 5,8; b) Приготування розчину IGF-1 в буфері і агенті, що перешкоджає агрегації, які використовувались на етапі (а), з одержанням розчину ІІ; с) Додавання розчину ІІ до розчину І з одержанням розчину ІІІ; d) Приготування розчину IV змішуванням буферу, переважно гістидинового, агента, що перешкоджає агрегації, переважно аргініну, сурфактанту, переважно полісорбату 20, необов’язково консерванту, переважно бензилового спирту, і необов’язково регулювання об’єму водою, при цьому розчин IV має або регулюється до рН біля 5,8; е) - варіант: Додавання лікарської речовини GH, яка необов’язково може містити буфер з натрію бікарбонатом, до розчину IV, щоб одержати розчин VI; f) Необов’язково, незалежне фільтрування розчинів ІІІ і ІV; g) Змішування профільтрованих розчинів ІІІ і ІV при співвідношенні IGF-1: GH (м/м) між приблизно 1:1 і 7:1 (м/м), переважно 1,1:1 (м/м), 3,3:1 (м/м) і 6,6:1 (м/м), з одержанням розчину VІІ; і h) Необов’язково, фільтрування розчину VІІ. В одному варіанті здійснення цього альтернативного процесу розчини І і ІV є ідентичними. В цьому варіанті здійснення етап (d) є зайвим, тобто розчин ІV не готується і розчин V просто змішується з розчином І, щоб одержати розчин VІ. Переважно, рідка лікарська речовина hGH являє собою розчин біля 20 мг/мл hGH в бікарбонатному буфері концентрації біля 6-10 мМ, переважно 7,5 мМ, і розводиться без 4 UA 108994 C2 5 10 15 20 25 30 35 40 45 50 55 попереднього діафільтрування в буфері, переважно цитратному, сукцинатному або гістидиновому при звичайному рН, переважно між приблизно 5 і 6,2, який необов’язково може містити агент, що перешкоджає агрегації, при концентрації в межах від приблизно 80 до 200 мМ, переважно від приблизно 100 мМ до приблизно 150 мМ. В іншому варіанті здійснення рідкий IGF-1 (наприклад, розчин приблизно 20-35 мг/мл в 200 мМ цитратному буфері) переводиться в інший буфер, переважно цитратний, сукцинатний або гістидиновий при звичайному рН, переважно між приблизно 5 і 6,5, і необов’язково може містити агент, що перешкоджає агрегації, при концентрації в межах від приблизно 80 до 200 мМ, переважно від приблизно 100 мМ до приблизно 150 мМ. Потім ці два незалежно приготовлені розчини змішуються разом. Фільтрування може здійснюватись будь-якими доцільними засобами, наприклад фільтрами на основі целюлози або ПЕС (поліефірсульфоновими) фільтрами. В кращому варіанті здійснення фільтрування всіх розчинів (до змішування розчинів і після змішування) може здійснюватись з використанням 0,22-мкм фільтрів з низькою афінністю до білків, таких як, наприклад, полівініліден фторидні (ПВДФ) фільтри. Мембрани цих фільтрів переважно мають межу молекулярної маси приблизно 5 кДа або приблизно 3 кДа. Бажано, щоб фармацевтичні композиції за цим винаходом були стабільними щонайменше впродовж 1 місяця, 3 місяців, 6 місяців, 9 місяців, 1 року або до 2 років. В своєму подальшому аспекті даний винахід охоплює використання аргініну в якості агента, що перешкоджає агрегації, в рідкій фармацевтичній композиції, яка містить IGF-1 і GH, краще hIGF-1 і hGH, а ще краще rhIGF-1 і rhGH, де концентрація аргініну коливається в межах від приблизно 80 мМ до приблизно 200 мМ, тобто становить, наприклад, приблизно 80 мМ, приблизно 90 мМ, приблизно 100 мМ, приблизно 110 мМ, приблизно 120 мМ, приблизно 130 мМ, приблизно 140 мМ, приблизно 150 мМ, приблизно 160 мМ, приблизно 170 мМ, приблизно 180 мМ, приблизно 190 мМ або 200 мМ. Було встановлено, що включення у фармацевтичну композицію амінокислоти дозволяє одержувати суміші IGF-1 і GH у вигляді прозорого розчину без жодних втрат візуальної 0 прозорості суміші під час наступного її охолодження до 2-8 С впродовж щонайменше 30 днів, краще впродовж щонайменше 6 місяців, а ще краще впродовж щонайменше 12 місяців. В одному кращому варіанті здійснення цього винаходу такий препарат є стабільним при 0 0 0 зберіганні при температурі -20 С або між 2 С і 8 С впродовж щонайменше 18 місяців. В одному варіанті здійснення даний винахід охоплює стабільний, спільно змішуваний препарат з активних інгредієнтів інсулін-подібного фактору росту 1 людини (hIGF-1) і гормону росту людини (hGH). В кращому варіанті здійснення ці активні інгредієнти одержуються рекомбінантними засобами і позначаються rhIGF-1 і rhGH. Такі препарати містять rhIGF-1 і rhGH, агент, що перешкоджає агрегації, і буфер. Такі препарати можуть містити також сурфактант, переважно неіонний сурфактант, необов’язково консервант і необов’язково модифікатор тонічності та/або наповнювач. Переважно, амінокислотою, яка дозволяє одержувати суміші IGF-1 і GH як один препарат у вигляді прозорого розчину, є аргінін або лізин, краще аргінін (наприклад, іон аргінінію). Переважно, амінокислота, яка діє як агент, що перешкоджає агрегації, додається окремо до кожного розчину перед їх змішуванням в одному препараті у вигляді прозорого розчину. Краще, щоб кінцева концентрація агента, що перешкоджає агрегації, в прозорому розчині була в межах від приблизно 80 мМ до приблизно 200 мМ, або в межах від приблизно 100 мМ до приблизно 180 мМ, або в межах від приблизно 120 мМ до приблизно 160 мМ, або становила приблизно 150 мМ. Значення рН регулюється в межах від приблизно 5 до приблизно 7, краще в межах від приблизно 5,5 до приблизно 6,5, а ще краще в межах від приблизно 5,8 до приблизно 6,2. В контексті значень рН термін «приблизно» означає, що величина рН може коливатись в межах ±0,2 або ±0,1. Значення рН розчину може регулюватись будь-якими доцільними засобами, такими як, наприклад, додавання відповідної кількості кислого розчину, такого як, наприклад, цитрат або краще HCl. Значення рН у відповідності до даного винаходу може становити, наприклад, 5,1; 5,2; 5,3; 5,4; 5,5; 5,6; 5,7; 5,8; 5,9; 6,0; 6,1; 6,2; 6,3; 6,4; 6,5, але краще, щоб воно становило 5,8; 6,2 або приблизно 6,5. В додатковому варіанті здійснення осмолітом або модифікатором тонічності може бути неорганічна сіль. Якщо це передбачено, цією неорганічною сіллю може бути, наприклад, натрію хлорид або калію хлорид, переважно натрію хлорид, присутній в композиції в концентрації від 0 до 150 мМ, переважно в концентрації від 1 до 150 мМ. 5 UA 108994 C2 5 10 15 20 25 30 35 40 45 50 55 60 До того ж, факультативний консервант може бути вибраний з наступного переліку: фенол, бензиловий спирт, m-крезол, хлорбутанол. Кращими консервантами є фенол або бензиловий спирт. Консервант може бути присутнім в композиції в концентрації приблизно 0,1до 5% (м/м), переважно приблизно 0,2 до 2% (м/м) або ще краще приблизно 1%. Сурфактант для композиції, описаної в даному винаході, вибирається, наприклад, з наступного переліку: полісорбат (Твін) або полоксамер, такий як полісорбат 80, полісорбат 20 або полоксамер 188. Переважно, сурфактант має бути неіонним, краще щоб це був полісорбат (Твін), такий як полісорбат 80, полісорбат 20 або полоксамер, такий як полоксамер 188. Краще, щоб це був полісорбат 20 або полоксамер 188 в концентрації в межах від приблизно 0,01 до 3% (м/м), краще від приблизно 0,03 до 0,50% (м/м), а ще краще біля 0,2% (м/м). Крім того, буфер може вибиратись з придатних, фармацевтично прийнятних буферів, які забезпечують рН від 5 до 6,5, таких як натрію цитрат або гістидин або обидва; переважно це ацетатні буфери, цитратні буфери, фосфатні буфери, амінокислота, така як гістидин, та всі їх солі. Кращими буферами є цитрат або гістидин. Переважно, буфер є присутнім в кінцевій композиції в концентрації від 1 до 100 мМ, краще від 1 до 50 мМ, а ще краще від приблизно 10 мМ до приблизно 20 мМ. Згідно з даним винаходом, кількість IGF-1 і GH становить приблизно від 2 до 40 мг/мл (IGF1) і приблизно від 1 до 12 мг/мл (hGH), відповідно, а краще, щоб вона становила приблизно від 5 до 20 мг/мл (IGF-1) і приблизно від 2 до 8 мг/мл (hGH). В інших кращих випадках ця кількість становить приблизно 10 мг/мл (IGF-1) і приблизно 3 мг/мл (hGH) або приблизно 13,2 мг/мл (IGF1) і 2 мг/мл (GH). Масове співвідношення IGF-1:GH (м/м) переважно коливається в межах від 1:1 до 9:1 або альтернативно від приблизно 1:9 до 1:1. Краще, щоб масове співвідношення IGF-1:GH (м/м) вибиралось з наступного переліку: 9:1 (м/м), 6:1 (м/м), 3:1 (м/м), 2:1 (м/м), 3:7 (м/м), 1:1 (м/м), 1:2 (м/м), 1:5 (м/м), 7:3 (м/м), 9:1 (м/м). Кращі масові співвідношення IGF-1:GH (м/м) вибираються з 1,1:1; 2,2:1; 3,3:1 та 6,6:1. В одному варіанті здійснення композиція містить комбінацію rhIGF-1 і rhGH в концентрації від приблизно 10 до 30 мг/мл (IGF-1) і від приблизно 1 до 12 мг/мл (rhGH), відповідно, при масовому співвідношенні IGF-1:GH (м/м) між приблизно 9:1 і 1:9 (м/м), біля 0,01-3,0% (м/м) сурфактанту, необов’язково біля 0,1-5,0% (м/м) консерванту, біля 1-150 мМ буферу, переважно цитрату або гістидину, і агент, що перешкоджає агрегації, такий як аргінін або лізин, в концентрації від 80 до 200 мМ. Необов’язково, така композиція може містити один або два модифікатори тонічності, такі як NaCl, KCl, в концентрації від 0 до 150 мМ для NaCl і KCl та/або наповнювачі, такі як трегалоза, манітол, сорбіт або сахароза, в концентрації від 1 до 10% (м/м) для манітолу, сорбіту, трегалози або сахарози. Додатково, даний винахід стосується процесу приготування фармацевтичної композиції, що містить комбінацію IGF-1 і GH. В фармацевтичних препаратах за даним винаходом гормон росту людини і інсулін-подібний фактор росту людини переважно одержуються рекомбінантними засобами. В одному з подальших варіантів здійснення IGF-1 і GH, переважно в складі композиції за цим винаходом, можуть вводитись пацієнту, кожний в ефективній кількості або кожний в кількості, що є субоптимальною, але в комбінації стає ефективною. Переважно, така кількість становить біля 25-250 мікрограмів IGF-1/кг маси тіла/добу і біля 0,05-0,5 мг GH/кг маси тіла/тиждень. Переважно, введення такого фармацевтичного препарату здійснюється шляхом ін’єкції, переважно парентеральної підшкірним, внутрішньом’язовим, внутрішньовенним або інфузійним шляхом; при цьому найкраще, щоб фармацевтична композиція використовувалась як щоденна болюсна ін’єкція і була препаратом негайного вивільнення. Пацієнтом, що лікується, переважно є ссавець, зокрема людина, але ним може бути також тварина. В одному з подальших варіантів здійснення даний винахід пропонує використання описаної композиції у виробництві медикаментів для лікування хвороби, яка характеризується підвищенням рівня гормону росту в плазмі або потребує його контролю. Зокрема, даний винахід пропонує способи і композиції для лікування дефіциту гормону росту (ДГР), синдрому Тернера, синдрому Прадера-Віллі, карликовості у дітей, що народились з дуже малою масою тіла, дефіциту гормону росту у дорослих, а також ендокринного розладу – такого, який передбачає, наприклад, введення пацієнту, що страждає від метаболічного розладу, який характеризується частковою активністю ендогенного гормону росту або проведення сигналів, такої кількості інсулін-подібного фактору росту 1 (IGF-1) і такої кількості гормону росту (GH), які є ефективними в комбінаційній терапії у відношенні поліпшення 6 UA 108994 C2 5 10 15 20 метаболічного порушення у цього пацієнта. Коли пацієнт має дорослий синдром ідіопатичної карликовості (ISS), коли пацієнт приймає одну дозу IGF-1 в день і одну дозу GH в день, йому можна вводити IGF-1 і GH одночасно. Даний винахід пропонує також способи і композиції для дітей, які страждають від розладів росту, що характеризуються частковою активністю ендогенного гормону росту або проведення сигналів. Ті розлади росту, які викликають порушення в дитинстві, зберігаються в дорослому віці, і така вражена доросла людина може страждати від різноманітних метаболічних розладів. Згідно з даним винаходом, hIGF-1 і hGH використовуються як медикамент або як фармацевтична композиція. Цінною перевагою даного винаходу є те, що він пропонує композиції, які можуть використовуватись для попереднього наповнення контейнерів, таких як шприци, або для препаратів, готових для застосування. Наступні приклади слугують як ілюстрація даного винаходу, не обмежуючи його. Приклад 1 Тести на розчинність ® Суміші Increlex (розчин 10 мг/мл, приготовлений в 50 мМ ацетатному буфері при рН 5,4) і ® Nutropin AQ (розчин 5 мг/мл, приготовлений в 10 мМ цитратному буфері при рН 6) були приготовлені з об’ємними відношеннями від 9:1 до 1:9. Ці суміші демонстрували різного ступеню видиму преципітацію негайно після змішування або в межах кількох годин після нього. Мас® ® спектроскопічний аналіз преципітатів, що утворились в сумішах Increlex та Nutropin AQ , виявив присутність в преципітатах обох білків. В Таблиці 1 зібрані спостереження і результати у відношенні прозорості спільних сумішей, приготовлених з комерційних продуктів IGF-1 ® ® (Increlex ) і GH (Nutropin AQ ). Таблиця 1 Відношення (о/о) Increlex (мл) Nutropin AQ (мл) 9:1 3,6 0,4 5:1 3,6 0,72 2:1 3,6 1,8 1:1 2,0 2,0 1:2 1,8 3,6 1:5 0,72 3,6 1:9 0,40 3,6 Негайно (20.03.2008) Дуже незначний, вільно плаваючий преципітат рН=5,42 Дуже незначний, вільно плаваючий преципітат рН=5,51 Вільно плаваючий преципітат рН=5,57 Вільно плаваючий преципітат рН=5,64 Каламутний, значний преципітат рН=5,74 Вільно плаваючий преципітат рН=5,85 Вільно плаваючий преципітат рН=5,94 Спостереження 24 години (21.03.2008) 1 тиждень (27.03.2008) Дуже незначний, Дуже незначний, вільно плаваючий вільно плаваючий преципітат преципітат Дуже незначний, Дуже незначний, вільно плаваючий вільно плаваючий преципітат преципітат Вільно плаваючий Вільно плаваючий преципітат преципітат Прозорий з Вільно плаваючий желатинозною преципітат плівкою на склі Прозорий з желатинозною плівкою на склі Прозорий з желатинозною плівкою на склі Прозорий з Значний, щільний желатинозною преципітат плівкою на склі Вільно плаваючий Вільно плаваючий преципітат преципітат 25 30 Було підтверджено, що розчинність IGF-1 перевищує 20 мг/мл у всьому діапазоні рН тестованих сумішей (5,4-5,9), а значить розчинність IGF-1 не була причиною преципітату, що спостерігався. Розчинність GH в цитратному, ацетатному або гістидиновому буферах в тестованому діапазоні рН виявилась залежною від буферу. Одержані результати демонструють стрімкий спад розчинності розчинів GH в ацетатному буфері при значеннях рН, нижчих за 5,6, чим може пояснюватись преципітація в розчинах сумішей, що спостерігалась. 7 UA 108994 C2 ® 5 10 15 ® Однак суміші Nutropin AQ з плацебо Increlex (яке не містить IGF-1, але у всьому іншому ® ® ® ідентичне по складу Increlex ) або суміші Increlex з плацебо Nutropin AQ (яке не містить GH, ® але у всьому іншому ідентичне по складу Nutropin AQ ) залишаються прозорими в розчині, що вказує на те, що знижена розчинність білків може бути пов’язаною також з взаємодією між цими ® ® двома білками. Більше того, Increlex , розведений плацебо Increlex до кінцевої концентрації 2,5 ® мг/мл, може змішуватись з Nutropin AQ при співвідношеннях IGF-1/hGH 2,2:1 або більше без жодних ознак преципітації, а це засвідчує, що взаємодія між цими білками є оборотною. Приклад 2 Порівняння і приготування одночасно змішуваних композицій, забуферених в цитраті при різних рН Ліофілізований hGH розчинили в 10 мМ цитратному буфері при рН 6, який містить 150 мМ натрію хлориду і 0,2% полісорбату 20, до кінцевої концентрації 5 мг/мл. Розчини IGF-1 в різних буферних сумішах, показаних в колонці 1 Таблиці 2, були приготовлені шляхом діалізу IGF-1 у відповідний буфер або шляхом розчинення ліофілізованого IGF-1 в буфері. Кінцева концентрація розчинів IGF-1 перед змішуванням з розчинами GH становила 10 мг/мл. Розчини GH і IGF-1 змішувались разом в різних співвідношеннях, наведених в Таблиці 2. Візуальний вигляд зведених сумішей, приготовлених з GH в цитратному буфері і IGF-1 в різних буферах при рН 5,4 і 6, наведено в Таблиці 2. Таблиця 2 Препарат IGF-1 10 мМ цитратний рН 5,4 20 мМ цитратний рН 6 50 мМ цитратний рН 5,4 10 мМ ацетатний рН 5,4 50 мМ ацетатний рН 5,4 10 мМ фосфатний рН 6 50 мМ фосфатний рН 6 Відношення змішування hGH:IGF-1 1:9 3:7 1:1 7:3 9:1 1:9 3:7 1:1 7:3 9:1 1:9 3:7 1:1 7:3 9:1 1:9 3:7 1:1 7:3 9:1 1:9 3:7 1:1 7:3 9:1 1:9 3:7 1:1 7:3 9:1 1:9 3:7 1:1 8 Візуальний вигляд сумішей через 1-2 0 тижні при 5 С Прозора Прозора Певна кількість часток Частки Непрозора Прозора Незначні частки Незначні частки Незначні частки Незначні частки після змішування Прозора Прозора Незначні частки Певна кількість часток Непрозора Прозора Злегка каламутна, прозора після змішування Злегка каламутний розчин Непрозорий розчин Непрозорий розчин Прозора Дуже незначна кількість часток Частки Непрозора суспензія Непрозора суспензія Прозора після змішування Непрозорий розчин Непрозорий розчин Непрозорий розчин Непрозорий розчин Злегка каламутна, прозора після змішування Непрозора після змішування Частки UA 108994 C2 Таблиця 2 Препарат IGF-1 10 мМ гістидиновий рН 5,4 50 мМ гістидиновий рН 5,4 10 мМ гістидиновий рН 6 50 мМ гістидиновий рН 6 5 10 15 20 Відношення змішування hGH:IGF-1 7:3 9:1 1:9 3:7 1:1 7:3 9:1 1:9 3:7 1:1 7:3 9:1 1:9 3:7 1:1 7:3 9:1 1:9 3:7 1:1 7:3 9:1 Візуальний вигляд сумішей через 1-2 0 тижні при 5 С Непрозора суспензія Непрозора суспензія Прозора Злегка каламутна після змішування Злегка каламутна після змішування Непрозорий розчин Непрозорий розчин Прозора Майже прозора після змішування Частки Непрозора суспензія Непрозора суспензія Прозора Прозора Злегка каламутна Злегка каламутна після змішування Непрозорий розчин Прозора Непрозорий розчин Непрозорий розчин Непрозорий розчин Непрозорий розчин Спостереження, наведені в Таблиці 2, показують, що розчини IGF-1 в різних буферах дають преципітацію при змішуванні з GH, приготовленому в цитратному буфері при рН 6. Приклад 3 Приготування композицій і тестування прозорості композицій з цитратним буфером Розчини з концентрацією приблизно 19 мг/мл кожного білку (IGF-1 і hGH) були окремо піддані діалізу в 10 мМ цитратному буфері при рН 6,0, який містив 10 мМ аргініну. Після діалізу впродовж ночі була визначена концентрація цих розчинів шляхом вимірювання поглинання в ультрафіолетовій частині спектру при 280 нм. Кінцеві концентрації розчинів IGF-1 і hGH становили 14 і 21 мг/мл, відповідно. Індивідуальні аліквоти кожного розчину були змішані з рештою допоміжних речовин, як показано в Таблиці 3, і розведені до кінцевої концентрації білку 10 мг/мл. Кожну пару індивідуально приготовлених розчинів білків (IGF-1 і hGH) змішали у відношенні 1:1, щоб одержати суміші, що містять по 5 мг/мл кожного білку. Після приготування сумішей двох білків до кожного індивідуального білкового препарату і до зведених сумішей додали один з двох сурфактантів до кінцевої концентрації. Розчини інспектувались після 72 годин перебування в холодильнику. Ті дві суміші, які залишались прозорими на цей момент (композиції, позначені А2 і А10 в Таблиці 3), зберігались далі в холодильнику і інспектувались знову для підтвердження того, що вони залишаться прозорими після 70 днів зберігання. В Таблиці 3 зібрані результати щодо тестування вигляду цитратних препаратів після 72 годин при 0 5 С. 9 UA 108994 C2 Таблиця 3 Зразок А1 А2 А3 А4 А5 А6 А7 А8 А9 А10 5 10 15 20 Допоміжні речовини 10 мМ аргініну, 0,2% полісорбату 20, 150 мМ NaCl, 1% BzOH, 10 мМ цитрату, рН 6,0 100 мМ аргініну, 0,2% полісорбату 20, 50 мМ NaCl, 1% BzOH, 10 мМ цитрату, рН 6,0 10 мМ аргініну, 0,2% полісорбату 20, 150 мМ NaCl, 0,25% фенолу, 10 мМ цитрату, рН 6,0 10 мМ аргініну, 0,3% полоксамеру 188, 150 мМ NaCl, 1% BzOH, 10 мМ цитрату, рН 6,0 100 мМ аргініну, 0,3% полоксамеру 188, 150 мМ NaCl, 1% BzOH, 10 мМ цитрату, рН 6,0 10 мМ аргініну, 0,03% полоксамеру 188, 150 мМ NaCl, 1% BzOH, 10 мМ цитрату, рН 6,0 100 мМ аргініну, 0,03% полоксамеру 188, 150 мМ NaCl, 1% BzOH, 10 мМ цитрату, рН 6,0 10 мМ аргініну, 0,3% полоксамеру 188, 150 мМ NaCl, 2,5% манітолу, 1% BzOH, 10 мМ цитрату, рН 6,0 10 мМ аргініну, 0,3% полоксамеру 188, 5% манітолу, 1% BzOH, 10 мМ цитрату, рН 6,0 100 мМ аргініну, 0,3% полоксамеру 188, 5% манітолу, 1% BzOH, 10 мМ цитрату, рН 6,0 Суміш (по 5 мг/мл IGF-1 і hGH) Прозорість розчину через 72 години IGF-1 (10 мг/мл) hGH (10 мг/мл) Так Ні Ні Так Так Так Так Ні Ні Так Ні Ні Так Ні Ні Так Ні Ні Так Ні Ні Так Ні Ні Так Ні Ні Так Так Так Обидва прозорі препарати (А2 і А10) містили 100 мМ доданого іону аргінінію і малу кількість або зовсім не містили натрію хлориду. Два препарати, позначені А1 і А9 в Таблиці 3, які були майже ідентичними по складу з препаратами А2 і А10, відповідно, але містили меншу кількість доданого іону аргінінію (10 мМ), не залишились прозорими. Приклад 4 Приготування і порівняльне тестування на прозорість композицій з гістидиновим буфером Розчин IGF-1 19 мг/мл було піддано діалізу в 10 мМ гістидиновому буфері при рН 5,6, який містив 10 мМ аргініну. Після діалізу була визначена концентрація цього розчину шляхом вимірювання поглинання в ультрафіолетовій частині спектру при 280 нм, яка склала 18 мг/мл. Розчин було доповнено відповідними кількостями аргініну, бензилового спирту, сурфактанту (полісорбат 20 або полоксамер 188), натрію хлориду і манітолу, щоб одержати композиції препаратів, позначених В1-В8 в Таблиці 4. Аліквоти препаратів, які містили тільки IGF-1, були використані для розчинення ліофілізованого гормону росту, щоб приготувати відповідні препарати, що містять по 5 мг/мл кожного білку. Вигляд розчинів спостерігали через 24 години 0 при 5 С. Всі препарати демонстрували певну преципітацію в цей момент, крім трьох, позначених В3, В4 і В8 в Таблиці 4. Ці препарати зберігались в холодильнику ще 65 днів і залишались прозорими в кінці цього періоду часу. В Таблиці 4 зібрані препарати з гістидиновим 0 буфером при рН 5,6 через 24 години при 5 С. 10 UA 108994 C2 Таблиця 4 Зразок 10 мМ аргініну, 0,2% полісорбату 20, 150 мМ NaCl, 1% BzOH, 10 мМ гістидину, рН 5,6 10 мМ аргініну, 0,02% полісорбату 20, 150 мМ NaCl, 1% BzOH, 10 мМ гістидину, рН 5,6 100 мМ аргініну, 0,02% полісорбату 20,50 мМ NaCl, 1% BzOH, 10 мМ гістидину, рН 5,6 100 мМ аргініну, 0,3% полоксамеру 188, 50 мМ NaCl, 1% BzOH, 10 мМ гістидину, рН 5,6 10 мМ аргініну, 0,3% полоксамеру 188, 150 мМ NaCl, 1% BzOH, 10 мМ гістидину, рН 5,6 10 мМ аргініну, 0,03% полоксамеру 188, 150 мМ NaCl, 1% BzOH, 10 мМ гістидину, рН 5,6 0,3% полоксамеру 188, 5% манітолу, 1% BzOH, 10 мМ гістидину, рН 5,6 100 мМ аргініну, 0,3% полоксамеру 188, 5% манітолу, 1% BzOH, 10 мМ гістидину, рН 5,6 В1 В2 В3 В4 В5 В6 В7 В8 5 10 15 20 Суміш (по 5 мг/мл IGF-1 і hGH) Прозорість розчину через 72 години IGF-1 (10 мг/мл) Допоміжні речовини Так Ні Так Ні Так Так Так Так Так Ні Так Ні Так Ні Так Так Всі три препарати, які залишились прозорими, містили 100 мМ іону аргінінію. Препарат, позначений В7, який точно відповідав складу препарату В8, але без доданого аргініну, демонстрував преципітацію при спостереженні після 24 годин знаходження в холодильнику, тоді як препарат В8 залишався прозорим. Подібно до цього, препарат, позначений В4 в Таблиці 4, залишався прозорим після тривалого зберігання в холодильнику, тоді як препарат В2, який містив тільки 10 мМ аргініну і додатковий натрію хлорид, втратив прозорість. Приклад 5 Приготування композиції на гістидиновому буфері при рН 6 Розчини з концентрацією приблизно 19 мг/мл кожного білку (IGF-1 і hGH) були окремо піддані діалізу в 10 мМ гістидиновому буфері при рН 6,0, який містив 10 мМ аргініну. Після діалізу впродовж ночі була визначена концентрація цих розчинів шляхом вимірювання поглинання в ультрафіолетовій частині спектру при 280 нм. Кінцеві концентрації розчинів IGF-1 і hGH становили 11 і 21 мг/мл, відповідно. Ці розчини були індивідуально змішані з відповідними кількостями додаткового аргініну, бензилового спирту, сурфактанту (полісорбат 20 або полоксамер 188), натрію хлориду і манітолу, щоб одержати два препарати, позначені С1 і С2 в Таблиці 5. Індивідуальні білкові препарати змішали у відношенні 1:1, щоб одержати суміші, і зовнішній вигляд всіх шести розчинів спостерігали після 72 годин перебування в холодильнику 0 при 5 С. Обидва комплекти препаратів гормону росту і зведених демонстрували певну преципітацію, можливо через високу концентрацію солі (150 мМ) в цих препаратах. В Таблиці 5 зібрані результати щодо тестування вигляду препаратів на гістидиновому буфері при рН 6 після 0 72 годин при 5 С. Таблиця 5 Зразок С1 С2 Допоміжні речовини Суміш (по 5 мг/мл IGF-1 і hGH) Прозорість розчину через 72 години IGF-1 (10 мг/мл) hGH (10 мг/мл) 100 мМ аргініну, 0,3% полоксамеру 188, 150 мМ NaCl, Так 1% BzOH, 10 мМ гістидину, рН 6,0 0,3% полоксамеру 188, 150 мМ NaCl, 1% BzOH, 10 мМ гістидину, Так рН 6,0 Ні Ні Ні Ні 25 Приклад 6 Приготування і порівняння композицій, забуферених цитратом і гістидином 11 UA 108994 C2 5 10 Були приготовлені два препарати з обома білками (IGF-1 і GH) з кінцевою концентрацією білків 20 мг/мл (IGF-1) і 6 мг/мл (GH), відповідно: Препарат 1: 10 мМ цитрату, 0,2% полісорбату 20, 1% бензилового спирту, 100 мМ аргініну, 50 мМ NaCl, рН 6,2 Препарат 2: 10 мМ гістидину, 100 мМ аргініну, 0,3% полоксамеру 188, 1% бензилового спирту, 50 мМ NaCl, рН 5,8 Препарати були приготовлені шляхом заміни буферу кожного білку з фільтруванням тангенціальним потоком, в кожному з двох буферів (буфер 1 і буфер 2), щоб одержати чотири основні розчини з концентраціями, показаними в Таблиці 6. В Таблиці 6 показане приготування основних розчинів для одержання препаратів. Таблиця 6 Концентрація білку після заміни буферу(мг/мл) IGF-1 GH Буферна система Буфер 1: 10 мМ цитрату, 50 мМ NaCl, 100 мМ 38 мг/мл аргініну, рН 6,0 Буфер 2: 10 мМ гістидину, 50 мМ NaCl, 100 мМ 29 мг/мл аргініну, рН 5,6 15 20 25 15 мг/мл 14 мг/мл Розчини додаткового буферу і сурфактанту були додані до кожного основного розчину при обережному перемішуванні, після чого додали відповідну кількість чистого бензилового спирту до досягнення кінцевої композиції препаратів 1 і 2 з кожним білком. Концентрація білку в препаратах IGF-1 і hGH становила 20 мг/мл і 6 мг/мл, відповідно. Чотири препарати (два IGF-1 і два hGH) потім розвели та/або змішали, щоб одержати кінцеві препарати і зведені суміші, 0 наведені в Таблиці 7. Ці розчини потім зберігались при 2-8 С до подальшого розведення/розливання у флакони. Всі білкові розчини стерилізувались фільтрацією з використанням мембран з поліефірсульфону, після чого ними заповнювали 3-мл скляні флакони. Флакони закривали, закатували і зберігали до 8 тижнів у холодильнику. Зовнішній вигляд кожного розчину оцінювали через 2-тижневі інтервали впродовж 8 тижнів. В кінці 8тижневого періоду всі 14 розчинів все ще були прозорими і безбарвними. В Таблиці 7 зібрані результати оцінки візуального вигляду препаратів на цитратному і гістидиновому буферах, які містили 100 мМ аргініну. Таблиця 7 Препарати на цитратному буфері: 10 мМ цитрату, 0,2% полісорбату 20, 1% бензилового спирту, 100 мМ аргініну, 50 мМ NaCl, рН 6,2 Зовнішній вигляд розчинів Відразу після 0 Через 8 тижнів при 5 С змішування Прозорий, безбарвний Прозорий, безбарвний СА1 1:1,1 3 3,3 розчин розчин Прозорий, безбарвний Прозорий, безбарвний СА2 1:4 2,5 10 розчин розчин Прозорий, безбарвний Прозорий, безбарвний СА3 Тільки GH 3 розчин розчин Прозорий, безбарвний Прозорий, безбарвний СА4 Тільки IGF-1 10 розчин розчин Прозорий, безбарвний Прозорий, безбарвний СС1 1:1,1 4,5 5 розчин розчин Прозорий, безбарвний Прозорий, безбарвний СС2 Тільки GH 6 розчин розчин Прозорий, безбарвний Прозорий, безбарвний СС3 Тільки IGF-1 20 розчин розчин Препарати на гістидиновому буфері: 10 мМ гістидину, 0,3% полоксамеру 188, 1% бензилового спирту, 100 мМ аргініну, 50 мМ NaCl, рН 5,8 Зовнішній вигляд розчинів Відношення hGH IGF-1 Зразок 0 GH:IGF-1 (мг/мл) (мг/мл) Відразу після Через 8 тижнів при 5 С Зразок Відношення GH:IGF-1 hGH (мг/мл) IGF-1 (мг/мл) 12 UA 108994 C2 НВ1 1:1,1 3 3,3 НВ2 1:4 2,5 10 НВ3 Тільки GH 3 НВ4 Тільки IGF-1 10 4,5 5 HD1 HD2 10 Тільки GH 6 HD3 5 1:1,1 Тільки IGF-1 20 змішування Прозорий, безбарвний розчин Прозорий, безбарвний розчин Прозорий, безбарвний розчин Прозорий, безбарвний розчин Прозорий, безбарвний розчин Прозорий, безбарвний розчин Прозорий, безбарвний розчин Прозорий, безбарвний розчин Прозорий, безбарвний розчин Прозорий, безбарвний розчин Прозорий, безбарвний розчин Прозорий, безбарвний розчин Прозорий, безбарвний розчин Прозорий, безбарвний розчин Хімічна стабільність композицій впродовж 8-тижневого періоду контролювалась шляхом періодичного аналізу препаратів і зведених сумішей. Вони зберігались охолодженими при 5°С і при 25°С, щоб виявити основні, обмежуючі стабільність продукти розпаду IGF-1 (des-Gly, ProIGF-1) і GH (дезамідований GH), а також порівняти ці швидкості розпаду зі встановленими ® швидкостями для зареєстрованих, довгостроково стабільних контрольних препаратів Increlex ® (IGF-1, рідина для ін’єкцій) і Nutropin AQ (GH, рідина для ін’єкцій). Швидкості розпаду показані в 8 і 9. Препарати не демонструють тенденції до повільного розпаду IGF-1 при 5°С впродовж 8тижневого періоду; однак нові препарати і зведені суміші, які зберігались при 25°С, показують стабільність, порівняну з типовими прискореними швидкостями розпаду, що спостерігаються ® для Increlex . Дезамідація GH в нових препаратах і зведених сумішах демонструє порівнянні ® швидкості з контрольними препаратами Nutropin AQ , як при 5°С, так і при 25°С. Таблиця 8 Препарат hGH (мг/мл) IGF-1 (мг/мл) СА1 СА2 СА4 СС1 СС3 НВ1 НВ2 НВ4 HD1 HD3 Increlex* 15 3 2,5 4,5 3 2,5 4,5 3,3 10 10 5 20 3,3 10 10 5 20 10 Швидкість розпаду (% збільшення 0 DGP-IGF-1 за тиждень) при 25 С 1,04Е-01 10 мМ цитрату, 0,2% 1,05Е-01 полісорбату 20, 1% бензилового спирту, 9,02Е-02 100 мМ аргініну, 50 8,49Е-02 мМ NaCl, рН 6,2 8,96Е-02 8,17Е-02 10 мМ гістидину, 100 8,72Е-02 мМ аргініну, 0,3% полоксамеру 188, 1% 7,31Е-02 бензилового спирту, 7,96Е-02 50 мМ NaCl, рН 5,8 6,78Е-02 50 мМ ацетату, 0,2% полісорбату 20, 1% 1,19Е-01 бензилового спирту, 100 мМ NaCl, рН 5,4 Допоміжні речовини *Середня швидкість розпаду для 15 партій 13 UA 108994 C2 Таблиця 9 СА1 СА2 СА3 СС1 СС2 НВ1 НВ2 НВ3 HD1 HD2 Nutropin AQ 5 10 hGH (мг/мл) IGF-1 (мг/мл) Допоміжні речовини 3 2,5 3 4,5 6 3 2,5 3 4,5 6 Препарат 3,3 10 10 мМ цитрату, 0,2% полісорбату 20, 1% бензилового спирту, 100 мМ аргініну, 50 мМ NaCl, рН 6,2 10 мМ гістидину, 100 мМ аргініну, 0,3% полоксамеру 188, 1% бензилового спирту, 50 мМ NaCl, рН 5,8 10 мМ цитрату, 0,2% полісорбату 20, 0,25% фенолу, 150 мМ NaCl, рН 6,0 5 3,3 10 5 5 Швидкість деамідації (% збільшення за тиждень) при 5°С при 25°С 1,91Е-02 2,85Е-01 2,09Е-02 3,25Е-01 1,56Е-02 2,71Е-01 2,48Е-02 3,04Е-01 2,36Е-02 3,00Е-01 1,53Е-02 1,33Е-01 2,01Е-02 1,62Е-01 1,43Е-02 1,22Е-01 1,66Е-02 1,51Е-01 1,99Е-02 1,44Е-01 2,12Е-02 2,99Е-01 Приклад 7 Приготування і порівняння композицій IGF-1 на гістидиновому буфері З IGF-1 були приготовлені два препарати з кінцевою концентрацією 20 мг/мл (IGF-1): Препарат 1: 20 мМ гістидину, 0,2% полісорбату 20, 1% бензилового спирту, 150 мМ аргініну, рН 5,8 Препарат 2: 50 мМ гістидину, 0,2% полісорбату 20, 1% бензилового спирту, 150 мМ аргініну, рН 5,8 Ці препарати були приготовлені шляхом заміни буферу білку в кожному з двох буферів з наступним додаванням сурфактанту і консерванту і оцінювались на стабільність разом з ® 0 0 0 контрольними препаратами Increlex . Результати тестування стабільності при 5 С, 25 С і 40 С представлені в Таблиці 10. Таблиця 10 -1 Пік/Група % активний 1 % головний пік % активний 1 % головний пік Зразок Препарат з 50 мМ гістидину Контрольний Increlex Препарат з 50 мМ гістидину Контрольний Increlex Препарат з 20 мМ гістидину Контрольний Increlex Препарат з 20 мМ гістидину Контрольний Increlex 15 Приклад 8 Дані щодо стабільності комбінованих препаратів 14 Швидкість розпаду (День ) 5°С 25°С 40°С 1,43Е-02 4,00Е-02 1,30Е-01 1,86Е-02 3,71Е-02 1,43Е-01 -2,14Е-02 -5,90Е-02 -2,43Е-01 -2,90Е-03 -3,29Е-02 -2,10Е-01 1,72Е-04 1,87Е-02 1,46Е-01 2,67Е-03 1,66Е-02 1,39Е-01 -1,36Е-02 -5,87Е-02 -3,03Е-01 4,39Е-03 -1,75Е-02 -2,12Е-01 UA 108994 C2 Таблиця 11 Increlex (% Дата Дійсних мономеру) Темп. Місяці есту/термін ісяців 1 придат. IGF-1 GH 0 22.10.09 0,000 99,5 -3 27.01.10 3,189 99,3 -5°С 6 03.05.10 6,345 99,9 -1 18.11.09 0,888 99,6 -15°С 3 18.01.10 2,893 99,4 -6 16.04.10 5,786 99,9 -1 18.11.09 0,888 99,5 -25°С 3 18.01.10 2,893 98,9 -6 16.04.10 5,786 99,2 -1 18.11.09 0,888 97,7 -40°С 3 18.01.10 2,893 92,3 - 5 10 Комб. Тільки Тільки rhGH Nutropin (% Форма 1:2,2 rhIGF-1 (% (% мономеру) (% мономеру) мономеру) мономеру) IGF-1 GH IGF-1 GH IGF-1 GH IGF-1 GH 99,7 --99,9 -- 100,0 99,5 100,0 99,5 --99,6 -99,9 99,5 100,0 99,9 --99,5 -- 100,0 100,0 100,0 NT NT -99,5 NT NT 99,4 100,0 NT NT -99,4 -99,8 99,4 99,9 NT NT -99,1 -99,9 100,0 100,0 99,5 --99,7 NT NT 99,2 100,0 98,8 --98,5 -98,8 99,0 99,4 98,4 --99,7 NT NT 97,9 98,0 95,0 --98,0 -98,0 93,3 83,2 --91,9 -94,3 92,9 Комб. Форма 1:6,6 (% мономеру) IGF-1 GH 99,6 100,0 99,6 100,0 100,0 100,0 99,5 100,0 99,4 100,0 100,0 100,0 99,3 100,0 99,2 100,0 98,6 98,9 97,6 94,5 93,9 88,3 NT: Зразок не тестувався 1 0 Оскільки зразки зберігались при 5 С до тестування, то дата тестування використовується 0 для одержання даних для 5 С, а термін придатності використовується для одержання даних в умовах прискореного старіння для більшої точності. Ці дані були одержані з використанням розмірно-ексклюзіонної хроматографії і стосуються стабільності через 1, 3 і 6 місяців. Приклад 9 Встановлення альтернативи процесу приготування rhIGF-1 і rhGH в одному препараті 1. Матеріали і метод 1.1 Вихідні матеріали В цьому дослідженні були використані наступні вихідні матеріали, як показано в Таблиці 12: Таблиця 12 Вихідні матеріали Матеріал rhGH rhIGF-1 Лимонна кислота Аргінін-HCl Фенол Полоксамер 188 Сахароза Гідроокис натрію Вода для ін'єкцій 5-мл флакони VB типу lyo 13-мм пробки 13-мм алюмінієві бортики Постачальник Genentech Lonza Sigma Merck Merck BASF Beghin Say Merck Cooper Schott West-CTSU West 15 20 25 1.2 Устаткування В цьому дослідженні було використане наступне устаткування: - Автоклав FEDEGARI, - Пляшки стерильні поліетиленові (ПЕ) Nalgene ref. 2019, - Касети BIOMAX PES ref.: PXB005A50 для діафільтрування, - Чисте приміщення, витяжна шафа з ламінарним потоком, - Устаткування для фільтрування тангенціальним потоком Cogent μScale MILLIPORE, - Фільтри MILLEX (33 мм) ПЕС 0,22 мкм (MILLIPORE), - Фільтри MILLEX (33 мм) ПВДФ 0,22 мкм (MILLIPORE), - Хімічні склянки, - Градуйовані циліндри, 15 UA 108994 C2 5 10 - Магнітні мішалки, - Мікропіпетки Р1000, - Піч FEDEGARI, - Апаратура спостереження за флаконами згідно вимог Фармакопеї, - Насос FLEXICON PF6 n 212118, - Шприц РЕ 50 мл, - Пробірки Eppendorf 1,5 мл, - Пробірки Falcon 50 мл і 15 мл, - Трубки Tygon (1,6 мм + закріплена голка), - Миюча машина CORIMA. 2. Оптимізація процесу і рецептури композиції Було проведене попереднє дослідження з метою оптимізації процесу і рецептури композиції. Рецептура композицій була такою, як описано в Таблиці 13 далі: Таблиця 13: Склад препаратів-прототипів А3-с ВІДНОШЕННЯ НАЗВА Стратегія процесу rhIGF-1 (мг/мл) rhGH (мг/мл) рН Наповнювач (мМ) Аргінін HCl (мМ) Гістидин (мМ) Цитрат (мМ) Сукцинат (мМ) Полоксамер 188 (мг/мл) Полісорбат 20 (мг/мл) Бензиловий спирт (мг/мл) Фенол (мг/мл) Антиоксидант (мМ) 2,2:1 2,2:1 А3 А А3-с А 7,9 3,6 6,0 Сахароза 200 150 20 2 3,7 7,9 3,6 6,0 Сахароза 140 150 20 2 3,7 15 20 25 30 35 40 2.1. Процес фільтрування rhIGF-1 тангенціальним потоком (TFF) Процес фільтрування rhIGF-1 тангенціальним потоком здійснювався з використанням наступних параметрів: - Кількість IGF-1, яка має бути задіяна: 80 мл rhIGF-1 при 25 мг/мл, - Концентрація діафільтрування 25 мг/мл, - Обмінний буфер: 20 мМ цитрату, 150 мМ аргініну, рН 6,0. - Касета Pellicon XL: регенерована целюлозна мембрана, 5 кДа відсічка, - ТМН 18-22 атмосфери, - Насос, встановлений на 12 % потужності, - 6 діаоб'ємів, - Кінцева концентрація rhIGF-1 30 мг/мл. 2.2 Приготування білків: 1. В цьому альтернативному процесі всі допоміжні речовини спочатку змішувались разом, а потім до цих допоміжних речовин додавали білок. 2. Розчин допоміжних речовин готувався при рН, нижчому за 6,0, так що додавання GH DS (при рН біля 7,5-8) давало розчин з рН до 7. 2.2.1. Приготування IGF-1 1. Зважили 8,44 % від кінцевого об'єму цитрату 80 мМ / аргініну 600, рН 5,5, в хімічній склянці. 2. Додали 10 % від кінцевого об'єму фенолу 3,7 %. 3. Додали 10 % від кінцевого об'єму полоксамеру 188 2 %. 4. Змішали до гомогенізації. 5. Додали 3,84 г сахарози. 6. Змішали до солюбілізації і гомогенізації. 7. Визначили величину рН: 5,86. 16 UA 108994 C2 5 10 15 20 25 30 35 40 45 50 55 60 8. При обережному перемішуванні розчину додали об'єм, який відповідає 1,6 г діафільтрованого rhIGF-1. Об'єм обчислили наступним чином: 9. 52,7 (мл) (об'єм діафільтрованого IGF-1) = 1600 (мг) (необхідна кількість rhIGF-1) / (30,36 (мг/мл) (концентрація IGF-1). 10. Змішали до гомогенізації. 11. Визначили величину рН: 6,05, що дозволило обійтися без корекції рН. 12. Довели водою для ін'єкцій до кінцевого об'єму 80 мл. 13. Визначили величину рН: 6,05. 14. Профільтрували через 0,22-мкм фільтри ПЕС. 15. Профільтрували через 0,22-мкм фільтри ПВДФ. 2.2.2. Приготування GH 1. Додали 25 % від кінцевого об'єму цитрату 80 мМ /аргініну 600 рН 5,5 в скляну хімічну склянку. 2. Додали 10 % від кінцевого об'єму фенолу 3,7 %. 3. Додали 10 % від кінцевого об'єму полоксамеру 188 2 %. 4. Додали 10 % від кінцевого об'єму води для ін'єкцій. 5. Змішали до гомогенізації. а. Прозорий розчин з невеликою кількістю часток (можливого походження з оточуючого середовища), б. Визначена величина рН: 5,9. 6. Додали 4,83 г сахарози. 7. Змішали до солюбілізації і гомогенізації. а. рН: 5,87; 8. Додали 30 мл GH DS при обережному перемішуванні розчину. 9. Змішали до гомогенізації. а. Визначена величина рН: 6,6. б. Кінцева величина рН: 6,0. 10. Фільтрування через 0,22-мкм фільтри ПЕС. 11. Фільтрування через 0,22-мкм фільтри ПВДФ. 2.2.3. Приготування зведеного препарату (або ко-мікс) Щоб одержати 45 мл кінцевого зведеного препарату rhIGF-1/rhGH (2,2:1): 1. Додали 17,9 мл препарату IGF-1 до 27,1 мл rhGH при перемішуванні магнітною мішалкою. 2. Змішали до гомогенізації. 3. Розчин виглядів прозорим без видимих часток. 4. Фільтрування через 0,22-мкм фільтри ПЕС в чистому приміщенні будівлі 2: одержали прозорий розчин без видимих часток / легкий для забору шприцом. 3. Застосування альтернативного процесу до вибраного препарату з використанням гістидину в якості буферу 3.1. Обґрунтованість приготування Приготування здійснювалось так, як описано в параграфі 2.2.1 для препарату rhIGF-1, в параграфі 2.2.2 для препарату rhGH і в параграфі 2.2.3 для зведеного препарату 2,2:1, крім використання: - гістидину замість цитрату в якості буферу; - рН 6,0 замість 5,8; - полісорбату 20 замість полоксамеру 188 в якості сурфактанту; - чистого бензилового спирту замість 10 % розчину фенолу в якості консерванту; - 2,5 % розчину HCl замість 2,5 % розчину лимонної кислоти для коригування рН; - фільтрів ПВДФ для фільтрування окремих білкових продуктів і зведеного препарату; - були приготовлені зведені препарати зі співвідношеннями 1,1:1 і 6,6:1 замість зведеного препарату 2,2:1. 3.1. Оптимізація відтворюваності фільтрування 0 Цей процес здійснювався так, як вже описувалось в параграфі 3.1 (в лабораторії при 21 С), за виключенням того, що процес фільтрування виконувався в наступній послідовності: - 150 мл препарату rhGH піддали першому фільтруванню через 0,22-мкм фільтри ПЕС для досягнення прозорості + другому фільтруванню через 0,22-мкм фільтри ПВДФ для стерилізації. - 150 мл препарату rhGH піддали першому фільтруванню через 0,22-мкм фільтри ПВДФ для досягнення прозорості + другому фільтруванню через 0,22-мкм фільтри ПВДФ для стерилізації. Були зроблені наступні спостереження: - Розчин rhGH перед фільтруваннями для досягнення прозорості виглядів слабо опалесцентним і вільним від преципітатів. 17 UA 108994 C2 5 - Після обох серій фільтрування препарати rhGH вигляділи вільними від часток. - Візуальний контроль підтвердив позитивний ефект застосування фільтрів ПВДФ для остаточної стерилізації фільтруванням окремих препаратів і зведених препаратів, тобто досягнення значного зменшення кількості видимих часточок і хорошої стабільності при використанні фільтрів цього типу. Таблиця 14: Композиції препаратів і зведених препаратів рН Буфер Сурфактант Консервант Стабілізатор 10 15 20 25 30 35 40 Композиції Зведений Зведений Індивідуальний Індивідуальний препарат IGF- препарат IGFпрепарат GH препарат IGF-1 1/GH 1,1:1 1/GH 6,6:1 5,8 Гістидин 20 мМ Бікарбонат Na 7,5 мМ 5,6 мМ 2,5 мМ Полісорбат 20 0,2 % Бензиловий спирт 1% Аргінін 150 мМ 5:4,5 13,2:2 6 мг/мл 20 мг/мл (мг:мг)/мл (мг:мг)/мл Приклад 10 Процеси приготування зведеного препарату rhIGF-1/rhGH Нерозфасований rhGH (лікарська речовина або DS) – це розчин 20 мг/мл в бікарбонатному буфері з концентрацією 7,5 мМ. Нерозфасований rhIGF-1 (DS) – це розчин 25-35 мг/мл в 200 мМ цитратному буфері. Три різних типи процесів були здійснені наступним чином (воно позначені як процес І і альтернативні процеси А і В): Етапи процесу І: - діафільтрування rhGH і rhIGF-1для заміни буферу (початковий буфер DS проти Гістидину (His) 20 мМ / Аргініну (Arg) 150 мМ рН 5,8), - для кожного індивідуального білку змішування здійснювалось в наступному порядку введення: - додавання обмінного буферу для регулювання концентрації DS, - додавання розчину полісорбату PS 20, - додавання розчину бензилового спирту (ВА), - спільне змішування індивідуальних препаратів з одержанням стабільного зведеного препарату. Етапи процесу А: - діафільтрування rhGH і rhIGF-1для заміни буферу (початковий буфер DS проти Гістидину (His) 20 мМ / Аргініну (Arg) 150 мМ рН 5,8), - кінцеве змішування для кожного білку здійснювалось в наступному порядку введення: - концентрований буфер, - розчин сурфактанту, - розчин консерванту, - вода для ін'єкцій, - наповнювач (якщо передбачений), - діафільтрована лікарська речовина, - коригування рН лимонною кислотою (або HCl), - вода для ін'єкцій до кінцевого об'єму. - спільне змішування індивідуальних препаратів з одержанням стабільного зведеного препарату. Етапи процесу В: - діафільтрування rhIGF-1для заміни буферу (початковий буфер DS проти Гістидину (His) 20 мМ / Аргініну (Arg) 150 мМ рН 5,8), - відсутність діафільтрування нерозфасованого rhGH, а пряме введення не розфасованого rhGH (тобто додавання rhGH DS до суміші допоміжних речовин без заміни буферу), 18 UA 108994 C2 - кінцеве змішування здійснювалось в тому ж порядку введення компонентів, що й в процесі А, - спільне змішування індивідуальних препаратів з одержанням стабільного зведеного препарату. 5 ФОРМУЛА ВИНАХОДУ 10 15 20 25 30 35 40 45 50 55 60 1. Фармацевтична композиція, яка містить IGF-1 і GH, а також агент, який перешкоджає агрегації; буфер; сурфактант; консервант і, необов'язково, модифікатор тонічності, де агентом, який перешкоджає агрегації, є аргінін в концентрації щонайменше від приблизно 80 мМ до приблизно 200 мМ, і де модифікатором тонічності є натрію хлорид в концентрації від 1 до 50 мМ. 2. Фармацевтична композиція за пунктом 1, в якій агентом, який перешкоджає агрегації, є аргінін в концентрації в межах від приблизно 100 мМ до приблизно 150 мМ. 3. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій буфер вибирається з гістидину, сукцинату або цитрату в концентрації в межах від приблизно 1 до 50 мМ, переважно від приблизно 10 до 20 мМ. 4. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій сурфактантом є неіонний сурфактант. 5. Фармацевтична композиція за пунктом 4, в якій неіонним сурфактантом є полісорбат 20 в концентрації в межах від приблизно 0,1 до 0,3 мас. %, переважно приблизно 0,2 мас. %. 6. Фармацевтична композиція за пунктом 4, в якій неіонним сурфактантом є полоксамер 188 в концентрації в межах від приблизно 0,1 до 0,5 мас. %, переважно приблизно 0,3 мас. %. 7. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій модифікатором тонічності є натрію хлорид. 8. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій наповнювачем є манітол та/або сахароза. 9. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій консервантом є бензиловий спирт або фенол. 10. Фармацевтична композиція за пунктом 1, в якій консервантом є бензиловий спирт в концентрації в межах від приблизно 0,2 до приблизно 2 мас. %, переважно приблизно 1 мас. %. 11. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій масове співвідношення IGF-1;GH (м/м) коливається в межах від приблизно 1:1 до 1:9 (м/м). 12. Фармацевтична композиція за будь-яким з пунктів 1-10, в якій масове співвідношення IGF1:GH (м/м) коливається в межах від приблизно 1:1 до 7:1 (м/м), і переважно становить 1,1:1 (м/м), 2,2:1 (м/м), 3,3:1 (м/м) або 6,6:1 (м/м). 13. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій рН фармацевтичної композиції коливається в межах від приблизно 5,0 до приблизно 6,5, краще від приблизно 5,4 до приблизно 6,2, а ще краще від приблизно 5,8 до приблизно 6,2. 14. Фармацевтична композиція за будь-яким з пунктів 1-12, яка являє собою готовий до використання препарат в попередньо наповненому шприці або в картриджі пристрою для ін'єкцій. 15. Процес приготування фармацевтичної композиції за пунктом 1, який включає: а) приготування розчину hGH в буфері при рН між 5 і 6,5, що містить агент, який перешкоджає агрегації, і модифікатор тонічності або наповнювач; б) приготування розчину IGF-1 шляхом діалізу препарату IGF-1 в буфері, що використовувався на етапі (а), який містить вказаний агент, що перешкоджає агрегації, і вказаний модифікатор тонічності; в) додавання сурфактанту і необов'язково консерванту до обох основних розчинів; і г) змішування разом розчинів hGH і IGF-1. 16. Процес за пунктом 15, в якому агентом, що перешкоджає агрегації, є аргінін. 17. Процес приготування фармацевтичної композиції за пунктом 1, який включає: а) приготування розчину І змішуванням буфера, переважно гістидинового буфера, агента, що перешкоджає агрегації, переважно аргініну, сурфактанту, переважно полісорбату 20, необов'язково консерванту, переважно бензилового спирту, і необов'язково регулювання об'єму водою, при цьому розчин І має рН приблизно 5,8 або регулюється до рН приблизно 5,8; 19 UA 108994 C2 5 10 15 20 25 б) приготування розчину IGF-1 в буфері і агенті, що перешкоджає агрегації, які використовувались на етапі (а), з одержанням розчину II; в) додавання розчину II до розчину І з одержанням розчину ІІІ; г) приготування розчину IV змішуванням буфера, переважно гістидину, агента, що перешкоджає агрегації, переважно аргініну, сурфактанту, переважно полісорбату 20, необов'язково консерванту, переважно бензилового спирту, і необов'язково регулювання об'єму водою, при цьому розчин IV має рН приблизно 5,8 або регулюється до рН приблизно 5,8; д) приготування розчину GH в буфері і агенті, що перешкоджає агрегації, які використовувались на етапі (г), при цьому GH необов'язково може містити натрій-бікарбонатний буфер, з одержанням розчину V; є) додавання розчину V до розчину IV з одержанням розчину VI; е) необов'язково, незалежне фільтрування розчинів III і VI; ж) змішування профільтрованих розчинів ІІI і VI при співвідношенні IGF-1:GH (м/м) в межах від приблизно 1:1 до 7:1 (м/м), переважно 1,1:1 (м/м), 3,3:1 (м/м) або 6,6:1 (м/м), з одержанням розчину VII; і з) необов'язково, фільтрування розчину VII. 18. Процес за пунктом 17, в якому рідка лікарська речовина GH безпосередньо змішується з розчином IV без виконання етапу (д). 19. Процес за пунктом 17, в якому лікарська речовина GH містить натрій-бікарбонатний буфер. 20. Процес за пунктом 17, в якому етапи фільтрування здійснюються на фільтрах PVDF (полівінілідену фторид). 21. Процес за пунктом 16, в якому агентом, який перешкоджає агрегації, є аргінін в концентрації в межах від приблизно 80 мМ до приблизно 200 мМ, переважно в межах від приблизно 100 мМ до приблизно 150 мМ. 22. Процес за пунктом 17, в якому агентом, який перешкоджає агрегації, є аргінін в концентрації в межах від приблизно 80 мМ до приблизно 200 мМ, переважно в межах від приблизно 100 мМ до приблизно 150 мМ. 20 UA 108994 C2 Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 21
ДивитисяДодаткова інформація
Назва патенту англійськоюRormulation for hgh and rhigf-1 combination
Автори англійськоюGopinath, Enona, Park, Susan, Arakawa, Tsutomu, Richard, Joel, Fais, Fabio
Автори російськоюГопинат Энона, Парк Сьюзен, Аракава Тсутому, Ришар Жоель, Фаис Фабио
МПК / Мітки
МПК: A61K 38/27, A61K 9/19, A61K 38/30, A61K 47/18
Мітки: композиція, приготування, процес, rhigf-1, фармацевтична, містить, варіанти, комбінацію
Код посилання
<a href="https://ua.patents.su/23-108994-farmacevtichna-kompoziciya-shho-mistit-kombinaciyu-hgh-i-rhigf-1-i-proces-prigotuvannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить комбінацію hgh і rhigf-1, і процес її приготування (варіанти)</a>
Попередній патент: Лікарська комбінація з теоброміном і її застосування у лікуванні кашлю
Наступний патент: Термічна і хімічна утилізація матеріалів, що містять вуглець, зокрема, для генерації енергії без шкідливих викидів
Випадковий патент: Спосіб визначення генотоксичності компонентів агроландшафту