Діарилкарбоксаміди
Формула / Реферат
1. Сполука формули І:
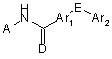 ,I
,I
де:
А є
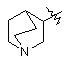 , II
, II 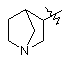 , III
, III
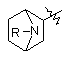 , IV
, IV 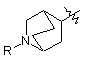 , V
, V
D - атоми оксигену або сульфуру,
Е - простий зв'язок, атоми оксигену чи сульфуру, або NR10, R є атом гідрогену або метил,
Ar1 - 5- або 6-членне ароматичне або гетероароматичне кільце, що містить 0, 1, 2 чи 3 атоми нітрогену, оксигену або сульфуру, але не більше одного атома оксигену чи сульфуру.
Ar2 - 5- або 6-членне ароматичне або гетероароматичне кільце, що містить 0, 1, 2 чи 3 атоми нітрогену, оксигену або сульфуру, але не більше двох атомів оксигену чи сульфуру, або 8-, 9- або 10-членну конденсовану ароматичну або гетероароматичну кільцеву систему, що містить 0, 1, 2 чи 3 атоми нітрогену, оксигену або сульфуру, але не більше двох атомів оксигену чи сульфуру,
причому, коли Ar2 - незаміщений феніл, Ar1 не є піразолілом,
ароматичні кільця Ar1 та Ar2 заміщені 0, 1, 2 або 3 замісниками, вибраними з групи, до складу якої входять: атом галогену, C1-4алкіл, C2-4алкеніл, C2-4алкініл, CN, NO2, NR1R2, CH2NR1R2, OR3, CH2OR3, CO2R4 та CF3, але, якщо Ar1 - феніл, а Ar2 - хінолініл, тоді Ar2 заміщений 0, 1, 2 або 3 замісниками, вибраними з групи, до складу якої входять: C1-4алкіл, C2-4алкеніл, C2-4алкініл, CN, NO2, NR1R2, CH2NR1R2, OR3, CH2ORЗ тa CO2R4,
R1, R2 та R3 незалежно - C1-4алкіл, арил, гетероарил, C(O)R5, C(O)NHR6, C(O)R7, SO2R8, або R1 та R2 можуть разом бути (СН2)jG(CH2)k, де G - атом оксигену чи сульфуру, NR9 або простий зв'язок,
j дорівнює 2, 3 чи 4,
k дорівнює 0, 1 чи 2,
R4, R5, R6, R7, R8, R9 та R10 незалежно - C1-4алкіл, арил або гетероарил:
або її енантіомер та фармацевтично прийнятні солі,
за умови, що:
(1) якщо D - атом оксигену, Е - простий зв'язок, А є
 , II
, II
а Ar1 або Ar2 - піразольне кільце, тоді усі замісники на піразольному кільці, як варіант, повинні бути атомом гідрогену, і
(2) якщо Ar1 - піридинове кільце, Ar2 - арил, а А є
 , II
, II
тоді усі замісники на піридиновому кільці, як варіант, повинні бути атомом гідрогену, а формула І не повинна представляти:
 .
.
2. Сполука за п. 1, яка відрізняється тим, що D - атом оксигену.
3. Сполука за п. 2, яка відрізняється тим, що Е - простий зв'язок.
4. Сполука за п. 2, яка відрізняється тим, що Е - атом оксигену або NR10.
5. Сполука за п. 1, яка відрізняється тим, що А є
 II.
II.
6. Сполука за п. 1, яка відрізняється тим, що Ar1 - 5- або 6-членне ароматичне або гетероароматичне кільце, що містить нуль або один атом нітрогену, нуль або один атом оксигену та нуль або один атом сульфуру, або її енантіомер та фармацевтично прийнятні солі.
7. Сполука за п. 5, яка відрізняється тим, що Ar1 - 5- або 6-членне ароматичне або гетероароматичне кільце, що містить нуль або один атом нітрогену, нуль або один атом оксигену та нуль або один атом сульфуру, або її енантіомер та фармацевтично прийнятні солі.
8. Сполука за п. 1, яка відрізняється тим, що Ar1 - феніл, фурил, тіофеніл або тіазоліл.
9. Сполука за п. 5, яка відрізняється тим, що Ar1 - феніл, фурил, тіофеніл або тіазоліл.
10. Сполука за п. 1, яка відрізняється тим, що Ar2- 5- або 6-членне ароматичне або гетероароматичне кільце, що містить від нуля до трьох атомів нітрогену, нуль або один атом оксигену та нуль або один атом сульфуру, або її енантіомер та фармацевтично прийнятні солі.
11. Сполука за п. 5, яка відрізняється тим, що Ar2 - 5- або 6-членне ароматичне або гетероароматичне кільце, що містить від нуля до трьох атомів нітрогену, нуль або один атом оксигену та нуль або один атом сульфуру, або її енантіомер та фармацевтично прийнятні солі.
12. Сполука за п. 9, яка відрізняється тим, що Аr2 - 5- або 6-членне ароматичне або гетероароматичне кільце, що містить від нуля до трьох атомів нітрогену, нуль або один атом оксигену та нуль або один атом сульфуру, або її енантіомери та фармацевтично прийнятні солі.
13. Сполука за п. 11, яка відрізняється тим, що Ar2 - феніл, фурил, тіофеніл чи піридиніл.
14. Сполука за п. 12, яка відрізняється тим, що Ar2 - феніл, фурил, тіофеніл або піридиніл.
15. Сполука за п. 1, яка відрізняється тим, що Ar1 - заміщений карбоксамідною або тіокарбоксамідною групою C(=D)NHA, але не подальшими замісниками.
16. Сполука за п. 14, яка відрізняється тим, що Ar1 - заміщений карбоксамідною або тіокарбоксамідною групою C(=D)NHA, але не подальшими замісниками.
17. Сполука за п. 15, яка відрізняється тим, що в ній замісники, -ЕAr2 та карбоксамідна або тіокарбоксамідна група C(=D)NHA, на Ar1 розташовані у положенні 1,3 один відносно одного.
18. Сполука за п. 16, яка відрізняється тим, що в ній замісники, -ЕAr2 та карбоксамідна або тіокарбоксамідна група C(=D)NHA, на Аr1 розташовані у положенні 1,3 відносно один одного.
19. Сполука за п. 1, яка відрізняється тим, що Ar1 або Ar2 заміщені жодним або одним замісником, вибраним з групи, до складу якої входять: атом галогену, C1-4алкіл, C2-4алкеніл, C2-4алкініл, CN, NO2, NR1R2, CH2NR1R2, OR3, CH2OR3, CO2R4 тa CF3.
20. Сполука за п. 14, яка відрізняється тим, що Ar1 або Ar2 заміщені жодним або одним замісником, вибраним з групи, до складу якої входять: атом галогену, C1-4алкіл, C2-4алкеніл, C2-4алкініл, CN, NO2, NR1R2, CH2NR1R2, OR3, CH2OR3, CO2R4 тa CF3.
21. Сполука за п. 1, яка відрізняється тим, що:
А є
 , II
, II
D - атом оксигену,
Е - простий зв'язок,
Ar1 - 5- або 6-членне ароматичне або гетероароматичне кільце, що містить нуль або один атом нітрогену, нуль або один атом оксигену та нуль або один атом сульфуру,
Ar2 - 5- або 6-членне ароматичне або гетероароматичне кільце, що містить від нуля до трьох атомів нітрогену, нуль або один атом оксигену та нуль або один атом сульфуру,
ароматичне кільце Ar1, заміщене Ar2 та карбоксамідною групою С(=O)NНА, але не подальшими замісниками, а
Ar2 заміщений жодним або одним замісником, вибраними з групи, до складу якої входять: атом галогену, C1-4алкіл, C2-4алкеніл, C2-4алкініл, CN, NO2, NR1R2, CH2NR1R2, OR3,
CH2OR3, CO2R4 та CF3.
22. Сполука за п. 21, яка відрізняється тим, що Ar1 - бензольне кільце, фуранове кільце або тіофенове кільце, або її енантіомер та фармацевтично прийнятні солі.
23. Сполука за п. 1, яка відрізняється тим, що:
А є
 , II
, II
D - атом оксигену,
Е - атом оксигену або NH,
Ar1 - 5- або 6-членне ароматичне або гетероароматичне кільце, що містить нуль або один атом нітрогену, нуль або один атом оксигену та нуль або один атом сульфуру,
Ar2 є 5- або 6-членне ароматичне або гетероароматичне кільце, що містить від нуля до трьох атомів нітрогену, нуль або один атом оксигену та нуль або один атом сульфуру,
ароматичне кільце Ar1 є заміщеним ЕAr2 та групою С(=O)NНА, але не подальшими замісниками,
Ar2 заміщений жодним або одним замісником, вибраними з групи, до складу якої входять: атом галогену, C1-4алкіл, C2-4алкеніл, C2-4алкініл, CN, NО2, NR1R2, CH2NR1R2, OR3, CH2OR3, CO2R4 та CF3.
24. Сполука за п. 23, яка відрізняється тим, що Ar1 - бензольне кільце, фуранове кільце, або тіофенове кільце, або її енантіомер та фармацевтично прийнятні солі.
25. Сполука за п. 24, яка відрізняється тим, що в ній ЕAr2 та карбоксамідна група С(=O)NНА на Ar1 розташовані у положенні 1,3 один відносно одного, або її енантіомер та фармацевтично прийнятні солі.
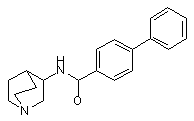
26. Сполука за п. 1, яка відрізняється тим, що її вибрано з групи:
N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілфуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-тієніл)бензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-фенілбензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-піридил)бензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-метоксифеніл)бензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-метоксифеніл)бензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-(N-ацетиламіно)феніл)бензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-флуорфеніл)бензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-метилфеніл)бензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-тієніл)бензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3,5-дихлорфеніл)бензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-нафтил)бензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-(4-флуорфеніл)бензамід),
N-(1-aзaдициклo[2,2,2]oкт-3-ил)(5-(3-пipидил)фypaн-2-кapбoкcaмiд),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-тієніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-бензо[b]фураніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-тієніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-метоксифеніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-флуорфеніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-нафтил)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метилфеніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-фурил)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-фурил)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(4-(2-піридил)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(4-(4-піридил)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(4-(3-піридил)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-нітрофеніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-трифлуорметилфеніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-хлорфеніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-етоксифеніл)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3,5-диметилізоксазол-4-іл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3,5-диметилізоксазол-4-іл)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-3-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-хлорфеніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіазол-3-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіазол-3-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N,N'-диметиламіно)феніл)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(8-хінолініл)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-3-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(4-фенілтіофен-2-карбоксамід),
N-(1-aзaдициклo[2,2,2]oкт-3-ил)(5-(3-цiaнoфeнiл)тioфeн-2-кapбoкcaмiд),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-метиламіно)феніл)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-гідроксифеніл)тіофен-2-карбоксамід),
N-(1-aзaдициклo[2,2,2]oкт-3-ил)(5-(3-пipидилaмiнo)тioфeн-2-кapбoкcaмiд),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-хлорфеніл)тіофен-2-карбоксамід),
N-(1-aзaдициклo[2,2,2]oкт-3-ил)(5-(3-(4-мopфoлiнiл)фeнiл)тioфeн-2-кapбoкcaмiд),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(амінометил)феніл)тіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенокситіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N,N-диметиламіно)феніл)фуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-формілфеніл)тіофен-2-карбоксамід) та
N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(гідроксиметил)феніл)тіофен-2-карбоксамід),
та її фармацевтично прийнятні солі.
27. Сполука за п. 1, яка відрізняється тим, що її вибрано з групи:
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілфуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-тієніл)бензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-фенілбензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-піридил)бензамід),
(R)-N-(1-азадицикло(2,2,2]окт-3-ил)(5-фенілтіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-метоксифеніл)бензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-метоксифеніл)бензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-(N-ацетиламіно)феніл)бензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-флуорфеніл)бензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-метилфеніл)бензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-тієніл)бензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3,5-дихлорфеніл)бензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-нафтил)бензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(4-флуорфеніл)бензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-тієніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-бензо[b]фураніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-тієніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-метоксифеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-флуорфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-нафтил)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метилфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-фурил)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-фурил)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло(2,2,2]окт-3-ил)(4-(2-піридил)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло(2,2,2]окт-3-ил)(4-(4-піридил)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло(2,2,2]окт-3-ил)(4-(3-піридил)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-нітрофеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-трифлуорметилфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-хлорфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-етоксифеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3,5-диметилізоксазол-4-іл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3,5-диметилізоксазол-4-іл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-3-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-хлорфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіазол-3-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіазол-3-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N,N-диметиламіно)феніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(8-хінолініл)тіофен-2-карбоксамід),
(S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід),
(S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід),
(S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)тіофен-2-карбоксамід),
(S)-N-(1-азадицикло[2,2,2]окт3-ил)(5-фенілтіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-3-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-фенілтіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-ціанофеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-метиламіно)феніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-гідроксифеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридиламіно)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-хлорфеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(4-морфолініл)феніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(амінометил)феніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенокситіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N,N-диметиламіно)феніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-формілфеніл)тіофен-2-карбоксамід) та
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(гідроксиметил)феніл)тіофен-2-карбоксамід),
та її фармацевтично прийнятні солі.
28. Сполука за п. 1, яка відрізняється тим, що її вибрано з групи:
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілфуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-тієніл)бензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-фенілбензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-(N-ацетиламіно)феніл)бензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-тієніл)бензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)фуран-2-карбоксамід),
(R)-N-(1-азадицикло(2,2,2]окт-3-ил)(5-(3-тієніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-бензо[b]фураніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-тієніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-флуорфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-нафтил)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метилфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-фурил)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-(2-піридил)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-нітрофеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-трифлуорметилфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-хлорфеніл)фуран-2-карбоксамід),
(R)-N-(1-aзaдициклo[2,2,2]oкт-3-ил)(5-(3-(N-aцeтилaмiнo)фeнiл)тioфeн-2-кapбoкcaмiд),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-етоксифеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3,5-диметилізоксазол-4-іл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-3-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-хлорфеніл)фуран-2-карбоксамід),
(R)-N-(1-aзaдициклo[2,2,2]oкт-3-ил)(5-(3-(N,N-димeтилaмiнo)фeнiл)тioфeн-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(8-хінолініл)тіофен-2-карбоксамід),
(S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід),
(S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід),
(S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)тіофен-2-карбоксамід),
(S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-3-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-фенілтіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-ціанофеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-метиламіно)феніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-гідроксифеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридиламіно)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(4-морфолініл)феніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(амінометил)феніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенокситіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N,N-диметиламіно)феніл)фуран-2-карбоксамід)
та
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(гідроксіетил)феніл)тіофен-2-карбоксамід),
та її фармацевтично прийнятні солі.
29. Сполука за п. 1, яка відрізняється тим, що її вибрано з групи:
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-флуорфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-нітрофеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-трифлуорметилфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-хлорфеніл)фуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-3-карбоксамід),
(S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід),
(S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-фенілтіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-ціанофеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-гідроксифеніл)тіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенокситіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)фуран-2-карбоксамід) або
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(гідроксіетил)феніл)тіофен-2-карбоксамід),
та її фармацевтично прийнятні солі.
30. Сполука за будь-яким одним з пп. 1-29, яка відрізняється тим, що призначена для використання у терапії.
31. Використання сполуки за будь-яким одним з пп. 1-29 у виробництві медикаменту для лікування чи профілактики психотичних розладів або розладів, що порушують інтелектуальні здібності.
32. Використання сполуки за будь-яким одним з пп. 1-29 у виробництві медикаменту для лікування чи профілактики хвороб або станів людини, в яких цілющою є активація нікотинового рецептора ![]() .
.
33. Використання сполуки за будь-яким одним з пп. 1-29 у виробництві медикаменту для лікування чи профілактики хвороби Альцгеймера, труднощів навчання, труднощів пізнання, дефіциту уваги, втрати пам'яті, слабоумства Леві-Боді, гіперактивного розладу з дефіцитом уваги, тривожності, шизофренії, манії або маніакальної депресії, хвороби Паркінсона, хвороби Хантингтона, синдрому Туретта, нейродегенеративних розладів, в яких наявна втрата холінергічних синапсів, порушення біоритмів, припинення паління, звички до нікотину, включаючи одержану від піддавання дії продуктів, що містять нікотин, болю або виразкового коліту.
34. Спосіб лікування чи профілактики психотичних розладів або розладів, що порушують інтелектуальні здібності, який полягає в уведенні терапевтично ефективної кількості сполуки за будь-яким одним з пп. 1-29.
35. Спосіб лікування чи профілактики хвороб або станів людини, в яких цілющою є активація нікотинового рецептора ![]() , який полягає в уведенні терапевтично ефективної кількості сполуки за будь-яким одним з пп. 1 до 29.
, який полягає в уведенні терапевтично ефективної кількості сполуки за будь-яким одним з пп. 1 до 29.
36. Спосіб за п. 35, який відрізняється тим, що розладом є хвороба Альцгеймера, труднощі навчання, труднощі пізнання, дефіцит уваги, втрата пам'яті, слабоумство Леві-Боді, гіперактивний розлад з дефіцитом уваги, тривожність, шизофренія, манія або маніакальна депресія, хвороба Паркінсона, хвороба Хантингтона, синдром Туретта, нейродегенеративні розлади, в яких наявна втрата холінергічних синапсів, порушення біоритмів, припинення паління, звичка до нікотину, включаючи одержану від піддавання дії продуктів, що містять нікотин, біль або виразковий коліт.
37. Спосіб отримання сполуки формули І, яку визначено у будь-якому одному з пп. 1-29, який включає:
реакцію сполуки формули VI:
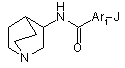 , VI
, VI
де:
J - атом галогену, або замісник OSO2CF3 у позиції кільця Ar1, на якій утворюється зв'язок з кільцем Ar2, з органометалічною сполукою формули VII:
Ar2-M VII
у присутності органометалічного каталізатора та розчинника.
38. Сполука формули VI:
 , VI
, VI
де: Ar1 - бензольне, фуранове або тіофенове кільце,
J - атом галогену або OSO2CF3, за умови, що коли Ar1 - бензольне кільце, J може бути тільки бромом, йодом або OSO2CF3 у позиції мета- або пара- відносно карбоксамідної групи,
або її енантіомер та фармацевтично прийнятні солі.
39. Сполука за п. 38, яка відрізняється тим, що її вибрано з групи:
N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромфуран-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромтіофен-2-карбоксамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-бромбензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(4-бромбензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(3-йодбензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(4-йодбензамід),
N-(1-азадицикло[2,2,2]окт-3-ил)(4-бромтіофен-2-карбоксамід) або
N-(1-aзaдициклo[2,2,2]oкт-3-ил)(5-бpoмтioфeн-2-кapбoкcaмiд),
або її енантіомер та фармацевтично прийнятні солі.
40. Сполука за п. 38, яка відрізняється тим, що її вибрано з групи:
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромфуран-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромтіофен-2-карбоксамід),
(S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромтіофен-2-карбоксамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-бромбензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-бромбензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-йодбензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-йодбензамід),
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-бромтіофен-2-карбоксамід) або
(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромтіофен-3-карбоксамід),
або її фармацевтично прийнятні солі.
Текст
Цей винахід стосується нових діарилкарбоксамідів або їх фармацевтично прийнятних солей, способів їх отримання, фармацевтичні композиції, що їх містять, та їх використання у терапії. Наступним об'єктом є отримання активних сполук, що є потужними лігандами для нікотинових ацетилхолінових рецепторів (NAChR). Використання сполук, які зв'язують нікотинові ацетилхолінові рецептори при лікуванні ряду розладів із залученням зменшеної холінергічної функції, як-то хвороба Альцгеймера, розлади пізнавальної здатності або уваги, тривожність, депресія, припинення паління, нейрозахист, шизофренія, аналгезія, синдром Туретта та хвороба Паркінсона, описано McDonald et al. (1995) "Nicotinic Acetylcholine Receptors: Molecular Biology, Chemistry and Pharmacology" (Нікотинові ацетилхолінові рецептори: Молекулярна Біологія, Хімія та Фармакологія", розділ 5 у Annual Reports in Medicinal Chemistry, т. 30, с.41-50, Academic Press Inc., San Diego, CA: та у Williams et al. (1994) "Neuronal Nicotinic Acetylcholine Receptors" (Нейроннні нікотинові ацетилхолінові рецептори), Drug News & Perspectives, т. 7, с.205-223. Згідно з винаходом, виявлено, що сполуки формули І: де: А є: D є атоми оксигенуабо сульфуру; Ε є простий зв'язок, атом оксигену чи сульфур у, або NR10; R є атом гідрогену або метил; Аr1 є 5- або 6-членне ароматичне або гетероароматичне кільце, що містить від нуля до трьох атомів нітрогену, нуль чи один атом оксигену та н уль чи один атом сульфур у: Аr2 є 5- або 6-членне ароматичне або гетероароматичне кільце, що містить від нуля до трьох атомів нітрогену, нуль чи один атом оксигену та н уль чи один атом сульфур у, або; 8-, 9- або 10-членну конденсовану ароматичну або гетероароматичну кільцеву систему, що містить від нуля до трьох атомів нітрогену, н уль чи один атом оксигену та нуль чи один атом сульфур у; причому, коли Аr2 є незаміщений феніл, Аr1 не є піразолілом; ароматичні кільця Аr1 та Аr2 , як варіант, заміщені одним-трьома замісниками, вибраними з групи, до складу якої входять: атом галогену, С1-4алкіл, С2-4алкеніл, С2-4алкініл, CN, NO2, NR1R2, CH2NR1R2, OR3, CH2OR3, CO2R4 та CF3, але якщо Аr 1 - феніл, а Аr2 - хінолініл, то Аr 2 заміщений 0, 1, 2 або 3 замісниками, вибраними з групи, до складу якої входять: С1-4алкіл, С2-4алкеніл, С2-4алкініл, CN, NO2, NR1R2, CH2NR1R2, OR3, CH2OR3 та CO 2R4; R1, R2 та R3 незалежно є С1-4алкіл, арил, гетероарил, C(O)R5, C(O)NHR6, C(O)R7, SO2R8, або R1 та R2 можуть разом представляти (CH2)jG(CH2)k, де G - атом оксигену чи сульфуру, NR9, або зв'язок; j дорівнює 2, 3 чи 4; k дорівнює 0, 1 чи 2; R4, R5, R6, R 7, R8 , R9 та R10, незалежно є С 1-4алкіл, арил, або гетероарил: або їх енантіомер та фармацевтично прийнятні солі, за умови, що; (1) якщо D є атом оксигену, Ε є простий зв'язок, А є: а Ar1 або Ar2 є кільце піразолу, тоді усі необов'язкові замісники на кільці піразолу є атом гідрогену; і (2) якщо Ar1 є піридинове кільце, Ar2 є арил, а А є: тоді усі необов'язкові замісники на кільці піридину повинні бути атомом гідрогену; а формула І не повинна представляти: є потужними лігандами нікотинових ацетилхолінових рецепторів. Якщо не показано інше, С1-4алкіли стосуються тут, наприклад, метилу, етилу, н-пропілу, н-бутилу, 1пропілу, 1-бутилу, трет-бутилу, втор-бутилу, які поодинці або як частина іншої групи, можуть мати лінійний або розгалужений ланцюг, а С3-4алкіли можуть також бути циклічними, наприклад, циклопропілом, циклобутилом. Алкіли, описані тут, можуть, як варіант, бути заміщеними одним-трьома атомами галогену. Якщо не показано інше, арил стосується фенільного кільця, яке може, як варіант, бути заміщеним однимтрьома наступними замісниками, вибраними з групи, до складу якої входять: атом галогену, С1-4алкіл, С21 2 1 2 3 3 4 4алкеніл, С 2-4алкініл, NR R , CH 2NR R , OR , CH 2OR , CO2R , CN, NO 2 та CF 3. Якщо не показано інше, гетероарил стосується 5- або 6-членного ароматичного або гетероароматичного кільця, що містить від нуля до трьох атомів нітрогену, нуль або один атом оксигену та нуль або один атом сульфур у, за умови, що кільце містить щонайменше один атом нітрогену, оксигену або сульфуру і може, як варіант, бути заміщеним одним чи більше замісниками, вибраними з групи, до складу якої входять: атом галогену, С1-4алкіл, С2-4алкеніл, С2-4алкініл, NR1R2, CH2NR1R2, OR3, CH2OR 3, CO 2R4, CN, NO2 тa CF3 . Якщо не показано інше, галоген стосується флуор у, хлор у, брому, або йоду. Фармацевтично прийнятні похідні включають сольвати та солі. Наприклад, сполуки формули І можуть утворювати кислотно-адитивні солі з кислотами, як-то звичайні фармацевтично прийнятні кислоти, наприклад, малеїновою, гідрохлоридною, гідробромідною, фосфатною, оцтовою, фумаровою, саліциловою, лимонною, молочною, мигдалевою, винною та метансульфоновою кислотами. Кращі сполуки згідно з винаходом єсполуками формули І, де А є або їх енантіомерами та фармацевтично прийнятними солями. Кращі втілення винаходу включають сполуки формули І, де D є атом оксигену; або їх енантіомери та фармацевтично прийнятні солі. Кращі втілення винаходу включають сполуки формули І, де Ε є простий зв'язок; або їх енантіомери та фармацевтично прийнятні солі. Кращі втілення винаходу включають сполуки формули І, де Ε є атом оксигену або NR10; або їх енантіомери та фармацевтично прийнятні солі. Кращі втілення винаходу включають сполуки формули І, де Ar 1 є 5- або 6-членне ароматичне або гетероароматичне кільце, що містить нуль або один атом нітрогену, нуль або один атом оксигену та нуль або один атом сульфуру, або їх енантіомери та фармацевтично прийнятні солі. Серед них сполуки, в яких Ar1 є бензольне кільце, фуранове кільце або тіофенове кільце, є особливо кращими. Кращі втілення винаходу включають сполуки формули І, де Ar 2 є 5- або 6-членне ароматичне або гетероароматичне кільце, що містить від нуля до трьох атомів нітрогену, нуль або один атом оксигену та нуль або один атом сульфур у, або їх енантіомери та фармацевтично прийнятні солі. Серед них сполуки, в яких Ar1 є бензольне кільце, фуранове кільце, тіофенове кільце, або піридинове кільце є особливо кращими. Кращі втілення винаходу включають сполуки формули І, де ароматичне кільце Ar1 є заміщеним -ЕAr2 та карбоксамідною або тіокарбоксамідною групою, C(=D)NHA, але не подальшими замісниками; або їх енантіомери та фармацевтично прийнятні солі. Кращі втілення винаходу включають сполуки, в яких замісники на Ar1, -ЕAr 2 та карбоксамідна або тіокарбоксамідна група, C(=D)NHA, розташовані у положенні 1,3 стосовно один одного, або їх енантіомери та фармацевтично прийнятні солі. Кращі втілення винаходу включають сполуки формули І, де Ar1 або Ar2 є заміщеними нуль або одним замісником, вибраним з групи, до складу якої входять: атом галогену, С1-4алкіл, С2-4алкеніл, С2-4алкініл, CN, NO2, NR1R2, CH2NR1R2, OR 3, CH2OR3 , CO 2R4 тa CF3; або їх енантіомери та фармацевтично прийнятні солі. Особливо кращі втілення винаходу такожвключають сполуки формули І, де А – D є атом оксигену; Ε є простий зв'язок; Ar1 є 5- або 6-членне ароматичне або гетероароматичне кільце, що містить нуль або один атом нітрогену, нуль або один атом оксигену та нуль або один атом сульфуру, а найкраще є бензольне кільце, фуранове кільце або тіофенове кільце; Ar2 є 5- або 6-членне ароматичне або гетероароматичне кільце, що містить від нуля до трьох атомів нітрогену, нуль або один атом оксигену та н уль або один атом сульфур у; Ароматичне кільце Ar1 є заміщеним -ЕAr2 та карбоксамідною групою, C(=O)NHA, але не подальшими замісниками, а ці замісники на Ar1 розташовані переважно у положенні 1,3 стосовно один одного; Ar2 є заміщеним нуль або одним замісником, вибраними з групи, до складу якої входять: атом галогену, С1алкіл, С2-4алкеніл, С2-4алкініл, CN, NO2, NR1R2, CH2NR1R2, OR3, CH2OR3, CO 2R4 та CF3 ; або їх енантіомери та 4 фармацевтично прийнятні солі. Особливо кращі втілення винаходувключають сполуки формули І, де А є: D є атом оксигену; Ε є атом оксигену, або ΝΗ; Ar1 є 5- або 6-членне ароматичне або гетероароматичне кільце, що містить нуль або один атом нітрогену, нуль або один атом оксигену та нуль або один атом сульфуру та переважно є бензольне кільце, фуранове кільце або тіофенове кільце; Ar1 є 5- або 6-членне ароматичне або гетероароматичне кільце, що містить від нуля до трьох атомів нітрогену, нуль або один атом оксигену та н уль або один атом сульфур у; Ароматичне кільце Ar1 є заміщеним -ЕAr2 та карбоксамідною групою, C(=O)NHA, але не подальшими замісниками, а ці замісники на Ar1 розташовані переважно у положенні 1,3 стосовно один одного; Ar2 є заміщеним нуль або одним замісником, вибраними з групи, до складу якої входять: атом галогену, С11 2 1 2 3 3 4 4алкіл, С 2-4алкеніл, С 2-4алкініл, CN, NO2, NR R , CH 2NR R , OR , CH 2OR , CO 2R та CF3 ; або їх енантіомери та фармацевтично прийнятні солі. Кращі втілення винаходу включають сполуки згідно з формулою І, де А є: а конфігурація атома карбону у хінуклідині, до якого приєднаний амідний атом нітрогену, є βконфігурацією, та їх фармацевтично прийнятні солі. Кращі сполуки згідно з винаходом включають наступні: N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілфуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-тієніл)бензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(3-фенілбензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-піридил)бензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-метоксифеніл)бензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-метоксифеніл)бензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-(ацетиламінофеніл)бензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-флуорфеніл)бензамід): N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-метилфеніл)бензамід): N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-тієніл)бензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3,5-дихлорфеніл)бензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-нафтил)бензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(3-(4-флуорфеніл)бензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-тієніл)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-бензо[b]фураніл)фуран-2-карбоксамід): N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-тієніл)фуран-2-карбоксамід); N-(1-aзaдициклo[2,2,2]oкт-3-ил)(5-(3-мeтoкcифeнiл)фypaн-2-кapбoкcaмiд); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-метоксифеніл)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-флуорфеніл)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-нафтил)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метилфеніл)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-фурил)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-фурил)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(4-(2-піридил)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(4-(4-піридил)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(4-(3-піридил)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-нітрофеніл)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-трифлуорметилфеніл)фуран-2-карбоксамід): N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-хлорфеніл)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-етоксифеніл)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3,5-диметилізоксазол-4-іл)фуран-2-карбоксамід); N-(1-азадицикпо[2,2,2]окт-3-ил)(5-(3,5-диметилізоксазол-4-іл)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)тіофен-2-карбоксамід); N-(1-aзaдициклo[2,2,2]oкт-3-ил)(5-(3-пipидил)тioфeн-3-кapбoкcaмiд); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-хлорфеніл)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіазол-3-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіазол-3-карбоксамід); N-(1-aзaдициклo[2,2,2]oкт-3-ил)(5-(3-(N,N-димeтилaмiнo)фeнiл)тioфeн-2-кapбoкcaмiд); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(8-хінолініл)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-3-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(4-фенілтіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-ціанофеніл)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-метиламіно)феніл)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-гідроксифеніл)тіофен-2-карбоксамід); N-(1-aзaдициклo[2,2,2]окт-3-ил)(5-(3-пipидилaмiнo)тioфeн-2-кapбoкcaмiд); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-хлорфеніл)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(4-морфолініл)феніл)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(амінометил)феніл)тіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенокситіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N,N-диметиламіно)феніл)фуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-формілфеніл)тіофен-2-карбоксамід); та N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(гідроксіетил)феніл)тіофен-2-карбоксамід). Особливо кращі сполуки згідно з винаходом включають наступні: (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілфуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-тієніл)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-фенілбензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-піридил)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-метоксифеніл)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-метоксифеніл)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-(N-ацетиламіно)феніл)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-флуорфеніл)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-метилфеніл)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-тієніл)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3,5-дихлорфеніл)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-нафтил)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(4-трифлуорфеніл)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-тієніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-бензо[b]фураніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-тієніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-метоксифеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-флуорфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-нафтил)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метилфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-фурил)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-фурил)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-(2-піридил)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-(4-піридил)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-(3-піридил)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-нітрофеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-трифлуорметилфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-хлорфеніл)фуран-2-карбоксамід); (R)-N-(1-aзaдициклo[2,2,2]oкт-3-ил)(5-(3-(N-aцeтилaмiнo)фeнiл)тioфeн-2-кapбoкcaмiд); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-етоксифеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3,5-диметилізоксазол-4-іл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3,5-диметилізоксазол-4-іл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-3-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)[5-(4-хлорфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіазол-3-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіазол-3-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N,N-диметиламіно)феніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(8-хінолініл)тіофен-2-карбоксамід); (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід); (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід); (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)тіофен-2-карбоксамід); (S)-N-(1-азадицикло(2,2,2]окт-3-ил)(5-фенілтіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-3-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-фенілтіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-ціанофеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-метиламіно)феніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-гідроксифеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридиламіно)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-хлорфеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(4-морфолініл)феніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(амінометил)феніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенокситіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)фуран-2-карбоксамід); (R)-N-(1-aзaдициклo[2,2,2]окт-3-ил)(5-(3-(N,N-димeтилaмiнo)фeнiл)фypaн-2-кapбoкcaмiд); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-формілфеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(гідроксіетил)феніл)тіофен-2-карбоксамід); та їх фармацевтично прийнятні солі. Серед цих сполук, наступні сполуки згідно з винаходом є особливо кращими: (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілфуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-тієніл)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-фенілбензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-(N-ацетиламіно)феніл)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-тіеніл)бензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-тієніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-бензо[b]фураніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-тієніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-флуорфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-нафтил)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метилфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-фурил)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-(2-піридил)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-нітрофеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-трифлуорметилфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2-2,2]окт-3-ил)(5-(3-хлорфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-етоксифеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3,5-диметилізоксазол-4-іл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2}окт-3-ил)(5-(3-амінофеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-3-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)[5-(4-хлорфеніл)фуран-2-карбоксамід); (R)-N-(1-aзaдициклo[2,2,2]oкт-3-ил)(5-(3-(N,N-димeтилaмiнo)фeнiл)тioфeн-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(8-хінолініл)тіофен-2-карбоксамід); (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід); (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід); (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)тіофен-2-карбоксамід); (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-3-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-фенілтіофен-2-карбоксамід); (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-метиламіно)феніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-гідроксифеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридиламіно)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(4-морфолініл)феніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(амінометил)феніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенокситіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N,N-диметиламіно)феніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(гідроксіетил)феніл)тіофен-2-карбоксамід); та їх фармацевтично прийнятні солі. Серед цих сполук, наступні сполуки згідно з винаходом є найкращими: (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-флуорфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламiно)феніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-нітрофеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-трифлуорметилфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-хлорфеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-3-карбоксамід); (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-2-карбоксамід); (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-фенілтіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-ціанофеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-гідроксифеніл)тіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенокситіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)фуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(гідроксіетил)феніл)тіофен-2-карбоксамід); та їх фармацевтично прийнятні солі. Способи отримання У схемах реакцій та наступному тексті А, Е, Ar1 та Ar2, якщо не показано інше, визначено вище для формули І. Сполуки формули І, в яких Ε є одиничні зв'язки, можна отримувати способами, показаними у схемі 1. Сполуки формули І, де D є атом оксигену, а Е є простий зв'язок, можна отримувати зі сполуки формули VI, де J є атом галогену або замісник OSO2CF3 у позиції кільця Ar1, в якій наявний зв'язок з кільцем Ar2, реакцією з прийнятною органометалічною сполукою формули VII у присутності, придатних органометалічного каталізатору та розчиннику, придатні сполуки формули VII включають боронові кислоти, в яких Μ є В(ОН)2, та сполуки органостануму, в яких М. є придатний триалкілстаніл, наприклад, триметилстаніл або три-нбутилстаніл, придатні органометалічні каталізатори включають комплекси паладію(0), наприклад, тетракіс(трифенілфосфін)паладій(0) або комбінацію трис(дибензиліденацетон)дипаладію(0) та, придатного ліганду, триарилфосфін у або триариларсину, наприклад, трифенілфосфіну, три(о-толіл)фосфін у або трифеніларсину, придатні розчинники включають інертні етерні розчинники, наприклад, 1,2-диметоксіетан, тетаргідрофуран, чи 1,4-діоксан, або спирти, як-то етанол, або їх суміші. Якщо сполука формули VII є бороновою кислотою, присутність придатної основи на додаток до інших реагентів є кращою, придатні основи включають карбонат натрію, карбонат цезію та гідроксид барію. Реакцію проводять при температурі 0-120°С, а переважно при температурі 60-120°С. Сполуки формули І, де D є атом оксигену, а Е є простий зв'язок, можна також отримати з органометалічних сполук формули VIII реакцією зі сполуками формули IX, в яких J є атом галогену або замісник OSO2CF3, у присутності, придатних органометалічного каталізатору та розчиннику, придатні сполуки формули VIII включають боронові кислоти, в яких Μ є В(ОН); та сполуки органостануму, в яких Μ є придатний триалкілстаніл, наприклад, триметилстаніл або три-н-бутилстаніл, придатні органометалічні каталізатори включають комплекси паладію(0), наприклад, тетракіс(трифенілфосфін)паладій(0) або комбінацію трис(дибензиліденацетон)дипаладію(0) та, придатного ліганду, триарилфосфіну або триариларсину, наприклад, трифенілфосфіну, три(о-толіл)фосфін у або трифеніларсину, придатні розчинники включають інертні, етерні розчинники, наприклад, 1,2-диметоксіетан, тетрагідрофуран, чи 1,4-діоксан, або спирти, як-то етанол, або їх суміші. Якщо сполука формули VII є бороновою кислотою, присутність придатної основи на додаток до інших реагентів є кращою, придатні основи включають карбонат натрію, карбонат цезію та гідроксид барію. Реакцію проводять при температурі 0-120°С, а переважно при температурі 60-120°С. Сполуки формули І, де D є атом оксигену, а Е є простий зв'язок, можна також отримати зі сполук формули X реакцією з придатною сполукою формули XI, де L є придатну відщеплювану гр упу, використовуючи, придатний спосіб ацилування, придатні відщеплювані групи L включають: ОН, атом галогену, Оалкіл, Оарил, ОСОалкіл, ОСОарил, придатний спосіб ацилування включає обробку сполуки формули X сполукою формули XI при 0-120°С у придатному розчиннику. Присутність основи, або, коли Υ = ОН, засобу сполучення, може також бути необхідною для відбуття реакції. Придатні для реакції основи включають: 4-(N,Nдиметиламіно)піридин, піридин, триетиламін, Ν,Ν-діізопропілетиламін. Кращою основою є Ν,Ν діізопропілетиламін. Придатні засоби сполучення, коли L = ОН, включають: карбодііміди, наприклад, 1,3дициклогексилкарбодіімід або гідрохлорид 1-(3-диметиламінопропіл-3-етилкарбодііміду; реагенти фосфонію, наприклад, гексафлуорфосфат бензотриазол-1-ілокситрис(диметиламіно)фосфонію або гексафлуорфосфат бензо-триазол-1-ілокситрипіролідинофосфонію; та реагенти уронію, наприклад, тетрафлуорборат Обензотриазол-1-іл-N,N,N¢,N¢-тетраметилуронію. Кращим засобом сполучення є тетрафлуорборат Обензотриазол-1-іл-N,N,N¢,N¢-тетраметилуронію. Придатні розчинники для реакції включають Ν,Νдиметилформамід, диметилсульфоксид, тетрагідрофуран, або хлороформ. Кращим розчинник є Ν,Νдиметилформамід. Реакцію переважно проводять при температурі 0-50°С, а найкраще при температурі 2030°С. Сполуки формули І, в яких D є суль фур, а Е є простий зв'язок, можна отримувати зі сполук формули І, в яких D є атом оксигену, а Е є простий зв'язок, реакцією з придатним сульфідом у придатному розчиннику. Кращими сульфідами є сульфіди фосфор у, зокрема, димер 4-метоксифенілтіонофосфінсульфіду ("реагент Лоуссона") та пентасульфід дифосфору. Придатні розчинники для реакції включають арильні вуглеводневі розчинники, наприклад, толуолі чи ксилол. Реакцію проводять при температурі 0-200°С, а переважно при температурі 50-180°С. Деякі сполуки формули VI, де J є атом галогену, можна отримувати зі сполук формули VI, де J є а том гідрогену, реакцією з придатним засобом галогенування у придатному розчиннику. Придатні засоби галогенування включають бром. Придатні розчинники включають оцтову кислоту. Реакцію переважно проводять при температурі 0-50°С, а найкраще при температурі 0-25°С. Сполуки формули VI, де J є OSO 2CF3, можна отримувати зі сполук формули VI, де J є ОН, реакцією з трифлуорметансульфоновим ангідридом або іншим трифлуорметансульфонілувальним засобом у присутності основи та придатного розчиннику. Придатні основи включають піридин та 2,6-ди-трет-бутилпіридин. Реакцію переважно проводять при температурі приблизно від -78 до 120°С, а найкраще при температурі приблизно від -78 до 0°С. Сполуки формули VI, де J є атом гідрогену, атом галогену, ОН, або OSO2CF3, можна отримувати зі сполук формули X реакцією з придатною сполукою формули XII, де L є придатну відщеплювану гр упу, a J є атом гідрогену, атом галогену, ОН, або OSO2CF3 , використовуючи придатний спосіб ацилування. Придатні відщеплювані групи L включають: ОН, атом галогену, Оалкіл, Оарил, ОСОалкіл, ОСОарил. Придатний спосіб ацилування включає обробку сполуки формули X зі сполукою формули XII при 0-120°С у придатному розчиннику. Присутність основи, або, коли L = ОН, засобу сполучення, можуть також бути необхідною для відбуття реакції. Придатні для реакції основи включають: 4-(N,N-диметиламіно)піридин, піридин, триетиламін, Ν,Ν-діізопропілетиламін. Кращою основою є Ν,Ν-діізопропілетиламін. Придатні засоби сполучення, коли Υ = ОН, включають: карбодііміди, наприклад, 1,3-дициклогексилкарбодіімід або гідрохлорид 1-(3диметиламінопропіл-3-етилкарбодііміду; реагенти фосфонію, наприклад, гексафлуорфосфат бензотриазол-1ілокситрис(диметиламіно)фосфонію або гексафлуор фосфат бензотриазол-1-ілокситрипіролідинофосфонію; та реагенти уронію, наприклад, тетрафлуорборат О-бензотриазол-1-іл-N,N,N¢,N¢-тетраметилуронію. Кращим засобом сполучення є тетрафлуорборат О-бензотриазол-1-іл-N,N,N¢,N¢-тетраметилуронію. Придатні розчинники для реакції включають Ν,Ν-диметилформамід, диметилсульфоксид. тетрагідрофуран, або хлороформ. Кращим розчинник є Ν,Ν-диметилформамід. Реакцію переважно проводять при температурі 050°С, а найкраще при температурі 20-30°С. Сполуки формули VIII, в яких Μ є В(ОН)2, можна отримувати зі сполук формули VI, в яких J є а том гідрогену, атом галогену, або OSO2CF 3, способами, відомими фахівцям. Наприклад, сполуки формули VI, в яких J є атом гідрогену або галогену, можна перетворювати у сполуки формули VIII, в яких Μ є В(ОН)2, перетворенням у відповідні сполуки ариллітію або арилмагнію, потім реакцією з триметилборатом та наступним гідролізом одержаного боратного естеру. Реакцію проводять у придатному інертному розчиннику, наприклад, тетрагідрофуран. Альтернативно, сполуки формули VI, де J є атом галогену або OSO2CF 3, можна перетворювати у сполуки формули VIII, в яких Μ є В(ОН)2, реакцією з біс(пінаколято)дибором та органометалічним каталізатором, потім гідролізом одержаного боратного естеру. Стосовно звичайних способів для здійснення таких перетворень, дивися, наприклад. Organic Syntheses, 1963, Coll. Vol. 4, 68; J. Org. Chem. 1995,60, 7508. Сполуки формули VIІІ, в яких М є триалкілстаніл, можна отримувати зі сполук формули VI, в яких J є атом гідрогену, атом галогену, або OSO2CF 3, способами, відомими фахівцям. Наприклад, сполуки формули VI, в яких J є атом гідрогену або галоген, можна перетворювати у сполуки формули VIII, в яких Μ є триалкілстаніл, перетворенням у відповідні сполуки ариллітію або арилмагнію, потім реакцією прийнятного галогеніду триалкілстанілу. Реакцію проводять у придатному інертному розчиннику, наприклад, тетрагідрофурані. Реакцію проводять при температурі від -78°С до 20°С, переважно при -78-0°С. Альтернативно, сполуки формули VI, де J є атом галогену або OSO2CF3, можна перетворювати у сполуки формули VIII, в яких Μ є триалкілстаніл, реакцією з прийнятним біс(триалкілстанумом). Реакцію проводять у придатному інертному розчиннику, наприклад, тетрагідрофурані, у присутності, придатного органометалічного каталізатору, наприклад, тетракіс(трифенілфосфіну). Реакцію проводять при температурі 0-150°С, переважно 20-100°С. Сполуки формули VIII, де Μ є В(ОН) 2 або триалкілстаніл, можна отримувати зі сполук формули X реакцією з придатною сполукою формули XIII, де L є придатну відщеплювану гр упу, Μ є В(ОН)2 або триалкілстаніл, використовуючи, придатний спосіб ацилування, придатні відщеплювані групи L включають: ОН, атом галогену, Оалкіл, Оарил, ОСОалкіл, ОСОарил. Придатний спосіб ацилування включає обробку сполуки формули X сполукою формули XIII при 0-120°С у придатному розчиннику. Присутність основи, або, коли L = ОН, засобу сполучення, можуть також бути необхідною для відбуття реакції. Придатні для реакції основи включають: 4(N,N-диметиламіно)піридин, піридин, триетиламін, Ν,Ν-діізопропілетиламін. Кращою основою є Ν,Νдіізопропілетиламін. Придатні засоби сполучення, коли L = ОН, включають: карбодііміди, наприклад, 1,3дициклогексилкарбодіімід або гідрохлорид 1-(3-диметиламінопропіл-3-етилкарбодііміду; реагенти фосфонію, наприклад, гексафлуорфосфат бензотриазол-1-ілокситрис(диметиламіно)фосфонію або гексафлуорфосфат бензотриазол-1-ілокситрипіролідинофосфонію; та реагенти уронію, наприклад, тетрафлуорборат Обензотриазол-1-іл-N,N,N¢,N¢-тетраметилуронію. Кращим засобом сполучення є тетрафлуорборат Обензотриазол-1-іл-N,N,N¢,N¢-тетраметилуронію. Придатні розчинники для реакції включають Ν,Νдиметилформамід, диметилсульфоксид, тетрагідрофуран, або хлороформ. Кращим розчинник є Ν,Νдиметилформамід. Реакцію переважно проводять при температурі 0-50°С, а найкраще при температурі 2030°С. Сполуки формули XI можна отримувати зі сполук формули XII, де J є атом галогену або замісник OSO2CF3 у позиції кільця Ar1, в якій наявний зв'язок з кільцем Ar2, реакцією з прийнятною органометалічною сполукою формули VII у присутності придатних органометалічного каталізатору та розчиннику. Придатні сполуки формули VII включають боронові кислоти, в яких Μ є В(ОН)2, та сполуки органостануму, в яких Μ є придатний триалкілстаніл, наприклад, триметилстаніл або три-н-бутилстаніл. Придатні органометалічні каталізатори включають комплекси паладію(0), наприклад, тетракіс(трифенілфосфін)паладію(0) або комбінацію трис(дибензилідієнацетон)дипаладію(0) та придатного триарилфосфін або триариларсину ліганд, наприклад, трифенілфосфін, три(о-толіл)фосфін або трифеніларсину у придатних розчинниках, включають інертні етерні розчинники, наприклад, 1,2-диметоксіетан, тетрагідрофуран, чи 1,4-діоксан, або спирти, як-то етанол, або їх суміші. Якщо сполукою формули VII є боронова кислота, присутність, придатної основи на додаток до інших реагентів є кращою. Придатні основи включають карбонат натрію, карбонат цезію та гідроксид барію. Реакцію проводять при температурі 0-120°С, а переважно при температурі 60-120°С. Сполуки формули XI можна також отримати з органометалічних сполук формули XIII реакцією зі сполуками формули IX, в яких J є атом галогену або OSO2CF3, у присутності придатних органометалічного каталізатору та розчиннику. Придатні сполуки формули XIII включають боронові кислоти, в яких Μ є В(ОН)2 та сполуки органостануму, в яких Μ є придатний триалкілстаніл, наприклад, триметилстаніл або три-нбутилстаніл. Придатні органометалічні каталізатори включають комплекси паладію(0), наприклад, тетракіс(трифенілфосфін)паладію(0) або комбінацію трис(дибензиліденацетон)дипаладію(0) та придатного ліганду триарилфосфіну або триариларсину, наприклад, трифенілфосфіну, три(о-толіл)фосфіну або трифеніларсину у придатних розчинниках, що включають інертні етерні розчинники, наприклад, 1,2-диметоксіетан, тетрагідрофуран, або 1,4-діоксан, або спирти, як-то етанол, або їх суміші. Якщо сполукою формули VII є боронова кислота, присутність, придатної основи на додаток до інших реагентів є кращою. Придатні основи включають карбонат натрію, карбонат цезію та гідроксид барію. Реакцію проводять при температурі 0-120°С, а переважно при температурі 60-120°С. Сполуки формули VII та сполуки формули XIII наявні у продажу, або їх можна отримувати способами, відомими фахівцям. Зокрема, способи, що є відомими фахівцям, перетворення арилгалогенідів або гетероарилгалогенідів у арил- або гетероарилборонові кислоти або арил- або гетероарилтриалкілстанани, що забезпечують способи перетворення сполук формули IX, в яких J є атом галогену, у сполуки формули VII, а сполук формули XII, в яких J є атом галогену, у сполуки формули XIII. Наприклад, боронові кислоти можна синтезувати з арил- або гетероарилгалогенідів перетворенням у сполуки ариллітію або арилмагнію, потім реакцією з триметилборатом, або реакцією з біс(пінаколято)дибором та органометалічним каталізатором, потім гідролізом одержаного боратного естеру (дивися, наприклад. Organic Syntheses, 1963, Coll. Vol. 4, 68; J. Org. Chem. 1995, 60, 7508). Триалкілстанани можна синтезувати з арил- або гетероарилгалогенідів перетворенням у сполуки ариллітію або арилмагнію, потім реакцією з прийнятним хлортриалкілстанумом, чи реакцією з прийнятним біс(триалкілстанумом) та органометалічним каталізатором. Сполуки формули І, де Ε є атом оксигену чи сульфур у або NR10, можна отримати способами, представленими на схемі 2. Сполуки формули І, де D є атом оксигену, а Е є NR10 , можна отримувати зі сполук формули VI, де J є а том галогену або замісник OSO2CF3 у позиції кільця Ar1, на якій утворюється зв'язок з атомом нітрогену, реакцією з прийнятним аміном формули XIV, в якому ЕН є NHR10. Реакцію можна проводити нагріванням у інертному розчиннику у присутності придатної сильної основи. Придатні інертні розчинники включають етерні розчинники, наприклад, тетрагідрофуран, 1,4-діоксан, 1,2-диметоксіетан, або ди(2-метоксіетил)етер, вуглеводневий розчинник, наприклад, бензол або толуолі, або амідний розчинник, наприклад, диметилформамід, або N-метил-2-піролідинон. Кращим розчинником є тетрагідрофуран. Придатні сильні основи включають алкоксид лужного металу або амідні основи, наприклад, трет-бутоксид натрію або третбутоксид калію, біс(триметилсиліл)амід літію, або діізопропіламід літію. Кращою сильною основою є третбутоксид натрію. Реакція може потребувати і її переважно проводять у присутності органометалічного каталізатору. Придатні органометалічні каталізатори включають комплекси паладію(0) з придатним фосфіновим лігандом, переважно триарилфосфіновим лігандом, а найкраще бідентатним триарилфосфіновим лігандом. Кращі ліганди включають 2,2'-біс(дифенілфосфіно)-1,1'-динафтил або 1,1'біс(дифенілфосфіно)фероцен. Каталізатор можна синтезувати сполученням придатного джерела паладію(0), наприклад, трис(дибензилїденацетон)дипаладію(0), з фосфіновим лігандом, його можна створювати раніше або утворювати in situ з джерела паладію та фосфінового ліганду у реакційній суміші. Реакцію проводять при температурі 0-150°С, а переважно при температурі 60-120°С. Сполуки формули І, де D є атом оксигену, а Е є NR10 , можна отримувати зі сполук формули IX, де J є а том галогену або замісник OSO2CF3 у позиції кільця Ar1, на якій утворюється зв'язок з атомом нітрогену, реакцією з прийнятним аміном формули XV, в якому ЕН є NHR10. Реакцію можна проводити нагріванням у інертному розчиннику у присутності придатної сильної основи. Придатні інертні розчинники включають етерні розчинники, наприклад, тетрагідрофуран, 1,4-діоксан, 1,2-диметоксіетан, або ди(2-метоксіетил)етер, вуглеводневий розчинник, наприклад, бензол або толуолі, або амідний розчинник, наприклад, диметилформамід, або N-метил-2-піролідинон. Кращим розчинником є тетрагідрофуран. Придатні сильні основи включають алкоксид лужного металу або амідні основи, наприклад, трет-бутоксид натрію або третбутоксид калію, біс(триметилсиліл)амід літію, або діізопропіламід літію. Кращою сильною основою є третбутоксид натрію. Реакція може потребувати і її переважно проводять у присутності органометалічного каталізатору. Придатні органометалічні каталізатори включають комплекси паладію(0) з придатним фосфіновим лігандом, переважно триарилфосфіновим лігандом, а найкраще бідентатним триарилфосфіновим лігандом. Кращі ліганди включають 2,2'-біс(дифенілфосфіно)-1,1'-динафтил або 1,1'біс(дифенілфосфіно)фероцен. Каталізатор можна синтезувати сполученням придатного джерела паладію(0), наприклад, трис(дибензиліденацетон)дипаладію(0), з фосфіновим лігандом, його можна створювати раніше або утворювати in situ з джерела паладію та фосфінового ліганду у реакційній суміші. Реакцію проводять при температурі 0-150°С, а переважно при температурі 60-120°С. Сполуки формули І, де D є атом оксигену, а Е є а том оксигену або сульфур можна також отримати зі сполуки формули VI, де J є а том галогену або замісник OSO2CF3 у позиції кільця Ar1, на якій утворюється зв'язок з атомом нітрогену, реакцією прийнятних сполук формули XIV, в яких ЕН є ОН або SH. Реакцію можна проводити нагріванням у інертному розчиннику у присутності придатної основи. Реакція може потребувати і її переважно проводять у присутності каталізатору. Придатні інертні розчинники включають етерні розчинники, наприклад, тетрагідрофуран, 1,4-діоксан, 1,2-диметоксіетан, або ди(2-метоксіетил)етер, амідний розчинник, наприклад, Ν,Ν-диметилформамід, або N-метилпіролідинон, або основний гетероциклічний ароматичний розчинник, наприклад, піридин. Кращим розчинником є піридин. Придатні основи включають алкоксиди лужних металів або карбонати лужних металів, наприклад, карбонат калію. Придатні органометалічні каталізатори включають мідь або її солі, переважно солі купруму(І), а найкраще йодид купруму(І). Реакцію проводять при температурі 0-150°С, а переважно при температурі 100-150°С. Сполуки формули І, де D є атом оксигену, а Е є а том оксигену або сульфур можна також отримати зі сполуки формули IX, де J є а том галогену або замісник OSO2CF3 у позиції кільця Ar1, на якій утворюється зв'язок з атомом нітрогену, реакцією прийнятних сполук формули XV, в яких ЕН є ОН або SH. Реакцію можна проводити нагріванням у інертному розчиннику у присутності придатної основи. Реакція може потребувати і її переважно проводять у присутності каталізатору. Придатні інертні розчинники включають етерні розчинники, наприклад, тетрагідрофуран, 1,4-діоксан, 1,2-диметоксіетан, або ди(2-метоксіетил)етер, амідний розчинник, наприклад, Ν,Ν-диметилформамід, або N-метилпіролідинон, або основний гетероциклічний ароматичний розчинник, наприклад, піридин. Кращим розчинником є піридин. Придатні основи включають алкоксиди лужних металів або карбонати лужних металів, наприклад, карбонат калію. Придатні органометалічні каталізатори включають мідь або її солі, переважно солі купруму(І), а найкраще йодид купруму(І). Реакцію проводять при температурі 0-150°С, а переважно при температурі 100-150°С. Сполуки формули І, де D є атом оксигену, а Е є атом оксигену чи суль фуру, або NR10 можна також отримати зі сполук формули X реакцією з придатною сполукою формули XVI, де Ε є атом оксигену чи сульфур у, або NR10, a L є придатну відщеплювану гр уп, використовуючи, придатний спосіб ацилування. Придатні відщеплювані групи L включають: ОН, атом галогену, Оалкіл, Оарил, ОСОалкіл, ОСОарил. Придатний спосіб ацилування включає обробку сполуки формули X сполукою формули XI при 0-120°С у придатному розчиннику. Присутність основи, або, коли Υ = ОН, засобу сполучення, може також бути необхідною для відбуття реакції. Придатні для реакції основи включають: 4-Ν,Ν-диметиламіно)піридин, піридин, триетиламін, Ν,Ν-діізопропілетиламін. Кращою основою є Ν,Ν-діізопропілетиламін. Придатні засоби сполучення, коли L = ОН, включають: карбодііміди, наприклад, 1,3-дициклогексилкарбодіімід або гідрохлорид 1-(3-диметиламінопропіл-3-етилкарбодііміду; реагенти фосфонію, наприклад, гексафлуорфосфат бензотриазол-1-ілокситрис(диметиламіно)фосфонію або гексафлуорфосфа т бензотриазол-1ілокситрипіролідинофосфонію; та реагенти уронію, наприклад, тетрафлуорборат О-бензотриазол-1-ілN,N,N¢,N¢-тетраметилуронію. Кращим засобом сполучення є тетрафлуорборат О-бензотриазол-1-іл-N,N,N¢,N¢тетраметилуронію. Придатні розчинники для реакції включають Ν,Ν-диметилформамід, диметилсульфоксид, тетрагідрофуран, або хлороформ. Кращим розчинником є Ν,Ν-диметилформамід. Реакцію переважно проводять при температурі 0-50°С, а найкраще при температурі 20-30°С. Сполуки формули І, де D є атом оксигену, а Е є атом оксигену чи суль фуру, або NR10 можна також отримати зі сполук формули X реакцією з придатною сполукою формули XVII, де Ε є атом оксигену чи сульфур у, або NR10, a L є придатну відщеплювану гр уп, використовуючи, придатний спосіб ацилування. Придатні відщеплювані групи L включають: ОН, атом галогену, Оалкіл, Оарил, ОСОалкіл, ОСОарил. Придатний спосіб ацилування включає обробку сполуки формули X сполукою формули XVII при 0-120°С у придатному розчиннику. Присутність основи, або, коли Υ = ОН, засобу сполучення, може також бути необхідною для відбуття реакції. Придатні для реакції основи включають: 4-Ν,Ν-диметиламіно)піридин, піридин, триетиламін, Ν,Ν-діізопропілетиламін. Кращою основою є Ν,Ν-діізопропілетиламін. Придатні засоби сполучення, коли L = ОН, включають: карбодііміди, наприклад, 1,3-дициклогексилкарбодіімід або гідрохлорид 1-(3-диметиламінопропіл-3-етилкарбодііміду; реагенти фосфонію, наприклад, гексафлуорфосфат бензотриазол-1-ілокситрис(диметиламіно)фосфонію або гексафлуорфосфа т бензотриазол-1ілокситрипіролідинофосфонію; та реагенти уронію, наприклад, тетрафлуорборат О-бензотриазол-1-ілN,N,N¢,N¢-тетраметилуронію. Кращим засобом сполучення є тетрафлуорборат 0-бензотриазол-1-іл-N,N,N¢,N¢тетраметилуронію. Придатні розчинники для реакції включають Ν,Ν-диметилформамід, диметилсульфоксид, тетрагідрофуран, або хлороформ. Кращим розчинником є Ν,Ν-диметилформамід. Реакцію переважно проводять при температурі 0-50°С, а найкраще при температурі 20-30°С. Сполуки формул І, XIV, XV або XVII, в яких Ε є NR10, a R10 є алкіл, можна отримувати зі сполук відповідної формули, де R10 є атом гідрогену, придатним способом алкілування. Звичайні способи алкілування включають обробку прийнятним алкілгалогенідом або сульфонатним естером та основою, наприклад, гідридом натрію, у придатному розчиннику, наприклад, Ν,Ν-диметилформаміді, або відновне алкілування, використовуючи прийнятний альдегід або кетон разом з придатним відновником у присутності кислотного каталізатору та у інертному розчиннику. Кращим способом є відновне алкілування. Придатні відновники включають борогідрид натрію та ціаноборогідрид натрію. Кращим, придатним відновником є борогідрид натрію. Придатні інертні розчинники включають воду, метанол або етанол. Кращим розчинником є метанол. Придатні кислотні каталізатори включають оцтову кислоту або хлорид цинку. Кращим кислотним каталізатором є оцтова кислота. Реакцію звичайно проводять при температурі 0-100°С, а переважно при 20-65°С. Сполуки формули І, XTV, XV або XVII, в яких Ε є NR10, a R10 є арил або гетероарил, можна отримувати зі сполук відповідної формули, де R10 є атом гідрогену, реакцією прийнятного ароматичного або гетероароматичного галогеніду або трифлуорметансульфонату. Реакцію можна проводити нагріванням у інертному розчиннику у присутності придатної сильної основи. Придатні інертні розчинники включають етерні розчинники, наприклад, тетрагідрофуран, 1,4-діоксан, 1,2-диметоксіетан, або ди(2-метоксіетил)етер, вуглеводневий розчинник, наприклад, бензол або толуолі, або амідний розчинник, наприклад, Ν,Νдиметилформамід, або N-метил-2-піролідинон. Кращим розчинником є тетрагідрофуран. Придатні сильні основи включають алкоксид лужного металу або амідні основи, наприклад, трет-бутоксид натрію або третбутоксид калію, біс(триметилсиліл)амід літію, або діізопропіламід літію. Кращою сильною основою є третбутоксид натрію. Реакція може потребувати і її переважно проводять у присутності органометалічного каталізатору. Придатні органометалічні каталізатори включають комплекси паладію(0) з придатним фосфіновим лігандом, переважно триарилфосфіновий ліганд, а найкраще бідентатним триарилфосфіновим лігандом. Кращі ліганди включають 2,2'-біс(дифенілфосфіно)-1,1'-динафтил або 1,1'біс(дифенілфосфіно)фероцен. Каталізатор можна синтезувати сполученням придатного джерела паладію(0), наприклад, трис(дибензиліденацетон)дипаладію(0), з фосфіновим лігандом, його можна створювати раніше або утворювати in situ з джерела паладію та фосфінового ліганду у реакційній суміші. Реакцію проводять при температурі 0-150°С, а переважно при температурі 60-120°С. Сполуки формули І, в яких D є сульфур, а Е є атом оксигену або NR10, можна отримувати зі сполук формули І, в яких D є атом оксигену, а Е є атом оксигену, або NR10, реакцією з придатним сульфідом у придатному розчиннику. Кращими сульфідами є сульфіди фосфор у, зокрема, димер 4метоксифенілтіонофосфінсульфіду ("реагент Лоуссона") та пентасульфід дифосфор у. Придатні розчинники для реакції включають арильні вуглеводневі розчинники, наприклад, толуолі чи ксилол. Реакцію проводять при температурі 0-200°С, а переважно при температурі 50-180°С. Сполуки формули XVI, де D є атом оксигену, а Е є NR10, можна отримувати зі сполук формули XII, де J є атом галогену або замісник OSO2CF3 у позиції кільця Ar1, на якій утворюється зв'язок з атомом нітрогену, реакцією з прийнятним аміном формули XIV, в якому ЕН є NHR10, або альтернативно, зі сполук формули XVII, в яких Ε є NR10, реакцією з прийнятною сполукою формули XIV, в якій J є атом галогену або замісник OSO2CF3 у позиції кільця Ar1, на якій утворюється зв'язок з атомом нітрогену. Реакцію можна проводити нагріванням у інертному розчиннику у присутності придатної сильної основи. Придатні інертні розчинники включають етерні розчинники, наприклад, тетрагідрофуран, 1,4-діоксан, 1,2-диметоксіетан, або ди(2-метоксіетил)етер, вуглеводневий розчинник, наприклад, бензол або толуолі, або амідний розчинник, наприклад, диметилформамід, або N-метил-2-піролідинон. Кращим розчинником є тетрагідрофуран. Придатні сильні основи включають алкоксид лужного металу або амідні основи, наприклад, трет-бутоксид натрію або третбутоксид калію, біс(триметилсиліл)амід літію, або діізопропіламід літію. Кращою сильною основою є третбутоксид натрію. Реакція може потребувати і її переважно проводять у присутності органометалічного каталізатору. Придатні органометалічні каталізатори включають комплекси паладію(0) з придатним фосфіновим лігандом, переважно триарилфосфіновим лігандом, а найкраще бідентатним триарилфосфіновим лігандом. Кращі ліганди включають 2,2'-біс(дифенілфосфіно)-1,1'-динафтил або 1,1'біс(дифенілфосфіно)фероцен. Каталізатор можна синтезувати сполученням придатного джерела паладію(0), наприклад, трис(дибензиліденацетон)дипаладію(0), з фосфіновим лігандом, його можна створювати раніше або утворювати in situ з джерела паладію та фосфінового ліганду у реакційній суміші. Реакцію проводять при температурі 0-150°С, а переважно при температурі 60-120°С. Сполуки формули XVI, де D є атом оксигену, а Е є атом оксигену або сульфур можна отримувати зі сполук формули XII, де J є атом галогену або замісник OSO2CF3, у позиції кільця Ar1, на якій утворюється зв'язок з атомом нітрогену, реакцією з прийнятною сполукою формули XIV, в якій ЕН є ОН або SH, або, альтернативно, зі сполукою формули XVII, в якій ЕН є ОН або SH, реакцією з прийнятною сполук формули IX, де J є атом галогену або замісник OSO2CF3, у позиції кільця Ar1, на якій утворюється зв'язок з атомом нітрогену. Реакцію можна проводити нагріванням у інертному розчиннику у присутності придатної основи. Реакція може потребувати і її переважно проводять у присутності каталізатору. Придатні інертні розчинники включають етерні розчинники, наприклад, тетрагідрофуран, 1,4-діоксан, 1,2-диметоксіетан, або ди(2-метоксіетил)етер, амідний розчинник, наприклад, Ν,Ν-диметилформамід, або N-метил-2-піролідинон, або основний гетероциклічний ароматичний розчинник, наприклад, піридин. Кращим розчинником є піридин. Придатні основи включають алкоксиди лужних металів, або карбонати лужних металів, наприклад, карбонат калію. Придатні органометалічні каталізатори включають мідь або її солі, переважно солі купруму(І), а найкраще йодид купруму(І). Реакцію проводять при температурі 0-150°С, а переважно при температурі 100-150°С. Сполуки формул IX, X та XII, XIV та XVII наявні у продажу, відомі з літератури, або їх можна отримувати способами, відомими фахівцям. Фахівець повинен розуміти, що деякі необов'язкові ароматичні замісники у сполуках згідно з винаходом можна уводити застосуванням ароматичних реакцій заміщення, або перетворенням функціональної групи для модифікації наявного заміснику, або їх комбінацією. Такі реакції можна проводити безпосередньо перед виконанням згаданих вище способів або негайно після цього, і їх включено як частковий аспект способу винаходу. Реагенти та реакційні умови для таких способів відомі в рівні техніки. Специфічні приклади способів, які можна застосовувати, включають, але без обмеження, електрофільну функціоналізацію ароматичного кільця, наприклад, нітруванням, галогенуванням, або ацилуванням; перетворення нітрогрупи у аміногрупу, наприклад, відновленням, як-то каталітичним гідруванням; ацилування, алкілування, сульфонілування аміногрупи або гідроксилу; заміщення аміногрупи іншою функціональною групою перетворенням у проміжну сіль діазонію, потім нуклеофільним або вільно-радикальним заміщенням солі діазонію; або заміщення атому галогену іншою функціональною групою, наприклад, нуклеофільною або каталізованою органометалом реакцією заміщення. Де необхідно, гідроксил, аміногрупа, або інші реакційні групи можуть бути захищеними, використовуючи захисні групи, як описано у стандартному довіднику "Protecting groups in Organic Synthesis" (Захисні групи у органічному синтезі), 3rd Edition (1999) by Greene та Wuts. Вищезазначені описані реакції, якщо не сказано інше, звичайно проводять при тиску приблизно від одної до трьох атмосфер, переважно при зовнішньому тиску (приблизно одна атмосфера). Якщо не зазначено інше, вищеописані реакції проводять в інертній атмосфері, переважно в атмосфері азоту. Сполуки згідно з винаходом та інтермедіати можна виділяти з їх реакційної суміші стандартними способами. Кислотно-адитивні солі сполук формули І, які можуть бути згаданими, включають солі мінеральних кислот, наприклад, гідрохлориди та гідроброміди; та солі, утворені органічними кислотами, як-то форміат, ацетат, малеат, бензоат, тартрат та фумарат. Кислотно-адитивні солі сполуки формули І можуть бути утворені реакцією вільної основи або солі, енантіомеру або її захи щеного похідного, з одним чи більше еквівалентами прийнятної кислоти. Реакцію можна проводити у розчиннику або середовищі, в яких сіль нерозчинна, або у розчиннику, в яких сіль розчинна, як-то, наприклад, вода, діоксан, етанол, тетрагідрофуран або діетиловий етер, або суміші розчинників, які можна видалити у вакуумі або сублімацією. Реакція може бути обмінною, або її можна проводити на іонообмінній смолі. Сполуки формули І існують у та утомерній або енантіомерній формах, усі вони знаходяться в рамках винаходу. Різні оптичні ізомери можна виділяти розділенням рацемічної суміші сполук, використовуючи звичайні способи, наприклад, фракційну кристалізацію, чи хіральну ВЕРХ. Альтернативно, індивідуальні енантіомери можна отримати реакцією прийнятних оптично активних вихідних матеріалів у реакційних умовах, які не викликають рацемізацію. Інтермедіати Наступний аспект винаходу стосується інтермедіатів. Важливими серед інтермедіатів є сполуки формули VI у схемі 1. Ці інтермедіати корисні у синтезі сполук формули І, але їх використання не обмежене синтезом таких сполук. Наприклад, сполуки формули VI активні як ліганди для рецепторів ацетилхоліну, а тому виявляють корисність, описану для сполук формули І. Відповідно, запропоновано також сполуку формули VI: де: Ar1 є бензольне, фуранове, або тіофенове кільце; J є атом галогену, або OSO2CF3, за умови, що коли Ar1 є бензольне кільце, J може представляти тільки бром, йод, або OSO2CF3 у позиції мета- або пара- стосовно карбоксамідної групи; або її енантіомер та її фармацевтично прийнятні солі. Кращі сполуки згідно з цим аспектом винаходу включають наступні: N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромфуран-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромтіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(3-бромбензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(4-бромбензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(3-йодбензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(4-йодбензамід); N-(1-азадицикло[2,2,2]окт-3-ил)(4-бромтіофен-2-карбоксамід); N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромтіофен-3-карбоксамід); або їх енантіомери та фармацевтично прийнятні солі. Особливо кращі сполуки згідно з цим аспектом винаходу включають наступні: (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромфуран-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромтіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромтіофен-2-карбоксамід); (R)-N-(-азадицикло[2,2,2]окт-3-ил)(3-бромбензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-бромбензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-йодбензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-йодбензамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-бромтіофен-2-карбоксамід); (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромтіофен-3-карбоксамід); або їх енантіомери та фармацевтично прийнятні солі. Проміжні сполуки також існують у енантіомерній формі і їх можна використовувати як виділені енантіомери, рацемати або суміші. Фармацевтичні композиції Наступний аспект винаходу стосується фармацевтичної композиції для лікування або попередження стану або розладу, які представлено нижче, що виникають від дисфункції нейротрансмісії нікотинового ацетилхолінового рецептору у ссавця, переважно людини, композиція включає кількість сполуки формули І, її енантіомеру або її фармацевтично прийнятної солі, що ефективна при лікуванні або попередженні такого розлад або стану, у суміші з інертним фармацевтично прийнятним розріджувачем або носієм. Для вищезгаданого використання застосовуване дозування залежатиме, безумовно, від застосовуваної сполуки, режим застосування і потрібного лікування. Однак, звичайно, задовільні результати отримують, коли сполуки згідно з винаходом вживають при добовому дозуванні приблизно від 0,1мг до 20мг на кг маси тіла тварини, переважно у поділених дозах від 1 до 4 разів на добу або у формі з уповільненим вивільненням. Для людини, загальна добова доза знаходиться в межах від 5мг до 1400мг, переважно від 10мг до 100мг, а форми дозованих одиниць, придатних для перорального вживання, включають від 2мг до 1400мг сполуки, змішаної з твердим або рідким фармацевтичним носієм або розріджувачем. Сполуки формули І, або їх енантіомери та фармацевтично прийнятні солі, можна використовувати самі по собі або у формі прийнятних медичних препаратів для парентерального або ентерального застосування. Згідно з наступним аспектом винаходу, запропоновано фармацевтичну композицію, що має масову частку сполуки згідно з винаходом переважно менше ніж 80%, а краще менше ніж 50%, у суміші з інертним фармацевтично прийнятним розріджувачем або носієм. Прикладами розріджувачів та носіїв є: для таблеток та драже: лактоза, крохмаль, тальк, стеаринова кислота; для капсул: винна кислота або лактоза; для розчинів для ін'єкцій: вода, спирти, гліцерин, рослинні олії; для супозиторіїв: природні або твердіючі олії або воски. Також запропоновано спосіб отримання такої фармацевтичної композиції, який включає змішування інгредієнтів. Корисність Наступний аспект винаходу стосується є використання сполук згідно з винаходом, їх енантіомерів або їх фармацевтично прийнятних солей у виробництві медикаменту для лікування чи профілактики одної з нижчезгаданих хвороб або станів; та спосіб лікування чи профілактики одної з нижчезгаданих хвороб або станів, який включає застосування до пацієнта терапевтично ефективної кількості сполуки згідно з винаходом, її енантіомеру або її фармацевтично прийнятної солі. Сполуки згідно з винаходом є агоністами нікотинових ацетилхолінових рецепторів. Без обмеження теорією, вважають, що агоністи підтипу a 7 N AChR (нікотинового ацетилхолінового рецептору) повинні бути корисними при лікуванні чи профілактиці психічних розладів та розладів мислення і мають перевагу над сполуками, які є також агоністами підтипу a 4 NAChR. Тому сполуки, які є селективними для підтипу a 7 N AChR є кращими. Сполуки згідно з винаходом показані як фармацевтичні, зокрема при лікуванні чи профілактиці психічних розладів та розладів мислення. Приклади психічних розладів включають шизофренію, манії та маніакальну депресію і тривожність. Приклади розладів мислення включають хворобу Альцгеймера, труднощі навчання, труднощі пізнання, дефіцит уваги, слабоумство Леві-Боді, втрату пам'яті та гіперактивний розлад з дефіцитом уваги. Сполуки згідно з винаходом можуть також бути корисними як аналгетики при лікуванні болю (включаючи хронічний біль) та при лікуванні чи профілактиці хвороби Паркінсона, хвороби Хантингтона, синдром Турета та нейродегенеративні розлади, в яких наявна втрата холінергічних синапсів. Сполуки можуть крім того, бути показані при лікуванні чи профілактиці порушення біоритмів, для використання у індукуванні припинення паління та для лікування чи профілактики пагубної звички до нікотину (включаючи одержані від піддавання дії продуктів, що містять нікотин). Також вважають, що сполуки згідно з винаходом корисні при лікуванні та профілактиці виразкового коліту. Фармакологія Фармакологічну активність сполук згідно з винаходом можна виміряти у тестах, описаних нижче: Тест А - Дослідження спорідненості до підтипу a 7 N AChR Зв'язування 125 І-a-бунгаротоксину (ВТХ) з мембранами гіпокампу щурів. Гіпокамп щурів гомогенізували у 20 об'ємах холодного гомогенізаційного буферу (НВ: концентрації складових (мМ): трис(гідроксіетил)амінометан 50; МgСІ2 1; NaCl 120; КСІ 5: рН 7,4). Гомогенат центрифугували протягом 5 хвилин при 1000g, надосадкову рідину залишали, а гранулу реекстрагували. Поєднані надосадкові шари центрифугували протягом 20 хвилин при 12000g, промивали та ресуспендували у буфері НВ. Мембрани (30-80мкг) інкубували з 5 нМ [125 І]a-ВТХ, 1мг/мл БСА (альбумін коров'ячої сироватки), тестованим лікувальним засобом та 2мМ СаСІ2 або 0,5мМ EGTA [е тиленгліколь-біс(b-аміноетиловий етер)] протягом 2 годин при 21°С, далі фільтрували та промивали 4 рази на Ватмановських скловолоконних фільтрах (щільність С), використовуючи збірник клітин Brandel. Попередня обробка фільтрів протягом 3 годин 1% (БСА/0,01% РЕІ (поліетиленімін) у воді була дуже необхідною для низьких пропусків фільтрів (0,07% загального підрахунку за хвилину). Неспецифічне зв'язування було охарактеризоване 100мкМ (-)-нікотину, а специфічне зв'язування було звичайно 75%. Тест В - Дослідження спорідненості стосовно підтипу a 4 N AChR Зв'язування [3Н]-(-)-нікотину. Використовуючи модифікований спосіб Мартино-Барроу та Келлар (Моl. Pharm (1987) 31:169-174), мозок щурів (кору головного мозку та гіпокамп) гомогенізували як у аналізі зв'язування (125І]a-ВТХ, центрифугували протягом 20 хвилин при 12000g, двічі промивали, далі ресуспендували у буфері НВ, що містить 100мкМ діізопропілфлуорфосфату. Через 20 хвилин при 4°С, мембрани (приблизно 0,5мг) інкубували з 3нМ [3Н]-(-)-нікотину, тестованим лікувальним засобом, 1мкМ атропіном та 2мМ СаСІ2 або 0,5мМ EGTA протягом 1 години при 4°С, далі фільтрували Ватмановських скловолоконних фільтрах (щільність С) (попередня оброблені протягом 1 години 0,5% РЕІ), використовуючи збірник клітин Brandel. Неспецифічне зв'язування було охарактеризоване 100мкМ карбахолу, а специфічне зв'язування було звичайно 84%. Аналіз даних зв'язування для тестів А та В Величини ІК50 та псевдо коефіцієнти Хілла (ηΗ) розраховували, використовуючи програму нелінійної підгонки кривої ALLRT (deLean A, Munson Ρ J та Rodbard D (1977) Am. J. Physiol., 235:E97-E102). Криві насичення підганяли до одно-місцевої моделі, використовуючи нелінійну регресійну програму ENZFITTER (Leatherbarrow, R.J. (1987)) з одержанням величин KD 1,67 та 1,70нМ для лігандів 125І-a-ВТХ та [3Н]-(-)-нікотину відповідно. Величини Кl оцінювали, використовуючи загальне рівняння Ченг-Пруссофа: Кі = [ІК 50]/((2+([ліганд] /KD]) n)1/n-1) де величину n = І використовували всякого разу, коли ηΗ 1,5. Зразки досліджували у потрійній кількості, вони були звичайно ± 5%. Величини Кl визначали, використовуючи 6 або більше концентрацій лікувального засобу. Сполуки згідно з винаходом є сполуками зі спорідненістю до зв'язування (Кl) менше 10мкМ у Тесті А або Тесті В, вказуючи, що можна очікувати, що вони мають корисну терапевтичну активність. Сполуки згідно з винаходом мають перевагу в тому, що вони можуть бути менш токсичними, бути більш ефективними, бути більш довгодіючими, мати широкі межі активності, бути більш потужними, продукувати меншу побічну дію, легше поглинаються або мають інші корисні фармакологічні властивості. Загальні експериментальні способи Комерційні реагенти використовували без подальшої очистки. Мас-спектри реєстрували, використовуючи мас-спектрометр Hewlett Packard 5988A або MicroMass Quattro-1 та виражали як m/z. для вихідного молекулярного іона. Кімнатна температура стосується 20-25°С. Приклади Наступні приклади є кращими необмежувальними прикладами, що охоплюють кращі аспекти винаходу. Інтермедіат 1 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромфуран-2-карбоксамід) Суміш дигідрохлориду N-1-азадицикло[2,2,2]окт-3-иламіну (655мг), 5-бромфуран-2-карбонової кислоти (681мг), гідрату 1-гідроксибензотриазолу (457мг), тетрафлуорборату О-бензотриазол-1-іл-N,N,N¢,N¢тетраметилуронію (1,069г), та Ν,Ν-діізопропілетиламіну (2,5мл) у Ν,Ν-диметилформаміді (10мл) перемішували до отримання гомогенногорозчину, далі тримали при кімнатній температурі протягом ночі. Розчин випарювали та залишок розподіляли між водним розчином гідроксиду натрію та хлороформом. Шар хлороформу сушили сульфатом магнію, фільтрували та випарювали, а залишок очищали хроматографією на силікагелі у твердофазному екстракційному патроні, використовуючи суміш насиченого аміаком метанолу з хлороформом як елюент. Сполуку далі розчиняли у тетрагідрофурані (20мл), додавали надлишок гідрогенхлориду (5мл; 1Μ розчин у діетиловому етері) та розчин випарювали, далі перекристалізовували з суміші метанолу з діетиловим етером з одержанням гідрохлориду потрібної сполуки як безбарвної твердої речовини (538мг); МС з електророзпиленням (ЕР+) 299, 301 (mН+). Інтермедіат 2 (R)-N-(1-азадицикло[2,2,21окт-3-ил)(5-бромтіофен-2-карбоксамід) Суміш дигідрохлориду(R)-1-азадицикло[2,2,2]окт-3-иламін (4г), 5-бромтіофен-2-карбонової кислоти (4,25г), гідрату 1-гідроксибензотриазолу (2,77г), те трафлуорборату О-бензотриазол-1-іл-N,N,N¢,N¢-тетраметилуронію (6,6г), та Ν,Ν-діізопропілетиламіну (14мл), у Ν,Ν-диметилформаміді (100мл) перемішували при кімнатній температурі протягом ночі. Розчин випарювали та залишок розподіляли між водним розчином гідроксиду натрію та хлороформом. Шар хлороформу сушили сульфатом магнію, фільтрували та випарювали. Залишок очищали флеш-хроматографією на силікагелі та елювали сумішшю 3,5Μ метанольного аміаку з хлороформом з градієнтом 5%-20%. Випарювання розчиннику дало жовту тверду речовину (5,87г); МС (ЕР+) 315, 317 (mН+). Інтермедіат 3 (S)-N-(1-азадицикло[2,2,21окт-3-ил)(5-бромтіофен-2-карбоксамід) Суміш дигідрохлориду(S)-N-(1-азадицикло[2,2,2]окт-3-иламіну (1,9г), 5-бромтіофен-2-карбонової кислоти (1,97г), гідрату 1-гідроксибензотриазолу (1,28г тетрафлуорборату О-бензотриазол-1-іл-N,N,N¢,N¢тетраметилуронію (3,06г), та Ν,Ν-діізопропілетиламіну (8,3мл) у Ν,Ν-диметилформаміді (20мл) перемішували при кімнатній температурі протягом ночі. Розчин випарювали та залишок розподіляли між водним розчином гідроксиду натрію та хлороформом. Шар хлороформу сушили сульфатом магнію, фільтрували та випарювали. Залишок очищали флеш-хроматографією на силікагелі та елювали сумішшю 3,5Μ метанольного аміаку з хлороформом з градієнтом 5%-20%. Випарювання розчиннику дало білу тверду речовину (3г); МС (ЕР+) 315, 317 (mН+). Інтермедіат 4 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-бромбензамід) Отримано способом, аналогічним описаному для отримання інтермедіату 1 з дигідрохлориду (R)-1азадицикло[2,2,2]окт-3-иламіну та 3-бромбензойної кислоти; сполуку очищали хроматографією на силікагелі, використовуючи суміш насиченого аміаком метанолу з хлороформом як елюент. Сполуку далі розчиняли у тетрагідрофурані, додавали надлишок гідрогенхлориду (1Μ розчин у діетиловому етері) та розчин випарювали, далі перекристалізовували з суміші метанолу з діетиловим етером з одержанням гідрохлориду потрібної сполуки як безбарвної твердої речовини; МС (ЕР+) 309, 311 (mН+). Інтермедіат 5 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-бромбензамід) Отримано способом, аналогічним описаному для отримання інтермедіату 1 з дигідрохлориду (R)-1азадицикло[2,2,2]окт-3-иламіну та 4-бромбензойної кислоти; сполуку очищали хроматографією на силікагелі, використовуючи суміш насиченого аміаком метанолу з хлороформом як елюент. Сполуку далі розчиняли у тетрагідрофурані, надлишок гідрогенхлориду (1Μ розчин у діетиловому етері) додавали та розчин випарювали, далі перекристалізовували з суміші метанолу з трет-бутил-метиловим етером з одержанням гідрохлориду потрібної сполуки як безбарвної твердої речовини; МС (ЕР+)309,311 (mН+). Інтермедіат 6 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-йодбензамід) Отримано способом, аналогічним описаному для отримання інтермедіату 1 з дигідрохлориду (R)-1азадицикло[2,2,2]окт-3-иламіну та 3-йодбензойної кислоти; сполуку очищали твердофазною екстракцією на силікагелі, використовуючи суміш насиченого аміаком метанолу з хлороформом як елюент, потім оберненофазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент, фракції з вмістом продукту випарювали, залишок розчиняли у метанолі, додавали надлишок розчину гідрогенхлориду (4 М у 1,4-діоксан) та розчин випарювали з одержанням гідрохлориду потрібної сполуки як безбарвної твердої речовини; МС (ЕР+) 357 (mН+). Інтермедіат 7 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-йодбензамід) Отримано способом, аналогічним описаному отриманню інтермедіату 1 з дигідрохлориду (R)-1азадицикло[2,2,2]окт-3-иламіну та 4-йодбензойної кислоти; сполуку очищали твердофазною екстракцією на силікагелі, використовуючи суміш насиченого аміаком метанолу з хлороформом як елюент, потім оберненофазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту випарювали, залишок розчиняли у метанолі, додавали надлишок розчину гідрогенхлориду (4 М у 1,4-діоксан) та розчин випарювали з одержанням гідрохлориду потрібної сполуки як безбарвної твердої речовини; МС (ЕР+) 357 (mН+). Інтермедіат 8 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-бромтіофен-2-карбоксамід) (А) 4-бромтіофен-2-карбонова кислота Оксид хрому(VІ) (20г) та концентровану сульфатн у кислоту (32г) розчиняли у воді (50мл) та після завершення розчинення об'єм доводили до 100мл водою 55мл одержаного розчину додавали краплями до розчину 4-бромтіофен-2-карбоксальдегіду (19,1г) у ацетоні (200мл) і перемішували при 0°С. Через 2 години розчин розбавляли водою та екстрагували хлороформом. Органічні екстракти промивали водою, далі екстрагували водним розчином гідроксиду натрію. Лужну суміш підкислювали обережним додаванням концентрованої гідрохлоридної кислоти, далі екстрагували хлороформом. Органічний шар далі сушили сульфатом магнію, фільтрували та випарювали. Одержану тверду речовину перекристалізовували з суміші діетилового етеру з гексаном з одержанням безбарвної твердої речовини; МС (ЕР+) 207, 209 (mН+). (В) (R)-N-(1-азадицикло[2.2.2]окт-3-ил)(4-бромтіофен-2-карбоксамід) Отримано способом, аналогічним описаному для отримання інтермедіату 1 з дигідрохлориду N-1-азадицикло[2,2,2]окт-3-иламіну та 4бромтіофен-2-карбонової кислоти. Залишок від випарювання реакційної суміші розподіляли між водною гідрохлоридною кислотою та хлороформом. Водний шар далі підлужували водним розчином гідроксиду натрію та екстрагували хлороформом. Органічні екстракти сушили сульфатом магнію, фільтрували та випарювали і одержану тверду речовину перекристалізовували з суміші етилацетату з гексаном з одержанням титульної сполуки як безбарвної твердої речовини: МС (ЕР+)315, 317 (mН+). Інтермедіат 9 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромтіофен-3-карбоксамід) (A) 5-бромтіофен-3-карбонова кислота Бром (46,5г) у оцтовій кислоті (200мл) додавали краплями до розчину тіофен-3-карбонової кислоти (38г) у оцтовій кислоті (300мл). Після завершення додавання перемішування продовжували при кімнатній температурі протягом 30 хвилин Реакційну суміш виливали у 2000мл води з льодом та осаджений твердий продукт збирали та перекристалізовували з води з одержанням безбарвної твердої речовини; МС (ЕР+) 205, 207 (mН+). (B) (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромтіофен-3-карбоксамід) Отримано способом, аналогічним описаному для отримання інтермедіату 1 з дигідрохлориду (R)-1азадицикло[2,2,2]окт-3-иламіну та 5-бромтіофен-3-карбонової кислоти. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту випарювали, залишки розчиняли у метанолі, додавали надлишок розчину гідрогенхлориду (4М у 1,4-діоксан) та розчин випарювали. Після сушки під вакуумом, гідрохлорид потрібної сполуки отримали як безбарвну тверду речовину; МС (ЕР+) 315, 317 (mН+) Приклад 1 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілфуран-2-карбоксамід) Гідрохлорид (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромфуран-2-карбоксаміду) (100мг), фенілборонову кислоту (45мг), тетракіс(трифенілфосфін)паладій(0)(20мг), карбонат цезію (547мг), у суміші 1,2-диметоксіетану (6мл), етанолу (1,5мл) та води (1мл) перемішували при кип'ятінні під зворотним холодильником в атмосфері азоту протягом 17 годин. Розчин випарювали та залишок розчиняли у хлороформі. Розчин промивали водним розчином карбонату натрію та органічний шар далі сушили сульфатом магнію, фільтрували та випарювали. ВЕРХ очистка, використовуючи суміш з градієнтом від 1:1 насиченого аміаком метанолу у хлороформі до хлороформу дала потрібну сполуку як безбарвну тверду речовину (63мг); МС (ЕР+) 297 (mН+). Приклад 2 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-[3-флуорфеніл)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та 3-флуорбензолборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші 1,2-диметоксіетану та води. Сполуку очищали фільтруванням через твердофазний екстракційний патрон з силікагелем, використовуючи суміш насиченого аміаком метанолу з хлороформом як елюент, далі обернено-фазовою ВЕРХ на колонці Waters Bondapak® С18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину три флуороцтової кислоти як елюент. Випарювання розчиннику дало трифлуорацетат потрібної сполуки як безбарвної твердої речовини; МС (ЕР+) 315 (mН+). Приклад 3 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-тіеніл)бензамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-1-азадицикло[2,2,2]окт-3-ил)(3бромбензамід) та 3-тіофенборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання розчиннику дало трифлуорацетат потрібної сполуки як безбарвної твердої речовини; МС (ЕР+) 313 (mН+). Приклад 4 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-фенілбензамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-1-азадицикло[2,2,2]окт-3-ил)(3бромбензаміду) та фенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, е танолу та води. Сполуку очи щали фле ш-хроматографією на силікагелі та елювали 3%-10% сумішшю 3,5 Η метанольного аміаку з хлороформом. Випарювання розчиннику дало потрібну сполуку як безбарвну тверду речовину; МС (ЕР+) 307 (mН+). Приклад 5 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-піридил)бензамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-1-азадицикло[2,2,2]окт-3-ил)(3бромбензаміду) та піридин-3-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® Cis, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1 Μ у діетиловому етері) додавали та розчин випарювали. Після сушки під вакуумом, дигідрохлорид потрібної сполуки отримали як безбарвну тверду речовину; МС (ЕР+) 308 (mН+). Приклад 6 (R) N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(,1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та фенілборонової кислоти, використовуючи те тракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 313 (mН+). Приклад 7 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-метоксифеніл)бензамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3 бромбензаміду) та 3-метоксифенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат цезію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР*) 337 (mН+). Приклад 8 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-метоксифеніл)бензамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3бромбензаміду) та 2-метоксифенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат цезію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 337 (mН+). Приклад 9 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-N-ацетиламіно)феніл)бензамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло(2,2,2]окт-3-ил)(3бромбензаміду) та 3-(N-ацетиламіно)фенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат цезію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 364 (mН+). Приклад 10 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(3-флуорфеніл)бензамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3бромбензаміду) та 3-флуорбензолборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат цезію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 325 (mН+). Приклад 11 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-[3-метилфеніл)бензамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3бромбензаміду) та 3-метилфенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат цезію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® С18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 321 (mН+). Приклад 12 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-тієніл)бензамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3бромбензаміду) та 2-тіофенборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0), карбонат цезію у суміші 1,2-диметоксіетану та води. Сполуку очи щали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину три флуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) (mН+). Приклад 13 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)[3-(3,5-дихлорфеніл)бензамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикпо[2,2,2]окт-3-ил)(3бромбензаміду) та 3,5-дихлорфенілборонової кислоти, тетракіс(трифенілфосфін)паладію(0), карбонату цезію у суміші 1,2-диметоксіетану та води. Сполуку очи щали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 375,377 МН+). Приклад 14 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(2-нафтилбензамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3бромбензаміду) та 2-нафталінборонової кислоти, тетракіс(трифенілфосфін)паладію(0), карбонату цезію у суміші 1,2-диметоксіетану та води. Сполуку очи щали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 357 (mН+). Приклад 15 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3-(4-флуорфеніл)бензамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(3бромбензаміду) та 4-флуорфенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат цезію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 325 (mН+). Приклад 16 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридинфуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та піридин-3-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Після сушки під вакуумом, дигідрохлорид потрібної сполуки отримали як безбарвну тверду речовину; МС (ЕР+) 298 (mН+). Приклад 17 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-тієніл)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та 3-тіофенборонової кислоти, тетракіс(трифенілфосфін)паладію(0), карбонату натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водної трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 303 (mН+). Приклад 18 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-бензо[b]фураніл)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та бензо[b]фуран-2-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водної трифлуороцтової кислоти як елюенту. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 337 (mН+). Приклад 19 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та піридин-4-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Після сушки під вакуумом, дигідрохлорид потрібної сполуки отримали як безбарвну тверду речовину; МС (ЕР+) 298 (NOT). Приклад 20 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-[2-тіеніл)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та 2-тіофенборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 303 (mН+). Приклад 21 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та 3-метоксифенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водної трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 327 (mН+). Приклад 22 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-метоксифеніл)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та 2-метоксифенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину: МС (ЕР+) 327 (mН+). Приклад 23 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-флуорфеніл)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та 4-флуорфенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 315 (mН+). Приклад 24 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-нафтилфуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксамід) та 2-нафталінборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат цезію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® С18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водної трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 347 (mН+). Приклад 25 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метилфеніл)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та 3-метилфенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат цезію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® С18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 311 (mН+). Приклад 26 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-фурил)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та 3-фуранборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат цезію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® С18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 287 (mН+). Приклад 27 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-фурил)фуран-2-карбоксамід) Суміш (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромфуран-2-карбоксаміду) (146мг), 2-(три-нбутилстаніл)фурану (0,15мл), трис(дибензиліденацетон)дипаладію(0)(13мг), хлориду літію (59мг) та три(отоліл)фосфін у (44мг) у 1,2-диметоксіетані (2мл) перемішували при кип'ятінні під зворотним холодильником в атмосфері азоту протягом 5 годин. Розчин фільтрували та випарювали. Сполуку очищали фільтруванням через твердофазний екстракційний патрон з силікагелем, використовуючи суміш насиченого аміаком метанолу з хлороформом як елюент, далі обернено-фазовою ВЕРХ на колонці Waters Bondapak® С18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину (59мг); МС (ЕР+) 287 (mН+). Приклад 28 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 29 з (R)-N-(,1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксамід) та 2-(три-н-бутилстаніл)піридин. Сполуку очищали фільтруванням через твердофазний екстракційний патрон з силікагелем, використовуючи суміш насиченого аміаком метанолу з хлороформом як елюент, далі обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Після сушки під вакуумом, дигідрохлорид потрібної сполуки отримали як світло-жовту тверду речовину; МС (ЕР+) 298 (mН+). Приклад 29 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та піридин-4-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 314 (mН+). Приклад 30 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-[3-піридил)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та піридин-3-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 14 (mH +). Приклад 31 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(2-піридил)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 27 з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) і 2-(три-н-бутилстаніл)піридину. Сполуку очищали фільтруванням через твердофазний екстракційний патрон з силікагелем, використовуючи суміш насиченого аміаком метанолу з хлороформом як елюент, далі обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Перекристалізація з суміші метанол /діетиловий етер дала дигідрохлорид потрібної сполуки як світложовту тверду речовин у; МС (ЕР+) 314 (mН+). Приклад 32 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-(2-піридил)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 27 з (R)-N-{1-азадицикло[2,2,2]окт-3-ил)(4бромтіофен-2-карбоксаміду) та 2-(три-н-бутилстаніл)піридину. Сполуку очи щали фільтруванням через твердофазний екстракційний патрон з силікагелем, використовуючи суміш насиченого аміаком метанолу з хлороформом як елюент, далі обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Після сушки під вакуумом, дигідрохлорид потрібної сполуки отримали як світло-жовту тверду речовину; МС (ЕР+) 314 (mН+). Приклад 33 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-(4-піридил)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4бромтіофен-2-карбоксаміду) та піридин-4-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водної трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1 Μ у діетиловому етері) додавали та розчин випарювали. Після сушки під вакуумом, дигідрохлорид потрібної сполуки отримали як безбарвну тверду речовину; МС (ЕР+) 314 (mН+) Приклад 34 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-[3-піридил)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4бромтіофен-2-карбоксаміду) та піридин-3-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 314 (mН+). Приклад 35 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-[3-(N-ацетиламіно)феніл)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та 3-(N-ацетиламіно)фенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Перекристалізація з суміші метанолу з діетиловим етером дала гідрохлорид потрібної сполуки як жовту тверду речовину; МС (ЕР+) 354 (mН+).; Приклад 36 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-нітрофеніл)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та 3-нітрофенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладію(0) та карбонат натрію у суміші диметилового етеру етиленгліколю та вод. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Перекристалізація з суміші метанолу з діетиловим етером дала гідрохлорид потрібної сполуки як жовту тверду речовину; МС (ЕР+) 342 (mН+). Приклад 37 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-3-трифлуорметилфеніл)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло(2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та 3-трифлуорметилфеніл-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладіи(0) та карбонат натрію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Після сушки під вакуумом, гідрохлорид потрібної сполуки отримали як безбарвну тверду речовину; МС (ЕР+) 365 (mН+). Приклад 38 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-хлорфент)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та 3-хлорфенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Після сушки під вакуумом, гідрохлорид потрібної сполуки отримали як безбарвну тверду речовину; МС (ЕР+) 331 (mН+). Приклад 39 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-ацетиламіно)феніл)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксамід)у та 3-(N-ацетиламіно)фенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 370 (mН+). Приклад 40 (R)-N-(1-(R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-флуорфеніл)тіофен-2-карбоксамід Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та 3-флуорфенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 331 (mН+). Приклад 41 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та 3-метоксифенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 343 (mН+). Приклад 42 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-етоксифеніл)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та 3-етоксифенілборонової кислот, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® С18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 357 (mН+). Приклад 43 (R)-N-(1 -азадициклоГ2.2.21окт-3-ил)(5-(3.5-диметилізоксазол-4-іл)фуран·2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксаміду) та 3,5 диметилізоксазоліл-4-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Перекристалізація з суміші метанолу з діетиловим етером дала гідрохлорид потрібної сполуки як безбарвну тверду речовину: МС (ЕР+) 316 (mН+). Приклад 44 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3,5-диметилізоксазол-4-ил)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та 3,5-диметилізоксазоліл-4-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Перекристалізація з суміші метанолу з діетиловим етером дала гідрохлорид потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 332 (mН+). Приклад 45 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та гідрохлориду 3-амінофенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1 Μ 50 у діетиловому етері) додавали та розчин випарювали. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як безбарвну тверду речовину: МС (ЕР+) 328 (mН+). Приклад 46 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридил)тіофен-3-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-3-карбоксаміду) та піридин-3-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Фракції з вмістом продукту далі випарювали та залишок розчиняли у метанолі. Надлишок розчину гідрогенхлориду (1Μ у діетиловому етері) додавали та розчин випарювали. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 314 МН+). Приклад 47 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-хлорфеніл)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-1-азадицикло[2,2,2]окт-3-иламіну дигідрохлориду та 5-(4-хлорфеніл)фуроєвої кислоти; сполуку очищали хроматографією на силікагелі, використовуючи суміш, насичений аміаком метанол/хлороформ як елюент; МС (ЕР+) 331, 333 (mН+). Приклад 48 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридинтіазол-3-карбоксамід) Суміш дигідрохлориду (R)-1-азадицикло[2,2,2]окт-3-иламіну (294мг). 2-(3-піридил)тіазол-4-карбонової кислоти (304мг), гідрату 1-гідроксибензотриазолу (199мг), тетрафлуорборату О-бензотриазол-1-іл-N,N,N¢,N¢тетраметилуронію (473г) та Ν,Ν-діізопропілетиламіну (1,0мл) у Ν,Ν-диметилформаміді (10мл) перемішували при кімнатній температурі протягом ночі. Розчин випарювали та залишок розподіляли між водним розчином гідроксиду натрію та хлороформом. Розчин випарювали та залишок очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчиненням залишку у метанолі, додавання надлишку розчину гідрогенхлориду (1Μ у діетиловому е тері) та випарюванням. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як безбарвну тверду речовину (428мг); МС (ЕР+) 315 (mН+). Приклад 49 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридинтіазол-3-карбоксамід) Суміш дигідрохлориду (R)-1-азадицикло[2,2,2]окт-3-иламіну (236мг), 2-(4-піридил)тіазол-4-карбонової кислоти (243мг), гідрату 1-гідроксибензотриазолу (\59мг), тетра флуорборату O-бензотриазол-1-іл-N,N,N¢,N¢тетраметилуронію (379мг) та Ν,Ν-діізопропілетиламіну (0,82мл) у Ν,Ν-диметилформаміді (10мл) перемішували при кімнатній температурі протягом ночі. Розчин випарювали та залишок розподіляли між водним розчином гідроксиду натрію та хлороформом. Розчин випарювали та залишок очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчиненням залишку у метанолі, додаванням надлишку розчину гідрогенхлориду (1Μ у діетиловому етері) та випарюванням. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохло-рид потрібної сполуки як безбарвну тверду речовину (428мг); МС (ЕР+) 315 (mН+). Приклад 50 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N,N-диметиламіно)феніл)-тіофен-2-карбоксамід) Формальдегід (37% розчин у воді, 0,18мл) додавали до розчину (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3амінофеніл)-тіофен-2-карбоксаміду) (92мг) у 1% оцтовій кислоті у метанолі (5мл). Через 30 хвилин при кімнатній температурі додавали ціаноборогідрид натрію (35мг) та реакційну суміш перемішували при кімнатній температурі протягом 1 години. Розчин випарювали та залишок очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчиненням залишку у метанолі, додаванням надлишку розчину гідрогенхлориду (1Μ у діетиловому етері) та випарюванням. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як безбарвну тверду речовину (54мг); МС (ЕР+) 356 (mН+). Приклад 51 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(8-хінолініл)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-aзaдицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та 8-хінолінборонової кислоти, тетракіс(трифенілфосфін)паладію(0), карбонату натрію у суміші ДМЕ та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчиненням залишку у метанолі, додаванням надлишку розчину гідрогенхлориду (1Μ у діетиловому е тері) та випарюванням. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 364 (mН+). Приклад 52 (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (S)-N-(1-aзaдицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та піридин-3-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчиненням залишку у метанолі, додаванням надлишку розчину гідрогенхлориду (1Μ у діетиловому етері) та випарюванням. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 314 (mН+). Приклад 53 (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(4-піридил)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, від (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та піридин-4-боронової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші 1,2-диметоксіетану та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® С18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчиненням залишку у метанолі, додаванням надлишку розчину гідрогенхлориду (1Μ у діетиловому етері) та випарюванням. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 314 (mН+). Приклад 54 (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-[2-піридил)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 27 з (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та 2-(три-н-бутилстаніл)піридину. Сполуку очищали флеш-хроматографією сумішшю з градієнтом елювали сумішшю 3,5 Η метанольного аміаку з хлороформом з градієнтом 5%-20% як елюентом. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчиненням залишку у метанолі, додаванням надлишку розчину гідрогенхлориду (1Μ у діетиловому е тері) та випарюванням. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 314 (mН+) Приклад 55 (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (S)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та фенілборонової кислоти, тетракіс(трифенілфосфін)паладію(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 313 (mН+). Приклад 56 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенілтіофен-3-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-aзaдицикло[2,2,2]окт-3-ил)(5бромтіофен-3-карбоксаміду) та фенілборонової кислоти, використовуючи те тракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® С18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водної трифлуороцтової кислоти як елюент. Випарювання фракцій з вмістом продукту дало трифлуорацетат потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 313 (mН+). Приклад 57 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4-фенілтіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(4бромтіофен-2-карбоксаміду) та фенілборонової кислоти, використовуючи те тракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчиненням залишку у метанолі, додаванням надлишку розчину гідрогенхлориду (1Μ у діетиловому етері) та випарюванням. Перекристалізація з етилацетату дала гідрохлорид потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 313 (mН+). Приклад 58 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-[3-ціанофеніл)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксамід) та 3-ціанофенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчинення залишку у метанолі, додавання надлишку розчину гідрогенхлориду (1Μ у діетиловому етері) та випарювання. Перекристалізація з суміші метанолу з діетиловим етером дала гідрохлорид потрібної сполуки як безбарвну тверду речовину; МС (ЕР+) 338 (mН+). Приклад 59 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N-метиламіно)феніл)тіофен-2-карбоксамід) Метоксид натрію (14мл, 0,5М розчин у метанолі) додавали до розчину (R)-N-(1-азадицикло[2,2,2]окт-3ил)(5-(3-амінофеніл)тіофен-2-карбоксаміду) (550мг) у метанолі (5мл), далі додавали параформальдегід (117мг). Суміш гріли при кип'ятінні під зворотним холодильником протягом 1 години. Після охолодження реакційної суміші до кімнатної температури, додавали борогідрид натрію (175мг) та розчин далі гріли при кип'ятінні під зворотним холодильником протягом 2 годин. Додавали водний розчин гідроксиду калію (1М, 1,4мл). Нагрівання при кип'ятінні під зворотним холодильником продовжували протягом 2 годин та реакційну суміш далі залишали при кімнатній температурі протягом 16 годин. Розчинник випарювали та залишок очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчиненням залишку у метанолі, додаванням надлишку розчину гідрогенхлориду (1Μ у діетиловому етері) та випарюванням. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як безбарвну тверду речовину (120мг); МС (ЕР+) 342 (mН+). Приклад 60 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-гідроксифеніл)тіофен-2-карбоксамід) До (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-метоксифеніл)тіофен-2-карбоксаміду) (900мг) додавали 48% водної гідробромідної кислоти (10мл) та льодяної оцтової кислоти (10мл). Після нагрівання при кип'ятінні під зворотним холодильником протягом 4 годин додавали насичений водний розчин карбонату натрію та твердий карбонат натрію для доведення рН до 10. Водний шар екстрагували хлороформом та поєднані екстракти сушили сульфатом магнію. Після фільтрування та випарювання, залишок очищали флеш-хроматографією, використовуючи суміші з градієнтом 5%-20% 3,5Μ метанольного аміаку з хлороформом як елюент. Отриманий продукт очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчиненням залишку у метанолі, додаванням надлишку розчину гідрогенхлориду (1Μ у діетиловому етері) та випарюванням. Перекристалізація з суміші метанолу з діетиловим етером дала гідрохлорид потрібної сполуки як безбарвну тверду речовину (32мг); МС (ЕР+) 329 (mН+). Приклад 61 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-піридиламіно)тіофен-2-карбоксамід) Суміш (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромтіофен-2-карбоксаміду) (315мг), 3-амінопіридину (188мг), трис(дибензиліденацетон)дипаладію(0) (46мг), рацемічного 2,2'-біс(дифенілфосфіно)-1,1'-динафтилу (62мг) та трет-бутоксиду натрію (192мг) у тетрагідрофурані (10мл) гріли при кип'ятінні під зворотним холодильником протягом 20h. Суміш фільтрували та залишок очищали флеш-хроматографією, використовуючи суміші 3,5Μ метанольного аміаку з хлороформом з градієнтом 5%-20% як елюент. Сполуку далі очищали оберненофазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчиненням залишку у метанолі, додаванням надлишку розчину гідрогенхлориду (1Μ у діетиловому етері) та випарюванням. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як жовту тверду речовину (77мг); МС (ЕР+) 329 (mН+). Приклад 62 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-G-хлорфеніл)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та 3-хлорфенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали фле ш-хроматографією, використовуючи суміші 3,5Μ метанольного аміаку з хлороформом з градієнтом 5%-20% як елюент з одержанням титульної сполуки як безбарвної твердої речовини; МС (ЕР+) 347 (mН+). Приклад 63 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(4-морфолініл)феніл)тіофен-2-карбоксамід) Суміш (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-хлорфеніл)тіофен-2-карбоксаміду) (0,98г), морфоліну (0,5мл), трис(дибензиліденацетон)дипаладію(0) (132мг), рацемічного 2,2'-біс(дифенілфосфіно)-1,1'-динафтилу (180мг) та трет-бутоксиду натрію (554мг) у тетрагідрофурані (25мл) гріли при кип'ятінні під зворотним холодильником протягом 20 години під азотом. Суміш фільтрували та залишок очищали флешхроматографією, використовуючи суміші 3,5Μ метанольного аміаку з хлороформом з градієнтом 5%-20% як елюент. Суміш далі піддавали обернено-фазовій ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчиненням залишку у метанолі, додаванням надлишку розчину гідрогенхлориду (1Μ у діетиловому етері) та випарюванням. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як тверду речовину (400мг); МС (ЕР+) 398 (mН+). Приклад 64 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(амінометил)феніл)тіофен-2-карбоксамід) До розчину (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-ціанофеніл)тіофен-2-карбоксаміду) (311мг) у метанолі та оцтової кислоти (1:1, 10мл) додавали каталітичну кількість 10% Pd-C та суміш гідрували при 50фунт/кв.дюйм протягом 36 години. Суміш фільтрували через шар броунмілериту. Залишок очищали спершу флеш-хроматографією, використовуючи суміші 3,5Μ метанольного аміаку з хлороформом з градієнтом 5%20% як елюент, далі обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Вільну основу отримували підлуженням фракцій з вмістом продукту та екстракцією у хлороформі, потім випарюванням потрібної сполуки (23мг); МС (ЕР+) 342 (mН+). Приклад 65 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-фенокситіофен-2-карбоксамід) До розчину (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-бромтіофен-2-карбоксаміду) (463мг) у піридині (10мл) додавали фенол (158мг), йодид купруму (32мг) та карбонат калію (97мг). Суміш перемішували при 125°С протягом 65 годин під азотом. Воду додавали та водний шар екстрагували хлороформом. Після випарювання залишок очищали флеш-хроматографією, використовуючи суміші 3,5Μ метанольного аміаку з хлороформом з градієнтом 5%-20% як елюент, далі обернено-фазовою ВЕРХ на колонці Waters Bondapak® C 18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Вільну основу отримували підлуженням фракцій з вмістом продукту та екстракцією у хлороформі, потім випарюванням до потрібної сполуки (80мг); МС (ЕР+) 329 (mН+). Приклад 66 ((R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)фуран-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5бромфуран-2-карбоксамід) та 3-амінофенілборонової кислоти, використовуючи тетракіс(трифенілфосфін)паладій(0) та карбонат натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали фле ш-хроматографією, використовуючи суміші 3,5Μ метанольного аміаку з хлороформом з градієнтом 5%-20% як елюент, далі обернено-фазовою ВЕРХ на колонці Waters Bondapak® С18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Вільну основу отримували підлуженням фракцій з вмістом продукту та екстракцією у хлороформі, потім випарюванням до потрібної сполуки; МС (ЕР+) 312 (mН+). Приклад 67 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(N,N-диметиламіно)феніл)-фуран-2-карбоксамід) До розчину (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-амінофеніл)фуран-2-карбоксаміду) (220мг) у 1% оцтовій кислоті у етанолі (10мл) формальдегід (0,26мл) додавали. Через 45 хвилин додавали ціаноборогідрид натрію (89мг). Суміш перемішували протягом 4 годин. Воду додавали та розчин підлужували до рН більше 10 додаванням твердого карбонату натрію. Водний шар екстрагували хлороформом та екстракти сушили сульфатом магнію, фільтрували та випарювали. Сполуку очищали флеш-хроматографією, використовуючи суміші 3,5Μ метанольного аміаку з хлороформом з градієнтом 5%-20% як елюент. Гідрохлорид отримували випарюванням фракцій з вмістом продукту, розчиненням залишку у метанолі, додаванням надлишку розчину гідрогенхлориду (1Μ у діетиловому етері) та випарюванням. Перекристалізація з суміші метанолу з діетиловим етером дала дигідрохлорид потрібної сполуки як тверду речовину (141мг); МС (ЕР+) 340 (mН+). Приклад 68 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-формілфеніл)тіофен-2-карбоксамід) Отримано способом, аналогічним описаному у прикладі 1, з (R)-N-(1-aзaдицикло[2,2,2]окт-3-ил)(5бромтіофен-2-карбоксаміду) та 3-формілфенілборонової кислоти, тетракіс(трифенілфосфін)паладію(0), карбонату натрію у суміші тетрагідрофурану, етанолу та води. Сполуку очищали обернено-фазовою ВЕРХ на колонці Waters Bondapak® C18, використовуючи суміші з градієнтом ацетонітрилу та 0,1% водного розчину трифлуороцтової кислоти як елюент. Вільну основу отримували підлуженням фракцій з вмістом продукту. Водний шар екстрагували хлороформом та випарювали до потрібної сполуки; МС (ЕР+) 341 (mН+). Приклад 69 (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-(гідроксиметил)феніл)тіофен-2-карбоксамід) До розчину (R)-N-(1-азадицикло[2,2,2]окт-3-ил)(5-(3-формілфеніл)тіофен-2-карбоксаміду) (875мг) у метанолі (15мл) додавали борогідрид натрію (97,2мг). Суміш далі перемішували при кімнатній температурі протягом 4 годин. Залишок розподіляли між водою та хлороформом. Екстракти сушили сульфатом магнію, фільтрували та випарювали, а залишок далі очищали флеш-хроматографією, використовуючи суміші 3,5Μ метанольного аміаку з хлороформом з градієнтом 5%-20% як елюент з одержанням титульної сполуки (547мг); МС (ЕР+) 343 (mН+).
ДивитисяДодаткова інформація
Назва патенту англійськоюDiarylcarboxamides
Назва патенту російськоюДиарилкарбоксамиды
МПК / Мітки
МПК: A61K 31/4709, A61P 43/00, A61P 25/04, A61P 25/22, A61K 31/4427, A61P 25/34, A61P 25/28, A61P 25/00, A61P 25/16, A61P 1/00, C07D 453/00, A61K 31/5377, A61P 25/24, C07D 487/08, A61K 31/439
Мітки: діарилкарбоксаміди
Код посилання
<a href="https://ua.patents.su/23-73540-diarilkarboksamidi.html" target="_blank" rel="follow" title="База патентів України">Діарилкарбоксаміди</a>
Попередній патент: Системно-комунікативний спосіб навчання іноземних мов
Наступний патент: Спосіб видалення лугів з пилу або суміші різних видів пилу
Випадковий патент: Теплоутилізатор-повітропідігрівач газотурбінної установки



























