Похідні карбамату хінуклідину та лікарські композиції, що містять названі похідні
Номер патенту: 76131
Опубліковано: 17.07.2006
Автори: Прат Квінонес Марія, Фернандез Форнер Марія Долорс, Буіл Альберо Марія Антонія
Формула / Реферат
1. Сполука, що являє собою карбамат формули (І):
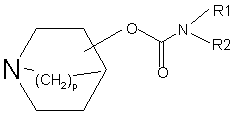 , (I)
, (I)
в якій:
R1 являє собою
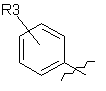 ,
,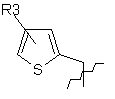 ,
,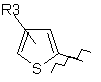 ,
,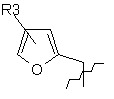 ,
,
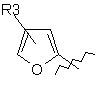 ,
,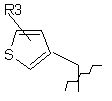 ,
,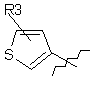 ,
,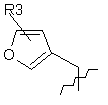 або
або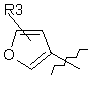 ,
,
R3 означає атом водню або галогену, або алкільну групу, яка містить 1-6 атомів вуглецю, з прямим або розгалуженим ланцюгом, або ціаногрупу;
R2 означає групу бензилу, фенетилу, фуран-2-ілметилу, фуран-3-ілметилу, тіофен-2-ілметилу або тіофен-3-ілметилу або алкільну групу, яка містить 3-8 атомів вуглецю, з прямим або розгалуженим ланцюгом, алкенільну групу, що містить від 3-8 атомів вуглецю, або циклоалкільну групу з 3-6 атомів вуглецю;
р дорівнює 1 або 2, а заміщення в азабіциклічному кільці може бути в положенні 2, 3 або 4, включаючи всі можливі конфігурації асиметричних атомів вуглецю;
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, що має формулою (II):
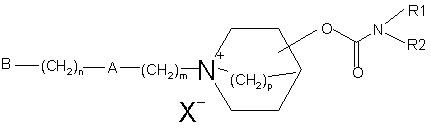 , (ІІ)
, (ІІ)
в якій Rl, R2 та р є такими, як визначено в п. 1;
m означає ціле число від 0 до 8;
А означає групу –СН2-, -CH=CR4-, -CR4=CH-, -CO-, -О-, -S-, -S(O)-, -SО2-, -NR4- або -CR4R5-, в яких R4 та R5, кожний незалежно означає атом водню, алкільну групу, яка містить 1-6 атомів вуглецю, з прямим або розгалуженим ланцюгом, або R4 та R5 разом утворюють аліциклічне кільце, яке містить 3-8 атомів вуглецю;
n відповідає цілому числу від 0 до 4;
В означає атом водню, алкоксигрупу, яка містить 1-6 атомів вуглецю, циклоалкільну групу, яка містить 3-6 атомів вуглецю, -COOR4 або -OOCR4, в яких R4 визначено як зазначено вище, або ціаногрупу, групу нафталінілу, групу 5, 6, 7, 8-тетрагідронафталінілу, біфенільну групу або групу формули (і) або (іі)
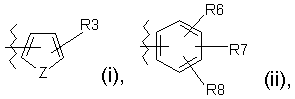
де Z означає О, N або S;
R3 визначено, як зазначено вище; та
R6, R7 та R8, кожний незалежно, означають атом водню або галогену, або групу гідрокси, фенілу, -OR4, -SR4, -NR4R5, -NHCOR4, -CONR4R5, -CN, -NO2, -COOR4 або -СF3, чи заміщену або незаміщену алкільну групу, яка містить 1-6 атомів вуглецю, з прямим або розгалуженим ланцюгом;
де R4 та R5, кожний незалежно, означають атом водню, алкільну групу, яка містить 1-6 атомів вуглецю, з прямим або розгалуженим ланцюгом, або R4 та R5 разом утворюють аліциклічне кільце, яке містить 3-8 атомів вуглецю, або R6 та R7 разом утворюють ароматичне кільце, яке містить 5-14 атомів вуглецю, аліциклічне кільце, яке містить 3-8 атомів вуглецю, або 3-10-членне гетероциклічне кільце; та
X- означає фармацевтично прийнятний аніон моно- або полівалентної кислоти.
3. Сполука за п. 1 або 2, в якій р дорівнює 2.
4. Сполука за будь-яким з пп. 1-3, в якій Rl означає групу фенілу, 4-фторфенілу, 4-метилфенілу, тіофен-2-ілметилу, тієнілу або фуран-2-ілметилу.
5. Сполука за будь-яким з попередніх пунктів, в якій R2 означає групу бензилу, тіофен-2-ілметилу, тіофен-3-ілметилу, фуран-2-ілметилу, фенетилу, пент-4-енілу, пентилу, бутилу, алілу або циклопентилу.
6. Сполука за будь-яким з пп. 2-5, в якій В являє собою атом водню або заміщену чи незаміщену групу фенілу, піролілу, тієнілу або фурилу, або групу біфенілу, нафталінілу, 5, 6, 7, 8-тетрагідронафталінілу або бензо[1,3]діоксолілу.
7. Сполука за п. 6, в якій В означає заміщену або незаміщену групу фенілу, та R6, R7 та R8, кожний незалежно, означають атом водню або галогену, або групу гідроксилу, метилу, -CH2OH, -ОМе, -NMe2, -NHCOMe, -CONH2, -CN, -NO2, -COOMe або -СF3.
8. Сполука за п. 7, де В означає групу фенілу, 4-фторфенілу або 3-гідроксифенілу.
9. Сполука за будь-яким з пп. 2-8, в якій n=0 або 1; m є ціле число від 1 до 6; та А означає групу -CH2-, -СН=СН-, -CO-, -NMe, -О- або -S-.
10. Сполука за п. 9, в якій m дорівнює 1, 2 або 3, а А означає групу -CH2-, -СН=СН- або -О-.
11. Сполука за будь-яким з пп. 2-10, в якій В-(СН2)n-А-(СН2)m- вибирають з групи 3-феноксипропілу, 2-феноксіетилу, 3-фенілалілу, фенетилу, 3-фенілпропілу, 3-(3-гідроксифенокси)пропілу, 3-(4-фторфенокси)пропілу, 3-тіофен-2-ілпропілу, 1-алілу та 1-гептилу.
12. Сполука за будь-яким з пп. 2-11, в якій Х- є аніон хлориду, броміду або трифторацетату.
13. Сполука за будь-яким з попередніх пунктів, в якій біциклічна група заміщена в положенні 3.
14. Сполука за п. 13, в якій замісник у положенні 3 має (R)-конфігурацію.
15. Сполука за будь-яким з попередніх пунктів, що є окремим (одиночним) ізомером.
16. Сполука за п. 1, яка є:
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір бензилфенілкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір бензил(4-фторфеніл)карбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір бензил-n-толілкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір бутилфенілкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір фенілтіофен-2-ілметилкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір фенетилфенілкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір пентилфенілкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір пент-4-енілфенілкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір фенілтіофен-3-ілметилкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір бутилтіофен-2-ілметилкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір біс-тіофен-2-ілметилкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір фуран-2-ілметил-2-тіофен-2-ілметилкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір алілтіофен-2-ілметилкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір циклопентилтіофен-2-ілметилкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір фуран-2-ілметилфенілкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-3-(R)иловий ефір біс-фуран-2-ілметилкарбамінової кислоти;
1-азабіцикло[2.2.1]гепт-4-(R)иловий ефір бензилфенілкарбамінової кислоти;
1-азабіцикло[2.2.2]окт-4-(R)иловий ефір бензилфенілкарбамінової кислоти; або її фармацевтично прийнятна сіль.
17. Сполука за п. 2, яка є:
3-(R)(бензилфенілкарбамоїлокси)-1-(3-фенілаліл)-1-азоніабіцикло[2.2.2]октан, бромід;
1-аліл-3-(R)(бензилфенілкарбамоїлокси)-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(бензилфенілкарбамоїлокси)-1-фенетил-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(бензилфенілкарбамоїлокси)-1-(3-тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(бензилфенілкарбамоїлокси)-1-(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(бензилфенілкарбамоїлокси)-1-(2-феноксіетил)-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(бензилфенілкарбамоїлокси)-1-(3-фенілаліл)-1-азоніабіцикло[2.2.2]октан, бромід;
1-аліл-3-(R)(бензилфенілкарбамоїлокси)-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(бутилфенілкарбамоїлокси)-1-(2-феноксіетил)-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(бутилфенілкарбамоїлокси)-1-[3-(3-гідроксифенокси)пропіл]-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(бутилфенілкарбамоїлокси)-1-[3-(4-фторфенокси)пропіл]-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(бутилфенілкарбамоїлокси)-1-(3-тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(бутилфенілкарбамоїлокси)-1-(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(фенілтіофен-2-ілметилкарбамоїлокси)-1-(3-тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід;
1-(2-феноксіетил)-3-(R)(фенілтіофен-2-ілметилкарбамоїлокси)-1-азоніабіцикло[2.2.2]октан, бромід;
1-аліл-3-(R)(фенілтіофен-2-ілметилкарбамоїлокси)-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(фенетилфенілкарбамоїлокси)-1-(2-феноксіетил)-1-азоніабіцикло[2.2.2]октан, трифторацетат;
1-гептил-3-(R)(пент-4-енілфенілкарбамоїлокси)-1-азоніабіцикло[2.2.2]октан, трифторацетат;
1-аліл-3-(R)(фенілтіофен-3-ілметилкарбамоїлокси)-1-азоніабіцикло[2.2.2]октан, трифторацетат;
3-(R)(фенілтіофен-3-ілметилкарбамоїлокси)-1-(3-тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід;
1-(2-феноксіетил)-3-(R)(фенілтіофен-3-ілметилкарбамоїлокси)-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(біс-тіофен-2-ілметилкарбамоїлокси)-1-(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід;
3-(R)(біс-тіофен-2-ілметилкарбамоїлокси)-1-(3-тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід;
1-аліл-3-(R)(алілтіофен-2-ілметилкарбамоїлокси)-1-азоніабіцикло[2.2.2]октан, трифторацетат;
3-(R)(циклопентилтіофен-2-ілметилкарбамоїлокси)-1-(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октан, трифторацетат;
3-(R)(фуран-2-ілметилфенілкарбамоїлокси)-1-(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октан, трифторацетат
або
1-аліл-3-(R)(біс-фуран-2-ілметилкарбамоїлокси)-1-азоніабіцикло[2.2.2]октан, трифторацетат.
18. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що має значення ІС50 (нМ) для мускаринових рецепторів М3 менше 35.
19. Сполука за будь-яким з пп. 1-18 для застосування в способі терапевтичного лікування людини або тварини.
20. Спосіб одержання карбамату формули (І)
 , (І)
, (І)
в якій Rl, R2 та р є такими, як визначено в будь-якому з пп. 1, 3-5 та 13-16, при якому здійснюють взаємодію сполуки формули (III):
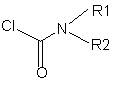 (ІІІ)
(ІІІ)
із сполукою формули (IV):
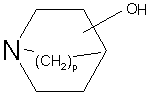 , (ІV)
, (ІV)
де Rl, R2 та р у формулах (III) та (IV) є такими, як визначено у будь-якому з пп. 1, 3-5 та 13-16.
21. Спосіб одержання солі формули (II):
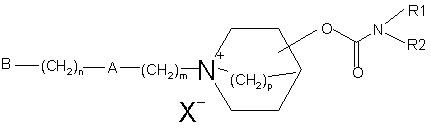 , (ІІ)
, (ІІ)
в якій Rl, R2, р, m, n, А, В і Х є такими, як визначено у будь-якому з пп. 1-17, при якому здійснюють кватернізацію атома азоту азабіциклічного кільця сполуки формули (І):
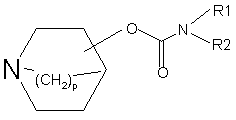 ,
,
де Rl, R2 та р є такими, як визначено у будь-якому з пп.1, 3-5 та 13-16,
з алкілувальним агентом формули (VI):
B(CH2)n-A-(CH2)m-W , (VI)
в якій m, n, А та В є такими, як визначено вище, a W означає відхідну групу.
22. Спосіб за п. 21, при якому W означає групу X, що визначена в п. 2 або 12.
23. Спосіб за п. 21 або п. 22, у якому одержану реакційну суміш очищають екстракцією твердої фази.
24. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-18 у суміші з фармацевтично прийнятним носієм або розріджувачем.
25. Спосіб лікування респіраторних, урологічних або шлунково-кишкових захворювань, при якому вводять людині або тварині, яка цього потребує, ефективну кількість сполуки за будь-яким з пп. 1-18.
26. Комбінований продукт, що містить
(і) сполуку за будь-яким з пп. 1-18; та
(iv) β2 – агоніст, стероїд, антиалергічний лікарський засіб, інгібітор фосфодіестерази IV та/або антагоніст лейкотриєну D4 (LTD4);
для одночасного, роздільного або послідовного застосування при лікуванні респіраторного захворювання.
Текст
1. Сполука, що являє собою карбамат формули (І): 3 або її фармацевтично прийнятна сіль. 2. Сполука за п. 1, що має формулою (II): 76131 R1 O B (CH2)n A (CH2)m N R2 + N O (CH2)p (ІІ) X , в якій Rl, R2 та р є такими, як визначено в п. 1; m означає ціле число від 0 до 8; А означає групу –СН2-, -CH=CR4-, -CR4=CH-, CO-, -О-, -S-, -S(O)-, -SО2-, -NR4- або -CR4R5-, в яких R4 та R5, кожний незалежно означає атом водню, алкільну групу, яка містить 1-6 атомів вуглецю, з прямим або розгалуженим ланцюгом, або R4 та R5 разом утворюють аліциклічне кільце, яке містить 3-8 атомів вуглецю; n відповідає цілому числу від 0 до 4; В означає атом водню, алкоксигрупу, яка містить 1-6 атомів вуглецю, циклоалкільну групу, яка містить 3-6 атомів вуглецю, -COOR4 або -OOCR4, в яких R4 визначено як зазначено вище, або ціаногрупу, групу нафталінілу, групу 5, 6, 7, 8тетрагідронафталінілу, біфенільну групу або групу формули (і) або (іі) R6 R3 R7 Z (i), R8 (ii), де Z означає О, N або S; R3 визначено, як зазначено вище; та R6, R7 та R8, кожний незалежно, означають атом водню або галогену, або групу гідрокси, фенілу, OR4, -SR4, -NR4R5, -NHCOR4, -CONR4R5, -CN, NO2, -COOR4 або -СF3, чи заміщену або незаміщену алкільну групу, яка містить 1-6 атомів вуглецю, з прямим або розгалуженим ланцюгом; де R4 та R5, кожний незалежно, означають атом водню, алкільну групу, яка містить 1-6 атомів вуглецю, з прямим або розгалуженим ланцюгом, або R4 та R5 разом утворюють аліциклічне кільце, яке містить 3-8 атомів вуглецю, або R6 та R7 разом утворюють ароматичне кільце, яке містить 514 атомів вуглецю, аліциклічне кільце, яке містить 3-8 атомів вуглецю, або 3-10-членне гетероциклічне кільце; та X- означає фармацевтично прийнятний аніон моно- або полівалентної кислоти. 3. Сполука за п. 1 або 2, в якій р дорівнює 2. 4. Сполука за будь-яким з пп. 1-3, в якій Rl означає групу фенілу, 4-фторфенілу, 4-метилфенілу, тіофен-2-ілметилу, тієнілу або фуран-2-ілметилу. 5. Сполука за будь-яким з попередніх пунктів, в якій R2 означає групу бензилу, тіофен-2ілметилу, тіофен-3-ілметилу, фуран-2-ілметилу, фенетилу, пент-4-енілу, пентилу, бутилу, алілу або циклопентилу. 6. Сполука за будь-яким з пп. 2-5, в якій В являє собою атом водню або заміщену чи незаміщену групу фенілу, піролілу, тієнілу або фурилу, або групу біфенілу, нафталінілу, 5, 6, 7, 8тетрагідронафталінілу або бензо[1,3]діоксолілу. 7. Сполука за п. 6, в якій В означає заміщену або незаміщену групу фенілу, та R6, R7 та R8, кожний незалежно, означають атом водню або галогену, або групу гідроксилу, метилу, -CH2OH, 4 ОМе, -NMe2, -NHCOMe, -CONH2, -CN, -NO2, COOMe або -СF3. 8. Сполука за п. 7, де В означає групу фенілу, 4фторфенілу або 3-гідроксифенілу. 9. Сполука за будь-яким з пп. 2-8, в якій n=0 або 1; m є ціле число від 1 до 6; та А означає групу CH2-, -СН=СН-, -CO-, -NMe, -О- або -S-. 10. Сполука за п. 9, в якій m дорівнює 1, 2 або 3, а А означає групу -CH2-, -СН=СН- або -О-. 11. Сполука за будь-яким з пп. 2-10, в якій В(СН2)n-А-(СН2)mвибирають з групи 3феноксипропілу, 2-феноксіетилу, 3-фенілалілу, фенетилу, 3-фенілпропілу, 3-(3гідроксифенокси)пропілу, 3-(4фторфенокси)пропілу, 3-тіофен-2-ілпропілу, 1алілу та 1-гептилу. 12. Сполука за будь-яким з пп. 2-11, в якій Х- є аніон хлориду, броміду або трифторацетату. 13. Сполука за будь-яким з попередніх пунктів, в якій біциклічна група заміщена в положенні 3. 14. Сполука за п. 13, в якій замісник у положенні 3 має (R)-конфігурацію. 15. Сполука за будь-яким з попередніх пунктів, що є окремим (одиночним) ізомером. 16. Сполука за п. 1, яка є: 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір бензилфенілкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір бензил(4фторфеніл)карбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір бензил-nтолілкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір бутилфенілкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір фенілтіофен-2-ілметилкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір фенетилфенілкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір пентилфенілкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір пент-4енілфенілкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір фенілтіофен-3-ілметилкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір бутилтіофен-2-ілметилкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір бістіофен-2-ілметилкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір фуран-2ілметил-2-тіофен-2-ілметилкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір алілтіофен-2-ілметилкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір циклопентилтіофен-2-ілметилкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір фуран-2ілметилфенілкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-3-(R)иловий ефір бісфуран-2-ілметилкарбамінової кислоти; 1-азабіцикло[2.2.1]гепт-4-(R)иловий ефір бензилфенілкарбамінової кислоти; 1-азабіцикло[2.2.2]окт-4-(R)иловий ефір бензилфенілкарбамінової кислоти; або її фармацевтично прийнятна сіль. 17. Сполука за п. 2, яка є: 3-(R)(бензилфенілкарбамоїлокси)-1-(3фенілаліл)-1-азоніабіцикло[2.2.2]октан, бромід; 5 76131 6 1-аліл-3-(R)(бензилфенілкарбамоїлокси)-118. Сполука за будь-яким з попередніх пунктів, азоніабіцикло[2.2.2]октан, бромід; яка відрізняється тим, що має значення ІС50 (нМ) 3-(R)(бензилфенілкарбамоїлокси)-1-фенетил-1для мускаринових рецепторів М3 менше 35. азоніабіцикло[2.2.2]октан, бромід; 19. Сполука за будь-яким з пп. 1-18 для застосу3-(R)(бензилфенілкарбамоїлокси)-1-(3-тіофен-2вання в способі терапевтичного лікування людиілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід; ни або тварини. 3-(R)(бензилфенілкарбамоїлокси)-1-(320. Спосіб одержання карбамату формули (І) R1 фенілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід; O N 3-(R)(бензилфенілкарбамоїлокси)-1-(2R2 (І) феноксіетил)-1-азоніабіцикло[2.2.2]октан, бромід; O N (CH2)p 3-(R)(бензилфенілкарбамоїлокси)-1-(3, фенілаліл)-1-азоніабіцикло[2.2.2]октан, бромід; в якій Rl, R2 та р є такими, як визначено в будь1-аліл-3-(R)(бензилфенілкарбамоїлокси)-1якому з пп. 1, 3-5 та 13-16, при якому здійснюють азоніабіцикло[2.2.2]октан, бромід; взаємодію сполуки формули (III): 3-(R)(бутилфенілкарбамоїлокси)-1-(2R1 феноксіетил)-1-азоніабіцикло[2.2.2]октан, бромід; Cl N 3-(R)(бутилфенілкарбамоїлокси)-1-[3-(3(ІІІ) R2 гідроксифенокси)пропіл]-1азоніабіцикло[2.2.2]октан, бромід; O 3-(R)(бутилфенілкарбамоїлокси)-1-[3-(4із сполукою формули (IV): фторфенокси)пропіл]-1-азоніабіцикло[2.2.2]октан, OH бромід; 3-(R)(бутилфенілкарбамоїлокси)-1-(3-тіофен-2N (CH2)p (ІV) ілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід; , 3-(R)(бутилфенілкарбамоїлокси)-1-(3де Rl, R2 та р у формулах (III) та (IV) є такими, як фенілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід; визначено у будь-якому з пп. 1, 3-5 та 13-16. 3-(R)(фенілтіофен-2-ілметилкарбамоїлокси)-1-(321. Спосіб одержання солі формули (II): тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, R1 бромід; O N R2 1-(2-феноксіетил)-3-(R)(фенілтіофен-2+ B (CH ) A (CH ) N (ІІ) O ілметилкарбамоїлокси)-1(CH ) азоніабіцикло[2.2.2]октан, бромід; X , 1-аліл-3-(R)(фенілтіофен-2в якій Rl, R2, р, m, n, А, В і Х є такими, як визнаілметилкарбамоїлокси)-1чено у будь-якому з пп. 1-17, при якому здійснюазоніабіцикло[2.2.2]октан, бромід; ють кватернізацію атома азоту азабіциклічного 3-(R)(фенетилфенілкарбамоїлокси)-1-(2кільця сполуки формули (І): феноксіетил)-1-азоніабіцикло[2.2.2]октан, триR1 фторацетат; O N R2 1-гептил-3-(R)(пент-4-енілфенілкарбамоїлокси)-1O N (CH2)p азоніабіцикло[2.2.2]октан, трифторацетат; 1-аліл-3-(R)(фенілтіофен-3, ілметилкарбамоїлокси)-1де Rl, R2 та р є такими, як визначено у будьазоніабіцикло[2.2.2]октан, трифторацетат; якому з пп.1, 3-5 та 13-16, 3-(R)(фенілтіофен-3-ілметилкарбамоїлокси)-1-(3з алкілувальним агентом формули (VI): тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, B(CH2)n-A-(CH2)m-W , (VI) бромід; в якій m, n, А та В є такими, як визначено вище, a 1-(2-феноксіетил)-3-(R)(фенілтіофен-3W означає відхідну групу. ілметилкарбамоїлокси)-122. Спосіб за п. 21, при якому W означає групу X, азоніабіцикло[2.2.2]октан, бромід; що визначена в п. 2 або 12. 3-(R)(біс-тіофен-2-ілметилкарбамоїлокси)-1-(323. Спосіб за п. 21 або п. 22, у якому одержану фенілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід; реакційну суміш очищають екстракцією твердої 3-(R)(біс-тіофен-2-ілметилкарбамоїлокси)-1-(3фази. тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, 24. Фармацевтична композиція, що містить спобромід; луку за будь-яким з пп. 1-18 у суміші з фармацев1-аліл-3-(R)(алілтіофен-2-ілметилкарбамоїлокси)тично прийнятним носієм або розріджувачем. 1-азоніабіцикло[2.2.2]октан, трифторацетат; 25. Спосіб лікування респіраторних, урологічних 3-(R)(циклопентилтіофен-2або шлунково-кишкових захворювань, при якому ілметилкарбамоїлокси)-1-(3-фенілпропіл)-1вводять людині або тварині, яка цього потребує, азоніабіцикло[2.2.2]октан, трифторацетат; ефективну кількість сполуки за будь-яким з пп. 13-(R)(фуран-2-ілметилфенілкарбамоїлокси)-1-(318. фенілпропіл)-1-азоніабіцикло[2.2.2]октан, три26. Комбінований продукт, що містить фторацетат (і) сполуку за будь-яким з пп. 1-18; та або (iv) β2 – агоніст, стероїд, антиалергічний лікарсь1-аліл-3-(R)(біс-фуран-2-ілметилкарбамоїлокси)кий засіб, інгібітор фосфодіестерази IV та/або 1-азоніабіцикло[2.2.2]октан, трифторацетат. антагоніст лейкотриєну D4 (LTD4); 2 n 2 m 2 p 7 76131 для одночасного, роздільного або послідовного хворювання. застосування при лікуванні респіраторного за Даний винахід стосується нових терапевтично ефективних похідних карбамату хінуклідину, до деяких способів їхнього одержання та до фармацевтичних композицій, що містять названі похідні. Нові сполуки відповідно до винаходу є антимускариновими агентами із сильною та довгостроково тривалою дією. Зокрема, названі сполуки виявляють високу спорідненість у відношенні домускаринових рецепторів М3. Згаданий підтип мускаринового рецептора присутній у залозах та гладкому м'язі та опосередковує збуджувальну дію парасимпатичної системи на секрецію залоз і скорочення вісцерального гладкого м'яза [Chapter 6, Cholinergic Transmission, in H.P. Rang et al., Pharmacology, Churchill Livingstone, New York, 1995]. Тому зрозуміло, що антагоністи М3 є ефективними при лікуванні захворювань, що характеризуються підвищеним тонусом парасимпатичної системи, надлишковою секрецією залоз або скороченням гладких м'язів [R.M. Eglen and S.S. Hegde, (1997), Drug News Perspect., 10 (8): 462-469]. Прикладами згаданого типу захворювань є респіраторні розлади, такі як хронічне обструктивне захворювання легень (COPD), бронхіт, підвищена реактивність бронхів, астма, кашель та риніт; урологічні розлади, такі як нетримання сечі, полакіурія, нейрогенний або нестабільний сечовий міхур, цистоспазм або хронічний цистит; шлунковокишкові розлади, такі як синдром подразненої товстої кишки, спастичний коліт, дивертикуліт і пептичні виразки; та серцево-судинні розлади, такі як вагус-індукована синусова брадикардія [Chapter 7, Muscarinic Receptor Agonists and Antagonists, in Goodman and Gilman's The Pharmacological Basis of Therapeutics, 10th edition, McGraw Hill, Ney York, 2001]. Сполуки за винаходом можуть бути використані самі по собі або в поєднанні з іншими лікарськими засобами, що звичайно вважаються ефективними для лікування перерахованих вище захворювань. Наприклад, їх можна вводити в поєднанні з 2-агоністами, стероїдами, протиалергічними лікарськими засобами, інгібіторами фосфодіестерази IV та/або антагоністами лейкотриєну D4 (LTD4) для одночасного, роздільного або послідовного застосування при лікуванні респіраторного захворювання. Пропоновані сполуки використовуються для лікування розглянутих вище респіраторних захворювань у комбінації з 2агоністами, стероїдами, протиалергічними лікарськими засобами або інгібіторами фосфодіестерази IV. Сполуки з близькою структурою описані в декількох патентах як спазмолітичні та антихолінергічні засоби. Наприклад, у заявці на патент ЕР 747355 описані похідні карбамату, що характеризуються на 8 ступною загальною формулою в якій кожен символ має наступне значення: кільце А означає кільце бензолу або піридину, кільце являє собою азотвмісне насичене гетерокільце, що може мати замісник при атомі азоту та яке може містити поперечний зв'язок, R1 означає фенільну групу, що може мати замісник, циклоалкільну або циклоалкенільну групу, що містить від 3 до 8 атомів вуглецю або п'яти- чи шестичленну азотвмісну гетероциклічну групу, X означає простий зв'язок або групу метилену, Υ означає простий зв'язок, карбонільну групу, метиленову групу, що може бути заміщена гідроксильною групою або групою, зображуваною формулою -S(O)1-, та 1 є цілим числом 0-2. Описані сполуки чітко відрізняються від сполук даного винаходу за їхніми структурними характеристиками, тому що вони завжди містять один водень при азоті карбаматного зв'язку. Крім того, в іншій заявці на патент ЕР 801067 описують сполуки, зображувані формулою в якій означає групу арилу, групу циклоалкілу, групу циклоалкенілу або групу гетероарилу, X означає простий зв'язок або групу метилену, 1 дорівнює 0 або 1, n дорівнює цілому числу 1 або 2. Описані сполуки також відрізняються від сполук, заявлених у даному винаході, тому що в них азот карбаматного зв'язку включений у циклічну структуру. У WO 01/04118 описані сполуки, що мають наступну загальну формулу 9 76131 10 в якій В являє собою групу формули (і) або (іі): мів вуглецю; m відповідає цілому числу від 0 до 8; А являє собою групу -СН2-, -CH=CR4-, CR4=CH-, -CO-, -0-, -S-, -S(О)-, SО2, -NR4- або групу -CR4R5-, у яких R4 та R5, кожний незалежно, означають атом водню, алкільну групу, яка містить 1-6 атомів вуглецю, з прямим або розгалуженим ланцюгом, або R4 та R5 разом утворюють аліциклічне кільце, що містить 3-8 атомів вуглецю; n означає ціле число від 0 до 4; В являє собою атом водню, алкоксигрупу, яка містить 1-6 атомів вуглецю, циклоалкільну групу, яка містить 3-6 атомів вуглецю, -COOR4 або A, , R1, R2, R3, m, n, р, X , Q, R8, R9 та OOCR4, у яких R4 є таким, як описано вище, або R10 описані в п.1 заявки, що цитується. ціаногрупу, групу нафталінілу, групу 5,6,7,8У даному винаході пропонуються нові сполуки, тетрагідро-нафталінілу, групу біфенілу або групу що є похідними карбамату хінуклідину, із сильною формули (і) або (іі) активністю антагоніста мускаринових рецепторів М3, що мають хімічну структуру, описану у формулі (І) або є їх фармацевтично прийнятними солями, включаючи солі формули (II). Формула (І) представляє карбамат наступної загальної структури: яка може бути кватернізована, щоб одержати фармацевтично прийнятну сіль карбамату формули (І), зокрема сіль загальної формули (II) в якій: R1 являє собою де R3 являє собою атом водню або галогену, або алкільну групу, яка містить 1-6 атомів вуглецю, з прямим або розгалуженим ланцюгом або ціаногрупу; R2 означає групу бензилу, фенетилу, фуран-2ілметилу, фуран-3-ілметилу, тіофен-2-ілметилу або тіофен-3-ілметилу, або алкільну групу, яка містить 3-8 атомів вуглецю, з прямим або розгалуженим ланцюгом, алкенільну групу, яка містить 3-8 атомів вуглецю, або циклоалкільну групу, що містить 3-6 атомів вуглецю; р дорівнює 1 або 2, а заміщення в біциклічному кільці може бути у 2, 3 або 4 положенні, включаючи всі можливі конфігурації асиметричних ато в якій Ζ означає O, N або S; R3 визначений як згадано вище; та R6, R7 та R8, кожний незалежно, означають атом водню або галогену, або гідроксигрупу, групу фенілу, -OR4, -SR4, -NR4R5, -NHCOR4, CONR4R5, -CN, -NO2. -COOR4 або -CF3. або заміщену або незаміщену алкільну групу, яка містить 1-6 атомів вуглецю, з прямим або розгалуженим ланцюгом, де R4 та R5, кожний незалежно, являють собою атом водню, алкільну групу, яка містить 1-6 атомів вуглецю, з прямим або розгалуженим ланцюгом, або R4 та R5 разом утворюють аліциклічне кільце, яке містить 3-8 атомів вуглецю; або R6 та R7 разом утворюють ароматичне кільце, що містить 5-14 атомів вуглецю, аліциклічне кільце, що містить 3-8 атомів вуглецю, або 3-10-членне гетероциклічне кільце; та X означає фармацевтично прийнятний аніон моно- або полівалентної кислоти. У сполуках четвертинного амонію даного винаходу, включаючи сполуки, представлені формулою (II), еквівалент аніона (X ) асоційований з позитивним зарядом атома N. X може бути аніоном різних мінеральних кислот, таким як, наприклад, хлорид, бромід, йодид, сульфат, нітрат, фосфат, або аніоном органічної кислоти, таким як, наприклад, ацетат, трифторацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат та п-толуолсульфонат. X переважно є аніоном, обраним із хлориду, броміду, йодиду, сульфату, нітрату, ацетату, малеату або оксалату сукцинату. Більш переважно, X означає хлорид, бромід, трифторацетат або метансульфонат. Наведені в описі групи нижчого алкілу та фрагменти, якщо не зазначено окремо, являють собою алкільні групи з прямим або розгалуженим ланцюгом, що містять від 1 до 6 атомів вуглецю, переважно від 1 до 4 атомів вуглецю. Переважні групи та 11 76131 12 фрагменти нижчого алкілу включають в себе меСполуки за даним винаходом, представлені тил, етил, н-пропіл, ізо-пропіл, н-бутил, втор-бутил формулою (І), та їхні солі, такі як представлені та трет-бутил. Згадані в описі алкільні групи, що формулою (II), що можуть мати один або кілька містять від 3 до 8 вуглеців, такі як групи, предстаасиметричних атомів вуглецю, включають в себе влені в групі R2, включають в себе н-пропіл, ізовсі можливі стереоізомери. Окремі ізомери та супропіл, н-бутил, втор-бутил, трет-бутил, пентил, міші ізомерів попадають у обсяг інтересів даного гексил, гептил та октил. винаходу. Згадані в описі, можливо заміщені групи нижПереважні карбамати формули (І) являють сочого алкілу включають в себе групи алкілу з прябою карбамати, в яких R1 означає групу фенілу, мим або розгалуженим ланцюгом, які містять від 1 тіофен-2-ілметилу, тієнілу або фуран-2-ілметилу, до 6, переважно від 1 до 4 атомів вуглецю, як згащо є незаміщеною (тобто, R3 означає водень). дано вище, що можуть бути незаміщеними або Однак, якщо R1 заміщений групою R3, що не є заміщеними в будь-якому положенні одним або воднем, замісник може знаходитися в положенні 2, декількома замісниками, наприклад 1, 2 або 3 за3, 4 або 5 або, якщо R1 означає групу фенілу, в місниками. Якщо є два або більше замісників, кожположенні 6. Коли R1 відповідає фенілу, замісник ний із замісників може бути тим самим або відрізпереважно знаходиться в положенні 4 кільця. Занятися. Замісник(и) звичайно являє собою місник R3 переважно означає водень, галоген або гідрокси- або алкоксигрупи. нижчий алкіл, переважно водень, фтор, хлор, меЗгадувані в описі групи алкенілу, що мають 3-8 тил або етил та особливо переважно водень, фтор атомів вуглецю, такі як групи, представлені в групі або метил. Приклади заміщених груп R1 включаR2, є групами з прямим або розгалуженим ланцюють в себе галоген-феніл, галоген-тіофен-2гом, такими як пропеніл, бутеніл, пентеніл, гексеілметил, галоген-тієніл, галоген-фуран-2-ілметил, ніл, гептеніл або октеніл з прямим або розгалуже(С1-4-алкіл)-феніл, (С1-4-алкіл) -тіофен-2-ілметил, ним ланцюгом. Подвійний зв'язок може (С1-4-алкіл)-тієніл або (С1-4-алкіл)-фуран-2-ілметил. знаходитися в будь-якому положенні в групі алкеКонкретні приклади включають у себе 4нілу, наприклад на кінцевому зв'язку відносно карфторфеніл, 4-метилфеніл, 4-хлорфеніл, 4баматної групи. етилфеніл, 3-метилфеніл, 3-фторфеніл, 3Згадувані в описі алкоксигрупи, такі як групи, хлорфеніл, 3-етилфеніл, фтортіофен-2-ілметил, представлені в групі В, звичайно означають групи фтортієніл та фторфуран-2-ілметил. Особливо нижчого алкокси, що є групами, що містять від 1 до переважні групи R1 включають у себе феніл, 46 атомів вуглецю, переважно від 1 до 4 атомів вугфторфеніл, 4-метилфеніл, тіофен-2-ілметил, тієніл лецю, з вуглеводневим ланцюгом, що є розгалута фуран-2-ілметил. женим або прямим. Переважні алкоксигрупи вклюПереважні групи R2 включають у себе бензил, чають в себе метокси, етокси, н-пропокси, ізотіофен-2-ілметил, тіофен-3-ілметил, фуран-2пропокси, н-бутокси, втор-бутокси та трет-бутокси. ілметил, фенетил, пент-4-еніл, пентил, бутил, аліл Згадувані в описі циклоалкільні групи та аліциабо циклопентил. клічні групи, якщо не зазначено окремо, звичайно Переважні групи -NR1R2 у формулі (І) містять містять від 3 до 8 атомів вуглецю, переважно від 3 у собі групи -N-(бензил)(феніл); -N-(бензил)(4до 6 атомів вуглецю. Групи циклоалкілу та аліцикфторфеніл); -N-(бензил)(п-толілфеніл); -Nлічні кільця з 3-6 атомів вуглецю включають в себе (бутил)(феніл); -N-(феніл)(тіофен-2-ілметил); -Nциклопропіл, циклобутил, циклопентил та циклоге(фенетил)(феніл); -N-(пентил)(феніл); -N-(пент-4ксил. еніл) (феніл); -N-(феніл) (тіофен-3-ілметил); -NАроматичне кільце, що згадується у зв'язку з (бутил) (тіофен-2-ілметил); -N-біс-тіофен-2R6 та R7, звичайно містить від 5 до 14, переважно ілметил; -N-(фуран-2-ілметил)(тіофен-2-ілметил); 5-10 атомів вуглецю. Приклади ароматичних груп N-(аліл)(тіофен-2-ілметил); -Nвключають в себе циклопентадієніл, феніл та на(циклопентил)(тіофен-2-ілметил); -N-(фуран-2фталініл. ілметил)(феніл) і N-біс-фуран-2-ілметил. Згадуване у зв'язку з R6 та R7 гетероциклічне Переважно, p дорівнює 2. Заміщення в азабікільце звичайно означає 3-10-членне кільце, таке цикло[2.2.2]октані переважно знаходиться в полояк 5- або 6-членне кільце, що містить один або женні 3. Заміщений атом вуглецю може мати (R)декілька гетероатомів, вибраних з N, S та О. Звиабо (S)-конфігурацію, переважно (R)-конфігурацію. чайно є присутніми 1, 2, 3 або 4 гетероатоми, пеНаступні сполуки загальної формули (І) призреважно 1 або 2 гетероатоми. Приклади гетероциначені для ілюстрації, а не обмеження рамок даноклічних кілець включають в себе піперидил, го винаходу. піролідил, азетидиніл, азиридил, піперазиніл, 1-азабіцикло[2.2.2]окт-3-(R)іловий ефір бензиморфолініл, тіоморфолініл, піроліл, імідазоліл, лфенілкарбамінової кислоти імідазолідиніл, піразолініл, індолініл, ізоіндолініл, 1-азабіцикло[2.2.2]окт-3-(R)іловий ефір бенпіридил, піразиніл, піримідиніл, піридазиніл, індозил(4-фторфеніл)карбамінової кислоти лізиніл, ізоіндоліл, індоліл, індазоліл, пуриніл, хі1-азабіцикло[2.2.2]окт-3-(R)іловий ефір беннолізиніл, ізохіноліл, хіноліл, фталазиніл, нафтирізил-п-толілкарбамінової кислоти диніл, хіноксалініл, хіназолініл, циннолініл, 1-азабіцикло[2.2.2]окт-3-(R)іловий ефір бутилптеридиніл, хінукідиніл, триазоліл, піразоліл, триафенілкарбамінової кислоти золіл, тетразоліл та тієніл. 1-азабіцикло[2.2.2]окт-3-(R)іловий ефір фенілАтом галогену представляє собою атом фтотіофен-2-ілметилкарбамінової кислоти ру, хлору, брому або йоду, звичайно атом фтору, 1-азабіцикло[2.2.2]окт-3-(R)іловий ефір фенехлору або брому. тилфенілкарбамінової кислоти 13 76131 14 1-азабіцикло[2.2.2]окт-3-(R)іловий ефір пентидо 6, зокрема 1, 2 або 3; а А означає групу -СН2-, лфенілкарбамінової кислоти СН=СН-, -CO-, -NMe-, -О- або -S-, зокрема групу 1-азабіцикло[2.2.2]окт-3-(R)іловий ефір пент-4СН2-, -СН=СН- або -O-. Приклади придатних груп енілфенілкарбамінової кислоти (СН2)m-А-(СН2)n- включають метилен, етилен, алі1-азабіцикло[2.2.2]окт-3-(R)іловий ефір феніллен, н-пропілен, і-пропілен, бутилен, 4-метилпенттіофен-3-ілметилкарбамінової кислоти 3-енілен, гептилен, етиленокси, пропіленокси, бу1-азабіцикло[2.2.2]окт-3-(R)іловий ефір бутилтиленокси, сульфаноілпропілен, метиламінопропітіофен-2-ілметилкарбамінової кислоти лен та 4-оксобутилен, переважно метилен, ети1-азабіцикло[2.2.2]окт-3-(R)іловий ефір біслен, алілен, н-пропілен, ізо-пропілен, гептилен, тіофен-2-ілметилкарбамінової кислоти етиленокси або пропіленокси. 1-азабіцикло[2.2.2]окт-3-(R)іловий ефір фуранБільш переважними солями формули (II) є со2-ілметил-2-тіофен-2-ілметилкарбамінової кислоти лі, в яких група азоніабіцикло заміщена при атомі 1-азабіцикло[2.2.2]окт-3-(R)іловий ефір алілтіазоту групою 3-феноксипропілу, 2-феноксіетилу, 3офен-2-ілметилкарбамінової кислоти фенілалілу, фенетилу, 4-фенілбутилу, 31-азабіцикло[2.2.2]окт-3-(R)іловий ефір циклофенілпропілу, 3-[2-гідроксифенокси]пропілу, 3-[4пентилтіофен-2-ілметилкарбамінової кислоти фторфенокси]пропілу, 2-бензилоксіетилу, 3-пірол1-азабіцикло[2.2.2]окт-3-(R)іловий ефір фуран1-ілпропілу, 2-тієн-2-ілетилу, 3-тієн-2-ілпропілу, 32-ілметилфенілкарбамінової кислоти феніламінопропілу, 3-(метилфеніламіно)пропілу, 1-азабіцикло[2.2.2]окт-3-(R)іловий ефір біс3-фенілсульфанілпропілу, 3-о-толілоксипропілу, 3фуран-2-ілметилкарбамінової кислоти (2,4,6-триметилфенокси)пропілу, 3-(2-трет-бутил1-азабіцикло[2.2.2]окт-3-(R)гепт-4-іловий ефір 6-метилфенокси)пропілу, 3-(біфеніл-4бензилфенілкарбамінової кислоти ілокси)пропілу, 3-(5,6,7,8-тетрагідронафталін-21-азабіцикло[2.2.2]окт-3-(R)окт-4-іловий ефір ілокси)пропілу, 3-(нафталін-6-ілокси)пропілу, 3бензилфенілкарбамінової кислоти (нафталін-1-ілокси)пропілу, 3-(2та їх фармацевтично прийнятні солі. хлорфенокси)пропілу, 3-(2,4Переважними солями формули (II) є солі, що дифторфенокси)пропілу, 3-(3відповідають переважним визначенням R1, R2, трифторметилфенокси)пропілу, 3-(3NR1R2 та р, як для формули (І) вище, та ті, що ціанофенокси)пропілу, 3-(4-ціанофенокси)пропілу, мають таку ж локалізацію та конфігурацію замісни3-(3-метоксифенокси)пропілу, 3-(4ка на азоніабіциклічному кільці. метоксифенокси)пропілу, 3-(бензо[1,3]діоксол-5Крім того, переважно, щоб В являв собою ілокси)пропілу, 3-(2-карбамоїлфенокси)пропілу, 3атом водню або заміщену або незаміщену групу (3-диметиламінофенокси)-пропілу, 3-(4фенілу, піролілу, тієнілу або фурилу, або групу нітрофенокси)пропілу, 3-(3-нітрофенокси)пропілу, біфенілу, нафталінілу, 5,6,7,83-(4-ацетиламінофенокси)пропілу, 3-(3тетрагідронафталінілу або групу бенметоксикарбонілфенокси)пропілу, 3-[4-(3зо[1,3]діоксолілу, зокрема заміщену або незаміщегідроксипропіл)-фенокси]пропілу, 3-(2ну групу фенілу або тієнілу, таку як група 2-тієнілу гідроксиметилфенокси)пропілу, 3-(3або група 3-тієнілу, особливо група 2-тієнілу. гідроксиметилфенокси)пропілу, 3-(4Група тієнілу, піролілу або фурилу може бути гідроксиметилфенокси)-пропілу, 3-(2незаміщеною або заміщеною групою R3, що опигідроксифенокси)пропілу, 3-(4-гідроксифенокси)сана вище. Заступник може знаходитися в полопропілу, 3-(3-гідроксифенокси)пропілу, 4-оксо-4женні 2, 3, 4 або 5 на кільці. тієн-2-ілбутилу, 3-(1-метил-[1Н]-імідазол-2Група фенілу може бути незаміщеною або заілсульфаніл)пропілу, 3-(бензотіазол-2міщеною однією, двома або трьома групами (R6ілокси)пропілу, 3-бензилоксипропілу, 6-(4R8), що можуть знаходитися у будь-якому полофенілбутокси)гексилу, 4-феноксибутилу або 2женні на кільці. Звичайно група фенілу незаміщена бензилоксіетилу. Особливо переважними солями або заміщена однією групою, наприклад, у полоє солі, в яких група азоніабіцикло заміщена по женні 2, 3 або 4. Переважно, замісники R6, R7 та атому азоту групою 3-феноксипропілу, 2R8, кожний незалежно, являють собою атом водфеноксіетилу, 3-фенілалілу, фенетилу, 3ню або галогену або групу гідроксилу, метилу, фенілпропілу, 3-(3-гідроксифенокси)пропілу, 3-(4терт-бутилу, -СН2ОН, 3-гідроксипропілу, -ОМе, фторфенокси)пропілу, 3-тіофен-2-ілпропілу, 1NMe2, -NHCOMe, -CONH2, -CN, -NO2, -COOMe або алілу або 1-гептилу. -CF3, або R6 та R7 разом утворюють 5- або 6Наступні солі загальної формули (II) призначленне кільце, таке як кільце фенілу або тіазолілу. чені для ілюстрації, а не обмеження рамок даного Більш переважно, R6, R7 та R8 означають атом винаходу. водню або галогену або групу гідроксилу, метилу, 3-(R)(Бензилфенілкарбамоїл-окси)-1-(3СН2ОН, -ОМе, -NMe, -NHCOMe, -CONH2, -CN, NO2, фенілаліл)-1-азоніабіцикло[2.2.2]октан, бромід -COOMe або -CF3, особливо атом водню, гідрокси1-Аліл-3-(R)(бензилфенілкарбамоїл-окси)-1групу або атом галогену, де атом галогену переазоніабіцикло[2.2.2]октан, бромід важно є фтором. Прикладами заміщених груп фе3-(R)(Бензилфенілкарбамоїл-окси)-1-фенетилнілу, що можуть представляти В, є толіл, 1-азоніабіцикло[2.2.2]октан, бромід включаючи о-, м- та п-толіл, 3-ціанофеніл, 2-, 3- та 3-(R)(Бензилфенілкарбамоїл-окси)-1-(34-гідроксифеніл, 2-, 3- та 4-фторфеніл та бензотіатіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, золіл. Особливо переважно В означає групу фенібромід лу, 4-фторфенілу або 3-гідроксифенілу. 3-(R)(Бензилфенілкарбамоїл-окси)-1-(3Звичайно, n=0 або 1; m є цілим числом від 1 фенілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід 15 76131 16 3-(R)(Бензилфенілкарбамоїл-окси)-1-(2феноксіетил)-1-азоніабіцикло[2.2.2]октан, бромід 3-(R)(Бутилфенілкарбамоїл-окси)-1-(3фенілаліл)-1-азоніабіцикло[2.2.2]октан, бромід 1-Аліл-3-(R)(бутилфенілкарбамоїл-окси)-1азоніабіцикло[2.2.2]октан, бромід 3-(R)(Бутилфенілкарбамоїл-окси)-1-(2феноксіетил)-1-азоніабіцикло[2.2.2]октан, бромід У формулах (I), (III) та (IV) R1, R2 та p є таки3-(R)(Бутилфенілкарбамоїл-окси)-1-[3-(3ми, як установлено вище. гідроксифенокси)пропіл]-1Сполуки загальної формули (III) можуть бути азоніабіцикло[2.2.2]октан, бромід одержані з відповідних вторинних амінів за стан3-(R)(Бутилфенілкарбамоїл-окси)-1-[3-(4дартним способом (b), описаним у літературі. фторфенокси)пропіл]-1-азоніабіцикло[2.2.2]октан, бромід 3-(R)(Бутилфенілкарбамоїл-окси)-1-(3-тіофен2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід 3-(R)(Бутилфенілкарбамоїл-окси)-1-(3фенілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід 3-(R)(Фенілтіофен-2-ілметилкарбамоїл-окси)1-(3-тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід Аміни загальної формули (V) , що не постав1-(2-Феноксіетил)-3-(R)(фенілтіофен-2ляються комерційно, одержані в результаті синтеілметилкарбамоїл-окси)-1зу за стандартними способами. Наприклад, аміни, азоніабіцикло[2.2.2]октан, бромід в яких R1 означає тіофен-2-ілметил, a R2 є таким, 1-Аліл-3-(R)(фенілтіофен-2-ілметилкарбамоїляк визначено вище, одержують гідроалкілуванням. окси)-1-азоніабіцикло[2.2.2]октан, бромід Відповідний альдегід обробляють придатним пер3-(R)(Фенетилфенілкарбамоїл-окси)-1-(2винним аміном для утворення іміну, що його відфеноксіетил)-1-азоніабіцикло[2.2.2]октан, трифтоновлюють боргідридом натрію, щоб одержати вторацетат ринний амін. 1-Гептил-3-(R)(пент-4-енілфенілкарбамоїлКарбамати формули (І) можуть бути перетвоокси)-1-азоніабіцикло[2.2.2]октан, трифторацетат рені на фармацевтично прийнятні солі за спосо1-Аліл-3-(R)(фенілтіофен-3-ілметилкарбамоїлбами, відомими у даній галузі. Зазвичай карбамат окси)-1-азоніабіцикло[2.2.2]октан, трифторацетат формули (І) обробляють неорганічною або органі3-(R)(Фенілтіофен-3-ілметилкарбамоїлокси)-1чною кислотою, як-от фумарова, винна, бурштино(3-тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, ва або хлористоводнева кислота. бромід Похідні четвертинного амонію загальної фор1-(2-Феноксіетил)-3-(R)(фенілтіофен-3мули (II) можна одержувати реакцією алкілувальілметилкарбамоїлокси)-1ного агента загальної формули (VI) зі сполуками азоніабіцикло[2.2.2]октан, бромід загальної формули (І). У формулах (І) , (II) та (VI), 3-(R)(Біс-тіофен-2-ілметилкарбамоїлокси)-1-(3R1, R2, А, В, X, n, m, та p є такими, як описано вифенілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід ще. 3-(R)(Біс-тіофен-2-ілметилкарбамоїлокси)-1-(3тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід 1-Аліл-3-(R)(алілтіофен-2ілметилкарбамоїлокси)-1азоніабіцикло[2.2.2]октан, трифторацетат 3-(R)(Циклопентилтіофен-2ілметилкарбамоїлокси)-1-(3-фенілпропіл)-1азоніабіцикло[2.2.2]октан, трифторацетат 3-(R)(Фуран-2-ілметилфенілкарбамоїл-окси)-1(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октан, трифторацетат 1-Аліл-3-(R)(біс-фуран-2-ілметилкарбамоїлокси)-1-азоніабіцикло[2.2.2]октан, трифторацетат. У даному винаході також пропонуються способи одержання сполук формул (І) та (II). Сполуки загальної формули (І) можна одержувати за способом (а), який проілюстровано у наступній схемі та докладно описано у експериментальному розділі. У формулі (VI) W відповідає будь-якій придатній відхідній групі, як-от група X, що описана вище. Переважно, W представляє групу X. Згадана реакція алкілування може бути проведена за двома різними експериментальними способами, (с) та (d), що описуються нижче. Зокрема, спосіб (d) являє собою новий експериментальний спосіб, що використовує технологію екстракції твердої фази, що допускає паралельне 17 76131 18 одержання декількох сполук. Якщо W являє собою азабіцикло[2.2.2]октану та продовжували перемігрупу іншу, ніж X, сіль четвертинного амонію форшування протягом 2 годин, і протягом цього часу мули (II) одержують з продукту способу (с) або (d) весь натрій вступав у реакцію з утворенням алкоза допомогою проведення реакції обміну за станголяту. Потім повільно додавали 6,00г (28,30ммоль) фенілбутилкарбамілхлориду, розчидартними способами, щоб замінити аніон W нененого в 30мл толуолу. Суміш кип'ятили зі зворотобхідним аніоном X . ним холодильником протягом однієї години, а поСпособи (с) та (d) описуються в експериментім реакційну суміш перемішували протягом усієї тальному розділі. Сполуки загальної формули (VI), ночі при кімнатній температурі. Суспензію фільтщо не поставляються комерційно, одержані в рерували та фільтрат випарювали. До залишку дозультаті синтезу за стандартними способами. Надавали простий ефір та перемішували протягом приклад, сполуки, у яких n=0, а А = -О-, -S- або 10 хвилин. Суспензію фільтрували та фільтрат NR4, де R4 визначений, як зазначено вище, одерконцентрували у вакуумі з одержанням 7,18г корижують у результаті реакції відповідної ароматичної чневої олії. Отриманий продукт очищали методом похідної або її калієвої солі з алкілувальнимагенколоночної хроматографії (силікагель, хлоротом загальної формули Y-(CH2)m-X, у якій X може форм/етанол/аміак 140:8 1) з одержанням 1,78г бути галогеном, a Y може бути галогеном або (5,89ммоль) (22%) чистого продукту, структуру складним сульфонатним ефіром. В інших приклапідтверджували 1Н-ЯМР. 300МГц, (CDCl3): 0,9 (м, дах сполуки загальної формули (VI), в якій n>=1, 3Н), 1,3 (м, 4Н), 1,5 (м, 4Н), 1,9 (с, 1Н), 2,7 (м, 5Н , синтезували за відомими способами з відповідного 3,2 (м, 1Η), 3,7 (м, 2Η), 4,7 (м, 1Η), 7,2-7,4 (м, 5Η); похідного спирту загальної формули (VII) МС[М+1]+: 303. В-(СН2)n-А-(CH2)m-OH (VII) Приклад 150 Одержання 1Сполуками формули (IV) можуть бути: азабіцикло[2.2.2]οκτ-3-(R)ілового ефіру циклопент4-гідрокси-1-азабіцикло[2.2.1]гептан, описаний рілтіофен-2-ілметилкарбамінової кислоти. у W093/15080 0,57г (24,59ммоль) натрію додавали до 70мл 4-гідрокси-1-азабіцикло[2.2.2]октан, описаний сухого толуолу. Суспензію кип'ятили зі зворотним [Grob, C.А. et.al. Helv. Chim. Acta (1958), 41, 1184холодильником при енергійному перемішуванні. 1190]. Коли весь натрій розплавлявся, додавали 3,11г 3(R)-гідрокси-1-азабіцикло[2.2.2]октан чи 3(S)(24,42ммоль) (R)-3-гідрокси-1гідрокси-1-азабіцикло[2.2.2]октан, описані азабіцикло[2.2.2]октану та перемішували протягом [Ringdahl, R. Acta Pharm Suec. (1979), 16, 281-283] 2 годин і протягом цього часу весь натрій вступав та комерційно поставляється фірмою CU Chemie у реакцію з утворенням алкоголяту. Потім повільно Uetikon Gmb. додавали 4,96г (20,35ммоль) циклопентилтіофенСтруктури отриманих сполук підтверджували 2-ілметилкарбамілхлориду, розчиненого в 30мл методами 1Н-ЯМР та МС. Спектри ЯМР реєструтолуолу. Суміш кип'ятили зі зворотним холодильвали, використовуючи прилад Varian 300МГц, та ником протягом п'яти годин, а потім реакційну сухімічні зрушення виражали як мільйонні частки ( ) міш перемішували протягом усієї ночі при кімнатщодо внутрішнього стандарту - тетраметилсилану. ній температурі. Суспензію фільтрували та Чистоту сполук визначали за допомогою ВЭЖХ, фільтрат промивали водою. Органічний шар екствикористовуючи хроматографію зі зверненою фарагували 20% НСІ, а водний шар підлужували 8н зою на приладі Waters, та одержували величини NaOH та екстрагували етилацетатом. Органічний вище 95%. Молекулярні іони одержували електрошар промивали водою, висушували над безводрозпорошувальною іонізаційною масним Na2SO4 та упарювали. Отриману олію (4,50г) спектрометрією на приладі Hewlett Packard. Досліочищували методом колонної хроматографії (силідження ВЭЖХ-МС проводили на приладі Gilson, кагель, хлороформ/етанол/аміак 225:8:1) з одеробладнаному бінарним насосом (поршневий насос жанням 2,25г (6,73ммоль) (33%) чистого продукту, Gilson 321); вакуумним дегазатором (Gilson 864); структуру підтверджували 1Н-ЯМР. 300МГц, інжектором - колектором фракцій (рідинний мані(DMSO-d6): 1,20-1,40 (м, 1Η), 1,45-1,72 (м, 11Н), пулятор Gilson 215); двома ін'єкційними модулями, 1,89 (уш.с, 1Н), 2,45-2,62 (м, 5Η), 3,30-3,10 (м, 1Η), аналітичним та препаративним (Gilson 819); кла4,22 (уш.с, 1Η), 4,50-4,63 (м, 3Н), 6,93-6,99 (м, 2Н), паном (Gilson Valvemate 7000); поділяючим при7,38 (м, 1Η); МС[М+1]+: 335. строєм 1/1000 (Acurate by LC Packings); насосом, Приклад 159 Одержання 1що подає, (Gilson 307); діодним детектором (Gilson азабіцикло[2.2.1]гепт-4-ілового ефіру бензилфені170) та детектором МС (Thermoquest Finnigan aQa, лкарбамінової кислоти. квадрупольний мас-спектрометр з іонізаційними У двогирлову колбу в атмосфері азоту помірежимами ES (електророзпорошування) та ACPI щали 3мл ТГФ та 150мг (1,33ммоль) 4-гідрокси-1(хімічна іонізація при атмосферному тиску). ВЭЖХазабіцикло[2.2.1]гептану. Суспензію охолоджували МС контролювали за допомогою IBM PC. до -60°С и по краплях додавали 0,7мл (1,46ммоль) Спосіб (а) діізопропіламіду літію (LDA). Після додавання доПриклад 54 Одержання 1зволяли температурі підвищуватися до 0°С і підтазабіцикло[2.2.2]окт-3-(R)ілового ефіру бутилфеніримували протягом двох годин. Протягом 30 хвилкарбамінової кислоти. лин додавали розчин 295мг (1,20ммоль) 0,65г (28,50ммоль) натрію додавали до 70мл бензилфенілкарбамілхлориду в 2мл ТГФ. Реакційсухого толуолу. Суспензію кип'ятили зі зворотним ну суміш залишали для повільного нагрівання до холодильником при енергійному перемішуванні. кімнатної температури та перемішували протягом Коли весь натрій розплавлявся, додавали 3,60г 18 годин. Суспензію фільтрували, а фільтрат кон(28,30ммоль) (R)-3-гідрокси-1 19 76131 20 центрували при зниженому тиску. Залишок екстра(м, 6Н), 2,34 (уш.с, 1Н), 2,82 (м, 2Н), 3,21-3,46 (м, гували дихлорметаном та водою. Органічний шар 7Н), 3,89 (м, 1Н), 4,54 (м, 4Н), 5,06 (м, 1Н), 6,95екстрагували 2н НСІ, а водний шар підлужували 7,01 (м, 4Н), 7,07-7,11 (м, 2Н), 7,38-7,49 (м, 3Н); 8н NaOH та екстрагували дихлорметаном. ОрганіМС [М-Вr]+: 487; температура 143°С. чні шари висушували над безводним Na2SO4 та Спосіб (d) упарювали. Отриману олію (162мг) очищали меПриклад 133 - Одержання 1-гептил-3тодом ВЭЖХ-МС з одержанням 4,86мг (R)(фенілтіофен-3-ілметилкарбамоїлокси)-1(0,015ммоль) продукту у вигляді форміату з 1,3% азоніабіцикло[2.2.2]октану, трифторацетату чистоти, структуру підтверджували 1Н-ЯМР. 30мг (0,08ммоль) 1-азабіцикло[2.2.2]окт-3(R)ілового ефіру фенілтіофен-3300МГц, (DMSO-d6): 1,86 (м, 4Н), 2,65 (с, 2Н), ілметилкарбамінової кислоти розчиняли в 1мл 2,77 (уш.с, 2Н), 3,03 (уш.с, 2Н), 4,84 (с, 2Н), 7,14ДМСО. До отриманого розчину додавали 75мг 7,32 (м, 10Н), 8,19 (с, 1Н); МС [М-НСОО]+: 323. (0,40ммоль) гептилбромиду. Після перемішування Спосіб (b) протягом ночі при кімнатній температурі суміш Карбамоїлхлориди загальної формули (III) очищали екстракцією твердої фази з використанодержували у відповідності зі способами, описаням катіонообмінного картриджу Mega Bond Elut, ними в літературі: [М. Saraswati et al., Drug попередньо урівноваженого 0,1Μ NаН2РO4Development Research (1994), 31, 142-146; G.M. буфером при рН=7,5. Реакційну суміш наносили Shutske et al., J. Heterocycl. Chem. (1990), 27, 1617; на картридж та промивали спочатку 2мл ДМСО, а GB 1246606; US 2762796]. потім три рази 5мл CH3CN, вимиваючи усі вихідні Приклад l-1 - Одержання бутилфенілкарбамоматеріали. Похідну амонію елюювали 5мл 0,03Μ їлхлориду розчину ТФОК у суміші CH3CN:CHCI3 (2:1). ОтриДо розчину 6,72г (45ммоль) бутилфеніламіну в маний розчин нейтралізували 300мг полі (450мл хлористого метилену, охолодженого до вінілпіридином), фільтрували та випарювали насу10°С, при перемішуванні повільно додавали 6,67г хо. (22,5ммоль) трифосгену в 40мл хлористого метиВихід складав 12мг (34%) зазначеної в загололену. Реакція протікала при кімнатній температурі протягом 27 годин. Розчинник випарювали, а завку сполуки. 1Н-ЯМР (DMSO-d6): 0,88 (м, 3Н), лишок двічі екстрагували н-гексаном. Органічний 1,28 (м, 8Н), 1,60-2,19 (м, 7Н), 3,00-3,41 (м, 7Н), розчин концентрували у вакуумі до одержання 3,83 (м, 1Н), 4,88 (с, 2Н), 5,99 (м, 1Н), 7,01 (м, 1Н), 9,11г (43,03ммоль) жовтої олії (96%). 1Н-ЯМР 7,21-7,39 (м, 6Н), 7,49-7,52 (м, 1Н); МС [MCF3COO]+: 441. (CDCl3): 0,9 (м, 3Н), 1,3 (м, 2Н), 1,6 (м, 2Н), 3,7 Також в обсяг даного винаходу включені фар(м, 2Н), 7,2-7,4 (м, 5Н). мацевтичні композиції, що містять як активний Приклад 1-2 - Одержання циклопентилтіофенінгредієнт, принаймні, одне похідне хінуклідину 2-ілметилкарбамілхлориду загальної формули (І) або (II) у комбінації з фарДо розчину 5,0г (27,58ммоль) циклопентилтіомацевтично прийнятним носієм або розріджувафен-2-ілметил-аміну в 40мл хлористого метилену чем. Переважно, композицію складають у формі, при 10°С при перемішуванні повільно додавали що підходить для перорального застосування. 4,09г (13,79ммоль) трифосгену в 35мл хлористого Фармацевтично прийнятний носій або розріметилену. Реакцію проводили при кімнатній темджувачі, що змішують зі сполукою або сполуками пературі протягом 64 годин, при кип'ятінні зі звородля утворення композиції за даним винаходом, тним холодильником протягом 4 годин та ще просамі по собі добре відомі, та використання визнатягом 25 годин при кімнатній температурі. чених наповнювачів залежить, у числі іншого, від Розчинник випарювали, а залишок екстрагували нпередбачуваного способу введення композиції. гексаном. Органічний розчин концентрували, щоб Композиції за даним винаходом адаптовані одержати 4,96г (20,34ммоль) коричневої олії для перорального застосування. У даному випад(74%). 1Н-ЯМР (CDCl3): 1,4 (м, 8Н), 4,2 (уш.с, 1Н), ку, композицію для перорального застосування 4,5 (м, 2Н), 6,8-7,3 (м, 3Н). можна приготувати у вигляді таблеток, покритих Спосіб (с) плівкою таблеток, рідкого інгаляційного препарату, Приклад 146 - Одержання (R)-3-(біс-тіофен-2порошкоподібного інгаляційного препарату та інілметилкарбамоїл-окси)-1-(3-тіофен-2-ілпропіл)-1галяційного аерозолю. Будь-який з цих препаратів азоніабіцикло[2.2.2]октану, броміду містить одну або кілька сполук за винаходом. Такі Змішували 0,54г (1,5ммоль) 1препарати можуть бути приготовлені способами, азабіцикло[2.2.2]окт-3-(R)-ілового ефіру бісдобре відомими в даній галузі. тіофен-2-ілметилкарбамінової кислоти, 7,5мл тетРозріджувачі, що можуть бути використані в рагідрофурану та 0,46г (2,25ммоль) 2-(3препаратах композицій, включають в себе ті рідкі бромпропілтіофену). Розчин кип'ятили зі зворотта тверді розріджувачі, що сумісні з активним інгним холодильником протягом 4 годин та залишаредієнтом, при необхідності разом із барвниками ли, щоб продовжити перемішування при кімнатній та смаковими агентами. Таблетки або покриті плітемпературі протягом 116 годин. Додавали ефір та вкою таблетки звичайно можуть містити між 0,1мг отриману суспензію перемішували протягом 30 та 500мг, переважно від 0,5 до 200мг активного хвилин. Розчинник екстрагували та додавали ще інгредієнта. Інгаляційні композиції можуть містити ефір. Описану процедуру повторювали кілька равід 1мкг до 1000мкг, переважно від 10 до 800мкг зів для того, щоб видалити алкілувальний агент. активного інгредієнта. При лікуванні людини, доза Нарешті, суспензію фільтрували, а залишок висусполуки загальної формули (І) або (II) залежить від шували у вакуумній печі. Вихід складав 0,69г необхідного ефекту та тривалості лікування; дози (1,22ммоль) (81%). 1Н-ЯМР (DMSO-d6): 1,78-2,10 21 76131 22 для дорослих звичайно складають від 0,5мг до 300мг у день у вигляді таблеток та від 10мкг до Переважні сполуки за винаходом мають вели800мкг у день у вигляді інгаляційної композиції. чину ІС50 (нМ) для рецепторів М3 менше 35, переСполуки даного винаходу або фармацевтичні важно менше 25, 20 або 15, більш переважно мекомпозиції, що містять їх, можуть бути використані нше 10. Випробування на бронхоспазм у морських разом з 2-агоністом, стероїдом, антиалергічним свинок лікарським засобом та/або інгібітором фосфодіесДослідження проводили згідно з [Н. Konzett терази IV для одночасного, роздільного або посліand Rossler (1940), Arch. Exp. Path. Pharmacol. 195, довного застосування при лікуванні респіраторно71-74] водні розчини агентів, які необхідно тестуго захворювання. вати, вводили розпиленням та інгаляцією анестеФармакологічна дія зованим самцям морських свинок, яким проводили Наступні приклади демонструють прекрасну штучну вентиляцію легень (Dunkin-Hartley). Бронфармакологічну активність сполук даного винахохіальну відповідну реакцію на внутрішньовенну ду. Результати щодо зв'язування мускаринового стимуляцію ацетилхоліном визначали до та після рецептора людини та впливу на бронхоспазм у введення лікарського засобу та зміни в легеневій морської свинки були отримані як описано нижче. резистентності по декількох тимчасових точках Дослідження мускаринового рецептора лювиражали як відсоток інгібування бронхоспазму. дини Сполуки даного винаходу виявляли бронхоліЗв'язування [3H]-NMS з мускариновими рецептичну активність з високою ефективністю та довторами людини проводили згідно з [Waelbroek et гою тривалістю дії. al., (1990), МоI. Pharmacol., 38: 267-273]. ДосліЗ представлених вище результатів кожний з дження виконували при 25°С. Використовували фахівців у даній галузі легко може зрозуміти, що мембранні препарати зі стабільно трансфікованих сполуки даного винаходу характеризуються гарклітин К1 яєчника китайського хом'яка (СНО), ексною антимускариновою активністю (М3) і, таким пресуючих гени мускаринових рецепторів М3 лючином, є ефективними при лікуванні захворювань, дини. у які втягнутий мускариновий рецептор М3, вклюДля визначення ІС50, мембранні препарати сучаючи респіраторні захворювання, такі як хронічне спендували в DPBS до кінцевої концентрації обструктивне захворювання легень, бронхіт, аст89мкг/мл для підтипу М3. Мембранну суспензію ма, підвищена реактивність бронхів та риніт; уроінкубували з тритованою сполукою протягом 60 логічні захворювання, такі як нетримання сечі, похвилин. Після інкубації мембранну фракцію відолакіурія, нейрогенний сечовий міхур, нічне кремлювали фільтруванням та визначали зв'язану нетримання сечі, хитливий сечовий міхур, цистосрадіоактивність. Неспецифічне зв'язування визнапазм та хронічний цистит; шлунково-кишкові зачали за допомогою додавання 10Μ атропіну. Анахворювання, такі як синдром подразненої товстої лізували, принаймні, шість концентрацій у дублікакишки, спастичний коліт, дивертикуліт та утворентах, щоб одержати індивідуальні криві заміщень. ня пептичних виразок; та серцевосудинні поруОтримані результати (Таблиця 1) демонструшення, такі як вагус-індукована синусова брадикають, що сполуки даного винаходу характеризуютьрдія. Наприклад, сполуки даного винаходу ся високою спорідненістю до мускаринових рецепвикористовуються для лікування респіраторних торів М3, переважно мускаринових рецепторів захворювань, таких як хронічне обструктивне залюдини. хворювання легень, хронічний бронхіт, астма та риніт; урологічних захворювань, таких як нетриТаблиця 1 мання сечі, прискорене сечовипускання при нейрогенній полакіурії, нейрогенний сечовий міхур, нічне Приклад № Зв'язування рецептора М3 (ІС50нМ) нетримання сечі, хитливий сечовий міхур, цистосАтропін 3,2 пазм та хронічний цистит; та шлунково-кишкових Іпратропіум 3,0 захворювань, таких як синдром подразненної тов1 5,0 стої кишки, спастичний коліт, дивертикуліт. 5 11,1 Крім того, у даному винаході пропонується 6 18,0 сполука формули (І) або (II) або фармацевтично 31 8,0 прийнятна композиція, що містить сполуку форму32 8,0 ли (І) або (II), для застосування в способі лікування 58 8,0 людини та тварин, особливо для лікування респі79 14,0 раторного, урологічного та шлунково-кишкового 82 4,5 захворювання. 90 9,2 Крім того, у даному винаході пропонується за91 6,8 стосування сполуки формули (І) або (II), або фар92 11,5 мацевтично прийнятної композиції, що містить 104 19,0 сполуку формули (І) або (II), для виробництва лі126 8,6 карського засобу для лікування респіраторного, 136 9,0 урологічного та шлунково-кишкового захворюван142 17,8 ня. 146 14,4 Далі, сполуки формули (І) або (II) та фармацевтичні композиції, що містять сполуку формули (І) 153 6,0 або (II), можна використовувати в способі лікуван156 18,0 23 76131 24 ня респіраторного, урологічного та шлунковоПриклад 4 кишкового захворювання, що включає введення 3-(R)(Бензилфенілкарбамоїл-окси)-1-(3людині або тварині ефективної кількості сполуки феноксипроліл)-1-азоніабіцикло[2.2.2]октан, триформули (І) або (II) або фармацевтичної композифторацетат ції, що містить сполуку формули (І) або (II) , при Названу в заголовку сполуку синтезували за необхідності такого лікування. способом d. Вихід на кінцевій стадії склав 21мг, Крім того, сполуки формули (І) та фармацев26%. 1Н-ЯМР (DMSO-d6): 1,56-1,91 (м, 4Н), 2,11тичні композиції, що містять сполуку формули (І), 2,20 (м, 3Н), 3,12 (м, 1Н), 3,34-3,51 (м, 6Н), 3,86 (м, можна використовувати в комбінації з іншими лі1Н), 4,06 (м, 2Н), 4,93 (с, 2Н), 5,02 (м, 1Н), 6,97 (м, карськими засобами, ефективними при лікуванні 3Н), 7,20-7,38 (м, 12Н); МС [M-CF3COO]+: 471. згаданих вище захворювань. Наприклад, їх можна Приклад 5 застосовувати в поєднанні з 2-агоністами, стерої3-(R)(Бензилфенілкарбамоїл-окси)-1-(3дами, антиалергічними лікарськими засобами, фенілаліл)-1-азоніабіцикло[2.2.2]октан, бромід інгібіторами фосфодіестерази IV та/або інгібітораНазвану в заголовку сполуку синтезували за ми лейкотриєну D4 (LTD4) для одночасного, роздіспособом с. Вихід на кінцевій стадії склав 220мг, льного або послідовного застосування при ліку70%. 1Н-ЯМР (DMSO-d6): 1,55-1,92 (м, 4Н), 2,21 ванні респіраторного захворювання. (с, 1H), 3,15 (м, 1Н), 3,34-3,50 (м, 5Η), 3,90 (м, 1Н), Тому в даному винаході далі пропонується 4,1 (м, 2H), 4,02 (с, 2Н), 5,05 (м, 1Н), 6,49 (м, 1Н), комбінований продукт, що містить 6,85-6,90 (д, 1Н), 7,20-7,59 (м, 12Н), 7,59-7,61 (м, (і) сполуку відповідно до винаходу; та 2Н); МС[М-Вr]+: 453, температура: 129°С. (іі) іншу сполуку, ефективну при лікуванні ресПриклад 6 піраторного, урологічного або шлунково-кишкового 1-Аліл-3-(R)(бензилфенілкарбамоїл-окси)-1захворювання або порушення для одночасного, азоніабіцикло[2.2.2]октан, бромід роздільного або послідовного застосування. Названу в заголовку сполуку синтезували за Сполука (іі), що ефективна при лікуванні ресспособом с. Вихід на кінцевій стадії склав 230мг, піраторного, урологічного або шлунково-кишкового 85%. 1Н-ЯМР (DMSO-d6): 1,58-1,91 (м, 4Η), 2,20 захворювання або порушення може являти собою (с, 1Н), 3,10 (м, 1Η), 3,27-3,41 (м, 4Н), 3,79-3,90 (м, 3Н), 4,92 (с, 2Н), 5,03 (м, 1Н), 5,61 (м, 2Н), 5,98 (м, 2-агоніст, стероїд, антиалергічний лікарський засіб, інгібітор фосфодіестерази IV та/або антагоніст 1Н), 7,20-7,38 (м, 10Н); МС [М-Вr]+: 377, темпералейкотриєну D4 (LTD4), якщо продукт призначатура: 70°С. ється для одночасного, роздільного або послідовПриклад 7 ного застосування при лікуванні респіраторного 3-(R)(Бензилфенілкарбамоїл-окси)-1-(2захворювання. Альтернативно, сполука (іі) може гідроксіетил)-1-азоніабіцикло[2.2.2]октан, трифтобути 2-агоністом, стероїдом, антиалергічним лірацетат карським засобом та/або інгібітором фосфодіестеНазвану в заголовку сполуку синтезували за рази IV, якщо продукт призначається для одночасспособом d. Вихід на кінцевій стадії склав 12мг, ного, окремого або послідовного застосування при 19%. МС [M-CF3COO]+: 381. лікуванні респіраторного захворювання. Приклад 8 Далі даний винахід буде проілюстровано на3-(R)(Бензилфенілкарбамоїл-окси)-1-ізопропілступними прикладами. Приклади представлені 1-азоніабіцикло[2.2.2]октан, трифторацетат тільки як ілюстрація та не повинні розглядатися як Названу в заголовку сполуку синтезували за обмеження винаходу. способом d. Вихід на кінцевій стадії склав 17мг, Приклад 1 26%. 1Н-ЯМР (DMSO-d6): 1,24 (м, 6Н), 1,64-1,89 1-Азабіцикло[2.2.2]окт-3-(R)іловий ефір бензи(м, 4Н), 2,20 (с, 1Н), 2,78 (м, 1Н), 3,23 (м, 4Η), 3,50 лфенілкарбамінової кислоти (м, 1Η) , 3,76 (м, 1Η), 4,92 (с, 2Н), 5,06 (м, 1Η), Названу в заголовку сполуку синтезували за 7,20-7,38 (м, 10Η); МС [M-CF3COO]+: 379. способом а. Вихід на кінцевій стадії склав 1000мг, Приклад 9 18%. 1Н-ЯМР (CDCl3): 1,3-1,7 (м, 4Η), 1,9 (с, 1Н), 3-(R)(Бензилфенілкарбамоїл-окси)-1-пропіл-12,5-2,8 (м, 5Н), 3,2 (м, 1Н), 4,8 (м, 1Н), 4,9 (с, 2Н), азоніабіцикло[2.2.2]октан, трифторацетат 7,1-7,4 (м, 10Н); МС [М+1]+: 337. Названу в заголовку сполуку синтезували за Приклад 2 способом d. Вихід на кінцевій стадії склав 16мг, 3-(R)(Бензилфенілкарбамоїл-окси)-1-метил-125%. 1Н-ΗΜΡ (DMSO-d6): 0,88 (м, 3Н), 1,57-1,68 азоніабіцикло[2.2.2]октан, трифторацетат (м, 4Η), 1,89 (м, 2Н), 2,18 (с, 1Н), 2,99-3,14 (м, 3Н), Названу в заголовку сполуку синтезували за 3,26-3,40 (м, 4Н), 3,83 (м, 1Н), 4,92 (с, 2Н), 5,01 (м, способом d. Вихід на кінцевій стадії склав 20мг, 1Н), 7,20-7,37 (м, 10Н); МС [M-CF3COO]+: 379. 1 34%. Н-ЯМР (DMSO-d6): 1,54-1,90 (м, 4Н), 2,17 Приклад 10 (с, 1Н), 2,95 (с, 3Н), 3,22-3,52 (м, 5Н), 3,84 (м, 1Н), 3-(R)(Бензилфенілкарбамоїл-окси)-1-(34,92 (с, 2Н), 4,99 (м, 1Н), 7,12-7,37 (м, 10Н); MC[Mціанопроліл)-1-азоніабіцикло[2.2.2]октан, трифтоCF3COO]+: 351. рацетат Приклад 3 Названу в заголовку сполуку синтезували за 3-(R)(Бензилфенілкарбамоїл-окси)-1-(4способом d. Вихід на кінцевій стадії склав 13мг, метилпент-3-еніл)-1-азоніабіцикло[2.2.2]октан, 19%. 1Η-ЯΜΡ (DMSO-d6): 1,67-2,07 (м, 6Η), 2,19 трифторацетат (с, 1Η), 2,60 (м, 2Н), 3,07 (м, 1Н), 3,21-3,48 (м, 6Н), Названу в заголовку сполуку синтезували за 3,85 (м, 1Н), 4,92 (с, 2Н), 5,01 (м, 1Н), 7,20-7,37 (м, способом d. Вихід на кінцевій стадії склав 18мг, 10Н); МС [M-CF3COO]+: 404. 25%. МС [M-CF3COO]+: 419. Приклад 11 25 76131 26 3-(R)(Бензилфенілкарбамоїл-окси)-13,19 (м, 2Н), 3,26-3,46 (м, 4Н), 3,80-3,84 (м, 1Н), циклопропхлметил-1-азоніабіцикло[2.2.2]октан, 4,04 (м, 2Н), 4,92 (с, 2Н), 5,01-5,02 (м, 1Н), 7,19трифторацетат 7,37 (м, 10Н); МС [M-CF3COO]+: 451. Названу в заголовку сполуку синтезували за Приклад 18 способом d. Вихід на кінцевій стадії склав 9мг, 3-(R)(Бензилфенілкарбамоїл-окси)-1-(4-оксо-4+ 14%. МС [M-CF3COO] : 391. тіофен-2-ілбутил)-1-азоніабіцикло[2.2.2]октан, Приклад 12 трифторацетат 3-(R)(Бензилфенілкарбамоїл-окси)-1-(2Названу в заголовку сполуку синтезували за етоксіетил)-1-азоніабіцикло[2.2.2]октан, трифтораспособом d. Вихід на кінцевій стадії склав 16мг, цетат 19%. 1Н-ЯМР (DMSO-d6): 1,55-1,69 (м, 2Н), 1,87Названу в заголовку сполуку синтезували за 2,05 (м, 4Н), 2,19 (с, 1Н), 3,09 (м, 3Н), 3,22 (м, 2Н), способом d. Вихід на кінцевій стадії склав 22мг, 3,29-3,46 (м, 4Н), 3,88 (м, 1Н), 4,93 (с, 2Н), 5,02 (м, 32%. 1Н-ЯМР (DMSO-d6): 1,12 (м, 3Н), 1,58-1,90 1Н), 7,19-7,38 (м, 11Н), 7,98-8,06 (м, 2Н); МС [M(м, 4Н), 2,19 (с, 1Н), 3,12-3,15 (м, 1Н), 3,28-3,53 (м, CF3COO]+: 489. 8Н), 3,75 (м, 2Н), 3,90 (м, 1Н), 4,91 (с, 2Н), 5,02 (м, Приклад 19 1Н), 7,20-7,37 (м, 10Н); МС [M-CF3COO]+: 409. 3-(R)(Бензилфенілкарбамоїл-окси)-1-[3-(3Приклад 13 гідроксифенокси)-пропіл]-13-(R)(Бензилфенілкарбамоїл-окси)-1-(4азоніабіцикло[2.2.2]октан, трифторацетат етоксикарбонілбутил)-1-азоніабіцикло[2.2.2]октан, Названу в заголовку сполуку синтезували за трифторацетат способом d. Вихід на кінцевій стадії склав 17мг, Названу в заголовку сполуку синтезували за 21%. 1Н-ЯМР (DMSO-d6): 1,57-1,68 (м, 2Н), 1,90 способом d. Вихід на кінцевій стадії склав 14мг, (м, 2Н), 2,08-2,19 (м, 3Н), 3,11 (м, 1Н), 3,28-3,50 (м, 18%. 1Н-ЯМР (DMSO-d6): 1,19 (м, 3Н), 1,50-1,67 6Н), 3,88 (м, 1Н), 3,97 (м, 2Н), 4,93 (с, 2Н), 5,02 (м, (м, 4Н), 1,85-1,88 (м, 2Н), 2,18 (с, 1Н), 2,38 (м, 2Н), 1Н), 6,33-6,40 (м, 3Н), 7,04 (м, 1Н), 7,20-7,38 (м, 3,99 (м, 1Н), 3,16-3,42 (м, 8Н), 3,82 (м, 1Н), 4,06 (м, 10Н), 9,5 (с, ОН); МС [M-CF3COO]+: 487. 2Н), 4,92 (с, 2Н), 5,02 (м, 1Н), 7,19-7,37 (м, 10Н); Приклад 20 МС [M-CF3COO]+: 465. 3-(R)(Бензилфенілкарбамоїл-окси)-1-гелтил-1Приклад 14 азоніабіцикло[2.2.2]октан, трифторацетат 3-(R)(Бензилфенілкарбамоїл-окси)-1-(4Названу в заголовку сполуку синтезували за фенілбутил)-1-азоніабіцикло[2.2.2]октан, трифтоспособом d. Вихід на кінцевій стадії склав 17мг, рацетат 23%. 1Н-ЯМР (DMSO-d6): 0,88 (м, 3Н) , 1,28 (м, Названу в заголовку сполуку синтезували за 8Н), 1,62 (м, 4Н), 1,85-1,88 (м, 2Н), 2,18 (с, 1Н), способом d. Вихід на кінцевій стадії склав 14мг, 3,02 (м, 1Н), 3,15 (м, 2Н), 3,26-3,40 (м, 4Н) , 3,83 18%. 1Н-ЯМР (DMSO-d6): 1,57-1,65 (м, 6Н), 1,88 (м, 1Η), 4,92 (с, 2Н), 5,01 (м, 1Н), 7,20-7,37 (м, (м, 2Н), 2,18 (с, 1Н), 2,63 (м, 2Н), 3,00 (м, 1H), 3,1810Н); МС [M-CF3COO]+: 435. 3,42 (м, 6Н), 3,79-3,86 (м, 1Н), 4,94 (с, 2Н), 5,00 (м, Приклад 21 1Н), 7,18-7,37 (м, 15Н) ; МС [M-CF3COO]+: 469. 1-(2-Бензилоксіетил)-3Приклад 15 (R)(бензилфенілкарбамоїл-окси)-13-(R)(Бензилфенілкарбамоїл-окси)-1-[3-(4азоніабіцикло[2.2.2]октан, трифторацетат фторфенокси)-пропіл]-1-азоніабіцикло[2.2.2]октан, Названу в заголовку сполуку синтезували за трифторацетат способом d. Вихід на кінцевій стадії склав 20мг, Названу в заголовку сполуку синтезували за 25%. 1Н-ЯМР (DMSO-d6): 1,54-1,94 (м, 4Н), 2,20 способом d. Вихід на кінцевій стадії склав 21мг, (с, 1Н), 3,17 (м, 1Н), 3,28-3,55 (м, 6Η), 3,85 (м, 2Н), 25%. 1Н-ЯМР (DMSO-d6): 1,55-1,91 (м, 4Н), 2,103,92-3,99 (м, 1Н), 4,53 (с, 2Н), 4,91 (с, 2Н), 5,02 (м, 2,20 (м, 3Н), 3,10 (м, 1Н), 3,28-3,50 (м, 6Н), 3,88 (м, 1Н), 7,18-7,40 (м, 15Н); МС [M-CF3COO]+: 471. 1Н), 4,02 (м, 2Н), 4,93 (с, 2Н), 5,02 (м, 1Н), 6,95Приклад 22 7,12 (м, 2Н), 7,12-7,38 (м, 12Н); МС[M-CF3COO]+: 1-Азабіцикло[2.2.2]окт-3-(R)іловий ефір бен489. зил-(4-фторфеніл)карбамінової кислоти Приклад 16 Названу в заголовку сполуку синтезували за 3-(R)(Бензилфенілкарбамоїл-окси)-1-(3способом а. Вихід на кінцевій стадії склав 1110мг, гідроксипропіл)-1-азоніабіцикло[2.2.2]октан, три13%. 1Н-ЯМР (DMSO-d6): 1,16-1,52 (м, 4Н), 1,81 фторацетат (с, 1Н), 2,42-2,57 (м, 5Н), 2,99-3,07 (м, 1Н), 4,63 (м, Названу в заголовку сполуку синтезували за 1Н), 4,84 (с, 2Н), 7,10-7,32 (м, 9Н); МС[М+1]+: 355. способом d. Вихід на кінцевій стадії склав 12мг, Приклад 23 18%. 1Н-ЯМР (DMSO-d6): 1,54-1,88 (м, 6Н), 2,18 1-Аліл-3-(R)[бензил-(4-фторфеніл)карбамоїл(с, 1Н), 3,09 (м, 1Н), 3,23-3,49 (м, 8Η), 3,85 (м, 1Н), окси]-1-азоніабіцикло[2.2.2]октан, трифторацетат 4,84 (м, ОН), 4,92 (с, 2Н), 5,02 (м, 1Н), 7,19-7,37 (м, Названу в заголовку сполуку синтезували за 10Н); МС [M-CF3COO]+: 395. способом d. Вихід на кінцевій стадії склав 10мг, Приклад 17 23%. МС [M-CF3COO]+: 395. 1-(4-ацетоксибутил-3Приклад 24 (R)(бензилфенілкарбамоїл-окси)-13-(R)[Бензил-(4-фторфеніл)карбамоїл-окси]-1азоніабіцикло[2.2.2]октан, трифторацетат (3-фенілпропіл)-1-азоніабіцикло[2.2.2]октан, триНазвану в заголовку сполуку синтезували за фторацетат способом d. Вихід на кінцевій стадії склав 9мг, Названу в заголовку сполуку синтезували за способом d. Вихід на кінцевій стадії склав 13мг, 12%. 1Н-ЯМР (DMSO-d6): 1,40-1,70 (м, 5Н), 1,8125%. МС [M-CF3COO]+: 473. 1,91 (м, 3Н), 2,02 (м, 3Н), 2,19 (с, 1Н), 3,03 (м, 1Н), 27 76131 28 Приклад 25 феноксіетил)-1-азоніабіцикло[2.2.2]октан, бромід 1-Азабіцикло[2.2.2]окт-3-(R)іловий ефір бенНазвану в заголовку сполуку синтезували за зил-п-толілкарбаміновоі кислоти способом с. Вихід на кінцевій стадії склав 360мг, Названу в заголовку сполуку синтезували за 67%. 1Н-ЯМР (DMSO-d6): 1,5-1,73 (м, 2Н), 1,89 способом а. Вихід на кінцевій стадії склав 1070мг, (м, 2Н), 2,20 (с, 1Н), 3,23 (м, 1Н), 3,46-3,72 (м, 6Н), 1 11%. Η-ЯΜΡ (DMSO-d6): 1,18-1,30 (м, 2Η), 1,454,02 (м, 1Η), 4,43 (м, 2Η), 4,92 (с, 2Н), 5,03 (м, 1Н), 1,55 (м, 2Н), 1,83 (с, 1Н), 2,25 (с, 3Н), 2,43-2,59 (м, 7,01 (м, 3Н), 7,17-7,38 (м, 12Н); МС[М-Вr]+: 457, 5Н), 3,01-3,10 (м, 1Н), 4,64 (м, 1Η), 4,85 (с ,2Н), температура 117°С. 7,12-7,34 (м, 9Н); МС[М+1]+: 351. Приклад 33 Приклад 26 3-(R)(Бензилфенілкарбамоїл-окси)-1-[3-(31-Аліл-3-(R)(бензил-п-толілкарбамоїл-окси)-1ціанофенокси)пропіл]-1-азоніабіцикло[2.2.2]октан, азоніабіцикло[2.2.2]октан, трифторацетат трифторацетат Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом d. Вихід на кінцевій стадії склав 9мг, способом d. Вихід на кінцевій стадії склав 16мг, 19%. МС [M-CF3COO]+: 391. 36%. МС [M-CF3COO]+: 496. Приклад 27 Приклад 34 3-(R)(Бензил-п-толілкарбамоїл-окси)-1-(33-(R)(Бензилфенілкарбамоїл-окси)-1-[3фенілпропіл)-1-азоніабіцикло[2.2.2]октан, трифто(нафталін-1-ілокси)пропіл]-1рацетат азоніабіцикло[2.2.2]октан, трифторацетат Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом d. Вихід на кінцевій стадії склав 13мг, способом d. Вихід на кінцевій стадії склав 10мг, 25%. МС [M-CF3COO]+: 469. 21%. МС [M-CF3COO]+: 521. Приклад 28 Приклад 35 3-(R)-(Бензиотфенілкарбамоїл-окси)-1-[2-(23-(R)(Бензилфенілкарбамоїл-окси)-1-[3метоксіетокси)етил]-1-азоніабіцикло[2.2.2]октан, (метилфеніламіно)-пропіл]-1бромід азоніабіцикло[2.2.2]октан, трифторацетат Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом с. Вихід на кінцевій стадії склав 390мг, способом d. Вихід на кінцевій стадії склав 12мг, 28%. МС [M-CF3COO]+: 484. 84%. 1Н-ЯМР (DMSO-d6): 1,55-1,75 (м, 2Н), 1,88 Приклад 36 (м, 3Н), 2,17 (с, 1Н), 3,14 (м, 1Н), 3,22 (м, 3Н), 3,293-(R)-(Бензилфенілкарбамоїл-окси)-1-(33,55 (м, 10Н), 3,78 (м, 2Н), 3,90 (м, 1Н), 4,89 (с, фенілсульфаніл-пропіл)-12Н), 4,99 (м, 1Н), 7,17-7,35 (м, 10Н); МС[М-Вr]+: азоніабіцикло[2.2.2]октан , трифторацетат 439. Названу в заголовку сполуку синтезували за Приклад 29 способом d. Вихід на кінцевій стадії склав 8мг, 3-(R)-(Бензилфенілкарбамоїл-окси)-1фенетил-1-азоніабіцикло[2.2.2]октан, бромід 18%. 1Н-ЯМР (DMSO-d6): 1,45-2,00 (м, 6Н), 2,1V Названу в заголовку сполуку синтезували за (уш.с, 1Н), 3,00 (м, 2Н), 3,28-3,41 (м, 7Η), 3,83 (м, способом с. Вихід на кінцевій стадії склав 200мг, 1Η), 4,91 (с, 2Η), 4,98 (м, 1Η), 7,18-7,41 (м, 15Н); MC[M-CF3COO]+: 487. 65%. 1Н-ЯМР (DMSO-d6): 1,55-1,75 (м, 2Н), 1,90 Приклад 37 (м, 2Н), 2,19 (с, 1Н), 3,00 (м, 2Н), 3,10 (м, 1H), 3,313-(R)-(Бензилфенілкарбамоїл-окси)-1-(4-оксо3,51 (м, 6Η), 3,90 (м, 1Н), 4,91 (с, 1Н), 5,04 (м, 1Η), 4-фенілбутил)-1-азоніабіцикло[2.2.2]октан, три7,18-7,37 (м, 15Н); MC[M-Br]+: 441, температура фторацетат 81°С. Названу в заголовку сполуку синтезували за Приклад 30 способом d. Вихід на кінцевій стадії склав 10мг, 3-(R)-(Бензилфенілкарбамоїл-окси)-1-(3тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, 23%. 1Н-ЯМР (DMSO-d6): 1,50-2,06 (м, 6Н), 2,20 бромід (уш.с, 1Н), 3,13-3,47 (м, 9Η), 3,89 (м, 1Н), 4,93 (с, Названу в заголовку сполуку синтезували за 2Η), 5,02 (м, 1Н), 7,19-7,38 (м, 10Н), 7,54-7,70 (м, способом с. Вихід на кінцевій стадії склав 970мг, 3Н), 7,98-8,00 (м, 2Н); МС [M-CF3COO]+: 483. 1 Приклад 38 82%. Н-ЯМР (DMSO-d6): 1,55-1,69 (м, 2Н), 1,853-(R)-(Бензилфенілкарбамоїл-окси)-1-[3-(2,4,62,04 (м, 4Н), 2,18 (с, 1Н), 2,83 (м, 2Н), 3,01 (м, 1Н), триметил-фенокси)пропіл]-13,20-3,44 (м, 6Н), 3,85 (м, 1Н), 4,92 (с, 2Н), 5,00 (м, азоніабіцикло[2.2.2]октан, трифторацетат 1Н), 6,94-7,00 (м, 2Н), 7,19-7,40 (м, 11Н); МС [МНазвану в заголовку сполуку синтезували за Вr]+: 461, температура 95°С. способом d. Вихід на кінцевій стадії склав 14мг, Приклад 31 3-(R)-(Бензилфенілкарбамоїл-окси)-1-(330%. 1Н-ЯМР (DMSO-d6): 1,50-2,20 (м, 7Н), 2,19 фенілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід (с, 9Н), 3,16-3,52 (м, 7Н), 3,73 (м, 2Н), 3,92 (м, 1Н), Названу в заголовку сполуку синтезували за 4,93 (с, 2Н), 5,03 (м, 1Н), 6,83 (с, 2Н), 7,19-7,38 (м, способом с. Вихід на кінцевій стадії склав 880мг, 10Н); МС [M-CF3COO]+: 513. 1 Приклад 39 79%. Н-ЯМР (DMSO-d6): 1,55-1,69 (м, 2Н), 1,853-(R)(Бензилфенілкарбамоїл-окси)-1-[3-(22,00 (м, 4Н), 2,18 (с, 1Н), 2,59 (м, 2Н), 3,04 (м, 1Н), хлорфенокси)пропіл]-1-азоніабіцикло[2.2.2]октан, 3,23-3,44 (м, 6Н), 3,85 (м, 1Н), 4,92 (с, 2Н), 5,02 (м, трифторацетат 1Н), 7,18-7,36 (м, 15Н); МС[М-Вr]+: 455, температуНазвану в заголовку сполуку синтезували за ра 101°С. способом d. Вихід на кінцевій стадії склав 14мг, Приклад 32 31%. МС [M-CF3COO]+: 506. 3-(R)-(Бензилфенілкарбамоїл-окси)-1-(2 29 76131 30 1 Приклад 40 22%. Н-ЯМР (DMSO-d6): 1,50-2,27 (м, 7Н), 3,09 3-(R)(Бензилфенілкарбамохл-окси)-1-[3-(3(уш.с, 1Н), 3,28-3,48 (м, 6Η), 3,88 (м, 1Н), 4,14 (м, трифторметил-фенокси)пропіл]-12Н), 4,93 (с, 2Н), 5,04 (м, 1Н), 7,02-7,15 (м, 2Η), азоніабіцикло[2.2.2]октан, трифторацетат 7,19-7,38 (м, 10Η), 7,44-7,50 (м, 1Н), 7,55 (уш.с, Названу в заголовку сполуку синтезували за ΝΗ2), 7,69-7,72 (дд, 1Η); МС [M-CF3COO]+: 514. способом d. Вихід на кінцевій стадії склав 14мг, Приклад 47 29%. 1Н-ЯМР (DMSO-d6): 1,50-2,00 (м, 4Н), 2,083-(R) Бензилфенілкарбамоїл-окси)-1-[3-(32,20 (м, 3Н), 3,12-3,50 (м, 7Н), 3,90 (м, 1Η), 4,14 (м, диметиламінo-фенокси)пропіл]-12Η), 4,93 (с, 2Н), 5,03 (м, 1Н), 7,19-7,38 (м, 13Н), азоніабіцикло[2.2.2]октан, трифторацетат 7,54-7,59 (м, 1Н); МС [M-CF3COO]+: 539. Названу в заголовку сполуку синтезували за Приклад 41 способом d. Вихід на кінцевій стадії склав 12мг, 3-(R)(Бензилфенілкарбамоїл-окси)-1-[326%. МС [M-CF3COO]+: 514. (біфеніл-4-ілокси)пропіл]-1Приклад 48 азоніабіцикло[2.2.2]октан, трифторацетат 1-[3-(4-Ацетиламінофенокси)пропіл]-3Названу в заголовку сполуку синтезували за (R)(бензилфенілкарбамоїл-окси)-1способом d. Вихід на кінцевій стадії склав 12мг, азоніабіцикло[2.2.2]октан, трифторацетат Названу в заголовку сполуку синтезували за 24%. 1Н-ЯМР (DMSO-d6): 1,50-2,20 (м, 7Н), 3,14 способом d. Вихід на кінцевій стадії склав 12мг, (уш.с, 1Н), 3,28-3,52 (м, 6Н), 3,91 (м, 1Н), 4,10 (м, 25%. 1Н-ЯМР (DMSO-d6): 1,50-1,92 (м, 4Н), 2,01 2Н), 4,93 (с, 2Н), 5,03 (м, 1Н), 7,03-7,08 (м, 2Н), 7,18-7,47 (м, 13Н), 7,61-7,65 (м, 4Н); МС [M(с, 3Н), 2,04-2,20 (м, 3Н), 3,12 (уш.с, 1Н), 3,28-3,51 CF3COO]+: 547. (м, 6Н), 3,89 (м, 1Н), 4,00 (м, 2Н), 4,93 (с, 2Η), 5,02 Приклад 42 (м, 1Н), 6,86-6,91 (м, 2Н), 7,19-7,38 (м, 10Н), 7,483-(R)(Бензилфенілкарбамоїл-окси)-1-[3-(2,47,53 (м, 2Н), 9,85 (c, NH); MC [M-CF3COO]+: 528. дифторфенокси)-пропіл]-1Приклад 49 азоніабіцикло[2.2.2]октан, трифторацетат 3-(R)(Бензилфенілкарбамоїл-окси)-1-[3-(4Названу в заголовку сполуку синтезували за метоксикарбоніл-фенокси)пропіл]-1способом d. Вихід на кінцевій стадії склав 10мг, азоніабіцикло[2.2.2]октан, трифторацетат Названу в заголовку сполуку синтезували за 22%. 1Н-ЯМР (DMSO-d6): 1,50-2,19 (м, 7Н), 3,10 способом d. Вихід на кінцевій стадії склав 12мг, (уш.с, 1Н), 3,28-3,51 (м, 3Н), 3,90 (м, 1H), 4,10 (м, 2Η), 4,93 (с, 2Н), 5,02 (м, 1Н), 7,02-7,09 (м, 1Η), 25%. 1Н-ЯМР (DMSO-d6): 1,50-2,20 (м, 7Н), 3,12 + 7,19-7,37 (м, 12Η) ; МС [M-CF3COO] : 507. (уш.с, 1Н), 3,29-3,51 (м, 6Н), 3,82 (с, 3Н), 3,87-3,93 Приклад 43 (м, 1Н), 4,14 (м, 2Н), 4,93 (с, 2Н), 5,03 (м, 1Н), 7,043-(R)(Бензилфенілкарбамоїл-окси)-1-[3-(47,09 (м, 2Н), 7,19-7,38 (м, 10Н), 7,92-7,96 (м, 2Н) ; метоксифенокси)-пропіл]-1MC [M-CF3COO]+: 529. азоніабіцикло[2.2.2]октан, трифторацетат Приклад 50 Названу в заголовку сполуку синтезували за 3-(R)(Бензилфенілкарбамоїл-окси)-1-[3-(4способом d. Вихід на кінцевій стадії склав 10мг, нітрофенокси)пропіл]-1-азоніабіцикло[2.2.2]октан, трифторацетат 22%. 1Н-ЯМР (DMSO-d6): 1,50-2,19 (м, 7Н), 3,11 Названу в заголовку сполуку синтезували за (уш.с, 1Н), 3,28-3,51 (м, 6Н), 3,70 (с, 3Н), 3,89 (м, способом d. Вихід на кінцевій стадії склав 12мг, 1Н), 3,94-3,99 (м, 2Н), 4,93 (с, 2Н), 5,02 (м, 1Н), 6,85-6,92 (м, 4Н), 7,19-7,38 (м, 10Н); МС [M26%. 1Н-ЯМР (DMSO-d6): 1,50-2,27 (м, 7Н), 3,12 + CF3COO] : 501. (уш.с, 1Н), 3,29-3,51 (м, 6Н), 3,87-3,94 (м, 1Н), 4,21 Приклад 44 (м, 2Н), 4,93 (с, 2Н), 5,03 (м, 1Н), 7,14-7,38 (м, 3-(R)(Бензилфенілкарбамоїл-окси)-1-[З12Н), 8,22-8,28 (м, 2Н); MC [M-CF3COO]+: 516. (5,6,7,8-тетрагідронафталін-2-ілокси)пропіл]-1Приклад 51 азоніабіцикло[2.2.2]октан, трифторацетат 3-(R)(Бензилфенілкарбамоїл-окси)-1-[3-(4Названу в заголовку сполуку синтезували за гідроксиметил-фєнокси)пропіл]-1способом d. Вихід на кінцевій стадії склав 10мг, азоніабіцикло[2.2.2]октан, трифторацетат Названу в заголовку сполуку синтезували за 21%. 1Н-ЯМР (DMSO-d6): 1,50-1,71 (м, 6Н), 1,87способом d. Вихід на кінцевій стадії склав 10мг, 2,19 (м, 5H), 2,63-2,68 (м, 4Н), 3,10 (уш.с, 1Н), 3,2822%. MC [M-CF3COO]+: 501. 3,50 (м, 6Н), 3,88 (м, 1Н), 3,98 (м, 2Н), 4,93 (с, 2Н), Приклад 52 5,02 (м, 1Н), 6,63-6,70 (м, 2Н), 6,95-6,98 (д, 1Н) , 1-Азабіцикло[2.2.2.]окт-3-(S)іловий ефір бен7,19-7,38 (м, 10Н); МС [M-CF3COO]+: 525. зилфенілкарбамінової кислоти Приклад 45 Названу в заголовку сполуку синтезували за 1-[3-(Бензо[1,3]діоксол-5-ілокси)пропіл]-3способом а. Вихід на кінцевій стадії склав 1000мг, (R)(бензилфенілкарбамоїл-окси)-1азоніабіцикло[2.2.2]октан, трифторацетат 23%. 1Η-ЯΜΡ (DMSO-d6): 1,14-1,57 (м, 4Η), 1,83 Названу в заголовку сполуку синтезували за (уш.с, 1Η), 2,43-2,61 (м, 5Н), 2,61-3,01 (м, 1Н), 4,64 способом d. Вихід на кінцевій стадії склав 12мг, (м, 1Н), 4,89 (с, 2Н), 7,16-7,35 (м, 10Н); МС[М+1]+: + 26%. МС [M-CF3COO] : 515. 337. Приклад 46 Приклад 53 3-(R)(Бензилфенілкарбамоїл-окси)-1-[3-(23-(S)(Бензилфенілкарбамоїл-окси)-1-(3карбамоїлфенокси)пропіл]-1фенілпропіл)-1-азоніабіцикло[2.2.2]октан, трифтоазоніабіцикло[2.2.2]октан, трифторацетат рацетат Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом d. Вихід на кінцевій стадії склав 10мг, способом с. Вихід на кінцевій стадії склав 660мг, 31 76131 32 9%. МС [M-CF3COO]+: 345. 83%. Н-ЯМР (DMSO-d6): 1,40-2,00 (м, 6Н), 2,18 Приклад 62 (уш.с, 1Н), 2,59 (м, 2Н), 2,95-3,44 (м, 7Н), 3,84 (м, 3-(R)(Бутилфенілкарбамоїл-окси)-1-пропіл-11Н), 4,92 (с, 2Н), 5,00 (м, 1Н), 7,19-7,36 (м, 15Н); азоніабіцикло[2.2.2]октан, трифторацетат МС[М-Вr]+: 455; температура: 64°С. Названу в заголовку сполуку синтезували за Приклад 54 способом d. Вихід на кінцевій стадії склав 16мг, 1-азабіцикло[2.2.2.]окт-3-(R)іловий ефір бути23%. МС [M-CF3COO]+: 345. лфенілкарбамінової кислоти Приклад 63 Названу в заголовку сполуку синтезували за 3-(R)(Бутилфенілкарбамоїл-окси)-1-(3способом а. Вихід на кінцевій стадії склав 1880мг, ціанопропіл)-1-азоніабіцикло[2.2.2]октан, трифто22%. 1Н-ЯМР (DMSO-d6): 0,9 (м, 3Н), 1,3 (м, 4Н), рацетат 1,5 (м, 4Н), 1,9 (с, 1Н), 2,7 (м, 5Η), 3,2 (м, 1Η), 3,7 Названу в заголовку сполуку синтезували за (м, 2Η), 4,7 (м, 1Н), 7,2-7,4 (м, 5Η); МС[М+1]+: 303. способом d. Вихід на кінцевій стадії склав 15мг, Приклад 55 20%. МС [M-CF3COO]+: 370. 3-(R)(Бутилфенілкарбамоїл-окси)-1-метил-1Приклад 64 азоніабіцикло[2.2.2]октан, трифторацетат 3-(R)(Бутилфенілкарбамоїл-окси)-1Названу в заголовку сполуку синтезували за циклолропілметил-1-азоніабіцикло[2.2.2]октан, способом d. Вихід на кінцевій стадії склав 16мг, трифторацетат 30%. МС [M-CF3COO]+: 317. Названу в заголовку сполуку синтезували за Приклад 56 способом d. Вихід на кінцевій стадії склав 2мг, 3%. 3-(R)(Бутилфенілкарбамоїл-окси)-1-(4МС [M-CF3COO]+: 357. метилпент-3-еніл)-1-азоніабіцикло[2.2.2]октан, Приклад 65 трифторацетат 3-(R)(Бутилфенілкарбамоїл-окси)-1-(2Названу в заголовку сполуку синтезували за етоксіетил)-1-азоніабіцикло[2.2.2]октан, трифтораспособом d. Вихід на кінцевій стадії склав 18мг, цетат 27%. МС [M-CF3COO]+: 385. Названу в заголовку сполуку синтезували за Приклад 57 способом d. Вихід на кінцевій стадії склав 19мг, 3-(R)(Бутилфенілкарбамоїл-окси)-1-(325%. МС [M-CF3COO]+: 375. феноксипропіл)-1-азоніабіцикло [2.2.2] октан, триПриклад 66 фторацетат 3-(R)(Бутилфенілкарбамоіл-окси)-1-(4Названу в заголовку сполуку синтезували за етоксикарбонілбутил)-1-азоніабіцикло[2.2.2]октан, способом d. Вихід на кінцевій стадії склав 21мг, трифторацетат 28%. МС [M-CF3COO]+: 437. Названу в заголовку сполуку синтезували за Приклад 58 способом d. Вихід на кінцевій стадії склав 12мг, 3-(R)(Бутилфенілкарбамоїл-окси)-1-(314%. МС [M-CF3COO]+: 431. фенілаліл)-1-азоніабіцикло[2.2.2]октан, бромід Приклад 67 Названу в заголовку сполуку синтезували за 3-(R)(Бутилфенілкарбамоїл-окси)-1-(3способом с. Вихід на кінцевій стадії склав 182мг, гідроксилропіл)-1-азоніабіцикло[2.2.2]октан, три48%. 1Н-ЯМР (DMSO-d6): 0,84 (м, 3Н), 1,25 (м, фторацетат 2Н), 1,40 (м, 2Н), 1,70-1,91 (м, 4Н), 2,20 (с, 1Н), 3,2Названу в заголовку сполуку синтезували за 3,4 (м, 6Н), 3,64 (м, 2Н), 3,88 (м, 1Н), 3,88-4,07 (д, способом d. Вихід на кінцевій стадії склав 12мг, 2Н), 4,97 (м, 1Н), 6,45 (м, 1Н), 6,83-6,88 (д, 1Н), 17%. МС [M-CF3COO]+: 361. 7,23-7,45 (м, 7Н), 7,60 (м, 2Н); МС[М-Вr]+: 419; темПриклад 68 пература 144°С. 3-(R)(Бутилфенілкарбамоїл-окси)-1-(3-пірол-1Приклад 59 ілпропіл)-1-азоніабіцикло[2.2.2]октан, трифтораце1-Аліл-3-(R)(бутилфенілкарбамоїл-окси)-1тат азоніабіцикло[2.2.2]октан, бромід Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом d. Вихід на кінцевій стадії склав 19мг, способом с. Вихід на кінцевій стадії склав 200мг, 23%. МС [M-CF3COO]+: 410. 72%. 1Н-ЯМР (DMSO-d6): 0,85 (м, 3Н), 2,21-1,34 Приклад 69 (м, 3Н), 1,40-1,45 (м, 2Н), 1,70-2,18 (м, 4Н), 3,151-(4-Ацетоксибутил)-33,40 (м, 5Н), 3,61-3,67 (м, 2Н), 3,82 (м, 1Н), 3,92(R)(бутилфенілкарбамоїл-окси)-13,94 (м, 2Н), 4,95 (м, 1Н), 5,62 (м, 2Н), 5,97-6,01 (м, азоніабіцикло[2.2.2]октан, трифторацетат 1Н), 7,26-7,44 (м, 5Н); МС[М-Вr]+: 343; температура Названу в заголовку сполуку синтезували за 141°С. способом d. Вихід на кінцевій стадії склав 10мг, Приклад 60 12%. МС [M-CF3COO]+: 417. 3-(R)(Бутилфенілкарбамоїл-окси)-1-(2Приклад 70 гідроксіетил)-1-азоніабіцикло[2.2.2]октан, трифто3-(R)(Бутилфенілкарбамоїл-окси)-1-(4-оксо-4рацетат тіофен-2-ілбутил)-1-азоніабіцикло[2.2.2]октан, Названу в заголовку сполуку синтезували за трифторацетат способом d. Вихід на кінцевій стадії склав 13мг, Названу в заголовку сполуку синтезували за 19%. МС [M-CF3COO]+: 347. способом d. Вихід на кінцевій стадії склав 17мг, Приклад 61 19%. МС [M-CF3COO]+: 455. 3-(R)(Бутилфенілкарбамоїл-окси)-1-ізопропілПриклад 71 1-азоніабіцикло[2.2.2]октан, трифторацетат 3-(R)(Бутилфенілкарбамоїл-окси)-1-(4Названу в заголовку сполуку синтезували за фенілбутил)-1-азоніабіцикло[2.2.2]октан, трифтоспособом d. Вихід на кінцевій стадії склав 20мг, 2 1 33 76131 34 рацетат феноксіетил)-1-азоніабіцикло[2.2.2]октан, бромід Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом d. Вихід на кінцевій стадії склав 17мг, способом с. Вихід на кінцевій стадії склав 260мг, 20%. МС [M-CF3COO]+: 435. 53%. 1Н-ЯМР (DMSO-d6): 0,84 (м, 3Н), 1,23-1,30 Приклад 72 (м, 2Н), 1,39-1,48 (м, 2Н), 1,70-2,20 (м, 5Н), 3,203-(R)(Бутилфенілкарбамоїл-окси)-1-[3-(33,72 (м, 9Н), 3,99 (м, 1Н), 4,44 (м, 2Н), 4,95 (м, 1Н), гідроксифенокси)-пропіл]-17,01 (м, 3Н), 7,24-7,40 (м, 7Н); МС[М-Вr]+: 423; темазоніабіцикло[2.2.2]октан, трифторацетат пература 153°С. Названу в заголовку сполуку синтезували за Приклад 80 способом d. Вихід на кінцевій стадії склав 21мг, 3-(R)(Бутилфенілкарбамоїл-окси)-1-(3-тіофен23%. МС [M-CF3COO]+: 453. 2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід Приклад 73 Названув заголовку сполуку синтезували за 3-(R)(Бутилфенілкарбамоїл-окси)-1-гептил-іспособом с. Вихід на кінцевій стадії склав 1100мг, азоніабіцикло[2.2.2]октан, трифторацетат 62%. 1Н-ЯМР (DMSO-d6): 0,84 (м, 3Н), 1,24-1,31 Названу в заголовку сполуку синтезували за (м, 2Н), 1,42 (м, 2Н), 1,60-2,21 (м, 7Н), 2,85 (м, 2Н), способом d. Вихід на кінцевій стадії склав 17мг, 3,0-3,50 (м, 7Н), 3,60-3,69 (м, 2Н), 3,85 (м, 1Н), 4,93 21%. МС [M-CF3COO]+: 401. (м, 1Н), 6,95-7,00 (м, 2Н), 7,28-7,43 (м, 6Н); МС [МПриклад 74 Вr]+: 427; температура 127°С. 1-(2-Бензилоксіетил)-ЗПриклад 81 (R)(бутилфенілкарбамоїл-окси)-13-(R)(Бутилфенілкарбамоіл-окси)-1-(3азоніабіцикло[2.2.2]октан, трифторацетат фенілпропіл)-1-азоніабіцикло[2.2.2]октан, бромід Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом d. Вихід на кінцевій стадії склав 22мг, способом с. Вихід на кінцевій стадії склав 280мг, 1 25%. МС [M-CF3COO]+: 437. 56%. Н-ЯМР (DMSO-d6): 0,84 (м, 3Н), 1,23-1,33 Приклад 75 (м, 2Н), 1,43 (м, 2Н), 1,60-2,20 (м, 7Н), 2,59 (м, 2Н), 3-(R)(Бутилфенілкарбамоїл-окси)-1-фенетил3,00-3,78 (м, 9Н), 3,84 (м, 1Н), 4,92 (м, 1Н), 7,201-азоніабіцикло[2.2.2]октан, бромід 7,42 (м, 10Н); МС[М-Вr]+: 421; температура 120°С. Названу в заголовку сполуку синтезували за Приклад 82 способом с. Вихід на кінцевій стадії склав 330мг, 1-Азабіцикло[2.2.2]окт-3-(R)іловий ефір феніл1 82%. Н-ЯМР (DMSO-d6): 0,83 (м, 3Н), 1,27-1,34 тіофен-2-ілметилкарбамінової кислоти (м, 2Н), 1,41-1,48 (м, 3Н), 1,60-2,23 (м, 4Н), 2,96Названу в заголовку сполуку синтезували за 3,47 (м, 7Н), 3,57-3,71 (м, 4Н), 3,92 (м, 1Н), 4,98 (м, способом а. Вихід на кінцевій стадії склав 310мг, + 1Н) , 7,25-7,45 (м, 10НА); МС [М-Вr] : 407; темпе10%. 1Н-ЯМР (DMSO-d6): 1,10-1,60 (м, 4Н), 1,87 ратура 139°С. (с, 1Н), 2,46-2,63 (м, 5Η), 3,04-3,33 (м, 1H), 4,66 (м, Приклад 76 1Η), 5,01 (с, 2Н), 6,87-6,94 (м, 2Н), 7,20-7,43 (м, 3-(R)(Бутилфенілкарбамоїл-окси)-1-[2-(26Η); МС[М+1]+: 343. метоксіетокси)етил]-1-азоніабіцикло[2.2.2]октан, Приклад 83 бромід 1-Метил-3-(R)(фенілтіофен-2Названу в заголовку сполуку синтезували за ілметрілкарбамоїл-окси)-1способом с. Вихід на кінцевій стадії склав 520мг, азоніабіцикло[2.2.2]октан, бромід 81%. 1Н-ЯМР (DMSO-d6): 0,82 (м, 3Н), 1,24-1,31 Названу в заголовку сполуку синтезували за (м, 2Н), 1,39-1,47 (м, 2Н), 1,70-2,20 (м, 5Н), 3,26 (с, способом с. Вихід на кінцевій стадії склав 160мг, 3Н), 3,35-3,70 (м, 13Н), 3,82-3,86 (м, 3Н), 4,94 (м, 80%. 1Н-ЯМР (DMSO-d6): 1,65-2,00 (м, 4Н), 2,20 1Н), 7,26-7,44 (м, 5Н); МС[М-Вr]+: 405. (с, 1Н), 2,98 (с, 3Н), 3,32-3,52 (м, 5Н), 3,85-3,92 (м, Приклад 77 1Н), 4,98-5,04 (м, 3Н), 6,94 (м, 2Н), 7,24-7,45 (м, 1-Азабіцикло[2.2.2]окт-3-(R)-іловий ефір бутил6Н); МС[М-Вr]+: 357. (4-фторфеніл)карбамінової кислоти Приклад 84 Названу в заголовку сполуку синтезували за 1-(3-Феноксипропіл)-3-(R)(фенілтіофен-2способом а. Вихід на кінцевій стадії склав 1650мг, ілметилкарбамоїл-окси)-124%. 1Н-ЯМР (DMSO-d6): 0,82 (м, 3Н), 1,20-1,54 азоніабіцикло[2.2.2]октан, трифторацетат (м, 8Н), 1,83 (м, 1Н), 2,49-2.70 (м, 5Н), 3,02-3,09 (м, Названу в заголовку сполуку синтезували за 1Н), 3,36-3,63 (м, 2Н), 4,59 (м, 1Н), 7,19-7,35 (м, способом d. Вихід на кінцевій стадії склав 16мг, + 4Н); МС[М+1] : 321. 42%. МС [M-CF3COO]+: 477. Приклад 78 Приклад 85 3-(R)(Бутилфенілкарбамоіл-окси)-1-[3-(41-(3-Фенілпропіл)-3-(R)(фенілтіофен-2фторфенокси)пропіл]-1-азоніабіцикло[2.2.2]октан, ілметилкарбамої.л-окси)-1хлорид азоніабіцикло[2.2.2]октан, трифторацетат Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом с. Вихід на кінцевій стадії склав 390мг, способом d. Вихід на кінцевій стадії склав 13мг, 1 75%. Н-ЯМР (DMSO-d6): 0,82 (м, 3Н), 1,26-1,31 35%. 1Н-ЯМР (DMSO-d6): 1,72-2,3 (м, 7Н), 2,58 (м, 2Н), 1,40-1,48 (м, 2Н), 1,70-2,17 (м, 5Н), 3,20-3,7 (м, 2Н), 3,00-3,48 (м, 7Н), 3,84(м, 1Н), 5,04 (м, 3Н), (м, 11Н), 3,86 (м, 1Н), 4,02 (м, 2Н), 4,94 (м, 1Н), 6,92-6,94 (м, 2Н), 7,20-7,43 (м, 11Н); MC[M6,95-7,00 (м, 2Н), 7,12-7,18 (м, 2Н), 7,26-7,44 (м, CF3COO]+: 461. 5Н); МС[М-Сl]+: 455; температура 126°С. Приклад 86 Приклад 79 1-(3-Фенілаліл)-3-(R)(фенілтіофен-23-(R)(Бутилфенілкарбамоїл-окси)-1-(2ілметилкарбамоїл-окси)-1 35 76131 36 азоніабіцикло[2.2.2]октан, трифторацетат 1-азоніабіцикло[2.2.2]октан, бромід Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом d. Вихід на кінцевій стадії склав 4мг, способом с. Вихід на кінцевій стадії склав 140мг, 11%. МС [M-CF3COO]+: 459. 73%. 1Н-ЯМР (DMSO-d6): 1,40-2,30 (м, 5Η), 2,80 Приклад 87 (м, 2Н), 2,94 (с, 3Н), 3,10-3,50 (м, 5Н), 3,78-3,95 (м, + 1-(2-Бензилоксіетил)-3-(R)(фенілтіофен-23Н), 4,89 (м, 1Н), 7,16-7,41 (м, 10Н); МС[М-Вr] : ілметилкарбамоїл-окси)-1365; температура 203°С. азоніабіцикло[2.2.2]октан, трифторацетат Приклад 95 Названу в заголовку сполуку синтезували за 1-Аліл-3-(R)(фенетилфенілкарбамоїл-окси)-1способом d. Вихід на кінцевій стадії склав 14мг, азоніабіцикло[2.2.2]октан, трифторацетат 37%. МС [M-CF3COO]+: 477. Названу в заголовку сполуку синтезували за Приклад 88 способом d. Вихід на кінцевій стадії склав 11мг, 1-[3-(3-Гідроксифенокси)пропіл]-335%. МС [M-CF3COO]+: 391. (R)(фенілтіофен-2-ілметилкарбамоїл-окси)-1Приклад 96 азоніабіцикло[2.2.2]октан, трифторацетат 3-(R)(Фенетилфенілкарбамоїл-окси)-1-(3Названу в заголовку сполуку синтезували за феноксипропіл)-1-азоніабіцикло[2.2.2]октан, триспособом d. Вихід на кінцевій стадії склав 11мг, фторацетат 28%. МС [M-CF3COO]+: 493. Названу в заголовку сполуку синтезували за Приклад 89 способом d. Вихід на кінцевій стадії склав 16мг, 1-Гептил-3-(R)(фенілтіофен-241%. МС [M-CF3COO]+: 485. ілметилкарбамоїл-окси)-1Приклад 97 азоніабіцикло[2.2.2]октан, трифторацетат 3-(R)(Фенетилфенілкарбамоїл-окси)-1-(2Названу в заголовку сполуку синтезували за феноксіетил)-1-азоніабіцикло[2.2.2]октан, трифтоспособом d. Вихід на кінцевій стадії склав 13мг, рацетат 37%. МС [M-CF3COO]+: 441. Названу в заголовку сполуку синтезували за Приклад 90 способом d. Вихід на кінцевій стадії склав 15мг, 3-(R)(Фенілтіофен-2-ілметилкарбамоїл-окси)40%. 1Н-ЯМР (DMSO-d6): 1,45-2,18 (м, 5Н), 2,81 1-(3-тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, (м, 2Н), 3,28-3,70 (м, 7Н), 3,80-4,02 (м, 3Н), 4,43 (м, бромід 2Н), 4,95 (м, 1Н), 6,98-7,04 (м, 2Н), 7,16-7,40 (м, Названу в заголовку сполуку синтезували за 13Н); МС [M-CF3COO]+: 471. способом с. Вихід на кінцевій стадії склав 140мг, Приклад 98 48%. 1Н-ЯМР (DMSO-d6): 1,40-2,30 (м, 7Н), 2,83 3(R)(Фенетилфенілкарбамоїл-окси)-1-(3(м, 2Н), 3,00-3,60 (м, 7Н), 3,88 (м, 1Н), 5,04 (м, 3Н), фенілпропіл)-1-азоніабіцикло[2.2.2]октан, трифто6,93-6,99 (м, 4Н), 7,28-7,43 (м, 7Н); МС [М-Вr]+: рацетат 467. Названу в заголовку сполуку синтезували за Приклад 91 способом d. Вихід на кінцевій стадії склав 14мг, 1-(2-Феноксіетил)-3-(R)(фенілтіофен-237%. 1Н-ЯМЕ (DMSO-d6): 1,45-2,20 (м, 7Н), 2,59 ілметилкарбамоіл-окси)-1(м, 2Н), 2,81 (м, 2Н), 3,05-3,5 (м, 7Н), 3,78-3,89 (м, азоніабіцикло[2.2.2]октан, бромід 3Н), 4,91 (м, 1Н), 7,17-7,42 (м, 15Н); МС [MНазвану в заголовку сполуку синтезували за CF3COO]+: 469. способом с. Вихід на кінцевій стадії склав 510мг, Приклад 99 80%. 1Н-ЯМР (DMSO-d6): 1,40-2,30 (м, 5Н), 3,203-(R)(Фенетилфенілкарбамоїл-окси)-1-(33,73 (м, 7Н), 4,05 (м, 1Н), 4,44 (уш.с, 2Н), 5,04 (м, фенілаліл)-1-азоніабіцикло[2.2.2]октан, трифтора3Н), 6,91-7,04 (м, 5Н), 7,24-7,41 (м, 8Н); МС[М-Вr]+: цетат 463; температура: 133°С. Названу в заголовку сполуку синтезували за Приклад 92 способом d. Вихід на кінцевій стадії склав 4мг, 1-Аліл-3-(R) (фенілтіофен-211%. МС [M-CF3COO]+: 467. ілметилкарбамоїл-окси)-1Приклад 100 азоніабіцикло[2.2.2]октан, бромід 1-(2-Бензилоксіетил)-3Названу в заголовку сполуку синтезували за (R)(фенетилфенілкарбамоїл-окси)-1способом с. Вихід на кінцевій стадії склав 360мг, азоніабіцикло[2.2.2]октан, трифторацетат 66%. 1Н-ЯМР (DMSO-d6): 1,40-2,30 (м, 5Н), 3,00Названу в заголовку сполуку синтезували за 3,41 (м, 5Н), 3,81-3,92 (м, 3Н), 5,04 (м, 3Н), 5,61 (м, способом d. Вихід на кінцевій стадії склав 14мг, 2Н), 5,93-6,05 (м, 1Н), 6,93-6,96 (м, 2Н), 7,24-7,46 36%. МС [M-CF3COO]+: 485. + (м, 6Н); МС[М-Вr] : 383; температура 110°С. Приклад 101 Приклад 93 1-[3-(3-Гідроксифенокси)пропіл]-31-Азабіцикло[2.2.2]окт-3-(R)іловий ефір фене(R)(фенетилфенілкарбамоїл-окси)-1тилфенілкарбамінової кислоти азоніабіцикло[2.2.2]октан, трифторацетат Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом а. Вихід на кінцевій стадії склав 1400мг, способом d. Вихід на кінцевій стадії склав 14мг, 17%. 1Н-ЯМР (DMSO-d6): 1,10-1,60 (м, 4Н), 1,83 35%. 1Н-ЯМР (DMSO-d6): 1,45-2,20 (м, 7Н), 2,82 (с, 1Н), 2,40-2,70 (м, 5Η), 2,78 (м, 2Н), 3,00-3,08 (м, (м, 2Н), 3,05-3,50 (м, 7Н), 3,83-3,99 (м, 5Н), 4,94 (м, 1Н), 3,87 (м, 2Н), 4,58 (м, 1Н), 7,16-7,40 (м, 10Н); 1Н), 6,33-6,39 (м, 3Н), 7,04-7,09 (м, 1Н), 7,18-7,44 МС[М+1]+: 351. (м, 10Н), 9,49 (с, ОН); МС [M-CF3COO]+: 501. Приклад 94 Приклад 102 1-Метил-3-(R)(фенетилфенілкарбамоїл-окси)1-Гептил-3-(R)(фенетилфенілкарбамоїл-окси) 37 76131 38 1 1-азоніабіцикло[2.2.2]октан, трифторацетат 37%. Н-ЯМР (DMSO-d6): 0,82 (м, 3Н), 1,20-1,25 Названу в заголовку сполуку синтезували за (м, 5Н), 1,44 (м, 3Н), 1,68-2,13 (м, 7Н), 2,58 (м, 2Н), способом d. Вихід на кінцевій стадії склав 15мг, 3,00-3,41 (м, 5Н), 3,54-3,69 (м, 2Н), 3,79-3,85 (м, 42%. 1Н-ЯМР (DMSO-d6): 0,88 (м, 3Н), 1,28 (м, 1Н), 4,92 (м, 1Н), 7,20-7,42 (м, 10Н); МС [M8Η), 1,55-2,20 (м, 7Η), 2,82 (м, 2Н), 3,00-3,50 (м, CF3COO]+: 435. 7Н), 3,68-3,89 (м, 3Н), 4,92 (м, 1Н), 7,18-7,43 (м, Приклад 110 10Н); MC[M-CF3COO]+: 449. 3-(R)(Пентилфенілкарбамоїл-окси)-1-(3Приклад 103 фенілаліл)-1-азоніабіцикло[2.2.2]октан, трифтора3-(R)(Фенетилфенілкарбамоїл-окси)-1-(3цетат тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, Названу в заголовку сполуку синтезували за трифторацетат способом d. Вихід на кінцевій стадії склав 4мг, Названу в заголовку сполуку синтезували за 12%. МС [M-CF3COO]+: 433. способом d. Вихід на кінцевій стадії склав 15мг, Приклад 111 39%. МС [M-CF3COO]+: 475. 1-(2-Бензилоксіетил)-ЗПриклад 104 (R)(пентилфенілкарбамоїл-окси)-11-Азабіцикло [2.2.2]окт-3-(R)іловий ефір пеназоніабіцикло[2.2.2]октан, трифторацетат тилфенілкарбамінової кислоти Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом d. Вихід на кінцевій стадії склав 15мг, способом а. Вихід на кінцевій стадії склав 620мг, 42%. МС [M-CF3COO]+: 451. 1 Приклад 112 9%. Н-ЯМР (DMSO-d6): 0,83 (м, 3Н), 1,22-1,30 1-[3-(3-Гідроксифенокси)пропіл]-З(м, 5Н), 1,43-1,56 (м, 5Н), 1,83 (с, 1Н), 2,42-2,65 (м, (R)(пентилфеніл-карбамоїл-окси)-15Н), 3,01-3,06 (м, 1Н), 3,59-3,65 (м, 2Н), 4,49 (м, азоніабіцикло[2.2.2]октан, трифторацетат 1Н), 7,22-7,41 (м, 5Н); МС[М+1]+: 317. Названу в заголовку сполуку синтезували за Приклад 105 способом d. Вихід на кінцевій стадії склав 12мг, 1-Метил-3-(R)(пентилфенілкарбамоїл-окси)-132%. МС [M-CF3COO]+: 467. азоніабіцикло[2.2.2]октан, трифторацетат Приклад 113 Названу в заголовку сполуку синтезували за 1-Гептил-3-(R)(пентилфенілкарбамоїл-окси)-1способом с. Вихід на кінцевій стадії склав 130мг, азоніабіцикло[2.2.2]октан, трифторацетат 68%. 1Н-ЯМР (DMSO-d6): 0,81 (м, 3Н), 1,21 (м, Названу в заголовку сполуку синтезували за 5Н), 1,45-2,20 (м, 6Н), 2,93 (с, 3Н), 3,10-3,70 (м, способом d. Вихід на кінцевій стадії склав 15мг, 7Н), 3,80 (м, 1Н), 4.88 (м, 1Н), 7,24-7,41 (м, 5Н); 45%. МС [M-CF3COO]+: 415. МС[М-Вr]+: 331. Приклад 114 Приклад 106 3-(R)(Пентилфенілкарбамоїл-окси)-1-(31-Аліл-3-(R)(пентилфенілкарбамоїл-окси)-1тіофен-2-ілпроліл)-1-азоніабіцикло[2.2.2]октан, азоніабіцикло[2.2.2]октан, трифторацетат трифторацетат Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом d. Вихід на кінцевій стадії склав 10мг, способом d. Вихід на кінцевій стадії склав 13мг, 35%. 1Н-ЯМР (DMSO-d6): 0,83 (м, 3Н), 1,21-1,28 37%, 1Н-ЯМР (DMSO-d6): 0,82 (м, 3Н), 1,22-1,26 (м, 4Н), 1,46 (м, 3Н), 1,54-1,91 (м, 3Н), 2,30 (м, 1Н), (м, 5Н), 1,46 (м, 3Н), 1,60-2,14 (м, 7Н), 2,82 (м, 2Н), 3,28-3,41 (м, 5Н), 3,78-3,92 (м, 5Н), 4,94 (м, 1Н), 3,20-3,41 (м, 5Н), 3,50-3,70 (м, 2Н), 3,82 (м, 1Н), 5,54-5,64 (м, 2Н), 5,98 (м, 1Н), 7,26-7,43 (м, 5Н); 4,92 (м, 1Н), 6,93-6,99 (м, 2Н), 7,25-7,43 (м, 6Н); МС [M-CF3COO]+: 357. МС [M-CF3COO]+: 441. Приклад 107 Приклад 115 3-(R)(Пентилфенілкарбамоїл-окси)-1-(31-Азабіцикло[2. 2.2]окт-3-(R)іловий ефір пентфеноксипропіл)-1-азоніабіцикло[2.2.2]октан, три4-енілфенілкарбамінової кислоти фторацетат Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом а. Вихід на кінцевій стадії склав 690мг, способом d. Вихід на кінцевій стадії склав 13мг, Χ 14%. Η-ЯΜΡ (DMSO-d6): 1,10-1,60 (м, 6Н), 1,84 36%. МС [M-CF3COO]+: 451. (уш.с, 1Η), 1,97-2,04 (м, 2Н), 2,45-2,65 (м, 5Н), 3,02Приклад 108 3,10 (м, 1Н), 3,29-3,66 (м, 2Н), 4,59 (м, 1Н), 4,613-(R)(Пентилфенілкарбамоїл-окси)-1-(25,00 (м, 2Н), 5,70-5,84 (м, 1Н), 7,22-7,42 (м, 5Н); феноксіетил)-1-азоніабіцикло[2.2.2]октан, трифтоМС[М+1]+: 315. рацетат Приклад 116 Названу в заголовку сполуку синтезували за 1-Аліл-3-(R)(пент-4-енілфенілкарбамоїл-окси)способом d. Вихід на кінцевій стадії склав 14мг, 1-азоніабіцикло[2.2.2]октан, трифторацетат 40%. 1Н-ЯМР (DMSO-d6): 0,82 (м, 3Н), 1,23 (м, Названу в заголовку сполуку синтезували за 4Н), 1,46 (м, 3Н), 1,54-1,91 (м, 3Н), 2,25 (с, 1Н), способом d. Вихід на кінцевій стадії склав 10мг, 3,28-3,70 (м, 9Н), 3,98 (м, 1Н), 4,43 (м, 2Н), 4,95 (м, 35%. МС [M-CF3COO]+: 355. 1Н), 6,98-7,04 (м, 3Н), 7,23-7,4 (м, 7Н); МС [М+ Приклад 117 CF3COO] : 437. 3-(R)(Пент-4-енілфенілкарбамоїл-окси)-1-(3Приклад 109 феноксипропіл)-1-азоніабіцикло[2.2.2]октан, три3-(R)(Пентилфенілкарбамоїл-окси)-1-(3фторацетат фенілпропіл)-1-азоніабіцикло[2.2.2]октан, трифтоНазвану в заголовку сполуку синтезували за рацетат способом d. Вихід на кінцевій стадії склав 15мг, Названу в заголовку сполуку синтезували за 42%. 1Н-ЯМР (DMSO-d6): 1,50-2,20 (м, 11Н), 3,23способом d. Вихід на кінцевій стадії склав 13мг, 39 76131 40 3,47 (м, 7Н), 3,56-3,73 (м, 2Н), 3,87 (м, 1Н), 4,03 (м, 2Н), 7,26-7,44 (м, 6Н); МС [M-CF3COO]+: 439. 2Н), 4,92-4,95 (м, 2Н), 5,00 (м, 1Н), 5,70-5,82 (м, Приклад 126 1Н), 6,93-6,99 (м, 2Н), 7,26-7,44 (м, 8Н); МС [М1-Азабіцикло [2.2.2]окт-3-(R)іловий ефір пенCF3COO]+: 449. тилтіофен-3-ілметилкарбамінової кислоти Приклад 118 Названу в заголовку сполуку синтезували за 3-(R)(Пент-4-енілфенілкарбамоїл-окси)-1-(2способом а. Вихід на кінцевій стадії склав 2000мг, феноксіетил)-1-азоніабіцикло[2.2.2]октан, трифто15%. 1Н-ЯМР (DMSO-d6): 1,10-1,60 (м, 4Η), 1,84 рацетат (уш.с, 1Η), 2,46-2,62 (м, 5Н), 3,02-3,10 (м, 1Н), 4,62Названу в заголовку сполуку синтезували за 4,67 (м, 1Н), 4,84 (с, 2Н), 6,99 (м, 1Н), 7,18-7,36 (м, способом d. Вихід на кінцевій стадії склав 13мг, 6Н), 7,47-7,50 (м, 1Н); МС[М+1]+: 343. 37%. 1Н-ЯМР (DMSO-d6): 1,55 (м, 2Н), 1,65-2,20 Приклад 127 (м, 7Н), 3,28-3,75 (м, 9Н), 3,98 (м, 1Н), 4,43 (уш.с, 1-Аліл-3-(R)(фенілтіофен-3-ілметилкарбамоїл2Н), 4,92-4,99 (м, 3Н), 5,70-5,83 (м, 1Н), 6,98-7,04 окси)-1-азоніабіцикло[2.2.2]октан, трифторацетат (м, 3Н), 7,24-7,40 (м, 7Н); МС [M-CF3COO]+: 435. Названу в заголовку сполуку синтезували за Приклад 119 способом d. Вихід на кінцевій стадії склав 8мг, 3-(R)(Пент-4-енілфенілкарбамоїл-окси)-1-(326%. 1Н-ЯМР (DMSO-d6): 1,45-2,00 (м, 4Н), 2,21 фенілпропіл)-1-азоніабіцикло[2.2.2]октан, трифто(уш.с, 1Н), 3,04-3,42 (м, 5Н), 3,78-3,91 (м, 3Н), 4,87 рацетат (с, 2Н), 5,02 (м, 1Н), 5,54-5,64 (м, 2Н), 5,91-6,02 (м, Названу в заголовку сполуку синтезували за 1Н), 7,00-7,02 (м, 1Н), 7,22-7,39 (м, 6Н), 7,50-7,52 способом d. Вихід на кінцевій стадії склав 13мг, (м, 1Н); МС [M-CF3COO] : 383. 37%. 1Н-ЯМР (DMSO-d6): 1,56 (м, 3Н), 1,70-2,14 Приклад 128 (м, 8Н), 2,58 (м, 2Н), 3,19-3,41 (м, 7Н), 3,56-3,71 (м, 1-(3-Феноксипропіл)-3-(R)(фенілтіофен-32Н), 3,81 (м, 1Н), 4,92-4,99 (м, 3Н), 5,70-5,83 (м, ілметилкарбамоїл-окси)-11Н), 7,20-7,43 (м, 10Н); МС [M-CF3COO]+: 433. азоніабіцикло[2.2.2]октан, трифторацетат Приклад 120 Названу в заголовку сполуку синтезували за 3-(R)(Пент-4-енілфенілкарбамоїл-окси)-1-(3способом d. Вихід на кінцевій стадії склав 12мг, фенілаліл)-1-азоніабіцикло[2.2.2]октан, трифтора31%. МС [M-CF3COO]+: 477. цетат Приклад 129 Названу в заголовку сполуку синтезували за 1-(3-Фенілпропіл)-3-(R)(фенілтіофен-3способом d. Вихід на кінцевій стадії склав 4мг, ілметилкарбамоїл-окси)-112%. МС [M-CF3COO]+: 431. азоніабіцикло[2.2.2]октан, трифторацетат Приклад 121 Названу в заголовку сполуку синтезували за 1-(2-Бензилоксіетил)-3-(R)(пент-4способом d. Вихід на кінцевій стадії склав 15мг, енілфенілкарбамоїл-окси)-141%. 1Н-ЯМР (DMSO-d6): 1,45-2,18 (м, 7Н), 2,59 азоніабіцикло[2.2.2]октан, трифторацетат (м, 2Н), 3,02-3,44 (м, 7Н), 3,84 (м, 1Н), 4,87 (с, 2Н), Названу в заголовку сполуку синтезували за 4,99 (м, 1Н), 7,00 (м, 1Н), 7,21-7,38 (м, 11Н), 7,47способом d. Вихід на кінцевій стадії склав 16мг, 7,50 (м, 1Н); МС [M-CF3COO]+: 461. 44%. МС [M-CF3COO]+: 449. Приклад 130 Приклад 122 1-(3-Фенілаліл)-3-(R)(фенілтіофен-31-[3-(3-Гідроксифенокси)пропіл]-3-(R)(пент-4ілметилкарбамоїл-окси)-1енілфеніл-карбамоїл-окси)-1азоніабіцикло[2.2.2]октан, трифторацетат азоніабіцикло[2.2.2]октан, трифторацетат Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом d. Вихід на кінцевій стадії склав 4мг, способом d. Вихід на кінцевій стадії склав 12мг, 11%. МС [M-CF3COO]+: 459. + 32%. МС [M-CF3COO] : 465. Приклад 131 Приклад 123 1-(2-Бензилоксіетил)-3-(R)(фенілтіофен-31-Гептил-3-(R)(пент-4-енілфенілкарбамоїлілметилкарбамоїл-окси)-1окси)-1-азоніабіцикло[2.2.2]октан, трифторацетат азониабіцикло[2.2.2]октан, трифторацетат Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом d. Вихід на кінцевій стадії склав 3мг, 9%. способом d. Вихід на кінцевій стадії склав 16мг, МС [M-CF3COO]+: 413. 42%. МС [M-CF3COO]+: 477. Приклад 124 Приклад 132 1-Метил-3-(R)(пент-4-енілфенілкарбамоїл1-[3-(3-Гідроксифенокси)пропіл]-3окси)-1-азоніабіцикло[2.2.2]октан, трифторацетат (R)(фенілтіофен-3-іл-метилкарбамоїл-окси)-1Названу в заголовку сполуку синтезували за азоніабіцикло[2.2.2]октан, трифторацетат способом d. Вихід на кінцевій стадії склав 13мг, 4 Названу в заголовку сполуку синтезували за 9%. МС [M-CF3COO]+: 429. способом d. Вихід на кінцевій стадії склав 13мг, Приклад 125 33%. МС [M-CF3COO]+: 493. 3-(R)(Пент-4-енілфенілкарбамоїл-окси)-1-(3Приклад 133 тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, 1-Гептил-3-(R)(фенілтіофен-3трифторацетат ілметилкарбамоіл-окси)-1Названу в заголовку сполуку синтезували за азоніабіцикло[2.2.2]октан, трифторацетат способом d. Вихід на кінцевій стадії склав 15мг, Названу в заголовку сполуку синтезували за 43%. 1Н-ЯМР (DMSO-d6): 1,40-2,20 (м, 11Н), 2,82 способом d. Вихід на кінцевій стадії склав 12мг, (м, 2Н), 3,05-3,5 (м, 7Н), 3,58-3,86 (м, 3Н), 4,92-4,95 34%. 1Н-ЯМР (DMSO-d6): 0,88 (м, 3Н), 1,28 (м, (м, 2Н), 5,00 (м, 1Н), 5,70-5,84 (м, 1Н), 6,93-7,00 (м, 8H), 1,60-2,19 (м, 7Н), 3,00-3,41 (м, 7Н), 3,83 (м, 41 76131 42 1Н), 4,88 (с, 2Н), 5,99 (м, 1Н), 7,01 (м, 1Н), 7,21тіофен-2-ілметилкарбамінової кислоти 7,39 (м, 6Н), 7,49-7,52 (м, 1Н); МС [MCF3COO]+: Названу в заголовку сполуку синтезували за 441. способом а. Вихід на кінцевій стадії склав 340мг, Приклад 134 7%. 1Н-ЯМР (DMSO-d6): 1,28-1,31 (м, 1Н), 1,451-Метил-3-(R)(фенілтіофен-31,72 (м, 3Н), 1,94-1,97 (м, 1Н), 2,49-2,71 (м, 5Η), ілметилкарбамоїл-окси)-13,06-3,14 (м, 1Η), 4,50-4,57 (м, 4Н), 4,62-4,69 (м, азоніабіцикло[2.2.2]октан, трифторацетат 1Η), 6,96-7,06 (м, 4Η), 7,44-7,46 (м, 2Η); МС[М+1]+: Названу в заголовку сполуку синтезували за 363. способом d. Вихід на кінцевій стадії склав 12мг, Приклад 141 42%. МС [M-CF3COO]+: 357. 1-Аліл-3-(R) (біс-тіофен-2-ілметилкарбамоїлПриклад 135 окси)-1-азоніабіцикло[2.2.2]октан, трифторацетат 3-(R)(Фенілтіофен-3-ілметилкарбамоїл-окси)Названу в заголовку сполуку синтезували за 1-(3-тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, способом d. Вихід на кінцевій стадії склав 9мг, бромід 19%. 1Н-ЯМР (DMSO-d6): 1,70-2,06 (м, 4Н), 2,35 Названу в заголовку сполуку синтезували за (уш.с, 1Н), 3,25-3,50 (м, 5Н), 3,80-3,94 (м, 3Н), 4,54способом с. Вихід на кінцевій стадії склав 500мг, 4,71 (м, 4Н), 5,10 (м, 1Н), 5,55-5,65 (м, 2Н), 5,8778%. 1Н-ЯМР (DMSO-d6): 1,45-2,19 (м, 7Н), 2,83 6,10 (м, 1Н), 6,98-7,01 (м, 2Н), 7,06-7,10 (м, 2Н), (м, 2Н), 3,04-3,13 (м, 1Н), 3,19-3,46 (м, 6Н), 3,837,47-7,48 (м, 2Н); МС [M-CF3COO]+: 403. 3,90 (м, 1Н), 4,88 (с, 2Н), 4,99 (м, 1Н), 6,94 (м, 3Н), Приклад 142 7,20-7,40 (м, 7Н), 7,49 (м, 1Н); МС[М-Вr]+: 467; тем3-(R)(Біс-тіофен-2-ілметилкарбамоїл-окси)-1пература 110°С. (3-фенілпропіл)-1-азоніабіцикло[2.2.2]октан, броПриклад 136 мід 3-(R)(Фенілтіофен-3-ілметилкарбамоїл-окси)Названу в заголовку сполуку синтезували за 1-(2-феноксіетил)-1-азоніабіцикло[2.2.2]октан, способом с. Вихід на кінцевій стадії склав 690мг, бромід 82%. 1Н-ЯМР (DMSO-d6): 1,78-2,10 (м, 6Н), 2,34 Названу в заголовку сполуку синтезували за (уш.с, 1Н), 2,53-2,63 (м, 2Н), 3,23-3,48 (м, 7Н), 3,88 способом с. Вихід на кінцевій стадії склав 350мг, (м, 1Н), 4,53-4,74 (м, 4Н), 5,05 (м, 1Н), 6,98-7,01 (м, 1 63%. Н-ЯМР (DMSO-d6): 1,45-2,20 (м, 5Н), 3,27 2Н), 7,02-7,11 (м, 2Н), 7,21-7,37 (м, 5Н), 7,44-7,48 (м, 1Н), 3,40-3,80 (м, 6Н), 4,00-4,06 (м, 1Н), 4,44 (м, 2Н); МС[М-Вr]+: 481. (уш.с, 2Н), 4,87 (с, 2Н), 5,02 (м, 1Н), 6,99-7,04 (м, Приклад 143 4Н), 7,20-7,38 (м, 8Н), 7,48 (м, 1Н); МС[М-Вr]+: 463; 1-Азабіцикло[2.2.2]окт-3-(R)іловий ефір фурантемпература 131°С. 2-ілметилкарбамінової кислоти Приклад 137 Названу в заголовку сполуку синтезували за 1-Азабіцикло[2.2.2]окт-3-(R)іловий ефір бутилспособом а. Вихід на кінцевій стадії склав 700мг, тіофен-2-ілметилкарбамінової кислоти 10%. 1Н-ЯМР (DMSO-d6): 1,10-1,34 (м, 1Н), 1,44Названу в заголовку сполуку синтезували за 1,67 (м, 3Н), 1,93 (уш.с, 1Н), 2,50-2,70 (м, 5Η), 3,05способом а. Вихід на кінцевій стадії склав 1300мг, 3,12 (м, 1Η), 3,37-4,40 (м, 2Н), 4,57-4,66 (м, 3Η), 29%. 1Η-ΗΜΡ (DMSO-d6): 0,85 (м, 3Η), 1,19-1,68 6,26-6,42 (м, 2Η), 6,95-7,03 (м, 2Η), 7,45 (м, 1Η), (м, 8Η), 1,92 (м, 1Н), 2,49-2,64 (м, 5Η), 3,05-3,22 (м, 7,61(м, 1Η); MC[M+1]+: 347. 3Н), 4,56-4,62 (м, 3Н), 6,95-7,04 (м, 2Н), 7,42-7,44 Приклад 144 (м, 1Н); МС[М+1]+: 323. 1-Аліл-3-(R)(фуран-2-ілметилтіофен-2Приклад 138 ілметилкарбамоїл-окси)-11-Аліл-3-(R)(фенілтіофен-2-ілметилкарбамоїлазоніабіцикло[2.2.2]октан, трифторацетат окси)-1-азоніабіцикло[2.2.2]октан, трифторацетат Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом d. Вихід на кінцевій стадії склав 7мг, способом d. Вихід на кінцевій стадії склав 10мг, 15%. МС [M-CF3COO]+: 387. 1 23%. Н-ЯМР (DMSO-d6): 0,86 (м, 3Н), 1,20-1,26 Приклад 145 (м, 2Н), 1,42-1,49 (м, 2Н), 1,58-2,05 (м, 4Η), 2,32 3-(R)(Фуран-2-ілметилтіофен-2(уш.с, 1Η), 3,20-3,41 (м, 7Η), 3,74-3,94 (м, 3Н), 4,51ілметилкарбамоїл-окси)-1-(3-фенілпропіл)-14,72 (м, 2Η), 4,99 (м, 1Н), 5,55-5,64 (м, 2Η), 5,87азоніабіцикло[2.2.2]октан, трифторацетат 6,10 (м, 1H) , 6,99 (м, 1Η), 7,08 (м, 1Η), 7,46 (м, 1Η); Названу в заголовку сполуку синтезували за МС [Μ-CF3COO]+: 363. способом d. Вихід на кінцевій стадії склав 11мг, Приклад 139 20%. 1Н-ЯМР (DMSO-d6): 1,70-2,10 (м, 6Н), 2,31 3-(R)(Бутилтіофен-2-ілметилкарбамоїл-окси)(уш.с, 1Н), 2,59 (м, 2Н), 3,15-3,50 (м, 7Н), 3,84 (м, 1-(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октан, 1Н), 4,36-4,56 (м, 4Н), 5,03 (м, 1Н), 6,32-6,44 (м, трифторацетат 2Н), 6,92-7,08 (м, 2Н), 7,20-7,35 (м, 5Н), 7,41-7,46 Названу в заголовку сполуку синтезували за (м, 1Н), 7,59-7,62 (м, 1Н); МС [M-CF3COO]+: 465. способом d. Вихід на кінцевій стадії склав 13мг, Приклад 146 25%. 1Н-ЯМР (DMSO-d6): 0,85 (м, 3Н), 1,19-1,26 3-(R)(біс-Тиофен-2-ілметилкарбамоїл-окси)-1(м, 2Н), 1,41-1,50 (м, 2Н), 1,75-2,10 (м, 6Н), 2,30 (3-тіофен-2-ілпропіл)-1-азоніабіцикло[2.2.2]октан, (уш.с, 1Н), 2,59 (м, 2Н), 3,10-3,50 (м, 9Н), 3,83 (м, бромід 1Н), 4,50-4,74 (м, 2Н), 4,97 (м, 1Н), 6,97 (м, 1Н), Названу в заголовку сполуку синтезували за 7,07 (м, 1Н), 7,20-7,35 (м, 5Н), 7,43 (м, 1Н); МС способом с. Вихід на кінцевій стадії склав 690мг, [MCF3COO]+: 441. 81%. 1Н-ЯМР (DMSO-d6): 1,78-2,10 (м, 6Н), 2,34 Приклад 140 (уш.с, 1Н), 2,82 (м, 2Н), 3,21-3,46 (м, 7Н), 3,89 (м, 1-Азабіцикло[2.2.2]окт-3-(R)іловий ефір біс1Η), 3,54 (м, 4Η), 5,06 (м, 1Η), 6,95-7,01 (м, 4Η), 43 76131 44 7,07-7,11 (м, 2Η), 7,38-7,49 (м, 3Н); MC[M-Br]+: 487; Приклад 153 температура 143°С. 1-Азабіцикло[2.2.2]окт-3-(R)іловий ефір фуранПриклад 147 2-ілметилфенілкарбамінової кислоти 1-Азабіцикло [2.2.2]окт-3-(R)іловий ефір алілНазвану в заголовку сполуку синтезували за тіофен-2-ілметилкарбамінової кислоти способом а. Вихід на кінцевій стадії склав 1400мг, 1 Названу в заголовку сполуку синтезували за 18%. Н-ЯМР (DMSO-d6): 1,19-1,60 (м, 4Н), 1,84 способом а. Вихід на кінцевій стадії склав 3220мг, (уш.с, 1Н), 2,44-2,57 (м, 5Η), 3,01-3,09 (м, 1H), 4,63 30%. 1Η-ΗΜΡ (DMSO-d6): 1,20-1,33 (м, 1H), 1,45(м, 1Η), 4,82 (с, 2Н), 6,21 (м, 1Н), 6,36 (м, 1Η), 7,201,80 (м, 3Η), 1,93 (уш.с, 1Н), 2,49-2,72 (м, 5Η), 3,057,37 (м, 5Η), 7,59 (м, 1Η); МС[М+1]+: 327. 3,09 (м, 1Н), 3,81-3,83 (м, 2Н), 3,83-4,55 (м, 3Η), Приклад 154 5,14 (м, 2Η), 5,70-5,82 (м, 1Н), 6,96-7,04 (м, 2Н), 1-Аліл-3-(R)(фуран-2-ілметилфенілкарбамоїл7,44-7,45 (м, 1Η); МС[М+1]+: 307. окси)-1-азоніабіцикло[2.2.2]октан, трифторацетат Приклад 148 Названу в заголовку сполуку синтезували за 3-Аліл-3-(R)(алілтіофен-2-ілметилкарбамоїлспособом d. Вихід на кінцевій стадії склав 7мг, окси)-1-азоніабіцикло[2.2.2]октан, трифторацетат 16%. 1Н-ЯМР (DMSO-d6): ; MC[M-CF3COO]+: 367. Названу в заголовку сполуку синтезували за Приклад 155 способом d. Вихід на кінцевій стадії склав 10мг, 3-(R)(Фуран-2-ілметилфенілкарбамоїл-окси)-124%. 1Н-ЯМР (DMSO-d6): 1,80-2,10 (м, 4Н), 2,32 (3-фенілпропіл)-1-азоніабіцикло[2.2.2]октан, три(уш.с, 1Н), 3,20-3,50 (м, 5Н), 3,75-3,94 (м, 5Н), 4,5фторацетат 4,69 (м, 2Н), 5,01 (м, 1Н), 5,10-5,23 (м, 2Н), 5,51Названу в заголовку сполуку синтезували за 5,65 (м, 2Н), 5,70-5,85 (м, 1Н), 5,90-6,08 (м, 1Н), способом d. Вихід на кінцевій стадії склав 11мг, 6,95-7,10 (м, 2H), 7,47 (м, 1Н); МС [M-CF3COO]+: 21%. 1Н-ЯМР (DMSO-d6): 1,65-2,10 (м, 6Н), 2,19 347. (уш.с, 1Н), 2,59 (м, 2Н), 3,10-3,50 (м, 7Н), 3,83 (м, Приклад 149 1Н), 4,85 (уш.с, 2Н), 4,98 (м, 1Н), 6,26 (м, 1Н), 6,36 3-(R)(Алілтіофен-2-ілметилкарбамоїл-окси)-1(м, 1Н), 7,20-7,39 (м, 10Н), 7,59 (м, 1Н); МС [М(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октан, триCF3COO]+: 445. фторацетат Приклад 156 Названу в заголовку сполуку синтезували за 1-Азабіцикло[2.2.2]окт-3-(R)іловий ефір бісспособом d. Вихід на кінцевій стадії склав 11мг, фуран-2-ілметрілкарбамінової кислоти 22%. 1Н-ЯМР (DMSO-d6): 1,74-2,10 (м, 6Н), 2,31 Названу в заголовку сполуку синтезували за (уш.с, 1Н), 2,59 (м, 2Н), 3,16-3,56 (м, 7Н), 3,76-3,90 способом а. Вихід на кінцевій стадії склав 2100мг, (м, 3Н), 4,48-4,71 (м, 2Н), 4,99 (м, 1Н), 5,11-5,23 (м, 22%. 1Η-ЯΜΡ (DMSO-d6): 1,20-1,70 (м, 4Η), 1,89 2Н), 5,72-5,83 (м, 1Н), 6,98 (м, 1Н), 7,06-7,07 (м, (уш.с, 1Η), 2,45-2,71 (м, 5Н), 3,00-3,12 (м, 1H), 4,40 1Н), 7,20-7,35 (м, 5Н), 7,44 (м, 1Н); МС[M(м, 4Η) , 4,62 (м, 1Η), 6,22-6,40 (м, 4Η), 7,59 (м, 2Η); CF3COO]+: 425. MC[M+1]+: 331. Приклад 150 Приклад 157 1-Азабіцикло [2.2.2]окт-3-(R)іловий ефір цик1-Аліл-3-(R)(біс-фуран-2-ілметрілкарбамоїллопентилтіофен-2-ілметилкарбамінової кислоти окси)-1-азоніабіцикло[2.2.2]октан, трифторацетат Названу в заголовку сполуку синтезували за Названу в заголовку сполуку синтезували за способом а. Вихід на кінцевій стадії склав 2250мг, способом d. Вихід на кінцевій стадії склав 7мг, 33%. 1Н-ЯМР (DMSO-d6): 1,20-1,40 (м, 1H), 1,4516%. 1Н-ЯМР (DMSO-d6): ; MC[M-CF3COO]+: 371. 1,72 (м, 11Н), 1,89 (уш.с, 1Н), 2,45-2,62 (м, 5Н), Приклад 158 3,03-3,10 (м, 1Н), 4,22 (уш.с, 1Н), 4,50-4,56 (м, 3Н), 3-(R)(Біс-фуран-2-ілметилкарбамоїл-окси)-16,93-6,99 (м, 2Н), 7,38 (м, 1Н); МС[М+1]+: 335. (3-фенілпропіл)-1-азоніабіцикло[2.2.2]октан, триПриклад 151 фторацетат 1-Аліл-3-(R) (циклопентилтіофен-2Названу в заголовку сполуку синтезували за ілметилкарбамоїл-окси)-1способом d. Вихід на кінцевій стадії склав 11мг, азоніабіцикло[2.2.2]октан, трифторацетат 20%. 1Н-ЯМР (DMSO-d6): 1,70-2,10 (м, 6Н), 2,29 Названу в заголовку сполуку синтезували за (уш.с, 1Н), 2,59 (м, 2Н), 3,10-3,50 (м, 7Н), 3,82 (м, способом d. Вихід на кінцевій стадії склав 10мг, 1Н), 4,32-4,54 (м, 4Н), 5,01 (м, 1Н), 6,29-6,41 (м, 1 22%. Н-ЯМР (DMSO-d6): 1,40-2,05 (м, 12Н), 2,27 4Н), 7,20-7,35 (м, 5Н), 7,57-7,61 (м, 2Н); МС [M(уш.с, 1Н), 3,03-3,42 (м, 5Н), 3,70-3,95 (м, 3Н), 4,15CF3COO]+: 449. 4,35 (м, 1Н), 5,58 (м, 2Н), 4,99 (м, 1Н), 5,54-5,65 (м, Приклад 159 2Н), 5,87-6,10 (м, 1Н), 6,97 (м, 1Н), 7,03 (м, 1Н), 1-Азабіцикло[2.2.1]гепт-4-иловий ефір бензи7,41-7,43 (м, 1Н); МС [M-CF3COO]+: 375. лфенілкарбамінової кислоти Приклад 152 Названу в заголовку сполуку синтезували за 3-(R)(Циклопентилтіофен-2-ілметилкарбамоїлспособом а. Вихід на кінцевій стадії склав 4,86мг, окси)-1-(3-фенілпропіл)-11,3% у вигляді форміату. 1Н-ЯМР (DMSO-d6): азоніабіцикло[2.2.2]октан, трифторацетат 1,86 (м, 4Н), 2,65 (с, 2Н), 2,77 (уш.с, 2Н), 3,03 Названу в заголовку сполуку синтезували за (уш.с, 2Н), 4,84 (с, 2Н), 7,14-7,32 (м, 10Н), 8,19 (с, способом d. Вихід на кінцевій стадії склав 13мг, 1Н); МС[М-НСОО]+: 323. 24%. 1Н-ЯМР (DMSO-d6): 1,40-2,10 (м, 14Н), 2,25 Приклад 160 (уш.с, 1Н), 2,58 (м, 2Н), 2,95-3,50 (м, 7Η), 3,81 (м, 1-Азабіцикло[2.2.2]окт-4-іловий ефір бензил1Η), 4,26 (м, 1Η), 4,50-4,70 (м, 2Н), 4,97 (м, 1Н), фенілкарбамінової кислоти 6,93 (м, 1Н), 7,03 (м, 1Н), 7,20-7,40 (м, 6Н); МС [МНазвану в заголовку сполуку синтезували за CF3COO]+: 453. способом а. Вихід на кінцевій стадії склав 2,56мг, 45 76131 46 1 штамп/пробійник 6,5мм у діаметрі, одержуючи в 1% у вигляді форміату. Н-ЯМР (DMSO-d6): 1,81 результаті 3000 таблеток, кожна з який має вагу (м, 6Н), 2,83 (м, 6Н), 4,81 (с, 2Н), 7,14-7,32 (м, 150мг. 10Н), 8,24 (с, 1Н); МС [М-НСОО]+: 337. Окремо готували покривний розчин суспендуПриклади 161-165 ілюструють фармацевтичні ванням 6,9г гідроксипропілметилцелюлози 2910, композиції відповідно до даного винаходу та спо1,2г поліетиленгліколю 6000, 3,3г двоокису титану соби їхнього одержання. та 2,1г очищеного тальку в 72,6г води. ВикористоПриклад 161 вуючи пристрій для нанесення покриття High Одержання фармацевтичної композиції: табCoated, 3000 отриманих таблеток покривали поклетки риваючим розчином, щоб одержати покриті плівСклад: кою таблетки, кожна з який має вагу 154,5мг. Сполука за даним винаходом 50мг Приклад 163 Лактоза 113,6мг Виготовлення фармацевтичної композиції: рідМікрокристалічна целюлоза 28,4мг кий інгаляційний препарат Пухкий кремнієвий ангідрид 1,5мг Склад: Стеарат магнію 1,5мг Сполука даного винаходу 400мкг Використовуючи змішувач, 15г сполуки даного Фізіологічний розчин 1мл винаходу змішували з 340,8г лактози та 85,2г мікПорцію 40мг сполуки даного винаходу розчирокристалічної целюлози. Суміш піддавали пресуняли в 90мл фізіологічного розчину та розчин дованню у формах, використовуючи роликовий комводили до загального обсягу 100мл тим же самим пактор з одержанням пластівчастого пресованого фізіологічним розчином, розподіляли порціями в матеріалу. Пластівчастий пресований матеріал 1мл в ампули ємністю 1мл, а потім стерилізували подрібнювали, використовуючи молоткову дробарпри 115°С на протязі 30 хвилин, щоб одержати ку, та здрібнений матеріал просівали через сито рідкий інгаляційний препарат. 20меш. До просіяного матеріалу додавали порцію Приклад 164 4,5г пухкого кремнієвого ангідриду та 4,5г стеарату Виготовлення фармацевтичної композиції: помагнію та змішували. Змішаний продукт оброблярошкоподібний інгаляційний препарат ли в таблетувальній машині, що обладнана систеСклад: мою штамп/пробійник 7,5мм у діаметрі, одержуючи Сполука даного винаходу 200мкг в результаті 3000 таблеток, кожна з який має вагу Лактоза 4000мкг 150мг. Порцію 20г сполуки даного винаходу рівномірПриклад 162 но змішували з 400г лактози та порцію 200мг суВиготовлення фармацевтичної композиції: поміші упаковували в порошковий пульверизатор криті таблетки для ексклюзивного застосування, щоб одержати Склад: порошкоподібний інгаляційний препарат. Сполука за даним винаходом 5,0мг Приклад 165 Лактоза 95,2мг Виготовлення фармацевтичної композиції: інКукурудзяний крохмаль 40,8мг галяційний аерозоль. Полівінілпіролідон 7,5мг Склад: Стеарат магнію 1,5мг Сполука даного винаходу 200мкг Гідроксипропілцелюлоза 2,3мг Дегідратований (абсолютний) етіПоліетиленгліколь 0,4мг ловий спирт USP 8400мкг Двоокис титану 1,1мг 1,1,1,2-Тетрафторетан (HFC-134A) 46810мкг Очищений тальк 0,7мг Концентрат активного інгредієнта одержували Використовуючи машину для гранулювання розчиненням 0,0480г сполуки даного винаходу в сипучого матеріалу, 15г сполуки даного винаходу 20160г етилового спирту. Концентрат вводили в змішували з 285,6г лактози та 122,4г кукурудзяного придатний апарат для заповнення. Концентрат крохмалю. Окремо розчиняли 22,5г полівінілпіроактивного інгредієнта наливали в аерозольний лідону в 127,5г води з одержанням єднального контейнер, головний простір контейнера продуварозчину. Використовуючи машину для гранулюли парами азоту або HFC-134A (інгредієнти, що вання сипучого матеріалу, єднальний розчин розпродувають, не повинні містити більш 1ч/млн кисприскували на вищезгадану суміш, щоб одержати ню) та герметично закривали клапаном. Потім у грануляти. До отриманих гранулятів додавали герметично закритий контейнер під тиском уводипорцію 4,5г стеарату магнію та змішували. Отрили 11,2344г пропеленту HFC-134A. ману суміш обробляли у таблетувальній машині, постаченою двоввігнутою системою Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinuclidine carbamate derivatives and medicinal compositions containing said derivatives
Автори англійськоюBuil Albero Maria Antonia
Назва патенту російськоюПроизводные карбамата хинуклидина и лекарственные композиции, которые содержат указанные производные
Автори російськоюБуил Альберо Мария Антония
МПК / Мітки
МПК: C07D 471/08, A61P 11/00, A61K 31/439, C07D 209/00, C07D 453/00, C07D 221/00, A61P 1/00, C07D 203/00, A61P 13/00
Мітки: карбамату, названі, лікарські, хінуклідину, похідні, композиції, містять
Код посилання
<a href="https://ua.patents.su/23-76131-pokhidni-karbamatu-khinuklidinu-ta-likarski-kompozici-shho-mistyat-nazvani-pokhidni.html" target="_blank" rel="follow" title="База патентів України">Похідні карбамату хінуклідину та лікарські композиції, що містять названі похідні</a>
Попередній патент: Застосування сполук, що одночасно є агоністами 5-ht1a рецептора і інгібіторами зворотного захоплення серотоніну, для лікування синдрому подразненого кишечнику
Наступний патент: Мишоловка коротюка-доробало
Випадковий патент: Спосіб виявлення колагену iii типу в гістологічних препаратах



























