Похідні хінуклідину та лікарські композиції, що їх містять
Номер патенту: 75626
Опубліковано: 15.05.2006
Автори: Прат Квінонес Марія, Фернандез Форнер Марія Долорс, Буіл Альберо Марія Антонія
Формула / Реферат
1. Сполука формули (І):
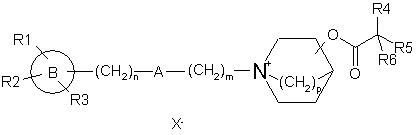 (I),
(I),
де В є фенільним кільцем, 5-10-членою гетероароматичною групою, що містить один або декілька гетероатомів, вибраних з N, S та О, або нафталенільною, 5,6,7,8-тетрагідронафталенільною, бензо[1,3]діоксолільною або біфенільною групою;
кожен із замісників R1, R2 і R3 незалежно являє собою атом водню або галогену або фенільну групу, -OR7, -SR7, -NR7R8, -NHCOR7, -CONR7R8, -CN, -NO2, -COOR7 або -CF3 групу, нерозгалужену або розгалужену С1-С8-алкільну групу, незаміщену або заміщену одним або більше атомами галогену, гідроксигрупами або С1-С6-алкоксигрупами, де кожен із замісників R7 і R8 незалежно являє собою атом водню, нерозгалужену або розгалужену С1-С8-алкільну групу, або разом утворюють С3-С8-аліциклічне кільце; або R1 і R2 разом утворюють С5-С14-ароматичне або С3-С8-аліциклічне кільце або 5-10-членну гетероциклічну групу, що містить один або більше гетероатомів, вибраних з N, S та О;
n є цілим числом від 0 до 4;
А являє собою групу, вибрану з -CH=CR9-, -CR9=CH-, -CR9R10-, -CO-, -O-, -S-, -S(O)-, -S(O)2- і -NR9-, де кожен із замісників R9 і R10 незалежно являє собою атом водню, нерозгалужену або розгалужену С1-С8-алкільну групу, або разом утворюють С3-С8-аліциклічне кільце;
m є цілим числом від 0 до 8, за умови, що якщо m дорівнює 0, А не є -СН2-;
р є цілим числом від 1 до 2, і заміщення в азонієвому біциклічному кільці можливе в положенні 2, 3 або 4, включаючи всі можливі конфігурації асиметричних атомів вуглецю;
R4 являє собою групу структури:
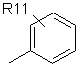 ,
, 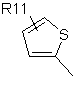 ,
, 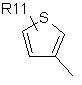 ,
, 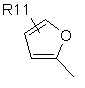 ,
, 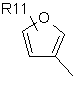 ,
,
де R11 являє собою атом водню або галогену, гідроксигрупу, С1-С6-алкоксигрупу, нітрогрупу, ціаногрупу, -CO2R12 або -NR12R13, де R12 і R13 є однаковими або різними й вибрані з водню і нерозгалужених або розгалужених С1-С8-нижчих алкільних груп, або нерозгалужену або розгалужену С1-С8 алкільну групу, незаміщену або заміщену одним або більше атомами галогену, гідроксигрупами або С1-С6-алкоксигрупами;
R5 являє собою алкільну групу, що містить від 1 до 7 атомів вуглецю, алкенільну групу, що містить від 2 до 7 атомів вуглецю, алкінільну групу, що містить від 2 до 7 атомів вуглецю, циклоалкільну групу, що містить від 3 до 7 атомів вуглецю, або групу формули:
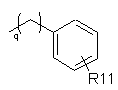 ,
,
де q дорівнює 1 або 2, а значення R11 визначене вище;
R6 являє собою атом водню, гідроксигрупу, метильну групу або групу -СН2ОН, і
Х- являє собою фармацевтично прийнятний аніон моно- або полівалентної кислоти.
2. Сполука за п. 1, де р дорівнює 2.
3. Сполука за п. 1 або п. 2, де R4 являє собою незаміщену фенільну, 2-тієнільну, 3-тієнільну, 2-фурильну або 3-фурильну групу.
4. Сполука за будь-яким із попередніх пунктів, де R5 являє собою циклопентильну, циклогексильну, пентильну, алільну, вінільну, пропінільну, бензильну або фенетильну групу.
5. Сполука за будь-яким із попередніх пунктів, де група -О-CO-C(R4)(R5)(R6) являє собою групу, вибрану з 2-циклопентил-2-гідрокси-2-тієн-2-ілацетоксигрупи; 2,3-дифенілпропіонілоксигрупи; 2-гідроксиметил-2,3-дифенілпропіонілоксигрупи; 2-гідрокси-2,3-дифенілпропіонілоксигрупи; 2-гідрокси-3-феніл-2-тієн-2-ілпропіонілоксигрупи; 2-гідрокси-2-тієн-2-ілпент-4-еноїлоксигрупи; 2-гідрокси-2-тієн-2-ілгептаноїлоксигрупи; 2-гідрокси-2-тієн-2-ілпент-3-іноїлоксигрупи; 2-гідрокси-2-тієн-2-ілбут-3-еноїлокси групи; 2-циклопентил-2-фур-2-ил-2-гідроксіацетоксигрупи; 2-циклогексил-2-гідрокси-2-фенілацетоксигрупи; 2-циклогексил-2-фур-2-ил-2-гідроксіацетоксигрупи; 2-циклопентил-2-гідрокси-2-фенілацетоксигрупи; 2-циклогексил-2-гідрокси-2-тієн-2-ілацетоксигрупи і 2-гідрокси-4-феніл-2-тієн-2-ілбутаноїлоксигрупи.
6. Сполука за будь-яким із попередніх пунктів, де В являє собою фенільну, піролільну, тієнільну, фурильну, біфенільну, нафталенільну, 5,6,7,8-тетрагідронафталенільну, бензо[1,3]діоксолільну, імідазолільну або бензотіазолільну групу.
7. Сполука за п. 6, де В являє собою фенільну, піролільну або тієнільну групу.
8. Сполука за будь-яким із попередніх пунктів, де кожен із замісників R1, R2 і R3 незалежно являють собою атом водню або галогену або гідроксигрупу, метильну, трет-бутильну, -СН2ОН, 3-гідроксипропільну, -ОМе, -NMe2, -NHCOMe, -CONH2, -CN, -NО2, -СООМе або -CF3 групу.
9. Сполука за п. 8, де кожен із замісників R1, R2 і R3 незалежно являють собою атом водню або галогену або гідроксигрупу.
10. Сполука за будь-яким із попередніх пунктів, де n дорівнює 0 або 1; m є цілим числом від 1 до 6; і А являє собою -CH2-, -CH=CH-, -CO-, -NMe-, -О- або -S-групу.
11. Сполука за п. 10, де m дорівнює 1, 2 або 3, і А являє собою -CH2-, -СН=СН-, -О- або -S-групу.
12. Сполука за будь-яким із попередніх пунктів, де атом азоту азонієвої біциклогрупи заміщений групою, вибраною з 3-феноксипропільної, 2-феноксіетильної, 3-фенілалільної, фенетильної, 3-фенілпропільної, 3-(3-гідроксифенокси)пропільної, 3-(4-фторфенокси)пропільної, 3-тієн-2-ілпропільної, 4-оксо-4-тієн-2-ілбутильної, 2-бензилоксіетильної, 3-орто-толілоксипропільної, 3-(3-ціанофенокси)пропільної, 3-(метилфеніламіно)пропільної, 3-фенілсульфанілпропільної, 4-оксо-4-фенілбутильної, 3-(2-хлорфенокси)пропільної, 3-(2,4-дифторфенокси)пропільної, 3-(4-метоксифенокси)пропільної, 3-(бензо[1,3]діоксол-5-ілокси)пропільної групи.
13. Сполука за будь-яким із попередніх пунктів, де Х- являє собою хлорид-, бромід-, трифторацетат- або метансульфонат-аніон.
14. Сполука за будь-яким із попередніх пунктів, де азонієва біциклічна група заміщена в положенні 3.
15. Сполука за п. 14, де замісник у положенні 3 азонієвої біциклічної групи має R-конфігурацію.
16. Сполука за п. 14, де замісник у положенні 3 азонієвої біциклічної групи має S-конфігурацію.
17. Сполука за будь-яким із попередніх пунктів, де атом вуглецю, заміщений R4, R5 і R6, має R-конфігурацію.
18. Сполука за будь-яким із пунктів 1-16, де атом вуглецю, заміщений R4, R5і R6, має S-конфігурацію.
19. Сполука за будь-яким із попередніх пунктів, що є одним ізомером.
20. Сполука за п. 1, яка є:
(3R)-3-(2,3-дифенілпропіонілокси)-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-(2,3-дифенілпропіонілокси)-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-(2-гідроксиметил-2,3-дифенілпропіонілокси)-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-(2-гідроксиметил-2,3-дифенілпропіонілокси)-1-фенетил-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-(2-гідрокси-2,3-дифенілпропіонілокси)-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октанбромід;
(3R)-3-(2-гідрокси-2,3-дифенілпропіонілокси)-1-(2-феноксіетил)-1-азоніабіцикло[2.2.2]октанбромід;
(3R)-3-(2-гідрокси-3-феніл-2-тієн-2-ілпропіонілокси)-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-(2-гідрокси-3-феніл-2-тієн-2-ілпропіонілокси)-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-(2-гідрокси-2-тієн-2-ілпент-4-еноїлокси)-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октанбромід;
(3R)-3-(2-гідрокси-2-тієн-2-ілпент-4-еноїлокси)-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-(2-гідрокси-2-тієн-2-ілпент-4-еноїлокси)-1-(2-феноксіетил)-1-азоніабіцикло[2.2.2]октанбромід;
(3R)-3-(2-гідрокси-2-тієн-2-ілгептаноїлокси)-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-(2-гідрокси-2-тієн-2-ілгептаноїлокси)-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-(2-гідрокси-2-тієн-2-ілпент-3-еноїлокси)-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-(2-гідрокси-2-тієн-2-ілпент-3-еноїлокси)-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-(2-гідрокси-2-тієн-2-ілбут-3-еноїлокси)-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-(2-гідрокси-2-тієн-2-ілбут-3-еноїлокси)-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октанбромід;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(2-феноксіетил)-1-азоніабіцикло[2.2.2]октанбромід;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-фенетил-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-фенілаліл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(4-фторфенокси)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(4-оксо-4-тієн-2-ілбутил)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[4-(4-фторфеніл)-4-оксобутил]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(3-гідроксифенокси)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
1-(2-бензилоксіетил)-(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-орто-толілоксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
1-[3-(3-ціанофенокси)пропіл]-(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(нафтален-1-ілокси)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(метилфеніламіно)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-фенілсульфанілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(4-оксо-4-фенілбутил)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(2,4,6-триметилфенокси)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
1-[3-(2-хлорфенокси)пропіл]-(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(3-трифторметилфенокси)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
1-[3-(біфеніл-4-ілокси)пропіл]-(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(2,4-дифторфенокси)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(4-метоксифенокси)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(5,6,7,8-тетрагідронафтален-2-ілокси)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
1-[3-(бензо[1,3]діоксол-5-ілокси)пропіл]-(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-азоніабіцикло[2.2.2]октантрифторацетат;
1-[3-(2-карбамоїлфенокси)пропіл]-(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(3-диметиламінофенокси)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
1-[3-(4-ацетиламінофенокси)пропіл]-(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(4-метоксикарбонілфенокси)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(4-нітрофенокси)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(4-гідроксиметилфенокси)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октанбромід;
(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(2-феноксіетил)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-фенетил-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-фенілаліл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-[3-(4-фторфенокси)пропіл]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-2-гідроксіацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-2-гідроксіацетокси]-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-2-гідроксіацетокси]-1-фенетил-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-2-гідроксіацетокси]-1-(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2-гідроксіацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2-гідроксіацетокси]-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2-гідроксіацетокси]-1-фенетил-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2-гідроксіацетокси]-1-(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклогексил-2-гідрокси-2-фенілацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклогексил-2-гідрокси-2-фенілацетокси]-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклогексил-2-гідрокси-2-фенілацетокси]-1-фенетил-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклогексил-2-гідрокси-2-фенілацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклогексил-2-гідрокси-2-фенілацетокси]-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклогексил-2-гідрокси-2-фенілацетокси]-1-фенетил-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклогексил-2-фур-2-ил-2-гідроксіацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(ЗR)-3-[(2S)-2-циклогексил-2-фур-2-ил-2-гідроксіацетокси]-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклогексил-2-фур-2-ил-2-гідроксіацетокси]-1-фенетил-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклогексил-2-фур-2-ил-2-гідроксіацетокси]-1-(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2-гідроксіацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2-гідроксіацетокси]-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2-гідроксіацетокси]-1-фенетил-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2-гідроксіацетокси]-1-(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-фенетил-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-(3-фенілсульфанілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-фенетил-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-(3-фенілсульфанілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклогексил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2S)-2-циклогексил-2-гідрокси-2-тієн-2-ілацетокси]-1-фенетил-1-азоніабіцикло[2.2.2]октантрифторацетат;
1-[3-(3-ціанофенокси)пропіл]-(3R)-3-[(2S)-2-циклогексил-2-гідрокси-2-тієн-2-ілацетокси]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклогексил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-[(2R)-2-циклогексил-2-гідрокси-2-тієн-2-ілацетокси]-1-фенетил-1-азоніабіцикло[2.2.2]октантрифторацетат;
1-[3-(3-ціанофенокси)пропіл]-(3R)-3-[(2R)-2-циклогексил-2-гідрокси-2-тієн-2-ілацетокси]-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3R)-3-(2-гідрокси-4-феніл-2-тієн-2-ілбутаноїлокси)-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3S)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октанбромід;
(3S)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
(3S)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1-(3-фенілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
4-[(2R)-2-циклогексил-2-гідрокси-2-фенілацетокси]-1-(3-тієн-2-ілпропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат;
4-[(2R)-2-циклогексил-2-гідрокси-2-фенілацетокси]-1-(3-феноксипропіл)-1-азоніабіцикло[2.2.2]октантрифторацетат.
21. Сполука за будь-яким з пп. 1-20 для застосування в терапевтичному способі лікування людини або тварини.
22. Спосіб одержання сполуки формули (І):
 (I),
(I),
де R1, R2, R3, R4, R5, R6, p, m, n, А, В і Х визначені вище в будь-якому з пп. 1-18, згідно з яким здійснюють кватернізацію атома азоту азонієвого біциклічного кільця сполуки формули (III):
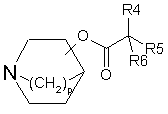 (III),
(III),
де R4, R5, R6 і р визначені вище, з алкілуючим агентом формули (II):
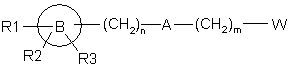 (II),
(II),
де R1, R2, R3, m, n, А і В визначені вище, a W являє собою групу, що відходить.
23. Спосіб за п. 22, де W являє собою групу X, як визначено в пунктах 1 або 13.
24. Спосіб за пунктом 22 або 23, де отриману реакційну суміш очищують методом екстракції твердою фазою.
25. Сполука формули (III):
 (III),
(III),
де р, R4, R5 і R6 визначені в п. 1, замісник в азабіциклогрупі знаходиться в положенні 3 або 4, і у випадку знаходження його в положенні 3 цей заміщений атом вуглецю має енантіомерно чисту R- або S-конфігурацію,
за умови, що якщо R4 є 3-тієнільною групою і R5 є циклогексильною групою, R6 не є гідроксигрупою;
яка є
(3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2R)-2-циклопентил-2-фур-2-ил-2-гідроксіоцтової кислоти;
(3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2S)-2-циклопентил-2-фур-2-ил-2-гідроксіоцтової кислоти;
(3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2R)-2-циклогексил-2-фур-2-ил-2-гідроксіоцтової кислоти;
(3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2S)-2-циклогексил-2-фур-2-ил-2-гідроксіоцтової кислоти;
1-азабіцикло[2.2.2]окт-4-иловий ефір (2R)-2-циклогексил-2-гідрокси-2-фенілоцтової кислоти.
26. Фармацевтична композиція, що містить сполуку за будь-яким із пп. 1-20 у суміші з фармацевтично прийнятним носієм або розріджувачем.
27. Застосування сполуки за будь-яким із пп. 1-20 для виготовлення лікарських засобів для лікування респіраторного, урологічного або шлунково-кишкового захворювання або розладу.
28. Спосіб лікування респіраторного, урологічного або шлунково-кишкового захворювання або розладу, при якому вводять ефективну нетоксичну кількість сполуки за будь-яким із пп. 1-20 людині або тварині, яка потребує лікування.
29. Комбінований продукт, що містить
(І) сполуку за будь-яким з пп. 1-20 та
(IІ) ![]() -агоніст, стероїд, антиалергічний лікарський засіб, інгібітор фосфодіестерази IV і/або антагоніст лейкотриєну D4 (LTD4),
-агоніст, стероїд, антиалергічний лікарський засіб, інгібітор фосфодіестерази IV і/або антагоніст лейкотриєну D4 (LTD4),
для одночасного, роздільного або послідовного застосування при лікуванні респіраторного захворювання.
Текст
1. Сполука формули (І): 3 75626 4 4. Сполука за будь-яким із попередніх пунктів, де 16. Сполука за п. 14, де замісник у положенні 3 R5 являє собою циклопентильну, циклогексильну, азонієвої біциклічної групи має S-конфігурацію. пентильну, алільну, вінільну, пропінільну, бензи17. Сполука за будь-яким із попередніх пунктів, де льну або фенетильну групу. атом вуглецю, заміщений R4, R5 і R6, має R5. Сполука за будь-яким із попередніх пунктів, де конфігурацію. 4 5 6 група -О-CO-C(R )(R )(R ) являє собою групу, виб18. Сполука за будь-яким із пунктів 1-16, де атом рану з 2-циклопентил-2-гідрокси-2-тієн-2вуглецю, заміщений R4, R5 і R6, має Sілацетоксигрупи; 2,3-дифенілпропіонілоксигрупи; конфігурацію. 2-гідроксиметил-2,3-дифенілпропіонілоксигрупи; 219. Сполука за будь-яким із попередніх пунктів, що гідрокси-2,3-дифенілпропіонілоксигрупи; 2є одним ізомером. гідрокси-3-феніл-2-тієн-2-ілпропіонілоксигрупи; 220. Сполука за п. 1, яка є: гідрокси-2-тієн-2-ілпент-4-еноїлоксигрупи; 2(3R)-3-(2,3-дифенілпропіонілокси)-1-(3гідрокси-2-тієн-2-ілгептаноїлоксигрупи; 2-гідроксифеноксипропіл)-12-тієн-2-ілпент-3-іноїлоксигрупи; 2-гідрокси-2-тієназоніабіцикло[2.2.2]октантрифторацетат; 2-ілбут-3-еноїлокси групи; 2-циклопентил-2-фур-2(3R)-3-(2,3-дифенілпропіонілокси)-1-(3-тієн-2ил-2-гідроксіацетоксигрупи; 2-циклогексил-2ілпропіл)-1гідрокси-2-фенілацетоксигрупи; 2-циклогексил-2азоніабіцикло[2.2.2]октантрифторацетат; фур-2-ил-2-гідроксіацетоксигрупи; 2-циклопентил(3R)-3-(2-гідроксиметил-2,32-гідрокси-2-фенілацетоксигрупи; 2-циклогексил-2дифенілпропіонілокси)-1-(3-тієн-2-ілпропіл)-1гідрокси-2-тієн-2-ілацетоксигрупи і 2-гідрокси-4азоніабіцикло[2.2.2]октантрифторацетат; феніл-2-тієн-2-ілбутаноїлоксигрупи. (3R)-3-(2-гідроксиметил-2,36. Сполука за будь-яким із попередніх пунктів, де В дифенілпропіонілокси)-1-фенетил-1являє собою фенільну, піролільну, тієнільну, фуазоніабіцикло[2.2.2]октантрифторацетат; рильну, біфенільну, нафталенільну, 5,6,7,8(3R)-3-(2-гідрокси-2,3-дифенілпропіонілокси)-1-(3тетрагідронафталенільну, бензо[1,3]діоксолільну, феноксипропіл)-1-азоніабіцикло[2.2.2]октанбромід; імідазолільну або бензотіазолільну групу. (3R)-3-(2-гідрокси-2,3-дифенілпропіонілокси)-1-(27. Сполука за п. 6, де В являє собою фенільну, феноксіетил)-1-азоніабіцикло[2.2.2]октанбромід; піролільну або тієнільну групу. (3R)-3-(2-гідрокси-3-феніл-2-тієн-28. Сполука за будь-яким із попередніх пунктів, де ілпропіонілокси)-1-(3-феноксипропіл)-1кожен із замісників R1, R2 і R3 незалежно являють азоніабіцикло[2.2.2]октантрифторацетат; собою атом водню або галогену або гідроксигрупу, (3R)-3-(2-гідрокси-3-феніл-2-тієн-2метильну, трет-бутильну, -СН2ОН, 3ілпропіонілокси)-1-(3-тієн-2-ілпропіл)-1гідроксипропільну, -ОМе, -NMe2, -NHCOMe, азоніабіцикло[2.2.2]октантрифторацетат; CONH2, -CN, -NО2, -СООМе або -CF3 групу. (3R)-3-(2-гідрокси-2-тієн-2-ілпент-4-еноїлокси)-1-(39. Сполука за п. 8, де кожен із замісників R1, R2 і R3 феноксипропіл)-1-азоніабіцикло[2.2.2]октанбромід; незалежно являють собою атом водню або гало(3R)-3-(2-гідрокси-2-тієн-2-ілпент-4-еноїлокси)-1-(3гену або гідроксигрупу. тієн-2-ілпропіл)-110. Сполука за будь-яким із попередніх пунктів, де азоніабіцикло[2.2.2]октантрифторацетат; n дорівнює 0 або 1; m є цілим числом від 1 до 6; і А (3R)-3-(2-гідрокси-2-тієн-2-ілпент-4-еноїлокси)-1-(2являє собою -CH2-, -CH=CH-, -CO-, -NMe-, -О- або феноксіетил)-1-азоніабіцикло[2.2.2]октанбромід; -S-групу. (3R)-3-(2-гідрокси-2-тієн-2-ілгептаноїлокси)-1-(311. Сполука за п. 10, де m дорівнює 1, 2 або 3, і А феноксипропіл)-1являє собою -CH2-, -СН=СН-, -О- або -S-групу. азоніабіцикло[2.2.2]октантрифторацетат; 12. Сполука за будь-яким із попередніх пунктів, де (3R)-3-(2-гідрокси-2-тієн-2-ілгептаноїлокси)-1-(3атом азоту азонієвої біциклогрупи заміщений грутієн-2-ілпропіл)-1пою, вибраною з 3-феноксипропільної, 2азоніабіцикло[2.2.2]октантрифторацетат; феноксіетильної, 3-фенілалільної, фенетильної, 3(3R)-3-(2-гідрокси-2-тієн-2-ілпент-3-еноїлокси)-1-(3фенілпропільної, 3-(3-гідроксифенокси)пропільної, феноксипропіл)-13-(4-фторфенокси)пропільної, 3-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілпропільної, 4-оксо-4-тієн-2-ілбутильної, 2(3R)-3-(2-гідрокси-2-тієн-2-ілпент-3-еноїлокси)-1-(3бензилоксіетильної, 3-орто-толілоксипропільної, 3тієн-2-ілпропіл)-1(3-ціанофенокси)пропільної, 3азоніабіцикло[2.2.2]октантрифторацетат; (метилфеніламіно)пропільної, 3(3R)-3-(2-гідрокси-2-тієн-2-ілбут-3-еноїлокси)-1-(3фенілсульфанілпропільної, 4-оксо-4феноксипропіл)-1фенілбутильної, 3-(2-хлорфенокси)пропільної, 3азоніабіцикло[2.2.2]октантрифторацетат; (2,4-дифторфенокси)пропільної, 3-(4(3R)-3-(2-гідрокси-2-тієн-2-ілбут-3-еноїлокси)-1-(3метоксифенокси)пропільної, 3-(бензо[1,3]діоксолтієн-2-ілпропіл)-15-ілокси)пропільної групи. азоніабіцикло[2.2.2]октантрифторацетат; 13. Сполука за будь-яким із попередніх пунктів, де (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2Х являє собою хлорид-, бромід-, трифторацетатілацетокси]-1-(3-феноксипропіл)-1або метансульфонат-аніон. азоніабіцикло[2.2.2]октанбромід; 14. Сполука за будь-яким із попередніх пунктів, де (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азонієва біциклічна група заміщена в положенні 3. ілацетокси]-1-(3-тієн-2-ілпропіл)-115. Сполука за п. 14, де замісник у положенні 3 азоніабіцикло[2.2.2]октантрифторацетат; азонієвої біциклічної групи має R-конфігурацію. 5 75626 6 (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2ілокси)пропіл]-1ілацетокси]-1-(2-феноксіетил)-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октанбромід; 1-[3-(бензо[1,3]діоксол-5-ілокси)пропіл]-(3R)-3(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2[(2S)-2-циклопентил-2-гідрокси-2-тієн-2ілацетокси]-1-фенетил-1ілацетокси]-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-21-[3-(2-карбамоїлфенокси)пропіл]-(3R)-3-[(2S)-2ілацетокси]-1-(3-фенілпропіл)-1циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2ілацетокси]-1-(3-фенілаліл)-1ілацетокси]-1-[3-(3-диметиламінофенокси)пропіл]азоніабіцикло[2.2.2]октантрифторацетат; 1-азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-21-[3-(4-ацетиламінофенокси)пропіл]-(3R)-3-[(2S)-2ілацетокси]-1-[3-(4-фторфенокси)пропіл]-1циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2ілацетокси]-1-(4-оксо-4-тієн-2-ілбутил)-1ілацетокси]-1-[3-(4азоніабіцикло[2.2.2]октантрифторацетат; метоксикарбонілфенокси)пропіл]-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[4-(4-фторфеніл)-4-оксобутил]-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(4-нітрофенокси)пропіл]-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(3-гідроксифенокси)пропіл]-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(4-гідроксиметилфенокси)пропіл]1-(2-бензилоксіетил)-(3R)-3-[(2S)-2-циклопентил-21-азоніабіцикло[2.2.2]октантрифторацетат; гідрокси-2-тієн-2-ілацетокси]-1(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-(3-феноксипропіл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октанбромід; ілацетокси]-1-(3-орто-толілоксипропіл)-1(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-(3-тієн-2-ілпропіл)-11-[3-(3-ціанофенокси)пропіл]-(3R)-3-[(2S)-2азоніабіцикло[2.2.2]октантрифторацетат; циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-(2-феноксіетил)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(нафтален-1-ілокси)пропіл]-1(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-фенетил-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(метилфеніламіно)пропіл]-1(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-(3-фенілпропіл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-(3-фенілсульфанілпропіл)-1(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-(3-фенілаліл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-(4-оксо-4-фенілбутил)-1(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(4-фторфенокси)пропіл]-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(2,4,6-триметилфенокси)пропіл]-1(3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-2азоніабіцикло[2.2.2]октантрифторацетат; гідроксіацетокси]-1-(3-феноксипропіл)-11-[3-(2-хлорфенокси)пропіл]-(3R)-3-[(2S)-2азоніабіцикло[2.2.2]октантрифторацетат; циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1(3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-2азоніабіцикло[2.2.2]октантрифторацетат; гідроксіацетокси]-1-(3-тієн-2-ілпропіл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(3-трифторметилфенокси)пропіл](3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-21-азоніабіцикло[2.2.2]октантрифторацетат; гідроксіацетокси]-1-фенетил-11-[3-(біфеніл-4-ілокси)пропіл]-(3R)-3-[(2S)-2азоніабіцикло[2.2.2]октантрифторацетат; циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1(3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-2азоніабіцикло[2.2.2]октантрифторацетат; гідроксіацетокси]-1-(3-фенілпропіл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(2,4-дифторфенокси)пропіл]-1(3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2азоніабіцикло[2.2.2]октантрифторацетат; гідроксіацетокси]-1-(3-феноксипропіл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(4-метоксифенокси)пропіл]-1(3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2азоніабіцикло[2.2.2]октантрифторацетат; гідроксіацетокси]-1-(3-тієн-2-ілпропіл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(5,6,7,8-тетрагідронафтален-2 7 (3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2гідроксіацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2гідроксіацетокси]-1-(3-фенілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-гідрокси-2фенілацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-гідрокси-2фенілацетокси]-1-(3-тієн-2-ілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-гідрокси-2фенілацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-гідрокси-2фенілацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклогексил-2-гідрокси-2фенілацетокси]-1-(3-тієн-2-ілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-гідрокси-2фенілацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклогексил-2-фур-2-ил-2гідроксіацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (ЗR)-3-[(2S)-2-циклогексил-2-фур-2-ил-2гідроксіацетокси]-1-(3-тієн-2-ілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклогексил-2-фур-2-ил-2гідроксіацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклогексил-2-фур-2-ил-2гідроксіацетокси]-1-(3-фенілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2гідроксіацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2гідроксіацетокси]-1-(3-тієн-2-ілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2гідроксіацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2гідроксіацетокси]-1-(3-фенілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2фенілацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2фенілацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2фенілацетокси]-1-(3-фенілсульфанілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2фенілацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2фенілацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2фенілацетокси]-1-(3-фенілсульфанілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; 75626 8 (3R)-3-[(2S)-2-циклогексил-2-гідрокси-2-тієн-2ілацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклогексил-2-гідрокси-2-тієн-2ілацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат; 1-[3-(3-ціанофенокси)пропіл]-(3R)-3-[(2S)-2циклогексил-2-гідрокси-2-тієн-2-ілацетокси]-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-гідрокси-2-тієн-2ілацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-гідрокси-2-тієн-2ілацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат; 1-[3-(3-ціанофенокси)пропіл]-(3R)-3-[(2R)-2циклогексил-2-гідрокси-2-тієн-2-ілацетокси]-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-(2-гідрокси-4-феніл-2-тієн-2-ілбутаноїлокси)1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3S)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2ілацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октанбромід; (3S)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2ілацетокси]-1-(3-тієн-2-ілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3S)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2ілацетокси]-1-(3-фенілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; 4-[(2R)-2-циклогексил-2-гідрокси-2-фенілацетокси]1-(3-тієн-2-ілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; 4-[(2R)-2-циклогексил-2-гідрокси-2-фенілацетокси]1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат. 21. Сполука за будь-яким з пп. 1-20 для застосування в терапевтичному способі лікування людини або тварини. 22. Спосіб одержання сполуки формули (І): R4 O R1 R2 (CH2)n B (CH2)m A R3 + N (CH2)p O R5 R6 (I), де R , R , R , R4, R5, R6, p, m, n, А, В і Х визначені вище в будь-якому з пп. 1-18, згідно з яким здійснюють кватернізацію атома азоту азонієвого біциклічного кільця сполуки формули (III): X 1 2 3 R4 O N O (CH2)p R5 R6 (III), де R4, R5, R6 і р визначені вище, з алкілуючим агентом формули (II): (CH2)n B R1 R2 R3 A (CH2)m W (II), де R1, R2, R3, m, n, А і В визначені вище, a W являє собою групу, що відходить. 23. Спосіб за п. 22, де W являє собою групу X, як визначено в пунктах 1 або 13. 24. Спосіб за пунктом 22 або 23, де отриману реакційну суміш очищують методом екстракції твердою фазою. 25. Сполука формули (III): 9 75626 10 1-азабіцикло[2.2.2]окт-4-иловий ефір (2R)-2O циклогексил-2-гідрокси-2-фенілоцтової кислоти. R5 R6 26. Фармацевтична композиція, що містить сполуN (CH ) O ку за будь-яким із пп. 1-20 у суміші з фармацев2 p (III), тично прийнятним носієм або розріджувачем. 4 5 6 де р, R , R і R визначені в п. 1, замісник в азабі27. Застосування сполуки за будь-яким із пп. 1-20 циклогрупі знаходиться в положенні 3 або 4, і у для виготовлення лікарських засобів для лікування випадку знаходження його в положенні 3 цей зареспіраторного, урологічного або шлунковоміщений атом вуглецю має енантіомерно чисту Rкишкового захворювання або розладу. або S-конфігурацію, 28. Спосіб лікування респіраторного, урологічного за умови, що якщо R4 є 3-тієнільною групою і R5 є або шлунково-кишкового захворювання або розциклогексильною групою, R6 не є гідроксигрупою; ладу, при якому вводять ефективну нетоксичну яка є кількість сполуки за будь-яким із пп. 1-20 людині (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2R)-2або тварині, яка потребує лікування. циклопентил-2-фур-2-ил-2-гідроксіоцтової кислоти; 29. Комбінований продукт, що містить (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2S)-2(І) сполуку за будь-яким з пп. 1-20 та циклопентил-2-фур-2-ил-2-гідроксіоцтової кислоти; (IІ) 2 -агоніст, стероїд, антиалергічний лікарський (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2R)-2засіб, інгібітор фосфодіестерази IV і/або антагоніст циклогексил-2-фур-2-ил-2-гідроксіоцтової кислоти; лейкотриєну D4 (LTD4), (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2S)-2для одночасного, роздільного або послідовного циклогексил-2-фур-2-ил-2-гідроксіоцтової кислоти; застосування при лікуванні респіраторного захворювання. R4 Даний винахід відноситься до нових терапевтично застосованих похідних хінуклідину, декільком способам їх одержання та фармацевтичним композиціям, що їх містять. Нові структури згідно з даним винаходом є антимускариновими засобами із сильним та тривалим ефектом. Конкретно, дані сполуки мають високу спорідненість до мускаринових рецепторів МЗ. Даний підтип мускаринового рецептора присутній у залозах та гладких м'язах та опосередковує збудливу дію парасимпатичної системи на секрецію залоз та скорочення гладкої мускулатури внутрішніх органів [Cholinergic Transmission, глава 6 у HP. Rang et al., Pharmacology, Churchill Livingstone, New York, 1995]. Тому відомо, що антагоністи МЗ застосовують для лікування захворювань, що характеризуються підвищеним тонусом парасимпатичної системи, підвищеною секрецією залоз або підвищеною скоротністю гладкої мускулатури [R. М. Eglen and S. S. Hegde, (1997), Drug News Perspect., 10(8): 462469]. Прикладами подібних захворювань є респіраторні порушення, такі як хронічне обструктивне захворювання легень (ХОЗЛ), бронхіт, гіперактивність бронхів, астма, кашель та риніт; урологічні порушення, такі як нетримання сечі, полакіурія, нейрогенний або нестабільний сечовий міхур, цистоспазм або хронічний цистит; порушення шлунково-кишкового тракту, такі як синдром роздратованої товстої кишки, спастичний коліт, дивертикуліт та пептична виразка; та порушення серцевосудинної системи, такі як індукована блукаючим нервом синусова брадикардія [Muscarinic Receptor Agonists and Antagonists, глава 7 у Goodman and Oilman's The Pharmacological Basis of Therapeutics, 10th edition, McGraw Hill, New York, 2001]. Сполуки згідно даного винаходу можуть застосовуватися самостійно або разом з іншими ліками, що звичайно вважаються ефективними при лікуванні зазначених захворювань. Наприклад, для одночасного, роздільного або послідовного застосування при лікуванні респіраторного захворювання вони можуть уводитися разом з 2-агоністами, стероїдами, протиалергічними лікарськими засобами, інгібіторами фосфодіестерази IV та/або антагоністами лейкотрізну D4 (LTD4). Для лікування зазначеного вище респіраторного захворювання сполуки, заявлені у формулі винаходу, застосовуються в сполученні з 2-агоністами, стероїдами, протиалергічними ліками, інгібіторами фосфодіестерази IV. Сполуки з подібною будовою були описані в деяких патентах як антихолінергичні та/або спазмолітичні засоби. Наприклад, [у патенті FR 2012964] описані похідні хінуклідинолу формули: у який R є Н, ОН або алкільною групою, що містить 1-4 атома вуглецю; R1 є фенільною аботіенільною групою; та R2 є циклогексильною, циклопентильною або тіенільною групою, або, якщо R є Н, R1 та R2 разом з атомом вуглецю, до якого вони приєднані, утворять трициклічну групу формули: у який X є -О-, -S- або -СН2-, або їх сіллю приєднання кислот або четвертинного амонію. [У патенті США №4465834] описаний клас антихолінергичних лікарських засобів формули: 11 75626 12 подібної до сполук згідно з даним винаходом, розкриті [в міжнародній патентній публікації WO 01/04118]. Даний винахід стосується нових складноефіру який R1 є карбоцикличною або розгалуженою них похідних хінуклідину, що мають могутню антааліфатичною групою, що містить 3-8 атомів вуглегоністичну активність відносно до мускаринових цю (така як феніл, циклогексил, циклопентил, цикМЗ-рецепторів та мають хімічну структуру, що попропіл, циклогептил та ізопропіл), R2 є розгалуописуєтся формулою (І): женою або лінійною аліфатичною групою, що містить 3-10 атомів вуглецю з 1 або 2 олефіновими або ацетиленовими зв'язками, або є фенілетинільною, стирильною або етинільною групою, та R3 є алкільною або циклічною групою, що містить 412 атомів вуглецю, що містить атом азоту третинде В є фенільним кільцем, 5-10-членною гетеного аміну. Сполуки згідно даного винаходу також роароматичною групою, що містить один або деківключені у формулу винаходу у вигляді їх солей лька гетероатомів, вибраних з N, S та О, або нафприєднання вільних основ або кислот, або четверталенільною, 5,6,7,8-тетрагідронафталенільною, тинних солей амонію. бензо[1,3]діоксолільною або біфенільною групою; [У патенті США №4843074] описані продукти кожен із замісників R1, R2 та R3 незалежно явформули: ляє собою атом водню або галогену, або фенільну де X є воднем, галогеном, нижчим алкілом, нижчої алкоксигрупою, гідроксигрупою, та R є морфолінилом, тіоморфолінилом, піперидинілом, 1,4-діокса-8-азаспіро[4,5]деканілом, 4-(2,6диметилморфолінилом), 4-кетопіперидинілом, 4гідроксипіперидинілом, заміщеним у положенні 4 піперазинілом. У винахід також включені четвертинні солі нижчого алкіл галогеніду та фармацевтично прийнятні кислотно-адитивні солі. [У патенті США №4644003] описані складні ефіри 3-хінуклідинолу -дизаміщених гліколевих кислот та їх фармацевтично прийнятні солі, де R є фенілом, незаміщеним або заміщеним 1-3 замісниками, включаючи алкоксигрупу, галоген, нітрогрупу, аміногрупу, алкіламіногрупу, діалкіламіногрупу, ациламіногрупу та трифторметил; та де R1 є воднем, алкілом, циклоалкілом, алкенілом, циклоалкенілом, алкінілом, алкілоксіалкілом, циклоалкілоксіалкілом, галогеналкілом або галогеналкенілом. [У міжнародній патентній публікації WO 92/04346] описані сполуки формули: та їх фармацевтично прийнятні солі, де X є фенільною (необов'язково заміщеною) або тієнільною групою, та "Het" або є (а) п'ятичленною азотовмісною гетероциклічною групою, (b) оксадіазолільною або тіадіазолільною групою, або (с) шестичленною азотовмісною гетероциклічною групою, та m дорівнює 1 або 2. (Для детальнішого опису див. вищезгадану публікацію). Азоніабіциклічні сполуки загальної структури, групу, -OR7, -SR7, -NR7R8, -NHCOR7, -CONR7R8, CN, -NO2, -COOR7 або -CF3 групу, або нерозгалужену або розгалужену С1-С8 алкільну групу, незаміщену або заміщену одним або більше атомами галогену, гідроксигрупами або С1-С6алкоксигрупами, де кожен із замісників R7 та R8 незалежно являє собою атом водню, нерозгалужену або розгалужену СГС8 алкільну групу або разом утворюють С3-С8 аліциклічне кільце; або R1 та R2 разом утворюють С5-С14 ароматичне або С3-С8 аліциклічне кільце або 5-10-членну гетероциклічну групу, що включає один або більше гетероатомів, вибраних з N, S та О; n є цілим числом від 0 до 4; А являє собою групу, вибрану з -CH=CR9-, CR9=CH-, -CR9R10-, -CO-, -О-, -S-, -S(O)-, -S(O)2- та -NR9-, де кожен із замісників R9 та R10 незалежно являє собою атом водню, нерозгалужену або розгалужену С1-С8 алкільну групу або разом утворюють С3-С8 аліциклічне кільце; m є цілим числом від 0 до 8 за умови, що якщо m=0, А не є -СН2-; p є цілим числом від 1 до 2, та заміщення в азонієвому біциклічному кільці можливе в положенні 2, 3 або 4, включаючи всі можливі конфігурації асиметричних атомів вуглецю; R4 являє собою групу структури: де R11 являє собою атом водню або галогену, гідроксигрупу, С1-С6-алкоксигрупу, нітрогрупу, ціаногрупу, -CO2R12 або -NR12R13, де R12 та R13 є однаковими або різними та вибрані з водню та нерозгалужених або розгалужених С1-С8 нижчих алкільних груп, або нерозгалужену або розгалужену С1-С8 алкільну групу, незаміщену або заміщену одним або більше атомами галогену, гідрокси група ми або С1-С6 алкоксигрупами; R5 являє собою алкільну групу, що містить від 1 до 7 атомів вуглецю, алкенільну групу, що містить від 2 до 7 атомів вуглецю, алкінільну групу, що містить від 2 до 7 атомів вуглецю, циклоалкільну групу, що містить від 3 до 7 атомів вуглецю або групу формули: 13 75626 14 женими або розгалуженими групами, такими як етиніл, пропініл або нерозгалужений або розгалужений бутиніл, пентиніл, гексиніл або гептиніл. Потрійний зв'язок може бути в будь-якому поло11 де q дорівнює 1 або 2, а значення R визнаженні алкінільної групи, як, наприклад, у зв'язку чене вище; вкінці. 6 R являє собою атом водню, гідроксигрупу, Зазначені алкоксигрупи, як ті, що можуть місметильну групу або групу -СН2ОН. титися в групі В, звичайно є нижчими алкоксигруАсиметричний атом вуглецю, розташований в пами, що містять 1-6 атомів вуглецю, переважно 1α-положенні щодо ефірного зв'язку та заміщений 4 атома вуглецю, причому вуглеводневий ланцюг 4 5 6 R , R та R , може мати R- та S-конфігурацію. є розгалуженим або нерозгалуженим. Кращі алкоXˉ являє собою фармацевтично прийнятний ксигрупи включають метоксигрупу, етоксигрупу, наніон моно- або полівалентної кислоти. пропоксигрупу, ізопропоксигрупу, н-бутоксигрупу, У четвертинних амонієвих сполуках згідно давтор-бутоксигрупу та трет-бутоксигрупу. ного винаходу, представлених формулою (І), еквіЗазначені циклоалкільні групи та аліциклічні валент аніона (Хˉ) зв'язаний з позитивним зарядом групи, якщо не уточнено додатково, звичайно місатома азоту. Xˉ може бути аніоном різних неоргатять 3-8 атомів вуглецю, переважно 3-6 атомів нічних кислот, такий як, наприклад, хлорид, бровуглецю. Циклоалкільні групи та аліциклічні кільця, мід, йодид, сульфат, нітрат, фосфат, або аніоном що містять 3-6 атомів вуглецю, включають циклоорганічних кислот, такий як, наприклад, ацетат, пропіл, циклобутил, циклопентил та циклогексил. малеат, фумарат, цитрат, оксалат, сукцинат, тартЦиклоалкільні групи, що містять 3-7 атомів вуглерат, малат, манделат, трифторацетат, метансуцю, включають групи, що містять 3-6 атомів вуглельфонат та пара-толуолсульфонат. Переважно Xˉ цю циклоалкільні групи та циклогептил. є аніоном, обираним із хлориду, броміду, йодиду, Зазначене у R1 та R2 ароматичне кільце звисульфату, нітрату, ацетату, малеату, оксалату, чайно містить 5-14, переважно 5-10 атомів вуглесукцинату або трифторацетату. Більш переважно цю. Приклади ароматичних груп включають циклоXˉ є хлоридом, бромідом, трифторацетатом або пентадіеніл, феніл та нафталеніл. метансульфонатом. Зазначена гетероциклічна або гетероароматиСполуки згідно даного винаходу, представлені чна група звичайно є 5-10-членною групою, такою описаною вище формулою (І), що можуть містити як 5, 6 або 7-членна група, що містить один або один або кілька асиметричних атомів, включають декілька гетероатомів, обраних з N, S та О. Звиусі можливі стереоізомери. Під об'єм даного виначайно є присутнім 1,2,3 або 4 гетероатому, переходу підпадають окремі ізомери та суміші ізомерів. важно 1 або 2 гетероатому. Гетероциклічна або Зазначена алкільна група звичайно є нижчою гетероароматична група може бути моноциклічною алкільною групою. Нижча алкільна група переважабо містити два або декілька конденсованих кіно містить 1-8, переважно 1-6 та більш переважно лець, де, щонайменше, одне кільце містить гете1-4 атома вуглецю. Зокрема, є кращим, щоб така роатом. Приклади гетероцикличних груп включаалкільна група являла собою метильну, етильну, ють піперидил, піролідил, піперазиніл, морфолініл, пропільну, включаючи ізопропільну, або бутильну, тіоморфолініл, піроліл, імідазоліл, імідазолідиніл, включаючи н-бутильну, втор-бутильну та третпіразолініл, індолініл, ізоіндолініл, піридил, піразибутильну групу. Зазначена алкільна група, що місніл, піримідиніл, піридазиніл, індолізиніл, ізоіндо5 тить 1-7 атомів вуглецю, така як представлена R , ліл, індоліл, індазоліл, пуриніл, хінолізиніл, ізохіможе бути зазначеною вище С1-4-алкільною груноліл, хіноліл, фталазиніл, нафтиридиніл, пою або нерозгалуженою або розгалуженою пенхіноксалініл, хіназолініл, цинолініл, птеридиніл, тильною, гексильною або гептильною групою. хінуклідиніл, триазоліл, піразоліл, тетразоліл та Зазначені необов'язково заміщені нижчі алкітіеніл. Приклади гетероароматичних груп включальні групи включають нерозгалужені або розгалують піридил, тіеніл, фурил, піроліл, імідазоліл, жені алкільні групи, що містить 1-6, переважно 1-4 бензотіазоліл, піридиніл, піразоліл, піразиніл, піатома вуглецю, що можуть бути незаміщеними або римідиніл, піридазиніл, індоліл, індазоліл, пуриніл, заміщені в будь-якому положенні одним або декіхіноліл, ізохіноліл, фталазиніл, нафтиридиніл, хількома замісниками, наприклад, 1,2 або 3 замісниноксалиніл, хіназолініл, цинолініл, триазоліл та ками. Якщо є два або декілька замісників, кожний піразоліл. із замісників може бути однаковим або різними. Зазначений атом галогену включає атом фтоЗамісник(и) звичайно є атомами галогену або гідру, хлору, брому або йоду, звичайно атом фтору, роксигрупами або алкоксигрупами, переважно гідхлору або брому. роксигрупами або алкоксигрупами. Кращими сполуками формули (І) є ті, де В явЗазначені алкенільні групи, що містять 2-7 ляє собою фенільную, піролільную, тіенільную, 5 атомів вуглецю, такі як представлені R , є нерозфурильную, біфенільную, нафталенільную, галуженими або розгалуженими групами, такими 5,6,7,8-тетрагідронафталенільную, беняк етеніл, нерозгалужений або розгалужений прозо[1,3]діоксолільную, імідазолільную або бензотіапеніл, бутеніл, пентеніл, гексеніл або гептеніл. золільную групу, особливо фенільную, піролільПодвійний зв'язок може бути в будь-якому полоную, тіенільную, фурильную, біфенільную, женні алкенільною групи, як, наприклад, у зв'язку нафталенільну, 5,6,7,8-тетрагідронафталенільную вкінці. або бензо[1,3]діоксолільну групу, таку як фенільна, Зазначені алкінільні групи, що містять 2-7 атотіенільна або піролільна група. мів вуглецю, такі як представлені R5, є нерозгалуВ може бути незаміщеним або заміщеним од 15 75626 16 нією, двома або трьома групами (R1-R3), що мофенілбутокси)гексильною, 4-феноксибутильною, жуть бути розташовувані в будь-якому положенні 4-(4-фторфеніл)-4-оксобутильною або 4-оксо-4кільця. Звичайно він є незаміщеним або заміщефенілбутильною групою. ний однією групою, наприклад, якщо В є фенільОсобливо кращими солями є ті, де атом азоту ною групою, вона може бути заміщена в положенні азонієвої біциклогрупи заміщений 31 2 2, 3 або 4. Звичайно кожний із замісників R , R та феноксипропільною, 2-феноксіетильною, 3R3 незалежно являє собою атом водню або галофенілалільною, фенетильною, 3-фенілпропільною, гену, або гідроксигрупу, метильну, трет-бутильну, 3-(3-гідроксифенокси)пропільною, 3-(4СН2ОН, 3-гідроксипропільну, -ОМе, -NMe2, фторфенокси)пропільною, З-тіен-2-ілпропільною NHCOMe, -CONH2, -CN, -NO2, -COOMe або -CF3 групою, 4-оксо-4-тіен-2-ілбутилом, 2групу, особливо атом водню, фтору або хлору, або бензилоксіетилом, 3-орто-толілоксипропілом, 3-(3гідроксигрупу, метильну, -СН2ОН, -ОМе, -NMe2, ціанофенокси)пропілом, 3NHCOMe, -CONH2, -CN, -NO2, -COOMe або -CF3 (метилфеніламіно)пропілом, 3групу. Найбільш кращими групами R1, R2 та R3 є фенілсульфанілпропілом, 4-оксо-4-фенілбутилом, атом водню, фтору або хлору або гідроксигрупа. 3-(2-хлорфенокси)пропілом, 3-(2,4Прикладами заміщених фенільних груп, що дифторфенокси)пропілом, 3-(4можуть являти собою В, є толіл, включаючи орто-, метоксифенокси)пропілом, 3-(бензо[1,3]діоксол-5мета- та пара-толіл, 3-ціанофеніл, 2-, 3- та 4ілокси)пропілом. Прикладами особливо кращих гідроксифеніл, та 2-, 3- та 4-фторфеніл. солей є ті, де атом азоту азонієвої біциклогрупи Кращими сполуками формули (І) є ті, де n дозаміщений 3-феноксипропільною, 2рівнює 0 або 1; m є цілим числом від 1 до 6, особфеноксіетильною, 3-фенілалільною, фенетильливо 1, 2 або 3; та А являє собою -СН2-, -СН=СН-, ною, 3-фенілпропільною, 3-(3-CO-, -NMe-, -О-або -S- групу, особливо -СН2-, гідроксифенокси)пропільною, 3-(4СН=СН-, -О- або -S- групу, наприклад, -СН2-, фторфенокси)пропільною або 3-тіен-2СН=СН- або -О- групу. ілпропільною групою. Більш кращими солями формули (І) є ті, де Додатковими кращими сполуками формули (І) атом азоту азонієвої біциклогрупи заміщений 3є ті, де R4 являє собою фенільную, 2-тіенільную, 3феноксипропільною, 2-феноксіетильною, 3тіенільную, 2-фурильную або 3-фурильную групу. фенілалільною, фенетильною, 4-фенілбутильною, R11 переважно являє собою атом водню або гало3-фенілпропільною, 3-(2гену або незаміщену нижчу алкільну групу, таку як гідроксифенокси)пропільною, 3-(4метил або етил. Найбільше переважно R11 є атофторфенокси)пропільною, 2-бензилоксіетильною, мом водню. Тому, наприклад, R4 може являти со3-пірол-1-ілпропільною, 2-тіен-2-ілетильною, 3бою незаміщену фенільну, 2-тіенільну або 2тіен-2-ілпропільною, 3-феніламінопропільною, 3фурильну групу. Альтернативно, R4 може являти (метилфеніламіно)пропільною, 3собою незаміщену фенільну або 2-тіенільну групу. фенілсульфанілпропільною, 3-ортоПереважно, R5 являє собою бензильну, фенетитолілоксипропільною, 3-(2,4,6льну, циклопентильну, циклогексильну, С2-5триметилфенокси)пропільною, 3-(2-трет-бутил-6алкільну, С2-5-алкенільну або С2-5-алкинильну груметилфенокси)пропільною, 3-(біфеніл-4пу, особливо циклопентильну, циклогексильну, ілокси)пропільною, 3-(5,6,7,8-тетрагідронафталенпентильну, алільну, вінільну, пропінільну, фенети2-ілокси)пропільною, 3-(нафтален-2льну або бензильну групу. Альтернативно, R5 явілокси)пропільною, 3-(нафтален-1ляє собою бензильну, циклопентильну, циклогекілокси)пропільною, 3-(2-хлорфенокси)пропільною, сильну, С2-5-алкільну, С2-5-алкенільну або С2-53-(2,4-дифторфенокси)пропільною, 3-(3алкінільну групу, особливо циклопентильну, циклотрифторметилфенокси)пропільною, 3-(3гексильну, пентильну, алільну, вінільну, пропінільціанофенокси)пропільною, 3-(4ну або бензильну групу. Асиметричний атом вугціанофенокси)пропільною, 3-(3лецю в α-положенні щодо ефірної групи, метоксифенокси)пропільною, 3-(4заміщений R4, R5 та R6, може мати R- або Sметоксифенокси)пропільною, 3-(бензо[1,3]діоксолконфігурацію. 5-ілокси)пропільною, 3-(2Кращими сполуками формули (І) є ті, де група карбамоїлфенокси)пропільною, 3-(3-O-CO-C(R4) (R5) (R6) являє собою групу, обрану з диметиламінофенокси)пропільною, 3-(42-циклопентил-2-гідрокси-2-тіен-2-ілацетоксигрупи; нітрофенокси)пропільною, 3-(32,3-дифенілпропіонілоксигрупи; 2-гідроксиметилнітрофенокси)пропільною, 3-(42,3-дифенілпропіонілоксигрупи; 2-гідрокси-2,3ацетиламінофенокси)пропільною, 3-(4дифенілпропіонілоксигрупи; 2-гідрокси-3-феніл-2метоксикарбонілфенокси)пропільною, 3-[4-(3тіен-2-ілпропіонілоксигрупи; 2-гідрокси-2-тіен-2гідроксипропіл)фенокси]пропільною, 3-(2ілпент-4-еноїлоксигрупи; 2-гідрокси-2-тіен-2гідроксиметилфенокси)пропільною, 3-(3ілгептаноїлоксигрупи; 2-гідрокси-2-тіен-2-ілпент-3гідроксиметилфенокси)пропільною, 3-(4иноїлоксигрупи; 2-гідрокси-2-тіен-2-ілбут-3гідроксиметилфенокси)пропільною, 3-(2еноїлоксигрупи; 2-циклопентил-2-фур-2-ил-2гідроксифенокси)пропільною, 3-(4гідроксіацетоксигрупи; 2-циклогексил-2-гідрокси-2гідроксифенокси)пропільною, 3-(3фенілацетоксигрупи; 2-циклогексил-2-фур-2-ил-2гідроксифенокси)пропільною, 4-оксо-4-тієн-2гідроксіацетоксигрупи; 2-циклопентил-2-гідрокси-2ілбутильною, 3-(1-метил[1Н]імідазолол-2фенілацетоксигрупи; 2-циклогексил-2-гідрокси-2ілсульфаніл)пропільною, 3-(бензотіазол-2тіен-2-ілацетоксигрупи та 2-гідрокси-4-феніл-2ілокси)пропільною, 3-бензилоксипропільною, 6-(4тіен-2-ілбутаноїлоксигрупи. Прикладами групи -O 17 75626 18 CO-C(R4) (R5) (R6) є 2-циклопентил-2-гідрокси-21-(3-тіен-2-ілпропіл)-1тіен-2-ілацетоксигрупа; 2,3азоніабіцикло[2.2.2]октантрифторацетат; дифенілпропіонілоксигрупа; 2-гідроксиметил-2,3(3R)-3-(2-гідрокси-2-тіен-2-ілпент-4-еноїлокси)дифенілпропіонілоксигрупа; 2-гідрокси-2,31-(2-феноксіетил)-1дифенілпропіонілоксигрупа; 2-гідрокси-3-феніл-2азоніабіцикло[2.2.2]октанбромід; тіен-2-ілпропіонілоксигрупа; 2-гідрокси-2-тіен-2(3R)-3-(2-гідрокси-2-тіен-2-ілгептаноїлокси)-1ілпент-4-еноїлоксигрупа; 2-гідрокси-2-тіен-2(3-феноксипропіл)-1ілгептаноїлоксигрупа; 2-гідрокси-2-тіен-2-ілпент-3азоніабіцикло[2.2.2]октантрифторацетат; иноїлоксигрупа; 2-гідрокси-2-тіен-2-ілбут-3(3R)-3-(2-гідрокси-2-тіен-2-ілгептаноїлокси)-1еноїлоксигрупа; 2-циклопентил-2-фур-2-ил-2(3-тіен-2-ілпропіл)-1гідроксіацетоксигрупа; 2-циклогексил-2-гідрокси-2азоніабіцикло[2.2.2]октантрифторацетат; фенілацетоксигрупа та 2-циклогексил-2-фур-2-ил(3R)-3-(2-гідрокси-2-тіен-2-ілпент-3-иноїлокси)2-гідроксіацетоксигрупа. 1-(3-феноксипропіл)-1У найбільш кращих утіленнях даного винаходу азоніабіцикло[2.2.2]октантрифторацетат; р дорівнює 2, азоніабіцикло[2.2.2]октанове кільце (3R)-3-(2-гідрокси-2-тіен-2-ілпент-3-иноїлокси)заміщене в положенні 3, та цей заміщений атом 1-(3-тіен-2-ілпропіл)-1вуглецю має (R)-конфігурацію. азоніабіцикло[2.2.2]октантрифторацетат; Наступні сполуки призначені для того, щоб (3R)-3-(2-гідрокси-2-тіен-2-ілбут-3-еноїлокси)проілюструвати, але не обмежити, обсяг даного 1-(3-феноксипропіл)-1винаходу: азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-(2,3-дифeнiлпpoпioнiлoкcи)-1-(3(3R)-3-(2-гідрокси-2-тіен-2-ілбут-3-еноїлокси)фeнoкcипpoпiл)-11-(3-тіен-2-ілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-(2,3-дифенілпропіонілокси)-1-(3-тіен-2(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2ілпропіл)-1ілацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октанбромід; (3R)-3-[(2*)-2-гiдpoкcимeтил-2,3(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2дифeнiлпpoпioнiлoкcи]-1-(3-тieн-2-ілпропіл)-1ілацетокси]-1-(3-тіен-2-ілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат (діастеазоніабіцикло[2.2.2]октантрифторацетат; реомер 1); (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2(3R)-3-[(2*)-2-гідроксиметил-2,3ілацетокси]-1-(2-феноксіетил)-1дифенілпропіонілокси]-1-фенетил-1азоніабіцикло[2.2.2]октанбромід; азоніабіцикло[2.2.2]октантрифторацетат (діасте(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2реомер 1); ілацетоксиі-1-фенетил-1(3R)-3-[(2*)-2-гідроксиметил-2,3азоніабіцикло[2.2.2]октантрифторацетат; дифенілпропіонілокси]-1-(3-тіен-2-ілпропіл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2азоніабіцикло[2.2.2]октантрифторацетат (діастеілацетокси]-1-(3-фенілпропіл)-1реомер 2); азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2*)-2-гідроксиметил-2,3(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2дифенілпропіонілокси]-1-фенетил-1ілацетокси]-1-(3-фенілаліл)-1азоніабіцикло[2.2.2]октантрифторацетат (діастеазоніабіцикло[2.2.2]октантрифторацетат; реомер 2); (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2(3R)-3-[(2*)-2-гідрокси-2,3ілацетокси]-1-[3-(4-фторфенокси)пропіл]-1дифенілпропіонілокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октанбромід (діастереомер 1); (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2(3R)-3-[(2*)-2-гідрокси-2,3ілацетокси]-1-(4-оксо-4-тіен-2-ілбутил)-1дифенілпропіонілокси]-1-(2-феноксіетил)-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октанбромід (діастереомер 1); (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2(3R)-3-[(2*)-2-гідрокси-2,3ілацетокси]-1-[4-(4-фторфеніл)-4-оксобутил]-1дифенілпропіонілокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат (діасте(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2реомер 2); ілацетокси]-1-[3-(3-гідроксифенокси)пропіл]-1(3R)-3-[(2*)-2-гідрокси-2,3азоніабіцикло[2.2.2]октантрифторацетат; дифенілпропіонілокси]-1-(2-феноксіетил)-11-(2-бензилоксіетил)-(3R)-3-[(2S)-2азоніабіцикло[2.2.2]октантрифторацетат (діастециклопентил-2-гідрокси-2-тіен-2-ілацетокси]-1реомер 2); азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-(2-гідрокси-3-феніл-2-тіен-2(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2ілпропіонілокси)-1-(3-феноксипропіл)-1ілацетокси]-1-(3-ортотолілоксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-(2-гідрокси-3-феніл-2-тіен-21-[3-(3-ціанофенокси)пропіл]-(3R)-3-[(2S)-2ілпропіонілокси)-1-(3-тіен-2-ілпропіл)-1циклопентил-2-гідрокси-2-тіен-2-ілацетокси]-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-(2-гідрокси-2-тіен-2-ілпент-4-еноїлокси)(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-21-(3-феноксипропіл)-1ілацетокси]-1-[3-(нафтален-1-ілокси)пропіл]-1азоніабіцикло[2.2.2]октанбромід; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-(2-гідрокси-2-тіен-2-ілпент-4-еноїлокси)(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2 19 75626 20 ілацетокси]-1-[3-(метилфеніламіно)пропіл]-1(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тіен-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-(3-фенілпропіл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]1-(3-фенілсульфанілпропіл)-1(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тіен-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-(3-фенілаліл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-(4-оксо-4-фенілбутил)-1(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тіен-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(4-фторфенокси)пропіл]-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(2,4,6-триметилфенокси)пропіл]-1(3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-2азоніабіцикло[2.2.2]октантрифторацетат; гідроксіацетокси]-1-(3-феноксипропіл)-11-[3-(2-хлорфенокси)пропіл]-(3R)-3-[(2S)-2азоніабіцикло[2.2.2]октантрифторацетат; циклопентил-2-гідрокси-2-тіен-2-ілацетокси]-1(3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-2азоніабіцикло[2.2.2]октантрифторацетат; гідроксіацетокси]-1-(3-тіен-2-ілпропіл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]1-[3-(3-трифторметилфенокси)пропіл](3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-21-азоніабіцикло[2.2.2]октантрифторацетат; гідроксіацетокси]-1-фенетил-11-[3-(біфеніл-4-ілокси)пропіл]-(3R)-3-[(2S)-2азоніабіцикло[2.2.2]октантрифторацетат; циклопентил-2-гідрокси-2-тіен-2-ілацетокси]-1(3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-2азоніабіцикло[2.2.2]октантрифторацетат; гідроксіацетокси]-1-(3-фенілпропіл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(2,4-дифторфенокси)пропіл]-1(3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2азоніабіцикло[2.2.2]октантрифторацетат; гідроксіацетокси]-1-(3-феноксипропіл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(4-метоксифенокси)пропіл]-1(3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2азоніабіцикло[2.2.2]октантрифторацетат; гідроксіацетокси]-1-(3-тіен-2-ілпропіл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1-[3-(5,6,7,8-тетрагідронафтален-2(3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2ілокси)пропіл]-1гідроксіацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; 1-[3-(бензо[1,3]діоксол-5-ілокси)пропіл]-(3R)-3(3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2[(2S)-2-циклопентил-2-гідрокси-2-тіен-2гідроксіацетокси]-1-(3-фенілпропіл)-1ілацетокси]-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-гідрокси-21-[3-(2-карбамоїлфенокси)пропіл]-(3R)-3-[(2S)фенілацетокси]-1-(3-феноксипропіл)-12-циклопентил-2-гідрокси-2-тіен-2-ілацетокси]-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-гідрокси-2(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2фенілацетокси]-1-(3-тіен-2-ілпропіл)-1ілацетокси]1-[3-(3-диметиламінофенокси)пропіл]азоніабіцикло[2.2.2]октантрифторацетат; 1-азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклогексил-2-гідрокси-21-[3-(4-ацетиламінофенокси)пропіл]-(3R)-3фенілацетокси]-1-фенетил-1[(2S)-2-циклопентил-2-гідрокси-2-тіен-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]-1(3R)-3-[(2S)-2-циклогексил-2-гідрокси-2азоніабіцикло[2.2.2]октантрифторацетат; фенілацетокси]-1-(3-феноксипропіл)-1(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2азоніабіцикло[2.2.2]октантрифторацетат; ілацетокси]1-[3-(4(3R)-3-[(2S)-2-циклогексил-2-гідрокси-2метоксикарбонилфенокси)пропіл]-1фенілацетокси]-1-(3-тіен-2-ілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2(3R)-3-[(2S)-2-циклогексил-2-гідрокси-2ілацетокси]-1-[3-(4-нітрофенокси)пропіл]-1фенілацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2(3R)-3-[(2S)-2-циклогексил-2-фур-2-ил-2ілацетокси]-1-[3-(4-гідроксиметилфенокси)пропіл]гідроксіацетокси]-1-(3-феноксипропіл)-11-азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тіен-2(3R)-3-[(2S)-2-циклогексил-2-фур-2-ил-2ілацетокси]-1-(3-феноксипропіл)-1гідроксіацетокси]-1-(3-тіен-2-ілпропіл)-1азоніабіцикло[2.2.2]октанбромід; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тіен-2(3R)-3-[(2S)-2-циклогексил-2-фур-2-ил-2ілацетокси]-1-(3-тіен-2-ілпропіл)-1гідроксіацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тіен-2(3R)-3-[(2S)-2-циклогексил-2-фур-2-ил-2ілацетокси]-1-(2-феноксіетил)-1гідроксіацетокси]-1-(3-фенілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тіен-2(3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2ілацетокси]-1-фенетил-1гідроксіацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; азоніабіцикло[2.2.2]октантрифторацетат; 21 75626 22 (3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2Даний винахід також відноситься до методик гідроксіацетокси]-1-(3-тіен-2-ілпропіл)-1одержання сполук формули (І). Похідні четвертиназоніабіцикло[2.2.2]октантрифторацетат; ного амонію загальної формули (І) можуть бути (3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2отримані шляхом проведення взаємодії алкілуючогідроксіацетокси]-1-фенетил-1го агента загальної формули (II) зі сполуками заазоніабіцикло[2.2.2]октантрифторацетат; гальної формули (III). У формулах (І), (II) та (III) (3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2значення R1, R2, R3, У, А, Хˉ, R4, R5, R6, n, m та p гідроксіацетокси]-1-(3-фенілпропіл)-1визначені вище. азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2фенілацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2фенілацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2фенілацетокси]-1-(3-фенілсульфанілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2фенілацетокси]-1-(3-феноксипропіл)-1Способи а та b азоніабіцикло[2.2.2]октантрифторацетат; У формулі (II) W являє собою будь-яку прида(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2тну групу, що відходить, таку як визначена вище фенілацетокси]-1-фенетил-1група X. Переважно, W являє собою групу X. азоніабіцикло[2.2.2]октантрифторацетат; Дану реакцію алкілування можна проводити (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2відповідно до двох описаних вище різних експерифенілацетокси]-1-(3-фенілсульфанілпропіл)-1ментальних методик а) та b). Конкретно спосіб b) азоніабіцикло[2.2.2]октантрифторацетат; відноситься до нового експериментального спосо(3R)-3-[(2S)-2-циклогексил-2-гідрокси-2-тіен-2бу з застосуванням методологічного підходу тверілацетокси]-1-(3-феноксипропіл)-1дофазної екстракції, що дозволяє паралельно азоніабіцикло[2.2.2]октантрифторацетат; одержувати декілька сполук. Способи а) та b) опи(3R)-3-[(2S)-2-циклогексил-2-гідрокси-2-тіен-2сані в експериментальному розділі. Якщо W являє ілацетокси]-1-фенетил-1собою групу, відмінну від X, четвертинну сіль амоазоніабіцикло[2.2.2]октантрифторацетат; нію формули (І) одержували з продукту способу (а) 1-[3-(3-ціанофенокси)пропіл]-(3R)-3-[(2S)-2або (b), використовуючи реакцію обміну у відповіциклогексил-2-гідрокси-2-тіен-2-ілацетокси]-1дності зі стандартними способами з метою заміни азоніабіцикло[2.2.2]октантрифторацетат; аніона Wˉ необхідним аніоном Xˉ. (3R)-3-[(2R)-2-циклогексил-2-гідрокси-2-тіен-2Комерційно недоступні сполуки загальної фоілацетокси]-1-(3-феноксипропіл)-1рмули (II) одержували шляхом синтезу у відповідазоніабіцикло[2.2.2]октантрифторацетат; ності зі стандартними способами. Наприклад, спо(3R)-3-[(2R)-2-циклогексил-2-гідрокси-2-тіен-2луки, де n дорівнює 0, та А є -О-, -S- або -NR9-, де ілацетокси]-1-фенетил-1значення R9 визначене вище, одержували шляхом азоніабіцикло[2.2.2]октантрифторацетат; проведення взаємодії відповідного ароматичного 1-[3-(3-ціанофенокси)пропіл]-(3R)-3-[(2R)-2похідного або його калієвої солі з алкілуючим агециклогексил-2-гідрокси-2-тіен-2-ілацетокси]-1нтом загальної формули Υ-(СН2)m-Х, де X може азоніабіцикло[2.2.2]октантрифторацетат; бути галогеном, та Υ може бути галогеном або (3R)-3-(2-гідрокси-4-феніл-2-тіен-2складним сульфонатним ефіром. В інших приклаілбутаноилокси)-1-(3-феноксипропіл)-1дах сполуки загальної формули (II), де n>1, синтеазоніабіцикло[2.2.2]октантрифторацетат; зували з відповідного спиртового похідного зага(3S)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2льної формули (IV) відомими способами: ілацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октанбромід; (3S)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2ілацетокси]-1-(3-тіен-2-ілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат; де значення R1, R2, R3, n, m, та А визначені (3S)-3-[(2S)-2-циклопентил-2-гідрокси-2-тіен-2вище. ілацетокси]-1-(3-фенілпропіл)-1Сполуки загальної формули (III) можуть бути азоніабіцикло[2.2.2]октантрифторацетат; отримані різними способами. Дані методики проі4-[(2R)-2-циклогексил-2-гідрокси-2люстровані наступними схемами та детально розфенілацетокси]-1-(3-тіен-2-ілпропіл)-1глянуті в експериментальному розділі. азоніабіцикло[2.2.2]октантрифторацетат; Спосіб с) 4-[(2R)-2-циклогексил-2-гідрокси-2Сполуки загальної формули (III) можуть бути фенілацетокси]-1-(3-феноксипропіл)-1синтезовані шляхом переетерифікації сполуки азоніабіцикло[2.2.2]октантрифторацетат. формули (V) за допомогою сполуки формули (VI): ((*): Конфігурація не визначена; можуть бути отримані або (2R)- або (2S)-ізомери зазначених вище сполук). 23 75626 24 енантіомерно чисту R- або S-конфігурацію, за умови, що якщо R4 є 3-тіенильною групою, та R5 є циклогексильною групою, R6 не є гідроксигрупой. У азабіциклогрупі замісник переважно знаходиться в положенні 3 та може мати R- або S4 5 конфігурацію. Атом вуглецю, заміщений R , R та 6 4 5 6 R , може мати R- або S-конфігурацію. Сполука у який значення формул R , R , R та ρ визнаможе бути одним ізомером. чені вище, та L являє собою групу, що відходить. Приклади нових сполук формули (III) включаНаприклад, L може бути атомом хлору, імідазол-1ють: ільною групою або групою -OR14, де R14 являє со(3R)-1-aзaбiциклo[2.2.2]oкт-3-илoвий ефір (2S)бою нерозгалужену або розгалужену, заміщену 2-циклопентил-2-фур-2-ил-2-гідроксіоцтової кислоабо незаміщену нижчу алкільну групу або групу ти ([ ]22D=+19,7° (с=1, СНСІ3)); COR15, де R15 являє собою -COCR4R5R6. Звичайно 14 14 (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2R)L є -OR , де R є метилом, етилом або пропілом, 2-циклопентил-2-фур-2-ил-2-гідроксіоцтової кислоабо L є імідазол-1-ільною групою. Проміжні продукти формули (VI) можуть бути ти ([ ]22D=-14,2° (с=1, СНСІ3)); отримані у відповідності зі стандартними описани(3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2S)ми в літературі способами, наприклад, [у патенті 2-циклогексил-2-фур-2-ил-2-гідроксіоцтової кислоFR 2012964]. ти ([ ]22D=+21,1° (с=1, СНСІ3)); Спосіб d) (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2R)Сполуки формули (III), де R6 є гідроксигрупою, 2-циклогексил-2-фур-2-ил-2-гідроксіоцтової кислота значення р, R4 та R5 описані вище, можуть бути ти ([ ]22D=-23,5° (с=1, СНСІ3)); отримані зі складних гліоксалатних ефірів загаль1-азабіцикло[2.2.2]окт-4-иловий ефір (2R)-2ної формули (VII) шляхом проведення взаємодії з циклогексил-2-гідрокси-2-фенілоцтової кислоти відповідним реактивом Гриньяра. ([a]22D=-27,6° (с=1, СНСІ3)). Зокрема: (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2S)2-циклопентил-2-фур-2-ил-2-гідроксіоцтової кислоти ([ ]22D=+19,7° (с=1, СНСІ3)); (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2R)2-циклопентил-2-фур-2-ил-2-гідроксіоцтової кислоСполуки загальної формули (VII) можуть бути ти ([ ]22D=-14,2° (с=1, СНСІ3)) ; отримані у відповідності зі стандартними способа(3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2S)ми, описаними в літературі [міжнародні заявки WO 2-циклопентил-2-фур-2-ил-2-гідроксіоцтової кисло01/04118 та WO 92/04346]. ти ([ ]22D=+21,1° (с=1, СНСІ3)); Спосіб e) 6 (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2R)Сполуки формули (III), де R є групою -СН2ОН, 2-циклогексил-2-фур-2-ил-2-гідроксіоцтової кислота значення р, R4 та R5 описані вище, можуть бути також отримані з відповідної сполуки формули (III), ти ([ ]22D=-23,5° (с=1, СНСІ3)). 6 де R є атомом водню, шляхом проведення взаєСполуки формули (V) можуть бути: модії з формальдегідом у лужних умовах. [Organic 4-гідрокси-1-азабіцикло[2.2.1]гептаном, описаSyntheses Collective Volumes, VII, 271-274, (1990); ним [у міжнародній патентній публікації міжнародна заявка WO 93/06098]. WO93/15080]; 4-гідрокси-1-азабіцикло[2.2.2]октаном, описаним [у С. A. Grab et al., Helv. Chim. Acta (1958), 41,1184-1190]; (3R)-3-гідрокси-1-азабіцикло[2.2.2]октаном або (3S)-3-гідрокси-1-азабіцикло[2.2.2]октаном, описаними [в R. Ringdahl, Acta Pharm Suec. (1979), 16, 281-283], та комерційно доступним від CU Chemie Як буде описано в експериментальному роздіUetikon Gmb. лі, діастереомери сполук формули (III) можуть буНаступні приклади покликані проілюструвати, ти розділені традиційними способами, наприклад, але не обмежити, описані вище експериментальні шляхом колоночної хроматографії або кристалізаметодики. ції. Будова отриманих сполук була підтверджена Наступні сполуки є сполуками загальної фор1 методами Н-ЯМР-спектроскопії та масмули (III), не описаними раніше: спектроскопії. ЯМР-спектри записували на апараСполуки формули (III) турі Varian 300Мгц та відображували хімічний зсув в мільйонних частках (δ) відносно тетраметилсилану. Їх чистоту визначали методом ВЕРХ, застосовуючи хроматографію зі зверненою фазою на апаратурі Waters та одержуючи в результаті значення понад 95%. Молекулярні іони одержували де значення р, R4, R5 та R6 визначені вище, методом електроспреєвої іонізаційної масзамісник у азабіциклогрупі знаходиться в полоспектроскопії на апаратурі Hewlett Packard. Знаженні 3 або 4, та у випадку його перебування в чення оптичного обертання одержували на поляположенні З цей заміщений атом вуглецю має 25 75626 26 риметрі PERKIN-ELMER 241 МС. редньо кондиційованого при рН=7,5 з 0,1Μ Спосіб -аNaH2PO4 буферним розчином. Реакційну суміш Приклад 13 наносили на картридж та потім промивали спочатОдержання (3R)-3-(2-гідрокси-2-тіен-2-ілпентку 2мл ДМСО, а потім тричі 5мл CH3CN, відмиваю4-еноїлокси)-1-(3-фенокскипропіл)-1чи від усіх вихідних речовин. Похідне амонію елюазоніабіцикло[2.2.2]октанброміду ювали 5мл 0,03Μ розчину ТФУ в CH3CN: CHCI3 250мг (0,81ммоль) (3R)-1-азабіцикло[2.2.2]окт(2:1). Цей розчин нейтралізували додаванням 3-илового ефіру 2-гідрокси-2-тіен-2-ілпент-4-енової 300мг полі(4-вінілпіридину), відфільтровували й кислоти, проміжного продукту І-3, розчиняли в 5мл випарювали насухо. Вихід зазначеної в заголовку ацетонітрилу та 7,5мл хлороформу. До цього розсполуки складав 10мг (26%). 1Н-ЯМР (DMCO-d6): δ чину додавали 0,63мл (4,1ммоль) фенокскипропі1,30-1,65 (м, 8Н), 1,80-2,10 (м, 4Н), 2,20-2,37 (м, лброміду. Після перемішування протягом 48 годин 3Н), 2,75-2,92 (м, 1Н), 3,20-3,65 (м, 7Н), 3,90-4,05 при кімнатній температурі в атмосфері азоту, роз(м, 1Н), 4,15-4,30 (м, 2Н), 5,15-5,22 (м, 1Н), 6,24 (с, чинники випарювали. Потім додавали ефір та пе1Н, ОН), 6,95-7,05 (м, 2Н), 7,15-7,20 (м, 1Н), 7,40ремішували суміш. Отриману тверду речовину 7,60 (м, 5Н), 7,85-7,95 (м, 1Н), 8,20-8,25 (м, 1Н). відфільтровували та кілька разів промивали ефіМС: [M-CF3COO]+: 520. ром. Вихід зазначеної в заголовку сполуки склав Просторові конфігурації сполук загальної фо0,3г (71%) у вигляді суміші діастереомерів; т. топ.: рмули (III) були виведені на основі конфігурацій 157°С. 1Н-ЯМР (ДМСО-d6): δ 1,70-2,05 (м, 4Н), відповідних їм кислот. Вони були визначені або 2,05-2,35 (м, 3Н), 2,70-2,83 (м, 1Н), 2,90-3,02 (м, при порівнянні отриманих значень [ ] зі значення1Н), 3,25-3,60 (м, 7Н), 3,82-3,97 (м, 1Н), 3,97-4,10 ми, описаними в літературі, або з застосуванням (м, 2Н), 5,05-5,25 (м, 3Н), 5,70-5,90 (м, 1Н), 6,50 (д, методу кругового дихроїзму (КД). 1Н, ОН), 6,90-7,05 (м, 4Н), 7,10-7,20 (м, 1Н), 7,27Тому що крива КД для (2S)-2-циклогексил-27,35 (м, 2Н), 7,45(м, 1Н). гідрокси-2-фенілоцтової кислоти відома (A. МС: [М-Вг]+: 442. Tambute and A. Collet, Bulletin de la Societe Спосіб -bChimique de France, 1984, №1-2, pages II77-II82) та Приклад 35 всі досліджувані кислоти структурно дуже подібні з Одержання (3R)-3-[(2S)-2-циклопентил-2(2S)-2-циклогексил-2-гідрокси-2-фенілоцтовою гідрокси-2-тіен-2-ілацетокси]-1-[3-(нафтален-1кислотою, можна припустити, що відносне розтаілокси)пропіл]-1шування арильного, циклоалкільного, карбоксильазоніабіцикло[2.2.2]октантрифторацетату ного та гідроксильного замісників може бути ви20мг (0,06ммоль) (3R)-1-азабіцикло[2.2.2]октзначене на основі порівняння відповідних їм 3-илового ефіру (2S)-2-циклопентил-2-гідрокси-2значень Δε. Отримані конфігурації були відобратіен-2-ілоцтової кислоти (проміжний продукт I-15а), жені як R- або S-y відповідності із системою Cahnрозчиняли в 1мл ДМСО. До даного розчину додаlngol-Prelog (дивися таблицю 1). вали 66мг (0,30ммоль) 3-(нафтален-1Криві спектрів КД були записані в 1мм кюветах ілокси)пропілхлориду. Після перемішування протяпри 25°С на спектрофотометрі Jasco-720 (Software гом ночі при кімнатній температурі суміш очищали J-700) у 0,43мМ розчинах зразків у МеОН. методом твердофазної екстракції за допомогою катіонообмінного картриджа Mega Bond Elut, попеТаблиця 1 Сполука (+)-2-циклогексил-2-гідрокси-2-фенілоцтова кислота (-)-2-циклогексил-2-гідрокси-2-фенілоцтова кислота (-)-2-циклопентил-2-гідрокси-2-фенілоцтова кислота (+)-2-циклопентил-2-гідрокси-2-тіен-2-ілоцтова кислотаc,1 (-)-2-циклопентил-2-гідрокси-2-тіен-2-ілоцтова кислотаc,2 (-)-2-циклогексил-2-гідрокси-2-тіен-2-ілоцтова кислота (+)-2-циклопентил-2-фур-2-ил-2-гідроксіоцтова кислотаc,3 (-)-2-циклопентил-2-фур-2-ил-2-гідроксіоцтова кислота (+)-2-циклогексил-2-фур-2-ил-2-гідроксіоцтова кислота (-)-2-циклогексил-2-фур-2-ил-2-гідроксіоцтова кислота [ ]22D +23,1° (c=1,4, EtOH) -23,6° (c=1,4, EtOH) -1,52° (c=3, EtOH) +6,63° (c=1, EtOH) -6,44° (c=1, EtOH) -15,1°(c=1, EtOH) +31,95°(c=1, EtOH) -32,10°(c=1, EtOH) +40,9°(c=1, EtOH) -39,7°(c=1, EtOH) Круговий дихроїзм λ (нм) Δε (Μ-1 см-1) 224 +12,1 224 -1,7 224 -8,93 233 +4,18 233 -4,19 235 -5,40 230 +7,64 230 -7,44 230 +10,9 230 -10,8 Конфігурація Sa R Rb R S S S R S R а) А. Tambute et A. Collet; Bulletin de la Societe Chimigue de France, (1984), №1-2, II-77-II-82: установлена S-конфігурація: [ ]24D=+25,2°(c=1,4, EtOH), Δε=+12,9 М-1см-1 (λ=225нм) b) M Mitsuya et al.,: Bioorg. Med. Chem., (1999), Vol.7, 2555-2567: установлена R-конфігурація [ ]20D=-1,9° (с=3, МеОН) c) Е. Atkinson et al., J. Med. Chem., (1977), Vol.20, №12, 1612-1617. Дано значення для [ ] (конфігурація не встановлена); с,1 та с,2: + 51,3° та - 51,0° (обертання спостерігалося при 350нм) (с=2-5%, МеОН)) Спосіб -сПохідні метилового ефіру загальної формули (VI) одержували стандартними способами, описаними в літературі, або за методикам, описаним у прикладах: проміжні продукти І-9, I-10, I-11, I-12, I-13. Проміжний продукт I-1 Одержання (3R)-1-азабіцикло[2.2.2]окт-3илового ефіру 2-гідрокси-2-тіен-2-ілгептанової кислоти 2,7г метилового ефіру 2-гідрокси-2-тіен-2ілгептанової кислоти (проміжний продукт І-9) (0,011моль) розчиняли в 70мл толуолу. До цього розчину додавали 1,63г (0,0128моль) (3R)-3 27 75626 28 гідрокси-1-азабіцикло[2.2.2]октану та 0,18г датні фракції поєднували й випаровували з одер(0,0045моль) гідриду натрію (60% дисперсія в міжанням двох діастереомерів: І-4а та І-4b. неральній олії). Суміш кип'ятили зі зворотним хоПроміжний продукт І-4а лодильником, постійно видаляючи дистилят шля(3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2S)хом заміщення його, у разі потреби, свіжим 2-циклогексил-2-фур-2-ил-2-гідроксіоцтової кислотолуолом, протягом 1 години. Охолоджену суміш ти екстрагували 1н соляною кислотою, водяний шар 1,59г олії, що відповідає першому елююємому промивали ефіром, підлуговували додаванням діастереомеру, розтирали із сумішшю етилового K2СО3 та екстрагували СНСІ3. Органічний шар ефіру/ізопропілового ефіру (1:1) з одержанням промивали водою, сушили над сульфатом магнію 0,82г (8,6%, у розрахунку на один ізомер) твердої й випарювали. Вихід зазначеної в заголовку споречовини, структура якої була підтверджена метолуки склав 2,85г (76%) у вигляді суміші діастереодом 1Н-ЯМР, у вигляді чистого діастереомера. мерів, структура підтверджена методом 1Н-ЯМР. [ ]22D=+21,1° (с=1, СНСІ3)). 1 1 Н-ЯМР (CDCI3): δ 0,80-0,95 (м, 3Н), 1,20-1,40 (м, Н-ЯМР (CDCI3): δ 1,10-1,45 (м, 8Н), 1,45-1,60 6Н), 1,40-1,90 (м, 4Н), 1,95-2,25 (м, 3Н), 2,50-2,95 (м, 2Н), 1,60-1,85 (м, 4Н), 1,94-2,02 (м, 1Н), 2,26(м, 5Н), 3,10-3,30 (м, 1Н), 4,4 (шир.с, 1Н, ОН), 4,822,38 (м, 1Н), 2,70-2,92 (м, 5Н), 3,20-3,28 (м, 1Н), 4,94 (м, 1Н), 6,94-7,02 (м, 1Н), 7,06-7,14 (м, 1Н), 3,78 (шир.с, 1Н, ОН), 4,90 (м, 1Н), 6,30-6,40 (м, 7,20-7,26 (м, 1Н). 2Н), 7,40 (м, 1Н). МС: [М+1]+: 338. МС: [М+1]+: 334. (Сполука також отримана методом d) Проміжний продукт І-4а піддавали гідролізу Проміжний продукт І-2 (EtOH/NaOH 2н, 2 години при кімнатній темпераОдержання (3R)-1-азабіцикло[2.2.2]окт-3турі, 1 година при 60°С) з одержанням (+)-2илового ефіру 2,3-дифенілпропіонової кислоти циклогексил-2-фур-2-ил-2-гідроксіоцтової кислоти: Отриманий методом, подібним з описаним для [ ]22D=+40,9° (с=1, ЕtOН)). Була встановлена Sпроміжного продукту I-1, але з метилового ефіру конфігурація (дивися таблицю 1) 2,3-дифенілпропіонової кислоти. Вихід зазначеної Проміжний продукт І-4b в заголовку сполуки склав 1,71 (61,5%) у вигляді (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2R)суміші діастереомерів. 1Н-ЯМР (ДМСО): δ 1,052-циклогексил-2-фур-2-ил-2-гідроксіоцтової кисло1,20 (м, 1Н), 1,30-1,60 (м, 3Н), 1,65-1,75 (м, 1Н), ти 2,10-2,20 (м, 1Н), 2,30-2,70 (м, 4Н), 2,85-3,10 (м, 1,12г олії, що відповідає другому елююємому 2Н), 3,20-3,40 (м, 1Н), 3,95-4,10 (м, 1Н), 4,50-4,65 діастереомеру, розтирали із сумішшю етилового (м, 1Н), 7,10-7,45 (м, 10Н). ефіру/ізопропілового ефіру (1:1) з одержанням + МС: [М+1] : 336. 0,57г (6%, у розрахунку на один ізомер) твердої (Метиловий ефір 2,3-дифенілпропіонової кисречовини, структура якої була підтверджена метолоти може бути отриманий з комерційно доступної дом 1Н-ЯМР, у вигляді чистого діастереомеру. 2,3-дифенілпропіонової кислоти). [ ]22D=-23,5° (с=1, СНСІ3)). 1 Проміжний продукт І-3 Н-ЯМР (CDCI3): δ 1,10-1,50 (м, 8Н), 1,50-1,90 Одержання (3R)-1-азабіцикло[2.2.2]окт-3(м, 6Н), 2,04-2,12 (м, 1Н), 2,24-2,36 (м, 1Н), 2,46илового ефіру 2-гідрокси-2-тіен-2-ілпент-4-енової 2,58 (м, 1Н), 2,68-2,94 (м, 4Н), 3,12-3,22 (м, 1Н), кислоти 3,77 (шир.с, 1Н, ОН), 4,90 (м, 1Н), 6,40 (м, 2Н), 7,42 Отриманий методом, подібним з описаним для (м, 1Н). проміжного продукту I-1, але з метилового ефіру 2МС: [М+1]+: 334. гідрокси-2-тіен-2-ілпент-4-енової кислоти (проміжПроміжний продукт І-4b піддавали гідролізу ний продукт I-10). Вихід зазначеної в заголовку (EtOH/NaOH 2н, 2 години при кімнатній темперасполуки склав 1,76г (63,1%) у вигляді суміші діастурі, 1 година при 60°С) з одержанням (-)-2тереомерів. 1Н-ЯМР (CDCI3): δ 1,25-1,80 (м, 4Н), циклогексил-2-фур-2-ил-2-гідроксіоцтової кислоти: 1,80-2,10 (м, 1Н), 2,50-3,05 (м, 7Н), 3,10-3,35 (м, [ ]22D=-39,7° (с=1, ЕtOН)). 2Н), 4,55 (шир.с, 1Н, ОН), 4,75-4,95 (м, 1Н), 5,10Була встановлена R-конфігурація (дивися 5,30 (м, 2Н), 5,70-5,95 (м, 1Н), 6,95-7,05 (м, 1Н), таблицю 1). 7,10-7,20 (м, 1Н), 7,20-7,30 (м, 1Н). Проміжний продукт І-5 МС: [М+1]+: 308. Одержання (3R)-1-азабіцикло[2.2.2]окт-3(Сполука також отримана методом d). илового ефіру 2-циклопентил-2-гідрокси-2Проміжний продукт І-4 фенілоцтової кислоти Одержання (3R)-1-азабіцикло[2.2.2]окт-3Отриманий методом, подібним з описаним для илового ефіру 2-циклогексил-2-фур-2-ил-2проміжного продукту I-1, але з 13,5г (0,0576моль) гідроксіоцтової кислоти метилового ефіру 2-циклопентил-2-гідрокси-2Отриманий методом, подібним з описаним для фенілоцтової кислоти (комерційно доступної), розпроміжного продукту I-1, але з 13,73г (0,057моль) чиненої в 350мл толуолу, 8,0г (0,063моль) (3R)-3метилового ефіру 2-циклогексил-2-фур-2-ил-2гідрокси-1-азабіцикло[2.2.2]октану та 0,91г гідроксіоцтової кислоти (проміжний продукт I-11), (0,023моль) гідриду натрію (60% дисперсія в мінерозчиненої в 350мл толуолу, 8,6г (0,067моль) (3R)ральній олії). Вихід зазначеної в заголовку сполуки 3-гідрокси-1-азабіцикло[2.2.2]октану та 1,37г склав 13,1г (69%) у вигляді суміші діастереомерів (0,0342моль) гідриду натрію (60% дисперсія в мів олії, структура підтверджена методом 1Н-ЯМР. неральної олії). Олію (10,33г) одержували шляхом Після декількох процедур кристалізації розділяли хроматографічного очищення на силікагелі, елююя два діастереомери І-5а та І-5b. хлороформом/метанолом/аміаком (97:3:0,3). При 29 75626 30 Проміжний продукт I-5а чиненої в 400мл толуолу, 9,5г (0,074моль) (3R)-3(3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2R)гідрокси-1-азабіцикло[2.2.2]октану та 1,51г 2-циклопентил-2-гідрокси-2-фенілоцтової кислоти (0,038моль) гідриду натрію (60% дисперсія в мінеУ результаті декількох обробок суміші діастеральній олії). Отриману олія (10,97г) очищали реомерів у вигляді олії різними сумішами діетилохроматографією на силікагелі, елююя хлорофорвого ефіру/гексану та діізопропілового ефімом/метанолом/аміаком (95:5:0,5), з одержанням ру/гексану (при охолодженні до -60°С) одержували 8,97г чистого продукту у вигляді суміші діастерео4,3г білої твердої речовини, ідентифікованої метомерів, структура підтверджена методом 1Н-ЯМР. 1 дом Н-ЯМР як збагачений діастереомер І-5а. ДаПісля триразової кристалізації продукту етиловим ну речовину двічі перекристалізовували з діетилоефіром одержували 1,68г (15,2%) чистого діастевого ефіру/гексану (при охолодженні до 0°С) з реомеру (проміжний продукт І-6а). Маточні кристаодержанням 2г (21%) чистого діастереомеру. лізаційні розчини були насичені іншим діастереомером (проміжний продукт І-6b). [ ]22D=-10,8°(c=1,CHCI3). 1 Проміжний продукт І-6а Н-ЯМР (CDCl3): δ 1,25-1,80 (м, 11Н), 1,80-1,95 (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2S)(м, 1Н), 2,05-2,15 (м, 1Н), 2,40-2,50 (м, 1Н), 2,622-циклогексил-2-гідрокси-2-тіен-2-ілоцтової кис3,05 (м, 5Н), 3,05-3,18 (м, 1Н), 3,80 (с, 1Н, ОН), лоти 4,85-4,90 (м, 1Н), 7,22-7,42 (м, ЗН), 7,60-7,75 (м, 2Н). [ ]22D=-16,5°(c=1,CDCI3)). 1 Проміжний продукт І-5а піддавали гідролізу Н-ЯМР (CDCI3): δ 1,05-1,85 (м, 13Н), 1,85-2,0 (EtOH/NaOH 2н, 2 години при кімнатній темпера(м, 1Н), 2,0-2,16 (м, 2Н), 2,58-2,68 (м, 1Н), 2,70-3,0 турі, 2 години при 60°С) з одержанням (-)-2(м, 4Н), 3,14-3,24 (м, 1Н), 4,0 (с, 1Н, ОН), 4,90-5,0 циклопентил-2-гідрокси-2-фенілоцтової кислоти у (м, 1Н), 6,95-7,05 (м, 1Н), 7,10-7,15 (м, 1Н), 7,207,30 (м, 1Н). вигляді чистого енантіомеру: [ ]20D=-1,52° (с=3, МС: [М+1]+: 350. МеОН). Для цього значення була встановлена RПроміжний продукт І-6а піддавали гідролізу конфігурація, за умови, що в літературі [М. Mitsuya (EtOH/NaOH 2н, 2 години при кімнатній темпераet al., Bioorg. Med. Chem., (1999), 7, 2555-2567] Rтурі, 1 година при 60°С) з одержанням (-)-2енантіомер був описаний значенням [ ]20D=-1,9° циклогексил-2-гідрокси-2-тіен-2-ілоцтової кислоти: (с=3, МеОН). (Дивися таблицю 1). [ ]22D=-15,1° (с=1, ЕtOН) Проміжний продукт l-5b Була встановлена S-конфігурація (дивися таб(3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2S)лицю 1). 2-циклопентил-2-гідрокси-2-фенілоцтової кислоти Проміжний продукт І-6b Маточний розчини першої твердої речовини І(3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2R)5а випаровували та обробляли малеїновою кисло2-циклогексил-2-гідрокси-2-тіен-2-ілоцтової кистою в ізопропанолі/діетиловому ефірі. Після охолоти лодження при 0-5°С одержували 7,0г білої твердої 1 Н-ЯМР (CDCl3): δ 1,05-2,0 (м, 14Н), 2,0-2,20 речовини, ідентифікованої методом 1Н-ЯМР як (м, 2Н), 2,65-3,02 (м, 5Н), 3,24-3,36 (м, 1Н), 4,0 (с, малеат суміші, збагаченою сумішшю другого діас1Н, ОН), 4,80-4,90 (м, 1Н), 6,95-7,05 (м, 1Н), 7,10тереомеру І-5b. Після триразової кристалізації 7,20 (м, 1Н), 7,20-7,30 (м, 1Н). продукту з ацетонітрилу/діетилового ефіру (1:2,2) Сигнали, що відповідають проміжному продукодержували 2,4г (18,7%, у розрахунку на вільну ту І-6а (приблизно 25%) спостерігалися при 2,58основу) малеату, збагаченого другим діастерео2,68, 3,14-3,24 та 4,90-5,0м.ч. мером І-5b (у пропорції 88:12, як визначено метоМС: [М+1]+: 350. дом 1Н-ЯМР). Була встановлена R-конфігурація через реДаний малеат, збагачений другим діастереозультати, отримані для проміжного продукту І-6а мером І-5b (88:12), обробляли СНСІ3 та розчином (дивися таблицю 1). K2СО3 з одержанням вільної основи. Проміжний продукт І-7 І-5b (вільна основа): [ ]22D=+19, 5° (с=1, (3S)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2S)СНСІ3). 1 2-циклопентил-2-гідрокси-2-тіен-2-ілоцтової кисН-ЯМР (CDCI3): δ 1,20-1,80 (м, 12Н), 1,85-2,0 лоти (м, 1Н), 2,60-3,05 (м, 6Н), 3,20-3,35 (м, 1Н), 3,80 (с, 510мг (0,00225моль) (2S)-2-циклопентил-21Н, ОН), 4,75-4,82 (м, 1Н), 7,20-7,45 (м, ЗН), 7,55гідрокси-2-тіен-2-ілоцтової кислоти (отриманої 7,75 (м, 2Н). шляхом гідролізу проміжного продукту I-15а) розСигнали, що відповідають діастереомеру І-5а чиняли в 7мл ДМФ. Даний розчин перемішували (12%), спостерігалися при 2,05-2,15, 2,40-2,50, при кімнатній температурі та декількома порціями 3,05-3,18, 4,85-4,90м.ч. додавали 638мг (0,00393моль) 1,1'Була встановлена S-конфігурація через рекарбонілдіімідазолу. Через 4,5 години, реакційну зультати, отримані для проміжного продукту І-5а суміш охолоджували до 0°С и додавали до неї (дивися таблицю 1). 315мг (0,00248моль) (3S)-3-гідрокси-1Проміжний продукт І-6 азабіцикло[2.2.2]октану та 83мг (0,0021моль) гідОдержання (3R)-1-азабіцикло[2.2.2]окт-3риду натрію (60% дисперсія в мінеральній олії). илового ефіру 2-циклогексил-2-гідрокси-2-тіен-2Після перемішування протягом 112 годин при кімілоцтової кислоти натній температурі реакційну суміш обробляли Отриманий методом, подібним з описаним для водою та тричі екстрагували діетиловим ефіром. проміжного продукту I-1, але з 16,2г (0,064моль) Органічні шари поєднували, промивали насиченим метилового ефіру 2-циклогексил-2-гідрокси-2-тіенсольовим розчином та сушили над безводним су2-ілоцтової кислоти (проміжний продукт I-12), роз 31 75626 32 льфатом магнію. Розчинник випарювали та залиОдержання метилового ефіру 2-гідрокси-2шок очищали колоночною хроматографією на ситіен-2-ілпент-4-еновой кислоти лікагелі (елююя СНСІ3/МеОН 15:1) з одержанням Отриманий методом, подібним з описаним для 360мг (47,6%) зазначеної в заголовку сполуки у проміжного продукту І-9. Вихід склав 1,92г. 45,3%. 1 вигляді олії, структура підтверджена методом 1НН-ЯМР (CDCI3): δ 2,75-3,0 (м, 2Η), 3,80 (с, 3Н), ЯМР. 4,0 (с, 1Н, ОН), 5,10-5,30 (м, 2Н), 5,70-5,90 (м, 1Н), 6,95-7,05 (м, 1Н), 7,10-7,20 (м, 1Н), 7,25-7,35 (м, [ ]22D=-18,16° (с=1,СНСІ3). 1 1Н). Н-ЯМР (CDCI3): δ (Той же самий опис, що й МС:[М]+:212. для проміжного продукту I-15b). + Проміжний продукт I-11 МС:[М+1] :336. Одержання метилового ефіру 2-циклогексилПроміжний продукт І-8 2-фур-2-ил-2-гідроксіоцтової кислоти 1-азабіцикло[2.2.2]окт-4-иловий ефір (2R)-2Отриманий методом, подібним з описаним для циклогексил-2-гідрокси-2-фенілоцтової кислоти проміжного продукту І-9, але з 73мл (0,146моль) Отриманий методом, подібним з описаним для 2М розчину хлориду циклогексилмагнію в діетилопроміжного продукту І-7, але з розчину 660мг вому ефірі та 22,51г (0,146моль) метилового ефіру (0,00282моль) (2R)-2-циклогексил-2-гідрокси-22-фур-2-ил-2-оксооцтової кислоти (розчиненого в фенілоцтової кислоти (отриманої шляхом гідролізу 330мл ТГФ). Отриману олію очищали по методу проміжного продукту I-16а) у 9мл ДМФ, 548мг колоночної хроматографії (силікагель), використо(0,00338моль) 1,1'-карбонілдіімідазолу, 394мг вуючи як елюент суміш гексана/AcOEt 9:1. Після (0,0031моль) 4-гідрокси-1-азабіцикло[2.2.2]октану видалення розчинника було отримано 13,73г та 104мг (0,00259моль) гідриду натрію (60% дис(39%) чистого продукту, структура якого підтверперсія в мінеральній олії). Після перемішування джена МС та 1Н-ЯМР. протягом 44 годин при кімнатній температурі реак1 Н-ЯМР (CDCI3): δ 1,05-1,75 (м, 6Н), 1,75-1,95 ційну суміш обробляли водою та тричі екстрагува(м, 4Н), 2,20-2,40 (м, 1Н), 3,80 (с, ЗН), 3,95 (с, 1Н, ли діетиловим ефіром. Органічні шари поєднуваОН), 6,30-6,50 (м, 2Н), 7,35-7,45 (м, 1Н). ли, промивали насиченим сольовим розчином та МС: [М]+: 238. сушили над безводним сульфатом магнію. Роз(Метиловий ефір 2-фур-2-ил-2-оксооцтової кичинник випарювали й очищали залишок колон очслоти одержували з комерційно доступної 2-фур-2ною хроматографією на силікагелі, елююя від ил-2-оксооцтової кислоти у відповідності зі станСНСІ3 до СНСІз/МеОН 15:1. Вихід склав 300мг дартною методикою). (31%) зазначеної в заголовку сполуки. Проміжний продукт I-12 [ ]22D=-27,6°(c=1,CHCI3). 1 Одержання метилового ефіру 2-циклогексилН-ЯМР (CDCI3): δ 1,0-1,55 (м, 7Н), 1,55-1,75 2-гідрокси-2-тієн-2-ілоцтової кислоти (м, 2Н), 1,75-1,85 (м, 1Н), 1,85-2,05 (м, 6Н), 2,1098,6мл (0,197моль) 2М розчину хлориду цик2,22 (м, 1Н), 2,90-3,10 (м, 6Н), 3,60-3,80 (шир.с, 1Н, логексилмагнію в діетиловому ефірі додавали до ОН), 7,20-7,40 (м, ЗН), 7,57-7,67 (м, 2Н). розчину 27,97 г (0,164моль) метилового ефіру 2МС: [М+1]+: 344. оксо-2-тієн-2-ілоцтової кислоти, розчиненого в Проміжний продукт І-9 370мл ТГФ, при -78°С в атмосфері азоту. Суміш Одержання метилового ефіру 2-гідрокси-2перемішували при даній температурі протягом 10 тіен-2-ілгептанової кислоти хвилин та потім нагрівали до кімнатної температу50мл розчину в ефірі 0,0338моль броміду пенри. Через 1 годину реакційну суміш обробляли тилмагнію, отриманого з 5,1г 1-бромпентану насиченим розчином хлориду амонію та тричі екс(0,0338моль) та 0,0372моль магнію, додавали до трагували додаванням етилацетату. Органічні фарозчину 5г метилового ефіру 2-оксо-2-тіен-2зи поєднували, промивали водою та сушили над ілоцтової кислоти, розчиненої в 40мл розчину ефіMgSO4. Після видалення розчинника отриману ру/ТГФ (50:50), при -70°С в атмосфері азоту. Суолію очищали по методу колоночної хроматографії міш перемішували при даній температурі протягом (силікагель), використовуючи як елюент гек10 хвилин та потім нагрівали до кімнатної темпесан/AcOEt (90:10). Вихід складав 16,2г (39,5%) ратури. Через 16г реакційну суміш обробляли начистого продукту, структура якого підтверджена сиченим розчином хлориду амонію та тричі екст1 Н-ЯМР. рагували додаванням етилацетату. Органічні фази 1 Н-ЯМР (CDCI3): δ 1,0-1,55 (м, 6Н), 1,55-1,90 поєднували, промивали водою та сушили над (м, 4Н), 2,0-2,20 (м, 1Н), 3,80 (с, 3Н), 4,0 (с, 1Н, MgSO4. Після видалення розчинника отриману ОН), 7,0 (м, 1Н), 7,10 (м, 1Н), 7,20-7,30 (м, 1Н). олію очищали по методу колоночної хроматографії МС: [М+]: 254. (силікагель), використовуючи як елюент суміші (Проміжний продукт I-12 описаний [в Е. гексану/AcOEt (25:1 до 15:1). Вихід складав 2,7г Atkinson et al. J. Med. Chem., (1977), Vol.20, №12, (38%) чистого продукту, структура якого підтвер1612-1617]). джена 1Н-ЯМР. 1 Проміжний продукт I-13 Н-ЯМР (CDCI3): δ 0,80-1,0 (м, 3Н), 1,10-1,45 Одержання метилового ефіру 2-циклопентил(м, 6Н), 1,90-2,30 (м, 2Н), 3,80 (с, ЗН), 4,05 (с, 1Н, 2-гідрокси-2-тієн-2-ілоцтової кислоти ОН), 7,0 (м, 1Н), 7,10 (м, 1Н), 7,30 (м, 1Н). Отримано, як у прикладі I-12. Вихід складав (Метиловий ефір 2-оксо-2-тіeн-2-ілоцтової ки3,83г (37%). слоти одержували з комерційно доступної 2-оксо1 Н-ЯМР (CDCI3): δ 1,35-1,75 (м, 8Н), 2,70-2,90 2-тіен-2-ілоцтової кислоти у відповідності зі стан(м, 1Н), 3,80 (с, 3Н), 4,02 (с, 1Н, ОН), 6,95-7,05 (м, дартною методикою). 1Н), 7,10-7,20 (м, 1Н), 7,20-7,25 (м, 1Н). Проміжний продукт I-10 33 75626 34 (Проміжний продукт I-13 описаний [в Е. (EtOH/NaOH 2н, 2 години при кімнатній темпераAtkinson et al. J. Med. Chem., (1977), Vol.20, №12, турі) з одержанням (-)-2-циклопентил-2-фур-2-ил1612-1617]). 2-гідроксіоцтової кислоти: Спосіб -d[ ]22D=-32,10° (c=1, EtOH). Проміжний продукт I-14 Установлено R-конфігурацію. (Див. таблицю 1). Одержання (3R)-1-азабіцикло[2.2.2]окт-3((3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір 2илового ефіру 2-циклопентил-2-фур-2-ил-2фур-2-ил-2-оксооцтової кислоти може бути отригідроксіоцтової кислоти маний, [як описано в WO 01/04118]). Хлорид циклопентилмагнію, 0,0472моль Проміжний продукт I-15 (23,6мл 2М розчину в ефірі), додавали до розчину Одержання (3R)-1-азабіцикло[2.2.2]окт-39,4г (0,0377моль) (3R)-1-азабіцикло[2.2.2]окт-3илового ефіру 2-циклопентил-2-гідрокси-2-тієн-2илового ефіру 2-фур-2-ил-2-оксооцтової кислоти, ілоцтової кислоти розчиненого в 125мл ТГФ, при -70°С в атмосфері Отриманий методом, подібним з описаним для азоту. Суміш перемішували при даній температурі проміжного продукту I-14, але з 20,8г (0,0784моль) протягом 10 хвилин та потім нагрівали до кімнат(3R)-1-азабіцикло[2.2.2]окт-3-илового ефіру 2-оксоної температури. Через 16 годин реакційну суміш 2-тієн-2-ілоцтової кислоти та хлориду циклопентиобробляли насиченим розчином хлориду амонію лмагнію, 0,08моль (40мл 2М розчину в ефірі). та тричі екстрагували додаванням етилацетату. Отриману олію (15,64г) очищали по методу колоОрганічні фази поєднували, промивали водою та ночної хроматографії на силікагелі, елююючи хлосушили над MgSO4. Після видалення розчинника роформом/метанолом/аміаком 97:3:0,5 з одержанотриману олію (7,5г) очищали по методу колоночням 8,38г (32%) чистого продукту, суміші ної хроматографії на силікагелі, елююючи хлородіастереомерів: I-15а та I-15b. формом/метанолом/аміаком 95:5:0,5. Придатні Структура підтверджена 1Н-ЯМР. фракції поєднували й упарювали з одержанням Проміжний продукт I-15а двох діастереомерів: I-14а, I-14b. (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2S)Проміжний продукт I-14а 2-циклопентил-2-гідрокси-2-тієн-2-ілоцтової кис(3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2S)лоти 2-циклопентил-2-фур-2-ил-2-гідроксіоцтової кисСуміш діастереомерів у виді олії обробляли лоти ізопропіловим ефіром з одержанням твердої речо1,55г олії, що відповідає першому елюююмому вини, що знову обробляли ізопропіловим ефіром з діастереомеру, розтирали із сумішшю ізопропілоодержанням 2,2г чистого діастереомеру (проміжвого ефіру/петролейного ефіру (1:1) з одержанням ного продукту I-15а, 16,7% у розрахунку на один 0,24г (4%, у розрахунку на один ізомер) твердої ізомер). речовини, структура якого була підтверджена ме[ ]22D=-5,75° (с=1, СНСІ3); т.пл. 152-157°С. 1 тодом 1Н-ЯМР, у виді чистого діастереомера; т.пл. Н-ЯМР (CDCI3): δ 1,40-1,80 (м, 11Н), 1,80-2,0 109,6-110,6°С. (м, 1Н), 2,10 (м, 1Н), 2,52-2,65 (м, 1Н), 2,70-2,95 (м, [ ]22D=19,7°(с=1,СНСІ3). 5Н), 3,10-3,22 (м, 1Н), 4,07 (с, 1Н, ОН), 4,85-4,95 1 Н-ЯМР (CDCI3): δ 1,22-1,37 (м, 1Н), 1,40-1,80 (м, 1Н), 6,95-7,05 (м, 1Н), 7,10-7,20 (м, 1Н), 7,20(м, 11Н), 1,97 (м, 1Н), 2,74-2,96 (м, 6Н), 3,19-3,30 7,27 (м, 1Н). (м, 1Н), 3,80 (уш.с, 1Н, ОН), 4,85-4,89 (м, 1Н), 6,34МС:[М+1]+: 336. 6,37 (м, 2Н), 7,35 (м, 1Н). Проміжний продукт I-15а піддавали гідролізу МС: [М+1]+: 320. (EtOH/NaOH 2н, 2 години при кімнатній темпераПроміжний продукт I-14а піддавали гідролізу турі, 2 години при 60°С) з одержанням (-)-2(EtOH/NaOH 2н, 2 години при кімнатній темперациклопентил-2-гідрокси-2-тієн-2-ілоцтової кислоти: турі) з одержанням (+)-2-циклопентил-2-фур-2-ил[ ]22D=-6,44° (c=1, EtOH). 2-гідроксіоцтової кислоти: [ ]22D=+31,95° (с=1, Установлено S-конфігурацію. (Див. таблицю 1). ЕtOН). Проміжний продукт I-15b Установлена S конфігурація. (Див. таблицю 1). (3R)-1-aзабіцикло[2.2.2]окт-3-иловий ефір (2S)Проміжний продукт I-14b 2-циклопентил-2-гідрокси-2-тієн-2-ілоцтової кис(3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2R)лоти 2-циклопентил-2-фур-2-ил-2-гідроксіоцтової кисМаточні розчини першої кристалізації проміжлоти ного продукту I-15а упарювали й отриману олію 1,10г твердої речовини, що відповідає другому обробляли ізопропіловим ефіром з одержанням елюююмому діастереомеру, розтирали із сумішшю твердої речовини, потім знову обробляли ізопроізопропілового ефіру/петролейного ефіру (1:1) з піловим ефіром з одержанням 1,47г другого діасодержанням 0,42г (7%, у розрахунку на один ізотереомеру проміжного продукту I-15b (11,2% у мер) твердої речовини, структура якої була підтрозрахунку на один ізомер). верджена методом 1Н-ЯМР, у виді чистого діасте[ ]22D=22,49° (с=1, СНСІ3); т.пл. 99-102°С. 1 реомера; т.пл. 119,9-122,1°С. Н-ЯМР (CDCI3): δ 1,25-1,85 (м, 12Н), 2,0 (м, 22 [ ] D=-14,2° (c=1,CHCI3). 1Н), 2,65-2,95 (м, 6Н), 3,22-3,34 (м, 1Н), 4,05 (с, 1Н, 1 Н-ЯМР (CDCI3): δ 1,40-1,90 (м, 12Н), 2,07 (м, ОН), 4,80-4,92 (м, 1Н), 6,90-7,0 (м, 1Н), 7,10-7,16 1Н), 2,49-2,56 (м, 1Н), 2,67-2,86 (м, 5Н), 3,12-3,24 (м, 1Н), 7,20-7,27 (м, 1Н). (м, 1Н), 3,80 (уш.с, 1Н, ОН), 4,87-4,91 (м, 1Н), 6,35МС:[М+1]+:336. 6,39 (м, 2Н), 7,38 (м, 1Н). Проміжний продукт I-15b піддавали гідролізу МС:[М+1]+: 320. (EtOH/NaOH 2н, 2 години при кімнатній темпераПроміжний продукт l-14b піддавали гідролізу турі, 2 години при 60°С) з одержанням (+)-2 35 75626 36 циклопентил-2-гідрокси-2-тієн-2-ілоцтової кислоти: кту I-16а упарювали та залишок розчиняли у воді. Отриманий розчин промивали ефіром, подлужу[ ]22D=+6,63° (с=1, EtOH). вали K2СО3 та екстрагували додаванням СНСІ3. Установлено R-конфігурацію. (Див. таблицю 1). Органічний шар сушили над MgSO4 та розчинник (Проміжні продукти I-15а та I-15b також були випарювали. Отриману олію (7,5г) розчиняли в отримані у відповідності з у таким способом с). 50мл ізопропанолу й обробляли ЕtOН/НСІ (г). Піс((3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір 2ля додавання 75мл етилового ефіру одержували оксо-2-тієн-2-ілоцтової кислоти може бути отрима3,1г хлоргідрату другого діастереомеру, проміжноний, [як описано в WO 01/04118]) го продукту I-16b. Проміжний продукт I-16 Хлоргідрат: МС: [М (вільна основа)+1]+=344. Одержання (3R)-1-азабіцикло[2.2.2]окт-3Хлоргідрат обробляли СНСІ3 та розчину K2СО3 илового ефіру 2-циклогексил-2-гідрокси-2з одержанням вільної основи проміжного продукту фенілоцтової кислоти I-16b. Хлорид циклогексилмагнію, 0,127моль (63,6мл 2М розчину в ефірі), додавали до розчину 28,7г I-16b (вільна основа): [ ]22D=25,3° (c=1, CHCI3). 1 (0,111моль) (3R)-1-азабіцикло[2.2.2]окт-3-илового Н-ЯМР (CDCI3): δ 1,0-1,78 (м, 13Н), 1,78-1,90 ефіру 2-оксо-2-фенілоцтової кислоти, розчиненого (м, 1Н), 1,92-2,0 (м, 1Н), 2,20-2,34 (м, 1Н), 2,66-2,96 в 350мл ТГФ, при -70°С в атмосфері азоту. Суміш (м, 5Н), 3,20-3,32 (м, 1Н), 3,70-3,85 (с, 1Н, ОН), перемішували при даній температурі протягом 10 4,75-4,85 (м, 1Н), 7,25-7,40 (м, ЗН), 7,60-7,70 (м, хвилин та потім нагрівали до кімнатної температу2Н). ри. Через 1 годину реакційну суміш обробляли Проміжний продукт I-16b (вільна основа) піднасиченим розчином хлориду амонію та двічі екстдавали гідролізу (EtOH/NaOH 2н, 8 годин при рагували додаванням етилацетату. Органічні фази 60°С) з одержанням (+)-2-циклогексил-2-гідроксипоєднували, промивали водою та сушили над 2-фенілоцтової кислоти у виді чистого енантіомеру MgSO4. Після видалення розчинника отриману [ ]22D=+23,1° (с=1,4, ЕtOН). Дане значення дозвоолію (27,0г) очищали по методу колоночної хромалило припустити S-конфігурацію відповідно до тографії на силікагелі, використовуючи як елюент результатів, отриманими для проміжного продукту хлороформ/метанол 10:1. Вихід склав 18,7г I-16а. (Див. таблицю 1). (49,2%) чистого продукту, суміші діастереомерів: I((3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір 216а та I-16b. оксо-2-фенілоцтової кислоти може бути отримаПроміжний продукт I-16а ний, [як описано в WO 92/04346]). (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2R)Проміжний продукт I-17 2-циклогексил-2-гідрокси-2-фенілоцтової кислоти (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір 216г суміші діастереомерів у виді олії розчинягідрокси-2,3-дифенілпропіонової кислоти ли в ізопропанолі й обробляли 5,4г фумарової Отриманий відповідно до того ж способу, що й кислоти. Після охолодження до 0-5°С одержували проміжний продукт I-16 у виді суміші діастереоме8г фумарату першого діастереомеру (проміжного рів I-17а та I-17b, що розділяли кристалізацією з продукту I-16а). використанням ефіру/ізопропілового ефіру. Фумарат: МС: [М (вільна основа)+1]+=344. Проміжний продукт I-17а 8г даної солі перекристалізовували з ізопро(3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2*)панолу з одержанням 5 г більш чистого продукту. 2-гідрокси-2,3-дифенілпропіонової кислоти, перДану сіль обробляли СНСІ3 та розчину K2СО3 з ший отриманий діастереомер одержанням вільної основи проміжного продукту IВихід складав 0,87г (42,6% у розрахунку на 16а. один ізомер), т. пл.: 132°С. 1 I-16а (вільна основа): Н-ЯМР (CDCI3): δ 1,30-1,60 (м, 2Н), 1,60-1,90 22 [ ] D=-14,9°(c=1, СНСІ3). (м, 2Н), 2,05 (м, 1Н), 2,20-2,35 (м, 1Н), 2,50-2,90 (м, 1 Н-ЯМР (CDCI3): δ 1,0-1,95 (м, 14Н), 2,04-2,12 4Н), 3,0-3,15 (м, 1Н), 3,25 та 3,60 (дд, 2Н), 3,70 (м, 1Н), 2,16-2,32 (м, 1Н), 2,38-2,50 (м, 1Н), 2,64(уш.с, 1Н, ОН), 4,70-4,80 (м, 1Н), 7,15-7,45 (м, 8Н), 2,96 (м, 4Н), 3,04-3,16 (м, 1Н), 3,70-3,85 (с, 1Н, 7,65-7,75 (м, 2Н). ОН), 4,85-4,90 (м, 1Н), 7,25-7,40 (м, ЗН), 7,60-7,70 МС:[М+1]+352. (м, 2Н). ((*): Конфігурація не встановлена). Проміжний продукт I-16а (вільна основа) підПроміжний продукт I-17b давали гідролізу (EtOH/NaOH 2н, 7 годин при (3RК)-1-азабіцикло[2.2.2]окт-3-иловий ефір 60°С) з одержанням (-)-2-циклогексил-2-гідрокси-2(2*)-2-гідрокси-2,3-дифенілпропіонової кислоти, фенілоцтової кислоти у виді чистого енантіомеру другий отриманий діастереомер Вихід складав 0,23г (11,2% у розрахунку на [ ]22D=-23,6° (с=1,4, ЕtOН). Дане значення дозвоодин ізомер), т. пл.: 107°С. 1Н-ЯМР (CDCI3): δ 1,20лило припустити R-конфігурацію за умови, що в 1,35 (м, 1Н), 1,35-1,55 (м, 2Н), 1,55-1,70 (м, 1Н), літературі [A. Tambute, A. Collet; Bulletin de la 1,80-1,95 (м, 1Н), 2,55-2,90 (м, 5Н), 3,10-3,20 (м, Societe Chimique de France, 1984, №1-2, стор. II-77 1Н), 3,25 та 3,60 (дд, 2Н), 3,80 (уш.с, 1Н, ОН), 4,65II-82) (2S)-2-циклогексил-2-гідрокси-24,80 (м, 1Н), 7,20-7,50 (м, 8Н), 7,65-7,75 (м, 2Н). фенілоцтова кислота описана з МС:[М+1]+: 352. [ ]22D=+25,2° (с = 1,4, ЕtOН). (Див. таблицю 1). ((*): Конфігурація не встановлена). Проміжний продукт I-16b Проміжний продукт I-18 (3R)-1(3R)-1-Азабіцикло[2.2.2]окт-3-иловий ефір азабіцикло[2.2.2]окт-3-иловий ефір 2-гідрокси-3(2S)-2-циклогексил-2-гідрокси-2-фенілоцтової кисфеніл-2-тієн-2-ілпропіонової кислоти лоти Отриманий відповідно до того ж способу, що й Маточні розчини фумарату проміжного проду 37 75626 38 проміжний продукт I-15 у виді суміші діастереомепо методу хроматографії на силікагелі, елююючи рів. Вихід складав 0,81г (54%). Продукт очищали хлороформом/метанолом/аміаком від 97,5:2,5:0,25 шляхом одержання хлоргідрату, одержували 0,57г до 90:10:1. Придатні фракції поєднували й упарюданої солі (63% у розрахунку на вільну основу). вали з одержанням двох діастереомерів: Хлоргідрат: Проміжні продукти І-22а та І-22b 1 Н-ЯМР (ДМСО-d6): δ 1,40-1,60 (м, 1Н), 1,60Проміжний продукт І-22а: 1,95 (м, 3Н), 2,05 та 2,10 (м, 1Н), 2,75-3,65 (м, 8Н), (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір (2*)4,90-5,05 (м, 1Н), 6,50 та 6,55 (с, 1Н, ОН), 6,95-7,05 2-гідроксиметил-2,3-дифенілпропіонової кислоти (м, 1Н), 7,10-7,30 (м, 6Н), 7,40-7,50 (м, 1Н), 10,9 1,25г твердої речовини, що відповідає першо(уш.с, 1Н, ΝΗ+). му елюююмому діастереомеру, розтирали з ізопМС: [М+1]+: 358. ропіловим ефіром з одержанням 0,95г (42%, у роПроміжний продукт I-19 зрахунку на один ізомер) білої твердої речовини, (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір 2структура якої була підтверджена методом 1Нгідрокси-2-тієн-2-ілпент-3-инової кислоти ЯМР, у виді чистого діастереомера; т.пл. 119°С. 1 Отриманий відповідно до того ж способу, що й Н-ЯМР (CDCI3): δ 1,20-1,35 (м, 1Н), 1,40-1,70 проміжний продукт I-15 у виді суміші діастереоме(м, 3Н), 1,90 (м, 1Н), 2,5 (уш.с, ОН), 2,60-2,85 (м, рів. Вихід складав 1,88г (25,6%). 5Н), 3,15-3,25 (м, 1Н), 3,40-3,50 (дд, 2Н), 3,95-4,10 1 Н-ЯМР (CDCI3): δ 1,20-1,90 (м, 4Η), 1,92 та (дд, 2Н), 4,85 (м, 1Н), 7,05 (м, 2Н), 7,15-7,40 (м, 1,96 (с, 3Н, СН3), 2,0 та 2,16 (м, 1Н), 2,45-2,90 (м, 8Н). 5Н), 3,05-3,20 та 3,15-3,27 (м, 1Н), 4,85-4,92 (м, МС:[М+1]+=366. 1Н), 6,94-7,0 (м, 1Н), 7,24-7 30 (м, 2Н), сигнал, що ((*): Конфігурація не встановлена). відповідає ОН-групі спостерігався між 4,5 та 5,5 у Проміжний продукт І-22b виді широкої смуги. МС: [М+1]+: 306. (3R)-1-Азабіцикло[2.2.2]окт-3-иловий ефір (2*)Проміжний продукт І-20 2-гідроксиметил-2,3-дифенілпропіонової кислоти (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір 21,84г олії, що відповідає другому елюююмому гідрокси-2-тієн-2-илбут-3-енової кислоти діастереомеру, очищали по методуколоночної Отриманий відповідно до того ж способу, що й хроматографії (в описаних вище умовах) з одерпроміжний продукт I-15 у виді суміші діастереомежанням 1,26г твердої речовини, що після розтирів. Вихід складав 1,74г (18,8%). рання з ізопропіловим ефіром дає 0,95г білої тве1 Н-ЯМР (CDCI3): δ 1,30-1,90 (м, 4Н), 2,05-2,15 рдої речовини, структура якої була підтверджена (м, 1Н), 2,60-3,0 (м, 5Н), 3,15-3,35 (м, 1Н), 3,40-4,70 методом 1Н-ЯМР, у виді чистого діастереомера (широка смуга, 1Н, ОН), 4,85-4,95 (м, 1Н), 5,30(42%, у розрахунку на один ізомер); т. пл. 154°С. 1 5,40 (м, 1Н), 5,60-5,75 (м, 1Н), 6,30-6,50 (м, 1Н), Н-ЯМР (CDCI3): δ 1,20-1,35 (м, 1Η), 1,50-1,75 6,95-7,05 (1Н), 7,10-7,15 (м, 1Н), 7,25-7,30 (м, 1Н). (м, ЗН), 2,0 (м, 1Н), 2,35 (уш.с, ОН), 2,50-2,80 (м, МС: [М+1]+: 294. 5Н), 3,10-3,20 (м, 1Н), 3,35-3,50 (дд, 2Н), 3,95-4,10 Проміжний продукт I-21 (дд, 2Н), 4,85 (м, 1Н), 7,0 (м,. 2Н), 7,15-7,40 (м, 8Н). (3R)-1-азабіцикло[2.2.2]окт-3-иловий ефір 2МС:[М+1]+:366. гідрокси-4-феніл-2-тієн-2-ілмасляної кислоти ((*): Конфігурація не встановлена). Отриманий відповідно до того ж способу, що й Також під об'єм даного винаходу підпадають проміжний продукт I-15 у виді суміші діастереомефармацевтичні композиції, що містять як активний рів. Вихід складав 0,29г (2,4%). інгредієнт, щонайменше, одне хінуклідинове похі1 Н-ЯМР (CDCI3): δ 1,25-1,95 (м, 4Н), 1,95-2,10 дне загальної формули (І) у сполученні з фарма(м, 1Н), 2,30-3,0 (м, 9Н), 3,10-3,25 (м, 1Н), 4,80-4,90 цевтично прийнятним або носієм розріджувачем. (м, 1Н), 6,95-7,05 (м, 1Н), 7,05-7,40 (м, 7Н). Переважно, композиція виготовлена у формі, що МС:[М+1]+: 372. підходить для перорального введення. Спосіб -еФармацевтично прийнятні носії або розріджуПроміжний продукт І-22 вачі, що змішують з активною сполукою або сполуОдержання (3R)-1-азабіцикло[2.2.2]окт-3ками для приготування композиції по даному виилового ефіру 2-гідроксиметил-2,3находу, добре відомі як такі, та застосування дифенілпропіонової кислоти конкретних наповнювачей залежить, крім іншого, 2,40мл 2М розчину діізопропіламіду літію від бажаного способу введення композиції. (0,0048моль) (у гептані/ТГФ/етилбензолі) додаваКомпозиції по даному винаходу переважно ли до розчину, що перемішується, 1,5г пристосовані для перорального введення. У дано(0,0045моль) (3R)-1-азабіцикло[2.2.2]окт-3-илового му випадку композиція для перорального введенефіру 2,3-дифенілпропіонової кислоти в 30мл ТГФ ня може приймати форму таблеток, таблеток із при -70°С в атмосфері азоту. СН2О (газ) барботуплівковим покриттям, рідкого препарату для інгавали через реакційну суміш за допомогою постійляцій, порошкоподібного препарату для інгаляцій ного потоку сухого азоту протягом 10 хвилин при та аерозолю для інгаляцій; кожний з який містить 70°С та потім у той час як суміш нагрівалася до одну або кілька сполук по даному винаходу; такі кімнатної температури. Реакцію гасили додаванпрепарати можуть бути приготовлені відповідно до ням насиченого розчину хлориду амонію (100мл) методик, добре відомих в даній області. та отриману суміш двічі екстрагували додаванням Розріджувачі, що можуть бути застосовані в 100мл етилацетату. Органічні шари поєднували, приготуванні композицій, містять у собі такі рідкі та сушили над MgSO4 та упарювали з одержанням тверді розріджувачі, що сумісні з активним інгреді1,9г олії. Ці 1,9г поєднували з 3,28г попереднього єнтом, за бажанням разом з барвниками та корипрепарату й отриманий продукт (5,18г) очищали гентами. Таблетки або покриті плівкою таблетки 39 75626 40 40 86,9 72,7 звичайно можуть містити від 1 до 500мг, переваж43 83,4 58,7 но, від 5 до 300мг активного інгредієнта. Компози44 84,6 44,6 ції для інгаляцій можуть містити від 1мкг до 46 87,1 57,6 1000мкг, переважно, від 10мкг до 800мкг активного 53 81,5 58 інгредієнта. У терапії людини доза сполуки загаль54 72,5 44,1 ної формули (І) залежить від бажаного ефекту та 56 77,3 53,8 тривалості лікування; дози для дорослих, як пра57 77,4 47,1 вило, складають від 3мг до 300мг у добу у виді 61 75,1 39,9 таблеток та від 10мкг до 800мкг у добу у виді ком64 78,6 64,5 позицій для інгаляцій. 65 79,8 66,0 Фармакологічна дія 67 75,1 52,5 Були отримані наступні результати по зв'язу69 70,8 43,9 ванню з мускариновими рецепторами людини й у 70 71,2 50,0 тесті на бронхоспазм у морських свинок. 80 72,4 55,8 Дослідження мускаринових рецепторів людини 81 70,1 45,4 82 70,6 55,3 Зв'язування [3H]-NMS з людськими мускарино83 72,7 60,3 вими рецепторами проводили відповідно до 84 68,3 41,0 Waelbroek et al. (1990), Моl. Pharmacol., 38:26786 68,2 37,2 273. Дослідження проводили при 25°С. Застосову88 65,5 35,7 вали препарати мембран стабільно трансфікова89 68,5 51,3 них клітин К1 яєчника китайського хом'ячка (СНО), 92 69,4 49,2 що експресують гени людських мускаринових рецепторів МЗ. Тест на бронхоспазм у морських свинок Для визначення ІС50 препарати мембран суДослідження проводили відповідно до [Н. спендували в DPBS до кінцевої концентрації Konzett and F. Rossler (1940), Arch. Exp.Path. 89мкг/мл для підтипу МЗ. Суспензію мембран інкуPharmacol. 195: 71-74]. Водні розчини підлягаючих бували з міченою тритієм сполукою протягом 60хв. тестуванню агентів розпорошували та інгалювали Після інкубації мембранну фракцію відокремлюваанестезованим самцям морських свинок (Dunkin ли фільтруванням та визначали зв'язану радіоакHartley) зі штучно вентильованими легенями. Витивність. Неспецифічне зв'язування визначали за -4 значали реакцію бронхів на внутрішньовенне стидопомогою додавання 10 Μ атропіну. Для побумулювання ацетилхоліном до та після введення дови індивідуальних кривих заміщення досліджулікарського засобу та різницю в несприйнятливості вали, щонайменше, шість концентрацій у двох легень по декільком тимчасовим точкам виражали повторах. у відсотках від інгібування бронхоспазму. Результати авторів показують, що сполуки по Сполуки по даному винаходу інгібували бронданому винаходу мають високу афінність стосовно хоспастичну відповідь на ацетилхолін з високою мускаринових рецепторів МЗ, переважно, людсьефективністю та великою тривалістю дії. ких мускаринових рецепторів. Рівні афінності виЗ приведених вище результатів фахівцю в дамірювали в дослідженнях in vitro, як описано вище, ній області цілком зрозуміло, що сполуки по данопри 100нМ та 10нМ. Переважні сполуки по даному му винаходу мають відмінну антимускаринову аквинаході інгібують зв'язування [3H]-NMS, щонайтивність (МЗ) та, таким чином, можуть менше, на 35% при 10нМ та, щонайменше, на 65% застосовуватися для лікування захворювань, в які при 100нМ (таблиця 2). втягнутий мускариновий рецептор МЗ, включаючи респіраторні порушення, такі як хронічна обструкТаблиця 2 тивна хвороба легень (ХОЗЛ), бронхіт, гіперреактивність бронхів, астма, кашель та риніт; урологіч% інгібування % інгібування конні порушення, такі як нетримання сечі, полакіурія, № сполуки концентрація: центрація: 1,00Е1,00Е-07Μ 08Μ нейрогенний або нестабільний сечовий міхур, цисАтропін 88,3 69,75 тоспазм або хронічний цистит; порушення шлункоІпратропія бромід 93,75 67,25 во-кишкового тракту, такі як синдром роздратова13 76 36 ної товстої кишки, спастичний коліт, дивертикуліт 14 76,5 39,0 та пептична виразка; та порушення серцево16 74,2 36,3 судинної системи, такі як індукована блукаючим 22 81,5 72 нервом синусова брадикардія. Наприклад, сполуки 23 75,6 63,3 по даному винаходу можуть застосовуватися для 24 78 56,6 лікування респіраторних захворювань, таких як 25 76,1 62,6 хронічне обструктивне захворювання легень, хро26 75,6 63,8 нічний бронхіт, астма та риніт; урологічних захво28 78,3 60,6 рювань, таких як нетримання сечі та полакіурія 29 79,0 53,8 при neuripenia pollakinuria, нейрогенний сечовий 31 74,3 54,3 міхур, нічний енурес, нестабільний сечовий міхур, 32 73,9 44,5 33 72,8 46,7 цистоспазм та хронічний цистит; захворювань 34 85,3 68,3 шлунково-кишкового тракту, таких як синдром роз36 84,2 42,0 дратованої товстої кишки, спастичний коліт та ди37 88,1 72,6 вертикуліт. 38 86,3 57,7 41 75626 42 Даний винахід додатково відноситься до споспособів с та b із проміжного продукту I-2. Вихід луки формули (І) або фармацевтично прийнятної кінцевої стадії складав 20мг, 71%. композиції, що містить сполуку формули (і), для МС [M-CF3COO]+: 470. 1 застосування в способі терапевтичного лікування Н-ЯМР (ДМСО-d6): δ 1,50-1,72 (м, 2Н), 1,75організму людини або тварини, зокрема, для ліку1,95 (м, 2Н), 1,97-2,15 (м, 3Н), 2,95-3,15 (м, 4Н), вання респіраторного, урологічного або шлунково3,20-3,50 (м, 5Н), 3,75-3,85 (м, 1Н), 3,95-4,15 (м, кишкового захворювання або порушення. 3Н), 4,95-5,05 (м, 1Н), 6,90-7,0 (м, 4Н), 7,15-7,45 (м, Даний винахід додатково відноситься до за11Н). стосування сполуки формули (І) або фармацевтиПриклад 2 чно прийнятної композиції, що містить сполуку (3R)-3-(2,3-Дифенілпропіонілокси)-1-(3-тієн-2формули (І), для виробництва лікарського препаілпропіл)-1рату для лікування респіраторного, урологічного азоніабіцикло[2.2.2]октантрифторацетат або шлунково-кишкового захворювання або поруЗазначена в заголовку сполука була синтезошення. вана у виді суміші діастереомерів відповідно до Крім того, сполуки формули (І) або фармацевспособів с та b із проміжного продукту І-2. Вихід тично прийнятні композиції, що містять сполуку кінцевої стадії складав 15мг, 55%. формули (І), можуть застосовуватися в способі MC [M-CF3COO]+: 460. 1 лікування респіраторного, урологічного або шлунН-ЯМР (ДМCO-d6): δ 1,50-1,70 (м, 2Н), 1,70ково-кишкового захворювання або порушення, 2,0 (м, 4Н), 2,0-2,15 (м, 1Н), 2,75-2,85 (м, 2Н), 2,85причому зазначений спосіб передбачає введення 3,20 (м, 4Н), 3,20-3,45 (м, 5Н), 3,70-3,82 (м, 1Н), людині або тварині, що потребує такого лікування, 4,02-4,12 (м, 1Н), 4,95-5,02 (м, 1Н), 6,90-7,05 (м, ефективної нетоксичної кількості сполуки формули 2Н), 7,10-7,45 (м, 11Н). (І) або фармацевтичної композиції, що містить Приклад 3 сполуку формули (І). (3R)-3-[(2*)-2-гідроксиметил-2,3Крім того, сполуки формули (І) або фармацевдифенілпропіонілокси]-1-(3-тієн-2-ілпропіл)-1тично прийнятні композиції, що містять сполуку азоніабіцикло[2.2.2]октантрифторацетат (діастеформули (І), можуть застосовуватися в сполученні реомер 1) з іншими лікарськими засобами, ефективними при Зазначена в заголовку сполука була синтезолікуванні даних захворювань. Наприклад, з р2вана у відповідності зі способами e та b із проміжагоністами, стероїдами, протиалергічними лікарсьного продукту І-22а. Вихід кінцевої стадії складав кими засобами, інгібіторами фосфодіестерази IV 15мг, 52%. MC [M-CF3COO]+: 490. 1 та/або антагоністами лейкотрієну D4 (LTD4) для Н-ЯМР (ДМСО-d6): δ 1,55-1,75 (м, 2Н), 1,75одночасного, роздільного або послідовного засто2,05 (м, 4Н), 2,21 (м, 1Н), 2,75-2,85 (м, 2Н), 2,85сування при лікуванні респіраторного зайво2,95 (м, 1Н), 3,05-3,45 (м, 8Н), 3,75-3,87 (м, 2Н), рювання. 3,92-4,0 (м, 1Н), 5,08 (м, 1Н), 5,20-5,23 (т, 1Н, ОН), Даний винахід, таким чином, додатково відно6,82-6,90 (м, 2Н), 6,90-6,95 (м, 1Н), 6,95-7,02 (м, ситься до комбінованого продукту, що містить: 1Н), 7,05-7,20 (м, 5Н), 7,20-7,35 (м, 3Н), 7,37-7,42 (і) сполуку по даному винаходу; та (м, 1Н). (іі) іншу сполуку, ефективну в лікуванні респіПриклад 4 раторного, урологічного або шлунково-кишкового (3R)-3-[(2*)-2-гідроксиметил-2,3захворювання або порушення для одночасного, дифенілпропіонілокси]-1-фенетил-1роздільного або послідовного застосування. азоніабіцикло[2.2.2]октантрифторацетат (діастеСполука (іі), що є ефективною у лікуванні ресреомер 1) піраторного, урологічного або шлунково-кишкового Зазначена в заголовку сполука була синтезозахворювання або порушення, може являти собою вана у відповідності зі способами e та b із проміжр2-агоніст, стероїд, протиалергічні ліки, інгібітор ного продукту І-22а. Вихід кінцевої стадії складав фосфодіестерази IV та/або антагоніст лейкотрієну 18мг, 64%. MC [M-CF3COO]+: 470. 1 D4 (LTD4), коли продукт призначений для одночаН-ЯМР (ДМСО-d6): δ 1,62-1,75 (м, 2Н), 1,80сного, роздільного або послідовного застосування 2,05 (м, 2Н), 2,26 (м, 1Н), 2,90-3,12 (м, ЗН), 3,20при лікуванні респіраторного захворювання. Аль3,55 (м, 8Н), 3,80-4,02 (м, 3Н), 5,10-5,17 (м, 1Н), тернативно, сполука (іі) може представляти собою 5,20-5,25 (т, 1Н, ОН), 6,82-6,90 (м, 2Н), 7,10-7,20 (м, 5Н), 7,22-7,40 (м, 8Н). 2-агоніст, стероїд, протиалергічний лікарський Приклад 5 засіб та/або інгібітор фосфодіестерази IV, коли (3R)-3-[(2*)-2-гідроксиметил-2,3продукт призначений для одночасного, роздільнодифенілпропіонілокси]-1-(3-тієн-2-ілпропіл)-1го або послідовного застосування при лікуванні азоніабіцикло[2.2.2]октантрифторацетат (діастереспіраторного захворювання. реомер 2) Даний винахід далі буде проілюстровано наЗазначена в заголовку сполука була синтезоступними прикладами. Приклади приведені в ілюсвана у відповідності зі способами є та b із проміжтративних цілях та не повинні тлумачитися як обного продукту І-22b. Вихід кінцевої стадії складав межуючі. 10,1мг, 37,5%. MC [M-CF3COO]+: 490. Приклад 1 1 Н-ЯМР (ДМСО-d6): δ 1,45-1,60 (м, 1Н), 1,60(3R)-3-(2,3-Дифенілпропіонілокси)-1-(31,75 (м, 1Н), 1,80-2,05 (м, 4Н), 2,18 (м, 1Н), 2,75феноксипропіл)-12,90 (м, 2Н), 2,95-3,10 (м, 1Н), 3,10-3,55 (м, 8Н), азоніабіцикло[2.2.2]октантрифторацетат 3,75-3,92 (м, 2Н), 4,0-4,12 (м, 1Н), 5,05-5,15 (м, 1Н), Зазначена в заголовку сполука була синтезо5,25-5,35 (т, 1Η, ОН), 6,70-6,85 (м, 2Н), 6,90-7,20 вана у виді суміші діастереомерів відповідно до 43 75626 44 (м, 7Н), 7,20-7,35 (м, 3Н), 7,35-7,42 (м, 1Н). вана у відповідності зі способами d та b із проміжПриклад 6 ного продукту I-17b. Вихід кінцевої стадії складав (3R)-3-[(2*)-2-гідроксиметил-2,35,4мг, 19%. дифенілпропіонілокси]-1-фенетил-1МС [M-CF3COO]+: 472. 1 азоніабіцикло[2.2.2]октантрифторацетат (діастеН-ЯМР (ДMCO-d6): δ 1,40-1,55 (м, 1Н), 1,55реомер 2) 1,70 (м, 1Н), 1,80-2,0 (м, 2Н), 2,12 (м, 1Н), 3,20-3,60 Зазначена в заголовку сполука була синтезо(м, 7Н), 3,60-3,70 (м, 2Н), 3,90-4,0 (м, 1Н), 4,42 (м, вана у відповідності зі способами e та b із проміж2Н), 5,0-5,1 (м, 1Н), 6,15 (с, 1Н, ОН), 6,95-7,05 (м, ного продукту І-22b. Вихід кінцевої стадії складав 3Н), 7,10-7,22 (м, 5Н), 7,25-7,40 (м, 5Н), 7,57-7,65 22мг, 76%. МС [M-CF3COO]+: 470. (м, 2Н). 1 Н-ЯМР (ДМСО-d6): δ 1,50-1,60 (м, 1Н), 1,60Приклад 11 1,80 (м, 1Н), 1,85-2,05 (м, 2Н), 2,21 (м, 1Н), 2,90(3R)-3-(2-гідрокси-3-феніл-2-тієн-23,10 (м, 2Н), 3,12-3,55 (м, 9Н), 3,78-3,83 (м, 1Н), ілпропіонілокси)-1-(3-феноксипропіл)-13,88-3,95 (м, 1Н), 4,07-4,12 (м, 1Н), 5,15-5,20 (м, азоніабіцикло[2.2.2]октантрифторацетат 1Н), 5,35-5,40 (т, 1Η, ОН), 6,75-6,80 (м,2Н), 7,0-7,15 Зазначена в заголовку сполука була синтезо(м, 3Н), 7,20-7,40 (м, 8Н). вана у виді діастереомерів у відповідності зі споПриклад 7 собами d та b із проміжного продукту I-18. Вихід (3R)-3-[(2*)-2-гідрокси-2,3кінцевої стадії складав 15мг, 52%. МС [Mдифенілпропіонілокси]-1-(3-феноксипропіл)-1CF3COO]+: 492. 1 азоніабіцикло[2.2.2]октан бромід (діастереомер 1) Н-ЯМР (ДМСО-d6): δ 1,45-1,70 (м, 1Н), 1,75Зазначена в заголовку сполука була синтезо2,0 (м, 3Н), 2,0-2,30 (м, 3Н), 3,0-3,17 (м, 1Н), 3,17вана у відповідності зі способами d та а з проміж3,57 (м, 8Н), 3,80-3,90 (м, 1Н), 3,97-4,10 (м, 2Н), ного продукту I-17а. Вихід кінцевої стадії складав 5,02-5,05 (м, 1Н), 6,52-6,60 (д, 1Н, ОН), 6,90-7,04 380мг, 96%. (м, 4Н), 7,14-7,28 (м, 6Н), 7,28-7,38 (м, 2Н), 7,42МС [М-Вг]+: 486, т.пл.: 103°С. 7,50 (м, 1Н). 1 Н-ЯМР (ДMCO-d6): δ 1,65-1,75 (м, 2Н), 1,75Приклад 12 2,02 (м, 2Н), 2,02-2,15 (м, 2Н), 2,24 (м, 1Н), 3,05(3R)-3-(2-Гідрокси-3-феніл-2-тієн-23,25 (м, 2Н), 3,25-3,55 (м, 7Н), 3,78-3,90 (м, 1Н), ілпропіонілокси)-1-(3-тієн-2-ілпропіл)-13,98-4,08 (м, 2Н), 5,02-5,10 (м, 1Н), 6,20 (с, 1Н, азоніабіцикло[2.2.2]октантрифторацетат ОН), 6,92-7,0 (м, 3Н), 7,10-7,22 (м, 5Н), 7,25-7,40 Зазначена в заголовку сполука була синтезо(м, 5Н), 7,52-7,58 (м, 2Н). вана у виді діастереомерів у відповідності зі споПриклад 8 собами d та b із проміжного продукту I-18. Вихід (3R)-3-[(2*)-2-гідрокси-2,3кінцевої стадії складав 21мг, 74%. дифенілпропіонілокси]-1-(2-феноксиетил)-1МС [M-CF3COO]+: 482. 1 азоніабіцикло[2.2.2]октан бромід (діастереомер 1) Н-ЯМР (ДMCO-d6): δ 1,45-1,70 (м, 1Н), 1,75Зазначена в заголовку сполука була синтезо2,05 (м, 5Н), 2,05-2,3 (м, 1Н), 2,77-2,87 (м, 2Н), вана у відповідності зі способами d та а з проміж2,90-3,10 (м, 1Н), 3,10-3,52 (м, 8Н), 3,75-3,82 (м, ного продукту I-17а. Вихід кінцевої стадії складав 1Н), 5,0-5,07 (м, 1Н), 6,52-6,57 (д, 1Н, ОН), 6,92320мг, 83%. 7,05 (м, 3Н), 7,10-7,27 (м, 6Н), 7,37-7,47 (м, 2Н) . МС [М-Вг]+: 472, т.пл.: 223°С. Приклад 13 1 Н-ЯМР (ДМСО-d6): δ 1,70-1,80 (м, 2Н), 1,80(3R)-3-(2-Гідрокси-2-тієн-2-ілпент-4-еноїлокси)2,0 (м, 2Н), 2,20 (м, 1Н), 3,15-3,55 (м, 7Н), 3,55-3,70 1-(3-феноксипропіл)-1(м, 2Н), 3,85-4,0 (м, 1Н), 4,30-4,45 (м, 2Н), 5,0-5,10 азоніабіцикло[2.2.2]октанбромід (м, 1Н), 6,10 (с, 1Н, ОН), 6,90-7,05 (м, ЗН), 7,05Зазначена в заголовку сполука була отримана 7,20 (м, 5Н), 7,20-7,40 (м, 5Н), 7,45-7,55 (м, 2Н). у виді діастереомерів у відповідності зі способами Приклад 9 с та а з проміжного продукту І-3. Вихід кінцевої (3R)-3-[(2*)-2-гідрокси-2,3стадії складав 300мг, 71%. дифенілпропіонілокси]-1-(3-феноксипропіл)-1MS [M-Br]+: 442, т. пл.: 157°С, (описано в ексазоніабіцикло[2.2.2]октантрифторацетат (діастепериментальному розділі, спосіб а). 1 реомер 2) Н-ЯМР (ДMCO-d6): δ 1,70-2,05 (м, 4Н), 2,05Зазначена в заголовку сполука була синтезо2,35 (м, 3Н), 2,70-2,83 (м, 1Н), 2,90-3,02 (м, 1Н), вана у відповідності зі способами d та b із проміж3,25-3,60 (м, 7Н), 3,82-3,97 (м, 1Н), 3,97-4,10 (м, ного продукту I-17b. Вихід кінцевої стадії складав 2Н), 5,05-5,25 (м, 3Η), 5,70-5,90 (м, 1Η), 6,50 (д, 1Н, 7,2мг, 25%. ОН), 6,90-7,05 (м, 4Н), 7,10-7,20 (м, 1Н), 7,27-7,35 МС [M-CF3COO]+: 486. (м, 2Н), 7,45 (м, 1Н). 1 Н-ЯМР (ДMCO-d6): δ 1,40-1,55 (м, 1Н), 1,55Приклад 14 1,70 (м, 1Н), 1,75-2,0 (м, 2Н), 2,11 (м, ЗН), 3,10-3,60 (3R)-3-(2-Гідрокси-2-тієн-2-ілпент-4-еноїлокси)(м, 9Н), 3,77-3,87 (м, 1Н), 4,0-4,1 (м, 2Н), 5,0-5,1 (м, 1-(3-тієн-2-ілпропіл)-11Н), 6,14 (с, 1Н, ОН), 6,90-7,0 (м, 3Н), 7,15-7,25 (м, азоніабіцикло[2.2.2]октантрифторацетат 5Н), 7,25-7,42 (м, 5Н), 7,60-7,67 (м, 2Н). Зазначена в заголовку сполука була отримана Приклад 10 у виді діастереомерів у відповідності зі способами (3R)-3-[(2*)-2-гідрокси-2,3с та b із проміжного продукту І-3. Вихід кінцевої дифенілпропіонілокси]-1-(2-феноксиетил)-1стадії складав 10мг, 39,3%. азоніабіцикло[2.2.2]октантрифторацетат (діастеМС [M-CF3COO]+: 432. 1 реомер 2) Н-ЯМР (ДMCO-d6): δ 1,65-2,18 (м, 6Н), 2,18Зазначена в заголовку сполука була синтезо2,30 (м, 1Н), 2,70-3,05 (м, 4Н), 3,10-3,55 (м, 4Н), 45 75626 46 3,55-3,68 (м, 1Н), 3,78-3,92 (м, 2Н), 4,0-4,1 (м, 1Н), Зазначена в заголовку сполука була отримана 5,0-5,20 (м, 3Н), 5,70-5,85 (м, 1Н), 6,48-6,52 (д, 1Н, у виді діастереомерів у відповідності зі способами ОН), 6,90-7,02 (м, 3Н), 7,10-7,20 (м, 1Н), 7,35-7,42 d та b із проміжного продукту I-19. Вихід кінцевої (м, 1Н), 7,42-7,50 (м, 1Н). стадії складав 2,4мг, 4,3%. Приклад 15 МС [M-CF3COO]+: 430. 1 (3R)-3-(2-Гідрокси-2-тієн-2-ілпент-4-еноїлокси)Н-ЯМР (ДМСО-d6): δ 1,60-2,10 (м, 9Н), 2,201-(2-феноксиетил)-12,35 (м, 1Н), 2,75-2,90 (м, 2Н), 3,10-3,70 (м, 7Н), азоніабіцикло[2.2.2]октанбромід 3,75-3,95 (м, 1Н), 5,12 (м, 1Н), 6,91-7,04 (м, 3Н), Зазначена в заголовку сполука була отримана 7,19-7,42 (м, 3Н), 7,48-7,55 (м, 1Н). у виді діастереомерів у відповідності зі способами Приклад 20 с та а з проміжного продукту І-3. Вихід кінцевої (3R)-3-(2-гідрокси-2-тієн-2-ілбут-3-еноїлокси)стадії складав 270мг, 66%. 1-(3-феноксипропіл)-1МС[М-Вr]+:428, т.пл.: 82°С. азоніабіцикло[2.2.2]октантрифторацетат 1 Н-ЯМР (ДMCO-d6): δ 1,72-2,10 (м, 4Н), 2,20Зазначена в заголовку сполука була отримана 2,35 (м, 1Н), 2,70-2,85 (м, 1Н), 2,90-3,05 (м, 1Н), у виді діастереомерів у відповідності зі способами 3,25-3,85 (м, 7Н), 3,92-4,12 (м, 1Н), 4,35-4,45 (м, d та b із проміжного продукту І-20. Вихід кінцевої 2Н), 4,95-5,20 (м, 3Н), 5,70-5,90 (м, 1Н), 6,50 (с, 1Н, стадії складав 9,6мг, 16%. ОН), 6,90-7,05 (м, 4Н), 7,10-7,18 (м, 1Н), 7,25-7,45 МС [M-CF3COO]+: 428. 1 (м, 3Н). Н-ЯМР (ДМСО-d3): δ 1,60-2,05 (м, 4Н), 2,05Приклад 16 2,20 (м, 2Н), 2,20-2,38 (м, 1Н), 3,15-3,60 (м, 7Н), (3R)-3-(2-Гідрокси-2-тієн-2-ілгептаноїлокси)-13,82-3,95 (м, 1Н), 3,98-4,10 (м, 2Н), 5,10-5,20 (м, (3-феноксипропіл)-11Н), 5,25-5,35 (м, 1Н), 5,45-5,55 (м, 1Н), 6,45-6,55 азоніабіцикло[2.2.2]октантрифторацетат (м, 1Н), 6,75-6,82 (д, 1Н, ОН), 6,92-6,96 (м, 3Н), Зазначена в заголовку сполука була отримана 6,98-7,03 (м, 1Н), 7,13-7,15 (м, 1Н), 7,28-7,34 (м, у виді діастереомерів у відповідності зі способами 1Н), 7,48-7,52 (м, 1Н). с та b із проміжного продукту I-1. Вихід кінцевої Приклад 21 стадії складав 16,2мг, 57%. (3R)-3-(2-Гідрокси-2-тієн-2-ілбут-3-еноїлокси)МС [M-CF3COO]+: 472. 1-(3-тієн-2-ілпропіл)-11 Н-ЯМР (ДМСО-d6): δ 0,80-0,90 (м, 3Н), 1,15азоніабіцикло[2.2.2]октантрифторацетат 1,40 (м, 6Н), 1,65-2,30 (м, 9Н), 3,20-3,60 (м, 5Н), Зазначена в заголовку сполука була отримана 3,85-3,95 (м, 1Н), 3,95-4,10 (м, 2Н), 5,05-5,17 (м, у виді діастереомерів у відповідності зі способами 1Н), 6,30-6,35 (д, 1Н, ОН), 6,90-7,05 (м, 4Н), 7,10d та b із проміжного продукту І-20. Вихід кінцевої + 7,17 (м, 1Н), 7,25-7,35 (м, 2Н), 7,42-7,48 (м, 1Н). стадії складав 5,8мг, 10%. MC[M-CF3COO] :418. 1 Приклад 17 Н-ЯМР (ДMCO-d6): δ 1,60-2,20 (м, 6Н), 2,20(3R)-3-(2-Гідрокси-2-тієн-2-ілгептаноїлокси)-12,35 (м, 1Н), 2,79-2,84 (м, 2Н), 3,10-3,55 (м, 7Н), (3-тієн-2-ілпропіл)-13,80-3,90 (м, 1Н), 5,10-5,20 (м, 1Н), 5,25-5,35 (м, азоніабіцикло[2.2.2]октантрифторацетат 1Н), 5,45-5,55 (м, 1Н), 6,45-6,55 (м, 1Н), 6,75-6,78 Зазначена в заголовку сполука була отримана (д, 1Н, ОН), 6,92-6,95 (м, 1Н), 6,95-7,05 (м, 2Н), у виді діастереомерів у відповідності зі способами 7,10-7,15 (м, 1Н), 7,35-7,42 (м, 1Н), 7,45-7,52 (м, с та b із проміжного продукту I-1. Вихід кінцевої 1Н). стадії складав 6,8мг, 12%. Приклад 22 МС [M-CF3COO]+: 462. (3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-21 Н-ЯМР (ДМСО-d6): δ 0,80-0,90 (м, 3Н), 1,15ілацетокси]-1-(3-феноксипропіл)-11,40 (м, 6Н), 1,65-2,30 (м, 9Н), 2,80-2,85 (м, 2Н), азоніабіцикло[2.2.2]октан бромід 3,10-3,55 (м, 7Н), 3,75-3,90 (м, 1Н), 5,10 (м, 1Н), Зазначена в заголовку сполука була синтезо6,30-6,32 (д, 1Н, ОН), 6,90-6,95 (м, 1Н), 6,95-7,02 вана у відповідності зі способами d та а з проміж(м, 2Н), 7,09-7,13 (м, 1Н), 7,37-7,39 (м, 1Н), 7,40ного продукту I-15а. Вихід кінцевої стадії складав 7,45 (м, 1Н). 230мг, 85%. Приклад 18 MC [M-Br]+: 470, т.пл.: 171°С. 1 (R)-3-(2-Гідрокси-2-тієн-2-ілпент-3-иноїлокси)Н-ЯМР (ДMCO-d6): δ 1,27-1,67 (м, 8Н), 1,81-(3-феноксипропіл)-12,05 (м, 4Н), 2,05-2,20 (м, 2Н), 2,25-2,35 (м, 1Н), азоніабіцикло[2.2.2]октантрифторацетат 2,70-2,92 (м, 1Н), 3,20-3,25 (м, 1Н), 3,25-3,60 (м, Зазначена в заголовку сполука була отримана 6Н), 3,80-3,95 (м, 1Н), 3,95-4,08 (м, 2Н), 5,10-5,20 у виді діастереомерів у відповідності зі способами (м, 1Н), 6,18 (с, 1Н, ОН), 6,87-7,05 (м, 4Н), 7,08d та b із проміжного продукту I-19. Вихід кінцевої 7,20 (м, 1Н), 7,25-7,37 (м, 2Н), 7,40-7,47 (м, 1Н). стадії складав 6,4мг, 12%. Приклад 23 МС [M-CF3COO]+: 440. (3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-21 Н-ЯМР (ДMCO-d6): δ 1,60-2,05 (м, 7Н), 2,05ілацетокси]-1-(3-тієн-2-ілпропіл)-12,20 (м, 2Н), 2,20-2,35 (м, 1Н), 3,10-3,60 (м, 7Н), азоніабіцикло[2.2.2]октантрифторацетат 3,82-3,97 (м, 1Н), 3,97-4,10 (м, 2Н), 5,13 (м, 1Н), Зазначена в заголовку сполука була синтезо6,90-7,06 (м, 4Н), 7,20-7,38 (м, 4Н), 7,50-7,56 (м, вана у відповідності зі способами d та b із проміж1Н). ного продукту I-15а. Вихід кінцевої стадії складав Приклад 19 21мг, 75%. (3R)-3-(2-Гідрокси-2-тієн-2-ілпент-3-иноїлокси)MC [M-CF3COO]+: 460. 1 1-(3-тієн-2-ілпропіл)-1Н-ЯМР (ДMCO-d6): δ 1,30-1,65 (м, 8Н), 1,80азоніабіцикло[2.2.2]октантрифторацетат 2,10 (м, 6Н), 2,28 (м, 1Н), 2,75-2,85 (м, 3Н), 3,10 47 75626 48 3,55 (м, 7Н), 3,80-3,90 (м, 1Н), 5,05-5,15 (м, 1Н), дії складав 15мг, 52%. MC [M-CF3COO]+: 488. 1 6,20 (с, 1Н, ОН), 6,90-6,95 (м, 1Н), 6,95-7,05 (м, Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,802Н), 7,10-7,20 (м, 1Н), 7,35-7,45 (м, 2Н). 2,05 (м, 4Н), 2,05-2,17 (м, 2Н), 2,30 (м, 1Н), 2,75Приклад 24 2,90 (м, 1Н), 3,17-3,27 (м, 1Н), 3,27-3,60 (м, 6Н), (3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-23,82-3,95 (м, 1Н), 3,97-4,05 (м, 2Н), 5,14 (м, 1Н), ілацетокси]-1-(2-феноксіетил)-16,22 (с, 1Н, ОН), 6,92-7,05 (м, 3Н), 7,10-7,20 (м, азоніабіцикло[2.2.2]октанбромід ЗН), 7,40-7,55 (м, 1Н). Зазначена в заголовку сполука була синтезоПриклад 29 вана у відповідності зі способами с та а з проміж(3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-2ного продукту I-15а. Вихід кінцевої стадії складав ілацетокси]-1-(4-оксо-4-тієн-2-ілбутил)-1338мг, 92%. азоніабіцикло[2.2.2]октантрифторацетат МС [М-Вr]+: 456; т.пл. 75°С. Зазначена в заголовку сполука була синтезо1 Н-ЯМР (ДMCO-d6): δ 1,25-1,65 (м, 8Н), 1,75вана, як описано в прикладі 23. Вихід кінцевої ста2,10 (м, 4Н), 2,27-2,35 (м, 1Н), 2,70-2,90 (м, 1Н), дії складав 4мг, 14%. 3,30-3,68 (м, 5Н), 3,68-3,83 (м, 2Н), 3,92-4,10 (м, МС [M-CF3COO]+: 488. 1 1Н), 4,32-4,50 (м, 2Н), 5,10-5,20 (м, 1Н), 6,20 (с, 1Н, Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,70ОН), 6,90-7,05 (м, 4Н), 7,10-7,20 (м, 1Н), 7,30-7,42 2,05 (м, 6Н), 2,30 (м, 1Н), 2,75-2,90 (м, 1Н), 3,05(м, 3Н). 3,12 (м, 2Н), 3,15-3,60 (м, 7Н), 3,80-3,92 (м, 1Н), Приклад 25 5,13 (м, 1Н), 6,22 (с, 1Н, ОН), 6,98-7,02 (м, 1Н), (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-27,12-7,18 (м, 1Н), 7,25-7,30 (м, 1Н), 7,40-7,55 (м, ілацетокси]-1-фенетил-11Н), 7,95-8,0 (м, 1Н), 8,02-8,07 (м, 1Н). азоніабіцикло[2.2.2]октантрифторацетат Приклад 30 Зазначена в заголовку сполука була синтезо(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2вана, як описано в прикладі 23. Вихід кінцевої стаілацетокси]-1-[4-(4-фторфеніл)-4-оксобутил]-1дії складав 17мг, 64%. азоніабіцикло[2.2.2]октантрифторацетат MC [M-CF3COO]+: 440. Зазначена в заголовку сполука була синтезо1 Н-ЯМР (ДМСО-d6): δ 1,30-1,65 (м, 8Н), 1,80вана, як описано в прикладі 23. Вихід кінцевої ста2,10 (м, 4Н), 2,32 (м, 1Н), 2,75-2,85 (м, 1Н), 2,95дії складав 9мг, 29%. 3,05 (м, 2Н), 3,20-3,50 (м, 6Н), 3,50-3,65 (м, 1Н), МС [M-CF3COO]+: 500. 1 3,85-3,95 (м, 1Н), 5,10-5,20 (м, 1Н), 6,22 (с, 1Н, Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,75ОН), 6,95-7,05 (м, 1Н), 7,10-7,20 (м, 1Н), 7,20-7,40 2,05 (м, 6Н), 2,30 (м, 1Н), 2,75-2,90 (м, 1Н), 3,05(м, 5Н), 7,40-7,55 (м, 1Н). 3,60 (м, 9Н), 3,80-3,95 (м, 1Н), 5,14 (м, 1Н), 6,22 (с, Приклад 26 1Н, ОН), 6,98-7,02 (м, 1Н), 7,12-7,20 (м, 1Н), 7,35(3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-27,45 (м, 3Н), 8,02-8,12 (м, 2Н). ілацетокси]-1-(3-фенілпропіл)-1Приклад 31 азоніабіцикло[2.2.2]октантрифторацетат (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2Зазначена в заголовку сполука була синтезоілацетокси]-1-[3-(3-гідроксифенокси)пропіл]-1вана, як описано в прикладі 23. Вихід кінцевої стаазоніабіцикло[2.2.2]октантрифторацетат дії складав 20мг, 74%. MC [M-CF3COO]+: 454. Зазначена в заголовку сполука була синтезо1 Н-ЯМР (ДМСО-d6): δ 1,30-1,65 (м, 8Н), 1,75вана, як описано в прикладі 23. Вихід кінцевої ста2,05 (м, 6Н), 2,28 (м, 1Н), 2,55-2,65 (м, 2Н), 2,75дії складав 14мг, 48%. 2,85 (м, 1Н), 3,10-3,40 (м, 6Н), 3,40-3,55 (м, 1Н), МС [M-CF3COO]+: 486. 1 3,77-3,87 (м, 1Н), 5,05-5,15 (м, 1Н), 6,20 (с, 1Н, Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,80ОН), 6,95-7,0 (м, 1Н), 7,10-7,15 (м, 1Н), 7,20-7,35 2,0 (м, 4Н), 2,0-2,20 (м, 2Н), 2,30 (м, 1Н), 2,75-2,90 (м, 5Н), 7,38-7,42 (м, 1Н). (м, 1Н), 3,17-3,25 (м, 1Н), 3,25-3,60 (м, 6Н), 3,82Приклад 27 3,92 (м, 1Η), 3,94-4,02 (м, 2Η), 5,14 (м, 1Н), 6,21 (с, (3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-21Н, ОН), 6,30-6,42 (м, 3Н), 6,95-7,10 (м, 2Н), 7,12ілацетокси]-1-(3-фенілаліл)-17,20 (м, 1Н), 7,20-7,45 (м, 1Н), 9,47 (с, 1Н, ОН). азоніабіцикло[2.2.2]октантрифторацетат Приклад 32 Зазначена в заголовку сполука була синтезо1-(2-Бензилоксіетил)-(3R)-3-[(2S)-2вана, як описано в прикладі 23. Вихід кінцевої стациклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1дії складав 3мг, 12%. азоніабіцикло[2.2.2]октантрифторацетат MC [M-CF3COO]+: 452. Зазначена в заголовку сполука була синтезо1 Н-ЯМР (ДМСО-d6): δ 1,25-1,60 (м, 8Н), 1,80вана, як описано в прикладі 23. Вихід кінцевої ста2,10 (м, 4Н), 2,31 (м, 1Н), 2,72-2,85 (м, 1Н), 3,12дії складав 10мг, 35%. 3,22 (м, 1Н), 3,22-3,45 (м, 3Н), 3,45-3,60 (м, 1Н), МС [M-CF3COO]+: 470. 1 3,82-3,92 (м, 1Н), 3,95-4,10 (м,2Н), 5,10-5,20 (м, Н-ЯМР (ДМСО-d6): δ 1,25-1,62 (м, 8Н), 1,801Н), 6,20 (с, 1Н, ОН), 6,35-6,50 (м, 1Н), 6,82-6,95 2,07 (м, 4Н), 2,30 (м, 1Н), 2,75-2,85 (м, 1Н), 3,0-3,65 (м, 2Н), 7,10-7,15 (м, 1Н), 7,25-7,47 (м, 4Н), 7,55(м, 7Н), 3,75-4,0 (м, 3Н), 4,50 (с, 2Н), 5,10-5,17 (м, 7,62 (м, 2Н). 1Н), 6,21 (с, 1Н, ОН), 6,95-7,0 (м, 1Н), 7,10-7,17 (м, Приклад 28 1Н), 7,27-7,45 (м, 6Н). (3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-2Приклад 33 ілацетокси]-1-[3-(4-фторфенокси)пропіл]-1(3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-2азоніабіцикло[2.2.2]октантрифторацетат ілацетокси]-1-(3-о-толілоксипропіл)-1Зазначена в заголовку сполука була синтезоазоніабіцикло[2.2.2]октантрифторацетат вана, як описано в прикладі 23. Вихід кінцевої стаЗазначена в заголовку сполука була синтезо 49 75626 50 вана, як описано в прикладі 23. Вихід кінцевої стаПриклад 38 дії складав 13мг, 45%. (3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-2МС [M-CF3COO]+: 484. ілацетокси]-1-(4-оксо-4-фенілбутил)-11 Н-ЯМР (ДMCO-d6): δ 1,23-1,65 (м, 8Н), 1,80азоніабіцикло[2.2.2]октантрифторацетат 2,05 (м, 4Н), 2,05-2,20 (м, 5Н), 2,31 (м, 1Н), 2,75Зазначена в заголовку сполука була синтезо2,90 (м, 1Н), 3,15-3,25 (м, 1Н), 3,27-3,60 (м, 6Н), вана, як описано в прикладі 23. Вихід кінцевої ста3,85-3,95 (м, 1Н), 3,97-4,05 (м, 2Н), 5,15 (м, 1Н), дії складав 9мг, 26%. 6,22 (с, 1Н, ОН), 6,83-6,93 (м, 2Н), 6,98-7,02 (м, МС [M-CF3COO]+: 482. 1 1Н), 7,12-7,20 (м, ЗН), 7,40-7,46 (м, 1Н). Н-ЯМР (ДМСО-d6): δ 1,30-1,67 (м, 8Н), 1,72Приклад 34 2,10 (м, 6Н), 2,30 (м, 1Н), 2,75-2,90 (м, 1Н), 3,101-[3-(3-ціанофенокси)пропіл]-(3R)-3-[(2S)-23,60 (м, 9Н), 3,85-3,95 (м, 1Н), 5,10-5,20 (м, 1Н), циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-16,23 (с, 1Н, ОН), 6,95-7,05 (м, 1Н), 7,12-7,20 (м, азоніабіцикло[2.2.2]октантрифторацетат 1Н), 7,40-7,47 (м, 1Н), 7,52-7,60 (м, 2Н), 7,62-7,72 Зазначена в заголовку сполука була синтезо(м, 1Н), 7,95-8,05 (м, 1Н). вана, як описано в прикладі 23. Вихід кінцевої стаПриклад 39 дії складав 11мг, 32%. (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2МС [M-CF3COO]+: 495. ілацетокси]-1-[3-(2,4,6-триметилфенокси)пропіл]-11 Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,75азоніабіцикло[2.2.2]октантрифторацетат 2,05 (м, 4Н), 2,05-2,20 (м, 2Н), 2,30 (м, 1Н), 2,75Зазначена в заголовку сполука була синтезо2,90 (м, 1Н), 3,20-3,25 (м, 1Н), 3,25-3,60 (м, 6Н), вана, як описано в прикладі 23. Вихід кінцевої ста3,82-3,95 (м, 1Н), 4,05-4,15 (м, 2Н), 5,07-5,20 (м, дії складав 13мг, 35%. 1Н), 6,20 (с, 1Н, ОН), 6,95-7,05 (м, 1Н), 7,12-7,20 MC[M-CF3COO]+: 512. 1 (м, 1Н), 7,25-7,35 (м, 1Н), 7,40-7,57 (м, 4Н). Н-ЯМР (ДМСО-d6): δ 1,30-1,65 (м, 8Н), 1,80Приклад 35 2,02 (м, 4Н), 2,02-2,25 (м, 11Н), 2,32 (м, 1Н), 2,75(3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-22,90 (м, 1Н), 3,23-3,28 (м, 1Н), 3,28-3,62 (м, 6Н), ілацетокси]-1-[3-(нафтален-1-ілокси)пропіл]-13,65-3,80 (м, 2Н), 3,85-3,97 (м, 1Н), 5,10-5,20 (м, азоніабіцикло[2.2.2]октантрифторацетат 1Н), 6,22 (с, 1Н, ОН), 6,82 (с, 2Н), 6,97-7,05 (м, 1Н), Зазначена в заголовку сполука була синтезо7,12-7,20 (м, 1Н), 7,40-7,47 (м, 1Н). вана, як описано в прикладі 23. Вихід кінцевої стаПриклад 40 дії складав 10мг, 26%. 1-[3-(2-Хлорфенокси)пропіл]-(3R)-3-[(2S)-2МС [M-CF3COO]+: 520, (описано в експерименциклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1тальному розділі, спосіб b). азоніабіцикло[2.2.2]октантрифторацетат 1 Н-ЯМР (ДМСО-d6): δ 1,30-1,65 (м, 8Н), 1,80Зазначена в заголовку сполука була синтезо2,10 (м, 4Н), 2,20-2,37 (м, 3Н), 2,75-2,92 (м, 1Н), вана, як описано в прикладі 23. Вихід кінцевої ста3,20-3,65 (м, 7Н), 3,90-4,05 (м, 1Н), 4,15-4,30 (м, дії складав 13мг, 36%. 2Н), 5,15-5,22 (м, 1Н), 6,24 (с, 1Н, ОН), 6,95-7,05 МС [M-CF3COO]+: 505. 1 (м, 2Н), 7,15-7,20 (м, 1Н), 7,40-7,60 (м, 5Н), 7,85Н-ЯМР (ДМСО-d6): δ 1,30-1,65 (м, 8Н), 1,757,95 (м, 1Н), 8,20-8,25 (м, 1Н). 2,05 (м, 4Н), 2,05-2,25 (м, 2Н), 2,31 (м, 1Н), 2,75Приклад 36 2,90 (м, 1Н), 3,19-3,23 (м, 1Н), 3,23-3,62 (м, 6Н), (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-23,85-4,0 (м, 1Н), 4,07-4,15 (м, 2Н), 5,10-5,20 (м, 1Н), ілацетокси]-1-[3-(метилфеніламино)пропіл]-16,22 (с, 1Н, ОН), 6,92-7,05 (м, 2Н), 7,12-7,22 (м, азоніабіцикло[2.2.2]октантрифторацетат 2Н), 7,27-7,37 (м, 1Н), 7,40-7,50 (м, 2Н). Зазначена в заголовку сполука була синтезоПриклад 41 вана, як описано в прикладі 23. Вихід кінцевої ста(3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-2дії складав 12мг, 35%. ілацетокси]-1-[3-(3-трифторметилфенокси)пропіл]МС [M-CF3COO]+: 483. 1-азоніабіцикло[2.2.2]октантрифторацетат 1 Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,75Зазначена в заголовку сполука була синтезо2,02 (м, 6Н), 2,28 (м, 1Н), 2,75-2,85 (м, 1Н), 2,87 (с, вана, як описано в прикладі 23. Вихід кінцевої ста3Н), 3,09-3,14 (м, 1Н), 3,15-3,55 (м, 8Н), 3,75-3,87 дії складав 13мг, 33%. МС [M-CF3COO]+: 538. 1 (м, 1Н), 5,05-5,15 (м, 1Н), 6,20 (с, 1Н, ОН), 6,60Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,756,70 (м, 1Н), 6,70-6,77 (м, 2Н), 6,92-7,0 (м, 1Н), 2,05 (м, 4Н), 2,05-2,25 (м, 2Н), 2,31 (м, 1Н), 2,757,10-7,25 (м, ЗН), 7,35-7,45 (м, 1Н). 2,90 (м, 1Н), 3,20-3,25 (м, 1Н), 3,25-3,62 (м, 6Н), Приклад 37 3,82-3,97 (м, 1Н), 4,05-4,20 (м, 2Н), 5,10-5,20 (м, (3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-21Н), 6,22 (с, 1Н, ОН), 6,95-7,05 (м, 1Н), 7,12-7,20 ілацетокси]-1-(3-фенілсульфанілпропіл)-1(м, 1Н), 7,22-7,30 (м, 2Н), 7,30-7,37 (м, 1Н), 7,40азоніабіцикло[2.2.2]октантрифторацетат 7,47 (м, 1Н), 7,50-7,62 (м, 1Н). Зазначена в заголовку сполука була синтезоПриклад 42 вана, як описано в прикладі 23. Вихід кінцевої ста1-[3-(Біфеніл-4-ілокси)пропіл]-(3R)-3-[(2S)-2дії складав 7мг, 22%. циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1+ МС [M-CF3COO] : 486. азоніабіцикло[2.2.2]октантрифторацетат 1 Н-ЯМР (ДMCO-d6): δ 1,25-1,65 (м, 8Н), 1,75Зазначена в заголовку сполука була синтезо2,02 (м, 6Н), 2,27 (м, 1Н), 2,75-2,90 (м, 1Н), 2,95вана, як описано в прикладі 23. Вихід кінцевої ста3,05 (м, 2Н), 3,07-3,15 (м, 1Н), 3,15-3,52 (м, 6Н), дії складав 11мг, 30%. 3,75-3,87 (м, 1Н), 5,05-5,15 (м, 1Н), 6,20 (с, 1Н, МС [M-CF3COO]+: 546. 1 ОН), 6,95-7,0 (м, 1Н), 7,12-7,17 (м, 1Н), 7,20-7,30 Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,77(м, 1Н), 7,30-7,45 (м, 5Н). 2,05 (м, 4Н), 2,05-2,25 (м, 2Н), 2,31 (м, 1Н), 2,75 51 75626 52 2,92 (м, 1Н), 3,20-3,23 (м, 1Н), 3,23-3,62 (м, 6Н), Приклад 47 3,85-3,97 (м, 1Н), 4,05-4,15 (м, 2Н), 5,10-5,20 (м, 1-[3-(2-Карбамоїлфенокси)пропіл]-(3R)-3-[(2S)1Н), 6,22 (с, 1Н, ОН), 6,95-7,10 (м, 3Н), 7,12-7,20 2-циклопентил-2-гідрокси-2-тієн-2-ілацетокси]-1(м, 1Н), 7,27-7,37 (м, 1Н), 7,40-7,50 (м, 3Н), 7,55азоніабіцикло[2.2.2]октантрифторацетат 7,70 (м, 4Н). Зазначена в заголовку сполука була синтезоПриклад 43 вана, як описано в прикладі 23. Вихід кінцевої ста(3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-2дії складав 13мг, 36%. ілацетокси]-1-[3-(2,4-дифторфенокси)пропіл]-1MC[M-CF3COO]+:513. 1 азоніабіцикло[2.2.2]октантрифторацетат Н-ЯМР (ДMCO-d6): δ 1,27-1,65 (м, 8Н), 1,80Зазначена в заголовку сполука була синтезо2,07 (м, 4Н), 2,12-2,27 (м, 2Н), 2,31 (м, 1Н), 2,82 (м, вана, як описано в прикладі 23. Вихід кінцевої ста1Н), 3,17-3,25 (м, 1Н), 3,25-3,45 (м, 5Н), 3,45-3,60 дії складав 10мг, 28%. (м, 1Н), 3,82-3,92 (м, 1Н), 4,10-4,17 (м, 2Н), 5,15 (м, МС [M-CF3COO]+: 506. 1Н), 6,23 (с, 1Н, ОН), 6,98-7,16 (м, 4Н), 7,42-7,50 1 Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,75(м, 2Н), 7,50-7,55 (уш.с, 2Н), 7,68-7,72 (м, 1Н). 2,05 (м, 4Н), 2,05-2,15 (м, 2Н), 2,30 (м, 1Н), 2,82 (м, Приклад 48 1Н), 3,17-3,28 (м, 1Н), 3,28-3,47 (м, 5Н), 3,47-3,60 (3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-2(м, 1Н), 3,82-3,95 (м, 1Н), 4,05-4,15 (м, 2Н), 5,14 (м, ілацетокси]-1-[3-(3-диметиламінофенокси)пропіл]1Н), 6,22 (с, 1Н, ОН), 6,95-7,10 (м, 2Н), 7,12-7,38 1-азоніабіцикло[2.2.2]октантрифторацетат (м, ЗН), 7,40-7,45 (м, 1Н). Зазначена в заголовку сполука була синтезоПриклад 44 вана, як описано в прикладі 23. Вихід кінцевої ста(3R)-3-[(2S)-2-Циклопентил-2-гідрокси-2-тієн-2дії складав 14мг, 40%. ілацетокси]-1-[3-(4-метоксифенокси)пропіл]-1MC[M-CF3COO]+: 513. 1 азоніабіцикло[2.2.2]октантрифторацетат Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,70Зазначена в заголовку сполука була синтезо2,20 (м, 6Н), 2,30 (м, 1Н), 2,75-2,95 (м, 7Н), 3,15вана, як описано в прикладі 23. Вихід кінцевої ста3,65 (м, 7Н), 3,80-4,05 (м, 3Н), 5,14 (м, 1Н), 6,15дії складав 11мг, 32%. 6,30 (м, 3Н), 6,32-6,36 (м, 1Н), 6,95-7,22 (м, ЗН), МС [M-CF3COO]+: 500. 7,40-7,45 (м, 1Н). 1 Н-ЯМР (ДМСО-сІ6): δ 1,25-1,65 (м, 8Н), 1,75Приклад 49 2,15 (м, 6Н), 2,30 (м, 1Н), 2,82 (м, 1Н), 3,18-3,25 (м, 1-[3-(4-Ацетиламінофенокси)пропіл]-(3R)-31Н), 3,25-3,45 (м, 5Н), 3,45-3,60 (м, 1Н), 3,70 (с, [(2S)-2-циклопентил-2-гідрокси-2-тієн-23Н), 3,82-3,92 (м, 1Н), 3,92-4,02 (м, 2Н), 5,14 (м, ілацетокси]-11Н), 6,22 (с, 1Н, ОН), 6,88 (м, 4Н), 6,98-7,02 (м, азоніабіцикло[2.2.2]октантрифторацетат 1Н), 7,15-7,16 (м, 1Н), 7,42-7,44 (м, 1Н). Зазначена в заголовку сполука була синтезоПриклад 45 вана, як описано в прикладі 23. Вихід кінцевої ста(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2дії складав 12мг, 34%. ілацетокси]-1-[3-(5,6,7,8-тетрагідронафтален-2МС [M-CF3COO]+: 527. 1 ілокси)пропіл]-1Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,75азоніабіцикло[2.2.2]октантрифторацетат 2,20 (м, 9Н), 2,30 (м, 1Н), 2,82 (м, 1Н), 3,17-3,28 (м, Зазначена в заголовку сполука була синтезо1Н), 3,28-3,45 (м, 5Н), 3,45-3,60 (м, 1Н), 3,84-3,92 вана, як описано в прикладі 23. Вихід кінцевої ста(м, 1Н), 3,96-4,02 (м, 2Н), 5,13 (м, 1Н), 6,22 (с, 1Н, дії складав 14мг, 38%. ОН), 6,86-6,90 (м, 2Н), 6,98-7,02 (м, 1Н), 7,15-7,17 МС [M-CF3COO]+: 524. (м, 1Н), 7,42-7,44 (м, 1Н), 7,48-7,52 (м, 2Н), 9,85 (с, 1 Н-ЯМР (ДМСО-d6): δ 1,30-1,65 (м, 8Н), 1,651Н, NH(CO)). 1,75 (м, 4Н), 1,75-2,20 (м, 6Н), 2,30 (м, 1Н), 2,50Приклад 50 2,70 (м, 4Н), 2,75-2,95 (м, 1Н), 3,17-3,25 (м, 1Н), (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-23,25-3,45 (м, 5Н), 3,45-3,60 (м, 1Н), 3,80-3,92 (м, ілацетокси]-1-[3-(41Н), 3,92-4,02 (м, 2Н), 5,14 (м, 1Н), 6,22 (с, 1Н, метоксикарбонілфенокси)пропіл]-1ОН), 6,60-6,70 (м, 2Н), 6,95-7,02 (м, 2Н), 7,15-7,20 азоніабіцикло[2.2.2]октантрифторацетат (м, 1Н), 7,42-7,45 (м, 1Н). Зазначену в заголовку сполуку було синтезоПриклад 46 вано, як описано в Прикладі 23. Вихід кінцевої 1-[3-(Бензо[1,3]діоксол-5-ілокси)пропіл]-(3R)-3стадії складав 14мг, 37%. МС [M-CF3COO]+: 528. 1 [(2S)-2-циклопентил-2-гідрокси-2-тієн-2Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,80ілацетокси]-12,05 (м, 4Н), 2,05-2,25 (м, 2Н), 2,31 (м, 1Н), 2,82 (м, азоніабіцикло[2.2.2]октантрифторацетат 1Н), 3,17-3,28 (м, 1Н), 3,28-3,45 (м, 5Н), 3,45-3,60 Зазначена в заголовку сполука була синтезо(м, 1Н), 3,82 (с, 3Н), 3,82-3,95 (м, 1Н), 4,10-4,15 (м, вана, як описано в прикладі 23. Вихід кінцевої ста2Н), 5,14 (м, 1Н), 6,22 (с, 1Н, ОН), 6,95-7,10 (м, дії складав 13мг, 38%. 3Н), 7,15-7,17 (м, 1Н), 7,43-7,45 (м, 1Н), 7,92-7,97 MC[M-CF3COO]+: 514. (м, 2Н). 1 Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,75Приклад 51 2,15 (м, 6Н), 2,30 (м, 1Н), 2,75-2,90 (м, 1Н), 3,15(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-23,25 (м, 1Н), 3,25-3,42 (м, 5Н), 3,42-3,60 (м, 1Н), ілацетокси]-1-[3-(4-нітрофенокси)пропіл]-13,82-3,92 (м, 1Н), 3,92-4,0 (м, 2Н), 5,13 (м, 1Н), 5,97 азоніабіцикло[2.2.2]октантрифторацетат (с, 2Н), 6,20 (с, 1Н, ОН), 6,36-6,40 (м, 1Н), 6,64-6,65 Зазначену в заголовку сполуку було синтезо(м, 1Н), 6,81-6,84 (м, 1Н), 6,98-7,02 (м, 1Н), 7,15вано, як описано в Прикладі 23. Вихід кінцевої 7,17 (м, 1Н), 7,42-7,44 (м, 1Н). стадії складав 15мг, 41%. MC[M-CF3COO]+: 515. 53 75626 54 Н-ЯМР (ДMCO-d6): δ 1,27-1,65 (м, 8Н), 1,77Приклад 56 2,07 (м, 4Н), 2,10-2,27 (м, 2Н), 2,31 (м, 1Н), 2,82 (м, (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-21Н), 3,17-3,28 (м, 1Н), 3,28-3,45 (м, 5Н), 3,45-3,60 ілацетокси]-1-фенетил-1(м, 1Н), 3,85-3,95 (м, 1Н), 4,15-4,25 (м, 2Н), 5,15 (м, азоніабіцикло[2.2.2]октантрифторацетат 1Н), 6,22 (с, 1Н, ОН), 6,97-7,02 (м, 1Н), 7,14-7,18 Зазначену в заголовку сполуку було синтезо(м, ЗН), 7,42-7,45 (м, 1Н), 8,22-8,27 (м, 2Н). вано, як описано в Прикладі 54. Вихід кінцевої Приклад 52 стадії складав 13мг, 50%. (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2МС [M-CF3COO]+: 440. 1 ілацетокси]-1-[3-(4-гідроксиметилфенокси)пропіл]Н-ЯМР (ДMCO-d6): δ 1,35-1,65 (м, 8Н), 1,651-азоніабіцикло[2.2.2]октантрифторацетат 1,85 (м, 2Н), 1,85-2,05 (м, 2Н), 2,25 (м, 1Н), 2,85Зазначену в заголовку сполуку було синтезо2,92 (м, 1Н), 2,95-3,10 (м, 2Н), 3,30-3,50 (м, 6Н), вано, як описано в Прикладі 23. Вихід кінцевої 3,50-3,65 (м, 1Н), 3,85-4,0 (м, 1Н), 5,12-5,20 (м, 1Н), стадії складав 13мг, 36%. МС [M-CF3COO]+: 500. 6,21 (с, 1Н, ОН), 6,95-7,05 (м, 1Н), 7,15-7,20 (м, 1 Н-ЯМР (ДМСО-d6): δ 1,25-1,65 (м, 8Н), 1,771Н), 7,25-7,40 (м, 5Н), 7,40-7,47 (м, 1Н). 2,05 (м, 4Н), 2,05-2,20 (м, 2Н), 2,30 (м, 1Н), 2,82 (м, Приклад 57 1Н), 3,17-3,60 (м, 7Н), 3,82-3,95 (м, 1Н), 3,95-4,05 (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2(м, 2Н), 4,35-4,45 (м, 2Н), 5,05-5,11 (т, 1Н, ОН), ілацетокси]-1-(3-фенілпропіл)-15,11-5,20 (м, 1Н), 6,22 (с, 1Н, ОН), 6,86-6,95 (м, азоніабіцикло[2.2.2]октантрифторацетат 2Н), 6,95-7,05 (м, 1Н), 7,15-7,17 (м, 1Н), 7,22-7,26 Зазначену в заголовку сполуку було синтезо(м, 2Н), 7,42-7,44 (м, 1Н). вано, як описано в Прикладі 54. Вихід кінцевої Приклад 53 стадії складав 14мг, 53%. (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-тієн-2МС [M-CF3COO]+: 454. 1 ілацетокси]-1-(3-феноксипропіл)-1Н-ЯМР (ДМСО-d6): δ 1,30-1,65 (м, 8Н), 1,65азоніабіцикло[2.2.2]октанбромід 1,77 (м, 2Н), 1,77-2,05 (м, 4Н), 2,21 (з, 1Н), 2,55Зазначену в заголовку сполуку було синтезо2,65 (м, 2Н), 2,75-2,92 (м, 1Н), 3,15-3,40 (м, 6Н), вано у відповідності із способами d і а з проміжно3,40-3,55 (м, 1Н), 3,80-3,90 (м, 1Н), 5,06-5,16 (м, го продукту I-15b. Вихід кінцевої стадії складав 1,2г 1Н), 6,19 (с, 1Н, ОН), 6,95-7,02 (м, 1Н), 7,12-7,18 (73%). Т. пл.: 181°С. (м, 1Н), 7,20-7,36 (м, 5Н), 7,38-7,46 (м, 1Н). МС [М-Вr]+: 470. Приклад 58 1 Н-ЯМР (ДМСО-d6): δ 1,30-1,70 (м, 8Н), 1,70(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-21,80 (м, 2Н), 1,80-2,05 (м, 2Н), 2,05-2,30 (м, 3Н), ілацетокси]-1-(3-фенілаліл)-12,80-2,95 (м, 1Н), 3,25-3,62 (м, 7Н), 3,87-4,0 (м, 1Н), азоніабіцикло[2.2.2]октантрифторацетат 4,0-4,10 (м, 2Н), 5,10-5,20 (м, 1Н), 6,20 (с, 1Н, ОН), Зазначену в заголовку сполуку було синтезо6,95-7,05 (м, 4Н), 7,15-7,25 (м, 1Н), 7,25-7,37 (м, вано, як описано в Прикладі 54. Вихід кінцевої 2Н), 7,42-7,45 (м, 1Н). стадії складав 7мг, 26%. Приклад 54 МС [M-CF3COO]+: 452. 1 (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-2Н-ЯМР (ДМСО-d6): δ 1,30-1,65 (м, 8Н), 1,75ілацетокси]-1-(3-тієн-2-ілпропіл)-12,05 (м, 4Н), 2,24 (м, 1Н), 2,75-2,90 (м, 1Н), 3,25азоніабіцикло[2.2.2]октантрифторацетат 3,45 (м, 4Н), 3,45-3,55 (м, 1Н), 3,72-3,95 (м, 1Н), Зазначену в заголовку сполуку було синтезо4,0-4,15 (м, 2Н), 5,10-5,17 (м, 1Н), 6,19 (с, 1Н, ОН), вано у відповідності із способами d і а із проміжно6,40-6,55 (м, 1Н), 6,82-6,70 (м, 2Н), 7,12-7,17 (м, го продукту I-15b. Вихід кінцевої стадії складав 1Н), 7,30-7,45 (м, 4Н), 7,55-7,62 (м, 2Н). 15мг (54%). Приклад 59 МС [M-CF3COO]+: 460. (3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-21 Н-ЯМР (ДMCO-d6): δ 1,30-1,65 (м 8Н), 1,65ілацетокси]-1-[3-(4-фторфенокси)пропіл]-11,80 (м, 2Н), 1,80-2,10 (м, 4Н), 2,21 (м, 1Н), 2,77азоніабіцикло[2.2.2]октантрифторацетат 2,90 (м, 3Н), 3,15-3,40 (м, 6Н), 3,40-3,55 (м, 1Н), Зазначену в заголовку сполуку було синтезо3,80-3,92 (м, 1Н), 5,05-5,18 (м, 1Н), 6,20 (с, 1Н, вано, як описано в Прикладі 54. Вихід кінцевої ОН), 6,92-6,96 (м, 1Н), 6,96-7,02 (м, 2Н), 7,12-7,20 стадії складав 19мг, 64%. (м, 1Н), 7,36-7,40 (м, 1Н), 7,40-7,46 (м, 1Н). MC [M-CF3COO]+: 488. 1 Приклад 55 Н-ЯМР (ДMCO-d6): δ 1,30-1,65 (м, 8Н), 1,65(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-тієн-21,80 (м, 2Н), 1,80-2,05 (м, 2Н), 2,05-2,20 (м, 2Н), ілацетокси]-1-(2-феноксиетил)-12,23 (м, 1Н), 2,80-2,95 (м, 1Н), 3,20-3,60 (м, 7Н), азоніабіцикло[2.2.2]октантрифторацетат 3,85-3,95 (м, 1Н), 3,97-4,07 (м, 2Н), 5,14 (м, 1Н), Зазначену в заголовку сполуку було синтезо6,20 (с, 1Н, ОН), 6,90-7,05 (м, ЗН), 7,10-7,20 (м, вано, як описано в Прикладі 54. Вихід кінцевої 3Н), 7,40-7,47 (м, 1Н). стадії складав 16мг, 58%. Приклад 60 МС [M-CF3COO]+: 456. (3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-21 Н-ЯМР (ДMCO-d6): δ 1,30-1,65 (м, 8Н), 1,75гідроксиацетокси]-1-(3-феноксипропіл)-11,85 (м, 2Н), 1,85-2,05 (м, 2Н), 2,23 (м, 1Н), 2,75азоніабіцикло[2.2.2]октантрифторацетат 2,90 (м, 1Н), 3,40-3,57 (м, 4Н), 3,57-3,70 (м, 1Н), Зазначену в заголовку сполуку було синтезо3,70-3,80 (м, 2Н), 3,97-4,10 (м, 1Н), 4,37-4,47 (м, вано у відповідності із способами d і b із проміжно2Н), 5,10-5,18 (м, 1Н), 6,20 (с, 1Н, ОН), 6,92-7,05 го продукту I-14а. Вихід кінцевої стадії складав (м, 4Н), 7,10-7,18 (м, 1Н), 7,30-7,38 (м, 2Н), 7,384мг, 15%. 7,44 (м, 1Н). MC [M-CF3COO]+: 454. 1 Н-ЯМР (ДМСО-d6): δ 1,45-1,67 (м, 9Н), 1,671 55 75626 56 1,80 (м, 1Н), 1,80-2,05 (м, 2Н), 2,05-2,22 (м, 3Н), МС [M-CF3COO]+: 444. 1 2,85-2,95 (м, 1Н), 3,20-3,55 (м, 7Н), 3,85-3,95 (м, Н-ЯМР (ДMCO-d6): δ 1,40-1,65 (м, 8Н), 1,751Н), 4,0-4,10 (м, 2Н), 5,10-5,20 (м, 1Н), 6,03 (з, 1Н), 2,10 (м, 6Н), 2,27 (м, 1Н), 2,70-2,90 (м, 3Н), 3,0-3,55 6,40-6,45 (м, 2Н), 6,90-7,0 (м, 3Н), 7,27-7,35 (м, 2Н), (м, 7Н), 3,77-3,82 (м, 1Н), 5,05-5,15 (м, 1Н), 6,03 (з, 7,62(м, 1Н). 1Н), 6,40-6,45 (м, 2Н), 6,90-7,05 (м, 2Н), 7,35-7,42 Приклад 61 (м, 1Н), 7,55-7,65 (м, 1Н). (3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-2Приклад 66 гідроксиацетокси]-1-(3-тієн-2-ілпропіл)-1(3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2азоніабіцикло[2.2.2]октантрифторацетат гідроксиацетокси]-1-фенетил-1Зазначену в заголовку сполуку було синтезоазоніабіцикло[2.2.2]октантрифторацетат вано, як описано в Прикладі 60. Вихід кінцевої Зазначену в заголовку сполуку було синтезостадії складав 2мг, 7%. вано, як описано в Прикладі 64. Вихід кінцевої MC [M-CF3COO]+: 444. стадії складав 15мг, 57%. 1 Н-ЯМР (ДMCO-d6): δ 1,40-1,66 (м, 9Н), 1,66МС [M-CF3COO]+: 424. 1 2,10 (м, 5Н), 2,17 (м, 1Н), 2,78-2,90 (м, 3Н), 3,14Н-ЯМР (ДМСО-d6): δ 1,30-2,40 (м, 13Н), 2,753,50 (м, 7Н), 3,80-3,90 (м, 1Н), 5,10-5,18 (м, 1Н), 2,85 (м, 1Н), 2,95-3,05 (м, 2Н), 3,10-3,75 (м, 7Н), 6,02 (з, 1Н), 6,38-6,46 (м, 2Н), 6,92-7,02 (м, 2Н), 3,85-4,0 (м, 1Н), 5,05-5,15 (м, 1Н), 6,02 (с, 1Н, ОН), 7,36-7,40 (м, 1Н), 7,60 (м, 1Н). 6,44 (м, 2Н), 7,20-7,40(м, 5Н), 7,63(м, 1Н). Приклад 62 Приклад 67 (3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-2(3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2гідроксиацетокси]-1-фенетил-1гідроксиацетокси]-1-(3-фенілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат азоніабіцикло[2.2.2]октантрифторацетат Зазначену в заголовку сполуку було синтезоЗазначену в заголовку сполуку було синтезовано, як описано в Прикладі 60. Вихід кінцевої вано, як описано в Прикладі 64. Вихід кінцевої стадії складав 4мг, 17%. стадії складав 10мг, 38%. MC [M-CF3COO]+: 424. МС [M-CF3COO]+: 438. 1 1 Н-ЯМР (ДМСО-d6): δ 1,40-2,05 (м, 12Н), 2,20 Н-ЯМР (ДМСО-d6): δ 1,40-1,60 (м, 8Н), 1,75(м, 1Н), 2,88 (м, 1Н), 2,95-3,05 (м, 2Н), 3,20-3,60 (м, 2,05 (м, 6Н), 2,27 (м, 1Н), 2,55-2,60 (м, 2Н), 2,79 (м, 7Н), 3,85-3,95 (м, 1Н), 5,18 (м, 1Н), 6,03 (с, 1Н, 1Н), 3,04-3,10 (м, 1Н), 3,12-3,40 (м, 5Н), 3,40-3,52 ОН), 6,40-6,45 (м, 2Н), 7,25-7,40 (м, 5Н), 7,62 (м, (м, 1Н), 3,80-3,90 (м, 1Н), 5,10 (м, 1Н), 6,02 (с, 1Н, 1Н). ОН), 6,40 (м, 2Н), 7,20-7,35 (м, 5Н), 7,58 (м, 1Н). Приклад 63 Приклад 68 (3R)-3-[(2S)-2-циклопентил-2-фур-2-ил-2(3R)-3-[(2R)-2-циклогексил-2-гідрокси-2гідроксиацетокси]-1-(3-фенілпропіл)-1фенілацетокси-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат азоніабіцикло[2.2.2]октантрифторацетат Зазначену в заголовку сполуку було синтезоЗазначену в заголовку сполуку було синтезовано, як описано в Прикладі 60. Вихід кінцевої вано у відповідності із способами d і b із проміжностадії складав 10мг, 36,2%. го продукту I-16а. Вихід кінцевої стадії складав МС [M-CF3COO]+: 438. 28мг, 100%. 1 Н-ЯМР (ДМСО-d6): δ 1,35-2,05 (м, 14Н), 2,16 МС [M-CF3COO]+: 478. 1 (м, 1Н), 2,55-2,65 (м, 2Н), 2,75-2,95 (м, 1Н), 3,10Н-ЯМР (ДМСО-d6): δ 0,95-1,18 (м, 4Н), 1,183,55 (м, 7Н), 3,77-3,92 (м, 1Н), 5,05-5,15 (м, 1Н), 1,65 (м, 5Н), 1,70-2,05 (м, 5Н), 2,05-2,17 (м, 2Н), 6,02 (с, 1Н, ОН), 6,35-6,45 (м, 2Н), 7,17-7,40 (м, 2,17-2,30 (м, 2Н), 3,15-3,25 (м, 1Н), 3,25-3,55 (м, 5Н), 7,60 (м, 1Н). 6Н), 3,75-3,90 (м, 1Н), 3,95-4,07 (м, 2Н), 5,05-5,15 Приклад 64 (м, 1Н), 5,78 (с, 1Н, ОН), 6,90-7,0 (м, ЗН), 7,25-7,45 (3R)-3-[(2R)-2-циклопентил-2-фур-2-ил-2(м, 5Н), 7,55-7,65 (м, 2Н). гідроксиацетокси]-1-(3-феноксипропіл)-1Приклад 69 азоніабіцикло[2.2.2]октантрифторацетат (3R)-3-[(2R)-2-циклогексил-2-гідрокси-2Зазначену в заголовку сполуку було синтезофенілацетокси]-1-(3-тієн-2-ілпропіл)-1вано у відповідності із способами d і b із проміжноазоніабіцикло[2.2.2]октантрифторацетат го продукту I-14Ь. Вихід кінцевої стадії складав Зазначену в заголовку сполуку було синтезо12мг, 46%. вано, як описано в Прикладі 68. Вихід кінцевої МС [M-CF3COO]+: 454. стадії складав 22мг, 78%. 1 Н-ЯМР (ДMCO-d6): δ 1,40-1,60 (м, 8Н), 1,75МС [M-CF3COO]+: 468. 1 2,05 (м, 4Н), 2,05-2,20 (м, 2Н), 2,30 (м, 1Н), 2,75Н-ЯМР (ДМСО-d6): δ 0,95-1,18 (м, 4Н), 1,182,87 (м, 1Н), 3,10-3,60 (м, 7Н), 3,85-3,95 (м, 1Н), 1,65 (м, 5Н), 1,70-2,0 (м, 7Н), 2,20 (м, 2Н), 2,75-2,85 3,97-4,07 (м, 2Н), 5,10-5,17 (м, 1Н), 6,04 (з, 1Н), (м, 2Н), 3,05-3,15 (м, 1Н), 3,15-3,50 (м, 6Н), 3,706,40-6,50 (м, 2Н), 6,90-7,0 (м, 3Н), 7,27-7,37 (м, 2Н), 3,85 (м, 1Н), 5,05-5,15 (м, 1Н), 5,76 (с, 1Н, ОН), 7,60-7,65 (м, 1Н). 6,90-7,05 (м, 2Н), 7,20-7,45 (м, 4Н), 7,55-7,65 (м, Приклад 65 2Н). (3R)-3-[(2R)-2-циіаіопентил-2-фур-2-ил-2Приклад 70 гідроксиацетокси]-1-(3-тієн-2-ілпропіл)-1(3R)-3-[(2R)-2-циклогексил-2-гідрокси-2азоніабіцикло[2.2.2]октантрифторацетат фенілацетокси]-1-фенетил-1Зазначену в заголовку сполуку було синтезоазоніабіцикло[2.2.2]октантрифторацетат вано, як описано в Прикладі 64. Вихід кінцевої Зазначену в заголовку сполуку було синтезостадії складав 14мг, 55%. вано, як описано в Прикладі 68. Вихід кінцевої 57 75626 58 стадії складав 14мг, 50%. вано, як описано в Прикладі 74. Вихід кінцевої МС [M-CF3COO]+: 448. стадії складав 3,6мг, 6%. 1 Н-ЯМР (ДМСО-d6): δ 0,97-1,15 (м, 3Н), 1,15МС [M-CF3COO]+: 458. 1 2,05 (м, 11Н), 2,15-2,30 (м, 2Н), 2,90-3,05 (м, 2Н), Н-ЯМР (ДМСО-d6): δ 1,0-1,45 (м, 7Н), 1,503,20-3,30 (м, 1Н), 3,30-3,50 (м, 5Н), 3,50-3,62 (м, 2,10 (м, 9Н), 2,15-2,30 (м, 2Н), 2,75-2,90 (м, 2Н), 1Н), 3,82-3,92 (м, 1Н), 5,15 (м, 1Н), 5,78 (с, 1Н, 3,10-3,55 (м, 7Н), 3,77-3,92 (м, 1Н), 5,13 (м, 1Н), ОН), 7,25-7,45 (м, 8Н), 7,58-7,64 (м, 2Н). 5,98 (с, 1Н, ОН), 6,36-6,46 (м, 2Н), 6,92-7,02 (м, Приклад 71 2Н), 7,36-7,40 (м, 1Н), 7,62 (м, 1Н). (3R)-3-[(2S)-2-циклогексил-2-гідрокси-2Приклад 76 фенілацетокси]-1-(3-феноксипропіл)-1(3R)-3-[(2S)-2-циіслогексил-2-фур-2-ил-2азоніабіцикло[2.2.2]октантрифторацетат гідроксиацетокси]-1-фенетил-1Зазначену в заголовку сполуку було синтезоазоніабіцикло[2.2.2]октантрифторацетат вано у відповідності із способами d і b із проміжноЗазначену в заголовку сполуку було синтезого продукту I-16b. Вихід кінцевої стадії складав вано, як описано в Прикладі 74. Вихід кінцевої 18мг, 63%. стадії складав 2,4мг, 4,2%. МС [M-CF3COO]+: 478. МС [M-CF3COO]+: 438. 1 1 Н-ЯМР (ДМСО-d6): δ 0,95-1,17 (м, 4Н), 1,20Н-ЯМР (ДМСО-d6): δ 1,0-1,45 (м, 7Н), 1,502,0 (м, 10Н), 2,02-2,35 (м, 4Н), 3,15-3,55 (м, 7Н), 2,05 (м, 7Н), 2,20-2,35 (м, 2Н), 2,92-3,15 (м, 2Н), 3,80-3,90 (м, 1Н), 3,97-4,10 (м, 2Н), 5,05-5,15 (м, 3,20-3,65 (м, 7Н), 3,85-3,95 (м, 1Н), 5,18 (м, 1Н), 6,0 1Н), 5,75 (с, 1Н, ОН), 6,90-7,02 (м, 3Н), 7,25-7,45 (с, 1Н, ОН), 6,37-6,47 (м, 2Н), 7,25-7,45 (м, 5Н), (м, 5Н), 7,57-7,67 (м, 2Н). 7,64 (м, 1Н). Приклад 72 Приклад 77 (3R)-3-[(2S)-2-циклогексил-2-гідрокси-2(3R)-3-[(2S)-2-циклогексил-2-фур-2-ил-2фенілацетокси]-1-(3-тієн-2-ілпропіл)-1гідроксиацетокси]-1-(3-фенілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат азоніабіцикло[2.2.2]октантрифторацетат Зазначену в заголовку сполуку було синтезоЗазначену в заголовку сполуку було синтезовано, як описано в Прикладі 71. Вихід кінцевої вано, як описано в Прикладі 74. Вихід кінцевої стадії складав 19мг, 99 66%. стадії складав 2,8мг, 4,8%. МС [M-CF3COO]+: 452. + 1 МС [M-CF3COO] : 468. Н-ЯМР (ДМСО-d6): δ 0,95-1,50 (м, 7Н), 1,501 Н-ЯМР (ДМСО-d6): δ 0,95-1,17 (м, 4Н), 1,202,10 (м, 9Н), 2,15-2,32 (м, 2Н), 2,55-2,65 (м, 2Н), 2,10 (м, 12Н), 2,15-2,35 (м, 2Н), 2,75-2,97 (м, 2Н), 3,10-3,60 (м, 7Н), 3,77-3,80 (м, 1Н), 5,12 (м, 1Н), 3,10-3,37 (м, 6Н), 3,37-3,55 (м, 1Н), 3,75-3,87 (м, 5,98 (с, 1Н, ОН), 6,36-6,46 (м, 2Н), 7,18-7,40 (м, 1Н), 5,05-5,12 (м, 1Н), 5,74 (с, 1Н, ОН), 6,90-7,05 5Н), 7,62 (м, 1Н). (м, 2Н), 7,22-7,45 (м, 4Н), 7,55-7,67 (м, 2Н). Приклад 78 Приклад 73 (3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2(3R)-3-[(2S)-2-циклогексил-2-гідрокси-2гідроксиацетокси]-1-(3-феноксипропіл)-1фенілацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат азоніабіцикло[2.2.2]октантрифторацетат Зазначену в заголовку сполуку було синтезоЗазначену в заголовку сполуку було синтезовано у відповідності із способами с і b із проміжновано, як описано в Прикладі 71. Вихід кінцевої го продукту І-4b. Вихід кінцевої стадії складав стадії складав 16мг, 58%. 3,0мг, 5%. МС [M-CF3COO]+: 448. МС [M-CF3COO]+: 468. 1 1 Н-ЯМР (ДМСО-d6): δ 0,98-1,15 (м, 3Н), 1,20Н-ЯМР (ДМСО-d6): δ 1,0-1,45 (м, 7Н), 1,552,05 (м, 11Н), 2,20-2,35 (м, 2Н), 2,90-3,10 (м, 2Н), 1,75 (м, 3Н), 1,80-2,05 (м, 4Н), 2,05-2,25 (м, ЗН), 3,20-3,50 (м, 6Н), 3,50-3,60 (м, 1Н), 3,80-3,92 (м, 2,30 (м, 1Н), 3,10-3,20 (м, 1Н), 3,20-3,60 (м, 6Н), 1Н), 5,12 (м, 1Н), 5,75 (с, 1Н, ОН), 7,25-7,40 (м, 3,85-3,95 (м, 1Н), 3,95-4,10 (м, 2Н), 5,16 (м, 1Н), 8Н), 7,60-7,65 (м, 1Н). 5,99 (с, 1Н, ОН), 6,40-6,50 (м, 2Н), 6,90-7,0 (м, 3Н), Приклад 74 7,25-7,38 (м, 2Н), 7,64 (м, 1Н). (3R)-3-[(2S)-2-циклогексил-2-фур-2-ил-2Приклад 79 гідроксиацетокси]-1-(3-феноксипропіл)-1(3R)-3-(2R)-2-циклогексил-2-фур-2-ил-2азоніабіцикло[2.2.2]октантрифторацетат гідроксиацетокси]-1-(3-тієн-2-ілпропіл)-1Зазначену в заголовку сполуку було синтезоазоніабіцикло[2.2.2]октантрифторацетат вано у відповідності із способами с і b із проміжноЗазначену в заголовку сполуку було синтезого продукту І-4а. Вихід кінцевої стадії складав вано, як описано в Прикладі 78. Вихід кінцевої 3,8мг, 6,2%. стадії складав 9,1мг, 33,1%. МС [M-CF3COO]+: 468. МС [M-CF3COO]+: 458. 1 1 Н-ЯМР (ДМСО-d6): δ 1,0-1,50 (м, 7Н), 1,50Н-ЯМР (ДМСО-d6): δ 0,95-1,55 (м, 7Н), 1,552,05 (м, 7Н), 2,05-2,35 (м, 4Н), 3,15-3,65 (м, 7Н), 2,10 (м, 9Н), 2,10-2,40 (м, 2Н), 2,75-2,95 (м, 2Н), 3,82-3,95 (м, 1Н), 4,0-4,1 (м, 2Н), 5,16 (м, 1Н), 5,99 3,0-3,12 (м, 1Н), 3,12-3,70 (м, 6Н), 3,80-3,95 (м, 1Н), (с, 1Н, ОН), 6,40-6,45 (м, 2Н), 6,90-7,0 (м, 3Н), 7,255,14 (м, 1Н), 6,0 (с, 1Н, ОН), 6,35-6,55 (м, 2Н), 6,907,35 (м, 2Н), 7,64 (м, 1Н). 7,10 (м, 2Н), 7,35-7,45 (м, 1Н), 7,60-7, 70 (м, 1Н). Приклад 75 Приклад 80 (3R)-3-[(2S)-2-циклогексил-2-фур-2-ил-2(3R)-3-(2R)-2-циклогексил-2-фур-2-ил-2гідроксиацетокси]-1-(3-тіен-2-ілпропіл)-1гідроксиацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат азоніабіцикло[2.2.2]октантрифторацетат Зазначену в заголовку сполуку було синтезоЗазначену в заголовку сполуку було синтезо 59 75626 60 вано, як описано в Прикладі 78. Вихід кінцевої вано у відповідності із способами с і b із проміжностадії складав 3,6мг, 6%. го продукту І-5b. Вихід кінцевої стадії складав МС [M-CF3COO]+: 438. 7,8мг, 12,9%. 1 Н-ЯМР (ДМСО-d6): δ 1,0-1,45 (м, 7Н), 1,55МС [M-CF3COO]+: 464. 1 1,80 (м, 3Н), 1,80-2,10 (м, 4Н), 2,12-2,28 (м, 1Н), Н-ЯМР (ДМСО-d6): δ 1,15-1,35 (м, 2Н), 1,352,30 (м, 1Н), 2,90-3,05 (м, 2Н), 3,15-3,25 (м, 1Н), 2,0 (м, 10Н), 2,0-2,30 (м, ЗН), 2,95-3,10 (м, 1Н), 3,25-3,50 (м, 5Н), 3,50-3,65 (м, 1Н), 3,85-3,95 (м, 3,20-3,60 (м, 7Н), 3,80-3,95 (м, 1Н), 3,97-4,10 (м, 1Н), 5,18 (м, 1Н), 6,0 (с, 1Н, ВІН), 6,38-6,48 (м, 2Н), 2Н), 5,09 (м, 1Н), 5,84 (с, 1Н, ОН), 6,90-7,0 (м, ЗН), 7,24-7,40 (м, 5Н), 7,65 (м, 1Н). 7,24-7,44 (м, 5Н), 7,60-7,70 (м, 2Н). Приклад 81 Приклад 86 (3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2гідроксиацетокси]-1-(3-фенілпропіл)-1фенілацетокси]-1-фенетил-1азоніабіцикло[2.2.2]октантрифторацетат азоніабіцикло[2.2.2]октантрифторацетат Зазначену в заголовку сполуку було синтезоЗазначену в заголовку сполуку було синтезовано, як описано в Прикладі 78. Вихід кінцевої вано, як описано в Прикладі 85. Вихід кінцевої стадії складав 5,8мг, 10%. стадії складав 5,2мг, 9,2%. МС [M-CF3COO]+: 452. МС [M-CF3COO]+: 434. 1 1 Н-ЯМР (ДМСО-d6): δ 1,0-1,42 (м, 7Н), 1,55Н-ЯМР (ДMCO-d6): δ 1,12-1,32 (м, 2Н), 1,321,77 (м, 3Н), 1,77-2,05 (м, 6Н), 2,18 (м, 1Н), 2,27 (м, 2,05 (м, 10Н), 2,20 (м, 1Н), 2,90-3,10 (м, ЗН), 3,201Н), 2,55-2,65 (м, 2Н), 3,02-3,12 (м, 1Н), 3,12-3,60 3,62 (м, 7Н), 3,82-3,97 (м, 1Н), 5,12 (м, 1Н), 5,85 (с, (м, 6Н), 3,77-3,90 (м, 1Н), 5,13 (м, 1Н), 5,98 (с, 1Н, 1Н, ОН), 7,22-7,45 (м, 8Н), 7,60-7,70 (м, 2Н). ОН), 6,40 (м, 2Н), 7,20-7,35 (м, 5Н), 7,61 (м, 1Н). Приклад 87 Приклад 82 (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2фенілацетокси]-1-(3-фенілсульфанілпропіл)-1фенілацетокси]-1-(3-феноксипропіл)-1азоніабіцикло[2.2.2]октантрифторацетат азоніабіцикло[2.2.2]октантрифторацетат Зазначену в заголовку сполуку було синтезоЗазначену в заголовку сполуку було синтезовано, як описано в Прикладі 85. Вихід кінцевої вано у відповідності із способами с і b із проміжностадії складав 4,0мг, 6,4%. го продукту І-5а. Вихід кінцевої стадії складав МС [M-CF3COO]+: 480. 1 9,4мг, 15,6%. Н-ЯМР (ДМСО-d6): δ 1,12-1,32 (м, 2Н), 1,32+ МС [M-CF3COO] : 464. 1,70 (м, 8Н), 1,70-2,0 (м, 4Н), 2,16 (м, 1Н), 2,92-3,05 1 Н-ЯМР (ДМСО-d6): δ 1,10-1,70 (м, 8Н), 1,70(м, 3Н), 3,15-3,60 (м, 7Н), 3,75-3,87 (м, 1Н), 5,04 (м, 2,02 (м, 4Н), 2,05-2,15 (м, 2Н), 2,24 (м, 1Н), 2,901Н), 5,82 (с, 1Н, ОН), 7,20-7,44 (м, 8Н), 7,58-7,68 2,97 (м, 1Н), 3,15-3,25 (м, 1Н), 3,25-3,60 (м, 6Н), (м, 2Н). 3,75-3,92 (м, 1Н), 3,95-4,10 (м, 2Н), 5,10 (м, 1Н), Приклад 88 5,86 (с, 1Н, ОН), 6,90-7,0 (м, ЗН), 7,20-7,40 (м, 5Н), (3R)-3-[(2S)-2-циклогексил-2-гідрокси-2-тієн-27,56-7,66 (м, 2Н). ілацетокси]-1-(3-феноксипропіл)-1Приклад 83 азоніабіцикло[2.2.2]октантрифторацетат Зазначе(3R)-3-(2R)-2-циішопентил-2-гідрокси-2ну в заголовку сполуку було синтезовано у відпофенілацетокси]-1-фенетил-1відності із способами с і b із проміжного продукту Іазоніабіцикло[2.2.2]октантрифторацетат 6а. Вихід кінцевої стадії складав 3,2мг, 5,1%. Зазначену в заголовку сполуку було синтезоMC [M-CF3COO]+: 484. 1 вано, як описано в Прикладі 82. Вихід кінцевої Н-ЯМР (ДМСО-d6): δ 1,0-1,45 (м, 7Н), 1,55стадії складав 5,0мг, 8,8%. 1,80 (м, 3Н), 1,80-2,20 (м, 7Н), 2,25-2,35 (м, 1Н), МС [M-CF3COO]+: 434. 3,20-3,28 (м, 1Н), 3,28-3,42 (м, 5Н), 3,42-3,55 (м, 1 Н-ЯМР (ДМСО-d6): δ 1,12-1,70 (м, 8Н), 1,751Н), 3,85-3,95 (м, 1Н), 4,01-4,05 (м, 2Н), 5,17 (м, 2,05 (м, 4Н), 2,26 (м, 1Н), 2,87-3,05 (м, ЗН), 3,151Н), 6,16 (с, 1Н, ОН), 6,92-7,03 (м, 4Н), 7,13-7,15 3,62 (м, 7Н), 3,80-3,92 (м, 1Н), 5,13 (м, 1Н), 5,86 (с, (м, 1Н), 7,28-7,34 (м, 2Н), 7,42-7,45 (м, 1Н). 1Н, ОН), 7,24-7,44 (м 8Н), 7,56-7,66 (м, 2Н). Приклад 89 Приклад 84 (3R)-3-[(2S)-2-циклогексил-2-гідрокси-2-тієн-2(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2ілацетокси]-1-фенетил-1фенілацетокси]-1-(3-фенілсульфанілпропіл)-1азоніабіцикло[2.2.2]октантрифторацетат азоніабіцикло[2.2.2]октантрифторацетат Зазначену в заголовку сполуку було синтезоЗазначену в заголовку сполуку було синтезовано, як описано в Прикладі 88. Вихід кінцевої вано, як описано в Прикладі 82. Вихід кінцевої стадії складав 3,4мг, 5,8%. стадії складав 3,2мг, 5,1%. MC [M-CF3COO]+: 454. 1 МС [M-CF3COO]+: 480. Н-ЯМР (ДМСО-d6): δ 1,0-1,45 (м, 7Н), 1,551 Н-ЯМР (ДMCO-d6): δ 1,12-1,65 (м, 8Н), 1,651,80 (м, ЗН), 1,80-2,15 (м, 5Н), 2,32 (м, 1Н), 2,952,0 (м, 6Н), 2,21 (м, 1Н), 2,85-3,15 (м, 4Н), 3,15-3,55 3,05 (м, 2Н), 3,20-3,52 (м, 6Н), 3,52-3,68 (м, 1Н), (м, 6Н), 3,70-3,85 (м, 1Н), 5,06 (м, 1Н), 5,83 (с, 1Н, 3,85-3,95 (м, 1Н), 5,20 (м, 1Н), 6,16 (с, 1Н, ОН), 7,0ОН), 7,20-7,46 (м, 8Н), 7,54-7,64 (м, 2Н). 7,04 (м, 1Н), 7,10-7,15 (м, 1Н), 7,25-7,40 (м, 5Н), Приклад 85 7,43-7,46 (м, 1Н). (3R)-3-[(2S)-2-циклопентил-2-гідрокси-2Приклад 90 фенілацетокси]-1-(3-феноксипропіл)-11-[3-(3-ціанофенокси)пропіл]-(3R)-3-[(2S)-2азоніабіцикло[2.2.2]октантрифторацетат циклогексил-2-гідрокси-2-тієн-2-ілацетокси]-1Зазначену в заголовку сполуку було синтезоазоніабіцикло[2.2.2]октантрифторацетат
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinuclidine derivatives and medicinal compositions containing the same
Автори англійськоюBuil Albero Maria Antonia
Назва патенту російськоюПроизводные хинуклидина и лечебные композиции, которые их содержат
Автори російськоюБуил Альберо Мария Антония
МПК / Мітки
МПК: C07D 453/00, A61K 31/439, A61P 13/00, A61P 1/00
Мітки: лікарські, композиції, хінуклідину, містять, похідні
Код посилання
<a href="https://ua.patents.su/32-75626-pokhidni-khinuklidinu-ta-likarski-kompozici-shho-kh-mistyat.html" target="_blank" rel="follow" title="База патентів України">Похідні хінуклідину та лікарські композиції, що їх містять</a>
Попередній патент: Спосіб охолоджування зливка в зоні вторинного охолоджування машини безперервного лиття заготовок (мблз)
Наступний патент: Склад харчоконцентрату
Випадковий патент: Високомоментний ключ полетучого












