Антигістамінові засоби та їх застосування для різкого зниження підвищеного внутрішньочерепного тиску
Номер патенту: 76803
Опубліковано: 15.09.2006
Автори: Леенартс Йозеф Елізабет, Янссенс Франс Едуард, Алькасар-Вака Мануель Хесус, Бартоломе-Небреда Хосе Мануель, Гомес-Санчес Антоніо, Тегтмайєр Франк, ван Россем Конраад Артур, Мартінес-Хіменес Педро, ван Реемптс Йозеф Лео Генрі, Фернандес-Гадеа Франсіско Хавьєр
Формула / Реферат
1. Сполука для застосування як гістаміновий Н1- та/або Н2-антагоніст загальної формули (І)
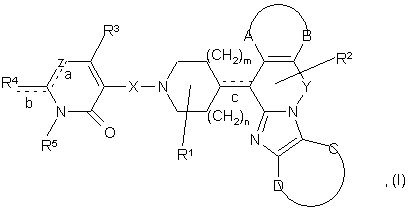
її фармацевтично прийнятні кислі або основні адитивні солі, стереохімічно ізомерні форми та N-оксидні форми, де:
m дорівнює 1 або 2;
n дорівнює 0, 1 або 2;
а, b, с є, незалежно, простим або подвійним зв'язком;
Х є ковалентним зв'язком або бівалентним С1-6алкандіїловим радикалом, де одна або більше -СН2- груп може бути заміщена, при потребі, -O-, -S-, -СО- або -NR7-;
де
R7 є воднем, алкілом, Аr, Аr-алкілом, Het, Het-алкілом, гідроксіалкілом, алкілокси групою, алкілоксіалкілом, алкілоксіалкілоксіалкілом, аміноалкілом, моно- або діалкіламіноалкілом, формілом, алкілкарбоніламіноалкілом, алкілкарбонілоксіалкілом, алкілоксикарбонілом, алкілоксикарбонілалкілом, алкіламінокарбонілом, алкіламінокарбонілалкілом, гідроксіалкілоксіалкілом, амінокарбонілом, амінокарбонілалкілом, алкілоксикарбонілом або алкілкарбонілоксіалкілоксіалкілом;
Y є С1-4алкандіїловим або С2-4алкандіїловим радикалом;
Z є N, і в цьому випадку а є подвійним зв'язком, та b є простим зв'язком, або N-R7, та в цьому випадку а є простим зв'язком, b є подвійним зв'язком, та R7 є таким, як визначено вище;
R1, R2 є, незалежно, воднем, гідроксигрупою, алкілом, алкілокси групою, Аr, Аr-алкілом, ді(Аr-)алкілом, Het або Het-алкілом;
-А-В- є, незалежно, бівалентним радикалом формули
-E-CR8=CR8-
(а-1);
-CR8=CR8-E-
(а-2);
-CR8=CR8=CR8=CR8-
(а-3);
де
кожен R8 є, незалежно, воднем, галогеном, гідрокси групою, алкілом або алкілоксигрупою;
Е є бівалентним радикалом формули -O-, -S- або -NR7-, де R7 є таким, як визначено вище;
-C-D- є, незалежно, бівалентним радикалом формули
-CR8=CR8=CR8=CR8-
(b-1);
-N=CR8-CR8=CR8-
(b-2);
-CR8=N-CR8=CR8-
(b-3);
-CR8=CR8-N=CR8-
(b-4);
-СR8=СR8-СR8=N-
(b-5);
де R8 є таким, як визначено вище;
R3 є воднем, галогеном, гідроксигрупою, алкілом, алкілокси групою, Аr, Аr-алкілом, ді(Аr-)алкілом, Het або Het-алкілом;
R4 є воднем, алкілом, аміногрупою, алкіламіногрупою, Аr-аміногрупою, Het-аміногрупою, алкілкарбоніламіногрупою, Аr-карбоніламіногрупою, Het-карбоніламіногрупою, алкіламінокарбоніламіногрупою, Аr-амінокарбоніламіногрупою, Het-амінокарбоніламіногрупою, алкілоксіалкіламіногрупою, Аr-оксіалкіламіногрупою або Het-оксіалкіламіно групою;
R5 є воднем або алкілом;
або R4 та R5 можуть утворювати разом бівалентний радикал формули
-M-CR9=CR10-
(c-1);
-CR10=CR9-M-
(c-2);
-M-CR9R8-CR10R8-
(c-3);
-CR10R8-CR9R8-M-
(c-4);
-CR8=N-NR7-
(c-5);
-NR7-N=CR8-
(c-6);
-CR8=CR9-CR10=CR8-
(c-7);
-CR8R8-CR9R8-CR10R8-M-
(c-8);
-M-CR10R8-CR9R8-CR8R8-
(c-9);
-CR8R8-CR8=N-NR7-
(c-10);
-NR7-N=CR8-CR8R8-
(c-11);
де
R7 та R8 є такими, як визначено вище;
R9, R10 є, незалежно, воднем, алкілом, галогеном, галоалкілом;
або R9 та R10 можуть утворювати разом бівалентний радикал формули
-CR8=CR8-CR8=CR8-; та
М є бівалентним радикалом формули -СН2-, -O-, -S- або -NR7-, де R7 є таким, як визначено вище;
Аr є гомоциклом, вибраним з групи нафтилу та фенілу, кожен з яких є заміщеним, при потребі, 1, 2 або 3 замісниками, кожен замісник вибраний, незалежно, з гідроксигрупи, галогену, ціаногрупи, нітрогрупи, аміногрупи, моно- або діалкіламіногрупи, алкілу, галоалкілу, алкілоксигрупи, галоалкілоксигрупи, карбоксилу, алкілоксикарбонілу, амінокарбонілу та моно- або діалкіламінокарбонілу;
Het є моноциклічним гетероциклом, вибраним з групи піролілу, піразолілу, імідазолілу, фуранілу, тіонілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, піридинілу, піримідинілу, піразинілу та піридазинілу; або біциклічним гетероциклом, вибраним з групи хінолінілу, індолілу, бензімідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, бензофуранілу та бензотієнілу; кожен моноциклічний та біциклічний гетероцикл може бути заміщений, при потребі, по атому карбону галогеном, гідроксигрупою, алкілом або алкілокси групою;
алкіл є прямим або розгалуженим насиченим вуглеводневим радикалом, що має від 1 до 6 атомів карбону; або є циклічним насиченим вуглеводневим радикалом, що має від 3 до 6 атомів карбону; або є циклічним насиченим вуглеводневим радикалом, що має від 3 до 6 атомів карбону, приєднаних до прямого або розгалуженого насиченого вуглеводневого радикала, що має від 1 до 6 атомів карбону; де кожен атом карбону може бути заміщеним, при потребі, галогеном, гідроксигрупою, алкілоксигрупою або оксогрупою;
галоген є замісником, вибраним з групи атомів фтору, хлору, брому та йоду;
галоалкіл є прямим або розгалуженим насиченим вуглеводневим радикалом, що має від 1 до 6 атомів карбону, або циклічним насиченим вуглеводневим радикалом, що має від 3 до 6 атомів карбону, де один або більша кількість атомів карбону заміщені одним або більшою кількістю атомів галогену.
2. Сполука за п.1, яка відрізняється тим, що, незалежно один від одного, Аr є нафтилом або фенілом, кожен із яких заміщений, при потребі, одним замісником, кожен замісник вибраний, незалежно, з групи галогену або алкілу, Het є піридинілом, піразинілом або індолілом, алкіл є метилом, етилом або циклогексилметилом, галоген є атомом фтору або хлору, та галоалкіл є трифторометилом.
3. Сполука за пп.1 або 2, яка відрізняється тим, що -А-В- є бівалентним радикалом формули (а-1) або (а-3), де Е є бівалентним радикалом формули -O-, -S- або -NR7-, де R7 є воднем, R8 є воднем, -C-D- є бівалентним радикалом формули (b-1) або (b-2), де R8 є воднем, та Y є бівалентним радикалом формули –СН2-, -СН2-СН2- або -СН=СН-.
4. Сполука за будь-яким з пп.1-3, яка відрізняється тим, що m та n обидва дорівнюють 1.
5. Сполука за будь-яким з пп.1-4, яка відрізняється тим, що кожний R1 та R2 є, незалежно, воднем, алкілом, Аr-алкілом, Het або Het-алкілом.
6. Сполука за будь-яким з пп.1-5, яка відрізняється тим, що Х є бівалентним радикалом формули –CH2CH2- або -СН2СН2СН2-.
7. Сполука за будь-яким з пп.1-6, яка відрізняється тим, що R3 є воднем або алкілом, Z є N-R7, де R7 є воднем або алкілом, а є простим зв'язком, та b є подвійним зв'язком, та R4 та R5 утворюють разом бівалентний радикал формули (с-1), (с-3), (с-5), (с-7), (с-8) або (с-10), де R7 та R8 є воднем.
8. Сполука за п. 7, яка відрізняється тим, що R9 та R10 утворюють разом бівалентний радикал формули –CR8=CR8-CR8=CR8-, де R8 є воднем.
9. Сполука за п.1, яка відрізняється тим, що є сполукою 3-[2-[4-(11,12-дигідро-6Н-бензімідазо[2,1-b][3]бензазепін-6-іл)-2-(фенілметил)-1-піперидиніл]етил]-2,10-диметилпіримідо[1,2-а]бензімідазол-4(10Н)-он, її фармацевтичнo прийнятною кислою або основною адитивною сіллю, стереохімічно ізомерною формою та N-оксидною формою.
10. Кисла адитивна сіль сполуки за п. 9, яка відрізняється тим, що є сполукою 3-[2-[4-(11,12-дигідро-6Н-бензімідазо[2,1-b][3]бензазепін-6-іл)-2-(фенілметил)-1-піперидиніл]етил]-2,10-диметилпіримідо[1,2-а]бензімідазол-4(10Н)-он (Е)-2-бутендіоату (2:3) гідрату (1:1) та її стереоізомерними формами.
11. Сполука або її кисла адитивна сіль за пп. 9 або 10, яка відрізняється тим, що є енантіомером (А)[(![]() )(А)], енантіомером (В)[(
)(А)], енантіомером (В)[(![]() )(А)] або їх сумішшю.
)(А)] або їх сумішшю.
12. Сполука, яка розкладається in vivo з утворенням сполуки за будь-яким з пп.1-11.
13. Застосування сполуки за будь-яким з пп.1-12 для виробництва медикаментів для лікування захворювання, пов'язаного з гістаміновими H1- та H2-рецепторами.
14. Застосування сполуки за будь-яким з пп.1-12 для виробництва медикаментів для імуномодуляції у ссавців, для приглушення підвищеної чутливості та/або запальних реакцій, та для лікування та/або запобігання алергічним та шлунково-кишковим хворобам.
15. Застосування сполуки за будь-яким з пп.1-12 для виробництва медикаментів для імуномодуляції у ссавців, для приглушення підвищеної чутливості та/або запальних реакцій, та для лікування шлунково-кишкових станів.
16. Застосування сполуки за будь-яким з пп.1-12 для виробництва медикаментів для зниження внутрішньочерепного тиску (ІСР) у ссавців.
17. Застосування сполуки за будь-яким з пп.1-12 для виробництва медикаментів для зниження підвищеного внутрішньочерепного тиску (ІСР) та/або вторинної ішемії у ссавців.
18. Застосування сполуки за будь-яким з пп.1-12 для виробництва медикаментів для запобігання підвищенню внутрішньочерепного тиску (ІСР) та/або вторинній ішемії у ссавців.
19. Застосування сполуки за будь-яким з пп.17-18 для виробництва медикаментів, яке відрізняється тим, що підвищення внутрішньочерепного тиску (ІСР) та/або вторинна ішемія у ссавців зумовлені травматичним (ТВІ) або нетравматичним ушкодженням мозку.
20. Застосування сполуки за будь-яким з пп.13-19 для виробництва медикаментів, яке відрізняється тим, що зазначена сполука використовується внутрішньовенно.
21. Застосування сполуки за будь-яким з пп.16-20 для виробництва медикаментів, яке відрізняється тим, що зазначена сполука вибрана з групи антагоністів гістамінового Н1-рецептора, антагоністів гістамінового Н2-рецептора та антагоніста гістамінового рецептора з комбінованою Н1/Н2 антагоністичною активністю.
22. Застосування сполуки за п. 21 для виробництва медикаментів, яке відрізняється тим, що зазначена сполука вибрана з групи астемізолу, азатадину, азеластину, бромофеніраміну, хлороциклізину, хлорофеніраміну, клемастину, клемізолу, ципрогептадину, диметиндену, дифенгідраміну, дифенілпіраліну, гідроксизину, кетотіфену, лоратидину, ніапразину, оксатоміду, феніраміну, прометазину, піриламіну, ранітидину, ритансерину, тіотидину, золантидину, їх похідних та сумішей з будь-яких двох або більшої кількості перелічених препаратів.
23. Застосування сполуки за п. 21 для виробництва медикаментів, яке відрізняється тим, що зазначена сполука вибрана з групи хлороциклізину, хлорофеніраміну, дифенгідраміну, кетотіфену, лоратидину, ранітидину, тіотидину, золантидину, їх похідних та сумішей з будь-яких двох або більшої кількості перелічених препаратів.
Текст
1. Сполука для застосування як гістаміновий Н1- та/або Н2-антагоніст загальної формули (І) C2 2 (19) 1 3 76803 4 боніламіногрупою, Аr-карбоніламіногрупою, Hetневим радикалом, що має від 3 до 6 атомів карбокарбоніламіногрупою, алкіламінокарбоніламіногну, де один або більша кількість атомів карбону рупою, Аr-амінокарбоніламіногрупою, Hetзаміщені одним або більшою кількістю атомів гаамінокарбоніламіногрупою, алкілоксіалкіламіноглогену. 2. Сполука за п.1, яка відрізняється тим, що, нерупою, Аr-оксіалкіламіногрупою або Hetоксіалкіламіно групою; залежно один від одного, Аr є нафтилом або феніR5 є воднем або алкілом; лом, кожен із яких заміщений, при потребі, одним або R4 та R5 можуть утворювати разом бівалентзамісником, кожен замісник вибраний, незалежно, ний радикал формули з групи галогену або алкілу, Het є піридинілом, піразинілом або індолілом, алкіл є метилом, ети-M-CR9=CR10(c-1); лом або циклогексилметилом, галоген є атомом -CR10=CR9-M(c-2); фтору або хлору, та галоалкіл є трифторомети-M-CR9R8-CR10R8(c-3); лом. 3. Сполука за пп.1 або 2, яка відрізняється тим, -CR10R8-CR9R8-M(c-4); -CR8=N-NR7(c-5); що -А-В- є бівалентним радикалом формули (а-1) -NR7-N=CR8(c-6); або (а-3), де Е є бівалентним радикалом формули -CR8=CR9-CR10=CR8(c-7); -O-, -S- або -NR7-, де R7 є воднем, R8 є воднем, -C-CR8R8-CR9R8-CR10R8-M(c-8); D- є бівалентним радикалом формули (b-1) або (b-M-CR10R8-CR9R8-CR8R8(c-9); 2), де R8 є воднем, та Y є бівалентним радикалом 8 8 8 7 -CR R -CR =N-NR (c-10); формули –СН2-, -СН2-СН2- або -СН=СН-. 4. Сполука за будь-яким з пп.1-3, яка відрізняєть-NR7-N=CR8-CR8R8(c-11); ся тим, що m та n обидва дорівнюють 1. де 5. Сполука за будь-яким з пп.1-4, яка відрізняєтьR7 та R8 є такими, як визначено вище; ся тим, що кожний R1 та R2 є, незалежно, воднем, R9, R10 є, незалежно, воднем, алкілом, галогеном, галоалкілом; алкілом, Аr-алкілом, Het або Het-алкілом. 6. Сполука за будь-яким з пп.1-5, яка відрізняєтьабо R9 та R10 можуть утворювати разом бівалентся тим, що Х є бівалентним радикалом формули – ний радикал формули -CR8=CR8-CR8=CR8-; та CH2CH2- або -СН2СН2СН2-. 7. Сполука за будь-яким з пп.1-6, яка відрізняєтьМ є бівалентним радикалом формули -СН2-, -O-, ся тим, що R3 є воднем або алкілом, Z є N-R7, де S- або -NR7-, де R7 є таким, як визначено вище; Аr є гомоциклом, вибраним з групи нафтилу та R7 є воднем або алкілом, а є простим зв'язком, та фенілу, кожен з яких є заміщеним, при потребі, 1, b є подвійним зв'язком, та R4 та R5 утворюють ра2 або 3 замісниками, кожен замісник вибраний, зом бівалентний радикал формули (с-1), (с-3), (снезалежно, з гідроксигрупи, галогену, ціаногрупи, 5), (с-7), (с-8) або (с-10), де R7 та R8 є воднем. 8. Сполука за п. 7, яка відрізняється тим, що R9 нітрогрупи, аміногрупи, моно- або діалкіламіногрупи, алкілу, галоалкілу, алкілоксигрупи, галоалкілота R10 утворюють разом бівалентний радикал фоксигрупи, карбоксилу, алкілоксикарбонілу, амінормули –CR8=CR8-CR8=CR8-, де R8 є воднем. 9. Сполука за п.1, яка відрізняється тим, що є карбонілу та моно- або діалкіламінокарбонілу; Het є моноциклічним гетероциклом, вибраним з сполукою 3-[2-[4-(11,12-дигідро-6Н-бензімідазо[2,1групи піролілу, піразолілу, імідазолілу, фуранілу, b][3]бензазепін-6-іл)-2-(фенілметил)-1тіонілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіапіперидиніл]етил]-2,10-диметилпіримідо[1,2золілу, піридинілу, піримідинілу, піразинілу та піа]бензімідазол-4(10Н)-он, її фармацевтичнo приридазинілу; або біциклічним гетероциклом, вибрайнятною кислою або основною адитивною сіллю, ним з групи хінолінілу, індолілу, бензімідазолілу, стереохімічно ізомерною формою та N-оксидною бензоксазолілу, бензізоксазолілу, бензотіазолілу, формою. 10. Кисла адитивна сіль сполуки за п. 9, яка відрібензізотіазолілу, бензофуранілу та бензотієнілу; зняється тим, що є сполукою 3-[2-[4-(11,12кожен моноциклічний та біциклічний гетероцикл може бути заміщений, при потребі, по атому кардигідро-6Н-бензімідазо[2,1-b][3]бензазепін-6-іл)-2бону галогеном, гідроксигрупою, алкілом або алкі(фенілметил)-1-піперидиніл]етил]-2,10локси групою; диметилпіримідо[1,2-а]бензімідазол-4(10Н)-он (Е)алкіл є прямим або розгалуженим насиченим вуг2-бутендіоату (2:3) гідрату (1:1) та її стереоізомерлеводневим радикалом, що має від 1 до 6 атомів ними формами. карбону; або є циклічним насиченим вуглеводне11. Сполука або її кисла адитивна сіль за пп. 9 або 10, яка відрізняється тим, що є енантіомером вим радикалом, що має від 3 до 6 атомів карбону; або є циклічним насиченим вуглеводневим ради(А)[( 2 ,4 )(А)], енантіомером (В)[( 2 ,4 )(А)] або калом, що має від 3 до 6 атомів карбону, приєднаїх сумішшю. них до прямого або розгалуженого насиченого 12. Сполука, яка розкладається in vivo з утворенвуглеводневого радикала, що має від 1 до 6 атоням сполуки за будь-яким з пп.1-11. мів карбону; де кожен атом карбону може бути 13. Застосування сполуки за будь-яким з пп.1-12 заміщеним, при потребі, галогеном, гідроксигрудля виробництва медикаментів для лікування запою, алкілоксигрупою або оксогрупою; хворювання, пов'язаного з гістаміновими H1- та галоген є замісником, вибраним з групи атомів H2-рецепторами. фтору, хлору, брому та йоду; 14. Застосування сполуки за будь-яким з пп.1-12 галоалкіл є прямим або розгалуженим насиченим для виробництва медикаментів для імуномодулявуглеводневим радикалом, що має від 1 до 6 атоції у ссавців, для приглушення підвищеної чутлимів карбону, або циклічним насиченим вуглеводвості та/або запальних реакцій, та для лікування 5 76803 6 та/або запобігання алергічним та шлунково21. Застосування сполуки за будь-яким з пп.16-20 для виробництва медикаментів, яке відрізняється кишковим хворобам. 15. Застосування сполуки за будь-яким з пп.1-12 тим, що зазначена сполука вибрана з групи антадля виробництва медикаментів для імуномодулягоністів гістамінового Н1-рецептора, антагоністів ції у ссавців, для приглушення підвищеної чутлигістамінового Н2-рецептора та антагоніста гістамівості та/або запальних реакцій, та для лікування нового рецептора з комбінованою Н1/Н2 антагонішлунково-кишкових станів. стичною активністю. 16. Застосування сполуки за будь-яким з пп.1-12 22. Застосування сполуки за п. 21 для виробництва медикаментів, яке відрізняється тим, що задля виробництва медикаментів для зниження внутрішньочерепного тиску (ІСР) у ссавців. значена сполука вибрана з групи астемізолу, аза17. Застосування сполуки за будь-яким з пп.1-12 тадину, азеластину, бромофеніраміну, для виробництва медикаментів для зниження підхлороциклізину, хлорофеніраміну, клемастину, вищеного внутрішньочерепного тиску (ІСР) та/або клемізолу, ципрогептадину, диметиндену, дифенвторинної ішемії у ссавців. гідраміну, дифенілпіраліну, гідроксизину, кетоті18. Застосування сполуки за будь-яким з пп.1-12 фену, лоратидину, ніапразину, оксатоміду, фенідля виробництва медикаментів для запобігання раміну, прометазину, піриламіну, ранітидину, підвищенню внутрішньочерепного тиску (ІСР) ритансерину, тіотидину, золантидину, їх похідних та/або вторинній ішемії у ссавців. та сумішей з будь-яких двох або більшої кількості 19. Застосування сполуки за будь-яким з пп.17-18 перелічених препаратів. для виробництва медикаментів, яке відрізняється 23. Застосування сполуки за п. 21 для виробництва медикаментів, яке відрізняється тим, що затим, що підвищення внутрішньочерепного тиску (ІСР) та/або вторинна ішемія у ссавців зумовлені значена сполука вибрана з групи хлороциклізину, травматичним (ТВІ) або нетравматичним ушкохлорофеніраміну, дифенгідраміну, кетотіфену, дженням мозку. лоратидину, ранітидину, тіотидину, золантидину, їх 20. Застосування сполуки за будь-яким з пп.13-19 похідних та сумішей з будь-яких двох або більшої для виробництва медикаментів, яке відрізняється кількості перелічених препаратів. тим, що зазначена сполука використовується внутрішньовенно. Даний винахід стосується нового антагоніста гістамінового рецептора та використання даного антагоніста гістамінового рецептора для зниження внутрішньочерепного тиску (ІСР), зокрема, для запобігання та лікування підвищеного внутрішньочерепного тиску та/або вторинної ішемії, зокрема, зумовленої черепно-мозковою травмою, більш конкретно, зумовленої травматичним (ТВІ) або нетравматичним ушкодженням мозку. ТВІ являє собою важливу проблему у розвинутих країнах. У США кожен рік приблизно 500000 травм голови є достатньо важкими, щоб потребувати госпіталізації. Смертність висока, і приблизно 80000 таких ТВІ-пацієнтів постають перед проблемою довічної втрати нормальної діяльності, у 5000 розвивається епілепсія і 2000 живуть у стійкому вегетативному стані. Сьогодні ТВІ є однією із головних причин смерті та інвалідності молодих людей, при витратах, що на 1989 рік складали, за оцінками, більше $25млрд/рік. Первинні необоротні порушення після черепно-мозкової травми включають крововилив, контузію, нейронний некроз та дифузну аксонну травму. Ці порушення, разом з можливою серцевосудинною та респіраторною депресією можуть викликати гострі вторинні ознаки, що включають набряк (вазогенний та/або клітинний), вторинну кровотечу, зміни об'єму мозкового кровообігу (CBV), порушену авторегуляцію мозкового кровотоку (CBF) та ішемію. Набряк, кровотеча та підвищення CBV призведе до зростання загального об'єму мозку і в результаті внутрішньочерепного тиску (ІСР). Це, у свою чергу, може призвести до подальшого прогресування ішемії, інфаркту та, у важких випадках, утворення грижі стовбура мозку з можливою гострою респіраторною депресією та смертю. Тому терапія ТВІ має бути спрямована на переривання зазначеного патологічного ланцюга та зниження об'єму мозку і ІСР. Запобігання загрозливому для життя вторинному підвищенню ІСР, котре часто виникає, наприклад, у посттравматичний період після гострої фази або після відновлення серцевої діяльності, також є мішенню для фармакологічного лікування. У теперішній час клінічні інструменти для ІСР обмежені. Стандартні схеми лікування включають хірургічний дренаж шлуночків, контроль кров'яного тиску, інфузію маніту, гіпервентиляцію та високодозову барбітуратну терапію. Побічні ефекти зазначеного нехірургічного лікування включають ішемію мозку, поворотні ефекти щодо ІСР та підвищений ризик бактеріального інфікування та сепсису. Крім того, різновид сполук з різними механізмами дії (наприклад, брадикініновий антагонізм, кальцієвий антагонізм, окисне інгібування стресу, блокада глутаматового рецептора та попередження епілепсії) випробувався у фазі II та III клінічних випробувань або ще випробується (наголос робиться на результатах, а не на ІСР). До цього часу не була затверджена жодна сполука для нагального лікування внутрішньочерепного тиску [К.К. Jain, Chapter 4 : Neuroprotection in Acute Trauma, 'Neuroprotection in CNS Disorders: Commercial Opportunities'. A Jain PharmaBiotech Report: 65-73, 2000]. Очевидно, є потреба у фармацевтичних препаратах та/або терапії для лікування підвище 7 76803 8 ного внутрішньочерепного тиску (ІСР) та/або втомають місце для антигістамінових препаратів. ринної ішемії, зокрема, зумовленої черепноОтже, метою даного винаходу є запровадженмозковою травмою, більш конкретно, травматичня похідних заміщеного тетрациклічного імідазолу ним ушкодженням мозку (ТВІ). для використання як гістамінового антагоніста, Автори даного винаходу знайшли, що похідні зокрема, як гістамінового Н1-антагоніста, більш заміщеного тетрациклічного імідазолу згідно з законкретно, як антагоніста, що виявляє як гістамін гальною формулою (І) виявляють активність як Н1-, так і Н2-антагоністичну активність, згідно з антагоністи гістамін Н1- та/або Н2-рецепторів. Крім загальною формулою (І) того, було показано, що дані сполуки особливо корисні для зниження внутрішньочерепного тиску (ІСР), зокрема, для запобігання та лікування підвищеного внутрішньочерепного тиску та/або вторинної ішемії, зокрема, зумовленої черепномозковою травмою, більш конкретно, зумовленої травматичним (ТВІ) та нетравматичним ушкодженням мозку. Крім того, автори винаходу знайшли, що сполуки, котрі виступають антагоністами гістамінних Н1- та/або Н2-рецепторів (що звичайно називаються антигістамінними засобами) є також корисними для зниження внутрішньочерепного тиску їх фармацевтично прийнятних кислих або ос(ІСР), зокрема, для запобігання та лікування підновних солей приєднання, стереохімічно ізомервищеного внутрішньочерепного тиску та/або втоних форм та N-оксидних форм, де: ринної ішемії, зокрема, зумовленої черепноm дорівнює 1 або 2; мозковою травмою, більш конкретно, зумовленої n дорівнює 0, 1 або 2; травматичним (ТВІ) та нетравматичним ушкоа, b, с являють собою, незалежно, простий чи дженням мозку. подвійний зв'язок; Характерним для всіх сполук є те, що вони X являє собою ковалентний зв'язок або біваздатні швидко знижувати внутрішньочерепний тиск лентний С1-6алкандііловий радикал, де одна або при уведенні у кров ссавця, зокрема, шляхом внубільше -СН2- груп може бути заміщена, при потретрішньовенного уведення. Корисним і дуже важлибі, -О-, -S-, -CO- або -NR7-; де: вим є те, що зазначені сполуки знижують ІСР і при R7 являє собою водень, алкіл, Аr, Аr-алкіл, Het, цьому у незначній мірі впливають на кров'яний Het-алкіл, гідроксиалкіл, алкілокси, алкілоксиалкіл, тиск або не впливають на нього, зокрема, ефект алкілоксиалкілоксиалкіл, аміноалкіл, моно- або зниження кров'яного тиску, що є найбільш бажадіалкіламіноалкіл, форміл, алкілкарбоніламіноалною властивістю потенційних ліків. кіл, алкілкарбонілоксиалкіл, алкілоксикарбоніл, До цього часу не розроблені антагоністи Н1алкілоксикарбонілалкіл, алкіламінокарбоніл, алкіта/або Н2 гістамінових рецепторів для зниження ламінокарбонілалкіл, гідроксиалкілоксиалкіл, аміІСР, зокрема, для посттравматичного зниження нокарбоніл, амінокарбонілалкіл, алкілоксикарбоніл ІСР. [Mohanty et al. у Journal of the Neurological або алкілкарбонілоксиалкілоксиалкіл; Sciences, 1989, 90:87-97] спостерігав, що гістамін Υ являє собою С1-4алкандііловий або відігравав певну роль у формуванні травматичного С2-4алкандііловий радикал; набряку мозку. Підвищений вміст води у мозку та Ζ є Ν, і в цьому випадку а являє собою подвійпідвищені рівні гістаміну у плазмі та мозку були ний зв'язок, і b являє собою простий зв'язок, або знижені за допомогою попереднього лікування N-R7, і в цьому випадку а являє собою простий антагоністом гістамінового Н2-рецептора циметизв'язок, b являє собою подвійний зв'язок, і R7 є дином. Проте, мейпірамін (антагоніст гістамін Н1такою, як визначено вище; рецептора) не давав ефекту щодо зниження підR1, R2 являють собою, незалежно, водень, гідвищеного вмісту води у мозку, і рівні гістаміну у рокси, алкіл, алкілокси, Аr, Аr-алкіл, ди(Аr-)алкіл, плазмі та мозку залишались високими. Вплив на Het або Het-алкіл; ІСР, зокрема, дія гістамінових антагоністів після -А-В- являє собою, незалежно, бівалентний підвищення ІСР для нагального зниження підвирадикал формули щеного ІСР, не вивчались, як не вивчався і вплив -E-CR8=CR8(а-1); на кров'яний тиск. -CR8=CR8-E(а-2); Як вважають автори даного винаходу, проте -CR8=CR8-CR8=CR8(а-3); не обмежуючись цим, з огляду на той факт, що де антагоністи гістамінового рецептора виявляють кожна R8 являє собою, незалежно, водень, газдатність знижувати нормальний ІСР за відсутносло, гідрокси, алкіл або алкілокси; ті мозкового набряку, та зважаючи на той факт, що Ε являє собою бівалентний радикал формули 7 7 антагоністи гістамінового рецептора не впливають -О-, -S- або -NR -, де R є такою, як визначено виабо впливають лише обмеженим чином на кров'яще; ний тиск, ефект, що приписувався периферичній -C-D- являє собою, незалежно, бівалентний вазодилятації, механізм їх дії відрізняється від радикал формули такого, що впливає лише на зниження мозкового -CR8=CR8-CR8=CR8(b-1); набряку або діє через вазодилятацію, ефекти, кот-N=CR8-CR8=CR8(b-2); рі, як відомо з попереднього досвіду у цій галузі, -CR8=N-CR8=CR8(b-3); 9 76803 10 -CR8=CR8-N=CR8(b-4); радикал, що має від 3 до 6 вуглецевих атомів; або -CR8=CR8-CR8=N(b-5); являє собою циклічний насичений вуглеводневий де R8 є такою, як визначено вище; радикал, що має від 3 до 6 вуглецевих атомів, R3 являє собою водень, гало, гідрокси, алкіл, приєднаних до прямого або розгалуженого насиалкілокси, Аr, Аr-алкіл, ди(Аr-)алкіл, Het або Hetченого вуглеводневого радикала, що має від 1 до алкіл; 6 вуглецевих атомів; де кожен вуглецевий атом R4 являє собою водень, алкіл, аміно, алкіл може бути заміщений, при потребі, гало, гідрокси, аміно, Аr-аміно, Het-аміно, алкілкарбоніламіно, Аrалкілокси або оксо. Краще, коли алкіл являє собою карбоніламіно, Het-карбоніламіно, алкіламінокарметил, етил або циклогексилметил. боніламіно, Аr-амінокарбоніламіно, HetУ межах даної заявки гало є замісником, що амінокарбоніламіно, алкілоксиалкіламіно, Аrвибирається із групи фторо, хлоро, бромо та йодо, оксиалкіламіно або Het-оксиалкіламіно; і галоалкіл являє собою прямий або розгалужений R5 являє собою водень або алкіл; насичений вуглеводневий радикал, що має від 1 або R4 та R5 можуть утворювати разом бівадо 6 вуглецевих атомів, або циклічний насичений лентний радикал формули вуглеводневий радикал, що має від 3 до 6 вугле-M-CR9=CR10(c-1); цевих атомів, де один або більше вуглецевих ато-CR10=CR9-M(c-2); мів заміщені одним або більше гало атомів. Кра-M-CR9R8-CR10R8(c-3); ще, коли гало являє собою фторо або хлоро, і -CR10R8-CR9R8-M(c-4); галоалкіл являє собою трифторометил. -CR8=N-NR7(c-5); Групою сполук, яким віддається перевага, є ті -NR7-N=CR8(c-6); сполуки формули (І), їх фармацевтично прийнятні -CR8=CR9-CR10=CR8(c-7); кислі або основні солі приєднання, стереохімічно -CR8R8-CR9R8-CR10R8-M(c-8); ізомерні форми та N-оксидні форми, у яких -M-CR10R8-CR9R8-CR8R8(c-9); -А-В- являє собою бівалентний радикал фор-CR8R8-CR8=N-NR7(c-10); мули (а-1) або (а-3), де Ε являє собою бівалентний -NR7-N=CR8-CR8R8(c-11); радикал формули -О-, -S-, або -NR7-, де R7 є водде нем, R8 є воднем, -C-D- являє собою бівалентний R7 та R8 є такими, як визначено вище; радикал формули (b-1) або (b-2), де R8 являє со9 10 R , R являють собою, незалежно, водень, бою водень, і Υ є бівалентним радикалом формуалкіл, гало, галоалкіл; ли -СН2-, -СН2-СН2- або -СН=СН-. або R9 та R10 можуть утворювати разом біваІншою групою сполук формули (І), яким віддалентний радикал формули ється перевага, є ті сполуки формули (І), їх фар8 8 8 8 -CR =CR -CR =CR -; та мацевтично прийнятні кислі або основні солі приєΜ являє собою бівалентний радикал формули днання, стереохімічно ізомерні форми та N-оксидні -СНг-, -О-, -S- або -NR7-, де R є такою, як визначеформи, у яких m та n дорівнюють 1. но вище. Іншою групою сполук формули (І), яким віддаУ межах даної заявки Аr являє собою гомоється перевага, є ті сполуки формули (І), їх фарцикл, котрий вибирається із групи нафтилу та фемацевтично прийнятні кислі або основні солі приєнілу, кожен із яких заміщений, при потребі, 1, 2 або днання, стереохімічно ізомерні форми та N-оксидні 3 замісниками, кожен замісник вибирається, незаформи, у яких кожна R1 та R2 являють собою, нележно, із групи гідрокси, гало, ціано, нітро, аміно, залежно, водень, алкіл, Аr-алкіл, Het або Het-алкіл. моно- або діалкіламіно, алкілу, галоалкілу, алкілоЩе однією групою сполук формули (І), яким кси, галоалкілокси, карбоксилу, алкілоксикарбонівіддається перевага, є ті сполуки формули (І), їх лу, амінокарбонілу та моно- або діалкіламінокарфармацевтично прийнятні кислі або основні солі бонілу. Краще, коли Аr являє собою нафтил або приєднання, стереохімічно ізомерні форми та Nфеніл, кожен із яких заміщений, при потребі, 1 заоксидні форми, у яких X являє собою бівалентний місником, кожен замісник вибирається, незалежно, радикал формули -СН2СН2- або -СН2СН2СН2-. із групи гало або алкілу. Ще однією групою сполук формули (І), яким У межах даної заявки Het являє собою моновіддається перевага, є ті сполуки формули (І), їх циклічний гетероцикл, що вибирається із групи фармацевтично прийнятні кислі або основні солі піролілу, піразолілу, імідазолілу, фуранілу, тіонілу, приєднання, стереохімічно ізомерні форми та Nоксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, оксидні форми, у яких R3 являє собою водень або піридинілу, піримідинілу, піразинілу та піридазиніалкіл, Ζ є N-R7, де R7 являє собою водень або аллу; або біциклічний гетероцикл, що вибирається із кіл, а являє собою простий зв'язок, і b являє собою групи хінолінілу, індолілу, бензімідазолілу, бензокподвійний зв'язок, і R4 та R5 утворюють разом бісазолілу, бензізоксазолілу, бензотіазолілу, бензівалентний радикал формули (с-1), (с-3), (с-5), (сзотіазолілу, бензофуранілу та бензотієнілу; кожен 7), (с-8) або (с-10), де R7 та R8 є воднями. моноциклічний та біциклічний гетероцикл може Ще однією групою сполук формули (І), яким бути заміщений, при потребі, по вуглецевому атовіддається перевага, є ті сполуки формули (І), їх му гало, гідрокси, алкілом або алкілокси. Краще, фармацевтично прийнятні кислі або основні солі коли Het являє собою піридиніл, піразиніл або інприєднання, стереохімічно ізомерні форми та Nдоліл. оксидні форми, у яких R3 являє собою водень або У межах даної заявки алкіл являє собою пряалкіл, Ζ є N-R7, де R7 являє собою водень або алмий або розгалужений насичений вуглеводневий кіл, а являє собою простий зв'язок, і b являє собою радикал, що має від 1 до 6 вуглецевих атомів; або подвійний зв'язок, і R4 та R5 утворюють разом біявляє собою циклічний насичений вуглеводневий валентний радикал формули (с-1), (с-3), (с-5), (с 11 76803 12 7), (с-8) або (с-10), де R та R8 є воднями, і R9 та (фенілметил)-1-піперидиніл]етил]-2,10R10 утворюють разом бівалентний радикал фордиметилпіримідо[1,2-а]бензімідазол-4(10Н)-он та мули -CR8=CR8-CR8=CR8-, де R8 є воднем. 3-[2-[4-(11,12-дигідро-6Н-бензімідазо[2,1Більш конкретно, найбільша перевага віддаb][3]бензазепін-6-іл)-2-(фенілметил)-1ється сполуці 3-[2-[4-(11,12-дигідро-6Нпіперидиніл]етил]-2,10-диметил піримідо[1,2бензімідазо[2,1-b][3]бензазепін-6-іл)-2а]бензімідазол-4(10Н)-он (Е)-2-бутендіоат (2:3) (фенілметил)-1-піперидиніл]етил]-2,10гідрат (1:1). диметилпіримідо[1,2-а]бензімідазол-4(10Н)-он, її Мається на думці, що N-оксидні форми сполук фармацевтично прийнятним кислим або основним згідно з формулою (І) включають ті сполуки форсолям приєднання, стереохімічно ізомерним формули (І), де один або кілька атомів азоту піддані мам та N-оксидним формам. окисненню до так званого N-оксиду, зокрема, ті NФармацевтично прийнятні кислі солі приєдоксиди, де один або більше атомів азоту піперинання, як мається на думці, включають терапевтидинілового радикалу у формулі (І) є N-окисненими. чно активні нетоксичні сольові форми, котрі здатні Вираз "стереохімічно ізомерні форми", що заутворювати сполуки формули (І). Зазначені кислі стосовується у даному тексті, визначає всі можлисолі приєднання можуть бути одержані шляхом ві ізомерні форми, котрі можуть мати сполуки фообробки основної форми сполук формули (І) відрмули (І). Якщо окремо не зазначено або не повідними кислотами, наприклад, неорганічними вказано, хімічне позначення сполук відповідає сукислотами, наприклад, галогеноводневою кисломіші всіх можливих стереохімічно ізомерних форм, тою, зокрема хлористоводневою кислотою, брозазначені суміші містять усі діастереомери та енамистоводневою кислотою, сірчаною кислотою, нтіомери базової молекулярної структури. Зокреазотною кислотою та фосфорною кислотою; оргама, стереогенні центри можуть мати R- або Sнічними кислотами, наприклад, оцтовою кислотою, конфігурацію; замісники на бівалентних циклічних гідроксиоцтовою кислотою, пропановою кислотою, (частково) насичених радикалах можуть мати цисмолочною кислотою, піровиноградною кислотою, або транс-конфігурацію. Сполуки, що мають пощавлевою кислотою, малоновою кислотою, буршдвійні зв'язки, можуть мати Ε або Z-стереохімію тиновою кислотою, малеїновою кислотою, фумапри зазначеному подвійному зв'язку. Очевидно, ровою кислотою, яблочною кислотою, винною кисщо стереохімічно ізомерні форми сполук формули лотою, лимонною кислотою, метансульфоновою (І) входять до обсягу даного винаходу. кислотою, етансульфоновою кислотою, бензолсуЗгідно з номенклатурною угодою СAS, коли у льфоновою кислотою, р-толуолсульфоновою кисмолекулі присутні два стереогенних центри з відолотою, цикламіновою кислотою, саліциловою кисмою абсолютною конфігурацією, символи R або S лотою, р-аміносаліциловою кислотою та памовою приписуються (згідно з правилом послідовності кислотою. Кана-Інгольда-Прелога) хіральному центру з найСполуки згідно з формулою (І), що містять кинижчим номером, базисному центру. Конфігурація слотні протони, можуть також бути перетворені у другого стереогенного центру позначається з висвої терапевтично активні нетоксичні основні солі користанням відносних символів [R*,R*] або приєднання шляхом обробки відповідними органі[R*,S*], де R* завжди визначається як базисний чними та неорганічними основами. Відповідні осцентр, і [R*,R*] відповідає центрам з тією самою новні сольові форми включають, наприклад, амохіральністю, a [R*,S*] відповідає центрам з відміннієві солі, солі лужних та лужноземельних металів, ною хіральністю. Наприклад, коли хіральний центр зокрема, літієві, натрієві, калієві, магнієві та кальз найнижчим номером у молекулі має S конфігуцієві солі, солі з органічними основами, наприклад, рацію, і другий центр є R-центром, стереосимвол бензатіном, N-метил-D-глюкаміном, гібрамінові буде позначатись як S-[R*,S*]. Коли використовусолі, та солі амінокислот, наприклад, аргініну та ються " " та " ": положення замісника з найвищим лізину. пріоритетом на асиметричному вуглецевому атомі Навпаки, зазначені кислотні або основні солі у кільцевій системі з найнижчим номером кільця приєднання можуть бути перетворені у вільні фозавжди довільно приймається як " " положення у рми шляхом обробки відповідною основою або середній площині, що визначається даною кільцекислотою. вою системою. Положення замісника з найвищим Вираз сіль приєднання, як застосовується у пріоритетом на іншому асиметричному вуглецемежах цієї заявки, також включає сольвати, котрі вому атомі у даній кільцевій системі відносно поздатні утворювати сполуки формули (І) та їх солі. ложення замісника з найвищим пріоритетом на Такими сольватами є, наприклад, гідрати та алкобазисному атомі позначається " ", якщо він знахоголяти. диться на тому самому боці середньої площини, Серед кислих солей приєднання найбільша що визначається даною кільцевою системою, або перевага віддається сполуці 3-[2-[4-(11,12-дигідро" ", якщо він знаходиться на другому боці серед6Н-бензімідазо[2,1-b][3]бензазепін-6-іл)-2ньої площини, що визначається даною кільцевою (фенілметил)-1-піперидиніл]етил]-2,10системою. диметилпіримідо[1,2-а]бензімідазол-4(10Н)-он (Е)Коли зв'язок у с є простим зв'язком, сполуки 2-бутендіоат (2:3) гідрат (1:1), що включає всі свої формули (І) та деякі з проміжних сполук мають стереоізомерні форми. принаймні два стереогенних центри у своїй струкОсоблива перевага віддається (Α)[(2 ,4 )(Α)] турі. Якщо R1 відрізняється від водню, моноцикліченантіомеру, (В)[(2 ,4 )(Α)] енантіомеру та їх суне N-кільце у формулі (І) має додатковий стереоміші, сполук 3-[2-[4-(11,12-дигідро-6Нгенний центр. Це може дати 8 стереохімічно бензімідазо[2,1-b][3]бензазепін-6-іл)-2відмінних структур. 13 76803 14 Сполуки формули (І), що отримані у процесах, CONRyRz, де Ry являє собою Н, С1-6алил, феніл описаних нижче, можуть бути синтезовані у формі або бензил, і Rz являє собою -ОН, Н, С1-6алкіл, рацемічних сумішей енантіомерів, котрі можуть феніл або бензил. бути відділені один від одного за допомогою відоСполуки згідно з даним винаходом, що мають мих у даній галузі процедур розділення. Рацемічні аміногрупу, можуть бути піддані реакції з кетоном сполуки формули (І) можуть бути перетворені у або альдегідом, таким як формальдегід, з утвовідповідні діастереомерні сольові форми шляхом ренням основи Маніха. Ця основа у водному розреакції з придатною хіральною кислотою. Зазначині гідролізується за реакцією першого порядку. чені діастереомерні сольові форми потім розділяСполуки згідно з формулою (І) можуть бути, ють, наприклад, за допомогою селективної або загалом, одержані за допомогою послідовності фракційної кристалізації, і енантіомери вивільнюреакційних стадій, кожна із яких відома фахівцеві у ють звідти лугом. Альтернативний метод роздіданій галузі. Способи одержання зазначених сполення енантіомерних форм сполук формули (І) лук розкриті у заявці, котра знаходиться на сумісвключає рідинну хроматографію з використанням ному розгляді, і на яку у даному тексті робиться хіральної стаціонарної фази. Зазначені чисті степосилання. реохімічно ізомерні форми можуть бути також Окрім використання для зниження ІСР, сполуодержані із відповідних чистих стереохімічно ізоки згідно з формулою (І) та їх похідні також корисні мерних форм відповідних вихідних матеріалів за для лікування інших захворювань з участю гістаумови, що дана реакція носить стереоспецифічний мінних Н1- та Н2 рецепторів, зокрема, для імунохарактер. Якщо потрібен специфічний стереоізомодуляції у ссавців, для приглушення підвищеної мер, то зазначена сполука може бути синтезована чутливості та/або запальних реакцій, для лікуванза допомогою стереоспецифічних способів одерня та запобігання алергічним хворобам, таким як жання, чому віддається перевага. У цих методах риніт, кропивниця, астма, анафілаксія і таке подібвигідно використовувати енантіомерно чисті вихідне, та для лікування шлунково-кишкових захворюні матеріали. вань, таких як виразки, диспепсія, різні рефлектоДеякі сполуки формули (І) можуть також існурні симптоми і таке подібне. Таким чином, даний вати у своїй таутомерній формі. Такі форми, хоча винахід також стосується використання антагонісвони й не зазначені у явному вигляді у вищенавета гістамінового рецептора згідно з формулою (І) деній формулі, як мається на думці, також вклюта його похідних для виробництва ліків для імуночені в обсяг даного винаходу. Наприклад, сполуки модуляції у ссавців, для пригнічення підвищеної формули (І), де R5 являє собою Н, можуть існувати чутливості та/або запальних реакцій, і для лікуу своїй відповідній таутомерій формі. вання та запобігання алергічним і шлунковоДаний винахід також включає похідні сполуки кишковим хворобам. (що звичайно називаються "проліки") фармаколоЩе одним аспектом даного винаходу є запрогічнно активних сполук згідно з даним винаходом, вадження нового використання антагоністів гістакотрі розкладаються in vivo з утворенням сполук мінового Н1- та/або Н2-рецепторів, зокрема, для згідно з даним винаходом. Проліки звичайно (але нагального зниження внутрішньочерепного тиску не завжди) мають меншу активність щодо мішені(ІСР), зокрема, при підвищеному ІСР, більш конкрецептора, ніж сполуки, до яких вони розкладаретно, критично підвищеного ІСР та/або запобіються. Проліки особливо корисні, коли потрібна гання підвищеному ІСР та вторинній ішемії, зумосполука має хімічні або фізичні властивості, що вленим черепно-мозковою травмою. Найбільша роблять її застосування важким або неефективперевага полягає у тому, що дані антагоністи гісним. Наприклад, потрібна сполука може бути лише тамінних Н1- та/або Н2-рецепторів не знижують малорозчинною, вона може погано транспортуваабо не підвищують, або мінімальним чином вплитись через слизовий епітелій, або може мати невають на кров'яний тиск. бажано короткий півперіод існування у плазмі. ДоЗгідно з даним винаходом, антагоністи гістадаткове обговорення питання щодо проліків [див. у мінних Н1- та/або Н2-рецепторів являють собою Stella, V.J. et al., "Prodrags", Drug Delivery Systems, або сполуки та їх похідні згідно з формулою (І), 1985, pp.112-176, та у Drugs, 1985, 29, pp.455-473]. або відомі антагоністи гістамінових Н1- та/або Н2Форми проліків фармакологічно активних спорецепторів, що є окремою та обмеженою групою лук згідно з даним винаходом загалом являють медикаментів, котрі визнані у даній галузі. собою сполуки згідно з формулою (І), їх фармацеДо цього часу антагоністи гістамінового Н1втично прийнятні кислі або основні солі приєднанрецептора звичайно використовуються для імуноня, стереохімічно ізомерні форми та N-оксидні модуляції у ссавців та для пригнічення підвищеної форми, що мають кислотну групу, котра є етерифічутливості та/або запальних реакцій. Зокрема, кованою або амідованою. У такі етерифіковані антагоніст гістамінового Н1-рецептора вибираєтькислотні групи включені групи формули -COORx, ся із групи акривастину, алімемазину, антазоліну, де Rx являє собою С1-6алкіл, феніл, бензил або астемізолу, азатадину, азеластину, бромофеніраодну із наступних груп: міну, буклізину, карбіноксаміну, каребастину, цетирізину, хлороциклізину, хлорофеніраміну, цинарізину, клемастину, клемізолу, клоцинізину, клонідину, циклізину, ципрогептадину, дескарбоетоксилоратидину, дексхлорофеніраміну, дименгідринату, диметиндену, диметотіазину, дифенгідраміну, дифенілпіраліну, доксиламіну, ебастину, ефлетрізину, епінастину, фексофенадіну, гідрокАмідовані групи включають групи формули 15 76803 16 сизіну, кетотіфену, левокабастину, лоратидіну, фармацевтично прийнятним носієм, котрий може меклізину, мекітазину, метаділазину, міансеріну, приймати широкий різновид форм у залежності від мізоластину, ніапразину, ноберастину, норастеміформи препарату, потрібного для введення. Зазолу, оксатоміду, оксомемазину, фенбензаміну, значені фармацевтичні композиції бажано мати в феніраміну, пікумасту, прометазину, піриламіну, унітарній лікарській формі, що придатна, зокрема, темеластину, терфенадіну, тримепразину, трипедля перорального введення або введення шляхом леннаміну та трипролідину, їх похідних та сумішей парентеральної ін'єкції. Наприклад, при приготуіз будь-яких двох або більше перелічених препаванні композицій для перорального введення моратів. жуть застосовуватись будь-які звичайні фармацеДо цього часу антагоністи гістамінового Н2втичні середовища, такі як, наприклад, вода, рецептора звичайно застосовуються для ссавців, гліколі, олії, спирти, і таке подібне, у випадку рідщо потерпають від деяких шлунково-кишкових ких препаратів перорального призначення, таких захворювань, таких як виразки, диспепсія, різні як суспензії, сиропи, еліксири, емульсії та розчини; рефлекторні симптоми, і таке подібне. Зокрема, або тверді носії, такі як крохмалі, цукри, каолін, антагоніст Н2-рецептора вибирається із групи рарозріджувачі, мастила, зв'язувальні речовини, дезнітидину, циметидину, фамотидину, нізатидину, інтегратори, і таке подібне, у випадку порошків, тіотидину, золантидину, їх похідних та сумішей із пілюль, капсул та таблеток. Завдяки легкості вжибудь-яких двох або більше перелічених препаравання, таблетки та капсули являють собою найтів. більш зручні оральні одиничні лікарські форми, в Крім того, антагоністи гістамінового рецептора яких очевидно використовуються тверді фармацеможуть виявляти антагоністичну активність як до втичні носії. Для парентеральних композицій дагістамінового Н1-, так і гістамінового Н2ний носій звичайно включає стерильну воду, прирецепторів, такі як ритансерин або сполуки згідно наймні у більшій своїй частині, хоча можуть бути з формулою (І), їх фармацевтично прийнятні кислі включені й інші інгредієнти, наприклад, для поліпабо основні солі приєднання, стереохімічно ізомешення розчинності. Розчини для ін'єкцій можуть рні форми та N-оксидні форми. готуватись, наприклад, таким чином, що носій Хоча усі сполуки виявляють помітне зниження включає сольовий розчин, розчин глюкози або ІСР, було показано, що наступні сполуки не знисуміш сольового розчину та розчину глюкози. Сужують або впливають лише у незначній мірі на спензії для ін'єкцій можуть готуватись таким чикров'яний тиск: кетотіфен, хлороциклізин, променом, що містять відповідні рідкі носії, агенти для тазин, піриламін, дифенілгідрамін, хлорофенірамін суспендування і таке подібне. Включені також прета золантадин. парати твердих форм, котрі, переводяться у преДля оцінки гістамінної антагоністичної активпарати рідкої форми безпосередньо перед вжиності сполук даного винаходу можуть бути застованням. совані in vitro дослідження з використанням відпоОсоблива перевага віддається складанню вивідних модельних рецепторних систем. щезазначених фармацевтичних композицій у стаДля оцінки біологічної активності сполук данондартній лікарській формі для легкості вживання го винаходу можуть бути застосовані in vivo досліта однорідності дозування. Стандартна лікарська дження. З цією метою була розроблена та викориформа в даній заявці стосується фізично дискретстана для тестування сполук даного винаходу них одиниць як уніфікованих лікарських форм, клінічно відповідна модель травматичного ушкокожна одиниця містить попередньо визначену кідження мозку у щурів (модель закритої травми лькість активного інгредієнта, що розрахована для голови) [К. Engelborghs et al., Temporal Changes in отримання бажаного терапевтичного ефекту, суміintracranial pressure in a modified experimental сно з потрібним фармацевтичним носієм. Приклаmodel of closed head injury, J. Neurosurg. 89: 796дами таких стандартних лікарських форм є табле806, 1998; K. van Rossem et al., Brain oxygenation тки (включаючи таблетки з покриттям), капсули, after experimental closed head injury, Adv. Exp. Med. пілюлі, порошкові упаковки, супозиторії, облатки, Biol., 471: 209-215, 1999; K. Engelborghs et al., розчини для ін'єкцій або суспензії і таке подібне, та Impaired autoregulation of cerebral blood flow in an кратні їх відокремлені порції. Найкраще, - для легexperimental model of traumatic brain injury, J. кості швидкого застосування - вищезазначену фаNeurotrauma, 17(8): 667-677, 2000]. В одному досрмацевтичну композицію складають як розчин для лідженні внутрішньочерепна гіпертензія у кролів ін'єкцій або перфузії, або як суспензію для ін'єкцій. була індукована шляхом кортикального охолоНаступні приклади слугують ілюстрацією данодження. го винаходу без будь-яких обмежень. Антагоніст гістамінового рецептора згідно з Експериментальна частина даним винаходом, що включає сполуки згідно з Для деяких сполук абсолютна стереохімічна формулою (І) та відомі у теперішній час антагонісконфігурація стереогенного вуглецевого атома (ів) ти гістамінового Н1-, Н2- та Н1/Н2-рецепторів, моекспериментально не визначалась. У таких випаджуть бути складені у різні фармацевтичні форми з ках та стереохімічно ізомерна форма, що виділяметою їх призначення пацієнтам. Як придатні комлась першою, позначається як "А" і друга як "В", позиції можна назвати всі композиції, що звичайно без додаткового посилання на фактичну стереохівикористовуються для систематичного введення мічну конфігурацію. Проте, зазначені "А" та "В" ліків. Для одержання фармацевтичних композицій ізомерні форми можуть бути однозначно ідентифіданого винаходу ефективна кількість конкретної ковані фахівцем у даній галузі з використанням сполуки, при потребі, у формі солі приєднання, як відомих у даній галузі методів, таких як, наприактивний інгредієнт комбінується у тонкій суміші з клад, рентгенівська дифракція. 17 76803 18 Наприклад, для сполуки піримідо[1,2(метоксиметилен)-1,2-біс(фенілметил)піперидин а]бензімідазол-4(10Н)-он, 3-[2-[4-(11,12-дигідроенантіомерної суміші (проміжна сполука 1) (100%). 6Н-бензімідазо[2,1-b][3]бензазепін-6-іл)-2b) Одержання проміжної сполуки 2 (фенілметил)-1-піперидиніл]етил]-2,10-диметил, 8 можливих стереохімічних ізомерних форм визначаються наступним чином: У попередньому та у подальшому викладах "DMF" визначається як Ν,Ν-диметилформамід, "DIPE" визначається як діізопропіловий ефір, "THF" визначається як тетрагідрофуран, "МВІК" визначається як метилізобутилкетон, "DIPA" визначається як діізопропіламін. А. Одержання проміжних сполук Приклад А1 а) Одержання проміжної сполуки 1 Використовувати сухий скляний посуд. Суміш (метоксиметил)трифенілфосфонійхлориду (0,35моль) у THF р.а.(молек. сита) (21) перемішувалась при -50°С під струменем N2. По краплях додавали BuLi, 2,5М/гексан (0,35моль), і дану суміш перемішували при -25°С протягом 30 хвилин. По краплях при температурі -25°С додавали розчин 1,2-біс(фенілметил)-4-піперидинону (0,35моль) у THF. Дану суміш витримували для нагрівання до кімнатної температури, потім перемішували при кімнатній температурі протягом ночі та розкладали водою. Органічний розчинник випарювали. Водний концентрат екстрагували СН2СІ2. Органічний шар відокремлювали, осушували (MgSO4), фільтрували, і розчинник випарювали. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3ОН 97,5/2,5). Чисті фракції збирали, і розчинник випарювали. Вихід: 121г 4 Суміш проміжної сполуки 1 (0,35моль) у THF (500мл) розмішували до повного розчинення. Додавали Н2О (900мл) і потім НСl р.а. 38% (100мл). Дану суміш перемішували та нагрівали із оберненим холодильником протягом 3 годин. Органічний розчинник випарювали. Водний концентрат підлуговували К2СО3 та екстрагували СН2СІ2. Органічний шар відокремлювали, осушували (MgSO4), фільтрували, і розчинник випарювали. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3ОН 97/3). Чисті фракції збирали, і розчинник випарювали. Вихід: 81г 1,2-біс(фенілметил)-4піперидинкарбоксальдегід енантіомерної суміші (проміжна сполука 2) (79%). с) Одержання проміжної сполуки 3 Суміш DIPA (0,33моль) у THF р.а. (попередньо осушеного на молек. ситах) (21) перемішували при -78°С під струменем N2. По краплях додавали BuLi, 2,5М/гексан (0,276моль). Дану суміш перемішували при -78°С протягом 15 хвилин. По краплях додавали розчин 1-(2-фенілетил)-1Нбензімідазолу (0,276моль) у THF. Дану суміш перемішували при -78 °С протягом 1 години. Додавали по краплях розчин проміжної сполуки 2 (0,276моль) у THF. Дану суміш перемішували при 78°С протягом 1 години, потім витримували для нагрівання до кімнатної температури, перемішували при кімнатній температурі протягом ночі та розкладали водою. Органічний розчинник випарювали. Водний концентрат екстрагували СН2СІ2. Органічний шар відокремлювали, осушували (MgSO4), фільтрували, і розчинник випарювали. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3ОН від 95/5 до 90/10). Чисті фракції збирали, і розчинник випарювали. Вихід: 113г -[1,2-біс(фенілметил)-4 19 піперидиніл]-1-(2-фенілетил)-1Н-бензімідазол-2метанолу (проміжна сполука 3) (79%). d) Одержання проміжної сполуки 4 Суміш проміжної сполуки 3 (0,22моль) у трифторометансульфоновій кислоті (750мл) перемішували при 110°С протягом 7 годин. Дану суміш охолоджували, виливали на лід, підлуговували NaOH 50% та екстрагували СН2СІ2. Органічний шар відокремлювали, осушували (MgSO4), фільтрували, і розчинник випарювали. Залишок кристалізували із CH3CN. Дану суміш фільтрували. Даний осад та фільтрат очищали окремо методом колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3ОН від 98,5/1,5 до 95/5). Чотири чисті фракції збирали, і їх розчинники випарювали. Залишки кристалізували із CH3CN. Осади відфільтровували та висушували. Вихід: 16г фракції 1 [(2 ,4 )(А)]-6-[1,2-біс(фенілметил)-4-піперидиніл]11,12-дигідро-6Н-бензімідазо[2,1-b][3]бензазепін (проміжна сполука 4) (14,6%), 19,5г фракції 2 [(2 ,4 )(Β)]-6-[1,2-біс(фенілметил)-4-піперидиніл]11,12-дигідро-6Н-бензімі дазо [2,1-b][3]бензазепін (17,8%), 8,66г фракції 3 [(2 ,4 )(А)]-6-[1,2біс(фенілметил)-4-піперидиніл]-11,12-дигідро-6Нбензімідазо[2,1-b][3]бензазепін (7,9%) та 7,74г фракції 4 [(2 ,4 )(В)]-6-[1,2-біс(феніл метил)-4піперидиніл]-11,12-дигідро-6Н-бензімідазо [2,1b][3]бензазепін (8,9%). e) Одержання проміжної сполуки 5 Суміш проміжної сполуки 4 (0,0305моль) у метанолі (150мл) піддавали гідруванню при 50°С протягом ночі з використанням Pd/C 10% (1г) як каталізатора. Після поглинання Н2 (1еквів.) каталізатор відфільтровували, і фільтрат випарювали. Залишок кристалізували із CH3CN. Осад відфільтровували та висушували. Вихід: 11,66г [(2 ,4 )(А)]11,12-дигідро-6-[2-(фенілметил)-4-піперидиніл]-6Нбензімідазо[2,1-b][3]бензазепін (проміжна сполука 5) (94%). Приклад А2 76803 20 а) Одержання проміжної сполуки 6 Використовувати сухий скляний посуд. Суміш DIPA (0,22моль) у THF р.а. (попередньо осушеного на молек. ситах) (1400мл) перемішували при -70°С під струменем N2. По краплях додавали BuLi 2,5M (0,185моль), і дану суміш перемішували при -70°С протягом 15 хвилин. 1-(фенілметил)-1Нбензімідазол (0,185моль), розчинений у THF, додавали по краплях при -70°С, і дану суміш перемішували при -70°С протягом 1 години. При температурі -70°С додавали по краплях проміжну сполуку 2 (0,185моль), розчинену у THF. Дану суміш перемішували при -70°С протягом 1 години, потім повільно доводили до кімнатної температури, перемішували при кімнатній температурі протягом ночі і розкладали водою. Органічний розчинник випарювали. Водний концентрат екстрагували СН2СІ2. Органічний шар відокремлювали, осушували (MgSO4), фільтрували, і розчинник випарювали. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3ОН 95/5). Чисті фракції збирали, і розчинник випарювали. Вихід: 91г проміжної сполуки 6 (98%). b) Одержання проміжної сполуки 7 Суміш проміжної сполуки 6 (0,18моль) у трифторометансульфоновій кислоті (700мл) перемішували при 120°С під струменем N2 протягом 18 годин. Дану суміш охолоджували, виливали на лід, підлуговували NaOH 50% та екстрагували СН2СІ2. Органічний шар відокремлювали, осушували (MgSO4), фільтрували, і розчинник випарювали. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: СН2СІ2/(СН3ОН/NН3) 99/1). Чисті фракції збирали, і розчинник випарю 21 вали. Вихід: 40г проміжної сполуки 7 (46%). с) Одержання проміжної сполуки 8 та одержання проміжної сполуки 9 Суміш проміжної сполуки 7 (0,081моль) у метанолі (200мл) піддавали гідруванню при 50°С з використанням Pd/C 10% (2г) як каталізатора. Після поглинання Н2 (1еквів.) даний каталізатор відфільтровували, і фільтрат випарювали. Дану фракцію очищали методом колонкової хроматографії на силікагелі (елюент: СН2СІ2/(СН3ОН/NН3) 97/3). Дві чисті фракції збирали, і їх розчинники випарювали. Вихід: Фракція 1 та 12,5г проміжної сполуки 9 (цис ізомери) (36%). Фракцію 1 кристалізували із CH3CN. Осад відфільтровували та висушували. Вихід: 4,44г проміжної сполуки 8 (14%) ([(2 ,4 )(Α)]-рацемат. Приклад A3 а) Одержання проміжної сполуки 10 Суміш DIPA (0,1моль) у THF (100мл) перемішували під струменем N2. Дану суміш охолоджували до -70°С, і порціями додавали BuLi, 2,5М/гексан (40мл). При перемішуванні протягом 10 хвилин температура суміші досягала -30°С. 76803 22 Дану суміш охолоджували до -70°С. При зазначеній температурі по краплях додавали розчин 1(фенілетил)-1Н-бензімідазолу (0,1моль) у THF (50мл), і дану суміш перемішували протягом 2 годин при -70°С. По краплях додавали етил 4форміл-1-піперидинкарбоксилат (0,1моль), і дану суміш перемішували протягом 30 хвилин при 70°С. Температуру даної суміші доводили до кімнатної, і перемішування продовжували протягом 30 хвилин. Дану суміш розкладали водою, потім випарювали. Залишок розмішували у воді, і цю суміш екстрагували СН2СІ2. Органічний шар відокремлювали, висушували, фільтрували, і розчинник випарювали. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3ОН 98/2). Чисті фракції збирали, і розчинник випарювали. Вихід: 38г етил 4-[гідрокси[1(2-фенілетил)-1Н-бензімідазол-2-іл]метил]-1піперидинкарбоксилату (проміжна сполука 10). b) Одержання проміжної сполуки 11 Суміш проміжної сполуки 10 (0,011моль) та МnО2 (15г) у СН2СІ2 (150мл) перемішували протягом ночі при кімнатній температурі. МnО2 відфільтровували через дикаліт. Дану реакцію повторювали з використанням ідентичних кількостей. Дану суміш перемішували протягом ночі, МnО2 відфільтровували через дикаліт. Фільтрат випарювали. Вихід: 4,5г етил 4-[[1-(2-фенілетил)-1Нбензімідазол-2-іл]карбоніл]-1піперидинкарбоксилату (проміжна сполука 11). c) Одержання проміжної сполуки 12 Суміш проміжної сполуки 11 (0,011моль) та НВr, 48% водн. (25мл) перемішували протягом 10 годин при 80°С. Розчинник випарювали. Залишок перемішували у киплячому 2-пропанолі, охолоджували, і утворений в результаті осад відфільтровували та висушували. Пробу (1г) ре кристалізували із етанолу. Кристали відфільтровували та висушували. Вихід: 0,5г [1-(2-фенілетил)-1Нбензімідазол-2-іл](4-піперидиніл)метанон дигідроброміду (проміжна сполука 12) (Тпл. 261,9°С). d) Одержання проміжної сполуки 13 23 Трифторометансульфонову кислоту (150мл) перемішували під струменем N2. Порціями додавали проміжну сполуку 12 (0,1моль), і утворену в результаті реакційну суміш перемішували протягом 20 годин при 100°С (струмінь N2). Реакційну суміш охолоджували, виливали на лід (1кг), і утворену в результаті суміш нейтралізували NaOH 50% при перемішуванні та охолодженні. Дану суміш екстрагували СН2СІ2. В результаті утворився осад. Органічний шар відокремлювали. Осад відфільтровували та рекристалізували із CH3CN. Кристали відфільтровували та знову піддавали рекристалізації із CH3CN. Одержані кристали відфільтровували та висушували. Вихід: 3,0г 11,12дигідро-6-(4-піперидиніліден)-6Н-бензімідазо[2,1b][3]бензазепін.трифторометансульфонату (2:3). Відокремлений органічний розчин об'єднували з маточними шарами, висушували, фільтрували, і розчинник випарювали. Залишок (37г) розчиняли у суміші вода/етанол, підлуговували 50% NaOH та екстрагували СН2СІ2. Відокремлений органічний шар осушували (MgSO4), фільтрували, і розчинник випарювали. Залишок розмішували у 2-пропанон/ DIPЕ, потім відфільтровували та висушували. Вихід: 16,2г 11,12-дигідро-6-(4-піперидиніліден)-6Нбензімідазо[2,1-b][3]бензазепіну (проміжна сполука 13) (Тпл. 180,3°С). Приклад А4 а) Одержання проміжної сполуки 14 Використовувати сухий скляний посуд. Суміш DIPA (1,1моль) у THF р.а. (попередньо осушеного на молек.ситах) (3000мл) перемішували при -78°С під струменем N2. По краплях при -70°С додавали BuLi 1,5М у гексані (1,05моль), і дану суміш перемішували при -70°С протягом 20 хвилин. По краплях при -78°С додавали 1-(фенілетил)-1Нбензімідазол (1моль), розчинений у THF, і дану суміш перемішували при -78°С протягом 1 години. По краплях при -70°С додавали 4-етил 1-(1,1диметил)1,4-піперидиндикарбоксилат (1,1моль), розчинений у THF. Дану суміш перемішували при 78°С протягом 1 години, потім доводили до кімнатної температури, перемішували при кімнатній температурі паротягом ночі та розкладали Н2О. Органічний розчинник випарювали. Водний конце 76803 24 нтрат екстрагували СН2СІ2. Органічний шар відокремлювали, осушували (MgSO4), фільтрували, і розчинник випарювали. Залишок кристалізували із CH3CN. Осад відфільтровували та висушували. Вихід: 350г проміжної сполуки 14 (81%). b) Одержання проміжної сполуки 15 Реакцію проводять під атмосферою N2. Метилмагнійхлорид (0,0165моль; 8,2мл, 2,0M/THF) додавали по краплях до розчину проміжної сполуки 14 (0,0150моль) у THF (90мл), перемішували при кімнатній температурі. Утворену в результаті реакційну суміш перемішували протягом 2 годин. Додавали воду. Органічний розчинник випарювали, і водний концентрат екстрагували СН2СІ2. Відокремлений органічний шар висушували, фільтрували, і розчинник випарювали. Залишок (6г) піддавали кристалізації із CH3CN. Осад відфільтровували та висушували. Вихід: 4,3г проміжної сполуки 15 (64%). с) Одержання проміжної сполуки 16 Суміш проміжної сполуки 15 (0,0076моль) у трифторометансульфоновій кислоті (29мл) перемішували протягом 48 годин при кімнатній температурі. Дану реакційну суміш виливали у воду. Дану суміш підлуговували К2СО3. Водний шар екстрагували СН2СІ2. Відокремлений органічний шар висушували, фільтрували, і розчинник випарювали. Залишок очищали методом колонкової хроматографії з короткою відкритою трубкою на силікагелі (елюент: СН2СІ2/(СН3OН/NH3) 90/10). Чисті фракції збирали, і розчинник випарювали. Вихід: 2г проміжної сполуки 16 (79%). Приклад А5 а) Одержання проміжної сполуки 17 25 76803 26 Реакцію проводять під атмосферою N2. До росилікагелі (елюент: СН2СІ2 /CH3CN від 97/3 до зчину проміжної сполуки 14 (0,0400моль) у THF 94/6). Дві фракції збирали, і розчинник випарюва(200мл) додавали фенілмагнійхлорид ли. Залишок другої фракції кристалізували із (0,0440моль), перемішували при кімнатній темпеDIPE/CH3CN. Отримані кристали відфільтровували ратурі. Утворену в результаті реакційну суміш пета висушували. Вихід: 7,0г (1,1-диметилетил) (Z)-4ремішували протягом 1 години. Додавали воду. [[1-(2-фенілетеніл)-1Н-бензімідазол-2-іл]карбоніл]Органічний розчинник випарювали, і водний кон1-піперидинкарбоксилату (41%) (проміжна сполука центрат екстрагували СН2СІ2. Відокремлений ор19) (Тпл. 155,8°С). ганічний шар висушували, фільтрували, і розчинb) Одержання проміжної сполуки 20 ник випарювали. Цей залишок поєднували з аналогічно одержаним матеріалом, і всю речовину (20г) кристалізували із CH3CN. Осад відфільтровували та висушували. Вихід: 20г проміжної сполуки 17 (98%). b) Одержання проміжної сполуки 18 Суміш проміжної сполуки 17 (0,0360моль) у трифторометансульфоновій кислоті (120мл) перемішували протягом 24 годин при температурі, що підвищувалась від 0°С до кімнатної температури. Дану реакційну суміш виливали у воду. Суміш підлуговували NaOH 50%, потім екстрагували СН2СІ2. Відокремлений органічний шар висушували, фільтрували, і розчинник випарювали, залишок кристалізували із CH3CN, відфільтровували, потім очищали методом колонкової хроматографії з короткою відкритою трубкою на силікагелі (елюент: СН2СІ2 /(CH3OH/NH3) 90/10). Чисті фракції збирали, і розчинник випарювали. Вихід: 11г проміжної сполуки 18 (78%) (Тпл. 270,7°С). Приклад А6 а) Одержання проміжної сполуки 19 Суміш 1-(2-фенілетеніл)-1Н-бензімідазолу (0,04моль) у THF (100мл) розмішували під струменем N2 та охолоджували до -70°С. По краплях при -70°С додавали BuLi, 2,5М/гексан (0,04моль), і перемішування продовжували протягом 30 хвилин при -70°С. По краплях додавали розчин 4-етил 1(1,1-диметилетил)-1,4-піперидиндикарбоксилату (0,04моль) у THF, і дану суміш перемішували протягом 1 години при -70°С. Суміш витримували до нагрівання до кімнатної температури і потім розкладали водою, потім екстрагували СН2СІ2. Відокремлений органічний шар осушували (MgSO4), фільтрувалі, і розчинник випарювали. Залишок очищали методом колонкової хроматографії на Суміш проміжної сполуки 19 (0,043моль) у трифторооцтовій кислоті (130мл) розмішували протягом ½ години при кімнатній температурі. Реакційну суміш виливали у діетиловий ефір. Осад відфільтровували, промивали діетиловим ефіром та висушували. Вихід: 18г (Z)-[1-(2-фенілетеніл)1Н-бензімідазол-2-іл] (4піперидиніл)метанон.трифтороацетату (1:1) (проміжна сполука 20) (94,0%) (Тпл. 202,2°С). c) Одержання проміжної сполуки 21 Суміш проміжної сполуки 20 (0,0276моль), АIСI3 (0,187моль) та NaCl (0,187моль) перемішували протягом 1 години при 150°С (розплав). Дана реакційна суміш розкладалась у суміші льоду, води та NaOH 50%. Суміш екстрагували дихлорометаном, і органічний шар відокремлювали, висушували, фільтрували та випарювали. Залишок (4,3г) очищали на скляному фільтрі на силікагелі (елюент: СН2СІ2 /(СН3ОН/NH3) 90/10). Чисті фракції збирали, і розчинник випарювали. Залишок перетворювали у сіль (Е)-2-бутендикислоти (2:3) в етанолі. Отриману сіль відфільтровували та висушували. Вихід: 1,8г 6-(4-піперидиніліден)-6Нбензімідазо[2,1-b][3]бензазепін.(Е)-2-бутендіоату (2:3) (13,4%) (проміжна сполука 21) (Тпл. 229,4°С). Приклад А7 a) Одержання проміжної сполуки 22 Суміш 2-амін-1Н-бензімідазолу (0,04моль), 3ацетилдигідро-2(3Н)-фуранону (0,53моль) та 4 27 76803 28 метилбензолсульфонової кислоти (4г) у ксилемі нагрівали зі зворотним холодильником протягом 4 (930мл) перемішували та нагрівали зі зворотним годин, і потім охолоджували. Додавали Н2О. Дану холодильником протягом ночі і потім охолоджувасуміш підлуговували К2СО3 та розділяли на два ли. Осад відфільтровували та розмішували у Н2О шари. Водний шар екстрагували СН2СІ2. Об'єдна(200мл), Na2СО3 (5г) та СН2СІ2 (500мл). Даний ний органічний шар осушували (MgSO4), фільтруосад відфільтровували, кип'ятили у СН3ОН, відфівали, і розчинник випарювали. Залишок кристалільтровували та висушували. Вихід: 47,4г 3-(2зували із CH3CN. Осад відфільтровували та гідроксиетил)-2-метил-піримідо[1,2-а]бензімідазолвисушували. Вихід: 3,44г проміжної сполуки 24. 4(10Н)-ону (проміжна сполука 22). В. Одержання кінцевих сполук Приклад В1 b) Одержання проміжної сполуки 23 Одержання сполуки 1 Суміш проміжної сполуки 22 (0,025моль) та К2СО3 р.а. (0,03моль) у DMF (70мл) перемішували при 50°С. По краплях додавали метилйодид (0,03моль). Дану суміш перемішували при 50°С протягом 4 годин та охолоджували. Розчинник випарювали. Залишок кип'ятили у СН3ОН. Осад відфільтровували та висушували. Залишок очищали методом високоефективної рідинної хроматографії на силікагелі (елюент: СН2СІ2/(СН3ОН/NН3) 97/3). Дві чисті фракції збирали, і їх розчинники випарювали. Вихід: 2,08г 3-(2гідроксиетил)-2,10-диметил-піримідо[1,2а]бензімідазол-4(10Н)-ону (проміжна сполука 23). c) Одержання проміжної сполуки 24 Суміш проміжної сполуки 23 (0,02моль) та SOCI2 (0,06моль) у СН3СІ (50мл) перемішували та та одержання сполуки 2 29 76803 30 31 76803 32 33 76803 34 35 76803 36 37 76803 38 той самий спосіб, що й активність гістамінового Н1-антагоніста, з використанням клітин смугастого тіла морських свинок та [125І] APT як радіоліганду у концентрації 0,1нМ. Інкубування проводилось протягом 150 хвилин при 22°С. Усі сполуки згідно з даним винаходом виявляли величину plC50 5 або більше для активності гістаміннонго Н1-антагоніста. Деякі сполуки виявляли значення plC50 6 або більше для активності гістамінового Н1-антагоніста. Ці сполуки перелічені у Таблиці 9. Крім того, спостерігали, що наявний у продажу типовий гістамінний Н1-антагоніст (дифенгідрамін) виявляє лише трохи вищу активність гістамінового Н1-антагоніста, ніж основна кількість сполук згідно з даним винаходом. Крім того, показано, що наявний у продажу Н2-антагоніст (ранітидин та циметидин) виявляє гістамінні Н2активності у межах (помірно високих) Н2активностей сполук згідно з даним винаходом. Деякі зі сполук, перелічених у Таблиці 9, включаючи наявні у продажу сполуки, випробувались також у in vivo експериментах щодо їх здатності знижувати ІСР. Таблиця 9 Результати скринінгу активності гістамінового Н1та Н2-антагоністів у рецепторній моделі № спол. С. Фармакологічні приклади СІ. In vitro визначення активності гістамінних Н1- та Н2-антгоністів Дослідження щодо зв'язування радіолігандного рецептора проводились in vitro для вибраних сполук з використанням препарату тканини, що була збагачена специфічним рецептором, тобто гістамінним Н1- або Н2-рецептором. Для гістамінового Н1-рецептора використана тканина являла собою СНО-клітини, що постійно піддавались трансфекції гістамінним Н1-рецептором людини. Відносно клітин кори із головного мозку морських свинок випробувався лише дифенгідрамін. Конкурентне інгібування [3Н] піриламіну (pyrilamine) випробуваними сполуками проводилось шляхом інкубування радіоліганду низької концентрації (нМ) з невеликою пробою препарату тканини (0,2-5мл; 15мг тканини) у буферному середовищі та при різних концентраціях сполук, розчинених у DMSO, з охопленням діапазону, що складає принаймні 4 порядки величини відносно значення pIC50, одержаного із кривої інгібування. Активність гістамінового Н2-антагоніста випробувалась практично у 14 94 104 46 110 1 (випробувався також in vivo) 6 23 78 81 82 50 55 87 12 13 15 (випробувався також in vivo) 45 (випробувався також in vivo) 48 49 53 54 83 88 20 32 (випробувався також in vivo) Активність Н1- Активність Н2антагоніста антагоніста (plC50) (plC50) 7,6 7,0 7,0 6,9 6,9 6,7 6,7 6,7 6,7 6,7 6,7 6,6 6,6 6,6 6,5 6,5 6,5 6,5 6,5 6,5 6,5 6,5 6,5 6,5 6,4 6,4 6,0 39 76803 40 гом кількох днів. Стан важкої травми голови використовувався для оцінки фармакологічних ефектів 47 (випробувався 6,4 зразу ж після травми (процедура скринінгу). Коли також in vivo) передбачалось виживання та пробудження від 57 6,4 анестезії, застосовувалась помірна травма голови. 58 6,4 У фармакологічних дослідженнях були також заді105 6,4 яні тварини з патологічним ІСР у межах від 12,5 до 29 6,3 35мм Hg. Зміни ІСР, середнього артеріального 51 6,3 кров'яного тиску (МАВР) та тиску церебральної 84 6,3 перфузії СРР (=МАВР-СРР) були виражені як від17 (випробувався соток від первинного значення на початку ліку6,2 також in vivo) вання. 27 6,2 Процедура скринінгу для сполук згідно з даним 37 6,2 винаходом 2 (випробувався На тижневому базисі порівнювали 4 групи з 3 6,1 також in vivo) щурів, що піддавались лікуванню, з 3 тваринами, 30 (випробувався яким уводився сольовий розчин. Оскільки звичайні 6,1 також in vivo) статистичні методи потребують більшу кількість 35 6,1 тварин, застосовувалась послідовна процедура. Послідовні методи діють на різних стадіях. На ко56 6,1 жній стадії групу тварин вибирали якомога більш 89 6,1 однорідною. Тварин розподіляли у випадковий 90 6,1 спосіб щодо введення ліків або щодо використан9 (випробувався 6,0 ня сольового розчину. Дана процедура дозволяла також in vivo) приймати рішення відносно відхилення даних ліків, 31 6,0 прийняття даних ліків як активних або продовжен41 6,0 ня з новою групою тварин на наступній стадії. При 44 (випробувався 6,0 даному біологічному відповідному рівні активності, також in vivo) що має визначатись, очікувана частка хибних по102 6,0 зитивних та негативних результатів була відомою Ранітидин (випрота фіксувалась. Був застосований послідовний, з бувався також in 5,5 подвійною вибіркою групований ранговий критерій. vivo) Оптимальною виявилась тристадійна послідовна Циметидин 5,9 схема з відносно невеликою кількістю тварин на Дифенгідрамін кожній стадії. Незважаючи на мінливість окремих (випробувався 7,2 даних, зазначена процедура постійно приймала також in vivo) еталонні ліки, такі як маніт, як активні, і в той самий час контрольні препарати відхиляла. Клінічно С.2. In vivo фармакологія відповідні внутрішньовенні дози маніту (3г протяМодель закритої травми голови (СНІ) гом 45 хвилин) постійно знижували ІСР (середнє Для випробування сполук згідно з даним виназниження близько 20%). ходом та сполук, що є наявними у продажу, була використана клінічно відповідна модель травматиТаблиця 10 чного ушкодження мозку у щурів. Ця модель імітує кілька клінічних особливостей травматичного Результати процедури скринінгу ушкодження мозку, таких як підвищений ІСР, знижений тиск церебральної перфузії, морфологічні Лікування(1) Дельта %(2) Рішення(3) зміни, включаючи дифузну аксонну травму, нейСполука 9 -12,4 активний ронний некроз та контузію, порушення авторегуСполука 15 -23,3 активний ляції мозкового кровотоку та зниження оксигенації Сполука 17 -8,9 активний мозку, і застосовувалась для скринінгу ліків з ІСРСполука 30 -9,3 активний знижувальними ефектами. Травма індукувалась у Сполука 32 -13,9 активний інтубованих, анестезованих ізофлураном (1,5% Сполука 44 -14,8 активний ізофлурану у суміші 30% О2 та 70% N2O) щурів Сполука 45 -13,1 активний (Sprague-Dawley) (380-400г), що були розміщені у Сполука 47 -12,0 активний стереотаксичний спосіб на столі, котрий поміщавCD10% 5Д неактивний ся на чотирьох пружинах. Стальний циліндр вагою CD10%+3H2T 10,0 неактивний 400г, захищений 9 мм силіконовим диском, скидаCD20% 19,1 неактивний вся на незахищений череп з висоти 70 або 50см CD2O%+HCI 2,4 неактивний 1 (відповідно, 'важка' та 'помірна' травма голови). Маніт -21,7 активний Ділянка удару була розташована поміж брегмою Маніт2 -22,1 активний та ламбдою. ІСР записували з використанням мікМаніт3 -13,0 активний росенсорного зонда Кодмена (Codman), уведеного Маніт4 -19,3 активний у тім'яну частину кори. Як при важкій, так і при поМаніт5 -19,9 активний мірній травмі голови ІСР підвищувався зразу після нанесення травми і залишався підвищеним протя 41 76803 (1) Експериментальні сполуки вводились у вигляді болюсу 1мг/кг протягом 1 хвилини з наступною інфузією 0,5мг/кг/хвилину протягом 44 хвилин; розчинники вводились як 0,4мл болюс протягом 1 хвилини з наступною інфузією 0,2мл/хвилину протягом 44 хвилин; маніт уводили шляхом інфузії 67мг/кг/хвилину протягом 45 хвилин. (2) Дельта%: середнє відхилення відносного ІСР від базисної лінії протягом періоду лікування. (3) Рішення: базується на послідовній статистичній оцінці. CD = гідроксипропіл- -циклодекстриновий ро 42 зчинник Н2Т = виннокислотний розчинник Маніт1-5: Маніт оцінювали 5 разів в окремих випробуваннях (позитивний контроль). Наведені результати кожного випробування. Додаткові дослідження У Таблиці 11 наведені варіації деяких відповідних фізіологічних змінних, що записувались підчас лікування після важкої СНІ у щурів. Лікування розпочиналось через 20 хвилин після нанесення важкої травми голови і включало введення дози 0,5мг/кг/хвилину протягом 10 хвилин з наступним уведенням 0,1мг/кг/хвилину протягом 50 хвилин. Таблиця 11 Варіації відповідних фізіологічних змінних підчас лікування після важкої СНІ у щурів Розчинник (n=10) ІСР (%) МАВР (%) СРР (%) ЕТСО2 (%) Част. серц. скорочень (%) Част, дихан. (%) Сполука 2 (n=10) Сполука 1 (n=10) 1,6(-9,4;11,1) -1,2(-2,7;3,7) -1,3(-8,0;5,8) 8,0(-1,2;12,9) -2,7(-5,4;3,9) 3,6(-4,3;11,8) -15,3(-20,0;-9,5)* 18,8(-2,0;31,0)* 24,2(0,9;43,6)* -4,4(-8,9;2,3)* -9,6(-21,8;0,7) 6,6(-1,3;14,6) -15,4(-22,6;-11,5)* -3,6(-11,9;-1,5) -1,9(-8,9;0,4) 2,2(-0,8;8,4) -4,1(-11,4;1,9) 5,3(-3,3;13,6) Рацемат (спол.1 та спол.2) (n=10) -19,1(-24,9;-10,8)* 0,6(-5,1;8,5) 7,5(-2,4;15,5) 2,4(-7,8;3,8) 5,6(-11,7;0,4) 9,6(3,0;14,8) Середня варіація по всьому періоду лікування, виражена як % зміни первинного значення. Наведені величини є медіанними (95% довірчий інтервал). * = Суттєво відрізняється від групи розчинника (р
ДивитисяДодаткова інформація
Назва патенту англійськоюAntihistamine agents and use thereof for sharp reduction of elevated intracranial pressure
Автори англійськоюJanssens, Frans, Eduard, Leenaerts Joseph Elisabeth, Bartolome-Nebreda, Jose, Manuel
Назва патенту російськоюАнтигистаминовые средства и их применение для резкого снижения повышенного внутричерепного давления
Автори російськоюЯнссенс Франс Эдуард, Леенартс Йозеф Элизабет
МПК / Мітки
МПК: A61P 29/00, C07D 519/00, A61K 31/519, A61K 31/513, A61P 37/06, A61K 31/55, C07D 471/00, A61P 37/08, A61P 37/02, C07D 487/04, A61P 9/10, A61K 31/517, C07D 471/04, A61P 1/04, C07D 487/00
Мітки: засоби, внутрішньочерепного, застосування, антигістамінові, зниження, різкого, тиску, підвищеного
Код посилання
<a href="https://ua.patents.su/24-76803-antigistaminovi-zasobi-ta-kh-zastosuvannya-dlya-rizkogo-znizhennya-pidvishhenogo-vnutrishnocherepnogo-tisku.html" target="_blank" rel="follow" title="База патентів України">Антигістамінові засоби та їх застосування для різкого зниження підвищеного внутрішньочерепного тиску</a>
Попередній патент: Фармацевтичний препарат водорозчинних проліків пропофолу на водній основі (варіанти)
Наступний патент: З’єднання теплоподавальних труб
Випадковий патент: Безрефлекторна іч-сушарка природної рослинної сировини












