Похідні піролідинію, спосіб їх одержання (варіанти), проміжна сполука (варіанти), фармацевтична композиція, комбінований продукт
Номер патенту: 79283
Опубліковано: 11.06.2007
Формула / Реферат
1. Сполука формули (І):
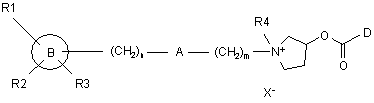 , (І)
, (І)
де
В означає феніл, нафталініл, 5,6,7,8-тетрагідронафталініл, бензо[1,3]діоксоліл або біфеніл, або 5-10-членну гетероароматичну групу, яка містить один або декілька гетероатомів, вибраних з азоту, кисню або сірки;
R1, R2 й R3 означають кожен незалежно водень або атом галоїду, або гідроксил, феніл, -OR5, -SR5, -NR5R6, -NHCOR5, -CONR5R6, -CN, -NO2, -COOR5 або -СF3, або необов'язково заміщену нижчу алкільну групу із прямим або розгалуженим ланцюгом;
або R1 й R2 разом утворюють ароматичне або аліциклічне кільце або гетероциклічну групу;
R5 й R6 означають кожен незалежно атом водню, необов'язково заміщений нижчий алкіл із прямим або розгалуженим ланцюгом, або разом утворюють аліциклічне кільце;
n означає ціле число від 0 до 4;
А означає групу, вибрану з –CH2-, -CH=CR7-, -CR7=CH-, -CR7R8-, -CO-, -O-, -S-, -S(O)-, -S(O)2- і –NR7-, де R7 й R8 означають кожен незалежно атом водню, необов'язково заміщений нижчий алкіл із прямим або розгалуженим ланцюгом, або разом утворюють аліциклічне кільце;
m означає ціле число від 0 до 8;
R4 означає нижчий алкіл;
D означає групу формули і) або іі)
і) 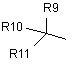 , іі)
, іі)  ,
,
де
R9 означає групу, вибрану з фенілу, 2-фурилу, 3-фурилу, 2-тієнілу або 3-тієнілу;
R10 означає групу, вибрану з фенілу, 2-фурилу, 3-фурилу, 2-тієнілу, 3-тієнілу або (С3-С7)циклоалкілу;
і R11 означає атом водню або гідроксил, метил або групу –СН2ОН;
циклічні групи, представлені R9 й R10, є необов'язково заміщеними одним або двома замісниками, вибраними з галогену, необов'язково заміщеного нижчого алкілу із прямим або розгалуженим ланцюгом, гідроксилу, необов'язково заміщеної (нижч.)алкоксигрупи, нітрогрупи, ціангрупи, -CO2R12 або –NR12R13, де R12 й R13 є однаковими або різними й вибираються з водню або необов'язково заміщених нижчих алкілів із прямим або розгалуженим ланцюгом;
Q означає простий зв'язок або групу –СН2-, -СН2-СН2-, -О-, -O-CH2-, -S-, -S-СН2- або -СН=СН-;
X- представляє фармацевтично прийнятний аніон одно- або багатоосновної кислоти;
включаючи всі окремі стереоізомери і їх суміші;
за умови, що в тих сполуках, де В означає феніл, R9 є незаміщеним фенілом, R10 є незаміщеним фенілом або незаміщеним (С3-С7)-циклоалкілом, R11 означає водень або гідроксил, послідовність -(CH2)n-A-(CH2)m- не представляє метилен, етилен або пропілен.
2. Сполука за п. 1, де В означає феніл, піроліл, тієніл, фурил, біфеніл, нафталініл, 5,6,7,8-тетрагідронафталініл, бензо[1,3]діоксоліл, імідазоліл або бензотіазоліл.
3. Сполука за п. 2, де В означає феніл, тієніл або піроліл.
4. Сполука за будь-яким з попередніх пунктів, де R1, R2 й R3 означають кожен незалежно водень або атом галоїду, або гідроксил, метил, трет-бутил, -СН2ОН, 3-гідроксипропіл, -ОМе, -NМe2, -NHCOMe, -СОNН2, -CN, -NO2, -СООМе або –СF3.
5. Сполука за п. 4, де R1, R2 й R3 означають кожен незалежно водень, фтор, хлор або гідроксил.
6. Сполука за будь-яким з попередніх пунктів, де n = 0 або 1; m означає ціле число від 1 до 6 й А означає –СН2-, -СН=СН-, -CO-, -NMe-, -О- або -S-.
7. Сполука за п. 6, де А означає –СН2-, -СН=СН- або -O-.
8. Сполука за п. 6, де піролідинієва група заміщена за атомом азоту (С1-С4)алкільною групою й іншою групою, вибраною з 3-феноксипропілу, 2-феноксіетилу, 3-фенілалілу, фенетилу, 3-фенілпропілу, 3-(3-гідроксифенокси)пропілу, 3-(4-фторфенокси)пропілу, 3-тієн-2-ілпропілу, 4-оксо-4-тієн-2-ілбутилу, 2-бензилоксіетилу, 3-о-толілоксипропілу, 3-(3-ціанфенокси)пропілу, 3-(метилфеніламіно)пропілу, 3-фенілсульфанілпропілу, 4-оксо-4-фенілбутилу, 4-(4-фторфеніл)-4-оксобутилу, 3-(2-хлорфенокси)пропілу, 3-(2,4-дифторфенокси)пропілу, 3-(4-метоксифенокси)пропілу, 3-(бензо[1,3]діоксол-5-ілокси)пропілу.
9. Сполука за п. 8, де піролідинієва група заміщена за атомом азоту (С1-С4)алкільною групою й іншою групою, вибраною з 3-феноксипропілу, 2-феноксіетилу, 3-фенілалілу, фенетилу, 3-фенілпропілу, 3-(3-гідроксифенокси)пропілу, 3-(4-фторфенокси)пропілу, 4-(4-фторфеніл)-4-оксобутилу або 3-тієн-2-ілпропілу.
10. Сполука за будь-яким з попередніх пунктів, де D є групою формули і) і де R9 є групою, вибраною з фенілу, 2-тієнілу або 2-фурилу; R10 є групою, вибраною з фенілу, 2-тієнілу, циклогексилу або циклопентилу, і R11 є гідроксильною групою.
11. Сполука за будь-яким з пп. 1-9, де D є групою формули іі) і де Q означає простий зв'язок або атом кисню й R11 означає атом водню або гідроксильну групу.
12. Сполука за будь-яким з попередніх пунктів, де X- означає хлорид, бромід, трифторацетат або метансульфонат.
13. Сполука за будь-яким з попередніх пунктів, де при атомі вуглецю в положенні 3 піролідинієвого кільця є R-конфігурація.
14. Сполука за будь-яким з пп. 1-12, де при атомі вуглецю в положенні 3 піролідинієвого кільця є S-конфігурація.
15. Сполука за будь-яким з пп. 1-10 й 12-14, де D є групою формули і) і при атомі вуглецю, заміщеному R9, R10 й R11, спостерігається R-конфігурація.
16. Сполука за будь-яким з пп. 1-10 й 12-14, де D є групою формули і) і при атомі вуглецю, заміщеному R9, R10 й R11, спостерігаєтьсяS-конфігурація.
17. Сполука за будь-яким з попередніх пунктів, яка представляє один ізомер.
18. Сполука за п. 1, яка означає одну з перерахованих сполук:
трифторацетат 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-фенетилпіролідинію;
3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)піролідинійбромід;
3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-тієн-2-ілпропіл)піролідинійбромід;
3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-феноксипропіл)піролідинійбромід;
трифторацетат 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілаліл)піролідинію;
трифторацетат 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(4-оксо-4-тієн-2-ілбутил)піролідинію;
трифторацетат 1-[4-(4-фторфеніл)-4-оксобутил]-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метилпіролідинію;
трифторацетат 1-етил-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-[3-(3-гідроксифенокси)пропіл]піролідинію;
трифторацетат 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-пірол-1-ілпропіл)піролідинію;
трифторацетат 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-[6-(4-фенілбутокси)гексил]піролідинію;
трифторацетат 1-(2-бензилоксіетил)-3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метилпіролідинію;
трифторацетат 1-[3-(3-ціанфенокси)пропіл]-3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метилпіролідинію;
трифторацетат 3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метил-1-[3-(нафталін-1-ілокси)пропіл]піролідинію;
трифторацетат 3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метил-1-[3-(метилфеніламіно)пропіл]піролідинію;
трифторацетат 3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-етил-1-(3-фенілсульфанілпропіл)піролідинію;
трифторацетат 1-[3-(бензотіазол-2-ілокси)пропіл]-3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метилпіролідинію;
3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-метил-1-(3-феноксипропіл)-піролідинійбромід;
трифторацетат 3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-метил-1-[3-(2,4,6-триметилфенокси)пропіл]піролідинію;
трифторацетат 1-[3-(2-хлорфенокси)пропіл]-3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-метилпіролідинію;
трифторацетат 3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-метил-1-[3-(3-трифторметилфенокси)пропіл]піролідинію;
трифторацетат 1-[3-(біфеніл-4-ілокси)пропіл]-3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-метилпіролідинію;
трифторацетат 3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-[3-(2,4-дифторфенокси)пропіл]-1-метилпіролідинію;
трифторацетат 3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-етил-1-[3-(4-метоксифенокси)пропіл]піролідинію;
трифторацетат 3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-метил-1-[3-(5,6,7,8-тетрагідронафталін-2-ілокси)пропіл]піролідинію;
трифторацетат 3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-метил-1-[3-(1-метил-1Н-імідазол-2-ілсульфаніл)пропіл]піролідинію;
1-метил-1-фенетил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинійбромід;
1-метил-1-(3-феноксипропіл)-3-(9Н-ксантен-9-ілкарбонілокси)піролідинійбромід;
трифторацетат 1-[3-(бензо[1,3]діоксол-5-ілокси)пропіл]-1-метил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинію;
трифторацетат 1-[3-(2-карбамоїлфенокси)пропіл]-1-метил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинію;
трифторацетат 1-[3-(3-диметиламінофенокси)пропіл]-1-метил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинію;
трифторацетат 1-[3-(4-ацетиламінофенокси)пропіл]-1-метил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинію;
трифторацетат 1-[3-(4-метоксикарбонілфенокси)пропіл]-1-метил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинію;
трифторацетат 1-метил-1-[3-(4-нітрофенокси)пропіл]-3-(9Н-ксантен-9-ілкарбонілокси)піролідинію;
трифторацетат 1-[3-(4-гідроксиметилфенокси)пропіл]-1-метил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинію;
форміат 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-[3-(3-гідроксифенокси)пропіл]-1-метилпіролідинію;
1-[3-(4-фторфенокси)пропіл]-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метилпіролідинійхлорид;
3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілпропіл)піролідинійбромід;
1-метил-1-(3-о-толілоксипропіл)-3-[(9Н-ксантен-9-ілкарбоніл)окси]піролідинійбромід;
форміат 3-{[(9-гідрокси-9Н-флуорен-9-іл)карбоніл]окси}-1-метил-1-(4-оксо-4-фенілбутил)піролідинію;
3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-етил-1-(3-фенілсульфанілпропіл)піролідинійбромід.
19. Сполука за п. 1, яка означає одну з перерахованих сполук:
(3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-фенетилпіролідинійбромід;
(3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-фенетилпіролідинійбромід;
(3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)піролідинійбромід;
(3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)піролідинійбромід;
(3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-тієн-2-ілпропіл)піролідинійбромід;
(3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-феноксипропіл)піролідинійбромід;
(3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-феноксипропіл)піролідинійбромід;
трифторацетат (3R)-3-[(2R)-2-циклогексил-2-фур-2-ил-2-гідроксіацетокси]-1-етил-1-(3-фенілсульфанілпропіл)піролідинію;
трифторацетат (3S)-3-[(2R)-2-циклогексил-2-фур-2-ил-2-гідроксіацетокси]-1-етил-1-(3-фенілсульфанілпропіл)піролідинію;
(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-(3-феноксипропіл)піролідинійбромід;
(3S)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-(3-феноксипропіл)піролідинійбромід;
(3R)-3-[(2S)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-(3-феноксипропіл)піролідинійбромід;
(3S)-3-[(2S)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-(3-феноксипропіл)піролідинійбромід;
(3R)-1-метил-1-фенетил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинійбромід;
(3S)-1-метил-1-фенетил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинійбромід;
форміат (3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-[3-(3-гідроксифенокси)пропіл]-1-метилпіролідинію;
форміат (3R)-3-{[(9-гідрокси-9Н-флуорен-9-іл)карбоніл]окси}-1-метил-1-(4-оксо-4-фенілбутил)піролідинію;
(3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(4-оксо-4-тієн-2-ілбутил)-піролідинійхлорид;
форміат (3R)-1-[4-(4-фторфеніл)-4-оксобутил]-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метилпіролідинію;
форміат (3R)-1-[3-(3-ціанофенокси)пропіл]-3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метилпіролідинію;
форміат (3R)-3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метил-1-[3-(нафталін-1-ілокси)пропіл]піролідинію;
(3R)-3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метил-1-[3-(метилфеніламіно)пропіл]піролідинійхлорид;
(3R)-1-[3-(бензотіазол-2-ілокси)пропіл]-3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метилпіролідинійхлорид;
(3R)-1-[3-(біфеніл-4-ілокси)пропіл]-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метилпіролідинійхлорид;
(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-[3-(5,6,7,8-тетрагідронафталін-2-ілокси)пропіл]піролідинійбромід;
(3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-[3-(1-метил-1Н-імідазол-2-ілсульфаніл)пропіл]піролідинійхлорид;
(3R)-1-[3-(2-хлорфенокси)пропіл]-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метилпіролідинійхлорид;
3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-етил-1-[3-(4-метоксифенокси)пропіл]піролідинійбромід;
(3R)-1-(2-бензилоксіетил)-3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метилпіролідинійбромід.
20. Сполука за п. 1, яка означає одну з перерахованих сполук:
(1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-фенетилпіролідинійбромід (діастереомер 1);
(1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-фенетилпіролідинійбромід (діастереомер 2);
(1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)піролідинійбромід (діастереомер 1);
(1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)піролідинійбромід (діастереомер 2);
(1*,3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)піролідинійбромід (діастереомер 1);
(1*,3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)піролідинійбромід (діастереомер 2);
(1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-феноксипропіл)піролідинійбромід (діастереомер 1);
(1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-феноксипропіл)піролідинійбромід (діастереомер 2);
(1*,3S)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-(3-феноксипропіл)піролідинійбромід (діастереомер 1);
(1*,3S)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-(3-феноксипропіл)піролідинійбромід (діастереомер 2);
(1*,3R)-1-метил-1-фенетил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинійбромід (діастереомер 1);
(1*,3R)-1-метил-1-фенетил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинійбромід (діастереомер 2);
(1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілаліл)піролідинійбромід (діастереомер 1);
(1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілаліл)піролідинійбромід (діастереомер 2);
(1*,3R)-1-[4-(4-фторфеніл)-4-оксобутил]-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метилпіролідинійхлорид (діастереомер 1);
(1*,3S)-1-[3-(4-фторфенокси)пропіл]-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метилпіролідинійхлорид (діастереомер 1);
(1*,3S)-1-[3-(4-фторфенокси)пропіл]-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метилпіролідинійхлорид (діастереомер 2);
(1*,3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілпропіл)піролідинійбромід (діастереомер 1);
(1*,3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3 -фенілпропіл)піролідинійбромід (діастереомер 2);
(1*,3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-(3-феноксипропіл)піролідинійбромід (діастереомер 1);
(1*,3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-(3-феноксипропіл)піролідинійбромід (діастереомер 2);
(1*,3R)-1-[3-(бензо[1,3]діоксол-5-ілокси)пропіл]-1-метил-3-[(9Н-ксантен-9-ілкарбоніл)окси]піролідинійбромід (діастереомер 1);
(1*,3R)-1-[3-(бензо[1,3]діоксол-5-ілокси)пропіл]-1-метил-3-[(9Н-ксантен-9-ілкарбоніл)окси]піролідинійбромід (діастереомер 2);
(1*,3S)-1-метил-1-(3-о-толілоксипропіл)-3-[(9Н-ксантен-9-ілкарбоніл)окси]піролідинійбромід (діастереомер 1);
(1*,3S)-1-метил-1-(3-о-толілоксипропіл)-3-[(9Н-ксантен-9-ілкарбоніл)окси]піролідинійбромід (діастереомер 2);
(1*,3R)-1-[3-(біфеніл-4-ілокси)пропіл]-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метилпіролідинійхлорид (діастереомер 1);
(1*,3R)-1-[3-(біфеніл-4-ілокси)пропіл]-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метилпіролідинійхлорид (діастереомер 2);
(1*,3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-[3-(5,6,7,8-тетрагідронафталін-2-ілокси)пропіл]піролідинійбромід (діастереомер 1);
(1*,3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-[3-(5,6,7,8-тетрагідронафталін-2-ілокси)пропіл]піролідинійбромід (діастереомер 2).
21. Спосіб одержання сполуки формули (І), як визначено в будь-якому з попередніх пунктів, який включає взаємодію алкілувального агента формули R4-W із проміжною сполукою формули (II)
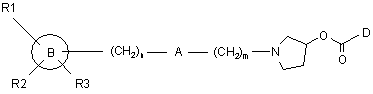 , (II)
, (II)
де m, n, А, В, D, R1, R2, R3 й R4 є такими, як визначено в п. 1, і W є будь-якою придатною групою, яка вилучається.
22. Спосіб за п. 21, за яким сполуку формули (II) одержують при реакції сполуки формули (V)
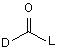 , (V)
, (V)
де D є таким, як визначено в п. 1, і L є групою, яка вилучається, зі сполукою формули (VI)
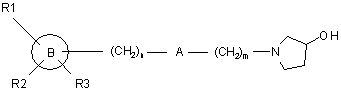 , (VI)
, (VI)
де m, n, А, В, D, R1, R2 й R3 є такими, як визначено в п. 1.
23. Сполука формули (II), яка означає одну з перерахованих сполук:
(3R)-1-(2-феноксіетил)піролідин-3-іловий ефір 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти;
(3R)-1-(3-феноксипропіл)піролідин-3-іловий ефір 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти;
(3R)-1-(3-тієн-2-ілпропіл)піролідин-3-іловий ефір 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти;
(3R)-1-фенетилпіролідин-3-іловий ефір 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти.
24. Сполука формули (VI), яка означає
(3R)-1-(3-феноксипропіл)піролідин-3-ол (3R)-1-(3-тієн-2-ілпропіл)піролідин-3-ол.
25. Спосіб одержання сполуки формули (І), як визначено в будь-якому з попередніх пунктів, який включає взаємодію алкілувального агента формули (IV)
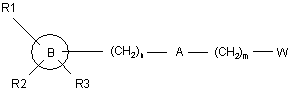 , (IV)
, (IV)
де m, n, А, В, D, R1, R2 й R3 є такими, як визначено в п. 1, і W означає будь-яку придатну групу, яка вилучається, із проміжною сполукою формули (III)
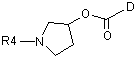 , (III)
, (III)
де R4 й D є такими, як визначено в п. 1.
26. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-20 у суміші з фармацевтичнo прийнятним носієм або розріджувачем.
27. Сполука за будь-яким з пп. 1-20 для лікування патологічного стану або захворювання, що піддається поліпшенню при дії антагоністів мускаринових рецепторів М3.
28. Застосування сполуки за будь-яким з пп. 1-20 для приготування лікарського засобу для лікування патологічного стану або захворювання, що піддається поліпшенню при дії антагоністів мускаринових рецепторів М3.
29. Застосування за п. 28, коли патологічним станом є респіраторне, урологічне або шлунково-кишкове захворювання або порушення.
30. Спосіб лікування суб'єкта, ураженого патологічним станом або захворюванням, що піддається поліпшенню при дії антагоністів мускаринових рецепторів М3, який включає введення згаданому суб'єктові ефективної кількості сполуки, охарактеризованої в будь-якому з пп. 1-20.
31. Спосіб за п. 30, коли патологічним станом є респіраторне, урологічне або шлунково-кишкове захворювання або порушення.
32. Комбінований продукт, який містить
(і) сполуку за будь-яким з пп. 1-20 й
(іі) іншу сполуку, ефективну при лікуванні респіраторного, урологічного або шлунково-кишкового захворювання або порушення, для одночасного, окремого або послідовного застосування.
33. Комбінований продукт за п. 32, який містить (і) сполуку за будь-яким з пп. 1-20 й
(іі) ![]() -агоніст, стероїд, протиалергічний лікарський засіб, інгібітор фосфодіестерази IV та/або антагоніст лейкотриєну D4 (LTD4) для одночасного, окремого або послідовного застосування при лікуванні респіраторного захворювання.
-агоніст, стероїд, протиалергічний лікарський засіб, інгібітор фосфодіестерази IV та/або антагоніст лейкотриєну D4 (LTD4) для одночасного, окремого або послідовного застосування при лікуванні респіраторного захворювання.
Текст
Даний винахід стосується нових, використовуваних у терапевтичних цілях, похідних піролідинію, деяких способів їх одержання та фармацевтичних композицій, які містять їх. Нові структури відповідно до винаходу є антимускариновими засобами ефективної й тривалої дії. Зокрема, ці сполуки проявляють високу спорідненість до мускаринових рецепторів М3. Цей підтип мускаринового рецептора присутній у залозах і гладеньких м'язах й опосередковує збуджувальні впливи парасимпатичної системи на залозисту секрецію й на скорочення гладеньких м'язів внутрішніх органів [Розділ 6, "Холінергічна передача", у книзі Н.Р. Rang й ін., Pharmacology, Churchill Livingstone, Нью-Йорк, 1995]. Внаслідок цього відомо, що антагоністи МЗ корисні для лікування захворювань, які характеризуються підвищеним парасимпатичним тонусом, надлишковою залозистою секрецією або скороченням гладеньких м'язів [R.M. Eglen й S.S. Hegde, (1997), Drug News Perspect, 10(8): 462-469]. Прикладами такого тину захворювань є респіраторні порушення, як, наприклад, хронічне обструктивне захворювання легень (COPD), бронхіт, підвищена реактивність бронхів, астма, кашель і риніт; урологічні порушення, як, наприклад, нетримання сечі, полакіурія, нейрогенний або нестабільний сечовий міхур, цистоспазм і хронічний цистит; шлунково-кишкові розлади, як, наприклад, синдром подразненої товстої кишки, спастичний коліт, дивертикуліт і виразка шлунка; і серцево-судинні порушення, як, наприклад, індукована блукаючим нервом синусова брадикардія [Глава 7, "Агоністи й антагоністи мускаринових рецепторів", у книзі Goodman й Gilman "The Pharmacological Basis of Therapeutics", 10-е видання, McGraw Hill, Нью-Йорк, 2001]. Сполуки за винаходом можуть бути застосовані окремо або в сполученні з іншими лікарськими засобами, які вважаються ефективними при лікуванні подібних захворювань. Наприклад, вони можуть бути застосовані в комбінації з β2-агоністами, стероїдами, протиалергічними лікарськими засобами, інгібіторами фосфодіестерази IV та/або антагоністами лейкотриєну D4 (LTD4) для одночасного, окремого або послідовного використання при лікування респіраторного захворювання. Нові похідні піролідинію за винаходом характеризуються хімічною структурою формули (І): (I) де В означає феніл, нафталініл, 5,6,7,8-тетрагідронафталініл, бензо[1,3]діоксоліл або біфеніл, або 5-10членну гетероароматичну гр упу, яка містить один або декілька, наприклад, 1, 2, 3 або 4 гетероатоми, вибраних з азоту, кисню або сірки; R1, R2 й R3 означають кожен незалежно водень або атом галоїду, або гідроксил, феніл,-OR5,-SR5,-NR5R6,NHCOR5,-CONR5R6,-CN,-NO2,-COOR 5 або-CF3, або необов'язково заміщену нижчу алкільну груп у із прямим або розгалуженим ланцюгом; або R1 й R2 разом утворюють ароматичне або аліциклічне кільце, або гетероциклічну гр упу; R5 й R6 означають кожен незалежно атом водню, необов'язково заміщений нижчий алкіл із прямим або розгалуженим ланцюгом або разом утворюють аліциклічне кільце; n означає ціле число від 0 до 4; А означає групу, вибрану з-СН2-,-CH=CR7-,-CR7=CH-,-CR7R8-,-CO-,-О-,-S-,-S(O)-,-S(O) 2- і –NR7-, де R7 й R8 означають кожен незалежно атом водню, необов'язково заміщений нижчий алкіл із прямим або розгалуженим ланцюгом або разом утворюють аліциклічне кільце; m означає ціле число від 0 до 8; R4 означає нижчий алкіл; D означає групу формули і) або іі) де R9 означає групу, вибрану з фенілу, 2-фурилу, 3-фурилу, 2-тієнілу або 3-тієнілу; R 10 означає групу, вибрану з фенілу, 2-фурилу, 3-фурилу, 2-тієнілу, 3-тієнілу або (С3-С7)циклоалкілу; і R11 означає атом водню або гідроксил, метил, або групу-СН 2ОН; циклічні групи, представлені R9 й R10, є необов'язково заміщеними одним або декількома замісниками, вибраними з галогену, необов'язково заміщеного нижчого алкілу із прямим або розгалуженим ланцюгом, гідроксилу, необов'язково заміщеної (нижч.) алкоксигрупи, нітрогрупи, ціангрупи,-CO2R12 або –NR12R13, де R12 й R13 є однаковими або різними й вибираються з водню або необов'язково заміщених нижчих алкілів із прямим або розгалуженим ланцюгом; Q означає простий зв'язок або групу-СН 2-,-СН2-СН2-,-О-,-О-СН2-,-S-,-S-СН2- або-СН=СН-; X- представляє фармацевтично прийнятний аніон одно- або багато основної кислоти; включаючи всі індивідуальні стереоізомери і їх суміші, за умови, що в тих сполуках, де В означає феніл, R9 є незаміщеним фенілом, R10 є незаміщеним фенілом або незаміщеним (С3-С7)-циклоалкілом, R11 означає водень або гідроксил, послідовність-(CH2)n-A-(CH2) m- не представляє метилен, етилен або пропілен. Іншими об'єктами даного винаходу є забезпечення способів одержання згаданих сполук; фармацевтичні композиції, які включають ефективну кількість згаданих сполук; застосування сполук для приготування лікарського засобу для лікування захворювань, які піддаються поліпшенню при дії антагоністів мускаринових рецепторів М3; і способи лікування захворювань, які піддаються поліпшенню при дії антагоністів мускаринових рецепторів М3, такі способи включають введення сполук за винаходом суб'єктові при необхідності лікування. Деякі складні ефіри 3-піролідинолу, включаючи деякі похідні піролідинію, які не охоплюються обсягом даного винаходу, були розкриті [в патенті US 2956062]. У четвертинних амонієвих сполуках за даним винаходом, представлених формулою (І), еквівалент аніона (X-) зв'язується з позитивним зарядом атома азоту. X' може бути аніоном різних мінеральних кислот, як, наприклад, хлорид, бромід, йодид, сульфат, нітрат, фосфат, або аніоном органічної кислоти, як, наприклад, форміат, ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, аніон мигдалевої кислоти, трифторацетат, метансульфонат і п-тодуол-сульфонат. X- переважно є аніоном, вибраним із хлориду, броміду, йодиду, сульфа ту, нітрату, форміату, ацетату, малеату, оксалату, сукцинату або трифторацетату. Більш переважно X- означає хлорид, бромід, трифторацетат, форміат або метансульфонат і ще більш переважно означає хлорид, бромід, трифторацетат або метансульфонат. Як використовується в контексті, алкільна група може мати прямий або розгалужений ланцюг і звичайно є нижчим алкілом. Нижчий алкіл містить від 1 до 8, переважно від 1 до 6 і більш переважно від 1 до 4 атомів вуглецю. Особливо переважно така алкільна група означає метил, етил, пропіл, включаючи ізопропіл, або бутил, включаючи н-бутил, втор-бутил і трет-бутил. Необов'язково заміщені нижчі алкільні групи, згадані тут, включають алкільні групи, які містять від 1 до 8, переважно від 1 до 6, більш переважно від 1 до 4 атомів вуглецю, як згадано вище, які можуть бути незаміщеними або можуть бути заміщені в будь-якому положенні одним або декількома замісниками, наприклад, 1, 2 або 3 замісниками. Коли присутні два або декілька замісники, замісники можуть бути однаковими або різними. Замісником(ами) звичайно є атоми галогену, переважно атоми фтору, і гідроксильні групи або алкоксигрупи. Алкоксигрупи, згадані тут, звичайно є (нижч.) алкоксигрупами, це групи, які містять від 1 до 8, переважно від 1 до 6 і більш переважно від 1 до 4 атомів вуглецю, з розгалуженим або прямим вуглеводневим ланцюгом і необов'язково заміщені за будь-яким положенням одним або декількома замісниками, наприклад, 1, 2 або 3 замісниками. Коли присутні два або декілька замісників, замісники можуть бути однаковими або різними. Звичайно замісником(ами) є атоми галогену, найбільш переважно атоми фтору. Переважні необов'язково заміщені алкоксигрупи включають метокси-, етокси-, н-пропокси-, ізопропокси-, н-бутокси-, втор-бутокси-, третбутокси-, трифторметокси- і дифторметоксигрупу. Циклоалкільні групи й аліциклічні групи, згадані тут, якщо не вказано інакше, звичайно містять від 3 до 8 вуглецевих атомів, переважно від 3 до 6 вуглецевих атомів. Циклоалкільні групи й аліциклічні кільця, які містять від 3 до 6 атомів вуглецю, включають циклопропіл, циклобутил, циклопентил і циклогексил. Циклоалкільні групи, які містять від 3 до 7 атомів вуглецю, включають циклоалкільні групи з 3-6 атомами вуглецю й циклогептил. Як використовується в контексті, ароматичне кільце або група звичайно містить від 5 до 14, переважно від 5 до 10 атомів вуглецю. Приклади ароматичних груп включають феніл і нафталініл. Гетероциклічна або гетероароматична група, згадана тут, звичайно є 5-10-членною групою, наприклад, 5-, 6- або 7-членною групою, яка містить один або декілька гетероатомів, вибраних з азоту, сірки й кисню. Звичайно присутні 1, 2, З або 4 гетероатоми, переважно 1 або 2 гетероатоми. Гетероциклічна або гетероароматична група може представляти одне кільце або два або декілька конденсованих кілець, де, як мінімум, одне кільце містить гетероатом. Приклади гетероциклічних гр уп включають піперидил, піролідил, піперазиніл, морфолініл, тіоморфолініл, піроліл, імідазоліл, імідазолідиніл, піразолініл, індолініл, ізоіндолініл, піридил, піразиніл, піримідиніл, піридазиніл, індолізиніл, ізоіндоліл, індоліл, індазоліл, пуриніл, хінолізиніл, ізохіноліл, хіноліл, фталазиніл, нафтиридиніл, хіноксалініл, хіназолініл, цинолініл, птеридиніл, хінуклідиніл, триазоліл, піразоліл, тетразоліл і тієніл. Приклади гетероароматичних груп включають піридил, тієніл, фурил, піроліл, імідазоліл, бензотіазоліл, піридиніл, піразоліл, піразиніл, піримідиніл, піридазиніл, індоліл, індазоліл, нуриніл, хіноліл, ізохіноліл, фталазиніл, нафтиридиніл, хіноксалініл, хіназолініл, цинолініл, триазоліл. Як використовується в контексті, атом галогену включає атом фтору, хлор у, брому й йоду, звичайно атом фтор у, хлор у або брому. Переважними сполуками формули (І) є ті, де В представляє феніл, піроліл, тієніл, фурил, біфеніл, нафталініл, 5,6,7,8-тетрагідронафталініл, бензо[1,3]діоксоліл, імідазоліл або бензотіазоліл. Більш переважно В означає феніл, тієніл або піроліл. В може бути незаміщеним або може бути заміщений однією, двома або трьома групами (від R 1 до R3), які можуть знаходитися при будь-якому положенні кільця. У переважних сполуках за винаходом R1, R2 й R3 означають кожен незалежно водень або атом галоїду, або гідроксил, метил, трет-бутил,-СН2ОН, 3-гідроксипропіл,-ОМе,-N Me2,-NHCOMe,-CONH 2,-CN,-NO2,-COOMe або-CF3. У найбільш переважних сполуках R1, R2 й R3 означають водень, фтор, хлор або гідроксил. Звичайно В є незаміщеним або заміщений однією групою, наприклад, коли В означає феніл, то він може бути заміщений по 2, 3 або 4-му положенню. Прикладами заміщених фенільних груп, які можуть представляти В, є толіл, включаючи о-, м- і п-толіл, 3-ціанфеніл, 2-, 3- і 4-гідроксифеніл, і 2-, 3- і 4-фтор-феніл. Переважними сполуками формули (І) є такі, де n=0 або 1; m означає ціле число від 1 до 6, зокрема, 1, 2 або 3; і А є групою-СН 2-,-СН=СН-,-CO-,-NMe-,-О- або-S-. Найбільш переважними сполуками є ті, де А означаєСН2-,-СН=СН-або-О-. Іншими переважними сполуками формули (І) є такі, де піролідинієва група заміщена за атомом азоту (С1С4)алкільною групою й іншою групою, вибраною з 3-феноксипропілу, 2-феноксіетилу, 3-фенілалілу, фенетилу, 4-фенілбутилу, 3-фенілпропілу, 3-(2-гідроксифенокси)пропілу, 3-(4-фтор фенокси)-пропілу, 2-бензилоксіетилу, 3-пірол-1-ілпропілу, 2-тієн-2-ілетилу, 3-тієн-2-іл-пропілу, 3-феніламінопропілу, 3-(метилфеніламіно)пропілу, 3фенілсульфаніл-пропілу, 3-о-толілоксипропілу, 3-(2,4,6-триметилфенокси)пропілу, 3-(2-трет-бутил-6метилфенокси)пропілу, 3-(біфеніл-4-ілокси)пропілу, 3-(5,6,7,8-тетрагідронафталін-2-ілокси)пропілу, 3(нафталін-2-ілокси)пропілу, 3-(нафталін-1-ілокси)пропілу, 3-(2-хлорфенокси)пропілу, 3-(2,4-дифторфенокси) пропілу, 3-(3-трифторметилфенокси)пропілу, 3-(3-ціанфенокси)пропілу, 3-(4-ціанфенокси)пропілу, 3-(3метоксифенокси)пропілу, 3-(4-метоксифенокси)-пропілу, 3-(бензо[1,3]діоксол-5-ілокси)пропілу, 3-(2карбамоїлфенокси)пропілу, 3-(3-диметиламінофенокси)пропілу, 3-(4-нітрофенокси)пропілу, 3-(3нітрофенокси)-пропілу, 3-(4-ацетиламінофенокси)пропілу, 3-(4-метоксикарбонілфенокси)пропілу, 3-[4-(3гідроксипропіл)фенокси]пропілу, 3-(2-гідроксиметилфенокси)пропілу, 3-(3-гідроксиметилфенокси)пропілу, 3-(4гідроксиметилфенокси)пропілу, 3-(2-гідроксифенокси)пропілу, 3-(4-гідроксифенокси)пропілу, 3-(3гідроксифенокси)пропілу, 4-оксо-4-тієн-2-ілбутилу, 3-(1-метил-[1Н]-імідазол-2-ілсульфаніл)пропілу, 3(бензотіазол-2-ілокси)пропілу, 3-бензил оксипропілу, 6-(4-фенілбутокси)гексилу, 4-феноксибутилу, 4-(4фтор феніл)-4-оксобутилу або 4-оксо-4-фенілбутилу. Найбільш переважними є сполуки, де піролідинієва група заміщена за атомом азоту (С1-С4)алкільною групою й іншою гр упою, вибраною з 3-феноксипропілу, 2-феноксіетилу, 3-фенілалілу, фенетилу, 3-фенілпропілу, 3-(3-гідроксифенокси)пропілу, 3-(4-фторфенокси)пропілу, 3-тієн-2-іл-пропілу, 4-оксо-4-тієн-2-ілбутилу, 2-бензилоксіетилу, 3-о-толілоксипропілу, 3-(3-ціанфенокси)пропілу, 3-(метилфеніламіно)пропілу, 3фенілсульфанілпропілу, 4-оксо-4-фенілбутилу, 4-(4-фтор феніл)-4-оксобутилу, 3-(2-хлорфенокси)пропілу, 3(2,4-дифторфенокси)пропілу, 3-(4-метоксифенокси)пропілу, 3-(бензо[1,3]діоксол-5-іл-окси)пропілу. Прикладами особливо переважних сполук є такі сполуки, у яких піролідинієва група заміщена за атомом азоту (С1-С4)-алкільною групою й іншою групою, вибраною з 3-феноксипропілу, 2-фенокси-етилу, 3фенілалілу, фенетилу, 3-фенілпропілу, 3-(3-гідроксифенокси)пропілу, 3-(4-фторфенокси)пропілу , 4-(4фтор феніл)-4-оксобутилу або 3-тієн-2-ілпропілу. Іншими переважними сполуками формули (І) є такі, у яких D означає груп у формули і), і де R9 є гр упою, вибраною з фенілу, 2-тієнілу, 3-тієнілу, 3-фурилу або 2-фурилу, більш переважні феніл, 2-тієніл або 2-фурил; R10 є гр упою, вибраною з фенілу, 2-тієнілу, 2-фурилу, 3-фурилу, 3-тієнілу, циклогексилу або циклопентилу, більш переважні феніл, 2-тієніл, циклогексил або циклопентил; і R11 є гідроксильною групою. Також переважні сполуки формули (І), де D є групою формули іі) і де Q означає простий зв'язок або атом кисню й R11 є атомом водню або гідроксильною групою. Сполуки за даним винаходом, представлені формулою (І), мають, як мінімум, два хіральні центри: один при атомі вуглецю в положенні 3 піролідинієвого кільця, а інший при атомі азоту піролідинієвого кільця. Крім того, залежно від природи групи D сполуки також можуть мати додатковий хіральний центр при атомі вуглецю цієї групи, зв'язаному із складноефірною функціональною групою. При кожному з таких хіральних центрів просторове розташування атомів може характеризуватися R- або S-конфігурацією. Окремі ізомери й суміші ізомерів входять в обсяг даного винаходу. Оскільки сполуки мають один або декілька хіральних центрів, вони можуть бути отримані у вигляді чистих ізомерів або у вигляді сумішей різних енантіомерів або діастереомерів. Зрозуміло, що за даним винаходом, коли немає яких-небудь вказівок на конфігурацію при хіральному центрі, мають на увазі суміш всі х можливих ізомерів при відповідному хіральному центрі. Коли маються на увазі сполуки із специфічною конфігурацією при хіральному центрі, це вказується в назві сполуки в такий спосіб: - коли відома конфігурація при хіральному центрі, її вказують, застосовуючи номенклатур у Кана-ІнгольдаПрелога, додаючи букву R або S до номера, який визначає положення хірального центра вмолекулі. - коли при хіральному центрі є специфічна конфігурація, яка, однак, невідома, вона вказується шляхом додавання зірочки (*) до числа, яке визначає положення хірального центра вмолекулі. Конкретні сполуки за винаходом включають: трифторацетат 3-(2-гідрокси-2,2-дитїєн-2-ілацетокси)-1-метил-1-фенетил-піролідинію 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)піролідиній-бромід 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-тієн-2-ілпропіл)-піролідинійбромід 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-феноксипропіл)піролідиній-бромід трифторацетат 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілаліл)-піролідинію трифторацетат 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(4-оксо-4-тієн-2-іл-бутил)піролідинію трифторацетат 1-[4-(4-фторфеніл)-4-оксобутил]-3-(2-гідрокси-2,2-дитієн-2-іл-ацетокси)-1-метилпіролідинію трифторацетат 1-етил-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-[3-(3-гідрокси-фенокси)пропіл]піролідинію трифторацетат 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-пірол-1-іл-пропіл)піролідинію трифторацетат 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-[6-(4-фенілбутокси)-гексил]піролідинію трифторацетат 1-(2-бензилоксіетил)-3-(2-циклогексил-2-фур-2-ил-2-гідроксиацетокси)-1-метилпіролідинію трифторацетат 1-[3-(3-ціанфенокси)пропіл]-3-(2-циклогексил-2-фур-2-ил-2-гідрокси-ацетокси)-1метилпіролідинію трифторацетат 3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метил-1-[3-(нафталін-1ілокси)пропіл]піролідинію трифторацетат 3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метил-1-[3-(метилфеніламіно)пропіл]піролідинію трифторацетат 3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-етил-1-(3-фенілсульфанілпропіл)піролідинію трифторацетат 1-[3-(бензотіазол-2-ілокси)пропіл]-3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1метилпіролідинію 3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-метил-1-(3-феноксипропіл)-піролідинійбромід трифторацетат 3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-метил-1-[3-(2,4,6триметилфенокси)пропіл]піролідинію трифторацетат 1-[3-(2-хлорфенокси)пропіл]-3-(2-циклопентил-2-гідрокси-2-феніл-ацетокси)-1метилпіролідинію трифторацетат 3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-метил-1-[3-(3 трифторметилфенокси)пропіл]піролідинію трифторацетат 1-[3-(біфеніл-4-ілокси)пропіл]-3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1метилпіролідинію трифторацетат 3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-[3-(2,4-дифтор-фенокси)пропіл]-1метилпіролідинію трифторацетат 3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-етил-1-[3-(4метоксифенокси)пропіл]піролідинію трифторацетат 3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-метил-1-[3-(5,6,7,8-тетрагідронафталін-2ілокси)пропіл]піролідинію трифторацетат 3-(2-циклопентил-2-гідрокси-2-фенілацетокси)-1-метил-1-[3-(1-метил-1Н-імідазол-2ілсульфаніл)пропіл]піролідинію 1-метил-1-фенетил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинійбромід 1-метил-1-(3-феноксипропіл)-3-(9Н-ксантен-9-ілкарбонілокси)піролідинійбромід трифторацетат 1-[3-(бензо[1,3]діоксол-5-ілокси)пропіл]-1-метил-3-(9Н-ксантен-9ілкарбонілокси)піролідинію трифторацетат 1-[3-(2-карбамоїлфенокси)пропіл]-1-метил-3-(9Н-ксантен-9-іл-карбонілокси)піролідинію трифторацетат 1-[3-(3-диметиламінофенокси)пропіл]-1-метил-3-(9Н-ксантен-9-іл-карбонілокси)піролідинію трифторацетат 1-[3-(4-ацетиламінофенокси)пропіл]-1-метил-3-(9Н-ксантен-9-іл-карбонілокси)піролідинію трифторацетат 1-[3-(4-метоксикарбонілфенокси)пропіл]-1-метил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинію трифторацетат 1-метил-1-[3-(4-нітрофенокси)пропіл]-3-(9Н-ксантен-9-ілкарбоніл-окси)піролідинію трифторацетат 1-[3-(4-гідроксиметилфенокси)пропіл]-1-метил-3-(9Н-ксантен-9-іл-карбонілокси)піролідинію форміат 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-[3-(3-гідроксифенокси)пропіл]-1-метилпіролідинію 1-[3-(4-фторфенокси)пропіл]-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-піролідинійхлорид 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілпропіл)піролідиній-бромід 1-метил-1-(3-о-толілоксипропіл)-3-[(9Н-ксантен-9-ілкарбоніл)окси]піролідиній-бромід форміат 3-{[(9-гідрокси-9Н-флуорен-9-іл)карбоніл]окси}-1-метил-1-(4-оксо-4-феніл-бутил)піролідинію 3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-етил-1-(3-фенілсульфаніл-пропіл)піролідинійбромід. Специфічні суміші ізомерів сполук за винаходом включають: (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-фенетилпіролідинійбромід (3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-фенетилпіролідинійбромід (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)-піролідинійбромід (3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)-піролідинійбромід (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-тієн-2-ілпропіл)-піролідинійбромід (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-феноксипропіл)-піролідинійбромід (3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-феноксипропіл)-піролідинійбромід трифторацетат (3R)-3-[(2R)-2-циклoгeкcил-2-фyp-2-ил-2-гiдpoкciaцeтoкcи]-1-етил-1-(3фенілсульфанілпропіл)піролідинію трифторацетат (3S)-3-[(2R)-2-циклoгeкcил-2-фyp-2-ил-2-гiдpoкciaцeтoкcи]-1-етил-1-(3фенілсульфанілпропіл)піролідинію (ЗR)-3-[(2R)-2-циклoпeнтил-2-гiдpoкcи-2-фeнiлaцeтoкcи]-1-мeтил-1-(3-фeнoкcи-пропіл)піролідинійбромід (ЗS)-3-[(2R)-2-циклoпeнтил-2-гiдpoкcи-2-фeнiлaцeтoкcи]-1-мeтил-1-(3-фeнoкcи-пропіл)піролідинійбромід (ЗR)-3-[(2S)-2-циклoпeнтил-2-гiдpoкcи-2-фeнiлaцeтoкcи]-1-мeтил-1-(3-фeнoкcи-пропіл)піролідинійбромід (3S)-3-[(2S)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-(3-фенокси-пропіл)піролідинійбромід (3R)-1-метил-1-фенетил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинійбромід (3S)-1-метил-1-фенетил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинійбромід форміат (3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-[3-(3-гідроксифенокси)-пропіл]-1-метилпіролідинію форміат (3R)-3-{[(9-гiдpoкcи-9H-флyopeн-9-iл)кapбoнiл]oкcи}-1-мeтил-1-(4-oкco-4-фенілбутил)піролідинію (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(4-оксо-4-тієн-2-ілбутил)-піролідинійхлорид форміат (3R)-1-[4-(4-фтopфeнiл)-4-oкcoбyтил]-3-(2-гiдpoкcи-2,2-дитiєн-2-iл-ацетокси)-1-метилпіролідинію форміат (3R)-1-[3-(3-цiaнфeнoкcи)пpoпiл]-3-(2-циклoгeкcил-2-фyp-2-ил-2-гідрокси-ацетокси)-1-метилпіролідинію форміат (3R)-3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метил-1-[3-(нафталін-1-ілокси)пропіл]піролідинію (3R)-3-(2-циклoгeкcил-2-фyp-2-ил-2-гiдpoкciaцeтoкcи)-1-мeтил-1-[3(мeтилфeнiламіно)пропіл]піролідинійхлорид (3R)-1-[3-(бeнзoтiaзoл-2-iлoкcи)пpoпiл]-3-(2-циклoгeкcил-2-фyp-2-ил-2-гiдpoкcи-ацетокси)-1метилпіролідинійхлорид (3R)-1-[3-(біфеніл-4-ілокси)пропіл]-3-[(2R)-2-циклопентил-2-гідрокси-2-феніл-ацетокси]-1метилпіролідинійхлорид (3R)-3-[(2R)-2-циклoпeнтил-2-гiдpoкcи-2-фeнiлaцeтoкcи]-1-мeтил-1-[3-(5,6,7,8-тетрагідронафталін-2ілокси)пропіл]піролідинійбромід (3R)-3-[(2R)-2-циклoпeнтил-2-гiдpoкcи-2-фeнiлaцeтoкcи]-1-мeтил-1-[3-(1-мeтил-1Н-імідазол-2ілсульфаніл)пропіл]піролідинійхлорид (3R)-1-[3-(2-xлopфeнoкcи)пpoпіл]-3-[(2R)-2-циклoпeнтил-2-гiдpoкcи-2-фeнiл-ацетокси]-1метилпіролідинійхлорид 3-[(2R)-2-циклoпeнтил-2-гiдpoкcи-2-фeнiлaцeтoкcи]-1-етил-1-[3-(4-метоксифенокси)пропіл]піролідинійбромід (3R)-1-(2-бензилоксіетил)-3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метил-піролідинійбромід Окремі ізомери сполук за винаходом включають: (1*,3R)-3-(2-гiдpoкcи-2,2-дитiєн-2-iлaцeтoкcи)-1-мeтил-1-фeнeтилпipoлідинiй-бромід (діастереомер 1) (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-фенетилпіролідиній-бромід (діастереомер 2) (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)-піролідинійбромід (діастереомер 1) (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)-піролідинійбромід (діастереомер (1*,3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)-піролідинійбромід (діастереомер (1*,3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)-піролідинійбромід (діастереомер 2) 1) 2) (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси-1-метил-1-(3-феноксипропіл)-піролідинійбромід (діастереомер 1) (1*,3R)-3-(2-гiдpoкcи-2,2-дитiєн-2-iлaцeтoкcи)-1-мeтил-1-(3-фeнoкcипpoпiл)-піролідинійбромід (діастереомер 2) (1*,3S)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-(3-фенокси-пропіл )піролідинійбромід (діастереомер 1) (1*,3S)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-(3-фенокси-пропіл)піролідинійбромід (діастереомер 2) (1*,3R)-1-мeтил-1-фeнeтил-3-(9H-кcaнтeн-9-iлкapбoнiлoкcи)пipoлiдинiйбpoмiд (діастереомер 1) (1*,3R)-1-метил-1-фенетил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинійбромід (діастереомер 2) (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілаліл)-піролідинійбромід (діастереомер 1) (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілаліл)-піролідинійбромід (діастереомер 2) (1*,3R)-1-[4-(4-фтopфeнiл)-4-oкcoбyтил]-3-(2-гiдpoкcи-2,2-дитiєн-2-iлaцeтoкcи)-1-метилпіролідинійхлорид (діастереомер 1) (1*,3S)-1-[3-(4-фторфенокси)пропіл]-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метилпіролідинійхлорид (діастереомер 1) (1*,3S)-1-[3-(4-фторфенокси)пропіл]-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метилпіролідинійхлорид (діастереомер 2) (1*,3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілпропіл)-піролідинійбромід (діастереомер 1) (1*,3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілпропіл)-піролідинійбромід (діастереомер 2) (1*,3R)-3-[(2R)-2-циклoпeнтил-2-гiдpoкcи-2-фeнiлaцeтoкcи]-1-метил-1-(3-фенокси-пропіл)піролідинійбромід (діастереомер 1) (1*,3R)-3-[(2R)-2-циклoпeнтил-2-гiдpoкcи-2-фeнiлaцeтoкcи]-1-метил-1-(3-фенокси-пропіл)піролідинійбромід (діастереомер 2) (1*,3R)-1-[3-(бензо[1,3] діоксол-5-ілокси)пропіл]-1-метил-3-[(9Н-ксантен-9-ілкарбоніл)окси]піролідинійбромід (діастереомер 1) (1*,3R)-1-[3-(бeнзo[l,3]дioкcoл-5-iлoкcи)пpoпiл]-1-мeтил-3-[(9H-кcaнтeн-9-iл-карбоніл)окси]піролідинійбромід (діастереомер 2) (1*,3S)-1-метил-1-(3-о-толілоксипропіл)-3-[(9Н-ксантен-9-ілкарбоніл)окси]-піролідинійбромід (діастереомер 1) (1*,3S)-1-метил-1-(3-о-толілоксипропіл)-3-[(9Н-ксантен-9-ілкарбоніл)окси]-піролідинійбромід (діастереомер 2) (1*,3R)-1-[3-(бiфeнiл-4-iлoкcи)пpoпiл]-3-[(2R)-2-циклoпeнтил-2-гiдpoкcи-2-феніл-ацетокси]-1метилпіролідинійхлорид (діастереомер 1) (1*,3R)-1-[3-(бiфeнiл-4-ίлoкcи)пpoпiл]-3-[(2R)-2-циклoпeнтил-2-гiдpoкcи-2-феніл-ацетокси]-1метилпіролідинійхлорид (діастереомер 2) (1*,3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-[3-(5,6,7,8-тетрагідронафталін-2ілокси)пропіл]піролідинійбромід (діастереомер 1) (1*,3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-[3-(5,6,7,8-тетрагідронафталін-2ілокси)пропіл]піролідинійбромід (діастереомер 2). Відповідно до іншого варіанта здійснення винаходу даний винахід забезпенує способи одержання нових похідних піролідинію формули (І). Ці сполуки можуть бути отримані, дотримуючись двох різних методик, представлених нижче як спосіб (а) і спосіб (б). Дотримуючись способу (а), сполуки формули (І) одержують при реакції алкілувального агента формули R4-W із проміжними сполуками формули (II). Спосіб а Дотримуючись способу (б), сполуки формули (І) одержують при реакції алкілувального агента формули (IV) із проміжними сполуками формули (III). Спосіб б У формулах (І), (II), (III) і (IV) m, n, А, В, D, R1, R2, R3 й R4 і X- є такими, як вказано вище. У формулах (IV) і R4-W W представляє будь-яку груп у, яка вилучається, як група X, як визначено вище для сполук формули (І). Переважно W означає групу X. Коли W означає іншу груп у, а не X, четвертинну амонієву сіль формули (І) одержують із продукту за способом (а) або (б) шляхом обмінної реакції відповідно до стандартних способів для заміни аніона W- бажаним аніоном X-. Способи (а) і (б) можуть бути здійснені за допомогою відомих експериментальних методик у загальноприйнятому синтезі, або використовуючи методики екстрагування із твердої фази, що дозволяє паралельно одержати декілька сполук. Діастереомери сполук формули (І) можуть бути розділені за допомогою загальноприйнятих способів, наприклад, шляхом хроматографії або кристалізації. Проміжні сполуки формули (II), які застосовують в способі (а), можуть бути отримані при реакції сполуки формули (V) зі сполукою формули (VI), як показано в способі (в) нижче Спосіб в У формулах (II), (V) і (VI) m, n, А, В, D, R1, R2 й R3 є такими, як вказано вище. Складні ефіри піролідинолу формули (II) можуть бути перетворені у фармацевтично прийнятні солі за допомогою відомих у даній галузі способів. Звичайно складний ефір формули (II) обробляють неорганічною або органічною кислотою, як, наприклад, щавлева, фумарова, малеїнова, винна, янтарна або соляна кислота. Складні ефіри піролідинолу формули (II), які мають один або декілька асиметричних атомів вуглецю, включають всі можливі стереоізомери, окремі ізомери й суміші ізомерів. Діастереомери сполук формули (II) можуть бути розділені за допомогою загальноприйнятих способів, наприклад, шляхом хроматографії або кристалізації. Деякі сполуки формули (II) є новими й охоплюються обсягом даного винаходу. Зокрема: (3R)-1-(2-феноксіетил)піролідин-3-іловий ефір 2-гідрокси-2,2-дитієн-2-іл-оцтової кислоти (3R)-1-(3-феноксипропіл)піролідин-3-іловий ефір 2-гідрокси-2,2-дитієн-2-іл-оцтової кислоти (3R)-1-(3-тієн-2-ілпропіл)піролідин-3-іловий ефір 2-гідрокси-2,2-дитієн-2-іл-оцтової кислоти (3R)-1-фeнeтилпipoлiдин-3-iлoвий ефір 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти. Сполуки формули (III), які використовували в способі (б), можуть бути отримані при реакції сполуки формули (V) зі сполукою формули (VII), як описано в способі (г), наведеному нижче. Спосіб г У сполуках формул (V), (III) і (IV) D й R4 є такими, як описано вище для сполук формули (І), і L у формулі (V) означає групу, яка вилучається. Наприклад, L може бути атомом хлору, імідазол-1-ільною групою або (нижч.) алкоксигрупою, як, наприклад, метоксигрупа. Проміжні сполуки формули (V) можуть бути отримані описаними в літературі способами, як показано далі в експериментальній частині. Складні ефіри піролідинолу формули (III) з одним або декількома асиметричними атомами вуглецю включають всі можливі стереоізомери, окремі ізомери й суміші стереоізомерів. Діастереомери сполук формули (III) можуть бути розділені звичайними способами, наприклад, шляхом хроматографії або кристалізації. Сполуки формули (VI), описані в способі (в), можуть бути отримані при реакції алкілувального агента формули (IV), де W означає галоген або сульфонат, з відповідним піролідинолом формули (VIII), як ілюструється нижче в способі (д). Спосіб д У формулах (IV) і (VI) m, n, А, В, R1, R2, R3 й W є такими, як описано ; вище. Деякі сполуки формули (VI) є новими й охоплюються обсягом даного винаходу. Зокрема: (3R)-1-(3-феноксипропіл)піролідин-3-ол (3R)-1-(3-тiєн-2-iлпpoпiл)пipoлiдин-3-oл. Ті сполуки формули (VII), описані в способі (г), які не є комерційно доступними, можуть бути отримані синтетично відповідно до стандартних способів, наприклад, при реакції сполуки формули (VIII) з відповідним алкілувальним агентом або при реакції сполуки формули (VIII) з відповідним альдегідом і відновником. Конкретний приклад описаний як спосіб (e) в експериментальній частині. Прикладами комерційно доступних сполук формули (VIII) є піролідин-3- : ол, (ЗR)-пipoлiдин-3-oл, (3S)піролідин-3-ол. Ті сполуки формули (IV), які не є комерційно доступними, одержували синтетично відповідно до стандартних способів. Наприклад, сполуки, у яких n означає 0 й А є однією із груп -О-,-S- або -NR7, де R7 є таким, як визначено вище, одержували при реакції відповідного спирту, тіолу або амінопохідного або його натрієвої або калієвої солі з алкілувальним агентом формули Y-(CH2) m-W, де W є таким, як вказано вище, і Υ може бути атомом галоїду або залишком складного ефіру суль фокислоти. Іншими прикладами є сполуки формули (IV), де η означає, принаймні, 1, які були синтезовані з відповідного похідного спирту формули (IX) за допомогою способів, добре відомих у даній галузі. (IX) Мається на увазі, що наступні приклади одержання ілюструють, але не обмежують експериментальні методики, описані вище. Спосіб (а). Одержання сполук формули (І). Спосіб (б). Одержання сполук формули (І). Спосіб (в). Одержання сполук формули (II). Спосіб (г). Одержання сполук формули (III). Спосіб (д). Одержання сполук формули (VI). Спосіб (e). Одержання сполук формули (VII). Структури отриманих сполук були підтверджені даними 1H-ЯМР-спектрів (1Н-ЯМР) і мас-спектрів (МС). ЯМР-спектри знімали, використовуючи прилад Varian 300 MHz або прилад Bruker DPX-250. Хімічні зсуви виражають у мільйонних частках (δ) відносно внутрішнього стандарту тетраметилсилану. Чистоту сполук визначали за допомогою високоефективної рідинної хроматографії (ВЕРХ), застосовуючи обернено-фазову хроматографію на приладі фірми Waters. Оптичне обертання визначали, використовуючи поляриметр PERKIN-ELMER 241 МС, імолекулярні іони одержували за допомогою мас-спектрометрії з іонізацією електророзпиленням на приладі фірми Hewlett Packard. Напівпрепаративні експерименти з використанням ВЕРХ-МС проводили на приладі фірми Gilson, обладнаному подвійною помпою (поршневий насос 321 фірми Gilson); вакуумним дегазатором (Gilson 864); інжектором-колектором фракцій (сортувальник рідини Gilson 215); двома модулями для введення проби, аналітичним і препаративним (Gilson 819); затвором (Gilson Valvemate 7000); роздільником 1/1000 (Acurate фірми LC Packings); підживлюванню помпою (Gilson 307); діодним матричним детектором (Gilson 170) і масспектрометричним детектором (Thermoquest Finnigan aQa, квадрупольний мас-спектрометр із режимами іонізації електророзпиленням і хімічної іонізації при атмосферному тиску). Прилад для ВЕРХ-МС управлявся за допомогою персональної ЕОМ фірми IBM. Спосіб (а) Приклад 6 Одержання (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-тієн-2-іл-пропіл)піролідинійброміду Розчиняли 0,3г (0,00069моля) (ЗR)-1-(3-тiєн-2-iлпpoпiл)пipoлiдин-3-ілового ефіру 2-гідрокси-2,2-дитієн-2ілоцтової кислоти (проміжний продукт 1-3) в 4мл ацетонітрилу й 6мл хлороформу. До цього розчину додавали 3,45мл (0,00345моля) 1 Μ розчину бромистого метилу в ацетонітрилі. Після перемішування суміші при кімнатній температурі в атмосфері азоту протягом 24 годин розчинники випарювали. До залишку додавали діетиловий ефір і суміш перемішували до одержання твердої речовини. Отриману тверду речовину декілька разів обробляли діетиловим ефіром, фільтрували й промивали діетиловим ефіром.Одержували 0,34г (93,2%) вказаної в заголовку сполуки у вигляді суміші двох стереоізомерів. 1Н-ЯМР: суміш діастереомерів 55:45. 1 Н-ЯМР (ДМСО-d 6): δ 1 ,95-2,20 (m, 3Н), 2,60-2,80 (m, 2Н), 2,80-2,90 (m, 1Н), 2,94 й 3,10 (s, 3Н), 3,20-3,45 (m, 2Н), 3,45-3,95 (m, 4Н), 5,52 (m, 1Н), 6,90-7,05 (m, 4H), 7,10-7,20 (m, 2H), 7,37 (m, 1H), 7,40-7,55 (m, 3H). MC [M-Br]+: 448. Приклад 9 Одержання (1*,3R)-3-(2-гiдpoкcи-2,2-дитiєн-2-iлaцeтoкcи)-1-мeтил-1-(3-феноксипропіл)піролідинійброміду (діастереомер 1) Приклад 10 Одержання (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-феноксипропіл)піролідинійброміду (діастереомер 2) Дотримуючись способу, описаному в прикладі 6, 1,6г (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1(3-феноксипропіл)піролідинійброміду, суміш дво х стереоізомерів, (сполука, описана в прикладі 8) одержували з (3R)-1-(3-фенокси-пропіл)піролідин-3-ілового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти, проміжний продукт 1-2, і 1Μ розчину бромистого метилу в ацетонітрилі. Отриману в результаті сполуку очи щали за допомогою хроматографії на силікагелі із градієнтним елююванням, використовуючи як елюент хлороформ + ізопропанол (50®100%). Відповідні фракції об'єднували й упарювали, одержували дві вказані у заголовку сполуки. Будову підтверджували за допомогою 1Н-ЯМР. Діастереомер 1 (перший елюйований діастереомер), одержували 0,628г (80,1% розраховуючи на окремий ізомер). Тпл 86,2-89,6°С. 1 Н-ЯМР: діастереомер 1 (діастереомер 2 не спостерігається) 1Н-ЯМР (ДМСО-d6): δ 2,10-2,30 (m, 3Н), 2,652,80 (m, 1Н), 3,0 (s, 3H), 3,50-3,65 (m, 3Н), 3,70-3,85 (m, 2H), 3,85-3,95 (m, 1H), 4,05 (m, 2H), 5,54 (m, 1H), 6,907,05 (m, 5H), 7,10-7,20 (m, 2H), 7,25-7,35 (m, 2H), 7,50-7,55 (m, 3H). MC [M-Br]+: 458. (* Конфігурація не визначена). Діастереомер 2 (другий елюйований діастереомер), 0,559г (71,3% розраховуючи на окремий ізомер). Тпл 87,1-89,0°С. 1 Н-ЯМР: діастереомер 2 (діастереомер 1 не спостерігається) 1 Н-ЯМР: (ДМС-d6): δ 2,05-2,30 (m, 3Н), 2,65-2,80 (m, 1H), 3,15 (s, 3Н), 3,40-3,55 (m, 2Н), 3,55-3,80 (m, 3Н), 3,95 (m, 3Н), 5,55 (m, 1Н), 6,90-7,05 (m, 5H), 7,05-7,20 (m, 2H), 7,30-7,40 (m, 2H), 7,45-7,50 (m, 3Н). MC [M-Br]+: 458. (* Конфігурація не визначена). Спосіб (б) Приклад 7 Одержання 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенокси-пропіл)піролідинійброміду Розчиняли 0,66г (0,002моля) 1-метилпіролідин-3-ілового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти (проміжний продукт 1-7) в 9мл хлороформу й 6мл ацетонітрилу. Додавали 1,6мл (3-бромпропокси)бензолу (2,15г, 0,01моля) і суміш перемішували 72 години при кімнатній температурі в атмосфері азоту. Розчинники випарювали. До залишку додавали діетиловий ефір і суміш перемішували до одержання твердої речовини. Тверду речовину обробляли декілька разів діетиловим ефіром, фільтрували й промивали діетиловим ефіром. Вихід вказаної в заголовку сполуки у вигляді суміші чотирьох стереоізомерів становив 0,75г (69,4%). Тпл 55,3-56,8°С. 1 Н-ЯМР: суміш діастереомерів 56:44. 1 Н-ЯМР (ДМС-d6): δ 2,05-2,30 (m, 3Н), 2,60-2,80 (m, 1H), 3,12 (s, 3Н), 3,40-3,50 (m, 1Н), 3,50-3,82 (m, 4H), 3,85-4,0 (m, 2H), 4,0-4,10 (m, 1H), 5,52 (m, 1H), 6,90-7,01 (m, 5H), 7,10-7,15 (m, 2H), 7,25-7,35 (m, 2H), 7,42-7,52 (m, 3H) MC [M-Br]+: 458. Приклад 4 Одержання (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)піролідинійброміду (діастереомер 1) Приклад 5 Одержання (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)піролідинійброміду (діастереомер 2) Розчиняли 2г (0,00618моля) (3R)-1-метилпіролідин-3-ілового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти (проміжний продукт 1-5) в 40мл тетрагідрофурану й додавали 1,86г (0,00927моля) (2брометокси)бензолу. Суміш кип'ятили зі зворотним холодильником протягом 81 години й перемішували 64 години при кімнатній температурі. Під час цього процесу додавали декількома порціями ще 2,46г (2брометокси)бензолу (0,0122моля). Після закінчення цього часу реакційну суміш фільтрували й отриманий твердий залишок промивали тетрагідрофураном і діетиловим ефіром. Отриману тверду речовину (1,5г) обробляли тетрагідрофураном при кип'ятінні зі зворотним холодильником протягом 30 хвилин, фільтрували, не о холоджуючи, і промивали тетрагідрофураном і діетиловим ефіром, одержували 0,850г (52,5% розраховуючи на окремий ізомер) діастереомеру 1. Маточні розчини після першої фільтрації кип'ятили зі зворотним холодильником ще 40 годин. Утворену тверду речовину (діастереомер 1) відфільтровували й отриманий розчин розбавляли діетиловим ефіром, одержували маслянистий залишок. Розчинники зливали й маслянистий залишок розчиняли в хлороформі. Розчин упарювали, одержували 801мг піноподібної речовини коричневого кольору, яку очи щали при хроматографії на силікагелі, застосовуючи хлороформ/ізопропанол (50:50) як елюент. Відповідні фракції об'єднували й упарювали, одержували 0,47г (29% розраховуючи на окремий ізомер) діастереомеру 2. Діастереомер 1. (Перший отриманий діастереомер) Тпл: 198,8-199,4°С 1 Н-ЯМР, діастереомер 1, 95:5. 1 Н-ЯМР (ДМСО-d6): δ 2,10-2,25 (m, 1Н), 2,65-2,82 (m, 1H), 3,20 (s, 3H), 3,60-3,90 (m, 5H), 3,95-4,05 (m, 1H), 4,38 (m, 2H), 5,56 (m, 1H), 6,95-7,05 (m, 5H), 7,10-7,20 (m, 2H), 7,30-7,42 (m, 2H), 7,45-7,60 (m, 3H). MC [M-Br]+: 444. (*Конфігурація не визначена). Діастереомер 2. (Другий отриманий діастереомер) Tпл 85,9-87,6°С. 1 Н-ЯМР: діастереомер 2, 95:5. 1 Н-ЯМР (ДМСО-d6): δ 2,10-2,25 (m, 1Н), 2,65-2,85 (m, 1H), 3,04 (s, 3Н), 3,62-3,72 (m, 1H), 3,78-3,90 (m, 4H), 3,97-4,04 (m, 1H), 4,45 (m, 2H), 5,55 (m, 1H), 6,98-7,03 (m, 5H), 7,12-7,16 (m, 2H), 7,32-7,37 (m, 2H), 7,50-7,52 (m, 3H). MC [M-Br]+: 444. (* Конфігурація не визначена). Приклад 11 Одержання (1*,3R)-1-метил-1-фенетил-3-(9Н-ксантен-9-ілкарбонілокси)-піролідинійброміду (діастереомер 1) Приклад 12 Одержання (1*,3R)-1-метил-1-фенетил-3-(9Н-ксантен-9-ілкарбонілокси)-піролідинійброміду (діастереомер 2) Розчиняли 0,7г (0,00226моля) (3R)-1-мeтилпipoлiдин-3-iлoвoгo ефіру 9Н-ксантен-9-карбонової кислоти (проміжний продукт 1-8) в 15мл тетрагідрофурану й додавали 0,63г (0,46мл, 0,0034моля) (2брометил)бензолу. Суміш кип'ятили зі зворотним холодильником 96 годин і перемішували 72 години при кімнатній температурі. У ході такої обробки додавали ще у вигляді декількох порцій 1,26г (2-брометил)бензолу (0,92мл, 0,0068моля). Після цього реакційну суміш фільтрували й отриману тверду речовину промивали тетрагідрофураном і діетиловим ефіром. Вихід діастереомеру 1 склав 0,301г (53,7% розраховуючи на окремий ізомер). Будова підтверджена даними 1H-ЯМР. Маточні розчини упарювали й маслянистий залишок (0,450г) очищали за допомогою хроматографії на силікагелі, проводячи градієнтне елюювання з використанням хлороформу + ізопропанолу (25®85%) як елюент. Відповідні фракції об'єднували й упарювали, одержували 0,193г (34,5% розраховуючи на окремий ізомер) діастереомеру 2. Діастереомер 1. (Перший отриманий діастереомер) Tпл: 232,3-233,1°С. ВЕРХ: діастереомер 1, 92,5:7,5 1 Н-ЯМР (ДМСО-d6): δ 2,0-2,15 (m, 1Н), 2,55-2,70 (m, 1H), 3,0 (s, 3H), 3,0-3,10 (m, 2H), 3,45-3,75 (m, 5H), 3,85-3,92 (m, 1H), 5,30 (s, 1H), 5,36 (m, 1H), 7,10-7,50 (m, 13H). MC[M-Br]+:414. (* Конфігурація не визначена). Діастереомер 2. (Другий отриманий діастереомер) Τпл: 79,6-81,2°С. ВЕРХ: діастереомер 2, 98,8:1,2. 1 Н-ЯМР (ДМСО-d6): δ 2,0-2,10 (m, 1H), 2,55-2,70 (m, 1H), 3,0-3,10 (m, 2H), 3,17 (s, 3H), 3,45-3,55 (m, 2H), 3,55-3,75 (m, 3H), 3,85-3,92 (m, 1H), 5,24 (s, 1H), 5,38 (m, 1H), 7,0-7,15 (m, 4H), 7,25-7,50 (m, 9H). MC [M-Br]+: 414. (* Конфігурація не визначена). Приклад 29 Форміат (3R)-3-{[(9-гідрокси-9Н-флуорен-9-іл)карбоніл]окси}-1-метил-1-(4-оксо-4-фенілбутил)піролідинію 0,575г (1,858ммоля) (3R)-1-метилпіролідин-3-ілового ефіру 9-гідрокси-9Н-флуорен-9-карбонової кислоти (проміжний продукт 1-10) і 1,018г (5,576ммоля) 4-хлор-1-фенілбутан-1-ону в 6мл тетрагідрофурану кип'ятили зі зворотним холодильником протягом 20 днів. Після цього тетрагідрофуран зливали й залишок промивали тетрагідрофураном для видалення алкілувального агента. Отриманий продукт (234мг) очищали за допомогою препаративної ВЕРХ-МС, одержували 65мг (7%) вказаної в заголовку сполуки (суміш двох стереоізомерів) у вигляді форміату. МС [М-НСОО-]+: 456. Умови, використовувані при очищенні за допомогою ВЕРХ-МС: колонка: Symmetry C18,100 А, 5мкм 19´100мм, Waters. Рухома фаза: А (Н2О 0,1% HCOONH 4). ((*): Конфігурація не визначена). Спосіб (в) Сполуки формули (V), які є складними метиловими ефірами можуть бути отримані за допомогою стандартних способів одержання складних ефірів, описаних у літературі, з відповідної карбонової кислоти або дотримуючись методик, [описаним у міжнародній заявці на патент WO 01/04118 А2], або відповідно до методик, [описаних у літературі: патент Франції FR 2012964; Larsson. L. і ін., Acta Pharm. Suec. (1974), 11(3), 304-308; Nyberg, K. і ін., Acta Chem. Scand. (1970), 24, 1590-1596; Cohen, V.I. і ін., J. Pharm. Sciences (1992), 81, 326-329; E. Atkinson й ін., J. Med. Chem. (1977), 20 (12), 1612-1617]. Проміжний продукт I-1 Одержання (3R)-1-(2-фкноксіетил)піролідин-3-ілового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти Розчиняли 1,33г метилового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти (0,0052моля) в 40мл толуолу. До отриманого розчину додавали 1,08г (0,0052моля) (3R)-1-(2-фeнoкcieтил)піpoлiдин-3-oлy (проміжний продукт I-15) і 0,104г (0,0026моля) NaH (60% дисперсія в мінеральному маслі). Суміш перемішували 30 хвилин при кімнатній температурі, кип'ятили зі зворотним холодильником протягом 45 хвилин, а потім кип'ятили зі зворотним холодильником протягом 1,5 годин з безперервним видаленням дистиляту й заміною свіжим толуолом при необхідності. Охолоджену суміш екстрагували 2н. соляною кислотою, водний шар підлуговували карбонатом калію й екстрагували хлороформом. Органічний шар промивали водою, сушили над сульфатом натрію й упарювали, одержували 1,77г маслоподібної речовини, яку очищали шляхом хроматографії на силікагелі, елююючи хлороформом/етанолом/гідроокисом амонію (200:8:1). Підходящі фракції об'єднували й упарювали, одержували 1,22г вказаної в заголовку сполуки у вигляді масла (54,7%). Отриманий продукт приводили у твердий стан шляхом утворення солі щавлевої кислоти. Оксалат (3R)-1-(2-фeнoкcieтил)піpoлiдин-3-iлoвoгo ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти: 1,03г (0,0024моля) вільної основи обробляли щавлевою кислотою (0,216г, 0,0024моля) в ацетоні/діетиловому ефірі. Одержували тверду речовину білого кольору, яку відфільтровували й промивали діетиловим ефіром. Вихід становив 0,91г (73,4%). Τпл: 134°С. 1 Н-ЯМР (ДМСО-d6): δ 1,80-1,95 (m, 1Н), 2,20-2,35 (m, 1H), 2,90-3,25 (m, 5H), 3,25-3,35 (m, 1H), 4,16 (t, 2H), 5,33 (m, 1H), 6,95-7,0 (m, 5H), 7,10-7,15 (m, 2H), 7,25-7,35 (m, 2H), 7,45-7,50 (m, 2H). MC [M+1]+: 430. Метиловий ефір 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти може бути отриманий, [як описано Nyberg, К. і ін. в Acta Chem. Scand. (1970), 24, 1590-1596]. Проміжний продукт I-2 Одержання (3R)-1-(3-фeнoкcипpoпiл)пipoлiдин-3-ілового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти Одержували, як описано для проміжного продукту I-1, з метилового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти й (3R)-1-(3-фeнoкcипpoпiл)пipoлiдин-3-олу (проміжний продукт l-16). Одержували 0,85г (49%) вказаного в заголовку продукту у вигляді масла. Частину продукту приводили у твердий стан шляхом утворення солі щавлевої кислоти. Оксалат (3R)-1-(3-фeнoкcипpomл)пipoлiдин-3-iлoвoгo ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти: 0,3г (0,000676моля) вільної основи обробляли щавлевою кислотою (0,060г, 0,00067моля) в ацетоні/діетиловому ефірі. Одержували тверду речовину, яку фільтрували й промивали діетиловим ефіром. Вихід склав 0,24г (67%). Тпл:115,6-117,2°С. 1 Н-ЯМР (ДМС-d6): δ 1,90-2,05 (m, 3Н), 2,20-2,40 (m, 1Н), 2,90-3,25 (m, 5H), 3,40-3,50 (m, 1H), 4,0 (t, 2H), 5,38 (m, 1H), 6,90-7,0 (m, 5H), 7,10-7,15 (m, 2H), 7,25-7,35 (m, 2H), 7,45-7,50 (m, 2H). MC [M+1]+: 444. Проміжний продукт І-3 Одержання (3R)-(3-тієн-2-ілпропіл)піролідин-3-ілового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтово'ї кислоти Одержували, як описано для проміжного продукту I-1, з метилового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти й (3R)-1-(3-тієн-2-ілпропіл)-піролідин-3-олу (проміжний продукт l-17). Одержували 0,83г (49,1%) вказаної в заголовку сполуки у вигляді масла. Частину цього продукту приводили у твердий стан шляхом утворення солі щавлевої кислоти. Оксалат (3R)-1-(3-тiєн-2-iлпpoпiл)пipoлiдин-3-iлoвoгo ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти: 0,3г (0,00069моля) вільної основи обробляли щавлевою кислотою (0,062г, 0,00069моля) в ацетоні/діетиловому ефірі. Одержували тверду речовину, яку фільтрували й промивали діетиловим ефіром. Вихід склав 0,27г (75%). Тпл: 112,6-114,1°С. 1 Н-ЯМР (ДМСО-d6): δ 1,80-2,05 (m, 3Н), 2,20-2,40 (m, 1Н), 2,70-3,0 (m, 4H), 3,0-3,30 (m, 3H), 3,40-3,55 (m, 1H), 5,37 (m, 1H), 6,85-7,05 (m, 4H), 7,10-7,20 (m, 2H), 7,30-7,40 (m, 1H), 7,45-7,50 (m, 2H), 8-10 (широка смуга, 3Н). MC [M+1]+: 434. Проміжний продукт l-4 Одержання (3R)-1-фeнeтилпipoлiдин-3-iлoвoгo ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти Одержували, як описано для проміжного продукту l-1, з метилового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти й (3R)-1-фeнeтилпipoлiдин-3-oлy (проміжний продукт I-18). Одержували 0,98г (50,5%) вказаної в заголовку сполуки. Тпл: 114,3-115,7°С. 1 Н-ЯМР (CDCl3): δ 1,85-1,95 (m, 1H), 2,20-2,35 (m, 1Н), 2,50-2,62 (m, 1H), 2,62-2,82 (m, 6H), 2,85-3,0 (m, 1H), 4,92 (ym. s, 1H, OH), 5,35 (m, 1H), 6,92-7,0 (m, 2H), 7,15-7,35 (m,9H). MC [M+1]+: 414. Спосіб (г) Одержання похідних складних метилових ефірів формули (V) описано в способі (в).l 1-5 Одержання (3R)-1-метилпіролідин-3-ілового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти Розчиняли 1г метилового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти (0,0039моля) в 30мл толуолу. До отриманого розчину додавали 0,394г (0,0039моля) (3R)-1-мeтилпipoлiдин-3-oлy (проміжний продукт I-19) і 0,078г (0,00195моля) NaH (60% дисперсія в мінеральному маслі). Суміш перемішували 30 хвилин при кімнатній температурі, кип'ятили зі зворотним холодильником протягом 1 години, а потім кип'ятили зі зворотним холодильником протягом 2 годин з безперервним видаленням дистиляту із заміною свіжим толуолом при необхідності. Охолоджену суміш екстрагували 2н. соляною кислотою, водний шар промивали невеликим об'ємом етилацетату, підлуговували твердим карбонатом калію й екстрагували три рази етилацетатом. Органічний шар промивали соляним розчином, сушили над сульфатом натрію й упарювали. Вихід вказаного в заголовку продукту склав 0,73г (58%) (структуру підтверджували даними 1Н-ЯМР). Отриманий продукт очищали шляхом хроматографії на силікагелі, елююючи хлороформом/етанолом/гідроокисом амонію (200:8:1). Відповідні фракції об'єднували й упарювали, одержували вказану в заголовку сполук у. Tпл: 84°C. 1 Н-ЯМР (ДМСО-d6): δ 1,62-1,75 (m, 1Н), 2,10-2,32 (m, 2H), 2,21 (s, 3H), 2,45-2,55 (m, 1H), 2,55-2,70 (m, 2H), 5,18 (m, 1H), 6,95-7,0 (m, 2H), 7,05-7,15 (m, 2H), 7,32 (s, 1H, OH), 7,45-7,50 (m, 2H). MC [M+1]+: 324. Проміжний продукт д-6 Одержання (3S)-1-метилпіролідин-3-ілового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти Одержували, як описано у випадку проміжного продукту I-5, з 0,98г (0,00385моля) метилового ефіру 2гідрокси-2,2-дитієн-2-ілоцтової кислоти в 30мл толуолу, 0,39г (0,00385моля) (3S)-1-метилпіролідин-3-олу (проміжний продукт l-20) і 0,108г (0,0027моля) NaH (60% дисперсія в мінеральному маслі). Вихід вказаного в заголовку продукту становив 0,31г (25%). Tпл: 84°C. 1 Н-ЯМР (ДМСО-d6): δ (еквівалентно 1-5). МС [М+1]+: 324. Проміжний продукт I-7 Одержання 1-метилпіролідин-3-ілового ефіру 2-гідрокси-2,2-дитієн-2-ілоцтової кислоти Одержували, як описано у випадку проміжного продукту I-5, з метилового ефіру 2-гідрокси-2,2-дитієн-2ілоцтової кислоти й 1-метилпіролідин-3-олу (комерційно доступного). Вихід склав 0,96г (30%). Tпл: 84°C. 1 Н-ЯМР (ДМСО-d6): δ (еквівалентно 1-5). МС [М+1]+: 324. Проміжний продукт I-8 Одержання (3R)-1-метилпіролідин-3-ілового ефіру 9Н-ксантен-9-карбонової кислоти Розчиняли 2г 9Н-ксантен-9-карбонової кислоти (0,0088моля) в 30мл хлороформу (який не містить етанолу). Розчин охолоджували до 0°С і додавали 1,08мл (0,0123моля) оксалілхлориду й краплю диметилформаміду. Суміш перемішували й залишали нагріватися до кімнатної температури. Після витримування протягом 1 години при цій температурі розчинники випарювали й залишок розчиняли в хлороформі й заново випарювали. Цю процедуру повторювали два рази. Отриману тверду речовину (2,19г) розчиняли в 20мл хлороформу й додавали до розчину 0,975г (0,0097моля) (3R)-1-мeтилmpoлiдин-3-олу (проміжний продукт I-19) в 15мл хлороформу, о холодженому до 0-5°С. Реакційній суміші давали нагрітися до кімнатної температури й перемішували протягом ночі. Розчинник випарювали й залишок розчиняли в толуолі й екстрагували 2 н. соляною кислотою. Водний шар підлуговували карбонатом калію й екстрагували хлороформом. Органічний шар промивали соляним розчином, сушили над сульфа том натрію й упарювали досуха, одержували 2,53г (93%) вказаної в заголовку сполуки у вигляді масла. 1 Н-ЯМР (CDCl3): δ 1,65-1,85 (m, 1H), 2,05-2,42 (m, 2Н), 2,30 (s, 3Н), 2,45-2,60 (m, 1Н), 2,60-2,80 (m, 2H), 5,0 (s, 1H), 5,05-5,20 (m, 1H), 7,0-7,25 (m, 4H), 7,25-7,40 (m, 4H). MC[M+1]+:310. Отриманий продукт затвердівав у результаті утворення солі щавлевої кислоти. Оксалат (3R)-1-мeтилпipoлiдин-3-iлoвoгo ефіру 9Н-ксантен-9-карбонової кислоти: 2,53г (0,0082моля) вільної основи обробляли щавлевою кислотою (0,74г, 0,0082моля) в ацетоні/діетиловому ефірі. Одержували тверду речовину, яку відфільтровували й промивали діетиловим ефіром. Вихід склав 2,48г (75,8%). Tпл: 155,0-155,8°C. МС[М+1]+:310. Проміжний продукт І-9 Одержання (3S)-1-метилпіролідин-3-ілового ефіру 9Н-ксантен-9-карбонової кислоти Цю сполуку одержували, як описано у випадку проміжного продукту I-8, ви ходячи з 9Н-ксантен-9карбонової кислоти й (3S)-1-метилпіролідин-3-олу (проміжний продукт I-20). Оксалат (3S)-1-метилпіролідин-3ілового ефіру 9Н-ксантен-9-карбонової кислоти одержували, як описано для оксалату проміжного продукту I-8. 1-метилпіролідин-3-іловий ефір 9Н-ксантен-9-карбонової кислоти (сірчанокисла сіль) описується B.V. Franko й ін. в J. Med. Pharm. Chem., (1960), 2 (5), 523-540. Проміжний продукт I-10 Одержання (3R)-1-мeтилпipoлiдин-3-iлoвoгo ефіру 9-гідрокси-9Н-флуорен-9-карбонової кислоти Розчиняли 0,980г (0,0041моля) метилового ефіру 9-гідрокси-9Н-флуорен-9-карбонової кислоти в 30мл толуолу. До цього розчину додавали 0,412г (0,0041моля) (3R)-1-мeтилпipoлiдин-3-oлy (проміжний продукт I-19) і каталітичну кількість Na(0) і суміш кип'ятили протягом 24 годин зі зворотним холодильником, використовуючи насадку Діна-Старка. Реакційну суміш охолоджували й екстрагували 2 н. соляною кислотою. Водний шар підлуговували карбонатом калію й екстрагували етилацетатом (3´100мл). Органічні шари об'єднували, сушили над сульфатом натрію й упарювали досуха, одержували залишок, який очищали за допомогою хроматографії на силікагелі, елююючи хлороформом + ізопропанолом (0%®20%). Відповідні фракції об'єднували й упарювали, одержували 0,390г (31%) вказаної в заголовку сполуки у вигляді масла. 1 Н-ЯМР (CDCI3): δ 7,65 (d, 2Н), 7,51 (d, 2H), 7,43-7,37 (m, 2H), 7,33-7,27 (m, 2H), 5,11 (m, 1Н), 2,65-2,59 (m, 1H), 2,26-2,17(m, 3H), 2,07-1,93 (m, 1H), l,99(s, 3H), 1,57-1,45 (m, 1H). MC [M+1]+:310. Метиловий ефір 9-гідрокси-9Н-фдуорен-9-карбонової кислоти одержували з 9-гідрокси-9Н-фдуорен-9карбонової кислоти стандартним способом одержання складних ефірів. Проміжний продукт I-11 Одержання (3R)-1-мeтилпipoлiдин-3-iлoвoгo ефіру 2-циклогексил-2-фур-2-ил-2-гідроксіоцтової кислоти Розчиняли 5,0г (0,021моля) метилового ефіру 2-циклогексил-2-фур-2-ил-2-гідроксіоцтової кислоти в 150мл безводного толуолу. До отриманого розчину додавали 2,12г (0,021моля) (3R)-1-метилпіролідин-3-олу (проміжний продукт I-19) і 500мг (0,021моля) NaH і суміш кип'ятили зі зворотним холодильником 24 години, використовуючи насадку Діна-Старка. Реакційну суміш охолоджували й екстрагували 2 н. соляною кислотою. Водний шар підлуговували карбонатом калію й екстрагували етилацетатом (3´100мл). Органічні шари об'єднували, сушили над сульфатом натрію й упарювали досуха, одержували залишок, який очищали при хроматографії на силікагелі, елююючи хлороформом + ізопропанолом (0%®10%). Відповідні фракції об'єднували й упарювали, одержували 1,37г (21%) вказаної в заголовку сполуки у вигляді масла. 1 Н-ЯМР (CDCI3): δ 7,38 (s, 1Н), 6,37-6,30 (m, 2H), 5,30-5,22 (m, 1H), 2,87-2,58 (m, 3H), 2,50-2,10 (m, 3H), 2,36 й 2,32 (s, 3H), 1,93-1,62 (m, 4H), 1,38-1,07 (m, 7H). MC [M+1]+: 308. Метиловий ефір 2-циклогексил-2-фур-2-ил-2-гідроксіоцтової кислоти може бути отриманий відповідно до способів, [описаних у міжнародній заявці на патент WO 01/04118 А2]. Проміжний продукт I-12 Одержання 1-етилпіролідин-3-ілового ефіру 2-циклогексил-2-фур-2-ил-2-гідроксіоцтової кислоти Розчиняли 1г (0,0042моля) метилового ефіру 2-циклогексил-2-фур-2-ил-2-гідроксіоцтової кислоти в 12мл етанолу й додавали 6мл розчину 2н. NaOH. Отриману суміш перемішували при 60°С протягом 1 години. Після цього етиловий спирт випарювали й залишок підкисляли 10% НСI. Водний розчин екстрагували етилацетатом (2´100мл). Органічні шари об'єднували, сушили й упарювали, одержували залишок (2-циклогексил-2-фур-2ил-2-гідроксіоцтову кислоту), який використовували без додаткового очищення. Отриману кислоту розчиняли в безводному диметилформаміді (12мл) і додавали 0,817г (0,005моля) 1,1'-карбоніл-діімідазолу. Суміш перемішували 1 годину при кімнатній температурі. Після цього додавали натрієву сіль 1-етилпіролідин-3-олу (отриману при додатку NaH (0,11г, 0,0046моля) до розчину 1-етилпіролідин-3-олу (0,531г, 0,0046моля) в 5мл безводного диметилформаміду). Після перемішування протягом 15 годин при кімнатній температурі реакційну суміш обробляли водою й водною фазою екстрагували діетиловим ефіром (2´100мл). Органічні фази об'єднували, промивали водою й сушили. Після видалення розчинника отриманий продукт очищали за допомогою хроматографії на силікагелі, елююючи хлороформом + ізопропанолом (5%®15%). Вихід вказаної в заголовку сполуки склав 460мг (34%, розраховуючи на ви хідний метиловий ефір). 1 Н-ЯМР (CDCI3): δ 1,05-1,45 (m, 10Н), 1,60-2,10 (m, 4H), 2,10-2,35 (m, 2H), 2,40-2,75 (m, 5Н), 2,85-3,0 (m, 1H), 3,76 (уш. s, ОН, 1Н), 5,27 (m, 1Н), 6,30-6,40 (m, 2Н), 7,39 (s, 1H). МС [М+1]+: 322. Метиловий ефір 2-циклогексил-2-фур-2-ил-2-гідроксіоцтової кислоти може бути отриманий відповідно до способів, [описаних у міжнародній заявці на патент WO 01/04118 А2]. 1-етилпіролідин-3-ол є комерційно доступною сполукою. Проміжний продукт I-13 (3R)-1-метилпіролідин-3-іловий ефір (2R)-2-циклопентил-2-гідрокси-2-фенілоцтової кислоти Розчиняли 0,545г (0,0025моля) (2R)-2-циклопентил-2-гідрокси-2-фенілоцтової кислоти в 8мл безводного диметилформаміду. До цього розчину додавали 0,481г (0,003моля) 1,1'-карбонілдіімідазолу й суміш перемішували при кімнатній температурі протягом 1 години. Після цього отриману суміш додавали до суспензії (3R)-1-мeтилпipoлiдин-3-oлy (проміжний продукт I-19, 0,531г, 0,0046моля) і NaH (0,065г, 0,0027моля) в 3мл безводного диметилформаміду. Після перемішування протягом 26 годин при кімнатній температурі реакційну суміш обробляли водою й екстрагували два рази діетиловим ефіром. Органічні шари об'єднували, промивали водою й сушили. Залишок очищали шляхом хроматографії на колонці із силікагелем (елюент: хлороформ + ізопропанол 0%®10%), одержували 450мг (60%) вказаного в заголовку продукту у вигляді масла. 1 Н-ЯМР (CDCI3): δ 7,60-7,56 (m, 2H), 7,29-7,15 (m, 3Н), 5,19-5,11 (m, 1H), 3,77 (уш. s, OH, 1H), 2,92-2,79 (m, 1H), 2,79-2,16 (m, 5H), 2,26 (s, 3H), 1,85-1,72 (m, 1H), 1,61-1,18 (m,8H). MC [M+1]+: 304. (2R)-2-циклопентил-2-гідрокси-2-фенілоцтова кислота [описується М. Mitsuya й ін.; Bioorg. Med. Chem., (1999), 7, 2555-2567]. Проміжний продукт I-14 1-етилпіролідин-3-іловий ефір (2R)-2-циклопентил-2-гідрокси-2-фенілоцтової кислоти Розчиняли 0,655г (0,00297моля) (2R)-2-циклопентил-2-гідрокси-2-фенілоцтової кислоти в 8мл безводного диметилформаміду. До цього розчину додавали 0,580г (0,0036моля) 1,1’-карбонілдіімідазолу й суміш перемішували при кімнатній температурі протягом 1 години. Після цього отриману суміш додавали до суспензії (охолодженої до 0°С) 1-етилпіролідин-3-олу (0,390г, 0,0033моля) і NaH (0,078г, 0,0033моля) в 4мл безводного диметилформаміду. Після перемішування протягом 15 годин при кімнатній температурі реакційну суміш обробляли водою й екстрагували три рази діетиловим ефіром. Органічні шари об'єднували, промивали водою й сушили. Залишок очищали шляхом хроматографії на колонці із силікагелем (елюент: хлороформ + ізопропанол 0%®5%), одержували 610мг (65%) вказаного в заголовку продукту у вигляді масла. 1 Н-ЯМР (CDCI3): δ 1,05 -1,15 (m, 3Н), 1,25-1,95 (m, 10Н), 2,10-2,35 (m, 1H), 2,40-3,0 (m, 6Н), 3,79 (уш. s, 1Н, ОН), 5,23 (m, 1H), 7,24-7,36 (m, 3Н), 7,65-7,67 (m, 2H). МС[М+1]+:318. (2R)-2-циклопентил-2-гідрокси-2-фенілоцтова кислота [описується М. Mitsuya й ін.; Bioorg. Med. Chem., (1999), 7, 2555-2567]. 1-етилпіролідин-3-ол є комерційно доступним. Спосіб (д) Проміжний продукт I-15 Одержання (3R)-1-(2-феноксіетил)піролідин-3-олу Розчиняли 0,5г (0,0057моля) (3R)-піролідин-3-олу (комерційно доступного) в 15мл ацетонітрилу. До отриманого розчину додавали 1,32г (0,0065моля) (2-брометокси)бензолу, 0,095г (0,00057моля) йодистого калію й 1,57г (0,0114моля) карбонату калію. Суміш перемішували протягом 72 годин при кімнатній температурі. Тверду речовину фільтрували й розчинник випарювали досуха. До залишку додавали хлороформ й отриманий розчин промивали водою й соляним розчином, сушили над сульфатом натрію й розчинник випарювали, одержували 1,43г маслоподібної речовини. Цей продукт очищали шляхом хроматографії на силікагелі, елююючи хлороформом/метанолом/гідроокисом амонію (90:10:1). Вихід вказаної в заголовку сполуки становив 1,08г (91,5%). МС [М+1]+: 208. 1 Н-ЯМР (CDCI3): δ 1,80 (m, 1H), 2,20 (m, 1H), 2,40 (m, 1H), 2,65 (m, 1H), 2,75-3,10 (m, 4H), 4,10 (t, 2H), 4,35 (m, 1H), 6,95 (m, 3H), 7,30 (m, 2H). (3R)-1-(2-Фeнoкcieтил)пipoлiдин-3-oл [описується в міжнародній заявці на патент WO 9625417 А1]. Проміжний продукт I-16 Одержання (3R)-(3-фeнoкcипpoпiл)пipoлiдин-3-oлy Одержували, як у випадку проміжного продукту I-15, з (3R)-nipofluiHH-3-олу (комерційно доступного) і (Збромпропокси)бензолу. Вихід вказаної в заголовку сполуки становив 2,26г (71,3%). МС [М+1]+: 222. 1 Н-ЯМР (CDCI3): δ 1,75 (m, 1H), 2,0 (m, 2Н), 2,10-2,40 (m, 2Н), 2,50 (m, 1H), 2,60-2,80 (m, 3Н), 2,90 (m, 1Н), 4,0 (t, 2H), 4,35 (m, 1H), 6,90 (m, 3H), 7,30 (m, 2H). Проміжний продукт І-17 Одержання (3R)-1-(3-тієн-2ілпропіл)піролідин-3-олу Одержували, як у випадку проміжного продукту I-15, з (3R)-пipoлiдин-3-олу (комерційно доступного) і 2-(3бромпропіл)тіофену. Ви хід вказаної в заголовку сполуки становив 1,02г (85%). МС [М+1]+: 212. 1 H-ЯMP (CDCI3): δ 1,65-2,0 (m, 3Н), 2,10-2,35 (m, 2Н), 2,40-2,60 (m, 3Н), 2,70 (m, 1H), 2,80-3,0 (m, 3Н), 4,35 (m, 1H), 6,80 (m, 1H), 6,90 (m, 1H), 7,10 (m, 1H). Проміжний продукт І-18 Одержання (3R)-1-фенетил)піролідин-3-олу Одержували, як у випадку проміжного продукту I-15, з (3R)-піролідин-3-олу (комерційно доступного) і (2брометил)бензолу. Вихід вказаної в заголовку сполуки становив 0,91г (83,5%). МС [М+1]+: 192. 1 Н-ЯМР (CDCI3): δ 1,65-1,85 (m, 1H), 2,10-2,40 (m, 2Н), 2,55 (m, 1H), 2,65-2,90 (m, 5H), 2,90-3,05 (m, 1H), 4,35 (m, 1H), 7,10-7,40 (m, 5H). 1-Фенетилпіролідин-3-ол [описується Zhu, Y-Q. і ін. в Yao Hsueh Hsueh Pao (1981), 16(3), 199-210]. Спосіб (e) Проміжний продукт І-19 Одержання (3R)-1-метилпіролідин-3-олу Розчиняли 15г (0,172моля) (3R)-пipoлiдин-3-oлy (комерційно доступного) в 240мл метилового спирту. Отриманий розчин охолоджували до 10-15°С і додавали невеликими порціями формальдегід (124,5мл 36%-го розчину у воді, розведеного 125мл метилового спирту) і боргідрид натрію (16,27г, 0,43моля), альтернативно протягом 1 години, підтримуючи температуру 10-15°С. Через 20 хвилин суміш нагрівали до кімнатної температури й реакцію продовжували протягом 1 години. Реакційну суміш підкисляли 2н. соляною кислотою, перемішували 20 хвилин і нейтралізували твердим бікарбонатом натрію. Метанол і більшу частину води випарювали й залишок розбавляли невеликою кількістю води, підлуговували твердим карбонатом калію й остаточно екстрагували хлороформом. Органічні фази об'єднували й сушили над сульфатом натрію. Хлороформ випарювали, одержували маслоподібний залишок, який очищали шляхом перегонки при зниженому тиску (0,2-0,3мбар, температура термостата 50-60°С), використовуючи тр убку з кульовим розширенням, одержували 14,91г (85,6%) вказаного в заголовку продукту. 1 H-ЯМР (CDCI3): δ 1,60-1,80 (m, 1H), 2,10-2,40 (m, 5H), 2,40-2,70 (m, 2H), 2,75-2,95 (m, 1H), 4,20-4,40 (m, 1H), 4,40-4,50 (уш. s, 1H, OH). Зразок в 1г отриманої речовини обробляли 1,5г (2R,3R)-bhhhoi кислота в метанолі/діетиловому ефірі, одержували 2,3г виннокислої солі, [α]D=+10,6° (c=1, Н2О)1. 1 [α] 22D=+11,1° (с=9,57, Н2О), [Sleevi й ін., J.Med. Chem, (1991), том 34, №4, 1314-1328]. Проміжний продукт I-20 Одержання (3S)-1-метилпіролідин-3-олу Одержували, як у випадку проміжного продукту I-19, з 2г (3S)-піролідин-3-олу (комерційно доступного). Одержували 1,65г (71,1%) маслоподібної речовини блідо-жовтого кольору, яку необов'язково було очищати шляхом перегонки. Цю речовину обробляли 2,5г (2S,3S)-винної кислоти в метанолі/діетиловому ефірі, одержували 3,65г виннокислої солі, [α]D=-11,3° (с=1, Н2О)2. 2 [α] 22D=-11,5° (с=1, Н2О), [Sleevi й ін., J.Med. Chem., (1991), том 34, №4, 1314-1328]. В обсяг даного винаходу також входять фармацевтичні композиції, які включають як активний інгредієнт, як мінімум, одне похідне піролідинію формули (І) разом з фармацевтично прийнятним носієм або розріджувачем. Переважно композиція готується у формі, яка підходить для перорального застосування. Фармацевтично прийнятні носій або розріджувачі, які змішують із активною сполукою або сполуками для утворення композиції за винаходом, добре самі по собі відомі й фактично використовувані наповнювачі залежать серед іншого від передбачуваного способу введення композиції. Композиції за винаходом переважно застосовуються для перорального введення. У цьому випадку композиція для перорального введення може бути у формі таблеток, таблеток з тонким шаром покриття, у рідкій лікарській формі для інгаляції, у порошкоподібній формі для інгаляції й у вигляді інгаляційного аерозолю; всі форми містять одну або декілька сполук за винаходом; такі препарати можуть бути отримані за допомогою добре відомих у даній галузі способів. Розріджувачі, які можуть бути використані при приготуванні композицій, включають такі рідкі й тверді розріджувачі, які сумісні з активним інгредієнтом, разом з барвниками й ароматизаторами, якщо бажано. Таблетки або таблетки з тонким шаром покриття можуть звичайно містити від 1 до 500мг, переважно від 5 до 300мг активного інгредієнта. Композиції для інгаляції можуть містити від 1мкг до 1000мкг, переважно від 10мкг до 800мкг активного інгредієнта. При лікуванні людей доза сполуки формули (І) залежить від бажаного ефекту й тривалості лікування; дози для дорослих звичайно становлять між 3мг й 300мг у день у вигляді таблеток і між 10мкг й 800мкг у день у вигляді композиції для інгаляції. Фармакологічна дія Результати за зв'язуванням людських мускаринових рецепторів і при дослідженні бронхоспазму в морських свинок були отримані, як описано нижче. Дослідження людських мускаринових рецепторів. Зв'язування N-[3Н]метилскополаміну ([3H]-NMS) з людськими мускариновими рецепторами проводили згідно із [Waelbroeck й ін. (1990), Моl. Pharmacol., 38: 267-273]. Досліди проводили при 25°С. Використали препарати мембран з підданих стійкій трансфекції клітин К1 яєчника китайського хом'ячка (СНО), які експресують гени для людських мускаринових рецепторів М3. Для визначення ІС50 (концентрація, яка викликає 50% інгібування) препарати мембран суспендували в забуференому фосфатом фізіологічному розчині Дюльбекко (DPBS) до кінцевої концентрації 89мкг/мл для підтану М3. С успензію мембран інкубували з насиченою тритієм сполукою протягом 60 хвилин. Після інкубування мембранну фракцію відокремлювали при фільтрації й визначали зв'язану радіоактивність. Неспецифічне зв'язування визначали при додатку 10-4Μ атропіну. Аналізували, як мінімум, шість концентрацій у паралельних дослідах для побудови індивідуальних кривих заміщення. Отримані результати показують, що сполуки за даним винаходом мають високу спорідненість до мускаринових рецепторів М3, переважно до людських мускаринових рецепторів. Так, ІС50 переважних сполук за винаходом нижче 35нМ. Найбільш переважні сполуки, як, наприклад, сполуки із прикладів 1-8, описані нижче, характеризуються значенням ІС50 нижче 20нМ. Тест на бронхоспазм у морських свинок Дослідження проводили згідно із [Η. Konzett й F. Rossler (1940), Arch. Exp. Path. Pharmacol. 195: 71-74]. Водні розчини призначених для дослідження засобів поміщали в розпилювач і проводили інгаляцію наркотизованих вентильованих самців морських свинок (Dunkin-Hartley). Бронхіальну відповідь на внутрішньовенну ацетилхолінову провокаційну пробу визначали до й після введення лікарського засобу й зміни в опорі в легені в деякі часові моменти виражали як відсоток пригнічення бронхоспазму. Сполуки за даним винаходом пригнічували бронхоспастичну реакцію на ацетилхолін з високою ефективністю й тривалою тривалістю дії. З описаних вище результатів звичайний фахівець у даній галузі зможе легко зрозуміти, що сполуки за даним винаходом мають відмінну антимускаринову активність відношенні М3 і тому корисні для лікування захворювань, у які задіяний мускариновий рецептор М3, включаючи респіраторні порушення, як, наприклад, хронічне обструктивне захворювання легень (COPD), бронхіт, підвищена реактивність бронхів, астма, кашель і риніт; урологічні порушення, як, наприклад, нетримання сечі, полакіурія, нейрогенний або нестабільний сечовий міхур, цистоспазм і хронічний цистит; шлунково-кишкові порушення, як, наприклад, синдром подразненої товстої кишки, спастичний коліт, виразка дивертикулу й шлунка; і серцево-судинні порушення, як, наприклад, індукована блукаючим нервом синусова брадикардія. Даний винахід далі забезпечує сполуку формули (І) або фармацевтично прийнятну композицію, яка включає сполуку формули (І), для застосування при лікуванні людини або тварини, зокрема, для лікування респіраторних, урологічних або шлунково-кишкових захворювань або порушень. Даний винахід далі забезпечує застосування сполуки формули (І) або фармацевтично прийнятної композиції, яка включає сполуку формули (І), для приготування лікарського засобу для лікування респіраторного, урологічного або шлунково-кишкового захворювання або порушення. Далі, сполуки формули (І) і фармацевтичні композиції, які включають сполуки формули (І), можуть бути застосовані в способі лікування респіраторного, урологічного або шлунково-кишкового захворювання або порушення, такий спосіб включає введення хворій людині або тварині при необхідності подібного лікування ефективної нетоксичної кількості сполуки формули (І) або фармацевтичної композиції, яка включає сполуку формули (І). Далі, сполуки формули (І) і фармацевтичні композиції, які включають сполуки формули (І), можуть бути застосовані в комбінації з іншими лікарськими засобами, ефективними при лікуванні вказаних захворювань. Наприклад, з β2-агоністами, стероїдами, протиалергічними лікарськими препаратами, інгібіторами фосфодіестерази IV та/або інгібіторами лейкотриєну D4 (LTD4) для одночасного, окремого або послідовного застосування при лікуванні респіраторного захворювання. Даний винахід далі буде проілюстрований наступними прикладами. Приклади наведені тільки як ілюстрація й не повинні розглядатися як такі, що обмежують винахід. Приклад 1 Трифторацетат 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-фенетил-піролідинію Вказану в заголовку сполуку одержували у вигляді суміші чотирьох стереоізомерів відповідно до способу (б) із проміжного продукту I-7. Вихід на кінцевій стадії склав 90мг (30%). MC [M-CF 3COO]+: 428. Приклад 2 (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-фенетилпіролідиній-бромід Вказану в заголовку сполуку одержували у вигляді суміші двох стереоізомерів відповідно до способу (а) із проміжного продукту I-4. Ви хід на кінцевій стадії склав 0,31г (84,7%). Τпл: 143,7-158,6°С. ВЕРХ: суміш діастереомерів 44:56. 1 Н-ЯМР (ДМСО-d 6): δ 2 ,10-2,30 (m, 1Н), 2,65-2,85 (m, 1H), 3,02-3,15 (m, 2H), 3,05 й 3,23 (s, 3Н), 3,40-3,85 (m, 5Н), 3,90-4,05 (m, 1H), 5,57 (m, 1Н), 6,90-6,95 (m, 1H), 7,0-7,05 (m, 1H), 7,05-7,22 (m, 2H), 7,25-7,42 (m, 5H), 7,42-7,60 (m, 3H). MC [M-Br]+: 428. Приклад 3 (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)-піролідинійбромід Вказану в заголовку сполуку одержували у вигляді суміші двох стереоізомерів відповідно до способу (а) із проміжного продукту I-1. Ви хід на кінцевій стадії склав 0,47г (81,6%). Τпл: 54,9-65,3°С. 1 Н-ЯМР: суміш діастереомерів 50:50. 1 Н-ЯМР (ДМСО-d6): δ 2,10-2,25 (m, 1H), 2,70-2,82 (m, 1H), 3,05 й 3,21 (s, 3H), 3,64-4,10 (m, 6H), 4,40 й 4,46 (m, 2H), 5,56 (m, 1H), 6,97-7,04 (m, 5H), 7,13-7,17 (m, 2H), 7,33-7,39 (m, 2H), 7,48-7,54 (m, 3H). MC [M-Br]+ 444. Приклад 4 (описаний у способі (б)) (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)-піролідинійбромід (діастереомер 1) Вказану в заголовку сполуку одержували у вигляді одного ізомеру відповідно до способу (б) із проміжного продукту I-5. Вихід на кінцевій стадії становив 0,85г (52,5% розраховуючи на один ізомер). Tпл: 198,8-199,4°C. 1 Н-ЯМР: діастереомер 1, 95:5. 1 Н-ЯМР (ДМСО-d6): δ 2,10-2,25 (m, 1H), 2,65-2,82 (m, 1H), 3,20 (s, 3H), 3,60-3,90 (m, 5H), 3,95-4,05 (m, 1H), 4,38 (m, 2H), 5,56 (m, 1H), 6,95-7,05 (m, 5H), 7,10-7,20 (m, 2H), 7,30-7,42 (m, 2H), 7,45-7,60 (m, 3H). MC [M-Br]+: 444. (* Конфігурація не визначена). Приклад 5 (описаний у способі (б)) (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(2-феноксіетил)-піролідинійбромід (діастереомер 2) Вказану в заголовку сполуку одержували у вигляді одного ізомеру відповідно до способу (б) із проміжного продукту I-5. Вихід на кінцевій стадії склав 0,47г (29% розраховуючи на один ізомер). Tпл: 85,9-87,6°C. 1 Н-ЯМР: діастереомер 2, 95:5. 1 Н-ЯМР (ДМСО-d6): δ 2,10-2,25 (m, 1H), 2,65-2,85 (m, 1H), 3,04 (s, 3H), 3,62-3,72 (m, 1H), 3,78-3,90 (m, 4H), 3,97-4,04 (m, 1H), 4,45 (m, 2H), 5,55 (m, 1H), 6,98-7,03 (m, 5H), 7,12-7,16 (m, 2H), 7,32-7,37 (m, 2H), 7,50-7,52 (m, 3H). MC [M-Br]+: 444. (* Конфігурація не визначена). Приклад 6 (описаний у способі (а)) (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-тієн-2-ілпропіл)-піролідинійбромід Вказану в заголовку сполуку одержували у вигляді суміші двох стереоізомерів відповідно до способу (а) із проміжного продукту I-3. Ви хід на кінцевій стадії склав 0,34г (93,2%). 1 Н-ЯМР: суміш діастереомерів 55:45. 1 Н-ЯМР (ДМСО-d 6): δ 1 ,95-2,20 (m, 3Н), 2,60-2,80 (m, 2Н), 2,80-2,90 (m, 1Н), 2,94 й 3.10 (s, 3Н), 3,20-3,45 (m, 2H), 3,45-3,95 (m, 4H), 5,52 (m, 1H), 6,90-7,05 (m, 4H), 7,10-7,20 (m, 2H), 7,37 (m, 1H), 7,40-7,55 (m, 3H). MC [M-Br]+: 448. Приклад 7 (описаний у способі (б)) 3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-феноксипропіл)-піролідинійбромід Вказану в заголовку сполуку одержували із проміжного продукту I-7 відповідно до способу (б) у вигляді суміші чотирьох стереоізомерів. Вихід на кінцевій стадії склав 0,75г (69,4%). Tпл: 55,3-56,8°C. 1 Н-ЯМР: суміш діастереомерів 56:44. 1 Н-ЯМР (ДМСО-d 6): δ 2 ,05-2,30 (m, 3Н), 2,60-2,80 (m, 1H), 2,96 й 3,12 (s, 3Н), 3,40-3,50 (m, 1H), 3,50-3,82 (m, 4H), 3,85-4,0 (m, 2H), 4,0-4,10 (m, 1H), 5,52 (m, 1H), 6,90-7,01 (m, 5H), 7,10-7,15 (m, 2H), 7,25-7,35 (m, 2H), 7,42-7,52 (m, 3H). MC [M-Br]+: 458. Приклад 8 (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-феноксипропіл)-піролідинійбромід Вказану в заголовку сполуку одержували із проміжного продукту I-2 у вигляді суміші двох стереоізомерів відповідно до способу (а). Вихід на кінцевій стадії склав 0,21г (70%). ВЕРХ: суміш діастереомерів 59:41. 1 Н-ЯМР (ДМСО-d6): δ 2,05-2,30 (m, 3Н), 2,65-2,80 (m, 1H), 3,0 й 3,15 (s, 3Н), 3,40-3,50 (m, 1H), 3,50-3,85 (m, 4H), 3,85-4,0 (m, 2H), 4,0-4,10 (m, 1H), 5,55 (m, 1H), 6,90-7,05 (m, 5H), 7,10-7,20 (m, 2H), 7,25-7,35 (m, 2H), 7,457,55 (m, 3H). MC [M-Br]+: 458. Приклад 9 (описаний у способі (а)) (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-феноксипропіл)-піролідинійбромід (діастереомер 1) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-2 відповідно до способу (а). Вихід на кінцевій стадії склав 0,628г (80,1% розраховуючи на один ізомер). Тпл: 86,2-89,6°С. 1 Н-ЯМР: діастереомер 1 (діастереомер 2 не спостерігається). 1 Н-ЯМР (ДМСО-d6): δ 2,10-2,30 (m, 3Н), 2,65-2,80 (m, 1H), 3,0 (s, 3Н), 3,50-3,65 (m, 3Н), 3,70-3,85 (m, 2Н), 3,85-3,95 (m, 1H), 4,05 (m, 2H), 5,54 (m, 1H), 6,90-7,05 (m, 5H), 7,10-7,20 (m, 2H), 7,25-7,35 (m, 2H), 7,50-7,55 (m, 3Н). MC [M-Br]+: 458 (* Конфігурація не визначена). Приклад 10 (описаний у способі (а)) (1*,3R)-3-(2-гiдpoкcи-2.2-дитiєн-2-iлaцeтoкcи)-1-мeтил-1-(3-феноксипропіл)-піролідинійбромід (діастереомер 2) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-2 відповідно до способу (а). Вихід на кінцевій стадії склав 0,559г (71,3% розраховуючи на один ізомер). Tпл: 87,1-89,0°С. 1 H-ЯМР: діастереомер 2 (діастереомер 1 не спостерігається). 1 Н-ЯМР (ДМСО-d6): δ 2,05-2,30 (m, 3Н), 2,65-2,80 (m, 1H), 3,15 (s, 3H), 3,40-3,55 (m, 2Н), 3,55-3,80 (m, 3Н), 3,95 (m, 3Н), 5,55 (m, 1Н), 6,90-7,05 (m, 5Н), 7,05-7,20 (m, 2Н), 7,30-7,40 (m, 2Н), 7,45-7,50 (m, 3Н). МС [М-Вr]+: 458 (* Конфігурація не визначена). Приклад 11 (описаний у способі (б)) (1*,3R)-1-метил-1-фенетил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинійбромід (діастереомер 1) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-8 відповідно до способу (б). Вихід на кінцевій стадії склав 0,301г (53,7% розраховуючи на один ізомер). Tпл: 232,3-233,1°С. ВЕРХ: діастереомер 1, 92,5:7,5. 1 H-ЯМР (ДМСО-d6): δ 2,0-2,15 (m, 1H), 2,55-2,70 (m, 1H), 3,0 (s, 3H), 3,0-3,10 (m, 2H), 3,45-3,75 (m, 5H), 3,85-3,92 (m, 1H), 5,30 (s, 1H), 5,36 (m, 1H), 7,10-7,50 (m, 13H). MC [M-Br]+: 414. (* Конфігурація не визначена). Приклад 12 (описаний у способі (б)) (1*,3R)-1-метил-1-фенетил-3-(9Н-ксантен-9-ілкарбонілокси)піролідинійбромід (діастереомер 2) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-8 відповідно до способу (б). Вихід на кінцевій стадії склав 0,193г (34,5% розраховуючи на один ізомер). Тпл: 79,6-81,2°С. ВЕРХ: діастереомер 2, 98,8:1,2. 1 H-ЯМР (ДМСО-d6): δ 2,0-2,10 (m, 1H), 2,55-2,70 (m, 1H), 3,0-3,10 (m, 2H), 3,17 (s, 3H), 3,45-3,55 (m, 2H), 3,55-3,75 (m, 3H), 3,85-3,92 (m, 1H), 5,24 (s, 1H), 5,38 (m, 1H), 7,0-7,15 (m, 4H), 7,25-7,50 (m, 9H). MC [M-Br]+: 414. (* Конфігурація не визначена). Приклад 13 (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілаліл)-піролідинійбромід (діастереомер 1) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-5 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 2 години. Очи щення за допомогою хроматографії на колонці (силікагель, елюент: дихлорметан + ізопропанол 30%®80%) приводило до 358мг (44,2%) вказаної в заголовку сполуки (перший елюйований діастереомер). 1 H-ЯМР: діастереомер 1 (діастереомер 2 не спостерігається). 1 H-ЯМР (ДМСО-d6): δ 7,60-7,50 (m, 5Н), 7,44-7,34 (m, 3Н), 7,16-7,12 (m, 2H), 7,02-6,98 (m, 2Н), 6,91 (d, 1Н), 6,57-6,45 (m, 1H), 5,55 (m, 1H), 4,24 (d, 2H), 4,04-3,96 (m, 1H), 3,74-3,64 (m, 3H), 2,97 (s, 3H), 2,19-2,61 (m, 1H), 2,23-2,12 (m, 1H). MC [M-Br]+: 440. (* Конфігурація не визначена). Приклад 14 (1*,3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілаліл)-піролідинійбромід (діастереомер 2) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-5 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 2 години. Очи щення за допомогою хроматографії на колонці (силікагель, елюент: дихлорметан + ізопропанол 30%®80%) приводило до 160мг (19,8%) вказаної в заголовку сполуки (другий елюйований діастереомер). 1 H-ЯМР: діастереомер 2 (діастереомер 1 не спостерігається). 1 Н-ЯМР (ДМСО-d6): δ 7,58-7,49 (m, 5Н), 7,45-7,36 (m, 3Н), 7, 18 (dd, 1Н), 7,13 (dd, 1H), 7,02-6,97 (m, 2H), 6,80 (d, 1H), 6,51-6,39 (m, 1H), 5,56 (m, 1H), 4,05 (d, 2H), 3,93-3,72 (m, 3H), 3,64-3,53 (m, 1H), 3,13 (s, 3H), 2,802,71 (m, 1H), 2,24-2,13 (m, 1H). MC [M-Br]+: 440. (* Конфігурація не визначена). Приклад 15 (3R)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(4-оксо-4-тієн-2-іл-бутил)піролідинійхлорид Вказану в заголовку сполуку одержували відповідно до способу (б) із проміжного продукту I-5 у вигляді суміші дво х стереоізомерів. Час реакції на останній стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 7 днів. Очищення продукту при промиванні декілька разів тетрагідрофураном при температурі кип'ятіння зі зворотним холодильником приводили до 120мг (8%) вказаної в заголовку сполуки (суміш двох стереоізомерів). ВЕРХ: суміш діастереомерів 3 8:62. 1 H-ЯМР (ДMCO-d6): δ 8,06-7,98 (m, 2Н), 7,60 (s, ОН, 1Н), 7,52-7,45 (m, 2H), 7,30-7,25 (m, 1H), 7,18-7,11 (m, 2H), 7,02-6,95 (m, 2H), 5,51 (m, 1H), 4,02-3,00 (m, 8H), 3,15 й 3,00 (s, 3H), 2,78-2,65 (m, 1H), 2,23-1,96 (m, 3H). MC [M-CI]+: 476. Приклад 16 (1*,3R)-1-[4-(4-фтopфeнiл)-4-oкcoбутил]-3-(2-гiдpoкcи-2,2-дитiєн-2-iл-ацетокси)-1-метилпіролідинійхлорид (діастереомер 1) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-5 відповідно до способу (б). Час реакції на останній стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 13 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 10%®90%) приводило до 187мг (25%) вказаної в заголовку сполуки (тільки елюйований діастереомер). 1 Н-ЯМР: діастереомер 1. 1 Н-ЯМР (ДМСО-d6): δ 8,10-8,04 (m, 2Н), 7,55-7,51 (m, 3Н), 7,38 (t, 2H), 7,18-7,13 (m, 2Н), 7,03-6,99 (m, 2Н), 5,53 (m, 1H), 3,95-3,70 (m, 3Н), 3,65-3,35 (m, 3Н), 3,16 (m, 2H), 2,99 (s, 3Н), 2,79-2,64 (m, 1H), 2,22-2,02 (m, 3H). MC [M-CI]+: 488. (* Конфігурація не визначена). Приклад 17 (1*,3S)-1-[3-(4-фторфенокси)пропіл]-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метилпіролідинійхлорид (діастереомер 1) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-6 відповідно до способу (б). Час реакції на останній стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 11 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 10%®85%) приводило до 309мг (41,5%) вказаної в заголовку сполуки (перший елюйований діастереомер). 1 H-ЯМР: діастереомер 1 (діастереомер 2 не спостерігається). 1 Н-ЯМР (ДМСО-d6): δ 7,54-7,51 (m, 3Н), 7,17-7,11 (m, 4H), 7,03-6,93 (m, 4H), 5,53 (m, 1Н), 4,02 (t, 2H), 3,953,38 (m, 6H), 2,98 (s, 3Н), 2,80-2,67 (m, 1H), 2,24-2,12 (m, 3H). MC [M-Cl]+: 476. (* Конфігурація не визначена). Приклад 18 (1*,3S)-1-[3-(4-фторфенокси)пропіл]-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метилпіролідинійхлорид (діастереомер 2) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-6 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 11 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 10%®85%) приводило до 62мг (8,5%) вказаної в заголовку сполуки (другий елюйований діастереомер). 1 H-ЯМР: діастереомер 2 (діастереомер 1 не спостерігається). 1 Н-ЯМР (ДМСО-d6): δ 7,49-7,47 (m, 3Н), 7,19-7,10 (m, 4H), 6,99-6,92 (m, 4H), 5,54 (m, 1H), 3,98-3,88 (m, 3Н), 3,75-3,61 (m, 3Н), 3,50-3,40 (m, 2H), 3,14 (s, 3Н), 2,79-2,64 (m, 1H), 2,23-2,06 (m, 3H). MC [M-CI]+: 476. (* Конфігурація не визначена). Приклад 19 (1*,3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілпропіл)-піролідинійбромід (діастереомер 1) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-6 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 8 днів. Очи щення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 10%®60%) приводило до 250мг (31,2%) вказаної в заголовку сполуки (перший елюйований діастереомер). 1 Н-ЯМР: діастереомер 1 (діастереомер 2 не спостерігається). 1 H-ЯМР (ДМСО-d 6): δ 7,46-7,44 (m, 3Н), 7,29-7,13 (m, 5H), 7,10 -7,05 (m, 2H), 6,96-6,92 (m, 2Н), 5,45 (m, 1Н), 3,85-3,77 (m, 1H), 3,71-3,31 (m, 5H), 2,87 (s, 3H), 2,71-2,58 (m, 1H), 2,54 (t, 2H), 2,13-1,90 (m, 3H). MC [M-Br]+: 442. (* Конфігурація не визначена). Приклад 20 (1*,3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-метил-1-(3-фенілпропіл)-піролідинійбромід (діастереомер 2) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-6 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 8 днів. Очи щення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 10%®60%) приводило до 169мг (20,8%) вказаної в заголовку сполуки (другий елюйований діастереомер). 1 Н-ЯМР: діастереомер 2 (діастереомер 1 не спостерігається). 1 H-ЯМР (ДМСО-d 6): δ 7,54-7,51 (m, 2Н), 7,50 (s, ОН, 1Н), 7,36-7,22 (m, 5H), 7,16 (dd, 1H), 7,11 (dd, 1H), 7,036,98 (m, 2H), 5,53 (m, 1H), 3,93-3,85 (m, 1H), 3,73-3,24 (m, 5H), 3,09 (s, 3H), 2,77-2,62 (m, 1H), 2,55 -2,45 (m, 2H), 2,18-2,09 (m, 1H), 2,03 -1,89 (m,2H). MC [M-Br]+: 442. (* Конфігурація не визначена). Приклад 21 (3R)-1-(2-бензилоксіетил)-3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-метилпіролідинійбромід (суміш стереоізомерів 1) Вказану в заголовку сполуку одержували у вигляді суміші стереоізомерів із проміжного продукту I-11 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 5 днів. Очи щення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 10%®50%) приводило до 169мг (53,0%) вказаної в заголовку сполуки (перша елюйована суміш стереоізомерів). 1 Н-ЯМР: суміш стереоізомерів 1. 1 Н-ЯМР (ДМСО-d6): δ 7,62 (m, 1Н), 7,37'-7,32 (m, 5H), 6,43-6,39 (m, 2H), 6,01 (s, ОН, 1H), 5,43 (m, 1H), 4,54 (m, 2H), 3,94-3,20 (m, 8H), 3,10-3,05 (d, 3H), 2,76-2,62 (m, 1H), 2,24-1,90 (m, 2H), 1,74-1,57 (m, 3H), 1,37 -1,11 (m, 7H). MC [M-Br]+: 442. Приклад 22 (3R)-1-(2-бензилоксіетил)-3-(2-циклогексил-2фyp-2-ил-2-гідроксіацетокси)-1-метилпіролідинійбромід (суміш стереоізомерів 2) Вказану в заголовку сполуку одержували у вигляді суміші стереоізомерів із проміжного продукту I-11 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 5 днів. Очи щення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 10%®50%) приводило до 125мг (40,0%) вказаної в заголовку сполуки (друга елюйована суміш стереоізомерів). 1 Н-ЯМР: суміш стереоізомерів 2. 1 Н-ЯМР (ДМСО-d 6): δ 7,58 (s, 1H), 7,35 (m, 5Н), 6,39 (m, 2Н), 6,00 (s, ОН, 1H), 5,44 (m, 1H), 4,55 (m, 2H), 3,91-3,20 (m, 8H), 3,20-3,04 (m, 3H), 2,65 (m, 1H), 2,23-1,86 (m, 2H), 1,65 (m, 3H), 1,38-1,06 (m, 7H). MC [M-Br]+: 442. Приклад 23 (1*,3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси-1-метил-1-(3-феноксипропіл)піролідинійбромід (діастереомер 1) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-13 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 63 години. Очищення шляхом хроматографії на колонці (силікагель, елюент: дихлорметан + ізопропанол 10%®30%) приводило до 248мг (36,6%) вказаної в заголовку сполуки (перший елюйований діастереомер). 1 Н-ЯМР: діастереомер 1 (діастереомер 2 не спостерігається). Н-ЯМР (ДМСО-d6): δ 7,59 (d, 2Н), 7,38-7,28 (m, 5Н), 6,98-6,91 (m, 3Н), 5,85 (s, ОН, 1Н), 5,38 (m, 1H), 4,04 (t, 2H), 3,91-3,51 (m, 6H), 3,05 (s, 3H), 2,98-2,84 (m, 1H), 2,71-2,61 (m, 1H), 2,25-2,07 (m, 3H), 1,59 1,16 (m, 8H). MC [M-Br]+: 438. (* Конфігурація не визначена). Приклад 24 (1*,3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси-1-метил-1-(3-феноксипропіл)піролідинійбромід (діастереомер 2) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-13 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 63 години. Очищення шляхом хроматографії на колонці (силікагель, елюент: дихлорметан + ізопропанол 10%®30%) приводило до 428мг (62,4%) вказаної в заголовку сполуки (другий елюйований діастереомер). 1 H-ЯМР: діастереомер 2 (діастереомер 1 не спостерігається). 1 Н-ЯМР (ДМСО-d6): δ 7,57 (d, 2Н), 7,36-7,18 (m, 5Н), 7,00-6,94 (m, 3Н), 5,84 (s, ОН, 1Н), 5,40 (m, 1H), 4,053,42 (m, 8H), 3,13 (s, 3H), 2,92-2,83 (m, 1H), 2,72-2,63 (m, 1H), 2,20-2,08 (m, 3H), 1,57-1,13 (m, 8H). MC [M-Br]+: 438. (* Конфігурація не визначена). Приклад 25 (1*,3R)-1-[3-(Бeнзo[1,3]дioкcoл-5-iлoкcи)пpoпiл]-1-мeтил-3-[(9H-кcaнтeн-9-ілкарбоніл)окси]піролідинійбромід (діастереомер 1) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-8 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 13 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 20%®40%) приводило до 219мг (29,7%) вказаної в заголовку сполуки (перший елюйований діастереомер). 1 H-ЯМР: діастереомер 1 (діастереомер 2 не спостерігається). 1 H-ЯМР (D MSO-d6): δ 7,47 (d, 2H), 7,41-7,33 (m, 2H), 7,21-7,13 (m, 4H), 6,82 (d, 1H), 6,63 (d, 1H), 6,37 (dd, 1H), 5,96 (s, 2H), 5,34 (m, 1H), 5,29 (s, 1H), 3,97-3,50 (m, 8H), 2,95 (s, 3H), 2,67-2,57 (m, 1H), 2,18-2,00 (m, 3H). MC [M-Br]+: 488. (* Конфігурація не визначена). Приклад 26 (1*,3R)-1-[3-(Бензо[1,3] діоксол-5-ілокси)пропіл]-1-метил-3-[(9Н-ксантен-9-ілкарбоніл)окси]піролідинійбромід (діастереомер 2) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-8 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 13 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 20%®40%) приводило до 443мг (60,3%) вказаної в заголовку сполуки (другий елюйований діастереомер). 1 Н-ЯМР: діастереомер 2 (діастереомер 1 не спостерігається). 1 Н-ЯМР (ДМСО-d6): δ 7,45-7,31 (m, 4Н), 7,18-7,09 (m, 4Н), 6,86 (d, 1H), 6,69 (d, 1H), 6,44 (dd, 1H), 5,97 (s, 2H), 5,35 (m, 1H), 5,25 (s, 1H), 3,99-3,82 (m, 3H), 3,66-3,40 (m, 5H), 3,11 (s, 3H), 2,66-2,58 (m, 1H), 2,12-1,99 (m, 3H). MC [M-Br]+: 488. (* Конфігурація не визначена). Приклад 27 (1*,3S)-1-метил-1-(3-о-толілоксипропіл)-3-[(9Н-ксантен-9-ілкарбоніл)окси]-піролідинійбромід (діастереомер 1) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-9 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 4 дні. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 10%®40%) приводило до 461мг (37,8%) вказаної в заголовку сполуки (перший елюйований діастереомер). 1 H-ЯМР: діастереомер 1 (діастереомер 2 не спостерігається). 1 Н-ЯМР (ДМСО-d6): δ 7,48-7,34 (m, 4H), 7,22-7,12 (m, 6H), 6,93-6,81 (m, 2H), 5,35 (m, 1H), 5,29 (s, 1Н), 4,02 (t, 2H), 3,85-3,69 (m, 3Н), 3,59-3,51 (m, 3Н), 2,96 (s, 3Н), 2,69-2,58 (m, 1H), 2,24-2,02 (m, 3Н), 2,16 (s, 3Н). MC [M-Br]+: 458. (* Конфігурація не визначена). Приклад 28 (1*,3S)-1-метил-1-(3-о-толілоксипропіл)-3-[(9Н-ксантен-9-ілкарбоніл)окси]-піролідинійбромід (діастереомер 2) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-9 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 4 дні. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 10%®40%) приводило до 704мг (59,2%) вказаної в заголовку сполуки (другий елюйований діастереомер). 1 H-ЯМР: діастереомер 2 (діастереомер 1 не спостерігається). 1 H-ЯМР (ДМСО-d6): δ 7,44-7,41 (m, 2Н), 7,34-7,24 (m, 2H), 7,21-7,07 (m, 6H), 6,99 (d, 1H), 6,89 (t, 1H), 5,37 (m, 1H), 5,25 (s, 1H), 4,01 (t, 2H), 3,94-3,85 (m, 1H), 3,69-3,63 (m, 3H), 3,48-3,41 (m, 2H), 3,13 (s, 3H), 2,71-2,56 1 (m, 1H), 2,19 (s, 3H), 2,19-2,00 (m, 3H). MC [M-Br]+: 458. (* Конфігурація не визначена). Приклад 29 (описаний у способі (б)) Форміат (3R)-3-{[(9-гідрокси-9H-флуорен-9-іл)карбоніл]окси}-1-метил-1-(4-оксо-4-фенілбутил)піролідинію Кип'ятили зі зворотним холодильником протягом 20 днів 0,575г (1,858ммоля) (3R)-1-мeтил-пipoлiдин-3iлoвoгo ефіру 9-гідрокси-9Н-флуорен-9-карбонової кислоти (проміжний продукт I-10) і 1,018г (5,576ммоля) 4хлор-1-фенілбутан-1-ону в 6мл тетрагідрофурану. Після закінчення цього часу тетрагідрофуран зливали й залишок промивали тетрагідрофураном для видалення алкілувального агента. Отриманий продукт (234мг) очищали за допомогою препаративної ВЕРХ-МС, одержували 65мг (7%) вказаної в заголовку сполуки (суміш двох стереоізомерів) у вигляді форміату. МС [М-НСОО-]+: 456. Умови, застосовувані при очищенні за допомогою ВЕРХ-МС: Колонка: Symmetry C18, 100 А, 5мкм 19´100мм, фірми Waters. Рухома фаза: А (Н2О 0,1% HCOONH 4, рН=3) і В (ацетонітрил 0,1% HCOONH 4, рН=3). Приклад 30 (3R)-3-(2-циклогексил-2-фyp-2-ил-2-гідроксіацетокси)-1-метил-1-[3-(метилфеніламіно)пропіл]піролідинійхлорид (суміш стереоізомерів 1) Вказану в заголовку сполуку одержували у вигляді суміші стереоізомерів із проміжного продукту I-11 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 27 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 5%®50%) приводило до 130мг (27%) вказаної в заголовку сполуки (перша елюйована суміш стереоізомерів). 1 Н-ЯМР: суміш стереоізомерів 1. 1 Н-ЯМР (ДМСО-d6): δ 7,62 (s, 1Н), 7,21-7,15 (m, 2H), 6,74 (d, 2H), 6,64 (t, 1H), 6,42-6,39 (m, 2H), 6,00 (s, OH, 1H), 5,43 (m, 1H), 3,90-3,30 (m, 6H), 3,05-3,01 (два s, 3H), 2,88 (s, 3H), 2,73-2,59 (m, 1H), 2,25-1,85 (m, 4H), 1,731,57 (m, 3H), 1,37-1,06 (m, 7H). MC [M-Cl]+: 455. Приклад 31 (3R)-3-(2-циклогексил-2-фyp-2-ил-2-гідроксіацетокси)-1-метил-1-[3-(метилфеніламіно)пропіл]піролідинійхлорид (суміш стереоізомерів 2) Вказану в заголовку сполуку одержували у вигляді суміші стереоізомерів із проміжного продукту I-11 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 27 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 5%®50%) приводило до 125мг (26%) вказаної в заголовку сполуки (друга елюйована суміш стереоізомерів). 1 Н-ЯМР: суміш стереоізомерів 2. 1 Н-ЯМР (ДМСО-d 6): δ 7,60 (s, 1H), 7,22-7,16 (m, 2H), 6,75 (d, 2H), 6,64 (t, 1H), 6,41 (m, 2H),), 6,07 (m, OH, 1H), 5,44 (m, 1H), 3,94-3,85 (m, 1H), 3,75-3,32 (m, 5H), 3,10 (s, 3Н), 2,90 (s, 3Н), 2,72-2,60 (m, 1H), 2,25 - 1,85 (m, 4H), 1,73 - 1,57 (m, 3H), 1,37-1,02 (m,7H). MC [M-CI]+: 455. Приклад 32 (3R)-1-[3-(Бeнзoтiaзoл-2-iлoкcи)пpoпiлl-3-(2-циклoгeкcил-2-фyp-2-ил-2-гідроксіацетоксиУІметилпіролідинійхлорид (суміш стереоізомерів 1) Вказану в заголовку сполуку одержували у вигляді суміші стереоізомерів із проміжного продукту I-11 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 26 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 10%®70%) приводило до 46мг (9,13 %) вказаної в заголовку сполуки (перша елюйована суміш стереоізомерів). 1 Н-ЯМР: суміш стереоізомерів 1. 1 Н-ЯМР (ДМСО-d6): δ 7,70 (d, 1H), 7,60 (s, 1H), 7,46-7,39 (m, 2H), 7,27-7,21 (m, 1H), 6,39 (m, 2H), 5,99 (s, OH, 1H), 5,43 (m, 1H), 4,02 (t, 2H), 3,90-3,65 (m, 2H), 3,65-3,20 (m, 4H), 3,03-3,00 (два s, 3H), 2,75-2,55 (m, 1H), 2,25-1,90 (m, 4H), 1,80-1,50 (m, 3H), 1,40-1,01 (m, 7H). MC [M-Cl]+: 499. Приклад 33 (3R)-1-[3-(Бeнзoтiaзoл-2-iлoкcи)пpoпiл]-3-(2-циклoгeкcил-2-фyp-2-ил-2-гідроксіацетоксиМметилпіролідинійхлорид (суміш стереоізомерів 2) Вказану в заголовку сполуку одержували у вигляді суміші стереоізомерів із проміжного продукту I-11 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 26 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 10%®70%) приводило до 167мг (32,37%) вказаної в заголовку сполуки (друга елюйована суміш стереоізомерів). ^-Я МР: суміш стереоізомерів 2. 1 H-ЯMP (ДМСО-d6): δ 7,69 (d, 1H), 7,60 (m, 1H), 7,49-7,38 (m, 2H), 7,27-7,20 (m, 1H), 6,39 (m, 2H), 6,01 (s, OH, 1H), 5,42 (m, 1H), 4,02 (m, 2H), 3,90-3,65 (m, 2H), 3,65-3,45 (m, 2H), 3,45-3,30 (m, 2H), 3,04-3,00 (два s, 3H), 2,75-2,55 (m, 1H), 2,25-1,85 (m, 4H), 1,73-1,56 (m, 3H), 1,35-1,01 (m, 7H). MC [M-Cl]+: 499. Приклад 34 (3R)-1-[3-(Бензотіазол-2-ілокси)пропіл-3-(2-циклогексил-2фyp-2-ил-2-гідроксіацетокси)-1 метилпіролідинійхлорид (суміш стереоізомерів 3) Вказану в заголовку сполуку одержували у вигляді суміші стереоізомерів із проміжного продукту I-11 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 26 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 10%®70%) приводило до 220мг (41,5%) вказаної в заголовку сполуки (третя елюйована суміш стереоізомерів). ^-Я МР: суміш стереоізомерів 3. 1 Н-ЯМР (ДМСО-d 6): δ 7,71 (d, 1Н), 7,60 (s, 1H), 7,52-7,38 (m, 2H), 7,25 (t, 1H), 6,41 (m, 2H), 6,07-6,04 ( два s, OH, 1H), 5,43 (m, 1H), 4,03 (m, 2H), 3,95-3,86 (m, 1H), 3,69-3,30 (m, 5H), 3,08 (s, 3H), 2,64 (m, 1H), 2,25-1,90 (m, 4H), 1,72-1,56 (m, 3H), 1,40-1,02 (m,7H). MC [M-Cl]+: 499. Приклад 35 3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-етил-1-(3-фенілсульфаніл-пропіл)піролідинійбромід (суміш стереоізомерів 1) Вказану в заголовку сполуку одержували у вигляді суміші стереоізомерів із проміжного продукту I-12 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 14 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 5%®15%) приводило до 153мг (29,2%) вказаної в заголовку сполуки (перша елюйована суміш стереоізомерів). 1 Н-ЯМР: суміш стереоізомерів 1. 1 Н-ЯМР (ДМСО-d6): 6 7,63 (s, 1H), 7,40-7,32 (m, 4H), 7,25-7,20 (m, 1H), 6,43-6,38 (m, 2H), 5,99 (s, OH, 1H), 5,41 (m, 1H), 3,87-3,18 (m, 6H), 3,04 (m, 2H), 2,66-2,54 (m, 1H), 2,25-1,90 (m, 4H), 1,73-1,58 (m, 3H), 1,36-1,05 (m, 10H). MC [M-Br]+: 472. Приклад 36 3-(2-циклогексил-2-фур-2-ил-2-гідроксіацетокси)-1-етил-1-(3-фенілсульфаніл-пропіл)піролідиній бромід (суміш стереоізомерів 2) Вказану в заголовку сполуку одержували у вигляді суміші стереоізомерів із проміжного продукту I-12 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 14 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 5%®15%) приводило до 226мг (43,8 %) вказаної в заголовку сполуки (друга елюйована суміш стереоізомерів). Ή-ЯМР: суміш стереоізомерів 2. 1 H-ЯМР (ДМСО-d6): δ 7,61 (s, 1H), 7,41-7,32 (m, 4H), 7,24 (m, 1H), 6,40 (m, 2H), 6,02- 6,00 ( два s, ОН, 1Н), 5,42 (m, 1H), 3,88-3,80 (m, 1H), 3,69-3,26 (m, 5H), 3,04 (m, 2H), 2,65-2,55 (m, 1H), 2,25-1,85 (m, 4H), 1,73-1,56 (m, 3H), 1,43-1,02 (m, 10H). MC [M-Br]+: 472. Приклад 37 (1*,3R)-1-[3-(Бiфeнiл-4-iлoкcи)пpoпiл]-3-[(2R)-2-циклoпeнтил-2-гiдpoкcи-2-фенілацетокси]-1метилпіролідинійхлорид (діастереомер 1) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-13 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 4 дні. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 5%®20%) приводило до 81мг (27,7%) вказаної в заголовку сполуки (перший елюйований діастереомер). 1 Н-ЯМР: діастереомер 1 (діастереомер 2 не спостерігається). 1 H-ЯМР (ДМСО-d6): δ 7,61-7,58 (m, 6Η), 7,42-7,24 (m, 6H), 7,02 (d, 2Н), 5,82 (s, ОН, 1Н), 5,39 (m, 1H), 4,124,08 (m, 2H), 3,91-3,55 (m, 6H), 3,07 (s, 3H), 2,95-2,65 (m, 2H), 2,27-2,09 (m, 3H), 1,61-1,17 (m, 8H). MC [M-CI]+:514. (* Конфігурація не визначена). Приклад 38 (1*,3R)-1-[3-(Біфеніл-4-ілокси)пропіл]-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1метилпіролідинійхлорид (діастереомер 2) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-13 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 4 дні. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 5%®20%) приводило до 111мг (38,3%) вказаної в заголовку сполуки (другий елюйований діастереомер). 1 Н-ЯМР: діастереомер 2 (діастереомер 1 не спостерігається). 1 Н-ЯМР (ДМСО-d6): δ 7,64-7,55 (m, 6H), 7,42 (t, 2Н), 7,33-7,19 (m, 4H), 7,04 (d, 2Н), 5,81 (s, ОН, 1Н), 5,40 (m, 1H), 4,10-4,06 (m, 2H), 3,90 (dd, 1H), 3,80 -3,50 (m, 5H), 3,13 (s, 3H), 2,93-2,83 (m, 1H), 2,75-2,62 (m, 1H), 2,242,08 (m, 3H), 1,64-1,10 (m, 8H). MC[M-CI]+:514. (* Конфігурація не визначена). Приклад 39 (1*,3R)-3-[(2-R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-[3-(5,6,7,8-тетрагідронафталін-2ілокси)пропіл]піролідинійбромід (діастереомер 1) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-13 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 5 днів. Очи щення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 0%®30%) приводило до 93мг (30,6 %) вказаної в заголовку сполуки (перший елюйований діастереомер). 1 Н-ЯМР: діастереомер 1 (діастереомер 2 не спостерігається). 1 Н-ЯМР (ДМСО-d6): δ 7,58 (d, 2Н), 7,34 (t, 2Н), 7,28-7,23 (m, 1Н), 6,94 (d, 1H), 6,67-6,61 (m, 2H), 5,81 (s, OH, 1H), 5,37 (m, 1H), 3,97 (t, 2H), 3,85 (dd, 1H), 3,79-3,30 (m, 5H), 3,04 (s, 3H), 2,90 (m, 1H), 2,67-2,62 (m, 5H), 2,16 (m, 3H), 1,70-1,23 (m, 12H). MC [M-Br]+: 492. (* Конфігурація не визначена). Приклад 40 (1*,3R)-3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-[3-(5,6,7,8-тетрагідронафталін-2ілокси)пропіл]піролідинійбромід (діастереомер 2) Вказану в заголовку сполуку одержували у вигляді одного ізомеру із проміжного продукту I-13 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 5 днів. Очи щення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 0%®30%) приводило до 163мг (54,4%) вказаної в заголовку сполуки (другий елюйований діастереомер). 1 H-ЯМР: діастереомер 2 (діастереомер 1 не спостерігається). 1 H-ЯМР (ДМСО-d6): δ 7,55 (d, 2Н), 7,29 (t, 2Н), 7,23-7,19 (m, 1H), 6,96 (d, 1H), 6,68-6,63 (m, 2H), 5,80 (s, ОН, 1H), 5,39 (m, 1H), 3,97 (t, 2H), 3,89 (dd, 1H), 3,78-3,30 (m, 5Н), 3,11 (s, 3Н), 2,87 (m, 1H), 2,68-2,63 (m, 3H), 2,192,06 (m, 3H), 1,70-1,03 (m, 12H). MC [M-Br]+: 492. (* Конфігурація не визначена). Приклад 41 3-[(2R)-2-циклoпeнтил-2-гiдpoкcи-2-фeнiлaцeтoкcи]-1-eтил-1-[3-(4-метоксифенокси)пропіл]піролідинійбромід (суміш стереоізомерів 1) Вказану в заголовку сполуку одержували у вигляді суміші стереоізомерів із проміжного продукту I-14 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 19 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 0%®20%) приводило до 202мг (24,1%) вказаної в заголовку сполуки (перша елюйована суміш стереоізомерів). 1 Н-ЯМР: суміш стереоізомерів 1. 1 Н-ЯМР (ДМСО-d 6): δ 7,58 (m, 2Н), 7,39-7,24 (m, 3Н), 6,86 (s, 4H), 5,84 (s, ОН, 1H), 5,38 (m, 1H), 3,95 (t, 2H), 3,92-3,80 (m, 1H), 3,69 (s, 3H), 3,69-3,27 (m, 7H), 2,91 (m, 1H), 2,60 (m, 1H), 2,07 (m, 3H), 1,59-1,11 (m, 11H). MC [M-Br]+: 482. Приклад 42 3-[(2R)-2-циклопентил-2-гідрокси-2-фенілацетокси]-1-метил-1-[3-(4-метоксифенокси)пропіл]піролідинійбромід (суміш стереоізомерів 2) Вказану в заголовку сполуку одержували у вигляді суміші стереоізомерів із проміжного продукту I-14 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 19 днів. Очищення шляхом хроматографії на колонці (силікагель, елюент: хлороформ + ізопропанол 0%®20%) приводило до 384мг (46,9%) вказаної в заголовку сполуки (друга елюйована суміш стереоізомерів). ^-ЯМР: суміш стереоізомерів 2. 1 Н-ЯМР (ДМСО-d6): δ 7,57 (d, 2Н), 7,35-7,20 (m, 3Н), 6,88 (s, 4H), 5,86 (s, ОН, 1Н), 5,39 (m, 1H), 3,98-3,84 (m, 3H), 3,69 (s, 3H), 3,74-3,30 (m, 7H), 2,88 (m, 1H), 2,59 (m, 1H), 2,13-1,96 (m, 3H), 1,56-1,12 (m, 11H). MC [M-Br]+: 482. Приклад 43 Форміат (3R)-1-[4-(4-фторфеніл)-4-оксобутил]-3-(2-гідрокси-2,2-дитієн-2-іл-ацетокси)-1-метилпіролідинію Вказану в заголовку сполуку одержували у вигляді суміші дво х стереоізомерів із проміжного продукту I-5 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 24 дні. Після закінчення цього часу тетрагідрофуран зливали й залишок промивали тетрагідрофураном для видалення алкілувального агента. Отриманий продукт (88мг) очищали за допомогою препаративної ВЕРХ-МС (в умовах, описаних у прикладі 29), одержували 30,1мг вказаної в заголовку сполуки (суміш дво х стереоізомерів). МС [М-НСОО-]+: 488. Приклад 44 Форміат (3S)-3-(2-гідрокси-2,2-дитієн-2-ілацетокси)-1-[3-(3-гідроксифенокси)пропіл]-1-метилпіролідинію Вказану в заголовку сполуку одержували у вигляді суміші дво х стереоізомерів із проміжного продукту I-6 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 19 днів. Після закінчення цього часу те трагідрофуран випарювали й частину отриманого залишку очищали за допомогою препаративної ВЕРХ-МС (в умовах, описаних у прикладі 29), одержували 5,0мг вказаної в заголовку сполуки (суміш дво х стереоізомерів). МС [М-НСОО-]+: 474. Приклад 45 Форміат (3R)-1-[3-(3-цiaнфeнoкcи)пpoпiл]-3-(2-циклoгeкcил-2-фуp-2-ил-2-гідроксіацетокси)-1метилпіролідинію Вказану в заголовку сполуку одержували у вигляді суміші стереоізомерів із проміжного продукту I-11 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 25 днів. Після закінчення цього часу те трагідрофуран випарювали й частину отриманого залишку очищали за допомогою препаративної ВЕРХ-МС (в умовах, описаних у прикладі 29), одержували 65,6мг вказаної в заголовку сполуки (суміш стереоізомерів). МС [М-НСОО-]+: 467. Приклад 46 Форміат (3R)-3-(7-циклогексил-2-фyp-2-ил-2-гідроксіацетокси)-1-метил-1-[3-(нафталін-1ілокси)пропіл]піролідинію Вказану в заголовку сполуку одержували у вигляді суміші стереоізомерів із проміжного продукту I-11 відповідно до способу (б). Час реакції на кінцевій стадії (умови: тетрагідрофуран, температура кипіння зі зворотним холодильником) становив 25 днів. Після закінчення цього часу те трагідрофуран випарювали й частину отриманого залишку очищали за допомогою препаративної ВЕРХ-МС (в умовах, описаних у прикладі 29), одержували 13,9мгвказаної в заголовку сполуки (суміш стереоізомерів). МС [М-НСОО-]+: 492. У наступних прикладах ілюстр уються фармацевтичні композиції згідно із даним винаходом й методики їх приготування. Приклад 47 Приготування фармацевтичної композиції: таблетки Технологія приготування готової лікарської форми: Сполука за даним винаходом 5,0мг Лактоза 113,6мг Мікрокристалічна целюлоза 28,4мг Легкий кремінний ангідрид 1,5мг Стеарат магнію 1,5мг За допомогою змішувального пристрою змішували 15г сполуки за винаходом з 340,8г лактози й 85,2г мікрокристалічної целюлози. Суміш піддавали пресуванню, застосовуючи роликовий ущільнювач для одержання пластівчастого спресованого продукту. Пластівчастий спресований продукт подрібнювали в порошок, використовуючи молотковий млин, і подрібнений матеріал просіювали через сито 20меш. До просіяного матеріалу додавали порцію в 4,5г легкого кремінного ангідриду й 4,5г стеарату магнію й змішували. Змішаний продукт піддавали таблетуванню на таблетувальній машині, обладнаною системою штамнування/перфорації діаметром 7,5мм, у такий спосіб одержували 3,000 таблеток, кожна масою 150мг. Приклад 48 Приготування фармацевтичної композиції: таблетки з покриттям Технологія приготування готової лікарської форми: Сполука за даним винаходом 5,0мг Лактоза 95,2мг Кукур удзяний крохмаль 40,8мг Полівінілпіролідон К25 7,5мг Стеарат магнію 1,5мг Гідроксипропілцелюлоза 2,3мг Поліетиленгліколь 6000 0,4мг Двоокис титану 1,1мг Очищений тальк 0,7мг Застосовуючи пристрій для грануляції в псевдозрідженому шарі, 15г сполуки за даним винаходом змішували з 285,6г лактози й 122,4г кукурудзяного крохмалю. Окремо розчиняли 22,5г полівінілпіролідону в 127,5г води для одержання сполучного розчину. Застосовуючи пристрій для грануляції в псевдозрідженому шарі, зв'язуючий розчин розпилювали на згадану вище суміш для одержання грануляту. До отриманого грануляту додавали порцію в 4,5г стеарату магнію й перемішували. Отриману суміш піддавали таблетуванню на таблетувальній машині, обладнаної системою штамнування/перфорації із двоввігнутою поверхнею діаметром 6,5мм, у такий спосіб одержували 3,000 таблеток, кожна масою 150мг. Окремо готували розчин для покриття шляхом суспендування 6,9г гідроксипропілметилцелюлози 2910, 1,2г поліетиленгліколю 6000, 3,3г двоокису титану й 2,1г очищеного тальку в 72,6г води. Застосовуючи прилад High Coated, на 3,000 таблеток, отриманих вище, наносили розчин для покриття для одержання таблеток із плівковим покриттям, маса кожної таблетки становила 154,5мг. Приклад 49 Приготування фармацевтичної композиції: рідка лікарська форма для інгаляції Технологія приготування готової лікарської форми: Сполука за даним винаходом 400мкг Фізіологічний розчин 1мл Розчиняли 40мг сполуки за даним винаходом в 90мл фізіологічного розчину й розчин доводили до загального об'єму в 100мл цим же фізіологічним розчином, розподіляли порції в 1мл в ампули об'ємом в 1мл і потім стерилізували при 115°С протягом 30 хвилин, одержували рідку лікарську форму для інгаляції. Приклад 50 Приготування фармацевтичної композиції: порошкоподібна лікарська форма для інгаляції Технологія приготування готової лікарської форми: Сполука за даним винаходом 200мкг Лактоза 4,000мкг Рівномірно змішували 20г сполуки за даним винаходом з 400г лактози й порцію суміші в 200мг упаковували в інгалятор для порошку для виняткового використання з метою продукування порошку, який вдихається. Приклад 51 Приготування фармацевтичної композиції: аерозоль для інгаляції Технологія приготування готової лікарської форми: Сполука за даним винаходом 200мкг Дегідратований (абсолютний) етиловий спирт за фармакопеєю США 8,400мкг 1,1,1,2-Тетрафторетан (HFC-134А) 46,810мкг Готують концентрат активного інгредієнта, розчиняючи 0,0480г сполуки за даним винаходом в 2,0160г етилового спирту. Концентрат додають у відповідний заповнюючий прилад. Концентрат активного інгредієнта розподіляють в аерозольному балоні, вільний простір над концентратом в аерозольному балоні продувають азотом або парою HFC-134A (інгредієнти для продування не повинні містити кисень у концентрації більше 1ч/млн) і герметизують за допомогою клапана. Потім герметизований балон заповнюють під тиском 11,2344г газа-витискувача HFC-134A.
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrrolidinium derivatives, process for the preparation thereof (variants), intermediate (variants), pharmaceutical composition, combined product
Автори англійськоюPrat Quinones, Maria, Fernandez Forner Maria Dolors
Назва патенту російськоюПроизводные пирролидиния, способ их получения (варианты), промежуточное соединение (варианты), фармацевтическая композиция, комбинированный продукт
Автори російськоюПрат Киньонес Мария, Фернандес Форнер Мария Долорс
МПК / Мітки
МПК: C07D 207/12, A61P 1/00, A61P 13/10, C07D 405/12, A61P 11/00, C07D 417/14, C07D 409/14, C07D 405/14
Мітки: сполука, композиція, фармацевтична, комбінований, спосіб, проміжна, піролідинію, похідні, варіанти, продукт, одержання
Код посилання
<a href="https://ua.patents.su/24-79283-pokhidni-pirolidiniyu-sposib-kh-oderzhannya-varianti-promizhna-spoluka-varianti-farmacevtichna-kompoziciya-kombinovanijj-produkt.html" target="_blank" rel="follow" title="База патентів України">Похідні піролідинію, спосіб їх одержання (варіанти), проміжна сполука (варіанти), фармацевтична композиція, комбінований продукт</a>
Попередній патент: Пристрій для очищення поверхні води від нафтопродуктів
Наступний патент: Похідні ациламінобензолу як селективні інгібітори моноаміноксидази b
Випадковий патент: Плазмовий реактор металевих наночастинок












