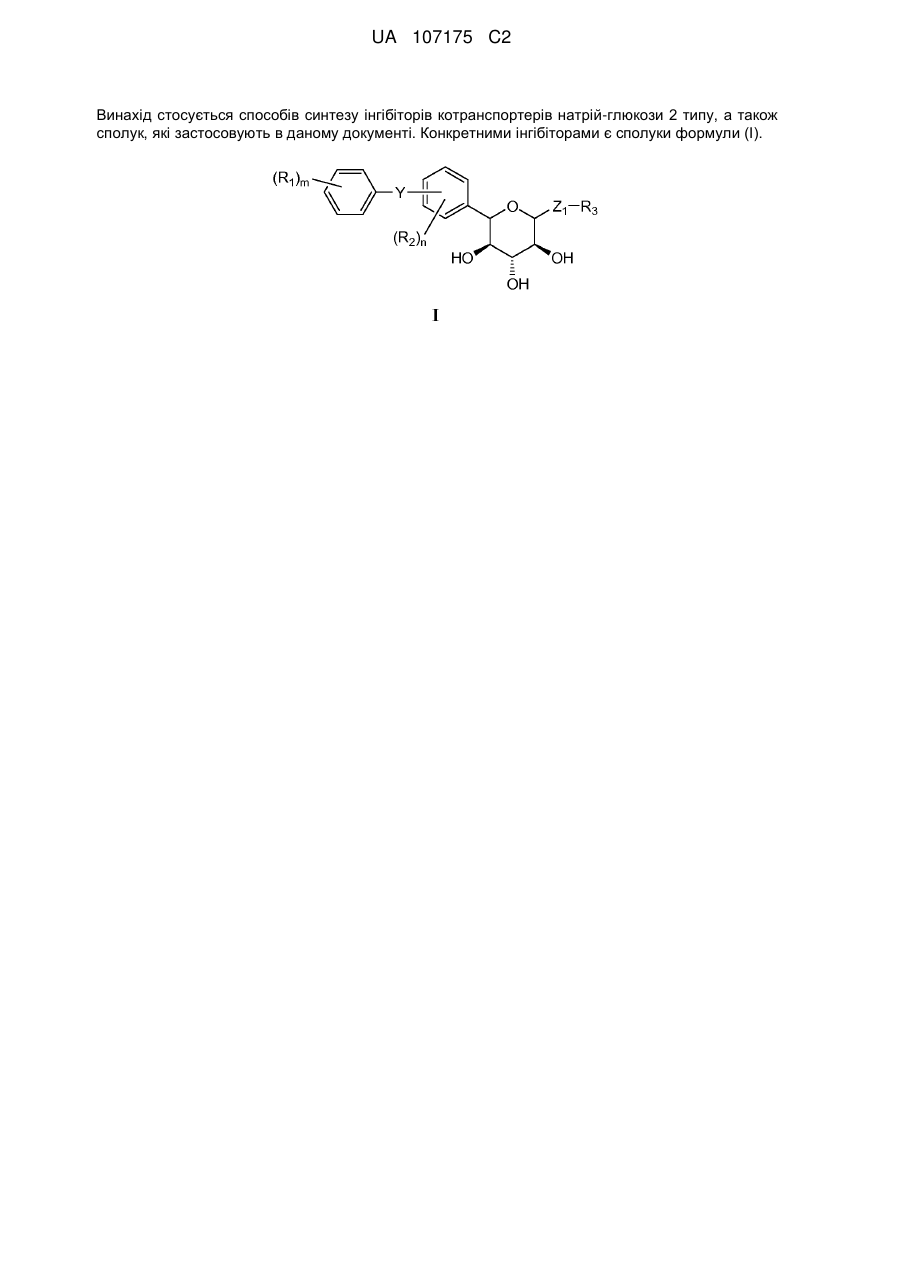
Спосіб і сполука, призначені для одержання інгібіторів контранспортера натрій-глюкози 2 типу, варіанти
Номер патенту: 107175
Опубліковано: 10.12.2014
Автори: Чжао Меттью Манчжу, Чжан Хаймін, Сонг Цюлін, Іімура Сінія, Янь Цзе, Мейбон Росс, Харрісон Брайс Олден, У Веньсюе, Гудвін Ніколь Кетлін
Формула / Реферат
1. Спосіб одержання сполуки формули І
 I
I
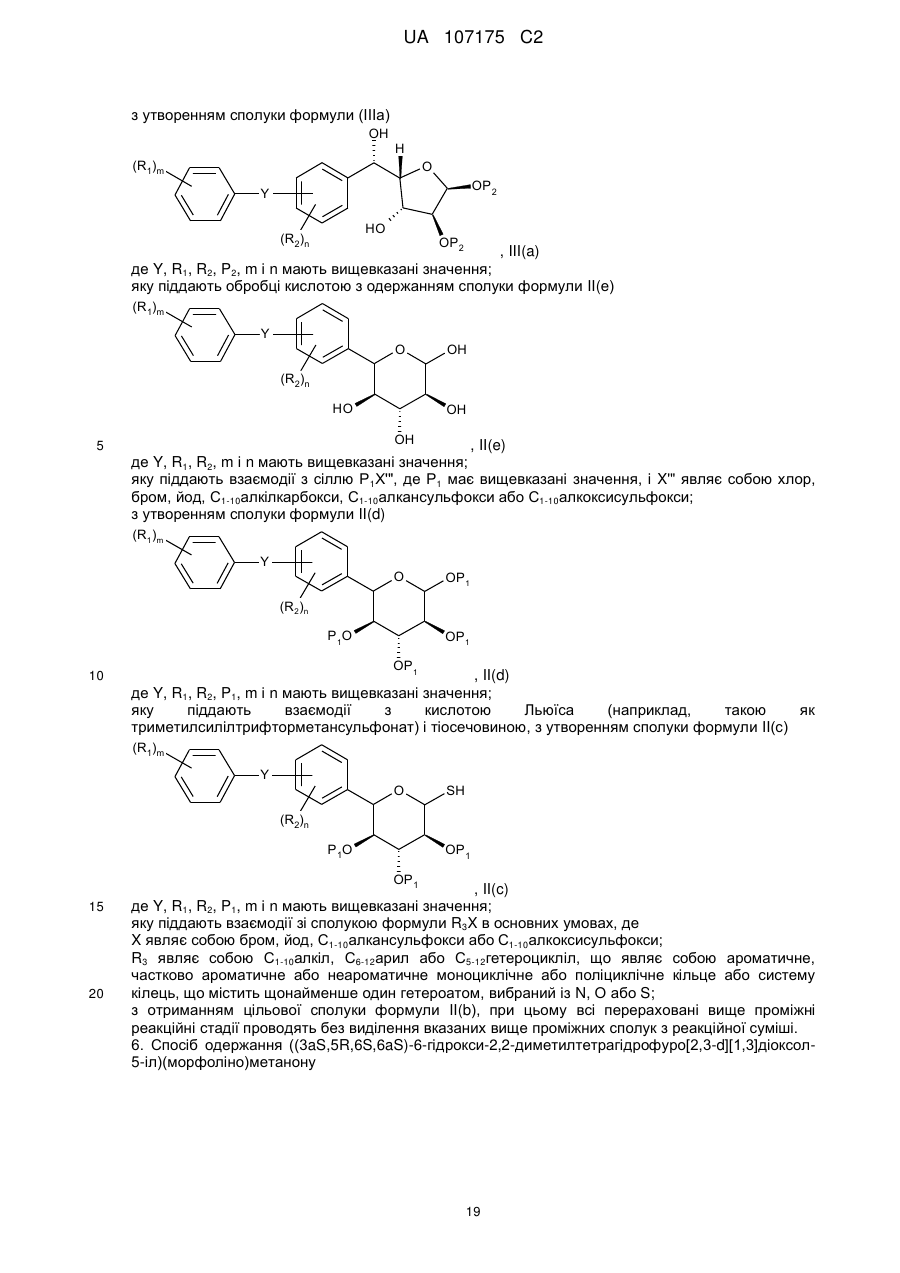
або її солі, в якому здійснюють стадію, на якій сполуку формули II
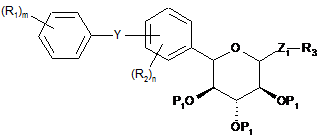 II
II
піддають взаємодії з основою з одержанням сполуки формули І, де
Y являє собою О, S, NR4 або C(R4)2;
Z1 являє собою О, S, SO або SO2;
кожний Р1 незалежно являє собою гідроксизахисну групу, стійку в кислих умовах;
кожний R1 незалежно являє собою водень, галоген, ціано, OR1A, SR1A або С1-10алкіл;
кожний R1A незалежно являє собою водень або С1-10алкіл або С6-12арил;
кожний R2 незалежно являє собою водень, галоген, ціано, OR2A, SR2A або С1-10алкіл;
кожний R2A незалежно являє собою водень або С1-10алкіл, або С6-12арил;
R3 являє собою С1-10алкіл або С6-12арил, або С5-12гетероцикліл, що являє собою ароматичне, частково ароматичне або неароматичне моноциклічне або поліциклічне кільце або систему кілець, що містить щонайменше один гетероатом, вибраний з N, О або S;
кожний R4 незалежно являє собою водень або С1-10алкіл;
n дорівнює 1-3 і
m дорівнює 1-3.
2. Спосіб за п. 1, де сполука формули І являє собою сполуку формули
aбо
 ,
,
де Z1 являє собою S або SO2.
3. Спосіб за п. 1, де Z1 являє собою SO2, і сполуку формули II одержують окисненням (наприклад, з використанням пероксидної сполуки, такої як м-хлорпербензойна кислота, пероцтова кислота, оксон або суміш пероксиду водню або комплексу пероксиду водню (наприклад, сечовини з пероксидом водню) та ангідриду кислоти (наприклад, фталевий ангідрид)) сполуки формули II(а)
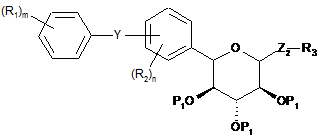 , ІІ(a)
, ІІ(a)
де Z2 являє собою S або SO.
4. Спосіб за будь-яким з пп. 1-3, в якому додатково здійснюють кристалізацію сполуки формули І.
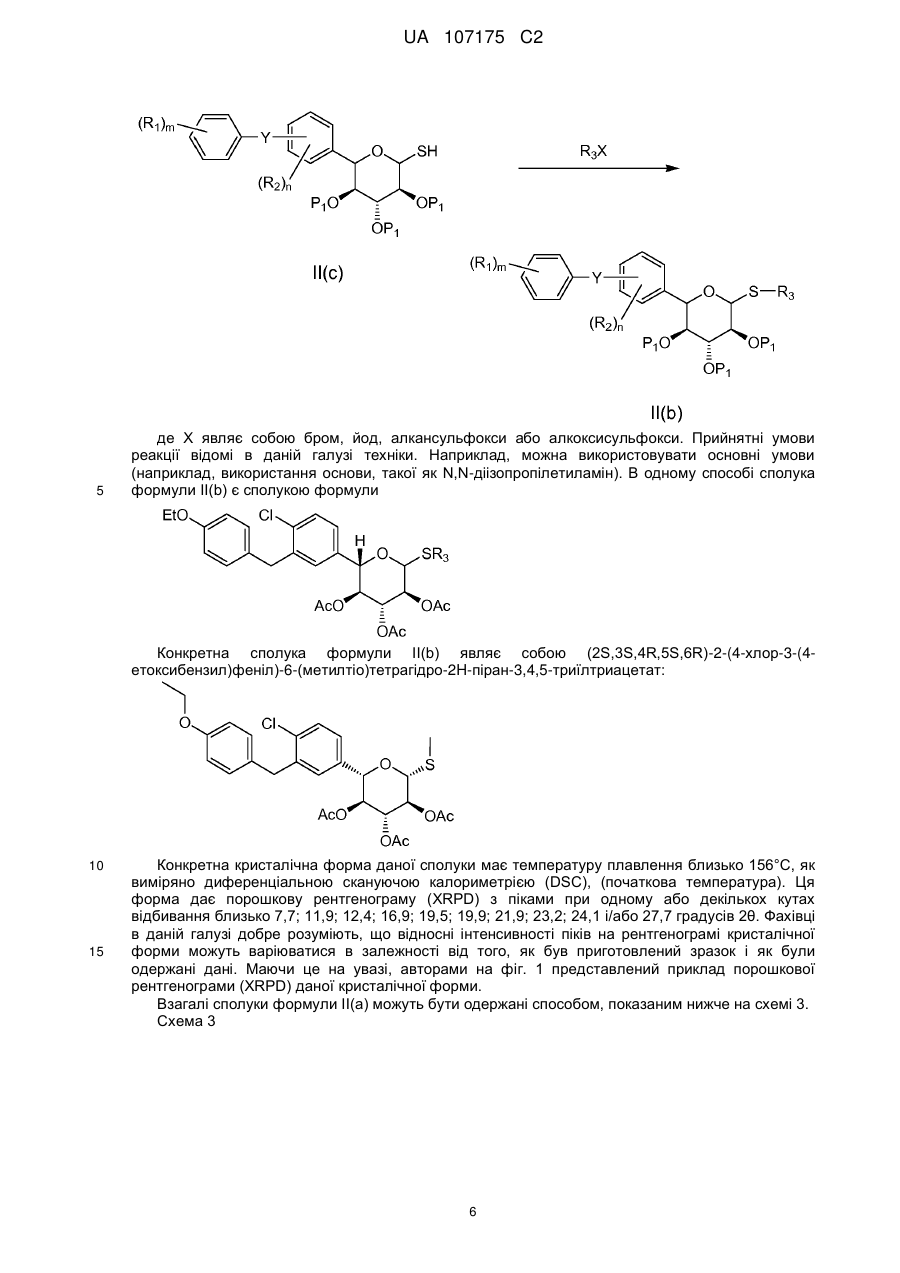
5. Спосіб одержання сполуки формули II(b)
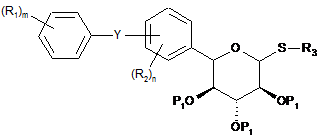 , II(b)
, II(b)
де Y являє собою О, S, NR4 або C(R4)2;
кожен P1 незалежно являє собою гідроксизахисну групу, стійку в кислих умовах;
кожен R1 незалежно являє собою водень, галоген, ціано, OR4, SR4 або С1-10алкіл;
кожен R2 незалежно являє собою водень, галоген, ціано, OR4, SR4 або С1-10алкіл;
R3 являє собою С1-10алкіл, С6-12арил або С5-12гетероцикліл, що являє собою ароматичне, частково ароматичне або неароматичне моноциклічне або поліциклічне кільце або систему кілець, що містить щонайменше один гетероатом, вибраний із N, О або S;
кожен R4 незалежно являє собою водень або С1-10алкіл;
n дорівнює 1-2 і
m дорівнює 1-2;
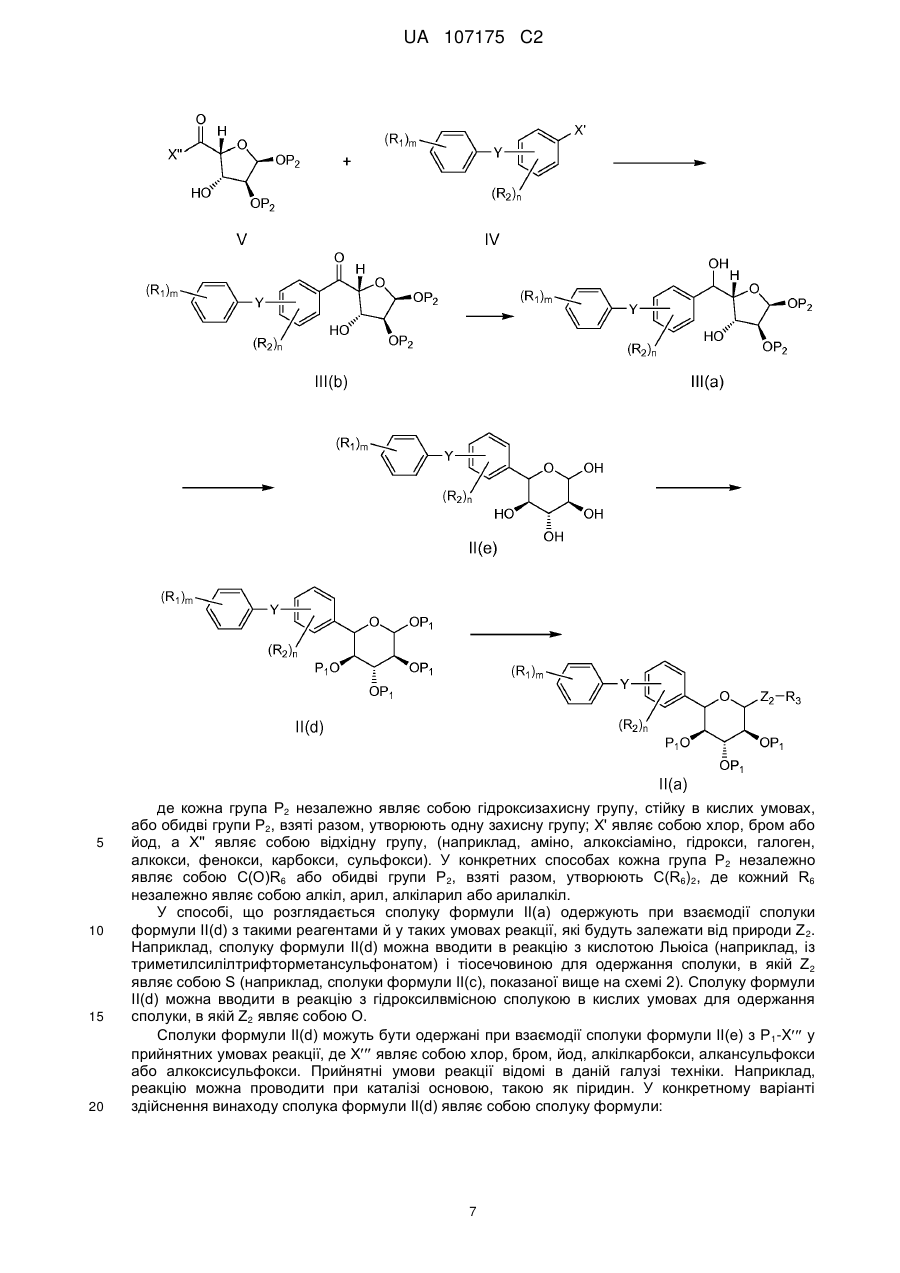
в якому здійснюють стадію, на якій проводять відновлення сполуки формули III(b)
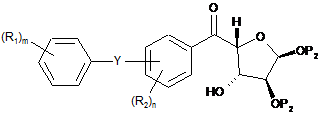 , III(b)
, III(b)
де кожен Р2 являє собою незалежно C(O)R6 або обидва Р2 разом утворюють C(R6)2, де кожен R6 являє собою незалежно С1-10алкіл;
і Y, R1, R2, m і n мають вищевказані значення;
з утворенням сполуки формули (IIIа)
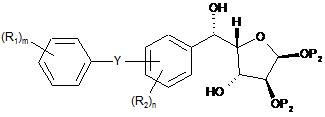 , III(a)
, III(a)
де Y, R1, R2, P2, m і n мають вищевказані значення;
яку піддають обробці кислотою з одержанням сполуки формули II(е)
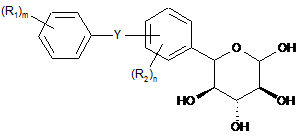 , II(e)
, II(e)
де Y, R1, R2, m і n мають вищевказані значення;
яку піддають взаємодії з сіллю Р1Х'", де Р1 має вищевказані значення, і X'" являє собою хлор, бром, йод, С1-10алкілкарбокси, С1-10алкансульфокси або С1-10алкоксисульфокси;
з утворенням сполуки формули II(d)
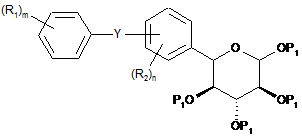 , II(d)
, II(d)
де Y, R1, R2, P1, m і n мають вищевказані значення;
яку піддають взаємодії з кислотою Льюїса (наприклад, такою як триметилсилілтрифторметансульфонат) і тіосечовиною, з утворенням сполуки формули II(с)
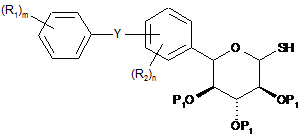 , II(c)
, II(c)
де Y, R1, R2, P1, m і n мають вищевказані значення;
яку піддають взаємодії зі сполукою формули R3X в основних умовах, де
X являє собою бром, йод, С1-10алкансульфокси або С1-10алкоксисульфокси;
R3 являє собою С1-10алкіл, С6-12арил або С5-12гетероцикліл, що являє собою ароматичне, частково ароматичне або неароматичне моноциклічне або поліциклічне кільце або систему кілець, що містить щонайменше один гетероатом, вибраний із N, О або S;
з отриманням цільової сполуки формули II(b), при цьому всі перераховані вище проміжні реакційні стадії проводять без виділення вказаних вище проміжних сполук з реакційної суміші.
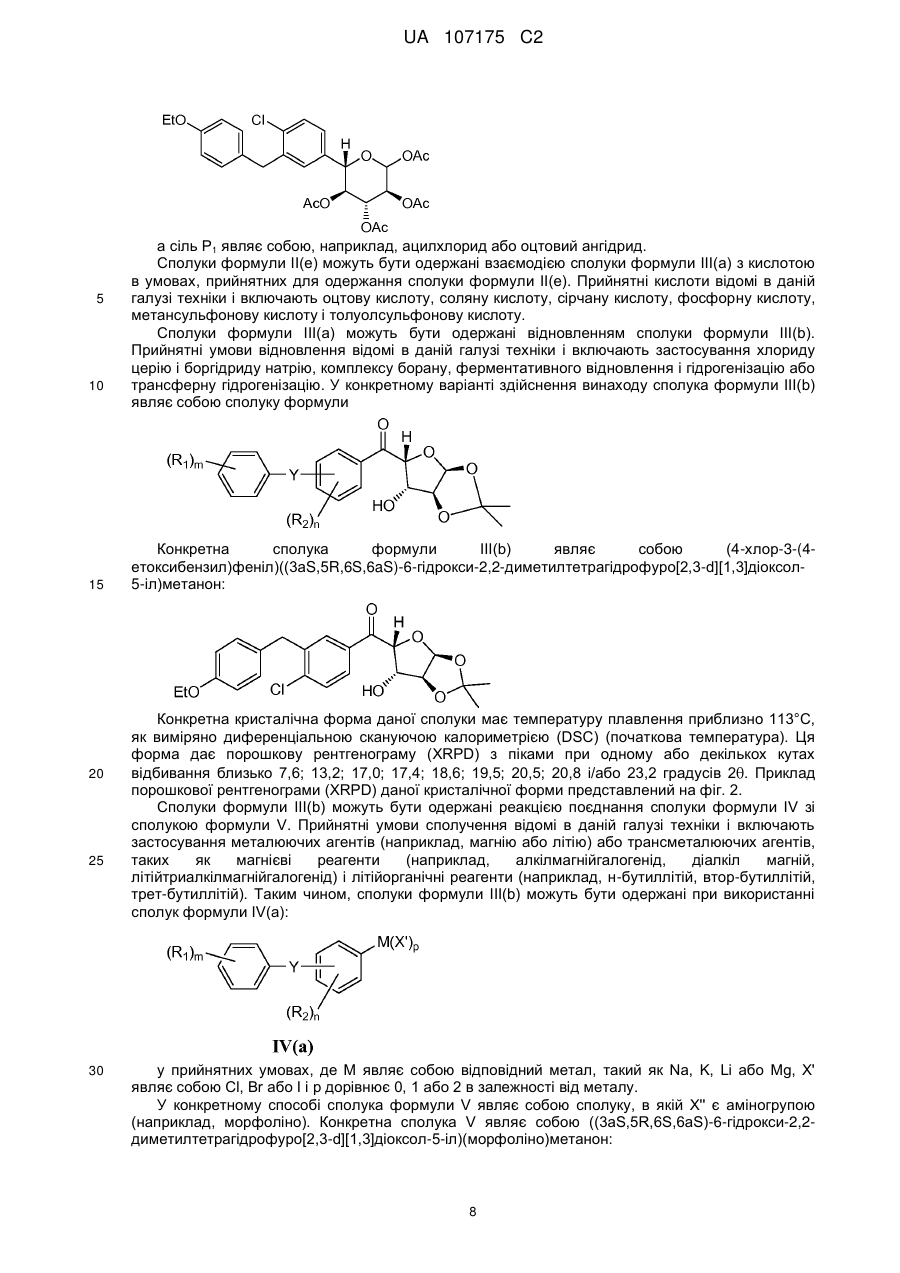
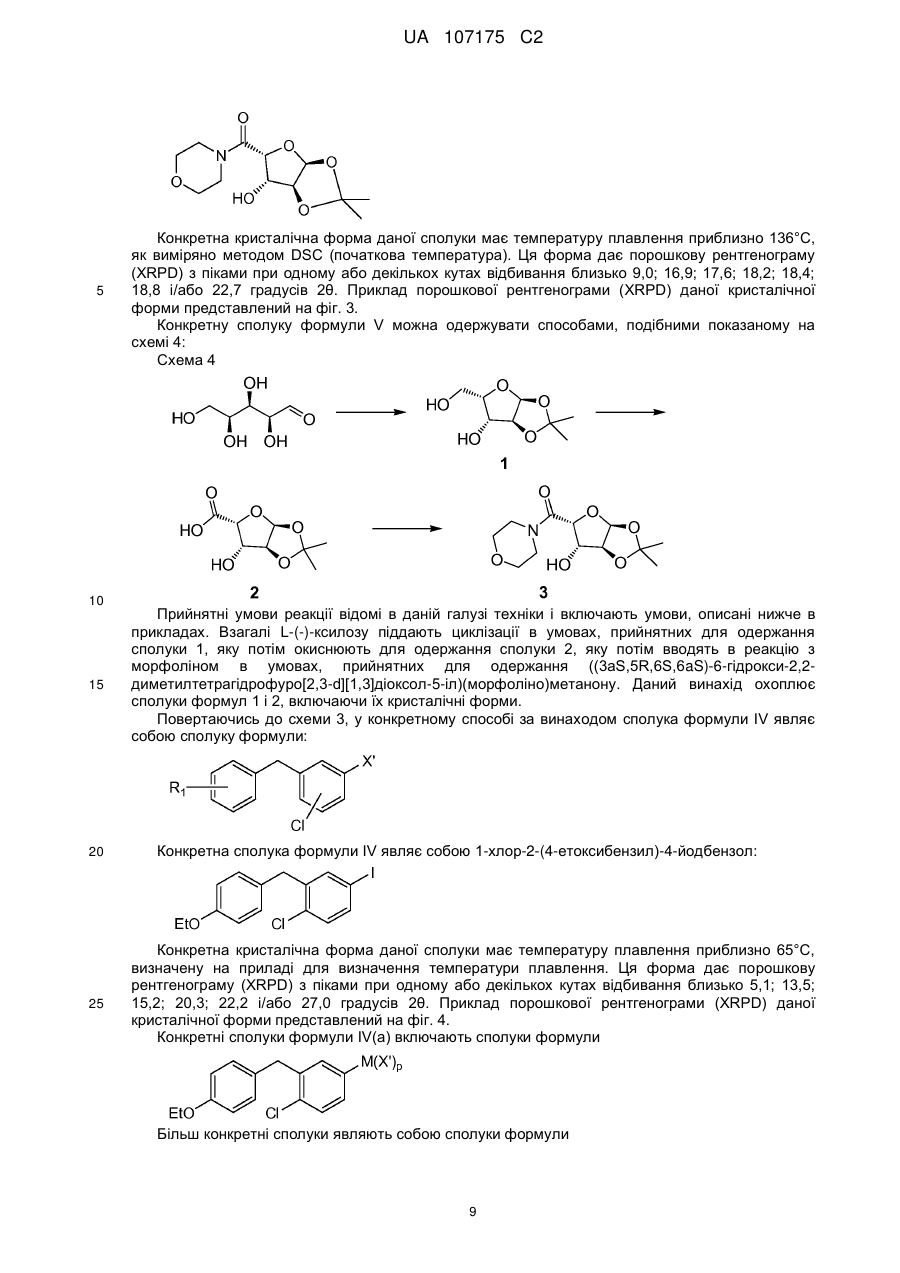
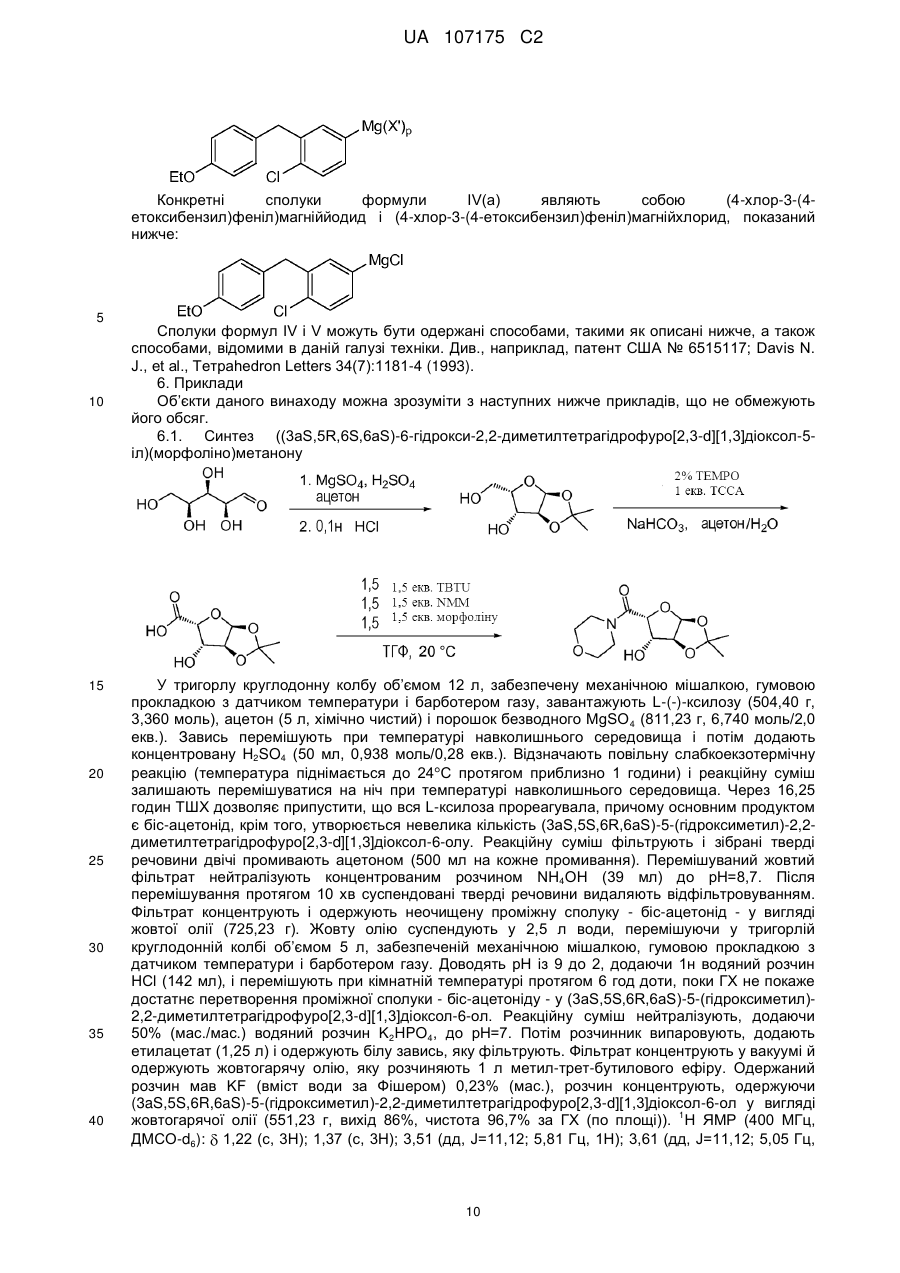
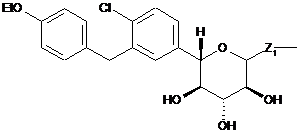
6. Спосіб одержання ((3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-іл)(морфоліно)метанону
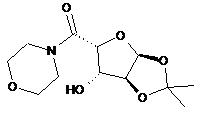 ,
,
який включає стадію, на якій проводять взаємодію (3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-карбонової кислоти з морфоліном з одержанням ((3аS,5R,6S,6аS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-іл)(морфоліно)метанону.
7. Спосіб за п. 6, де (3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-карбонову кислоту одержують окисненням (3aS,5S,6R,6aS)-5-(гiдpoкcимeтил)-2,2-димeтилтeтpaгiдpoфypo[2,3-d][1,3]діоксол-6-олу з одержанням (3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-карбонової кислоти, і де (3аS,5S,6R,6аS)-5-(гідроксиметил)-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-6-ол одержують циклізацією L-(-)-ксилози в присутності ацетону з одержанням (3aS,5S,6R,6aS)-5-(гiдpoкcимeтил)-2,2-димeтилтeтpaгiдpoфypo[2,3-d][l,3]дioкcoл-6-олу.
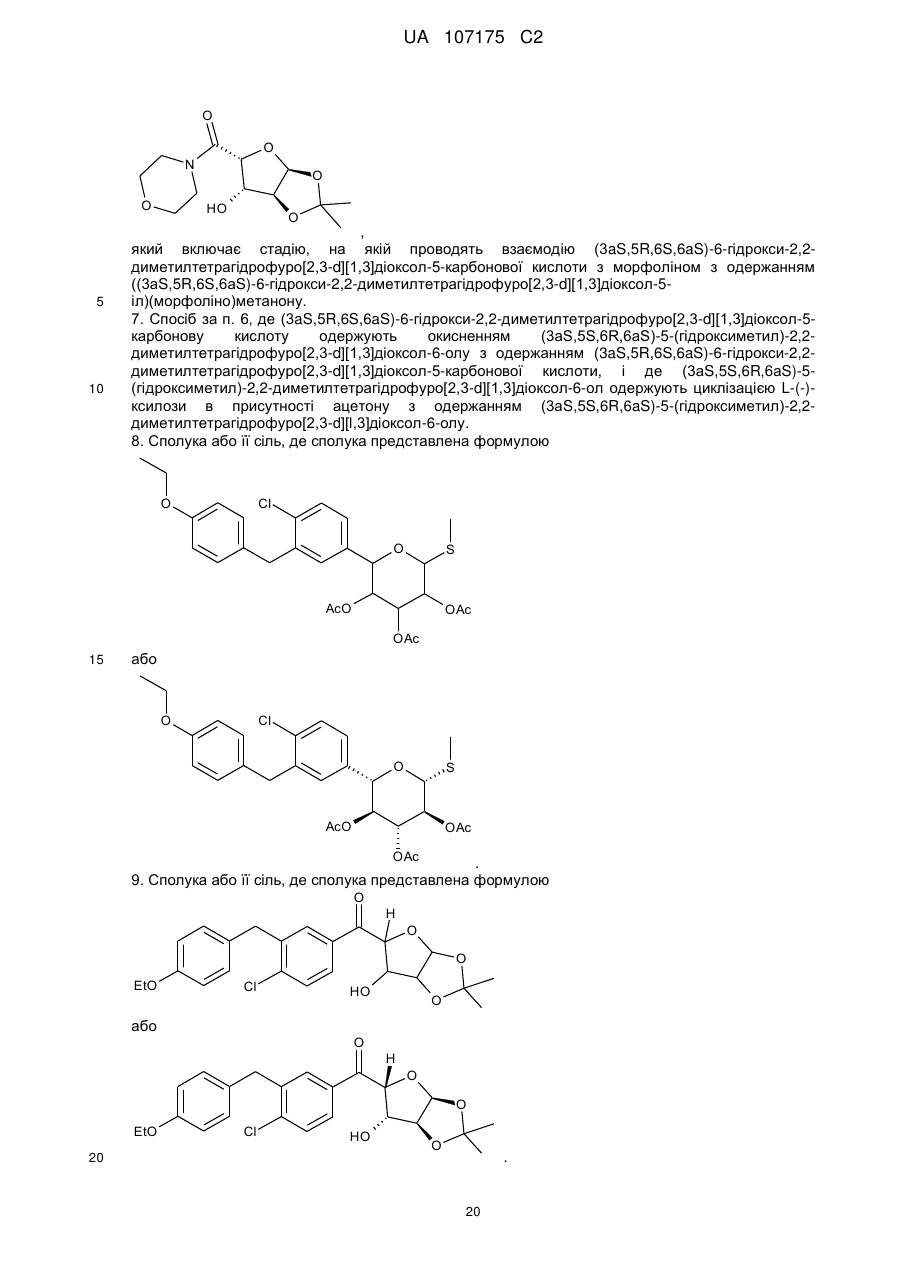
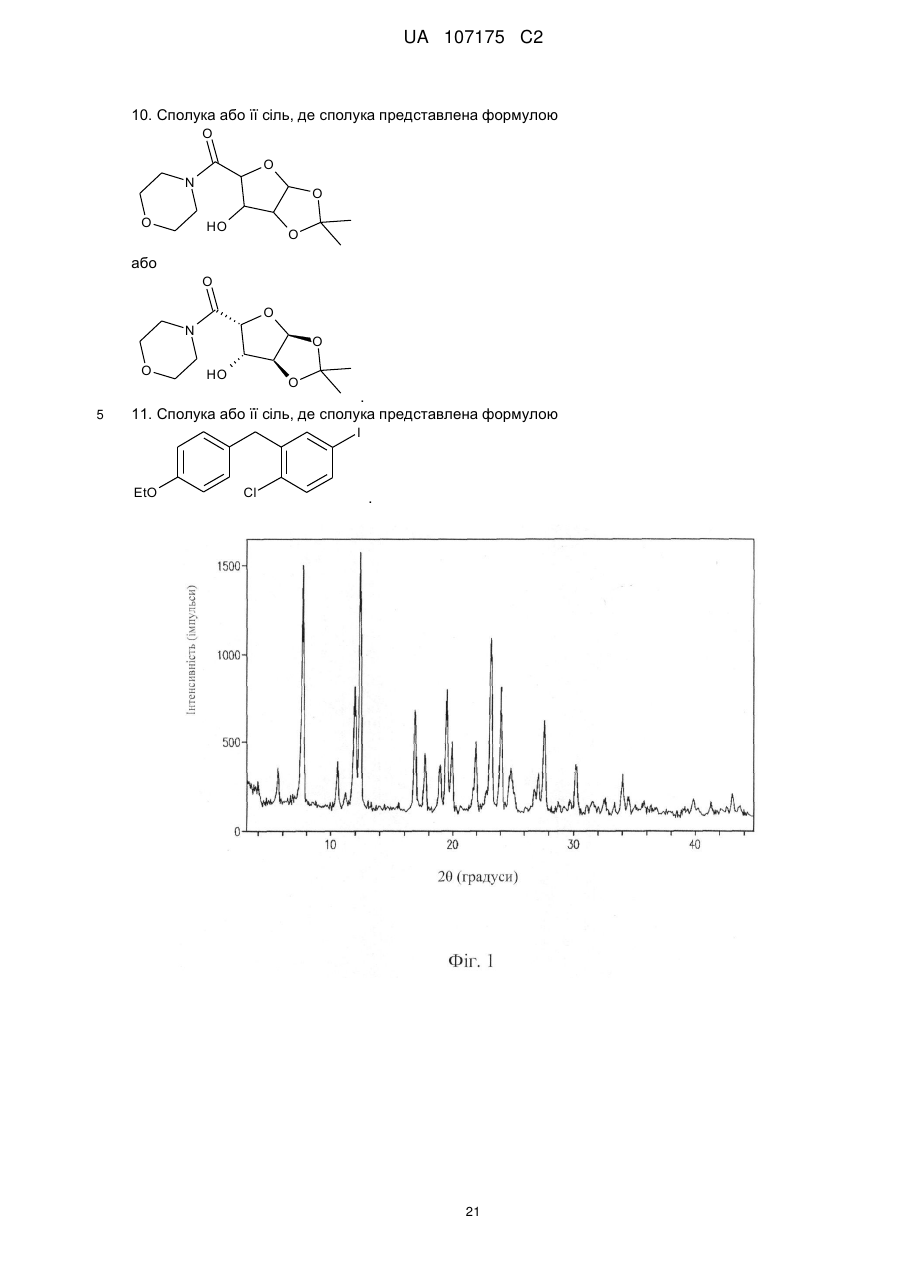
8. Сполука або її сіль, де сполука представлена формулою

або
 .
.
9. Сполука або її сіль, де сполука представлена формулою
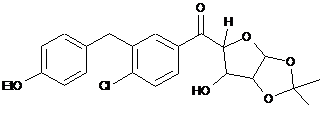
або
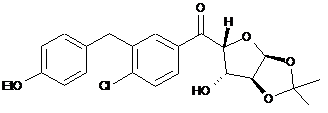 .
.
10. Сполука або її сіль, де сполука представлена формулою
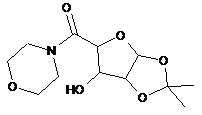
або
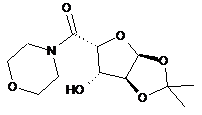 .
.
11. Сполука або її сіль, де сполука представлена формулою
 .
.
Текст
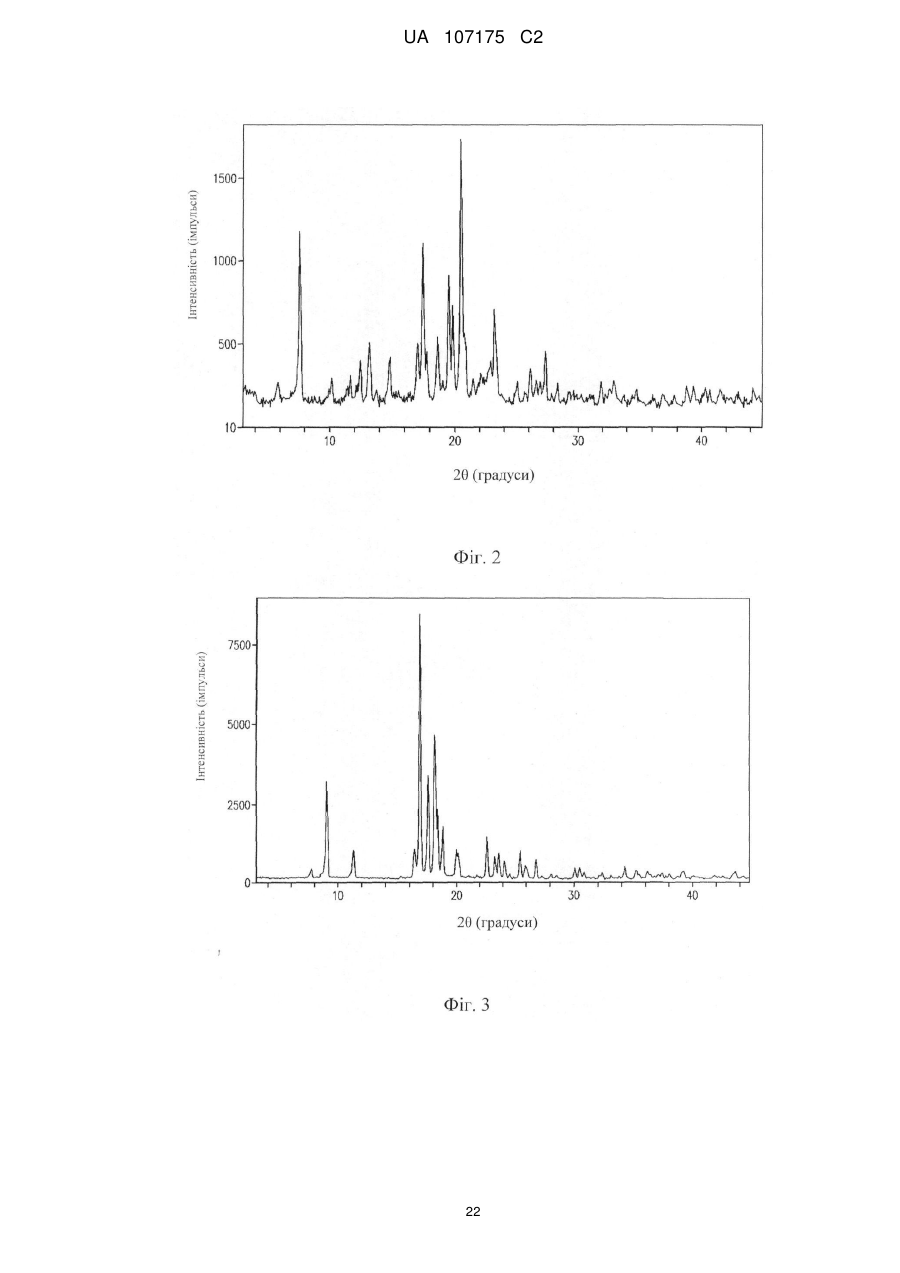
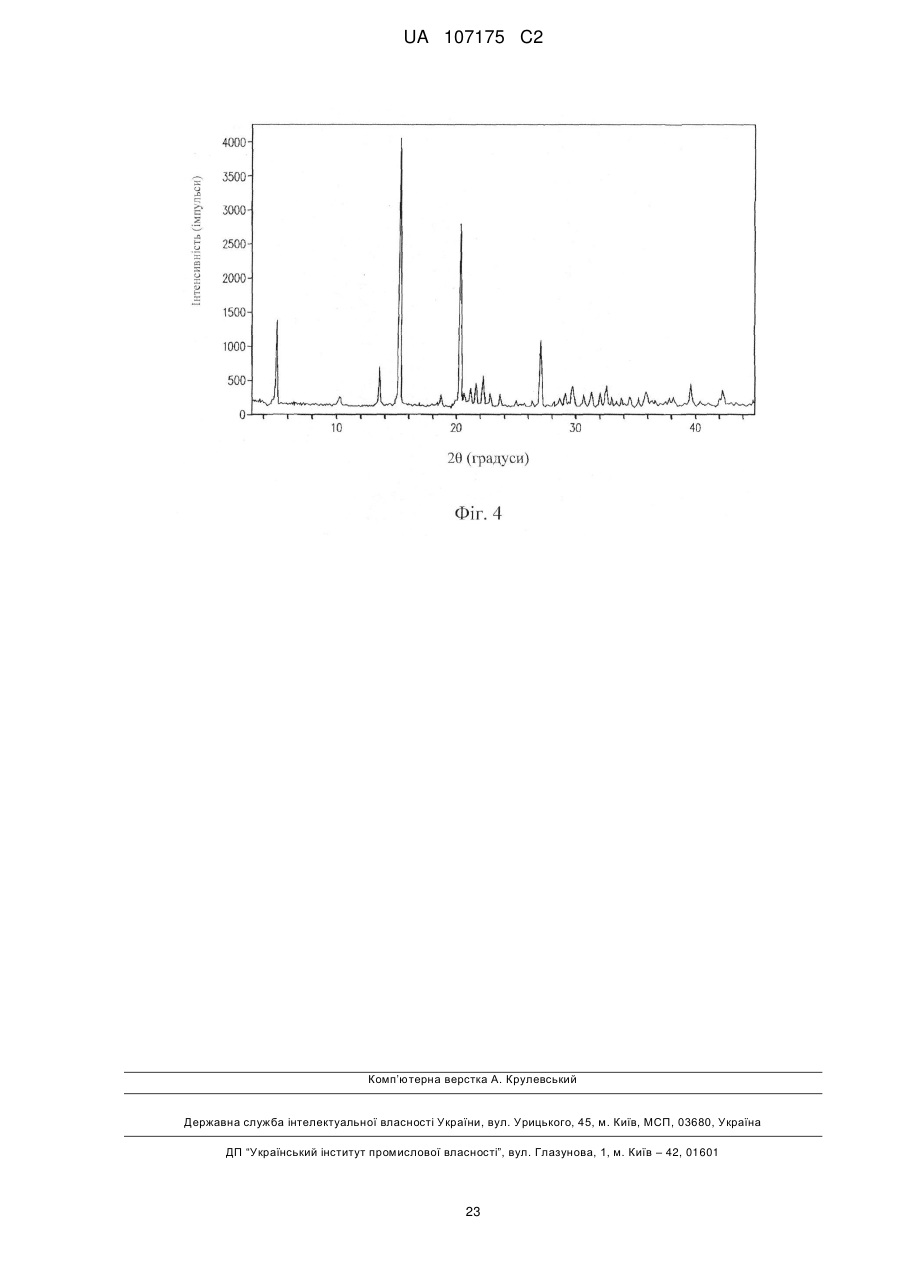
Реферат: (R1)m Y O Z1 R 3 (R2)n HO OH OH (I) UA 107175 C2 (12) UA 107175 C2 Винахід стосується способів синтезу інгібіторів котранспортерів натрій-глюкози 2 типу, а також сполук, які застосовують в даному документі. Конкретними інгібіторами є сполуки формули (І). UA 107175 C2 5 10 15 20 25 30 35 40 За даною заявкою вимагається пріоритет на підставі попередньої заявки на патент США № 60/952122, поданої 26 липня 2008 року, яка у всій повноті включена в дану заявку шляхом посилання. 1. Галузь техніки, до якої належить винахід Даний винахід стосується способів одержання інгібіторів котранспортеру натрій-глюкози 2 типу. 2. Рівень техніки Котранспортер натрій-глюкози 2 типу (SGLT2) являє собою транспортер, який реабсорбує глюкозу з ниркового фільтрату і запобігає втраті глюкози із сечею. Оскільки конкуруючі інгібітори SGLT2 викликають ниркове виведення глюкози, вони можуть бути використані для нормалізації високих рівнів глюкози в крові, пов’язаних з такими захворюваннями, як діабет [Handlon, A. L., Expert Opin. Ther. Patents 15(11):1531-1540 (2005)]. При пошуку нових лікарських засобів, які можуть використовуватися для лікування діабету, був описаний ряд інгібіторів SGLT2 [див., наприклад, Handlon, вище; патент США № 6515117; публікації заявок на патент США № 2006/0035841 і № 2004/0138439]. Щонайменше один інгібітор є об’єктом клінічних досліджень як засіб для лікування цукрового діабету типу 2, Див., наприклад, [Komoroski, B., et al., «Dapagliflozin (BMS-512148), a Selective Inhibitor of the SodiumGlucose Uptake Transporter 2 (SGLT2), Reduces Fasting Serum Glucose and Glucose Excursion in Type 2 Diabetes Mellitus Patients Over 14 Days» American Diabetes Assn. 67th Scientific Sessions. Abstract 0188-OR (2007)]. 3. Суть винаходу Даний винахід охоплює способи одержання деяких інгібіторів SGLT2, а також сполук, застосовних тут. Один варіант здійснення винаходу охоплює спосіб одержання сполук формули I замісники в якій визначені тут, і їх солей, який включає взаємодію сполуки формули II з основою в прийнятних умовах. Винахід також охоплює різні проміжні сполуки, призначені для одержання інгібіторів SGLT2, включаючи сполуки формули I. 4. Короткий опис фігур Деякі аспекти винаходу можна зрозуміти на підставі прикладених фігур. На фіг. 1 представлена дифракційна рентгенограма кристалічної твердої форми (2S,3S,4R,5S,6R)-2-(4-хлор-3-(4-етоксибензил)феніл)-6-(метилтіо)тетрагідро-2H-піран-3,4,5триїлтриацетату. Спектр був записаний на дифрактометрі Rigaku MiniFlex (Cu (1,54060 Å)випромінювання). На фіг. 2 представлена дифракційна рентгенограма кристалічної твердої форми (4-хлор-3(4-етоксибензил)феніл)((3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3d][1,3]діоксол-5-іл)метанону. Спектр був записаний на дифрактометрі Rigaku MiniFlex (Cu (1,54060 Å)випромінювання). На фіг. 3 представлена дифракційна рентгенограма кристалічної твердої форми ((3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-5 1 UA 107175 C2 5 10 15 20 25 30 35 40 45 50 55 60 іл)(морфоліно)метанону. Спектр був одержаний на дифрактометрі Rigaku MiniFlex (Cu (1,54060 Å) випромінювання). На фіг. 4 представлена дифракційна рентгенограма кристалічної твердої форми 1-хлор-2-(4етоксибензил)-4-йодбензолу. Спектр був записаний на дифрактометрі Rigaku MiniFlex (Cu (1,54060 Å) випромінювання). 5. Докладний опис Недавно були описані нові сполуки, які інгібують котранспортер натрій-глюкози 2 типу (SGLT2). Див. попередні заявки на патент США № 60/848156 (подана 29 вересня 2006 року) і № 60/905714 (подана 8 березня 2007 року). Даний винахід частково базується на нових способах одержання таких сполук. Конкретні способи за винаходом передбачають великомасштабне виробництво сполук. 5.1. Визначення Якщо не зазначено інше, термін «алкеніл» означає нерозгалужений, розгалужений і/або циклічний вуглеводень, що містить від 2 до 20 (наприклад, 2-10 або 2-6) атомів вуглецю, і який включає щонайменше один вуглець-вуглець подвійний зв’язок. Типові алкенільні групи включають вініл, аліл, 1-бутеніл, 2-бутеніл, ізобутиленіл, 1-пентеніл, 2-пентеніл, 3-метил-1бутеніл, 2-метил-2-бутеніл, 2,3-диметил-2-бутеніл, 1-гексеніл, 2-гексеніл, 3-гексеніл, 1-гептеніл, 2-гептеніл, 3-гептеніл, 1-октеніл, 2-октеніл, 3-октеніл, 1-ноненіл, 2-ноненіл, 3-ноненіл, 1-деценіл, 2-деценіл і 3-деценіл. Якщо не зазначено інше, термін «алкокси» означає -О-алкільну групу. Приклади алкоксигруп включають (але не обмежуються ними) -OCH3, -OCH2CH3, -O(CH2)2CH3, O(CH2)3CH3, O(CH2)4CH3 і -O(CH2)5CH3, Якщо не зазначено інше, термін «алкіл» означає нерозгалужений, розгалужений і/або циклічний («циклоалкільний») вуглеводень, що містить від 1 до 20 (наприклад, 1-10 або 1-4) атомів вуглецю. Алкільні групи, що містять від 1 до 4 атомів вуглецю, називаються «нижчий алкіл». Приклади алкільних груп включають (але не обмежуються ними) метил, етил, пропіл, ізопропіл, н-бутил, трет-бутил, ізобутил, пентил, гексил, ізогексил, гептил, 4,4-диметилпентил, октил, 2,2,4-триметилпентил, ноніл, децил, ундецил і додецил. Циклоалкільні групи можуть бути моноциклічними або поліциклічними, і приклади включають циклопропіл, циклобутил, циклопентил, циклогексил і адамантил. Додаткові приклади алкільних груп містять нерозгалужені, розгалужені і/або циклічні частини (наприклад, 1-етил-4-метилциклогексил). Термін «алкіл» включає насичені вуглеводні, а також алкенільні й алкінільні групи. Якщо не зазначено інше, термін «алкіларил» або «алкіл-арил» означає алкільну групу, зв’язану з арильною групою. Якщо не зазначено інше, термін «алкілгетероарил» або «алкіл-гетероарил» означає алкільну групу, зв’язану з гетероарильною групою. Якщо не зазначено інше, термін «алкілгетероцикл» або «алкіл-гетероцикл» означає алкільну групу, зв’язану з гетероциклічною групою. Якщо не зазначено інше, термін «алкініл» означає нерозгалужений, розгалужений і/або циклічний вуглеводень, що містить від 2 до 20 (наприклад, 2-20 або 2-6) атомів вуглецю і включає щонайменше один потрійний вуглець-вуглецевий зв’язок. Типові алкінільні групи включають ацетиленіл, пропініл, 1-бутиніл, 2-бутиніл, 1-пентиніл, 2-пентиніл, 3-метил-1-бутиніл, 4-пентиніл, 1-гексиніл, 2-гексиніл, 5-гексиніл, 1-гептиніл, 2-гептиніл, 6-гептиніл, 1-октиніл, 2октиніл, 7-октиніл, 1-нонініл, 2-нонініл, 8-нонініл, 1-дециніл, 2-дециніл і 9-дециніл. Якщо не зазначено інше, термін «арил» означає ароматичне кільце або ароматичну або частково ароматичну циклічну систему, що складається з атомів вуглецю і водню. Арильна група може містити кілька кілець, зв’язаних або конденсованих разом. Приклади арильних фрагментів включають (але не обмежуються ними) антраценіл, азуленіл, біфеніл, флуореніл, індан, інденіл, нафтил, фенантреніл, феніл, 1,2,3,4-тетрагідронафталін і толіл. Якщо не зазначено інше, термін «арилалкіл» або «арил-алкіл» означає арильну групу, зв’язану з алкільною групою. Якщо не зазначено інше, термін «галоген» охоплює фтор, хлор, бром і йод. Якщо не зазначено інше, термін «гетероалкіл» належить до алкільної групи (наприклад, лінійної, розгалуженої або циклічної), в якій щонайменше один з атомів вуглецю замінений гетероатомом (наприклад, N, O або S). Якщо не зазначено інше, термін «гетероарил» належить до арильної групи, в якій щонайменше один з її атомів вуглецю замінений гетероатомом (наприклад, N, O або S). Приклади включають (але не обмежуються ними) акридиніл, бензімідазоліл, бензофураніл, бензоізотіазоліл, бензоізоксазоліл, бензохіназолініл, бензотіазоліл, бензоксазоліл, фурил, імідазоліл, індоліл, ізотіазоліл, ізоксазоліл, оксадіазоліл, оксазоліл, фталазиніл, піразиніл, 2 UA 107175 C2 5 10 15 20 25 30 35 40 45 50 55 60 піразоліл, піридазиніл, піридил, піримідиніл, пірімідил, піроліл, хіназолініл, хінолініл, тетразоліл, тіазоліл і триазиніл. Якщо не зазначено інше, термін «гетероарилалкіл» або «гетероарил-алкіл» означає гетероарильну групу, зв’язану з алкільною групою. Якщо не зазначено інше, термін «гетероцикл» належить до ароматичного, частково ароматичного або неароматичного моноциклічного або поліциклічного кільця або системи кілець, що містять вуглець, водень і щонайменше один гетероатом (наприклад, N, O або S). Гетероцикл може містити кілька (тобто два або більше) кільця, конденсованих або зв’язаних разом. Гетероцикли включають гетероарили. Приклади включають (але не обмежуються ними) бензо[1,3]діоксоліл, 2,3-дигідробензо[1,4]діоксиніл, цинолініл, фураніл, гідантоїніл, морфолініл, оксетаніл, оксираніл, піперазиніл, піперидиніл, піролідиноніл, піролідиніл, тетрагідрофураніл, тетрагідропіраніл, тетрагідропіридиніл, тетрагідропіримідиніл, тетрагідротіофеніл, тетрагідротіопіраніл і валеролактаміл. Якщо не зазначено інше, термін «гетероциклалкіл» або «гетероцикл-алкіл» належить до гетероциклічної групи, зв’язаної з алкільною групою. Якщо не зазначено інше, термін «гетероциклоалкіл» належить до неароматичного гетероциклу. Якщо не зазначено інше, термін «гетероциклоалкілалкіл» або «гетероциклоалкіл-алкіл» належить до гетероциклоалкільної групи, зв’язаної з алкільною групою. Якщо не зазначено інше, термін «фармацевтично прийнятні солі» належить до солей, одержаних з фармацевтично прийнятних нетоксичних кислот або основ, що містять неорганічні кислоти і основи й органічні кислоти і основи. Прийнятні фармацевтично прийнятні адитивні солі з основами включають (але не обмежуються ними) солі металів, одержані з алюмінію, кальцію, літію, магнію, калію, натрію і цинку, або органічні солі, одержані з лізину, N,N'дибензилетилeндіаміну, хлорпрокаїну, холіну, діетаноламіну, етилeндіаміну, меглуміну (Nметилглюкаміну) і прокаїну. Прийнятні нетоксичні кислоти включають (але не обмежуються ними) неорганічні й органічні кислоти, такі як оцтова, альгінова, антранілова, бензолсульфонова, бензойна, камфорсульфонова, лимонна, етенсульфонова, мурашина, фумарова, фуранкарбонова, галактуронова, глюконова, глюкуронова, глутамінова, гліколева, бромистоводнева, хлористоводнева, ізетіонова, молочна, малеїнова, яблучна, мигдальна, метансульфонова, муцинова, азотна, памова, пантотенова, фенілоцтова, фосфорна, пропіонова, саліцилова, стеаринова, бурштинова, сульфанілова, сірчана, винна кислота і птолуолсульфонова кислота. Конкретні нетоксичні кислоти включають хлористоводневу, бромистоводневу, фосфорну, сірчану і метансульфонову кислоти. Приклади конкретних солей включають, таким чином, гідрохлориди і мезилати. Інші добре відомі в даній галузі техніки. Див., наприклад, Remington’s Pharmaceutical Sciences, 18th ed. (Mack Publishing, Easton PA: 1990) and Remington: The Science and Practice of Pharmacy, 19th ed. (Mack Publishing, Easton PA: 1995). Якщо не зазначено інше, термін «стереоізомерна суміш» охоплює рацемічні суміші, а також стереохімічно збагачені суміші (наприклад, R/S=30/70, 35/65, 40/60, 45/55, 55/45, 60/40, 65/35 і 70/30). Якщо не зазначено інше, термін «стереохімічно чистий» означає композицію, яка містить один стереоізомер сполуки і по суті не містить інших стереоізомерів сполуки. Наприклад, стереохімічно чиста композиція сполуки, що містить один стереоцентр, по суті не повинна містити протилежного за знаком стереоізомеру цієї сполуки. Стереохімічно чиста композиція сполуки, що містить два стереоцентри, по суті не повинна містити інших діастереомерів сполуки. Типова стереохімічно чиста сполука містить більше приблизно 80% (мас.) одного стереоізомеру сполуки і менше приблизно 20% (мас.) інших стереоізомерів сполуки, більше приблизно 90% (мас.) одного стереоізомеру сполуки і менше приблизно 10% (мас.) інших стереоізомерів сполуки, більше приблизно 95% (мас.) одного стереоізомеру сполуки і менше приблизно 5% (мас.) інших стереоізомерів сполуки, більше приблизно 97% (мас.) одного стереоізомеру сполуки і менше приблизно 3% (мас.) інших стереоізомерів сполуки або більше приблизно 99% (мас.) одного стереоізомеру сполуки і менше приблизно 1% (мас.) інших стереоізомерів сполуки. Якщо не зазначено інше, термін «заміщений» при використанні для опису хімічної структури або групи належить до похідної такої структури або до такої групи, де один або кілька атомів водню заміщені хімічним фрагментом або функціональною групою, такими як (але не обмежені ними) спиртова, альдегідна, алкокси, алканоїлокси, алкоксикарбоніл, алкеніл, алкіл (наприклад, метил, етил, пропіл, трет-бутил), алкініл, алкілкарбонілокси (-OC(O)алкіл), амідна (-C(O)NHалкіл- або -алкілNHC(O)алкіл), амідиніл (-C(NH)NH-алкіл- або -C(NR)NH2), амінна (первинна, вторинна і третинна, така, як алкіламіно, ариламіно, арилалкіламіно), ароїл, арил, арилокси, 3 UA 107175 C2 5 10 15 20 25 30 35 40 aзо, карбамоїл (-NHC(O)O-алкіл- або -OC(O)NH-алкіл), карбаміл (наприклад, CONH2, a також CONH-алкіл, CONH-арил, і CONH-арилалкіл), карбоніл, карбоксил, карбонова кислота, ангідрид карбонової кислоти, хлорангідрид карбонової кислоти, ціано, складний ефір, епоксид, ефір (наприклад, метокси, етокси), гуанідино, галоген, галогеналкіл (наприклад, -CCl3, -CF3, -C(CF3)3), гетероалкіл, напівацеталь, імін (первинний і вторинний), ізоціанат, ізотіоціанат, кетон, нітрил, нітро, оксо, фосфодіефір, сульфід, сульфонамідо (наприклад, SO 2NH2), сульфон, сульфоніл (включаючи алкілсульфоніл, арилсульфоніл і арилалкілсульфоніл), сульфоксид, тіол (наприклад, сульфгідрил, тіоефір) і сечовина (-NHCONH-алкіл-). Якщо не зазначено інше, термін «включають» має те ж значення, що і «включають, але не обмежуються». Аналогічно термін «такий як» має те ж значення, що і «такий як, але не обмежений цим». Якщо не зазначено інше, один або кілька прикметників безпосередньо перед низкою іменників варто розглядати як такі, що належать до кожного з іменників. Наприклад, фраза «необов’язково заміщений алкіл, арил або гетероарил» має те ж значення, що і «необов’язково заміщений алкіл, необов’язково заміщений арил або необов’язково заміщений гетероарил». Слід зазначити, що хімічний фрагмент, який утворює частину більш крупної молекули, може бути тут описаний за допомогою назви, що звичайно відповідає йому, коли він існує у вигляді окремої молекули, або назви, що звичайно відповідає його радикалу. Наприклад, терміни «піридин» і «піридил» мають те саме значення, коли використовуються для опису фрагмента, приєднаного до інших хімічних фрагментів. Таким чином, дві фрази «XOH, де X являє собою піридил», і «XOH, де X являє собою піридин», мають те саме значення і містять піридин-2-ол, піридин-3-ол і піридин-4-ол. Слід також зазначити, що якщо стереохімія структури або частини структури не зазначена, наприклад, «жирними» або пунктирними лініями, структуру або частину структури варто розглядати як таку, що включає всі її стереоізомери. Крім того, передбачається, що будь-який атом, показаний на кресленні з незадовільними валентностями, з’єднаний з достатньою кількістю атомів водню для додержання валентності. Крім того, хімічні зв’язки, зображені однією суцільною лінією, яка паралельна одній пунктирній лінії, включають як одинарні, так і подвійні (наприклад, ароматичні) зв’язки, якщо валентності це допускають. 5.2. Способи Даний винахід охоплює способи одержання сполук формули I і її солі і cпівкристали, де Y являє собою O, S, NR4 або C(R4)2; Z1 являє собою O, S, SO або SO2; кожний R1 незалежно являє собою водень, галоген, ціано, OR1A, SR1A або необов’язково заміщений алкіл; кожний R1A незалежно являє собою водень або необов’язково заміщений алкіл або арил; кожний R2 незалежно являє собою водень, галоген, ціано, OR2A, SR2A або необов’язково заміщений алкіл; кожний R2A незалежно являє собою водень або необов’язково заміщений алкіл або арил; R3 являє собою необов’язково заміщений алкіл, арил або гетероцикл; кожний R4 незалежно являє собою водень або необов’язково заміщений алкіл або арил; n дорівнює 1-3 і m дорівнює 1-3. Конкретний метод показаний нижче на схемі 1: Схема 1 4 UA 107175 C2 5 10 15 20 25 30 35 де кожний P1 незалежно являє собою гідроксизахисну групу, стійку в кислих умовах. В даному методі сполуку формули II(a) окиснюють і одержують сполуку формули II, яку потім піддають взаємодії з основою, одержуючи сполуку формули I. Прийнятні умови окиснювання добре відомі в даній галузі техніки і включають застосування пероксидних сполук, таких як мхлорпербензойна кислота, пероцтова кислота, оксон, суміш пероксиду водню або його комплексу (наприклад, сечовина-пероксид водню) і ангідриду кислоти (наприклад, фталевого ангідриду). Прийнятні основи також відомі в даній галузі техніки і включають алкоксиди, гідроксиди, карбонати й аміни. Зрозуміло, потенційно реакційноздатні фрагменти, охоплювані визначеннями різних фрагментів (наприклад, R1-R3), приведеними тут, можуть бути захищені способами, відомими в даній галузі техніки. Крім того, кінцеві продукти можна піддавати подальшим реакціям, відомим у даній галузі техніки, щоб одержати інші сполуки, охоплювані формулою I. Кінцеві продукти також можна кристалізувати. В одному способі продукт співкристалізують з амінокислотою (наприклад, з L-фенілаланіном, L-фенілгліцином, L-аргініном). У відношенні всіх загальних структур і реакцій, описаних тут (наприклад, у схемах 1-3), у відповідних випадках деякі варіанти здійснення винаходу такі, що Y являє собою C(R 4)2. В інших варіантах Z1 являє собою S, SO або SO2. У деяких інших кожна Р1 незалежно являє собою C(O)R5, де кожний R5 незалежно являє собою алкіл, арил, алкіларил або арилалкіл. Приклади P1 включають ацетил, бензоїл і півалоїл. В інших варіантах здійснення винаходу R1 являє собою OR1A і R1A являє собою, наприклад, необов’язково заміщений нижчий алкіл. В інших варіантах R2 являє собою галоген. В інших варіантах R3 являє собою нижчий алкіл (наприклад, метил або етил). В інших варіантах R4 являє собою водень. В інших варіантах m дорівнює 1. В інших варіантах n дорівнює 1. В одному варіанті здійснення винаходу Y являє собою CH2, Z1 являє собою S або SO2, R1 являє собою етокси, R2 являє собою хлор, а R3 являє собою метил. Наприклад, у конкретному способі сполука формули I є сполукою формули У ще одному варіанті здійснення винаходу Y являє собою CH2, Z1 являє собою S або SO2, R1 являє собою етокси, R2 являє собою хлор, а R3 являє собою етил. Наприклад, у конкретному способі сполука формули I є сполукою формули У конкретному варіанті здійснення винаходу сполука формули II(a) є сполукою формули II(b), яку можна одержати, як показано на схемі 2: Схема 2 5 UA 107175 C2 5 де Х являє собою бром, йод, алкансульфокси або алкоксисульфокси. Прийнятні умови реакції відомі в даній галузі техніки. Наприклад, можна використовувати основні умови (наприклад, використання основи, такої як N,N-діізопропілетиламін). В одному способі сполука формули II(b) є сполукою формули Конкретна сполука формули II(b) являє собою (2S,3S,4R,5S,6R)-2-(4-хлор-3-(4етоксибензил)феніл)-6-(метилтіо)тетрагідро-2H-піран-3,4,5-триїлтриацетат: 10 15 Конкретна кристалічна форма даної сполуки має температуру плавлення близько 156°С, як виміряно диференціальною скануючою калориметрією (DSC), (початкова температура). Ця форма дає порошкову рентгенограму (XRPD) з піками при одному або декількох кутах відбивання близько 7,7; 11,9; 12,4; 16,9; 19,5; 19,9; 21,9; 23,2; 24,1 і/або 27,7 градусів 2θ. Фахівці в даній галузі добре розуміють, що відносні інтенсивності піків на рентгенограмі кристалічної форми можуть варіюватися в залежності від того, як був приготовлений зразок і як були одержані дані. Маючи це на увазі, авторами на фіг. 1 представлений приклад порошкової рентгенограми (XRPD) даної кристалічної форми. Взагалі сполуки формули II(а) можуть бути одержані способом, показаним нижче на схемі 3. Схема 3 6 UA 107175 C2 5 10 15 20 де кожна група P2 незалежно являє собою гідроксизахисну групу, стійку в кислих умовах, або обидві групи P2, взяті разом, утворюють одну захисну групу; X' являє собою хлор, бром або йод, а X'' являє собою відхідну групу, (наприклад, аміно, алкоксіаміно, гідрокси, галоген, алкокси, фенокси, карбокси, сульфокси). У конкретних способах кожна група P2 незалежно являє собою C(O)R6 або обидві групи P2, взяті разом, утворюють C(R6)2, де кожний R6 незалежно являє собою алкіл, арил, алкіларил або арилалкіл. У способі, що розглядається сполуку формули II(a) одержують при взаємодії сполуки формули II(d) з такими реагентами й у таких умовах реакції, які будуть залежати від природи Z 2. Наприклад, сполуку формули II(d) можна вводити в реакцію з кислотою Льюіса (наприклад, із триметилсилілтрифторметансульфонатом) і тіосечовиною для одержання сполуки, в якій Z2 являє собою S (наприклад, сполуки формули II(c), показаної вище на схемі 2). Сполуку формули II(d) можна вводити в реакцію з гідроксилвмісною сполукою в кислих умовах для одержання сполуки, в якій Z2 являє собою O. Сполуки формули II(d) можуть бути одержані при взаємодії сполуки формули II(e) з P 1-X у прийнятних умовах реакції, де X являє собою хлор, бром, йод, алкілкарбокси, алкансульфокси або алкоксисульфокси. Прийнятні умови реакції відомі в даній галузі техніки. Наприклад, реакцію можна проводити при каталізі основою, такою як піридин. У конкретному варіанті здійснення винаходу сполука формули II(d) являє собою сполуку формули: 7 UA 107175 C2 5 10 15 20 25 30 а сіль P1 являє собою, наприклад, ацилхлорид або оцтовий ангідрид. Сполуки формули II(е) можуть бути одержані взаємодією сполуки формули III(a) з кислотою в умовах, прийнятних для одержання сполуки формули II(e). Прийнятні кислоти відомі в даній галузі техніки і включають оцтову кислоту, соляну кислоту, сірчану кислоту, фосфорну кислоту, метансульфонову кислоту і толуолсульфонову кислоту. Сполуки формули III(a) можуть бути одержані відновленням сполуки формули III(b). Прийнятні умови відновлення відомі в даній галузі техніки і включають застосування хлориду церію і боргідриду натрію, комплексу борану, ферментативного відновлення і гідрогенізацію або трансферну гідрогенізацію. У конкретному варіанті здійснення винаходу сполука формули III(b) являє собою сполуку формули Конкретна сполука формули III(b) являє собою (4-хлор-3-(4етоксибензил)феніл)((3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол5-іл)метанон: Конкретна кристалічна форма даної сполуки має температуру плавлення приблизно 113°С, як виміряно диференціальною скануючою калориметрією (DSC) (початкова температура). Ця форма дає порошкову рентгенограму (XRPD) з піками при одному або декількох кутах відбивання близько 7,6; 13,2; 17,0; 17,4; 18,6; 19,5; 20,5; 20,8 і/або 23,2 градусів 2 . Приклад порошкової рентгенограми (XRPD) даної кристалічної форми представлений на фіг. 2. Сполуки формули III(b) можуть бути одержані реакцією поєднання сполуки формули IV зі сполукою формули V. Прийнятні умови сполучення відомі в даній галузі техніки і включають застосування металюючих агентів (наприклад, магнію або літію) або трансметалюючих агентів, таких як магнієві реагенти (наприклад, алкілмагнійгалогенід, діалкіл магній, літійтриалкілмагнійгалогенід) і літійорганічні реагенти (наприклад, н-бутиллітій, втор-бутиллітій, трет-бутиллітій). Таким чином, сполуки формули III(b) можуть бути одержані при використанні сполук формули IV(a): у прийнятних умовах, де М являє собою відповідний метал, такий як Na, K, Li або Mg, Х' являє собою Cl, Br або I і p дорівнює 0, 1 або 2 в залежності від металу. У конкретному способі сполука формули V являє собою сполуку, в якій X'' є аміногрупою (наприклад, морфоліно). Конкретна сполука V являє собою ((3aS,5R,6S,6aS)-6-гідрокси-2,2диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-іл)(морфоліно)метанон: 8 UA 107175 C2 5 10 15 20 25 Конкретна кристалічна форма даної сполуки має температуру плавлення приблизно 136°С, як виміряно методом DSC (початкова температура). Ця форма дає порошкову рентгенограму (XRPD) з піками при одному або декількох кутах відбивання близько 9,0; 16,9; 17,6; 18,2; 18,4; 18,8 і/або 22,7 градусів 2θ. Приклад порошкової рентгенограми (XRPD) даної кристалічної форми представлений на фіг. 3. Конкретну сполуку формули V можна одержувати способами, подібними показаному на схемі 4: Схема 4 Прийнятні умови реакції відомі в даній галузі техніки і включають умови, описані нижче в прикладах. Взагалі L-(-)-ксилозу піддають циклізації в умовах, прийнятних для одержання сполуки 1, яку потім окиснюють для одержання сполуки 2, яку потім вводять в реакцію з морфоліном в умовах, прийнятних для одержання ((3aS,5R,6S,6aS)-6-гідрокси-2,2диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-іл)(морфоліно)метанону. Даний винахід охоплює сполуки формул 1 і 2, включаючи їх кристалічні форми. Повертаючись до схеми 3, у конкретному способі за винаходом сполука формули IV являє собою сполуку формули: Конкретна сполука формули IV являє собою 1-хлор-2-(4-етоксибензил)-4-йодбензол: Конкретна кристалічна форма даної сполуки має температуру плавлення приблизно 65°С, визначену на приладі для визначення температури плавлення. Ця форма дає порошкову рентгенограму (XRPD) з піками при одному або декількох кутах відбивання близько 5,1; 13,5; 15,2; 20,3; 22,2 і/або 27,0 градусів 2θ. Приклад порошкової рентгенограми (XRPD) даної кристалічної форми представлений на фіг. 4. Конкретні сполуки формули IV(a) включають сполуки формули Більш конкретні сполуки являють собою сполуки формули 9 UA 107175 C2 Конкретні сполуки формули IV(a) являють собою (4-хлор-3-(4етоксибензил)феніл)магніййодид і (4-хлор-3-(4-етоксибензил)феніл)магнійхлорид, показаний нижче: 5 10 15 20 25 30 35 40 Сполуки формул IV і V можуть бути одержані способами, такими як описані нижче, а також способами, відомими в даній галузі техніки. Див., наприклад, патент США № 6515117; Davis N. J., et al., Тетраhedron Letters 34(7):1181-4 (1993). 6. Приклади Об’єкти даного винаходу можна зрозуміти з наступних нижче прикладів, що не обмежують його обсяг. 6.1. Синтез ((3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-5іл)(морфоліно)метанону У тригорлу круглодонну колбу об’ємом 12 л, забезпечену механічною мішалкою, гумовою прокладкою з датчиком температури і барботером газу, завантажують L-(-)-ксилозу (504,40 г, 3,360 моль), ацетон (5 л, хімічно чистий) і порошок безводного MgSO 4 (811,23 г, 6,740 моль/2,0 екв.). Завись перемішують при температурі навколишнього середовища і потім додають концентровану H2SO4 (50 мл, 0,938 моль/0,28 екв.). Відзначають повільну слабкоекзотермічну реакцію (температура піднімається до 24 С протягом приблизно 1 години) і реакційну суміш залишають перемішуватися на ніч при температурі навколишнього середовища. Через 16,25 годин ТШХ дозволяє припустити, що вся L-ксилоза прореагувала, причому основним продуктом є біс-ацетонід, крім того, утворюється невелика кількість (3aS,5S,6R,6aS)-5-(гідроксиметил)-2,2диметилтетрагідрофуро[2,3-d][1,3]діоксол-6-олу. Реакційну суміш фільтрують і зібрані тверді речовини двічі промивають ацетоном (500 мл на кожне промивання). Перемішуваний жовтий фільтрат нейтралізують концентрованим розчином NH4OH (39 мл) до pН=8,7. Після перемішування протягом 10 хв суспендовані тверді речовини видаляють відфільтровуванням. Фільтрат концентрують і одержують неочищену проміжну сполуку - біс-ацетонід - у вигляді жовтої олії (725,23 г). Жовту олію суспендують у 2,5 л води, перемішуючи у тригорлій круглодонній колбі об’ємом 5 л, забезпеченій механічною мішалкою, гумовою прокладкою з датчиком температури і барботером газу. Доводять рН із 9 до 2, додаючи 1н водяний розчин HCl (142 мл), і перемішують при кімнатній температурі протягом 6 год доти, поки ГХ не покаже достатнє перетворення проміжної сполуки - біс-ацетоніду - у (3aS,5S,6R,6aS)-5-(гідроксиметил)2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-6-ол. Реакційну суміш нейтралізують, додаючи 50% (мас./мас.) водяний розчин K2HPO4, до pН=7. Потім розчинник випаровують, додають етилацетат (1,25 л) і одержують білу завись, яку фільтрують. Фільтрат концентрують у вакуумі й одержують жовтогарячу олію, яку розчиняють 1 л метил-трет-бутилового ефіру. Одержаний розчин мав KF (вміст води за Фішером) 0,23% (мас.), розчин концентрують, одержуючи (3aS,5S,6R,6aS)-5-(гідроксиметил)-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-6-ол у вигляді жовтогарячої олії (551,23 г, вихід 86%, чистота 96,7% за ГХ (по площі)). 1H ЯМР (400 МГц, ДМСО-d6): 1,22 (с, 3Н); 1,37 (с, 3H); 3,51 (дд, J=11,12; 5,81 Гц, 1Н); 3,61 (дд, J=11,12; 5,05 Гц, 10 UA 107175 C2 5 10 15 20 25 30 35 40 45 50 55 60 1Н); 3,93-4,00 (м, 1Н); 3,96 (с, 1Н); 4,36 (д, J=3,79 Гц, 1H); 4,86 (уш. с, 2Н); 5,79 (д, J=3,54 Гц, 1H). 13C ЯМР (101 МГц, ДМСО-d6): 26,48; 27,02; 59,30; 73,88; 81,71; 85,48; 104,69; 110,73. До розчину (3aS,5S,6R,6aS)-5-(гідроксиметил)-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол6-олу (25,0 г, 131 ммоль) в ацетоні (375 мл, 15X) і H 2O (125 мл, 5X) додають NaHCO3 (33,0 г, 3,0 екв.), NaBr (2,8 г, 20% мол.) і TEMPO (0,40 г, 2% мол.) при 20°С. Суміш охолоджують до 0-5°C і потім порціями додають тверду трихлорізоціанурову кислоту (TCCA, 30,5 г, 1,0 екв.). Завись перемішують при 20°С протягом 24 год. Додають метанол (20 мл) і суміш перемішують при 20°С протягом 1 год. Біла завись утворюється на даній стадії. Суміш фільтрують, промивають ацетоном (50 мл, 2X). Органічний розчинник видаляють у вакуумі, водяний шар екстрагують EtOAc (300 мл, 12X х3) і об’єднані органічні шари концентрують, одержуючи олієподібну суміш з деякою кількістю твердого залишку. Додають ацетон (125 мл, 5X) і суміш фільтрують. Потім ацетоновий розчин концентрують і одержують необхідну кислоту ((3aS,5R,6S,6aS)-6-гідрокси2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-карбонову кислоту) у вигляді твердої жовтої 1 речовини (21,0 г, 79%). H ЯМР (метанол-d4), 6,00 (д, J=3,2 Гц, 1H), 4,72 (д, J=3,2 Гц, 1H), 4,53 (д, J=3,2 Гц, 1H), 4,38 (д, J=3,2 Гц, 1H), 1,44 (с, 3H), 1,32 (с, 3H). До розчину (3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-5карбонової кислоти (5,0 г, 24,5 ммоль) у TГФ (100 мл, 20X) додають TBTU (11,8 г, 1,5 екв.), Nметилморфолін (NMM, 4,1 мл, 1,5 екв.) і суміш перемішують при 20 С протягом 30 хв. Потім додають морфолін (3,2 мл, 1,5 екв.) і реакційну суміш перемішують при 20 С протягом 6 год додатково. Тверду речовину відфільтровують і шар на фільтрі промивають ТГФ (10 мл, 2X х2). Органічний розчин концентрують у вакуумі, залишок очищують колонковою хроматографією на силікагелі (гексани:EtOAc, від 1:4 до 4:1) і одержують 4,3 г необхідного морфолінаміду (64%) у вигляді білої твердої речовини. 1H ЯМР (CDCl3): 6,02 (д, J=3,2 Гц, 1H); 5,11 (уш. с, 1H); 4,62 (д, J=3,2 Гц, 1H); 4,58 (д, J=3,2 Гц, 1H); 3,9-3,5 (м, 8H); 1,51 (с, 3H); 1,35 (с, 3H). 6.2. Альтернативний синтез ((3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3d][1,3]-діоксол-5-іл)(морфоліно)метанону Розчин діолу (3aS,5S,6R,6aS)-5-(гідроксиметил)-2,2-диметилтетрагідрофуро[2,3d][1,3]діоксол-6-олу в ацетонітрилі (5,38 кг, 65% мас./мас., 3,50 кг активного, 18,40 моль) ацетонітрилу (10,5 л) і TEMPO (28,4 г, 1% мол.) додають до розчину K 2HPO4 (0,32 кг, 1,84 моль) і KH2PO4 (1,25 кг, 9,20 моль) у воді (10,5 л). Розчин NaCl 2 (3,12 кг, 80% мас./мас., 27,6 моль, 1,50 екв.) у воді (7,0 л) і розчин K2HPO4 (2,89 кг, 0,90 екв.) у воді (3,0 л) готують при охолодженні. Побутовий відбілювач (3,0 л, приблизно 6% розчин) змішують із приготовленим розчином K2HPO4. Додають приблизно 20% приготовленого розчину NaCl 2 (1,6 л) і розчин відбілювач/K2HPO4 (400 мл, ~1% мол.). Залишки двох розчинів додають одночасно. Реакційна суміш набуває темний червоно-коричневий колір і спостерігається повільна екзотермічна реакція. Швидкість додання розчину NaCl 2 становить близько 40 мл/хв (додання протягом 3-4 год), а швидкість додання розчину відбілювач/K2HPO4 становить близько 10-12 мл/хв (додаток протягом 10 год) при підтримуванні температури бані 15-25 С. Кожні 5-6 год здійснюють додаткові завантаження TEMPO (14,3 г, 0,5% мол.) до тих пір, поки реакція не завершиться (звичайно достатньо виконати два завантаження). Для того, щоб не допустити накопичення зелено-жовтого газу в посудині, здійснюють безупинне продування азотом газової фази в скрубер з водою. Реакційну суміш охолоджують до температури нижче 10 С и гасять трьома порціями Na2SO3 (1,4 кг, 0,6 екв.) протягом 1 години. Потім реакційну суміш підкислюють H3PO4 (2,5-2,7 л) до pН 2,0-2,1 при 5-15 С. Шари розділяють і водяний шар екстрагують ацетонітрилом (10,5 л 3). Об’єднаний органічний шар концентрують у вакуумі (~100-120 торр) при температурі нижче 35°C (температура парів 28-32°C, температура бані 45-50°C) до меншого об’єму (~6-7 л) і потім промивають ацетонітрилом (40 л) доти, поки KF (вміст води за Фішером) не стане менше 1% при розведенні ацетонітрилом до об’єму приблизно 12-15 л. Додають морфолін (1,61 л, 18,4 моль, 1,0 екв.) протягом 4-6 год і завись витримують в атмосфері азоту протягом ночі. Суміш охолоджують до 0-5 С и витримують 3 години, потім фільтрують. Осад на фільтрі промивають ацетонітрилом (10 л). Сушіння в струмі азоту дає 4,13 кг морфолінової солі ((3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-карбонової кислоти 1 у вигляді білої твердої речовини (92-94% чистоти за даними Н ЯМР з 1,4-диметоксибензолом як внутрішнього стандарту), вихід 72-75% з поправкою на чистоту. 1H ЯМР (D2O): 5,96 (д, J=3,6 Гц, 1H); 4,58 (д, J=3,6 Гц, 1H); 4,53 (д, J=3,2 Гц, 1H); 4,30 (д, J=3,2 Гц, 1H); 3,84 (м, 2H); 3,18 (м, 13 2H); 1,40 (с, 1H); 1,25 (с, 1H). H ЯМР (D2O): 174,5; 112,5; 104,6; 84,2; 81,7; 75,0; 63,6; 43,1; 25,6; 25,1. Морфолінову сіль ((3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол5-карбонової кислоти (7,85 кг, 26,9 моль), морфолін (2,40 л, 27,5 моль) і борну кислоту (340 г, 5,49 моль, 0,2 екв.) додають до толуолу (31 л). Одержану завись деаеруюють і нагрівають зі 11 UA 107175 C2 5 10 15 20 25 30 35 40 45 50 зворотним холодильником з пасткою Діна-Старка в атмосфері азоту протягом 12 год, а потім охолоджують до кімнатної температури. Суміш фільтрують для видалення нерозчинних речовин і осад на фільтрі промивають толуолом (5 л). Фільтрат концентрують до об’єму приблизно 14 л і промивають толуолом (~80 л) для видалення надлишку морфоліну. Після доведення кінцевого об’єму приблизно до 12 л повільно додають гептан (14 л) при 60-70°С. Одержану завись поступово охолоджують до кімнатної температури і витримують 3 години. Потім її фільтрують, промивають гептаном (12 л) і сушать в атмосфері азоту, одержуючи 1 рожевувату тверду речовину (6,26 кг, чистота 97%, вихід 98%). Т. пл.: 136 C (DSC). H ЯМР (CDCl3): 6,02 (д, J=3,2 Гц, 1H); 5,11 (уш. с, 1H); 4,62 (д, J=3,2 Гц, 1H); 4,58 (д, J=3,2 Гц, 1H); 3,93,5 (м, 8H); 1,51 (с, 3H); 1,35 (с, 3H). 13C ЯМР (метанол-d4): 26,84; 27,61; 44,24; 47,45; 68,16; 77,14; 81,14; 86,80; 106,87; 113,68; 169,05. 6.3. Синтез 1-хлор-2-(4-етоксибензил)-4-йодбензолу У тригорлу круглодонну колбу об’ємом 2 л, забезпечену механічною мішалкою, гумовою прокладкою, датчиком температури і краплинною лійкою з вирівнюванням тиску і з барботером газу, завантажують 2-хлор-5-йодбензойну кислоту (199,41 г, 0,706 моль), дихлорметан (1,2 л, KF=0,003% (мас.)) і одержану завись починають перемішувати при температурі навколишнього середовища. Додають N,N-диметилформамід (0,6 мл, 1,1% мол.), потім протягом 11 хв додають оксалілхлорид (63 мл, 0,722 моль, 1,02 екв.). Реакційну суміш залишають перемішуватися на ніч при температурі навколишнього середовища, і завись стає розчином. Через 18,75 години додають додаткову порцію оксалілхлориду (6 мл, 0,069 моль, 0,10 екв.), щоб витратити непрореаговану вихідну речовину. Через 2 години реакційну суміш концентрують у вакуумі й одержують неочищений 2-хлор-5-йодбензоїлхлорид у вигляді ясно-жовтої піни, який використовують на наступній стадії. У тригорлу круглодонну колбу в сорочці об’ємом 2 л, забезпечену механічною мішалкою, гумовою прокладкою, датчиком температури і краплинною лійкою з вирівнюванням тиску і з барботером газу, завантажують хлорид алюмінію (97,68 г, 0,733 моль, 1,04 екв.) і дихлорметан (0,65 л, KF=0,003%(мас.)) і одержану завись перемішують в атмосфері азоту і охолоджують приблизно до 6°С. Потім додають етоксибензол (90 мл, 0,712 моль, 1,01 екв.) протягом 7 хвилин, підтримуючи внутрішню температуру нижче 9°С. Одержаний жовтогарячий розчин розріджують дихлорметаном (75 мл) і охолоджують до -7°С. Потім додають розчин 2-хлор-5йодбензоїлхлориду (≤0,706 моль) у 350 мл дихлорметану за 13 хвилин, підтримуючи внутрішню температуру нижче +3°C. Реакційну суміш злегка нагрівають і витримують при +5°C протягом 2 годин. ВЕРХ-аналіз дозволяє припустити, що реакція завершена, і реакцію гасять попередньо охолодженим (~5°C) 2н водяним розчином HCl (450 мл) при перемішуванні в круглодонній колбі із сорочкою. Гасіння проводять порціями протягом 10 хв, при цьому внутрішня температура залишається нижче 28°C. Двофазну суміш після гасіння перемішують при 20°C протягом 45 хв і нижній органічний шар промивають 1н водяним розчином HCl (200 мл), двічі насиченим водяним розчином бікарбонату натрію (200 мл на 1 промивання) і насиченим водяним розчином хлориду натрію (200 мл). Промитий екстракт концентрують на роторному випарнику й одержують неочищений (2-хлор-5-йодфеніл) (4-етоксифеніл)метанон у вигляді не зовсім білої твердої речовини (268,93 г, 99,0% по площі піка на ВЕРХ при 220 нм, 1,0% регіоізомеру по площі піка на ВЕРХ при 200 нм, вихід 98,5% «як є»). У тригорлу круглодонну колбу об’ємом 1 л, забезпечену механічною мішалкою, гумовою прокладкою з датчиком температури і барботером газу, завантажують неочищений (2-хлор-5йодфеніл) (4-етоксифеніл)метанон (30,13 г, 77,93 ммоль) і ацетонітрил (300 мл, KF=0,004% (мас.)) і одержану завись перемішують в атмосфері азоту і охолоджують приблизно до 5°С. Додають триетилсилан (28 мл, 175,30 ммоль, 2,25 екв.), потім діетилефірат трифториду бору (24 мл, 194,46 ммоль, 2,50 екв.), який додають протягом приблизно 30 секунд. Реакційну суміш нагрівають до температури навколишнього середовища протягом приблизно 30 хвилин і перемішують протягом 17 годин. Реакційну суміш розріджують метил-трет-бутиловим ефіром (150 мл), потім насиченим водяним розчином бікарбонату натрію (150 мл), який додають приблизно за 1 хвилину. Відзначається помірне виділення газу; двофазний розчин перемішують при температурі навколишнього середовища протягом 45 хвилин. Верхню органічну фазу 12 UA 107175 C2 5 10 15 20 25 30 35 40 45 50 55 промивають насиченим водяним розчином бікарбонату натрію (100 мл) і насиченим водяним розчином хлориду натрію (50 мл). Промитий екстракт концентрують на роторному випарнику приблизно до половини первісного об’єму і розріджують водою (70 мл). Проводять подальше концентруванняу вакуумі при 45 С доти, поки не утворяться білі гранули, яким дають остудитися до температури навколишнього середовища при перемішуванні. Приблизно через 30 хвилин при температурі навколишнього середовища суспендовані тверді речовини виділяють фільтруванням, промивають водою (30 мл) і сушать у вакуумі при 45 С. Приблизно через 2,5 години одержують 1-хлор-2-(4-етоксибензил)-4-йодбензол у вигляді білого гранульованого порошку, трохи подібного до воску (28,28 г, 98,2% по площі піка на ВЕРХ при 220 нм, вихід 97,4% «як є»). 6.4. Синтез (4-хлор-3-(4-етоксибензил)феніл) ((3aS,5R,6S,6aS)-6-гідрокси-2,2диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-іл)метанону До розчину 1-хлор-2-(4-етоксибензил)-4-йодбензолу (500 мг, 1,34 ммоль) у ТГФ (5,0 мл) додають i-PrMgCl (2,0M у ТГФ, 1,0 мл, 2,00 ммоль) при 0-5 C і суміш перемішують протягом 1,5 год при 0-5 C. Додають по краплях розчин (3aS,5R,6S,6aS)-6-гідрокси-2,2диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-іл)(морфоліно)метанону (146,5 мг, 0,536 ммоль) у ТГФ (1,0 мл) при 0-5 C і суміш перемішують протягом 1 години, нагрівають до 20 С и перемішують при 20 С протягом 2 годин. Реакційну суміш гасять насиченим водяним розчином NH4Cl, екстрагують MTBE, промивають насиченим водяним розчином хлориду натрію. Органічний шар концентрують, залишок очищують колонковою хроматографією на силікагелі й 1 одержують необхідний кетон (178 мг, 76%) у вигляді білої твердої речовини. H ЯМР (CDCl3): 7,88 (дд, J=8,4; 2,0 Гц, 1H); 7,82 (д, J=2,0 Гц, 1H); 7,50 (д, J=8,4 Гц, 1H); 7,12 (д, J=8,4 Гц, 2H); 6,86 (д, J=8,4 Гц, 2H); 6,07 (д, J=3,2 Гц, 1H); 5,21 (д, J=3,2 Гц, 1H); 4,58 (д, J=3,2 Гц, 1H); 4,56 (д, J=3,2 Гц, 1H); 4,16 (д, J=7,2 Гц, 2H); 4,03 (кв, J=7,2 Гц, 2H); 1,54 (с, 3H); 1,42 (т, J=7,2 Гц, 3H); 1,37 (с, 3H). 6.5. Альтернативний синтез (4-хлор-3-(4-етоксибензил)феніл) ((3aS,5R,6S,6aS)-6-гідрокси2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-іл)метанону У реактор об’ємом 20 л, забезпечений механічною мішалкою, регулятором температури і пристроєм для подачі азоту, завантажують йодид (3,00 кг, 8,05 моль) і TГФ (8 л, 4X по відношенню до морфолінаміду) при кімнатній температурі і охолоджують до -5 С. До одержаного розчину додають по краплях розчин i-PrMgCl у TГФ (Aldrich, 2 M, 4,39 л, 8,82 моль) при -5 C протягом 3 годин. Одержаний розчин Грин’яра використовують у реакції утворення кетону, описаній нижче. У реактор об’ємом 50 л, забезпечений механічною мішалкою, регулятором температури і пристроєм для подачі азоту завантажують морфолінамід (чистота за ВЕРХ = 97% (мас.), 2,01 кг, 7,34 моль) і TГФ (11 л, 5,5X) при кімнатній температурі і перемішують протягом 45 хвилин при кімнатній температурі і протягом 15 хвилин при 30°С. Гомогенний розчин потім охолоджують до -25 С. До одержаного розчину додають розчин трет-BuMgCl у ТГФ (Aldrich, 1 M, 7,32 л, 7,91 моль) при -25 C протягом 3 годин. Потім до цього розчину додають вищезгаданий розчин Грин’яра при -20 С протягом 41 хвилини. Одержаний розчин додатково перемішують при -20 C перед гасінням. Реакційну суміш додають до 10% (мас.) водяного розчину NH4Cl (10 л, 5X) при 0 С при енергійному перемішуванні і перемішують протягом 30 хвилин при 0 С. До суміші, що утворилася, повільно додають 6н розчин HCl (4 л, 2X) при 0°С для одержання прозорого розчину і перемішують протягом 30 хвилин при 10°С. Після розділення фаз органічний шар промивають 25% (мас.) водяним розчином NaCl (5 л, 2,5X). Потім органічний шар концентрують до 3X розчини в наступних умовах: 200 мбар, температура бані 50°С. Додають EtOAc (24 л, 12X) і упарюють до 3X розчину в наступних умовах: 150 мбар, температура бані 50°С. Після видалення твердих речовин за допомогою «полірувальної» фільтрації додають EtOAc (4 л, 2X) і концентрують досуха (150 мбар, температура бані 50°С). Вологий осад з фільтра потім переносять у реактор об’ємом 50 л, забезпечений механічною мішалкою, регулятором температури і пристроєм для подачі азоту. Після додання EtOAc завись нагрівають при 70°C для одержання 2,5X гомогенного розчину. До одержаного гомогенного розчину повільно додають гептан (5 л, 2,5X) при тій же температурі. У гомогенний розчин поміщають затравку і до мутнуватого розчину повільно додають гептан (15 л, 7,5X) при 70°C. Після перемішування 13 UA 107175 C2 5 10 15 20 25 30 35 40 45 протягом 0,5 год при 70°C завись повільно охолоджують до 60°С і перемішують протягом 1 години при 60°С. Завись потім повільно охолоджують до кімнатної температури і перемішують протягом 14 год при тій же температурі. Кристали виділяють і промивають гептаном (8 л, 4X), сушать у вакуумі при 45 С и одержують необхідний кетон у вигляді пухкої твердої речовини (2,57 кг, 100% (мас.) за ВЕРХ, вихід 81% з поправкою на чистоту). 6.6. Синтез (2S,3S,4R,5S,6R)-2-(4-хлор-3-(4-етоксибензил)феніл)-6-(метилтіо)тетрагідро-2Hпіран-3,4,5-триїлтриацетату До розчину кетону (4-хлор-3-(4-етоксибензил)феніл)((3aS,5R,6S,6aS)-6-гідрокси-2,2диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-іл)метанону (114,7 г, 0,265 моль) у MeOH (2 л, 17X) додають CeCl3×7H2O (118,5 г, 1,2 екв.) і суміш перемішують при 20 С до розчинення всіх твердих речовин. Потім суміш охолоджують до -78 С и порціями додають NaBH4 (12,03 г, 1,2 екв.) таким чином, щоб температура реакції не перевищувала -70 C. Суміш перемішують при 78 С протягом 1 години, повільно нагрівають до 0 С и гасять насиченим водяним розчином NH4Cl (550 мл, 5X). Суміш концентрують у вакуумі для видалення MeOH, потім екстрагують EtOAc (1,1 л, 10X x2) і екстракт промивають насиченим розчином хлориду натрію (550 мл, 5X). Об’єднані органічні екстракти концентрують у вакуумі й одержують необхідний спирт у вигляді безбарвної олії (неочищений продукт, 115 г). До одержаної безбарвної олії додають AcOH (650 мл) і H2O (450 мл) і суміш нагрівають до 100 С и перемішують протягом 15 годин. Потім суміш охолоджують до кімнатної температури (20 С), концентрують у вакуумі, одержуючи жовту олію (неочищений продукт, ~118 г). До одержаної неочищеної олії додають піридин (500 мл) і суміш охолоджують до 0 C. Потім додають Ac2O (195 мл, ~8,0 екв.), суміш нагрівають до 20 С и перемішують при 20 С протягом 2 годин. Реакцію гасять H2O (500 мл) і розріджують EtOAc (1000 мл). Органічний шар відділяють і концентрують у вакуумі для видалення EtOAc і піридину. Залишок розріджують EtOAc (1000 мл) і промивають водяним розчином NaHSO 4 (1н, 500 мл, x2) і насиченим сольовим розчином (300 мл). Органічний шар концентрують, одержуючи необхідний проміжний тетраацетат у вигляді жовтої піни (~133 г). До розчину тетраацетату (133 г, 0,237 моль приблизно чистого) і тіосечовини (36,1, 2,0 екв.) у діоксані (530 мл, 4X) додають триметилсилілтрифторметансульфонат (TMSOTf) (64,5 мл, 1,5 екв.) і реакційну суміш нагрівають при 80°C протягом 3,5 годин. Суміш охолоджують до 20 С, додають MeІ (37 мл, 2,5 екв.) і N,N-діізопропілетиламін (DiPEA) (207 мл, 5,0 екв.) і суміш перемішують при 20 С протягом 3 год. Потім суміш розріджують метил-трет-бутиловим ефіром (MTBE) (1,3 л, 10X) і промивають H2O (650 мл, 5X x2). Органічний шар відділяють, концентрують у вакуумі й одержують жовту тверду речовину. До одержаної жовтої речовини додають MeOH (650 мл, 5X) і суміш повторно суспендують при 60 С протягом 2 год, потім охолоджують до 0 С и перемішують при 0 С протягом 1 год. Суміш фільтрують і осад на фільтрі промивають MeOH (0 C, 70 мл, х3). Осад сушать у вакуумі при 45 С протягом ночі й одержують необхідний триацетат (2S,3S,4R,5S,6R)-2-(4-хлор-3-(4-етоксибензил)феніл)-6-(метилтіо)тетрагідро-2H1 піран-3,4,5-триїлтриацетат (88 г, 60% після 4 стадій) у вигляді ясно-жовтої твердої речовини. H ЯМР (CDCl3): 7,37 (д, J=8,0 Гц, 1H); 7,20 (дд, J=8,0; 2,0 Гц, 1H); 7,07 (м, 2H); 6,85 (м, 2H); 5,32 (т, J=9,6 Гц, 1H); 5,20 (т, J=9,6 Гц, 1H); 5,05 (т, J=9,6 Гц, 1H); 4,51 (д, J=9,6 Гц, 1H); 4,38 (д, J=9,6 Гц, 1H); 4,04 (м, 2H); 2,17 (с, 3H); 2,11 (с, 3H); 2,02 (с, 3H); 1,73 (с, 3H); 1,42 (т, J=7,2 Гц, 3H). 6.7. Альтернативний синтез (2S,3S,4R,5S,6R)-2-(4-хлор-3-(4-етоксибензил)феніл)-6(метилтіо)тетрагідро-2H-піран-3,4,5-триїлтриацетату У реактор об’ємом 50 л в атмосфері азоту завантажують 40 л MeOH, потім кетон (2,50 кг, 5,78 моль) і CeCl3×7H2O (2,16 кг, 1,0 екв.). Додають метанол (7,5 л) як рідину для промивання 14 UA 107175 C2 5 10 15 20 25 30 35 40 45 50 (всього 47,5 л, 19X). Повільно додають свіжоприготовлений розчин NaBH4 (87,5 г, 0,4 екв.) у 1н водяному розчині NaOH (250 мл) при 15-25 С протягом 35 хв. Потім суміш перемішують протягом 15 хвилин. ВЕРХ-аналіз реакційної суміші показав, що співвідношення діастереомерів становить приблизно 90:10. Реакцію гасять 10% (мас.) водяним розчином NH4Cl (2,5 л, 1X) і суміш концентрують у вакуумі до 5X, розріджують водою (10 л, 4X) і MTBE (12,5 л, 5X). Суміш охолоджують до 10 С и додають 6н водяний розчин HCl до досягнення рН суміші 2,0. Перемішування продовжують протягом 10 хвилин і шари розділяють. Органічний шар промивають H2O (5 л, 2X). Об’єднаний водяний шар екстрагують MTBE (12,5 л, 5X). Об’єднані органічні шари промивають насиченим водяним розчином хлориду натрію (2,5 л, 1X) і концентрують у вакуумі до 3X. Додають MeCN (15 л, 6X). Суміш знову концентрують до 10 л (4X) і будь-який твердий залишок видаляють «полірувальною» фільтрацією. Осад на фільтрі промивають мінімальною кількістю MeCN. Органічний фільтрат переносять у реактор об’ємом 50 л і додають попередньо приготовлений 20% (мол.) водяний розчин H2SO4 (61,8 мл 98% концентрованої H2SO4 і 5 л H2O). Суміш нагрівають при 80 С протягом 2 годин, потім охолоджують до 20 С. Реакцію гасять насиченим водяним розчином K2CO3 (5 л, 2X) і розріджують MTBE (15 л, 6X). Органічний шар відділяють, промивають насиченим водяним розчином хлориду натрію (5 л, 2X) і концентрують у вакуумі до 5 л (2X). Додають MeCN (12,5 л, 5X) і суміш концентрують до 7,5 л (3X). Одержаний розчин (3S,4R,5R,6S)-6-(4-хлор-3-(4-етоксибензил)феніл)тетрагідро-2H-піран2,3,4,5-тетраoлу в MeCN охолоджують до 10 С, додають диметиламінопіридин (17,53 г, 2,5% мл), потім повільно додають оцтовий ангідрид (3,23 л, 6,0 екв.) і триетиламін (5 л, 2X, 6,0 екв.) таким чином, щоб температура суміші зберігалася нижче 20 С. Потім реакційну суміш нагрівають до 20 С, перемішують протягом 1 години і розріджують MTBE (15 л, 6X). Суміш повільно гасять водою (7,5 л, 3X). Органічний шар відділяють і промивають послідовно насиченим водяним розчином KHCO3 (5 л, 2X), 1н розчином NaHSO4 (5 л, 2X) і насиченим водяним розчином хлориду натрію (5 л, 2X). Органічний шар потім концентрують у вакуумі до 5 л (2X). Додають MeCN (12,5 л, 5X) і розчин концентрують до об’єму 7,5 л (3X) (KF=0,08%). Додають діоксан (12,5 л, 5X) і розчин концентрують до об’єму 7,50 л (3X) (KF=0,02%). Будь-які залишки твердих речовин видаляють «полірувальною» фільтрацією і шар осаду на фільтрі промивають мінімальною кількістю діоксану (500 мл). До вищезгаданого фільтрату додають тіосечовину (880 г, 2,0 екв.) і TMSOTf (1,57 л, 1,5 екв.). Реакційну суміш нагрівають при 80°С протягом 3 годин (конверсія >97%). Суміш охолоджують до 20°С, додають метилйодид (541 мл, 1,5 екв.) і діетилізопропіламін (3,02 л, 3,0 екв.) і суміш перемішують при 20°С протягом 18 годин. Додають додаткову кількість метилйодиду (90 мл, 0,25 екв.) і суміш перемішують при 20°С протягом 1 години. Потім суміш розріджують MTBE (25 л, 10X) і промивають водою (12,5 л, 5X x2). Органічний шар відділяють і концентрують у вакуумі до ~5 л (2X). Додають MeOH (12,5 л, 5X) і суміш концентрують до 5X, одержуючи завись. Потім суміш нагрівають при 60 С протягом 1 години, охолоджують до 0 С и перемішують при 0 С протягом 1 год. Суміш фільтрують і осад на фільтрі промивають MeOH (0 C, 2,5 л, 1X x2, 1,0 л, 0,4X). Осад сушать у вакуумі при 45 С протягом ночі й одержують необхідний триацетат (1,49 кг, 47% після 4 стадій) у вигляді ясно-жовтої/не зовсім білої твердої речовини. 6.8. Синтез (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-етоксибензил)феніл)-6-(метилтіо)тетрагідро-2Hпіран-3,4,5-триолу До зависі (2S,3S,4R,5S,6R)-2-(4-хлор-3-(4-етоксибензил)феніл)-6-(метилтіо)тетрагідро-2Hпіран-3,4,5-триїлтриацетату (90,0 м, 0,164 моль) у MeOH (900 мл, 10X) додають NaOMe у MeOH (25% (мас.), 18 мл, 0,2X) при 20 С и суміш перемішують при 20 С протягом 2 годин до зникнення всіх твердих речовин. Потім суміш концентрують до 300 мл, додають до води (1 л) і перемішують протягом 1 години. Тверду речовину відфільтровують і промивають H2O (100 мл 3), осад на фільтрі сушать у вакуумі при 45 С протягом ночі й одержують необхідний метилтіолят (67,0 г, 95%). 1H ЯМР (CDCl3): 7,38 (д, J=8,4 Гц, 1H); 7,22 (м, 2H); 7,11 (д, J=8,8 Гц, 15 UA 107175 C2 5 10 15 20 25 30 35 40 45 50 55 2H); 6,83 (д, J=8,8 Гц, 2H); 4,35 (д, J=9,6 Гц, 1H); 4,15 (д, J=9,6 Гц, 1H); 4,10-3,95 (м, 3H); 3,64 (т, J=8,8 Гц, 1H); 3,50 (м, 2H), 2,73 (уш. с, 3H); 2,17 (с, 3H); 1,40 (т, J=7,2 Гц, 3H). 6.9. Одержання форми 1 кристалічного безводного (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4етоксибензил)феніл)-6-(метилтіо)тетрагідро-2H-піран-3,4,5-триолу У реактор об’ємом 50 л завантажують MeOH (12 л) і триацетат (1,70 кг, 3,09 моль) при слабкому позитивному тиску азоту. Додають метанол (5 л) як рідину для промивання. Потім до зависі додають NaOMe у MeOH (25% (мас.), 340 мл, 0,2X) за 15 хвилин при 20°C і суміш перемішують при 20°С протягом 2 годин до зникнення всіх твердих речовин. До суміші повільно (протягом 45 хвилин) додають воду (25,5 л, 15X), що містить 5 г затравки (DSC 123°С). Випадає тверда речовина і суміш перемішують при 20 С протягом 1 години, охолоджують до 0 С і перемішують протягом 30 хвилин. Тверду речовину відфільтровують і промивають водою (1,7 л, 1X, x2), осад на фільтрі сушать у вакуумі при 45 С протягом ночі й одержують зазначену в заголовку сполуку (т. пл. 123 C по піку DSC; 1,28 кг, вихід 97,7%). 6.10. Одержання форми 2 кристалічного безводного (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4етоксибензил)феніл)-6-(метилтіо)тетрагідро-2H-піран-3,4,5-триолу У реактор об’ємом 50 л завантажують MEK (2-бутанон, 4 л) і форму 1 (2S,3R,4R,5S,6R)-2-(4хлор-3-(4-етоксибензил)феніл)-6-(метилтіо)тетрагідро-2H-піран-3,4,5-триолу (1,49 кг) при слабкому позитивному тиску азоту. Додають МЕК (3,45 л) як рідину для промивання. Суміш нагрівають до 80°С і повільно додають гептан (14,9 л, 10X) протягом 1,5 годин. Починається випадання твердих речовин і в суміш завантажують гептан (14,9 л, 10X) протягом 6 год. Суміш перемішують при 80°С протягом 15 годин. Суміш охолоджують до 20°С за 3 години і перемішують при 20°С протягом 1 години. Тверді речовини відфільтровують, осад на фільтрі промивають сумішшю MEK/гептан (2,5:7,5, об./об., 1,49 л, IX x2), сушать в атмосфері азоту протягом 12 годин і у вакуумі при 50 C протягом 24 годин і одержують зазначену в заголовку сполуку у вигляді білої твердої речовини (т. пл. 134 C по піку DSC; 1,48 кг, повернуто 98%). 6.11. Альтернативне одержання форми 2 кристалічного безводного (2S,3R,4R,5S,6R)-2-(4хлор-3-(4-етоксибензил)феніл)-6-(метилтіо)тетрагідро-2H-піран-3,4,5-триолу У реактор об’ємом 250 л завантажують триацетат (10 кг) і метанол (75 кг). Додають метоксид натрію (1,6 кг, 30% розчин) з 5 кг метанолу для промивання. Суміш перемішують при кімнатній температурі протягом щонайменше 2 годин або до завершення реакції. Додають деревне вугілля (Darco G-60, 1 кг) з 5 кг метанолу для промивання. Одержану суміш нагрівають при 40°С протягом 1 години, охолоджують до кімнатної температури і фільтрують через целіт. Осад на фільтрі промивають метанолом (10 кг). Додають воду (100 кг) і суміш концентрують у вакуумі. Додають MTBE (200 кг) і воду (50 кг) і фази розділяють. Органічний шар промивають водою (100 кг) і концентрують у вакуумі. Додають MEK (100 кг) і практично весь розчинник відганяють у вакуумі. Таке додання MEK і відгін у вакуумі повторюють, щоб висушити розчин. Додають MEK у кількості, достатній для того, щоб одержати розчин (2S,3R,4R,5S,6R)-2-(4-хлор3-(4-етоксибензил)феніл)-6-(метилтіо)тетрагідро-2H-піран-3,4,5-триолу в 50 л MEK. Одержаний розчин піддають «полірувальній» фільтрації і додають гептан (100 л) при температурі близько 80°С. Додають «затравку» форми 2 (0,1 кг) з наступним повільним доданням гептану (100 л) при 80°С. Продовжують нагрівання більше 8 годин при 80°С, охолоджують до 20°С щонайменше протягом 3 годин, витримують при цій температурі щонайменше 2 години, фільтрують і промивають сумішшю MEK/гептан. Осад на фільтрі сушать при 50 С у вакуумі й одержують зазначену в заголовку сполуку у вигляді білої твердої речовини (6,6 кг, вихід 86%). 6.12. Синтез (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-етоксибензил)феніл)-6(метилсульфоніл)тетрагідро-2H-піран-3,4,5-триолу До суміші комплексу сечовини і пероксиду водню (UHP, 92,34 г, 6,0 екв.) і фталевого ангідриду (72,70 г, 3,0 екв.) додають MeCN (720 мл) і MeOH (180 мл). Суміш перемішують при 20 С доти, поки не розчиняться всі тверді речовини. Потім додають розчин (2S,3S,4R,5S,6R)-2(4-хлор-3-(4-етоксибензил)феніл)-6-(метилтіо)тетрагідро-2H-піран-3,4,5-триїлтриацетату (90,00 м, 0,163 моль) у MeCN (540 мл, 6X) і суміш перемішують при 20 С протягом 7 годин. Потім суміш розріджують EtOAc (900 мл, 10X) і промивають насиченим водяним розчином NaHCO 3 (900 мл, 450 мл) і H2O (450 мл). Органічний шар потім концентрують у вакуумі й одержують білу тверду речовину (~95 г). До одержаної білої твердої речовини додають MeOH (900 мл) і потім 16 UA 107175 C2 5 10 NaOMe у MeOH (25% (мас.), 18 мл, 0,2X) і суміш перемішують при 20 С протягом 3 год до зникнення всіх твердих речовин. Суміш концентрують до об’єму 300 мл і повільно додають H2O (1350 мл) при перемішуванні. Перемішування продовжують протягом 1 години. Тверду речовину відфільтровують і осад на фільтрі промивають H2O (90 мл, x2) і сушать у вакуумі при 45 C 1 протягом ночі й одержують необхідний сульфон (71,4 г, 96%). H ЯМР (CDCl3): 7,35 (д, J=8,4 Гц, 1H); 7,20 (м, 2H); 7,081 (д, J=8,8 Гц, 2H); 6,78 (д, J=8,8 Гц, 2H); 4,58 (уш. с, 1H); 4,51 (уш. с, 1H); 4,42 (д, J=9,6 Гц, 1H); 4,24 (д, J=9,6 Гц, 1H); 4,10-3,90 (м, 4H); 3,74 (м, 1H); 3,54 (м, 1H); 3,36 (уш. с, 1H); 2,81 (с, 3H); 1,37 (т, J=7,2 Гц, 3H). Всі публікації (наприклад, патенти і заявки на патент), цитовані вище, включені в даний документ шляхом посилання у всій повноті. ФОРМУЛА ВИНАХОДУ 1. Спосіб одержання сполуки формули І (R1)m Y O Z1 R 3 (R2)n HO 15 OH OH I або її солі, в якому здійснюють стадію, на якій сполуку формули II (R1)m Y O Z1 R 3 (R2)n P1O OP1 OP1 20 25 30 II піддають взаємодії з основою з одержанням сполуки формули І, де Y являє собою О, S, NR4 або C(R4)2; Z1 являє собою О, S, SO або SO2; кожний Р1 незалежно являє собою гідроксизахисну групу, стійку в кислих умовах; кожний R1 незалежно являє собою водень, галоген, ціано, OR1A, SR1A або С1-10алкіл; кожний R1A незалежно являє собою водень або С1-10алкіл або С6-12арил; кожний R2 незалежно являє собою водень, галоген, ціано, OR2A, SR2A або С1-10алкіл; кожний R2A незалежно являє собою водень або С1-10алкіл, або С6-12арил; R3 являє собою С1-10алкіл або С6-12арил, або С5-12гетероцикліл, що являє собою ароматичне, частково ароматичне або неароматичне моноциклічне або поліциклічне кільце або систему кілець, що містить щонайменше один гетероатом, вибраний з N, О або S; кожний R4 незалежно являє собою водень або С1-10алкіл; n дорівнює 1-3 і m дорівнює 1-3. 2. Спосіб за п. 1, де сполука формули І являє собою сполуку формули EtO Cl H O HO Z1 OH OH aбо 17 UA 107175 C2 EtO Cl H O Z1 HO OH OH 5 , де Z1 являє собою S або SO2. 3. Спосіб за п. 1, де Z1 являє собою SO2, і сполуку формули II одержують окисненням (наприклад, з використанням пероксидної сполуки, такої як м-хлорпербензойна кислота, пероцтова кислота, оксон або суміш пероксиду водню або комплексу пероксиду водню (наприклад, сечовини з пероксидом водню) та ангідриду кислоти (наприклад, фталевий ангідрид)) сполуки формули II(а) (R1)m Y O Z2 R 3 (R2)n P1O OP1 OP1 10 , ІІ(a) де Z2 являє собою S або SO. 4. Спосіб за будь-яким з пп. 1-3, в якому додатково здійснюють кристалізацію сполуки формули І. 5. Спосіб одержання сполуки формули II(b) (R1)m Y O S R3 (R2)n P1O OP1 OP1 15 20 , II(b) де Y являє собою О, S, NR4 або C(R4)2; кожен P1 незалежно являє собою гідроксизахисну групу, стійку в кислих умовах; кожен R1 незалежно являє собою водень, галоген, ціано, OR4, SR4 або С1-10алкіл; кожен R2 незалежно являє собою водень, галоген, ціано, OR4, SR4 або С1-10алкіл; R3 являє собою С1-10алкіл, С6-12арил або С5-12гетероцикліл, що являє собою ароматичне, частково ароматичне або неароматичне моноциклічне або поліциклічне кільце або систему кілець, що містить щонайменше один гетероатом, вибраний із N, О або S; кожен R4 незалежно являє собою водень або С1-10алкіл; n дорівнює 1-2 і m дорівнює 1-2; в якому здійснюють стадію, на якій проводять відновлення сполуки формули III(b) O H (R1)m O OP2 Y 25 (R2)n HO OP2 , III(b) де кожен Р2 являє собою незалежно C(O)R6 або обидва Р2 разом утворюють C(R6)2, де кожен R6 являє собою незалежно С1-10алкіл; і Y, R1, R2, m і n мають вищевказані значення; 18 UA 107175 C2 з утворенням сполуки формули (IIIа) OH H (R1)m O OP2 Y HO (R2)n OP2 , III(a) де Y, R1, R2, P2, m і n мають вищевказані значення; яку піддають обробці кислотою з одержанням сполуки формули II(е) (R1)m Y O OH (R2)n HO 5 OH OH , II(e) де Y, R1, R2, m і n мають вищевказані значення; яку піддають взаємодії з сіллю Р1Х'", де Р1 має вищевказані значення, і X'" являє собою хлор, бром, йод, С1-10алкілкарбокси, С1-10алкансульфокси або С1-10алкоксисульфокси; з утворенням сполуки формули II(d) (R1)m Y O OP1 (R2)n P1O 10 OP1 OP1 , II(d) де Y, R1, R2, P1, m і n мають вищевказані значення; яку піддають взаємодії з кислотою Льюїса (наприклад, такою як триметилсилілтрифторметансульфонат) і тіосечовиною, з утворенням сполуки формули II(с) (R1)m Y O SH (R2)n P1O OP1 OP1 15 20 , II(c) де Y, R1, R2, P1, m і n мають вищевказані значення; яку піддають взаємодії зі сполукою формули R3X в основних умовах, де X являє собою бром, йод, С1-10алкансульфокси або С1-10алкоксисульфокси; R3 являє собою С1-10алкіл, С6-12арил або С5-12гетероцикліл, що являє собою ароматичне, частково ароматичне або неароматичне моноциклічне або поліциклічне кільце або систему кілець, що містить щонайменше один гетероатом, вибраний із N, О або S; з отриманням цільової сполуки формули II(b), при цьому всі перераховані вище проміжні реакційні стадії проводять без виділення вказаних вище проміжних сполук з реакційної суміші. 6. Спосіб одержання ((3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол5-іл)(морфоліно)метанону 19 UA 107175 C2 O O N O 5 10 O HO O , який включає стадію, на якій проводять взаємодію (3aS,5R,6S,6aS)-6-гідрокси-2,2диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-карбонової кислоти з морфоліном з одержанням ((3аS,5R,6S,6аS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-5іл)(морфоліно)метанону. 7. Спосіб за п. 6, де (3aS,5R,6S,6aS)-6-гідрокси-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-5карбонову кислоту одержують окисненням (3aS,5S,6R,6aS)-5-(гiдpoкcимeтил)-2,2димeтилтeтpaгiдpoфypo[2,3-d][1,3]діоксол-6-олу з одержанням (3aS,5R,6S,6aS)-6-гідрокси-2,2диметилтетрагідрофуро[2,3-d][1,3]діоксол-5-карбонової кислоти, і де (3аS,5S,6R,6аS)-5(гідроксиметил)-2,2-диметилтетрагідрофуро[2,3-d][1,3]діоксол-6-ол одержують циклізацією L-(-)ксилози в присутності ацетону з одержанням (3aS,5S,6R,6aS)-5-(гiдpoкcимeтил)-2,2димeтилтeтpaгiдpoфypo[2,3-d][l,3]дioкcoл-6-олу. 8. Сполука або її сіль, де сполука представлена формулою O Cl O S AcO OAc OAc 15 або O Cl O S AcO OAc OAc . 9. Сполука або її сіль, де сполука представлена формулою O H O O EtO Cl HO O або O H O O EtO 20 Cl HO O . 20 UA 107175 C2 10. Сполука або її сіль, де сполука представлена формулою O O N O O HO O або O O N O 5 O HO O . 11. Сполука або її сіль, де сполука представлена формулою I EtO Cl . 21 UA 107175 C2 22 UA 107175 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 23
ДивитисяДодаткова інформація
Назва патенту англійськоюMethods and compounds useful for the preparation of sodium glucose co-transporter 2 inhibitors
Автори російськоюGoodwin, Nicole, Cathleen, Harrison, Bryce, Alden, Iimura, Shinya, Mabon, Ross, Song, Qiuling, Wu, Wenxue, Yan, Jie, Zhang, Haiming, Zhao, Matthew, Mangzhu
МПК / Мітки
МПК: C07H 15/04, C07H 9/00, C07H 7/00, C07H 5/00
Мітки: контранспортера, типу, призначені, варіанти, сполука, натрій-глюкози, спосіб, інгібіторів, одержання
Код посилання
<a href="https://ua.patents.su/25-107175-sposib-i-spoluka-priznacheni-dlya-oderzhannya-ingibitoriv-kontransportera-natrijj-glyukozi-2-tipu-varianti.html" target="_blank" rel="follow" title="База патентів України">Спосіб і сполука, призначені для одержання інгібіторів контранспортера натрій-глюкози 2 типу, варіанти</a>
Попередній патент: Упаковка для харчового продукту
Наступний патент: Електричний інсталяційний прилад з підзарядним пристроєм для мобільного телефону
Випадковий патент: Вантажозахоплювальний пристрій