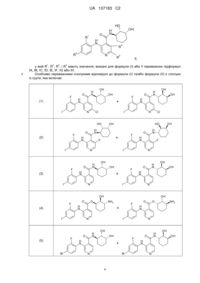
Феніламіно-ізонікотинамідні сполуки, їх застосування, фармацевтична композиція, що їх містить, та спосіб лікування гіперпроліферативних захворювань
Номер патенту: 107183
Опубліковано: 10.12.2014
Автори: Аск'ю Бенні С., Ліу-Буяльскі Леслі, Юй Генрі, Гутопулос Андреас
Формула / Реферат
1. Сполука формули (ІІ)
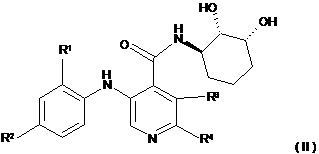
або її фармацевтично прийнятні солі або сольвати,
де:
R1 являє собою водень, метил, етил, н-пропіл, iзопропіл, SH або Hal,
R2 являє собою водень, метокси, етокси, ацетилен, ціано, SH або Hal,
R3 і R4 незалежно вибирають із водню, SH або Hal, і
Hal являє собою F, Сl, Вr або І.
2. Сполука відповідно до пункту 1, де радикали, не вказані докладно, мають значення, вказані для формули (ІІ) відповідно до пункту 1, але де
у підформулі ІА
R1 являє собою Hal, метил або етил,
R2 являє собою водень, Hal, метокси або ацетилен,
R3 являє собою водень або Hal,
R4 являє собою водень або Hal,
Hal являє собою F, Сl, Вr або І,
у підформулі IB
R1 являє собою Hal,
R2 являє собою водень або Hal,
R3 являє собою водень або Hal,
R4 являє собою водень або Hal,
Hal являє собою F, Сl, Вr або І,
у підформулі IС
R1 являє собою F, Сl, метил або етил,
R2 являє собою водень, І, Вr, метокси або ацетилен,
R3 являє собою водень або Hal,
R4 являє собою водень або Hal,
Hal являє собою F, Сl, Вr або І,
у підформулі ID
R1 являє собою F, Сl, метил або етил,
R2 являє собою водень, І, Вr, метокси або ацетилен,
R3 являє собою водень або F,
R4 являє собою водень або Сl,
у підформулі IE
R1 являє собою F або Сl,
R2 являє собою І або Вr,
R3 являє собою водень або F,
R4 являє собою водень або Сl,
у підформулі IF
R1 являє собою F або Сl,
R2 являє собою І або Вr,
R3 являє собою водень або F,
R4 являє собою водень або Сl,
у підформулі IG
R1 являє собою F або Сl,
R2 являє собою І або Вr,
R3 яляє собою водень,
R4 являє собою водень,
і в підформулі ІН
R1 являє собою F,
R2 являє собою І,
R3 являє собою водень або F,
R4 являє собою водень або Сl,
або її фармацевтично прийнятні солі або сольвати.
3. Сполука відповідно до пункту 1, де сполуку вибирають із групи, яка включає:
(1)

(2)

(3)
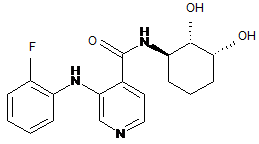
або її фармацевтично прийнятні солі або сольвати.
4. Сполука відповідно до будь-якого з пунктів 1-3, або її фармацевтично прийнятна сіль або сольват, для застосування як лікарського засобу.
5. Сполука відповідно до будь-якого з пунктів 1-3, або її фармацевтично прийнятна сіль або сольват, для лікування гіперпроліферативних захворювань, пов'язаних з гіперактивністю МЕК, а також захворювань, які модулюються МЕК-каскадом у ссавців.
6. Сполука за пунктом 5, або її фармацевтично прийнятна сіль або сольват, де захворювання вибирають із групи, яка включає злоякісні новоутворення, запалення, панкреатит або захворювання нирок, біль, доброякісну гіперплазію шкіри, рестеноз, захворювання передміхурової залози, захворювання, пов'язані з васкулогенезом або ангіогенезом, пухлинним ангіогенезом, захворювання шкіри, вибрані із псоріазу, екземи і склеродерми, діабет, діабетичну ретинопатію, ретинопатію недоношених, вікову дегенерацію жовтої плями, гемангіому, гліому, меланому й саркому Капоші.
7. Фармацевтична композиція, яка містить сполуку відповідно до будь-якого з пунктів 1-3, або її фармацевтично прийнятну сіль або сольват, як активний компонент, разом з фармацевтично прийнятним носієм.
8. Застосування сполуки відповідно до будь-якого з пунктів 1-3, або її фармацевтично прийнятної солі або сольвату, для приготування лікарського засобу для лікування гіперпроліферативних захворювань, пов'язаних з гіперактивністю МЕК, а також захворювань, які модулюються МЕК-каскадом у ссавців.
9. Застосування відповідно до пункту 8, де захворювання вибирають із групи, яка включає злоякісні новоутворення, запалення, панкреатит або захворювання нирок, біль, доброякісну гіперплазію шкіри, рестеноз, захворювання передміхурової залози, захворювання, пов'язані з васкулогенезом або ангіогенезом, пухлинним ангіогенезом, захворювання шкіри, вибрані із псоріазу, екземи і склеродерми, діабет, діабетичну ретинопатію, ретинопатію недоношених, вікову дегенерацію жовтої плями, гемангіому, гліому, меланому й саркому Капоші.
10. Спосіб лікування гіперпроліферативних захворювань, пов'язаних з гіперактивністю МЕК, а також захворювань, які модулюються МЕК-каскадом у ссавців, за яким вводять суб'єкту сполуку відповідно до будь-якого з пунктів 1-3, або її фармацевтично прийнятну сіль або сольват.
11. Спосіб за пунктом 10, де захворювання вибирають із групи, яка включає злоякісні новоутворення, запалення, панкреатит або захворювання нирок, біль, доброякісну гіперплазію шкіри, рестеноз, захворювання передміхурової залози, захворювання, пов'язані з васкулогенезом або ангіогенезом, пухлинним ангіогенезом, захворювання шкіри, вибрані із псоріазу, екземи і склеродерми, діабет, діабетичну ретинопатію, ретинопатію недоношених, вікову дегенерацію жовтої плями, гемангіому, гліому, меланому й саркому Капоші.
Текст
Реферат: Винахід стосується сполук відповідно до формули (І), їх приготування й застосування для лікування гіперпроліферативних захворювань, таких як злоякісні новоутворення, рестеноз і запалення. 5 6 R R O 1 R X H N 3 R 2 R N 4 R UA 107183 C2 (12) UA 107183 C2 UA 107183 C2 5 10 15 20 25 30 35 40 45 50 55 60 Феніламіно-ізонікотинамідна сполука, її застосування, фармацевтична композиція, що її містить, та спосіб лікування гіперпроліферативних захворювань Галузь техніки, до якої належить винахід Винахід стосується групи заміщених феніламіно-ізонікотинамідних сполук, придатних для лікування гіперпроліферативних захворювань, таких як злоякісні новоутворення і запальні порушення, у ссавців. Також описане застосування таких сполук для лікування гіперпроліферативних захворювань у ссавців, особливо людей, і фармацевтичні композиції, що містять такі сполуки. Короткий виклад релевантного рівня техніки Ras/Raf/MEK/ERK метаболічний шлях є центральним шляхом передачі сигналів, який передає сигнали від різних рецепторів клітинної поверхні до транскрипційних факторів у ядрі, які регулюють експресію генів. Цей шлях часто позначається як шлях MAP кінази, де MAPK означає мітоген-активовану протеїнкіназу, вказуючи на те, що цей шлях може стимулюватися мітогенами, цитокінами й факторами росту (Steelman та ін., Leukemia 2004, 18, 189-218). Залежно від стимулу й типу клітини, цей шлях може передавати сигнали, які приведуть до запобігання або індукції апоптозу або здійсненню клітинного циклу. Показано, що Ras/Raf/MEK/ERK шлях є надзвичайно важливим для проліферації клітин і запобігання апоптозу. Аберантна активація цього шляху звичайно спостерігається в злоякісно трансформованих клітинах. Ампліфікація ras прото-онкогенів й активуючі мутації, які приводять до експресії конститутивно активних Ras білків, спостерігається приблизно в 30 % усіх злоякісних новоутворень людини (Stirewalt та ін., Blood 2001, 97, 3589-95). Мутовані, онкогенні форми Ras були виявлені в 50 % раку ободової кишки й >90 % раку підшлункової залози, а також при багатьох інших типах злоякісних новоутворень (Kohl та ін., Science 1993, 260, 18341837). Впливи Ras на проліферацію й пухлиногенез був описаний на імморталізованих клітинних лініях (Mccubrey та ін., Int J Oncol 1995, 7, 295-310). braf мутації були ідентифіковані більш ніж в 60 % злоякісної меланоми (Davies, H та ін., Nature 2002, 417, 949-954). Беручи до уваги високий рівень мутацій, який виявлений в Ras, це шлях завжди розглядався як основна мішень для терапевтичного втручання (Chang та ін., Leukemia 2003, 17,1263-93). Ras/Raf/MEK/ERK шлях передачі сигналів може регулювати проліферацію шляхом κ нижчерозташованих мішеней - транскрипційних факторів, включаючи NF-κ B, CREB, Ets-1, AP-1 і c-myc. ERK може безпосередньо фосфорилувати Ets-1, AP-1 і c-myc, що приводить до їх активації. Альтернативно, ERK може фосфорилувати і активувати нижчерозташовану цільову кіназу RSK, яка потім фосфорилує і активує транскрипційні фактори, такі як CREB. Ці транскрипційні фактори індукують експресію генів, які важливі для здійснення клітинного циклу, наприклад, Cdk, цикліни, фактори росту, і для запобігання апоптозу, наприклад, антиапоптотичний Bcl-2 і цитокіни. У цілому, обробка клітин факторами росту приводить до активації ERK, що викликає проліферацію й, у деяких випадках, диференціацію (Lewis та ін., Adv. Cancer Res, 1998, 74, 49-139). Сімейство MEK генів складається з п'яти генів: MEK1, MEK2, MEK3, MEK4 і MEK5. Це сімейство кіназ із подвійною специфічністю має як серин/треонін, так і тирозинкіназну активність. Структура MEK включає аміно-кінцевий негативний регуляторний домен і карбоксикінцевий домен зв'язування MAP кінази, який необхідний для зв'язування й активації ERK. Делеція регуляторного MEK1 домену приводить до конститутивної MEK1 і ERK активації (Steelman та ін., Leukemia 2004, 18, 189-218). MEK1 представляє собою білок з 393 амінокислот з молекулярною масою 44 кДа (Crews та ін., Science 1992, 258, 478-80). MEK1 помірно експресується при ембріональному розвитку й підвищена в тканинах дорослих з найвищими рівнями, виявленими в тканині головного мозку. Для активації MEK1 необхідно фосфорилування S218 і S222, і заміщення цих залишків або аспарагіновою кислотою (D) або глутаміновою кислотою (E) приводить до підвищення активності й утворення вогнищ в NIH3T3 клітинах (Huang та ін., Mol Biol Cell, 1995, 6, 237-45). Конститутивна активність MEK1 у первинній клітинній культурі сприяє старінню й індукує p53 і INK4a p16 , і протилежне спостерігається в імморталізованих клітинах або клітинах, у яких відсутня INK4a або p53 або p16 (Lin та ін., Genes Dev, 1998, 12, 3008-3019). Конститутивна активність MEK1 κ інгібує NF-κ B транскрипцію шляхом негативної регуляції p38 MAPK активностями (Carter та ін., J Biol Chem 2000, 275, 27858-64). Основними фізіологічними субстратами MEK є представники ERK (кіназа, регульована позаклітинними сигналами) або MAPK (мітоген-активована протеїнкіназа) сімейства білків. Аберантна експресія MEK1 була виявлена при багатьох різних типах злоякісних новоутворень, і мутовані форми MEK1 будуть трансформувати фібробласти, гемопоетичні клітини й клітини інших типів. Конститутивна активація MEK1 приводити до трансформації клітин. Отже, MEK1 1 UA 107183 C2 5 10 15 20 25 30 представляє собою перспективну мішень для фармакологічного втручання при проліферативних і запальних захворюваннях (Lee та ін., Nature 1994, 372, 739-746; Dudley та ін., Proc. Natl. Acad. Sci. U.S.A. 1995, 92, 7686-7689). Були розроблені придатні інгібітори MEK, які проявляли потенційні терапевтичні переваги в деяких дослідженнях. Наприклад, було показано, що низькомолекулярні інгібітори MEK інгібують ріст пухлини на ксенотрансплантатах в "голих" мишей (Yeh, T. та ін., Proceedings of the American Association of Cancer Research 2004, 45, реф. 3889 і Lee, P. та ін., Proceedings of the American Association of Cancer Research 2004, 45, реф. 3890). MEK інгібітори проходять клінічні випробування, тобто ARRY142886 (Wallace, E. та ін., Proceedings of the American Association of Cancer Research 2004, 45, Abs 3891; Adjei, A. A. та ін., Journal of Clinical Oncology 2008, 26, 21392146; Shannon, A. M. та ін., Molecular Cancer Therapeutics 2007, 6, 3414S-3415S Part 2), PD0325901 (Swanton C, Johnston S IDDB MEETING REPORT 2003, February 13-1; Haura, E.B. та ін., Molecular Cancer Therapeutics 2007, 6, 3468S-3469S частина 2; Lorusso, P. A. та ін., Molecular Cancer Therapeutics 2007, 6, 3469S-3470S частина 2), PD-184352 (Waterhouse та ін., Proceedings of the American Society for Clinical Oncology 2003, 22, Abs 816), XL-518 (Johnston, S., Molecular Cancer Therapeutics 2007, 6, 3595S-3595S частина 2), RDEA-119 (2007 прес-реліз), і RDEA-436 (2008 прес-реліз). Сполуки, придатні як MEK інгібіторів, також описані в US 5,525,625; WO 98/43960; WO 99/01421; WO 99/01426; WO 00/41505; WO 00/42002; WO 00/42003; WO 00/41994; WO 00/42022; WO 00/42029; WO 00/68201; WO 01/68619; WO 02/06213; WO 03/077855; WO03/077914; WO2004/005284; WO2004/056789, WO2006/045514, WO2008/076415, WO2007/121269, і WO2007/121481. Опис винаходу Об'єктом даного винаходу є забезпечення нових MEK інгібіторів, придатних для лікування гіперпроліферативних захворювань, пов'язаних з гіперактивністю MEK, а також захворювань, які модулюються MEK каскадом, таких як злоякісні новоутворення і запалення в ссавців з поліпшеними фармакологічними властивостями як відносно їх активностей, так і щодо їх розчинності, метаболічного кліренсу й характеристик біодоступності. Таким чином, даний винахід забезпечує нові, заміщені феніламіно-ізонікотинамідні сполуки і їх фармацевтично прийнятні солі, сольвати або проліки, які є інгібіторами MEK і придатні для лікування вищевказаних захворювань. Сполуки визначаються формулою (I): 5 6 R X O 1 R R H N 3 R 2 R N 4 R 35 40 45 50 формула (I) і їх фармацевтично прийнятні солі, сольвати або проліки, де: X представляє собою NH або O, 1 R представляє собою водень, метил, етил, н-пропіл, ізо-пропіл, SH або Hal, 2 R представляє собою водень, метокси, етокси, ацетилен, ціано, SH або Hal, 3 4 R , R незалежно вибирають із водню, SH або Hal, 5 6 R , R незалежно вибирають із OH, SH або NH2 і Hal представляє собою F, Cl, Br або I. Переважними є сполуки підформул IA, IB, IC, ID, IE, IF, IG і IH формули (I), і їх фармацевтично прийнятні солі, сольвати або проліки, де у підформулі IA X представляє собою NH, 1 R представляє собою Hal, метил або етил, 2 R представляє собою водень, Hal, метокси або ацетилен, 3 R представляє собою водень або Hal, 4 R представляє собою водень або Hal, 2 UA 107183 C2 5 5 10 15 20 25 30 35 40 45 50 55 6 R , R являють собою OH, Hal представляє собою F, Cl, Br або I, у підформулі IB X представляє собою NH, 1 R представляє собою Hal, 2 R представляє собою водень або Hal, 3 R представляє собою водень або Hal, 4 R представляє собою водень або Hal, 5 6 R , R являють собою OH, Hal представляє собою F, Cl, Br або I, у підформулі IC X представляє собою NH, 1 R представляє собою F, Cl, метил або етил, 2 R представляє собою водень, I, Br, метокси або ацетилен, 3 R представляє собою водень або Hal, 4 R представляє собою водень або Hal, 5 6 R , R являють собою OH, Hal представляє собою F, Cl, Br або I, у підформулі ID X представляє собою NH, 1 R представляє собою F, Cl, метил або етил, 2 R представляє собою водень, I, Br, метокси або ацетилен, 3 R представляє собою водень або F, 4 R представляє собою водень або Cl, 5 6 R , R являють собою OH, у підформулі IE X представляє собою NH, 1 R представляє собою F або Cl, 2 R представляє собою I або Br, 3 R представляє собою водень або F, 4 R представляє собою водень або Cl, 5 6 R , R являють собою OH, у підформулі IF X представляє собою NH, 1 R представляє собою F або Cl, 2 R представляє собою I або Br, 3 R представляє собою водень або F, 4 R представляє собою водень або Cl, 5 6 R , R являють собою OH, у підформулі IG X представляє собою NH, 1 R представляє собою F або Cl, 2 R представляє собою I або Br, 3 R представляє собою водень, 4 R представляє собою водень, 5 6 R , R являють собою OH, і в підформулі IH X представляє собою NH, 1 R представляє собою F, 2 R представляє собою I, 3 R представляє собою водень або F, 4 R представляє собою водень або Cl, 5 6 R , R являють собою OH. Більш переважна група сполук формули (I) і її підформул IA, IB, IC, ID, IE, IF, IG і IH відповідає формулі (II): 3 UA 107183 C2 HO O 1 R OH H N H N 3 R 2 R 1 5 2 3 N 4 R II, 4 у якій R , R , R , і R мають значення, вказані для формули (I) або її переважних підформул IA, IB, IC, ID, IE, IF, IG або IH. Особливо переважними сполуками відповідно до формули (I) та/або формули (II) є сполуки із групи, яка включає O F OH H N OH H N (1) + I N F H N F (3) O F H N OH N F + H N O (4) F + H N O O O N OH OH H N F + Br N 4 NH2 H N I N F Br NH2 H N I (5) OH O O OH N OH F OH H N I N OH F OH H N I Cl H N O I N H N OH HO + F I N OH H N O O H N I Cl HO (2) F OH H N H N O H N N OH OH UA 107183 C2 Cl (6) Br H N O OH OH Cl H N + O H N O F OH OH H N Br N H N N OH OH H N (7) I N H N O F OH OH H N (8) I N H N O F OH OH H N (9) Br N H N O F OH OH H N (10) N 5 10 15 або їх фармацевтично прийнятні солі, сольвати або проліки. Якщо дві структури представлені зі знаком “+” між ними, то це вказує на 1:1 рацемічну суміш двох енантіомерів. Сполуки відповідно до даного винаходу можуть знаходитися у формі пролікарської сполуки. "Пролікарська сполука" означає похідне, яке перетворюється в біологічно активну сполуку відповідно до даного винаходу у фізіологічних умовах у живому організмі, наприклад, шляхом окиснення, відновлення, гідролізу або інших, кожне з яких здійснюється ферментативно, або без залучення ферментативного середовища. Прикладами проліків є сполуки, де аміногрупа в сполуці згідно із даним винаходом ацилована, алкілована або фосфорилована, наприклад, ейкозаноїламіно, аланіламіно, півалоїлоксиметиламіно або де гідроксильна група ацилована, алкілована, фосфорилована або перетворена в борат, наприклад, ацетилокси, пальмітоїлокси, півалоїлокси, сукцинілокси, фумарилокси, аланілокси або де карбоксильна група естерифікована або амідована, або де сульфгідрильна група утворює дисульфідний місток з молекулою носія, наприклад, пептидом, яка доставляє лікарський засіб до мішені та/або в цитозоль клітини. Ці сполуки можуть бути отримані зі сполук згідно із даним винаходом 5 UA 107183 C2 5 10 15 20 25 30 35 40 45 50 55 60 відповідно до добре-відомих методів. Іншими прикладами проліків є сполуки, де карбоксилат у сполуці згідно із даним винаходом, наприклад, перетворений в алкіл-, арил-, холін-, аміно, ацилоксиметиловий складний ефір, ліноленоїл-складний ефір. Метаболіти сполук згідно із даним винаходом також охоплюються обсягом даного винаходу. Якщо зустрічається таутомерія, наприклад, кето-єнольна таутомерія, сполук згідно із даним винаходом або їх проліків, то індивідуальні форми, наприклад, кето- або єнольна форма, заявляються окремо й спільно у вигляді сумішей у будь-якому співвідношенні. Аналогічне застосовується для стереоізомерів, наприклад, енантіомерів, цис/транс ізомерів, конформерів і т.д. Якщо це є бажаним, то ізомери можуть бути розділені за допомогою методів, добре відомих у даній галузі техніки, наприклад, шляхом рідинної хроматографії. Аналогічне застосовується для енантіомерів, наприклад, шляхом застосування хіральних нерухомих фаз. Додатково, енантіомери можуть бути виділені шляхом їх перетворення в діастереомери, тобто, комбінації в енантіомерно чистою допоміжною сполукою, наступного розщеплення отриманих діастереомерів і відщеплення допоміжного залишку. Альтернативно, будь-який енантіомер сполуки згідно із даним винаходом може бути отриманий при стереоселективному синтезі, використовуючи оптично чисті вихідні речовини. Сполуки відповідно до даного винаходу можуть знаходитися у формі фармацевтично прийнятної солі або сольвату. Термін "фармацевтично прийнятні солі" стосується солей, отриманих з фармацевтично прийнятних нетоксичних основ або кислот, включаючи неорганічні основи або кислоти й органічні основи або кислоти. У тих випадках, коли сполуки відповідно до даного винаходу містять одну або декілька кислотних або основних груп, то винахід також охоплює їх відповідні фармацевтично або токсикологічно прийнятні солі, зокрема їх фармацевтично використовувані солі. Таким чином, сполуки відповідно до даного винаходу, які містять кислотні групи, можуть бути представлені в сольовій формі, і можуть використовуватися відповідно до винаходу, наприклад, у вигляді солей лужних металів, солей лужноземельних металів або у вигляді солей амонію. Більш переважні приклади таких солей включають солі натрію, солі калію, солі кальцію, солі магнію або солі з аміаком або органічними амінами, такими як, наприклад, етиламін, етаноламін, триетаноламін або амінокислотами. Сполуки згідно із даним винаходом, які містять одну або декілька основних груп, тобто груп, які можуть бути протоновані, можуть бути представлені в сольовій формі, і можуть використовуватися відповідно до винаходу у формі їх солей приєднання з неорганічними або органічними кислотами. Прикладами підходящих кислот є соляна кислота, бромистоводнева кислота, фосфорна кислота, сірчана кислота, азотна кислота, метансульфонова кислота, птолуолсульфонова кислота, нафталіндисульфонові кислоти, щавлева кислота, оцтова кислота, винна кислота, молочна кислота, саліцилова кислота, бензойна кислота, мурашина кислота, пропіонова кислота, півалінова кислота, діетилоцтова кислота, малонова кислота, янтарна кислота, пімелінова кислота, фумарова кислота, малеїнова кислота, яблучна кислота, сульфамінова кислота, фенілпропіонова кислота, глюконова кислота, аскорбінова кислота, ізонікотинова кислота, лимонна кислота, адипінова кислота, і інші кислоти, відомі фахівцеві в даній галузі техніки. Якщо сполуки відповідно до даного винаходу одночасно містять кислотні й основні групи в молекулі, то винахід також включає, додатково до вказаних сольових форм, внутрішні солі або бетаїни (цвітер-іони). Відповідні солі можуть бути отримані за допомогою звичайних методів, які відомі фахівцеві в даній галузі техніки, наприклад, шляхом їх контактування з органічною або неорганічною кислотою або основою в розчиннику або диспергаторі, або шляхом обміну аніонами або обміну катіонами з іншими солями. Даний винахід також включає всі солі сполук відповідно до даного винаходу які, внаслідок їх низької фізіологічної сумісності, не можуть бути безпосередньо придатні для застосування в лікарських засобах, але які можуть застосовуватися, наприклад, як проміжні продукти для хімічних реакцій або для приготування фармацевтично прийнятних солей. Крім того, даний винахід стосується фармацевтичних композицій, що містять сполуку згідно із даним винаходом, або її пролікарську сполуку, або її фармацевтично прийнятну сіль або сольват як активний компонент разом з фармацевтично прийнятним носієм. "Фармацевтична композиція" означає один або декілька активних компонентів, і один або декілька інертних компонентів, які становлять носій, а також будь-який інший продукт, яка утворюється, безпосередньо або опосередковано, при комбінації, комплексоутворенні або агрегації будь-яких двох або більше компонентів, або при дисоціації одного або більше компонентів, або при інших типах реакцій або взаємодій одного або більше компонентів. Отже, фармацевтичні композиції згідно із даним винаходом охоплюють будь-яку композицію, отриману при змішуванні сполуки згідно із даним винаходом й фармацевтично прийнятного носія. 6 UA 107183 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтична композиція згідно із даним винаходом додатково може містити одну або декілька інших сполук як активних компонентів, такі як одну або декілька додаткових сполук згідно із даним винаходом, або пролікарську сполуку або інші MEK інгібітори. Фармацевтичні композиції включають композиції, придатні для перорального, ректального, місцевого, парентерального (включаючи підшкірне, внутрішньом'язове й внутрішньовенне), очного (офтальмічного), легеневого (назальної або букальної інгаляції), або назального введення, хоча найбільш підходящий шлях для будь-якого даного випадку буде залежати від природи й тяжкості станів, що піддаються лікуванню, і природи активного компонента. Вони підходяще можуть бути представлені в одиничній дозованій формі й можуть бути приготовлені за допомогою будь-якого зі способів, добре відомих в галузі фармацевтики. В одному варіанті здійснення, вказані сполуки й фармацевтична композиція призначені для лікування злоякісного новоутворення, такого як рак головного мозку, легені, плоских клітин, сечового міхура, шлунка, підшлункової залози, молочної залози, голови, шиї, нирки, нирки, яєчників, передміхурової залози, ободової і прямої кишки, стравоходу, яєчок, жіночих статевих органів, щитовидної залози, меланоми, гемобластозів, таких як гострий мієлолейкоз, множинна мієлома, хронічний мієлолейкоз, лейкоз мієлоїдних клітин, або будь-якого іншого типу сóлідних або рідких пухлин. В іншому варіанті здійснення, вказана фармацевтична композиція призначена для лікування незлоякісного гіперпроліферативного порушення, такого як доброякісна гіперплазія шкіри (наприклад, псоріаз), рестеноз, полікістозне захворювання нирок, або передміхурової залози (наприклад, доброякісна гіпертрофія передміхурової залози (BPH)) і також для лікування запальних і аутоімунних захворювань, таких як ревматоїдний артрит, хвороба Крона, астма, неспецифічний виразковий коліт, синдром подразненого кишечнику, розсіяний склероз, червоний вовчак й інші. В іншому варіанті здійснення, вказана фармацевтична композиція призначена для лікування генетичних станів, які характеризуються підвищеною регуляцією MEK/ERK шляху, такі як синдром Costello, синдром Noonan, кардвофаціошкірний синдром та інші. Винахід також стосується застосування сполук відповідно до винаходу для приготування лікарського засобу для лікування гіперпроліферативних захворювань, пов'язаних з гіперактивністю MEK, а також захворювань, які модулюються MEK каскадом у ссавців, або порушень, опосередковуваних аберантною проліферацією, таких як злоякісні новоутворення і запалення. Винахід також стосується сполуки або фармацевтичної композиції для лікування панкреатиту або захворювання нирок (включаючи проліферативний гломерулонефрит і захворювання нирок, індуковане діабетом) або болю в ссавця, яка включає терапевтично ефективну кількість сполуки згідно із даним винаходом, або її фармацевтично прийнятної солі, проліків або гідрату, і фармацевтично прийнятний носій. Винахід також стосується сполуки або фармацевтичної композиції для запобігання імплантації бластоцитів у ссавця, яка включає терапевтично ефективну кількість сполуки згідно із даним винаходом, або її фармацевтично прийнятної солі, проліків або гідрату, і фармацевтично прийнятний носій. Винахід також стосується сполуки або фармацевтичної композиції для лікування захворювання, пов'язаного з васкулогенеозом або ангіогенезом, у ссавця, яка включає терапевтично ефективну кількість сполуки згідно із даним винаходом, або її фармацевтично прийнятної солі, проліків або гідрату, і фармацевтично прийнятний носій. В одному варіанті здійснення, вказана сполука або фармацевтична композиція призначена для лікування захворювання, вибраного із групи, яка включає пухлинний ангіогенез, хронічне запальне захворювання, таке як ревматоїдний артрит, запальне захворювання кишечнику, атеросклероз, захворювання шкіри, такі як псоріаз, екзема, і склеродерма, діабет, діабетичну ретинопатію, ретинопатію недоношених, вікову дегенерацію жовтої плями, гемангіому, гліому, меланому, саркому Капоши й рак яєчників, молочної залози, легені, підшлункової залози, передміхурової залози, ободової кишки й епідерміоїдний рак. Винахід також стосується застосування для лікування гіперпроліферативного порушення в ссавця, який включає введення вказаному ссавцеві терапевтично ефективної кількості сполуки згідно із даним винаходом, або її фармацевтично прийнятної солі, проліків або гідрату. В одному варіанті здійснення, вказане застосування стосується лікування злоякісного новоутворення, такого як рак головного мозку, легені, плоских клітин, сечового міхура, шлунка, підшлункової залози, молочної залози, голови, шиї, нирки, нирки, яєчників, передміхурової залози, ободової і прямої кишки, стравоходу, яєчок, жіночих статевих органів або щитовидної залози. В іншому варіанті здійснення, вказане застосування стосується лікування незлоякісних гіперпроліферативних порушень, таких як доброякісна гіперплазія шкіри (наприклад, псоріаз), 7 UA 107183 C2 5 10 15 20 25 30 35 40 45 50 55 60 рестеноз, або передміхурової залози (наприклад, BPH). Винахід також стосується застосування для лікування гіперпроліферативного порушення в ссавця, який включає введення вказаному ссавцеві терапевтично ефективної кількості сполуки згідно із даним винаходом, або її фармацевтично прийнятної солі, проліків або гідрату, у комбінації із протипухлинним засобом, вибраним із групи, яка включає інгібітори мітозу, алкілувальні засоби, антиметаболіти, інтеркалюючі антибіотики, інгібітори факторів росту, антиангіогенні засоби, інгібітори клітинного циклу, інгібітори ферментів, інгібітори типоізомерази, модифікатори біологічного відгуку, антигормональні засоби, інгібітори ангіогенезу, і антиандрогени, або імуномодулятори. Винахід також стосується застосування для лікування панкреатиту або захворювання нирок або болю в ссавця, який включає введення вказаному ссавцеві терапевтично ефективної кількості сполуки згідно із даним винаходом, або її фармацевтично прийнятної солі, проліків або гідрату. Винахід також стосується застосування для запобігання імплантації бластоцитів у ссавця, який включає введення вказаному ссавцеві терапевтично ефективної кількості сполуки згідно із даним винаходом, або її фармацевтично прийнятної солі, проліків або гідрату. Винахід також стосується застосування для лікування захворювань, пов'язаних з васкулогенеозом або ангіогенезом, у ссавця, який включає введення вказаному ссавцеві терапевтично ефективної кількості сполуки згідно із даним винаходом, або її фармацевтично прийнятної солі, проліків або гідрату. В одному варіанті здійснення, вказаний спосіб призначений для лікування захворювання, вибраного із групи, яка включає пухлинний ангіогенез, хронічне запальне захворювання, таке як ревматоїдний артрит, атеросклероз, запальне захворювання кишечнику, захворювання шкіри, такі як псоріаз, екзема, і склеродерма, діабет, діабетичну ретинопатію, ретинопатію недоношених, вікову дегенерацію жовтої плями, гемангіому, гліому, меланому, саркому Капоши й рак яєчників, молочної залози, легені, підшлункової залози, передміхурової залози, ободової кишки й епідерміоїдний рак. Пацієнти, які можна піддавати лікуванню із застосуванням сполук згідно із даним винаходом, або фармацевтично прийнятних солей, проліків і гідратів вказаних сполук, відповідно до способів згідно із даним винаходом включають, наприклад, пацієнтів, у яких був поставлений діагноз псоріаз, рестеноз, атеросклероз, BPH, рак легені, рак кісток, хронічні мієломоноцитарні лейкози, рак підшлункової залози, рак шкіри, рак голови й шиї, шкірна або внутрішьноочна меланома, рак матки, рак яєчників, рак прямої кишки, рак анальної ділянки, рак шлунка, рак ободової кишки, рак молочної залози, пухлини яєчок, жіночих статевих органів (наприклад, саркоми матки, карциноми фалопієвих труб, карцинома ендометрію, карцинома шийки матки, карцинома піхви або карцинома зовнішніх жіночих статевих органів), хвороба Ходжкіна, рак стравоходу, рак тонкого кишечнику, рак ендокринної системи (наприклад, рак щитовидної залози, паращитовидної залози або надниркової залози), саркоми м'яких тканин, рак уретри, рак пенісу, рак передміхурової залози, хронічний або гострий лейкоз, сóлідні пухлини в дітей, лімфоцитарні лімфоми, рак сечового міхура, рак нирки або уретри (наприклад, нирково-клітинний рак, карцинома ниркової миски), або новоутворення центральної нервової системи (наприклад, первинна лімфома ЦНС, пухлини осі хребта, гліоми стовбура мозку або аденоми гіпофіза). Даний винахід також стосується сполуки або фармацевтичної композиції для інгібування атипового клітинного росту в ссавця, яка включає кількість сполуки згідно із даним винаходом, або її фармацевтично прийнятної солі або сольвату або проліків, у комбінації з кількістю іншого протиракового терапевтичного засобу, де кількості сполуки, солі, сольвату, або проліків, і хіміотерапевтичного засобу спільно ефективні для інгібування атипового клітинного росту. У цей час у даній галузі відомо багато протиракових терапевтичних засобів. В одному варіанті здійснення, протираковий терапевтичний засіб представляє собою хіміотерапевтичний засіб, вибраний із групи, яка включає інгібітори мітозу, алкілуючі засоби, антиметаболіти, інтеркалюючі антибіотики, інгібітори факторів росту, інгібітори клітинного циклу, ферменту, інгібітори типоізомерази, модифікатори біологічного відгуку, антигормональні засоби, інгібітори ангіогенезу, і антиандрогени. В іншому варіанті здійснення протираковий терапевтичний засіб представляє собою антитіло, вибране із групи, яка включає бевацизумаб, CD40-специфічні антитіла, chtnt-1/B, денозумаб, занолімумаб, IGF1R-специфічні антитіла, лінтузумаб, едреколомаб, WX G250, ритуксимаб, тицилімумаб, трастузумаб і цетуксимаб. Даний винахід також стосується способу інгібування атипового клітинного росту в ссавця або лікування гіперпроліферативного порушення, який включає введення ссавцеві кількості сполуки згідно із даним винаходом, або її фармацевтично прийнятної солі або сольвату або проліків, у комбінації із променевою терапією, де кількості сполуки, солі, сольвату, або проліків, представлені в комбінації із променевою терапією, ефективні для інгібування атипового клітинного росту або лікування гіперпроліферативного порушення в ссавця. Техніки введення 8 UA 107183 C2 5 10 15 20 25 30 35 40 45 50 55 60 променевої терапії відомі з рівня техніки, і ці техніки можна використовувати в комбінованій терапії, розкритій в даній заявці. Введення сполуки згідно з винаходом у цій комбінованій терапії можна визначити, як описано в даній заявці. Вважаються, що сполуки відповідно до даного винаходу можуть надавати атиповим клітинам більшу чутливість до лікування із застосуванням променевої терапії для знищення та/або інгібування росту таких клітин. Отже, даний винахід також стосується способу сенсибілізації атипових клітин у ссавця до лікування із застосуванням променевої терапії, який включає введення ссавцеві кількості сполуки згідно із даним винаходом або її фармацевтично прийнятної солі або сольвату або проліків, де кількість є ефективною для сенсибілізації атипових клітин до лікування за допомогою променевої терапії. Кількість сполуки, солі, або сольвату в цьому методі можна визначити відповідно до методів для встановлення ефективних кількостей таких сполук, описаних у даній заявці. Винахід також стосується способу інгібування атипового клітинного росту в ссавця, який включає кількість сполуки згідно із даним винаходом, або її фармацевтично прийнятної солі або сольвату, її проліків, або її похідного, міченого радіоактивним ізотопом, і кількість однієї або декількох речовин, вибраних з антиангіогенних засобів, інгібіторів передачі сигналів, і антипроліферативних засобів. При практичному використанні, сполуки відповідно до даного винаходу можна комбінувати як активний компонент в ретельній суміші з фармацевтичним носієм відповідно до загальноприйнятих технік приготування лікарських засобів. Носій може мати різні форми залежно від форми препарату, бажаного для введення, наприклад, перорального або парентерального (включаючи внутрішньовенне). Для приготування композицій для пероральних дозованих форм, можна використовувати будь-які звичайні фармацевтичні середовища, такі як, наприклад, вода, гліколі, масла, спирти, ароматизатори, консерванти, барвники та інші. У випадку пероральних рідких препаратів, можна використовувати будь-які звичайні фармацевтичні середовища, такі як, наприклад, суспензії, еліксири й розчини; або носії, такі як крохмалі, цукри, мікрокристалічна целюлоза, розріджувачі, гранулюючі засоби, замаслювачі, сполучні, дезінтегратори й інші. У випадку твердих пероральних препаратів, композиція може знаходитися в таких формах, як, наприклад, порошки, тверді й м'які капсули й таблетки, при цьому тверді пероральні препарати є переважними відносно рідких препаратів. У зв'язку із простотою їх введення, таблетки й капсули є найбільш сприятливими пероральними дозованими одиничними формами, у цих випадках обов'язково використовуються тверді фармацевтичні носії. Якщо це є бажаним, то таблетки можуть бути покриті оболонкою за допомогою стандартних водних або неводних технік. Такі композиції й препарати повинні містити принаймні 0,1 відсоток активної сполуки. Відсоток активної сполуки в цих композиціях, мабуть, може змінюватися й підходяще може становити від приблизно 2 відсотків до приблизно 60 відсотків від ваги одиниці. Кількість активної сполуки в таких терапевтично придатних композиціях буде такою, щоб одержати ефективну дозу. Активні сполуки також можна вводити інтраназально, наприклад, у вигляді рідких крапель або спрею. Таблетки, пігулки, капсули, і інші форми також можуть містити сполучне, таке як трагакантову камедь, гуміарабік, кукурудзяний крохмаль або желатин; наповнювачі, такі як дикальцій фосфат; дезінтегруючий засіб, такий як кукурудзяний крохмаль, картопляний крохмаль, альгінову кислоту; замаслювач, такий як стеарат магнію; і підсолоджувач, такий як сахароза, лактоза або сахарин. Якщо одинична дозована форма представляє собою капсулу, то вона може містити, додатково до матеріалів вищеописаного типу, рідкий носій, такий як жирне масло. Різні інші матеріали можуть бути представлені у вигляді покриттів або для модифікації фізичної форми дозованої одиниці. Наприклад, таблетки можуть бути покриті за допомогою шелаку, цукру або обох речовин. Сироп або еліксир може містити, додатково до активного компонента, сахарозу як підсолоджувач, метил і пропілпарабени як консерванти, барвник і ароматизатор, такий як вишневий або апельсиновий ароматизатор. Сполуки згідно із даним винаходом також можуть вводитися парентерально. Розчини або суспензії цих активних сполук можуть бути приготовлені у воді, що підходяще змішана з поверхнево-активною речовиною, такою як гідрокси-пропілцелюлоза. Дисперсії також можуть бути приготовлені в гліцерині, рідких поліетиленгліколях і їх сумішах у маслах. При звичайних умовах зберігання й застосування, ці препарати містять консервант для запобігання росту мікроорганізмів. Фармацевтичні форми, що підходять для ін'єкцій, включають стерильні водні розчини або дисперсії й стерильні порошки для екстемпоральних препаратів стерильних ін'єкційних розчинів або дисперсій. У всіх випадках, форма повинна бути стерильною й повинна бути рідкою настільки, щоб її легко можна було вводити за допомогою шприца. Вона повинна бути 9 UA 107183 C2 5 10 15 20 25 30 35 стабільною в умовах виготовлення й зберігання й повинна бути захищена від забруднюючого дії мікроорганізмів, таких як бактерії й гриби. Носій може переставляти собою розчинник або дисперсійне середовище, що містить, наприклад, воду, етанол, поліол (наприклад, гліцерин, пропіленгліколь і рідкий поліетиленгліколь), їх підходящі суміші, і рослинні олії. Будь-який підходящий шлях введення може застосовуватися для забезпечення ссавця, особливо людини, ефективною дозою сполуки згідно із даним винаходом. Наприклад, можна застосовувати пероральний, ректальний, місцевий, парентеральний, очний, легеневий, назальний і інші шляхи. Дозовані форми включають таблетки, коржі, дисперсії, суспензії, розчини, капсули, креми, мазі, аерозолі й інші. Переважно сполуки згідно із даним винаходом вводять перорально. Ефективне дозування застосовуваного активного компонента може змінюватися залежно від конкретної застосовуваної сполуки, способу введення, стану, що піддається лікуванню, і ваги стану, що піддається лікуванню. Такі дозування легко можуть бути встановлені фахівцем у даній галузі техніки. При лікуванні або запобіганні злоякісного новоутворення, запалення або інших проліферативних захворювань, для яких показані сполуки згідно із даним винаходом, звичайно задовільні результати одержують, якщо сполуки відповідно до даного винаходу вводять у добовій дозі від приблизно 0,01 міліграма до приблизно 100 міліграм на кілограм ваги тіла тварини, переважно презентовано у вигляді одиничної добової дози. Для найбільш великих ссавців, загальна добова доза становить від приблизно 0,1 міліграма до приблизно 1000 міліграм, переважно від приблизно 0,2 міліграм до приблизно 50 міліграм. Для дорослої людини вагою 70 кг, загальна добова доза звичайно буде становити від приблизно 0,2 міліграм до приблизно 200 міліграм. Ця схема дозування може регулюватися для забезпечення оптимальної терапевтичної відповіді. Винахід також стосується комплекту (набору), що складається з окремих пакетів а) ефективної кількості сполуки відповідно до винаходу або її фізіологічно прийнятної солі, сольвату або проліків, і б) ефективної кількості додаткового активного компонента лікарського засобу. Комплект включає підходящі контейнери, такі як коробки, окремі пляшки, пакети або ампули. Комплект може містити, наприклад, окремі ампули, кожна з яких містить ефективну кількість сполуки відповідно до винаходу й/або її фармацевтично придатних похідних, сольватів і стереоізомерів, включаючи їх суміші у всіх співвідношеннях, і ефективної кількості додаткового активного компонента лікарського засобу в розчиненій або ліофілізованій формі. Деякі скорочення, які можуть використовуватися в даній заявці, мають наступні значення: Скорочення Позначення Ac ACN b BSA CDI d DBU ДХМ dd DIPEA DMEM ДМФА ДМСО DTT EDCI EDTA Et год. Hobt ВЕРХ IPA РХ/MС Ацетил ацетонітрил Широкий пік Бичачий сироватковий альбумін N, N-Карбонілдіімідазол Дублет 1,8-діазабіцикло[5,4,0]ундец-7-ен Дихлорметан Дублет дублетів N-Етилдіізопропіламін Середовище Ігла, модифіковане за способом Дульбеко N, N-Диметилформамід диметилсульфоксид дитіотреїтол 1-(3-Диметиламінопропіл)-3-етилкарбодіімід гідрохлорид Етилендіамінтетраоцтова кислота етил година 1-гідроксибензотриазол Високоефективна рідинна хроматографія Ізопропіловий спирт Рідинна хроматографія, зв'язана з мас-спектрометрією 10 UA 107183 C2 Lihmds m M mcpba Me хв МС m/z н. NMO ЯМР PG Pybop RPMI q Rf Rt s Трет ТФО THAB ТГФ ТШХ TRIS Tsoh УФ Вид. 5 10 15 20 25 30 Літій гексаметилдисилазид мультиплет Молекулярний іон 3-Хлорпероксибензойна кислота метил хвилина Мас-спектрометрія Відношення маси до заряду нормальність (одиниця концентрації) 4-метилморфолін N-оксид Ядерний магнітний резонанс Захисна група Гексафторфосфат бензотриазол-1-іл-окси-триспіролідинoфосфонію Середовище із серії Інституту Розуела Парка Квартетний (або квартет) Фактор утримання Час утримання Синглет Третинний Трифтороцтова кислота Бромід тетрагексиламонію Тетрагідрофуран Тонкошарова хроматографія трис(гідроксиметил)амінометан п-толуолсульфонова кислота ультрафіолет видимий Сполуки відповідно до даного винаходу можуть бути приготовлені відповідно до процедур з наступних схем і прикладів, використовуючи підходящі матеріали, і додатково ілюструються наступними специфічними прикладами. Крім того, при використанні процедур, описаних у даній заявці, у комбінації з типовими знаннями для кваліфікованого фахівця в даній галузі техніки, легко можуть бути приготовлені додаткові сполуки згідно із даним винаходом, заявлені в даній заявці. Проте, сполуки, ілюстровані в прикладах, не повинні розглядатися як такі, що становлять лише клас, охоплюваним винаходом. Приклади додатково ілюструють деталі приготування сполук згідно із даним винаходом. Для кваліфікованих фахівців у даній галузі техніки буде очевидним, що для приготування цих сполук можна використовувати відомі модифікації умов і процесів наступних препаративних процедур. Сполуки, описані в даній заявці, звичайно виділяють у вигляді їх фармацевтично прийнятних солей, таких як солі, описані вище. Основи з вільним аміном, що відповідають виділеним солям, можуть бути отримані шляхом нейтралізації з підходящою основою, такою як водний гідрокарбонат натрію, карбонат натрію, гідроксид натрію й гідроксид калію, і екстрагування виділеної у вільному стані основи з вільним аміном в органічному розчиннику, з наступним упарюванням. Основа з вільним аміном, виділена таким чином, надалі може бути перетворена в іншу фармацевтично прийнятну сіль шляхом розчинення в органічному розчиннику, з наступним додаванням підходящої кислоти й наступного упарювання, осадження або кристалізації. Ілюстрації приготування сполук згідно із даним винаходом представлені на наступних схемах. Якщо на схемах спеціально не вказано інакше, то змінні мають значення, аналогічні до вказаних вище. Даний винахід також стосується способів приготування сполуки формул (I), (II), підформула IA – IH, а також сполук, представлених у таблиці 1, відповідно до нижчеописаних схем і прикладів обробки. Схема 1 Схема 1 ілюструє загальний шлях синтезу, який використовується для синтезу всіх Прикладів 2.1 – 2.20 згідно з формулою (I). Першим етапом є реакція конденсації між заміщеним аніліном (11) і 3-фтор-ізонікотиновою кислотою, або її похідним (12), одержуючи відповідні проміжні кислоти (13). Проміжні кислоти, у свою чергу, піддають реакції з підходящими амінами або спиртами, одержуючи аміди або складні ефіри (14) відповідно. У тих випадках, коли 11 UA 107183 C2 присутня захисна група, (наприклад, ацетонідна група, або інша), включають підходящу стадію зняття захисту на завершальній стадії, одержуючи сполуки (15). 5 10 15 20 25 Схема 2 Схема 2 ілюструє синтез переважної аміндіольної проміжної сполуки, або її діол-захищеного аналога. Синтез починають, виходячи з рацемічного циклогекс-2-енолу (16) спочатку з ацетилуванням. Потім ацетильну групу (17) заміщають стереоспецифічним чином у каталізованій паладієм реакції із фталімідом калію в присутності ліганду Trost (як описано Trost та ін… в J. Am. Chem. Soc. 1994, 116, 4089-4090), одержуючи сполуку (18). Після цього подвійний зв'язок син-дигідроксилували шляхом обробки з тетроксидом осмію, одержуючи діол (19), потім або шляхом безпосереднього видалення фталімідо групи (одержуючи амін 27), або спочатку шляхом захисту діолу у вигляді ацетоніду (20) і потім видалення фталімідо групи, одержуючи амін (21). Схема 3 На Схемі 3 ілюструється синтез рацемічних амінодіолів. Як описано в (1) Nishikawa, N; Asai, M; Ohyabu, N; Isobe, M. J. Org. Chem. 1988, 188-192. і (2) Donohoe, J. T.; Blades, K; Moore, P. R.; Waring, M. J.; Winter, J. J. G.; Helliwell, M.; Newcombe, N. J.; Stemp, G. J. Org. Chem. 2002, 79467956, синтез починали з перегрупування Overman рацемічного циклогекс-2-енoлу (16) (за допомогою трихлорацетімідатного проміжного продукту), одержуючи трихлорацетамід (22), який потім син-дигідроксилували шляхом обробки з тетроксидом осмію, одержуючи діоли 23-26. 12 UA 107183 C2 Отриману діастереомерну суміш чотирьох амінодіолів (23-26) розділяють за допомогою ахіральної хроматографії на дві рацемічні пари (23/24 і 25/26), з яких потім можна зняти захист, одержуючи відповідні рацемічні амінодіоли (27/28 і 29/30). 5 10 15 20 25 30 35 Приклади Приклади, представлені нижче, призначені для ілюстрації переважних варіантів здійснення винаходу, і жодним чином не призначені для обмеження обсягу опису або формули винаходу. 1 Аналізи Аналітичну РХ/MС здійснювали, використовуючи два наступні методи: 18 Метод A: Discovery C , 5 мкм, 3×30 мм колонку використовували при швидкості потоку 400 мкл/хв., пробовідбірна петля 5 мкл, рухома фаза: (A) вода з 0,1 % мурашиною кислотою, рухома фаза, (B) метанол з 0,1 % мурашиною кислотою; час утримання представлений у хвилинах. Подробиці методу: (I) проганяли на Quaternary Pump G1311A (Agilent) з УФ/Вид. детектором на діодній матриці G1315B (Agilent) і Finnigan LCQ Duo МS детектором в ESI + режимі з Уфвизначенням при 254 і 280 нм із градієнтом 15-95 % (B) в 3,2 хв. лінійному градієнті (II), витримуючи протягом 1,4 хв. при 95 % (B) (III), знижуючи від 95-15 % (B) в 0,1 хв. лінійному градієнті (IV), витримуючи протягом 2,3 хв. при 15 % (B). 18 Метод B: Waters Symmetry C , 3,5 мкм, 4,6×75 мм колонка при швидкості потоку 1 мл/хв., пробовідбірна петля 10 мкл, рухома фаза (A) представляє собою воду з 0,05 % ТФО, рухома фаза (B) представляє собою ACN з 0,05 % ТФО; час утримання представлений у хвилинах. Подробиці методів: (I) проганяли на Binary Pump G1312A (Agilent) з УФ/Вид. детектором на діодній матриці G1315B (Agilent) і Agilent G1956B (SL) МS детектором в ESI + режимі з Уфвизначенням при 254 і 280 нм із градієнтом 20-85 % (B) в 10 хв. лінійному градієнті (II), витримуючи протягом 1 хв. при 85 % (B) (III), знижуючи від 20-85 % (B) в 0,2 хв. лінійному градієнті (IV), витримуючи протягом 3,8 хв. при 20 % (B). Аналітична хіральна ВЕРХ Аналітичну хіральну ВЕРХ здійснювали, використовуючи колонку Chiralpak AD-H (250×4,6 мм) від Daicel Chemical Industries, Ltd. на системі Agilent 1100 Series. У методі використовували об'єм, що вводиться, 5,0 мкл, зі швидкістю потоку 1 мл/хв. 100 % метанолу протягом 15 хв. при 25 °C, і Уф-виявленні при 254 і 280 нм. Препаративна ВЕРХ Препаративну ВЕРХ здійснювали, використовуючи або колонку Waters Atlantis dc 18 OBD ™ 10 мкM (30×250 мм) або колонку Waters Sunfire Prep C18 OBD 10 мкM (30×250 мм). Колонки 13 UA 107183 C2 5 використовували при швидкості потоку 60 мл/хв. на Waters Prep LC 4000 System, обладнаній пробовідбірною петлею (10 мл) і ISCO UA-6 УФ/Вид. детектором. Рухома фаза надходила із двох резервуарів розчинників, що містять (A) воду й (B) ацетонітрил ВЕРХ-ступеню. При звичайному препаративному прогоні використовували лінійний градієнт (наприклад, 0-60 % розчинника B протягом 60 хвилин). 2 Хімічний синтез 2.1 Циклогекс-2-еніл ацетат (17) OAc 10 15 До розчину 2-циклогексен-1-олу (16) (45,5 ммоль, 5,02 мл) у піридині (0,27 моль, 22 мл) при 0 °C, додавали по краплях оцтовий ангідрид і реакційну суміш перемішували при 0 °C протягом півгодини. Льодяну баню видаляли, і суміш перемішували при кімнатній температурі протягом ночі. Суміш розводили за допомогою EtОАс, промивали HСl (1 н.), насиченим NaНСО 3, сольовим розчином, і концентрували у вакуумі, одержуючи 6 г (94 %) неочищеного продукту 17, який використовували на наступній стадії без додаткового очищення. ТШХ із 20 % EtОАс/Гексан, утворення плям з 5 % H2SO4/EtОН, Rf для (16): 0,4, Rf для (17): 0,8. 2.2 2-[(1R)-циклогекс-2-ен-1-іл]-1H-ізоіндол-1,3(2H)-діон (18) O N O 20 25 30 До суміші фталіміду калію (160 ммоль, 29,6 г), N,N'-(1S,2S)-циклогексан-1,2-діїлбіс[2(дифенілфосфіно)бензаміду] (ліганд Trost) (6 ммоль, 4,14 г), [Pd(п-аліл)Cl]2 (2 ммоль, 0,73 г) і броміду тетрагексиламонію (216 ммоль, 94 г) у безводному ДХМ (40 мл) в атмосфері N 2, додавали 2-циклогексен-1-іл ацетат (17) (13 г неочищеного) в 40 мл безводного ДХМ. Суміш перемішували при температурі навколишнього середовища протягом ночі. Після цього реакцію загартовували водою (250 мл) і екстрагували за допомогою ДХМ (3×250 мл). Органічні компоненти об'єднували й промивали сольовим розчином (400 мл), висушували над Na 2SO4 і концентрували, одержуючи неочищений продукт у вигляді жовтого масла. При перекристалізації з MeОН одержували 9,024 г продукту (чистота: 100 % за допомогою ВЕРХ, вихід 50 %). Маточну рідину очищали шляхом флеш-хроматографії (10 % EtОАс/Гексани), одержуючи 8,8 г 18 (чистота 86 % за допомогою ВЕРХ, вихід 48 %). ЯМР і МС дані відповідають публікації: Trost, B. M.; Bunt, R. C. J. Am. Chem. Soc. 1994, 4089-4090. 2.3 2-[(1R, 2S, 3R)-2,3-дигідроксициклогексил]-1H-ізоіндол-1,3(2H)-діон (19) 35 O N O OH OH 40 До суспензії 2-[(1R)-циклогекс-2-ен-1-іл]-1H-ізоіндол-1,3(2H)-діону (18) (19,9 ммоль, 4,53 г) і 4-метилморфолін-N-оксиду (60 ммоль, 7,01 г) в ацетоні/воді (4:1, 62,5 мл), додавали тетроксиду осмію (0,2 ммоль, 50 мг). Реакцію перемішували протягом 4 годин. Суміш концентрували й додавали насичений сульфіт натрію (40 мл). Потім його відразу екстрагували за допомогою EtОАс три рази. Об'єднані органічні шари промивали водою й сольовим розчином, висушували над MgSO4 і концентрували, одержуючи неочищений продукт у вигляді білої твердої речовини (4,94 г, вихід 95 %). Хіральна ВЕРХ [8,53 хв.]. Аналітичні дані відповідають опублікованим даним 14 UA 107183 C2 (Donohoe, J. T.;та ін., J. Org. Chem., 2002, 67, 7946-7956). 2.4 2-[(3aS, 4R, 7aR)-2,2-диметилгексагідро-1,3-бензодіоксол-4-іл]-1H-ізоіндол-1,3(2H)-діон (20) O O N O O 5 10 15 До розчину 2-[(1R, 2S, 3R)-2,3-дигідроксициклогексил]-1H-ізоіндол-1,3(2H)-діону (19) (50,0 г, 191,4 ммоль) і 2, 2-метоксипропану (500 мл, 4,07 моль) в ацетоні (500 мл), додавали каталітичну кількість п-толуолсульфонової кислоти й отриману реакційну суміш перемішували при кімнатній температурі протягом 3 годин. Реакцію загартовували за допомогою насиченого розчину Na2CO3 для доведення pН до 10 і розчинник видаляли. До залишку додавали воду (750 мл) і екстрагували за допомогою етилацетату (2×750, 500 мл). Органічні компоненти об'єднували, висушували над Na2SO4 і концентрували, одержуючи бажаний продукт у вигляді білої твердої речовини (55,8 г, 96,8 % вихід). РХ/MС [Метод B: rt: 6,16 хв.; m/z: 302 (M+1)]. 2.5 (3aS, 4R, 7aR)-2,2-диметилгексагідро-1,3-бензодіоксол-4-амін (21) NH2 O O 20 25 30 Суміш 2-[(3aS, 4R, 7aR)-2,2-диметилгексагідро-1,3-бензодіоксол-4-іл]-1H-ізоіндол-1,3(2H)діону (20) (191,4 ммоль, 50,00 г), гідразину (308,4 ммоль, 15,0 мл) в етанолі (500 мл) нагрівали в колбі зі зворотним холодильником протягом 4 годин. За здійсненням реакції спостерігали за допомогою ВЕРХ. ВЕРХ аналіз вказував на те, що реакція не завершилася (86 % перетворення). До реакційної суміші додатково додавали 3 мл гідразину й нагрівали в колбі зі зворотним холодильником протягом 2 годин. Реакцію охолоджували до 0 °C і фільтрували. Осад на фільтрі промивали IPA і висушували, одержуючи бажаний продукт 21 (9,52 г, вихід 21 %, вагова чистота: 84 % на основі ЯМР). Фільтрат концентрували й залишок ресуспендували в IPA (близько 200 мл). Побічний продукт кристалізували й відфільтровували, і з фільтрату видаляли леткі компоненти й висушували, одержуючи другу партію бажаного продукту 21(28,46 г, 64 % вихід). ТШХ (80 % MeОН/EtОАс з 1 краплею оцтової кислоти, плями утворювалися шляхом занурення в нінгідрин). 2.6 3-[(2-фтор-4-йодфеніл)аміно]ізонікотинова кислота F H N I 35 40 45 OH O N Суміш 2-фтор-4-йод-феніламіну (20,0 г, 84,38 ммоль) у безводному тетрагідрофурані (80 мл) охолоджували до – 65 °C в інертній атмосфері, потім повільно додавали 1,0 M біс(триметилсиліл)амід літію (255 мл, 255 ммоль) з такою швидкістю, щоб внутрішню температуру підтримувати нижче – 55 °C. Після завершення додавання, густу суспензію перемішували протягом 30 хвилин і потім обробляли за допомогою 3-фтор-ізонікотинової кислоти (8,0 г, 56,69 ммоль). Суміш перемішували при кімнатній температурі протягом 4 днів і після цього вливали у водний 2,0 н. гідроксид натрію (1000 мл) і етилацетату (250 мл). Шари розділяли й органічні компоненти знову екстрагували за допомогою водного гідроксиду натрію (2×1000 мл). pН об'єднаних водних фракцій доводили до 2 за допомогою концентрованої соляної кислоти, що викликало осадження твердої речовини. Матеріал фільтрували, промивали водою (300 мл) і висушували у високому вакуумі при 40 °C протягом 18 годин, одержуючи продукт (19,05 г, 53,19 ммоль, 94 %) у вигляді жовтої твердої речовини. 15 UA 107183 C2 2.7 N-[(3aS, 4R, 7aR)-2,2-диметилгексагідро-1,3-бензодіоксол-4-іл]-3-[(2-фтор-4-йодфеніл) аміно]ізоікотинамід (31) O O N O F N N I 5 10 15 Суспензію 3-[(2-фтор-4-йодфеніл) аміно] ізонікотинової кислоти (10,46 г, 29,2 ммоль), (3aS, 4R, 7aR)-2,2-диметилгексагідро-1,3-бензодіоксол-4-аміну (21) (5,00 г, 29,2 ммоль), 1гідроксибензотриазолу (4,41 г, 29,2 ммоль) і EDCI (5,6 г, 29,2 ммоль) у ДМФА (100 мл) перемішували при кімнатній температурі протягом ночі. Реакцію загартовували за допомогою води (150 мл) і екстрагували за допомогою етилацетату (150 мл). Утворювалася емульсія і її збирали, фільтрували й фільтрат об'єднували з органічним шаром. Органічний шар промивали насиченим розчином NaНСО3 (150 мл) і водою (2×150 мл), сольовим розчином і висушували над Na2SO4 і концентрували, одержуючи коричневу піну. Неочищену речовину очищали шляхом кристалізації з IPA. Маточну рідину концентрували й очищали шляхом флеш-хроматографії, одержуючи бажаний продукт (12 г. вихід 80 %). РХ/MС [Метод A: rt: 7,35 хв.; m/z: 512 (M+1)]. 2.8 (N-[(1R, 2S, 3R)-2,3-дигідроксициклогексил]-3-[(2-фтор-4-йодфеніл)аміно]ізонікотинамід) (8) HO F OH H N O H N I N 20 25 30 17,62 мл 2 M HСl у простому діетиловому ефірі додавали до коричневого розчину N-[(3aR, 4S, 7aS)-2,2-диметилгексагідро-1,3-бензодіоксол-4-іл]-3-[(2-фтор-4йодфеніл)аміно]ізонікотинаміду (31) (6,65 ммоль, 3,15 г) в MeОН (64 мл) і отриману реакційну суміш перемішували при кімнатній температурі протягом 5 годин. Реакційну суміш концентрували до приблизно 30 мл і утворювалася жовта тверда речовина, фільтрували, одержуючи продукт у вигляді гідрохлоридної солі. До солі додавали 10 мл MeОН і додавали гідроксид амонію до одержання pН 10. Утворювалася біла тверда речовина й тверду речовину (1,83 г, вихід 58 %) збирали шляхом фільтрації й промивали водою. Фільтрат концентрували й одержували другу партію у вигляді білої твердої речовини (0,56 г, вихід 18 %). РХ/MС [Метод B: rt: 5,83 хв.; m/z: 472 (M+1)]. Хіральна ВЕРХ [7,06 хв.]. 2.9 2,2,2-Трихлор-N-циклогекс-2-ен-1-ілацетамід (22) O Cl HN Cl Cl 35 40 До розчину 2-цилогексен-1-олу (16) (18 г, 0,183 моль) у безводному дихлорметані (275 мл) додавали DBU (41,88 г, 0,275 моль) і суміш охолоджували до -20 °C. До цього розчину, додавали по краплях трихлорацетонітрил (47,66 г, 0,330 моль). Реакцію перемішували протягом 3 годин при -20 °C і загартовували за допомогою водного розчину хлориду амонію. Органічну фазу відокремлювали й висушували над карбонатом калію. Розчинник видаляли у вакуумі, одержуючи проміжний циклогекс-2-ен-1-іл 2,2,2-трихлоретанімідоат. Його розчиняли в толуолі (100 мл) і обробляли карбонатом калію (30 г). Суміш нагрівали в колбі зі зворотним холодильником протягом 12 годин. Після охолодження суміш фільтрували через целіт і фільтрат упарювали, одержуючи 9 г (20 %) (22) у вигляді твердої речовини. РХ/MС: Виявлена 16 UA 107183 C2 5 маса (m/z, МС, 242,9) Метод: A-0,1 % HCOOH, B-ACN (70 %), Потік - 0,8 мл/хв. Колонка: 1 GENESIS C18 50×4,6 мм 3U, Rt (хв.): 1,645: H ЯМР (CdСl3, 400 MГц) δ 1,64-1,74 (3H, m), 1,962,12 (3H, m), 4,46-4,47 (1H, m), 5,64-5,67 (1H, m), 5,97-5,6,01 (1H, m), 6,59 (1H, bs). 2.10 2,2,2-трихлор-N-[(1RS, 2SR, 3RS)-2,3-дигідроксициклогексил]ацетамід (рацемічна суміш 23 і 24) NHCOCCl3 NHCOCCl3 OH OH OH OH + 10 15 20 До розчину 2,2,2-трихлор-N-циклогекс-2-ен-1-ілацетаміду (22) (4,5 г, 0,0182 моль) і N-метил морфолін –N-оксиду (7,5 г, 0,055 моль) в ацетоні (100 мл) додавали воду (25 мл), потім додавали каталітичну кількість тетроксиду осмію (0,1 г, тверда речовина). Реакційну суміш перемішували при кімнатній температурі протягом 14 годин і загартовували за допомогою насиченого розчину сульфіту натрію (20 мл). Суміш додатково перемішували протягом 20 хв. і потім розчинник видаляли у вакуумі й залишок очищали шляхом хроматографії, використовуючи петролейний ефір /етилацетат (3/7) як елюент, одержуючи 3,3 г (60 %) рацемічного діолу у вигляді твердої речовини. РХ/MС: Виявлена маса (m/z, -МС, 275,8), Метод: A-0,1 % HCOOH, B-ACN (70 %), Потік - 0,8 мл/хв.; Колонка: GENESIS C18 50×4,6 мм 3U; Rt (хв.): 1 0,695: H ЯМР (CdСl3, 400 МГц) δ 1,31-1,70 (6H, m), 3,87-3,92 (2H, m), 4,00-4,10 (1H, m), 7,68 (1H, bs). 2.11 (1RS, 2SR, 3RS)-3-аміноциклогексан-1,2-діол.HСl (рацемічна суміш 27 і 28) NH2 NH2 OH OH + OH 25 30 Суміш 2,2,2-трихлор-N-[(1RS, 2SR, 3RS)-2,3-дигідроксициклогексил]ацетаміду (23 & 24) (2,3 г) і 5M водної HСl (30 мл) нагрівали в колбі зі зворотним холодильником протягом 10 годин і упарювали при зниженому тиску, одержуючи 1,2 г (86 %) вказаної в заголовку сполуки у вигляді в'язкої рідини. МС: Маса (m/z, МС, 131,9), ВЕРХ > 98 % Метод: A-Вода, B-ACN: Потік - 0,8 мл/хв. 1 Колонка: C18 XDB, 250×4,6 мм, SC\276. Rt (хв.), 2,715: H ЯМР (CD3OD 400 МГц) δ 1,43-1,91 (6H, m), 2,98-3,02 (1H, m), 3,31-3,42 (1H, m), 3,84 (1H, m). 2.12 N-[(1SR, 2RS, 3SR)-2,3-дигідроксициклогексил]-3-фтор-5-[(2-фтор-4-йодфеніл) ізонікотинамід (2) F I 35 40 45 OH O HO H N H N F N OH F + I O HO H N H N OH F N 3-Фтор-5-(2-фтор-4-йод-феніламіно)-ізонікотинову кислоту (119 мг, 0,32 ммоль) і 1,1'карбонілбіс(1H-імідазол) (67 мг, 0,41 ммоль) суспендували в ДМСО (2 мл). Суміші дозволяли перемішуватися протягом ночі (12 годин) при кімнатній температурі. Потім додавали 3аміноциклогексан-1,2-діол (рацемічний 27/28) (40 мг, 0,31 ммоль, ) і триетиламін (0,07 мл, 0,49 ммоль). Суміш перемішували додатково протягом 6 годин при кімнатній температурі. Після завершення реакції, реакційну суміш обробляли водним гідроксидом натрію (1 мл, 1,0 M) і перемішували при кт протягом 4 годин. Розчин нейтралізували до pН 7 за допомогою конц. HСl. Після цього суміш упарювали для видалення більшої кількості води. Отриману суміш очищали шляхом препаративної ВЕРХ, одержуючи продукт (2). РХ/MС [Метод A: rt: 4,89 хв.; m/z: 490 (M+1)]. 2.13 N-[(1SR, 2RS, 3SR)-2,3-дигідроксициклогексил]-3-[(2-фтор-4-йодфеніл)аміно] ізонікотинамід (3) 17 UA 107183 C2 HO H N O F 5 10 OH H N I N N 3-(2-Фтор-4-йод-феніламіно)-ізонікотинову кислоту (300 мг, 0,84 ммоль.) і 1,1'карбонілбіс(1H-імідазол) (177 мг, 1,1 ммоль) суспендували в ДМСО (4 мл). Суміші дозволяли перемішуватися протягом ночі (12 годин) при кімнатній температурі. Після цього додавали 3аміноциклогексан-1,2-діол (рацемічний 27/28) (110 мг, 0,84 ммоль,). Суміш перемішували додатково протягом 12 годин при кімнатній температурі. Суміш розділяли шляхом препаративної ВЕРХ, одержуючи два продукти, рацемічний амід (3) і рацемічні складні ефіри (4). РХ/MС [Метод A: rt: 6,01 хв.; m/z: 472 (M+1)]. Хіральна ВЕРХ [7,10 хв., 13,12 хв.]. 2.14 (1RS, 2SR, 3RS)-3-Аміно-2-гідрокси-циклогексиловий ефір 3-фтор-5-(2-фтор-4-йодфеніламіно)-ізонікотинової кислоти (4) HO H N F I HO NH2 O O F 15 O F + H N I HO H N OH F + N O O H N I NH2 F N Див., будь ласка, Приклад 2.13. РХ/MС [Метод A: rt: 4,53 хв.; m/z: 472 (M+1)]. 2.15 2-Хлор-N-((1RS, 2SR, 3RS)-2,3-дигідрокси-циклогексил)-5-(2-фтор-4-йод-феніламіно)зонікотинамід (1) F OH H N O OH H N + O OH H N N I Cl N I F OH H N Cl 20 25 2-Хлор-5-(2-фтор-4-йод-феніламіно)-ізонікотинову кислоту (75 мг, 0,19 ммоль.) і 1,1'карбонілбіс(1H-імідазол) (40 мг, 0,25 ммоль) суспендували в ДМСО (2,5 мл). Суміші дозволяли перемішуватися протягом ночі (12 годин) при кімнатній температурі. Після цього додавали 3аміноциклогексан-1,2-діол (рацемічний 27/28) (32 мг, 0,19 ммоль, ) і триетиламін (0,05 мл, 0,38 ммоль). Суміш перемішували протягом ночі при кімнатній температурі. Суміш очищали шляхом препаративної ВЕРХ, одержуючи продукт РХ/MС [Метод B: rt: 5,359 хв.; m/z: 506 (M+1)]. 2.16 3-(4-Бром-2-фтор-феніламіно)-N-((1RS, 2SR, 3RS)-2,3-дигідрокси-циклогексил)ізонікотинамід (5) F 30 35 Br O HO H N H N OH F + N Br O HO H N OH H N N Отриманий відповідно загальної методики для (1), РХ/MС [Метод B: rt: 5,602 хв.; m/z: 425 (M+1)]. 2.17 3-(4-Бром-2-хлор-феніламіно)-N-((1RS, 2SR, 3RS)-2,3-дигідрокси-циклогексил)ізонікотинамід (6) 18 UA 107183 C2 Cl Br 5 HO H N O OH H N Cl + O OH H N Br N HO H N N Отриманий відповідно загальної методики для (1), РХ/MС [Метод B: rt: 6,163 хв.; m/z: 441 (M+1)]. 2.18 N-((1R, 2S, 3R)-2,3-Дигідрокси-циклогексил)-3-(2-фтор-феніламіно)-ізонікотинамід (10) F HO H N O OH H N N 10 15 У запечатану трубку завантажували (N-[(1R, 2S, 3R)-2,3-дигідроксициклогексил]-3-[(2-фтор4-йодфеніл)аміно]ізонікотинамід) (8) (42 мг, 0,09 ммоль), борогідрид натрію (34 мг, 0,89 ммоль), дихлорид паладію (7,9 мг, 0,04 ммоль), гідроксид натрію (17,8 мг, 0,45 ммоль), ТГФ-воду (1:1, 3 мл). Суміш перемішували при кімнатній температурі протягом 2 днів. Суміш фільтрували й фільтрат концентрували. Отриманий залишок піддавали флеш-хроматографії, одержуючи продукт. РХ/MС [Метод A: rt: 0,43 хв.; m/z: 346 (M+1)]. 2.19 3-(4-бром-2-фторфеніламіно)-N-((1R, 2S, 3R)-2,3-дигідроксициклогексил)ізонікотинамід (9) F Br 20 HO H N O OH H N N Отриманий відповідно загальної методики для (1) за винятком того, що замість рацемічної суміші діолів, використовували хірально чистий 3-аміноциклогексан-1,2-діол (27). РХ/MС [Метод B: rt: 5,19 хв.; m/z: 426,1 (M+1)]. 2.20 N-((1S, 2R, 3S)-2,3-дигідроксициклогексил)-3-(2-фтор-4-йодфеніламіно)ізонікотинамід (7) 25 30 35 Отриманий відповідно загальної методики для (1) за винятком того, що замість рацемічної суміші діолів, використовували хірально чистий 3-аміноциклогексан-1,2-діол (28). РХ/MС [Метод A: rt: 4,54 хв.; m/z: 472,3 (M+1)]. 3. Біологічна активність 3.1 Дослідження ферменту MEK-1 (LANCE-HTRF) Активність сполук відповідно до даного винаходу можна визначити за допомогою наступної процедури: за інгібуванням активності MEK1 кінази людини спостерігали за допомогою гомогенного аналізу на основі флуоресценції. В аналізі використовували резонансний перенос енергії флуоресценції з розділенням у часі до проби для фосфорування ERK1 за допомогою MEK1. Аналіз здійснювали в низькооб'ємних мікротитрувальних планшетах на 96 лунок. У 19 UA 107183 C2 5 10 15 20 загальному об'ємі 15 мкл, сполуки інкубували з 100 нM MEK1, 15 мкМ ATP, 300 нM ERK2, застосовуючи буфер, що містить 20 мМ TRIS/HСl, 10 мМ Mgcl2, 100 мкМ Navo4, 1 мМ DTT, і 0,005 % Твін 20 (pН 7,4). Через дві години, додавали 5 нМ европій-анти-py20 (Perkin Elmer) і 50 нМ анти-gst-алофікоціаніну (Cisbio) у буфері, що містить 50 мМ EDTA і 0,05 % BSA і реакцію інкубували протягом однієї години на темряві. Флуоресценцію з часовим розділенням вимірювали за допомогою Ljl-analyst (Molecular Devices) при довжині хвилі збудження 340 нм і довжині хвилі емісії 665 нм. Кінцева концентрація ДМСО становила 2 %. Для оцінки інгібуючого потенціалу сполук, визначали значення IC50, як показано в таблиці 1. 3.2 Дослідження проліферації пухлинних клітин (ATP Lite) Клітини C26 ободової кишки мишей, A375 меланоми людини й Miapaca-2 підшлункової залози людини поміщали в білі планшети Corning на 96 лунок (1500 клітин/лунку для C26, і 2000 клітин/лунку для A375, і Miapaca-2) і культивували протягом ночі при 37 °C в 5 % CO2. Інгібітори серійно розводили в 100 % ДМСО й після цього додавали до клітин для досягнення кінцевої концентрації 0,25 % ДМСО. Клітини інкубували протягом 4 днів у присутності тестованих сполук у середовищі для росту клітин (DMEM з 10 % фетальною бичачою сироваткою, 2 мМ глутаміном для C26, і Miapaca-2, і RPMI з 10 % фетальною бичачою сироваткою, 2 мМ глутаміном для A375). Кількісно визначали проліферацію клітин за допомогою набору для визначення проліферації клітин ATP lite (Packard). Інгібовані проліферації клітин презентовано в таблиці 1. У рядках 2-5 представлена концентрація сполук, необхідна для індукування загибелі 50 % клітин (IC50 у мкМ) клітин ендометрію людини. Таблиця 1 Сполука (1) (2) (3) (4) (5) (6) (7) (8) (9) (10) 25 30 35 40 MEK1 (IC50, мкМ) C26 (IC50, мкМ) 0,0345 0,002 0,074 0,005 0,0948 0,016 0,16 0,02 0,098 0,073 0,038 0,113 2,67 5,4 0,133 0,0047 не тестували не тестували 0,189 0,15 A375 (IC50, мкМ) MIAPACA (IC50, мкМ) 0,002 0,002 0,001 0,0045 0,0014 0,0073 0,0855 0,049 0,0075 0,0425 0,0168 0,0753 0,274 2,12 0,0016 0,0027 не тестували не тестували 0,0215 0,074 3.3 Дослідження ефективності in vivo (моделі ксенотрансплантатів у мишей) Самцям "голих" (nu/nu) мишей підшкірно ін'єкували вище правої передньої лапи певну кількість клітин пухлинних клітинних ліній людину, таких як Colo-205, A375 або Miapaca2. Пухлини вимірювали за допомогою штангенциркуля через один тиждень після імплантації клітин. Вимірювали довжину пухлини (д) і ширину (ш) і об'єм пухлини розраховували за 2 допомогою рівняння д*ш /2. Тварин розділяли на групи таким чином, щоб у кожній групі 3 середній об'єм пухлини становив 150-200 мм і починали обробки із застосуванням сполук (позначали як День 0). Для кожної тварини вимірювали об'єм пухлини й вагу тіла в Дні 0, 4, 6, 8, 10, 12 і 14. Об'єм пухлини й відсоток ваги тіла аналізували за допомогою подвійного дисперсійного аналізу повторних вимірювань (Two-way Repeated Measures Analysis of Variance (RM-ANOVA)) з наступним багаторазовим попарним порівнянням отриманих результатів згідно із Fisher для середніх значень лікованих груп. Сполуки в цьомуваріанті здійснення винаходу є ефективними на цих моделях пухлин і приводять до дозозалежного інгібування росту пухлини, включаючи регрес пухлини або пухлину. Наприклад, сполука (9) викликає інгібування росту пухлини на 98,5 % на моделі ксенотрансплантата Colo-205 при щоденному введенні в дозі 1,5 мг/кг при пероральному шляху введення. Сполука (8), на аналогічній моделі, викликає інгібування росту пухлини на 100,69 % (TGI) при введенні в дозі 50 мкг/кг* добу при пероральному шляху введення, і інгібування росту пухлини на 115,33 % при введенні в дозі 150 мкг/кг/добу. На моделі Miapaca2, сполука (8) забезпечує 100,97 % TGI при введенні в дозі 33 мкг/кг/добу, і 110,74 % TGI при введенні в дозі 50 мкг/кг/добу. 20 UA 107183 C2 ФОРМУЛА ВИНАХОДУ 1. Сполука формули (ІІ) HO O R1 H N R2 5 10 15 20 25 30 35 40 45 50 OH H N R3 N R4 ( II ) або її фармацевтично прийнятні солі або сольвати, де: 1 R являє собою водень, метил, етил, н-пропіл, iзопропіл, SH або Hal, 2 R являє собою водень, метокси, етокси, ацетилен, ціано, SH або Hal, 3 4 R і R незалежно вибирають із водню, SH або Hal, і Hal являє собою F, Сl, Вr або І. 2. Сполука відповідно до пункту 1, де радикали, не вказані докладно, мають значення, вказані для формули (ІІ) відповідно до пункту 1, але де у підформулі ІА 1 R являє собою Hal, метил або етил, 2 R являє собою водень, Hal, метокси або ацетилен, 3 R являє собою водень або Hal, 4 R являє собою водень або Hal, Hal являє собою F, Сl, Вr або І, у підформулі IB 1 R являє собою Hal, 2 R являє собою водень або Hal, 3 R являє собою водень або Hal, 4 R являє собою водень або Hal, Hal являє собою F, Сl, Вr або І, у підформулі IС 1 R являє собою F, Сl, метил або етил, 2 R являє собою водень, І, Вr, метокси або ацетилен, 3 R являє собою водень або Hal, 4 R являє собою водень або Hal, Hal являє собою F, Сl, Вr або І, у підформулі ID 1 R являє собою F, Сl, метил або етил, 2 R являє собою водень, І, Вr, метокси або ацетилен, 3 R являє собою водень або F, 4 R являє собою водень або Сl, у підформулі IE 1 R являє собою F або Сl, 2 R являє собою І або Вr, 3 R являє собою водень або F, 4 R являє собою водень або Сl, у підформулі IF 1 R являє собою F або Сl, 2 R являє собою І або Вr, 3 R являє собою водень або F, 4 R являє собою водень або Сl, у підформулі IG 1 R являє собою F або Сl, 2 R являє собою І або Вr, 3 R яляє собою водень, 4 R являє собою водень, і в підформулі ІН 21 UA 107183 C2 1 5 R являє собою F, 2 R являє собою І, 3 R являє собою водень або F, 4 R являє собою водень або Сl, або її фармацевтично прийнятні солі або сольвати. 3. Сполука відповідно до пункту 1, де сполуку вибирають із групи, яка включає: OH H N O F ( OH H N 1) N I OH H N O F ( OH H N 2) Br N OH ( 3) H N O F OH H N N 10 15 20 25 30 або її фармацевтично прийнятні солі або сольвати. 4. Сполука відповідно до будь-якого з пунктів 1-3, або її фармацевтично прийнятна сіль або сольват, для застосування як лікарського засобу. 5. Сполука відповідно до будь-якого з пунктів 1-3, або її фармацевтично прийнятна сіль або сольват, для лікування гіперпроліферативних захворювань, пов'язаних з гіперактивністю МЕК, а також захворювань, які модулюються МЕК-каскадом у ссавців. 6. Сполука за пунктом 5, або її фармацевтично прийнятна сіль або сольват, де захворювання вибирають із групи, яка включає злоякісні новоутворення, запалення, панкреатит або захворювання нирок, біль, доброякісну гіперплазію шкіри, рестеноз, захворювання передміхурової залози, захворювання, пов'язані з васкулогенезом або ангіогенезом, пухлинним ангіогенезом, захворювання шкіри, вибрані із псоріазу, екземи і склеродерми, діабет, діабетичну ретинопатію, ретинопатію недоношених, вікову дегенерацію жовтої плями, гемангіому, гліому, меланому й саркому Капоші. 7. Фармацевтична композиція, яка містить сполуку відповідно до будь-якого з пунктів 1-3, або її фармацевтично прийнятну сіль або сольват, як активний компонент, разом з фармацевтично прийнятним носієм. 8. Застосування сполуки відповідно до будь-якого з пунктів 1-3, або її фармацевтично прийнятної солі або сольвату, для приготування лікарського засобу для лікування гіперпроліферативних захворювань, пов'язаних з гіперактивністю МЕК, а також захворювань, які модулюються МЕК-каскадом у ссавців. 9. Застосування відповідно до пункту 8, де захворювання вибирають із групи, яка включає злоякісні новоутворення, запалення, панкреатит або захворювання нирок, біль, доброякісну гіперплазію шкіри, рестеноз, захворювання передміхурової залози, захворювання, пов'язані з васкулогенезом або ангіогенезом, пухлинним ангіогенезом, захворювання шкіри, вибрані із псоріазу, екземи і склеродерми, діабет, діабетичну ретинопатію, ретинопатію недоношених, вікову дегенерацію жовтої плями, гемангіому, гліому, меланому й саркому Капоші. 22 UA 107183 C2 5 10. Спосіб лікування гіперпроліферативних захворювань, пов'язаних з гіперактивністю МЕК, а також захворювань, які модулюються МЕК-каскадом у ссавців, за яким вводять суб'єкту сполуку відповідно до будь-якого з пунктів 1-3, або її фармацевтично прийнятну сіль або сольват. 11. Спосіб за пунктом 10, де захворювання вибирають із групи, яка включає злоякісні новоутворення, запалення, панкреатит або захворювання нирок, біль, доброякісну гіперплазію шкіри, рестеноз, захворювання передміхурової залози, захворювання, пов'язані з васкулогенезом або ангіогенезом, пухлинним ангіогенезом, захворювання шкіри, вибрані із псоріазу, екземи і склеродерми, діабет, діабетичну ретинопатію, ретинопатію недоношених, вікову дегенерацію жовтої плями, гемангіому, гліому, меланому й саркому Капоші. 10 Комп’ютерна верстка М. Шамоніна Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 23
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel phenylamino isonicotinamide compounds
Автори російськоюGoutopoulos, Andreas, Yu, Henry, Askew, Benny, C., Liu-Bujalski, Lesley
МПК / Мітки
МПК: C07D 213/81, C07D 213/79, A61P 29/00, A61P 35/00, A61K 31/44
Мітки: лікування, фармацевтична, сполуки, застосування, захворювань, гіперпроліферативних, містить, феніламіно-ізонікотинамідні, композиція, спосіб
Код посилання
<a href="https://ua.patents.su/25-107183-fenilamino-izonikotinamidni-spoluki-kh-zastosuvannya-farmacevtichna-kompoziciya-shho-kh-mistit-ta-sposib-likuvannya-giperproliferativnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Феніламіно-ізонікотинамідні сполуки, їх застосування, фармацевтична композиція, що їх містить, та спосіб лікування гіперпроліферативних захворювань</a>
Попередній патент: Лікування діабету у пацієнтів, для яких лікування метформіном є неприйнятним
Наступний патент: Спосіб вибіркової боротьби з бур’янистими рослинами
Випадковий патент: Вантажопідйомний прямокутний електромагніт