Спосіб одержання продукту на основі глатирамеру ацетату
Номер патенту: 116060
Опубліковано: 25.01.2018
Автори: Сафаді Мухаммад, Хаббах Сассон, Кохен Ракефет
Формула / Реферат
1. Спосіб одержання фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності, що включає етапи
(i) одержання водного фармацевтичного розчину глатирамеру ацетату і маніту;
(ii) фільтрування водного фармацевтичного розчину за температури від вище 0 °C до 17,5 °C з одержанням фільтрату і
(iii) заповнення придатної ємності фільтратом, одержаним після виконання етапу (ii), з одержанням таким чином фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності.
2. Спосіб за п. 1, де етап (ii) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр або перший фільтр і другий фільтр.
3. Спосіб за п. 2, який додатково включає етап зниження температури другого фільтра до температури від вище 0 °C до 17,5 °C.
4. Спосіб за п. 2 або п. 3, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C перед пропусканням через другий фільтр.
5. Спосіб за будь-яким із пп. 2-4, де етап (ii) фільтрування додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар.
6. Спосіб за п. 5, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C після того, як він вийшов з приймального резервуара, і перед тим, як увійшов до другого фільтра.
7. Спосіб за п. 5 або п. 6, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C під час знаходження у приймальному резервуарі.
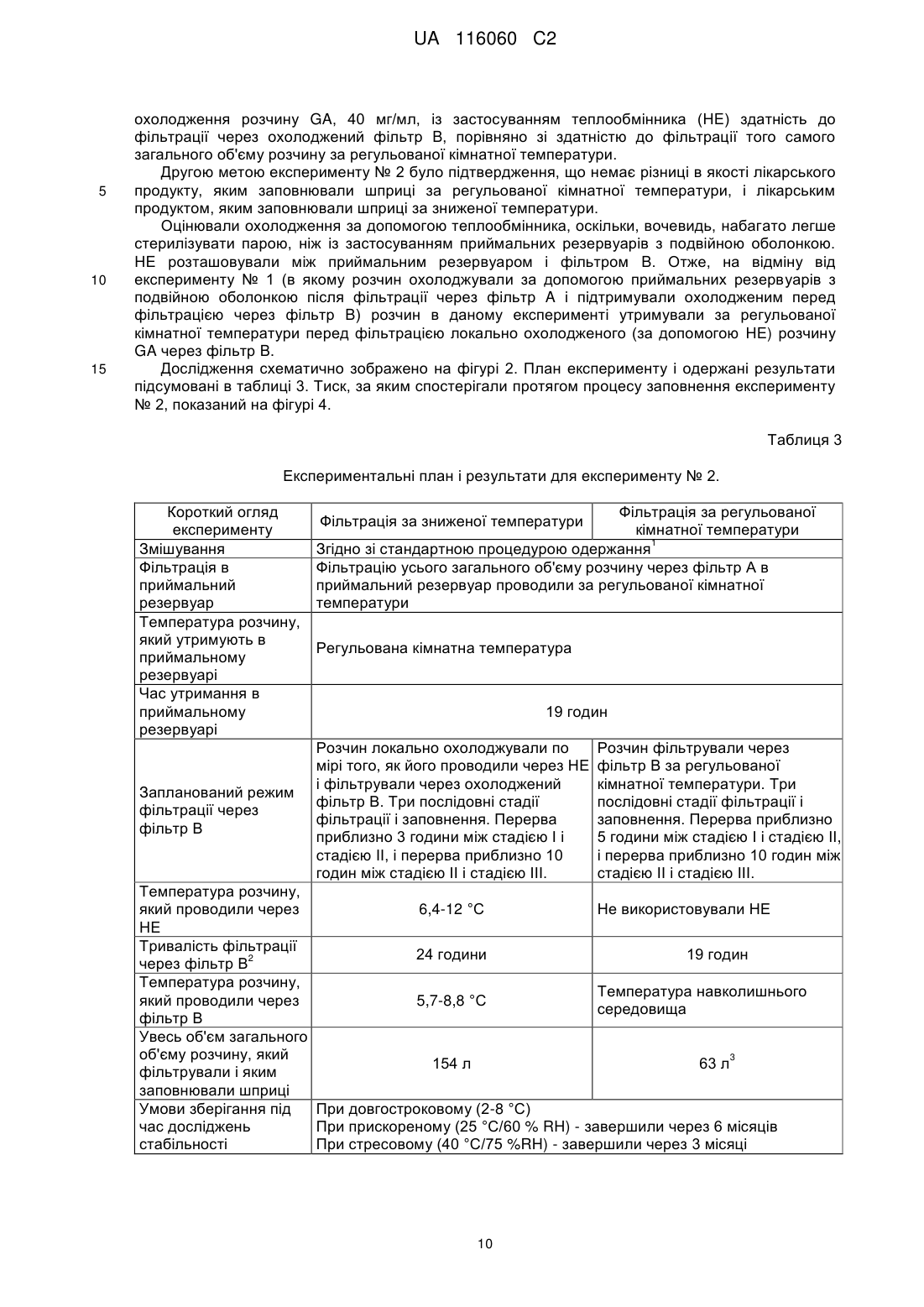
8. Спосіб за будь-яким із пп. 2-7, який додатково включає етап зниження температури першого фільтра до температури від вище 0 °C до 17,5 °C.
9. Спосіб за будь-яким із пп. 2-8, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C перед пропусканням через перший фільтр.
10. Спосіб за будь-яким із пп. 2-9, де етап (i) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування.
11. Спосіб за п. 10, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C після того, як він вийшов з резервуара для змішування, і перед тим, як увійшов до першого фільтра.
12. Спосіб за п. 10 або п. 11, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C під час знаходження в резервуарі для змішування.
13. Спосіб за будь-яким із пп. 2-14, де водний фармацевтичний розчин пропускають через другий фільтр зі швидкістю 3-25 л/год., переважно зі швидкістю 3-22 л/год., більш переважно зі швидкістю 3-15 л/год. або більш переважно зі швидкістю 3-10 л/год.
14. Спосіб за будь-яким із пп. 1-12, де тиск під час етапу (ii) фільтрування і тиск під час етапу (iii) заповнення підтримують нижче 5,0 бар або переважно нижче 3,0 бар.
15. Спосіб за будь-яким із пп. 1-13, де тиск під час етапу (ii) фільтрування і тиск під час етапу (iii) заповнення підтримують нижче 2,0 бар.
16. Спосіб за будь-яким із пп. 1-15, де температура водного фармацевтичного розчину становить від 0 °C до 14 °C, або температуру водного фармацевтичного розчину знижують до температури від 0 °C до 14 °C.
17. Спосіб за будь-яким із пп. 1-15, де температура водного фармацевтичного розчину становить від 0 °C до 12 °C, або температуру водного фармацевтичного розчину знижують до температури від 0 °C до 12 °C.
18. Спосіб за будь-яким із пп. 1-15, де температура водного фармацевтичного розчину становить 2-12 °C, або температуру водного фармацевтичного розчину знижують до 2-12 °C.
19. Спосіб за будь-яким із пп. 1-15, де температура водного фармацевтичного розчину становить 4-12 °C, або температуру водного фармацевтичного розчину знижують до 4-12 °C.
20. Спосіб за будь-яким із пп. 1-19, де фільтрування виконують за допомогою стерилізувального фільтра з розміром пор 0,2 мкм або менше, при цьому перший, другий або обидва фільтри є стерилізувальними фільтрами з розміром пор 0,2 мкм або менше.
21. Спосіб за будь-яким із пп. 1-20, де фармацевтичний препарат у придатній ємності являє собою водний фармацевтичний розчин, який містить 20 мг/мл глатирамеру ацетату і 40 мг/мл маніту.
22. Спосіб за будь-яким із пп. 1-20, де фармацевтичний препарат у придатній ємності являє собою водний фармацевтичний розчин, який містить 40 мг/мл глатирамеру ацетату і 40 мг/мл маніту.
23. Спосіб за будь-яким із пп. 1-22, де фармацевтичний препарат у придатній ємності являє собою водний фармацевтичний розчин зі значенням pH у діапазоні 5,5-7,0.
24. Спосіб за будь-яким із пп. 1-23, де фармацевтичний препарат у придатній ємності являє собою водний фармацевтичний розчин, який є стерилізованим водним розчином, котрий був стерилізований за допомогою фільтрації і без піддавання водного фармацевтичного розчину дії нагрівання, хімічних речовин або опромінення.
25. Спосіб за будь-яким із пп. 1-20, де фармацевтичний препарат являє собою ліофілізований порошок на основі глатирамеру ацетату і маніту.
26. Спосіб за будь-яким із пп. 1-20 або п. 25, який додатково включає етап ліофілізації фільтрату після того, як ним була заповнена придатна ємність, для того, щоб одержати ліофілізований порошок на основі глатирамеру ацетату і маніту в придатній ємності.
27. Спосіб за будь-яким із пп. 1-26, де придатна ємність являє собою шприц, флакон, ампулу, картридж або систему для інфузій.
28. Спосіб за п. 27, де придатна ємність являє собою шприц.
29. Спосіб за п. 28, де шприц містить 1 мл водного фармацевтичного розчину.
30. Спосіб одержання попередньо заповненого шприца, який містить 1 мл водного фармацевтичного розчину, що має значення рН у діапазоні 5,5-7,0, який містить 40 мг/мл глатирамеру ацетату і 40 мг/мл маніту, що включає етапи
(і) одержання водного фармацевтичного розчину глатирамеру ацетату і маніту;
(іі) фільтрування водного фармацевтичного розчину за температури від вище 0 °С до 17,5 °С з одержанням фільтрату і
(ііі) заповнення шприца фільтратом, одержаним після виконання етапу (іі), з одержанням таким чином попередньо заповненого шприца, який містить 1 мл водного фармацевтичного розчину, що має значення рН у діапазоні 5,5-7,0, який містить 40 мг/мл глатирамеру ацетату і 40 мг/мл маніту.
31. Спосіб за п. 30, де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр або перший фільтр і другий фільтр.
32. Спосіб за п. 31, який додатково включає етап зниження температури другого фільтра до температури від вище 0 °С до 17,5 °С.
33. Спосіб за п. 31, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С перед пропусканням через другий фільтр.
34. Спосіб за будь-яким із пп. 31-33, де етап (іі) фільтрування додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар.
35. Спосіб за п. 34, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С після того, як він вийшов із приймального резервуара, і перед тим, як увійшов до другого фільтра.
36. Спосіб за п. 34 або п. 35, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С під час знаходження в приймальному резервуарі.
37. Спосіб за будь-яким із пп. 31-36, який додатково включає етап зниження температури першого фільтра до температури від вище 0 °С до 17,5 °С.
38. Спосіб за будь-яким із пп. 31-36, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С перед пропусканням через перший фільтр.
39. Спосіб за будь-яким із пп. 31-38, де етап (і) одержання включає
(a) змішування водного фармацевтичного розчину в резервуарі для змішування;
(b) змішування водного фармацевтичного розчину в резервуарі для змішування і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С після того, як він вийшов із резервуара для змішування, і перед тим, як увійшов до першого фільтра; або
(c) змішування водного фармацевтичного розчину в резервуарі для змішування і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С під час знаходження в резервуарі для змішування.
40. Спосіб за будь-яким із пп. 31-39, де водний фармацевтичний розчин пропускають через другий фільтр зі швидкістю 3-25 л/год., зі швидкістю 3-22 л/год., зі швидкістю 3-15 л/год. або зі швидкістю 3-10 л/год.
41. Спосіб за будь-яким із пп. 30-40, де тиск під час етапу (іі) фільтрування і тиск під час етану (ііі) заповнення підтримують нижче 5,0 бар або нижче 3,0 бар, або нижче 2,0 бар.
42. Спосіб за будь-яким із пп. 30-41, де температура водного фармацевтичного розчину становить від 0 °С до 14 °С, або температуру водного фармацевтичного розчину знижують до температури від 0 °С до 14 °С.
43. Спосіб за будь-яким із пп. 30-41, де температура водного фармацевтичного розчину становить від 0 °С до 12 °С, або температуру водного фармацевтичного розчину знижують до температури від 0 °С до 12 °С.
44. Спосіб за будь-яким із пп. 30-41, де температура водного фармацевтичного розчину становить 2-12 °С, або температуру водного фармацевтичного розчину знижують до 2-12 °С.
45. Спосіб за будь-яким із пп. 30-41, де температура водного фармацевтичного розчину становить 4-12 °С, або температуру водного фармацевтичного розчину знижують до 4-12 °С.
46. Спосіб за будь-яким із пп. 31-45, де фільтрування виконують за допомогою стерилізувального фільтра з розміром пор 0,2 мкм або менше, при цьому перший, другий або обидва фільтри є стерилізувальними фільтрами з розміром пор 0,2 мкм або менше.
47. Спосіб за будь-яким із пп. 30-46, де водний фармацевтичний розчин у попередньо заповненому шприці являє собою стерилізований водний розчин, котрий був стерилізований за допомогою фільтрації і без піддавання водного фармацевтичного розчину дії нагрівання, хімічних речовин або опромінення.
48. Спосіб за п. 1 або п. 30, де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, де водний фармацевтичний розчин фільтрують через другий фільтр за температури від вище 0 °С до 17,5 °С.
49. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, і де водний фармацевтичний розчин фільтрують через другий фільтр за температури від вище 0 °С до 17,5 °С; де етап (іі) фільтрування додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар, і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С під час знаходження в приймальному резервуарі; і де спосіб додатково включає зниження температури другого фільтра до температури від вище 0 °С до 17,5 °С.
50. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, і де водний фармацевтичний розчин фільтрують через другий фільтр за температури від вище 0 °С до 17,5 °С; де етап (іі) фільтрування додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар, і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С після того, як він вийшов із приймального резервуара, і перед тим, як увійшов до другого фільтра; і де спосіб додатково включає зниження температури другого фільтра до температури від вище 0 °С до 17,5 °С.
51. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С під час знаходження в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, і де водний фармацевтичний розчин фільтрують через перший і другий фільтр за температури від вище 0 °С до 17,5 °С; де спосіб додатково включає етап зниження температури першого фільтра до температури від вище 0 °С до 17,5 °С; і де спосіб додатково включає етап зниження температури другого фільтра до температури від вище 0 °С до 17,5 °С.
52. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, і де водний фармацевтичний розчин фільтрують через перший і другий фільтр за температури від вище 0 °С до 17,5 °С; де спосіб додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С перед пропусканням через перший фільтр; де спосіб додатково включає етап зниження температури першого фільтра до температури від вище 0 °С до 17,5 °С; і де спосіб додатково включає етап зниження температури другого фільтра до температури від вище 0 °С до17,5 °С.
53. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, і де водний фармацевтичний розчин фільтрують через другий фільтр за температури від вище 0 °С до 17,5 °С; де етап (іі) фільтрування додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар; і де спосіб додатково включає зниження температури другого фільтра до температури від вище 0 °С до 17,5 °С.
54. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, і де водний фармацевтичний розчин фільтрують через другий фільтр за температури від вище 0 °С до 17,5 °С; і де спосіб додатково включає етап зниження температури другого фільтра до температури від вище 0 °С до 17,5 °С.
55. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С під час знаходження в резервуарі для змішування; і де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр.
56. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр; де етап (іі) фільтрування додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар, і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С під час знаходження в приймальному резервуарі.
Текст
Реферат: Винахід стосується способу одержання фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності, що включає етапи (i) одержання водного фармацевтичного розчину глатирамеру ацетату і маніту; (ii) фільтрування водного фармацевтичного розчину за температури від вище 0 °C до 17,5 °C з одержанням фільтрату і (iii) заповнення придатної ємності фільтратом, одержаним після виконання етапу (ii), з одержанням таким чином фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності. UA 116060 C2 (12) UA 116060 C2 UA 116060 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дана заявка заявляє пріоритет непопередньої заявки на видачу патенту США № 14/608126, поданої 28 січня 2015 року, повний зміст якої включено в даний документ за допомогою посилання. По всій даній заявці посилання на різні публікації наведені за першим автором та роком публікації. Повні посилання для даних публікацій представлено у розділі "Бібліографічні дані" безпосередньо перед формулою винаходу. Розкриття цих документів і публікацій, наведених в даному документі, таким чином включені в повному обсязі за допомогою посилання в дану заявку для більш повного опису галузі техніки на даний час, до якої відноситься даний винахід. Передумови створення винаходу Глатирамеру ацетат (GA), активний інгредієнт Copaxone®, складається з ацетатних солей синтетичних поліпептидів, які містять чотири амінокислоти природного походження: Lглутамінову кислоту, L-аланін, L-тирозин і L-лізин із середньою молекулярною долею 0,141, 0,427, 0,095 і 0,338 відповідно. Пікова середня молекулярна маса глатирамеру ацетату становить від 5000 до 9000 дальтон. Глатирамеру ацетат ідентифікують за специфічними антитілами (копаксон, етикування, схвалене Управлінням по контролю за харчовими продуктами та лікарськими засобами (посилальний ID: 3443331) [через всесвітню мережу Інтернет], TEVA Pharmaceutical Industries Ltd., 2014 [відновлене 24 грудня 2014 року], відновлене із всесвітньої мережі Інтернет: ). Хімічно глатирамеру ацетат називають полімером L-глутамінової кислоти з L-аланіном, Lлізином і L-тирозином, ацетатом (сіллю). Його структурна формула являє собою наступну: (Glu, Ala, Lys, Tyr)x.X CH3COOH; (C 5H 9NO 4. C 3H 7NO 2. C 6H 14N 2O 2. C 9H 11 NO 3 ) x . xC 2H 4O 2; CAS-147245-92-9. ® Copaxone являє собою прозорий, від безбарвного до злегка жовтого, стерильний, ® апірогенний розчин для підшкірної ін'єкції. Кожен 1 мл розчину Copaxone містить 20 мг або 40 мг GA, активного інгредієнту, і 40 мг маніту. pH розчинів становить приблизно 5,5-7,0. ® Copaxone , 20 мг/мл, у попередньо заповненому шприці (PPS) являє собою схвалений продукт, безпека й ефективність якого доведені більш ніж двома десятками клінічних досліджень і більш ® ніж десятьма дослідженнями після виходу на ринок. Copaxone , 40 мг/мл, в PPS розробляли як ® новий склад GA як активного інгредієнту. Copaxone , 40 мг/мл являє собою рецептурний медичний засіб, застосовуваний для лікування людей з рецидивуючою формою розсіяного склерозу (копаксон, етикування, схвалене Управлінням по контролю за харчовими продуктами та лікарськими засобами (посилальний ID: 3443331) [через всесвітню мережу Інтернет], TEVA Pharmaceutical Industries Ltd., 2014 [відновлене 24 грудня 2014 року], відновлене із всесвітньої мережі Інтернет: ). Об'єктом даного винаходу є забезпечення поліпшеного способу одержання лікарських продуктів з GA. Короткий опис винаходу Дана заявка на видачу патенту передбачає спосіб одержання фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності, що включає етапи (i) одержання водного фармацевтичного розчину глатирамеру ацетату і маніту; (ii) фільтрування водного фармацевтичного розчину за температури від вище 0 °C до 17,5 °C з одержанням фільтрату і (iii) заповнення придатної ємності фільтратом, одержаним після виконання етапу (ii), з одержанням, таким чином, фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності. Дана заявка на видачу патенту також передбачає попередньо заповнений шприц, який містить 40 мг глатирамеру ацетату і 40 мг маніту, при цьому шприц одержують способом за даним винаходом. Дана заявка на видачу патенту додатково передбачає водний фармацевтичний розчин, який містить 40 мг/мл глатирамеру ацетату і 40 мг/мл маніту, при цьому водний фармацевтичний розчин a) має в'язкість в діапазоні 2,0-3,5 сПа або b) має осмоляльність в діапазоні 275-325 мосмоль/кг. Дана заявка на видачу патенту також передбачає попередньо заповнений шприц, який містить 1 мл водного фармацевтичного розчину, одержаного способом за даним винаходом. Дана заявка на видачу патенту також передбачає автоматичний ін'єктор, який містить попередньо заповнений шприц, одержаний способом за даним винаходом. Аспекти даного винаходу відносяться до способу лікування пацієнта-людини, що страждає 1 UA 116060 C2 5 10 15 20 25 30 35 40 45 50 55 60 на рецидивуючу форму розсіяного склерозу, який включає введення пацієнту-людині трьох підшкірних ін'єкцій з дозою 40 мг/мл глатирамеру ацетату на тиждень із застосуванням попередньо заповненого шприца за даним винаходом, із застосуванням водного фармацевтичного розчину за даним винаходом або із застосуванням автоматичного ін'єктора за даним винаходом з лікуванням, таким чином, пацієнта-людини. Короткий опис графічних матеріалів Фігура 1. Схематичний опис способу фільтрації за допомогою охолодженого приймального резервуара і корпусу фільтра. Фігура 2. Схематичний опис способу фільтрації за допомогою теплообмінника і охолодженого корпусу фільтра. Фігура 3. Запис тиску для експерименту № 1. * Зупиняли фільтрацію розчину GA за регульованої кімнатної температури і залишковий розчин переміщали до охолоджених приймальних резервуарів. Фігура 4. Запис тиску для експерименту № 2. * Витримки довжиною 3 години і 5 годин для розчинів GA, профільтрованих за регульованої кімнатної температури і за зниженої температури відповідно. ** Витримка довжиною 10 годин для обох розчинів GA. *** Фільтрацію розчину GA за регульованої кімнатної температури зупиняли. Залишковий розчин GA фільтрували за зниженої температури. Фігура 5. Запис тиску для експерименту № 3. Фігура 6. Схематичний опис способу фільтрації за допомогою охолодженого резервуара для змішування і охолоджених корпусів фільтрів як на фільтрі A, так і на фільтрі B. Фігура 7. Схематичний опис способу фільтрації за допомогою теплообмінника і охолоджених корпусів фільтрів як на фільтрі A, так і на фільтрі B. Фігура 8. Схематичний опис способу фільтрації за допомогою охолодженого корпусу фільтра тільки на фільтрі B. Фігура 9. Схематичний опис способу фільтрації за допомогою охолоджених корпусів фільтрів як на фільтрі A, так і на фільтрі B. Фігура 10. Схематичний опис способу фільтрації за допомогою охолодженого резервуара для змішування. Фігура 11. Схематичний опис способу фільтрації за допомогою охолодженого приймального резервуара. Детальний опис винаходу Даний винахід передбачає спосіб одержання фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності, що включає етапи (i) одержання водного фармацевтичного розчину глатирамеру ацетату і маніту; (ii) фільтрування водного фармацевтичного розчину за температури від вище 0 °C до 17,5 °C з одержанням фільтрату і (iii) заповнення придатної ємності фільтратом, одержаним після виконання етапу (ii), з одержанням, таким чином, фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності. В деяких варіантах здійснення етап фільтрування (ii) включає фільтрування водного фармацевтичного розчину через перший фільтр, або перший фільтр і другий фільтр. В деяких варіантах здійснення спосіб додатково включає етап зниження температури другого фільтра до температури від вище 0 °C до 17,5 °C. В деяких варіантах здійснення спосіб додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C перед пропусканням через другий фільтр. В деяких варіантах здійснення етап фільтрування (ii) додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар. В деяких варіантах здійснення спосіб додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C після того, як він вийшов з приймального резервуара і перед тим, як увійшов до другого фільтра. В деяких варіантах здійснення спосіб додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C під час знаходження розчину в приймальному резервуарі. В деяких варіантах здійснення спосіб додатково включає етап зниження температури першого фільтра до температури від вище 0 °C до 17,5 °C. В деяких варіантах здійснення спосіб додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C перед 2 UA 116060 C2 5 10 15 20 25 30 35 40 45 50 55 60 пропусканням через перший фільтр. В деяких варіантах здійснення етап одержання (i) включає змішування водного фармацевтичного розчину в резервуарі для змішування. В деяких варіантах здійснення спосіб додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C після того, як він вийшов з резервуара для змішування і перед тим, як увійшов до першого фільтра. В деяких варіантах здійснення спосіб додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C під час знаходження розчину в резервуарі для змішування. В деяких варіантах здійснення водний фармацевтичний розчин пропускають через другий фільтр за швидкості 3-25 літрів/година. В деяких варіантах здійснення водний фармацевтичний розчин пропускають через другий фільтр, переважно, за швидкості 3-22 літрів/година. В деяких варіантах здійснення водний фармацевтичний розчин пропускають через другий фільтр, більш переважно, за швидкості 3-15 літрів/година. В деяких варіантах здійснення водний фармацевтичний розчин пропускають через другий фільтр, більш переважно, за швидкості 3-10 літрів/година. В деяких варіантах здійснення тиск під час етапу фільтрування (ii) і тиск під час етапу заповнення (iii) підтримують нижче 5,0 бар. В деяких варіантах здійснення тиск під час етапу фільтрування (ii) і тиск під час етапу заповнення (iii) підтримують, переважно, нижче 3,0 бар. В деяких варіантах здійснення тиск під час етапу фільтрування (ii) і тиск під час етапу заповнення (iii) підтримують нижче 2,0 бар. В деяких варіантах здійснення температура водного фармацевтичного розчину становить від 0 °C до 14 °C, або температуру водного фармацевтичного розчину знижують до температури від 0 °C до 14 °C. В деяких варіантах здійснення температура водного фармацевтичного розчину становить від 0 °C до 12 °C, або температуру водного фармацевтичного розчину знижують до температури від 0 °C до 12 °C. В деяких варіантах здійснення температура водного фармацевтичного розчину становить 2 °C-12 °C, або температуру водного фармацевтичного розчину знижують до 2 °C-12 °C. В деяких варіантах здійснення температура водного фармацевтичного розчину становить 4 °C-12 °C, або температуру водного фармацевтичного розчину знижують до 4 °C-12 °C. В деяких варіантах здійснення фільтрування виконують за допомогою стерилізувального фільтра з розміром пор 0,2 мкм або менше, при цьому перший, другий або обидва фільтри є стерилізувальними фільтрами з розміром пор 0,2 мкм або менше. В деяких варіантах здійснення фармацевтичний препарат в придатній ємності являє собою водний фармацевтичний розчин, який містить 20 мг/мл глатирамеру ацетату і 40 мг/мл маніту. В деяких варіантах здійснення фармацевтичний препарат в придатній ємності являє собою водний фармацевтичний розчин, який містить 40 мг/мл глатирамеру ацетату і 40 мг/мл маніту. В деяких варіантах здійснення фармацевтичний препарат в придатній ємності являє собою водний фармацевтичний розчин із значенням pH в діапазоні 5,5-7,0. В деяких варіантах здійснення фармацевтичний препарат в придатній ємності являє собою водний фармацевтичний розчин, який є стерилізованим водним розчином, котрий стерилізували за допомогою фільтрації і без піддання водного фармацевтичного розчину дії нагрівання, хімічних речовин або опромінення. В деяких варіантах здійснення фармацевтичний препарат являє собою ліофілізований порошок на основі глатирамеру ацетату і маніту. В деяких варіантах здійснення спосіб додатково включає етап ліофілізації фільтрату після того, як ним заповнили придатну ємність, для того щоб одержати ліофілізований порошок на основі глатирамеру ацетату і маніту в придатній ємності. В деяких варіантах здійснення придатна ємність являє собою шприц, флакон, ампулу, картридж або систему для інфузій. В деяких варіантах здійснення придатна ємність являє собою шприц. В деяких варіантах здійснення шприц містить 1 мл водного фармацевтичного розчину. Даний винахід передбачає попередньо заповнений шприц, який містить 40 мг глатирамеру ацетату і 40 мг маніту, при цьому шприц одержують способом за даним винаходом. Згідно з будь-яким варіантом здійснення попередньо заповненого шприца, розкритого в даному документі, попередньо заповнений шприц містить 1 мл водного фармацевтичного розчину глатирамеру ацетату в дозуванні 40 мг/мл і маніту в дозуванні 40 мг/мл. 3 UA 116060 C2 5 10 15 20 25 30 35 40 45 50 55 60 Згідно з будь-яким варіантом здійснення попередньо заповненого шприца, розкритого в даному документі, водний фармацевтичний розчин a) має в'язкість в діапазоні 2,0-3,5 сПа або b) має осмоляльність в діапазоні 270-330 мосмоль/кг. Згідно з будь-яким варіантом здійснення попередньо заповненого шприца, розкритого в даному документі, водний фармацевтичний розчин a) має в'язкість в діапазоні 2,2-3,0 сПа або b) має осмоляльність в діапазоні 275-325 мосмоль/кг. Даний винахід передбачає водний фармацевтичний розчин, який містить 40 мг/мл глатирамеру ацетату і 40 мг/мл маніту, при цьому водний фармацевтичний розчин a) має в'язкість в діапазоні 2,0-3,5 сПа або b) має осмоляльність в діапазоні 275-325 мосмоль/кг. Згідно з деякими варіантами здійснення водного фармацевтичного розчину водний фармацевтичний розчин має в'язкість в діапазоні 2,0-3,5 сПа. Згідно з деякими варіантами здійснення водного фармацевтичного розчину водний фармацевтичний розчин має в'язкість в діапазоні 2,61-2,92 сПа. Згідно з деякими варіантами здійснення водного фармацевтичного розчину водний фармацевтичний розчин має осмоляльність в діапазоні 275-325 мосмоль/кг. Згідно з деякими варіантами здійснення водного фармацевтичного розчину водний фармацевтичний розчин має осмоляльність в діапазоні 300-303 мосмоль/кг. Згідно з деякими варіантами здійснення водного фармацевтичного розчину водний фармацевтичний розчин містить глатирамеру ацетат із в'язкістю в діапазоні 2,3-3,2 сПа. Згідно з деякими варіантами здійснення водного фармацевтичного розчину водний фармацевтичний розчин містить глатирамеру ацетат із в'язкістю в діапазоні 2,6-3,0 сПа. Згідно з деякими варіантами здійснення водного фармацевтичного розчину водний фармацевтичний розчин містить глатирамеру ацетат з осмоляльністю в діапазоні 290310 мосмоль/кг. Згідно з деякими варіантами здійснення водного фармацевтичного розчину водний фармацевтичний розчин містить глатирамеру ацетат з осмоляльністю в діапазоні 295305 мосмоль/кг. Згідно з деякими варіантами здійснення водного фармацевтичного розчину водний фармацевтичний розчин має значення pH в діапазоні 5,5-7,0. Даний винахід передбачає попередньо заповнений шприц, який містить 1 мл водного фармацевтичного розчину, одержаного за допомогою даного винаходу. Даний винахід передбачає автоматичний ін'єктор, який містить попередньо заповнений шприц, одержаний за допомогою даного винаходу. Даний винахід передбачає спосіб лікування пацієнта-людини, що страждає на рецидивуючу форму розсіяного склерозу, який включає введення пацієнту-людині трьох підшкірних ін'єкцій з дозою 40 мг/мл глатирамеру ацетату на тиждень із застосуванням попередньо заповненого шприца за даним винаходом, із застосуванням водного фармацевтичного розчину за даним винаходом або із застосуванням автоматичного ін'єктора за даним винаходом з лікуванням, таким чином, пацієнта-людини. В деяких варіантах здійснення пацієнт-людина страждає на рецидивуюче-ремітуючий розсіяний склероз. В деяких варіантах здійснення пацієнт-людина зазнав першого клінічного епізоду і має MRIознаки, що вказують на розсіяний склероз. Даний винахід передбачає спосіб одержання фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності, що включає етапи (i) одержання водного фармацевтичного розчину глатирамеру ацетату і маніту; (ii) фільтрування водного фармацевтичного розчину за температури від вище 0 °C до 17,5 °C з одержанням фільтрату і (iii) заповнення придатної ємності фільтратом, одержаним після виконання етапу (ii), з одержанням, таким чином, фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності. В одному варіанті здійснення етап фільтрування (ii) включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр. В одному варіанті здійснення етап одержання (i) включає змішування водного фармацевтичного розчину в резервуарі для змішування. В одному варіанті здійснення спосіб додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C під час знаходження 4 UA 116060 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчину в резервуарі для змішування. В одному варіанті здійснення спосіб додатково включає етап зниження температури першого фільтра до температури від вище 0 °C до 17,5 °C. В одному варіанті здійснення спосіб додатково включає етап зниження температури другого фільтра до температури від вище 0 °C до 17,5 °C. Даний винахід передбачає спосіб одержання фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності, що включає етапи (i) одержання водного фармацевтичного розчину глатирамеру ацетату і маніту; (ii) фільтрування водного фармацевтичного розчину за температури від вище 0 °C до 17,5 °C з одержанням фільтрату і (iii) заповнення придатної ємності фільтратом, одержаним після виконання етапу (ii), з одержанням, таким чином, фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності. В одному варіанті здійснення етап фільтрування (ii) включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр. В одному варіанті здійснення етап одержання (i) включає змішування водного фармацевтичного розчину в резервуарі для змішування. В одному варіанті здійснення спосіб додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C після того, як він вийшов з резервуара для змішування і перед тим, як увійшов до першого фільтра. В одному варіанті здійснення спосіб додатково включає етап зниження температури першого фільтра до температури від вище 0 °C до 17,5 °C. В одному варіанті здійснення спосіб додатково включає етап зниження температури другого фільтра до температури від вище 0 °C до 17,5 °C. Даний винахід передбачає спосіб одержання фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності, що включає етапи (i) одержання водного фармацевтичного розчину глатирамеру ацетату і маніту; (ii) фільтрування водного фармацевтичного розчину за температури від вище 0 °C до 17,5 °C з одержанням фільтрату і (iii) заповнення придатної ємності фільтратом, одержаним після виконання етапу (ii), з одержанням, таким чином, фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності. В одному варіанті здійснення етап фільтрування (ii) включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр. В одному варіанті здійснення спосіб додатково включає етап зниження температури другого 0 фільтра до температури від вище 0 °C до 17,5 C. Даний винахід передбачає спосіб одержання фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності, що включає етапи (i) одержання водного фармацевтичного розчину глатирамеру ацетату і маніту; (ii) фільтрування водного фармацевтичного розчину за температури від вище 0 °C до 17,5 °C з одержанням фільтрату і (iii) заповнення придатної ємності фільтратом, одержаним після виконання етапу (ii), з одержанням, таким чином, фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності. В одному варіанті здійснення етап фільтрування (ii) включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр. В одному варіанті здійснення спосіб додатково включає етап зниження температури першого фільтра до температури від вище 0 °C до 17,5 °C. В одному варіанті здійснення спосіб додатково включає етап зниження температури другого фільтра до температури від вище 0 °C до 17,5 °C. Даний винахід передбачає спосіб одержання фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності, що включає етапи (i) одержання водного фармацевтичного розчину глатирамеру ацетату і маніту; (ii) фільтрування водного фармацевтичного розчину за температури від вище 0 °C до 17,5 °C з одержанням фільтрату і (iii) заповнення придатної ємності фільтратом, одержаним після виконання етапу (ii), з одержанням, таким чином, фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності. В одному варіанті здійснення етап фільтрування (ii) включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр. 5 UA 116060 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному варіанті здійснення етап одержання (i) включає змішування водного фармацевтичного розчину в резервуарі для змішування. В одному варіанті здійснення спосіб додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C під час знаходження розчину в резервуарі для змішування. Даний винахід передбачає спосіб одержання фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності, що включає етапи (i) одержання водного фармацевтичного розчину глатирамеру ацетату і маніту; (ii) фільтрування водного фармацевтичного розчину за температури від вище 0 °C до 17,5 °C з одержанням фільтрату і (iii) заповнення придатної ємності фільтратом, одержаним після виконання етапу (ii), з одержанням, таким чином, фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності. В одному варіанті здійснення етап фільтрування (ii) включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр. В одному варіанті здійснення етап фільтрування (ii) додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар. В одному варіанті здійснення спосіб додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C під час знаходження розчину в приймальному резервуарі. Автоматичний пристрій для ін'єкцій Механічну внутрішню частину автоматичного допоміжного пристрою для ін'єкцій можна одержати згідно з розкриттям в публікації європейської заявки № EP0693946 і патенті США № 7855176, які включені в даний документ за допомогою посилання. Всі комбінації різних елементів, описаних у даному документі, входять в обсяг даного винаходу. Визначення Використовуваний в даному документі "глатирамеру ацетат" являє собою складну суміш ацетатних солей синтетичних поліпептидів, які містять чотири амінокислоти природного походження: L-глутамінову кислоту, L-аланін, L-тирозин і L-лізин. Пікова середня молекулярна маса глатирамеру ацетату становить від 5000 до 9000 дальтон. Хімічно глатирамеру ацетат називають полімером L-глутамінової кислоти з L-аланіном, L-лізином і L-тирозином, ацетатом (сіллю). Його структурна формула являє собою наступну: (Glu, Ala, Lys, Tyr)x.X CH3COOH; (C5H9NO4.C3H7NO2.C6H14N2O2.C9H11NO3) x.x C2H4O2; CAS-147245-92-9. Використовувана в даному документі "лікарська речовина-глатирамеру ацетат" являє собою глатирамеру ацетат як активний інгредієнт перед його складанням в лікарський продукт з глатирамеру ацетатом. Використовуваний в даному документі "лікарський продукт з глатирамеру ацетатом" являє собою склад для фармацевтичного застосування, який містить лікарську речовину-глатирамеру ® ацетат. Copaxone являє собою промисловий лікарський продукт з глатирамеру ацетатом, що виготовляється TEVA Pharmaceutical Industries Ltd. (Ізраїль), який описаний в етикуванні для копаксону, схваленому Управлінням по контролю за харчовими продуктами та лікарськими засобами (посилальний ID: 3443331) [через всесвітню мережу Інтернет], TEVA Pharmaceutical Industries Ltd., 2014 [відновлене 24 грудня 2014 року], відновлене із всесвітньої мережі Інтернет: , змісти яких ® включені в даний документ за допомогою посилання. Copaxone доступний у дозуванні 20 мг/мл, що вводять один раз на добу, та/або у дозуванні 40 мг/мл, що вводять три рази на тиждень. Використовуваний в даному документі "стерилізувальний фільтр" являє собою фільтр з розміром пор 0,2 мкм або менше, який буде ефективно видаляти мікроорганізми. Діапазон, розкритий у даному документі, передбачає, що усі соті, десяті та цілі одиничні кількості у межах діапазону, зокрема, розкриті як частина даного винаходу. Таким чином, наприклад, від 1 мг до 50 мг означає, що одиничні кількості 1,1, 1,2…1,9 і 2, 3…49 мг включені як варіанти здійснення даного винаходу. Даний винахід можна буде краще зрозуміти при посиланні на докладний опис експериментів, що наведений нижче, але фахівці в даній галузі легко зрозуміють, що конкретні детально описані експерименти лише ілюструють даний винахід, описаний більш повно у 6 UA 116060 C2 5 10 15 формулі винаходу, наведеній у даному документі далі. Докладний опис експериментів Способи Ін'єкцію глатирамеру ацетату (GA), 40 мг/мл, в попередньо заповненому шприці (GA-ін'єкція, 40 мг/мл, в PFS або Copaxone®, 40 мг/мл) розробляли як новий склад глатирамеру ацетату як ® активного інгредієнта, що також застосовують в ринковому продукті Copaxone , 20 мг/мл, ® розчині для ін'єкції в попередньо заповненому шприці. Copaxone , 40 мг/мл, підлягає введенню три рази на тиждень шляхом підшкірної ін'єкції пацієнтам з рецидивуюче-ремітуючим розсіяним ® склерозом. Новий склад базується на складі ринкового Copaxone , 20 мг/мл, розчину для ін'єкції ® в попередньо заповненому шприці. Copaxone , 20 мг/мл, являє собою схвалений продукт, безпека й ефективність якого доведені більш ніж двома десятками клінічних досліджень і більш ніж десятьма дослідженнями після виходу на ринок. Єдиною різницею між складами є подвійна кількість використовуваної активної речовини, що призводить в результаті до розчину з подвійною концентрацією глатирамеру ацетату (40 мг/мл проти 20 мг/мл). Кількість маніту в ® обох складах Copaxone залишається незмінною (40 мг/мл). ® ® Композиції Copaxone , 20 мг/мл, і Copaxone , 40 мг/мл, описані докладно в таблиці 1. Таблиця 1 ® ® Композиції Copaxone , 20 мг/мл, і Copaxone , 40 мг/мл ® Компоненти Глатирамеру ацетат Маніт, USP/Ph.Eur. Вода для ін'єкції, USP/Ph.Eur/JP 20 25 30 35 40 45 50 1 ® Copaxone , 20 мг/мл Copaxone , 40 мг/мл Вміст на мл 20,0 мг 40,0 мг 40,0 мг 40,0 мг в достатній кількості до 1,0 мл в достатній кількості до 1,0 мл 1. Розрахований на основі аналізу сухої маси і 100 %. ® Дослідження проводили, щоб перевірити, що склад Copaxone , 40 мг/мл, спосіб його одержання і хімічні, біологічні й мікробіологічні властивості придатні для введення в обіг. Дослідження також проводили, щоб підтвердити придатність запропонованої закорковувальної ® системи ємності для Copaxone , 40 мг/мл. ® Маніт обирали як засіб, що впливає на тонічність, для первісного складеного Copaxone (сублімованого продукту, відновлювального перед введенням) оскільки він також являє собою об'ємоутворюючий засіб. Коли на даний час реалізовуваний на ринку готовий до застосування ® склад Copaxone , 20 мг/мл, розчину для ін'єкції в попередньо заповненому шприці розробляли, маніт використовували в даному складі також як осморегулятор. В результаті, коли новий склад ® в дозуванні 40 мг/мл розробляли, на основі складу Copaxone , 20 мг/мл, маніт залишився як осморегулятор. Маніт широко застосовується в парентеральних складах як осморегулятор. Він легко розчиняється у воді та стабільний у водних розчинах. Розчини маніту можна стерилізувати фільтрацією. В розчині на маніт не впливає атмосферний кисень у відсутності каталізатора. ® Концентрація маніту в Copaxone , 40 мг/мл, становить 40 мг/мл. Збереження концентрації ® маніту в Copaxone , 40 мг/мл, призводить в результаті, в цілому, до ізотонічного розчину. Вода для ін'єкції (WFI) є найбільш широко застосовуваним розчинником й інертним носієм в парентеральних складах. Вода є хімічно стабільною в усіх фізіологічних станах. Вона є основою для багатьох біологічних форм життя, і її безпека у фармацевтичних складах не викликає сумнівів. Приклад 1 ® Спосіб одержання Copaxone , 40 мг/мл, включає - змішування загального об'єму розчину GA і маніту у воді для ін'єкцій (WFI); - стерилізувальну фільтрацію основного об'єму розчину з одержанням стерильного розчину GA в загальному об'ємі; - асептичне заповнення загальним об'ємом стерильного розчину циліндрів шприців і закорковування; - огляд і остаточне складання заповнених шприців. Спочатку, фільтрацію загального об'єму розчину з резервуара для змішування виконували через ланцюг послідовних фільтрів, що містив два послідовно розташовані стерилізувальні фільтри (фільтри називані A1 і A2 відповідно), до приймального резервуара. З приймального 7 UA 116060 C2 5 10 15 20 25 30 35 40 45 50 55 60 резервуара його переносили до проміжного резервуара в установці для заповнення і далі через дозувальні насоси і голки до попередньо заповнених шприців. Однак, згідно з вимогою органів охорони здоров'я розташовувати стерилізувальний фільтр настільки близько, наскільки це можливо до місця заповнення, другий стерилізувальний фільтр переміщували між приймальним і проміжним резервуарами. В даній послідовності фільтрації перший стерилізувальний фільтр називали фільтром A і другий пересунутий стерилізувальний фільтр називали фільтром B. Див. фігуру 1. ® Відповідно до способу для схваленого складу Copaxone , 20 мг/мл, усі технологічні етапи ® для нового складу Copaxone , 40 мг/мл, спершу виконували за регульованої кімнатної температури. Однак фільтрація розчину з більш високою концентрацією призвела в результаті до збільшення тиску на другому фільтрі, фільтрі B. Незважаючи на спостережуване підвищення тиску на фільтрі B, можна одержати лікарський продукт високої якості шляхом фільтрації GA, 40 мг/мл, за регульованої кімнатної температури, що підтверджується даними вивільнення і стабільності. Все ж, був необхідним поліпшений спосіб фільтрації, за допомогою якого уникають збільшення на другому фільтрі. Швидкість потоку для рідин можна визначати за диференціальним тиском і навпаки стримувати за допомогою в'язкості. В'язкість, в свою чергу, як правило, є взаємооберненою по відношенню до температури (Meltzer and Jornitz, Filtration and Purification in the Biopharmaceutical Industry, Second Edition, CRC Press, 2007, page 166). Підвищення температури розчину буде, в нормі, знижувати в'язкість, збільшуючи, таким чином, швидкість потоку. Намагаючись вирішити проблему збільшення тиску на другому фільтрі, температурну умову фільтрації підвищили вище регульованої кімнатної температури. Хоча в'язкість знизилась, знизилась здатність до фільтрації, що призвело в результаті до невдалої спроби. Виконували наведені нижче дослідження. - Валідаційне дослідження фільтрів: визначення діапазонів для виробничих параметрів, пов'язаних зі стерилізувальним фільтром A і стерилізувальним фільтром B, загального об'єму розчину, а також підтвердження сумісності фільтрів з лікарським продуктом. - Спосіб фільтрації вибір умов стерилізувальної фільтрації, найбільш придатних для способу одержання і якості лікарського продукту. ® ® Одержання фільтрів, використовуваних для Copaxone , 20 мг/мл, і Copaxone , 40 мг/мл ® Спосіб одержання Copaxone , 40 мг/мл, оснований на способі, застосовуваному для ® одержання ринкового Copaxone , 20 мг/мл, розчину для ін'єкції в попередньо заповненому шприці. Отже, використовували такі самі фільтри, які використовували для фільтрації ринкового продукту. Використовували два стерилізувальні фільтри, кожен з яких з розміром пор 0,2 мкм або менше, для ефективного видалення мікроорганізмів. Стерилізацію забезпечували тільки за допомогою фільтрації із застосуванням стерилізувальних фільтрів і без застосування інших способів, наприклад, стерилізацію забезпечували без застосування дії тепла, хімічних речовин або опромінення. Валідаційне дослідження фільтра - підтвердження і встановлення параметрів, зв'язаних із сумісністю фільтрів і зі стерилізувальною фільтрацією Наведені нижче тести виконували для підтвердження дієвості фільтрів. - Тестування на екстраговані речовини - оцінювання екстрагованих речовин, вивільнених з фільтра при стерилізації парою, і їх видалення з фільтру за допомогою типового розчинника, оцінювання, таким чином, об'єму, який треба відкинути після фільтрації через фільтр B, перед початком асептичного заповнення. - Тестування на сумісність/адсорбцію - оцінювання хімічної сумісності розчинів GA, 20 мг/мл, і GA, 40 мг/мл, з матеріалом фільтра і ступеню їх адсорбції фільтром, оцінювання, таким чином, об'єму, який треба відкинути після фільтрації через фільтр B, перед початком асептичного заповнення для забезпечення вмісту основної речовини в межах технічних вимог. - Залишковий ефект - щоб упевнитись, що на фільтрі після фільтрації не залишилася значна кількість залишкового розчину GA, 20 мг/мл, або GA, 40 мг/мл, яка може впливати на результати апостеріорного тесту на цілісність. - Бактеріальне навантаження - щоб пересвідчитися, що спосіб фільтрації не впливає на здатність фільтра забезпечувати стерильний розчин. Зазначені вище тести виконували із застосуванням максимального тиску (до 5,0 бар). Валідаційне дослідження показало, що вибрана система фільтрації здатна забезпечувати ® ® високоякісні Copaxone , 20 мг/мл, і Copaxone , 40 мг/мл. Враховуючи точні і чітко визначені операційні параметри й параметри обладнання способу фільтрації розчину GA, 40 мг/мл, розробляли план, щоб зменшити можливе підвищення тиску 8 UA 116060 C2 5 10 15 20 шляхом зниження температури фільтрації. Без надмірних сподівань було вирішено вивчити спосіб фільтрації стерильного загального об'єму розчину GA, 40 мг/мл, через фільтр B за умов зниженої температури із застосуванням тих самих фільтрів і послідовності фільтрації як і для фільтрації за регульованої кімнатної температури. Відповідно, експерименти виконували для того, щоб порівняти фільтрацію стерильного загального об'єму розчину GA, 40 мг/мл, через фільтр B за зниженої температури і регульованої кімнатної температури в навколишньому середовищі для одержання і впевнитись, що немає ніякої різниці відносно профілів якості і стабільності профільтрованих розчинів. В усіх експериментах стерильний загальний об'єм розчину одержували згідно зі стандартною послідовністю змішування і фільтрації (див. фігуру 1) і фільтрували через два фільтри: фільтр A і фільтр B. В експериментах тестували дві різні технології охолодження (охолоджені приймальні резервуари проти теплообмінника) з охолодженим фільтром. Дослідження схематично зображені на фігурі 1 і фігурі 2. Додаткові подробиці про ці експерименти і їх результати представлені в даному документі нижче. Спосіб фільтрації - експеримент № 1 Метою експерименту № 1 було порівняння здатності до фільтрації партії загального об'єму розчину, який утримують і фільтрують через фільтр B або за регульованої кімнатної температури, або за умов зниженої температури (охолодження за допомогою приймального резервуара з подвійною оболонкою і охолодженого корпусу фільтра B). Дослідження схематично зображено на фігурі 1. План експерименту і одержані результати підсумовані в таблиці 2 і на фігурі 3. Таблиця 2 Експериментальні план і результати для експерименту № 1. Короткий огляд експерименту Змішування Час утримання в приймальному резервуарі Температура розчину, який утримують в приймальному резервуарі Запланований режим 3 фільтрації через фільтр B Увесь об'єм профільтрованого загального об'єму розчину Фільтрація за зниженої Фільтрація за регульованої кімнатної температури температури 1 Згідно зі стандартною процедурою одержання 13 годин 6,6-10,7°C 13 годин 2 17,8-24,6 °C Проміжна фільтрація: Стадія I-5 фільтраційних етапів фільтрації приблизно 10 літрів загального об'єму розчину - з наступними витримками приблизно в 50 хвилин кожна, після яких ішла витримка в 5 годин. Стадія II-4 фільтраційні етапи фільтрації приблизно 10 літрів загального об'єму розчину - з наступними витримками приблизно в 50 хвилин кожна, після яких ішла витримка приблизно в 5 годин. Стадія III - фільтрація залишкового розчину. Приблизно 85 літрів. Приблизно 125 л. Фільтрацію Фільтрацію зупиняли через завершували. підвищення тиску на фільтрі B. 25 30 35 1. Один загальний об'єм розчину одержували і розділяли на дві частини. Розмір загального об'єму розчину: 230 літрів. Фільтрацію розчину за регульованої кімнатної температури зупиняли після того, як 85 літрів проганяли через фільтр завдяки підвищеному тиску і залишковий розчин переносили до охолоджених приймальних резервуарів. 2. Температура, підвищена (до 14,9 °C) одного разу під час фільтрації після додавання залишкового розчину, зберігається на рівні навколишнього середовища. 3. Фільтрації здійснювали паралельно. Несподівано, фільтрація за зниженої температури дозволила завершити фільтрацію без підвищення тиску, зв'язаного з фільтрацією за регульованої кімнатної температури. Приклад 2 Спосіб фільтрації - експеримент № 2 Першою метою експерименту № 2 було оцінювання чи може поліпшити локальне 9 UA 116060 C2 5 10 15 охолодження розчину GA, 40 мг/мл, із застосуванням теплообмінника (HE) здатність до фільтрації через охолоджений фільтр B, порівняно зі здатністю до фільтрації того самого загального об'єму розчину за регульованої кімнатної температури. Другою метою експерименту № 2 було підтвердження, що немає різниці в якості лікарського продукту, яким заповнювали шприці за регульованої кімнатної температури, і лікарським продуктом, яким заповнювали шприці за зниженої температури. Оцінювали охолодження за допомогою теплообмінника, оскільки, вочевидь, набагато легше стерилізувати парою, ніж із застосуванням приймальних резервуарів з подвійною оболонкою. HE розташовували між приймальним резервуаром і фільтром B. Отже, на відміну від експерименту № 1 (в якому розчин охолоджували за допомогою приймальних резервуарів з подвійною оболонкою після фільтрації через фільтр A і підтримували охолодженим перед фільтрацією через фільтр B) розчин в даному експерименті утримували за регульованої кімнатної температури перед фільтрацією локально охолодженого (за допомогою HE) розчину GA через фільтр B. Дослідження схематично зображено на фігурі 2. План експерименту і одержані результати підсумовані в таблиці 3. Тиск, за яким спостерігали протягом процесу заповнення експерименту № 2, показаний на фігурі 4. Таблиця 3 Експериментальні план і результати для експерименту № 2. Короткий огляд експерименту Змішування Фільтрація в приймальний резервуар Температура розчину, який утримують в приймальному резервуарі Час утримання в приймальному резервуарі Запланований режим фільтрації через фільтр B Фільтрація за регульованої кімнатної температури 1 Згідно зі стандартною процедурою одержання Фільтрацію усього загального об'єму розчину через фільтр A в приймальний резервуар проводили за регульованої кімнатної температури Фільтрація за зниженої температури Регульована кімнатна температура 19 годин Розчин локально охолоджували по мірі того, як його проводили через HE і фільтрували через охолоджений фільтр B. Три послідовні стадії фільтрації і заповнення. Перерва приблизно 3 години між стадією I і стадією II, і перерва приблизно 10 годин між стадією II і стадією III. Розчин фільтрували через фільтр B за регульованої кімнатної температури. Три послідовні стадії фільтрації і заповнення. Перерва приблизно 5 години між стадією I і стадією II, і перерва приблизно 10 годин між стадією II і стадією III. Температура розчину, який проводили через 6,4-12 °C Не використовували HE HE Тривалість фільтрації 24 години 19 годин 2 через фільтр B Температура розчину, Температура навколишнього який проводили через 5,7-8,8 °C середовища фільтр B Увесь об'єм загального об'єму розчину, який 3 154 л 63 л фільтрували і яким заповнювали шприці Умови зберігання під При довгостроковому (2-8 °C) час досліджень При прискореному (25 °C/60 % RH) - завершили через 6 місяців стабільності При стресовому (40 °C/75 %RH) - завершили через 3 місяці 10 UA 116060 C2 Продовження таблиці 3 Короткий огляд експерименту Дані стабільності 5 10 15 20 25 Фільтрація за регульованої кімнатної температури З даних стабільності видно, що лікарський продукт має однаковий профіль стабільності, коли його фільтрують за регульованої кімнатної температури або за умов зниженої температури. Обидва способи фільтрації показують подібний склад домішок. Фільтрація за зниженої температури 1. Один загальний об'єм розчину одержували і розділяли на дві частини. Розмір загального об'єму розчину: 230 літрів. 2. Обидва способи фільтрації (знижена і регульована кімнатна температура) здійснювали паралельно для порівняння. На кожній стадії фільтрацію здійснювали за регульованої кімнатної температури з наступною фільтрацією за зниженої температури. 3. Фільтрацію розчину за регульованої кімнатної температури зупиняли через підвищення тиску і залишковий розчин фільтрували за зниженої температури. Приклад 3 Спосіб фільтрації - експеримент № 3 Однією метою експерименту № 3 було підтвердження того, чи дає змогу охолодження загального об'єму розчину GA, 40 мг/мл, перед фільтрацією, із застосуванням HE і охолодженого корпусу фільтра фільтрувати і розливати партії в об'ємі 130 л під час здійснення різних режимів одержання. Іншою метою експерименту № 3 було оцінювання впливу часу утримання на різних стадіях способу одержання на здатність до фільтрації GA, 40 мг/мл. Іншою метою експерименту 3 було показати, з високим ступенем впевненості, що локально охолоджений розчин GA, 40 мг/мл, профільтрований через фільтр B, не відрізняється за своїм профілем якості й стабільності від розчину GA, 40 мг/мл, профільтрованого через фільтр B, за умов регульованої кімнатної температури, приймаючи до уваги заздалегідь визначені параметри й обмеження. Одержували серію з трьох партій загального об'єму розчину, вироблених за різних режимів. Кожний загальний об'єм розчину одержували в результаті однакової комбінації аналогічних трьох партій лікарської речовини. План і результати експерименту підсумовані в таблиці 4. Таблиця 4 Експериментальні план і результати для експерименту № 3 Короткий огляд експерименту № партії Змішування Об'єм партії Час утримання в резервуарі для 2 змішування Час утримання в приймальному 3 резервуарі Тривалість фільтрації через фільтр B Фільтрація за Фільтрація за регульованої зниженої кімнатної температури температури 1 A A-2 B Стандартне Стандартне Стандартне змішування змішування змішування Перші 130 л із Залишкові 50 л із загального об'єму загального об'єму 180 л розчину A розчину A 4 години (такий самий загальний 4 години 8 годин об'єм розчину як для A) Фільтрація за зниженої температури 1,5 години 10,5 години 7 годин 3 години 11 4 Фільтрація за регульованої кімнатної температури C Стандартне змішування 180 л 3,5 години 16 годин 13 годин 19,5 години 13 годин UA 116060 C2 Продовження таблиці 4 Короткий огляд експерименту Загальна тривалість всього способу (загальний час утримання) Температурний діапазон перед фільтром B Температурний діапазон після фільтра B Максимальний тиск перед фільтром B Загальний об'єм, яким заповнювали шприці Фільтрація за зниженої температури Фільтрація за регульованої кімнатної температури Фільтрація за зниженої температури Фільтрація за регульованої кімнатної температури 12,5 години 17,5 години 43,5 години 29,5 години 10,4-12,2 °C 9,3-11,0 °C Регульована кімнатна температура Регульована кімнатна температура 10,2-11,7 °C 9,0-10,2 °C Регульована кімнатна температура Регульована кімнатна температура 0,6 бар 0,3 бар 0,6 бар 2,5 бар 130 л 50 л 180 л 5 134 л При довгостроковому (2-8 °C) При прискореному (25 °C/60 % RH) При стресовому (40 °C/60 % RH) З даних стабільності видно, що лікарський продукт має однаковий профіль стабільності за усіх трьох умов зберігання, незалежно від того чи Дані стабільності й фільтрували його за регульованої кімнатної температури, або за умов висновки зниженої температури. Обидва способи фільтрації дають в результаті продукт фактично з аналогічним профілем розкладання й складу домішок за стресових умов. При довгостроковому Умови зберігання (2-8 °C) При стресовому під час досліджень При прискореному (40 °C/60 % RH) стабільності (25 °C/60 %RH) При стресовому (40 °C/60 % RH) 5 10 15 20 25 При довгостроковому (2-8 °C) При прискореному (25 °C/60 % RH) При стресовому (40 °C/60 % RH) 1. Партії A і A-2 являють собою партії з одного й того самого загального об'єму розчину. Фільтр B заміняли новим фільтром перед фільтрацією A-2. 2. Змішування і наступний час утримання в резервуарі для змішування (вкл. фільтрацію через фільтр A). 3. Час від кінця фільтрації через фільтр A до початку фільтрації через фільтр B і заповнення. 4. Оскільки A-2 фільтрували і цим розчином заповнювали шприці після фільтрації і заповнення A, зазначений час утримання являє собою суму часу утримання A плюс час A-2, який пройшов до того як почали фільтрацію за регульованої кімнатної температури. 5. Протягом заповнення поступове збільшення тиску при фільтрації було необхідно для підтримки швидкості потоку, який би відповідав швидкості, необхідній для безперервного заповнення. Виходячи з результатів експерименту № 3, підтвердили, що локальне охолодження за допомогою теплообмінника є достатнім для забезпечення фільтрації партії об'ємом 130 л. Окрім того, виявили, що профілі якості й стабільності розчинів GA, 40 мг/мл, профільтрованих за регульованої кімнатної температури і зниженої температури є в цілому ідентичними. Приклад 4 Охолодження загального об'єму розчину GA, 40 мг/мл, нижче 17,5 °C в резервуарі для змішування перед пропусканням через охолоджений фільтр A і охолоджений фільтр B послідовно (див. фігуру 6) призводить у результаті до більш низького тиску під час етапу фільтрації як через фільтр A, так і через фільтр B у порівнянні з утриманням того самого загального об'єму розчину в резервуарі для змішування і пропускання його через фільтр A і фільтр B за регульованої кімнатної температури (охолодження загального об'єму розчину 12 UA 116060 C2 5 10 15 20 25 30 35 40 45 50 55 60 шляхом використання резервуара для змішування з подвійною оболонкою і охолодження фільтрів шляхом використання корпусів фільтрів з подвійною оболонкою). Зниження температури загального об'єму розчину GA, 40 мг/мл, в резервуарі для змішування і пропускання його через охолоджені фільтр A і фільтр B послідовно (див. фігуру 6) значною мірою знижує ступінь порушення здатності до фільтрації, викликаного загальною тривалістю способу (часом утримання), а також більшим об'ємом, який фільтрують, порівняно з тим самим загальним об'ємом розчину, що утримують і фільтрують за регульованої кімнатної температури. Приклад 5 Локальне охолодження загального об'єму розчину GA, 40 мг/мл, за допомогою теплообмінника і пропускання розчину через охолоджений фільтр A і охолоджений фільтр B послідовно (див. фігуру 7) призводить у результаті до більш низького тиску під час етапу фільтрації як через фільтр A, так і через фільтр B у порівнянні з пропусканням того самого загального об'єму розчину, що утримують і фільтрують за регульованої кімнатної температури. Зниження температури загального об'єму розчину GA, 40 мг/мл, із застосуванням теплообмінника і пропускання його через охолоджений фільтр A і охолоджений фільтр B послідовно (див. фігуру 7) значною мірою знижує ступінь порушення здатності до фільтрації, викликаного загальною тривалістю способу (часом утримання), а також більшим об'ємом, який фільтрують, порівняно з тим самим загальним об'ємом розчину, що утримують і фільтрують за регульованої кімнатної температури. Приклад 6 Пропускання стерилізованого загального об'єму розчину GA, 40 мг/мл, з приймального резервуара через охолоджений фільтр B (див. фігуру 8) значною мірою призводить у результаті до більш низького тиску під час етапу фільтрації, порівняно з пропусканням того самого загального об'єму розчину, профільтрованого через фільтр B за регульованої кімнатної температури. Пропускання стерилізованого загального об'єму розчину GA, 40 мг/мл, з приймального резервуара через охолоджений фільтр B (див. фігуру 8) значною мірою знижує ступінь порушення здатності до фільтрації, викликаного загальною тривалістю способу (часом утримання), а також більшим об'ємом, який фільтрують, порівняно з тим самим загальним об'ємом розчину, що утримують і фільтрують за регульованої кімнатної температури. Приклад 7 Пропускання загального об'єму розчину GA, 40 мг/мл, з резервуара для змішування через охолоджений фільтр A і охолоджений фільтр B послідовно (див. фігуру 9) приводить в результаті до більш низького тиску під час етапу фільтрації як через фільтр A, так і через фільтр B у порівнянні з пропусканням того самого загального об'єм розчину, що фільтрують за регульованої кімнатної температури. Пропускання загального об'єм розчину GA, 40 мг/мл, з приймального резервуара через охолоджені фільтр A і фільтр B послідовно (див. фігуру 9) значною мірою знижує ступінь порушення здатності до фільтрації, викликаного загальною тривалістю способу (часом утримання), а також більшим об'ємом, який фільтрують, порівняно з тим самим загальним об'ємом розчину, що фільтрують за регульованої кімнатної температури. Приклад 8 Охолодження загального об'єму розчину GA, 40 мг/мл, нижче 17,5 °C в резервуарі для змішування перед пропусканням через фільтр A і фільтр B послідовно (див. фігуру 10) приводить у результаті до більш низького тиску під час етапу фільтрації як через фільтр A, так і через фільтр B у порівнянні з утриманням того самого загального об'єму розчину в резервуарі для змішування і пропускання його через фільтр A і фільтр B за регульованої кімнатної температури (охолодження загального об'єму розчину шляхом використання резервуара для змішування з подвійною оболонкою). Зниження температури загального об'єму розчину GA, 40 мг/мл, в резервуарі для змішування і пропускання його через фільтр A і фільтр B один за одним (див. фігуру 10) значною мірою знижує ступінь порушення здатності до фільтрації, викликаного загальною тривалістю способу (часом утримання), а також більшим об'ємом, який фільтрують, порівняно з тим самим загальним об'ємом розчину, що утримують при цьому за регульованої кімнатної температури. Приклад 9 Охолодження загального об'єму розчину GA, 40 мг/мл, нижче 17,5 °C в приймальному резервуарі перед пропусканням через фільтр B (див. фігуру 11) приводить у результаті до більш низького тиску під час етапу фільтрації через фільтр B у порівнянні з утриманням того 13 UA 116060 C2 5 10 15 20 25 30 35 40 45 50 55 60 самого загального об'єму розчину в резервуарі для змішування за регульованої кімнатної температури (охолодження загального об'єму розчину шляхом використання резервуара для змішування з подвійною оболонкою). Зниження температури загального об'єму розчину GA, 40 мг/мл, в приймальному резервуарі (див. фігуру 10) значною мірою знижує ступінь порушення здатності до фільтрації, викликаного загальною тривалістю способу (часом утримання), а також більшим об'ємом, який фільтрують, порівняно з тим самим загальним об'ємом розчину, що утримують за регульованої кімнатної температури. Обговорення прикладів 1-9 Зниження температури стерильного загального об'єму розчину GA, 40 мг/мл, значною мірою поліпшує його здатність до фільтрації, що продемонстровано набагато меншими підвищеннями тиску на фільтрі B під час фільтрації і заповнення і більшим об'ємом, який можна профільтрувати за зниженої температури. Підвищення тиску спостерігали тоді, коли стерильний загальний об'єм розчину утримували і фільтрували за регульованої кімнатної температури, у той час як не було значного підвищення тиску, коли розчин фільтрували за умов зниженої температури. Час утримання загального об'єму розчину під час фільтрації через фільтр B негативно впливав на здатність до фільтрації розчину. Однак загальна тривалість способу (час утримання) порушувала (порушував) здатність до фільтрації значно менше, коли фільтрацію виконували за умов зниженої температури. Отже, більш довгий час утримання можна використовувати з фільтрацією за зниженої температури. Як виявили і охолодження розчину шляхом пропускання його через теплообмінник (локальне охолодження), і/або охолодження усього об'єму (наприклад, за допомогою приймального резервуара з подвійною оболонкою) перед фільтрацією через охолоджені фільтри A або B або A і B давали придатні розчини для фільтрації за зниженої температури. З накопичених даних стабільності видно, що немає значної різниці відносно профілю якості й стабільності між розчином, профільтрованим за умов зниженої температури, і розчином, профільтрованим за регульованої кімнатної температури. Загалом, за результатами виконаних експериментів видно, що фільтрація за зниженої температури через фільтр B значною мірою поліпшує здатність до фільтрації розчину GA, 40 мг/мл, порівняно зі здатністю до фільтрації розчину при фільтруванні за регульованої кімнатної температури. Більш того, зниження температури загального об'єму розчину під час стадії змішування або перед пропусканням через фільтр A, або зниження температури фільтра A також поліпшує здатність до фільтрації розчину GA, 40 мг/мл, порівняно зі здатністю до фільтрації розчину за регульованої кімнатної температури. Отже, запропонований спосіб одержання товарних партій GA, 20 мг/мл, і GA, 40 мг/мл, включає охолодження розчину перед фільтрацією загального об'єму розчину через фільтр B. Приклад 10 Закорковувальна система ємності ® Закорковувальні системи ємностей, вибрані для Copaxone , 40 мг/мл, є такими самими, які ® застосовуються для ринкового продукту Copaxone , 20мг/мл, PFS. Закорковувальна система ємності містить безбарвний скляний циліндр, пластмасовий шток поршня і сірий гумовий стопор. Довгострокові й прискорені дослідження стабільності Доступні дані задовільної стабільності після до 36 місяців зберігання за довгострокових умов зберігання (5 °C ± 3 °C) і після 6 місяців зберігання за прискорених умов (25 °C ± 2 °C/60±5 % RH). З даних видно, що запропоновані закорковувальні системи ємностей придатні для захисту і збереження якості лікарського продукту впродовж його передбачуваного строку придатності. Захист від світла ® Ринковий Copaxone слід зберігати в захищеному від світла місці. Виходячи з даної ® рекомендації, передбачається, що Copaxone , 40 мг/мл, буде, подібним чином, упакований в прозорі PVC блістерні упаковки всередині картонної коробки, яка забезпечить захист від світла. ® Захист від світла запропонованої упаковки при застосуванні відносно Copaxone , 40 мг/мл, рекомендується відповідно до результатів, одержаних з дослідження фотостабільності, в якому зрівняні наступні комплектації упаковки: 1. шприц зі скляним циліндром і шток поршню (первинна упаковка); шприц зі скляним циліндром і шток поршню в прозорій блістерній упаковці (часткова вторинна упаковка); шприц зі скляним циліндром і шток поршню в прозорій блістерній упаковці всередині картонної коробки (повної комплектація передбачуваної упаковки). 14 UA 116060 C2 5 10 15 20 25 30 Як приклад додані наступні комплектації: 2. шприц зі скляним циліндром і шток поршню, загорнуті в алюмінієву фольгу; скляний циліндр і шток поршню в прозорій блістерній упаковці, загорнутій в алюмінієву фольгу. Усі упаковки одночасно піддавали дії стандартизованого сонячного світла (5 KLUX) протягом 10 днів і близького до УФ-світла протягом додаткових 5 днів. Усі одержані результати з дослідження фотостабільності знаходяться в межах технічних вимог. Однак виявлений пік домішок є нижчим при упакуванні лікарського продукту в повну комплектацію упаковки. Було показано, що картонна коробка поліпшує фотостабільність і забезпечує захист від світла настільки ж добре, як і упаковка з алюмінієвої фольги, яка розглядається як повний захист від світла. Отже, передбачена комплектація упаковки вважається придатною відносно її використання. Документ по зберіганню для захисту продукту від дії світла потрібно додавати до інструкції із застосування продукту. Мікробіологічні характеристики Медичний продукт є стерильною, одноразовою дозою лікарської форми для парентерального введення. Стерилізацію забезпечують за допомогою стерильної фільтрації. Для лікарської речовини проводили аналіз на мікробіологічну чистоту. Стерильність і рівень бактеріальних токсинів контролювали на момент вивільнення і протягом досліджень стабільності лікарського продукту за допомогою способів фармакопеї. Застосовувані рівні ® чистоти є ідентичними таким, застосовуваним для ринкового Copaxone . ® Такі самі закорковувальні системи ємностей використовували для Copaxone , 20 мг/мл, і ® Copaxone , 40 мг/мл. Дослідження цілісності виконували, щоб показати, що ефективність закорковувальних систем ємностей при застосуванні для ринкового продукту також вважається ® відповідною для Copaxone , 40 мг/мл. Приклад 11 В'язкість ® Одержували і порівнювали середню в'язкість партій Copaxone , 20 мг/мл, профільтрованих ® за регульованої кімнатної температури, і середню в'язкість партій Copaxone , 40 мг/мл, ® профільтрованих за зниженої температури. Середня в'язкість різних партій Copaxone , 20 мг/мл, профільтрованих за регульованої кімнатної температури, відображена в таблиці 5. ® Середня в'язкість різних партій Copaxone , 40 мг/мл, профільтрованих за зниженої температури, відображена в таблиці 6. Таблиця 5 В'язкість партій Copaxone®, 20 мг/мл, профільтрованих за регульованої кімнатної температури № партії 1 2 3 4 5 Вода для ін'єкцій Середнє значення Середнє значення 1 в'язкість [сПа] 1,921 1,581 1,581 2 1,57 1. 672 0,932 1,664 Стандартне відхилення 0,03 0,00 0,00 0,00 0,01 0,00 35 40 1 Кожна величина являє собою середнє значення 3 окремих результатів. одержували із застосуванням Rheocalc V2.5 моделі LV, веретено CP40, швидкість швидкість зсуву 600 1/с, температура 25 °C±0,1. 2 Кожна величина являє собою середнє значення 6 окремих результатів. одержували із застосуванням Rheocalc V2.5 моделі LV, веретено CP40, швидкість швидкість зсуву 600 1/с, температура 25 °C±0,1. 15 Величини 80 об./хв., Величини 80 об./хв., UA 116060 C2 Таблиця 6 В'язкість партій Copaxone®, 40 мг/мл, профільтрованих за зниженої температури № партії Середня в'язкість [сПа] 1 2 3 4 5 6 7 Середнє значення 5 10 Стандартне відхилення 0,000 0,008 0,010 0,012 0,004 0,021 0,016 0,007 1 2,82 2,92 2,91 2,61 2,61 2,73 2,61 2,743 1. Кожна величина являє собою середнє значення 6 окремих результатів. Величини одержували із застосуванням Rheocalc V2.5 моделі LV, веретено CP40, швидкість 80 об./хв., швидкість зсуву 600 1/с, температура 25 °C±0,1. Осмоляльність ® Вимірювали осмоляльність партій Copaxone , 20 мг/мл, профільтрованих за ® регульованої кімнатної температури, і осмоляльність партій Copaxone , 40 мг/мл, профільтрованих за зниженої температури. Зразки від кожної партії тестувати в трьох повторностях. Результати відображені в таблиці 7. Таблиця 7 Осмоляльність партій Copaxone®, 20 мг/мл, профільтрованих за регульованої кімнатної температури, і партій Copaxone®, 40 мг/мл, профільтрованих за зниженої температури № партії Дозування GA Дозування маніту Середня осмоляльність ® Copaxone , 40 мг/мл, № 1 ® Copaxone , 40 мг/мл, № 2 ® Copaxone , 40 мг/мл, № 3 ® Copaxone , 20 мг/мл, № 1 ® Copaxone , 20 мг/мл, № 2 Плацебо 15 Відносний стандарт Відхилення (RSD) 40 мг/мл 40 мг/мл 303 мосмоль/кг 40 мг/мл 40 мг/мл 300 мосмоль/кг 1,7 4 0 мг/мл 40 мг/мл 302 мосмоль/кг 2,1 20 хв. 40 мг/мл 268 мосмоль/кг 2,6 20 хв. 40 мг/мл 264 мосмоль/кг 1,2 0 мг/мл 40 мг/мл 227 мосмоль/кг 0 1 1,2 1. Розраховували з 4 вимірювань. ® З результатів видно, що осмоляльність партій Copaxone , 40 мг/мл, була цілком в межах ® діапазонів ізотонічного розчину. З результатів також видно, що партії Copaxone , 40 мг/мл, відповідають загальним межам осмоляльності парентерального лікарського продукту ® 300±30 мосмоль/кг. Крім того, результати вказують на те, що партії Copaxone , 20 мг/мл, були злегка гіпотонічними. 20 ФОРМУЛА ВИНАХОДУ 25 1. Спосіб одержання фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності, що включає етапи (i) одержання водного фармацевтичного розчину глатирамеру ацетату і маніту; (ii) фільтрування водного фармацевтичного розчину за температури від вище 0 °C до 17,5 °C з одержанням фільтрату і 16 UA 116060 C2 5 10 15 20 25 30 35 40 45 50 55 60 (iii) заповнення придатної ємності фільтратом, одержаним після виконання етапу (ii), з одержанням таким чином фармацевтичного препарату на основі глатирамеру ацетату і маніту в придатній ємності. 2. Спосіб за п. 1, де етап (ii) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр або перший фільтр і другий фільтр. 3. Спосіб за п. 2, який додатково включає етап зниження температури другого фільтра до температури від вище 0 °C до 17,5 °C. 4. Спосіб за п. 2 або п. 3, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C перед пропусканням через другий фільтр. 5. Спосіб за будь-яким із пп. 2-4, де етап (ii) фільтрування додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар. 6. Спосіб за п. 5, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C після того, як він вийшов з приймального резервуара, і перед тим, як увійшов до другого фільтра. 7. Спосіб за п. 5 або п. 6, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C під час знаходження у приймальному резервуарі. 8. Спосіб за будь-яким із пп. 2-7, який додатково включає етап зниження температури першого фільтра до температури від вище 0 °C до 17,5 °C. 9. Спосіб за будь-яким із пп. 2-8, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C перед пропусканням через перший фільтр. 10. Спосіб за будь-яким із пп. 2-9, де етап (i) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування. 11. Спосіб за п. 10, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C після того, як він вийшов з резервуара для змішування, і перед тим, як увійшов до першого фільтра. 12. Спосіб за п. 10 або п. 11, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °C до 17,5 °C під час знаходження в резервуарі для змішування. 13. Спосіб за будь-яким із пп. 2-14, де водний фармацевтичний розчин пропускають через другий фільтр зі швидкістю 3-25 л/год., переважно зі швидкістю 3-22 л/год., більш переважно зі швидкістю 3-15 л/год. або більш переважно зі швидкістю 3-10 л/год. 14. Спосіб за будь-яким із пп. 1-12, де тиск під час етапу (ii) фільтрування і тиск під час етапу (iii) заповнення підтримують нижче 5,0 бар або переважно нижче 3,0 бар. 15. Спосіб за будь-яким із пп. 1-13, де тиск під час етапу (ii) фільтрування і тиск під час етапу (iii) заповнення підтримують нижче 2,0 бар. 16. Спосіб за будь-яким із пп. 1-15, де температура водного фармацевтичного розчину становить від 0 °C до 14 °C, або температуру водного фармацевтичного розчину знижують до температури від 0 °C до 14 °C. 17. Спосіб за будь-яким із пп. 1-15, де температура водного фармацевтичного розчину становить від 0 °C до 12 °C, або температуру водного фармацевтичного розчину знижують до температури від 0 °C до 12 °C. 18. Спосіб за будь-яким із пп. 1-15, де температура водного фармацевтичного розчину становить 2-12 °C, або температуру водного фармацевтичного розчину знижують до 2-12 °C. 19. Спосіб за будь-яким із пп. 1-15, де температура водного фармацевтичного розчину становить 4-12 °C, або температуру водного фармацевтичного розчину знижують до 4-12 °C. 20. Спосіб за будь-яким із пп. 1-19, де фільтрування виконують за допомогою стерилізувального фільтра з розміром пор 0,2 мкм або менше, при цьому перший, другий або обидва фільтри є стерилізувальними фільтрами з розміром пор 0,2 мкм або менше. 21. Спосіб за будь-яким із пп. 1-20, де фармацевтичний препарат у придатній ємності являє собою водний фармацевтичний розчин, який містить 20 мг/мл глатирамеру ацетату і 40 мг/мл маніту. 22. Спосіб за будь-яким із пп. 1-20, де фармацевтичний препарат у придатній ємності являє собою водний фармацевтичний розчин, який містить 40 мг/мл глатирамеру ацетату і 40 мг/мл маніту. 23. Спосіб за будь-яким із пп. 1-22, де фармацевтичний препарат у придатній ємності являє собою водний фармацевтичний розчин зі значенням pH у діапазоні 5,5-7,0. 17 UA 116060 C2 5 10 15 20 25 30 35 40 45 50 55 24. Спосіб за будь-яким із пп. 1-23, де фармацевтичний препарат у придатній ємності являє собою водний фармацевтичний розчин, який є стерилізованим водним розчином, котрий був стерилізований за допомогою фільтрації і без піддавання водного фармацевтичного розчину дії нагрівання, хімічних речовин або опромінення. 25. Спосіб за будь-яким із пп. 1-20, де фармацевтичний препарат являє собою ліофілізований порошок на основі глатирамеру ацетату і маніту. 26. Спосіб за будь-яким із пп. 1-20 або п. 25, який додатково включає етап ліофілізації фільтрату після того, як ним була заповнена придатна ємність, для того, щоб одержати ліофілізований порошок на основі глатирамеру ацетату і маніту в придатній ємності. 27. Спосіб за будь-яким із пп. 1-26, де придатна ємність являє собою шприц, флакон, ампулу, картридж або систему для інфузій. 28. Спосіб за п. 27, де придатна ємність являє собою шприц. 29. Спосіб за п. 28, де шприц містить 1 мл водного фармацевтичного розчину. 30. Спосіб одержання попередньо заповненого шприца, який містить 1 мл водного фармацевтичного розчину, що має значення рН у діапазоні 5,5-7,0, який містить 40 мг/мл глатирамеру ацетату і 40 мг/мл маніту, що включає етапи (і) одержання водного фармацевтичного розчину глатирамеру ацетату і маніту; (іі) фільтрування водного фармацевтичного розчину за температури від вище 0 °С до 17,5 °С з одержанням фільтрату і (ііі) заповнення шприца фільтратом, одержаним після виконання етапу (іі), з одержанням таким чином попередньо заповненого шприца, який містить 1 мл водного фармацевтичного розчину, що має значення рН у діапазоні 5,5-7,0, який містить 40 мг/мл глатирамеру ацетату і 40 мг/мл маніту. 31. Спосіб за п. 30, де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр або перший фільтр і другий фільтр. 32. Спосіб за п. 31, який додатково включає етап зниження температури другого фільтра до температури від вище 0 °С до 17,5 °С. 33. Спосіб за п. 31, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С перед пропусканням через другий фільтр. 34. Спосіб за будь-яким із пп. 31-33, де етап (іі) фільтрування додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар. 35. Спосіб за п. 34, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С після того, як він вийшов із приймального резервуара, і перед тим, як увійшов до другого фільтра. 36. Спосіб за п. 34 або п. 35, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С під час знаходження в приймальному резервуарі. 37. Спосіб за будь-яким із пп. 31-36, який додатково включає етап зниження температури першого фільтра до температури від вище 0 °С до 17,5 °С. 38. Спосіб за будь-яким із пп. 31-36, який додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С перед пропусканням через перший фільтр. 39. Спосіб за будь-яким із пп. 31-38, де етап (і) одержання включає (a) змішування водного фармацевтичного розчину в резервуарі для змішування; (b) змішування водного фармацевтичного розчину в резервуарі для змішування і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С після того, як він вийшов із резервуара для змішування, і перед тим, як увійшов до першого фільтра; або (c) змішування водного фармацевтичного розчину в резервуарі для змішування і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С під час знаходження в резервуарі для змішування. 40. Спосіб за будь-яким із пп. 31-39, де водний фармацевтичний розчин пропускають через другий фільтр зі швидкістю 3-25 л/год., зі швидкістю 3-22 л/год., зі швидкістю 3-15 л/год. або зі швидкістю 3-10 л/год. 41. Спосіб за будь-яким із пп. 30-40, де тиск під час етапу (іі) фільтрування і тиск під час етану (ііі) заповнення підтримують нижче 5,0 бар або нижче 3,0 бар, або нижче 2,0 бар. 18 UA 116060 C2 5 10 15 20 25 30 35 40 45 50 55 60 42. Спосіб за будь-яким із пп. 30-41, де температура водного фармацевтичного розчину становить від 0 °С до 14 °С, або температуру водного фармацевтичного розчину знижують до температури від 0 °С до 14 °С. 43. Спосіб за будь-яким із пп. 30-41, де температура водного фармацевтичного розчину становить від 0 °С до 12 °С, або температуру водного фармацевтичного розчину знижують до температури від 0 °С до 12 °С. 44. Спосіб за будь-яким із пп. 30-41, де температура водного фармацевтичного розчину становить 2-12 °С, або температуру водного фармацевтичного розчину знижують до 2-12 °С. 45. Спосіб за будь-яким із пп. 30-41, де температура водного фармацевтичного розчину становить 4-12 °С, або температуру водного фармацевтичного розчину знижують до 4-12 °С. 46. Спосіб за будь-яким із пп. 31-45, де фільтрування виконують за допомогою стерилізувального фільтра з розміром пор 0,2 мкм або менше, при цьому перший, другий або обидва фільтри є стерилізувальними фільтрами з розміром пор 0,2 мкм або менше. 47. Спосіб за будь-яким із пп. 30-46, де водний фармацевтичний розчин у попередньо заповненому шприці являє собою стерилізований водний розчин, котрий був стерилізований за допомогою фільтрації і без піддавання водного фармацевтичного розчину дії нагрівання, хімічних речовин або опромінення. 48. Спосіб за п. 1 або п. 30, де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, де водний фармацевтичний розчин фільтрують через другий фільтр за температури від вище 0 °С до 17,5 °С. 49. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, і де водний фармацевтичний розчин фільтрують через другий фільтр за температури від вище 0 °С до 17,5 °С; де етап (іі) фільтрування додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар, і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С під час знаходження в приймальному резервуарі; і де спосіб додатково включає зниження температури другого фільтра до температури від вище 0 °С до 17,5 °С. 50. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, і де водний фармацевтичний розчин фільтрують через другий фільтр за температури від вище 0 °С до 17,5 °С; де етап (іі) фільтрування додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар, і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С після того, як він вийшов із приймального резервуара, і перед тим, як увійшов до другого фільтра; і де спосіб додатково включає зниження температури другого фільтра до температури від вище 0 °С до 17,5 °С. 51. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С під час знаходження в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, і де водний фармацевтичний розчин фільтрують через перший і другий фільтр за температури від вище 0 °С до 17,5 °С; де спосіб додатково включає етап зниження температури першого фільтра до температури від вище 0 °С до 17,5 °С; і де спосіб додатково включає етап зниження температури другого фільтра до температури від вище 0 °С до 17,5 °С. 52. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, і де водний фармацевтичний розчин фільтрують через перший і другий фільтр за температури від вище 0 °С до 17,5 °С; де спосіб додатково включає етап зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С перед пропусканням через перший фільтр; де спосіб додатково включає етап зниження температури першого фільтра до температури від вище 0 °С до 17,5 °С; і де спосіб додатково включає етап зниження температури другого фільтра до температури від вище 0 °С до 17,5 °С. 53. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, і де 19 UA 116060 C2 5 10 15 20 водний фармацевтичний розчин фільтрують через другий фільтр за температури від вище 0 °С до 17,5 °С; де етап (іі) фільтрування додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар; і де спосіб додатково включає зниження температури другого фільтра до температури від вище 0 °С до 17,5 °С. 54. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр, і де водний фармацевтичний розчин фільтрують через другий фільтр за температури від вище 0 °С до 17,5 °С; і де спосіб додатково включає етап зниження температури другого фільтра до температури від вище 0 °С до 17,5 °С. 55. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С під час знаходження в резервуарі для змішування; і де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр. 56. Спосіб за п. 1 або п. 30, де етап (і) одержання включає змішування водного фармацевтичного розчину в резервуарі для змішування; де етап (іі) фільтрування включає фільтрування водного фармацевтичного розчину через перший фільтр і другий фільтр; де етап (іі) фільтрування додатково включає етап одержання водного фармацевтичного розчину, профільтрованого через перший фільтр у приймальний резервуар, і зниження температури водного фармацевтичного розчину до температури від вище 0 °С до 17,5 °С під час знаходження в приймальному резервуарі. 20 UA 116060 C2 21 UA 116060 C2 22 UA 116060 C2 Комп’ютерна верстка А. Крижанівський Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 23
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for manufacturing glatiramer acetate product
Автори англійськоюCohen, Rakefet, Habbah, Sasson, Safadi, Muhammad
Автори російськоюКохен Ракефет, Хаббах Сассон, Сафади Мухаммад
МПК / Мітки
МПК: A61M 5/178, A61K 47/10, A61K 38/16, A61K 9/08
Мітки: глатирамеру, спосіб, ацетату, основі, продукту, одержання
Код посилання
<a href="https://ua.patents.su/25-116060-sposib-oderzhannya-produktu-na-osnovi-glatirameru-acetatu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання продукту на основі глатирамеру ацетату</a>
Попередній патент: Спосіб обробки металу в сталерозливному ковші
Наступний патент: Спосіб одержання мікро-мезопористих алюмосилікатів на основі цеоліту zsm-5
Випадковий патент: 3-оксифеніламід 5-ізопропіл-2-(1,3,4-тіадіазоліл) сукцинамінової кислоти, який проявляє діуретичну, антиоксидантну та протизапальну активність