Інгібітори реплікації респіраторно-синцитіального вірусу
Номер патенту: 74787
Опубліковано: 15.02.2006
Автори: Янссенс Франс Едуард, Андріес Конрад Жозеф Людовик Марсель, Меерсман Катлін Петрус Марі-Хосе, Соммен Франсуа Марія
Формула / Реферат
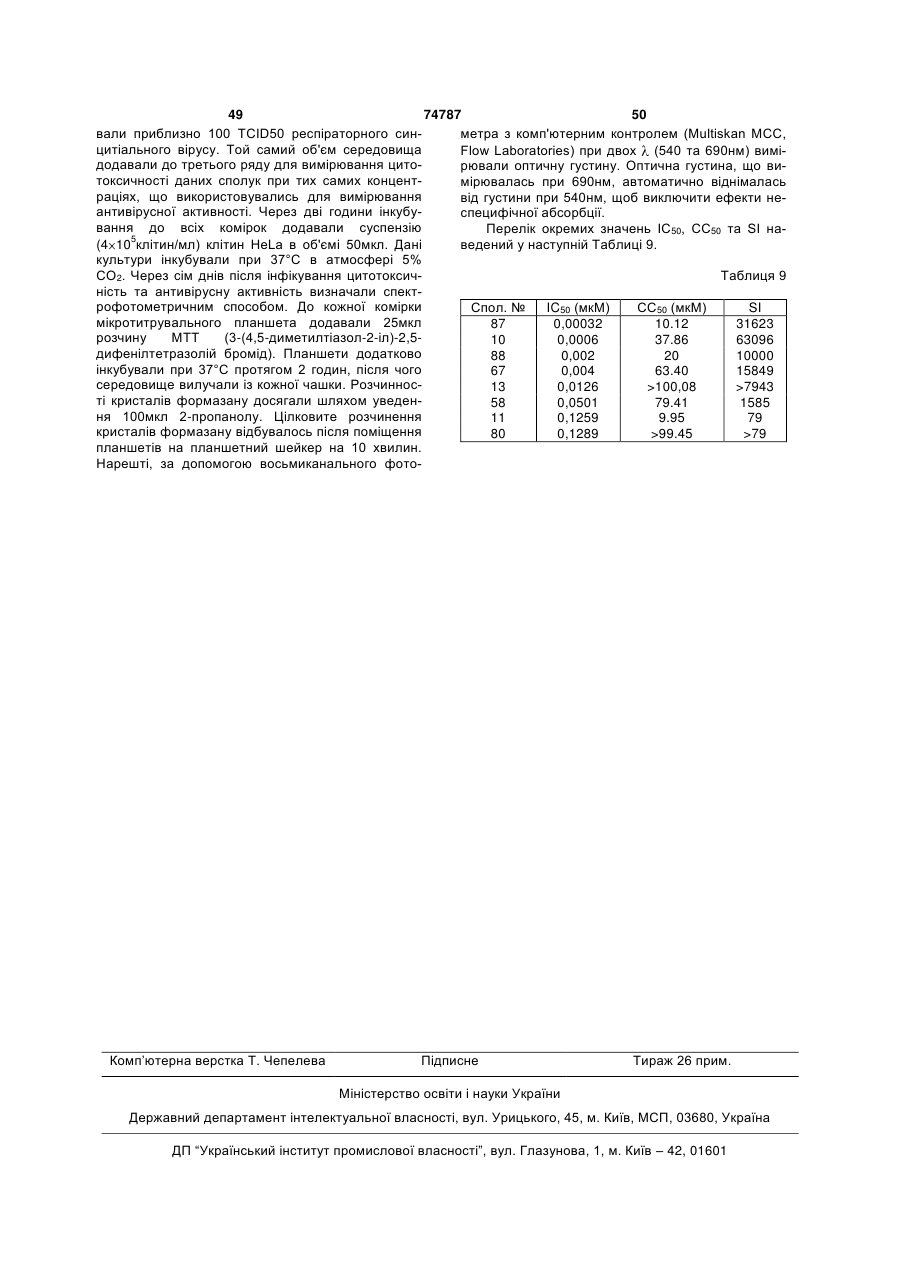
1. Сполука формули
 , (I)
, (I)
її промедикамент, N-оксид, сіль приєднання, четвертинний амін, металічний комплекс або
стереохімічна ізомерна форма, де
-а1=а2=а3=а4- являє собою бівалентний радикал формули
-СН=СН-СН=СН- (а-1);
-N=CH-CH=CH- (а-2);
-CH-N-CH=CH- (а-3);
-CH-CH-N=H- (а-4) або
-CH=CH-CH=N- (а-5);
де кожен атом водню у радикалах (а-1), (а-2), (а-3), (а-4) та (а-5) може бути замінений, при потребі, гало, С1-6алкілом, нітро, аміно, гідрокси, С1-6алкілокси, полігалоС1-6алкілом, карбоксилом, аміноС1-6алкілом, моно- або ді(С1-4алкіл)аміноС1-6алкілом, С1-6алкілоксикарбонілом, гідроксіС1-6алкілом або радикалом формули
 ,
,
де =Z є =O, =CH-C(=O)-NR5aR5b, =CH2, =СН-С1-6алкілом, =N-OH або =N-O-C1-6aлкілом;
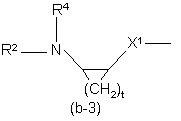
Q є радикалом формули
 ,
, 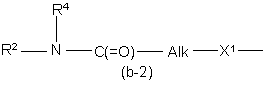 ,
,
 ,
, 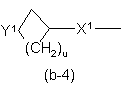 ,
,
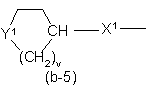 ,
, 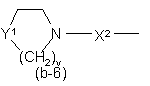 ,
,
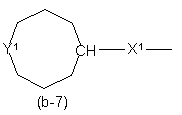 ,
, 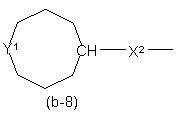 ,
,
де Alk являє собою С1-6алкандіїл;
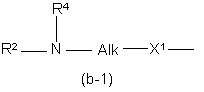
Y1 являє собою бівалентний радикал формули -NR2- або CH(NR2R4)-;
X1 являє собою NR4, S, S(=O), S(=O)2, О, СН2, С(=O), С(=СН2), СН(ОН), СН(СН3), СН(ОСН3), СН(SСН3), CH(NR5aR5b), CH2-NR4 aбo NR4-CH2;
X2 являє собою прямий зв'язок, СН2, С(=O), NR4, С1-4алкіл-NR4, NR4-C1-4алкіл;
t є 2, 3, 4 або 5;
u є 1, 2, 3, 4 або 5;
v є 2 або 3; і де кожен атом водню у Alk та карбоциклах і гетероциклах, що визначені у
радикалах (b-3), (b-4), (b-5), (b-6), (b-7) та (b-8), може бути при потребі замінений на
R3; за умови, що коли R3 являє собою гідрокси або С1-6алкілокси, R3 не може замінювати
атом водню у ![]() - положенні відносно атома азоту;
- положенні відносно атома азоту;
G є С1-10алкадіїлом, заміщений одним або більше гідрокси, С1-6алкілокси, арилС1-6алкілокси, С1-6алкілтіо, арилС1-6алкілтіо, НО(-СН2-СН2-O)n-, С1-6алкілокси-(-СН2-СН2-O)n- чи арилС1-6алкілокси(-СН2-СН2-O)n-;
R1 являє собою моноциклічний гетероцикл чи арил; цей гетероцикл вибирається із піперидинілу, піперазинілу, піридилу, піразинілу, піридазинілу, піримідинілу, піролілу, фуранілу, тетрагідрофуранілу, тієнілу, оксазолілу, тіазолілу, імідазолілу, піразолілу, ізоксазолілу, оксадіазолілу та ізотіазолілу; і кожен гетероцикл може бути заміщений, при потребі, 1 або, де це можливо, більшою кількістю, такою як 2, 3 або 4, замісників, що вибираються із гало, гідрокси, аміно, ціано, карбокси, С1-6алкілу, С1-6алкілокси, С1-6алкілтіо, С1-6алкілоксіС1-6алкілу, арилу, арилС1-6алкілу, арилС1-6алкілокси, гідроксіС1-6алкілу, моно- або ді(С1-6алкіл)аміно, моно- або ді(С1-6алкіл)аміноС1-6алкілу, полігалоС1-6алкілу, С1-6алкілкарбоніламіно, C1-6aлкiл-SO2-NR5c-, арил-SO2-NR5c-, С1-6алкілоксикарбонілу, -C(=O)-NR5CR5d, НО(-СН2-СН2-O)n-, гало(-СН2-СН2-O)n-, С1-6алкілокси(-СН2-СН2-O)n- арилС1-6алкілокси(-СН2-СН2-O)n-, та моно- або ді(С1-6алкіл)аміно(-СН2-СН2-O)n-;
кожне n є, незалежно, 1, 2, 3 або 4;
R2 являє собою водень, форміл, С1-6алкілкарбоніл, Гет-карбоніл, піролідиніл, піперидиніл, гомопіперидиніл, С3-7циклоалкіл, заміщений N(R6)2, або С1-10алкіл, заміщений N(R6)2, і, при потребі, другим, третім або четвертим замісниками, що вибираються із аміно, гідрокси, С3-7циклоалкілу, С2-5алкандіїлу, піперидинілу, моно- або ді (С1-6алкіл)аміно, С1-6алкілоксикарбоніламіно, арилу та арилокси;
R3 являє собою водень, гідрокси, С1-6алкіл, С1-6алкілокси, арилС1-6алкіл або арилС1-6алкілокси;
R4 являє собою водень, С1-6алкіл або арилС1-6алкіл;
кожна із груп R5a, R5b, R5c та R5d є, незалежно, воднем або С1-6алкілом; або
R5a та R5b, або R5c та R5d утворюють разом бівалентний радикал формули -(СH2)s-, де s дорівнює 4 або 5;
R6 являє собою водень, С1-4алкіл, форміл, гідроксіС1-6алкіл, С1-6алкілкарбоніл або С1-6алкілоксикарбоніл;
арил являє собою феніл або феніл, заміщений 1 або більшою кількістю, такою як 2, 3 або 4, замісників, що вибираються із гало, гідрокси, С1-6алкілу, гідроксіС1-6алкілу, полігалоС1-6алкілу та С1-6алкілокси;
Гет являє собою піридил, піримідиніл, піразиніл, піридазиніл.
2. Сполука згідно п.1, яка відрізняється тим, що –а1=а2=а3=а4- є радикалом формули (а-1) чи (а-2).
3. Сполука згідно пп.1 чи 2, яка відрізняється тим, що феніл довільно заміщується гало,
С1-6алкілом чи С1-4алкілокси; чи піридил довільно заміщується з 1 чи більше замісниками вибраними з арилС1-6алкілокси, С1-6алкілоксіС1-6алкілу, арил, моно- чи ді(С1-6алкіл)аміно, C(=O)-NR5CR5d, гало чи С1-6алкілу.
4. Сполука згідно з будь-яким з пп.1-3, яка відрізняється тим, що G є С1-4 алкадіїлом, заміщеним гідрокси, С1-6алкілокси, НО(-СН2-СН2-O)n-, С1-6алкілокси(-СН2-СН2-O)n- чи арилС1-6алкілокси(-СН2-СН2-O)n-.
5. Сполука згідно з будь-яким з пп.1-4, яка відрізняється тим, що Q є радикалом формули (b-5), де v є 2 та Y1 є -NR2-.
6. Сполука згідно з будь-яким з пп.1-5, яка відрізняється тим, що X1 є NH чи СН2.
7. Сполука згідно з будь-яким з пп.1-6, яка відрізняється тим, що R2 є воднем або С1-10алкілом, заміщеним з NHR6, де R6 є воднем або С1-6 алкілоксикарбонілом.
8. Сполука згідно з п. 1, яку вибирають з групи:
[(А),(S)]-N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]-1-[(6-бромо-2-піридиніл)-етоксиметил]-1Н-бензімідазол-2-амін;
[(A),(S)]-N-[1-(2-амінопропіл)-4-піперидиніл]-1-[етоксі(6-метил-2-піридиніл)метил]-1Н-бензімідазол-2-амін;
(±)N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]-1-[(2-метоксіетокси)(6-метил-2-піридиніл)метіл]-1Н-бензімідазол-2-амін;
N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]-6-хлоро-1-[(2-метоксіетокси)(6-метил-2-піридиніл)метил]-4-метил-1Н-бензімідазол-2-амінотригідрохлориду тригідрат;
[(A),(R)]-N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]-1-[етокси(6-метил-2-піридиніл)метил]-1Н-бензімідазол-2-аміномоногідрат;
(±)-N-[1-(2-амінопропіл)-4-піперидиніл]-1-[етокси(6-метил-2-тридиніл)метил]-1Н-бензімідазол-2-амін;
[(A),(S)]-N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]-1-[етокси(6-метил]-2-метил-піридиніл)метил]-1Н-бензімідазол-2-аміномоногідрат;
N-[1-(2-аміноетил)-4-піперидиніл]-1-[[3-(2-хлороетокси)-6-метил-2-піридиніл]метил]-1Н-бензімідазол-2-амін;
[(A),(R)]-N-[1-(2-амінопропіл)-4-піперидиніл]-1-[етокси(6-метил-2-піридиніл)метил]-1Н-бензімідазол-2-аміномоногідрат;
(±)-N-[1-(2-аміноетил)-4-піридиніл]-1-[(6-бромо-2-піридиніл)етоксиметил]-2-бензімідазол-2-амін;
(±)-N-[1-(2-аміно-3-метилбутил)-4-піридиніл]-1-[етокси)(6-метил-2-піридиніл)метил]-1Н-бензімідазолімідазо[4,5-б]піридиніл-2-амін;
[(В),(S)]N-[1-(2-амінопропіл)-4-піридиніл]-1-[етокси(6-метил-2-піридиніл)метил]-1Н-бензімідазол-2-аміномоногідрат;
(±)-N-[1-(2-аміно-3-метилбутил)-4-піридиніл]-3-[(2-метоксіетокси)(6-метил-2-піридиніл)метил]-7-метил-3Н-імідазо[4,5-б]піридиніл-2-аміно;
(±)-N-[1-(2-аміно-3-метилбутил)-4-піридиніл]-1-[(2-етоксіетокси)(6-метил-2-піридиніл)метил]-1Н-бензімідазол-2-амін;
(±)-N-[1-(2-аміноетіл)-4-піридиніл]-1-[(2-метоксіетокси)(6-метил-2-піридиніл)метил]-1Н-бензімідазол-2-амін;
(±)-N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]-1-[(6-бромо-2-піридиніл)етоксиметил]-4-метил-1Н-бензімідазол-2-аміномоногідрат;
[(А),(R)]-N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]-1-[(6-бромо-2-піридиніл)етоксиметил]-1Н-бензімідазол-2-амін;
(±)-N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]-1-[(6-бромо-2-піридиніл)етоксиметил]-1Н-бензімідазол-2-амін;
їх промедикаментів, N-оксидів, солей приєднання, четвертинних амінів, металічних комплексів та стереохімічно ізомерних форм.
9. Сполука згідно з будь-яким із п.1 або п. 8, яка відрізняється тим, що використовується як медикамент.
10. Фармацевтична композиція, що містить фармацевтично прийнятний носій і як активний
інгредієнт терапевтично активну кількість сполуки згідно з пп. 1-8.
11. Спосіб одержання композиції за п. 10, який відрізняється тим, що фармацевтично прийнятний носій ретельно змішується з терапевтично ефективною кількістю сполуки згідно з п. 1 або п. 8.
12. Проміжна сполука формули
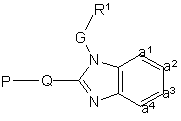 , (IV)
, (IV)
де R1, G та –а1=а2=а3=а4- такі, як визначено в п.1, Р є захисною групою, і Q1 зазначено як Q згідно з п.1 за умов, що замісники R2 або R6 - видалені.
13. Проміжна сполука формули
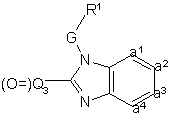 , (IX)
, (IX)
де R1, G та –а1=а2=а3=а4- такі, як визначено в п.1, і (O=)Q3 є карбонілпохідним від Q, - зазначене Q визначається згідно з п.1, за умови, що замісники -NR2 R4 або –NR2 - видалені.
14. Проміжна сполука формули
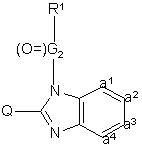 , (XXII)
, (XXII)
де R1, Q та –а1=а2=а3=а4- такі, як визначено в п.1, і (O=)G2 є карбонілпохідним від G, зазначене G визначається згідно п.1.
15. Спосіб одержання сполуки згідно з п. 1, який відрізняється тим, що
включає амінування проміжної сполуки формули (IX)
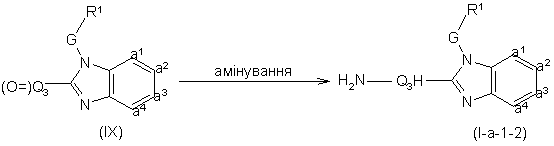 ,
,
де R1, G та –а1=а2=а3=а4- такі, як визначено в п. 2, і H2N-Q3H визначено як Q згідно з п. 2, за умови, що обидва R6 замісники є воднем, або R2 та R4 є обидва воднем, і вуглецевий атом суміжний з азотом, що несе R6, або R2 та R4 замісники містять принаймні один водень, у присутності придатного агента амінування,
і, при потребі, перетворення сполук формули (І) одна в одну з використанням відомих у даній галузі методів трансформації, і, крім того, при потребі, перетворення сполук формули (І) у терапевтично активну нетоксичну кислу сіль приєднання шляхом обробки кислотою, або у терапевтично активну нетоксичну основну сіль приєднання шляхом обробки основою, або, навпаки, перетворення кислої сольової форми у вільну основу шляхом обробки лугом, або перетворення основної солі приєднання у вільну кислоту шляхом обробки кислотою; та, при потребі, одержання їх стереохімічно ізомерних форм, металічних комплексів, четвертинних амінів або N-оксидних форм.
16. Продукт, що містить (а) сполуку згідно з п.1 та (б) іншу антивірусну сполуку, як комбінований препарат для одночасного, окремого або послідовного застосування у лікуванні або запобіганні вірусним інфекціям.
17. Фармацевтична композиція, що містить фармацевтично прийнятний носій і як активні інгредієнти (а) сполуку згідно з п.1 та (б) іншу антивірусну сполуку.
Текст
1. Сполука формули 2 3 74787 4 v є 2 або 3; і де кожен атом водню у Alk та карбоС1-6алкілом чи С1-4алкілокси; чи піридил довільно циклах і гетероциклах, що визначені у заміщується з 1 чи більше замісниками вибраними радикалах (b-3), (b-4), (b-5), (b-6), (b-7) та (b-8), з арилС1-6алкілокси, С1-6алкілоксіС1-6алкілу, арил, може бути при потребі замінений на моно- чи ді(С1-6алкіл)аміно, C(=O)-NR5CR5d, гало 3 3 R ; за умови, що коли R являє собою гідрокси або чи С1-6алкілу. 3 4. Сполука згідно з будь-яким з пп.1-3, яка відрізС1-6алкілокси, R не може замінювати няється тим, що G є С1-4 алкадіїлом, заміщеним атом водню у - положенні відносно атома азоту; гідрокси, С1-6алкілокси, НО(-СН2-СН2-O)n-, С1G є С1-10алкадіїлом, заміщений одним або більше чи арилС1-6алкілокси(6алкілокси(-СН2-СН2-O)nгідрокси, С1-6алкілокси, арилС1-6алкілокси, С1СН2-СН2-O)n-. 6алкілтіо, арилС1-6алкілтіо, НО(-СН2-СН2-O)n-, С15. Сполука згідно з будь-яким з пп.1-4, яка відріз6алкілокси-(-СН2-СН2-O)n- чи арилС1-6алкілокси(няється тим, що Q є радикалом формули (b-5), де СН2-СН2-O)n-; v є 2 та Y1 є -NR2-. R1 являє собою моноциклічний гетероцикл чи 6. Сполука згідно з будь-яким з пп.1-5, яка відрізарил; цей гетероцикл вибирається із піперидинілу, няється тим, що X1 є NH чи СН2. піперазинілу, піридилу, піразинілу, піридазинілу, 7. Сполука згідно з будь-яким з пп.1-6, яка відрізпіримідинілу, піролілу, фуранілу, тетрагідрофураняється тим, що R2 є воднем або С1-10алкілом, нілу, тієнілу, оксазолілу, тіазолілу, імідазолілу, заміщеним з NHR6, де R6 є воднем або С1-6 алкілопіразолілу, ізоксазолілу, оксадіазолілу та ізотіазоксикарбонілом. лілу; і кожен гетероцикл може бути заміщений, при 8. Сполука згідно з п.1, яку вибирають з групи: потребі, 1 або, де це можливо, більшою кількістю, [(А),(S)]-N-[1-(2-аміно-3-метилбутил)-4такою як 2, 3 або 4, замісників, що вибираються із піперидиніл]-1-[(6-бромо-2-піридиніл)гало, гідрокси, аміно, ціано, карбокси, С1-6алкілу, етоксиметил]-1Н-бензімідазол-2-амін; С1-6алкілокси, С1-6алкілтіо, С1-6алкілоксіС1-6алкілу, [(A),(S)]-N-[1-(2-амінопропіл)-4-піперидиніл]-1арилу, арилС1-6алкілу, арилС1-6алкілокси, гідрок[етоксі(6-метил-2-піридиніл)метил]-1НсіС1-6алкілу, моно- або ді(С1-6алкіл)аміно, монобензімідазол-2-амін; або ді(С1-6алкіл)аміноС1-6алкілу, полігалоС1(±)N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]-1С1-6алкілкарбоніламіно, C1-6aлкiл-SO26алкілу, [(2-метоксіетокси)(6-метил-2-піридиніл)метіл]-1НNR5c-, арил-SO2-NR5c-, С1-6алкілоксикарбонілу, бензімідазол-2-амін; C(=O)-NR5CR5d, НО(-СН2-СН2-O)n-, гало(-СН2-СН2N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]-6O)n-, С1-6алкілокси(-СН2-СН2-O)nарилС1хлоро-1-[(2-метоксіетокси)(6-метил-2алкілокси(-СН2-СН2-O)n-, та моно- або ді(С16 піридиніл)метил]-4-метил-1Н-бензімідазол-26алкіл)аміно(-СН2-СН2-O)n-; амінотригідрохлориду тригідрат; кожне n є, незалежно, 1, 2, 3 або 4; [(A),(R)]-N-[1-(2-аміно-3-метилбутил)-4R2 являє собою водень, форміл, С1-6алкілкарбоніл, піперидиніл]-1-[етокси(6-метил-2-піридиніл)метил]Гет-карбоніл, піролідиніл, піперидиніл, гомопіпе1Н-бензімідазол-2-аміномоногідрат; ридиніл, С3-7циклоалкіл, заміщений N(R6)2, або С16 (±)-N-[1-(2-амінопропіл)-4-піперидиніл]-1-[етокси(610алкіл, заміщений N(R )2, і, при потребі, другим, метил-2-тридиніл)метил]-1Н-бензімідазол-2-амін; третім або четвертим замісниками, що вибирають[(A),(S)]-N-[1-(2-аміно-3-метилбутил)-4ся із аміно, гідрокси, С3-7циклоалкілу, С2піперидиніл]-1-[етокси(6-метил]-2-метилпіперидинілу, моно- або ді (С15алкандіїлу, піридиніл)метил]-1Н-бензімідазол-26алкіл)аміно, С1-6алкілоксикарбоніламіно, арилу та аміномоногідрат; арилокси; N-[1-(2-аміноетил)-4-піперидиніл]-1-[[3-(2R3 являє собою водень, гідрокси, С1-6алкіл, С1хлороетокси)-6-метил-2-піридиніл]метил]-1Н6алкілокси, арилС1-6алкіл або арилС1-6алкілокси; бензімідазол-2-амін; R4 являє собою водень, С1-6алкіл або арилС1[(A),(R)]-N-[1-(2-амінопропіл)-4-піперидиніл]-16алкіл; [етокси(6-метил-2-піридиніл)метил]-1Нкожна із груп R5a, R5b, R5c та R5d є, незалежно, водбензімідазол-2-аміномоногідрат; нем або С1-6алкілом; або (±)-N-[1-(2-аміноетил)-4-піридиніл]-1-[(6-бромо-2R5a та R5b, або R5c та R5d утворюють разом бівалепіридиніл)етоксиметил]-2-бензімідазол-2-амін; нтний радикал формули -(СH2)s-, де s дорівнює 4 (±)-N-[1-(2-аміно-3-метилбутил)-4-піридиніл]-1або 5; [етокси)(6-метил-2-піридиніл)метил]-1НR6 являє собою водень, С1-4алкіл, форміл, гідрокбензімідазолімідазо[4,5-б]піридиніл-2-амін; сіС1-6алкіл, С1-6алкілкарбоніл або С1[(В),(S)]N-[1-(2-амінопропіл)-4-піридиніл]-16алкілоксикарбоніл; [етокси(6-метил-2-піридиніл)метил]-1Нарил являє собою феніл або феніл, заміщений 1 бензімідазол-2-аміномоногідрат; або більшою кількістю, такою як 2, 3 або 4, заміс(±)-N-[1-(2-аміно-3-метилбутил)-4-піридиніл]-3-[(2ників, що вибираються із гало, гідрокси, С1-6алкілу, метоксіетокси)(6-метил-2-піридиніл)метил]-7гідроксіС1-6алкілу, полігалоС1-6алкілу та С1метил-3Н-імідазо[4,5-б]піридиніл-2-аміно; 6алкілокси; (±)-N-[1-(2-аміно-3-метилбутил)-4-піридиніл]-1-[(2Гет являє собою піридил, піримідиніл, піразиніл, етоксіетокси)(6-метил-2-піридиніл)метил]-1Нпіридазиніл. бензімідазол-2-амін; 2. Сполука згідно п.1, яка відрізняється тим, що – (±)-N-[1-(2-аміноетіл)-4-піридиніл]-1-[(2а1=а2=а3=а4- є радикалом формули (а-1) чи (а-2). метоксіетокси)(6-метил-2-піридиніл)метил]-1Н3. Сполука згідно пп.1 чи 2, яка відрізняється бензімідазол-2-амін; тим, що феніл довільно заміщується гало, 5 74787 6 (±)-N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]-1де R1, Q та –а1=а2=а3=а4- такі, як визначено в п.1, і [(6-бромо-2-піридиніл)етоксиметил]-4-метил-1Н(O=)G2 є карбонілпохідним від G, зазначене G вибензімідазол-2-аміномоногідрат; значається згідно п.1. [(А),(R)]-N-[1-(2-аміно-3-метилбутил)-415. Спосіб одержання сполуки згідно з п.1, який відрізняється тим, що піперидиніл]-1-[(6-бромо-2-піридиніл)етоксиметил]1Н-бензімідазол-2-амін; включає амінування проміжної сполуки формули (±)-N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]-1(IX) R1 R1 [(6-бромо-2-піридиніл)етоксиметил]-1НG G бензімідазол-2-амін; a1 a1 N N a2 a2 амінування їх промедикаментів, N-оксидів, солей приєднання, H2N Q3H (O=)Q3 a3 a3 четвертинних амінів, металічних комплексів та N N a4 a4 стереохімічно ізомерних форм. (IX) (I-a-1-2) , 9. Сполука згідно з будь-яким із п.1 або п.8, яка де R1, G та –а1=а2=а3=а4- такі, як визначено в п.2, і відрізняється тим, що використовується як медиH2N-Q3H визначено як Q згідно з п.2, за умови, що камент. обидва R6 замісники є воднем, або R2 та R4 є оби10. Фармацевтична композиція, що містить фардва воднем, і вуглецевий атом суміжний з азотом, мацевтично прийнятний носій і як активний що несе R6, або R2 та R4 замісники містять приінгредієнт терапевтично активну кількість сполуки наймні один водень, у присутності придатного агезгідно з пп.1-8. нта амінування, 11. Спосіб одержання композиції за п.10, який віді, при потребі, перетворення сполук формули (І) різняється тим, що фармацевтично прийнятний одна в одну з використанням відомих у даній галуносій ретельно змішується з терапевтично ефекзі методів трансформації, і, крім того, при потребі, тивною кількістю сполуки згідно з п.1 або п.8. перетворення сполук формули (І) у терапевтично 12. Проміжна сполука формули активну нетоксичну кислу сіль приєднання шляхом R1 обробки кислотою, або у терапевтично активну G a1 нетоксичну основну сіль приєднання шляхом обN a2 Q робки основою, або, навпаки, перетворення кислої P a3 N сольової форми у вільну основу шляхом обробки a4 , (IV) лугом, або перетворення основної солі приєднанде R1, G та –а1=а2=а3=а4- такі, як визначено в п.1, ня у вільну кислоту шляхом обробки кислотою; та, Р є захисною групою, і Q1 зазначено як Q згідно з при потребі, одержання їх стереохімічно ізомерних п.1 за умов, що замісники R2 або R6 - видалені. форм, металічних комплексів, четвертинних амінів 13. Проміжна сполука формули або N-оксидних форм. R1 16. Продукт, що містить (а) сполуку згідно з п.1 та G a1 (б) іншу антивірусну сполуку, як комбінований преN 2 a парат для одночасного, окремого або послідовно(O=)Q3 3 a N го застосування у лікуванні або запобіганні вірусa4 , (IX) ним інфекціям. 1 1 2 3 4 де R , G та –а =а =а =а - такі, як визначено в п.1, і 17. Фармацевтична композиція, що містить фар(O=)Q3 є карбонілпохідним від Q, - зазначене Q мацевтично прийнятний носій і як активні інгредієвизначається згідно з п.1, за умови, що замісники нти (а) сполуку згідно з п.1 та (б) іншу антивірусну 2 4 2 NR R або –NR - видалені. сполуку. 14. Проміжна сполука формули R1 (O=)G2 N a1 Q N a2 a3 a4 , (XXII) Даний винахід стосується бензимідазолів та імідазопіридинів, що мають антивірусну активність, зокрема, інгібіторну активність щодо реплікації респіраторного синцитіального вірусу. Крім того, даний винахід стосується їх одержання та композицій, що включають ці сполуки, і також їх застосування як медикаментів. Респіраторний синцитіальний вірус людини (RSV) є великим РНК вірусом, що належить до родини параміксовірусів, підродини пневмовірусів разом з бичачим RSV вірусом. RSV людини спричиняє у людей будь-якого віку у світі цілий спектр хвороб дихальних шляхів. Він є головною причиною захворювання нижніх дихальних шляхів у немовлят та дітей. Більше половини всіх немовлят потерпають від RSV протягом першого року життя і майже всі на протязі перших двох років. Дана інфекція може спричинити у дітей ураження легенів, що зберігається протягом років і може сприяти виникненню хронічної легеневої хвороби у подальші роки (хронічний стридор, астма). Діти старшого віку та дорослі часто потерпають при RSV інфікуванні від (важкої) нежиті. У літньому віці чутливість до даного вірусу знову зростає, і RSV був 7 74787 8 причетним до ряду спалахів пневмонії у літніх люде =Z є =0, =CH-C(=O)-NR5aR5b, =CH2, =СН-С1дей, що спричинило значну смертність. 6алкілом, =N-OH або =N-O- С1-6алкілом; Q є радиІнфікування вірусом з даної підгрупи не захикалом формули щає від повторного інфікування RSV культурою з тієї самої підгрупи у наступний зимовий період. Таким чином, повторне інфікування RSV є звичайним, незважаючи на існування лише двох підтипів, А та В. На теперішній час лише три лікарських препарати були ухвалені для застосування проти RSV інфекції: Рибавірин, аналог нуклеозиду, призначено для аерозольного лікування тяжких RSV інфекде Alk є С1-6алкандіїлом; цій у дітей, підданих госпіталізації. Аерозольна Y1 є бівалентним радикалом формули –NR2схема застосування, токсичність (ризик тератогенабо CH(NR2R4)-; ності), висока вартість та варіююча у широких меX1 є NR4, S, S(=O), S(=O)2, О, CH2, C(=O), жах ефективність обмежують його застосування. C(=CH2), CH(OH), СН(СН3), Два інших препарати, респігам (RespiGam®) та СН(ОСН3), CH(SCH3), CH(NR5aR5b), CH2-NR4 палівізумаб, імуностимулятори поліклонального та або NR4-CH2; моноклонального антитіл, призначені для викорисХ2 є прямим зв'язком, СН2, С(=О), NR4, С1тання як запобіжні засоби. 4 4 6алкіл-NR , NR -С1-6алкілом; Інші спроби розробити безпечну та ефективну t є 2, 3, 4 або 5; RSV вакцину не дали позитивного результату. u є 1, 2, 3, 4 або 5; Інактивовані вакцини не давали захисту від інфекν є 2 або 3 і де кожен атом водню у Alk та карції, і у деяких випадках фактично підсилювали боциклах і гетероциклах, що визначені у хворобу під час наступного інфікування. Атенуйорадикалах (b-3), (b-4), (b-5), (b-6), (b-7) та (b-8), вані вакцини випробувались з обмеженим успіхом. може бути при потребі замінений на Очевидно, що є потреба у ефективних нетоксичR3; за умови, що коли R є гідрокси або С1них ліках проти реплікації RSV, що легко застосо3 6алкілокси, R не може замінювати атом водню у α вувати. положенні відносно атому азоту; [Патенти ЕР-А-0,005,138, ЕР-А-0,099,139, ЕРG є прямим зв'язком або С1-10алкандіїлом; А-0,145,037, ЕР-А-0,144,101, ЕР-А-0,151,826, ЕРR1 є моноциклічним гетероциклом, що вибираА-0,151,824, ЕР-А-0,232,937, ЕР-А-0,295,742, ЕР ється з піперидинілу, піперазинілу, піридилу, піра0,297,661, ЕР-А-0,307,014, WO 9201697] описують зинілу, піридазинілу, піримідинілу, фуранілу, тетбензимідазол- та імідазопіридин-заміщені похідні рагідрофуранілу, тієнілу, піролілу, тіазолілу, піперидину та піперазину як антигістамінні та прооксазолілу, імідазолілу, ізоксазолілу, піразолілу тиалергічні засоби або антагоністи серотоніну. ізотіазолілу та оксадіазолілу; і кожен гетероцикл Даний винахід стосується використання сполуможе бути заміщено, при потребі, 1 або, де це моки для виробництва медичного препарату для ліжливо, більшою кількістю, такою як 2, 3 або 4, закування вірусної інфекції, де дана сполука є спомісників, що вибираються із гало, гідрокси, аміно, лукою формули ціано, карбокси, С1-6алкілу, С1-6алкілокси, С16алкілтіо, С1-6алкілоксиС1-6алкілу, арилу, арилС16алкілу, арил С1-6алкілокси, гідроксиС1-6алкілу, мо(I) но- або ди(С1-6алкіл)аміно, моно- або ди (С1полігалоС1-6алкілу, С16алкіл)аміноС1-6алкілу, С1-6aлкiл-SO2-NR5с-, арил6алкілкарбоніламіно, її промедикаментом, N-оксидом, сіллю приєднанSO2-NR5c-, С1-6алкілоксикарбонілу, -C(=O)-NR5cR5d, ня, четвертинним аміном, металевим комплексом HO(-CH2-CH2-O)n-, гало(-СН2-СН2-О)n-, С1та стереохімічною ізомерною формою, де –а1=а26алкілокси(-СН2-СН2-О)n-, арилС1-6алкілокси(-СН23 4 а =а - є бівалентним радикалом формули СН2-О)n-, та моно- або ди (С1-6алкіл)аміно(-СН2СН2-О)n-; кожне n є, незалежно, 1, 2, 3 або 4; R2 є воднем, формілом, С1-6алкілкарбонілом, Геткарбонілом, піролідинілом, піперидинілом, гомопіперидинілом, С3-7циклоалкілом, заміщеним N(R6)2, або С1-10алкілом, заміщеним N(R6)2 і, при потребі, другим, третім або четвертим замісником, що вибирається з аміно, гідрокси, С3-7циклоалкілу, де кожен атом водню у радикалах (а-1), (а-2), С2-5алкандіілу, піперидинілу, моно- або ди (С1(а-3), (а-4) та (а-5) може бути замінено, при потре6алкіл)аміно, С1-6алкілоксикарбоніламіно, арилу та бі, гало, С1-6алкілом, нітро, аміно, гідрокси, С1арилокси; 6алкілокси, полігалоС1-6алкілом, карбоксилом, аміR3 є воднем, гідрокси, С1-6алкілом, С1ноС1-6алкілом, моно- або ди С1-4алкіл)аміноС1арилС1-6алкілом або арил С16алкілокси, 6алкілом, С1-6aлкiлoкcи карбонілом, гідроксиС16алкілокси; 6алкілом, або радикалом формули R4 є воднем, С1-6алкілом або арилС1-6алкілом; кожна з груп R5a, R5b, R5c та R5d є, незалежно, воднем або С1-6алкілом; або 9 74787 10 R5a та R5b, або R5c та R5d утворюють разом біцюгами, що мають від 1 до 4 атомів вуглецю, такі валентний радикал формули -(CH2)s-, де s дорівяк, наприклад, метилен, 1,2-етандііл, 1,3нює 4 або 5; пропандііл, 1,4-бутандіїл тощо; С1-6алкандіїл, як R6 є воднем, С1-4алкілом, формілом, мається на увазі, включає С1-4алкандіїл і вищі його гiдpoкcиС1-6aлкiлoм, С1-6алкілкарбонілом або С1гомологи, що мають від 5 до 6 атомів вуглецю, такі як, наприклад, 1,5-пентандііл, 1,6-гександііл тощо; 6алкіл оксикарбонілом; арил є фенілом або фенілом, заміщеним 1 або С1-10алкандіїл, як мається на увазі, включає С1більшою кількістю, такою як 2, 3, або 4, замісників, 6лкандіїл і вищі його гомологи, що мають від 7 до що вибираються з гало, гідрокси, С1-6алкілу, гідро10 атомів вуглецю, такі як, наприклад, 1,7ксиС1-6алкілу, полігалоС1-6алкілу, С1-6алкілокси; та гептандіїл, 1,8-октандіїл, 1,9-нонандіїл, 1,10Гет є піридилом, піримідинілом, піразинілом, декандіїл тощо. піридазинілом. Як застосовувалось у даному тексті вище, груПід терміном промедикамент у даному тексті па (=О) утворює карбонільну складову, коли вона мається на увазі фармацевтично прийнятні похідприєднана до атому вуглецю, сульфоксидну склані, наприклад, ефіри та аміди, такі, що продукт, дову, коли вона приєднана до атому сірки та суутворений в результаті біотрансформації даної льфонільну складову, коли до атому сірки приєдпохідної, є активним медикаментом, як визначено нані дві зазначених групи. Група (=N-ОH) утворює у сполуках формули (І). У даному тексті зроблене гідроксилімінну складову, коли вона приєднана до посилання на роботу Goodman and Gilman [The атому вуглецю. Pharmacological Basis of Therapeutics, 8th ed., Термін гало є загальним до атомів фтору, McGraw-Hill, Int. Ed. 1992, "Biotransfbrmation of хлору, брому та йоду. Як застосовувалось у даноDrugs", p.13-15], де описуються у загальному плані му тексті вище та буде застосовано у подальшому промедикаменти. викладі, полігалоС1-6алкіл як група або частина Як застосовується у даному тексті, С1-3алкіл як групи визначається як моно- або полігалозаміщегрупа або частина групи визначає насичені вуглений С1-6алкіл, зокрема метил з одним або більшою водневі радикали з прямими або розгалуженими кількістю атомів фтору, наприклад, дифторометил ланцюгами, що мають від 1 до 3 атомів вуглецю, або трифторометил. У випадку, коли до алкільної такі як метил, етил, пропіл, 1-метилетил і таке погрупи приєднано більше одного атома галогену, у дібне; С1-4алкіл як група або частина групи визнамежах визначення полігалоС1-6алкілу вони можуть чає насичені вуглеводневі радикали з прямими бути однаковими або різними. або розгалуженими ланцюгами, що мають від 1 до Коли будь-яка змінна (наприклад, арил, R2, R3, 4 4 атомів вуглецю, такі як групи, що визначені для R , R5a, R5b тощо) зустрічається у будь-якій склаС1-3алкілу, та бутил тощо; С2-4алкіл як група або довій більше одного разу, кожне визначення є нечастина групи визначає насичені вуглеводневі залежним. радикали з прямими або розгалуженими ланцюгаЗрозуміло, що деякі зі сполук формули (І) та їх ми, що мають від 2 до 4 атомів вуглецю, такі як промедикаменти, N-оксиди, солі приєднання, чететил, пропіл, 1-метилетил, бутил і таке подібне; С1вертинні аміни, металеві комплекси та стереохімічно ізомерні форми можуть містити один або бі6алкіл як група або частина групи визначає насичені вуглеводневі радикали з прямими або розгальше хіральних центрів та існувати як луженими ланцюгами, що мають від 1 до 6 атомів стереохімічно ізомерні форми. вуглецю, такі як групи, що визначені для С1Вираз "стереохімічно ізомерні форми", що застосовувався у попередньому викладі, визначає 4алкілу, та пентил, гексил, 2-метилбутил і таке подібне; С1-9алкіл як група або частина групи визнавсі можливі стереоізомерні форми, котрі можуть чає насичені вуглеводневі радикали з прямими мати сполуки формули (І) та їх промедикаменти, або розгалуженими ланцюгами, що мають від 1 до N-оксиди, солі приєднання, четвертинні аміни, 9 атомів вуглецю, такі як групи, що визначені для металеві комплекси або фізіологічно функціональС1-6алкілу, та гептил, октил, ноніл, 2-метилгексил, ні похідні. Якщо окремо не зазначено або не вка2-метилгептил і таке подібне, С1-10алкіл як група зано, хімічне позначення сполук відповідає суміші або частина групи визначає насичені вуглеводневі всіх можливих стереохімічно ізомерних форм, зарадикали з прямими або розгалуженими ланцюгазначені суміші містять як усі діастереомери та ми, що мають від 1 до 10 атомів вуглецю, такі як енантіомери базової молекулярної структури, так і групи, що визначені для С1-9алкілу, та децил, 2кожну з окремих ізомерних форм сполук формули метилноніл і таке подібне. С3-7циклоалкіл є джене(І) та їх промедикаментів, N-оксидів, солей, сольриком до з циклопропілу, циклобутилу, циклопенватів, четвертинних амінів, металевих комплексів у тилу, циклогексилу та циклогептилу; С2-5алкандііл суттєво вільній формі, тобто асоційованих з менше визначає бівалентні насичені вуглеводневірадиза 10%, краще - менше за 5%, особливо - менше кали з прямими та розгалуженими ланцюгами, що за 2% і найкраще - менше за 1% інших ізомерів мають від 2 до 5 атомів вуглецю, такі як, наприОчевидно, що, як мається на увазі, стереохімічно клад, 1,2-етандііл, 1,3-пропандііл, 1,4-бутандііл, ізомерні форми сполук формули (І), входять в об1,2-пропандііл, 2,3-бутандііл, 1,5-пентандііл тощо, сяг даного винаходу. С2-5алкандііл є замісником у С1-10алкілі, як передЯк застосовуватиметься у подальшому виклабачено у визначенні R2, мається на увазі, що це ді, терміни транс, цис, R або S є добре відомими заміщення відбувається по одному атому вуглецю фахівцям у даній галузі. з результуючим утворенням спіроскладовоі, С1Для деяких сполук формули (І), їх промедикаментів, N-оксидів, солей, сольватів, четвертинних 4алкандіїл визначає бівалентні насичені вуглеводневі радикали з прямими та розгалуженими ланамінів або металевих комплексів та проміжних 11 74787 12 сполук, що використовуються при їх одержанні, сольватами є, наприклад, гідрати, алкоголяти тоабсолютна стереохімічна конфігурація експеримещо. нтально не визначалась. У таких випадках та стеВираз "четвертинний амін", як застосовувареоізомерна форма, що виділялась першою, позлось вище, визначає солі четвертинного амонію, начається як "А", і друга як "B" без додаткового які здатні утворювати сполуки формули (І) шляхом посилання на фактичну стереохімічну конфігурареакції між азотистою основою сполуки формули цію. Проте, зазначені "А" та "В" стереоізомерні (І) та відповідним агентом кватернізації, таким як, форми можуть бути однозначно ідентифіковані, наприклад, заміщений, при потребі, галоїдоалкіл, наприклад, за їх оптичним обертанням у випадку, галоїдоарил або галоїдоарилалкіл, наприклад, коли "А" та "В" мають енантіомерне співвідношенметилйодид або бензилйодид. Можуть також виня. Фахівець у даній галузі здатен визначити абсокористовуватись інші реагенти з групами, що легко лютну конфігурацію таких сполук з використанням відщеплюються, такі як алкіл трифторометансувідомих у даній галузі методів, таких як, наприльфонати, алкіл метансульфонати та алкіл рклад, рентгенівська дифракція. У випадку, коли "А" толуолсульфонати. Четвертинний амін має позита "В" є стереоізомерними сумішами, вони можуть тивно заряджений азот. Фармацевтично прийнятні бути додатково розділені, і відповідні перші видіпротиіони включають хлоро, бромо, йодо, трифтолені фракції позначаються як "A1" та "В1" і другі роацетат та ацетат. Протиіон за вибором може як "А2" та "В2" без додаткового посилання на факбути уведено з використанням іонообмінних смол. тичну стереохімічну конфігурацію. Зрозуміло, що сполуки формули (І) можуть маДля терапевтичного застосування солі сполук ти металозв'язувальні, хелатоутворювальні та формули (І) є такими, у яких протиіон є фармацевкомплексоутворювальні властивості і тому можуть тично прийнятним. Проте, солі кислот та основ, що існувати у вигляді металевих комплексів або мене є фармацевтично прийнятними, можуть також талевих хелатів. Такі метальовані похідні сполук знайти застосування, наприклад, при одержанні формули (І) також включені, як мається на увазі, в або очищенні фармацевтично прийнятної сполуки. обсяг даного винаходу. Усі солі, незалежно від того, чи є вони фармацевДеякі зі сполук формули (І) можуть також існутично прийнятними, включені в обсяг даного винавати у своїй таутомерій формі. Хоча такі форми й ходу. не вказані у явному вигляді у вищенаведених фоФармацевтично прийнятні кислі та основні солі рмулах, вони також включені, як мається на увазі, приєднання, що згадувались вище, включають, як в обсяг даного винаходу. мається на увазі, терапевтично активні нетоксичні Спеціальну групу сполук складають ті сполуки кислі та основні форми солей приєднання, що здаформули (І), де застосовується одне або більше з тні утворювати сполуки формули (І). Фармацевтинаступних обмежень: чно прийнятні кислі солі приєднання можуть зви-Q є радикалом формули (b-1), (b-3), (b-4), (bчайно одержуватись обробкою основної форми 5), (b-6), (b-7) або (b-8); такою відповідною кислотою. Відповідні кислоти -Х2 є прямим зв'язком, СН2 або С(=О); включають, наприклад, неорганічні кислоти, такі як -R2 є воднем, піролідинілом, піперидинілом, галоїдоводневі кислоти, наприклад, хлористоводгомопіперидинілом, С3-7циклоалкілом, заміщеним нева або бромистоводнева кислота, сірчана, азотNHR6, або С1-10алкілом, заміщеним NHR6 і, при на, фосфорна тощо; або органічні кислоти, такі як, потребі, другим, третім або четвертим замісником, наприклад, оцтова, пропанова, гідроксиоцтова, що вибирається з аміно, гідрокси, С3-7циклоалкілу, молочна, піровиноградна, щавлева (тобто етандиС2-5алкандіілу, піперидинілу, моно- або ди (С1кислота), малонова, бурштинова (тобто бутанди6алкіл)аміно, С1-6алкілоксикарбоніламіно, арилу та кислота), малеїнова, фумарова, яблучна (тобто арилокси; гідроксибутандикислота), винна, лимонна, метан-R3 - це водень, гідрокси, С1-6алкіл, С1сульфонова, етансульфонова, бензолсульфонова, 6алкілокси або арилС1-6алкіл; р-толуолсульфонова, цикламінова, саліцилова, р-R6 - це водень, С1-4алкіл, форміл, С1аміносаліцилова, памова і подібні кислоти. 6алкілкарбоніл або С1-6алкілоксикарбоніл. Навпаки, зазначені сольові форми можуть буТакож цікаву групу сполук складають ті сполути перетворені обробкою відповідною основою у ки формули (І), де застосовуються наступні обмеформу вільної основи. ження: Сполуки формули (І), що містять кислотний -а1=а2-а3=а4- є радикалом формули (а-1) або протон, можуть бути також перетворені в їх неток(а-2); сичні металеві або амінні форми солей приєднанR1 є фенілом, при потребі заміщеним гало, С1ня обробкою відповідною органічною та неорганіч6алкілом чи С1-4алкілокси; або піридилом, при потною основами. Відповідні основні сольові форми ребі заміщеним одним або більше замісниками включають, наприклад, амонієві солі, солі лужних обраними з арилС1-6алкілокси, С1-6алкілоксиС1та лужноземельних металів, наприклад, солі літію, 6алкілом, арилом, моно- або ди(С1-6алкіл)аміном, натрію, калію, магнію, кальцію тощо, солі з органіС(=О)-NR5cR5d, гало або С1-6алкілом; чними основами, наприклад, бензатинові, NG є С1-4алканеділом, заміщеним гідрокси, С1метил-D-глюкамінові, гідрабамінові солі та солі з 6алкілокси, НО(-СН2-СН2-О)n-, С1-6алкілокси(-СН2амінокислотами, такими як, наприклад, аргінін, СН2-О)n- чи арилС1-6алкілокси(-СН2-СН2-О)n-; лізин тощо. Q є радикалом формули (b-5), де ν - цє 2, і Υ1 Вираз сіль приєднання, як застосовувалось цe N-R2; вище, включає також сольвати, що здатні утворюХ1 є NH або СH; вати сполуки формули (І), і також їх солі. Такими R2 є С1-10алкілом, заміщеним NHR6, де R6 є 13 74787 14 воднем або С1-6алкілоксикарбонілом. бензимідазол імідазо[4,5-6]піридиніл-2Особливими сполуками є такі сполуки формуамін(сполука 64); ли (І), де R2 є С1-10алкілом, заміщеним NH2. [(B),(S)]N-[1-(2-амінопропіл)-4-піридиніл]-1Іншими особливими сполуками є такі сполуки [етокси(6-метил-2-піридиніл)метил]-1Нформули (І), де G є метиленом або 1,2бензимідазол-2-аміномоногідрат(сполука 76); етанеділом, обидва заміщені гідрокси, С1(±)-N-[1-(2-аміно-3-метилбутіл)-4-піридиніл]-3[(2-метоксиетокси)(6-метил-2-піридиніл)метил]-76алкілокси, НО(-СН2-СН2-О)n-, С1-6алкілокси(-СН2СН2-О)n- чи арілС1-6алкілокси(-СН2-СН2-О)n-. метил-3Н-імідазо[4,5-6]піридиніл-2-амін (сполуТакож особливими сполуками є такі сполуки ка 89); формули (І), де R1 є піридилом, бажано 2(±)-Ν-[1-(2-аміно-3-метилбутіл)-4-піридиніл]-1піридилом, заміщеним одним або 2 замісниками, [(2-етоксиетокси)(6-метил-2-піридиніл)метил]-1Нобраними з гало, гідрокси, аміно, ціано, карбокси, бензимідазол-2-амін (сполука 83); С1-6алкілом, С1-6алкілокси, С1-6алкілтіо, С1(±)-N-[1-(2-аміноетил)-4-піридиніл]-1-[(2метоксиетокси)(6-метил-2-піридиніл)метил]1Н6алкілоксиС1-6алкілом, арилом, арилС1-6алкілом, арилС1-6алкілокси, гідрокси С1-6алкіл, моно- або бензимідазол-2-амін (сполука 82); ді(С1-6алкіл)аміно, моно- або ді(С1-6алкіл)аміноС1їх промедикаментів, N-оксидів, солей приєдполігалоС1-6алкілом, С1нання, четвертинних амінів, металевих комплексів 6алкілом, С1-6алкіл-SО2-NR5c-, арилта стереохімічно ізомерних форм. 6aлкілкapбoнiлaмінo, 5c SO2-NR -, С1-6aлкiлoкcикapбoнілoм, -С(=О)Найкращими сполуками є: NR5сR5d, HO(-CH2-CH2-O)n-, гало(-СН2-СН2-О)n-, С1(±)-N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]1-[(6-бромо-2-піридиніл)етоксиметил]-4-метил-1Н6алкілокси(-СН2-СН2-О)n-, арилС1-6алкілокси(-СН2СН2-О)n-, та моно- або ді(С1-6алкіл)аміно(-СН2-СН2бензимідазол-2-аміну моногідрат, (сполука 87); О)n-, бажано обрані з арилС1-6алкілокси, С1[(А),(R)]-N-[1-(2-аміно-3-метилбутил)-4арил, моно- або ди(С1піперидиніл]-1-[(6-бромо-2-піридиніл)етоксиметил]6алкілоксиС1-6алкіл, -С(=О)-NR5cR5d, гало або С14-метил-1Н-бензимідазол-2-амін, (сполука 70); 6алкіл)аміном, (±)-N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]6алкілом. Кращими сполуками є такі сполуки формули 1-[(6-бромо-2-піридиніл)етоксиметил]-4-метил-1Н(І), де R1 є необов'язковою заміщеною складовою бензимідазол-2-амін, (сполука 10); 2-піридилу, зокрема, 2-піридилу, 6-заміщеного-2їх промедикаментів, N-оксидів, солей приєдпіридилу або частково 3,6-двозаміщеного-2нання, четвертинних амінів, металевих комплексів піридилу. та стереохімічно ізомерних форм. Кращими сполуками є Загалом, сполуки формули (І) можуть бути [(А),(S)]-N-[1-(2-аміно-3-метилбутил)-4одержані шляхом реакції проміжної сполуки форпіперидиніл]-1-[(6-бромо-2-піридиніл)мули (II-а) або (II-b), де Ρ є захисною групою, таетоксиметил]-1Н-бензимідазол-2-амін (сполука кою як, наприклад, С1-4алкілоксикарбоніл, або ти69); ми захисними групами, що згадуються у Розділі 7 [(А),(S)]-N-[1-(2-амінопропіл)-4-піперидиніл]-1"Protective Groups in Organic Synthesis" by T. [етокси(6-метил-2-піридиніл)метил]-1Н-бензи мідаGreene and P. Wuyts [John Wiley & Sons Inc., 1991], зол-2-амін (сполука 75); з проміжною сполукою формули (III), де W1 є при(+)-N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]йнятна група, що відщеплюється, така як гало 1-[(2-метоксиетокси)(6-метил-2-піридиніл) метил]атом, наприклад, атом хлору, атом брому, у при1Н-бензимідазол-2-амін(сполука 86); сутності придатної основи, такої як, наприклад, N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]-6гідрид натрію. Зазначена реакція може здійснювахлоро-1-[(2-метоксиетокси)(6-метил-2тися в інертному щодо реакції розчиннику, такому піридиніл)метил]-4-метил-1Н-бензимідазол-2як Ν,Ν-диметилформамід. амінотрипдрохлоріду тригідрат (сполука 88); [(А),(R)]-N-(1-(2-аміно-3-метилбутил)-4тперидиніл]-1-[етокси(6-метил-2-піридиніл)метил]1Н-бензимідазол-2-амін моногідрат (сполука 68); (±)-Ν-[1-(2-амінопропіл)-4-піперидиніл]-1[етокси(6-метил-2-піридиніл)метил]-1Нбензимідазол-2-амін (сполука 12); [(А)(S)]-N-[1-(2-аміно-3-метилбутил)-4піперидиніл]-1-[етокси(6-метил-2-піридиніл)метил]1Н-бензимідазол-2-амін моногідрат(сполука 67); (±)N-[1-(2-аміно-3-метилбутил)-4-піперидиніл]1-[етокси(6-метил-2-піридиніл]метил]-1Нбензимідазол-2-амін (сполука 83); [(A),(R)]-N-[1-(2-aмїнoпpoпiл)-4-піпepидиніл]-1[eтoкcи(6-мeτил-2-піpидиніл)мeтил]-1HСполуки формули (І), де, у визначенні Q, R2 бензимідазол-2-аміномоногідрат(сполука74); або принаймні один замісник R6 є воднем, зазна(+)-N-[1-(2-аміноетил)-4-піперидиніл]-1-[(6чений Q подано H-Q1 і зазначені сполуки подані бромо-2-піридиніл)етоксиметил]-2-бензимідазол-2формулою (l-а), можуть бути одержані и шляхом амін (сполука 9); депротектування проміжної сполуки формули (IV), (±)-N-[1-(2-аміно-3-метилбутіл)-4-піперидиніл]де Р є захисною групою, наприклад, С11-[етокси)(6-метил-2-піридиніл)метил]-1Налкілоксикарбонілом, бензилом або захисними 4 15 74787 16 групами, що згадуються у Розділі 7 "Protective одержані шляхом депротектування проміжної споGroups in Organic Synthesis" by T. Greene and P. луки формули (VI) згідно з процедурою, що описаWuyts [John Wiley & Sons inc., 1991]. на для одержання сполук формули (l-а). Коли Р є, наприклад, С1-4алкілоксикарбонілом, зазначена реакція депротектування може здійснюватися, наприклад, шляхом кислотного гідролізу у присутності придатної кислоти, такої як бромистоводнева, хлористоводнева, сірчана, оцтова, або трифторооцтова, або суміші зазначених кислот, або шляхом основного гідролізу у присутності придатної основи, такої як, наприклад, гідроксид калію, у придатному розчиннику, такому як вода, спирт, суміш вода-спирт, метиленхлорид. Придатними спиртами є метанол, етанол, 2-пропанол, 1бутанол тощо. Для підвищення швидкості даної реакції бажано нагрівати реакційну суміш, зокрема до температури перегонки. Як альтернатива, коли Ρ є, наприклад, бензилом, реакція депротектування може здійснюватись шляхом каталітичного гідрування у присутності водню та відповідного каталізатора в інертному щодо реакції розчиннику. Придатним каталізатором у вищезазначеній реакції є, наприклад, платина на вугіллі, паладій на вугіллі тощо. Відповідним інертним розчинником для зазначеної реакції є, наприклад, спирт, наприклад, метанол, етанол, 2-пропанол тощо, складний ефір, наприклад, етилацетат тощо, кислота, наприклад, оцтова кислота тощо. Реакція каталітичного гідрування, що описана вище, може також використовуватися для одержання сполуки формули (l-а) шляхом депротектування та відновлення проміжної сполуки формули (IV), де Q1 включає ненасичений зв'язок, зазначений Q1 подано Q1a(CH=CH), і зазначена проміжна сполука подана формулою (IV-a). Сполуки формули (І), де, у визначенні Q, обидва замісники R6 є воднем, або R2 та R4 є обидва воднем, зазначений Q подано H2N-Q2 і зазначені сполуки подані формулою (l-а-1), можуть бути також одержані шляхом депротектування проміжної сполуки формули (V). Зазначена реакція депротектування може здійснюватися у присутності придатної основи, такої як, наприклад, гідразин, або у присутності придатної кислоти, такої як хлористоводнева кислота тощо, у придатному розчиннику, такому як спирт, оцтова кислота тощо. Сполуки формули (І-а-1) можуть бути також Сполуки формули (l-а) або (І-а-1), де Q1 або Q2 включає гідрокси замісника, зазначені Q1 або Q2 подані Q1 OH або Q2 OH і зазначені сполуки подані формулою (І-а-2) або (І-а-1-1), можуть бути одержані шляхом депротектування проміжної сполуки формули (VII) або (VIII), як описано вище для одержання сполук формули (l-а). Сполуки формули (І), де, у визначенні Q, обидва замісники R6 є воднем, або R2 та R4 є обидва воднем, і атом вуглецю, суміжний з азотом, що 6 2 4 несе R або R та R замісників, містить принаймні один атом водню, зазначений Q подано H2N-Q3H і зазначені сполуки подані формулою (І-а-1-2), можуть бути також одержані відновлювальним амінуванням проміжних сполук формули (IX) у присутності придатного агента амінування, такого як, наприклад, аміак, гідроксиламін, або бензиламін, і у присутності придатного відновлювального агента, наприклад, водню, і відповідного каталізатора. Відповідним каталізатором у зазначеній вище реакції є, наприклад, платина на вугіллі, паладій на вугіллі, родій на Аl2О3 тощо, при потребі, у присутності каталітичної отрути, такої як розчин тіофену. Придатним інертним щодо реакції розчинником, є, наприклад, спирт, наприклад, метанол, етанол, 2пропанол тощо. Сполуки формули (І), де Q включає -CH2NH2 складову, зазначений Q подано H2N-CH2-Q4, і зазначені сполуки подані формулою (І-а-1-3), можуть бути одержані відновленням проміжної сполуки формули (X). Зазначена реакція може здійснюватися за допомогою придатного відновлювального агента, 17 74787 18 такого як літійалюмінію гідрид або водень, при N(R6)2, і зазначені сполуки подані формулою (І-спотребі, у присутності придатного каталізатора, 1), можуть бути одержані відновленням проміжної такого як нікель Ренея. Придатним розчинником сполуки формули (XV) у присутності придатного для вищезазначеної реакції є, наприклад, тетрагівідновлювального агента, такого як літійалюмінію дрофуран, або розчин аміаку у спирті. Придатними гідрид, у придатному інертному щодо реакції розспиртами є метанол, етанол, 2-пропанол і таке чиннику, такому як тетрагідрофуран. подібне. Зазначена реакція відновлення, що здійснюється у розчині аміаку у спирті, може також використовуватись для одержання сполук формули (І-а-1-3), де R1 заміщено С1-6алкілоксиС1-6алкілом, зазначений R1 подано R1-С1-6алкілоксиС1-6алкілом, Сполуки формули (І), де, у визначенні Q, R2 і зазначені сполуки подані формулою (l-а-1-3-1), або один R6 замісник є воднем, зазначений Q повиходячи із проміжної сполуки формули (Х-а). дано H-Q1, і де R1 є моноциклічним гетероциклом, заміщеним 1 або більшою кількістю замісників, що вибираються із гідрокси, гідрокси С1-6алкілу, або НО(-СН2-СН2-О)n-, зазначені замісники подані формулою А-ОН, зазначений R1 подано R1a-(A-OH)w, де w відповідає кількості замісників при R1a, що Сполуки формули (І), де Q включає -CH2варіює від 1 до 4, і зазначені сполуки подані форCHOH-CH2-NH2 складову, зазначений Q подано мулою (l-d), можуть бути одержані шляхом депроH2N-CH2-CHOH-CH2-Q4, і зазначені сполуки подані тектування проміжної сполуки формули (XVI) приформулою (І-а-1-3-2), можуть бути одержані шлядатною кислотою, такою як хлористоводнева хом реакції проміжної сполуки формули (XI) з амікислота тощо, при потребі, у присутності придатаком у присутності розчинника, придатного щодо ного розчинника, такого як спирт. Придатними реакції, такого як спирт, наприклад, метанол. спиртами є метанол, етанол, 2-пропанол тощо. Як альтернатива, одна захисна група може також захищати більше одного замісника при R1a, зазначена захисна група подана P1, як показано у формулі (XVI-a). Два шляхи протектування замісників R1a, тобто окремою, як у формулі (XVI), або 2 Сполуки формули (І), де, у визначенні Q, R комбінованою, як у формулі (XVI-a), захисною груабо один замісник R6 є формілом, зазначений Q пою можуть бути скомбіновані в одній проміжній подано H-C(=O)-Q1, і зазначені сполуки подані фосполуці, як зображено формулою (XVI-b). рмулою (1-b), можуть бути одержані шляхом реакції проміжної сполуки формули (XII) з мурашиною кислотою, формамідом та аміаком. Сполуки формули (І), де, у визначенні Q, R2 є відмінним від водню, зазначений R2 подано R2a, R4 є воднем, і атом вуглецю, суміжний з азотом, що несе R2 та R4 замісників, несе також принаймні один атом водню, зазначений Q подано R2a-NHHQ5, і зазначені сполуки подані формулою (l’-с), можуть бути одержані відновлювальним амінуванням проміжної сполуки формули (Хlll) проміжною сполукою формули (XIV) у присутності придатного відновлювального агента, такого як водень, і придатного каталізатора, такого як паладій на вугіллі, платина на вугіллі і таке подібне. Придатним інертним щодо реакції розчинником для вищезазначеної реакції є, наприклад, спирт, наприклад, метанол, етанол, 2-пропанол і таке подібне. Сполуки формули (l-c), де R2a репрезентує С1алкіл, заміщений N(R6)2 та гідрокси, і вуглецевий 10 атом, що несе гідрокси, несе також два атоми водню, зазначений R2a подано [(С1-9алкіл)СН2ОН] Сполуки формули (І), де Q є радикалом формули (b-2), зазначені сполуки подані формулою (Iе), можуть бути одержані шляхом реакції проміжної сполуки формули (XVII) з проміжною сполукою формули (ХVlll) у присутності ціаніду натрію та придатного інертного щодо реакції розчинника, такого як спирт, наприклад, метанол тощо. 19 Сполуки формули (І), де, у визначенні Q, Х2 є С2-4алкіл-NR4, зазначений Q подано Q6N-CH2-С14 3алкіл-NR , і зазначені сполуки подані формулою (l-р), можуть бути одержані шляхом реакції проміжної сполуки формули (XIX) з проміжною сполукою формули (XX) у присутності ізопропіл титанату (IV) та придатного відновлювального агента, такого як NaBH3CN, та у присутності придатного інертного щодо реакції розчинника, такого як метиленхлорид або спирт, наприклад, етанол. Сполуки формули (l-р), де R2 являє собою С1алкілкарбоніл, і Q являє собою радикал формули, 6 (b-6), де Y1 є NR2, зазначені сполуки подані формулою (I-p-1), можуть бути одержані шляхом реакції проміжної сполуки формули (XIX) з проміжною сполукою формули (ХХ-а) згідно з процедурою, що описана для одержання сполук формули (l-р). Сполуки формули (І), де G заміщено воднем або НO(-СH2-СH2-О)n-, зазначений G представлено G1-OH, і зазначені сполуки подані формулою (lq), можуть бути одержані шляхом депротеінізації проміжної сполуки формули (XXI), де Ρ представлено придатною захисною групою, наприклад, бензилом. Зазначена реакція депротектування може здійснюватись шляхом каталітичного гідрування у присутності водню та відповідного каталізатора в інертному щодо реакції розчиннику. Придатним каталізатором у вищезазначеній реакції є, наприклад, платина на вугіллі, паладій на вугіллі тощо. Відповідним інертним розчинником для зазначеної реакції є, наприклад, спирт, наприклад, метанол, етанол, 2-пропанол тощо, складний ефір, наприклад, етилацетат тощо, кислота, наприклад, оцтова кислота тощо. Сполуки формули (І), де G є заміщеним гідрокси, і атом вуглецю, що несе гідрокси, несе також принаймні один атом водню, зазначений G представлено H-G2-OH, та зазначені сполуки що представлені формулою (l-q-1), можуть також бути виготовлені за скороченою проміжною формулою (XXII). 74787 20 Зазначену реакцію відновлювання бажано здійснити з використанням придатних відновлювальних агентів, таких, як наприклад, натрію борогідрат, в інертному щодо реакції розчиннику, такому як спирт або тетрагідрофуран, або їх суміш. Придатними спиртами є метанол, етанол, 2-пропанол тощо. Сполуки формули (І) можуть бути перетворені одна в одну з використанням відомих у даній галузі реакцій трансформування функціональних груп, включаючи ті реакції, що описані далі. Сполуки формули (l) можуть бути перетворені у відповідні N-оксидні форми з використанням відомих у даній галузі процедур для перетворення тривалентного азоту в його N-оксидну форму. Зазначена реакція N-окислення може бути, загалом, здійснена шляхом реакції вихідного матеріалу формули (І) з відповідним органічним або неорганічним пероксидом. Відповідні неорганічні пероксиди включають, наприклад, пероксид водню, пероксиди лужних або лужноземельних металів, наприклад, пероксид натрію, пероксид калію; відповідні органічні пероксиди можуть включати перкислоти, такі як, наприклад, пербензойна кислота або гало заміщена пербензойна кислота, наприклад, 3хлоропербензойна кислота, пералканові кислоти, наприклад, пероцтова кислота, алкілгідропероксиди, наприклад, t.бутил гідропероксид. Придатними розчинниками є, наприклад, вода, нижчі спирти, наприклад, етанол тощо, вуглеводні, наприклад, толуол, кетони, наприклад, 2-бутанон, галогеновані вуглеводні, наприклад, дихлорометан, та суміші таких розчинників. Сполуки формули (І), де R1 є моноциклічним гетероциклом, заміщеним С1-6алкілокси карбонілом, зазначений R1 подано R1-С(=О)ОС1-6алкілом, і зазначені сполуки подані формулою (l-f), можуть бути одержані етерифікацією сполуки формули (lg) у присутності придатного спирту, наприклад, метанолу, етанолу, пропанолу, бутанолу, пентанолу, гексанолу тощо, і у присутності придатної кислоти, такої як хлористоводнева кислота тощо. Сполуки формули (l-а) можуть бути перетворені у сполуки формули (І), де, у визначенні Q, R2 або принаймні один замісник R^ є відмінним від водню, зазначений R2 або R6 подано Z1, зазначений Q подано Z1-Q1 і зазначені сполуки подані формулою (l-h), шляхом реакції реагенту формули (XXI), де W2 є придатною групою, що відщеплюється, такою як гало атом, наприклад, атом брому, або 4-метилбензилсульфонат, у присутності придатної основи, такої як, наприклад, карбонат дина 21 74787 22 трію, карбонат дикалію, гідроксид натрію тощо, в такому як, наприклад, метиленхлорид, у присутноінертному щодо реакції розчиннику, наприклад, 3сті придатного агента депротектування, наприметил-2-бутаноні, ацетонітрилі, Ν,Νклад, трибромоборану. диметилформаміді. Сполуки формули (l-h), де, у визначенні Z1, R2 є СH2-С1-9алкілом, заміщеним N(R6)2, зазначені сполуки подані формулою (l-h-1), можуть бути також одержані шляхом реакції сполуки формули (lа), де, у визначенні H-Q1, R2 є воднем, зазначена H-Q1 подана H-Q1b, і зазначені сполуки подані формулою (І-а-3), з проміжною сполукою формули (XXIV), у присутності придатного відновлювального агента, такого як натрій ціаноборогідрид, у придатному інертному щодо реакції розчиннику, такому як спирт. Сполуки формули (l-h), де Z1 включає форміл, С1-6алкілкарбоніл, або С1-6алкілоксикарбоніл, зазначений Z1 подано Z1a, і зазначені сполуки подані формулою (I-h-2), можуть бути перетворені у сполуки формули (l-а) шляхом кислотного гідролізу у присутності придатної кислоти, такої як бромистоводнева, хлористоводнева, сірчана, оцтова або трифторооцтова кислота, або суміші зазначених кислот, або шляхом основного гідролізу у присутності придатної основи, такої як, наприклад, гідроксид калію, у придатному розчиннику, такому як вода, спирт, суміш вода-спирт, метиленхлорид. Придатними спиртами є метанол, етанол, 2пропанол, 1-бутанол, втор, бутанол тощо. Для підвищення швидкості даної реакції бажано працювати при підвищених температурах. Сполуки формули (l-b) можуть бути одержані шляхом реакції сполуки формули (l-а) з мурашиною кислотою. Сполуки формули (І), де R1 є моноциклічним гетероциклом або арилом, заміщеним гідрокси, зазначений R1 подано HO-R1, і зазначені сполуки подані формулою (l-і), можуть бути одержані шляхом депротектування сполуки формули (Ι-j), де R1 є моноциклічним гетероциклом, заміщеним С16алкілокси або арилС1-6алкілокси, зазначені С11 6алкіл або арилС1-6алкіл подані Z2, і зазначений R подано Z2-O-R1. Зазначене депротектування може проводитися в інертному щодо реакції розчиннику, Сполуки формули (І), де R1 є моноциклічним гетероциклом, заміщеним гало(-CH2-CH2-O)n, зазначені сполуки подані формулою (l’-k), можуть бути перетворені у сполуку формули (l-1-1) або (l1-2) шляхом реакції з відповідним аміном формули (XXV) або (XXVI) у придатному інертному щодо реакції розчиннику, наприклад, тетрагідрофурані. Сполуки формули (І), де R є моноциклічним гетероциклом, заміщеним гало, зазначені сполуки подані формулою (l-m), можуть бути перетворені у сполуки формули (І) шляхом реакції з 1бутантіолом у присутності паладію на вугіллі та СаО у придатному інертному щодо реакції розчиннику, такому як тетрагідрофуран. Сполуки формули (l), де атом водню у радикалах формули (а-1), (а-2), (а-3), (а-4) або (а-5) замінено на нітро, зазначені сполуки подані формулою (l-n), можуть бути відновлені до сполуки формули (І-o) у присутності придатного відновлювального агента, такого як водень, у присутності придатного каталізатора, такого як платина на вугіллі, і, при потребі, у присутності придатної каталітичної отрути, наприклад, розчину тіофену. Дана реакція може здійснюватись у придатному інертному щодо реакції розчиннику, такому як спирт. У наступних параграфах описано кілька способів одержання проміжних сполук у вищезазначених процедурах. Ряд проміжних сполук та вихідних матеріалів є у продажу або є відомими сполуками, що можуть бути одержані згідно зі звичайними реакційними процедурами і є, загалом, відомими у даній галузі або аналогічними до способів, [котрі описані у ЕР-А-0005318, ЕР-А0099139, ЕР-А-0151824, ЕР-А-0151826, ЕР-А 23 74787 24 0232937, ЕР-А-0295742, ЕР-А-0297661, ЕР-АПроміжні сполуки формули (XXX), де G3(=О) є 0539420, ЕР-А-0539421, US 4634704, US 4695569]. СН(=О), зазначені проміжні сполуки подані форУ попередніх та наступних способах одержанмулою (ХХХ-а), можуть бути одержані шляхом ня реакційну суміш обробляють згідно з відомими реакції проміжної сполуки формули (XXXII), де W3 у даній галузі способами, і реакційний продукт виє придатною групою, що відщеплюється, такою як діляють, і, при потребі, піддають додатковому гало атом, наприклад, атом брому, з Ν,Νочищенню. диметилформамідом у присутності бутиллітію в Проміжні сполуки формули (lll) можуть бути інертному щодо реакції розчиннику, наприклад, одержані шляхом реакції проміжної сполуки фортетрагідрофурані, діетиловому ефірі або їх суміші. мули (XXVII) з придатною групою, що відщеплюється, тобто W1, що вводить агент, наприклад, 1гало-2,5-піролідиндіон, у присутності дибензоїл Проміжні сполуки формули (IV) можуть бути пероксиду, в інертному щодо реакції розчиннику, одержані шляхом реакції проміжної сполуки форнаприклад, тетрахлорометані. мули (ХХХlll-а) або (ХХХlll-b), де Ρ репрезентує придатну захисну групу, таку як, наприклад, С14алкілоксикарбоніл, з проміжною сполукою формули (III), згідно з реакцією, що описана для загальних способів одержання сполук формули (І). Проміжні сполуки формули (XXVII), де R1 є моноциклічним гетероциклом або арилом, заміщеним атомом хлору, зазначений R1 подано Cl-R1, і зазначені проміжні сполуки подані формулою (XXVll-a), можуть бути одержані шляхом реакції проміжної сполуки формули (ΧΧVIII), де (O=)R1bH визначається як карбонільна похідна R1, де один вуглець або азот, суміжні з даним карбонілом, несе принаймні один водень, з оксихлоридом фосфору. Проміжні сполуки формули (ХХУШ) можуть також реагувати як їх енольні таутомерні форми. Проміжні сполуки формули (lll), де W1 є атом хлору, що приєднаний до атома вуглецю, котрий несе принаймні один водень, зазначений G подано G1H, і зазначені проміжні сполуки подані формулою (lll-а), можуть бути також одержані шляхом реакції проміжної сполуки формули (XXIX) з тіонілхлоридом у інертному щодо реакції розчиннику, наприклад, метиленхлориді. Проміжні сполуки формули (XXIX) можуть бути одержані відновленням проміжної сполуки формули (XXX) у інертному щодо реакції розчиннику, наприклад, спирті, у присутності придатного відновлювального агента, наприклад, борогідриду натрію. Як альтернатива проміжні сполуки формули (XXIX) можуть бути також одержані шляхом депротектування проміжної сполуки формули (XXXI), де Ρ є придатна захисна група, наприклад, С14алкілкарбоніл, у інертному щодо реакції розчиннику, такому як спирт, у присутності придатної основи, наприклад, гідроксиду натрію. Проміжні сполуки формули (IV) можуть бути також одержані шляхом реакції проміжної сполуки формули (ХХХllІ-а) з проміжною сполукою формули (XXXIV), що реагувала з метансульфонілхлоридом, у присутності придатної основи, такої як гідрид натрію, та у присутності придатного інертного щодо реакції розчинника, наприклад, Ν,Νдиметилформаміду. Проміжні сполуки формули (IV) можуть бути також одержані за допомогою реакції циклізації проміжної сполуки формули (XXXV) у інертному щодо реакції розчиннику, наприклад, спирті або Ν,Ν-диметилформаміді, у присутності оксиду ртуті та сірки. Проміжні сполуки формули (IV), де Q1 включає ненасичений зв'язок, зазначений Q1 подано Q1a(CH=CH), і зазначені проміжні сполуки формулою (IV-a), можуть бути одержані шляхом реакції проміжної сполуки формули (XXXVI) з проміжною сполукою формули (lll) у присутності придатної основи, такої як дикалій карбонат. 25 Проміжні сполуки формули (IV), де, у визначенні Q1, Χ1 або Х2 складові у радикалах формул (b-1)-(b-8) репрезентують NH, зазначений Q1 подано Q1c-NH, і зазначені проміжні сполуки формулою (IV-b), можуть бути також одержані шляхом реакції проміжної сполуки формули (XXXVII) з проміжною сполукою формули (XXXVIII). Проміжні сполуки формули (IV), де R1 є собою моноциклічним гетероциклом, заміщеним аміноабо моно- або ди(С1-6алкіл)аміно, зазначений R1 подано R5aR5bN-R1, де R5a та R5b визначаються як описано вище, і зазначені проміжні сполуки подані формулою (IV-c), можуть бути одержані шляхом реакції проміжної сполуки формули (XXXIX) з відповідним аміном, що поданий формулою (XL), у присутності відповідного каталізатора, наприклад, паладію, та (R)-(+)-2,2-біс(дифеніл-фосфіно)-1,1’бінафтилу, у придатному інертному щодо реакції розчиннику, наприклад, тетрагідрофурані. Проміжні сполуки формули (IV), де R1 є моноциклічним гетероциклом, заміщеним С(=О)NR5aR5b, де R5a та R5b визначаються як описано вище, зазначений R1 подано R5aR5bN-C(=O)-R1, і зазначені проміжні сполуки подані формулою (lVd), можуть бути одержані шляхом реакції проміжної сполуки формули (XXXIX) з відповідним аміном, що подано формулою (XL), в атмосфері моноксиду вуглецю, у присутності придатного каталізатора, наприклад, паладію (II) ацетату, та 1,3-біс(дифенілфосфіно)пропану, у придатному інертному щодо реакції розчиннику, наприклад, тетрагідрофурані. Проміжні сполуки формули (IV), де P-Q1 включає С1-10алкіл або С3-7циклоалкіл, заміщений NR6P, зазначений С1-10алкіл або С3-7циклоалкіл поданий Z3, зазначена P-Q1 подана P-N R6-Z3-Q1b, і зазначені проміжні сполуки подані формулою (IV-e), можуть бути одержані шляхом реакції сполуки формули (І-а-3) з проміжною сполукою формули (XLI), де W4 репрезентує придатну групу, що відщеплюється, таку як р-толуолсульфонат. Зазначена реакція може здійснюватися в інертному щодо реакції розчиннику, наприклад, ацетонітрілі, у присутності придатної основи, наприклад, дикалій 74787 карбонату. 26 Проміжні сполуки формули (IV-e), де R6 є гідроксиС1-6алкілом, зазначені проміжні сполуки подані формулою (IV-e-1), можуть бути одержані шляхом реакції проміжної сполуки формули (XLII) з проміжною сполукою формули (XLIII) у присутності придатної основи, наприклад, динатрію карбонату, та придатного розчинника, наприклад, ацетонітрилу. Проміжні сполуки формули (ХХХlll-а) або (ΧΧΧllΙ-b) можуть бути одержані шляхом протектування проміжної сполуки формули (XLIV) придатною захисною групою, такою як, наприклад, С14алкілоксикарбоніл, у інертному щодо реакції розчиннику, такому як метиленхлорид або спирт, наприклад, метанол, етанол, 2-пропанол тощо, у присутності придатного реагента, наприклад, диС14алкілдикарбонату, і, при потребі, у присутності придатної основи, наприклад, ацетату натрію. Як альтернатива, проміжні сполуки формули (ХХХlll-а) або (ΧΧΧllΙ-b) можуть перетворюватись у проміжні сполуки формули (XLIV) за реакцією з придатною кислотою, такою як хлористоводнева кислота або бромистоводнева кислота тощо, або їх сумішами, у присутності придатного розчинника, наприклад, води. Проміжні сполуки формули (ХХХІll-а) або (ΧΧΧllΙ-b), де, у визначенні Q1, Х1 або Х2 складові у радикалах формул (b-1)-(b-8) репрезентують NH, зазначений Q1 подано Q1c-NH, і зазначені проміжні сполуки формулою (ХХХllІ-а-1) або (ХХХІІІ-b-1), можуть бути одержані шляхом реакції проміжної сполуки формули (XLV-a) або (XLV-b), де W3 репрезентує придатну групу, що відщеплюється, таку як, наприклад, гало атом, наприклад, атом хлору, з проміжною сполукою формули (XLVI). 27 74787 28 Проміжні сполуки формули (XLV-a) або (XLVПроміжні сполуки формули (LI) можуть бути b) можуть бути одержані шляхом реакції проміжної одержані шляхом реакції проміжної сполуки форсполуки формули (XLVII-a) або (XLVII-b) з мули (LII) з проміжною сполукою (LIll), де W6 реН2Р(=О)(W5)3 у присутності придатної кислоти, презентує придатну групу, що відщеплюється, таку наприклад, хлористоводневої кислоти. як гало атом, наприклад, атом хлору. Дана реакція може здійснюватися в .інертному щодо реакції розчиннику, наприклад, ацетонітрілі, у присутності придатної основи, наприклад, дикалію карбонату. 28 Проміжні сполуки формули (XLVII-a) або (XLVII-b) можуть бути одержані шляхом реакції проміжної сполуки формули (XLVIII-a) або (XLVIllb) з проміжною сполукою формули (lL). Проміжні сполуки формули (LII) можуть бути одержані шляхом реакції проміжної сполуки формули (LIV) з придатною кислотою, такою як хлористоводнева кислота, у присутності придатного розчинника, наприклад, спирту, наприклад, етанолу. Проміжні сполуки формули (LIV) можуть бути одержані шляхом реакції проміжної сполуки формули (llІ) з NaN[C(=O)H]2. Проміжні сполуки формули (ХХХІll-а) можуть також бути одержані шляхом реакції проміжної сполуки формули (XLVIII-a) з P-Q1C(=NH)-O-CH2CH3 у інертному щодо реакції розчиннику, такому як спирт. Проміжні сполуки формули (XXXV) можуть бути одержані шляхом реакції проміжної сполуки формули (L) з проміжною сполукою формули PQ1=C=S, що синтезується згідно з процедурами, котрі описані [у ЕР 0005318], у інертному щодо реакції розчиннику, такому як спирт, наприклад, етанол. Для підвищення швидкості реакції її можна проводити при підвищених температурах. Проміжні сполуки формули (L) можуть бути одержані відновленням проміжної сполуки формули (LI) у інертному щодо реакції розчиннику, наприклад, спирті, у присутності придатного відновлювального агента, наприклад, водню, та відповідного каталізатора, наприклад, нікелю Ренея. Проміжні сполуки формули (LI) можуть бути також одержані шляхом реакції проміжної сполуки формули (LIII) з проміжною сполукою формули (LV) [J. Org. Chem., 25, p.1138, 1960] у інертному щодо реакції розчиннику, наприклад, Ν,Νдиметилформаміді, у присутності відповідної основи, наприклад, гідриду натрію. Проміжні сполуки формули (XXXVI) можуть бути одержані шляхом дегідратації проміжної сполуки формули (LVI) придатною кислотою, такою як сірчана кислота. Проміжні сполуки формули (LVI), де, у визначенні Q1a, X1 та Х2 складові є СH2, зазначена Q1a подана Q1b, і зазначені проміжні сполуки подані формулою (LVI-a), можуть бути одержані шляхом реакції карбонільної складової формули (LVII) з проміжною сполукою формули (LVIII) у присутності Ν,Ν-діізопропіламіну та бутиллітію, у придатному інертному щодо реакції розчиннику, наприклад, тетрагідрофурані. Проміжні сполуки формули (IV), де G є С1заміщеним з С1-6алкілокси, арил С1 10алкаденілом 29 74787 30 алкілокси, НО(-СН2СН2О)n-, С1-6алкілокси(-СН2сполук формули (LXVI) отримують сполуку фор6 СН2-O)n-, чи арилС1-6алкілокси(-СН2-СН2-О)n-, замули (Ι-q-1). де Q поедставлено Н-Q1, зазначені значена група замісників представлена Ο-Ζ4, засполуки представлені формулою (I-q-1-1). значений G представлено Ζ4-Ο-G1, і зазначені сполуки представлені формулою (IV-f), може також бути отримана реакцією проміжної сполуки формули (ХХХІІІ-а) з проміжною сполукою формули (LIX), необов'язково в присутності придатної кислоти, такої як толуолсульфонова кислота тощо, і необов'язково в присутності придатного розчинника, такого як Ν,Ν-диметилацетамід. Для підвищеня швидкості реакції реакція може бути проведена при підвищених температурах. Проміжні сполуки формули (LIX), можуть бути отримані реакцією проміжної сполуки формули (LX) з реагентом формули (LXI) або (LXII) у інертному щодо реакції розчиннику, такому як спирт або толуол, в присутності кислоти, наприклад, 4метилбензенсульфонової кислоти Проміжні сполуки формули (LX), можуть бути отримані реакцією окислення проміжної сполуки формули (LXIH) з прийнятним окислювачем, наприклад, ΜnO2 у інертному щодо реакції розчиннику, такому як метилен хлориду. Проміжні сполуки формули (IV-f), може також бути отримана реакцією проміжної сполуки формули (IV), де G є С1-10алкаденілом, заміщеним гідрокси, зазначений G представлено G1-OH, та зазначені проміжні сполуки представлені формулою (IV-g), з проміжною сполукою формули (LXIV), де W7 є прийнятною групою, такою як гало атом, наприклад, атом йоду, в присутності прийнятної основи, наприклад, натрію гідриду, в інертному щодо реакції розчиннику, наприклад, тетрагідрофурану. Проміжні сполуки формули (IV-g), де атом вуглецю d, що переноситься гідрокси, також переносить атом водню, зазначена G1-OH представлена у вигляді Н- G2-OH, та зазначені проміжні сполуки представлені формулою (IV-g-1), можуть бути виготовлені відновленням проміжної сполуки формули (LXV) в присутності прийнятного відновлювального агента, наприклад, натрію борогідрат, у інертному щодо реакції розчиннику, такому як спирт, тетрагідрофуран або їх суміш. Проміжні сполуки формули (LXV) можуть також спочатку бути депротеїнізовані, наприклад, в присутності прийнятної кислоти, такої як соляна кислота та подібні, з отриманих внаслідок реакції проміжних Проміжні сполуки формули (IV), де G є етилом, заміщеним гідрокси, зазначені сполуки представлені формулою (IV-g-2) може також бути отримана реакцією проміжної сполуки формули (ХХХlll-а) з проміжною сполукою формули (LXVII) у присутності прийнятної основи, такої як гідрид натрію, у придатному інертному щодо реакції розчиннику, наприклад, Ν,Ν-диметилформамиду. Підгрупа проміжних сполук формули (IV-g-2), що представлена формулою (IV-g-2-1), може також бути отримана реакцією проміжної сполуки формули (LXVIII) з проміжною сполукою формули (LXIX) в присутності 1,3-діциклогексілкарбодііміду у інертному щодо реакції розчиннику, наприклад, толуолі. Проміжні сполуки формули (XLV) можуть бути отримані реакцією проміжної сполуки формули (ХХХlll-а) з проміжною сполукою формули (LXX), де W8 є придатною залишковою групою, такою як гало атом, наприклад, атом брому, в присутності придатної основи, наприклад, гідриду натрію, у придатному інертному щодо реакції розчиннику, наприклад, Ν,Ν-диметилформамід. Проміжні сполуки формули (V) можуть бути 31 74787 32 отримані реакцією проміжної сполуки формули Проміжні сполуки формули (LXXI), де, у визна(LXXI) з 1Н-ізоіндол-1,3 (2Н)-діон у присутності ченні Q2, атом вуглецю, що несе гідрокси, також трифеніл фосфіну та діетил азодікарбоксилату. несе два атоми водню, зазначена HO-Q2 представлена HO- Q3H, і зазначені сполуки представлені формулою (LXXI-d), можуть бути виготовлені за відновленою проміжною формулою (IX) в присутності придатного відновлювального агента, наприклад, натрію борогідрід, у придатному інертному щодо реакції розчиннику, наприклад, спирті. Проміжні сполуки формули (V), можуть також бути отримані реакцию проміжної сполуки формули (LXXII) з 1Н-ізоіндол-1,3 (2Н)-діон в присутності придатної основи, такої як Ν,Ν-диметилформамід. Проміжні сполуки формули (LXXll) можуть бути виготовлені реакцією проміжної сполуки формули (LXXI) з проміжною сполукою формули (LXXIll), де W9 представлена залишковою групою, такою як гало атом, наприклад, атом хлору, в присутності придатної основи, такої як, Ν,Ν-діетилетанамін, і придатному розчиннику, такому як метилен хлориду. Проміжні сполуки формули (V), де, у визна2 ченні Q2, R є С1-10алкілом, зазначений Q2 представлено С1-10алкіл-Q1b, і зазначені проміжні формули (V-a), можуть бути виготовлені за допомогою реакції сполук формули (І-а-3) з проміжною сполукою формули (LXXIV), де W10 є залишковою групою, такою як гало атом, наприклад, атом хлору, в присутності придатної основи, такої як, наприклад, дикалій карбонату, і придатному розчиннику, такому як ацетонітріл. Проміжні сполуки формули (LXXI), де, у визначенні Q2, атом вуглецю, що несе гідрокси, також несе два атоми водню, зазначена HO-Q2 була представлена HO-CH2-Q2-, і зазначені сполуки представлені формулою (LXXI-a), можуть бути виготовлені за відновленою проміжною формулою (LXXV) в присутності придатного відновлювального агента, такого як алюмогідрид літію, у придатному інертному щодо реакції розчиннику, наприклад, тетрагідрофурані. Проміжні сполуки формули (VI), де, у визначенні Q2, R2 є С1-10алкілом, заміщеним N(P)2, і атом вуглецю, суміжний з атомом азоту, що несе R2 замісника, несе також принаймні один атом водню, зазначений Q2 подано (Р)2-N-С1-10алкіл-NН-О2aH, і зазначені проміжні сполуки подані формулою (VIa), можуть бути одержані відновлювальним амінуванням проміжної сполуки формули (LXXVI) проміжною сполукою формули (LXXVII) у присутності придатного відновлювального агента, такого як водень, та придатного каталізатора, такого як паладій на вугіллі, платина на вугіллі тощо, і, при потребі, у присутності придатного каталітичної отрути, такої як розчин тіофену. Придатним розчинником у даній реакції є інертний щодо неї розчинник, такий як спирт. Проміжні сполуки формули (LXXVI) можуть бути одержані шляхом депротектування проміжної сполуки формули (LXXVIII) у присутності придатної кислоти, такої як хлористоводнева кислота тощо, у придатному розчиннику, наприклад, воді. Проміжні сполуки формули (IX) можуть бути одержані шляхом депротектування проміжної сполуки формули (LXXIX) у присутності придатної кислоти, наприклад, хлористоводневої кислоти тощо. Проміжні сполуки формули (LXXIX) можуть бути одержані шляхом реакції проміжної сполуки формули (LXXX) з проміжною сполукою формули (lll) у присутності придатної основи, наприклад, дикалію карбонату, у придатному інертному щодо реакції розчиннику, наприклад, ацетонітрилі. 33 Проміжні сполуки формули (LXXX), де, у визначенні Q3, X1 або Х2 складові радикалів формул (b-1)-(b-8) репрезентують NH, зазначений Q3 подано Q3-NH, і зазначені проміжні сполуки подані формулою (LXXX-a), можуть бути одержані циклізацією проміжної сполуки формули (LXXXI) у присутності оксиду ртуті та сірки, у придатному інертному щодо реакції розчиннику, наприклад, спирті. Проміжні сполуки формули (LXXXI) можуть бути одержані відновленням проміжної сполуки формули (LXXXII) у присутності придатного відновлювального агента, такого як водень, у присутності придатного каталізатора, такого як паладій на вугіллі, платина на вугіллі тощо, у придатному розчиннику, наприклад, суміші аміаку та спирту. Придатними спиртами є метанол, етанол, 2-пропанол тощо. Проміжні сполуки формули (LXXXII) можуть бути одержані шляхом реакції проміжної сполуки формули (LXXXIII) з проміжною сполукою формули (LXXXIV) у придатному інертному щодо реакції розчиннику, наприклад, етанолі. 74787 34 метил-2-бутаноні, у присутності придатної основи, наприклад, дикалію карбонату, бікарбонату натрію тощо. Проміжні сполуки формули (X), де NC-Q4 репрезентує МС-(С1-9алкіл)(R4)N-С(=О)-Аlk-Х1, зазначені проміжні сполуки подані формулою (Х-b), можуть бути одержані шляхом реакції проміжної сполуки формули (LXXXVII) з проміжною сполукою формули (LXXXVllI) у присутності ди-1Н-імідазол2-іл-метанону, придатної основи, такої як Ν,Νдіетилетанамін, та придатного розчинника, такого як метиленхлорид. Проміжні сполуки формули (XI), де Q4, репрезентує Q1b, зазначені проміжні сполуки подані формулою (ХІ-а), можуть бути одержані шляхом реакції сполуки формули (І-а-3) з проміжною сполукою формули (LXXXlX), де W13 репрезентує придатну групу, що відщеплюється, таку як гало атом, наприклад, атом хлору, у присутності придатної основи, такої як динатрій карбонат, та у присутності придатного розчинника, такого як 3-метил-2бутанон. Проміжні сполуки формули (XIX) можуть бути одержані шляхом реакції проміжної сполуки формули (ХС) з придатною кислотою, такою як хлористоводнева кислота. Проміжні сполуки формули (IX), де, у визначенні Q3, R2 включає С1-10алкіл, зазначена Q3 подана С1-10алкіл-Q1b, і зазначені проміжні сполуки подані формулою (ІХ-а), можуть бути одержані шляхом реакції сполуки формули (І-а-3) з реагентом формули (LXXXV), де (О=)С1-10алкіл репрезентує карбонільну похідну С1-10алкілу і де W9 є придатною групою, що відщеплюється, таку як гало атом, наприклад, атом брому, у інертному щодо реакції розчиннику, наприклад, ацетонітрилі, у присутності придатної основи, наприклад, дикалію карбонату. Проміжні сполуки формули (X), де Q4 включає С1-9алкіл, зазначений Q4 подано С1-9алкіл-Q1b, і зазначені проміжні сполуки подані формулою (Ха), можуть бути одержані шляхом реакції сполуки формули (І-а-3) з реагентом формули (LXXXVI), де W10 репрезентує придатну групу, що відщеплюється, таку як гало атом, наприклад, атом хлору, у інертному щодо реакції розчиннику, наприклад, 3 Чисті стереохімічно ізомерні форми сполук формули (І) можуть бути одержані застосуванням відомих у даній галузі процедур. Діастереомери можуть бути відокремлені за допомогою фізичних методів, таких як селективна кристалізація, та хроматографічних методів, наприклад, протиточним розподілом, рідинною хроматографією тощо. Сполуки формули (І), що одержані за допомогою описаних вище способів, є, загалом, рацемічними сумішами енантіомерів, котрі можуть бути відокремлені один від одного з використанням відомих у даній галузі процедур розщеплення. Рацемічні сполуки формули (І), що є суттєво основними або кислотними, можуть бути перетворені у відповідні діастереомерні сольові форми шляхом реакції з придатною хіральною кислотою, відповідно - хіральною основою. Зазначені діастереомерні сольові форми потім розділяють, наприклад, селективною або фракційною кристалізацією, і енантіомери виділяють лу 35 74787 36 гом або кислотою. Альтернативний спосіб роздіоднорідну суміш з фармацевтично прийнятним лення енантіомерних форм сполук формули (І) носієм, що може приймати широкий різновид включає рідинну хроматографію, зокрема, рідинну форм у залежності від форми препарату, бажаної хроматографію з використанням хіральної стаціодля застосування. Зазначені фармацевтичні комнарної фази. Зазначені чисті стереохімічно ізомепозиції краще мати в одиничній дозовій формі, що рні форми можуть також бути виділені з відповідпридатна, зокрема, для перорального, ректальноних чистих стереохімічно ізомерних форм го, крізьшкірного застосування або застосування у відповідних вихідних матеріалів, за умови, що давигляді парентеральної ін'єкції. Наприклад, при на реакція здійснюється у стереоспецифічний споприготуванні даних композицій в оральній дозовій сіб. Якщо потрібен специфічний стереоізомер, то формі може використовуватись будь-яке звичайне краще, коли зазначену сполуку синтезують стерефармацевтичне середовище, таке як, наприклад, оспецифічним методами одержання. У цих метовода, гліколі, олії, спирти і таке подібне у випадку дах переважно застосовуються енантіомерно чисті оральних рідких препаратів, таких як суспензії, вихідні матеріали. сиропи, еліксири, емульсії та розчини; або тверді Сполуки формул (І) виявляють антивірусні носії, такі як крохмалі, цукри, каолін, мастила, зв'явластивості. Вірусні інфекції, що піддаються лікузувальні речовини, дезінтегратори тощо у випадку ванню сполуками та способами даного винаходу, порошків, пілюль, капсул та таблеток. Завдяки включають ті інфекції, що спричинені орто- та палегкості вживання, таблетки та капсули є найбільш раміксовірусами і, зокрема, респіраторним синцизручними оральними одиничними дозові форми, в тіальним вірусом людини та бичачим вірусом яких очевидно використовуються тверді фармаце(RSV). втичними носіями. Для парентеральних композиIn vitro антивірусна активність даних сполук цій даний носій звичайно включає стерильну воду, щодо RSV випробувалась у дослідах, що описані в принаймні у більшій своїй частині, хоча можуть експериментальній частині даного опису, і може бути включені й інші інгредієнти, наприклад, для бути також проілюстрована у пробі на зниження поліпшення розчинності. Розчини для ін'єкцій мовиходу вірусу. In vivo антивірусна активність даних жуть готуватись, наприклад, таким чином, що носій сполук щодо RSV може бути продемонстрована у включає сольовий розчин, розчин глюкози або дослідній моделі з використанням бавовняних хосуміш сольового розчину та розчину глюкози. Сум'яків, як описано [Wyde et al., Antiviral Research спензії для ін'єкцій можуть готуватись таким чи(1998), 38, 31-42]. ном, що містять відповідні рідкі носії, агенти для Завдяки своїм антивірусним властивостям, зосуспендування тощо. Включені також препарати крема, анти-RSV властивостям, сполуки формули твердих форм, котрі, як мається на увазі, перево(І) або будь-якої її підгрупи, їх промедикаменти, Nдяться у препарати рідкої форми безпосередньо оксиди, солі приєднання, четвертинні аміни, метаперед вживанням. У композиціях, придатних для леві комплекси та стереохімічно ізомерні форми крізьшкірного введення, носій включає, при потрепридатні для лікування індивідуумів, що потерпабі, агент, що поліпшує проникнення, та/або придають від вірусної інфекції, зокрема, RSV інфекції, і тний змочувальний агент, при потребі, у поєднанні для профілактики зазначених інфекцій. Загалом, з придатними добавками будь-якої природи у несполуки даного винаходу можуть бути корисними у значних пропорціях, котрі не дають значного шкідлікуванні теплокровних тварин, інфікованих цими ливого впливу на шкіру. вірусами, зокрема, респіраторним синцитіальним Сполуки даного винаходу можуть також увовірусом. дитись шляхом пероральної інгаляції або інсуфляТому сполуки даного винаходу або будь-якої їх ції з використанням способів та препаратів, що підгрупи можуть застосовуватись як медикаменти. застосовуються у даній галузі для введення за Зазначене використання як ліків або як способу цією схемою. Загалом, сполуки даного винаходу лікування включає систематичне введення суб'єкможуть вводитися у легені в формі розчину, сутам, інфікованим вірусом, або суб'єктам, які є чутспензії або сухого порошку, перевага надається ливими до вірусних інфекцій, ефективної кількості розчину. Будь-яка система, що розроблена для ліків, що здатна протистояти станам, котрі асоцідоставки розчинів, суспензій або сухих порошків юються з даною вірусною інфекцією, зокрема, RSV шляхом інгаляції або інсуфляції, придатна для інфекцією. введення сполук даного винаходу. Даний винахід також має відношення до викоТаким чином, даний винахід запроваджує таристання як сполуки даного винаходу або будькож фармацевтичну композицію, що адаптована якої її підгрупи у виготовлені медикаменту для до введення шляхом інгаляції або інсуфляції крізь лікування або попередження вірусної інфекції, рот, котра включає сполуку формули (І) або фарзокрема, RSV інфекції. мацевтично прийнятний носій. Краще, коли сполуСполуки даного винаходу або будь-якої їх підки даного винаходу вводяться шляхом інгаляції групи можуть застосовуватись для складання різрозчину у вигляді розпилених або аерозольних них фармацевтичних форм лікувального признадоз. чення. Придатними композиціями можуть бути Особлива перевага надається складанню вибудь-які композиції, що звичайно застосовуються щезазначених фармацевтичних композицій в одидля системно ліків, що призначаються. Для пригоничній дозовій формі для легкості вживання та тування фармацевтичних композицій даного винаоднорідності дозування. Одинична дозова форма ходу ефективну кількість даної сполуки, при потв даному тексті стосується фізично дискретних ребі, у формі солі приєднання або металічного одиниць як уніфікованих дозових форм, кожна комплексу, як активний інгредієнт комбінують в одиниця містить попередньо визначену кількість 37 74787 38 активного інгредієнта, що розрахована для отрилука 1). мання бажаного терапевтичного ефекту, сумісно з b) Суміш проміжної сполуки (1) (0,015моль) у потрібним фармацевтичним носієм. Прикладами НСІ 12N (100мл) перемішували та нагрівали із таких одиничних дозових форм є таблетки (вклюоберненим холодильником протягом 12 годин, чаючи таблетки з покриттям), капсули, пілюлі, порозчинник випаровували. Додавали етилацетат. рошкові упаковки, супозиторії, облатки, розчини Дану суміш підлуговували з насиченим розчином для ін'єкцій або суспензії тощо, та кратні їм сегреNаНСО3 Осад відфільтровували, промивали воговані порції. дою та етилацетатом та висушували. Осад (5,5г) Загалом, вважається, що ефективна щодо вікристалізований з етилацетату. Осад відфільтрорусу добова кількість складає від 0,01мг/кг до вували та висушували, вихід 4,8г 1-(4500мг/кг ваги тіла, краще, від 0,1мг/кг до 50мг/кг хлорофеніл)-2-[2-(4піпериніділаміно)ваги тіла. У деяких випадках доцільно потрібну 1Нбензимідазол-1-іл]етанон дігідрат (80%) (промідозу розділяти на дві, три, чотири або більше доз і жна сполука 2) вживати крізь відповідні інтервали часу протягом Приклад А2 доби. Зазначені "субдози" можуть бути складені як a) NaBH4 (0,034моль) при 5°С додавали порціодиничні дозові форми, що містять, наприклад, від ями до суміші (+)-1,1-диметилетил 4-[[1-(2-оксо1 до 1000мг, і, зокрема, від 5 до 200мг активного 2фенілетил)-1Н-бензимідазол-2-іл[аміно]-1інгредієнта на одиничну дозову форму. піперидінкарбоксилат (0,034моль) у тетрагідрофуТочне дозування та частота вживання залеран (250мл) та метанол(250мл). Дану суміш пережать від конкретної сполуки формул (І), що застомішували при 5°С та гідролізували в охолодженосовується, конкретного стану, що потребує лікуму стані з Н2О. Розчинник випаровували та вання, тяжкості стану, що потребує лікування, віку, залишок розчиняли у Н2О. Залишок відфільтровуваги, статі, ступеня розладу та загального фізичвали, промивали з діізопропілефіром та висушуного стану конкретного пацієнта, як і від інших лівали, вихід 11,3г (±)-1,1-диметил-етил 4-[[1-(2ків, що може вживати пацієнт, як це добре відомо гідрокси-2-феніл-етил)-1Н-бензимідазол-2фахівцям у даній галузі. Крім того, зрозуміло, що іл[аміно]-1-піперидінкарбоксилат (76%) (проміжна зазначена ефективна добова кількість може бути сполука 3). знижена або підвищена у залежності від реакції b) Суміш проміжної сполуки (3) (0,0183моль) з суб'єкта, що потребує лікування, та/або у залежтетрагідрофураном (50мл) охолоджували до 0°С ності від оцінки лікаря, котрий призначає сполуки під течією N2. NaH 80% (0,0366моль) додавали даного винаходу. Тому зазначені вище ефективні порціями. Суміш доводили до кімнатної темперадобові кількості є лише орієнтирами. тури та перемішували протягом 30 хвилин, потім Крім того, як ліки можуть використовуватись знову охолоджували до 0°С. Розчин СН3І комбінації інших антивірусних агентів та сполук (0,0183моль) з тетрагідрофураном (50мл) додаваформули (І) Таким чином, даний винахід стосуєтьли по краплях. Суміш перемішували при кімнатній ся також продукту, що містить (а) сполуку формутемпературі протягом 2 годин, потім охолоджували (І) та (б) іншу антивірусну сполуку, як комбіноли, гідролізували та екстрагували з етилацетатом. ваний препарат для одночасного, окремого або Органічний шар відокремлювали, висушували, послідовного використання в антивірусному лікуфільтрували, і розчинник випарювали. Залишок ванні. Різні ліки можуть комбінуватися в єдиний очищали методом колонкової хроматографії на препарат разом з фармацевтично прийнятними силікагелі (елюент: CH2O2/CH3OH/NH4OH носіями. Наприклад, сполуки даного винаходу мо98.5/1.5/0.1). Потрібні фракції збирали, і розчинник жуть комбінуватися з інтерфероном-бета або факвипарювали, вихід 5г (±)-1,1-диметилетил4-[[1-(2тором-альфа пухлинного некрозу для лікування метокси-2фенілетил)-1Н-бензимідазол-2-іл[аміно]або запобігання RSV інфекціям. 1-піперидінкарбоксилат (проміжна сполука 4). Наступні приклади мають на меті проілюструПриклад A3 вати даний винахід. а) NaОСН3 (0,2моль) додавали до суміші N-(4А. Одержання проміжних сполук піперидиніл)-1Н-бензимідазол-2-амін дигідроброПриклад A1 міду (0,1моль) у метанолі (389мл), дану суміш a) K2СО3 (0,129моль) суспендували у розчині охолоджували на льодяній бані та перемішували етилу 4-(1Н-бензимідазолу-2-іл-аміно)-1протягом 2 годин. До охолодженої суміші на льопіпериділкарбоксилату (0.0347моль) та 2-бромо-1дяній бані додавали біс(1,1(4-хлорофеніл)етанону (0,0647моль) в ацетонітридиметилетил)дикарбоноат (0,1моль) і потім переті (150мл). Суміш перемішували та нагрівали із мішували протягом 18 годин при кімнатній темпеоберненим холодильником протягом 8 годин, охоратурі. Дану суміш випарювали та суспендували у лоджували, додавали H2О та екстрагували з вода/DIPE. Залишок відфільтровували, промивали СН2СІ2. Органічний шар відокремлювали осушувасумішшю вода/DIPE та висушували. Залишок підли, фільтрували, і розчинник випарювали. Залидавали кип'ятінню у СН3ОН. Вихід: 17,46г 1,1шок очищали методом колонкової хроматографії диметилетил 4-(1Н-бензимідазол-2-іламіно)-1на силікагелі (елюент: CH2CI2/CH3OH/NH4OH піперидинкарбоксилату (55,2%) (проміжна сполу97.5/2.5/0.1). Чисті фракції збирали, і розчинник ка 5). випарювали. Частину цієї фракції (3г) зайняв 2b) Суміш 3-(бензилокси)-6-метил-2пропанон та діетиловий ефір. Осад відфільтрувапіперидінметанол (0,0314моль) та ΜnO2 (29,52г) з ли, висушили, вихід 2г етил 4-[[1-[2-(4СН2СІ (100мл) перемішували при кімнатній темпехлорофеніл)-2-оксоетил]-1Н бензимідазол-2ратурі протягом ночі потім очищували за допомоіл]аміно]-1-піперидинкарбоксилат (проміжна спогою сілікагелю через скляний фільтр (елюент: 39 74787 40 СН2СІ2 100%). Чисті фракції збирали і розчинник Ν,Ν-диметилформамиді (75мл). Додавали 2випарювали, вихід 6,71г 6-метил-3-(фенілбромофенілетанон (0,28моль). Суміш перемішуметокси)-2-піридинкарбоксальдегід (94%) (проміжвали при кімнатній температурі протягом 1 години. на сполука 6). Додавали H2О та екстрагували суміш з етилацетаc) Суміш проміжної сполуки (6) (0,0385моль) та том. Органічний шар відокремлювали, висушуватріетилортоформіатом в присутності 4ли, фільтрували, і розчинник випарювали. Залиметилбензилсульфонієвої кислоти (0,5г) в толуолі шок очищали методом колонкової хроматографії (200мл) перемішували та нагрівали зі зворотним на силікагелі (елюент: CH2CI2/CH3OH/NH4OH холодильником 6 годин. Розчинник випарювали. 97.5/2.5/0.1). Чисті фракції збирали та розчинник Залишок розчиняли у Н2О, Na2CO3 та СН2СІ2. Орвипаровували, вихід 4,7г етил4-[[1-(2оксо-2ганічний шар відокремлювали, висушували, фільфенілетил)-1Н-імідазо[4,5-b]піридин-2-іл]метил]-1трували, і розчинник випарювали, вихід 9,6г 2піперидінкарбоксилат (50,5%) (проміжна сполу(діетоксиметил)-6-метил-3-(фенілметокси)піридин ка 10) (83%) (проміжна сполука 7). с) NaBH4 (0,0137моль) порціями додавали при d) Проміжну сполуку (7) (0,03185моль) та про5°С під течією N2 до суміші проміжної сполуки (10) міжну сполуку (5) (0,03185моль) нагрівали до 150° (0,0137моль) та метанолу (100мл). Суміш гідроліта очищували за допомогою силікагелю через зували з Н2О та екстрагували з етилацетатом. Орскляний фільтр (елюент: СН2СІ2/СН3ОН/NН3) 98/2). ганічний шар відокремлювали, висушували, фільЧисті фракції збирали та розчинник випаровували, трували, і розчинник випарювали, вихід 5,6г (±)вихід 10,25г (+)-1,1-диметилетил4-[[1-[етоксиетил 4-[[1-(2-гідрокси-2-феніл-етил)-1Н-імідазо[4,56метил-3(фенілметокси)-2-піридин]метил]-1Нb]піридин-2-іл]метил]-1-піперидінкарбоксилат бензимідазол-2-іл[аміно]-1-піперидінкарбоксилат (проміжна сполука 11). (56%) (проміжна сполука 8) Приклад А5 е) Суміш 2-(діетоксиметил)-6-бромо-піридин Суміш (±)-1-[етокси(6-метил-2(0,03моль), проміжної сполуки 5 (0,03моль) та 4піридиніл)метил]-№(4-піперидініл)-1Нметилбензенсульфонової кислоти (92г) з толуолом бензимідазол-2-амін (0,00205моль), 1-хлоро-2(700мл) перемішували та нагрівали зі зворотним пропанон (0,00308моль) з K2СО3 (0,0041моль) у холодильником 20 годин використовуючи водний ацетонитрилі (8мл) перемішували та нагрівали з сепаратор. 4-метилбензенсульфонову кислоту обратним холодильником протягом 8 годин. Додадодавали та суміш перемішували та нагрівали зі вали воду та екстрагували суміш з етилацетатом. зворотним холодильником протягом 48 годин. 4Органічний шар відокремлювали, висушували, метилбензенсульфонову кислоту додавали знову фільтрували, і розчинник випарювали. Залишок та суміш перемішували та нагрівали зі зворотним очищали методом колонкової хроматографії на холодильником протягом ще 48 годин. 4силікагелі (елюент: СH2Сl2/СH3ОН/NH4OH метилбензенсульфонову кислоту додавали знову. 97/3/0.1).Чисті фракції збирали та розчинник випаСуміш перемішували та нагрівали зі зворотним ровували, вихід 0,67г (±)-1-[4-[[1-[етокси(6-метил-2холодильником протягом 24 годин, потім охолопіридиніл)метил]-1Н-бензимідазол-2-іл]аміно]-1джували та промивали з розведеним розчином піперидініл]-2-пропанон (77%) (проміжна сполуNaOH. Органічний шар відокремлювали, висушука 12). вали, фільтрували, і розчинник випарювали. ЗаПриклад А6 лишок очищали методом колонкової хроматогра4-метилбензенсульфоніл хлорид (0,2222моль) фії на силікагелі (елюент: CН2CI2/C2H5OH 95/5). додавали порціями при температурі 10°С до суміЧисті фракції збирали, і розчинник випарювали. ші 1,1-діметилетил [1-(гідроксиметил)-2Залишок суспензований в петролейному ефірі. метилпропіл]карбамоат (0,202моль) та піридину Залишок відфільтровували та висушували, вихід (65мл). Суміш перемішували при температурі 10°С 1,4г (±)-1,1-диметилетил4-[[1-[(6-бромопротягом 2 годин. Н2О (75мл) доводили до 10°С. 2піридиніл]етоксиметил]-1Н-бензимідазол-2Осад відфільтровували, промивали водою та доіл[аміно]-1-піперидінкарбоксилат (9%) (проміжна давали до СН2СІ2. Органічний розчинник промивасполука 33). ли водою, висушували, фільтрували та розчинник Приклад A4 випарювали, вихід 49г (+)-1,1-диметилетил[1-[[[(4a) Суміш 2,3-піридиндіаміну (0,05моль) та етиметилфеніл)-сульфоніл]окси]іметил]-2лу 4-(2-етокси-2-іміноетил)-1-піперидінкарбоксилат метилпропіл]карбамат (68%) (проміжна сполумоногідрохлориду (0,05моль) у метанолі (150мл) ка 13). перемішували та нагрівали зі зворотним холодиПриклад А7 льником протягом 3 діб. Розчинник випаровували a) Суміш, яка містить (±)-1,1-диметилетил 4та осад розчиняли у СH2СІ2. Органічний розчинник [[1-[(6-бромо-2-піридиніл]етоксиметил]-1Нпромивали з 10% K2СО3, висушували, фільтрувабензимідазол-2-ілі]аміно]-1-піперидінкарбоксилат. ли та розчинник випаровували. Залишок очищали (0,00189моль) (проміжна сполука 33), Pd (0.026г), методом колонкової хроматографії на силікагелі (R)-(+)-2,2'-біс(діфеніл-фосфіно)-1,1'-бінафтіл (елюент: CH2CI2/CH3OH/NH4OH 94/6/0.1). Чисті (0,046г), та газ Na(СН3)2 (10г), тетрагідрофуран фракції збирали та розчинник випаровували, вихід (200мл) перемішували в автоклаві при 100°С про7,6г етил 4-[(1Н-імідазо[4,5-b]піридин-2-іл)метил]тягом 16 годин під тиском CO (30атм). Суміш філь1-піперидінкарбоксилат (52%) (проміжна сполутрували та фільтрат випаровували. Залишок прока 9). пускали через силікагель на скляному фільтрі b) NaH (0,028моль) додавали порціями при (елюент: CH2CI2/CH3OH/NH3OH 99/1). Чисті фрак0°С до суміші проміжної сполуки (9) (0,023моль) у ції збирали та розчинник випаровували, вихід 0,8г 41 74787 (±)-1,1-діметилетил4-[[1-[[6-(діметилетиламіно)-2піридиніл]етоксиметил]-1Н-бензимідазол-2іл]аміно]-1-піперидінкарбоксилат (86%) (проміжна сполука 14). b) Суміш проміжної сполуки 33 (0,0032моль), Pd (0,030г), 1,3-пропанеділбіс[діфенілфосфін] (0,110г) з тетрагідрофураном (100мл) в присутності рідкого аміаку (10атм) та газу CO (30атм) перемішували протягом 16 годин при температурі 100°С. Розчинник випаровували. Залишок пропускали через силікагель на скляному фільтрі (елюент: CH2CI2/CH3OH/NH3OH 98/2). Чисті фракції збирали та розчинник випаровували, вихід 0,15г, проміжна сполука 41. Приклад А8 Суміш -[[(3-аміно-2піридиніл)аміно]метил]бенземетанол (0,043моль), етил 4-ізотіоціанато-1-піперидінкарбоксилат (0,047моль) та толуолу (200мл) перемішували та нагрівали зі зворотним холодильником протягом 30 хвилин. Додавали Ν,Ν'-метанететраілбісциклогексанамін (0,065моль) та суміш перемішували та нагрівали зі зворотним холодильником протягом ночі. Розчинник випаровували. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH 96/4/0,2). Чисті фракції збирали та розчинник випаровували. Частину осаду (1,5г) кристалізували з діізопропіл ефіром. Осад відфільтровували та висушували, вихід 1,35г (±)-етил[4-[[1-(2-гідрокси-2фенілетил)-1Н-імідазо[4,5-b]піридин-2-іл]аміно]-1піперидінкарбоксилат (проміжна сполука 15). Приклад А9 Реакція проходить під течією N2. NaH 60% (0,02моль) додавали до суміші 1,1-діметил-етил 4(1Н-бензимідазол-2-іламіно)-1піперидінкарбоксилат (0,02моль) та Ν,Νдіметилформаміду (100мл). Суміш перемішували при температурі 40°С протягом 1 години. 6(Епоксиетил)-2-піколін (0,02моль)додавали до невеликої кількості Ν,Ν-діметилформаміду. Суміш перемішували при температурі 100°С протягом ночі. Розчинник випарювали. До залишку додавали воду та СР2СІ2. Органічний шар відокремлювали, висушували, фільтрували, і розчинник випарювали. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3ОН 95/5 та 90/10). Чисті фракції збирали та розчинник випарювали, вихід 3,5г (±)-1,1діметилетил4-[[1-[2-гідрокси-2-(6-метил-2піридиніл)етил]-1Н-бензимідазол-2-іл]аміно]-1піперидінкарбоксилат (проміжна сполука 16). У Таблицях 1, 2 та 3 подається перелік проміжних сполук, що були одержані аналогічно з одним із наведених вище прикладів. 42 В. Приготування кінцевих сполук Приклад В1 Суміш проміжної сполуки (4) (0,0102моль) у НСІ 3N (80мл) та 2-пропанол (10мл) перемішували при температурі 40°С протягом 2 годин. Суміш доводили до кімнатної температури та виливали на лід. Додавали СH2Сl2. Дану суміш підлуговували твердим K2СО3, перемішували при кімнатній 43 74787 44 температурі та екстрагували з СH2Сl2. Органічний силікагелі (елюент: СН2СІ2/(СН3ОНNH3) 90/10). шар відокремлювали, промивали водою, висушуЧисті фракції збирали та розчинник випарювали., вали, фільтрували, і розчинник випарювали. Завихід 1,5г (±)-1-[етокси(2-піридиніл)метил]-N-4лишок кристалізували з діетилового ефіру та піперидініл)]-2-бензимідазол-2-аміно (39%) (сполуСН3ОН. Осад відфільтровували, висушували, вика 5). хід 2,9г (+)-1-(2-метокси-2-фенілетил)-N-(4Приклад В5 піпиридініл)-1Н-бензимідазол-2-амін (81%) (сполуNaBH4 (0,0078моль) додавали по краплях до ка 1). суміші проміжної сполуки (2) (0,0078моль) у тетраПриклад В2 гідрофурані (50мл) та метанолі (50мл), та суміш Суміш проміжної сполуки (11) (0.0139моль) та перемішували при температурі 5°С під течією N2 КОН (0,1моль) у 2-пропанолі (200мл) перемішувапротягом 2 годин. Суміш гідролізували на холоді з ли та нагрівали зі зворотним холодильником проН2О (3мл) та розчинник випаровували. Осад фільтягом ночі. Розчинник випарювали, залишок очитрували, промивали з H2O та висушували. Залищали методом колонкової хроматографії на шок (3г) кристалізували з діізопропіл ефіру. Осад силікагелі (елюент: СН2СІ2/СН3ОНNH4OH 80/20/3). відфільтровували та висушували, вихід 2,9г 9г Чисті фракції збирали та розчинник випарювали. (4-хлорофеніл)-2-(4-піперидінаміно)-1НЗалишок перетворювали в сіль етандіолової кисбензимідазол-1-етанол (100%) (сполука 6). лоти (1:2) з етандіоловою кислотою. Суміш крисПриклад В6 талізували з 2-пропанону. Осад відфільтровували Суміш проміжної сполуки (4) (0,0035моль), 1,1та висушували, вихід 3,9г -феніл-2-(4діметилетил (2-бромометил)-карбамоат піперидінілметил)-1H-імідазо[4,5-b]піридин-1(0,005моль) та Na2CO3 (0,01моль) у 2-бутаноні етанол етандіол (1:2) (сполука 2). (100мл) перемішували та нагрівали зі зворотним Приклад В3 холодильником протягом 20 годин. Додавали H2О. a) Суміш проміжної сполуки (8) (0,00175моль) Органічний шар відокремлювали, висушували, у фторуксусній кислоті (20мл) та СН2СІ2 (50мл) фільтрували, і розчинник випарювали. Залишок перемішували при кімнатній температурі протягом очищали методом колонкової хроматографії на 2 годин, виливали в льодяну воду та відлуговувасилікагелі (елюент: СН2СІ2/СН3ОН від 95/5 до ли з розчином NaOH. Додавали СН2СІ2. Органіч90/10). Чисті фракції збирали та розчинник випаний шар відокремлювали, висушували, фільтруварювали, вихід 1,3г -1,1-діметилетил[2-[4-[[1-[(6ли, і розчинник випарювали. Залишок очищали бромо-2-піридиніл)етоксиметил]-1Н-бензимідазолчерез силікагель на скляному фільтрі (елюент: 2-іл]аміно]-1-піперидініл]етил]карбамат (сполука СН2СІ2/СН3ОНNН3 90/10). Чисті фракції збирали та 7). розчинник випарювали. Залишок перетворювали в Приклад В7 сіль соляної кислоти (1:3). Осад відфільтровували, Суміш проміжної сполуки (4) (0,00348моль), висушували, вихід 0,48г (±)-1-[етокси[6-метил-(3проміжна сполука (13) (0,00348моль) та K2СО3 фенілметокси)-2-піридиніл]метил]-N-(4(0,01392моль) у ацетонітриті (20мл) та Ν,Νпіпиридініл)-1Н-бензимідазол-2-аміно тетрахлорід діметилформамід (4мл) перемішували при темпедігідрат 2-пропанолат (1:1) (сполука 3). ратурі 60°С протягом 4 годин (1 еквівалент проміb) Суміш (±)-1,1-діметилетил 4-[[1-[6-бромо-2жної сполуки (13) додавали кожну годину) та потім піридиніл)етоксиметил]-1Н-бензимідазол-2охолоджували. Розчинник випарювали. Залишок іл]аміно]-1-піперидінкарбоксилат (0,0026моль) у 2додавали у СН2СІ2. Органічний розчинник промипропанолі (30мл) та НВr/СН3СООН (2мл) перемівали з H2О, висушували, фільтрували та розчиншували та нагрівали зі зворотним холодильником ник випаровували. Залишок очищали методом протягом 2 годин потім охолоджували. Розчинник колонкової хроматографії на силікагелі (елюент: випарювали. Залишок додавали у воду та СН2СІ2. CH2CI2/CH3OHNH4OH 96.5/3.5/0.1). Дві чисті фракСуміш відлуговували з розчином NaOH. Органічції збирали та їх розчинник випарювали, вихід 1г ний шар відокремлювали, промивали Н2О, вису1,1-діметилетил [1-[[4-[[1-[(6-бромо-2шували, фільтрували, і розчинник випарювали. піридиніл)етоксиметил]-1Н-бензимідазол-2Залишок очищали методом колонкової хроматогіл]аміно]-1-піперидініл]метил]-2рафії на силікагелі (елюент: CH2CI2/CH3OHNH3 метилпропіл]карбамат (сполука 8). 90/10). Чисті фракції збирали та розчинник випаПриклад В8 рювали. Залишок розчиняли у нафтовому ефірі. Суміш проміжної сполуки (7) (0,0026моль) у 2Осад відфільтровували та висушували. Цю фракпропанолі (30мл) та НВr/оцетова кислота (2мл) цію рекристалізували з невеликої кількості CH3CN. перемішували та нагрівали зі зворотним холодиОсад відфільтровували та висушували, вихід 0,22г льником протягом 90 хвилин та потім охолоджува1-[(6-бромо-2-піридиніл)етоксиметил]-N-(4ли. Розчинник випарювали. Залишок додавали у піпериніділ)-1Н-бензимідазол-2-іл]аміно (19,6%) СН2СІ2 та H2О. Органічний розчинник відокремлю(сполука 4). вали, висушували, фільтрували та розчинник виПриклад В4 паровували. Залишок очищали методом колонкоСуміш (±)-1-[етокси(2-піридиніл)метил]-N-[1вої хроматографії на силікагелі (елюент: (фенілметил)-4-піперидініл]-1Н-бензимідазол-2СH2СІ2/СН3ОНNН3) 90/10). Чисті фракції збирали аміно (0,011моль) у метанолі (150мл) гідрогенізута розчинник випарювали. Залишок розчиняли у вали 4 доби з Pd/C 10% (2г), в якості каталізатора. діізопропіл ефірі. Осад відфільтровували та висуПісля виділення H2 (1 еквівалент), каталізатор вішували. Цю фракцію знов очищали методом колодфільтрували та фільтрат випарили. Залишок нкової хроматографії на силікагелі (елюент: очищали методом колонкової хроматографії на СH2СI2/СН3ОНNH4ОН) 90/10). Чисті фракції збира 45 74787 46 ли та розчинник випарювали. Залишок розчиняли піперидініл]-аміно]-1Н-бензимідазол-2-іл](6-метилу діізопропіл ефірі. Осад відфільтровували та ви2-піридиніл)метокси]етанол моногідрат (18%) сушували, вихід 0,23г (+)-N-[1-(2-аміноетил)-4(сполука 13). піперидініл]-1-[(6-бромо-2-піридиніл)етоксиметил]Приклад В13 1Н-бензимідазол-2-аміно (сполука 9). Суміш (±)-1-[4-[[1-(2-етоксиетокси)(6-метил-2Приклад В9 піридиніл)метил]-1Н-бензимідазол-2-іл]аміно]-1Суміш проміжної сполуки (8) (0,00162моль) у піперидініл]-3-метил-2-бутанон (0,0032моль) у 2-пропанол/НСl (1мл) та 2-пропанол (10мл) переNH3/CH3OH (200мл) гідрогенізували протягом 3 діб мішували та нагрівали зі зворотним холодильнипри температурі 20°С з Rh/АІ2О3 5% (1г) в якості ком протягом 1 години, потім охолоджували. Розкаталізатора в присутності розчину тіофену (2мл). чинник випарювали. Залишок додавали у СН2СІ2. Після виділення H2 (1 еквівалент), каталізатор віОрганічний розчинник промивали з K2СО3 10% та з дфільтровували та фільтрат випаровували. ЗалиН2О, висушували фільтрували та розчинник випашок очищали методом колонкової хроматографії рювали. Залишок очищали методом колонкової на силікагелі (елюент: СН2СІ2/(СН3ОН/NН3 93/5). хроматографії (елюент: CH2CI2/CH3OHNH4OH Чисті фракції збирали та розчинник випарювали. 94/6/1). Чисті фракції збирали та розчинник випаЗалишок кристалізували з дізопропіл ефіру, відфірювали, вихід 0,23г (±)-N-[1-(2-аміно-3льтровували та висушували, вихід 0,58г (±)-Ν-[1метилбутіл)-4-піперидініл]-1-[(6-бромо-2(2-аміно-3-метилбутіл)-4-піперидініл]-1-[(2піридиніл)етоксиметил]-1Н-бензимідазол-2-аміно етоксиетокси)(6-метил-2-піридиніл)метил]-1Н(сполука 10). бензимідазол-2-аміно (сполука 14). Приклад B10 У Таблицях 4-8 подається перелік сполук фоСуміш (±)-1,1-діметилетил[2-[4-[[1-[етокси[6рмули (І), що були одержані згідно з одним із наметил-3(фенілметокси)-2-піридиніл)метил]-1Нведених вище прикладів. бензимідазол-2-іл]аміно]-1піперидініл]етил]карбамат (0,0016моль) та КОН (1г) у сухому бутанолі (25мл) перемішували та нагрівали зі зворотним холодильником протягом 6 годин. Розчинник випарювали. Залишок очищали через силікагель на скляному фільтрі (елюент: СH2Сl2/(СН3ОНNН3) від 95/5, 93/7 до 90/10). Чисті фракції збирали та розчинник випарювали. Залишок перетворювали на сіль соляної кислоти (1:3). Осад відфільтровували та висушували, вихід 0,5г (±)-N-[1-(2-аміноетил)-4-піперидініл]-1-[етокси[6метил-3-(фенілметокси)-2-піридиніл]-метил]-1Нбензимідазол-2-аміно тригідрохлорид дігідрат (сполука 11). Приклад В11 Суміш проміжної сполуки (12) (0,0016моль) та бензенеметанаміну (0,0048моль) у метанолі (7мл) гідрогенізували при 40°С під тиском 5бар протягом 8 годин з Pd/C (0,07г) в якості каталізатора. Після виділення H2 (1 еквівалент), каталізатор фільтрували через целіт, промивали з СН3ОН та СН2СІ2 та фільтрат випарювали. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: СH2Сl2/(СН3ОНNH4OH 93/7/0.7). Чисті фракції збирали та розчинник випарювали. Залишок кристалізували з діетил ефіру. Осад відфільтровували та висушували, вихід 0,4г (±)-№[1-(2-амінопропіл)-4піперидініл]-1-[етокси(6-метил-2-піридиніл)метил]1Н-бензимідазол-2-аміно (59%) (сполука 12). Приклад В12 Суміш (+)-N-[1-(2-аміноетил)-4-піперидініл]-1[(6-метил-2-піридиніл)[2(фенілметокси)етокси]метил]-1Н-бензимідазол-2аміно (0,003моль) у метанолі (150мл) перемішували при кімнатній температурі з Pd/C 10% (0,5г) в якості каталізатора. Після виділення Н2 (1 еквівалент), каталізатор відфільтровували та фільтрат випаровували. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: СН2СІ2/(СН3ОНNН3) 90/10). Чисті фракції збирали та розчинник випарювали. Залишок розчинювали у нафтовому ефірі. Осад відфільтровували та висушували, вихід 0,23г (±)-2-[[2-[[1-(2-аміноетил)-4 47 Продовження таблиці 5 74787 48 С. Фармакологічний приклад Приклад С1: In vitro скринінг активності проти респіраторного синцитіального вірусу. Ступінь захисту у відсотках проти цитопатології, спричиненої вірусами (антивірусна активність або ІС50), що досягається випробуваними сполуками, та їх цитотоксичність (СС50) обчислювались за кривими дозачутливість. Селективність антивірусного ефекту подається індексом селективності (SI), що обчислюється шляхом поділу СС50 (цитотоксичної дози для 50% клітин) на ІС50 (антивірусна активність для 50% даних клітин). Для визначення ІС50 та СС50 випробуваних сполук застосовували автоматизовані колориметричні проби на основі тетразолію. Пластикові мікротитрувальні 96-коміркові планшети з плоским дном заповнювали 180мкл базального середовища Ігл (Eagle's Basal Medium), що було доповнене 5% FCS (сироватка плода корови) (0% для FLU) та 20мМ буфера Гепес (Hepes). Потім додавали маточні розчини (7,8 кінцевим тестовим концентраціям) сполук у 45мкл об'ємах до ряду трикратно дубльованих комірок з метою одночасної оцінки впливу даних сполук на інфіковані вірусом клітини та на клітини з імітацією інфікування. Безпосередньо у мікротитрувальних планшетах з використанням роботосистеми готували п'ять п'ятикратних розведень. У кожен дослід включали необроблені контрольні проби вірусу та контрольні клітини HeLa. До двох із трьох рядів в об'ємі 50мкл дода 49 74787 50 вали приблизно 100 ТСID50 респіраторного синметра з комп'ютерним контролем (Multiskan МСС, цитіального вірусу. Той самий об'єм середовища Flow Laboratories) при двох (540 та 690нм) вимідодавали до третього ряду для вимірювання циторювали оптичну густину. Оптична густина, що витоксичності даних сполук при тих самих концентмірювалась при 690нм, автоматично віднімалась раціях, що використовувались для вимірювання від густини при 540нм, щоб виключити ефекти неантивірусної активності. Через дві години інкубуспецифічної абсорбції. вання до всіх комірок додавали суспензію Перелік окремих значень ІС50, СС50 та SI на(4 105клітин/мл) клітин HeLa в об'ємі 50мкл. Дані ведений у наступній Таблиці 9. культури інкубували при 37°С в атмосфері 5% СO2. Через сім днів після інфікування цитотоксичТаблиця 9 ність та антивірусну активність визначали спектрофотометричним способом. До кожної комірки Спол. № IC50 (мкМ) СС50 (мкМ) SI мікротитрувального планшета додавали 25мкл 87 0,00032 10.12 31623 розчину МТТ (3-(4,5-диметилтіазол-2-іл)-2,510 0,0006 37.86 63096 дифенілтетразолій бромід). Планшети додатково 88 0,002 20 10000 інкубували при 37°С протягом 2 годин, після чого 67 0,004 63.40 15849 середовище вилучали із кожної чашки. Розчиннос13 0,0126 >100,08 >7943 ті кристалів формазану досягали шляхом уведен58 0,0501 79.411585 ня 100мкл 2-пропанолу. Цілковите розчинення 11 0,1259 9.95 79 кристалів формазану відбувалось після поміщення 80 0,1289 >99.45 >79 планшетів на планшетний шейкер на 10 хвилин. Нарешті, за допомогою восьмиканального фото Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюRespiratory syncytial virus replication inhibitors
Автори англійськоюJanssens, Frans, Eduard, Sommen Francois Maria
Назва патенту російськоюИнгибиторы репликации респираторно-синцитиального вируса
Автори російськоюЯнссенс Франс Эдуард, Соммен Франсуа Мария
МПК / Мітки
МПК: A61K 45/00, C07D 471/04, A61K 31/4545, A61P 31/14, C07D 401/14, C07B 61/00, C07D 401/12, A61K 31/454, A61P 31/12, A61K 31/437, A61P 11/00, A61P 43/00
Мітки: респіраторно-синцитіального, інгібітори, вірусу, реплікації
Код посилання
<a href="https://ua.patents.su/25-74787-ingibitori-replikaci-respiratorno-sincitialnogo-virusu.html" target="_blank" rel="follow" title="База патентів України">Інгібітори реплікації респіраторно-синцитіального вірусу</a>
Попередній патент: Спосіб надлишкових вимірювань тиску та пристрій для його здійснення
Наступний патент: Спосіб лікування алергічних кон’юктивітів за допомогою кетотифену
Випадковий патент: Вітронасосна установка