Антагоністи аденозинових рецепторів, спосіб їх одержання та використання
Номер патенту: 77937
Опубліковано: 15.02.2007
Автори: Даулінг Джеймс Е., Кумаравел Гнанасамбандам, Петтер Расселл С., Енсінгер Керол Л.
Формула / Реферат
1. Сполука, що має формулу:
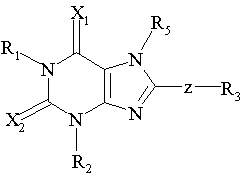 ,
,
де R1 і R2 незалежно вибрані з групи, що складається з:
(a) водню;
(b) алкілу, алкенілу, що має не менше 3 атомів вуглецю, або алкінілу, що має не менше 3 атомів вуглецю, де вказані алкіл, алкеніл або алкініл є або незаміщеними, або функціоналізованими одним або двома замісниками, вибраними з групи, що складається з гідрокси, алкокси, аміно, алкіламіно, діалкіламіно, гетероциклілу, ациламіно, алкілсульфоніламіно і гетероциклілкарбоніламіно; і
(c) арилу і заміщеного арилу;
R3 представляє біциклічну або трициклічну групу, вибрану з групи, що складається з:
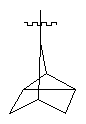 ,
,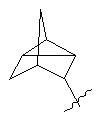 ,
,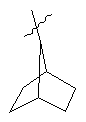 ,
,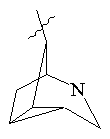 ,
,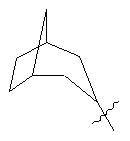 ,
,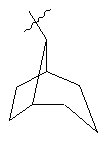 ,
,
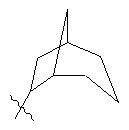 ,
,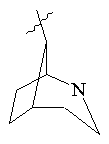 ,
,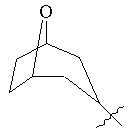 ,
,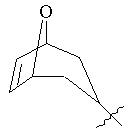 ,
,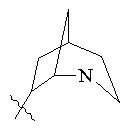 ,
,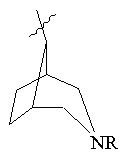 ,
,
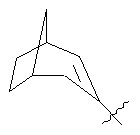 ,
,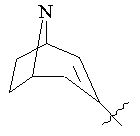 ,
,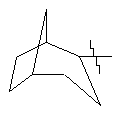 ,
,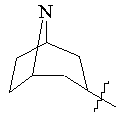 ,
,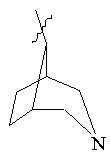 ,
,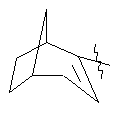 ,
,
де вказана біциклічна або трициклічна група є незаміщеною, або
функціоналізованою одним або декількома замісниками, вибраними з групи, що складається з:
(a) алкілу, алкенілу і алкінілу; де вказані алкіл, алкеніл і алкініл є або незаміщеними, або функціоналізованими одним або декількома замісниками, вибраними з групи, що складається з алкокси, алкоксикарбонілу, алкоксикарбоніламіноалкіламіно, аралкоксикарбонілу, -R5, діалкіламіно, гетероциклілалкіламіно, гідрокси, заміщеного арилсульфоніламіноалкіламіно і заміщеного гетероцикліламіноалкіламіно;
(b) ациламіноалкіламіно, алкеніламіно, алкоксикарбонілу, алкоксикарбонілалкіламіно, алкоксикарбоніламіноацилокси, алкоксикарбоніламіноалкіламіно, алкіламіно, аміно, аміноацилокси, аралкілоксикарбонілалкілу, карбонілу, карбокси, карбоксіалкенілу, карбоксіалкілу, -R5, R5-алкокси, R5-алкіламіно, діалкіламіноалкіламіно, гетероциклілу, гетероциклілалкіламіно, гідрокси, фосфату, заміщеного арилсульфоніламіноалкіламіно, заміщеного гетероциклілу і заміщеного гетероцикліламіноалкіламіно;
R4 вибраний з групи, що складається з -Н, -С1-4алкілу, -С1-4алкіл-СО2Н і фенілу, і є або незаміщеним, або функціоналізованим одним або декількома замісниками, вибраними з групи, що складається з галогену, -ОН, -ОМе, -NH2, -NO2 або бензилу, необов'язково заміщеного однією, двома або трьома групами, вибраними з галогену, -ОН, -ОМе, -NH2 і –NO2;
R5 вибраний з групи, що складається з CH2COOH, -С(СF3)2OН, –CONHNHSO2CF3, -CONHOR4, -CONHSO2R4, -CONHSO2NHR4, -C(OH) R4PO3H2, -NHCOCF3, -NHCONHSO2R4, -NHPO3H2, -NHSO2R4, -NHSO2NHCOR4, -ОРО3Н2, -OSO3Н2, -PO(OH)R4, -РО3Н2, -SO3Н2, -SO2NHR4, -SO3NНСОR4, -SO3NHCONHCO2R4 і
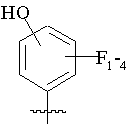 ,
,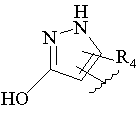 ,
,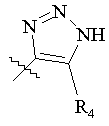 ,
,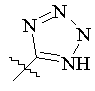 ,
,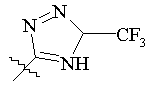 ,
,
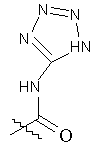 ,
,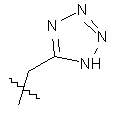 ,
,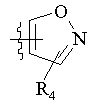 ,
, 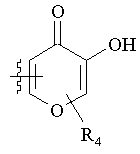 ,
,
Х1 і Х2 незалежно вибрані з О і S;
Z вибраний з групи, що складається з простого зв'язку, -O-, -(СH2)1-3, -O(СН2)1-2, СН2OСН2-, -(CH2)1-2О-, -СН=СНСН2-, -СН=СН- і СН2СН=СН-; і
R6 вибраний з групи, що складається з водню, алкілу, ацилу, алкілсульфонілу, аралкілу, заміщеного аралкілу, заміщеного алкілу і гетероциклілу.
2. Сполука за п.1, де вказана сполука приймає форму, вибрану з групи, що складається з ахіральної сполуки, рацемату, оптично активної сполуки, чистого діастереомеру, суміші діастереомерів або фармацевтично прийнятної адитивної солі.
3. Сполука за п. 1, де кожний з R1 і R2 представляє алкільні групи.
4. Сполука за п. 1, де кожний з R1 і R2 представляє н-пропіл.
5. Сполука за п. 4, де Z представляє простий зв'язок.
6. Сполука за п.1, де R3 вибраний з групи, що складається з:
 ,
,  ,
, ,
,
і функціоналізований одним або декількома замісниками, вибраними з карбонілу, гідрокси, алкенілу, алкенілокси, гідроксіалкілу, карбокси, карбоксіалкенілу, карбоксіалкілу, аміноацилокси, карбоксіалкокси, діалкіламіноалкенілу і діалкіламіноалкілу.
7. Сполука за п.1, де R3 представляє:

і функціоналізований одним або декількома замісниками, вибраними з карбонілу, гідрокси, алкенілу, карбоксіалкенілу, гідроксіалкілу, діалкіламіноалкенілу і діалкіламіноалкілу.
8. Сполука за п. 6, де R3 заміщений замісниками, вибраними з групи, що складається з гідрокси, гідроксіалкілу, діалкіламіноалкенілу і діалкіламіноалкілу.
9. Сполука за п. 1, яка являє собою 8-(5-гідрокситрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропіл-3,7-дигідропурин-2,6-діон.
10. Сполука за п. 1, яка являє собою 8-(5-гідроксиметилтрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропіл-3,7-дигідропурин-2,6-діон.
11. Сполука за п. 1, яка являє собою 8-[5-(3-диметиламінопропіліден)-трицикло[2.2.1.02,6]гепт-3-ил] -1,3-дипропіл-3,7-дигідропурин-2,6-діон.
12. Сполука за п. 1, яка являє собою 8-[5-(3-диметиламінопропіл)-трицикло[2.2.1.02,6]гепт-3-ил]-1,3-дипропіл-3,7-дигідропурин-2,6-діон.
13. Сполука за п. 1, де R3 вибраний з:
 ,
, ,
, ,
, ,
,
і функціоналізований одним або декількома замісниками, вибраними з групи, що складається з гідрокси, карбонілу, алкілу, -R5, R5-алкілу, діалкіламіноалкіламіно, алкоксикарбонілалкіламіно, R5-алкіламіно, гетероциклілу, алкеніламіно, аміно, алкіламіно, гетероциклілалкіламіно, ациламіноалкіламіно, фосфату, гетероцикліламіноалкіламіно і гетероцикліламіноалкіламіноалкілу.
14. Сполука за п. 1, де R3 представляє

і функціоналізований одним або декількома заступниками, вибраними з групи, що складається з гідрокси, -R5, R5-алкілу і гідроксіалкілу.
15. Сполука за п. 1, яка являє собою 4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)-біцикло-[3.2.1]октан-1-карбонову кислоту.
16. Сполука за п. 1, де R3 представляє:

і функціоналізований одним або декількома замісниками, вибраними з групи, що складається з алкілу, гідрокси, карбонілу, -R5 і R5-алкілу.
17. Сполука за п. 1, яка являє собою 8-(4-гідрокси-біцикло[3.2.1]окт-6-ил)-1,3-дипропіл-3,7-дигідропурин-2,6-діон.
18. Сполука за п. 1, яка являє собою 8-(4-оксобіцикло[3.2.1]окт-6-ил)-1,3-дипропіл-3,7-дигідропурин-2,6-діон.
19. Сполука за п. 1, де R3 представляє

і функціоналізований одним або декількома замісниками, вибраними з групи, що складається з карбонілу, гідрокси, діалкіламіноалкіламіно, -R5 і заміщеного гетероцикліламіноалкіламіноалкілу.
20. Сполука за п. 1, яка являє собою 8-[8-(2-диметиламіноетиламіно)біцикло[3.2.1]окт-3-ил]-1,3-дипропіл-3,7-дигідропурин-2,6-діон.
21. Сполука за п. 1, яка являє собою 8-(8-гідроксибіцикло[3.2.1]окт-3-ил]-1,3-дипропіл-3,7-дигідропурин-2,6-діон.
22. Сполука за п. 1, де R3 представляє

і функціоналізований одним або декількома замісниками, вибраними з групи, що складається з карбонілу, гідрокси і –R5.
23. Сполука за п. 1, яка являє собою 8-(3-гідрокси-біцикло[3.2.1]окт-8-ил]-1,3-дипропіл-3,7-дигідропурин-2,6-діон.
24. Сполука за п. 6, де R3 вибраний з групи, що складається з:
 ,
, ,
,
і функціоналізований одним або декількома замісниками, вибраними з групи, що складається з гідроксіалкілу, гідрокси і алкоксикарбонілу.
25. Сполука за п. 1, яка являє собою 8-(8-оксабіцикло[3.2.1]окт-6-ен-3-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон.
26. Сполука за п. 1, де R3 представляє:

і функціоналізований одним або декількома замісниками, вибраними з групи, що складається з карбонілу, аралкілоксикарбонілалкілу і алкоксикарбонілалкілу.
27. Сполука за п. 1, яка являє собою 8-(2-оксо-3-азабіцикло[3.2.1]окт-8-ил)-1,3- дипропіл-3,7-дигідропурин-2,6-діон.
28. Лікарська композиція, що містить сполуку за п.1 разом з відповідним наповнювачем.
29. Спосіб лікування індивідуума, який страждає станом, що характеризується підвищеною концентрацією аденозину і/або підвищеною чутливістю до аденозину, що передбачає введення вказаному індивідууму ефективної кількості аденозинінгібуючої сполуки за п. 1.
30. Спосіб за п. 29, де вказаний стан вибрано з: порушень роботи серця і кровообігу, дегенеративних розладів центральної нервової системи, захворювань дихальних шляхів, захворювань, при яких показано лікування діуретиками, хвороби Паркінсона, депресії, травматичного ураження головного мозку, післяшокового неврологічного розладу, пригнічення дихання, травми головного мозку у новонароджених, дислексії, гіперактивності, кістозного фіброзу, цирозних асцитів, апное новонароджених, ниркової недостатності, діабету, астми і станів, що супроводжуються набряками.
31. Спосіб за п. 29, де вказаний стан вибрано із застійної серцевої недостатності або дисфункції нирок.
32. Спосіб одержання 8-заміщених ксантинів, що включає стадії:
a) одержання N7, С8-дигідроксантину;
b) введення захисту вказаного ксантину в N7-положенні;
c) депротонування С8-положення сильною основою з одержанням аніона;
d) уловлювання (захоплення) вказаного аніона карбоксильною, карбонільною, альдегідною або кетонною сполукою; і
e) зняття захисту в захищеному N7-пoлoжeннi з одержанням 8-заміщеного ксантину.
Текст
1. Сполука, що має формулу: 2 (13) 1 C2 (54) АНТАГОНІСТИ АДЕНОЗ ИНОВИХ РЕЦ ЕПТОРІВ, СПОСІБ ЇХ ОДЕРЖАННЯ ТА ВИКОРИСТАННЯ 3 77937 4 (a) алкілу, алкенілу і алкінілу; де вказані алкіл, алкеніл і алкініл є або незаміщеними, або функціоналізованими одним або декількома замісниками, вибраними з групи, що складається з алкокси, алкоксикарбонілу, алкоксикарбоніламіноалкіламіно, аралкоксикарбонілу, -R5, діалкіламіно, гетероциклілалкіламіно, гідрокси, заміщеного арилсульфоніламіноалкіламіно і заміщеного гетероцикліламіноалкіламіно; (b) ациламіноалкіламіно, алкеніламіно, алкоксикарбонілу, алкоксикарбонілалкіламіно, алкоксикарбоніламіноацилокси, алкоксикарбоніламіноалкіламіно, алкіламіно, аміно, аміноацилокси, аралкілоксикарбонілалкілу, карбонілу, карбокси, карбоксіалкенілу, карбоксіалкілу, -R5, R5-алкокси, R5-алкіламіно, діалкіламіноалкіламіно, гетероциклілу, гетероциклілалкіламіно, гідрокси, фосфату, заміщеного арилсульфоніламіноалкіламіно, заміщеного гетероциклілу і заміщеного гетероцикліламіноалкіламіно; R4 вибраний з групи, що складається з -Н, -С14алкілу, -С 1-4алкіл-СО2Н і фенілу, і є або незаміщеним, або функціоналізованим одним або декількома замісниками, вибраними з групи, що складається з галогену, -ОН, -ОМе, -NH2, -NO 2 або бензилу, необов'язково заміщеного однією, двома або трьома групами, вибраними з галогену, -ОН, ОМе, -NH 2 і –NO2; R5 вибраний з групи, що складається з CH2COOH, -С(СF3)2OН, –CONHNHSO2CF3, -CONHOR4, CONHSO2R4, -CONHSO2NHR4, -C(OH) R4PO 3H2, NHCOCF3, -NHCONHSO2R4, -NHPO3H2, -NHSO2R4, -NHSO2NHCOR4, -ОРО3Н 2, -OSO3Н2 , -PO(OH)R4, РО3Н2, -SO3Н 2, -SO2NHR4, -SO3NНСОR4, SO3NHCONHCO2R4 і , , N , , , , N , , O O , , HO N NR , , R4 HO , N H N N F 1- 4 , N N NH R4 N N N NH , N , , N N N N , , , N N HN HN CF3 NH , N O , O N N NH , O N, , де вказана біциклічна або трициклічна група є незаміщеною, або функціоналізованою одним або декількома замісниками, вибраними з групи, що складається з: OH O R4 , Х1 і Х2 незалежно вибрані з О і S; R4 , 5 77937 6 Z вибраний з групи, що складається з простого і функціоналізований одним або декількома замісзв'язку, -O-, -(СH2)1-3, -O(СН2) 1-2, СН2OСН2-, -(CH2)1никами, вибраними з групи, що складається з гідрокси, карбонілу, алкілу, -R5 , R5-алкілу, діалкіламі2О-, -СН=СНСН2-, -СН=СН- і СН 2СН=СН-; і R6 вибраний з групи, що складається з водню, алноалкіламіно, алкоксикарбонілалкіламіно, R5кілу, ацилу, алкілсульфонілу, аралкілу, заміщеного алкіламіно, гетероциклілу, алкеніламіно, аміно, аралкілу, заміщеного алкілу і гетероциклілу. алкіламіно, гетероциклілалкіламіно, ациламіноал2. Сполука за п.1, де вказана сполука приймає кіламіно, фосфату, гетероцикліламіноалкіламіно і форму, вибрану з групи, що складається з ахірагетероцикліламіноалкіламіноалкілу. льної сполуки, рацемату, оптично активної сполу14. Сполука за п. 1, де R3 представляє ки, чистого діастереомеру, суміші діастереомерів або фармацевтично прийнятної адитивної солі. 3. Сполука за п. 1, де кожний з R 1 і R2 представляє алкільні групи. 4. Сполука за п. 1, де кожний з R1 і R2 представляє н-пропіл. і функціоналізований одним або декількома засту5. Сполука за п. 4, де Z представляє простий зв'япниками, вибраними з групи, що складається з зок. гідрокси, -R5, R5-алкілу і гідроксіалкілу. 6. Сполука за п.1, де R3 вибраний з групи, що 15. Сполука за п. 1, яка являє собою 4-(2,6-діоксоскладається з: 1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло-[3.2.1]октан-1-карбонову кислоту. 16. Сполука за п. 1, де R3 представляє: , , , і функціоналізований одним або декількома замісниками, вибраними з карбонілу, гідрокси, алкенілу, алкенілокси, гідроксіалкілу, карбокси, карбоксіалкенілу, карбоксіалкілу, аміноацилокси, карбоксіалкокси, діалкіламіноалкенілу і діалкіламіноалкілу. 7. Сполука за п.1, де R3 представляє: і функціоналізований одним або декількома замісниками, вибраними з карбонілу, гідрокси, алкенілу, карбоксіалкенілу, гідроксіалкілу, діалкіламіноалкенілу і діалкіламіноалкілу. 8. Сполука за п. 6, де R3 заміщений замісниками, вибраними з групи, що складається з гідрокси, гідроксіалкілу, діалкіламіноалкенілу і діалкіламіноалкілу. 9. Сполука за п. 1, яка являє собою 8-(5гідрокситрицикло[2.2.1.02,6]гепт-3-ил)-1,3-дипропіл3,7-дигідропурин-2,6-діон. 10. Сполука за п. 1, яка являє собою 8-(5гідроксиметилтрицикло[2.2.1.02,6]гепт-3-ил)-1,3дипропіл-3,7-дигідропурин-2,6-діон. 11. Сполука за п. 1, яка являє собою 8-[5-(3диметиламінопропіліден)-трицикло[2.2.1.02,6]гепт3-ил] -1,3-дипропіл-3,7-дигідропурин-2,6-діон. 12. Сполука за п. 1, яка являє собою 8-[5-(3диметиламінопропіл)-трицикло[2.2.1.02,6]гепт-3ил]-1,3-дипропіл-3,7-дигідропурин-2,6-діон. 13. Сполука за п. 1, де R3 вибраний з: , , , , і функціоналізований одним або декількома замісниками, вибраними з групи, що складається з алкілу, гідрокси, карбонілу, -R5 і R5-алкілу. 17. Сполука за п. 1, яка являє собою 8-(4-гідроксибіцикло[3.2.1]окт-6-ил)-1,3-дипропіл-3,7дигідропурин-2,6-діон. 18. Сполука за п. 1, яка являє собою 8-(4оксобіцикло[3.2.1]окт-6-ил)-1,3-дипропіл-3,7дигідропурин-2,6-діон. 19. Сполука за п. 1, де R3 представляє і функціоналізований одним або декількома замісниками, вибраними з групи, що складається з карбонілу, гідрокси, діалкіламіноалкіламіно, -R5 і заміщеного гетероцикліламіноалкіламіноалкілу. 20. Сполука за п. 1, яка являє собою 8-[8-(2диметиламіноетиламіно)біцикло[3.2.1]окт-3-ил]1,3-дипропіл-3,7-дигідропурин-2,6-діон. 21. Сполука за п. 1, яка являє собою 8-(8гідроксибіцикло[3.2.1]окт-3-ил]-1,3-дипропіл-3,7дигідропурин-2,6-діон. 22. Сполука за п. 1, де R3 представляє і функціоналізований одним або декількома замісниками, вибраними з групи, що складається з карбонілу, гідрокси і –R5. 23. Сполука за п. 1, яка являє собою 8-(3-гідроксибіцикло[3.2.1]окт-8-ил]-1,3-дипропіл-3,7дигідропурин-2,6-діон. 7 77937 8 24. Сполука за п. 6, де R3 вибраний з групи, що трацією аденозину і/або підвищеною чутливістю складається з: до аденозину, що передбачає введення вказаному O O індивідууму ефективної кількості аденозинінгібуючої сполуки за п. 1. 30. Спосіб за п. 29, де вказаний стан вибрано з: порушень роботи серця і кровообігу, дегенеративних розладів центральної нервової системи, за, , хворювань дихальних шляхів, захворювань, при і функціоналізований одним або декількома замісяких показано лікування діуретиками, хвороби Паниками, вибраними з групи, що складається з гідркінсона, депресії, травматичного ураження голороксіалкілу, гідрокси і алкоксикарбонілу. вного мозку, післяшокового неврологічного розла25. Сполука за п. 1, яка являє собою 8-(8ду, пригнічення дихання, травми головного мозку у оксабіцикло[3.2.1]окт-6-ен-3-іл)-1,3-дипропіл-3,7новонароджених, дислексії, гіперактивності, кістодигідропурин-2,6-діон. зного фіброзу, цирозних асцитів, апное новонаро26. Сполука за п. 1, де R3 представляє: джених, ниркової недостатності, діабету, астми і станів, що супроводжуються набряками. 31. Спосіб за п. 29, де вказаний стан вибрано із застійної серцевої недостатності або дисфункції нирок. 32. Спосіб одержання 8-заміщених ксантинів, що включає стадії: a) одержання N7, С8-дигідроксантину; N b) введення захисту вказаного ксантину в N7і функціоналізований одним або декількома замісположенні; никами, вибраними з групи, що складається з карc) депротонування С8-положення сильною оснобонілу, аралкілоксикарбонілалкілу і алкоксикарбовою з одержанням аніона; нілалкілу. d) уловлювання (захоплення) вказаного аніона 27. Сполука за п. 1, яка являє собою 8-(2-оксо-3карбоксильною, карбонільною, альдегідною або азабіцикло[3.2.1]окт-8-ил)-1,3дипропіл-3,7кетонною сполукою; і дигідропурин-2,6-діон. e) зняття захисту в захищеному N7-пoлoжeннi з 28. Лікарська композиція, що містить сполуку за одержанням 8-заміщеного ксантину. п.1 разом з відповідним наповнювачем. 29. Спосіб лікування індивідуума, який страждає станом, що характеризується підвищеною концен Даний винахід відноситься до антагоністів аденозинових рецепторів і до способів їх одержання і використання для лікування захворювань. Аденозин є внутрішньоклітинним і позаклітинним мессенджером, що генерується всіма клітинами в організмі. Він продукується також позаклітинно шляхом ферментативного перетворення. Аденозин зв'язується з рецепторами, що мають 7 трансмембранних доменів, зв'язаних з трансмембранним g-білком, і активує їх, викликаючи ряд фізіологічних відповідей. Сам аденозин, а також речовини, які імітують дію аденозина (агоністи) і речовини, яку інгібують його дію, мають важливе клінічне застосування. Аденозинові рецептори діляться на чотири відомих підтипи (тобто, А1, А2а, А2b, і А3). Рецептори вказаних підтипів продукують унікальні, а іноді і протилежні один одному ефекти. Активація аденозинового рецептора А1 наприклад, приводить до підвищення резистентності ниркових судин, а активація аденозинового рецептора А2а приводить до зниження резистентності ниркових судин. У системах більшості органів, періоди метаболічних стресів приводять до значного збільшення концентрації аденозину в тканині. Наприклад, в серці продукується і вивільняється аденозин, який опосередковує адаптивні відповіді на стрес, такі як зниження частоти серцевих скорочень і коронарна вазодилатація. Аналогічним образом, концентрації аденозину в нирках підвищуються у відповідь на гіпоксію, метаболічний стрес і присутність багатьох нефротоксичних речовин. Нирки також продукують аденозин конститутивно. Нирки коректують кількість конститутивно продукованого аденозину внаслідок чого відбувається регуляція гломерулярної фільтрації і реабсорбції електролітів. Що стосується регуляції гломерулярної фільтрації, то активація рецепторів А1 приводить до скорочення приносячи (аферентних) артеріол, а активація рецепторів А2а приводить до розширення виносячи (еферентних) артеріол. Активація рецепторів А2а може також надавати судинорозширювальну дію на приносячу артеріолу. Загалом, ефект активації цих гломерулярних аденозинових рецепторів направлений на зниження швидкості гломерулярної фільтрації. Крім того, аденозинові рецептори А1 локалізуються в проксимальних канальцях і дистальних канальцях. Активація цих рецепторів стимулює реабсорбцію натрію з просвіту цих канальців. Відповідно до цього, блокування впливу аденозину на ці рецептори буде приводити до збільшення швидкості гломерулярної фільтрації і до збільшення екскреції натрію. Даний винахід заснований на несподіваному виявленні того факту, що сполуки формули І є сильнодіючими і селективними інгібіторами конк 9 77937 10 ретних підтипів аденозинових рецепторів. АнтагоR5 вибраний з СН2СООН, -C(CF3)2OH ністи аденозину можуть бути використані для поCONHNHSO2CF3, -CONHOR 4, -CONHSO2R4, передження і/або лікування багатьох захворювань, CONHSO2NHR4, -C(OH)R4PO3H2, -NHCOCF3, включаючи порушення роботи серця і кровообігу, NHCONHSO2R4, - NHPO3H2, -NHSO 2R4, дегенеративні розлади центральної нервової сисNHSO2NHCOR4, -OPO3H 2, -OSO3H2 , -PО(ОH)R4, теми, захворювання дихальних шляхів, і багато які PO3H2, -SO 3H, -SO2NHR4, -SO3NHCOR4, хвороби, для яких показано лікування діуретиками. SO3NHCONHCO2R4, і наступних гр уп: В одному з варіантів свого здійснення, даний винахід відноситься до сполуки формули (І): де R1 і R2 незалежно вибрані з: (а) водню; (b) алкілу, алкенілу, що має не менше 3 атомів вуглецю, або алкінілу, що має не менше 3 атомів вуглецю, де алкіл, алкеніл або алкініл є або незаміщеними, або функціоналізованими одним або двома заступниками, вибраними з групи, що складається з гідрокси, алкокси, аміно, алкіламіно, діалкіламіно, гетероциклілу, ациламіно, алкілсульфоніламіно і гетероциклілкарбоніламіно; і (с) арилу і заміщеного арилу. R3 представляє біциклічну або трициклічну груп у, вибрану з: де вказана біциклічна або трициклічна група може бути незаміщеною, або заміщеного одним або декількома (наприклад, одним, двома, трьома або більше) замісниками, вибраними з: (а) алкілу, алкенілу і алкінілу; де вказані алкіл, алкеніл і алкініл є або незаміщеними, або одним або декількома, вибраними з групи, що складається з алкокси, алкоксикарбонілу, алкоксикарбоніламіноалкіламіно, аралкоксикарбонілу, -R5, діалкіламіно, гетероциклілалкіламіно, гідрокси, заміщеного арилсульфоніламіноалкіламіно і заміщеного гетероцикліламіноалкіламіно; (b) ациламіноалкіламіно, алкеніламіно, алкоксикарбонілу, алкоксикарбонілалкіламіно, алкоксикарбоніламіноацилокси, алкоксикарбоніламіноалкіламіно, алкіламіно, аміно, аміноацилокси, карбонілу, - R5, R5-алкокси, R5-алкіламіно, діалкіламіноалкіламіно, гетероциклілу, гетероциклілакіламіно, гідрокси, фосфату, заміщеного арилсульфоніламіноалкіламіно, заміщеного гетероциклілу і заміщеного гетероцикліламіноалкіламіно. R4 вибраний з -Н, -С1-4алкілу, -С1-4-алкіл-СО2Н і фенілу; і може бути або незаміщеним, або функціоналізованим одним або декількома заступниками, вибраними з галогену, -ОН, -ОМе, NH2, -NO2 і бензилу, необов'язково заміщеного однією, двома або трьома групами, вибраними з галогену, -ОН, ОМе, -NH 2 і -NO2 . (S). Χ1 і Х2 незалежно вибрані з кисню (О) і сірки Ζ вибраний з простого зв'язку, -О-, -(СН2)1-3 ,О(СН2)1-2, -СН2ОСН2-, -(СН2) 1-2О-, -СН=СНСН 2-, CH=CH- і СН2СН=СН-. R6 вибраний з водню, алкілу, ацилу, алкілсульфонілу, аралкілу, заміщеного аралкілу, заміщеного алкілу і гетероциклілу. R6, переважно, представляє водень. Однак, якщо R6 представляє метил або інший неводневий заступник, то вказані сполуки можуть бути високоселективними відносно інгібування аденозинових рецепторів А2а. У деяких варіантах здійснення винаходу, R 1 і R2 можуть представляти однакові або різні алкільні групи. Так, наприклад, вони обидва можуть представляти н-пропіл. У деяких варіантах здійснення винаходу, Ζ представляє простий зв'язок. В одному з варіантів здійснення винаходу, R3 вибраний з наступних біцикличних і трициклічних структур: і одним або декількома, вибраними з карбонілу, гідрокси, алкенілу, алкенілокси, гідроксіалкілу, карбокси, карбоксіалкенілу, карбоксіалкілу, аміноацилокси, карбоксіалкокси, діалкіламіноалкенілу і діалкіламіноалкілу. В іншому варіанті здійснення винаходу, R3 представляє: і одним або декількома, вибраними з карбонілу, гідрокси, алкенілу, карбоксіалкенілу, гідроксіалкілу, діалкіламіноалкенілу і діалкіламіноалкілу. Так, наприклад, така сполука може являти собою 8-(5гідрокси-трицикло[2.2.1.02,6]гепт-3-іл)-1,3-дипропіл3,7-дигідропурин-2,6-діон; 8-(5-гідроксиметилтрицикло[2.2.1.02,6]гепт-3-іл)-1,3-дипропіл-3,7дигідропурин-2,6-діон; 8-[5-(3-диметиламінопропіліден)-трицикло[2.2.1.02,6] гепт-3-іл]-1,3дипропіл-3,7-дигідропурин-2,6-діон; або 8-[5-(3диметиламінопропіл)-трицикло [2.2.1.02,6] гепт-3-іл] -1,3- дипропіл-3, 7-дигідропурин-2,6-діон. В іншому варіанті здійснення винаходу, R3 11 77937 12 представляє і одним або декількома, вибраними з гідрокси, карбонілу, алкілу, -R 5, R5-алкілу, діалкіламіноалкіламіно, алкоксикарбонілалкіламіно, R5-алкіл-аміно, гетероциклілу, алкеніламіно, аміно, алкіламіно, гетероциклілалкіламіно, ациламіноалкіламіно, фосфату, гетероцикліламіноалкіламіно і гетероцикліламіноалкіламіноалкілу. У ще одному варіанті здійснення винаходу, R3 представляє і одним або декількома, вибраними з гідрокси, -R5, R5-алкілу і гідроксіалкілу. Так, наприклад, така сполука може являти собою 4-(2,6-діоксо-1,3дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)бицикло-[3.2.1]-октан-1-карбонову кислоту. В іншому варіанті здійснення винаходу, R3 представляє: і одним або декількома, вибраними з алкілу, гідрокси, карбонілу, - R5 і R5-алкілу. Так, наприклад, така сполука може являти собою 8-(4гідрокси-біцикло[3.2.1]окт-6-іл)-1,3-дипропіл-3,7дигідропурин-2,6-діон або 8-(4-оксобіцикло[3.2.1]окт-6-іл)-1,3-дипропіл-3,7дигідропурин-2,6-діон. В іншому варіанті здійснення винаходу, R3 представляє і одним або декількома, вибраними з карбонілу, гідрокси, діалкіламіноалкіламіно, -R5, і заміщеного гетероцикліламіноалкіламіноалкілу. Так, наприклад, така сполука може являти собою 8-[8-(2диметил-аміноетиламіно)-біцикло[3.2.1]окт-3-іл]1,3-дипропіл-3,7-дигідропурин-2,6-діон; або 8-(8гідрокси-біцикло[3.2.1]окт-3-іл]-1,3- дипропіл-3,7дигідропурин-2,6-діон. У ще одному варіанті здійснення винаходу, R3 представляє і одним або декількома вибраними з карбонілу, гідрокси і -R5- Так, наприклад, така сполука може являти собою 8-(3-гідрокси-біцикло[3.2.1]окт-8-іл]1,3-дипропіл-3,7-дигідропурин-2,6-діон. В іншому варіанті здійснення винаходу, R3 представляє: і одним або декількома, вибраними з гідроксіалкілу, гідрокси і алкоксикарбонілу. Так, наприклад, така сполука може являти собою 8-(8-оксабіцикло[3.2.1]окт-6-ен-3-іл)-1,3-дипропіл-3,7дигідропурин-2,6-діон. У ще одному варіанті здійснення винаходу, R3 представляє: і одним або декількома вибраними з карбонілу, аралкоксикарбонілалкілу і алкоксикарбонілалкілу. Так, наприклад, така сполука може являти собою 8-(2-оксо-3-аза-біцикло[3.2,1]окт-8-іл)-1,3дипропіл-3,7-дигідропурин-2,6-діон. Сполука даного винаходу може, наприклад, мати форму ахиральної сполуки, рацемату, оптично активної сполуки, чистого діастереомеру, суміші діастереомерів або фармацевтично прийнятної адитивної солі. Сполуки даного винаходу можуть бути також модифіковані шляхом приєднання відповідних функціональних груп для посилення селективних біологічних властивостей. Такі модифікації відомі фа хівцям і до них відносяться модифікації, які посилюють біологічну проникність в дану біологічну систему (наприклад, в кров, лімфатичну систему, центральну нервову систему), підвищують доступність сполук при пероральному введенні, підвищують розчинність, що дозволяє здійснювати введення шляхом ін'єкції, змінюють метаболізм і/або змінюють швидкість екскреції. Прикладами таких модифікацій є, але не обмежуються ними, етерифікація поліетиленгліколями, дериватизація пиволатами або заступниками у вигляді жирних кислот, перетворення в карбамати, гідроксилювання ароматичних кілець і заміщення по гетероатому в ароматичних кільцях. Даний винахід також відноситься до лікарської композиції, що включає будь-яку з вищезгаданих сполук, взятих або окремо, або в комбінації, разом з відповідним наповнювачем. Даний винахід також відноситься до способу лікування індивідуума, який страждає станом, що характеризується підвищеною концентрацією аденозину і/або підвищеною чутливістю до аденозину і/або підвищеним числом аденозинових рецепторів або підвищеною ефективністю їх скріплення. Вказаний спосіб включає стадію введення вказаному індивідууму певної кількості будь-якої з вищезгаданих сполук, яка є ефективною як антагоніст аденозинового рецептора А1. Вказаним станом може бути, наприклад, порушення роботи серця і порушення кровообігу, дегенеративний розлад центральної нервової системи, захворювання дихальних шляхів, захворювання, при якому показано лікування діуретиками, гіпертензія, хво 13 77937 14 роба Паркінсона, депресія, травматична поразка структур у "H2N-CO2-. "Алкілкарбамоїл" і "діалкілкаголовного мозку, післяшоковий неврологічний розрбамоїл" означають карбамоїльні групи, в яких в лад, пригноблення дихання, травма головного азоту є одна або дві алкільні групи, приєднані замозку у новонароджених, дислексія, гіперактивмість атомів водню, відповідно. Аналогічно, "арилність, кистозний фіброз, цирозний асцит, апное карбамоїльні" і "арилалкіл-карбамоїльні групи" новонароджених, ниркова недостатність, діабет, включають арильну груп у замість одного з атомів астма, стани, що супроводжуються набряками, водню, а в останньому випадку, алкільну групу застійна серцева недостатність або дисфункція замість другого атома водню. нирок, асоційована з використанням діуретиків при "Карбоксильна група" означає -СООН-групу. застійній серцевій недостатності. "Алкокси-група" означає алкіл-О-групу, де теДаний винахід також відноситься до способу рмін "алкіл" визначений вище. одержання 8-заміщених ксантинів. Вказаний спосіб "Алкоксиалкільна група" означає алкільну грувключає стадії одержання N7, С8-дигідроксантіну, пу, визначену вище, із заміною водню алкоксизахист вказаного ксантину в N7-положенні (напригрупою, як описано вище. клад, у вигляді ТНР або ВОМ-ефіру); депротону"Галоген" або "галогено-група" означає фтор, вання С8-положення сильною основою (такою як хлор, бром або йод. діізопропіламід літію або н-бутиллітій) з одержан"Гетероциклільна група" означає кільцеву ням аніона; захоплення вказаного аніона карбокструктур у, що має від 5 до близько 10 членів, де сильною, карбонільною, альдегідною або кетоноодин або декілька атомів в кільці представляють вою сполукою; і зняття захисту в захищеному N7елементи, що не є вуглецем, наприклад, N, О, S. положенні з одержанням 8-заміщеного ксантину. Гетероциклільна група може бути ароматичною Термін, що використовується тут "алкільна або неароматичною, тобто, вона може бути насигрупа" означає насичену аліфатичну вуглеводневу ченою, або частково або повністю ненасиченою. груп у, Алкільна група може бути прямою або розПрикладами гетероциклільних груп є піридил, імігалуженою і може містити, наприклад, від 1 до 6 дазоліл, фураніл, тієніл, тіазоліл, тетрагідрофураатомів вуглецю в ланцюгу. Прикладами прямих ніл, тетрагідропіраніл, морфолініл, тіоморфолініл, алкільних груп є, але не обмежуються ними, етил і індоліл, індолініл, ізоіндолініл, піперидиніл, піримібутил. Прикладами розгалужених алкільних груп є, диніл, піперазиніл, ізоксазоліл, ізоксазолідиніл, але не обмежуються ними, ізопропіл і трет-бутил. тетразоліл і бензімідазоліл. "Алкенільна група" означає аліфатичну вугле"Заміщена гетероциклільна група" означає геводневу груп у, яка має, принаймні, один подвійний тероциклільну груп у, в якій один або декілька атозв'язок. Алкенільна група може бути прямою або мів водню заміщені заступниками, такими як алкорозгалуженою і може мати, наприклад, від 3 до 6 кси, алкіламіно, діалкіламіно, карбалкокси, атомів вуглецю в ланцюгу і 1 або 2 подвійні зв'язкарбамоїл, ціано, галогено, тригалогенметил, гідки. Прикладами алкенільних груп є, але не обмерокси, карбоніл, тіокарбоніл, гідроксіалкіл або жуються ними, аліл і ізопреніл. нітро. "Алкінільна група" означає аліфатичну вугле"Гідроксіалкіл" означає алкільну групу, заміводневу гр упу, яка має, принаймні, один потрійний щену гідроксигрупою. зв'язок. Алкенільна група може бути прямою або "Сульфамоїльна група" має структуру розгалуженою і може мати, наприклад, від 3 до 6 S(O)2NH2. "Алкілсульфамоїл" і "діалкілсульфамоїл" атомів вуглецю в ланцюгу і 1 або 2 потрійні зв'язки. означають сульфамоїльні групи, в яких у азоту є Прикладами алкінільних груп є, але не обмежуодна або дві алкільні групи, приєднані замість ються ними, пропаргіл і бутиніл. атомів водню, відповідно. Аналогічно, "арилсуль"Арильна група" означає фенільну або нафтифамоїльна" і "арилалкілсульфамоїльна" групи льну груп у або їх похідне. "Заміщена арильна грувключають арильну груп у замість одного з атомів па" означає арильну груп у, заміщену одним або водню, а в останньому випадку, алкільну групу декількома заступниками, такими як алкіл, алкокзамість другого атома водню. си, аміно, нітро, карбокси, карбоалкокси, ціано, "Антагоніст" являє собою молекулу, яка зв'язуалкіламіно, діалкіламіно, галоген, гідрокси, гідроється з рецептором без активації вказаного рецепксіалкіл, меркаптил, алкілмеркаптил, тригалогенатора. Ця молекула конкурує з ендогенним ліганлкіл, карбоксіалкіл, сульфокси або карбамоїл. дом за скріплення в даній дільниці і, таким чином, "Аралкільна група" означає алкільну груп у, заослабляє здатність ендогенного ліганду стимулюміщену арильною групою. Прикладом аралкільної вати цей рецептор. групи є бензил. У контексті даного винаходу, "селективний ан"Циклоалкільна група" означає аліфатичне кітагоніст" означає антагоніст, який зв'язується з льце, що складається, наприклад, з 3-8 атомів аденозиновим рецептором даного конкретного вуглецю. Прикладами циклоалкільних груп є цикпідтипу з більш високою афінністю, ніж з рецептолопропіл і циклогексил. рами інших підтипів. "Ацильная група" означає пряму або розгалуАнтагоністи даного винаходу можуть, наприжену алкіл-С(=О)-групу або формільну груп у. Приклад, володіти високою афінністю по відношенню кладами ацильних груп є алканоїльні групи (надо рецептору А1 або по відношенню до рецептору приклад, що мають від 1 до 6 атомів вуглецю в А2а і є селективними, маючи, при цьому, (а) наноалкільній групі). Прикладами ацильних гр уп є ацемолярну афінність скріплення по відношенню до тил і півалоїл. Ацильні групи можуть бути заміщеодного з цих двох підтипів, і (b) афінність скріпними або незаміщеними. лення по відношенню до одного підтипу, яка, при"Карбамоїльна група" означає групу, що має наймні, в 10 раз, більш переважно, в 50 раз, а 15 77937 16 найбільш переважно, в 100 раз перевищує афінвказаного урацил а в умовах Форбрюггена. Після ність по відношенню до іншого підтипу. нітрозування, відновлення, реакції з альдегідом Даний винахід має множину переваг. Вказані або карбоновою кислотою або хлорангідридом сполуки можуть бути легко одержані з легко докарбонової кислоти, алкілування у N1 урацила і ступних початкових матеріалів при здійсненні відзамикання кільця одержують ксантини. носно невеликого числа стадій. Вказані сполуки У конкретному випадку, анти-3-оксомають ряд варіабельних дільниць, що дозволяє трицикло[2.2.1.02,6]-гептан-3-карбонова кислота здійснювати систематичну оптимізацію. Оскільки може бути легко синтезована з норборнадину, вказані сполуки є А1- специфічними антагоністами, параформальдегіду, мурашиної кислоти і сірчаної то вони можуть мати широке застосування в мекислоти [див. наприклад, J.Am.Chem.Soc. 99, 4111, дицині. Оскільки вказані сполуки володіють силь1977; Tetrahedron 37 Supplement №1 411, 1981. ною активністю і є А1- специфічними антагоністаВона може бути легко виділена з використанням ми, то вони (1) можуть бути використані в низьких ліпази A Candida antartica (Tetrahedron Lett. 37, дозах для мінімізації імовірності виникнення побіч3975, 1996)]. них ефектів і (2) вони можуть бути введені у виУ багатьох випадках, потрібні альдегіди, кетон, гляді численних лікарських форм, включаючи, але карбонові кислоти і хлорангідриди карбонових кине обмежуючись ними, драже, таблетки, капсули, слот є комерційно доступними [наприклад, від аерозолі, супозиторії, рідкі композиції для перораAldrich Chemical Co., Inc., Milwaukee, Wise.], або льного введення або ін'єкцій, харчові добавки або вони можуть бути легко одержані з комерційно препарати для місцевого застосування. Крім задоступних матеріалів добре відомими методами стосувань в медицині, вказана сполука-антагоніст синтезу. Такими методами синтезу є, але не обможе бути використана для лікування великої ромежуються ними, окислення, відновлення, гідроліз, гатої худоби і домашніх тварин. алкілування і реакції гомологізації Віттіга. Якщо це не обумовлене особливо, то всі техБіциклоалканкарбонові кислоти даного винанічні і наукові терміни, що використовуються в даходу можуть бути також одержані раніше опубліному описі, мають загальноприйняті значення, що кованими методами [див. наприклад, Aust. J. звичайно використовуються в області, до якої відChem. 38, 1705, 1985; Aust. J. Chem. 39, 2061, носиться даний винахід. Хоч для здійснення або 1986; J. Am. Chem. Soc. 75, 637, 1953; J. Am. для тестування даного винаходу можуть бути виChem. Soc. 86, 5183, 1964; J. Am. Chem. Soc. користані методи і матеріали, аналогічні або екві102,6862, 1980; J.Org. Chem., 46, 4795, 1981; і J. валентні описаним тут методам і матеріалам, одOrg. Chem. 60, 6873, 1995]. нак, найбільш відповідні методи і матеріали Активація аденозинових рецепторів індукує описані нижче. Всі публікації, патентні заявки, пабагато які фізіологічні відповіді, включаючи знитенти і інші згадані тут роботи у всій своїй повноті ження рівня кровотоку в нирках, зниження швидкоприведені в даному описі як посилання. Крім того, сті гломерулярної фільтрації і підвищення реабсоописані матеріали, методи і приклади мають лише рбції натрію в нирках. Активація аденозинових ілюстративний характер і не обмежують даного рецепторів приводить до зниження частоти серцевинаходу. Ін ші відмітні ознаки і переваги даного вих скорочень, до зниження швидкості провідності винаходу будуть очевидні з нижченаведеного доі до зниження скоротності. Ці і інші ефекти активакладного опису і з формули винаходу. ції аденозинових рецепторів в інших органах явНа Фіг.1 представлена серія речовинляють собою нормальні регуляторні процеси. Одантагоністів аденозину А1. нак, вказані ефекти стають аномальними при У загальних рисах, даний винахід відноситься багатьох патологічних станах. Таким чином, антадо сильнодіючих і селективних антагоністів аденогоністи аденозину мають широке застосування як зиннового рецептора А1. Також описані селективні для попередження, так і для лікування захворюантагоністи аденозинового рецептора А2а . вання. Захворюваннями, які можуть бути попереСполуки даного винаходу можуть бути одерджені і/або піддані лікуванню антагоністами адежані рядом відомих методів. У загальних рисах, нозинових рецепторів є будь-які стани, (а) що ксантини можуть бути одержані за допомогою взахарактеризуються присутністю аномального рівня ємодії 1,3-дизаміщених 5,6-діаміно-урацилів з аденозину і/або (b) що вимагають для свого лікуальдегідами або карбоновими кислотами або хловання інгібування або стимуляції продукування рангідридами карбонових кислот з подальшим і/або вивільнення аденозину. Такими станами є, замиканням кільця. Альтернативно, 1,3-дизаміщені але не обмежуються ними, застійна серцева недо6-аміно-5-нітрозоурацили можуть бути конденсостатність, серцево-легенева реанімація, геморагівані з альдегідами з одержанням потрібних ксанчний шок і інші порушення роботи серця і кровотинів. обігу, дегенеративні розлади центральної нервової 1,3-Дизаміщені 5,6-диаміноурацили можуть системи, захворювання дихальних шляхів (наприбути одержані за допомогою обробки відповідної клад, бронхіальна астма, алергічні захворювання симетрично або несиметрично заміщеною сечовилегенів), і багато які захворювання, для яких покани ціанооцтовою кислотою з подальшим нітрозузано лікування діуретиками (наприклад, гостра і ванням і відновленням [див. наприклад, J.Org. хронічна ниркова недостатність, недостатність Chem. 16, 1879, 1951; Can.J.Chem. 46, 3413, 1968]. ниркової функції, гіпертензія). З активністю адоноАльтернативно, несиметрично заміщені ксантини зинових рецепторів пов'язані всі дегенеративні можуть бути одержані методом Mueller [J.Med.Soc. хвороби, такі як хвороба Паркінсона, депресія, 36,3341, 1993]. В даному методі, 6-аміноурацил травматична поразка головного мозку, післяшокопіддають специфічному моноалкілуванню у N3 вий неврологічний розлад, травма головного мозку 17 77937 18 у новонароджених, дислексія, гіперактивність і трування розчинника одержують неочищений прокистозний фіброз. Іншими станами, при яких лікудукт, який використовують в наступній стадії без вання антагоністами аденозинових рецепторів додаткового очищення. MC (ES+ 361). може виявитися терапевтично ефективним, є ци(6-Аміно-2,4-діоксо-1,3-дипропіл-1,2,3,4розні асцити, апное новонароджених, ниркова нететрагідропіримідин-5-іл)амід 5-оксодостатність, асоційована з традиційною терапією трицикло[2.2.1.02,6]гептан-3-карбонової кислоти діуретиками, діабет і астма. (360мг), одержаний в стадії 1, розчиняють в суміші Крім того, заявниками було виявлено, що вве(1:1) ізопропанол:вода (5мл) і додають КОН (84мг). дення високоселективних і сильнодіючих антагоніРеакційну суміш кип'ятять із зворотним холодильстів аденозинового рецептора А1, може, наприником протягом півтори години. Після охолоджуклад, індукувати діуретичн у відповідь при їх вання реакційної суміші до кімнатної температури, введенні окремо і може потенціювати діуретичну iРrОН видаляють на роторному випарнику. Водний відповідь на традиційні діуретики. Крім того, ввешар нейтралізують 2н НСl і екстрагують етилацедення антагоністів аденозинових рецепторів разом татом (3´50мл). Об'єднаний органічний шар проз іншими традиційними діуретинами сповільнюють мивають водою і насиченим розчином солі і сузниження швидкості гломерулярної фільтрації, шать над Na2SO4. Після концентрування, індукованої традиційними діуретиками. Заявлені неочищений продукт очищають хроматографією методи є застосовними, наприклад, при станах, на силікагелі, елююючи сумішшю етилацещо супроводжуються набряками, таких як застійна тат:тексан (1:1). Вихід 75мг. MC (ES+ 343). серцева недостатність і асцити. Приклад 2 Вказані сполуки можуть бути введені тварині Ендо/екзо 8-(5-гідрокси(наприклад, ссавцеві, такому як людина, примат, трицикло[2.2.1.02,6]гепт-3-іл)-1,3-дипротл-3,7відмінний від людини, кінь, собака, корова, свиня, дигідропурин-2,6-діон вівця, коза, кішка, миша, пацюк, морська свинка, 8-(5-оксо-трицикло [2.2.1.02,6] гепт-3-іл)-1,3кролик, хом'як, піщанка, тхір, ящірка, рептилії або дипропіл-3, 7-дигідропурин-2,6-діон (700мг) розчиптахи). Вказані сполуки можуть бути введені в няють в МеОН (50мл). Потім додають NaBH4 будь-якій формі, відповідній для введення фарма(100мг) при 0°С і перемішують протягом 5 хвилин. цевтичних сполук, включаючи, але не обмежуюПісля цього додають воду і перемішують 30 хвичись ними, драже, таблетки, капсули, аерозолі, лин. МеОН видаляють на роторному випарнику супозиторії, рідкі композиції для ковтання або ін'єпри зниженому тиску. Реакційну суміш екстрагують кцій або для використання у вигляді очних або етилацетатом, промивають водою, насиченим вушних крапель, дієтичні добавки або препарати розчином солі і сушать над MgSO4. Після концентдля місцевого застосування. Вказані сполуки морування одержують 700мг суміші ендо:екзожуть бути введені перорально, інтраназально, кріспиртів у відношенні 6:4. зьшкірно, внутрішньошкірно, вагінально, у вуха, в Приклад 3 очі, трансбукально, ректально, через слизову або 8-(5-Метилен-трицикло [2.2.1.02,6] гепт-3-іл)шляхом інгаляції, імплантації (наприклад, хірургіч1,3- дипропіл-3, 7-дигідропурин-2,6-діон но) або внутрішньовенного введення. Бромід метилтрифенілфосфонію (2,08г) розВказані сполуки можуть бути, але необов'язкочиняють в ТГФ (50мл) при -78°С. Потім повільно во, введені в поєднанні з не модифікуючою аденододають n-BuLi (3,66мл, 1,6М) при -78°С і перемізин фармацевтичною композицією (наприклад, в шують протягом 1 год. 8-(5-оксокомбінації з не модифікуючим аденозин діуретитрицикло[2.2.1.02,6]гепт-3-іл)-1,3-дипропіл-3,7ком, описаним, наприклад, в заявці, що одночасно дигідропурин-2,6-діон (приклад 1) (1г) розчиняють розглядається PCT/US99/08879, поданій 23 квітня в ТГФ і повільно додають до реакційної суміші при 1999, яка у всій своїй повноті вводиться в даний -78°С. Після завершення додання, реакційну суміш опис як посилання. повільно нагрівають до кімнатної температури і Даний винахід детально описаний на нижчеперемішують при кімнатній температурі протягом наведених прикладах, які не повинні розглядатися ночі. На наступний день, реакційну суміш гасять 1н як обмеження об'єму винаходу, визначеного в фоНСl і екстрагують етилацетатом (3´50мл). Об'єдрмулі винаходу. наний органічний шар промивають водою, насичеПриклади ним розчином солі і сушать над Na2SO4. Після Приклад 1 концентрування, продукт очищають на колонці з 8-(5-оксо-трицикло[2.2.1.02,6]гепт-3-іл)-1,3силікагелем. MC (ES+ 341). дипропіл-3,7-дигідропурин-2,6-діон Приклад 4 Анти-3-оксотрицикло(2.2.1.02,6)гептан-78-(5-Метоксиметилен-трицикло[2.2.1.02,6]гепткарбонову кислоту (837мг) розчиняє в СН 2Сl2 3-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон (20мл) при 0°С. Потім додають триетиламін Хлорид метоксиметилтрифенілфосфонію (1,74мл), ізобутилхлор форміат (724мкл) і суміш (1,1г) розчиняють в толуолі (10мл) при 0°С. Потім перемішують при 0°С протягом 15 хвилин. Після додають біс(триметилсиліл)амід калію (0,5Μ в тоцього додають 1,3-дипропіл-5,6-діаміноурацил НСl луолі, 12,8мл) і перемішують при 0°С протягом і перемішують при 0°С протягом 30 хвилин і при 1год. До реакційної суміші додають 8-(5-оксокімнатній температурі протягом ночі. На наступний трицикло-[2.2.1.02,6]гепт-3-іл)-1,3дипропіл-3,7день реакційну суміш розбавляють водою (50мл) і дигідропурин-2,6-діон (приклад 1) (1г), а потім наекстрагують СН 2Сl2 (3´25мл). Об'єднані органічні грівають до кімнатної температури і перемішують шари промивають нас. NaHCO3, водою, насиченим протягом ночі. На наступний день, реакційну суміш розчином солі і сушать над Na2SO4. Після конценгасять водою і екстрагують етилацетатом 19 77937 20 Приклад 8 (3´50мл). Об'єднаний органічний шар промивають 8-(5-Гідрокси-5-гідроксиметилводою і насиченим розчином солі і сушать над Na2SO4. Після концентрування, неочищений протрицикло[2.2.1.02,6]гепт-3-іл)-1,3-дипротл-3,7дигідропурин-2,6-діон; дукт очи щають на колонці. MC (ES+ 371). 8-(5-Метилен-трицикло [2.2.1.02,6] гепт-3-іл)Приклад 5 2,6 1,3-дипропіл-3,7-дигідропурин-2,6-діон (284мг) 8-(5-ендо-Гідрокси-тріцикло[2.2.1.0 ]гепт-3розчиняють в суміші ацетон:вода (1:1, 5мл) при іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон Борогідрид натрію (22мг) розчиняють в МеОН 0°С. Потім додають OsO4 (2мл), і суміш перемішують протягом 15 хвилин. Після цього додають N(5мл) при 0°С. Потім до реакційної суміші при 0°С метилморфолін-N-оксид (120мг) і суміш перемідодають 8-(5-оксо-трицикло[2.2.1.02,6]гепт-3-іл)шують при кімнатній температурі протягом ночі. На 1,3-дипропіл-3,7-дигідропурин-2,6-діон (приклад наступний день реакційну суміш гасять розчином 1)(200мг) в МеОН (5мл). Після перемішування при 0°С протягом 1 години, реакційну суміш гасять 1н NaHSO3 і екстрагують етилацетатом (3´25мл). Об'єднаний органічний шар промивають водою, НСl і екстрагують етилацетатом (3´25мл). Об'єднасиченим розчином солі і сушать над Na2SO4. наний органічний шар промивають водою, насичеПісля концентрування неочищений продукт очиним розчином солі і сушать над Na2SO4. Після щають на колонці з двоокисом кремнію (ES+ 375). концентрування розчинника продукт очищають Приклад 9 препаративною ВЕРХ. MC (ES+ 345). Продукт явЕндо-5-(2,6-діоксо-1,3-дипропіл-2,3,6,7ляє собою суміш двох ізомерів (2:1). Головний тетрадигідро-1Н-пурин-8-іл)трицикло[2.2.1.02,6] ізомер являє собою ендо-гідроксильну сполуку. гептан-3-ендо-карбоновая кислота Приклад 6 8-(5-ендо-гідроксиметил-5-метил8-(5-екзо-Гідрокси-тріцикло[2.2.1.02,6]гепт-3-іл)трицикло[2.2.1.02,6]гепт-3-іл)-1,3-дипропіл-3,71,3-дипропіл-3.,7-дигідропурин-2,6-діон дигідропурин-2,6-діон і 8-(5-екзо-гідрокси-5До розчину 8-(5-оксо-трицикло [2.2.1.02,6] гептгідроксиметил-трицикло-[2.2.1.02,6]гепт-3-іл)-1,33-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діону (придипропіл-3,7-дигідропурин-2,6-діон (100мг) розчиклад 1) (2г) в ТГФ (40мл) при -78°С по краплях няють в ДМФ (5мл). Потім додають PDC (232мг) додають розчин К-селектриду (20мл, 1М в ТГФ). при 0°С і перемішують при температурі в межах Суміш перемішують при -78°С протягом 30 хвилин, від 0°С до кімнатної температури протягом ночі. а потім нагрівають до 0°С, гасять водою і екстраНа наступний день додають ще 232мг PDC і перегують етилацетатом (3´50мл). Об'єднаний органімішують при кімнатній температурі протягом чний шар промивають насиченим розчином солі і 24год. ДМф видаляють при зниженому тиску. Посушать над MgSO4. Після фільтрації і концентрутім розчиняють в насиченому розчині НаНСО3 і вання при зниженому тиску одержують потрібний екстрагують етилацетатом (2´50мл). Водний шар продукт (1,97г) у вигляді суміші (20:1) екзо і ендопідкисляють 1н НСl і екстрагують етилацетатом спиртів. MC (ES+ 345). Приклад 7 (3´100мл). Етилацетатний шар промивають наси8-(5-ендо-Гідрокси-метил-5-метилченим розчином солі, сушать над Na2SO4 і концентрицикло[2.2.1.02,6]гепт-3-іл)-1,3-дипропіл-3,7трують. Суміш екзо- і ендо-кислот розділяють предигідропурин-2,6-діон і 8-(5-екзо-гідрокси-5паративною ВЕРХ. MC (ES+ 373). 2,6 гідроксиметил-трицикло-[2.2.1.0 ]гепт-3-іл)-1,3Аналогічним методом було одержано наступні дипропіл-3,7-дигідропурин-2,6-діон сполуки: 8-(5-Метоксиметилен-трицикло[2.2.1.02,6]гептПриклад 9а: Екзо-5-(2,6-діоксо-1,3-дипропіл3-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон 2,3,6,7-тетрадигідро-1Н-пурин-8(368мг) розчиняють в ТГФ (5мл). До реакційної іл)трицикло[2.2.1.02,6]гептан-3-екзо-карбонова киссуміші додають 1н НСl (2мл) і перемішують при лота кімнатній температурі протягом 4год. Реакційну Приклад 10 [5-(2,6- діоксо-1,3-дипропіл-2, 3, 6, 7суміш екстрагують етилацетатом (3´25мл). Об'єдтетрадигідро-1Н-пурин-8-іл)трицикло[2.2.1.02,6] наний екстрат промивають над NaHCO3, водою і гепт-3-іліден] - оцтова кислота насиченим розчином солі і сушать над Na2SO4. Метилдиетилфосфоноацетат (100мкл) розчиПродукт являє собою суміш ендо- і екзоняють в толуолі (5мл) при 0°С. Потім додають альдегідів, яку використовують в наступній стадії біс(триметилсиліл)амід калію (0,5Μ в толуолі, без додаткового очищення. 2,2мл) і перемішують при 0°С протягом 1год. До Вказану суміш альдегідів відновлюють з викореакційної суміші додають 8-(5-оксо-трициклористанням NaBH4 в МеОН, а потім здійснюють [2.2.1.0 2,6 ]гепт-3-іл)-1,3-дипропіл-3,7-дигідропуринпроцедуру, описану в прикладі 5. Одержаний про2,6-діон (приклад 1) (171мг), розчинений в 5мл дукт у ви гляді суміші ендо і екзотолуолу, після чого суміш нагрівають до кімнатної гідроксилметильних сполук розділяють препаратитемператури і перемішують протягом ночі. На навною ВЕРХ. MC(ES+359). ступний день, реакційну суміш гасять водою, підАналогічними методами були одержані настукисляють 1н НСl і екстрагують етилацетатом пні сполуки: Приклад 7а: ендо-8-(5-ендо-гідроксиметил-5(2´100мл). Об'єднаний органічний шар промиваметил-трицикло-[2.2.1.02,6]-гепт-3-іл)-1,3-дипропілють водою і насиченим розчином солі і сушать над 3,7-дигідропурин-2,6-діон; Na2SO4. Після концентрування, неочищений проПриклад 7b: ендо-8-(5-ендо-гідроксиметил-5дукт (156мг) використовують в подальшій стадії метил-трицикло-[2.2.1.02,6]-гепт-3-іл)-1,3- дипропілбез додаткового очищення. MC (ES+ 399). 3,7-дигідропурин-2,6-діон; Складний ефір (156мг), одержаний в стадії 1, 21 77937 22 гідролізують з використанням LiOH (34мг). Продукт 5-оксо-трицикло[2.2.1.02,6]-гептан-3-карбонової очищають препаративною ВЕРХ. Вихід 52мг. MC кислоти, одержаний в стадії 2, перетворюють в (ES+ 385)· метиловий ефір 3-бензилоксиметил-5-формілПриклад 11 трицикло-[2.2.1.02,6] гептан-3-карбонової кислоти [5-(2,6-діоксо-1,3-дипропіл-2,3,6,7відповідно до процедур, описаних в прикладі 4 і в тетрадигідро-1H-пурин-8-іл) трицикло[2.2.1.02,6] прикладі 7. гепт-3-іліден] - оцтова кислота У розчин метилового ефіру 3Продукт (100мг), одержаний в стадії 1 приклабензилоксиметил-5-форміл-трицикло [2.2.1.02,6] ду 10, гідрують в EtOH (5мл) з використанням 5% гептан-3-карбонової кислоти (475мг) в 10мл tPd/C під тиском Н2 60 фунт/кв.дюйм протягом 24 BuOH і 8мл 2-метил-бут-2-ену при 0°С додають годин. Каталізатор відфільтровують і розчинник NaClO2 (904мл) і NaH2PO4 Н2О (1,37г) у воді (5мл). концентрують. Цей продукт використовують в наСуміш перемішують при кімнатній температурі ступній стадії. протягом 5 годин. Реакційну суміш підкисляють Складний ефір (90мг), одержаний в стадії 1, гіНОАс, екстрагують етилацетатом, промивають дролізують з використанням LiOH (19мг) в суміші водою і сушать. Після концентрування одержують МеОН:Н 2О (5:1, 5мл) при кімнатній температурі потрібну кислоту (175мг). протягом ночі. Продукт очищають препаративною Метиловий ефір 3-бензилоксиметил-трицикло ВЕРХ. Вихід 51мг. MC (ES+ 387) [2.2.1.0 2,6 ] - гептан-3,5-дикарбонової кислоти Приклад 12 (168мг), одержаний як описано вище, піддають 8-(5-оксо-біцикло[2.2.1]гепт-7-іл)-1,3- дипропілреакції поєднання з 1,3-дштропіл-5,63,7-дигідро-пурин-2,6-діон диаміноурацил НСl (263мг) з використанням EDC 2-Оксо-біцикло[2.2.1]гептан-7-карбонову кис(191мг), DIEA (258мг) в СН2Сl2 (20мл) при кімнатлоту (308мг) піддають реакції поєднання з 1,3ній температурі протягом ночі. Після обробки, продипропіл-5,6-діаміноурацил НСl (576мг) і циклізудукт циклізують з використанням водного КОН в ють відповідно до процедур, описаних в прикладі іРrОН. 1. Вихід 320мг. MC (ES+ 345) 3-Бензилоксиметил-5-(2,6-діоксо-1,3-дипропілПриклад 13 2,3,6,7-тетрадигідро-1H-пурин-8-іл)трицикло8-(2-гідрокси-біцикло[2.2.1]гепт-7-іл)-1,3[2.2.1.0 2,6 ]гептан]-3-карбонову кислоту (50мг) гіддипропіл-3,7-дигідропурин-2,6-діон рують в етилацетаті з використанням 5% Pd/C при 8-(2-оксо-біцикло[2.2.1]гепт-7-іл)-1,3-дипропілтиску Н2 в 1атм. протягом ночі. Каталізатор фільт3,7-дигідропурин-2,6-діон (200мг) відновлюють з рують через двоокис кремнію, елююючи 10% Мевикористанням NaBH4 (44мг) в МеОН (10мл). Вихід ОН:СНСl3. Вихід 31мг. MC(ES+403). + 120 20 мг. MC (ES 347). Приклад 15 Приклад 14 [7-(2,6-діоксо-1,3-дипропіл-2,3,6,7[5-(2,6-діоксо-1,3-дипропіл-2,3,6.7тетрадигідро-1Н-пурин-8-іл)-біцикло[2.2.1]гепт-2тетрадигідро-1Н-пурин-8-іл)-3-гідроксиметилілідені оцтова кислота трицикло[2.2.1.02,6]гептан1-3-карбонова кислота 8-(2-оксо-біцикло[2.2.1]гепт-7-іл)-1,3-дипропілАнти-3-оксотрицикло[2.2.1.02,6]гептан-73,7-дигідропурин-2,6-діон перетворюють у вказану карбонову кислоту (2,0г) розчиняють в МеОН в заголовку сполуку відповідно до процедури, опи(50мл), додають конц. H2SO4 (0,2мл) і кип'ятять із саної в прикладі 10. MC (ES+387). зворотним холодильником протягом ночі. На наПриклад 16 ступний день, після охолоджування, реакційну Ендо-2-трет-бутоксикарбоніламіно-3суміш виливають в насичений розчин NaHCO3 і метилмасляної кислоти 5-(2,6-діоксо-1,3-дипропілекстрагують етилацетатом. Після концентрування 2,3,6,7-тетрадигідро1Н-пурин-8-іл)етилацетату одержують 2,61г метилового складнотрицикло[2.2.1.02,6]гепт-3-иловий ефір го ефіру 5, 5-диметокси-трицикло [2.2.1.02,6] гепДо розчину DIC (126мг) і DMAP (122мг) в тан-3-карбонової кислоти. СН2Сl2 (10мл) при 0°С додають Boc-L-валін Метиловий ефір 5,5-диметокси-трицикло (217мг). Суміш перемішують протягом 30 хвилин, а [2.2.1.0 2,6 ] гептан-3-карбонової кислоти (1,01г), потім додають 8-(5-ендо-гідрокси-трицикло одержаний в стадії 1, розчиняють в сухому ТГФ [2.2.1.0 2,6 ] гепт-3-іл)-1,3дипропіл-3, 7(20мл) при -78°С і по краплях додають LDA дигідропурин-2,6-діон (110мг). Одержану суміш (3,53мл, 2М в ТГФ). Одержану суміш залишають перемішують при кімнатній температурі протягом на 1 годину при -78°С. Потім по краплях додають ночі. На наступний день реакційну суміш розбавВОМС1 (2,29г). Після витримування протягом 30 ляють етилацетатом, промивають НСl, нас. хвилин при -78°С, суміш нагрівають до 0°С і переNaHCO3 і насиченим розчином солі і сушать над мішують 1 годину. Реакцію гасять нас. NH4CI і ексMgSO4 . Продукт фільтрують, концентрують і очищають на двоокисі кремнію з одержанням потрібтрагують етилацетатом (2´50мл). Після концентрування, неочищений продукт розчиняють в ТГФ ної сполуки. Вихід 155мг. MC (ES+ 544). Приклад 16а: Екзо-2-трет(20мл) і додають 1н НСl (5мл). бутоксикарбоніламіно-3-метилмасляної кислоти 5Реакційну суміш перемішують при кімнатній (2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрадигідро-1Hтемпературі протягом 1 години, розбавляють вопурин-8-іл)- трицикло [2.2.1.02,6] гепт-3-иловий дою і екстрагують етилацетатом. Етилацетат промивають насиченим розчином солі і сушать ефір. Приклад 17 MgSO4 . Після концентрування, продукт очищають Ендо-2-аміно-3-метилмасляної кислоти 5-(2,6на колонці з двоокисом кремнію. Вихід 515мг. діоксо-1,3-дипропіл-2,3,6,7-тетрадигідро-1Н Стадія 3: Метиловий ефір 3-бензилоксиметил 23 77937 24 пурин-8-іл)- трицикло [2.2.1.02,6] - гепт-3-иловий лацетатом (3´50мл). Об'єднаний етилацетатний ефір, НСl шар промивають водою, насиченим розчином солі 5-(2,6-Діоксо-1,3-дипропіл-2,3,6,7-тетрагідроі сушать над Na2SO4. Після концентрування, не1Н-пурин-8-іл)-трицикло [2.2.1.02,6]гепт-3-иловий очищену суміш використовують в наступній стадії. ефір ендо-2-трет-бутоксикарбоніламіно-3Продукт, одержаний як описано вище, розчиметилмасляної кислоти (120мг) розчиняють в ТГФ няють в етилацетаті (5мл) і додають 100мг Pd/C (2мл). Потім додають IM HCl в ефірі (2мл), і реак(10%) 1мл конц. НСl. Реакційну суміш гідрують в ційну суміш перемішують при кімнатній темпераатмосфері Н2 під тиском 60фунт/кв.дюйм протягом турі протягом ночі. Розчинник видаляють при зниночі. Каталізатор відфільтровують і розчинник виженому тиску. Неочищений залишок розчиняють в даляють на роторному випарнику. Залишок розчиТГФ, після чого продукт осаджують доданням ефіняють в 5мл МеОН і додають LiOH (100мг). Реакру. Ви хід 55мг. MC (ES+ 444). ційну суміш перемішують при кімнатній Приклад 18 температурі протягом ночі. На наступний день, (+) Ендо-8-(5-гідрокси-трицикло[2.2.1.0 2,6]гептрозчинник видаляють, розбавляють водою і екст3-іл)-1.3-дипропіл-3,7-дигідропурин-2,6-діон рагують етилацетатом (2´50мл). Водний шар під(+) Анти-3-оксотрицикло [2.2.1.02,6] гептан-7кисляють 1н НСl і екстрагують етилацетатом карбонову кислоту, одержану відповідно до про(3´50мл). Етилацетатний шар промивають водою і цедур, описаних в Tetrahedron Letters, 37, 3975насиченим розчином солі і сушать над Na2SO4. 3976, 1996, піддають реакції поєднання з 1,3Після концентрування етилацетатного шару одердипропіл-5,6-діаміноурацилом і циклізують відпожують 390мг суміші ендо- і екзо-продуктів, яку відно до процедури, описаної в прикладі 1. Одеррозділяють з допомогою ВЕРХ. MC (ES+ 403). жаний кетон відновлюють до спирту відповідно до Приклад 20а: Екзо-[5-(2,6-діоксо-1,3-дипротлпроцедури, описаної в прикладі 5. 2,3,6,7-тетра-дигідро-1H-пурин-8-іл)трицикло Приклад 18а: [2.2.1.0 2,6 ] гепт-3-ылокси] - оцтова кислота. (-) Ендо-ендо-8-(5-гідрокси-трицикло Приклад 21 [2.2.1.0 2,6 ]гепт-3-іл)-1,3-дипропіл-3,7-дигідропурин(-) Ендо-2-трет-бутоксикарбоніламіно-32,6-діон метилмасляної кислоти 5-(2,6-діоксо-1,3-дипропілПриклад 19 2,3,6,7-тетрадигідро-1Н-пурин-8-іл)трицикло Екзо-2-аміно-3-метилмасляної кислоти 5-(2,6[2.2.1.0 2,6 ] гепт-3-иловий ефір діоксо-1,3-дипропіл-2,3,6,7-тетрадигідро-1Н (-) Ендо-8-(5-гідрокси-трицикло [2.2.1.02,6] гептпурин-8-іл)- трицикло [2.2.1.02,6]- гепт-3-иловий 3-іл)-1,3- дипропіл-3,7-дигідропурин-2,6-діон підефір; сполука з трифтороцтовою кислотою дають реакції поєднання з Boc-L-валіном відповід5-(2,6-Діоксо-1,3-дипропіл-2,3,6,7но до процедури, описаної в прикладі 16. 2,6 тетрадигідро-1Н-пурин-8-іл)-трицикло [2.2.1.0 ] Приклад 22 гепт-3-иловий ефір екзо-2-трет-буто(-) Ендо-2-аміно-3-метилмасляної кислоти ксикарбоніламіно-3-метилмасляної кислоти 5(2,6-діоксо-1,3-ди-пропіл-2,3,6,7-тетрадигідро-1H (100мг) обробляють сумішшю CH2Cl2:TFA (1:1, -пурин-8-іл)- трицикло [2.2.1.02,6] -гепт-3-иловий 5мл) при кімнатній температурі протягом ночі. ефір, НСl 5-(2,6-Діоксо-1,3-дипропіл-2,3,6,7Розчинник видаляють при зниженому тиску і нететрадигідро-1Н-пурин-8-іл)-трицикло очищений залишок очищають ВЕРХ. MC (ES+ 444). [2.2.1.0 2,6 ]гепт-3-иловий ефір (-) ендо-2-третПриклад 20 Ендо-[5-(2,6-діоксо-1,3-дипропілбутоксикарбоніламіно-3-метилмасляної кислоти 2,3,6,7-тетрадигідро-1H-пурин-8-іл)- трицикло перетворюють в потрібний продукт відповідно до [2.2.1.0 2,6 ] гепт-3-ілокси]оцтова кислота 8-(5процедури, описаної в прикладі 17. MC (ES+ 444). Оксо-трицикло [2.2.1.0 2,6] гепт-3-іл)-1,3- дипропілПриклад 23 8-[5-(3-Диметиламіно-пропілиден)3,7-дигідропурин-2,6-діон (1г) розчиняють в ДМФ трицикло[2.2.1.02,6]гепт-3-іл]-1,3-дипропіл-3,7(10мл), додають Cs 2CO3 (5,85г), а потім ВОМСl дигідропурин-2,6-діон; сполука з трифтороцтовою (810мкл) при кімнатній температурі, Реакційну сукислотою міш перемішують при кімнатній температурі протяБромід (3гом ночі. Cs 2CO3 відфільтровують і ДМФ видалядиметиламінопропіл)трифенілфосфонію (514мг) ють при зниженому тиску. Неочищений продукт розчиняють в ТГФ (20мл) при 0°С. Потім додають очищають на колонці з двоокисом кремнію. біс(триметилсиліл)амід калію (0,5Μ в толуолі, 5мл) Одержаний кетон відновлюють з використані перемішують при 0°С протягом 1год. До реакційням NaBH4 як описано в даному прикладі. Вихід: ної суміші додають 8-(5-оксо-трицикло-[2.2.1.02,6] 1,3г суміші ендо- і екзо-спиртів. гепт-3-іл)-1,3- дипропіл-3,7-дигідропурин-2,6-діон NaH (240мг, 60% суспензія в мінеральному (342мг), розчинений в 5мл ТГФ, при 0°С. Реакційну маслі) 3 рази промивають сухим пентаном і розчисуміш перемішують при температурі в межах від няють в сухому ТГФ при 0°С. До реакційної суміші 0°С до кімнатної температури протягом ночі. На додають суміш спиртів, одержану як описано винаступний день, ТГФ видаляють на роторному ще, (500мг) в ТГФ (5мл), і перемішують при 0°С випарнику при зниженому тиску, залишок розчипротягом 1год. Потім додають бром-третняють у воді (10мл), підкисляють 1н НСl і екстрабутилацетат (420мг) при 0°С і перемішують при гують етил ацетатом (2´100мл). Водний шар контемпературі в межах від 0°С до кімнатної темперацентрують і очищають ВЕРХ. Вихід 140мг. тури протягом ночі. На наступний день, реакційну MC(ES+412). суміш нагрівають при 60°С протягом 3год. Після Приклад 24 охолоджування до кімнатної температури, реак8-[5-(3-Диметиламінопропіл)ційну суміш розбавляють водою і екстрагують етитрицикло[2.2.1.02,6]гепт-3-іл1-1,3-дипропіл-3,7 25 77937 26 дигідропурин-2,6-діон дою, екстрагують етилацетатом, промивають 8-[5-(3-Диметиламінопропіліден)водою і сушать над Na2SO4. Після концентрувантрицикло[2.2.1.02,6]гепт-3-іл]-1,3-дипропіл-3,7ня, неочищений продукт використовують в наступдигідропурин-2,6-діон, сполуку з трифтороцтовою ній стадії. кислотою, гідрують в атмосфері Н 2 при тиску 7-Бензилоксиметіл-8-біцикло[2.2.1]гепт-5-ен-260фунт/кв.дюйм протягом ночі з використанням іл-1,3-дипропіл-3,7-дигідропурин-2,6-діон (5г), оде5% Pt/C в ЕtOН (10мл) і 1мл конц. НСl. Каталізатор ржаний в стадії 1, розчиняють в ТГФ (25мл) при відфільтровують і розчинник видаляють при зни0°С. Потім додають ВН 3ТГФ (12мл, 1М). Через дві женому тиску. Неочищений продукт очищають за години додають 6н NaOH (1мл) і Н2О2 (12мл) і педопомогою ВЕРХ. Ви хід 30мг. MC (ES+ 414). ремішують ще 2 години. Реакційну суміш підкисПриклад 25 ляють 1 НСl і екстрагують етилацетатом. Органіч8-(4-Гідрокси-біцикло[3.2.]окт-6-іл)-1,3ний шар промивають водою, насиченим розчином дипропіл-3,7-дигідро-пурин-2,6-діон солі і сушать над Na2SO4. Після концентрування 4-Ацетокси-біцикло[3.2.1]октан-6-карбонову органічного шару одержують суміш двох продуктів, кислоту (425мг) розчиняють в СН 2Сl2 (5мл) при яку розділяють колонковою хроматографією. 0°С. Потім додають TEA (700мкл) і ізоМенш полярну сполуку, 7-бензилоксиметил-8-(6бутилхлорформіат (285мкл) і перемішують при 0°С гідрокси-біцикло[2.2.1]гепт-2-іл)-1,3- дипропіл-3,7протягом 30 хвилин. Після цього додають 1,3дигідропурин-2,6-діон (головний продукт) одержудіізопропіл-5,6-діаміноурацил-НСl (524мг) і переють з виходом 1,7м. MC (ES+ 467). мішують при 0°С протягом 30 хвилин і при кімнат7-Бензилоксиметіл-8-(6-гідроксиній температурі протягом ночі. На наступний день біцикло[2.2.1]гепт-2-іл)-1,3-дипропіл-3,7реакційну суміш розбавляють СН 2Сl2 (25мл), продигідропурин-2,6-діон (1,6г) окисляють з викорисмивають водою, сушать над Na2SO4 і концентрутанням РСС (855мг) відповідно до процедури, ють. Неочищений продукт (820мг) використовують описаної в прикладі 26. в наступній стадії без додаткового очищення. 7-Бензилоксиметіл-8-(6-оксоОдержаний продукт циклізують в суміші біцикло[2.2.1]гепт-2-іл)-1,3-дипропіл-3,7іРrОН/вода (1:1, 15мл) з використанням КОН дигідропурин-2,6-діон (435мг), одержаний в стадії (280мг) при кип'ятінні із зворотним холодильником 3, розчиняють в оцтовій кислоті (5мл). Потім допротягом 1год. Потім проводять процедуру, опидають гідроксиламіно-О-сульфонову кислоту сану в прикладі 1. Вихід 450мг. MC(ES+361). (211мг) і кип'ятять із зворотним холодильником Приклад 26 протягом 3 годин. Після охолоджування реакційну 8-(4-Оксо-біцикло[3.2.1]окт-6-іл)-1,3-дипропілсуміш екстрагують етилацетатом (3´25мл). Орга3,7-дигідро-пурин-2,6-діон нічний шар промивають нас. NaHCO3, водою, на8-(4-гідрокси-біцикло[3.2.1]окт-6-іл)-1,3сиченим розчином солі і сушать над Na2SO4. Роздипропіл-3,7-дигідропурин-2,6-діон (140мл), одерчинник видаляють на роторному розчиннику і жаний в стадії 1, розчиняють в СН2Сl2 (5мл). Після потрібний продукт очищають на колонці з двоокицього додають целіт (2г), а потім РСС (90мг) і песом кремнію. MC (ES+ 360). ремішують при кімнатній температурі протягом Приклад 29 1год. Потім знов додають РСС (90мг) і перемішу8-[2-Оксо-3-аза-бщикло[3.2.]окт-8-іл)-1.3ють при кімнатній температурі протягом 2 год. Редипропіл-3,9-дигідропурин-2,б-діон акційну суміш розбавляють простим ефіром У розчин NaN3 (65мг) в СНСl3 (2мл) додають (100мл), фільтрують через целіт і концентрують. H2SO4 (0,5мл). Одержаний розчин охолоджують до Після очищення на колонці з двоокисом кремнію 0°С. Потім додають 8-(2-оксо-біцикло[2.2.1]гепт-7при елююванні сумішшю етилацетат.тексан (25:75) іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон (173мг) одержують 65мг потрібного продукту. MC (ES+ в СНСl3 (3мл). Одержаний розчин перемішують 369). при кімнатній температурі протягом 3 годин. РеакПриклад 27 ційну суміш виливають на лід, нейтралізують 8-(4-Гідрокси-4-метил-біцикло[3.2.1)окт-6-іл)NaHCO3 і екстрагують етилацетатом (3´25мл). 1,3- дипропіл-3,7-дигідропурин-2,6-діон Об'єднаний екстракт сушать над MgSO4, фільтру8-(4- Оксо-біцикло[3.2.1]окт-6-іл)-1,3-дипропілють і концентрують. Неочищений продукт очища3,7-дигідропурин-2,6-діон (51мг) розчиняють в ТГФ ють перекристалізацією з МеОН. Вихід 155мг. MC (3мл) при 0°С. Потім додають CH3MgBr (1мл, 3,0Μ) (ES+ 360). і перемішують 2 години. Реакційну суміш гасять Приклад 30 нас. NH4Cl і екстрагують етилацетатом. ОрганічБензиловий ефір [8-(2,6-Діоксо-1,3-дипропілний шар промивають водою, насиченим розчином 2,3,6,7-тетра-дигідро- 1Н-пурин-8-іл)солі і сушать Na2SO 4. Після концентрування і по3-аза-біцикло[3.2.1]окт-3-іл]оцтової кислоти дальшого очищення на колонці з двоокисом крем8-(2-Оксо-3-аза-біцикло[3.2.1]окт-8-іл)-1,3нію одержують потрібний продукт. MC (ES+ 375). дипрошл-3,9-дигідропурин-2,6-діон (85мг) розчиПриклад 28 няють в ТГФ (2мл), додають 1мл 1M LAH в ефірі і 8-(3-оксо-2-аза-біцикло[3.2.1]окт-6-іл)-1,3кип'ятять із зворотним холодильником протягом дипропіл-3,7-дигідропурин-2,6-діон ночі. На. наступний день, після охолоджування, 8-Біцикло[2.2.1]гепт-5-ен-2-іл-1,3-дипропіл-3,7реакцію гасять льодом, додають 1н КОН і екстрадигідро-пурин-2,6-діон (5г) обробляють NaH гують етилацетатом (3´25мл). Об'єднаний екст(878мг) в ТГФ при 0°С. Через одну годину, по краракт промивають насиченим розчином солі і суплях додають ВОМСl (2,52мл) і перемішують прошать над MgSO4. Розчинник видаляють при тягом ночі. На наступний день, реакцію гасять возниженому тиску. Продукт (14мг) розчиняють в 27 77937 28 2мл СН 2СІ2, додають бензиловий ефір бромоцтолин при -78°С, реакційну суміш гасять нас. NH4Cl. вої кислоти (23мг) і перемішують при кімнатній Реакційну суміш розчиняють в етилацетаті, протемпературі протягом ночі. На наступний день, мивають водою, насиченим розчином солі і сушать реакційну суміш підлужують 1н NaOH і екстрагунад MgSO4. Розчинник видаляють при зниженому ють етилацетатом. Неочищений продукт очищатиску, і неочищений продукт використовують в ють на колонці з двоокисом кремнію. Вихід 7мг. наступній стадії без додаткового очищення. MC (ES+ 494). Продукт, одержаний в стадії 1, розчиняють в Приклад 31 ДМФ (10мл). Потім додають 1,3-дипропіл-5,6[8-(3-Оксо-2-аза-біцикло[3.2.1]окт-8-іл]-1,3діаміноурацил НСl (263мг), PPh3 (15мг), Pd(OAc)2 дипропіл-3,7-дигідропурин-2,6-діон (7 мг) і DIEA (194мг). Реакційну суміш перемішують 8-(2-Оксо-біцикло[2.2.1]гепт-7-іл)-1,3-дипропілпри 100°С при повільному барботуванні моноокису 3,7-дигідропурин-2,6-діон (278мг) перетворюють в вуглецю протягом 1 дня. Розчин охолоджують до потрібний продукт (185мг) відповідно до процедукімнатної температури, розбавляють етилацетари, описаної в прикладі 27. MC (ES+ 360) том, промивають 1н НСl і насиченим розчином Приклад 32 солі і сушать над MgSO4. Розчинник видаляють [8-(3-Оксо-4-аза-трицикло[3.2.1.02,7]окт-6-іл]при зниженому тиску і неочищений продукт вико1,3-дипропіл-3,7-дигідропурин-2,6-діон ристовують в наступній стадії без додаткового 8-(5-Оксо-трицикло[2.2.1.02,6] гепт-3-іл)-1,3очищення. дипропіл-3, 7-дигідропурин-2,6-діон (150мг) переПродукт, одержаний в стадії 2, циклізують в творюють в потрібний продукт (135мг) відповідно іРrОН (15мл), 1н КОН (5мл) при кип'я тінні із звородо процедури, описаної в прикладі 27. MC (ES+ тним холодильником протягом ночі. Після охоло358) джування до кімнатної температури, розчинник Приклад 33 концентрують при зниженому тиску, підкисляють [8-(3-Оксо-біцикло[3.2.]окт-8-іл]-1,3-дипропіл1н НСl, насичують твердим NaCl, екстрагують ети3,7-дигідро-пурин-2,6-діон Етиловий ефір 3-оксолацетатом, промивають насиченим розчином солі біцикло[3.2.1]октан-8-карбонової кислоти, одержаі сушать над MgSO4 . Після концентрування, нений відповідно до процедури, описаної в літературі очищений продукт очищають на колонці з двооки[J. Org. Chem., 1997, 62, 174-181] гідролізують в сом кремнію. Вихід: 50мг. MC (ES+ 387)· кето-кислоту з використанням КОН в МеОН. Приклад 35а: Етиловий ефір 3-(2,6-діоксо-1,33-Оксо-біцикло[3.2.1]октан-8-карбонову кислодипропіл-2,3,6,7-тетрагідро-1H-пурин-8-іл)-8ту (205мг), одержану в стадії 1, піддають реакції азабіцикло[3.2.1]окт-2-ен-8-карбонової кислоти. поєднання з діаміноурацил-НСІ (395мг) з викорисMC (ES+ 416). танням EDC (287мг), в СН2Сl2 в присутності DIEA Приклад 36 (490мг) і циклізують в ІРrOН (50мл), 1н КОН (10мл) 3-(2,6-Діоксо-1,3-дипротл-2,3,6,7-тетрагідропри кип'ятінні із зворотним холодильником протя1Н-пурин-8-іл)- біцикло [3.2.11октан-8-карбонова гом ночі. Неочищений продукт очищають на колокислота нці з двоокисом кремнію. Вихід 210мг. MC(ES+359). 3-(2,6-Діоксо-1,3-дипропіл-2,3,6,7-тетрагідроПриклад 34 1Н-пурин-8-іл)-біцикло [3.2.1] окт-2-ен-8-карбонову Екзо-8-(3-Пдрокси-біцикло[3.2.1]окт-8-іл)-1,3кислоту (приклад 29) гідрують з використанням дипропіл-3, 7-дигідропурин-2,6-діон Pd/C в етилацетаті. MC (ES+ 389). 8-(3-Оксо-біцикло[3.2.1]окт-8-іл)-1,3- дипропілПриклад 37 3,7-дигідропурин-2,6-діон (30мг) розчиняютьв 8-(8-Оксо-біцикло[3.2.11окт-6-іл)-1,3-дипропілМеОН (2мл) і до реакційної суміші при 0°С дода3,7-дигідро-пурин-2,6-діон ють NaBH 4 (20мг), а потім перемішують 10 хвилин. Продукт (390мг), одержаний в прикладі 35, Реакцію гасять водою і екстрагують етилацетатом. розчиняють в ТГФ (10мл) 6н НСl (3мл) і нагрівають Органічний шар сушать над MgSO4 і концентрудо температури дефлегмації протягом ночі. На ють. Неочищені продукти (суміш ендо- і екзонаступний день, після охолоджування до кімнатної спиртів) очищають за допомогою ВЕРХ. Екзотемператури, виливають на лід, нейтралізують спирт –4мг.MC(ES+361). NaHCO3, екстрагують етилацетатом, промивають Приклад 34а: Ендо-8-(3-гідроксинасиченим розчином солі і сушать над MgSO4. біцикло[3.2.1]окт-8-іл)-1,3-дипропіл-3,7Потім фільтрують, концентрують і очищають на дигідропурин-2,6-діон. Ендо-спирт (12мг). MC (ES+ двоокисі кремнію. Вихід 321мг. MC (ES+ 359). 361). Приклад 38 Приклад 35 8-[8-Гідрокси-біцикло[3.2.1]окт-3-іл)-1.33-(2,6-Діоксо-1,3-дипропіл-2,3,6,7дипропіл-3,7-дигідро-пурин-2,6-діон тетрадигідро-1Н-пурин-8-іл)- біцикло [3.2.1]οκτ-28-(8-Оксо-біцикло[3.2.1]окт-3-іл)-1,3- дипропілен-8-карбонова кислота 3,7-дигідропурин-2,6-діон (25мг) відновлюють з У розчин етилового ефіру 3-оксовикористанням NaBH4 (30мг) в МеОН при 0°С. біцикло[3.2.1]октан-8-карбонової кислоти (100мг), Продукт очищають з допомогою ВЕРХ. Вихід 7мг. одержаний відповідно до процедури, описаної в J. MC (ES+ 361) Org. Chem., 62, 174-181,1997, в ТГФ (5мл) при Приклад 39 78°С по краплях додають розчин LDA (0,3мл, 2М). 2-[3-(2,6-Діоксо-1,3-дипропіл-2,3,6Л-тетрагідроРеакційну суміш перемішують при -78°С протягом 1H-пурин-8-іл)-біцикло[3.2.1]окт-8-іл]малонова ки30 хвилин. Одержаний енолят гасять слота біс(трифторметилсульфоніл)амінобензолом 8-(8-Гідрокси-біцикло[3.2.1]окт-3-іл)-1,3(214мг). Після витримування протягом ще 30 хвидипропіл-3,7-дигідропурин-2,6-діон (30мл) розчи 29 77937 30 няють в СНСІ3 (5мл). До цього розчину додають Приклад 40h: К-{2-[3-(2,6-діоксо-1,3-дипропілкислоту Meldram (58мг), піперидин (10мг) і нагрі2,3,6,7-тетра-гідро-1Н-пурин-8-іл)вають до температури дефлегмації протягом ночі. біцикло[3.2.1]окт-8-іламіно]етил}ацетамід; сполука На наступний день, після охолоджування до кімназ трифтороцтовою кислотою. MC(ES+445). тної температури, суміш розбавляють етилацетаПриклад 40і: 8-[8-(3-диметиламінотом, промивають 1н НСl, нас. NaHCO3, насиченим пропіламіно)-біцикло[3.2.1]-окт-8-іл]-1,3-дипропілрозчином солі і сушать. Розчинник видаляють при 3,7-дигідропурин-2,6-діон; сполука з трифтороцтозниженому тиску, неочищений залишок розчинявою кислотою. MC (ES+ 445). ють в МеОН, охолоджують до 0°С, додають NaBH4 Приклад 40і: 8-[8-(3-Морфолін-4-іл(30мг), і суміш перемішують протягом 15 хвилин. пропіламіно)-біцикло[3.2.1]-окт-3-іл]-1,3-дипропілРеакційну суміш розбавляють 1н НСl, і екстрагу3,7-дигідропурин-2,6-діон; сполука з трифтороцтоють етилацетатом. Органічний шар промивають вою кислотою. MC (ES+487). насиченим розчином солі, сушать над MgSO4 і Приклад 40k: 8-[8-(3-імідазол-1-ілконцентрують. Залишок розчиняють в ТГФ (5мл), пропіламіно)-біцикло[3.2.1]-окт-3-іл]-1,3-дипропілдодають 4н НСl (5мл) і перемішують протягом 1 3,7-дигідропурин-2,6-діон; сполука з трифтороцтодня. Реакційну суміш екстрагують етилацетатом, вою кислотою. MC (ES+468). промивають насиченим розчином солі і концентПриклад 40l: 8-{8-[3-(2-оксо-піролідин-1рують. Неочищений продукт очищають з допомоіл)пропіламіно]-біцикло[3.2.1]-окт-3-іл}-1,3гою ВЕРХ. Ви хід 6мг. MC (ES+ 447). дипропіл-3,7-дигідропурин-2,6-діон; сполука з Приклад 40 трифтороцтовою кислотою. MC (ES+468). 8-[3-(2-Диметиламіно-етиламіно)Приклад 41 біцикло[3.2.1]окт-8-іл1-1,3-дипропіл-3,78-(8-(1.4Діокса-спиро-4-біцикло[3.2.1]окт-6дигідропурин-2,6-діон; сполука з трифтороцтовою іл)-1.3-дипропіл-3,7-дигідропурин-2,6-діон кислотою До розчину 1-циклопент-і-еніл-піролідину До розчину 8-(3-оксо-біцикло[3.2.1]окт-8-іл)(1,01г) і триетиламіну (0,82г) в CH3CN (20мл) до1,3- дипропіл-3,7-дигідропурин-2,6-діону (60мг) в дають розчин етилового ефіру 3-бром-2СН2Сl2 (10мл) при 0°С додають N1,N1бромметилпропіонової кислоти (2,03г) в CH3CN діметилетан-1,2-діамін (100мг), Na(OAc)3BH (10мл). Потім, реакційну суміш нагрівають до тем(100мг) і HO Ac (5 крапель). Реакційну суміш пеператури дефлегмації протягом ночі, охолоджують ремішують при кімнатній температурі протягом до кімнатної температури, додають 5% HOAc ночі. На наступний день реакцію гасять водою і (5мл), а потім нагрівають до температури дефлегпідкисляють 1н НСl. Водний шар промивають мації протягом 30 хвилин. Суміш охолоджують до СН2Сl2, а потім нейтралізують 1н КОН, екстрагукімнатної температури, розбавляють етилацетатом, промивають 1н НСl, нас. NaHCO3, насиченим ють етилацетатом (3´25мл), промивають насичерозчином солі, а потім сушать. Розчинник видаляним розчином солі, сушать над MgSO 4 і концентють при зниженому тиску, неочищену речовину рують. Неочищений залишок очищають розчиняють в етиленгліколі (30мл), додають TsOH препаративною ВЕРХ. Ви хід 31мг. MC (ES+ 431). Приклад 40а: Етиловий ефір [3-(2,6-діоксо-1,3(50мг), і суміш нагрівають до температури дефлегмації протягом 1 дня. Потім суміш охолоджують дипропіл-2,3,6, 7-тетрагідро-1Н -пурин-8-іл)- біцикдо кімнатної температури, розбавляють етилацело[3.2.1]окт-8-іламіно]оцтової кислоти. MC татом, промивають водою і насиченим розчином (ES+446). солі і сушать. Після концентрування, неочищений Приклад 40b: 8-[8-(2-диметиламіноетиламіно)-біцикло[3.2.1]окт-8-іл]-1,3-дипропіл-3,7продукт очищають на двоокисі кремнію, з одержанням 1,90г речовини. дигідропурин-2,6-діон; сполука трифтороцтової Продукт, одержаний в стадії 1, розчиняють в кислоти з 8-(8-оксо-біцикло[3.2.1]окт-3-іл)-1,3- дипТГФ (30мл), МеОН (30мл), 1н КОН (30мл) і нагріропіл-3,7-дигідропурин-2,6-діоном. MC (ES+ 431). вають при 50°С протягом ночі. На наступний день, Приклад 40с: метиловий ефір 1-[3-(2,6-діоксо1,3-дипрошл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)розчин охолоджують до кімнатної температури, концентрують, підкисляють 1н НСl, насичують твебіцикло[3.2.1]окт-8-іл]-піролідин-2-карбонової кисрдим NaCl, екстрагують етилацетатом, промивалоти; сполука з трифтороцтовою кислотою. MC ють насиченим розчином солі і концентрують. (ES+ 472). Продукт, одержаний в стадії 2 (кеталькислота) Приклад 40d: 8-[8-морфолін-4-ілбіцикло[3.2.1]окт-3-іл]-1,3-дипропіл-3,7піддають реакції поєднання з діаміноурацилом-НСІ з використанням EDC, DIEA в метиленхлориді і дигідропурин-2,6-діон; сполука з трифтороцтовою циклізують з використанням КОН в суміші І-РrOНкислотою. MC (ES+430). вода. MC (ES+ 403). Приклад 40е: 8-[8-аліламіно-біцикло[3.2.1]октПриклад 42 3-іл]-1,3-дипропіл-3,7-ди-гідропурин-2,6-діон; сполука з трифтороцтовою кислотою. MC (ES+ 400). [3-(2.6-Діоксо-1,3-дипропіл-2.3,6,7-тетрагідро1Н-пурин-8-іл)-біцикло[3.2.1]окт-8-іламіно]оцтова Приклад 40f: 8-[8-(2-піперидин-1-ілкислота етиламіно)біцикло[3.2.1]окт-3-іл]-1,3-дипропіл-3,7Етиловий ефір [3-(2,6-діоксо-1,3-дипропілдигідропурин-2,6-діон; сполука з трифтороцтовою 2,3,6,7-тетра-гідро-1H-пурин-8-іл)кислотою. MC (ES+471). Приклад 40g: 8-[8-(2-Морфолін-4-ілбіцикло[3.2.1]окт-8-іламіно] оцтової кислоти (приклад 40а) гідролізують з використанням 1н КОН в етиламіно)-біцикло[3.2.1]окт-3-іл]-1,3-дипропіл-3,7МеОН/ТГФ. MC (ES+ 418). дигідропурин-2,6-діон; сполука з трифтороцтовою + Приклад 43 кислотою. MC (ES 473). 31 77937 32 Етиловий ефір екзо-3-(2,6-діоксо-1,3-дипропіліл]малонову кислоту перетворюють в потрібний 2,3,6,7-тетрагідро-1Н-пурин-8-іл)-8-азапродукт шляхом кип'ятіння із зворотним холодильбіцикло[3.2.1]октан-8-карбонової кислоти ником в МеОН в присутності 1н КОН (1мл) протяЕтиловий ефір 3-(2,6-діоксо-1,3-дипропілгом 2 днів. MC (ES+ 403). 2,3,6,7-тетра-гідро-1Н-пурин-8-іл)-8-азаПриклад 48 8-(8-Гідрокси-8-метилбіцикло[3.2.1]окт-2-ен-8-карбонової кислоти гідрубіцикло[3.2.1]окт-3-іл)-1,3дипропіл-3,7ють з використанням 10% Pd/C в МеОН. У резульдигідропурин-2,6-діон таті утворюється суміш (1:3) ендо- і екзо-продуктів. Етиловий ефір транс-8-оксоВказані продукти розділяють з допомогою ВЕРХ. біцикло[3.2.1]октан-3-карбонової кислоти синтезуЕкзо-ізомер. MC (ES+418). ють відповідно до процедури, описаної в J. Org. Приклад 43а: Ендо-[3-(2,6-діоксо-1,3-дипротілChem., 1969, vol.34, page 12.25-1229. 2,3,6,7-тетра-гідро-1Н-пурин-8-іл)-8-азаВищезгаданий кетон (6,55г, 33ммоль), моногібіцикло[3.2.1]октан-8-карбонової кислоти етиловий драт толуолсульфонової кислоти (0,63г, 3ммоль) і ефір етиленгліколь (20мл) в толуолі (100мл) кип'ятять із Приклад 44 зворотним холодильником з використанням пастки Ендо 8-(8-аза-біцикло[3.2.1]окт-3-іл)-1,3Діна-Старка для азеотропного видалення води. дипропіл-3,7-дигідро-пурин-2,6-діон; сполука з Через 8 годин суміш охолоджують, промивають трифтороцтовою кислотою бікарбонатом натрію, сушать над сульфатом магСуміш етилового ефіру екзо-3-(2,6-діоксо-1,3нію і концентрують з одержанням відповідного дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)-8-азакеталю у вигляді транс-ізомеру (1,26г неочищеного біцикло[3.2.1]октан-8-карбонової кислоти і етилопродукту). вого ефіру ендо-3-(2,6-діоксо-1,3-дипропіл-2,3,6,7Вищезгаданий транс-кеталь обробляють 1н тетрагідро-1Н-пурин-8-іл)-8-аза-біциклоNaOH в метанолі протягом ночі при 50°С. Метанол [3.2.1]октан-8-карбонової кислоти (1:3) розчиняють випаровують у вакуумі, підкисляють 2н НСl (охов 10мл СН2Сl2. Потім додають TMSI (1мл) і перелодженої льодом) і екстрагують етилацетатом. мішують при кімнатній температурі протягом 48 Етилацетат випаровують з одержанням 6,42г цисгодин. Після цього додають МеОН (3мл), суміш 8-оксо-біцикло[3.2.1]октан-3-карбонової кислоти з розчиняють в етилацетаті, промивають нас. карбонільною групою, захищеною в кеталевій фоNaHCO3, промивають 10% розчином Na2S2O3, нармі. сиченим розчином солі і сушать над MgSO4. Потім Вищезгадану цис-кислоту (6,42г, 30ммоль), гісуміш фільтрують і концентрують. Після очищення дрохлоридну сіль 5,6-діаміно-1,3-дипропіл-1НВЕРХ одержують ендо-ізомер. MC (ES+ 346) піримідин-2,4-діону (10,34г, 39ммоль), 5,6-діаміноПриклад 44а: Екзо 8-(8-аза-біцикло[3.2.1]окт-31,3-дипропіл-1Н-піримідин-2,4-діон (7,51г, іл)-1,3- дипропіл-3,7-дигідропурин-2,6-діон; сполу39ммоль) і діетилізопропіламін (14мл, 80ммоль) в ка з трифтороцтовою кислотою. Екзо-ізомер. MC метиленхлориді (200мл) перемішують при кімнат(ES+ 346). ній температурі протягом ночі. Потім суміш промиПриклад 45 вають 1н НСl, бікарбонатом натрію і насиченим 1-[3-(2,6-Діоксо-1,3-дипропіл-2,3,6,7розчином солі, сушать над сульфатом магнію і тетрагідро-1Н-пурин-8-іл)-біцикло[3.2.1]окт-8-ілі концентрують у вакуумі. Залишок кип'ятять із звопіролідин-2-карбонова кислота: сполука з трифторотним холодильником в суміші 1н роцтовою кислотою NaOH/ізопропанол протягом ночі. Суміш охолоМетиловий ефір 1-[3-(2,6-діоксо-1,3-дипропілджують, підкисляють 3н НСl, екстрагують етилаце2,3,6,7-тетрагідро-1Н-пурин-8-іл)-біцикло[3.2.1]окттатом і концентрують. Потім залишок обробляють 8-іл]-піролідин-2-карбонової кислоти (приклад 40с) сумішшю 6н НСl/ТГФ при 75°С протягом 3год. з гідролізують з використанням 1н КОН в ТГФ. MC одержанням цис-8-(8-оксо-біцикло[3.2.1]окт-3-іл)(ES+ 458). 1,3- дипропіл-3,7-дигідропурин-2,6-діону у вигляді Приклад 46 неочищеного продукту. Після очищення колонко8-(8-Аміно-біцикло[3.2.1]окт-3-іл)-1,3-дипропілвою хроматографією одержують 4,5 грами продук3,7-дигідро-пурин-2,6-діон; сполука з трифтороцту (ви хід 40%). товою кислотою Вищезгаданий кетон (40мг, 0,11ммоль) розчи8-(8-Аліламіно-біцикло[3.2.1.]окт-3-іл)-1,3няють в ТГФ (7мл). До розчину додають бромід дипропіл-3,7-дигідропурин-2,6-діон гідрують в Меметилмагнію (0,4мл, 1н в ТГФ). Реакційну суміш ОН/НОАс в присутності Pd/C під тиском Н2 перемішують при кімнатній температурі протягом 60фунт/кв.дюйм протягом 8 годин. Каталізатор 2год. Потім реакцію гасять розчином NH4Cl. Після фільтрують і концентрують. Неочищений продукт очищення на колонці одержують 25мг вказаної в (суміш дво х сполук) очищають за допомогою заголовку сполуки (вихід 60%). MC (M+1 375). ВЕРХ. Приклад 49 Приклад 46а: 1,3-дипропіл-8-(8-пропіламіноТранс-3-[3-(2,6-діоксо-1,3-дипропіл-2,3,6,7біцикло[3.2.1]окт-3-іл)-3,7-дигідро-пурин-2,6-діон; тетрагідро-1H-пурин-8-іл)-біцикло[3.2.1]окт-8сполука з трифтороцтовою кислотою. MC іл]пропіонова кислота (ES+402). Хлорид (метоксиметил)трифенілфосфонію Приклад 47 [3-(2,6-Діоксо-1,3-дипропіл-2,3,6,7(296мг, 0,86ммоль) в толуолі охолоджують на критетрагідро-1Н-пурин-8-іл)- біцикло [3.2.1]οκТ-8-іл] жаній бані. Потім, через шприц по краплях додаоцтова кислота ють біс(триметилсиліл)амід калію (2,5мл, 0,5Μ в 2-[3-(2,6-Діоксо-1,3-дипропіл-2,3,6,7толуолі). Суміш перемішують при 0°С протягом тетрагідро-1Н-пурин-8-іл)-біцикло[3.2.1] окт-81год. Після цього до суміші додають 8-(8-оксо 33 77937 34 біцикло-[3.2.1.]окт-3-іл)-1,3дипропіл-3,7дигідропурин-2,6-діону як початкового матеріалу. дигідропурин-2,6-діон (100мг), і одержану суміш Загальний вихід 70%. MC (М+1 441). залишають для нагрівання до кімнатної темпераПриклад 52 тури і перемішують протягом ночі. Толуол випароТрет-бутиловий ефір {2-[3-(2,6-діоксо-1,3вують і залишок обробляють 1н НСl в ТГФ при дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)70°С протягом 3год. Для екстракції продукту викобщикло[3.2.1]окт-8-іламіно]етил}-карбамінової кисристовують етилацетат. Після проведення колонлоти; сполука з трифтороцтовою кислотою кової хроматографії одержують 94мг 3-(2,6-діоксоЦис-8-(8-оксо-біцикло[3.2.1]окт-3-іл)-1,3- дип1,3-дипропіл-2,3,6,7-тетрагідро-1Н -пурин-8-іл)ропіл-3,7-дигідропурин-2,6-діон (50мг, 0,12ммоль), біцикло[3.2.1]октан-8-карбальдегіду у вигляді сутрет-бутиловий ефір (2-аміноетил)карбамінової міші цис- і транс-продуктів (вихід 90%). кислоти (35мг, 0,2ммоль) і оцтову кислоту (2 крапАльдегід, одержаний як описано вище, (300мг, лі) в СН2Сl2/МеOН перемішують протягом 30 хви0,80ммоль) в ТГФ (10мл) піддають взаємодії з мелин. До суміші додають ціаноборогідрид натрію тиловим ефіром (трифеніл-15(0,5мл, 1н в ТГФ). Реакційну суміш перемішують фосфаніліден)оцтової кислоти (540мг, 1,6ммоль), і протягом ночі. Суміш промивають бікарбонатом суміш кип'ятять із зворотним холодильником пронатрію і насиченим розчином солі і концентрують у тягом 16год. Розчинник випаровують і після очивакуумі. Після препаративної ВЕРХ одержують щення колонковою хроматографією одержують 10мг продукту у вигляді TFA-солі. MC (M+1 503). 300мг метилового ефіру 3-[3-(2,6-діоксо-1,3Аналогічним образом одержують наступні дипрошл-2,3,6,7-тетрагідро-1H-пурин-8-іл)сполуки: біцикло[3.2.1]окт-8-іл]акрилової кислоти у вигляді Приклад 52а: 1,3- дипропіл-8-{8-[ (тіофен-2суміші цис- і транс-продуктів (вихід 70%). ілметил)аміно]біцикло[3.2.1]окт-3-іл}-3,7Після гідрування в метанолі звикористанням дигідропурин-2,6-діон; сполука з трифтороцтовою 10% Pd/C під тиском 40фунт/кв.дюйм протягом кислотою. MC (M+1 456). 4год. одержують метиловий ефір 3-[3-(2,6-діоксоПриклад 52b: {2-[3-(2,6-діоксо-1,3-дипропіл1,3-дипропіл-2,3,6,7-тетрагідро-1H-пурин-8-іл)2,3,6,7-тетрагідро-1Н-пурин-8-іл)-біцикло [3.2.1 біцикло[3.2.1]окт-8-іл]-пропіонової кислоти. ]окт-8-іламіно]етил}-амід 5-диметиламіноВищезгаданий метиловий ефір гідролізують в нафталін-1 -сульфонової кислоти; сполука з трисуміші 1н NaOH/метанол при 60°С протягом 30 фтороцтовою кислотою. MC (M+1 636). хвилин. Після препаративної ВЕРХ і подальшої Приклад 52с: 8-{8-[2-(1H-індол-3-іл) етиламіобробки одержують 19мг вказаних в заголовку но]-біцикло[3.2.1]-окт-3-іл}-1,3-дипропіл-3,7сполуки у вигляді транс-ізомеру. MC (M+1 417). дигідропурин-2,6-діон; сполука з трифтороцтовою Приклад 49а: цис-3-[3-(2,6-діоксо-1,3-дипротлкислотою. MC (М+1 503). 2,3,6,7-тетра-гідро-1Н-пурин-8-іл)Приклад 52d: 8-{8-[2-(5-нітропіридин-2-іламіно) біцикло[3.2.1]окт-8-іл]пропіонова кислота. Цисетиламіно]- біцикло[3.2.1]- окт-3-іл}-1,3-дипропілізомер (5мг), одержаний у вищеописаному експе3,7-дигідропурин-2,6-діон; MC (М+1 525). рименті, являє собою вказану в заголовку сполуку. Приклад 52е: 1,3-дипропіл-8-[8-[2-піридин-2-іл) MC (M+1 417). етиламіно]- біцикло [3.2.1]окт-3-іл]-3,7- дигідропуПриклад 50 рин-2,6-діон; MC (М+1 465). Транс-3-(2,6-діоксо-1,3-дипропіл-2,3,6,7Приклад 52f: Трифтороцтова кислота; 8-{8-[2тетрагідро-1Н-пурин-8-іл)-біцикло[3.2.1]октан-8(2-метил-5-нітро-імідазол-1-іл)етиламіно]карбонова кислота біцикло[3.2.1]окт-3-іл}-1,3-дипропіл-3,73-(2,6-Діоксо-1,3-дипропіл-2,3,6,7-тетрагідродигідропурин-2,6-діон; MC (М+1 513). 1Н-пурин-8-іл)-біцикло [3.2.1]октан-8-карбальдегід Приклад 52g: (1H-Бензоімідазол-2-ілметил)-[3(94мг, 0,25ммоль) і 2-метил-2-бутен (2,5мл, (2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1H2,5ммоль) в трет-бутанолі перемішують на крижапурин-8-іл)біцикло[3.2.1]окт-8-іл]амоній трифтораній бані. Потім по краплях додають моногідрат цетат; MC (M+1490). дигідрофосфату натрію (348мг, 2,5ммоль) і хлорит Приклад 53 натрію (285мг, 2,5ммоль) у воді. Суміш поступово (1Н-Бензоімідазол-2-ілметил)-[3-(2,6-діоксодоводять до кімнатної температури і продовжують 1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8перемішува ти протягом ночі. Для екстракції продуіл)біцикло[3.2.1]окт-8-ілметил]амоній трифторацекту використовують етилацетат. Після очищення тат; колонковою хроматографією одержують 20мг вкаПроводять процедуру відновного амінування, заної в заголовку сполуки у вигляді транс-ізомеру. аналогічну описаній в Прикладі 52. Вказану в загоMC (M+1 389). ловку сполуку синтезують з використанням 3-(2,6Приклад 51 діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8Моно-[3-(2,6-діоксо-1,3-дипропіл-2,3,6,7іл)біцикло[3.2.1]октан-8-карбальдегіду і С-(1Hтетрагідро-1Н-пурин-8-іл)-37 біцикло[3.2.1]окт-8бензоімідазол-2-іл)метиламіну як початкової споіл]ефір фосфорної кислоти луки. MC (M+1 514). Відповідно до процедури, описаної для одерАналогічним образом одержують наступні жання моно-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7сполуки: тетрагідро-1Н-пурин-8-іл)-біцикло[2.2.2]окт-1Приклад 53а: трифторацетат [3-(2,6-діоксо-1,3іл]ефіру фосфорної кислоти (в заявці, що одночадипропіл-2,3,6,7-тетрагідро-1Н-пурин-8сно розглядається), вказану в заголовку сполуку іл)біцикло[3.2.1]окт-8-ілметил]-(3-імідазол-1-ілодержують з використанням 8-(8-гідроксипропіл)амоній; MC (M+1 482). біцикло[3.2.1]окт-3-іл)-1,3дипропіл-3,7Приклад 53b: трифторацетат (2-трет 35 77937 36 бутоксикарбоніламіноетил)-[3-(2,6-діоксо-1,3-78°С додають H-BuLi (1,55Μ в гексані, 1,2екв., дипропіл-2,3,6,7-тетрагідро-1Н-пурин-81,3мл). Одержана жовта суміш набуває оранжевоіл)біцикло[3.2.1]окт-8-ілметил]амоній; MC (М+1 червоного кольору, після чого її перемішують при 517). вказаній температурі протягом 0,5год. Потім за Приклад 53с: трифторацетат [3-(2,6-діоксо-1,3допомогою шприца протягом 20 хвилин додають дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8розчин 8-окса-біцикло[3.2.1]окт-6-ен-3-ону (1, екв, іл)біцикло[3.2.1]окт-8-ілметил]тіофен-2222мг, 1,79ммоль) в ТГФ (4мл). Суміш витримують ілметиламонію; MC (М+1 470). Приклад 53d: три2 години при -78°С, і залишають на ніч для нагріфторацетат [2-(5-диметиламіно-нафталін-1вання до кімнатної температури (12год). Реакційну сульфоніламіно)-етил)-[3-(2,6-діоксо-1,3-дипропілсуміш розподіляють між насиченим водним NH4Cl 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[3.2.1] окт(20мл) і EtOAc (20мл), і водну фазу екстрагують 8-ілметил]амонію; MC (М+1 650). EtOAc (20мл). Об'єднані органічні екстракти проПриклад 53е: трифторацетат [3-(2,6-діоксо-1,3мивають насиченим водним NaCl (20мл), сушать дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8(MgSO4), фільтрують і концентрують у вакуумі. іл)біцикло[3.2.1]окт-8-ілметил]-[2-(1Н-індол-3-іл) Одержане оранжеве масло очищають хроматогетил]амонію; MC (М+1 517). рафією на двоокисі кремнію з використанням 5% Приклад 53f: трифторацетат [3-(2,6-діоксо-1,3МеОН в СН 2Сl2 як елюенту, внаслідок чого одердипропіл-2,3,6,7-тетрагідро-1Н-пурин-8жують прозоре масло, яке затверджується після іл)біцикло[3.2.1]окт-8-ілметил]-[2-(5-нітропіридин-2відстоювання (50мг, 8%). 1 іламіно)етил] амонію; MC (М+1 539). H ЯМР (300МГц, CDCl3); d 0,94 (відповідає т, Приклад 53g: трифторацетат [3-(2,6-діоксо-1,36Н), 1,66 (м, 2Н), 1,77 (м, 2Н), 1,83 (д, 2Н, дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8J=14,6Гц), 2,77 (дд, 2Н, J=4,0, 14,7Гц), 3,97 (т, 2Η), іл)біцикло[3.2.1]окт-8-ілметил]-(2-піридин-2-іл4,05 (т, 2Η), 4,30 (шир. с, 1Н), 4,91 (д, 2Н, J=3,7Гц), етил)амонію; MC (M+1 479). 6,59 (с, 2Н); MC: 361 (МН+). Приклад 53h: трифторацетат [2-(1НПриклад 57 бензоімідазол-2-іл) етил]-[3-(2,6діоксо-1,38-(8-Окса-біцикло[3.2.1]окт-6-ен-3-іл)-1,3- дипдипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)- біцикропіл-3,7-дигідропурин-2,6-діон ло[3.2.1]- окт-8-ілметил] амонію; МС(М+1 518). До охолодженої льодом суспензії хлориду (меПриклад 53і: трифторацетат [2-(1Нтоксиметил)три-фенілфосфонію (1,77ммоль, бензоімідазол-2-іл) етил]-[3-(2,6-діоксо-1,30,61мг) в PhMe (6мл) додають розчин гексаметилдипропіл-2,3,6,7-тетрагідро-1Н-пурин-8дисилазиду калію (0,5М, 3,48мл). Одержану черіл)біцикло[3.2.1]-окт-8-іл]амонію; MC (М+1 504). воно-оранжеву суміш перемішують при темпераПриклад 54 турі льоду протягом 30 хвилин. До охолодженої 8-(3-Оксо-4-аза-трицикло[3.2.1.02,71окт-6-іл)суміші додають 8-окса-біцикло[3.2.1]окт-6-ен-3-она b3-дипропіл-3,7-дигідропурин-2,6-діон [Mann, J. et al., J. Chem. Soc. Perkin Trans I, 1992, 8-(5-Оксо-трицикло [2.2.1.02,6] гепт-3-іл)-1,3787] (1,61ммоль, 0,200г) у вигляді розчину в Ph Me дипропіл-3, 7-дигідропурин-2,6-діон (150мг) розчи(6мл). Реакційну суміш перемішують протягом ночі няють в НОАс (5мл), додають H2NOSO3H (100мг) і при нагріванні до кімнатної температури, а потім кип'ятять із зворотним холодильником протягом розподіляють між насиченим NH4C1 і Et2O. Водний 5год. Суміш о холоджують до кімнатної температушар екстрагують Et2O і об'єднані органічні екстракри, обробляють льодом, нас. NaHCO3, а потім ексти промивають насиченим NH4Cl, H2O і насиченим трагують етилацетатом, промивають насиченим розчином солі, а потім сушать (MgSO 4). Після фірозчином солі і сушать над MgSO4. Після концентльтрації і випаровування, з подальшим проведенрування, неочищений продукт кристалізують з суням колонкової флеш-хроматографії і елююванміші ацетон/вода. Вихід: 135мг. MC (ES+ 358). ням градієнтною сумішшю Et2O/CH2Cl2, одержують Приклад 55 потрібний продукт (0,179г, 73%) у вигляді жовтої 1,3-Дипропіл-7-піролідин-1-ілметил-3,7рідини. ТШХ (двоокис кремнію, суміш ЕЇ2О/гексан, дигідропурин-2,6-діон 1:1, І2-візуалізація), Rf (потрібний продукт) = 0,59. Розчин 1,3-дипропіл-3,9-дигідропурин-2,6До розчину 3-метоксиметилен-8-оксадіону (446мг, 1,89ммоль), 37% водного формальбіциісло[3.2.1]окт-6-ену (1,18ммоль, 0,18г) в ТГФ дегіду (1,2екв., 2,26ммоль, 0,190мл) і піролідину (1,2мл) при кімнатній температурі додають 1н НСl (1,2екв., 2,26ммоль, 161мг) в ЕtOН (25мл) кип'я (1,2мл). Реакційну суміш перемішують протягом тять із зворотним холодильником протягом 36год. ночі при кімнатній температурі, а потім гасять 5% Охолоджену реакційну суміш концентрують у ваNaHCO3 і екстрагують Et2O. Об'єднані, органічні куумі з одержанням твердої речовини, яку сушать екстракти промивають 5% NaHCO3, насиченим у вакуумі протягом 24год. (598мг, 99%). розчином солі і сушать (MgSO4). Після фільтрації і 1 Н ЯМР (300МГц, CDCl3); d 0,94 (відповідає т, випаровування одержують вказану в заголовку 6Н), 1,64 (м, 2Н), 1,75 (м, 4Н), 1,78 (м, 2Н, частково сполуку (0,155г, 95%) у вигляді масла. ТШХ (двоприхований), 2,69 (м, 2Н), 4,00 (м, 4Н), 5,30 (с, 2Н), окис кремнію, суміш Еt 2О/гексан, 1:1, І27,59 (с, 1Н); MC: 320 (МН+). візуалізація), Rf (потрібний продукт) = 0,22. Приклад 56 До розчину 8-окса-біцикло[3.2.1]окт-6-ен-38-(3-Гідрокси-8-аза-біцикло[3.2.1]окт-6-ен-3-іл)карбальдегіду (0,434ммоль, 0,060г) в EtOH (2,2мл) 1,3-дипропіл-3,9-дигідропурин-2,6-діон при кімнатній температурі додають 1н NaOH До розчину, що перемішується 1,3 -дипропіл-7(2,2мл), а потім Ag2O (0,521ммоль, 0,121г). Реакпіролідин-1 -ілметил-3,7-дигідропурин-2,6-діону ційну суміш, яка злегка нагрівається, швидко пе(приклад 48) (522мг, 1,63ммоль) в ТГФ (50мл) при ремішують протягом 1год. Одержану суміш фільт 37 77937 38 рують через шар целіту, промиваючи колбу і осатягом 2год. Суміш фільтрують через целіт, і осадок на фільтрі сумішшю (1:1) ЕtOН/Н2О. Фільтрат док на фільтрі промивають МеОН. Після фільтраконцентрують для видалення основної кількості ції і випаровування з подальшим очищенням EtOH і водний залишок екстрагують Et2O. Ці екстПТШХ і елююванням градієнтною сумішшю (1:1) ракти відкидають. Водну фазу підкисляють (pH4) ЕtOАс/СН 2Сl2 одержують вказану в заголовку споконц. НСl і екстрагують Et2O. Ці екстракти промилуку (0,010г, 100%). 1 вають насиченим розчином солі і сушать (MgSO4). H ЯМР (300МГц, CDCl3): 0,93-0,99 (м, 6Н), Після фільтрації і випаровування одержують по1,68-1,89 (м, 8Н), 2,04-2,07 (м, 2Н), 2,16-2,25 (м, трібний продукт (0,0386г, 58%) у вигляді масла, 2Н), 3,34-3,42 (м, 1Н), 4,05-4,12 (м,4Н), 4,50 (шир. яке затверджується при відстоюванні. У 1H-ЯМРс, 2Н), 8,9 (шир. с, 1Н). аналізі ендо-ізомер не був детектований. Приклад 59 1 H ЯМР (300МГц CDCl3): 1,67 (шир. дд, 2Н, 1,3-Дипропіл-7-(тетрагідропіран-2-іл)-3,7- дигіJ=5,88, 13,7Гц), 1,92 (ддд, 2Н, J=3,62, 11,6, дропурин-2,6-діон 13,7Гц), 2,80 (тт, 1H, J=5,88, 11,6Гц), 4,78 (шир. с, Суспензію 1,3-дипропіл-3,9-дигідропурин-2,62Н), 6,16 (с, 2Н). діону (1,0мг, 4,2ммоль) і PPTS (0,42ммоль, 106мг) До розчину 8-окса-біцикло[3.2.1]окт-6-ен-3в 3,4-дигідропірані (15мл) і СНСІ3 (5мл) перемішукарбонової кислоти (0,25ммоль, 0,0386г), HATU ють при кімнатній температурі протягом 48год. (0,25ммоль, 0,0952г) і гідрохлориду 5,6-діаміноРозчинник видаляють у вакуумі з одержанням блі1,3-дипропіл-1Н-піримідин-2,4-діону [Daly J.W. et до-жовтої твердої речовини, яку розчиняють в al., J. Med. Chem. 1985, 28(4), 487] (0,25ммоль, СН2Сl2, промивають водою (2´20мл), сушать 0,0658г) в ДМФ (2,5мл) додають iPr2NEt (Na2SO4), фільтрують і концентрують у вакуумі з (0,75ммоль, 0,13мл). Реакційну суміш перемішуодержанням білої твердої речовини (1,2г, 89%). ють протягом ночі при кімнатній температурі. Цю MC 343 (МН+). суміш концентрують за допомогою насоса для Приклад 60 видалення ДМФ. Залишок розчиняють в ЕtOАс і Диметиловий ефір 3-(2,6-діоксо-1,3-дипpoпiлпромивають 1н НСl, 5% NaHCO3 і насиченим роз2,3,6,7-тeтpaгiдpo-1Н-пypин-8-iл)-3-гiдpoкcи-8-oкcaчином солі і сушать (MgSO4). Після фільтрації і бiциклo[3.2.1] октан-6,7-дикарбонової кислоти випаровування, з подальшим проведенням колонРозчин WA одержують доданням, при -78°С, nкової флеш-хроматографії і елююванням градієнтBuLi (1,8Μ в гексані, 1,7мл) до розчину iPr2NH ною сумішшю ТГФ/СН 2Сl2 одержують потрібний (3,61ммоль, 0,506мл) в ТГФ (25мл). Після додання, продукт (0,067г, 74%) у вигляді масла, яке затверLDA витримують при -78°С протягом 45 хвилин. джується після відстоювання. Потім повільно, при -78°С, додають розчин 1,31 Н ЯМР (300МГц, CDCl3): 0,90 (т, 3Н,. J=7,4Гц), дипропіл-7-(тетрагідропіран-2-іл)-3,7-дигідропурин0,97 (т, 3Н, J=7,3Гц), 1,53-1,72 (м, ОН), 1,95-2,03 2,6-діону (приклад 52) (2,78ммоль, 0,89г) в ТГФ (м, 2Н), 3,0 (шир. м, 1Н), 3,82-3,91 (м, 4Н), 4,79 (35мл). Після перемішування ще протягом 1 годи(шир. с, 2Н), 6,18 (с, 2Н). ни при -78°С додають розчин 8-оксаРозчин (6-аміно-2,4-діоксо-1,3-дипропілбіцикло[3.2.1]окт-6-ен-3-ону [Mann, J. et al., J. 1,2,3,4-тетра-гідропіримідин-5-іл) аміду 8-оксаChem. Soc. Perkin Trans I, 1992, 787] (2,78ммоль, біцикло[3.2.1]окт-6-ен-3-карбонової кислоти 0,345г) в ТГФ (5мл). Реакційну суміш перемішують (0,185ммоль, 0,067г) в 20% NaOH (1,23мл) і МеОН протягом ночі з нагріванням до кімнатної темпера(6,2мл) перемішують і кип'ятять із зворотним хотури. Потім реакцію гасять доданням насиченого лодильником протягом ночі. Реакційну суміш о хоNH4Cl і екстрагують ЕtOАс. Об'єднані органічні лоджують до кімнатної температури, а потім конекстракти промивають насиченим NH4Cl, H2O і центрують для видалення МеОН. Водний залишок насиченим розчином солі і сушать (MgSO 4). Після екстрагують Et2O і екстракти відкидають. Водний фільтрації і випаровування з подальшим провешар підкисляють (pH 2-3) конц. НСl, а потім екстденням колонкової флеш-хроматографії і елююрагують EtOAc. Об'єднані ЕtOАс-екстракти промиванням градієнтною сумішшю ЕtOАс/СН2Сl2, одевають Н2О і насиченим розчином солі і сушать ржують потрібний продукт (0,55г, 45%). MC (ESP+, (MgSO4). Після фільтрації і випаровування з пода60В): 445,07 (М+Н, 35%), 361,06 (48%), 343,05 льшим проведенням колонкової флеш(100%). хроматографії і елююванням градієнтною сумішРозчин 8-(3-гідрокси-8-окса-біцикло[3.2.1]окт-6шю (1:1) ЕtOАс/СН2Сl2 одержують вказану в загоен-3-іл)-1,3-дипропіл-7-(тетрагідропіран-2-іл)-3,7ловку сполуку (0,037г, 58%) у вигляді твердої редигідропурин-2,6-діон (0,113ммоль, 0,050г) і Et3N човини бежевого кольору. (1,13ммоль, 0,16мл) в МеОН (3мл) насичують СО, 1 НЯМР (300МГц, CDCl3): 0,93-0,99 (м, 6Н), що барботується з лекційного балончика протягом 1,62-1,83 (м, 6Н), 2,14-2,25 (м, 2Н), 3,40-3,51 (м, 30 хвилин. Потім до реакційної суміші додають 1H), 4,05-4,10 (м, 4Н), 4,86 (шир. с, 2Н), 6,25 (с, PdCl2 (0,023ммоль, 0,0041г) і СuСl2 (0,339ммоль, 2Н). 0,046г). Реакційну суміш перемішують протягом Приклад 58 ночі при кімнатній температурі в статичній атмос8-(8-Окса-біцикло[3.2.1]окт-3-іл)-1,3-дипропілфері CO. Завершену реакцію гасять доданням 3,7-дигідро-пурин-2,6-діон концентрованого NH4OH, розбавляють EtOAc і До розчину 8-(8-окса-біцикло[3.2.1]окт-6-ен-3фільтрують через целіт для видалення твердих іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діону (приречовин. Двофазний фільтрат розділяють і водну клад 50) (0,029ммоль, 0,010г) в МеОН (5мл) додафазу екстрагують EtOAc. Об'єднані органічні шари ють 10% Pd/C (50% Н2О) і одержану суспензію промивають 1н НС1, насиченим NaHCO3, H2O і швидко перемішують в а тмосфері Н 2 (1атм.) пронасиченим розчином солі, а потім сушать (MgSO4). 39 77937 40 Після фільтрації і випаровування одержують по59,69 (т), 121,04 (с), 121,44 (с), 137,18 (д), 138,16 трібний продукт (0,060 г, 94%). MC (ESP+, 60В): (д), 177,60 (с), 177,63 (с). 563,13 (M+H, 28%), 479,10 (100%). З використанням процедури, описаної в ПриДо розчину диметилового ефіру 3-[2,6-діоксокладі 50, етиловий ефір 4-метоксиметилен1,3-дипропіл-7-(тетрагідропіран-2-іл)-2,3,6,7біцикло[3.2.1]октан-1-карбонової кислоти тетрагідро-1Н-пурин-8-іл]-3-гідрокси-8-окса(3,84ммоль, 0,86г) перетворюють в потрібний пробіцикло-[3.2.1]октан-6,7-дикарбонової кислоти дукт (0,81г, 100%). ТШХ (двоокис кремнію, 20% (0,060ммоль, 0,030г) в суміші (1:1) ТГФ/МеОН Еt2О/гексан, 20% PMA/EtOH-візуалізація) Rf (потрі(6мл) додають 1н НСl (3 краплі). Реакційну суміш бний продукт) = 0,29. перемішують при кімнатній температурі протягом 3 До охолодженого льодом розчину етилового днів, а потім концентрують досуху. Залишок очиефіру 4-форміл-біцикло[3.2.1]октан-1-карбонової щають ПТШХ на 1мм-шарі, елююючи 20% кислоти (3,85ммоль, 0,81г) повільно додають реаТТФ/СН2Сl2, і одержують вказану в заголовку спогент Джонса (2,7Μ, 1,43мл). Реакційну суміш пелуку (0,0162г, 56%). ремішують при температурі льоду протягом 20 13 С ЯМР (100МГц, CDCl3): 11,53 (кв.), 11,50 хвилин, а потім гасять доданням іРrОН, розбавля(кв.), 21,72 (т), 21,75 (т), 41,74 (т), 43,82 (т), 45,85 ють Н2О і екстрагують Et2 O. Об'єднані органічні (т), 51,02 (d), 52,64 (кв.), 70,37 (с), 77,12 (д), 107,53 екстракти промивають Н 2О, насиченим розчином (с), 149,12 (с), 151,17 (с), 156,32 (с), 159,98 (с), солі і суша ть (MgSO 4). Після фільтрації і випаро173,36 (с). вування одержують потрібний в'язкий маслянисПриклад 61 тий продукт (0,76г, 87%) у вигляді, суміші аксіаль8-(3-Гідрокси-6,7-біс-гідроксиметил-8-оксаної і екваторіальної кислот. 13 біциклоГ3.2.1]окт-3-іл)-1,3-дипропіл-3,7С ЯМР (100МГц, CDCl3): 14,16 (кв.), 19,86 (т), дигідропурин-2,6-діон 21,07 (т), 25,98 (т), 29,20 (т), 31,52 (т), 31,87 (т), До розчину диметилового ефіру 3-[2,6-діоксо32,27 (т), 33,39 (т), 37,80 (д), 38,07 (т), 38,10 (д), 1,3-дипропіл-7-(тетрагідропіран-2-іл)-2,3,6,742,06 (τ), 44,80 (д), 45,78 (д), 49,38 (с), 49,60 (с), тетрагідро-1Н-пурин-8-іл]-3-гідрокси-8-окса60,31 (т), 60,36 (т), 177,08 (с), 180,01 (с). біцикло -[3.2.1]октан-6,7-дикарбонової кислоти Відповідно до процедури, описаної в прикладі (приклад 53) (0,060ммоль, 0,030г) в ТГФ (3мл) до50, стадія D, 1-етиловий ефір біцикло[3.2.1]октандають розчин LiBH4 (2M, 0,050мл). Реакційну су1,4-дикарбонової кислоти (0,84ммоль, 0,19г) підміш перемішують при кімнатній температурі 3 дні. дають взаємодії з гідрохлоридом 5,6-діаміно-1,3Потім реакцію обережно гасять доданням 1н НСl і дипропіл-1Н-піримідин-2,4-діону (0,84ммоль, 0,22г) екстрагують ЕtOАс. Об'єднані органічні екстракти з одержанням потрібного продукту (0,36г, 100%) у промивають насиченим NaHCO3 (IX) і насиченим вигляді суміші аксіального і екваторіального амірозчином солі і сушать (MgSO4). Після фільтрації і дів. MC (ESP+, 60В): 456,95 (М + Na, 45%), 46 випаровування одержують потрібний продукт 435,00 (M+H, 8%), 325,12 (42%), 280,05 (100%). (0,028г, 92%)у вигляді масла. MC (ESP+, 60В): Відповідно до процедури, описаної в прикладі 529,7 (M+Na, 20%), 507,32 (М+Н, 43%), 423,20 50, етиловий ефір 4-(6-аміно-2,4-діоксо-1,3(87%), 223,08 (100%). дипропіл-1,2,3,4-тетрагідропіримідин-5До розчину 8-(3-гідрокси-6,7-біс-гідроксиметилілкарбамоїл)біцикло [3.2.1] октан-1 -карбонової 8-окса-біцикло[3.2.1]окт-3-іл)-1,3-дипропіл-7кислоти (0,84ммоль, 0,36г) перетворюють у вказа(тетрагідропіран-2-іл)-3,7-дигідропурин-2,6-діону ну в заголовку сполуку. Після флеш-хроматографії (0,059ммоль, 0,030г) в суміші (1:1) ТГФ/МеОН і елюювання сумішшю (95:5:0,1) СН2Сl2/ТГФ/АсOН (6мл) додають 1н НСl (0,5мл). Реакційну суміш досягається часткове розділення аксіального (пеперемішують при кімнатній температурі протягом рша смуга, 0,032г) і екваторіального (друга смуга, ночі, а потім концентрують досуху. Залишок очи0,055г) ізомерів. MC (ESP+, 60В): (аксіальний ізощають ВЕРХ із зворотною фазою з одержанням мер) 389,12 (М+Н, 100%), 343,11 (15%); (екваторівказаної в заголовку сполуки (0,0024г, 10%). MC альний ізомер) 389,12 (М+Н, 100%), 347,05 (8%). (ESP+, 60В): 423,15 (М+Н, 100%); MC (ESP-, 60В): Приклад 63 421,01 (М-Н, 100%). 4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідроПриклад 62 4-(2,6-діоксо-1,3-дипропіл-2,3,6,71Н-пурин-8-іл)- біцикло [3.2.1] окт-3-ен-1 тетрагідро-1Н-пурин-8-іл) біцикло [3.2.1] октан-1карбонова кислота карбонова кислота До розчину етилового ефіру 4-оксоЗ використанням процедури, описаної в Прибіцикло[3.2.1]октан-1-карбонової кислоти [Kraus, кладі 50, етиловий ефір 4-оксо-біцикло[3.2.1]октанW. et al. Liebigs Ann. Chem. 1981, 10, 1826; Kraus 1-карбонової кислоти [Kraus, W. et al. Liebigs Ann. W. et al. Tetrahedron Lett. 1978, 445; Filippini, M.-H. Chem. 1981, 10, 1826; Kraus W. et al. Tetrahedron et al. J. Org. Chem. 1995, 60, 6872] (0,51ммоль, Lett. 1978, 445; Filippini, M.-H. et al. J.Org.Chem. 0,100г) в ТГФ (2,5мл) при -78°С додають LiHMDS 1995, 60, 6872] (6,17ммоль, 1,21г) перетворюють в (1,0Μ в ТГФ, 0,56мл). Після витримування протяпотрібний продукт. Після проведення флешгом 1год. при -78°С додають розчин PhNTf2 хроматографії і елюювання сумішшю 10% (0,56ммоль, 0,200г) в ТГФ (1мл). Реакційну суміш Еt2О/гексан одержують чистий продукт (0,96г, 69%) перемішують протягом ночі з нагріванням до кіму вигляді рідини (суміш ізомерів E/Z). натної температури. Після завершення реакції, 13 С Я МР 100МГц, CDCl3): 14,31 (кв.), 19,15 (т), реакційну суміш концентрують досуху і залишок 22,97 (т), 23,61 (т), 23,91 (т), 29,97 (т), 31,13 (т), очищають шляхом пропускання через шар силіка32,04 (т), 32,36 (т), 34,61 (т), 34,85 (д), 35,81 (т), гелю, елююючи сумішшю EtOAc/CH 2Cl2. Після ви43,18 (т), 43,63 (т), 50,47 (с), 50,77 (з), 59,63 (кв.), паровування фільтрату одержують потрібний про 41 77937 42 дукт (0,15г, 90%). Пацючий рецептор A1: Мембрани одержували Розчин етилового ефіру 4з кори головного мозку, витягнутої у пацюків відратрифторметансульфонілокси-біцикло[3.2.1]окт-3зу після ефтаназії. Тканини гомогенізували в буен-1 -карбонової кислоти (0,46ммоль, 0,15г), гідрофері А (10мМ EDTA, 10мМ Na-HEPES, pH7,4), хлориду 5,6-діаміно-1,3-дипропіл-1Н-піримідин-2,4який містив інгібітори протеази (10мкг/мл бензамідіону (0,55ммоль, 0,146г), iPr2NEt (0,92ммоль, дину, 100мкМ PMSF і 2мкг/мл (кожного) апротині0,16мл), Pd(OAc)2 (0,02ммоль, 0,0046г) і Ph3P ну, пепстатину і лейпептину) і центрифугували при (0,035ммоль, 0,092г) в ДМФ (5мл) насичують СО, 20000´g протягом 20 хвилин. Осадок ресуспендуякий барботується з лекційного балончика протявали і двічі промивали буфером НЕ (10мМ Naгом 30 хвилин. Реакційну суміш перемішують і HEPES, 1мМ EDTA, pH7,4, плюс інгібітори протеанагрівають при 100°С протягом 6год. в статичній зи). Кінцевий осадок ресуспендували в буфері НЕ, атмосфері СО. ДМФ видаляють з використанням який містив 10% (мас/об.) сахарозу і інгібітори пронасоса. Залишок розчиняють в ЕtOАс, промивають теази, і заморожували в аліквотах при -80°С. Кон1н НСl, насиченим NaHCO3, H2O і насиченим розцентрації білка визначали з використанням набору чином солі і сушать (MgSO4). Після фільтрації і для аналізу на білок, ВСA (Pierce). випаровування з подальшим проведенням колонЛюдський рецептор A1: кДНК людського адекової флеш-хроматографії і елююванням сумішшю нозинового рецептора А1 одержували за допомо10% ТГФ/СН2Сl2, одержують потрібний чистий гою ОТ-ПЛР і субклонували в pcDNA3 (Invitrogen). продукт (0,054г, 27%) у вигляді масла. MC (ESP+, Стабільну трансфекцію клітин СНО-К1 здійснюва60В): 455,16 (M+Na, 13%), 433,1 (М+Н, 15%), ли, використовуючи середовище 439,15 (27%), 182,93 (100%). LIPOFECTAMINE-PLUS (GIBCO-BRL) і колонії відВідповідно до процедури, описаної в прикладі бирали на середовищі, що містить 1мг/мл G418 і 50, етиловий ефір 4-(6-аміно-2,4-діоксо-1,3скринінг проводили за допомогою аналізів на скрідипропіл-1,2,3,4-тетра-гідропіримідин-5плення з радіо лігандом. Для одержання мемілкарбамоїл) біцикло[3.2.1] окт-3-єн-1-карбонової бранних препаратів, клітини СНО-К1, зростаючі як кислоти (0,125ммоль, 0,054г) перетворюють у вкамоношари на повному середовищі (F12+101 зану в заголовку сполуку. Чистий продукт (0,0031г, FCS+1мг/мл G418) промивали в PBS і збирали в 6,5%) одержують із зворотно фазової ВЕРХ. MC буфері А, який містив інгібітори протеази. Клітини (ESP+, 60В): 387,06 (М+Н, 100%). гомогенізували, центрифугували і двічі промивали Приклад 64 буфером НЕ як описано вище. Кінцевий осадок 1,3- Дипропіл-7-(тетрагідропіран-2-іл)-3,7- дизберігали в аліквотах при -80°С. Аналізи на скріпгідропурин-2,6-діон лення з радіолігандом Суспензію 1,3-дипропіл-3,9-дигідропурин-2,6Мембрани (50мкг мембранного білка для щудіону (1,0мг, 4,2ммоль) і PPTS (0,42ммоль, 106мг) рячих AIAR і 25мкг мембранного білка СНО-К1 для в 3,4-дигідропірані (15мл) і СНСl3 (5мл) перемішулюдського AIAR), радіол іганди і різні концентрації ють при кімнатній температурі протягом 48год. конкуруючих лігандів інкубували в потрійній репліРозчинник видаляють у вакуумі з одержанням блікації в 0,-1мл буферу НЕ, які містив 2од/мл аденодо-жовтої твердої речовини, яку розчиняють в зин-дезамінази, протягом 2,5год. при 21°С. Для СН2СІ2, промивають водою (2´20мл), сушать аналізів на конкурентне скріплення з A1AR викори(Na2SO4), фільтрують і концентрують у вакуумі з стали радіоліганд [3H]DPCPX (112Ки/ммоль від одержанням білої твердої речовини (1,2г, 89%). NEN, кінцева концентрація: 1мМ). Неспецифічне MC 343 (МН+). скріплення визначали в присутності 10мкМ Приклад 65 BG9719. Аналізи на скріплення завершували фільБуло одержано 106 похідних ксантину, що матрацією через скловолоконні фільтри Whatman ють структури, подані на Фіг.1. Для деяких з цих GF/C з використанням складальника клітин сполук, величини Кi для пацючих і людських А1 BRANDEL. Фільтри три рази промивали 3-4мл аденозинових рецепторів і для людських аденозиохолодженого на льоду 10мМ Трис-НСІ, pH7,4, і нових А2а рецепторів визначали відповідно до ни5мМ MgCl2 при 4°С. жченаведеного протоколу аналізу на скріплення. Фільтрувальний папір переносили в судин у і Було також обчислене відношення А2а/А1. додавали 3мл сцинтиляційної суміші ScintiVersell Аденозин-дезаміназу і HEPES закуповували у (Fisher). Радіоактивність визначали β-лічильником Sigma [St. Louis, МО]. Середовище Хемса F12 для Wallac. культивування клітин і фетальну бичачу сироватку Для визначення К1: Дані по конкурентному закуповували у GIBCO Life Technologies [Gaithersскріпленню відповідали моделі моносайтового burg, MD]. Ан тибіотик G-418, 150мМ-планшети для скріплення, і за цим даними будували криві з викокультивування Falcon і 12-ямкові планшети для ристанням Prizm GraphPad. Для обчислення K1 культивування Costar закуповували у Fisher виходячи з величин ІС 50 використали рівняння [Pittsburg, PA]. [3H] CPX закуповували у DuPontЧенга-Прусова КI=IC50/(l+[I]/KD), Де КІ означає New England Nuclear Research Products (Boston, афінну константу для конкурентного скріплення MA). Суміш антибіотиків пеніцилін/стрептоміцин ліганду, [І] означає концентрацію вільного радіолізакуповували у Mediatech (Washington, DC). ганду, а КD означає константу афінності для радіоHEPES-буферований розчин Хенкса мав наступліганду. ний склад: 130мМ NaCl, 5,0мМ СІ, 1,5мМ СаСl2, Для % скріплення: Для аналізів на моносайто0,41мМ MgSO4 , 0,49мМ Na2HPO4 , 0,44мМ КН2РО4, ве скріплення, дані були представлені як % від 5,6мМ декстроза і 5мМ HEPES (pH 7,4). загального специфічного скріплення конкуруючої Одержання мембран сполуки при концентрації 1мкМ: % всього скріп 43 77937 44 лення = 100* (специфічне скріплення з 1мкМ конбілка) інкубували протягом 2 годин при 25°С з куруючої сполуки/загальне специфічне скріплен0,15-20нМ [ 3Н]СРХ і з аденозин-дезаміназою ня). (2од/мл) в 100мкл 50мМ Трис-НСІ, pH7,4. ІнкубуДля всіх протестованих сполук, величини Кi вання припиняли шляхом розведення 4мл охолодля щурячого рецептора Аl становили 0,47-225нМ, дженого льодом 50мМ Трис-НСІ, негайно збираювеличини К; для людського рецептора Аl становичи мембрани на скловолоконі фільтри [Schleicher ли 12-1000нМ, а величини Ki для людського реце& Schuell, Keene, NH] за допомогою вакуумної фіптора А2 становили 18-100000нМ. Всі сполуки, за льтрації [Brandel, Gaithersburg, MD]. Фільтри три винятком однієї, мали відношення А2а /А1 принаймрази швидко промивали охолодженим льодом ні, 8, більшість з них мали відношення більш, ніж буфером для видалення непов'язаного радіоліга50, значне число - більш, ніж 100, і принаймні, однду. Фільтрувальні диски, що містять імобілізована сполука мала відношення вище, ніж 200. ний пов'язаний з мембранами радіоліганд, вміщуПриклад 66 вали в 4мл сцинтиляційної суміші Scintiverse BD Альтернативна методика аналізу Матеріали (Fisher), і визначали радіоактивність з використандив. Приклад 65. ням рідинного сцинтиляційного лічильника. Для Клітинна культура визначення неспецифічного скріплення з [3Н]СРХ, Клітини СНО, стабільно експресуючі рекомбімембрани інкубували як описано вище, і в буфер нантний людський A1 AdoR (клітини СНО: A1 AdoR) для інкубування додавали 10мкМ СРТ. Неспециодержували як описано в літературі [Kollias-Barker фічне скріплення визначали як скріплення [3Н]СРХ et al., J. Pharma. Exp. Ther. 281(2), 761, 1997] і в присутності 10мкМ СРТ. Специфічне скріплення культивували так само, як клітини СНО дикого тирадіоліганду з AlAdoR визначали шляхом відніпу. Клітини СНО культивували у вигляді моношамання неспецифічного скріплення із загального рів на пластикових чашках в середовищі Хемса Fскріплення. Було виявлено, що неспецифічне скрі12, яке додатково містило 10% фетальну бичачу плення лінійно зростає із зростанням концентрації сироватку, 100од пеніциліну G і 100мкг стрептомі[3Н]СРХ. Аналіз з трьома повторностями проводицину в атмосфері 5% СО2/95% повітря з підвищели для кожної концентрації [3Н] СРХ, що тестуєтьною вологістю при 37°С. Щільність сайтів скріпся. лення з [3Н]СРХ в клітинах СНО становила 26±2 Для визначення афінностей антагоністів (n=4) фмоль/мг білка. Після відділення клітин з Al AdoR для людського рекомбінантного AlAdoR, використанням 1мМ EDTA в HEPESекспресованого в клітинах СНО, оцінювали скріпбуферованому розчині Хенкса, що не -містить лення 2нм [3Н]СРХ в присутності зростаючих конCa2+-Mg2+, ці клітини субкультивували два рази на центрацій антагоніста. Аліквоти мембран клітин тиждень. Для даного експерименту використали СНО (100мкл: 5мкг білка), [3Н]СРХ, антагоніста три різних клони клітин СНО: Al AdoR, і всі резуль(0,1нМ-100мкМ) і аденозин-дезамінази (2од./мл) тати були підтверджені для клітин від двох або інкубували протягом 3 годин при 25°С в 200мкл трьох клонів. Щільність AlAdoR в цих клітинах ста50мМ Трис-НСІ-буферу (pH 7,4). Аналізи завершуновила 4000-8000фмоль/мг білка, як було визнавали як описано вище. чено в аналізі на специфічне скріплення з [3H]CPX. Аналіз даних Скріплення з радіолігандом Параметри скріплення (тобто, Bmax, KD, IC50 , Ki Клітини СНО, вирощені на 150мм-чашках для і коефіцієнти Хілла) визначали з використанням культивування, промивали HEPES-буферованим програми для аналізу на скріплення з радіоліганрозчином Хенкса, а потім видаляли за допомогою дами, LIGAND 4.0 (Elsevier-Biosoft). Більшість проскребачки-складальника клітин і гомогенізували в тестованих сполук мали відношення А2а /Аl що стаохолодженому льодом 50мМ Трис-НСІ, pH7,4. Кліновлять, принаймні, 20, значне число з них тинні мембрани осаджували за допомогою перевищувало 50, а деякі перевищували 100. центрифугування клітинного гомогенату при Інші варіанти здійснення винаходу Потрібно зазначити, що незважаючи на при48000´g протягом 15 хвилин. Мембранний осадок двічі промивали за допомогою ресуспендування в ведений вище докладний опис даного винаходу, вказаний опис носить лише ілюстративний хараксвіжому буфері і центрифугування. Кінцевий осатер і не обмежує об'єму даного винаходу, який док ресуспендували в невеликому об'ємі 50мМ визначений в представленій нижче формулі винаТрис-НСІ, pH7,4, і зберігали в аліквотах 1мл при ходу. Інші аспекти, переваги і модифікації входять 80°С аж до використання в аналізах. Для визначення щільності AlAdoR в мембрав об'єм нижченаведеної формули винаходу. нах клітин СНО, 100мкл-аліквоти мембран (5мкг 45 77937 46 47 77937 48 49 Комп’ютерна в ерстка В. Мацело 77937 Підписне 50 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAntagonists of adenosine rесерtor, method for production and use thereof
Назва патенту російськоюАнтагонисты аденозиновых рецепторов, способ их получения и применения
Автори російськоюKumaravel, Gnanasambandam
МПК / Мітки
МПК: A61P 11/00, A61P 13/00, A61P 25/28, C07D 473/06, A61P 3/10, A61P 43/00, A61P 7/12, A61P 25/00, A61P 11/06, A61P 25/18, A61P 9/04, A61K 31/52, A61P 7/10, C07D 519/00, A61P 9/00, A61P 25/24, A61P 13/12, A61P 1/00
Мітки: антагоністи, використання, спосіб, аденозинових, рецепторів, одержання
Код посилання
<a href="https://ua.patents.su/25-77937-antagonisti-adenozinovikh-receptoriv-sposib-kh-oderzhannya-ta-vikoristannya.html" target="_blank" rel="follow" title="База патентів України">Антагоністи аденозинових рецепторів, спосіб їх одержання та використання</a>
Попередній патент: Суміш харчова композиційна комплексна для ковбасних виробів і шинок (варіанти)
Наступний патент: Підпірна стінка
Випадковий патент: Композиція інгредієнтів для бальзаму "финарос"












