Похідні індану або індену як антагоністи ендотелінових рецепторів, фармацевтична композиція на їх основі, спосіб їх одержання та спосіб пригнічення ендотелінових рецепторів
Номер патенту: 44686
Опубліковано: 15.03.2002
Автори: Джон Дункан Елліотт, Маріа Ампаро Лего, Джек Дейл Лебер, Катерін Елізабет Пейшофф, Рассел Донован Казінс
Формула / Реферат
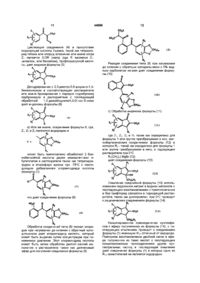
1. Производные общей формулы (I):
где - или
является
R3 и R5 независимо один от другого представляют собой водород, ОН, или - где метиленовые группы могут быть незамещенными или замещенными одной или более группами,
- водород,
- ОН или который может быть незамещен или замещен метоксигруппой,
- водород или
- водород,
или тетразол,
или фенилен, каждый из которых может быть незамещенным или замещенным одним или более ОН, или СООН,
- моно или дивалентный или которые могут быть незамещенными или замещенными одним или более ОН, либо
представляет собой
пиридил, тетразолил, которые могут быть незамещены или замещены одной или более или группами,
и независимо один от другого представляют собой водород, ОН, фенил, бензил или которые могут быть независимо замещены СООН или ОН, либо и вместе могут быть -О-А-О- на смежных атомах углерода,
пунктирная линия обозначает необязательное наличие двойной связи, или их фармацевтически приемлемая соль, при условии, что а) не является водородом, когда когда необязательная двойная связь присутствует, есть только один и отсутствует с) соединение формулы (І) не является дифенилинден-2-карбоновой кислотой, (цис, цис)дифенилиндан-2-карбоновой кислотой, [3-метил-1-фенил-1(Н)-инд-2-ен-1-ил]пропионовой кислотой, 2-[1,3-дифенил-(1Н)-инд-2-ен-2-ил]этановой кислотой, 1,3-дифенил-1-этоксиинден-2-карбоновой кислотой, 1,2,3-трифенилиденом, 1,3-дифенилинденом, 1-(2,3-диметил-2-бутен-1-ил)-1,3-дифенилинденом, 1,3-дифенилметилинденом, 1,3-дифенил-2-метилинданом, 1,3-дифенилинданом, 5,6-диметокси-1,3-дифенилинденом, 1,3-бис(4,5-диметокси-2-гидроксифенил)-5,б-диметоксиинданом, 1,3-бис(3,4-диметоксифенил)-5,6-диметоксиинданом, 1,3-дифенил-2-метоксииндёном, 1,3-дифенил-2-этоксиинденом, 5-фтор-2-метилинден-3-уксусной кислотой.
2. Производное по п. 1, отличающееся тем, что представляет собой является фрагментом формулы (а) или и независимо представляют собой водород, ОН, пиридил, фенил, - водород, ОН, и независимо - бензил, водород, ОН, или и вместе могут быть -О-А-О- на смежных атомах углерода, и независимо представляют собой водород, или тетразол, - фрагмент формулы (а) или фенил или пиридил и
3. Производное по п. 2, отличающееся тем, что представляет собой водород, и независимо представляют собой водород, ОН, - водород, - водород и - водород, ОН, бензил или или и вместе могут быть -О-А-О- на смежных атомах углерода.
4. Производное по п. 3, отличающееся тем, что представляет собой фрагмент формулы и - фрагмент формулы (а) или отсутствует необязательная двойная связь, и находятся в транс-положении по отношению к водород, - водород, представляет собой водород, - водород или -водород.
5. Производное по п. 1, отличающееся тем, что оно выбрано из группы, включающей следующие соединения: -1-(4-метоксифенил)-3-(3,4-метилендиоксифенил)индан-2-карбоновая кислота, -5-гидрокси-3-(4-метоксифенил)-1-(3,4-метилендиоксифенил)индан-2-карбоновая кислота, -5-мeтoкcи-3-(4-мeтoкcифeнил)-l-(3,4-мeтилeндиoкcифeнил)индaн-2-карбоновая кислота, -l,3-биc(3,4-мeтилeндиoкcифeнил)-5,5-гидроксииндан-2-карбоновая кислота, -3-(2-карбоксиметокси-4-метоксифенил)-1-(3,4-метилендиоксифенил)-5-(проп-1 -илокси)индан-2-карбоновая кислота, -3-(2-кapбoкcимeтoкcи-4-мeтoкcифeнил)-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота, -3-(2-кapбoкcимeтoкcи-4-мeтoкcифeнил)-l-(2-мeтoкcи-4,5-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота, -3-[2-(1-кapбoкcиэт-2-илoкcи)-4-мeтoкcифeнил]-1-(3,4-мeтилeндиoкcифeнил)-5-(проп-1-илокси)индан-2-карбоновая кислота, соль (бис)дициклогексиламина, -3-[2-[(Е)-2-кapбoкcиэтилeн-l-ил]-4-мeтoкcифeнил]-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота, -3-[2-(2-кapбoкcиэт-1-ил)-4-мeтoкcифeнил]-1-(3,4-мeтилeндиoкcифeнил)-5-(проп-1-илокси)индан-2-карбоновая кислота, -3-[2-(3-карбоксифенил)-4-метоксифенил]-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
6. Производное по любому из пп. 1-5, отличающееся тем, что оно обладает свойствами антагониста эндотелиновых рецепторов.
7. Производное по любому из пп. 1-6, отличающееся тем, что оно обладает свойствами блокатора эндотелиновых рецепторов.
8. Фармацевтическая композиция, обладающая свойствами антагониста эндотелиновых рецепторов и включающая активное вещество и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного вещества она содержит эффективное количество производного по любому из пп. 1-5.
9. Способ подавления эндотелиновых рецепторов, включающий введение, нуждающемуся в этом субъекту фармацевтически активного вещества, отличающийся тем, что в качестве фармацевтически активного вещества вводят эффективное количество производного по любому из пп. 1-5.
10. Способ получения производного формулы (І) по п. 1 или его фармацевтически приемлемой соли, отличающийся тем, что проводят взаимодействие соединения формулы (II):
где и - такие, как в п. 1, или группа, превращаемая в них,
- алкил,
с магнийорганическим соединением формулы (ІІІ):
где такой, как в п. 1, или группа, превращаемая в него, в подходящем растворителе с получением соединения формулы
которое восстанавливают и после этого при желании или необходимости подвергают конверсии для получения производного формулы (І).
Текст
1 Производные общей формулы (I) R - водород, R11 - ОН или (Сі-С^алкокси, к о т о р ы й м о ж е т быть незамещен или замещен метоксигруппои, R 6 - водород или R7 -водород, ( ^ D 8 D 11 рп Н к - к , ^ и 2 пилитеТразол, R - ( С 2 -С 10 )алкенилен и л и ф е н и л е Н ] к а Ж д ы й из которых может быть незамещенным или замещенным одним или более ОН, или СООН, R10 - 3 4 R11 - моно или дивалентный (С 2 -С 8 )алкенил или (С 2 -С 8 )алкинил к о т о р ы е м о г у т бы т ь неза мещенными или замещенными одним или более 11 он, либо R -соон, Х-(СН 2 ) п илиЭ(О) д , Y-CH 2 X(CH 2 ) n Ar, Аг представляет собой R3 (а) где R1 - ХіСНЛАг (Ь) пиридил, тетразолил, которые могут быть неза или мещены или замещены одной или более R3 или R4 группами, 1 P -X(CH 2 ) n R 8 A-[C(R6)z]m, P2 является x ( C H 2 ) n R 8 , R3 и R5 независимо один от другого представляют собой S(O)R11, водород, _XR9Y R11. ИЛИ ОН, (^-Сзіалкокси, .-Х(СН2)ПР8, г д е м е т и л е . новые группы л ^ н 2 ) п к , М огут быть незамещенными или замещенными одной или более О В--СН2 - и л и - О Z 1 и Z 2 независимо один от другого представляют собой водород, ОН, (^-СзЭалкокси, N(R 6 ) Z , NHCOR6, ф е н и Л ] б е н з и л и л и (С 2 -С 8 )алкенил которые могут быть независимо замещены СООН или ОН, либо Z 1 и Z 2 вместе могут быть -О-А-Она смежных атомах углерода, (О 00 (О 44686 q = 0 или 1 1 связь, R и XR n = 0-6, ляется водородом, когда 2 ^ ^' не яв ^) когда не обязательная двойная связь присутствует, есть 10 только один R и отсутствует Р ' с) соединение формулы (I) не является линден-2-карбоновой цис) - (1RS) -1,3 -(1RS)-1,3- дифеникислотой, (цис, дифенилиндан-2-карбоновой кислотой, -(1RS)-3- [3-метил-1-фенил-1(Н)-инд2-ен-1-ил]пропионовой кислотой, -(1RS)- 2-[1,3дифенил-(1Н)-инд-2-ен-2-ил]этановой кислотой, 1,3-дифенил-1 -этоксиинден-2-карбоновой кислотой, 1,2,3-трифенилиденом, 1,3-дифенилинденом, 1-(2,3-диметил-2-бутен-1-ил)-1,3дифенилинденом, 1,3-дифенилметилинденом, 1,3дифенил-2-метилинданом, 1,3-дифенилинданом, 5,6-диметокси-1,3-дифенилинденом, 1,3-бис(4,5диметокси-2-гидроксифенил)-5,бдиметоксиинданом, 1,3-бис(3,4-диметоксифенил)5,6-диметоксиинданом, 1,3-дифенил-2метоксиинденом, 1,3-дифенил-2-этоксиинденом, 5-фтор-2-метилинден-3-уксусной кислотой 2 Производное по п 1, отличающееся тем, что представляет собой ^ 2Jn n 3 R является фрагментом формулы (а) или С ) R и R5 независимо представляют собой водород, ОН, (Ц -О 8 )алкокси, 1 зил, ПИ р И д И Л ] фенил, R4 - водород, ~с 5 )алкокси, 2 1 водород, 3 ОН, и z 2 независимо - бенN(R 6 ) Z , (Сї-С^алкокси, NHCOR , и л и 7 1 и Z 2 вместе могут быть-О-А-Она смежных атомах углерода, Р1 и Р2 независимо представляют собой водород, СО2Н или тетразол, Аг - фрагмент формулы (а) или С3)- фенил или пиридил и Х--(СН 2 ) П 3 Производное по п 2, отличающееся тем, что R3 4 R представляет собой водород, -X(CH 2 ) n R , и R5 независимо представляют собой водо род, ОН, (Ci-CsJanKOKCH, водород, Z 1 1 (Ст-СзЭалкил - водород и Z NH2 2 р 2 _ - водород, ОН, N H(CO)CH 3 , 2 или Z и Z вместе могут быть -О-А-О- на смежных атомах углерода 4 Производное по п 3, отличающееся тем, что R1 представляет собой фрагмент формулы С3) и R2 - фрагмент формулы (а) или С3) В--О-, 2 отношению к Р . приемлемая соль, при условии, что а) ОН, t находятся в транс-положении по 1 m = 1,2 или 3, пунктирная линия обозначает необязательное наличие двойной связи, или их фармацевтически R 2 отсутствует необязательная А-СН2, двойная Z -OH, 1 3 дород, Z - водород, R дород, 2R5]fl p ю . представляет собой во X(CH 2 ) n CO 2 H (С^С^алкокси, (С^С^алкокси, R R 4 _ ВО дОрОд и л и i o _ВОдород 5 Производное по п 1, отличающееся тем, что оно выбрано из группы, включающей следующие соединения (1RS,2RS,3SR) ^ _(4-метоксифенил)-3(3,4-метилендиоксифенил)индан-2-карбоновая кислота, (1RS,2RS,3SR) -5-гидрокси-3-(4метоксифенил)-1-(3,4метилендиоксифенил)индан-2-карбоновая кислота, (1RS,2RS,3SR) -5-метокси-3-(4-метоксифенил)І-(3,4-метилендиоксифенил)индан-2-карбоновая кислота, (1RS,2RS,3SR) .^З-бисСЗ^метилендиоксифенил)-5,5-гидроксииндан-2карбоновая кислота, (1RS,2RS,3SR) .3.(2карбоксиметокси-4-метоксифенил)-1-(3,4метилендиоксифенил)-5-(проп-1 -илокси)индан-2карбоновая кислота, (1RS,2RS,3SR) .3.(2карбоксиметокси-4-метоксифенил)-1-(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоновая кислота, (1RS,2RS,3SR) .3.(2карбоксиметокси-4-метоксифенил)-І-(2-метокси4,5-метилендиоксифенил)-5-(проп-1-илокси)индан2-карбоновая кислота, (1RS,2RS,3SR) _з_[2-(1карбоксиэт-2-илокси)-4-метоксифенил]-1-(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоновая кислота, соль (бис)дициклогексиламина, (1RS,2RS,3SR) _3-[2-[(Е)2-карбоксиэтилен-1-ил]-4-метоксифенил]-1-(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоновая кислота, (1RS,2RS,3SR)-3-[2-(2карбоксиэт-1-ил)-4-метоксифенил]-1-(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоновая кислота, (1RS,2RS,3SR)-3-[2-(3карбоксифенил)-4-метоксифенил]-1-(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоновая кислота 6 Производное по любому из пп 1-5, отличающееся тем, что оно обладает свойствами антагониста эндотелиновых рецепторов 7 Производное по любому из пп 1-6, отличающееся тем, что оно обладает свойствами блокатора эндотелиновых рецепторов 8 Фармацевтическая композиция, обладающая свойствами антагониста эндотелиновых рецепторов и включающая активное вещество и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного вещества она содержит эффективное количество производного по любому из пп 1-5 9 Способ подавления эндотелиновых рецепторов, включающий введение, нуждающемуся в этом субъекту фармацевтически активного вещества, отличающийся тем, что в качестве фармацевтически активного вещества вводят эффективное количество производного по любому из пп 1 -5 10 Способ получения производного формулы (I) 5 44686 по п 1 или его фармацевтически приемлемой согде R такой, как в п 1, или группа, превращаели, отличающийся тем, что проводят взаимодеймая в него, в подходящем растворителе с получествие соединения формулы (II) нием соединения формулы ('V) со,х (И) где ^ > Z и R - такие, как в п 1, или группа, превращаемая в них, X - алкил, с магнииорганическим соединением формулы (III) i/ но которое восстанавливают и после этого при желании или необходимости подвергают конверсии 1 2 1 2 R ,R ,Z ,Z для получения производного формулы (I) 2 R -(CH2)n-MgBr, Изобретение относится к новым индан и инден производным, фармацевтическим композициям содержащим эти соединения и их использованию в качестве эндотелиновых рецепторных антагонистов Эндотелии (ЕТ) является чрезвычайно высокоактивным сосудосуживающим пептидом синтезируемым и выделенным васкулярным эндотелием Эндотелии существует в виде трах изоформ, ЕТ-1, ЕТ-2 и ЕТ-3 Было найдено, что из них только ЕТ-1 и ЕТ-3 экспрессируются в системах млекопитающих (Если не указано особо "эндотелии" будет означать любой или все изомеры (изоформы) эндотелина) Эндотелии оказывает глубокое воздействие на сердечно-сосудистую систему, и в частности, на коронарное, почечное и мозговое кровообращение Повышенное или ненормальное выделение эндотелина связано с сокращением гладких мышц, которые вовлекаются в патогенез сердечно-сосудистой, церебрально-сосудистой, респираторной и почечной патафизиологии Сообщалось о существовании повышенных уровней эндотелина в плазме у пациента со значительной артериальной гипертензией, острым инфарктом миокарда субарахноидальным кровоизлиянием, атеросклерозом, и пациентов с уремией подвергающихся диализу In vivo, эндотелии оказывает явно выраженное воздействие на кровяное давление и минутный сердечный выброс Внутривенозная инъекция ударной дозы ЕТ (от 0,1 до Знмоль/кг) вызывает у крыс временную, связанную с дозой депрессорную реакцию отклик) (спустя от 0,5 по 2 минут) с последующим устойчивым, зависящим от дозы, повышением артериального кровяного давления, которое может оставаться увеличенным в течение 2 - 3 часов после введения дозы У крыс дозы свыше Знмоль/кг часто вызывают летальный исход Эндотелии по-видимому оказывает предпочтительное воздействие на почечное сосудистое ложе Он вызывает заметное продолжительное снижение почечного кровотока, сопровождаемое существенным снижением в GFR, объема мочи, выделения натрия и калия с мочой Эндотелии вызывает длительный антинатриуретический эффект несмотря на значительное увеличение атриального натриуретического пептида Эндотелии также стимулирует knin активность (плазмы) Эти результаты наводят на мысль, что ЕТ вовлекается в регулирование почечной функции и вызовет в целом ряд почечных расстройств, включающих острую почечную недостаточность, циклоспориновую нефротоксичность и хроническую почечную недостаточность Исследования показали, что in vivo, церебральная сосудистая сеть является высокочувствительной как к сосудорасширяющему, так и сосудосуживающему воздействию эндотелина Поэтому, ЕТ может быть важным медиатором церебральнососудистого спазма частого и часто смертельного последствия субарахноидального кровотечения ЕТ также проявляется непосредственное воздействие на нейтральную нервную систему, такое как тяжелое апноэ и ишемические патологии, которые наводят на мысль, что ЕТ может принимать участие в развитии церебральных инфарктов и гибели нейронов ЕТ может быть также вовлеченным в ишемию миокарда (Nichols et al Br J Pharm 99 597 - 601, 1989 and Clojel, Circ Res 65 1193 - 1200, 1989) спазмы коронарных сосудов (Fukuda et al, Bur J Pharm 165 301 - 304, 1989 and Znscher, Circ 83 701, 1991) при сердечной недостаточности, пролиферацию васкулярных клеток гладкой мышцы, (Fakagi, Biochem SBiophys Res Commun 168 537 - 843, 1990, Bobek et al , Am J Physiol 258 408 - С 415, 1990) и атеросклерозы (Nakaki et al , 153 880 - 881, 1989, and Zerman et al , New Eng J of Med 325 997-1001,1991) Было показано существование повышенных уровней эндоталина после коронарной пластической операции с использованием надувного баллона (Kadel et al , No 2491, Circ, 82 627, 1990) Кроме того, было найдено, что эндотелии является сильнодействующим констриктором выделенной у млекопитающих ткани дыхательных пу 44686 тей, включающей человеческие бронхи (Ushida et al , Eur J of Pharm 154 227 - 228 1988, ZaYente, Clm Exp Allergy, 20 343 - 348, 1990, and Spnngall (с) et al , Zancet, 337 697 - 701, 1991) Эндотелии связан с возникновением кровоизR2 является водородом, Аг или (с), лияний и некротических нарушений слизистой P i - ЯВЛЯеТСЯ -X(CH2)n F?8, оболочки желудка (Whittle et al , Br J Pharm 95 Р2 - является -X(CH2)n Rs, или -XP9Y, 1011 - 1013, 1988), симптома Raynand'a Cinnmiello R3 и Rs независимо представляют водород, et al , Zancet, 337 114 - 115, 1991), мигрени (EdRn, ОН, Сі в алкокоси, S(O)qRn, N(R6)2, Br, F, І, СІ, meads, Headache, Feb 1991 p 127), сепсиса (WeitCF3, NHCOR6, -P11CO2R7, -XP94 или -X(CH2)n Rs jberg et al , Circ Shock, 33 222 - 227, 1991, Pittet et где метиленовые группы -Х(СН2) Rs могут быть al , Ann Surg 213 262 - 264, 1991, циклоспориннезамещенными или замещенными одной иди индуцируемой почечной недостаточности или гиболее -(СНгіп Аг группами, пертензии (EurJ Pharmacol 180 191 - 192, 1990, Kidney Int ,37 1487 - 1491, 1990) и эндотоксиновоР4 представляет водород, Rn, ОН, Сі 5 алкокго бактериально-токсического шока и других выси, S(O)q P11 N(R6)2l -X(Rn), Br, F, I, Cl или NHCR6 зываемых эндотоксином заболеваний Biochem , где С1-С5 алкокси может быть незамещенной или Biophys Res Commun 161 1220 - 1227, 1989, замещенной с помощью ОН, метокси или галогеActaPhysiol Scand 137 317-318,1989) на, R6 независимо представляет водород или С •] &, Таким образом, эндотелиновые рецепторные ал кил, антагонисты будут представлять уникальный меR7 независимо представляет водород, С-і-Сє тод для фармакотерапии гипертензии, почечной алкил или (СН2)п Аг недостаточности, заболеваний сосудов головного Rs представляет водород, R11CO2R7, PO3H2, мозга, ишемии миокарда, ангины, сердечной неP(O)(OH)R7, CN2-C(O)N(R6)2, тетразол или OR6, достаточности, астмы, атеросклероза, симптома Raynand'a, язв, сепсиса, мигрени, глаукомы, эндоРэ представляет Сі-Сю алкил, С2-Сю алкенил токсинового шока, вызываемого эндотоксином или фенил, все они могут быть незамещенными множественного органического нарушения или или замещенными одним или более ОН N(R6)2, распространенной внутрисосудистой коагуляции, СООН, галогеном или XCi 5 алкилом циклоспорин-индуцируемой почечной недостаточR-іо представляет R3 или R4, ности и в качестве вспомогательного средства при Rn представляет Ci-Cs алкил, C2-Cs алкенил, пластической операции на сосудах и предотвраСг-Св алкинил, все они могут быть незамещенныщения рестеноза ми или замещенными одним или более ОН, СНгОН, І\І(Рб)2 или галогеном, Данное изобретение включает индан и инден X представляет (СНгіп, О, NR6 или S(O)q, производные представленные формулой (I) и Y представляет СНз или Х(СН2)П Аг, фармацевтические композиции содержащие эти Аг является соединения, и их использование в качества эндотелии рецепторных антагонистов, которые являются полезными в лечении разнообразных сердечно-сосудистых и почечных заболеваний, включающих, но не ограничиваемых ими, следующие гипертензия, острая и хроническая почечная недостаточность, циклоспорининдуцируемая нефротоксичность, внезапный приступ, цереброваскулярный вазоспазм, ишемия u-tw миокарда, ангина, сердечная недостаточность и or атесклероз Кроме того, изобретение представляет способ подавления эндотелиновых рецепторов у животнафтил, индонил, пиридил, тиенил, оксазолиных, включая людей, который включает введение динил, оксазолил, тиазолил, изотиазолил, пиразонуждающемуся в этом животному эффективного лил, триазолил, тетразолил, имидазолил, имидаколичества соединения формулы (I) золидинил, тиазолидинил, изоксазолил, ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ окоадиазолил, тиадиазолил, морфолинил, пипеСоединения данного изобретения представридинил, пидеразинил, пирролил, или пиримидил, лены структурной формулой (I) все они могут быть незамещенными иди замещенными одной или более R3 или R4 группами, А является С = 0, или [C(R6)2]m В является -СН2- или -О-, Zi и Z2 представляют независимо водород, d Cs алкил, Сг 8 алкенил, - С2 8 алкинил, ОН, Ci s алкокси, S(O)q, Сі % алкил, N(R6)2, Br, F, I, Cl, NHCOR6, -X(CH2)nP8, фенил, бензил или Сз є цикгде лоалкил, где Ci s алкил, С2 s алкенил, или С2 s алявляется -Х(СН2)пАг или -X(CH2)n Rs или кинил могут быть независимо замешанными СООН, ОН, СО(СН2)пСНз, CO(CH2)nCH2N(P6)2, или галогеном, или Z^\ и Z2 вместе могут быть -О-А-О л, 44686 10 водород, Zi представляет водород, R3 представна прилегающих углеродных атомах, ляет водород, X(CH2)qCOOH или СН=СНСО2Н, R4 Z3 является Zi иди XRgY, представляет водород, замещенный фенил, или q равно нулю, одному или двум, Сі 2 алкокси, и R5, Rio и R2 являются водородом п представляет целое число от 0 до шести, Особенно предпочтительными являются m равно 1, 2 или 3, следующие соединения и пунісгирная линия обозначает необязательное наличие двойной связи, или фармацевтически (1 RS, 2RS, 3RSJ-1 -(4-метоксифенил)-3-(3,4приемлемая их соль, при условии, что метилендиокси-фенил)индан-2-карбоновая кислота, 'F?2 не является водородом, когда X равно S(O)q, (1RS, 2RS, 3RS)-5-l~HflpoKCH-3-(4' когда необязательная двойная связь присутметоксифенил)-1-(3,4-метиленствует, есть только один R-іо и отсутствует P-i, диоксифенил)индан-2-карбоновая кислота, ' соединение формулы I не является (1RS)(1RS, 2RS, 3RS)-5-MeTOKCH-3-(41,3-дифенилиден-2-карбоновая кислота, (цис, метоксифенил)-1-(3,4-метиленцис)-(1 RS 3SR)-1,3-дифенилиндан-2-карбоновая диоксифенил)индан-2-карбоновая кислота, кислота, (1 RS)-3-[3-Me™i-1 -фенил-(1 Н)-инд-2-ен(1RS, 2RS, 3RS)-1,3-BHC(3,41-]ил пропионовая кислота, или (1RS)-2[1,3метилендиоксифанил)-5-5гидроксииндан-2дифенил-(1Н)-инд-2-ен-2-ил] этановая кислота В карбоновая кислота, изобретение также включаются фармацевтически (1 RS, 2RS, 3RS)-3-(2-Kap6oKCHMeTOKCH-4приемлемые комплексы солей метоксифенил)-1-(3,4-метилендиоксифенил)-5(проп-1 -илокси)-индан-2-карбоновая кислота Все алкил, алкенил, алкинил и алкокси группы могут быть прямолинейными или разветвленны(1 RS, 2RS, 3RS)-3-(2-Kap6oKCHMeTOKCH-4ми Термин "галоген" используется для обозначеметоксифенил)-1-(2-метокси-4,5ния иодо, фторо, хлоро или бромо Алкильные метилендиоксифенил)-(проп-1-илокси)-индан-2группы могут быть замещенными одним или более карбоновая кислота галогенами до полного галогенирования (1RS, 2RS, 3RS)-3-2-(1-Kap6oKCH3T-2-nnoKCH)4-метоксифенил-1-(3,4-метилендиоксифенил)-5Соединения данного изобретения могут со(проп-1-илокси)-индан-2-карбоновая кислота, соль держать один или более асимметричных атомов бис-дициклогексиламина, углерода и могут существовать в рацемической иди оптически активной форме Все эти соедине(1RS, 2RS, 3RS)-3-/2-/(E)-2-Kap6oKCH3TeH-1-nnния и диастереоизомеры рассматриваются как 4-метоксифенил/-1-(3,4-метилендиоксифенил)-5вводящие в рамки объема данного изобретения и (проп-1 -илокси)индан-2-карбоновая кислота, приложенных пунктов (1 RS, 2RS, 3RS)-3-[2-(2-Kap6oKCH3T-1 -ил)-4метоксифенил]-1-(3,4-метилендиоксифенил)-5Предпочтительными являются такие соедине(проп-1-идокси)-индан-2 карбоновая кислота, ния, в которых Ri является Х(СЬІ2)пАг, (Аг представляет (а) или (в)), дигидробензофуранил, бен(1 RS, 2RS, ЗИЗ)-3-[2-(3-Карбоксифенил)-4зодиоксанил, циклогексил, Сі 4 алкил, R2 метоксифенил]-1-(3,4-метилендиоксифенил)-5представляет (а), (в) Сі 4 алкил, индонил или во(проп-1-илокси) индан-2-карбоновая кислота дород, R3 и Rs представляют независимо водород, Данное изобретение дает соединения формуОН, Сі 5 алкокси, галоген, -ОСі 4 алкил фенил, лы (I) приведенные выше RnCO2P7, Сі 4 алкил, N(P6)2, NH(CO)CH3, -X(CH2)n Rs, -XPg пиридил, фенил или S(O)pCi 5 алкил, R4 представляет водород, ОН, Сі 5 алкокси, галоген, Сі 4 алкил, N(P6)2, Н(СО)СН3 или S(O)pCi 5 алкил, (I! Zi, Z2 и Z3 независимо представляют XRgY, бензил, водород, ОН, Сі 5 алкокси, -NfReb, S(O)q С1 s алкил, ЫНСОРб, X(CH2)n Rs или галоген, или Zi и Z2 вместе могут быть -О-А-0 на прилегающих угкоторые могут быть приготовлены по способу леродных атомах, Pi и P-z независимо представвключающему ляют водород, СОгН или тетразол, Аг представляа) взаимодействие соединения формулы (2), ет (а), (в), фенил, или пиридил, X представляет где X является Сі 5 алкилом (СН2)п или кислород Более предпочтительными являются соединения, в которых R3 представляет водород или X(CH2)n Rs, R11CO2R7, R4 и Rs независимо представляют водород, ОН, Сі 5 алкокси, SCi 5 алкил, F, Вг, Сі 3 алкил или NH2, Z-i, и Z3 представляют водород и Z2 представляет водород, ОН, Сі 5 алкокси, галоген, X(CH2)n Rs, NH2, бензил, NH(CO)CH3, или Zi и Z2 вместе могут быть О-А-0 Самыми предпочтительными являются соединения, в которых Ri представляет (в) и R2 представляет (а) или (в), А является СНг, В является О-, отсутствует необязательная двойная связь, Pi и PR2 находятся в транс по отношению к Pi, Z2 представляет ОН, Сі 5 алкокси, -ОСН2СНСН2 или СОз* (2) с замещенным бензальдегидом или альдегидом формулы (3) D-CHO (3) где D является Аг или (с) как определено в формуле 1, в подходящем растворителе, таком как бензол, с катализатором, таким как пиперидин ацетат, при нагревании до кипения с обратным холодильником с целью получения соединения формулы (4) 44686 12 co,x 2 Циклизация соединения (4) в присутствии подходящей кислоты Льюиса, такой как тетрахлорид титана или хлорид алюминия или иначе когда Zi является 3-OR (мета) (где R является Сі бэлкилом, или бензилом), трифторуксусной кислоты, дает инданон формулы (5) Р Дегидрирование с 2,3-дихлор-5,6-дициано-1,4бензохиноном в соответствующем растворителе или иначе бронирование с пиридин гидробромид пербромидом в дихлорметане с последующей обработкой 1,5-диазабицикло/4,3,0/-нон-5-ином дает инденомы формулы (6) (9) Реакция соединения типа (9) при нагревании до кипения с обратным холодильником с 5% водным карбонатом натрия дает соединения формулы (10) COjX (10) с) Обработка инденона формулы (11) (6) COjX в) Или же иначе, соединение формулы 6, где, Z-i, Z2 и Z3 являются водородом и VV может быть приготовлено обработкой 2 бромобензойной кислоты двумя эквивалентами нбутиллития в растворителе таком как тетрагидрофуран в атмосфере аргона при -78°С с последующим добавлением хлорангидрида кислоты формулы (7) где Z-і, Z2, Z3 и такие как определено для формулы 1 или группа преобразуемая в них, магнийорганическим соединением формулы (12) в котором R2 - такой как определено для формулы 1 или группа преобразуемая в него, в подходящем растворителе при 0°С R2(CH2)n)MgBr(12) дает соединения формулы (13) СО2Х (13) Омыление соединений формулы (13) использованием гидроокиси натрия в водном метаноле с последующим восстановлением стриэтилсиланом и бор трифторид эфератом в подходящей растворителе, таком как дихлорметан, при 0°С приводит к рацемическим соединениям формулы (14) •{СН^ что дает соединение формулы (8) («Щ. (11) (8) Обработка соединений типа (8) тионил хлоридом при нагревании до кипения с обратный холодильником дает хлорангидрид кислоты, который может быть выделен путем концентрации при пониженном давлении Этот хлорангидрид кислоты может быть затем обработан диэтил магний малонатом в растворителе таком как диэтиловый эфир для получения соединения формулы (9) (14) Коньюгированное присоединение нуклеофилов к эфиру полученному из формулы (14), с последующим опылением приводит к соединениям формулы (1) имеющим R-іо отличный от водорода Повторное восстановление двойной связи в эфире полученном из таких кислот с последующим коньюгированным присоединением других нуклеофильных частиц и последующее омыление дает соединения формулы (1) в которых один из R-іо заместителей не является водородом 13 44686 Восстановление соединений формулы (13) триэтилсиланом и бор трифторид эфератом в подходящем растворителе таком как дихлорметан при 0°С с последующим гидрированием газообразным водородом под давлением приблизительно 60psi (4,22кг/см2) в присутствии подходящего катализатора такого как 10% палладий на активированном угле, дает соединения формулы (15) W (15) Алкилирование или ацилирование эфирного энолята производного от формулы (15) дает соединения, в которых Pi и Рг являются такими как определено для формулы (1) Иначе, гидрирование соединений формулы (13) газообразные водородом под давлением приблизительно 60psi в присутствии подходящего катализатора такого как 10% палладий на активированное угле в подходящем растворителе таком как этил ацетат или метанол содержащей 1 - 5% уксусной кислоты дает соединения формулы (15) Обработка этих соединений основанием таким как гидроокиси натрия в подходящем растворителе таком как водный этанол дает рацемические соединения формулы (16) А •COjH (16) где Z-i, Z2 и Z3 являются водородом, Ri = R2 и п = 0 Обработка соединений формулы (13) триэтилсиланом и бор трифторид эфератом в подходящем растворителе таком как дихлорметан при 0°С с последующим взаимодействием с самарий II йодидом в подходящем растворителе таком как тетрагидрофуран и затем омылением, дает соединений формулы (17) ft COjH (17) С соответствующими корректировками и защитой любых химических функциональных групп, синтеза оставшихся соединений формулы (1) выполняются по методикам аналогичным приведенным выше и методикам описанным в Экспериментальном разделе С целью использования соединения формулы (1) или его фармацевтически приемлемой соли для лечения людей и других млекопитающих оно обычно составляется в соответствии со стандартной фармацевтической практикой в виде фармацевтической композиции Для лечения указанных заболеваний соединения формулы (1) и их фармацевтически приемлемые соли могут назначаться стандартным способом, например орально, парентерально, подъязычно, через кожу, ректально, посредством ингаляции или транбуккальным методом Соединения формулы (1) и их фармацевтиче 14 ски приемлемые сажи, которые активны, когда вводятся орально, могут быть составлены в виде сиропов, таблеток, капсул и лепешек Технология приготовления лекарственного средства в виде сиропа обычно должна включать суспензию или раствор соединения или его соли в жидком носителе, например, этаноле, арахисовом масле, оливковом масле, глицерине или воде с ароматическими добавками и красителями Когда композиции составлена в форме таблеток, могут быть использованы любые фармацевтические носители обычно применяемые в технологии приготовления твердых лекарственных препаратов Примеры таких носителей включают стеарат магния, terra alba, тальк, желатину, агар, пектин, смолу акации, стеариновую кислоту, крахмал, лактозу, сахарозу Когда композиция используется в форме капсул, подходящими являются любые общепринятые включения в капсулу, например, использование вышеупомянутых носителей в твердой желатиновой оболочке капсулы Когда композиция составляется в форме капсулы с мягкой желатиновой оболочкой, могут рассматриваться любые фармацевтические носители обычно используемые идя приготовления дисперсий или суспензий, например, важные камеди, целлюлозы, силикаты или масла и заключаться в мягкую желатиновую оболочку капсулы Типичные парентеральные композиции состоят из раствора или суспензии соединения или соли в стерильном водном иди безводном носителе необязательно содержащем парентерально приемлемое масло, например, полиэтиленгликоль, поливинилпирролидон, лецитин, арахисовое масло или кунжутное масло Типичные композиции для ингаляции изготавливаются в форме раствора, суспензии или эмульсии, которые могут вводиться как сухой порошок или в форме аэрозоли использующего общепринятые пропелленты такие как дихлордифторметан или трихлортрифторметан Типичный состав суппозитория включает соединение формулы (1) или его фармацевтически приемлемую соль, которые активны при введении таким путем, со связывающим и/или смазывающим агентом, например полимерными гликолями, желатиной, маслом какао или другим растительным воском или жирами или их синтетическими аналогами Типичные трансдермальные составы включают обычные водные или безводные наполнители, например паста, мазь, лосьон или крем или применяются в форме медицинского пластыря, бляшки или пленки Предпочтительно композиции изготавливаются в унифицированной дозировочной форме, например, таблетки, капсулы или измеренной аэрозольной дозе, так что пациент может применять их в разовой дозе Каждая дозированная единица для орального введения содержит соответственно от 0,1мг до 500мг/кг, и предпочтительно от 1мг до 100мг/кг, и каждая дозированная единица для парентерального введения содержит соответственно от 0,1 до 100мг, соединения формулы (1) иди его фармацевтически приемлемой соли, рассчитанной на 44686 16 15 свободную кислоту Каждая дозированная единиВ) Протокол І ЕТ-1 связывания 125 ца введения через нос содержит соответственно 1 Связывание I ЕТ-1 с мембранный крысиного - 400мг предпочтительно от 10 до 200мг на индимозжечка (2 - 5мг белка/пробирку) или кортикальвида Составы локального применения содержат ного слоя почки (3 - 8мг белка на пробирку) измесоответственно от 0,01 до 1,0% соединения форряли после 60 минут инкубации при 30°С в буфере мулы (1) 50мМ Трис НСІ, ЮмМ MgCI2, 0,05% (В А) бычьего Суточная дозировка требующаяся для оральсывороточного альбумина, рН 7,5 в общем объеного введения составляет соответственно приме 100мл Мембранный белок добавляли в проблизительно от 0,01мг/кг до 40мг/кг, соединения бирки содержащие или буфер или указанные формулы (1) или его фармацевтически приемле1 5 концентрации соединений [ І] ЕТ-1 (2200 мой соли в расчете на свободную кислоту СуточСі/мМоль) разбавили в том же буфере содержаная дозировка требуемая для парентерального щем бычий сывороточный альбумин (БСА) так введения составляет соответственно приблизичтобы получить конечную концентрацию 0,2 тельно от 0,001 мг/кг до 40мг/кг, соединения фор0,5нМ ЕТ-1 Общее и неспецифическое связывамулы (1) или его фармацевтически приемлемой ние измеряли в отсутствии и в присутствии ЮОнМ соли в расчете на свободную кислоту намеченного ЕТ-1 После инкубации, реакции гаСуточная дозировка требуемая для введения сили 3 мл охлажденного буфера содержащего через нос или для ротовой ингаляции составляет 50мМ Трис и ЮмМ MgCI2, рН 7,5 Связанную с соответственно приблизительно от 10 до мембранами радиоактивность отделили от сво500мг/индивид Активный ингредиент может ввободного лиганда фильтрацией через фильтродиться от 1 до 6 раз в день, что достаточно для вальную бумагу whatman GF/C и промыванием проявления желаемой активности фильтра 5 раз по Змл охлажденного буфера, исПри введении соединений данного изобретепользуя устройстве для сбора клеток Brandel'a ния в соответствии с данными изобретением, исФильтры просчитаны в гамма счетчике с эффекключаются нежелательные токсикологические тивностью 75%, IC5o's для соединений данного эффекты изобретения находиться в пределах от 0,1 нм до 50мкм Биологическая активность соединений формулы (1) демонстрируется следующими испыта2 Активность гладкой мускулатуры сосудов in ниями vivo 1 Тест связывания Аорту крысы очистили от соединительной ткаА) Приготовление мембран ни и прилипшего жира и разрезали на кольцевые Крысиный мозжечок или кортикальный слой сегменты приблизительно от 3 до 4мм длиной почек быстро извлекли и немедленно заморажиСосудистые кольца суспендировали в камерах вали в жидком азоте или использовали свежими для инкубации органов (10мл) содержащих бикарТкани, 1 - 2г для мозжечка или 3 - 5г для кортибонатный раствор Кребса следующего состава (в кального слоя почек, гомогенизировали в 15мл миллимолях) NaCI, 112,0, KCI, 4,7, КН2РО4, 1,2, буфера содержащего 20мМ трис HCI и 5мМ ЭДТА, MgSO4, 1,2, CaCI2, 2,5, N2HCO3, 25,0, и декстрозы, рН 7,5 при 4°С используя механический гомогени11,0 Инкубационные растворы поддерживали при затор Гомогенаты отфильтровали через марлю и 37°С и непрерывно аэрировали смесью 95% О2 и центрифугировали при 20,000 (об/мин) Юмин при 5% СО2 Остаточное напряжение аорты поддер4°С Супернатант удалили и центрифугировали живали при 1 г и дали уравновеситься в течение 2 ври 40,000 Хд ЗОмин при 4°С Полученный в речасов, в течение которых инкубационных раствор зультате осадок ресуспендировали в небольшом заменяли каждые 1 5 - 2 0 минут Изометрические объеме буфера содержащего 50мМ Трис, ЮмМ напряжения записывали на динографах ВескМдСЬ, рН 7,5, разделили на аликвоты в маленьких man'a R-611 с преобразователем силы Grass'a сосудах и заморозили в жидком азоте Препарат FT03 Кумулятивные кривые концентрация-ответ мембран разбавили так, чтобы на каждую пробирна ЕТ-1 или других стимуляторов сокращения поку количество белка в анализе связывания состастроили методом постепенного пошагового привило 1 и 8мг для мозжечка и кортикального слоя бавления стимулятора Концентрации ЕТ-1 увелипочек чивали только после того как предыдущая концентрация давала в ответ устойчивое сокраСвежевыделенные мезентериальная артерия щение На каждом кусочке ткани получали только и коллатеральное сосудистое ложе крысы промыодну кривую концентрация-ответ на ЕТ-1 Антаголи ледяным физиологическим раствором и удалинисты рецепторов ЕТ добавлялись к парным обли лимфатические узлы вдоль главного сосуда разцам ткани за 30 минут до начала определения Затем, ткань гомогенизировали используя политконцентрационных кривых ответа на стимуляторы рон в буфере содержащем 20мМ Трис и 5мМ ЭДсокращения ТА, рН 7,5 при 4°С в 15мл объеме для ~ 6gm мезентериального ложа артерии Гомогенат Индуцируемые ЕТ-1 сокращения сосудов выпропустили через марлю и центрифугировали при ражают как процент ответа на бОмМ KCI для каж2,000 Хд Юмин при 4°С Супернатант удалили и дой индивидуальной ткани, который определяют в центрифугировали при 40,000 Хд ЗОмин при 4°С начале каждого эксперимента Данные выражают Полученный осадок ресуспендировали как объяскак среднее ± стандартная ошибка среднего нено выше для мозжечка и кортикального слоя (S Е М ) Константы диссоциации (Кв) конкурентпочки В экспериментах по связыванию использоных антагонистов определили стандартный метовали приблизительно 10мг мембранного белка дом Arunlakshana и Schild'a Действующий диападля каждой пробирки зон для соединений данного изобретения 17 44686 18 находится в пределах от 0,1 нМ до 50мкм ( (8,5г, 14,3ммоля) в ЕЮН (70мл) добавили 5Н NaOH (9мл, 46ммолей) Полученную смесь переСледующие примеры являются иллюстративмешивали в атмосфере аргона 1 день, добавив за ными и не ограничивают соединения данного изоэто время НгО (70мл) Смесь сконцентрировали бретения при пониженном давлении Водный остаток экстПример 1 рагировали Et20 и Et20 экстракты отбросили (1RS, 2RS, 3SRJ-1 -(4-Метоксифенил)Водную фазу подкислили 6М HCI и экстрагировафенилиндан-2-карбоновая кислота ли несколько раз ЕЮАс Объединенные ЕЮАс a) Этил(1 RS)-[1 -Гидрокси-1 -(4экстракты промыли последовательно водой и наметоксифенил)]-3-фенилинден-2-карбоксилат сыщенным водным NaCI и высушили РаствориК сухой магниевой стружке (0,88г, Збммоль) в тель удалили при пониженном давлении для поатмосфере аргона добавили порциями раствор плучения маслянистого остатка броманизола (4,5мл, Збммолей) в 5% ТГФ/ЕігО кристаллизовавшегося при стоянии Твердый про(37мл) Полученный раствор п-метоксифенил магдукт перекристаллизовывался из ЕЮАс/гексан, ний бромида добавили к раствору этил 1-оксо-Зполучив названное в заглавии соединение (4,25г, фенил-инден-2-карбоксилата (5,0г, 18ммолей) в 83%), Т пл 164-166°С Et20 (300мл) в атмосфере аргона при 0°С Полу1 ченной смеси дали нагреться до комнатной темЗдесь и далее в спектре НМР ( Н-ЯМР) пературы и перемешивали Юмин Смесь распреm - мультиплет, делялась между ЗМ HCI (100мл) Е ОАс (200мл) d - дуплет, Органический экстракт последовательно промыли s - син глет, водой, водным NaHCO3, H2O и насыщенным водt -триплет, ным NaCI и высушили (МагЄСч) Растворитель dd - двойной дуплет, удалили при пониженной давлении для получения br - уширенный, желтого масла, которое обработали ЕігО/гексан apparent - кажущийся, Образовавшийся твердый продукт собрали путем sextet - секстет, фильтрации (3,47г) Фильтрат сконцентрировали dt - двойной триплет, при пониженном давлении и очистили мгновенной В данных элемент, анализа хроматографией Материал, который был изолиCalc - рассчитано, рован, обработали ЕігО/гексан, и образовавшийся Found - найдено дополнительный твердый продукт (1,76г, 75% обВ данных масс спектрометрия щего выхода) собрали путем фильтрации с целью (exact mass) -точная масса получения названного в заглавии соединения *Н ЯМР (CDCI3) 5 7,35 - 7,18 (m, 9H), 6,92 b) Этил (RSJ-1 -(4-Метоксифенил)-36,88 (m, 4Н), 4,68 (d, 1Н, J = 10Hz), 4,64 (d, 1H, J = фенилинден-2-карбоксилат 10Hz), 3,81 (s, 3H), 3,34 (t, 1H, J = 10Hz) К раствору этил (1RS) [1 -гидрокси-1 -(4M 345 [(M + H)+] метоксифенил)]-3-фенилинден-2 карбоксилата Anal Calc C23H20O3 C, 80,21, H, 5,85, C, 80,21, (4,65г, 12,0ммоля) в СН2СІ2 (40мл) при 0°С в атмоH6.03 сфере аргона добавили триэтилсилан (2,34мл), Пример 2 (14,6ммоля), и впоследствии - бор трифторид (транс, транс)-1,3,-Ди(4-метоксифенил)-инданэферат (8,8мл, 71ммоль) Реакционной смеси да2-карбоновая кислота ли нагреться до комнатной температуры и переа) Этил 2-Бензоил-3-(4мешивали Юмин, медленно добавив за это время гидроксифенил)пропеонат ЗМ НСІ (50мл) Смесь экстрагировали ЕЮАс К раствору 4-гидроксибензадьдегида (31,7г, (150мл) Органический экстракт последовательно 0,26ммолей) и этил бензои л ацетата (45,5мл, промыли водой, водным N2HCO3, НгО и насижен0,26ммоля) в ЕЮН (45мл), в атмосфере аргона ным водным NaCI и высушили Растворитель удадобавили пиперидин (2,6мл, 0,026ммоля) и уксуслили при пониженном давлении, и остаток очиную кислоту (3 капли) После перемешивания в стили мгновенной хроматографией на силикагеле, течение ночи при комнатной температура, полуэлюируя 10% ЕЮАс/гексан для получения названченную твердую смесь обрабатывали горячим ного в заглавии соединения (4,2г, 95%) в виде ЕЮН (700мл), и затем дали охладиться Образосмеси Д1 и Д2 изомеров двойной связи вавшиеся кристаллы собрали фильтрацией, получив названное в заглавии соединение (81,Ог, 79%) c) Этил (1RS, 2SR, ЗSR)-1-(4-Meтoкcифeнил)З-фенилиндан-2-карбоксилат (Ь) Этил (2RS, ЗSR)-3-(4-Гидpoкcифeнил)-1оксоиндан-2-карбоксилат К раствору этил ^3)-1-(4-метоксифенил)-3фенилинден-2-карбоксилата (5,75г, 18ммолей) в К смеси этил 2-бензоил-3-(4ЕЮАс (150мл) добавили 8% палладий на активигидроксифенил)пропеоната (0,50г, 1,7ммоля) в рованном углероде (600мг) Полученную суспенCH2CI2 (15мл) при 0°С в атмосфере аргона добазию перемешивали в атмосфере ЬЬ 1 день, затем вили титан тетрахлорид (0,93мл, 8,3ммоля) Полупрофильтровывали через слой Целита Фильтрат ченной смеси дали перемешаться в течение ночи сконцентрировали при пониженном давлении, что при комнатной температуре Реакцию медленно дало названное в заглавии соединение, которое прекратили добавлением ЗМ охлажденной HCI, использовали без дополнительной очистки затем реакционную смесь распределили между ЕЮАс (50мл) и ЗМ HCI Водную фазу экстрагироd) (1RS, 2RS, 3^)-1-(4-Метоксифенил)вали ЕЮАс, и объединенные органические эксфенилиндан-2-карбоновая кислота тракты промыли последовательно НгО и насыК раствору этил (1RS, 2SR, 3SR)-1-(4щенным водным NaCI, и высушили метоксифенил)-3-фенилиндан-2-карбоксилата, 20 19 44686 Растворитель удалили при пониженном давлении, атмосфере аргона добавили триэтилсилан и твердый остаток перекристаллизовали из (0,48мл, З.Оммоля), и впоследствии бор трифтоЕЮАс/гексан для получения названного в загларид эферат (1,8мл, 14,6ммоля) Реакционной смевии соединения (410мг, 82%) си дали нагреться до комнатной температуры и перемешивали Юмин, добавляя медленно за это c) Этил (2RS, 3SR)-3-(4-Tвремя ЗМ HCI Смесь экстрагировали ЕЮАс ОрБутилдиметилсилоксифенил)-1-оксоиндан-2ганический экстракт промыли последовательно карбоксилат НгО, водным ЫаНСОз, НгО и насыщенным водным К раствору этил (2RS, 3SR)-3-(4NaCI и вылили Растворитель удалили при понигидроксифенил)-1-оксо-индан-2-карбоксилата женном давлении, и остаток очистили мгновенной (3,0г, 10,2ммоля) в ДМФ (10мл) в атмосфере аргохроматографией на силикагеле, элюируя 15% на добавили имидазол (1,72г, 25,3ммоля) и тЕігО/гексан с целью получения названного в забутилдиметилхлоро-силан (1,82г, 12,1ммоля) Поглавии соединения в виде смеси Д1и Д2 изомеров лученной смеси дали перемешиваться 3 дня при двойной связи (820мг, 67% для двух ступеней) комнатной температуре, затем вылили а разбавленную водную HCI и экстрагировали ЕЮАс (2х) д) Этил (1RS, 2SR, 3SR)-1-(4-TОбъединенные органические экстракты промыли Бутилдиметилсилоксифенил)-3-(4последовательно Ь^О, водным ЫаНСОз, ЬЬО и метоксифенил)индан-2-карбоксилат насыщенным видным NaCI и высушили РаствоК раствору этил (RS)-3-(4-Tритель удалили при пониженном давлении для бутилдиметилсилоксифенил)-1 -(4получения названного в заглавии соединения метоксифенил)инден-2-карбоксилата (смесь Д1 и (5,40г), которое использовали без дальнейшей Д2 изомеров двойной связи) (780мг, 1,5ммоля) в очистки ЕЮН (25мл) добавили 5% палладий на активированном углероде (70мг) Подученную суспензию d) Этил 3-(4-т-Бутилдиметилсилоксифенил)-1перемешивали в атмосфере ЬЬ 18 часов, затем оксоинден-2-карбоксилат профильтровывали через слой Целита Фильтрат К раствору этил (2RS, 3SR)-3-(4-Tсконцентрировали при пониженном давлении с бутиллдиметилсилоксифенил)-1-окссиндан-2целью получения названного в заглавии соединекарбоксилата (130мг, 0,32ммоля) в CH2CI2 (Змл) в ния (730мг, 97%, которое использовали без доатмосфере аргона добавили 2,3-дихлоро-5,6полнительной очистки дициано-1,4-бензохинон (80мг, 0,35ммоля) Полученную смесь перемешивали 2,5 часа Добавили п) Этил (1RS, 2RS, ЗSR)-1-(4-Гдиpoкcифeнил водный ЫаНСОз и ЕЮАс, и смесь перемешивали метоксифенил)индан-2-карбоксилат 5мин Водную фазу отдалили и экстрагировали К раствору этил (1RS, 2SR, 3SR)-1-(4-TЕЮАс, и объединенные органические экстракты бутилдиметилсилоксифенил)-(4промыли последовательно водным ЫаНСОз, ЬЬО метоксифенил)индан-2-карбоксилата (723мг, и насыщенный водным NaCI и высушили Раство1,4ммоля) в ЕЮН (20мл) добавили 1М NaOH ритель удалили при пониженном давлении и оста(1,6мл, 1,6ммоля), и полученную смесь переметок очистили мгновенной хроматографией на сишивали при комнатной температуре ЗОмин Смесь ликагеле с целью получения названного в распределили между ЗМ HCI и ЕЮАс Водную заглавии соединения (110мг, 85%) фазу экстрагировали ЕЮАс и объединенные орe) Этил (1 RS)-3-(4-Tганические экстракты промывали последовательБутилдиметилсилоксифенил)-1 -гидрокси-1 -(4но НгО и насыщенным водным NaCI и высушили метоксифенил)инден-2-карбоксилат Растворитель удалили при пониженном давлении с целью получения названного в заглавии соедиК сухой магниевой стружке (119мг, 4,9ммоля) нения (654мг, 100%) в атмосфере аргона, порциями, добавили раствор п-бромоанизола (0,61мл, 4,9 ммоля) в 9 1 Et20 і) Этил (цис, цис)-1,3-Ди(4ТГФ (10мл) Полученный раствор п-метоксифенил метоксифенил)индан-2-карбоксилат магний бромида добавили к раствору этил 3-(4-тК раствору этил (1RS, 2RS, 3SR)-1-(4бутилдиметилсилоксифенил)-1-оксоинден-2гидроксифенил)-3-(4-метоксифенил)индан-2 каткарбоксилата (1,00г, 2,6ммоля) в Et20 (60мл) в боксилата (270мг, 0,7ммоля) в ацетонитриле (5мл) атмосфере аргона при 0°С Полученной смеси дапри 0°С добавили 1,8 -диазабицикло /5 4 0/ ундекли нагреться до комнатной температуры и пере7-ена (0,25мл, 1,7ммоля), и впоследствии метил мешали в течение бмин Смесь распределили иодид (0,5мл, 8,0ммоля) Полученной смеси дали между ЗМ HCI и ЕЮАс Органический экстракт нагреться до комнатной температуры и перемепромыли последовательно Ь^О водным ЫаНСОз, шивали всю ночь Смесь распределили между НгО и насиженным водным NaCI и высушили ЕЮАс и разбавленной водной HCI Органический Растворитель удалили ври пониженном давлении экстракт промыли насыщенным водный NaCI и с целью получения указанного в заглавии соедивысушили Растворитель удалили при пониженнения (1,47г), которое использовали без дальнейном давлении, и остаток очистили мгновенной шей очистки хроматографией для получения названного в заглавии соединения (40мг, 32% относительно выf) Этил (RS)-1-(4-Tделенного исходного материала) Бутилдиметилсилоксифенил)-3(4метоксифенил)инден-2-карбоксилат j) (транс, транс)-1,3-Ди(4К раствору этил (1 RS)-3-(4-Tметоксифенил)инден-2-карбоновая кислота бутилдиметилсилоксифенил)-1 -гидрокси-1 -(4К раствору этил (цис, цис)-1,3-ди(4метоксифенил)инден-2-карбоксилата (2,5ммоля, метоксифенил)-индан-2-карбоксилата (35мг, приготовленного выше) в CH2CI2 (10мл) при 0°С в 0,09ммоля) в ЕЮН (Змл) добавили 1М NaOH 22 21 44686 (0,25мл, 0,25ммоля), и полученной смеси дали (50мл) и к этому раствору добавили раствор диперемешиваться при комнатной температуре всю этил магний малоната приготовленный по методиночь Тонкослойный хроматографический анализ ке Walker and Houser, TACS 68, 1386 (1946) исна это время показал, что реакция завершилась, пользованием (0,8г, ЗЗ.Зммоля) и диэтил после чего добавили 5М NaOH (0,15мл, малоната (4,9г, ЗО.бммоля) в Et20 Полученную 0,75ммоля), и смесь оставили стоять 5 дней при смесь нагревали до кипения с обратным холо0°С Добавили воду и смесь сконцентрировали дильником 1 ч, затем дали охладиться и вылили в при пониженной давлении Важный остаток экстохлажденную льдом 10% водную H2SO4 (100мл) рагировали Et2O (2x), и отбросили эфирные эксВодную фазу экстрагировали Et20, и объединентракты Водную фазу подкислили 6М HCI и экстраный органический продукт промыли насыщенным гировали несколько раз ЕЮАс Объединенные водным NaCI и высушили Растворитель удалили ЕЮАс экстракты промыли последовательно Н2О и при пониженной давлении с целью получения нанасыщенным водным NaCI высушили Растворизванного в заглавии соединения в виде органичетель удалили при пониженном давлении получив ского масла, которое использовали без дальнеймаслянистый остаток, который кристаллизовался шей очистки при стоянии Твердый продукт перекристаллизоc) Этил 3-(3,4-Метилендиоксифенил)-1вали из ЕЮАс/гексан для получения названного в оксоинден-2-карбоксилат заглавии соединения (19мг, 59%), Т пл 192 Раствор содержащий диэтил 2-[2-(3,4193°С метилендиоксибензоил) бензоилмалонат (неочи1 щенное вещество приготовленное выше) в 5% Н-НМР (ацетон - de) 5 7,25 (dd, 4H, J = 6,6Hz, водном Na2CO3 (100мл) нагревали до кипения с 2,1 Hz), 7,21 - 7,18 (m, 2H), 6,92 (dd, 4H, J = 6,6Hz, обратным холодильником Юмин Реакционной 2,1 Hz), 6,86 - 6,83 (m, 2H), 4,69 (d, 2H, J = 10Hz), смеси дали затем охладиться, и водную часть 3,79 (s, 6H), 3,26 (t, 1H, J = 10Hz) MS 392 [(M + удалили декантацией Остаток поместили в НгО NH4)+] (50мл), и смесь нагрели до кипения, охладили и Anal Calc, C24H22O4, C, 76,99, H, 5,92, C, 76,74, сконцентрировали при пониженном давлении ОсH6.15, таток перекристаллизовали из гексана для полуПример 3 чения названного в заглавии соединения в виде (1RS, 2SR, 3SR)-1 -(4-Метоксифенил)-3-(3,4желтого твердого продукта (5,6г, 100% для двух метилендиоксифенил)индан-2-карбоновая кислота стадий) a) 2-(3,4-Метилендиоксибензоил) бензойная d) Этил (ШЗ)-1-Гидрокси-1-(4-метоксифенил)кислота 3-(3,4-метилендиоксифенил)инден-2-карбоксилат К раствору 2-бромбензойной кислоты (12г, Раствор 4-броманизола (0,89г, 5,0ммоля) в 9 1 О.Обмоля) в ТГФ (200мл) при -100°С в атмосфере Е1:2ОЛТФ (10мл) добавили к магниевой стружке аргона добавили по каплям н-бутиллитий (50мл (0,105г, 5,0ммоля), и полученной смеси дали пе2,5М раствора в гексане, 0,125моля), поддерживая ремешаться ЗОмин Полученный 4-метоксифенил температуру ниже -90°С По завершении добавмагний бромид добавили по каплям к раствору ления, полученный раствор перемешивали 1 час этил 3-(3,4-метилендиоксифенил)-1-оксоинден-2при -100°С, медленно добавив за это время раскарбоксилата (0,77г, 2,4ммоля) в 101 Е1:2ОЛТФ твор хлорангидрида пиперониловой кислоты (11 г, (85мл) при 0°С Полученную смесь перемешивали О.Обммоля) в ТГФ (50мл), поддерживая темперапри 0°С 1ч и затем распределили между ЕЮАс и туру ниже -90°С Полученной смеси дали нагреть1М НСІ Водную фазу экстрагировали ЕЮАс, и ся до -80°С и перемешивали 1 час, затем дали объединенные органические экстракты промыли медленно нагреться до комнатной температуры, и последовательно 5% водным NaHCO3 и насыщеноставили стоять на 48 часов Реакционную смесь ным водным NaCI и высушили (MgSO4) Растворисконцентрировали при пониженном давлении, и тель удалили при пониженном давлении, и остаостаток распределили между Et2O и 1М HCI Орток очистили мгновенной хроматографией на ганическую фазу экстрагировали 10% водным силикагеле, элюируя 10% ЕЮАс/гексан для полуNaOH NaOH - экстракт подкислили концентрирочения названного в заглавии соединения в виде ванной HCI, и объединенный водный продукт эксжелтого стеклообразного твердого продукта трагировали Et20 Et20 - экстракм высушили (0,80г, 80%) (MgSO4) и сконцентрировали при пониженном давлении Остаток очистили мгновенной хроматоe) Этил (RS)-1 -(4-метоксифенил)-3-(3,4графией на силикагеле, элюируя с градиентом Метилендиоксифенил) инден-2-карбоксилат растворителя 10 - 30% ЕЮАс/0,1% НОАс/гексан К раствору этил (ШЗ)-1-(4-метоксифенил)-3для получения названного в заглавии соединения (3,4-метилендиоксифенил)-инден-2-карбоксилата в виде не совсем белого твердого продукта (4,5г, (0,80г, 1,9ммоля) в СН 2 СІ 2 (10мл) при 0°С в атмо28%) сфере аргона добавили триэтилсилан (0,23г, 2,4ммоля) и впоследствии бор трифторид эферат b) Диэтил 2-[2-(3,4(1мл, 8,1ммоля) Полученный раствор перемешиМетилендиоксибензоил)бензоил-малонат вали при 0°С Юмин, и затем распределили между Раствор 2-(3,4ЕЮАс и ЗМ HCI Органический экстракт пробили метилендиоксибензоил)бензойной кислоты (4,0г, насыщенным водным NaCI и высушили (MgSO4) 14,8ммоля) втионил хлориде (30мл) нагревали до Растворитель удалили при пониженном давлении кипения с обратный холодильником в течение 2ч, и остаток профильтровали через слой силикагеля,затем дали охладиться и сконцентрировали при элюируя CH2CI2 Названное в заглавии соединепониженном давлении Остаток растворили в Et20 ние (см Д1 и Д2 изомеров двойной связи) получи 24 23 44686 ли в виде стеклообразного, желтого твердого веРастворитель удалили при пониженном давлении щества (0,72г, 94%) для получения названного в заглавии соединения (40мг, 90%) в виде смеси Д1 и Д2 изомеров двойf) Этил (1RS, 2RS, ЗЗР)-1-(4-Метоксифенил)ной связи 3-(3,4-метилендиоксифенил)-инден-2-карбоксилат К раствору этил (РЗ)-1-(4-метоксифенил)-3c) Этил (1RS, 2RS, ЗSR)-1-(4-фтopoфeнил)-3(3,4-метилен-диоксифенил)-инден-2-карбоксилата (3,4-метилендиоксифенил)индан-2-карбоксилат (0,72г, 1,7ммоля) в ЕЮН (30мл) добавили 10% К раствору этил ^3)-1-(4-фторофенил)-3-(3,4палладий на активированной углероде (1г) Полуметилендиоксифенил)инден-2-карбоксилата ченную суспензию перемешивали в атмосфере ЬЬ (40мг, О.Юммолей) в ЕЮН (Змл) добавили 10% 56ч и отфильтровывали Фильтрат сконцентриропалладий на активированном углероде (45мг) вали при пониженном давлении для получения Полученную суспензию перемешивали в атмоназванного в заглавии соединения в виде желтого сфере Нг в течение ночи, затем профильтровали твердого вещества (0,70г, 95%), которое испольчерез слой Целита Фильтрат сконцентрировали зовали без дальнейшей очистки при пониженном давлении с целью получения названного в заглавии соединения (40мг, 100%), g) (1RS, 2SR, ЗЗР)-1-(4-метоксифенил-3-(3,4которое использовали без дальнейшей очистки метилен-диоксифенил)-индан-2-карбоновая кислота d) (1RS, 2SR, ЗSR)-1-(4-фтopoфeнил)-3-(3,4К раствору этил (1RS, 2RS, 3SR)-1-(4метилендиоксифенил)индан-2-карбоновая кислота метоксифенил)-3-(3,4К раствору этил (1RS, 2RS, 3SR)-1-(4метилендиоксифенил)индан-2 карбоксилата фторофенил)-3-(3,4-метилендиоксифенил)индан(0,1 Ог, 0,2ммоля) в ЕЮН (5мл) добавили раствор 2-карбоксилата (60мг, 0,15ммоля) в ЕЮН (0,5мл) гидроокиси натрия (0,1 Ог, 2,5ммоля) в Ь^О (Змл) добавили 6М КОН (0,14мл, 0,84ммоля) ПолученПолученную смесь перемешивали при комнатной ной смеси дали перемешаться при комнатной температуре в течение ночи Смесь подкислили и температуре в течение ночи, затем сконцентрирообразовавшийся твердый продукт собрали фильтвали при пониженном давлении Остаток распрерацией и высушили при пониженном давлении делили между НгО и Et20 Водную фазу подкисдля получения названного в заглавии соединения лили ЗМ HCI и экстрагировали несколько раз в виде рыжевато-коричневого твердого вещества ЕЮАс Объединенные ЕЮАс экстракты промыли (0,04г, 86%) последовательно НгО и насыщенный водным 1 NaCI и высушили (MgSO4) Растворитель удалили Н НМР (CDCI3) 5 7,25 (m, 5H), 6,90 (m, 4H), при пониженном давлении с целью получения 6,77 (d, 2H, J = 7Hz), 5,95 (m, 2H), 4,61 (d, 2H, J = масла, которое кристаллизовали из ЕЮАс/гексан 10Hz), 3,81 (s, 3H), 3,25 (t, 2H, J = 10Hz) MS 387 Названное в заглавии соединение получили в ви[(M - H)+] де почти белого кристаллического твердого вещеAnal Calc C24H20O5 1/8 H2O C, 73,79, H, 5,22, ства (82мг, 39%), Т пл 146 - 149°С C, 76,73, H 5,21 1 Пример 4 Н НМР (CDCI3) 5 7,23 (m, 4H), 6,96 (m, 1H), (1RS, 2SR, 3SRJ-1 -(4фторофенил)-3-(3,46,90 (m, 1Н), 6,79 (2Н), 6,75 (s, 1H), 5,96 (m, 2H), метилендиоксифенил)индан-2-карбоновая кислота 4,62 (apparent br t 2Н, J = 10Hz), 3,25 (t, 1H, J = a) Этил (ШЗ)-1-(4фторофенил)-1-гидрокси-310Hz) (3,4-метилендиоксифенил)инден-2-карбоксилат MSm/e(rel int) 753 [(2M + 1)+, 3] К раствору этил 3-(3,4-метилендиоксифенил)Anal Calcd C23H17PO4 C, 73,40, H, 4,55 1-оксоинден-2-карбоксилата (100мг, 0,31ммоля) в Found C, 73,19, H, 4,45 ТГФ (6мл) в атмосфере аргона при 0°С добавили Пример 5 раствор свежеприготовленного 4-фторофенил (1 Rs, 2SR, 3SRJ-1 -(3-Метоксифенил)-3-(3,4магний бромида (0,62ммоля) После перемешиваметилендиоксифенил)индан-2-карбоновая кислота ний в течение 45мин смесь распределили между а) Этил (ШЗ)-1-Гидрокси-1-(3-метоксифенил)ЗМ HCI и ЕЮАс Органический экстракт последо3-(3,4-метилендиоксифенил)инден-2-карбоксилат вательно промыли НгО, 5% водным ЫаНСОз и К раствору этил 3-(3,4-метилендиоксифенил)насыщенным водным NaCI Растворитель удали1-окосинден-2-карбоксилата (100мг, 0,31ммоля) в ли при пониженном давлении, и остаток очистили ТГФ (2мл) в атмосфере аргона при 0°С добавили мгновенной хроматографией, элюируя 15% раствор свежеприготовленного 3-метоксифенил ЕЮАс/гексан с целью получения названного в магний бромида (0,31ммоля) После перемешивазаглавии соединения (45мг, 35%) ния в течение 15мин дополнительно добавили 3метоксифенил магний бромид (О.Обммоля) Переb) Этил (RSJ-1 -(4-фторофенил)-3-(3,4мешивание продолжали 45мин, к этому времени метилендиоксифенил)инден-2-карбоксилат анализ тонкослойной хроматографией показал, К раствору этил (1 RS)-1 -(4-фторфенил)-1 что реакция завершена Дополнительно добавили гидрокси-3-(3,4-метилендиоксифенил)инден-23-метоксифенил магний бромид (0,12ммоля) Покарбоксилата (45мг, 0,11ммоля) в CH2CI2 (Змл) сле перемешивания в течение еще 2ч, смесь распри 0°С добавили триэтилсилан (38мкл, пределили между ЗМ HCI и ЕЮАс Органический 0,24ммоля), и впоследствии бор трифторид эфеэкстракт последовательно промыли НгО, 8% водрат (121мкл, 0,38ммоля) Реакционной смеси дали ный NaHCO3, H2O и насыщенным водный NaCI нагреться до комнатной температуры и перемаРастворитель удалили при пониженном давлении, щивали 15мин, медленно добавляя за это время и остаток очистили мгновенной хроматографией, ЗМ HCI Смесь экстрагировали ЕЮАс Органичеэлюируя 15% ЕЮАс/гексан с целью получения ский экстракт промыли последовательно Ь^О, 8% названного в заглавии соединения (150мг, 100%) водным ЫаНСОз и насыщенным водным NaCI 25 44686 26 b) Этил (1 RS)-1 -(3-Метоксифенил)-3-(3,4ТГФ (4мл) Полученный 3,4метилендиоксифенил)инден-2-карбоксилат метилендиоксифенилмагний бромид добавили к раствору этил 3-(3,4-метилендиоксифенил)-1К раствору этил (1 RS)-1 -гикрокси-1 -(3оксоинден-2-карбоксилата (0,60г, 2ммоля) в 1 4 метоксифенил)-3-(3,4-метилендиоксифенил)ТГФ/ЕігО (25мл) в атмосфере аргона при 0°С Поинден-2-карбоксилата (150мг, 0,35ммоля) в CH2CI2 лученную смесь перемешивали при 0°С 15мин, за добавили триэтилсилан (67мкл, 0,42ммоля) и впоэто время добавили 1М НСІ (50мл) Фазы раздеследствии бор трифторид эферат (213мкл, лили и водную фазу экстрагировали Et20 Объе1,73ммоля) Реакционной смеси дали перемешидиненные органические экстракты промыли наваться в течение ЗОмин медленно добавив за это сыщенным водным NaCI и высушили (MgSO4) время 5% водную HCI Смесь экстрагировали Растворитель удалили при пониженном давлении ЕЮАс Органический экстракт промыли последои остаток очистили мгновенной хроматографией, вательно ЬЬО, 5% водным ЫаНСОз, ЬЬО и насыэлюируя 10% ЕЮАс/гексан с целью получения щенным водным NaCI и высушили (MgSO4) Расназванного в заглавии соединения в виде желтого творитель удалили в вакууме, и остаток очистили твердого продукта (0,29г, 42%) мгновенной хроматографией, элюируя 10% ЕЮАс/гексан с целью получения названного в b) Этил (RS)-1-1,3-fln-(3,4заглавии соединения (45мг, 31%) в жиде смеси Д1 метилендиоксифенил)инден-2-карбоксилат и Д2 изомеров двойной связи К раствору этил (1RS)-1,3-flH-(3,4c) Этил (1RS, 2RS, ЗSR)-1-(3-Meтoкcифeнил)метилендиоксифенил)-1-гидроксиинден-23-(3,4-метилендиоксифенил) индан-2-карбоксилат карбоксилата (0,29г, 0,65ммоля) в СН2СІ2 (Змл) при 0°С в атмосфере аргона добавили триэтилсиК раствору этил ^3)-1-(3-метоксифенил)-3лан (91мг, 0,78ммоля), и впоследствии бор триф(3,4-метилендиоксифенил)инден-2-карбоксилата торид эферат (0,3мл, 2,4ммоля) Реакционную (45мг, 0,11ммоля) в ЕЮН (Змл) добавили 10% смесь перемешивали Юмин, за это время добапалладий на активированном углероде (45мг) вили охлажденную льдом 1М HCI, и смесь экстраПолученную суспензию встряхивали на гидрогенигировали ЕЮАс Органический экстракт промыли заторе Парра при 50psi (10,546кг/см2) ЬІ2 в течение насыщенным водным NaCI и высушили (MgSO4) ночи, затем профильтровывали через слой ЦелиРастворитель удалили при пониженном давлении, та Фильтрат концентрировали при пониженном осадок поместили на небольшой слой силикагеля, давлении с целью получения названного в заглаэлюируя CH2CI2 для получения названного в завии соединения (43мг, 94%), которое использоваглавий соединения (257мг, 92%) ли без дальнейшей очистки d) (1RS, 2SR, 3SR)-1-(3-MeTOK^eHHn)-3-(3,4c) Этил (1RS, 3RS)-1,3-fln-(3,4метилендиоксифенил)индан-2-карбоновая кислота метилендиоксифенил индан-2-карбоксилат К раствору этил (1Р, 2Р, ЗР)-1-(3Этил (RS)-1,3-flH-(3,4метоксифенил)-3-(3,4метилендиоксифенил)инден-2-кар-боксилат метилендиоксифенил)индан-2-карбоксилата (163мг, 0,38ммоля) поместили в МеОН (0,05мл), и (43мг, О.Юммоля) в ЕЮН (1мл) добавили 6М КОН к этой смеси добавили Smb (10мл 0,1М раствора (0,10мл, О.бОммоля) Полученной смеси дали пев ТГФ, 1,0ммоля) Полученную смесь перемеширемешиваться при комнатной температуре в тевали в атмосфере аргона в течение ночи, к этому чение ночи, затем распределили между НгО и времени анализ тонкослойной хроматографией Et20 Водную фазу подкислили ЗМ HCI и экстрагипоказал, что реакция завершилась Добавили доровали несколько раз ЕЮАс Объединенные полнительное количество Smb (5мл 0,1 М раствоЕЮАс экстракты промыли последовательно НгО и ра в ТГФ, 0,5ммоля), и перемешивание продолжанасыщенным водным NaCI и высушили (MgSO4) ли в течение 2ч Реакционную смесь Растворитель удалили при пониженном давлении распределили между Et20 5% водным Na2S2O3 для получения масла, которое кристаллизовали из Органический экстракт промыли насиженным водЕігО/гексан Названное соединение получено в ным NaCI и высушили (MgSO4) Растворитель виде твердого продукта с Т пл 131-133°С удалили при пониженном давлении, и остаток 1 очистили мгновенной хроматографией, элюируя Н NMP (CDCI3) 5 7,21 (m, ЗН), 6,97 - 6,73 (m, 10% ЕЮАс/гекоан с целью получения названного 8Н), 5,95 (m, 2H), 4,61 (apparent br t 2H, J = 9Hz), в заглавии соединения в виде бесцветного, стек3,67 (s, 3H), 3,30 (t, 1H, J = 9Hz) лообразного твердого вещества (120мг, 75%) + MSm/e(rel mt) 777/(2M + 1) , 65/ d) (1RS, 3RS)-1,3-fln-(3,4Anal calcd C24H20O5 C, 74,21, H, 5,19, метилендиоксифенил)индан-2-карбоновая кислота Found С 74,71, H, 5,47 К раствору этил (1RS, 3RS)-1,3-flH-(3,4Пример 6 метилендиоксифенил)индан-2-карбоксилата (1RS, 3RS)-1,3-Ди-(3,4-метилендиоксифенил)(75мг, 0,17ммоля) в ЕЮН (20мл), добавили NaOH индан-2-карбоновая кислота (0,10г, 2,6ммоля) Полученной смеси дали переа) Этил (1RS)-1,3-flH-(3,4мешиваться при комнатной температуре 3 дня, к метилендиоксифенил)-1-гидроксиинден-2этому времени тонкослойная хроматография покарбоноилат казала, что реакции завершилась Смесь нагреваК сухой магниевой стружке (0,25г, Юммолей) в ли затем до кипения с обратным холодильником в атмосфере аргона добавили раствор 4-броно-1,2течение 36ч, дали охладиться и сконцентрировали метиледиоксибензола (2,1, Юммоля) в 110 при пониженном давлении К остатку добавили Tr/Et20 (22мл) Полученному раствору дали пеконцентрированной HCI, и образовавшийся тверремешиваться при комнатной температуре в тедый продукт собрали фильтрацией и высушили чение 2ч За это время дополнительно добавили 28 27 44686 Твердый продую" растерли в порошок с кипящим в заглавии соединения (1,03г, 72%) гексаном с целью получения названного в заглаb) Этил (РЗ)-1-(3,4-Метилендиоксифенил)инден-2-карбоксилат вии соединения в виде белого твердого вещества К раствору этил (1 RS)-1 -гидрокси-1 -(3,4(50мг, 73%), Т пл 182-185°С 1 метилендиоксифенил)-3-фенилинден-2Н NMP (CDCIs), 5 7,26 (m, 2H), 7,15 (m, 1H), карбоксилата (1,03г, 2,58ммоля) в СН2СІ2 (40мл) 7,00 (m, 1H), 6,76 (s, 2H), 6,68 (m, 2H), 6,50 (dd, 1H, добавили триэтилсилан (0,49мл, 3,07ммоля) и J = 8,1 Hz), 6,40 (d, 1Н, J = 2Hz), 5,94 (s, 2H), 5,90 впоследствии бор трифторид эферат (1,55мл, (d, 1H, J = 1Hz), 5,87 (d, 1H, J = 1Hz), 4,84 (d, 1H, J 12,6ммоля) Реакционной смеси дали переме= 10Hz), 4,78 (d, 1H, J = 10Hz), 3,63 (dd, 1H, J = шаться в течение 15мин, за это время медленно 10Hz, 9Hz) + добавили ЗМ HCI Смесь экстрагировали ЕЮАс MS 402 (M) Органический экстракт промыли последовательно Anal Calcd С24Ні80б - 1/5 H2O C, 71,00, H, НгО, 5% водный ЫаНСОз и насищенным водным 4,62 NaCI Растворитель удалили при пониженном Found C, 71,13, H, 4,46 давлении для получения названного в заглавии Пример 7 соединения (1,00г, 100%) в виде смеси Д1 и Д2 (транс, транс)-1,3-Ди-(3,4изомеров двойной связи метилендиоксифенил)индан-2-карбоновая кислота c) Этил (1RS, 2SR, 3SR)-1-(3,4a) Этил (цис, цис)-1,3-Ди-(3,4Метилендиоксифенил)-3-фенилиндан-2метилендиоксифенил)-индан-2-карбоксилат карбоксилат К раствору этил (RS)-1,3-flH-(3,4К раствору этил (RS)-1-(3,4метилендиоксифенил)инден-2-карбоксилата (93мг, 0,22ммоля) в ЕЮН (2мл) добавили 10% метилендиоксифенил)-3-фенилинден-2палладий на активированном углероде (0,1 Ог) карбоксилат (1,00г, 2,60ммоля) в (25мл) добавили Полученную суспензию встряхивали на гидрогани10% палладия на активированном углероде заторе Парра при 55psi (10,898кг/см2) в атмосфе(30мг) Полученную суспензию перемешивали в ре ЬІ2 в течение 2 дней, затем профилировали атмосфере ЬІ2 в течение ночи Когда анализ тончерез слой Целита Фильтрат сконцентрировали кослойной хроматографией показал, что реакция при пониженном давлении с целью получения закончилась, добавили дополнительно 10% палназванного соединений (45мг, 48%) в виде стекладия на активированном углероде (30мг), и лообразного, желтого твердого вещества, которое смесь встряхивали на гидрогенизаторе Парра при использовали без дальнейшей очистки 30psi (2,109кг/см2) ЬІ2 в течение 2 дней К этому времени, анализ тонкослойной хроматографией b) (транс, транс)-1,3-Ди-(3,4снова показал, что реакция завершена Реакционметилендиоксифенил)-индан-2-карбоновая кислоную смесь профильтровали через слой Целита и та добавили 10% палладий на активированном углеК раствору этил (цис, цис)-1,3-ди-(3,4роде (250мг) Реакционную смесь встряхивали на метилендиоксифенил)индан-карбоксилата (45мг, гидрогенизаторе Парра при 60psi (4,218кг/см2) ЬЬ 0,1ммоля) в 2 1 ЕЮН/НгО (15мл) добавили гидров течение ночи Фильтрация и повтор последних окись натрия (50мг, 1,2ммоля) Полученному расусловий гидрирования привели к полному расхотвору дали перемешиваться при комнатной темдованию исходного материала Реакционную пература в течение ночи, затем сконцентрировали смесь профильтровали через слой Целита, и при пониженном давлении Остаток обработали фильтрат сконцентрировали при пониженном концентрированной НСІ, и полученный твердый давлении с целью получения у названного в запродукт собрали фильтрацией и высушили Тверглавии соединения (650мг, 65%), которое испольдый продукт перекристаллизовали из ЕігО/гексан зовали без дальнейшей очистки с целью получения названного в заглавии соединений, в виде твердого вещества светлоd) (1RS, 2RS, 3SR)-1-(3,4рыжевато-коричневого цвета (12мг, 30%), Т пл Метилендиоксифенил)-3-фенилиндан-2188-191 °С карбоновая кислота К раствору этил (1RS, 2SR, 3SR)-1-(3,4Пример 8 метилендиоксифенил)-3-фенилиндан-2(1RS, 2RS, ЗЗР)-1-(3,4-Метилендиоксифенил)карбоксилата (650мг, 1,68ммоля) в ЕЮН содерЗ-фенилиндан-2-карбоновая кислота жащему несколько капель ТГФ, добавили 6М КОН а) Этил (1RS)-1-l~HpoKCH-1-(3,4(1,68мл, 10,1ммоля) Полученный смеси дали пеметилендиоксифенил)-3-фенилинден-2ремешиваться при комнатной температуре в текарбоксилат чение ночи, затем сконцентрировали при пониК раствору этил 1 -оксо-З-фенилинден-2женном давлении Остаток распределили между карбоксилата (1,0г, З.бммоля) в ТГФ (35мл) в атНгО и Et20 Водную фазу подкислили ЗМ HCI и мосфере аргона при 0°С добавили к раствору экстрагировали несколько раз ЕЮАс Объединенсвежеприготовленного 3,4-метилендиоксифенил ные ЕЮАс экстракты промыли последовательно магний бромид (6,4ммоля) После перемешивания НгО и насыщенный водным NaCI и высушили в течение ЗОмин, смесь распределили между ЗМ (MgSO4) Растворитель удалили при пониженном HCI и ЕЮАс Органический экстракт промыли подавлении с целью излучения масла, которое криследовательно НгО, 5% водным насыщенным сталлизовалось из ЕЮАс/гексан Названное соводным NaCI и высушили (MgSO4) Растворитель единение получено в виде твердого вещества удалили при пониженном давлении, и остаток (305мг, 61%), Т пл 185-187°С очистили мгновенной хроматографией, элюируя 10% ЕЮАс/гексан с целью получения названного Anal Calcd C23H18O4 С, 77,08, Н, 5,06 29 44686 ЗО Found С, 76,60, H, 5,08 (Lichroprep RP-18, MeOH/H2O = 60/40) и затем пеПример 9 рекристаллизацией, Т пл 155 - 157°С (1RS, 2SR, 3SRJ-1 -(4-метоксифенил)-3-(3,4(ЕЮАс/гексан) 1 метилендиоксифенил)-2-(тетразол-5-ил)индан Н NMR (CDCI3) 5 7,28 - 7,15 (m, 4H), 7,03 a) (1RS, 2SR, 3SR)-1-(4-MeTOKCH4)eHHn)-3-(3,46,95 (m, 2H), 6,87 - 6,84 (m, 2H), 6,74 (s, ЗН), 5,94 метилендиоксифенил)индан-2-карбоксамид (d, 1H, J = 1,2Hz), 5,92 (d, 1H, J = 1,2Hz), 4,79 (d, Смеси (1RS, 2SR, 3SR)-1-(4-MeTOKC^eHHn)-31H, J = 11,6Hz), 4,73 (d, 1H, J = 11,6Hz), 3,79 (s, (3,4-метилендиоксифенил)инидан-2-карбоновой 3H), 3,65 (t, 1H, J = 11,6Hz) MS (m/e) 413,2 ((M + кислоты (250мг, 0,68ммоля) в SOCb (2,5мл) дали П) ) перемешиваться в течение ночи в атмосфере арПример 10 гона Реакционную смесь сконцентрировала при (1 RS, 2SR, 3RS)-1 -(2-метоксифенил)-3-(3,4пониженном давлении, и остаток растворили в метилендиоксифенил)индан-2-карбоновая кислота бензоле (5мл) К полученной смеси добавили в a) Этил (ШЭ)-1-Гидрокси-1-(2-метоксифенил)атмосфере аргона концентрированный ЬЦОН 3-(3,4-метилендиоксифенил)инден-2-карбоксилат (5мл) Образовавшийся твердый продукт собрали К сухой магниевой стружке (81мг, 3,4ммоля) в фильтрацией, промыли НгО и высушили при поатмосфере аргона добавили раствор 2ниженном давлении с целью получения названноброманизола (0,64г, 3,4ммоля) в 5 1 ТГФ/Е12О го в заглавии соединения (185мг, 75%) (Змл) Часть образовавшегося раствора 2b) (1RS, 2SR, 3SR)-1-(4-MeTOK^eHHn)-3-(3,4метоксифенил магний бромида (0,45мл, метилендиоксифенил)индан-2-карбонитрил 0,51 ммоля) добавили по каплям к раствору этил 3(3,4-метилендиоксифенил)-1-оксоинден-2К охлажденному льдом ДМФ (1 мл) в атмосфекарбоксилата (100мг, 0,34ммоля) в ТГФ (6мл) в ре аргона добавили оксалил хлорид (68мкл, атмосфере аргона при 0°С После перемешивания 0,78ммолей) После перемешивали в течение в течение 15мин, смесь распределили между ЗМ 5мин при 0°С, добавили раствор (1RS, 2SR, 3SR)HCI и ЕЮАс Органический экстракт промыли по1-(4-метоксифенил)-3-(3,4следовательно НгО, 5% водным NaHCO3, H2O и метилендиоксифенил)индан-2-карбоксамида насыщенным водным NaCI Растворитель удалили (150мг, 0,39ммоля) в ДМФ (2мл), и дополнительно при пониженном давлении, и остаток очистили продолжали перемешивание Юмин при 0°С Ремгновенной хроматографией, элюируя 15% акционную смесь распределили между ЕЮАс и ЕЮАс/гексан с целью получения названного в ЗМ HCI Водную фазу экстрагировали ЕЮАс, и заглавии соединения (100мг, 68%) объединенный органические экстракты промыли последовательно Ь^О, водным ЫаНСОз, ЬЬО и b) Этил (RS)-1 -(2-метоксифенил)-3-(3,4насыщенным водным NaCI и высушили Раствометилендиоксифенил)инден-2-карбоксилат ритель удалили при пониженном давлении с цеК раствору этил (1 Р)-1 -гидрокси-1 -(2лью получения названного в заглавии соединения метоксифенил)-3-(3,4в виде белого твердого вещества (135мг, 94%), метилендиоксифенил)инден-2-карбоксилата которое использовали без дальнейшей очистки (100мг, 0,23ммоля) в CH2CI2 (5мл) добавили триc) (1RS, 2SR, 3SR)-1-(4-MeTOK^eHHn)-3-(3,4этилсилан (32мг, 0,28ммоля), и впоследствии бор метилендиоксифенил)-2-(тетразол-5-ил)индан трифторид эферат (0,13мл, 1,05ммоля) Реакционной смеси дали нагреться до комнатной темпеК ТГФ (2,5мл) при -78°С в атмосфере аргона ратуры и перемешивали Юмин, за это время меддобавили алюминий хлорид (90мг, 0,67ммоля) ленно добавил ЗМ HCI Смесь экстрагировали После медленного нагревания до комнатной темЕЮАс Органический экстракт промыли последопературы, добавили азид натрия (130мл, вательно НгО, 5% водным NaHCO3, H2O и насы2,2ммоля), и полученную смесь нагревали при щенным водным NaCI и высушили (MgSO4) Рас70°С в течение 5мин, затем охладили до комнаттворитель удалили при пониженном давлении для ной температуры К реакционной смеси добавили получении названного в заглавии соединения раствор (1RS, 2SR, ЗЗЇ?)-1-(4-метоксифенил)-3(91мг, 96%) в вида смеси Д1 и Д2 изомеров двой(3,4-метилендиоксифенил)-индан-2-карбонитрила ной связи (125мг, 0,34ммоля) в ТГФ (2,5мл) После нагревания при 70°С в течении ночи, анализ реакционной c) Этил (1RS, 2RS, ЗRS)-1-(2-мeтoкcифeнил)смеси тонкослойной хроматографией показал 3-(3,4-метилендиоксифенил)индан-2-карбоксилат присутствие исходного материала, поэтому было К раствору этил ^Э)-1-(2-метоксифенил)-3приготовлено дополнительное количество А1(Ыз)з (3,4-метилендиоксифенил)инден-2-карбоксилата как описано выше (1,34ммоля) в ТГФ К этой сме(90мг, 0,22ммоля) в ЕЮН (10мл) добавили 10% си добавили реакционную смесь, и нагревали при палладий на активированном углероде (90мг) 70°С продолжали дополнительно 5ч Смесь расПолученную суспензию встряхивали на гидрогенипределили между ЕЮАс и ЗМ HCI Водную фазу заторе Парра при 60psi H2 в течение ночи, затем экстрагировали ЕЮАс, и объединенные органичепрофильтровали через слой Целита Фильтрат ские экстракты промыли последовательно ЬЬО и сконцентрировали при пониженной давлении о насыщенным водным NaCI и высушили Раствоцелью получения названного в заглавии соединеритель удалили при пониженном давлении, и осния (90мг, 100%), которое использовали без дальтаток кристаллизовали из ЕЮАс/гексан с целью нейшей очистки получения названного в заглавии соединения d) (1RS, 2SR, 3RS)-1-(2-MeTOK^eHHn)-3-(3,4(78мг, 56%) Часть этого продукта была в дальметилендиоксифенил)индан-2-карбоновая кислота нейшем очищена методом MPLO (многократной К раствору этил (1RS, 2RS, 3RS)-1-(2препаративной тонкослойной хроматографией) метоксифенил)-3-(3,4 31 32 тропным удалением воды После нагревания до кипения с обратным холодильником в течение 4ч, реакционную смесь сконцентрировали при пониженном давлении, и остаток кристаллизовали из ЕЮН с целью получения названного в заглавии соединения (93,5г, 85%), Т пл 116-118°С d) Метил (1RS, 2SR)-5-BeH3HnoKCH-1-(3,4метилендиоксифенил)-3-оксоиндан-2-карбоксилат К трифторуксусной кислоте (150мл) при 0°С в атмосфере аргона добавили метил 2-(3бензилоксибензоил)-3-(3,4метиледиоксифенил)пропеноат (80,Ог, 0,19моля) Смеси дали нагреться до комнатной температуры и перемешивали ЗОмин, при этом смесь сконцентрировали при пониженном давлении Остаток растворили в ЕЮАс и промыли последовательно ЫаНСОз, НгО и насыщенным водным NaCI и высушили Растворителе удалили при пониженном давлении, и маслянистый остаток кристаллизовали из ЕЮАс/гексан с целью излучения названного в заглавии соединения (51,Зг, 64%) Т пл 148 150°С 44686 метилендиоксифенил)индан-2-карбоксилат (90мг, 0,22ммоля) в ЕЮН (2мл) содержащему несколько капель ТГФ добавили 6М КОН (0,22мл, 1,32ммоля) Полученной смеси дали перемешиваться при комнатной температуре в течение ночи, затем сконцентрировали при пониженном давлении Остаток распределили между Ь^О и Et20 Водную фазу подкислили ЗМ HCI и экстрагировали ЕЮАс ЕЮАс экстракт промыли последовательно НгО и насыщенным водным NaCI и высушили (MgSO4) Растворитель удалили при пониженном давлении с целью получения названного в заглавии соединения (40мг, 49%) 1 Н NMR (CDCI3) 5 7,37 - 6,73 (m, 11H), 5,93 (m, 2H), 5,03 (d, 1H, J = 10Hz), 4,67 (d, 1H, J = 10Hz), 3,70 (s, 3H), 3,38 (t, 1H, J = 10Hz) Пример 11 (1RS, 2SR, 3SR)-5-l~HflpoKCH-3-(4метоксифенил)-1-(3,4метилендиоксифенил)индан-2-карбоновая кислота, натриевая соль a) З-Бензилоксиацетофенон К смеси гидрида натрия (4,5г, 80% дисперсии в минеральном масле, 0,15моля), который был освобожден от минерального масла промывкой, в ДМФ (25мл) добавили, по каплям при охлаждении, раствор 3-гидроксиацетофенона (20,5г, 0,16моля) в ДМФ (25мл) После завершения добавления, смеси дали перемешиваться при комнатной температуре 15мин, за это время добавили бензил бромид (25,6г 0,15моля) Полученной смеси дали перемешиваться при комнатной температуре в течение ночи, затем распределит между ЕЮАс и ЗМ HCI Водную фазу экстрагировали ЕЮАс, и объединенные органические экстракты промывали последовательно 1М NaOH, H2O и насыщенным водным NaCI и высушили Растворитель удалили при пониженной давлений с целью получения названного в заглавии соединения (ЗЗг, 97%), которое использовали без дальнейшей очистки b) Метил 2-(3-Бензилокси)бензоилацетат К смеси гидрида натрия (28,Зг 80% дисперсии в минеральном масле, 0,94моля), который был освобожден от минерального масла промывкой, в диметил карбонате (100мл) в атмосфере аргона добавили за ЗОмин раствор 3-бензилоксиацетофенона (92,Зг, 0,41 моль) в диметил карбонате (150мл) По завершении добавления, смесь нагревали до кипения с обратным холодильником в течение ЗОмин, затем охладили в ледяной бане и остановили реакцию медленным добавлением ЗМ HCI, и водную фазу экстрагировали ЕЮАс Объединенные органические экстракты промыли последовательно НгО, водным ЫаНСОз, НгО и насыщенным водным NaCI и высушили Растворитель удалили при пониженном давлении с целью получения названного в заглавии соединения (112,5г. 97%) c) Метил 2-(3-Бензилоксибензоил)-3-(3,4метилендиоксифенил)пропенат Смесь содержащую метил 2-(3бензилокси)бензоилацетат (75,Ог, 0,26моля) пиперонал (43,6г, 0,29моля), уксусную кислоту (3,6мл) и пиперидин (1,2мл) в бензоле (70мл) нагревали до кипения с обратным холодильником, с азео e) Метил 5-Бензилокси-1 -(3,4метилендиоксифенил)-3-оксоинден-2-карбоксилат К раствору метил 5-бензилокси-1 -(3,4метилендиоксифенил)-3-оксоиндан-2карбоксилата (27,Зг, 65,6ммоля) в бензоле (90мл), охлажденному в бане лед - вода, добавили 2,3дихлоро-5,6-дициано-1,4-бензохинон (15,4г, 67,8моля) Полученную смесь перемешивали при 0°С 1 час, дали нагреться до комнатной температуры за 1,5ч, и в заключение нагрели до 40°С за 1 час Образовавшийся твердый продукт удалили фильтрацией и промыли бензолом Объединенный фильтрат и промывные воды вылили в ЕЮАс (200мл) и промыли последовательно водным Na2CO3 (Зх), Н2О (Зх), ЗМ HCI, Н2О (Зх) и насыщенным водным NaCI и высушили Растворитель удалили при пониженном давлении, и остаток кристаллизовали из ЕЮАс/гексан с целью получения названного в заглавии соединения (16,4г, 60%) в виде красного кристаллического твердого соединения, Т пл 140-141 °С f) Метил (3RS)-5-BeH3HnoKCH-3-rnflpoKCH-3-(4метоксифенил)-1-(3,4метилендиоксифенил)инден-2-карбоксилат К сухим магниевым стружкам (0,96г, 40ммоля) в атмосфере аргона добавили раствор 4бромоанизола (7,48г, 40ммоля) в 9 1 ЕігОЛТФ (50мл) Полученный раствор 4-метоксифенил магний бромида добавили порциями к раствору метил-5-бензилокси-1-(3,4-метилендиоксифенил)-3оксоинден-2-карбоксилата (8,29г, 20ммолей) в ТГФ (250мл) в атмосфере аргона По завершении добавления, смесь резко охладили добавлением ЗМ охлажденной НСІ и экстрагировали ЕЮАс Органический экстракт промыли последовательно НгО, водным NaHCO3, H2O и насыщенным водным NaCI Растворитель удалили при пониженном давлении с целью получения названного в заглавии соединения (11,58г, 100%), которое использовали без дальнейшей очистки д) Метил (RS)-5-BeH3nnoKCH-(4метоксифенил)-1-(3,4метилендиоксифенил)инден-2-карбоксилат К раствору метил (3RS)-5-6eH3nnoKCH-3 34 33 44686 гидрокси-3-(4-метоксифенил)-1-(3,4метоксифенил)-1-(3,4-метилендиоксифенил)-5метидендиоксифенил)инден-2-карбоксилата (сы(проп-1 -илокси)-индан-2-карбоновая кислота рой продую" приготовленный выше) в CH2CI2 a) 3-(Проп-1-илокси)ацетофенон (75мл) в атмосфере аргона при 0°С добавили триК суспензии NaH (13,84г, 0,58моля) в суэтилсилан (3,9мл, 23,5ммоля) и впоследствии бор хом ДМФ (60мл) при 0°С, добавили раствор 3трифторид эферат (14,7мл, 120ммолей) Реакцигидроксиацетофенона (50г, 0,37моля) После пеонную смесь перемешивали Юмин при 0°С при ремешивания в течение ЗОмин добавили 1этом смесь распределили между ЗМ HCI и ЕЮАс иодопропан (70мл, 0,72моля) и смесь перемешиОрганический экстракт промыли последовательно вали в течение ночи при комнатной температуре НгО, водным ЫаНСОз, НгО и насыщенным водным Смесь разбавили сухим ДМФ (50мл) и далее доNaCI и высушили Растворитель удалили при побавили (2,77г, 0,12моля) и впоследствии 1 ниженном давлении, и остаток очистили мгновениодопропан (23мл, 0,24моля) Через 1ч ТСХ поканой хроматографией, элюируя с градиентом расзала, что реакция закончена и продукт осторожно творителя 25 - 45% ЕігО/гексан Названное в погасили 6М HCI и экстрагировали ЕЮАс ЕЮАс заглавии соединение (8,41 г, 83% для двух стадий) экстракт промыли последовательно НгО, 10% выделили в виде смеси Д1 и Д2 изомеров двойной водным NaOH и затем раствором соли После связи высушивания (МдБОД фильтрация и упаривание дали названное в заглавии соединения (65г, 98%) п) Метил (1RS, 2RS, 3SR)-5-l~HflpoKCH-3-(4в виде желтого масла, которое использовали без метоксифенил)-1-(3,4дальнейшей очистки метилендиоксифенил)индан-2-карбоксилат b) Метил 3-(Проп-1-илокси)бензоилацетат К дегазированному раствору метил (Р)-5К суспензии NaH (12г, 0,5моля) в сухом димебензилокси-3-(4-метоксифенил)-2-(3,4тил карбонате (60мл) добавили медленно раствор метилендиоксифенил)инден-2-карбоксилата 3-(Проп-1-илокси)ацетофенона (65г, 0,37моля) в (6,60г, 13,0ммоля) в ЕЮАс (25мл) и ЕЮН (175мл) сухом диметил карбонате (100мл) Во время додобавили 5% палладий на активированном углебавления экзотермичность реакции привела к народе (0,6г) Полученную суспензию встряхивали греванию до температуры кипения После добавна гидрогенизаторе Парра при 60psi H2 в течение ления смесь перемешивали механически в 20ч, к этому времени ЯМР анализ реакционной течение ночи и затем осторожно погасили ЗМ HCI смеси показал, что реакция завершилась Каталии экстрагировали ЕЮАс ЕЮАс экстракт промыли затор удалили фильтрацией через слой Целита, и последовательно НгО, 5% водным NaHCO3, H2O добавили свежий 5% палладий на активировани раствором соли После промывания (МдБОД ном углероде (0,6г) Смесь встряхивали на гидрофильтрации и упаривание дали желтое масло генизаторе Парра при 60psi H2 дополнительно (82г, количественный) которые использовали без 48ч Катализатор удалили фильтрацией через дальнейшей очистки слой Целита и фильтрат сконцентрировали при пониженном давлении Остаток кристаллизовали c) Метил-fiRS, 2SR)-1-(3,4из ЕЮАс/гексан с целью названного в заглавии Метилендиоксифенил)-5-(проп-1-илокси)-3-оксосоединения (4,83г, 89%), Т пл 187-188°С индан-2-карбоксилат К раствору метил-3-(Проп-1 і) (1RS, 2SR, 3SR)-5-l~HflpoKCH-3-(4идокси)бензоилацетата (Юг, 4,2ммоля) в бензоле метоксифенил)-1-(3,4-метилендиоксенил)индан-2(50мл) добавили 3,4-метилен диоксибензальдегикарбоновая кислота натриевая соль да (6,36г, 4,2ммоля) и впоследствии пиперидин К раствору метил (1RS, 2RS, 3SR)-5-rnflpoKCH(0,42мл, 0,42ммоля) и ледяную уксусную кислоту 3-(4-метоксифенил)-1-(3,4(прибл 8 капель) Смесь нагревали до кипения с метилендиоксифенил)индан-2-карбоксилата обратным холодильником в течение 2ч и летучие (150мг, О.Збммоля) в ЕЮН (4мл) добавили 10% продукты удалили при пониженном давлении поNaOH (4мл) и полученной смеси дали перемешилучив метил (2)-3-(3,4-метилендиоксифенил)-2-3ваться в атмосфере аргона в течение ночи Доба(проп-і-илокси)-бензоил пропеонат в виде желтовили воду (5мл), и смесь сконцентрировали при го масла Этот остаток растворили в трифторукпониженном давлении Концентрат экстрагировасусной кислоте (50мл) и смесь перемешивали при ли Et20, и водную фазу подкислили и экстрагирокомнатной температуре 20мин Трифторуксусную вали ЕЮАс ЕЮАс экстракт промыли последовакислоту удалили при пониженном давлении для тельно НгО и насыщенным водным NaCI и получения названного в заглавии соединения в высушили Растворитель удалили при пониженвиде темного маслянистого остатка (16г), который ном давлении Приготовили натриевую соль, и использовали в следующей стадии без очистки порцию ее (100мг) очистили обращенно-фазовой 1 хроматографией с целью получения названного в Н NMR (CDCI3) 5 inter aha 7,85 (1Н, s), 7,66 заглавии соединения (73мг, 48%) Растирание 7,30 (ЗН, m), 7,08 - 7,18 (1Н, m), 6,95 (1Н, dd, J = этого продукта с ЕЮАс дало белый кристалличе8,2Hz), 6,78 ский твердый продукт, Т пл 198°С(разл) d) Метил-3-(3,4-Метилендиоксифенил)-51 (проп-1 -илокси)-1 -оксо-инден-2-карбоксилат Н NMR (МеОН - d4) 5 7,20 (dd, 2H, J = 6,8 Hz, Метил (1RS, 2SRJ-1-(3,42,0Hz), 6,85 (dd, 2H, J = 6,8Hz, 2,0Hz), 6,80 - 6,64 метилен диоксифенил)-5-(проп-1-илокси)-3-оксо(m, 5H), 6,25 (s, 1H), 5,88 - 5,87 (m, 2H), 4,47 (d, 1H, индан-2-карбоксилат (16г, сырой продукт из преJ =10Hz), 4,43 (d, 1H, J = 10Hz), 3,76 (s, 3H), 3,03 (t, дыдущего эксперимента) растворили в диоксане 1H, J = 10Hz) MS (m/e) 427 [(M + H)+] (150мл) и добавили DDQ 22г, 0,097моля) Смесь Пример 12 нагревали до кипения с обратным холодильником (1RS, 2SR 3RS)-3-(2-Kap6oKCHMeTOKCH-4 35 44686 36 в течение 2ч, затем охладили, отфильтровали и п) Метил-(1 RS, 2RS, 3RS)-3-(2растворитель удалили при пониженном давлении Карбоэтоксиметокси-4-метоксифенил)-1-(3,4Продую" очистили мгновенной колоночной хромаметилендиоксифенил)-5-(проп-1-илокси)индан-2тографией на силикагеле (элюент ЕЮАс/гексан, карбоксилат 20 80) для получения названного в заглавии соРаствор Me™i-(1RS, 2RS, 3RS)-3-(2-mflpoKCHединения в виде оранжевого твердого вещества 4-метоксифенил)-1-(3,4-метилендиоксифенил)-5(5,2г, 31% за две стадии), Т пл 125-126°С (проп-1-илокси)-индан-2-карбоксилата (0,05г, e) Метил-(1 RSJ-1 -(2-Бензилокси-(3,40,11ммоля) в сухом ДМФ (1мл) добавили к NaH метилендиоксифенил)-6-(проп-1-илокси)инден-2(4мг, 0,17ммоля) в небольшом объеме сухого карбоксилат ДМФ Смесь перемешивали при комнатной температуре Юмин и добавили этил бромацетат К сухим магниевым стружкам (0,15г, 6,25мг, (0,016мл, 0,14ммоля) Через 20мин реакция была атомов) в атмосфере аргона добавили порциями остановлена смешением продуктов с ЗМ охлажраствор 2-бензилокси-4-метоксибромбензола денной HCI и смесь экстрагировали ЕЮАс ЕЮАс (приготовление смотри ниже) (1,80г, 6,15ммоля) в экстракт промыли водой и затем раствором соли, 5% ТГФ/диэтиловый эфир (7мл) Полученный 2высушили (MgSO4), профильтровали и упарили бензилокси-4-метоксифенил магний бромид добаПродукт очистили колоночной хроматографией на вили к раствору метил-3-(3,4силикагеле (элюент ЕЮАс/гексан, 30 70) для пометилендиоксифенил)-(проп-1 -илокси)-1 -оксолучения названного в заглавии соединения в виде инден-2-карбоксилата (1,5г, 4,1ммоля) в Et20 бледно-желтого масла (0,05г, 85%) (65мл) в атмосфере аргона при 0°С Полученному раствору дали нагреться до комнатной темпераі) (1RS, 2SR, 3RS)-3-(2-Kap6oKCHMeTOKCHтуры и перемешивали Юмин Смесь распредели4метоксифенил)-1-(3,4-метилендиоксифенил)-5ли между ЗМ HCI (30мл) и ЕЮАс (75мл) Органи(проп-1 -илокси)индан-2-карбоновая кислота ческий экстракт промыли последовательно Ь^О, К раствору метил-fiRS, 2RS, 3RS)-3-(2водным ЫаНСОз, ЬЬО и насыщенным водным карбоэтоксиметокси-4-метоксифенил)-1-(3,4NaCI и высушили (ЫагЗСч) Растворитель удалили метилендиоксифенил)-5-(проп-1-илокси)индан-2при пониженном давлении, остаток очистили карбоксилата (0,05г, 0,089ммоля) в ЕЮН (1мл) мгновенной хроматографией на силикагеле (элю(необходимо нагревание) добавили 6М NaOH ент ЕЮАс/гексан, 30 70) с целью получения на(0,089мл, 0,53ммоля) После перемешивания в званного в заглавии соединения в вире бледнотечение ночи продукт распределили между ЕЮАс желтого масла (1,4г, 59%) и ЗМ HCI Органический экстракт промыли НгО и затем раствором соли, высушили (МдБОД проf) Me™-|-(RS)-3-(2-BeH3HnoKCH-4фильтровали и упарили для получения бесцветнометоксифенил)-1-(3,4-метилендиоксифенил)-5го масла Продукт кристаллизовали из ЕігО/гексан (проп-1-илокси)инден-2-карбоксилат для получения названного в заглавии соединения К раствору (1,35г, 2,33ммоля) в СН 2 СІ 2 (20мл) в виде не совсем белого твердого вещества (0,03г, при 0°С в атмосфере аргона добавили триэтилси65%), Т пл 195-198°С лан (0,47мл, 2,94ммоля), и впоследствии бор 1 трифторид эферат (1,4мл, 11,4ммоля) ПолученН NMR [(CD3)CO] 5 7,17 (1Н, d, J = 9,1 Hz), 6,8 ный раствор перемешивали при 0°С Юмин, затем - 6,71 (5Н, m), 6,55 - 6,47 (ЗН, m), 5,94 (2Н, s), 4,97 распределили между 1М HCI и органический экс(1Н, br, d), 4,73 (1Н, d, J = 16,5Hz), 4,63 (1H, d, J = тракт промыли последовательно, Ь^О, 5% водным 16,5Hz), 4,52 (1H, d, J = 7Hz), 3,80 - 3,76 (2H, m), ЫаНСОз, НгО и раствором соли После высушива3,76 (3H, s), 3,48-3,35 (1H, br, m), 1,65 (2H, sextet ния (Na2SO4) растворитель удалили при понижен= 7,4Hz), 0,92 (3H, t, J = 7,4Hz) MS 538 [(M + ном давлении, и продукт очистили колоночной NH4)+] хроматографией на силикагеле (элюент Anal Calc C29H28O9 C, 66,92, H, 5,42, C, 67,37, ЕЮАс/гексан, 25 25) Названное в заглавии соH, 5,32 единение (в виде отдельного неопределенного Пример 12a изомера двойной связи) получено в виде желтого Приготовление 2-Бензилокси-1-бромо-4масла (0,65г, 50%) метоксибензола a) 1 -Бромо-2-гидрокси-4-метоксибензол д) Метил-(1 RS, 2RS, 3RS)-3-(2-l~HflpoKCH-43-Бромо-2-гидрокси-6-метоксибензойная киметоксифенил)-1-(3,4-метилендиоксифенил)-5слота (проп-1-илокси)индан-2-карбоксилат [Г de Pauhd et al , J Med Chem (1985)6 28, Метил-^3)-3-(2-бензилокси-4-метоксифенил)1263 - 1269 / (5г, 0,02моля) нагревали в хинолине 1 -(3,4-метоксифенил)-1 -(3,4(200мл) при 160°С в течение 1ч При охлаждении, метилендиоксифенил)-5-(проп-1-илокси)-инден-2продукт распределили между Et20 и ЗМ HCI Оркарбоксилат (0,64г, 1,13ммоля) растворили в неганический экстракт промыли водой и раствором большом объеме ЕЮАс и добавили ЕЮН (25мл) и соли и высушили (MgSO4), профильтровали и впоследствии 10% палладий на активированном упарили для получения названного в заглавии углероде (0,2г) Полученный раствор перемешисоединения в виде светло-коричневого масла (4г, вали в атмосфере водорода 10 дней и профильт97%) Этот продукт использовали без дальнейшей ровали Фильтрат сконцентрировали при пониочистки женном давлении и продукт очистили колоночной 1 хроматографией на силикагеле (элюент, Н NMR (CDCI3) 5 7,32 (1Н, d, J = 9Hz), 6,60 ЕЮАс/гексан, 30 70) для получения названного в (1Н, d, J = 1,5Hz), 6,43 (1H, dd, J = 9,1, 5Hz) заглавии соединения в виде бесцветного твердого b) 2-Бензилокси-1 -бромо-4-метоксибензол продукта (0,21г, 39%), Т пл 155-156°С К суспензии NaH (1,01г, 0,042моля) в сухом 38 37 44686 бис-дициклогексиламина ДМФ (мл) при 0°С добавили раствор 1-бромо-2гидрокси-4-метоксибензола (7г, 0,035моля) После (1 RS, 2SR, 3RS)-3-2-(3-l~HflpoKCHnpon-1 перемешивания при комнатной температуре в илокси)-4-метоксифенил-1-(3,4течение ЗОмин раствор охладили до 0°С и добаметилендиоксифенил)-5-(проп-1-илокси)индан-2вили бензил бромид (6,24мл, 0,052ммоля) Смесь карбоновую кислоту (0,07г, 0,13ммоля) растворинагрели до комнатной температуры на ЗОмин и ли в сухом дихлорметане (0,5мл) и добавили пезатем осторожно остановили реакцию добавления риодинан Dess-Martin'a (0,07г, 0,17ммоля) в сухом ЗМ охлажденной HCI и экстрагировали ЕЮАс дихдорметане (1мл) Через 2ч продукт распредеЕЮАс экстракт промыли последовательно Ь^О, лили между диэтиловым эфиром и насыщенным 5% водным ЫаНСОз ЬЬО и окончательно раствоводным раствором карбоната натрия содержащим ром соли После высушивания (MgSC^) фильтратиосульфат натрия Эфирный экстрактпромыли ция и упаривание дали темно окрашенное масло водой, затем раствором сади, высушили (MgSO4 Продукт очистили мгновенной колоночной хромабезводным), профильтровали и упарили для потографией (элюент ЕЮАс/гексан, 20 80) для получения масла, которое использовали без очистлучения названного в заглавии соединения в виде ки Сырой продукт растворили в т-бутаноле (5мл) бесцветного масла (7,6г, 73%) и к этому раствору добавили раствор хлорида натрия (18мг, 0,2ммоля) и сульфаминовой кисло1 Н NMR (CDCI3) 7,50 - 7,25 (6Н, т ) , 6,51 (1Н, ты (21мг, 0,22ммоля) в воде (1,5мл) После переd, J = 1,5Hz), 6,39 (1Н, d, J = 9Hz), 5,09 (2H, s), 3,72 мешивания в течение 1ч при температуре окру(3H, s) жающей среды продукт экстрагировали ПримеріЗ этилацетатом Органический слой промыли водой, (1RS, 2SR, 3RS)-3-[2-(3-l~HflpoKCHnpon-1 затем раствором соли и затем высушили (MgSO4 илокси)-4-метоксифенил]-1 -(3,4безводн), профильтровали и упарили до получеметилендиоксифенил)-5-(проп-1-илокси)-индан-2ния масла Продукт очистили колоночной хромакарбоновая кислота, соль дициклогексиламина тографией на силикагеле (элюент этилацеМетил (1RS, 2RS, 3RS)-3-(2-l~HflpoKCH-4тат/гексан/3% уксусная кислота) для получения метоксифенил)-1-(3,4-метилендиоксифенил)-512мг свободной кислоты, которую превратили в ее (прор-1-илокси)-индан-2-карбоксилат (0,14г, соль бисдициклогексиламина Т пл 160-162°С 0,29ммоля) в сухой ДМФ (1мл) добавили к NaH (9мг, 0,38ммоля) в небольшом объеме сухого MS (exact mass) M + 534,1879 (free di-acid) (Д = ДМФ Смесь перемешивали при температуре ок+1,1mDAforC3oH3o09) ружающей среды в течение 20мин, затем добавиПо приведенным выше методикам полули З-бромопропан-1-ол (37мкл, 0,41ммоль) После чения следующие соединения по примерам 15 перемешивания в течение 1ч продукт распреде29 лили между ЗМ водной НСІ и этил ацетатом ОрПример 15 ганический слой промыли водой и затем раство(1 RS)-1 -(4-Метоксифенил)-3-фенилинден-2ром соли, затем высушили (MgSC^ безводн), карбоновая кислота профильтровали и упарили для получения масла Т пл 191 -193°С Продукт очистили колоночной хроматографией Anal С2зНі80з, С, 80,68, Н, 5,30 С, 80,54, Н, для получения метил (1RS, 2SR, 3RS)-3-[2-(35,33 Гидроксипроп-1 -илокси)-4-метоксифенил-1 -(3,4Пример 16 метилендиоксифенил]-5-(проп-1-илокси)индан-2(транс, транс)-1,3-Дифенилиндан-2карбоксилата (0,1 г, 65%) (ПМР доказал, что прокарбоновая кислота изошла некоторая эпимеризация при С-2) Этот Т пл 164-165°С продукт использовали без дальнейшей очистки m p 164-165°С Метил (1RS, 2SR, 3RS)-3-[2-(3-l~HflpoKCHnpon-1+ MS (m/e) 332 [(М + NH4) ] илокси)-4-метоксифенил]-1 -(3,4Пример 17 метилендиоксифенил)-6-(проп-1-илокси)-индан-2(1 RS, 2RS, 3SR)-1 -(4-Гидроксифенил)-3карбоксилат (0,04г, 0,075ммоля) растворили в мефенилиндан-2-карбоновая кислота таноле (2мл) и добавили водную гидроокись калия MS (m/e) 331 [(М + Н)+] (2М, 0,22мл, 0,44ммоля) Смесь перемешивали Пример 18 при нагревании до температуры кипения с обрат(1 RS, 2RS, 3SRJ-1 -(4-Карбоксифенил)-3ным холодильником в течение ночи, затем охлафенилиндан-2-карбоновая кислота дили, разбавили водой, подкислили ЗМ водной MS (m/e) 359 [(М + Н)+] соляной кислоты и экстрагировали етилацетатом Пример 19 Органический экстракт промыли водой и раство(1 RS, 2RS, 3SRJ-1 -(З-метоксифенил)-Зром соли, высушили (MgSO4 безводный), профенилиндан-2-карбоновая кислота фильтровали и упарили для получения масла MS (m/e) 362 [(М + NH4)+] Продукт очистили хроматографией на силикагеле Пример 20 (элюент этилацетат/гексан/3% уксусная кислота) (1RS, 2RS, 3SR)-1-(4-3iw^eHHn)для получения 12мг свободной кислоты, которую превратили в ее соль с дициклогексиламином Т фенилиндан-2-карбоновая кислота пл 110-112°С Т пл 163-164°С MS (m/e) 360 [(М + NH4)+] Пример 14 Anal Calcd C24H22O2 С, 84,18, H, 6,48, (1RS, 2SR, 3RS)-3-[2-(1-Kap6oKCH3T-2-m-ioKCH)Found С, 84,24, Н, 8,73 4-метоксифенил]-1-(3,4-метилендиоксифенил)-5Пример 21 (проп-1-илокси)-индан-2-карбоновая кислота, соль (1 RS, 2RSJ-1,3-Дифенилиндан-2-карбоновая 40 39 44686 кислота денной в примере 12 и этот сырой материал обработали согласно методике примера 70 для удаТ пл 210-211°С ления метоксиметил группы с 55% выходом Пример 22 Названное в заглавии соединение получили затем (1RS, 2RS, 3SRJ-1 -(4Бут-илоксифенил)-3-(4согласно методике, приведенной в примере 12 с метоксифенил)индан-2-карбоновая кислота 1 42% выходом Т пл 188-190°С Н NMR (CDCI3) 5 7,26 - 7,17 (m, 6H), 6,83 6,87 (m, 6H), 4,62 (d, 2H, J = 10,1 Hz), 3,96 (t, 2H, J = Anal Calcd СзоНзоОю С, 65,45, Н, 5,49 6,8Hz), 3,81 (s, 3H), 3,29 (t, 1H,J = 10,1 Hz), 1,80 Found С, 65,38, Н, 5,49 1,73 (m, 2H), 1,54 - 1,45 (m, 2H), 0,98 (t, 3H, J = Пример 31 7,3Hz) (1 RS, 2SR, 3RS)-3-(2-MeTOKCHMeTOKCH-4метоксифенил)-1-(3,4-метилендиоксифенил)-5Пример 23 карбоновая кислота (1 RS, 2RS, 3SR)-1 -(4-Ацетамидофенил)-(4метоксифенил)-индан-2-карбоновая кислота Т пл 161 -163°С Пример 32 T пл 231 - 232°С + (1RS, 2SR, 3RS)-3-(2-l~HflpoKCH-4MS (m/e ret mt) 803 [(2M + l) , 100] метоксифенил)-1-(3,4-метилендиоксифенил)Anal Calcd C25H23NO4, 1 2 H2O C, 73,12, H, (проп-1 -илокси)индан-2-карбоновая кислота 5,85, (exact mass) M + 462,1678 (Д -0,4 mDA N, 3,41 Found C, 72,92, H, 5,61, П, 3,24 С27Н26О7) Пример 24 (1 RS, 2RS, 3SR)-1 -(4-Аминофенил)-3-(4Пример 33 метоксифенил)-индан-2-карбоновая кислота, соль (1 RS, 2SR, 3SR)-3-(2-Kap6oKCHMeTOKCH-4дициклогексиламина метоксифенил)-1 -[2-проп-1 -илокси)-4,5метилендиоксифенил]-5-(проп-1-илокси)индан-2Т пл 187-190°С карбоновая кислота MS (m/e ret mt) 1076,2 [(2M + l)+, 25] Anal Calc C32H34O10, 0,5 Н2О С, 66,41, Н, Пример 25 6,00 (1 RS, 2RS, 3SR)-1 -(4-Гидроксифенил)-3-(3,4Found С, 65,27, Н, 5,99 метилендиоксифенил)индан-2-карбоновая кислота р 196-197°С Т пл 94-96°С Пример 34 MS (m/e) 392,4 [(М + NH4)+] (1 RS, 2SR, 3RSJ-1 -(2-Карбоксиметокси-4,5Пример 26 метилендиоксифенил)-3-(4-метоксифенил)-5(1 RS, 2RS, 3SR)-1 -(3,4-Диметоксифенил)-(4(проп-1 -илокси)индан-2-карбоновая кислота метоксифенил) индан-2-карбоновая кислота MS (DCI NH3) m/e 538,2 (М + NH3)+, 520,2 Т пл 126-128°С + (М+Н)+ MS (m/e ret mt) 807 [(2M + l) , 35], 403 [(M (exact mass) M + 520,1733 (Д = 0 0 mDa for H), 100] C29H28O9) Anal Calcd C25H24O5 С, 74,24, H, 5,98 Пример 35 Found С, 74,10, Н, 5,99 (1RS, 2SR, ЗRS)-1-(3,4-Meтилeндиoкcифeнил)Пример 27 3-[(2-проп-1 -илокси)фенил]-5-(проп-1 (1RS, 2RS, ЗSR)-1-(3,4-Meтилeндиoкcифeнил)3-(4-метилтиофенил)индан-2-карбоновая кислота илокси)индан-2-карбоновая кислота Т пл 179-180°С MS (exact mass) (M)+ = 404,1074 (Д = + 0,8 mDAforC24H2o04) MS (DCI СН4) m/e 503,2 (М + С2Н5)+, 474,1 (М Пример 28 (exact mass) 474,2034 (Д = +0,8 mDa for (1RS, 2RS, 3SR)-5-MeTOKCH-3-(4метоксифенил)-1-(3,4метилендиоксифенил)индан-2-карбоновая кислота Пример 36 (1 RS, 2SR, ЗRS)-3-(2-Гидpoкcифeнил)-1 -(3,4Т пл 129-131°С MS (m/e) 441,2 [(М + Na)+] метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоновая кислота Пример 29 Т пл 97-98°С (1RS, 2RS, 3SR)-1,3-BHC)3,4метилендиоксифенил)-5-гидроксииндан-2MS (exact mass) M + 432,1568 (Д = + 0,5 mDa карбоновая кислота f o r С бН 4Об) MS (m/e) 436,2 [(М + NH4)+] Пример 37 Пример 30 (1RS, 2SR, ЗRS)-3-(2-Kapбoкcимeтoкcифeнил)(1 RS, 2SR, 3SR)-3-(2-Kap6oKCHMeTOKCH-41 -(3,4-метилендиоксифенил)-5-(проп-1 метоксифенил)--1-(2-метокси-4,5илокси)индан-2-карбоновая кислота метилендиоксифенил)-5-(проп-1-илокси)-индан-2Т пл 169-170°С карбоновая кислота Anal Calc С28Н2б08, 0,25 Н2О С, 67,94, Н, Метил (1RS, 2RS, 3SR)-5-rnnpoKCH-3-(25,40 метоксиметокси-4-метоксифенил)-1-(2-метоксиFound С, 67,75, Н, 5,37 4,5-метилендиоксифенил)-индан-2-карбоновую Пример 38 кислоту приготовили с 23% общим выходом из (1RS, 2SR, 3RS)-3-(2-6eH3HnoKCH-4метил 2-(3-бензилокси)бензоилацетата согласно метоксифенил)-1-(3,4-метилендиоксифенил)-5методике примера 11 5-гидроксил составляющую (проп-1 -илокси)-индан-2-карбоновая кислота превратил в пропилат согласно методике привеMS (exact mass) M + 552,2149 (Д = -0,1 mDa for 2 2 41 44686 C34H32O7) Пример 39 (1RS, 2SR, 3RS)-3-[2-(2-rHflpoKH3T-1-m-iOKCH)-4метоксифенил]-1-(3,4-метилендиоксифенил)-5(проп-1-илокси)индан-2-карбоновая кислота, соль дициклогексиламина Т пл 182-184°С Anal Calc С41Н53ПО8 С, 71,59, Н, 7,77, N, 2,04 Found С, 71,67, Н, 7,66, Н, 2,42 Пример 40 (1RS, 2SR, 3RS)-3-(2-3TOKCH-4-MeTOKCH4)eHm-|)1 -(3,4-метилендиоксифенил)-5-(проп-1 илокси)индан-2-карбоновая кислота Anal Calc C29H30O7 С, 71,01, Н, 6,16, Found С, 70,71, Н, 6,01 Пример 41 (1RS, 2SR, 3RS)-3-4-MeTOKCH-2-(npon-1 илокси)-1 -1 -(3,4-метилендиоксифенил)-5-(проп-1 илокси)индан-2-карбоновая кислота Anal Calc C30H32O7 С, 71,41, Н, 6,39, Found С, 71,43, Н, 6,31 Пример 42 (1 RS, 2SR, 3RS)-3-[4-MeTOKCH-2-npon-2илокси)фенил]-1-(3,4-метилендиоксифенил)-5(проп-1 -илокси)индан-2-карбоновая кислота Тпл 75-79°С Пример 43 (1 RS, 2SR, 3RS)-3-[4-MeTOKCH-2-(-2метилпроп-1-илокси)фенил]-1-(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоновая кислота Тпл 85-89°С Пример 44 (1RS, 2SR, 3RS)-3-[4-MeTOKCH-2-(3-Me™-i6yr-1илокси)фенил]-1-(3,4-метилендиоксифенил)-5(проп-1-илокси)индан-2-карбоновая кислота, соль дициклогексиламина Тпл 150-155°С Пример 45 (1RS, 2SR, 3RS)-3-[4-MeTOKCH-2-(3пиридилметокси)-фенил]-1-(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоновая кислота Anal Calc C33H31O7, 0,5 Н2О С, 71,02, Н, 5,78, N, 2,51, Found С, 71,02, Н, 5,53, Н, 2,30 Пример 46 (1RS, 2SR, 3RS)-3-[4-MeTOKCH-2-(4пиридилметокси)-фенил]-1-(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоновая кислота Anal Calc C33H31NO7, 0,5 Н2О С, 71,02, Н, 5,78, N, 2,51, Found С, 70,89, Н, 5,59, Н, 2,37 Пример 47 (1RS, 2SR, 3RS)-3-[4-MeTOKCH-2-(2пиридилметокси)-фенил]-1-(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоновая кислота Т пл 153-155°С Пример 48 (1 RS, 2SR, 3RS)-3-[2-(l~enT-1 -илокси)-4метоксифенил]-1-(3,4-метилендиоксифенил)-5(проп-1 -илокси)индан-2-карбоновая кислота Т пл 70-73°С Пример 49 (1RS, 2SR, 3RS)-3-[4-MeTOKCH-2-(5 42 тетразилилетокси)-фенил]-1-(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоновая кислота Т пл 102-105°С Пример 50 (1 RS, 2SR, 3RS)-3-[2-L4HaHOMeTOKCH-4метоксифенил-1-(3,4-метилендиоксифенил)-5(проп-1 -илокси)индан-2-карбоновая кислота Т пл 199-201°С Пример 51 (1RS, 2SR, 3RS)-3-(2-Kap6oKcaMHflOMeTOKCHfl4-метоксифенил)-1-(3,4-метилендиоксифенил)-5(проп-1 -илокси)индан-2-карбоновая кислота Anal Calc C29H29NO8, 0,5С4Н8О С, 67,02, Н, 5,99, N, 2,52, Found С, 67,76, Н, 5,96, Н, 2,56 Пример 52 (1 RS, 2SR, 3SR)-5-AueTaMHflo-1,3-бис(3,4метилендиоксифенил)индан-2-карбоновая кислота MS m/e 460 [(М + Н)+] Пример 53 (1 RS, 2SR, 3SR)-5-AMHHO-1 ,3-бис(3,4 метилендиоксифенил)индан-2-карбоксилат, соль дициклогексиламина MS m/e 418 [(М+ Н)+] Пример 54 (1 RS, 2SR, 3RS)-3-[2-(3-Kap6oK^eHHn)-4метоксифенил]-1-(3,4-метилендиоксифенил)-5(проп-1 -илокси)индан-2-карбоновая кислота a) Этил 3-[три-1-ил/станнил]бензоат Этил 3-бромобензоат (2,0г, 3,7ммоля), гексабутилдистаннан (5,51мл, 10,9ммоля), тетракис(трифенилфосфин)палладий (0) (0,08г, 0,07ммоля) и ацетат палладия (П) (0,19г, 0,85ммоля) смешали в сухом толуоле (25мл) и нагревали до кипения с обратным холодильником в течение 72ч в атмосфере аргона Растворитель удалили при пониженном давлении и остаток очистили колоночной хроматографией на силикагеле (элюент гексан) Названное в заглавии соединение получили в виде бесцветного масла (1,1 г, 30%) b) Метил (1RS, 2SR, 3RS)-3-[2-(3карбометоксифенил)-4-метоксифенил]-1-(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоксилат Метил (1RS, 2SR, 3RS)-3-(4-MeTOKCH-2трифторометансульфонилоксифенил)-1-(3,4метилендиоксифенил)-5-проп-1-илокси)индан-2карбоксилат (0,113г, 0,19ммоля), литий хлорид (0,058г, 1,37ммоля), тетракис(трифенилфосфин)палладий (0) (0,018г, 0,016ммоля) и этил 3-три(бутил-1-ил)станнил бензоат (0,253г, 0,53ммоля) смешали в сухом диметилформамиде (5мл) и нагревали до кипения с обратным холодильником в течение 24ч Продукт профильтровали через целит и целит промыли этилацетатом Объединенный фильтрат упаривали при пониженном давлении и методом ТСХ было показано, что он представляет смесь двух компонентов Очистка колоночной хроматографией на силикагеле дала менее полярную фракцию метил (1RS, 2SR, 3SR)3-[2-(бут-1 -ил)-4-метоксифенил)-1 -(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоксилат (0,038г) который был получен в виде бесцветного масла Названное в заглавии соеди 44 43 44686 нение представляло более полярный компонент нический злой высушили (MgSO4 безводный), (0,08г), который все еще оставался загрязненными профильтровали через небольшую колонку из остатками олова (ПМР) и был использован без силикагеля и сконцентрировали при пониженном дальнейшей очистки давлении для получения масла Продукт очистили мгновенной колоночной хроматографией (силикас) (1RS, 2SR, ЗРЗ)-3-[2-Карбоксифенил)-4гель, градиентное алюирование из гексана 10% метоксифенил]-1-(3,4-метилендиоксифенил)-5этил ацетат/гексан) с целью получения названного (проп-1 -илокси)-индан-2-карбоновая кислота соединения в виде белого твердого вещества Метил (1RS, 2SR, 3RS)-3-[2-(3(92мг, 86%) Карбометоксифенил)-4-метоксифенил]-1-(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2b) (1RS, 2SR, 3SR)-3-(4-MeTOKCH-2карбоксилат (0,08г, сырой) растворили в пропан-2фенилфенил)-1-(3-4-метилендиоксифенил)-5оле (1мл) и добавили водную гидроокись натрия (проп-1 -илокси)индан-2-карбоновая кислота (1М, 1мл, 1ммоль) Смесь нагревали до кипения с К раствору Метил (1RS, 2RS, 3SR)-3-(4обратным холодильником 12 часов, затем охлаМетокси-3-фенилфенил)-1 -(3,4дили, разбавили водой, подкислили ЗМ-водной метилендиоксифенил)-5-(проп-1-илокси)индан-2соляной кислотой и экстрагировали этил ацетатом карбоксилата (80мг, 0,12ммоля) в диоксане (2мл) (Зх) Объединенный органический экстракт очидобавили 1М водного NaOH (0,3мл, О.Зммоля) стили колоночной хроматографией на силикагеле Полученную смесь нагревали до кипения с обрат(элюент 30% ЕЮАс/гексан/5% АсОН) для полученым холодильником в течение 48час, затем сконния названного в заглавии соединения в виде центрировали при пониженном давлении Остаток бесцветного твердого вещества (20мг) распределили между разбавленной водной HCI и этилацетатом Этилацетатный экстракт промыли Т пл 257-268°С водой и высушили (MgSO4 безводный) РаствориПример 55 тель удалили при пониженном давлении и остаток (1RS, 2SR, 3SR)-3-[2-(Byr-1-ил)-4очистили мгновенной колоночной хроматографией метоксифенил)-1-(3,4-метилендиоксифенил)-5(силикагель, 20% этил ацетат/гексан содержащий (проп-1-илокси)индан-2-карбоновая кислота, соль 5% уксусную кислоту) с целью получения названдициклогексиламина ного в заглавии соединения (36мг, 46%) Метил (1RS, 2SK 3SR)-3-[2-(Byr-1 -ил)-4Т пл 199-200°С метоксифенил)-1-(3,4-метилендиоксифенил)-51 Н NMR (CDCI3) 5 7,18 - 7,09 (m, 6H), 6,85 (dd, (проп-1-илокси)индан-2-карбоксилат (0,038г, 1Н, J = 8,6, 2,1 Hz), 6,71 - 6,65 (m, 6H), 6,36 (b s 0,074ммлля) растворили в пропан-2-ола (1мл) и 1H), 5,85 (s, 2H), 4,59 (d, 1H, J = 10,2Hz), 4,31 (d, добавили водную гидроокись натрия, (1М, 0,75мл, 1H, J = 10,2Hz), 3,75 (t, 2H, J = 7,3Hz), 3,73 (s, 3H), 0,75ммоля) Смесь нагревали до кипения с обрат3,14 (dd, 1H, J = 10,2Hz), 1,68 (sextet, 2H, J = ным холодильником 12час и затем охладили, раз7,3Hz), 0,93 (t, 3H, J = 7,3 H) бавили водой, подкислили ЗМ-водной соляной MS m/e 540 (M+NH4)+ кислотой и экстрагировали этилацетатом (Зх) Anal Calc С3зНзо06 3/4 H2O C, 73,93, H, 5,90 Объединенный органический экстракт очистили колоночной хроматографией на силикагеле (элюFound C, 74,12, H, 5,80 ент 30% ЕЮАс /гексан затем 30% ЕЮАс гексан/ Пример 57 5% АсОН) Превращение продукта в его соль с (1RS, 2SR, 3SR)-3-[2-[(E)-2-Kap6oKCH3TeH-1 дициклогексиламином дало названное соединеил]-4-метоксифенил]-1-(3,4-метилендиоксифенил)ние 5-(проп-1 -илокси)индан-2-карбоновая кислота а) Метил (1RS, 2SR, 3SR)-3-[2-[(E)-2Т пл 179-182°С Карбометокси-этен-1-ил]-4-метоксифенил]-1-(3,4Anal Cald C41H53NO8 С, 71,59, Н, 7,77, N, метилендиоксифенил)-5-(проп-1-илокси)индан-22,04 карбоксилат Found С, 71,67, Н, 7,66, Н, 2,42 1,3-бис(дифенилфосфино)пропан Пример 56 (0,068ммоля), (1RS, 2SR, 3SR)-3-(4-MeroKCH-2-4>eHHn4>eHiin)трис(дибензилиденацетон)дипалладий (0) (24мг, 1 -(3,4-метилендиоксифенил)-5-(проп-1 0,026ммоля) и бис(трифенилфосфин)палладий (II) илокси)индан-2-карбоновая кислота хлорид (18мг, 0,026ммоля), растворили в 4 1 смеа) Метил (1RS, 2RS, 3SR)-3-(4-MeTOKCH-2си триэтиламин/ацетонитрил (5мл) в атмосфере фенилфенил)-1-(3,4-метилендиоксифенил)-5аргона Через Юмин при комнатной температуре, (проп-1-илокси)индан-2-карбоксилат раствор метил (1RS, 2SR, 3SR)-3-(4-MeTOKCH-2К суспензии безводного LiCI (46мг, 1,1ммоля) трифторометиленсульфонилоксифенил)-1-(3,4и тетракис (трифенилфосфин)палладия (0) (24мг, метилендиоксифенил)-5-(проп-1-илокси)индан-20,02ммоля) в сухом диоксане (Змл) добавили раскарбоксилата (160мг, 0,26ммоля) и метил акрилат твор Метил (1RS, 2RS, 3RS)-3-(4-MeTOKCH-2(679мг, 7,89ммоля) добавили в упомянутой выше трифторометансульфонилоксифенил)-1-(3,4смеси растворителей (Змл) Реакционную смесь метилендиоксифенил)-5-(проп-1-илокси)индан-2нагревали до кипения с обратным холодильником карбоксилат (95мг, 0,16ммоля) и три(бут-1в атмосфере аргона в течение 20ч, охладили до ил)станнилбензола (319мг, 0,87ммоля) в диоксане комнатной температуры и небольшую аликвотную (1мл) Смесь нагревали до кипения с обратным пробу анализировали методом ПМР, который похолодильником в атмосфере аргона 17ч, охладиказал, что реакция не происходит Затем добавили до комнатной температуры, разбавили этилли ацетат палладия (II) (6мл, 0,025ммоля) и метил ацетатом (5мл) и полученный раствор промыли ацетат (679мг, 7,89ммоля) в сухом ДМФ (5мл) последовательно раствором соли и водой Орга 45 44686 46 Реакционную смесь нагревали до кипения с обC27H26O7) ратным холодильником в течение ночи Во охлажПо методикам приведенным выше в Примерах дении раствор профильтровали через колонку с 54 - 58 были получены следующие соединения силикагелем и сконцентрировали до получения Пример 59 масла Сырой продукт очистили мгновенной коло(1 RS, 2SR, 3RS)-3-(2-Kap6oKCHMeTHnTHO-4ночной хроматографией (силикагель, градиентное метоксифенил)-1-(3,4-метилендиоксифенил)-5элюирование от 10% до 20% этилацетат/гексан) с (проп-і-илокси)индан карбоновая кислота целью получения названного в заглавии соединеТ пл 242 - 246°С (разл ) ния в виде рыжевато-коричневого твердого вещеПример 60 ства (87мг, 62%) (1RS, 2SR, 3SR)-3-[4-MeTOKCH-2-(npon-2-eH-11 Н NMR(CDCI3) 5 8,17 (d, 1H, J = 15,7Hz), 7,44 ил)фенил]-1 -(3,4-метилендиоксифенил)-5-(проп-1 (d, 1H, J = 8,7Hz), 7,11 - 7,07 (m, 2H), 6,90 - 6,70 илокси)индан-2-карбоновая кислота (m, 6H), 6,42 (d, 1H, J = 15,7Hz), 5,94 (bs, 2H), 5,04 Т пл 126-127°С + (d, 1H, J = 7,5Hz), 4,75 (d, 1H, J = 7,6Hz), 3,89 (t, (exact mass) M 486,2021 (Д = +2,1 mDA for 2H, J = 6,3Hz), 3,85 (s, 3H), 3,85 (dd, 1H, J = 7,5, СзоНзоОє) 7,4Hz), 3,83 (s, 3H), 2,96 (s, 3H), 1,79 (sextet, 2H, J Пример 61 = 6,7Hz), 1,03 (t, 3H, J = 6,7Hz) (1 RS, 2SR, 3SR)-3-[4-MeTOKCH-2-(npon-1 b) (1RS, 2SR, 3SR)-3-[2-[(E)-2-Kap6oKCH3TeH-1ил)фенил]-1 -(3,4-метилендиоксифенил)-5-(проп-1 ил]-4-метоксифенил]-1-(3,4-метилендиоксифенил)илокси)индан-2-карбоновая кислота 5-(проп-1 -илокси)индан-2-карбоновая кислота Т пл 155-156°С К раствору метил (1RS, 2SR, 3SR)-3-[2-[(E)-2Anal Calc С30Н32О6 С, 73,75, Н, 6,60 Карбоксиэтен-1-ил]-4-метоксифенил]-1-(3,4Found С, 73,45, Н, 6,43 метилендиоксифенил)-5-(проп-1-илокси)индан-2Пример 62 карбоксилата (80мг, 0,15ммоля) в диоксане (2мл) (1RS, 2SR, 3RS)-3-[2-Kap6oKCH-Aдобавили 1Н NaOH (0,5мл, 0,5ммоля) Полученметоксифенил]-1-(3,4-метилендиоксифенил)-5ную смесь нагревали до кипения с обратным хо(проп-1 -илокси)индан-2-карбоновая кислота лодильником в течение Зч, затем охладили и Anal Calc С28Н2бО8 С, 68,56, Н, 5,34 сконцентрировали при пониженном давлении ОсFound С, 68,61, Н, 5,58 таток распределили между разбавленным водным Пример 63 HCI и этилацетатом Этилацетатный экстракт (1 RS, 2SR, 3SR)-3-[2-(2-rnflpoKCH3THn)-4промыли водой и высушили (MgSO4 безводный) метоксифенил]-1-(3,4-метилендиоксифенил)-5Растворителе увалили при пониженном давлении (проп-1 -илокси)индан-2-карбоновая кислота и названное в заглавии соединение получили в (exact mass) M + 490,1994 (Д = +0,3mDA for виде белого твердого вещества (73мг, 96%) 1 Н NMR (CDCI3) 5 8,32 (d, 1H, J = 15,6Hz), 7,24 - 6,55 (m, 9H), 6,29 (d, 1H, J = 15,6Hz), 5,94 (bs, 2H), 5,18 (d, 1H, J = 9,9Hz), 4,69 (d, 1H, J = 9,9Hz), 3,85 (s, 3H), 3,84 (t, 2H, J = 6,9Hz), 2,94 (dd, 1H, J = 9,9, 9,9Hz), 1,79 (sextet, 2H, J = 6,9Hz), 1,00 (t, 3H, J = 6,9Hz) MSm/e 517 [(M+ H)+] Anal Calc C3oH2808 C, 69,76, H, 5,46 Found C, 69,73, H, 5,26 Пример 58 (1RS, 2SR, 3SR)-3-[2-(2-Kap6oKCH3T-1 -ил)-4метоксифенил]-1-(3,4-метилендиоксифенил)-5(проп-1 -илокси)-индан-2-карбоновая кислота К раствору (1RS, 2SR, 3SR)-3-[2-[(E)-2карбоксиэтен-1-ил]-4-метоксифенил]-1-(3,4метилендиоксифенил)-5-(проп-1-илокси)индан-2карбоновой кислоты (43мг, 0,08ммоля) в этаноле (40мг) добавили 10% палладий на активированном углероде (40мг) Полученную суспензию перемешивали в течение ночи на атмосфера аргона, затем профильтровали через слой целита Фильтрат сконцентрировали при пониженном давлении с целью получения названного в заглавии соединения (35мг, 82%) в виде белого твердого вещества 1 Н NMR (CDCI3) 5 6,99 (d, 1Н, J = 8,6Hz), 6,73 - 6,66 (m, 7H), 6,23 (bs, 1H), 5,88 - 5,87 (m, 2H), 4,88 (d, 1H, J = 9,7Hz), 4,54 (d, 1H, J = 8,7Hz), 3,72 (s, 3H), 3,70 (t, 2H, J = 7Hz), 2,98 - 2,90 (m, 1H), 2,68 - 2,51 (m, 2H), 1,65 (sextet, 2H, J = 7,0Hz), 0,89 (t, 3H, J = 7,0Hz) MS (exact mass) M + 518,1930 (Д = +1,1mDA for С29Н30О7) Пример 64 (1 RS, 2SR, 3SR)-3-(2-Kap6oKCHMe™>4метоксифенил]-1-(3,4-метилендиоксифенил)-5(проп-1 -илокси)индан-2-карбоновая кислота (exact mass) M + 504,1788 (Д = -0,4mDA for С29Н28О8) Пример 65 (1RS, 2SR, 3SR)-3-[2-(3-rHflpoKCHnpon-1-mr)-4метоксифенил]-1-(3,4-метилендиоксифенил)-5(проп-1 -илокси)индан-2-карбоновая кислота MS (exact mass) M + 504,2143 (Д = +0,5mDA for С30Н32О7) Пример 66 (1 RS, 2SR, ЗSR)-5-(4-Kapбoкcифeнил)-1,3бис(3,4-метилендиоксифенил)-1-индан-2карбоновая кислота Тпл 230-231 °С Пример 67 (1 RS, 2SR, ЗSR)-5-(4-Бeнзилoкcифeнил)-1,3бис(3,4-метилендиоксифенил)индан-2-карбоновая кислота Тпл 105-106°С Пример 68 (1 RS, 2SR, 3SR)-5-(4-l~HflpoKO^eHHn)-1,3бис(3,4-метилендиоксифенил)индан-2-карбоновая кислота MSm/e 512 [(М+ NH4)+] Пример 69 (транс,транс-1,3,5-трис(3,4метилендиоксифенил)-индан-2-карбоновая кислота 48 47 44686 Anal Calc С31Н22О8, 5/8H2O C, 69,76, H, 4,39 3,79 (s, 3H), 2,39 - 2,82 (m, 1H), 2,15 - 2,08 (m, 1H), 1,77 - 1,71 (sextet, 2H, J = 7,2Hz), 0,99 (t, 3H, J = Found C, 69,81, H, 4,46 2,5Hz) Пример 70 + (1RS, ЗРЗ)-3-(2-Гидрокси-4-метоксифенил)-1 MS (exact mass) M Found 418,1782 (Д = (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан 0,2mDAforC26H26O5) a) (1 RS, 3RS)-3-[(2-MeTOKCHMeTOKCH)-4Пример 71 метоксифенил)]-1-(3,4-метилендиоксифенил)-5(1 RS, 2RS)-3-(2-Kap6oKCHMeTOKCH-4(проп-і-илокси)индан метоксифенил)-1-(3,4-метилендиоксифенил)-5Раствор (1RS, 2SR, 3RS)-3-2(проп-і-илокси)индан (Метоксиметокси)-4-метоксифенил-1-(3,4К суспензии гидрида натрия (5мг, 0,21ммоля) метилендиоксифенил)-5-(проп-1-илокси)индан-2в диметилформамиде (0,5мл) добавили (1RS, карбоновой кислоты (0,2г, 0,39ммоля) в дихлормеЗRS)-3-(2-Гидpoкcи-4-мeтoкcифeнил)-1-(3,4тане (4мл) и пиридин (28мкл, 1,6ммоля) охладили метилендиоксифенил)-5-(проп-1-илокси)индан до 0°С в атмосфере аргона К раствору добавили (0,053г, 0,14ммоля) при температуре ледяной батионил хлорид (бОмкл, 0,8ммоля) Смеси дали ни в атмосфера аргона После перемешивания в нагреться до температуры окружающей среды за течение 15мин, добавили этил бромацетат (50мкл, 20мин летучие продукты удалили при пониженном 0,2ммоля) и раствор перемешивали в течение 1ч давлении Остаток повторно растворили в толуопри комнатной температуре Продукт распределиле и упарили при пониженном давлении (дважды) ли между этилацетатом и ЗМ водн НСІ ОрганичеОстаток растворили в дихлорметане (4мл) и добаский экстракт промыли водой, раствором насывили триэтиламин (250мкл) К этому раствору при щенного водного ЫаНСОз и окончательно комнатной температуре в атмосфере аргона дораствором соли После высушивания (MgSO4 безбавили 2-меркаптопиридиноксид (120мг, водный) фильтрация и упаривание с последую0,8ммоля) растворенный в дихлорметане (1мл) щей хроматографией дали (1RS, 3RS)-3-(2После перемешивания в течение 20мин при комкарбоэтоксиметокси-4-метоксифенил)-1-(3,4натной температуре добавили т-бутилтионил метилендиоксифенил)-5-(проп-1-илокси)индан (450мкл, 4ммоля) и смесь облучали 20мин (0,041 г) Продукт растворили в горячем этаноле (150ватт точечный источник света) Летучие про(10мл) и добавили 1М водный NaOH Смесь надукты удалили при пониженном давлении и прогревали до кипения с обратным холодильником в дукт распределили между етилацетатом и ЗМтечение 1ч, затем охладили, подкислили 6М водводной НСІ Органический экстракт промыли воной HCI и экстрагировали этилацетатом Посла дой, нас водн раствором ЫаНСОз и окончательно упаривания остаток кристаллизовали из этилацараствором соли После высиживания (MgSO4 безтат/гексан для получения названного в заглавии водный), продукт отфильтровали и упарили Очисоединения (0,035г, 93%) Т пл 177-178°С стка колоночной хроматографией дала названное 1 Н NMR (CDCI3) 5 7,18 (d, 1H, J =0,5Hz), 6,87 в заглавии соединение (0,075г, 41%) (d, 1H, J = 8,4Hz), 6,88 - 6,71 (4H, m), 6,56 (dd, 1H, J 1 Н NMR (CDCI3) 5 7,13 (d, 1H, J = 8,5Hz), 6,83 = 8,4, 2,3Hz), 6,53 (br, s, 1H), 6,41 (d, 1H, J = 2,3Hz), (d, 1Н, J =8,3Hz), 6,79 - 6,69 (m, 5H), 6,54 (dd, 1H, J 5,91 (br, s, 2H), 4,68 - 4,60 (m, 3H), 4,61 (dd, 1H, J = = 8,5, 2,5Hz), 6,51 (br, s, 1H), 5,92 (br, s, 2H) 5,18 (d, 10,7, 7,2Hz), 3,83 - 3,80 (m, 2H), 3,81 (s, 3H), 3,86 1H, J = 6,7Hz), 5,15 (d, 1H, J = 6,7Hz), 4,66 (dd, J = (dt, 1H, J = 12,4, 7,2Hz), 2,10 - 1,98 (m, 1H), 1,73 10,5, 7,6Hz, 1H, J = 6,7Hz), 4,22 (dd, 1H, J = 10,5, (sextet, 2H, J = 7,2Hz), 0,98 (t, 3H, J = 7,4Hz) 7,4Hz), 3,81 (m, 2H), 3,80 (s, 3H), 3,43 (s, 3H), 2,90 M (в exact mass) M + = 476,1829 (Д = +0,6mDA -2,83 (m, 1H), 2,06-1,98 (m, 1H), 1,73 (sextet, 1H, for C28H28O7) J = 7,1Hz), 0,92 (t, 3H, J = 7,1Hz) Пример 72 - 84 (b) (1RS, 3RS)-3-(2-l~HflpoKCH-4По приведенным выше методикам получены метоксифенил)-1-(3,4-метилендиоксифенил)-5следующие соединения (проп-і-илокси)индан (1RS, 2SR, 3SR)-1-(4-MeTOK^eHHn)-3-(3,4,5К раствору (1RS, 3RS)-3-(2-MeTOKCHMeTOKcn)-4триметоксифенил)индан-2-карбоновая кислота, метоксифенил)-1-(3,4-метилендиоксифенил)-5(1 RS, 2SR, 3SRJ-1 -(4-Этоксифенил)-3-(3,4(проп-і-илокси)индан (0,075г, 0,16ммоля) в метаметилендиоксифенил)индан-2-карбоновая кислоноле (5мл) добавили 4 - 5 капель 6М-НСІ и смесь та, нагревали до кипения с обратным холодильником (1 RS, 2SR, 3SR)-5-Kap6oKCH-1,3-бис(3,4в течение 1,5ч в атмосфере аргона Растворитель метилендиоксифенил)индан-2-карбоновая кислоудалили при пониженном давлении и продукт раста, пределили между ЕЮАс и водой Органический (1 RS, 2SR, 3SR)-3-(4-MeTOK^eHHn)-1 -(3,4экстракт промыли водой, затем насыщенным водметилендиоксифенил)-5-(проп-2-анилокси)инданным раствором ЫаНСОз и окончательно раство2-карбоновая кислота, ром соли После высушивания (MgSO4 безвод(1 RS, 2SR, ЗRS)-3-(2,4-Димeтoкcифeнил)-5ным) фильтрация и упаривание дали названное в гидрокси-1-(3,4-метилендиоксифенил)индан-2заглавии соединение (0,064г, 94%) карбоновая кислота, 1 Н NMR (CDCI3) 5 7,11 (d, 1H,J = 8,4Hz), (1RS, 2SR, 3SR)-3-5-(2,3-flnrHflpo)6,87(d, 1H, J = 7,3Hz), 6,77 - 6,74 (4H, m), 6,61 (brs, бензфуранил-5-гидрокси-1 -(3,41H), 6,50 (dd, 1H, J = 8,4, 2,5Hz), 6,42 (d, 1H, J = метилендиоксифенил)-индан-2-карбоновая кисло2,5Hz), 5,94 (d, 1H, J = 1,2Hz), 5,93 (d, 1H,J = та, 1,2Hz), 4,74 (s, 1H), 4,43 (dd, 1H, J = 10,4, 7,6Hz), (1RS, 2SR, 3RS)-5-l~HflpoKCH-3-(3,44,20 (dd, 1H, J = 10,7, 7,3Hz), 3,82 (t, 2H, J = 6,7Hz), метилендиоксифенил)-1-(2,4,6 50 49 44686 триметоксифенил)индан-2-карбоновая кислота, карбоновая кислота, (1RS, 2SR, 3SR)-1-5-(2,3(1RS, 2SR, 3RS)-5-MeTOKCH-3-(4Дигидробензфуранил-1-(4-метоксифенил)индан-2метоксифенил)-1-(2-метокси-4,5карбоновая кислота, метилендиоксифенил)индан-2-карбоновая кислота (1RS, 2SR, 3RS)-1-3,4-(1,2Этилендиокси)фенил-3-(4-метоксифенил)индан-2Пример 85 карбоновая кислота, Составы для фармацевтического использова(1RS, 2SR, 3SR)-5-l~HflpoKCH-3-(3,4ния включающие соединения данного изобретения могут быть приготовлены в разнообразных метилендиоксифенил)-1-(4-метоксифенил)инданформах и с многочисленными наполнителями 2-карбоновая кислота, Примеры таких составов приведены ниже (1RS, 2SR, 3RS)-5-rnflpoKCH-3-(4метоксифенил)-1-(2-метокси-4,5Составы для ингаляции метилендиоксифенил)индан-2-карбоновая кислоСоединение формулы 1, (от 1мг до 100мг) та, распыляется из отмеряющего дозу ингалятора для отпуска желаемого количества лекарства на (1RS, 2SR, ЗSR)-1-(3,4-Meтилeндиoкcифeнил)применение 3-(4-метоксифенил)-5-(проп-1-илокси)индан-2Таблетки/Ингредиенты 1 Активный ингредиент (соед форм 1) 2 Кукурузный крахмал 3 Альгиновая кислота 4 Альгинат натрия 5 Мд стеарат Стадия 1 Стадия 2 Стадия 3 Стадия 5 Стадия 6 На таблетку 40мг 20мг 20мг 20мг 1,3мг 2,3мг Способ приготовления таблеток Смешивают ингредиенты № 1, № 2, № 3 и № 4в подходящем миксере/смесителе К смеси из стадии 1 добавляют достаточное количество воды порциями с тщательным перемешиванием после каждого добавления Такие добавления воды и перемешивание продолжают до тех пор, пока консистенция массы позволит превратить ее во влажные гранулы Влажную массу превращают в гранулы пропуская ее через вибрационный гранулятор, используя фильтр № 8 меш (2,38мм) Влажные гранули затем высушивают в сушильном шкафу при 140°С (60°С) досуха В сухие гранулы вводят смазывающий ингредиент № 5 Смазанные гранулы прессуют на соответствующем прессе для таблеток Парентеральний состав Фармацевтическую композицию для парентерального применения приготавливают растворением соответствующего количества соединения формулы 1 в полиэтилен гликоле при нагревании Этот раствор разбавляют затем водой для инъекций PR Eur (до 100мл) Раствор затем стерилизуют фильтрацией через 0,22 микрона мембранный фильтр и запаивают в стерильные емкости ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044) 456 - 20 - 90
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/381, C07C 323/00, C07D 407/08, C07C 23/00, C07D 209/04, C07C 39/00, C07D 333/10, C07D 249/02, C07C 62/00, C07C 61/00, A61P 13/02, C07F 9/38, A61K 31/357, C07C 43/188, C07C 67/343, C07C 13/00, A61K 31/34, C07C 35/00, A61P 9/12, A61K 31/443, C07C 45/71, C07C 69/738, C07C 211/42, A61K 31/404, C07F 9/30, A61K 31/40, C07D 213/60, C07D 405/12, A61K 31/38, A61P 15/00, C07D 317/60, A61P 9/08, A61K 31/19, A61K 31/41, C07D 307/79, C07D 405/08, A61K 31/343, C07C 43/21, C07C 49/84, A61K 31/44, A61K 31/36, C07D 275/00, C07D 233/56, C07D 277/22, A61P 43/00, C07C 67/31, C07C 33/00, C07D 257/00, C07C 235/82, C07C 69/757, A61P 9/10, A61P 9/00, A61K 31/415, C07C 25/00, C07C 211/57, A61K 31/403, C07C 69/734, C07D 317/50
Мітки: спосіб, пригнічення, основі, індану, антагоністи, похідні, ендотелінових, фармацевтична, індену, композиція, рецепторів, одержання
Код посилання
<a href="https://ua.patents.su/25-44686-pokhidni-indanu-abo-indenu-yak-antagonisti-endotelinovikh-receptoriv-farmacevtichna-kompoziciya-na-kh-osnovi-sposib-kh-oderzhannya-ta-sposib-prignichennya-endotelinovikh-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Похідні індану або індену як антагоністи ендотелінових рецепторів, фармацевтична композиція на їх основі, спосіб їх одержання та спосіб пригнічення ендотелінових рецепторів</a>
Попередній патент: Багатокомпонентний лужний мийний засіб, що містить полімерну плівку, лужна мийна композиція та очисна система
Наступний патент: Спосіб одержання лактону 1r-цис-2,2-диметил-3-формілциклопропан-1-карбонової кислоти і проміжний продукт
Випадковий патент: Спосіб діагностики розвитку остеопорозу